의견 : 안드로겐 수용체, 도파민 및 성기능에 관한 거의 모든 관련 연구에 대한 훌륭한 검토. 시상 하부 보상 회로 상호 관계를 그리는 환상적인.
Horm Behav. 2008 May; 53(5): 647-658.
온라인 2008 2 월 13에 게시되었습니다. doi : 10.1016 / j.yhbeh.2008.01.010
추상
청소년기는 즐거움을 추구하는 행동의 증가와 관련이 있으며, 이는 차례로 hypothalamo-pituitary-gonadal axis의 사춘기 활성화에 의해 형성됩니다. 성, 고환 안드로겐과 같은 자연적으로 보람있는 행동의 동물 모델에서 남성의 행동의 발달과 표현에 기여합니다. 행동 성숙에 영향을주기 위해, 뇌는 청소년기 동안 상당한 리모델링을 겪으며, 많은 변화는 마찬가지로 안드로겐 수용체 (AR)를 통해 작용하는 안드로겐에 민감하다. 생식선 호르몬과 뇌 발달의 섬세한 상호 작용을 고려할 때,이 민감한 기간 동안 호르몬 수치의 붕괴가 청소년 및 성인 행동을 크게 변화 시킨다는 것은 놀라운 일이 아닙니다. 남성 햄스터에서, 청소년기 동안 테스토스테론에 대한 노출은 성인 성 행동의 정상적인 표현에 필요합니다. 사춘기 전시 도중 안드로겐을 박탈당한 남성은 짝짓기의 적자를 유지했습니다. 반대로, 안드로겐만으로는 사춘기 이전에 뇌 AR이 존재하더라도 사춘기 전 남성의 교배를 유도하기에 충분하지 않습니다. 이러한 맥락에서, 청소년기 동안 신진 대사-남성 스테로이드 (AAS)의 광범위한 사용은 중요한 관심사입니다. AAS 남용은 청소년 남성의시기와 안드로겐 수준을 모두 변화시킬 수 있습니다. 햄스터에서, 청소년 AAS 노출은 침략을 증가시키고 신경 전달 물질 시스템에서 지속적인 변화를 일으킨다. 또한 AAS는 테스토스테론 및 기타 AAS의 자체 투여로 입증 된 것처럼 자체 강화됩니다. 그러나 최근의 증거는 안드로겐의 강화 효과가 고전적 AR을 요구하지 않을 수 있음을 시사합니다. 따라서, 청소년 뇌의 안드로겐과 보람 행동 사이의 상호 작용에 대한 추가 검사는 AAS 남용에 대한 더 나은 이해가 필요합니다.
살펴보기
청소년기는 두뇌를 즐거움과 위험으로 깨 웁니다. 십대 청소년의 경우 약물과 섹스 실험 형태를 자주 사용합니다. 미국에서 남성의 첫 성교의 평균 연령은 16.4 세이며 65 %는 12th 학년의 성교를 가졌습니다 (카이저 가족 재단, 2005). 마찬가지로이 인구는 미국에서 불법 약물 사용률이 가장 높습니다. 약물 사용 및 건강에 관한 2004 National Survey에 따르면 38 – 18 연령의 남성 25 %가 지난해 불법 약물을 사용했습니다 (SAMHSA / OAS, 2005). 또한 십대 소년의 31 %가 마지막 성행위 동안 약물이나 알코올을 사용했습니다 (카이저 가족 재단, 2005). 또한 청소년기는 우울증, 불안, 섭식 장애 및 행동 장애와 같은 특정 정신 병리학의 병인학에서 중추적 인 시간입니다. 우리는 생식선 호르몬의 사춘기 분비, 뇌에서 스테로이드 수용체의 활성화, 그리고 청소년 뇌 발달에 대한 호르몬과 경험 사이의 상호 작용이 청소년기 동안 보이는 행동 변화에 기여한다고 주장합니다.
우리의 목표는 생식선 안드로겐이 청소년의 성숙과 동기 부여 된 행동의 성인 성과뿐만 아니라 이러한 행동의 보람있는 속성을 중재한다는 증거를 검토하는 것입니다. 우리는 또한 테스토스테론 자체가 보람이 있다는 증거를 제시하는데, 이는 테스토스테론 수치가 급등 할 때 청소년기 동안 동기 행동의 성숙 변화에 기여할 가능성이 있습니다. 이 논문의 초점은 테스토스테론과 도파민 (DA) 사이의 상호 작용에 특별히 중점을 둔 남성의 성 행동, 특히 시리아 햄스터에서의 신경 회로에 대한 우리의 연구에 중점을두고 있습니다. 우리는 사춘기 안드로겐이 보상 회로와 동기 부여 행동에 일시적이고 장기적인 영향을 미칠 것을 제안합니다. 우리는 또한 신진 대사-남성 스테로이드 (AAS)의 형태로 외인성 안드로겐을 보충하면 사춘기 안드로겐의 정상적인 영향을 증대시켜 뇌와 행동의 청소년 발달에 악영향을 미친다는 가설을 세웁니다.
뇌 발달에 민감한시기 인 청소년
궁극적으로, 뇌는 청소년기에 안드로겐 작용의 방아쇠이자 표적입니다. 어린 소년 (12 세 미만)과 어린 햄스터 (28 일 미만)에서 순환하는 안드로겐과 성선 자극 호르몬은 기본 수준입니다. 시상 하부 성선 자극 호르몬 방출 호르몬에 대한 반응으로 뇌하수체 전엽에서 황체 형성 호르몬 분비가 증가함에 따라 순환하는 테스토스테론 농도가 크게 증가합니다. 이것은 소년의 경우 Tanner II / III 단계 (14 세), 햄스터의 경우 28 일에 발생합니다. 소년이 Tanner IV / V 기 (약 16 세)에 도달하거나 햄스터가 50-60 일이되면 내인성 테스토스테론이 성인 남성 범위 내에 있습니다. 사춘기 호르몬 분비는 인간의 약 12 ~ 20 세에 발생하는 청소년기와 일치합니다. 사춘기 호르몬은 말초 조직에 작용하여 사춘기의 명백한 징후 인 XNUMX 차 성징의 출현을 유발할뿐만 아니라, 청소년기 뇌의 리모델링과 행동 성숙에 영향을 미치는 중심적으로 작용합니다. 더욱이, 사춘기 호르몬에 의해 야기 된 생리적 및 신경 학적 변화는 개인의 경험에 중요한 변화를 가져오고, 이는 그 자체로 뇌 발달 과정을 근본적으로 바꿀 수 있습니다. 따라서 생식 신경 내분비 축의 발달시기에 따른 성숙에 의해 유도 된 성 스테로이드 호르몬의 사춘기 증가는 신경계에 대한 직간접 적 영향을 통해 청소년 행동 발달을 형성합니다.
인간의 청소년기는 이제 행동 회로가 개조되고 개선되는 주요한 역동적 인 신경 발달 기간으로 인식되고 있습니다. 5 세 아동의 뇌는 이미 성인 크기의 90 % (데카 반, 1978), 중요한 개장은 여전히 진행 중입니다. 이 개념은 주 산기 뇌 발달 동안 발생하는 많은 기본 발달 과정이 청소년기 동안 되풀이된다는 것을 기록한 인간과 동물 연구에 의해 빛을 발했습니다. 이러한 과정에는 신경 생성 (엑켄 호프와 라키 크, 1988; 그와 승무원, 2007; Pinos, Collado, Rodriguez-Zafra, Rodriguez, Segovia 및 Guillamon, 2001; Rankin, Partlow, McCurdy, Giles 및 Fisher, 2003), 프로그램 된 세포 사멸 (Nunez, Lauschke 및 Juraska, 2001; Nunez, Sodhi 및 Juraska, 2002), 수지상 arborizations 및 시냅스의 정교화 및 가지 치기 (Andersen, Rutstein, Benzo, Hostetter 및 Teicher, 1997; Huttenlocher와 Dabholkar, 1997; Lenroot and Giedd, 2006; Sowell, Thompson, Leonard, Welcome, Kan 및 Toga, 2004), 골수 화 (Benes, Turtle, Khan 및 Farol, 1994; Paus, Collins, Evans, Leonard, Pike 및 Zijdenbos, 2001; Sowell, Thompson, Tessner 및 Toga, 2001) 및 성적 차별화 (정, 드 베리, 스와 브, 2002; Davis, Shryne 및 Gorski, 1996; Nunez 등, 2001). 따라서, 출생 후 뇌의 발달 궤적은 선형이 아니라, 빠른 변화의 청소년 버스트를 특징으로하며 진행성 및 회귀 적 사건을 모두 포함한다. 모든 발달 생물학자가 알고 있듯이, 빠른 발달 변화 신호 기간은 경험에 의존하는 변화와 섭동과 모욕의 부정적인 결과에 대한 민감성과 취약성을 높였으며, 인간의 청소년 뇌 발달이 예외라고 생각할 이유가 없습니다.안데르센, 2003; 스피어, 2000). 따라서, 사춘기 뇌에 대한 사춘기 호르몬 영향의시기에 섭동은 성인 행동에 오래 지속되는 결과를 가져올 것으로 예상됩니다.
동기 행동을위한 안드로겐과 신경 회로
청소년기는 일시적이고 역동적 인 발달 단계이기 때문에 청소년의 뇌와 고립 된 행동을 평가하기가 어려울 것입니다. 대신, 청소년기의 독특한 특성을 이해하기 위해서는 성숙한 성인의 두뇌와 행동과 대조하는 것이 도움이됩니다. 따라서 남성의 성 행동과 보상에 대한 본 논문의 초점을두고, 행동 활성화에 대한 생식선 스테로이드 호르몬의 역할 및 안드로겐에 대한 수용체 분포를 포함하여 성인 남성의 교미 및 성적 동기에 대한 신경 회로를 소개하는 것이 중요합니다. (AR) 및 에스트로겐 (ER).
AR은 성과 같은 사회적 행동을 보상하는 신경 회로를 형성하는 세포 그룹에 존재합니다. 또한 뇌 AR은 햄스터에서 사춘기 이전에 발현되며 청소년 및 성인 남성 모두에서 안드로겐에 의해 상향 조절됩니다 (Kashon, Hayes, Shek 및 Sisk, 1995; 온유, 로미오, 노박 및 시스 크, 1997). 설치류 뇌에서는 AR과 ER의 분포가 상당히 겹칩니다 (우드 앤 뉴먼, 1995) 및 아로마 타제 (Celotti, Negri-Cesi 및 Poletti, 1997) (에스트로겐 수용체의 α 및 β 형태 모두 포함) (Shughrue, Lane 및 Merchenthaler, 1997). 리간드에 결합 할 때, "고전적인"AR 및 ER은 새로운 단백질의 전사 및 합성을 유도하는 전사 인자로서 기능한다. 놀랍지 않게도, 이러한 효과는 지연된 행동으로 비교적 느린 시간 경과를 따릅니다. 남성 햄스터 성 행동의 스테로이드 자극귀족과 알섬, 1975)는 고전적인 게놈 행동을 통한 행동과 일치합니다. 예를 들어, 장기 거세에서 짝짓기를 복원하려면 2주의 스테로이드 노출이 필요합니다. 쥐에 대한보다 최근의 연구는 고전 수용체가 거의없는 뇌 영역에서 안드로겐의 빠른 세포 효과를 보여주었습니다.1996, Mermelstein, Becker 및 Surmeier). 이러한 스테로이드 작용은 비유 전자 수용체에 의해 매개되는 것으로 생각된다. 햄스터 뇌에서 고전적 AR과 ER의 분포는 상대적으로 제한적이지만 (나무와 스완, 1999), 비유 전자 안드로겐 작용에 대한 잠재적 인 뇌 표적이 훨씬 더 넓다.
MPOA (medial preoptic area)는 금붕어에서 인간까지 수컷의 교미에 중심적인 역할을한다 ( 선체, 목재 및 맥 케나, 2006). 또한 햄스터 MPOA는 풍부한 AR과 ER을 통해 생식선 스테로이드 호르몬을 형질 도입하며 MPOA의 테스토스테론 임플란트는 장기 거세에서 성행위를 회복하기에 충분합니다.나무와 스완, 1999). 수컷 쥐에서 생식선 스테로이드는 MPOA에서 작용하여 기저 DA 방출을 조절합니다 (Putnam, Sato 및 Hull, 2003)와 짝짓기 자극 (헐, 듀, 로레인, 마투 제 위치, 1995). 처음에는 암컷이 화면 뒤에 표시 될 때 DA가 약간 증가합니다. 교미 중 MPOA DA가 추가로 증가하고 (기준의 + 50 %)이 효과는 안드로겐 (헐 (Hull) 등, 1995; Putnam 등 2003). 당연히 짝 짓지 않는 거세 된 남성에서는 MPOA DA가 증가하지 않습니다 (헐 (Hull) 등, 1995). DA 방출의 부족은 성적 활동의 부재로 인해 혼란스러워지기 때문에이 결과를 해석하는 것은 다소 어렵습니다. 그러나 MPOA의 DA 방출은 단기 거세에서 짝짓기 손실과 관련이 있습니다.헐 (Hull) 등, 1995), 장기 거세에서 테스토스테론에 의한 성 활동 회복 (Du, Lorrain 및 Hull, 1998; Putnam, Du, Sato 및 Hull, 2001).
설치류 MPOA 내에서 테스토스테론의 안드로겐 성 및 에스트로겐 성 대사 산물은 짝짓기 조절에 특정한 역할을합니다 (Putnam 등 2003; Putnam, Sato, Riolo 및 Hull, 2005). 교미를 시작하기위한 대기 시간 (마운트 또는 인트 로이트)은 성적 동기의 한 척도입니다. 성적 활동에 대한 대기 시간은 MPOA 산화 질소 신타 제의 유지를 통해 에스트로겐에 민감하며, 이는 결국 기초 DA 수준을 유지합니다. 에스트로겐으로 처리 된 거세는 높은 기저 DA 수준을 나타내며, 이는 구리를 시작하는 능력과 밀접한 관련이 있습니다. 그러나 그들은 DA 방출에서 암컷과 구리에 의한 유발 증가를 보여주지 못하는데 이는 성적 성과와 밀접한 관련이 있습니다. 결과적으로 성적 성과는 그대로입니다. 한편, 비 방향족 안드로겐 단독으로 처리 된 거세는 기저 DA 수준이 높지 않으며 교미를 시작하지 못합니다. 따라서 정상적인 성기능을 위해서는 에스트로겐과 안드로겐이 모두 필요합니다. 성적인 성과는 일반적으로 산, 입문 및 사정의 빈도 측정으로 표현됩니다. 에스트로겐과 안드로겐이 모두 교체 된 경우에만 거세 된 수컷은 DA 수준이 높아지고 (대기 시간이 짧아짐) 암컷과 구리에 의해 유발되는 DA가 증가하고 (빈도가 증가 함) 나타납니다. 이러한 방식으로, MPOA의 에스트로겐은 성적 동기 부여에 기여하고, 에스트로겐과 안드로겐은 성기능에 기여합니다.
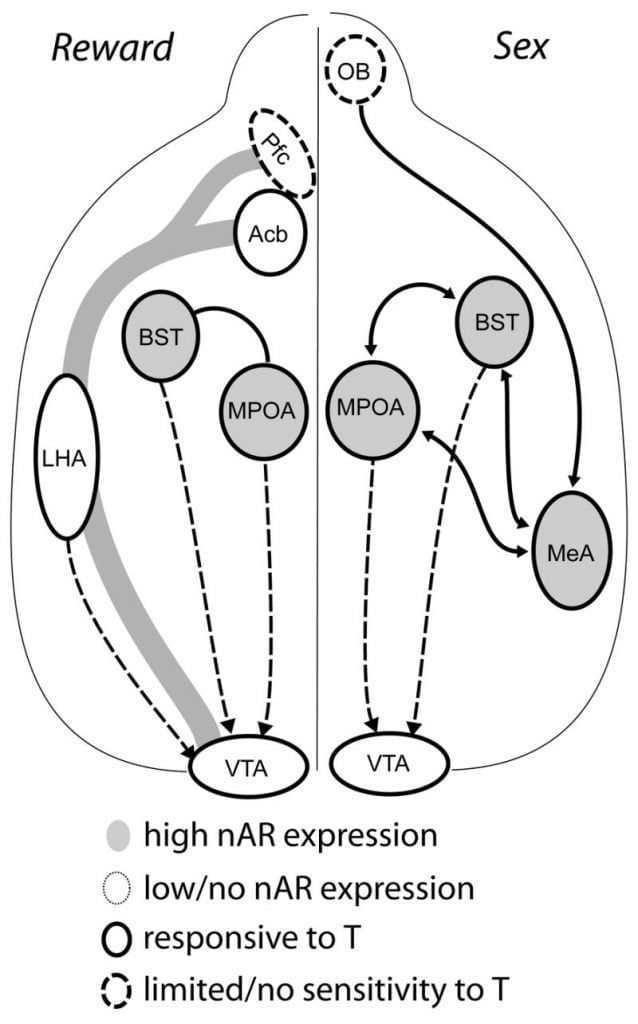
테스토스테론은 남성 copulatory 행동 동안 MPOA DA 방출과 짝짓기에 필요하지만, 테스토스테론이나 짝짓기만으로는 MPOA에서 DA를 유발할 수 없습니다. 대신, MPOA에서 DA 방출을 위해서는 특정 암컷의 화학 감각 신호가 필요하다. 설치류에서 화학 감각 자극은 남성의 성행위를 시작하는 주요한 감각 방식입니다 (Fig. 1). 화학 감각 신호는 후각 구근에서 내측 편도핵 및 선조 종말의 층핵을 통해 후각 전구에서 MPOA로 전달됩니다.나무와 스완, 1999). 짝짓기 유발 된 DA에서 화학 감각 단서의 역할을 결정하기 위해, 일측 후각 구근 절제술 (UBx, Triemstra, Nagatani 및 Wood, 2005). 후각 구근의 양측 제거는 성적 활동 및 MPOA DA 방출을 제거하지만, 일방적 구근 절제는 교합을 방해하지 않습니다. 이 연구에서, 구리는 병변 후각 구와 반대쪽을 측정 하였을 때 MPOA DA 방출을 유도했지만 동측 반구에서는 그렇지 않았다 (Fig. 2). 내측 편도의 병변이있는 수컷 쥐에서 유사한 결과가 관찰되었다 (Dominguez, Riolo, Xu 및 Hull, 2001). 관련 연구에서, 쥐에서 내측 편도의 화학적 자극은 교미 동안의 것과 동등한 MPOA DA 방출을 유도 하였다 (도 밍게 즈와 헐, 2001). 종합하면, 이들 데이터는 테스토스테론이 외부 감각 자극이 MPOA에 도달하고 교미 동안 DA 방출을 유도 할 수있는 허용적인 환경을 생성 함을 시사한다.

Fig. 2
궁극적으로 성적 행동 및 기타 자연적인 보상은 신경 보상 경로를 활성화합니다. 중음부 전위 DA 회로는 복부 Tegmental Area (VTA), Nucleus Accumbens (Acb) 및 Prefrontal Cortex (Pfc)로 구성됩니다. VTA 프로젝트에 상주하는 도파민 세포체는 Acb와 Pfc에Koob과 Nestler, 1997). 쥐에서 DA는 성관계 중에 Acb로 방출됩니다 (Pfaus, Damsma, Nomikos, Wenkstern, Blaha, Phillips 및 Fibiger, 1990). 또한 많은 약물 남용 약물은 mesolimbic DA 시스템에서 DA 방출 (암페타민)을 증가 시키거나 DA 재 흡수 (코카인, 디 키아라와 임페라토, 1988) 중독성 강화 이러한 방식으로 테스토스테론은 성적 행동의 향상과 남용 약물의 행동을 통해 Acb에서 DA의 방출에 영향을 줄 수 있습니다 (아래 참조).
현재의 증거는 청소년기 동안 mesocorticolimbic DA 시스템이 성숙함을 시사합니다. Acb DA 섬유 밀도는 gerbils에서 청소년기 동안 급격히 증가하여 Acb에 대한 VTA dopaminergic 계획의 성숙이 청소년기 동안 발생 함을 시사합니다.Lesting, Neddens 및 Teuchert-Noodt, 2005). 또한, 쥐 내측 전전두엽 피질에서 GABA (γ- 아미노 부티르산)-에르 신 세포에 대한 도파민 성 입력은 사춘기 발달 동안 세로토닌 성 시스템에 의해 풍부 해지고 조절된다 (Benes, Taylor 및 Cunningham, 2000), 및 성인 랫트에서 안드로겐의 조작은 전전두엽 피질 내에서 도파민 성 축삭 밀도의 변화를 초래한다 (크리처, 2003). Pfc, Acb 및 VTA에는 AR 또는 ER이 거의 없지만 ERβ는 VTA에 있지만 (Shughrue et al., 1997). 따라서, 안드로겐은 시상 하부에서와 같이 안드로겐에 민감한 구 심성 또는 VTA의 ERβ를 통해 mesocorticolimbic DA 시스템에 영향을 줄 것으로 보인다 (Handa et al.,이 이슈). 우리의 데이터 남성 햄스터에서 안 드로 겐에 민감한 세포 스테로이드에 민감한 행동과 관련 된 구조에서 VTA에 프로젝트를 보여줍니다. 예를 들어, MPOA와 stria terminalis (BST)의 상핵은 VTA에 투영되는 많은 수의 AR- 양성 세포 (사토와 우드, 2006). 복부 pallidum, 주요 Acb efferent 대상 (Zanum and Heimer, 1990)에는 VTA에 투영되는 많은 AR- 양성 세포가 포함되어 있습니다. 이러한 투영법은 안드로겐이 중생 골수 계 DA 시스템의 활동을 수정할 수있는 기회를 제공합니다.
청소년기의 스테로이드 의존적 행동 조직
청소년 행동에 대한 호르몬 작용에 대한 전통적인 견해는 스테로이드 호르몬의 활성화 효과에 기초합니다. 스테로이드 호르몬은 행동이 신경 회로의 기본 기능인 표적 세포 내에서 작용함으로써 특정 사회적 맥락에서 행동을 촉진하는 스테로이드의 능력을 나타냅니다. 활성화 효과는 호르몬의 유무에 관계없이 일시적인 것이며 일시적으로 성인 행동의 표현과 관련이 있습니다. 대조적으로, 조직 효과는 발달 동안 스테로이드가 신경계 구조를 조각 할 수있는 능력을 말한다. 구조적 조직은 영구적이며, 호르몬 노출 기간을 넘어 지속되며, 성인의 스테로이드에 대한 신경 및 행동 반응을 결정합니다. 스테로이드 호르몬의 조직 효과와 활성화 효과 사이의 발달 관계에 대한 우리의 이해는 지난 50 년 동안 진화했습니다. 피닉스와 동료들은 먼저 스테로이드 호르몬에 대한 성인 행동 (활성화) 반응이 주 산기 발달의 최대 민감한 기간 동안 스테로이드 호르몬에 의해 프로그래밍 (조직화)된다고 제안했습니다.Phoenix, Goy, Gerall 및 Young, 1959). 나중에 Scott과 동료들은 신경계의 점진적 조직을 위해 여러 민감한시기가 존재한다는 이론적 토대를 마련했으며 민감한시기는 빠른 발달 변화 기간 (1974) 동안 발생할 가능성이 가장 높다고 지적했습니다. 결과적으로 Arnold와 Breedlove는 뇌의 스테로이드 의존적 조직이 민감한 발달 기간이 아닌 곳에서 발생할 수 있다고 지적했다.아놀드와 브리드 러브, 1985). 지난 15 년 동안 다양한 동물 모델과 행동 시스템을 사용한 연구에 따르면 청소년 뇌가 생식선 스테로이드의 활성화 및 조직 효과에 민감하다는 것이 분명해졌습니다. 시스 크와 제르, 2005). 그리고 다른시기의 빠른 발달 변화와 마찬가지로, 청소년기는 스테로이드 의존적 뇌 리모델링을위한 정해진 기회 창을 나타냅니다.
햄스터를 동물 모델로 사용한 우리의 연구는 사춘기 동안 남성의 사회적 행동이 스테로이드에 의해 수정되었다는 증거를 제공합니다 (Schulz, Menard, Smith, Albers 및 Sisk, 2006; 슐츠와 시스 크, 2006). 사춘기 이전에, 테스토스테론 치료는 햄스터에서 성적인 행동을 활성화시킬 수 없어, 신경계가 스테로이드 호르몬에 의해 활성화되거나 조직화되기 쉬운 성숙 과정은 아직 발생하지 않았 음을 암시합니다 (Meek et al., 1997; Romeo, Richardson 및 Sisk, 2002a). 반대로, 성인기에 남성 생식 행동이 명백하게 표현되기 위해서는 청소년기 동안 생식선 스테로이드가 반드시 필요한 것은 아니지만, 행동이 최대한 표현될 때는 필요합니다. 사춘기 전(NoT@P) 또는 사춘기 후(T@P)에 거세한 후 성인기에 테스토스테론으로 치료한 남성의 남성 생식 행동을 비교하면, 사춘기 전 NoT@P 거세자는 청소년기 이후에 거세한 남성에 비해 남성 행동이 50% 이상 부족합니다. (Fig. 3, Schulz, Richardson, Zehr, Osetek, Menard 및 Sisk, 2004). 또한 생식 행동의 결함은 오래 지속되며 장기간의 테스토스테론 치료 또는 성인의 성적 경험으로 극복 할 수 없습니다 (Schulz et al., 2004). 마찬가지로, 에스트로겐과 프로게스테론으로 치료한 후 NoT@P 수컷은 성인이 되어 거세한 수컷에 비해 전만 잠복기가 더 짧고 전만 지속 기간이 더 길었습니다.Schulz et al., 2004)에 따르면 사춘기 전의 거세는 사춘기 테스토스테론에 노출 된 수컷보다 덜 여성화됩니다.

Fig. 3
NoT@P 남성은 성적 동기 감소로 고통받을 수도 있습니다. 이 질문을 해결하는 한 가지 방법은 항문 생식기 조사(AGI)와 사춘기 이전(NoT@P)과 사춘기 이후(T@P) 생식선 절제술을 받은 남성 간의 장착에 참여하는 대기 시간을 비교하는 것입니다. 성적 동기가 청소년기의 생식선 호르몬 노출에 달려 있다면 NoT@P 남성의 성적 행동에 참여하는 데 더 긴 잠복기가 있을 것으로 예측할 수 있습니다. 실제로, 발정기 암컷에 반복적으로 노출되면 NoT@P 수컷은 T@P 수컷에 비해 AGI 및 탑승을 시작하는 데 더 오랜 시간이 걸립니다.Fig. 4). 따라서 사춘기 호르몬은 성행위의 측면을 구성하는 것 외에도 성적 행동의 보람 있는 측면도 구성하는 것으로 보입니다. 이러한 가능성을 뒷받침하기 위해 성인기에 DA 작용제 아포모르핀을 중앙 투여하면 NoT@P 남성의 증가하는 행동이 성인의 전형적인 수준으로 회복됩니다. 이는 청소년기의 테스토스테론이 일반적으로 도파민 신경 회로를 구성한다는 것을 의미합니다(Salas-Ramirez, Montalto, and Sisk, 2006) ). 그럼에도 불구하고 많은 흥미로운 질문이 남아 있습니다. NoT@P 수컷은 발정한 암컷을 위해 바프레스할 것인가, 아니면 짝짓기 장소에 대해 조건부 선호 장소를 개발할 것인가? 향후 연구에서는 성적 동기와 성적 수행을 조직하는 데 있어서 사춘기 호르몬의 역할을 탐구할 것입니다.

Fig. 4
사춘기 이전(NoT@P) 또는 사춘기 이후(T@P) 생식선 절제술을 받은 수컷 햄스터가 나타내는 항문생식기 조사(AGI) 잠복기 및 기간. 모든 남성은 성선 절제술 후 7주와 첫 번째 행동 테스트 XNUMX주일 전에 성인기에 테스토스테론 프라이밍을 받았습니다. A. T@P 수컷은 발정된 암컷을 사용한 세 가지 테스트에서 유사한 AGI 잠복기를 보인 반면, NoT@P 수컷은 발정된 암컷을 사용한 세 번째 테스트에서 AGI 잠복기를 증가시켰습니다. B. T@P 수컷은 발정 여성을 대상으로 한 세 가지 행동 테스트에서 마운트 대기 시간을 줄인 반면, noT@P 수컷은 세 가지 행동 테스트에서 마운트 대기 시간에 변화가 없는 것으로 나타났습니다. 이러한 데이터는 사춘기 생식선 호르몬이 여성과 성행위를 하려는 성인 남성의 동기에 지속적이고 촉진적인 효과가 있음을 시사합니다. (동물을 대상으로 한 미공개 데이터는 Schulz, KM, Richardson, HN, Zehr, JL, Osetek, AJ, Menard, TA 및 Sisk, CL, 2004).
스테로이드에 대한 사춘기 전 행동 반응
청소년 행동 발달의 지속적인 퍼즐 중 하나는 스테로이드 노출에 반응하여 생식 행동의 활성화가 사춘기 전 남성 햄스터에서 약화되는 이유입니다. 사춘기 이전의 안드로겐 수치가 사춘기 전 남성의 남성 성 행동의 표현을 제한하는 경우, 사춘기 전 남성의 내인성 안드로겐 보충은 교배를 유발해야합니다. 이것은 사실이 아닙니다 (Meek et al., 1997; Romeo, Cook-Wiens, Richardson 및 Sisk, 2001; Romeo, Wagner, Jansen, Diedrich 및 Sisk, 2002b), 짝짓기 회로를 통한 AR 및 ER의 수 및 분포는 호르몬 치료 된 사춘기 및 성인 거세에서 비슷하다는 사실에도 불구하고Meek et al., 1997; Romeo, Diedrich 및 Sisk, 1999; Romeo et al., 2002a). 따라서 남성의 성행위 표현에는 안드로겐과 AR이 필요하지만 충분하지 않은 것으로 보입니다.
사춘기 이전에 성행위를 제한하는 요인을 찾기위한 노력은 지금까지 혼합되어 있습니다. 발정기 암컷의 화학 감각 신호에 대한 Fos 반응은 사춘기 전과 성인 남성 햄스터에서 비슷합니다 (Romeo, Parfitt, Richardson 및 Sisk, 1998). 이 데이터는 감각 전달 메커니즘이 사춘기 전에 성숙함을 보여줍니다. 따라서, 청소년 수컷은 암컷으로부터 화학 감각 신호를 검출 할 수있다; 성인과 다른 점은 그 신호에 어떻게 대응 하는가입니다. 잠재적 인 설명 중 하나는 사춘기 전의 남성이 성적인 행동에 동기를 부여하지 않는다는 것입니다. 우리는 prepubertal 남성 햄스터 여성 페로몬에 대 한 응답으로 MPOA에 증가 된 dopaminergic 응답을 표시하지 않는 반면 성적 순진한 성인 남성 같은 자극에 대 한 강력한 MPOA dopaminergic 응답을 표시 (Fig. 5, Schulz, Richardson, Romeo, Morris, Lookingland 및 Sisk, 2003). 마찬가지로, 사춘기 전의 수컷은 여성 페로몬에 노출 된 후 순환 테스토스테론이 성인에서 전형적으로 증가하지 않음을 나타냅니다 (Parfitt, Thompson, Richardson, Romeo 및 Sisk, 1999). 따라서, 여성 페로몬은 성인에서 신경 화학 및 신경 내분비 반응에 대한 무조건 자극으로 보이지만 사춘기 전 남성에서는 그렇지 않으며, 이러한 사회적 관련 감각 자극의 영향이 사춘기 발달에 비해 변할 수 있으며, 이는 보람있는 속성 및 성적인 동기 부여와 관련이있을 수 있습니다. 또한, 테스토스테론은 사춘기 전 남성의 여성의 AGI를 촉진하지만,이 효과는 남성이 발정 한 여성에게 이전에 노출되었는지 여부에 달려 있습니다. 아마도 놀랍게도, 테스토스테론 치료는 성적으로 나이가 적은 prepubertal 남성에서만 지연 시간을 줄이고 AGI의 지속 시간을 증가시킵니다 (Fig. 6). 또한 여성에 대한 이전 경험이 있었던 사춘기 전 남성은 처음으로 수용 여성과 상호 작용하는 남성보다 AGI 대기 시간이 짧고 AGI 기간이 짧습니다 (Fig. 6). 이 데이터는 사춘기 이전에 estrous 여성과의 상호 작용이 사춘기 이전에 보람이 아니라 혐오 스럽기 때문에 여성과의 후속 상호 작용 중에 AGI에 대한 테스토스테론의 촉진 효과를 제거합니다. estrous 여성에 대한 초기 노출의 부정적인 행동 결과가 젊음과 성인으로 지속되는지, 특히 estrous 여성에 반복적으로 노출되는 경우를 아는 것이 흥미로울 것입니다. ...동안 청소년기는 일반적으로 남성 생식 행동의 표현을 촉진합니다.Molenda-Figueira, Salas-Ramirez, Schulz, Zehr, Montalto 및 Sisk, 2007).

Fig. 5
질 분비물에 포함 된 여성 페로몬에 대한 전립선 및 성인 남성 중간 전안 영역 (MPOA) 도파민 반응. 성인 남성은 여성 질 분비에 노출 된 MPOA 도파민 활성을 증가시키는 반면, 사춘기 전 남성은 여성 페로몬에 대한 MPOA 도파민 반응을 증가시키지 않았다. (에서 다시 그리기 Schulz, KM, Richardson, HN, Romeo, RD, Morris, JA, Lookingland, KJ 및 Sisk, CL, 2003).

사춘기 이전의 안드로겐 치료가 교미를 유발할 수는 없지만, 우리 실험실의 최근 연구에 따르면 햄스터 신경계는 사춘기 이전의 생식 행동에 대한 테스토스테론의 조직 작용에 민감합니다 (Schulz, Zehr, Salas-Ramirez 및 Sisk, 2007). 청소년기 전 또는 동안 (후)에 테스토스테론 노출을 거세하지 않고 19 일 동안 거세하면 테스토스테론이 성인으로 교체되었을 때 장착 행동이 촉진되었습니다. 사춘기 이전 또는 이후에 테스토스테론에 노출 된 남성은 사춘기 중 또는 사후 테스토스테론에 노출 된 남성보다 성인기에 더 많은 내향성을 보였다 (Schulz et al., 2007). 이 데이터는 행동 신경 회로를 구성하는 테스토스테론의 능력이 나이가 들어감에 따라 감소하고, 청소년기의 테스토스테론 노출에 대한 산후 민감한 기간의 끝을 나타냅니다.
약리 안드로겐
상기 데이터는 내인성 생식선 스테로이드가 청소년기 동안 동기 부여 된 행동을 향상 시킨다는 것을 시사한다. 자, 한 명의자가 관리자가 100x 정상 생리 학적 농도까지 안드로 프하면 어떻게됩니까? 이것은 신진 대사 남성 홀몬 스테로이드 (AAS) 남용의 문제입니다 브루어, 2002; 클라크 앤 헨더슨, 2003). 여기에 짧은 침략이 적절하다 : 모든 AAS는 테스토스테론의 유도체이며, 모든 AAS는 4 융합 고리를 갖는 탄소 골격을 갖고, 대부분 19 탄소를 갖는다. AAS는 주로 신진 대사 (근육 형성) 효과에 사용됩니다. 그러나 이름에서 알 수 있듯이 AAS에는 남성 홀몬 특성도 있습니다. 테스토스테론은 안드로겐 보상의 기본 메커니즘을 탐구하기 위해 동물 연구에서 논리적으로 선택됩니다. 그것은 테스토스테론 프로 피오 네이트와 같은 오래 지속되는 테스토스테론 에스테르의 형태로 인간 사용자에게도 인기있는 선택으로 남아 있습니다. 2006에서 테스토스테론은 WADA 인증 실험실에서 소변 검사에서 발견 된 가장 흔한 단일 금지 물질이었습니다 (와다, 2006). 테스토스테론은 34 시드니 올림픽 게임에서 AAS 양성 소변 검사의 가장 큰 비율 (2000 %)을 차지했습니다 (Van Eenoo와 Delbeke, 2003). 마찬가지로 AAS 사용자의 소변 검사에서 41 %는 테스토스테론에 대해 양성으로 검사되었습니다 (브루어, 캐 틀린, 블로우, 엘리오 폴로 스, 베레스포드, 1991). 고용량에서 AAS는 중대한 행동 변화를 일으 킵니다. 특히, 테스토스테론과의 밀접한 관계로 인해, 10 년 동안의 AAS 사용은 스테로이드 노출의 양,시기 및 유형을 포함하여 발달하는 인간 청소년 신경계의 정상적인 스테로이드 환경을 교란시키는 것으로 보인다.
다른 불법 약물과 마찬가지로, 인간 AAS 남용은 청소년기의 문제입니다. 약물 사용에 관한 1994 전국 가구 조사에 따르면SAMHSA / OAS, 1996), 스테로이드는 18 세의 청소년기 후기에 피크를 사용합니다. 또한 미래의 모니터링 조사에서Johnston, O'Malley and Bachman, 2003), 고등학생 (2.7 %)의 스테로이드 사용 수명은 크랙 코카인 (3.5 %) 또는 헤로인 (1.4 %)과 비슷합니다. 스테로이드 사용은 또한 어린 나이에 점점 일반화되고 있습니다 : 2.5 학년 학생의 8 % (13 – 14 년)는 크랙 발생률 (2.5 %) 및 헤로인 사용 (1.6 %)과 유사한 스테로이드를 사용했습니다. 10 대 초반 AAS 사용에 대한 이러한 경향은 1) 청소년의 경우 특히 AAS 남용에 취약 할 수 있다는 우려와 2), 약리학 적 수준에서 AAS에 대한 청소년 노출이 뇌와 뇌의 정상적인 성숙을 실질적으로 변화시킬 가능성이 있다는 점에서 문제가됩니다. 급성 및 만성적으로 과장된 형태 및 행동 반응을 일으키는 행동.
부적절한 침략은 인간 AAS 남용과 가장 관련이있는 행동 반응입니다. 공개 된 사례 보고서에서 스테로이드 사용은 여러 가지 폭력 살인에 연루되어 있습니다 (코나 허와 노동자, 1989; 교황과 카츠, 1990; 교황, 코 우리, 파월, 캠벨, 카츠, 1996; 슐트, 홀 및 보이어, 1993). 현재 AAS 사용자를 대상으로 한 조사에서 공격성과 과민성이 증가한 것이 AAS 사용의 가장 일반적인 행동 부작용이었습니다 (본드 최와 교황 1995; Galligani, Renck 및 Hansen, 1996; Midgley, Heather 및 Davies, 2001; 앵무새, 최, 데이비스, 1994; Perry, Kutscher, Lund, Yates, Holman 및 Demers, 2003). 그러나 안드로겐 노출의 범위, 다양한 정신 증상 및 기존 정신 장애의 가능성을 고려할 때 이러한 인간 침략의 경우 AAS의 정확한 역할을 결정하는 것은 어렵습니다. AAS 주사를받은 인간 지원자에 대한 전향 적 연구 결과가 혼합되었습니다. Tricker 등 (1996) 및 오코너 등 (2004) 화난 행동은 증가하지 않았으며 다른 연구에서는 공격성이 증가한 것으로 나타났습니다.Daly, Su, Schmidt, Pickar, Murphy 및 Rubinow, 2001; Hannan, Friedl, Zold, Kettler 및 Plymate, 1991; Kouri, Lukas, Pope 및 Oliva, 1995; 교황과 카츠, 1994; Su, Pagliaro, Schmidt, Pickar, Wolkowitz 및 Rubinow, 1993). 그럼에도 불구하고, 인간 자원 봉사자에게 투여되는 복용량은 보디 빌딩 웹 사이트에서 주장하는 복용량보다 훨씬 낮으며 치료 기간은 일반적으로 짧다는 것을 명심하는 것이 중요합니다. 따라서, AAS는 적어도 취약한 개인들에게 작용제 행동을 향상시킬 가능성이 있다고 결론을 내리는 것이 공정한 것 같습니다. 교황 외 (1994) AAS는 취약한 개인의 정신 증상을 유발한다는 사실을 발견했습니다.
동물 연구는 또한 AAS- 유도 된 침략에 대한 강력한 증거를 제공했다. 고용량 스테로이드로 만성적으로 치료 된 청소년 수컷 햄스터는 치료되지 않은 수컷에 비해 공격 지연 시간이 짧고 수컷 침입자를 향한 공격과 물기가 더 많습니다 (해리슨, 코너, 노박, 내쉬, 멜로니, 2000; 멜로니, 코너, Hang, Harrison, Ferris, 1997). 마찬가지로 경미한 도발 (꼬리 핀치)은 암컷에 대한 침략을 포함하여 사춘기 수컷 쥐에서 침략이 지속적으로 증가합니다 (커닝햄과 맥기니스, 2006). 더 큰 걱정거리 인 햄스터에서 AAS에 노출되면 스테로이드 사용이 중단 된 후에도 지속되는 작용 작용이 지속적으로 증가합니다 (Grimes and Melloni, 2006). 이러한 행동 변화는 시상 하부의 신경 회로의 지속적인 리모델링을 동반합니다. 특히, 햄스터에서의 청소년 AAS 노출은 아르기닌 바소프레신 (AVP, Grimes and Melloni, 2006) 및 세로토닌 및 세로토닌 성 5HT1A 및 5HT1B 수용체를 하향 조절합니다 (Ricci, Rasakham, Grimes 및 Melloni, 2006). AAS가 AR의 뇌 수준을 변화시키는 것은 놀라운 일이 아닙니다. 테스토스테론 또는 난드 롤론에 만성 노출되면 수컷 쥐의 세포 핵 AR을 상향 조절합니다 (메 나드와 할란, 1993; 웨슨과 맥기니스, 2006). 따라서, AAS가 내인성 안드로겐을 보충하고 증가 된 AR 발현을 통해 안드로겐 반응성을 증가시킴으로써 안드로겐-의존적 거동을 향상시킬 가능성이있다.
작용 작용에 비해 AAS는 수컷 설치류의 짝짓기 행동에 덜 현저한 영향을 미치며 반응은 사용 된 특정 스테로이드에 따라 달라집니다 ( 클라크 앤 헨더슨, 2003). 구강 용 용액에서 테스토스테론을 섭취하는 수컷 햄스터에서 사정 량은 복용량에 따라 증가했습니다 (Wood, 2002). 그러나, 테스토스테론이나 낸드 롤론은 사춘기 수컷 쥐에서 짝짓기를 강화하지 않았습니다. 최소 안드로겐 활성을 갖는 비교적 덜 강력한 AAS 인 Stanozolol은 실제로 내인성 안드로겐 수준을 감소시킴으로써 교배 및 침략 (Farrell and McGinnis, 2003)을 모두 억제했습니다.
청소년 및 성인 햄스터는 AAS 노출에 대해 다른 행동 반응을 보일 수 있다는 점에 특히 유의해야합니다. AAS는 사춘기 남성에서 작용 작용을 현저히 향상 시켰지만, 성인의 동일한 치료는 공격적인 행동의 완만 한 증가와 성적인 행동의 현저한 감소를 가져 왔습니다 (살라스 라미레즈, 몬탈도 및 시스 크, 2008). 이것은 안드로겐 작용에 민감한 기간으로서의 청소년기 개념과 일치합니다. 또한 성인 남성 햄스터가 외인성 테스토스테론에 대한 내성을 얻는 것처럼 (피터와 우드, 2005), 우리는 남성이 발달함에 따라 테스토스테론에 대한 내성을 얻습니다. 따라서, 청소년 발달에 걸쳐 AAS의 영향이 변하고, 청소년 AAS 노출은 성인이 될 수있는 과도한 공격적이고 성적인 행동 패턴을 유발할 수 있습니다.
안드로겐의 강화 효과
짝짓기와 싸움은 각각 보람이 있습니다 (적어도 싸움에서이기는 경우). 수컷 쥐는 암컷과 교감하기 위해 레버를 반복해서 누릅니다 (Everitt와 Stacey, 1987). 마찬가지로 수컷 생쥐와 암컷 햄스터는 이전에 전투에서 승리 한 장소에 대해 조건부 장소 선호 (CPP)를 형성합니다 (Martinez, Guillen-Salazar, Salvador 및 Simon, 1995; Meisel과 Joppa, 1994). AAS가 생식선 손상 남성에서 일반적으로 관찰되는 수준 이상의 보람있는 사회적 행동을 향상시킬 수 있다면, 테스토스테론 자체가 보람을 가질 것으로 기대하는 것이 합리적입니다. 이것은 보상과 강화를 위해 잘 확립 된 두 가지 동물 모델 인 CPP와 자기 관리를 사용하여 테스트되었습니다. 이 연구의 결과는 테스토스테론이 단백 동화 효과와 운동 성능과 관련이없는 실험 상황에서 강화되고 있음을 보여줍니다. CPP를 사용하면 테스트 물질이 고유 한 환경 (예 : 테스트 장치의 특정 챔버)과 반복적으로 페어링됩니다. 일단 동물이 강화 시험 물질을 그 환경과 연관 시키면 보상이없는 환경에서도 환경을 찾을 것입니다. 실험실 동물에서 안드로겐 보상의 첫 번째 보고서는 수컷 생쥐에서 CPP를 유도하기 위해 테스토스테론의 전신 주사를 사용했습니다.Arnedo, Salvador, Martinez-Sanchis 및 Gonzalez-Bono, 2000; Arnedo, Salvador, Martinez-Sanchis 및 Pellicer, 2002) 및 쥐 (Alexander, Packard 및 Hines, 1994; de Beun, Jansen, Slangen 및 Van de Poll, 1992). 그 후, 우리 실험실은 테스토스테론의 자기 관리를 사용하여 안드로겐 강화를 보여주었습니다.존슨과 우드, 2001). 우리는 수컷 햄스터가 2- 병 선택 시험과 음식에 의한 음주를 사용하여 테스토스테론의 경구 용액을 자발적으로 섭취 할 것임을 발견했습니다. 이후 연구에서, 우리는 수컷 쥐와 햄스터에서 IV자가 투여를 시연했습니다 (Wood, Johnson, Chu, Schad 및 Self, 2004). 정맥 내 전달은 안드로겐 섭취에 대한 맛 또는 내장 충진의 잠재적 혼란 효과를 제거합니다.
AAS 남용의 맥락에서, 안드로겐의 중추 및 말초 효과를 구별하는 것이 중요합니다. 테스토스테론은 전신에 광범위한 영향을 미치기 때문에, 전신 테스토스테론 주사에 의한 보상과 강화는 테스토스테론의 전신 신진 대사 및 남성 홀몬 작용에 이차적 일 수 있습니다. 즉, 테스토스테론은 근육 피로를 줄이고 관절 기능을 개선하여 동물이 세 연령의 아시안이 보다 나은. 실제로,이 설명은 AAS에 대한 의존성과 중독 가능성에 대항하기 위해 임상 문헌 (실험적 증거는 없지만)에서 사용되었다.DiPasquale, 1998). 그러나 Packard et al.Packard, Cornell 및 Alexander, 1997)은 테스토스테론을 쥐 뇌에 직접 주사하면 CPP를 유도 할 수 있음을 보여 주었다. 마찬가지로, 우리 실험실은 남성 햄스터에서 뇌 실내 (icv) 테스토스테론자가 투여를 시연했습니다 (Wood 등, 2004). 테스토스테론을 이용한 뇌내 CPP 및 icv자가 투여는 안드로겐 강화를 매개하는 중심 표적을 주장한다.
테스토스테론 강화가 성 행동에 대한 스테로이드 효과에 대해 이전에 확립 된 것과 동일한 메커니즘을 반드시 따르지 않을 수도 있습니다. 앞에서 논의한 바와 같이, MPOA는 남성 설치류 성행위 조직을위한 주요 사이트입니다 (선체, Meisel 및 Sachs, 2002). 햄스터에서 MPOA는 풍부한 스테로이드 수용체를 가지고 있으며 MPOA의 테스토스테론 임플란트는 장기 거세에서 성적 활동을 회복합니다 (나무와 스완, 1999). 이러한 스테로이드 효과의 시간 경과는 느리다 : 난관 절제술 후 몇 주 동안 장착 거동이 지속되며 장기 거세에서 짝짓기를 복원하기 위해 장기간의 스테로이드 노출이 필요합니다.귀족과 알섬, 1975). 그러나 수컷 쥐의 MPOA에 테스토스테론 주사는 CPP를 유도하지 못한다.킹, 팩커드 및 알렉산더, 1999). 이것은 다른 뇌 영역이 안드로겐 강화에 중요하다는 것을 시사합니다.
대조적으로, 수컷 쥐는 Acb에서 테스토스테론 주사에 대한 CPP를 형성 할 것입니다.Packard et al., 1997). 다른 남용 약물과 마찬가지로 DA는 테스토스테론 강화를위한 주요 신경 전달 물질 일 가능성이 높습니다. 전신 테스토스테론 주사로 유도 된 CPP는 D1 및 D2 도파민 수용체 길항제에 의해 차단됩니다 (슈뢰더와 팩커드, 2000). 그러나 다른 약물 남용과 달리 햄스터에 대한 연구에 따르면 테스토스테론은 Acb DA 방출을 유발하지 않습니다.트리엠 스트라, 사토, 우드, 언론). 마찬가지로, 수컷 쥐에 대한 연구에 따르면 안드로겐은 기저 DA 수준 또는 암페타민 자극 DA 방출에 영향을 미치지 않습니다 (Birgner, Kindlundh-Hogberg, Nyberg 및 Bergstrom, 2006; 뿐만 아니라 참조 Clark, Lindenfeld 및 Gibbons, 1996). 또한, 테스토스테론은 Acb DA 조직 수준에 비교적 작은 영향을 미칩니다 (Thiblin, Finn, Ross 및 Stenfors, 1999). 함께, 이들 데이터는 테스토스테론 강화가 궁극적으로 Acb에서 DA 활성을 변화시킬 수 있지만, 그 메커니즘은 코카인 또는 다른 자극제의 메커니즘과 구별 될 수 있음을 시사한다. 이와 관련하여 최근 데이터에 따르면 AAS에 만성적으로 노출되면 DA 대사를 변경하여 DA에 대한 민감도를 변경할 수 있다고합니다 (Kurling, Kankaanpaa, Ellermaa, Karila 및 Seppala, 2005), DA 수용체 수준 (Kindlundh, Lindblom, Bergstrom, Wikberg 및 Nyberg, 2001; Kindlundh, Lindblom 및 Nyberg, 2003) 또는 DA 운송업자 (Kindlundh, Bergstrom, Monazzam, Hallberg, Blomqvist, Langstrom 및 Nyberg, 2002).
현재, 테스토스테론 강화를위한 특정 스테로이드 신호, 수용체 및 뇌 작용 부위는 알려져 있지 않다. 우리 실험실의 최근 햄스터 연구에 따르면, 테스토스테론의 강화 효과는 안드로겐과 에스트로겐에 의해 매개되는 것으로 보입니다 (DiMeo와 Wood, 2006). 일반적으로 사용되는 AAS에는 방향 및 비 방향족 안드로겐 (갤러웨이, 1997; 와다, 2006). 이것은 AR과 ER 둘 다 보상을 위해 스테로이드 자극을 유발할 수 있음을 의미합니다. 테스토스테론 강화가 고전적 및 비-게놈 수용체의 조합에 의해 매개 될 수있는 추가 가능성이있다.
여러 줄의 증거는 AAS의 강화 효과에서 비 게놈 수용체의 작용을 지적합니다. Acb 및 VTA에서 AR의 희박한 분포 외에도 안드로겐 강화의 시간 경과가 빠르며 (30 분 미만) 기존 AR을 통한 신호 처리는 강화를위한 충분히 빠르지 않을 수 있습니다. 따라서 AAS 강화에서 비 게놈 AR의 역할을 테스트하기 위해 두 가지 보완 기술을 사용했습니다 (Fig. 7). 한 실험에서Sato, Johansen, Jordan 및 Wood, 2006), 본 발명자들은 고환 여성화 돌연변이 (Tfm,이 이슈 참조)를 갖는 래트가 비 방향족 화 안드로겐 인 디 하이드로 테스토스테론 (DHT)을자가-투여하도록 허용 하였다. Tfm 돌연변이는 AR에서 리간드 결합을 크게 감소시킨다. 그럼에도 불구하고, Tfm 랫트 및 그들의 야생형 수컷 형제 자매는 대략 동일한 양의 DHT를자가 투여 하였다. 이것은 DHT의 비유 전 학적 효과를 주장한다. 후속 연구에서, 우리는 수컷 햄스터가 소 혈청 알부민 (BSA, Fig. 8, 사토와 우드, 2007). DHT-BSA 접합체는 막 불 침투성이며; 따라서 그 효과는 세포 표면으로 제한됩니다. 이전에 입증 된 바와 같이 햄스터는 자체 관리 DHT (DiMeo와 Wood, 2006). 이들은 DHT-BSA 컨쥬 게이트에 대해 유사한 선호도를 보였지만, BSA 만 단독으로 투여하지는 못했다.
이러한 데이터는 안드로겐 강화에서 세포 표면 AR에 대한 중심 역할을 지시한다. 현재, 이러한 수용체의 정확한 성질은 알려져 있지 않다. 안드로겐은 전용 막 AR에 결합하여 세포 표면에서 작용할 수 있다고 제안되었습니다.Thomas, Dressing, Pang, Berg, Tubbs, Benninghoff 및 Doughty, 2006이 문제도 참조하십시오). 이것은 해마에서보고 된 바와 같이 핵외 고전 AR의 형태 일 수있다 (Sarkey et al.,이 문제). 대안 적으로, 이전의 연구는 또한 다른 신경 전달 물질 시스템상의 스테로이드-결합 부위를 기술 하였다. 구체적으로, AAS를 포함한 다양한 스테로이드 호르몬은 GABA-A 수용체를 동종이 식적으로 조절할 수 있습니다.헨더슨, 2007; Lambert, Belelli, Peden, Vardy 및 Peters, 2003). 마찬가지로, 황산 화 신경 스테로이드는 N-메틸-D-아스 파르 테이트 수용체 아형 (Malayev, Gibbs 및 Farb, 2002) 수용체. 이것은 미래의 연구를위한 중요한 영역입니다.
왜 막 AR이 있어야합니까? 앞서 논의한 바와 같이, 안드로겐 분비와 보람있는 사회적 행동 사이에는 밀접한 관련이 있습니다. 우리는 짝짓기 나 싸움을 따르는 테스토스테론 분비의 증가가 행동을 강화시키는 데 도움이된다고 추측 할 수 있습니다. 그렇다면 자극 (행동)과 보상 (테스토스테론)의 빠른 결합이 필요합니다. 이것은 막 AR에 결합함으로써 가장 잘 달성 될 수있다. 이와 관련하여, 짝짓기 동안 안드로겐 분비물이 성 행동의 보람있는 효과를 감소시키는 지 여부를 결정하는 것이 중요합니다.
요약
여기 우리는 안드로겐 성인 동기 행동의 강력한 중재자이며 또한 개발 프로그램 및 안 드로 겐 노출 성인의 시간 동안 안드로겐 노출의 타이밍 증거를 검토합니다. 신진 대사 스테로이드는 미국의 청소년들이 선호하는 약물 남용으로 빠르게 발전하고 있습니다. AAS는 코카인이나 헤로인의 중독성이 없을 수 있지만, 안드로겐 강화 및 중독의 가능성을 이해하기 시작했습니다. 특히, 청소년 스포츠의 경쟁이 치열 해지면서 어린 나이부터 시작하여 스테로이드를 사용하도록 운동 선수를 개발해야한다는 압박이 커지고 있습니다. 이 경향은 청소년의 스테로이드에 민감한 신경 성숙에 대한 새로운 증거의 관점에서 문제가되고 있습니다.
청소년기에 수반되는 심각한 신경 변화에 대한 대중과 과학계의 인식이 높아 졌음에도 불구하고 사춘기의 발달 신경 생물학에 대한 실험적 연구는 제한적입니다. 사춘기 발달의 동물 모델은 발달 중 호르몬 노출 시점이 어떻게 개인의 정신 병리학 및 약물 사용 위험을 증가시키는 지, 그리고 어떤 유형의 경험이 사춘기시기에 편차의 행동 효과를 완화 시키거나 증폭시키는지를 조사하기 위해 필요합니다. 예를 들어, 동료 영향과 같은 사회적 요인은 물질 및 알코올 사용에 대한 사춘기 타이밍의 영향을 악화시킵니다.Biehl, Natsuaki 및 Ge, 2007; Patton, Novy, Lee 및 Hickok, 2004; Simons-Morton과 Haynie, 2003; Wichstrom and Pedersen, 2001). 사춘기 타이밍의 동물 모델은 또한 인간의 연구 노력에 정보를 제공하고, 잠재적으로 청소년기 동안보다 효과적인 치료 적 개입으로 이어질 것입니다.
감사의
이 연구에 도움을 준 Eleni Antzoulatos, Cortney Ballard, Lucy Chu, Kelly Peters, Jennifer Triemstra, Jane Venier, Lisa Rogers 및 Pamela Montalto에게 감사드립니다. 이 작업은 NIH (DA12843에서 RIW로, MH68764에서 CLS로, MH070125에서 KMS로)의 허가로 지원됩니다.
각주
발행인의 면책 조항 : 이 파일은 편집을 위해 편집되지 않은 원고의 PDF 파일입니다. 우리 고객들을위한 서비스로서이 초기 버전의 원고를 제공하고 있습니다. 사본은 최종 인용 가능 형식으로 출판되기 전에 결과 교정본의 사본 편집, 조판 및 검토를 거치게됩니다. 생산 과정 중에 내용에 영향을 미칠 수있는 오류가 발견 될 수 있으며 해당 저널에 적용되는 모든 법적 고지 사항이 포함됩니다.
참고자료
- 알렉산더 GM, 팩커드 MG, 하인스 테스토스테론 (Hines M. Testosterone)은 수컷 쥐에게 보람있는 정서적 인 성질을 가지고 있습니다. 성적 동기 부여의 생물학적 기초에 대한 함의. 행동 신경 과학. 1994;108: 424-8. [PubMed]
- Andersen SL. 두뇌 발달의 궤적 : 취약점의 지점 또는 기회 창? 신경 과학 및 생체 행동 검토. 2003;27: 3-18. [PubMed]
- Andersen SL, Rutstein M, Benzo JM, Hostetter JC, Teicher MH. 도파민 수용체 과잉 생산과 제거의 성별 차이. Neuroreport. 1997;8: 1495-8. [PubMed]
- Arnedo MT, Salvador A, Martinez-Sanchis S, Gonzalez-Bono E. 손상되지 않은 수컷 마우스에서 테스토스테론의 특성에 대한 연구 : 예비 연구. 약리학, 생화학 및 행동. 2000;65: 327-32.
- Arnedo MT, Salvador A, Martinez-Sanchis S, Pellicer O. 짧고 긴 공격 대기 시간 개체로 평가 된 마우스에서 테스토스테론의 유사한 보상 효과. 중독 생물학. 2002;7: 373-9. [PubMed]
- 아놀드 AP, Breedlove SM. 성 스테로이드가 뇌와 행동에 미치는 조직 및 활성화 효과 : 재분석. 호르몬 및 행동. 1985;19: 469-98. [PubMed]
- Benes FM, Taylor JB, Cunningham MC. 산후 기간 동안 내측 전전두엽 피질에서 단일 아민 계 시스템의 수렴 및 가소성 : 정신 병리학의 발달에 대한 영향. 대뇌 피질. 2000;10: 1014-27. [PubMed]
- Benes FM, Turtle M, Khan Y, Farol P. hippocampal 형성에서 중요한 중계 영역의 수유는 어린 시절, 청소년기 및 성인기에 인간 뇌에서 일어납니다. General Psychiatry의 기록 보관소. 1994;51: 477-84. [PubMed]
- Biehl MC, Natsuaki MN, Ge XJ. 사춘기시기가 알코올 사용 및 음주 음주 궤도에 미치는 영향. 청소년 및 청소년 저널. 2007;36: 153-167.
- Birgner C, Kindlundh-Hogberg AM, Nyberg F, Bergstrom L. 신경 과학 편지. 2006. 서브-만성 난드 롤론 투여 및 후속 암페타민 챌린지에 대한 응답으로 래트 핵 축적 체에서 DOPAC 및 HVA의 세포 외 수준을 변경 하였다.
- Bond AJ, Choi PY, Pope HG., Jr 단백 동화-안드로겐 스테로이드 사용자 및 비 사용자의주의 바이어스 및 기분 평가. 약물 및 알코올 의존. 1995;37: 241-5. [PubMed]
- Brower KJ. 신진 대사 스테로이드 남용 및 의존. 현재 정신과 보고서. 2002;4: 377-87. [PubMed]
- Brower KJ, Catlin DH, Blow FC, Eliopulos GA, Beresford TP. 신진 대사 안드로겐 성 스테로이드 남용 및 의존성에 대한 임상 평가 및 소변 검사. 미국 약물 및 알코올 남용 저널. 1991;17: 161-171. [PubMed]
- 포유류 뇌의 Celotti F, Negri-Cesi P, Poletti A. 스테로이드 대사 : 5alpha- 감소 및 아로마. 뇌 연구 게시판. 1997;44: 365-75. [PubMed]
- 정 WC, De Vries GJ, Swaab DF. 인간의 선조 종말 단의 성핵 분화는 성인기까지 연장 될 수 있습니다. Journal of Neuroscience. 2002;22: 1027-33. [PubMed]
- Clark AS, 헨더슨 LP. 신진 대사 남성 홀몬 스테로이드에 대한 행동 및 생리 학적 반응. 신경 과학 및 생체 행동 검토. 2003;27: 413-36. [PubMed]
- Clark AS, 린덴 펠트 RC, Gibbons CH. 신진 대사 남성 홀몬 스테로이드와 뇌 보상. 약리학, 생화학 및 행동. 1996;53: 741-5.
- Conacher GN, Workman DG. 단백 동화 스테로이드 사용과 관련된 폭력 범죄. 미국 정신과 학회지. 1989;146: 679. [PubMed]
- 커닝햄 RL, 맥기니스 MY. 사춘기 신진 대사 남성 홀몬 스테로이드에 노출 된 수컷 쥐의 물리적 도발은 암컷에 대한 침략을 유발합니다. 호르몬 및 행동. 2006;50: 410-6. [PubMed]
- Daly RC, Su TP, Schmidt PJ, Pickar D, Murphy DL, Rubinow DR. 메틸 테스토스테론 투여 후 뇌척수액 및 행동 변화 : 예비 발견. General Psychiatry의 기록 보관소. 2001;58: 172-7. [PubMed]
- Davis EC, Shryne JE, Gorski RA. 래트 시상 하부의 뇌실 주위 뇌실 핵에서의 구조적 성 이형성은 생식선 스테로이드에 주 근관에 민감하지만, 사춘기에서 발생합니다. 신경 내분비학. 1996;63: 142-8. [PubMed]
- de Beun R, Jansen E, Slangen JL, Van de Poll NE. 쥐의 식욕 있고 차별적 인 자극으로서의 테스토스테론 : 성 및 복용량에 따른 영향. 생리학 및 행동. 1992;52: 629-34. [PubMed]
- 데카 반 AS. 인간의 생애 기간 동안의 뇌 무게 변화 : 뇌 무게와 몸무게 및 체중의 관계. 신경과의 연대기. 1978;4: 345-56. [PubMed]
- Di Chiara G, Imperato A. 인간에 의해 학대받는 약물은 자유롭게 움직이는 쥐의 중뇌 변형 시스템에서 시냅스 도파민 농도를 우선적으로 증가시킵니다. 미합중국 국립 과학 아카데미 회보. 1988;85: 5274-8. [PMC 무료 기사] [PubMed]
- DiMeo AN, Wood RI. 수컷 햄스터에서 에스트로젠 및 디 하이드로 테스토스테론의자가 투여. 호르몬 및 행동. 2006;49: 519-26. [PubMed]
- DiPasquale M. 신진 대사 스테로이드. 에서 : Tarter RE, Ammerman RT, Ott PJ, 편집자. 약물 남용 핸드북. 플레 넘 프레스; 뉴욕 : 1998. pp. 547–565.
- Dominguez J, Riolo JV, Xu Z, Hull EM. 교미와 내측 전 광학 도파민 방출의 내측 편도체에 의한 조절. Journal of Neuroscience. 2001;21: 349-355. [PubMed]
- Dominguez JM, 헐 EM. 내측 편도의 자극은 내측 시신경 도파민 방출을 향상시킨다 : 수컷 쥐의 성적 행동에 대한 영향. 두뇌 연구. 2001;917: 225-229. [PubMed]
- Du J, Lorrain DS, Hull EM. Castration은 세포 외 경로를 감소 시키지만 수컷 쥐의 내측 전 광학 영역에서는 세포 내 dopamine을 증가시킨다. 두뇌 연구. 1998;782: 11-17. [PubMed]
- Eckenhoff MF, Rakic P. 붉은 털 원숭이 원숭이의 수명 동안 해마 치아 이랑에서 증식 성 세포의 자연과 운명. Journal of Neuroscience. 1988;8: 2729-47. [PubMed]
- Everitt BJ, Stacey P. 수컷 쥐 (Rattus norvegicus)에서 성적 보강을 통한 도구 적 행동 연구 : II. 수술 전 영역 병변, 거세 및 테스토스테론의 영향. 비교 심리학 저널. 1987;101: 407-19. [PubMed]
- 갤러웨이 S. 스테로이드 성경. 벨 인터내셔널 프레스; 새크라멘토, 캘리포니아 : 1997.
- 신진 대사 남성 홀몬 스테로이드를 사용하는 남자의 Galligani N, Renck A, Hansen S. 성격 단면도. 호르몬 및 행동. 1996;30: 170-5. [PubMed]
- Grimes JM, Melloni RH., Jr 햄스터에서 사춘기 신진 대사-안드로겐 성 스테로이드 노출이 중단 된 후 세로토닌 신경계의 연장 된 변화 (Mesocricetus auratus) 행동 신경 과학. 2006;120: 1242-51. [PubMed]
- Hannan CJ, Jr, Friedl KE, Zold A, Kettler TM, Plymate SR. 남성 홀몬 스테로이드를 투여 한 남성의 심리적 및 혈청 호모 바 닐산 변화. 정신 신경 내분비학. 1991;16: 335-43. [PubMed]
- Harrison RJ, Connor DF, Nowak C, Nash K, Melloni RH., Jr 청소년기 동안의 신진 대사-안드로겐 성 스테로이드 치료는 온전한 시상 하부 바소프레신과 온전한 햄스터의 공격성을 증가시킵니다. 정신 신경 내분비학. 2000;25: 317-38. [PubMed]
- 그는 J, Crews FT. 뇌 성숙 동안 청소년기에서 성인기로의 신경 발생이 감소합니다. 약리학, 생화학 및 행동. 2007;86: 327-33.
- 헨더슨 LP. 시상 하부에서의 GABAA 수용체-매개 전달의 스테로이드 조절 : 생식 기능에 대한 영향. 신경 약리학. 2007;52: 1439-53. [PMC 무료 기사] [PubMed]
- 선체 EM, Du J, Lorrain DS, Matuszewich L. 중간 시신경 부위의 세포 외 도파민 : 성적인 동기 부여 및 교미 호르몬 조절에 대한 영향. Journal of Neuroscience. 1995;15: 7465-7471. [PubMed]
- 선체 EM, Meisel RL, Sachs BD. 남성의 성적 행동. Pfaff DW, Arnold AP, Etgen AM, Fahrbach SE, Rubin RT, 편집자. 호르몬, 뇌 및 행동. 학술 출판사; 뉴욕 : 2002. pp. 3–137.
- 선체 EM, Wood RI, McKenna KE. 남성 성 행동의 신경 생물학. 편집자 : Neill JD 생식 생리학. Vol. 1. 엘스 비어 프레스; 뉴욕 : 2006. pp. 1729–1824.
- Huttenlocher PR, Dabholkar AS. 인간의 대뇌 피질에서 시냅스 발생의 지역적 차이. Journal of Comparative Neurology. 1997;387: 167-78. [PubMed]
- Johnson LR, Wood RI. 수컷 햄스터에서 경구 테스토스테론자가 투여. 신경 내분비학. 2001;73: 285-92. [PubMed]
- Johnston LD, O'Malley PM, 바흐 만 JG. 중등 학생 (NIH 출판 번호 03–5375) I. Bethesda, MD : 약물 남용에 관한 국립 연구소; 2003. 약물 사용에 관한 미래의 전국 조사 결과 모니터링 1975–2002.
- 카이저 패밀리 파운데이션. 미국 십대 성행위. 2005. pp. # 3040–02.
- Kashon ML, Hayes MJ, Shek PP, Sisk CL. 사춘기 전 남성 흰 족제비의 안드로겐에 의한 뇌 안드로겐 수용체 면역 반응성의 조절. 생식 생물학. 1995;52: 1198-205. [PubMed]
- Kindlundh AM, Bergstrom M, Monazzam A, Hallberg M, Blomqvist G, Langstrom B, Nyberg F. 양전자 방출 단층 촬영에 의해 래트 뇌에서 nandrolone으로 만성 치료 한 후 도파민 효과. 신경 정신 약리학 및 생물학적 정신과의 진전. 2002;26: 1303-8.
- Kindlundh AM, Lindblom J, Bergstrom L, Wikberg JE, Nyberg F. 단백 동화 안드로겐 성 스테로이드 인 난 드 롤론 데 카노 에이트는 수컷 쥐 뇌의 도파민 수용체의 밀도에 영향을 미칩니다. European Journal of Neuroscience. 2001;13: 291-6. [PubMed]
- Kindlundh AM, Lindblom J, Nyberg F. nandrolone decanoate를 이용한 만성 투여는 쥐 뇌에서 도파민 D (1)-및 D (2)-수용체의 유전자 전사 내용의 변화를 유도합니다. 두뇌 연구. 2003;979: 37-42. [PubMed]
- BE 왕, Packard MG, Alexander GM. 수컷 랫트에서 테스토스테론의 중간 전안 영역 주사의 영향 특성. 신경 과학 편지. 1999;269: 149-52. [PubMed]
- Koob GF, Nestler EJ. 약물 중독의 신경 생물학. 신경 정신과 및 임상 신경 과학 저널. 1997;9: 482-97. [PubMed]
- Kouri EM, Lukas SE, Pope HG, Jr, Oliva PS. 테스토스테론 cypionate의 점진적인 복용량 투여 후 남성 지원자에 대한 공격적인 반응 증가. 약물 및 알코올 의존. 1995;40: 73-9. [PubMed]
- Kritzer MF. 장기 생식선 절제술은 성인 수컷 쥐의 중간 전두엽 피질에서 티로신 하이드 록시 라제-하지만 도파민-베타-하이드 록시 라제-, 콜린 아세틸 트랜스퍼 라제-또는 세로토닌-면역 반응성 축삭의 밀도에 영향을 미칩니다. 대뇌 피질. 2003;13: 282-296. [PubMed]
- Kurling S, Kankaanpaa A, Ellermaa S, Karila T, Seppala T. 쥐의 뇌에서 dopaminergic 및 serotonergic 신경계에 sub-chronic nandrolone decanoate 처리의 효과. 두뇌 연구. 2005;1044: 67-75. [PubMed]
- Lambert JJ, Belelli D, Peden DR, Vardy AW, Peters JA. GABAA 수용체의 신경 스테로이드 조절. 신경 생물학의 진보. 2003;71: 67-80. [PubMed]
- Lenroot RK, Giedd JN. 어린이와 청소년의 뇌 발달 : 해부학 적 자기 공명 영상의 통찰력. 신경 과학 및 생물 행동 검토. 2006;30: 718-29.
- Lesting J, Neddens J, Teuchert-Noodt G. Gerbils의 핵 축적에서 도파민 신경 분포의 종양. 두뇌 연구. 2005;1066: 16-23. [PubMed]
- Malayev A, Gibbs TT, Farb DH. 프레 그네 놀론 설페이트에 의한 NMDA 반응의 억제는 설페이트 화 된 스테로이드에 의한 NMDA 수용체의 서브 타입 선택적 조절을 나타낸다. 영국 약리학 저널. 2002;135: 901-9. [PMC 무료 기사] [PubMed]
- Martinez M, Guillen-Salazar F, 살바도르 A, 사이먼 VM. 마우스의 성공적인 성전환 및 조건부 선호도. 생리학 및 행동. 1995;58: 323-8. [PubMed]
- Meek LR, Romeo RD, Novak CM, Sisk CL. 사춘기 전 및 사춘기 전 남성 햄스터에서 테스토스테론의 작용 : 생식 행동 및 뇌 안드로겐 수용체 면역 반응성에 대한 영향의 해리. 호르몬 및 행동. 1997;31: 75-88.
- Meisel RL, Joppa MA. 공격적 또는 성행 한 후 여성 햄스터의 조건부 선호도. 생리학 및 행동. 1994;56: 1115-8. [PubMed]
- Melloni RH, Jr, Connor DF, Hang PT, Harrison RJ, Ferris CF. 골든 햄스터에서 청소년기 및 공격적인 행동 중 단백 동화 안드로겐 성 스테로이드 노출. 생리학 및 행동. 1997;61: 359-64. [PubMed]
- Menard C, Harlan R. 남성 홀몬 신진 대사 스테로이드에 의한 쥐 뇌에서의 안드로겐 수용체 면역 반응의 상향 조절. 두뇌 연구. 1993;622: 226-236. [PubMed]
- Mermelstein PG, Becker JB, Surmeier DJ. 에스트라 디올은 막 수용체를 통해 래트 신 생물 뉴런에서 칼슘 전류를 감소시킨다. Journal of Neuroscience. 1996;16: 595-604. [PubMed]
- Midgley SJ, Heather N, 데이비스 JB. 단백 동화-안드로겐 성 스테로이드 사용자 그룹 간의 공격 수준. 의학, 과학 및 법. 2001;41: 309-14.
- Molenda-Figueira HN, Salas-Ramirez KY, Schulz KM, Zehr JL, Montalto PR, Sisk CL. 사춘기의 사회적 경험은 사춘기 테스토스테론이없는 시리아 햄스터 남성의 성인 사정 행동을 회복시킵니다. 행동 신경 내분비학 학회; 퍼시픽 그 로브, 캘리포니아 : 2007.
- 노블 RG, 알섬 PB. 골든 햄스터 (Mesocricetus auratus)의 호르몬 의존 성 이형성 생리학 및 행동. 1975;14: 567-74. [PubMed]
- Nunez JL, Lauschke DM, Juraska JM. 수컷 및 암컷 쥐에서 후방 피질의 발달에서 세포 사멸. Journal of Comparative Neurology. 2001;436: 32-41. [PubMed]
- Nunez JL, Sodhi J, Juraska JM. 산후 20 후 난소 호르몬은 래트 일차 시각 피질에서 뉴런 수를 감소시킵니다. 신경 생물학 저널. 2002;52: 312-21. [PubMed]
- 오코너 DB, 궁수 J, 우 FC. 테스토스테론이 청년의 기분, 침략 및 성적 행동에 미치는 영향 : 이중 맹검, 위약 대조, 교차 연구. Journal of Clinical Endocrinology & Metabolism. 2004;89: 2837-45. [PubMed]
- Packard MG, Cornell AH, Alexander GM. 테스토스테론의 핵내 accumbens 주사의 보상 특성. 행동 신경 과학. 1997;111: 219-24. [PubMed]
- Parfitt DB, Thompson RC, Richardson HN, Romeo RD, Sisk CL. 남성 시리아 햄스터 뇌에서 사춘기에 따라 GnRH mRNA가 증가합니다. 신경 내분비학 저널. 1999;11: 621-7. [PubMed]
- Parrott AC, Choi PY, 아마추어 선수의 데이비스 M. 단백 동화 스테로이드 사용 : 심리적 기분 상태에 미치는 영향. Journal of Sports Medicine & Physical Fitness. 1994;34: 292-8. [PubMed]
- Patton PE, Novy MJ, Lee DM, Hickok LR. 완전한 자궁 자궁, 복제 자궁 경부 및 질 격막의 외과 적 치료 후 진단 및 생식 결과. American Journal of Obstetrics & Gynecology. 2004;190: 1669–75. 1675–8. [PubMed]
- Paus T, Collins DL, Evans AC, Leonard G, Pike B, Zijdenbos A. 인간 두뇌의 백질 성숙 : 자기 공명 연구 검토. 뇌 연구 게시판. 2001;54: 255-66. [PubMed]
- Perry PJ, Kutscher EC, Lund BC, Yates WR, Holman TL, Demers L. 남성 홀몬 신진 대사 스테로이드를 사용하거나 사용하지 않는 남성 역도의 공격 및 기분 변화 측정. 법의학 저널. 2003;48: 646-51. [PubMed]
- Peters KD, Wood RI. 햄스터의 안드로겐 의존성 : 과다 복용, 내성 및 잠재적 오피 오 딕성 메커니즘. 신경 과학. 2005;130: 971-81. [PubMed]
- Pfaus JG, Damsma G, Nomikos GG, Wenkstern DG, Blaha CD, Phillips AG, Fibiger HC. 성적 행동은 수컷 쥐에서 중앙 도파민 전염을 향상시킵니다. 두뇌 연구. 1990;530: 345-348. [PubMed]
- 피닉스 CH, Goy RW, Gerall AA, Young WC. 여성 기니피그에서 짝짓기 행동을 매개하는 조직에 태아기 투여 된 테스토스테론 프로 피오 네이트의 작용을 조직. 내분비학. 1959;65: 369-82. [PubMed]
- Pinos H, Collado P, Rodriguez-Zafra M, Rodriguez C, Segovia S, Guillamon A. 쥐의 유전자좌에서 성차의 발달. 뇌 연구 게시판. 2001;56: 73-8. [PubMed]
- 교황 HG, Jr, Katz DL. 신진 대사 스테로이드 사용자에 의한 살인 사건 및 거의 살인 사건. 임상 정신과 저널. 1990;51: 28-31. [PubMed]
- 교황 HG, Jr, Katz DL. 신진 대사 남성 홀몬 스테로이드 사용의 정신과 의학 효력. 160 운동 선수에 대한 통제 된 연구. General Psychiatry의 기록 보관소. 1994;51: 375-82. [PubMed]
- 교황 HG, Jr, Kouri EM, Powell KF, Campbell C, Katz DL. 133 포로들 사이에서 신진 대사 안드로겐 성 스테로이드 사용. 종합 정신과. 1996;37: 322-7. [PubMed]
- Putnam SK, Du J, Sato S, Hull EM. copulatory 행동의 테스토스테론 복원 거세 남성 쥐에서 중간 preoptic 도파민 방출과 관련이 있습니다. 호르몬 및 행동. 2001;39: 216-224. [PubMed]
- 퍼트 남 SK, 사토 에스, 헐 EM. 거세 된 수컷 랫트에서 테스토스테론 대사 물질이 교미 및 중간 시력 도파민 방출에 미치는 영향. 호르몬 및 행동. 2003;44: 419-26. [PubMed]
- Putnam SK, Sato S, Riolo JV, Hull EM. 거세 된 수컷 흰쥐에서 테스토스테론 대사 산물이 교미, 내경 검사 전 도파민 및 NOS 면역 반응에 미치는 영향 호르몬 및 행동. 2005;47: 513-522. [PubMed]
- Rankin SL, Partlow GD, McCurdy RD, Giles ED, Fisher KR. 돼지 시상 하부의 바소프레신 및 옥시토신-함유 핵에서의 출생 후 신경 발생. 두뇌 연구. 2003;971: 189-96. [PubMed]
- Ricci LA, Rasakham K, Grimes JM, Melloni RH., Jr 세로토닌 -1A 수용체 활성 및 발현은 햄스터에서 청소년 신진 대사 / 남성 생성 스테로이드 유발 공격을 조절합니다. 약리학, 생화학 및 행동. 2006;85: 1-11.
- Romeo RD, Cook-Wiens E, Richardson HN, Sisk CL. Dihydrotestosterone은 성인 남성 햄스터에서는 성행위를 활성화하지만 청소년에서는 성행위를 활성화하지 않습니다. 생리학 및 행동. 2001;73: 579-84. [PubMed]
- Romeo RD, Diedrich SL, Sisk CL. 사춘기 이전과 성인 남성 시리아 햄스터에서 에스트로겐 수용체 면역 반응성. 신경 과학 편지. 1999;265: 167-70. [PubMed]
- Romeo RD, Parfitt DB, Richardson HN, Sisk CL. 페로몬은 사춘기 이전과 성인 남성 시리아 햄스터에서 동등한 수준의 Fos- 면역 반응을 유발합니다. 호르몬 및 행동. 1998;34: 48-55. [PubMed]
- Romeo RD, Richardson HN, Sisk CL. 사춘기와 남성 뇌의 성숙과 성행위 : 행동 잠재력을 되 찾는 것. 신경 과학 및 생체 행동 검토. 2002a;26: 381-91. [PubMed]
- Romeo RD, Wagner CK, Jansen HT, Diedrich SL, Sisk CL. 에스트라 디올은 시상 하부 프로게스테론 수용체를 유도하지만 사춘기 이전에 수컷 햄스터 (Mesocricetus auratus)에서 교배 행동을 활성화 시키지는 않습니다. 행동 신경 과학. 2002b;116: 198-205. [PubMed]
- Salas-Ramirez KY, Montalto PR, Sisk CL. 신진 대사 남성 홀몬 스테로이드 (AAS)는 청소년 및 성인 남성 시리아 햄스터의 사회적 행동에 차별적으로 영향을 미칩니다. 호르몬 및 행동. 2008 .
- SAMHSA / OAS. DHHS 간행물 번호 (SMA) 1996. 약물 남용에 대한 1994 국가 가구 조사, 주요 결과 1994; pp. 96–3085.
- SAMHSA / OAS. 약물 사용 및 건강에 관한 2004 National Survey의 결과 : National Findings. 2005. NSDUH 시리즈 H-28, DHHS 발행 번호 SMA 05–4062.
- Sato SM, Johansen J, Jordan CL, Wood RI. Tfm 래트에서의 안드로겐자가 투여. 행동 신경 내분비학을위한 10th 연례 연례 회의 2006.
- Sato SM, Wood RI. 시리아 햄스터에서 막불 투과성 신진 대사-안드로겐 성 스테로이드 (aas)의 자체 투여. 행동 신경 내분비학을위한 11th 연례 연례 회의 2007.
- 슈뢰더 JP, 팩커드 MG. 래트에서 테스토스테론 조절 된 장소 선호의 획득에서 도파민 수용체 아형의 역할. 신경 과학 편지. 2000;282: 17-20. [PubMed]
- Schulte HM, Hall MJ, Boyer M. 단백 동화 스테로이드 남용과 관련된 가정 폭력. 미국 정신과 학회지. 1993;150: 348. [PubMed]
- Schulz KM, Menard TA, Smith DA, Albers HE, Sisk CL. 청소년기 동안 고환 호르몬 노출은 측면 중격에서 측면 마킹 행동과 바소프레신 수용체 결합을 구성합니다. 호르몬 및 행동. 2006;50: 477-83. [PubMed]
- Schulz KM, Richardson HN, Romeo RD, Morris JA, Lookingland KJ, Sisk CL. 남성 시리아 햄스터에서 사춘기 동안 여성 페로몬에 대한 중간 시력 영역 도파민 반응이 발생합니다. 두뇌 연구. 2003;988: 139-45. [PubMed]
- Schulz KM, Richardson HN, Zehr JL, Osetek AJ, Menard TA, Sisk CL. 생식선 호르몬은 남성 시리아 햄스터에서 사춘기 동안 생식 행동을 남성화하고 탈피합니다. 호르몬 및 행동. 2004;45: 242-9. [PubMed]
- Schulz KM, Sisk CL. 사춘기 호르몬, 청소년 뇌 및 사회적 행동의 성숙 : 시리아 햄스터의 교훈. 분자 및 세포 내분비학. 2006:254–255. 120–6.
- Schulz KM, Zehr JL, Salas-Ramirez KY, Sisk CL. 신경 과학 회의 플래너. 샌디에고, 캘리포니아 : 신경 과학 학회; 2007. 청소년은 성인 남성 생식 행동에 대한 테스토스테론의 조직화 효과에 대해 두 번째 민감한 기간입니까? 2007 온라인.
- Scott JP, 스튜어트 JM, De Ghett VJ. 시스템 구성의 중요 기간. 발달 심리학. 1974;7: 489-513. [PubMed]
- Shughrue PJ, Lane MV, Merchenthaler I. 쥐 중추 신경계에서 에스트로겐 수용체-알파 및-베타 mRNA의 비교 분포. Journal of Comparative Neurology. 1997;388: 507-25. [PubMed]
- Simons-Morton BG, Haynie DL. 6 학년 중 흡연 단계가 증가한 심리 사회적 예측 인자. 미국 건강 행동 저널. 2003;27: 592-602. [PubMed]
- Sisk CL, Zehr JL. 사춘기의 호르몬은 사춘기의 뇌와 행동을 조직합니다. 신경 내분비학의 최전방. 2005;26: 163-74. [PubMed]
- Sowell ER, Thompson PM, Leonard CM, 환영 SE, Kan E, Toga AW. 정상적인 어린이의 피질 두께와 뇌 성장의 세로 매핑. Journal of Neuroscience. 2004;24: 8223-31. [PubMed]
- Sowell ER, Thompson PM, Tessner KD, Toga AW. 등쪽 정면 피 질에서 지속적인 두뇌 성장과 회백질 밀도 감소 매핑 : 사춘기 뇌 성숙 중 역 관계. Journal of Neuroscience. 2001;21: 8819-29. [PubMed]
- Spear LP. 사춘기의 뇌 및 연령과 관련된 행동 발현. 신경 과학 및 생물 행동 검토. 2000;24: 417-63.
- Su TP, Pagliaro M, Schmidt PJ, Pickar D, Wolkowitz O, Rubinow DR. 남성 정상 지원자에서 단백 동화 스테로이드의 신경 정신병 효과. JAMA. 1993;269: 2760-4. [PubMed]
- Thiblin I, Finn A, Ross SB, Stenfors C. 단백 동화 남성 홀몬 스테로이드로 장기간 치료 한 후 수컷 쥐 뇌에서 도파민 작용과 5-hydroxytryptaminergic 활동이 증가했습니다. 영국 약리학 저널. 1999;126: 1301-6. [PMC 무료 기사] [PubMed]
- Thomas P, 드레싱 G, Pang Y, Berg H, Tubbs C, Benninghoff A, Doughty K. Progestin, 에스트로겐 및 안드로겐 G- 단백질 결합 수용체 어류 생식선. 스테로이드. 2006;71: 310-6. [PubMed]
- Tricker R, Casaburi R, Storer TW, Clevenger B, Berman N, Shirazi A, Bhasin S. 건강한 eugonadal 남성의 화난 행동에 대한 생리학 상 테스토스테론 용량의 영향-임상 연구 센터 연구. Journal of Clinical Endocrinology & Metabolism. 1996;81: 3754-8. [PubMed]
- Triemstra JL, Nagatani S, Wood RI. 화학 감각 신호는 남성 시리아 햄스터의 MPOA에서 짝짓기 유도 된 도파민 방출에 필수적입니다. Neuropsychopharmacology. 2005;30: 1436-42. [PubMed]
- Triemstra JL, Sato SM, Wood RI. 남성 시리아 햄스터에서 테스토스테론과 핵 accumbens 도파민. Psychoneuroendocrinology (언론에서)
- Van Eenoo P, Delbeke FT. 국제 스포츠에서의 도핑 유병률에 비해 플랜더스에서의 도핑 유병률. 국제 스포츠 의학 저널. 2003;24: 565-570. [PubMed]
- 와다. 공인 된 실험실에서보고 된 이상적 분석 결과. 2006. http://www.wada-ama.org.
- Wesson DW, McGinnis MY. 쥐의 사춘기 동안 단백 동화 남성 홀몬 스테로이드 (AAS) : 신경 내분비 및 행동 평가. 약리학, 생화학 및 행동. 2006;83: 410-9.
- Wichstrom L, Pedersen W. 청소년기에 단백 동화-남성 스테로이드 사용 : 승리,보기 또는 나쁨? 알코올에 관한 연구. 2001;62: 5-13. [PubMed]
- Wood RI, Johnson LR, Chu L, Schad C, 자체 DW. 테스토스테론 강화 : 수컷 쥐와 햄스터에서 정맥 내 및 뇌 실내 자기 투여. 정신 약물학. 2004;171: 298-305. [PubMed]
- Wood RI, Newman SW. 안드로겐과 에스트로겐 수용체는 시리아 햄스터의 뇌에서 개별 뉴런과 공존합니다. 신경 내분비학. 1995;62: 487-97. [PubMed]
- Wood RI, Swann JM. 남성의 성 행동을 제어하는 화학 감각 및 호르몬 신호의 신경 통합. : Wallen K, Schneider JS, 편집자. 맥락에서의 재생산. MIT Press; 케임브리지 : 1999. pp. 423–444.
- Zahm DS, Heimer L. 쥐 핵 축적에서 발생하는 두 개의 경 두개 통로. Journal of Comparative Neurology. 1990;302: 437-46. [PubMed]