Neurosci Biobehav Rev. 2011 1 월, 35 (3) : 939-55. doi : 10.1016 / j.neubiorev.2010.10.014. Epub 2010 Nov 2.
- 1Bernard B. Brodie 칼리아리 대학의 신경 과학부, Cittadella Universitaria, 09042 Monserrato, CA, Italy. [이메일 보호]
추상
옥시토신 (Oxytocin)은 중추 신경계에 주입 될 때 음경 발기의 강력한 유도제입니다. 수컷 쥐에서 옥시토신의 발기 부전에 가장 민감한 뇌 영역은 시상 하부의 방실 핵입니다. 이 핵과 주변 지역은 여분의 시상 하부 뇌 영역과 척수로 투사되는 모든 옥시토신 성 뉴런의 세포 기관을 포함합니다. 이 리뷰는 옥시토신이 이러한 영역 중 일부 (예 : 복부 tegmental 영역, 해마의 복강, 편도의 후두 피질 핵 및 흉추 - 요추 척수)에 주사 할 때도 음경 발기를 유도 함을 보여줍니다. 뇌내 미세 투석과 이중 면역 형광 연구와 결합 된 미세 주입 연구는이 영역의 옥시토신이 중배엽 도파민 성 뉴런을 직접 또는 간접적으로 (주로 글루탐산을 통해) 활성화한다는 것을 시사한다. 측위 핵에서 방출되는 도파민은 차례로 방실 핵을 활성화시켜 방실 핵에서 시상 하부의 도파민 성 뉴런의 활성화를 유도한다. 이것은 척수에 투영되고 음경 발기를 중재하는 옥시토신 성 뉴론뿐만 아니라 상기 외측 시상 하부 영역에 투영되어, 동기 및 보상을 조절하는 중배엽 도파민 성 뉴런의 활성을 직접 또는 간접적으로 (글루탐산을 통해) 조절한다. 함께 이러한 신경 경로는 성행위 (발기 기능과 교합)의 완결 단계뿐만 아니라 성행위의 예상 단계의 동기 부여 및 보람있는 측면에서도 역할을하는 복잡한 가상 회로를 구성 할 수 있습니다.
1.Introduction
음경 발기는 남성을 포함한 포유 동물의 번식에 핵심적인 역할을하는 남성 성 반응이며, 이는 복제와 엄격히 관련이있는 것과는 다른 상황에서도 관찰 될 수 있습니다. 음경 발기가 발생하는 맥락에 따라 다양한 중추 신경계 및 말초 신경 및 / 또는 체액 기전이 그 조절에 참여한다 (Meisel and Sachs, 1994, Argiolas and Melis, 1995, 2004, 2005, Sachs, 2000, 2007, McKenna, 2000, Giuliano and Rampin, 2000, 2004, Andersson, 2001, Melis와 Argiolas, 1995a, 2003, Hull et al., 2002). 음경 발기를 조절하는 중추 신경 전달 물질과 신경 펩타이드 중에서 가장 잘 알려진 것은 도파민, 세로토닌, 흥분성 아미노산, 산화 질소, 부 신피질 자극 호르몬, 옥시토신 및 오피오이드 펩타이드. 그들은 여러 뇌 영역에서 행동함으로써 음경 발기를 촉진하거나 억제 할 수 있으며, 즉 시상 하부의 방실 핵, 복부 tegmental 영역, 해마, 편도선, stria terminalis의 침대 핵, 측벽 핵, 뇌간과 척수 (Table 1) (Mittel and Sachs, 1994, Witt and Insel, 1994, Stancampiano 등, 1994, Argiolas and Melis, 1995, 2005, Argiolas, 1999, Bancila 등, 2002, Giuliano and Rampin, 2000, McKenna, 2000, Andersson, 2001, Hull et al., 2002, Coolen et al., 2004).
수유 및 출산시 호르몬 역할로 잘 알려진 신경 뚱뚱한 펩타이드 인 옥시토신은 암컷과 수컷에 존재하는데, 신경 인형에 투사 된 시상 하부의 방실 상부 핵 (supraoptic nuclei)에있는 세포체를 가진 뉴런뿐만 아니라 뉴런 방실 핵, 주변 구조물에서부터 외 시달린 뇌 영역 (예 : 중격, 복부 피질 영역, 해마, 편도선, 뇌간과 척수)에 이르기까지 다양합니다. 이 뉴런은 음경 발기 및 양성 행동을 포함한 기억, 학습, 제휴 및 사회 - 성 행동과 같은 수많은 중심 기능에 관여한다고 생각됩니다 (Buijs, 1978, Sofroniew, 1983, Argiolas and Gessa, 1991, Pedersen et al 1992, 1992, Tang 등, 1993, Veronneau-Longueville et al., 1995). 실제로, 옥시토신은 생쥐, 쥐, 토끼, 원숭이의 발기 기능과 남성 성 행동을 촉진시킨다. (Argiolas and Gessa, 1997, Carter, 1998, Pedersen et al., 1999, Argiolas and Melis, 1991, 1992, Argiolas, 1992. 이것은 혈장 옥시토신이 성적 자극에 의해 특히 사정 (Carmichael et al., 1995, Murphy et al., 2004)과 유방과 생식기의 조작에 의해 증가되기 때문에 사람에서도 발생할 수있다. 성교 (Tindall, 1999).
옥시토신이 남성의 성행위에 미치는 촉진 효과는 정맥 내 옥시토신이 첫 번째 사정에 걸리는 시간을 줄이고 수용성 암컷과 쌍을 이루는 수컷 토끼의 성적인 피로를 늦추는 능력에 의해 처음 입증되었습니다 (Melin and Kihlstrom, 1963). 그러나 옥시토신의 성적인 영향은 80 년대에만 명확하게 인정되었습니다. 수컷 쥐에서 음경 발기 (argiolas et al., 1985, 1986)를 유도하고 양성 반응 (Arletti et al., 1985)을 개선하고 암컷 쥐의 전만증을 증가시킬 수있는 것으로 나타났다 (Arletti (Argiolas and Melis, 1985, 1986, Argiolas, 1995, Melis and Argiolas, 2004 및 그 안의 참고 문헌 참조)에 작용하여 분명히 Bertolini, 1999, Bertolini, 2003, Caldwell 등. 옥시토신은 성기능이있는 수컷 쥐 (Arletti et al., 1985)뿐만 아니라 노화 된 수컷 쥐 (Arletti et al., 1990) 및 종속성이없는 남성 다람쥐 원숭이 (Winslow and Insel , 1991).
옥시토신의 발기 부전 효과는 뇌하수체 절제술 및 거세에 의해 폐지되고 테스토스테론 또는 그 대사 산물, 에스트라 디올 및 5_- 디 하이드로 테스토스테론을 함께 공급함으로써 테스토스테론 의존성이다 (Melis et al., 1994a). 옥시토신에 의한 음경 발기 유도에 가장 민감한 두뇌 영역은 시상 하부의 방실 핵 (Melis et al., 1986)이며, 모든 시상 하부의 옥시토신 성 투상이 시작됩니다 (위 참조). 옥시토신은 3 pmol (아래 2.1 참조)만큼 낮은 용량으로 주사하면 음경 발기 (및 하품)를 유도 할 수있는 것으로 밝혀졌습니다. Oxytocin은 해마의 CA1 영역으로 양측에 주사 하였을 때도 penile 발기를 유도하였으나 (아래 2.3 절 참조), lateral septum, caudate nucleus, medial preoptic area, 시상 하부의 ventromedial nucleus 및 supraoptic nucleus (Melis et al., 1986). 옥시토신이 방실 핵을 통해 성 반응을 유도하는 메커니즘에 관해서는 많은 연구에서 옥시토신이 자체 뉴런을 활성화 시킨다는 사실을 제시합니다. 이 가설에 따라, 성적 상호 작용은 음경 발기의 조절에 관여하는 척수로 돌출하는 방실 세 옥시토신 성 뉴런에서 초기 초기 유전자 c-fos의 유전자 산물 인 FOS를 증가시킨다 (Witt and Insel, 1994 및 참고 문헌 참조). (예를 들어, 성숙한 수컷 쥐가 난소 절제 된 에스트로겐 - 프로게스테론 림프구가있는 수용성 여성과 교미 할 수 없음)가 수컷 랫트에서 시상 하부의 방실 핵에서 낮은 수준의 옥시토신 mRNA와 관련되어있다 (Arletti et al. al., 1997).
옥시토신이 예상되는 단계에 영향을 미치는지 또는 성 행동의 완결 단계에 영향을 미치는지는 현재 불분명하다. 옥시토신이 음경 발기를 유도하고 옥시토신의 보조적인 행동에 미치는 주 효과는 수컷 랫트에서 사정 후 발작 간격이 감소하기 때문에 (Arletti et al., 1985) 펩타이드가 성기능을 향상 시킨다고 가정하는 것이 타당합니다. 그러나 옥시토신은 또한 사회 - 성 상호 작용을 증가 시키므로 (Pedersen et al., 1992, Carter et al., 1997, Ivell and Russel, 1995 참조), 옥시토신 수용체 길항제는 비접촉 발기를 예방한다 (Melis et al., 1999a). (Sachs, 1997, 2000, 2007, Melis et al., 1998, 1999b 및 그 참고 문헌 참조), 성적 흥분과 성적인 동기 부여에서 옥시토신의 역할이 배제 될 수는 없다.
이 리뷰는 최근 연구의 발표되지 않은 결과와 게시되지 않은 결과를 요약하며, 옥시토신은 시상 하부의 방실 핵에 주입 될 때뿐만 아니라 복부 피 두드러기 영역과 같은 다른 시상 하부 뇌 영역에도 주사 될 때 음경 발기를 유도합니다 (Melis et al., 2007, 2009a, Succu et al., 2008), t그는 해마의 복부 subiculum과 편도의 후부 핵 (Melis et al., 2009b, 2010)은 변연계의 중요한 구성 요소이며 동기와 보상 과정에서 중요한 역할을한다고 여겨진다. 이 연구는 옥시토신이 도파민과 글루탐산과 같은 다른 신경 전달 물질, 그리고 방실 피질 영역, 측벽 핵, 해마 및 아직 존재하지 않는 영역과 같은 방실 핵 이외의 다른 뇌 영역을 포함하는 신경 회로에 참여한다는 것을 밝혀줍니다 확인했다. 이러한 회로는 중뇌 변성과 시상 하부 - 도파민 성 시스템 사이의 상호 작용을 중재하고, 남성 성 행동 (예 : 음경 발기 및 교합)의 완결 단계뿐만 아니라 성욕 및 성욕에서도 역할을 할 가능성이있다 각성, 따라서 성적 활동의 동기 부여와 보람있는 특성을 설명하기위한 신경 기질을 제공합니다.
2. 옥시토신은 다른 뇌 영역에서 행동함으로써 음경 발기에 영향을줍니다.
2.1. 시상 하부의 방실 핵
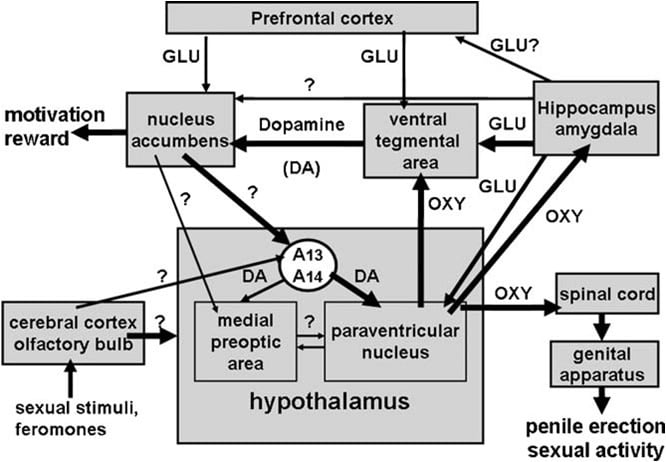
위에서 상기 한 바와 같이, 시상 하부의 방실 핵은 곧 옥시토신의 발기 부전 효과에 가장 민감한 뇌 영역으로 확인되었다. 이 핵에서 일방적으로 주사 할 때, 옥시토신은 3 ng (3 pmol)만큼 낮은 투여 량에서 활성을 나타내었다 (Melis 등, 1986). 구조 - 활성 관계 연구에 의하면 옥시토신에 의해 유도 된 음경 발기가 자궁 내막 옥시토신 수용체에 의해 매개되고 옥시토신 성 신경 세포의 세포 외로의 Ca2 + 유입과 결합하여 시상 하부의 뇌 영역으로 돌출되어 있으며 산화 질소 신타 아제의 활성화에 관여합니다. 산화 질소는 아직 알려지지 않은 메커니즘 (guanylate cyclase가 관여하지 않음)으로 세포 내 전달자 역할을하여 척수 및 여분 시상 하부 뇌 영역으로 돌출하는 옥시토신 성 신경 세포의 활성화를 유도하여 음경 발기를 유도한다 (그림 1) Argiolas and Melis, 1995, 2004, 2005 및 그 안의 참고 문헌). 자체 뉴런을 활성화시키는 옥시토신의 능력
그림 1. (MISSING) 시상 하부의 방실 핵에서 유래하고 척수, VTA, 해마, 편도체 등과 같은 여분의 시상 하부 뇌 영역에 투사하는 옥시토신 성 뉴런의 도식적 표현. 이러한 뉴런의 활성화는 도파민, 흥분성 아미노산, 옥시토신 자체, 헥사 레린 유사체 펩타이드 및 VGF- 유도 펩타이드는 음경 발기를 유도하며, 이는 GABA 성, 오피오이드 및 카나비노이드 CB1 수용체의 자극에 의해 감소 및 / 또는 폐지 될 수있다. 옥시토신 성 뉴런의 활성화는 이들 뉴런에 존재하는 산화 질소 합성 효소의 활성화에 이차적이다. 실제로, 방실 핵으로 직접적으로 주어진 산화 질소 공여자에서 유래 한 바와 같이, 도파민, 흥분성 아미노산 또는 옥시토신 수용체 또는 외인성 산화 질소의 자극에 의해 형성된 내인성 산화 질소는 아직 확인되지 않은 메카니즘에 의해 옥시토신 성 뉴런을 활성화시키고, 구아닐 레이트 시클 라제의 자극. 이것은 척수 및 여분 시상 하부 뇌 영역에서 옥시토신의 방출을 차례로 일으킨다. 옥시토신이 음경 발기를 유도하는 기전에 대한 몇 가지 세부 사항 (예 : VTA, 복부 subiculum 및 편도선)은 각 뇌 영역 섹션에 설명되어 있습니다. 여기서 옥시토신은 자체 수용체에 작용하여 NO 생산을 증가시켜 PVN에서 발견되는 음경 발기를 유도합니다. 그러나, PVN과의 차이에서, 꼬리 VTA NO는 구아닐 레이트 시클 라제를 활성화시킨다. 이것은 mesolimbic dopaminergic 뉴런의 활성화와 음경 발기로 이어지는 cGMP 농도 증가를 일으 킵니다. VS NO에서는 VTA를 포함하여 extra-hippocampal 부위로 돌출하는 글루탐산 신경 세포를 활성화시킵니다. VTA의 글루탐산은 옥시토신으로 발견되는 중배엽 도파민 성 뉴런을 활성화시킨다. 위에 설명 된 것과 유사한 메커니즘은 음경 발기가 생리적 인 상황에서 발생하는 경우, 즉 수컷 쥐가 접근하기 어려운 수용 여성 (예 : 비접촉 발기) 또는 교미 중일 때와 같은 경우에도 작동 할 수 있습니다.
방실 핵은 다음과 같은 연구 결과에 의해 뒷받침되었다 : (1) 옥시토신 수용체가이 시상 하부 핵에 존재한다 (Freund-Mercier 등, 1987, Freund-Mercier 및 Stoeckel, 1995); (2) 옥시토신은 생체 외 (in vitro) 및 생체 내 (in vivo) (Freund-Mercier 및 Richard, 1981, 1984, Moos 등, 1984); 과 (3) 옥시토신은 방실 핵에 작용하여 자신의 뉴런을 자극합니다 (Yamashita et al., 1987). 또한, magnocellular oxytocinergic neurons의 세포 기관에 충돌하는 oxytocinergic synapses은 시상 하부의 방실 상부 핵 (supraoptic nucleus)에서 확인되었다 (Theodosis, 1985). 마지막으로, 중추 신경계와 척수에서 옥시토신 함량을 완전히 고갈시키는 방실 핵의 전기 화학적 흥분 독성 병변에 의한 중심 옥시토신 성 뉴런의 파괴는 옥시토신의 발기 부전 효과뿐만 아니라 약물 유도 성을 손상시킨다 음경 발기 및 비접촉식 발기 (아래 및 Argiolas 외, 1987a, b, Liu 외, 1997 및 그 참고 문헌 참조). 방실 핵의 병변에서 발견되는 것과 유사한 결과가 강력하고 선택적 옥시토신 수용체 길항제에서 발견된다. 실제로, 나노 그램 양으로 방실 핵으로 주입 된 이들 화합물은 옥시토신에 의해 유도 된 음경 발기를 완전히 막았으며, 측실 심실에 투여했을 때 옥시토신 자체에 의한 음경 발기뿐만 아니라 약물 유발 음경 발기도 예방할 수있었습니다 (아래 3 절 참조). Argiolas and Melis, 1995, 2004, 2005 및 그 안의 참고 문헌) 및 비접촉식 발기술 (Melis et al., 1999a)이 있었으며 또한 성적으로 유력한 수컷 랫트 (Argiolas et al., 1988)의 copulatory behavior를 손상 시키는데 매우 효과적이었다. 더욱이 성적 상호 작용은 음경 발기 조절에 관여하는 척수로 돌출하는 방실 세 옥시토신 성 뉴론에서 초기 초기 유전자 c-fos의 유전자 산물 인 FOS를 증가시킨다 (Witt and Insel, 1994 및 그 참고 문헌 참조). 마지막으로, 성적 발기 부전 (예, 성체 수컷 랫트가 에스트로젠 - 프로게스테론 특이 적 수용성 여성과 교미 할 수 없음) h또한 수컷 랫트에서 시상 하부의 방실 핵에 낮은 수준의 옥시토신 mRNA와 산화 질소 합성 효소가 관련되어있다 (Benelli et al., 1995, Arletti et al., 1997) (이들 연구에 대한 광범위한 검토는 Argiolas, 1999, Argiolas and Melis, 2004, 2005 참조).
2.2. 복부 tegmental 영역
복부 tegmental 지역은 옥시토신이 음경 발기를 유도하는 뇌 부위로 최근에 발견되었다. 이 영역은 방실 핵 및 옥시토신 수용체에서 유래 한 옥시토신 성 신경 종말을 포함한다 (Freund-Mercier et al., 1987, Vaccari et al., 1998). 보다 정확하게, 옥시토신은꼬리 부분에 일방적으로 주사 할 때 음경 발기를 자극하지만,하지는하지 않는다. (Melis et al., 2007). 활성 선량은 방실 핵에 주사 할 때 필요한 것보다 높았으며 해마 복부 또는 편도의 후 내 피질 핵으로 주사 할 때 음경 발기 유도와 유사했다 (아래 참조). 분명히 발기 부전 효과는 측벽 핵의 껍질로 돌출하는 중뇌 변형 도파민 성 신경 세포의 활성화에 의해 매개된다. 이것은 음경 발기를 중재하는 방실 세 옥시토신 성 뉴런에 충돌하는 시상 하부의 도파민 성 신경원으로 돌출하는 아직 알려지지 않은 신경 경로를 활성화시킨다 (Melis et al., 2007, 2009a).
옥시토신이 복부 피 두드러기 영역에서 도파민 성 신경 전달을 활성화시키는 기전에 관해서는, 옥시토신은 중배엽 도파민 성 뉴런의 세포 기관에 위치한 옥시토신 성 수용체를 자극합니다. 이것은 dopaminergic 뉴런의 세포 기관 내부에 Ca2 + 유입을 증가시켜 nitric oxide synthase를 활성화시킨다 (Succu et al., 2008). 방실 핵과의 차이점 (아래 3 절 참조)에서 산화 질소는 guanylate cyclase를 활성화시켜 사이 클릭 GMP의 농도를 증가시킵니다. 이 메커니즘과 일치하여, 강력한 옥시토신 길항제 또는 S-methyl-thio-l-citrulline (뉴런 산화 질소 신타 아제의 강력한 억제제)을 dCNUMXTyr (Me) 2-Orn5-vasotocin 옥시토신 전의 꼬리 복부 피질 부분, 음경 발기의 폐지 및 옥시토신에 의해 유도 된 측벽 핵의 외피에서의 세포 외 도파민 농도의 증가. 또한, 활성 포스 포 디에스 테라 제 저항성 사이 클릭 GMP 유사체 인 2- 브로 모 - 사이 클릭 GMP는 꼬리 복부 피질 영역으로 주입 될 때 음경 발기를 유도하고, 옥시토신을 주사 한 경우에서 발견되는 바와 같이 측위 핵의 외피에서 세포 외 도파민 농도를 증가시킨다 (Succu et al., 8, Melis et al., 8a) (그림 2008도 참조).
이 메커니즘과 항상 일치하면서, 중추의 껍질에 주사되는 강력한 도파민 D2 수용체 길항제 인 haloperidol은 복부 tegmental 영역으로 주입 된 옥시토신에 의해 유도 된 음경 발기를 감소시킵니다 (Melis et al., 2007). 위의 메커니즘은 이중 면역 형광 연구에 의해 뒷받침되며, 옥시토신 섬유가 꼬리 복부 피 두드러기 영역의 도파민 성 신경 세포의 세포 체에 충돌한다는 것을 보여 주며, 역전사 인 플루오로 골드 (Fluorogold)가 측쇄 핵 Melis et al., 2007, Succu et al., 2008). 이들 도파민 성 신경 세포 및 도말 핵 수용체의 활성화는 아직 확인되지 않은 신경 경로의 활성화로 이끄는데, 이는 시상 하부의 도파민 성 뉴런을 자극하여 방실 핵에서 도파민을 방출함으로써 옥시토신 성 뉴런을 활성화시켜 척수 및 중개 음경 발기 (위와 Melis et al., 2007, Succu et al., 2007, 2008 참조). 사실, 음경 발기를 유도하는 용량에서 꼬리 복부 피 두뇌 영역으로 주입 된 옥시토신은 측벽 핵뿐만 아니라 방실 핵 (Succu et al., 2007)에서도 얻은 투석액에서 세포 외 도파민 농도를 증가시켰다.
2.3. 해마
해마의 CA1 필드는 옥시토신 성 섬유가 풍부한 다른 뇌 영역이었다 및 옥시토신의 주사가 음경 발기를 유도 한 초기 연구에서 확인 된 수용체 (Bujis, 1978, Sofroniew, 1983 참조). 그러나, 방실 핵과의 차이에서, 여기 옥실토신은 양심 실성 핵에서 활성 인 것으로 밝혀진 것보다 높은 양으로 양측으로 주입 될 때만 음경 발기를 유도 할 수있는 것으로 밝혀졌다 (Melis et al., 1986, Chen et al., 1992). 이러한 초기 연구에서 옥시토신을 사구 내로 주사하는 것은 비활성이었다. 그러나 최근의보다 세심한 미세 주입 연구는 복부 지방 부분 옥시토신 주입은 용량 의존적으로 음경 발기를 유도 할 수 있었다 (Melis et al., 2009b). 이 뇌 영역에 주입 된 옥시토신의 발기 부전 효과는 방실 핵에서 발견되는 일방적 인 주사 후 복부 tegmental 영역에서 활동성이있는 것과 비슷한 투여 량에서 관찰되었다 (Melis et al., 2007). 옥시토신이 복부 샘에 주입되면 산화 질소 합성 효소를 포함하는 뉴런에서 옥시토신 성 수용체를 활성화시켜 음경 발기를 유도하여 산화 질소 생산을 증가시킵니다. 산화 질소는 차례로 세포 간 전달자 역할을하여 글루타민산 신경 전달을 활성화시켜 음경 발기를 유도하며, 아마도 복부 subiculum에서 신경 (glutamatergic) 원심성 투상을 통해 mesolymic dopaminergic neurons (예 : 복부 tegmental 영역, 전두엽 피질, 방실 핵)의 활성을 조절하는 extra-hippocampal brain 영역 (Melis, 2007, 2009b; Succu et al., 2008 참조).
이 작용 기전은 음경 발기를 유도하는 투여 량에서 복강 내로 주사 된 옥시토신이 복강 내에서 투석액의 산화 질소 생산 및 세포 외 글루탐산 농도를 증가시키는 것을 보여주는 대뇌 내 미세 투석 실험에 의해지지된다 (Melis et al. , 2010), 그리고 세포 내 도파민 (agnumbus)에있는 세포 외 도파민 (melis et al., 2007). 이러한 반응은 옥시토신 수용체 길항제 d (CH2) 5Tyr (Me) 2-Orn8- 바소토신뿐만 아니라 연결성 산화 질소 신타 제 억제제 S- 메틸 - 티오 - 시스 트린 및 산화 질소 제거제 헤모글로빈에 의해 길항되었다 옥시토신 (Melis et al., 2010)이 나오기 몇 분 전에 복부에 위치한다.
또한, 이러한 작용 기전에 따라, NMDA가 복강 내로 주사하여 글루타메이트 성 신경 전달을 활성화 시키면 음경 발기가 유도된다 (Melis 등, 2010). 중이 배부 도파민 성 신경 세포의 활성화를 유발하고 복강 내에서 세포 외 도파민의 증가를 일으키는 복부 샘에서 원심성 투상의 표현형은 현재 알려지지 않았다. 그러나, 옥시토신에 의해 유도 된 옥시토신에 의해 유도 된 음경 발기가 복부 피질 부분에서부터의 투석액에서 세포 외 글루탐산의 증가와 동시에 발생하고, 측벽 핵으로부터의 세포 외 글루탐산의 증가와 (+) MK-801에 의해 길항되며, NMDA 아형 (Woodruff et al., 1987)의 흥분성 아미노산 수용체의 강력한 비 경쟁적 길항제는 복부 tegmental 영역으로 주입되었지만, 측위 핵에서는 주입되지 않았다 (Fig. 2 and Melis et al., 2009b 참조) , 이러한 예측이 복부 피 두드러기 영역에서 글루탐산 동성 신경 전달의 활성화로 이어질 가능성이 있으며, 이는 차례로 중격자 도파민 성 뉴런을 활성화시켜 중추 측근에 투사한다. 옥시토신이 복강 내로 주입 된 후 복부 피 두드러기 영역에서 발견되는 글루탐산의 농도가 증가하는지 여부는 대뇌 또는 다른 뇌 영역 (예 : 전두엽 피질)에서 발생하는 뉴런에서 방출되는지 여부는 현재 알 수 없습니다. 그럼에도 불구하고, 이것은 mesolimbic dopaminergic 뉴런의 활성화와 측위 핵에서 도파민의 방출을 증가시킨다. 여기에서 도파민 수용체의 활성화는 협심 - 시상 하부의 도파민 성 뉴런의 활성화를 일으키고, 방실 핵에서 도파민을 방출하여 척수로 돌출하는 옥시토신 성 뉴런을 활성화시키고 음경 발기를 중재한다 (위와 Melis et al., 2007, 2009a, Succu et al., 2008 참조).
2.4. 편도체
편도체는 옥시토신 섬유와 수용체가 풍부한 또 다른 뇌 영역이다 (Freund-Mercier et al., 1987, Vaccari et al., 1998, Uhl-Bronner et al., 2005 참조). 옥시토신은 불안 장애, 사회적 기억과 인식, 사회적으로 강화 된 학습, 정서적 공감, 정서적 인 얼굴 처리, 인간의 기능과 성적 행동 발기에 대한 두려움과 같은 다양한 기능에 관여한다고 생각됩니다 (Kondo 외, 1998, Dominguez et 2001, HuNan 등, 2005, Domes 등, 2005, Petrovic 등, 2007, Lee 등, 2008, Donaldson and Young, 2009, Hurlemann et al., 2009, Ebner et al. , 2010). 그러나, 편도의 후 외측 피질 핵에서 유도되었을 때 남성 쥐에서 음경 발기를 유도하는 옥시토신의 능력은 최근에 발견되었다 (Melis 등, 2009b). 이 반응은 복강 내로의 옥시토신 주입 후에 발견 된 바와 같이, 측벽 핵의 껍질로부터 얻어진 투석액에서의 세포 외 도파민 농도의 증가와 함께 발생 하였다 (Melis 등, 2009b). 편도의 후 내 피질 핵에 주입 된 옥시토신이 음경 발기를 유도하는 메커니즘은 현재 알려져 있지 않습니다. 이용 가능한 데이터는 옥시토신 수용체 길항제 d (CH2) 5Tyr에 의해 두 반응이 모두 사라지면서 옥시토신 성 수용체의 활성화에 의해 측벽 핵으로부터 얻어진 투석 물에서 페니스 발기 및 세포 외 도파민 농도의 증가가 매개됨을 보여준다 Me) 2-Orn8-vasotocin은 옥시토신 (Melis et al., 2009b)보다 몇 분 전에 편도선 핵에 주입되었습니다.
편도체의 후 내피 피질 핵에서 옥시토신이 활성화하는 어떤 메커니즘 이건간에, 펩타이드에 의해 유도 된 성 반응은 모든 도파민 수용체를 차단하여 cis-flupenthixol이 측쇄 핵의 껍질에 주입되고 NMDA 수용체의 차단에 의해 ( +) MK-801은 복부 피지 부분에 주입 되었으나 옥시토신이 복부 피질 내로 주입되어 음경 발기에 의해 발견 된 것과 같이 측벽 핵으로는 주입되지 않았다 (Melis et al., 2009b). 이는 편도체의 후 내핵에 주입 된 옥시토신이 복부 피 두드러기 영역에서 글루탐산 신경 전달을 활성화 시킨다는 것을 시사한다. 이것은 음경 발기로 이어지는 중파 변이 도파민 성 신경 세포의 활성화를 일으킨다. 이 편도체의 핵을 복부 subiculum과 연결하는 신경 경로를 보여주는 연구 결과 (Canteras et al., 1995, French and Totterdell, 2003)에 따르면 이러한 발견은이 두 뇌 영역간에 상호 작용이 존재할 가능성을 높인다. 편도체에서 측 방향 핵으로 또는 복부 tegmental 영역으로의 경로가 기술되어있다 (Kelley and Domesick, 1982, Witter, 2006).
2.5. 척수
척수는 옥시토신이 섬유질과 수용체를 포함하는 중추 신경계의 또 다른 영역이다. (Freund-Mercier 등, 1987, Uhl-Bronner 등, 2005) 옥시토신이 음경 발기를 유도한다 (Tang et al., 1998 Veronneau-Longueville et al., 1999, Giuliano and Rampin, 2000, Giuliano et al., 2001). 상기 한 바와 같이, 이들 옥시토신 성 섬유는 시상 하부의 방실 핵에서 유래하고, 음경 발기를 중재하는 척추 자율 신경을 제어하는 하강 경로에 기여한다. 실제로 이러한 섬유는 음경 해면 경관의 신경절과 교감 신경 및 부교감 신경 세포의 기둥을 흉추 - 요추 및 요실강 내로 형성하고 음경 해면체를 음경 해부학 적으로 음경 해면체와 접촉하게 만든다 (Marson and McKenna, 1996, Giuliano and Rampin, 2000, Giuliano et al. , 2001). 이러한 시냅스 접촉은 페니스 뉴런의 음경에서 시작하여 동종 코로나에 주사 된 특정 역행 추적자와 함께 척수에 도달하고 이중 면역 형광 및 공 초점 레이저 현미경 검사와 결합하여 증명되었다 (Tang et al., 1998, Veronneau-Longueville et al., 1999). 이 연구들과 일치하여, 마취 된 수컷 쥐의 요추 - 흉골에서 옥시토신 누적 량의 척수강 내 주입으로 흉 요추 수준이 아닌 도출 된 해면 내압이 용량 의존적으로 증가한다. 이러한 효과는 d (CH2) 5Tyr (Me) 2-Orn8-vasotocin에 의한 옥시토신 성 수용체의 차단과 골반 신경 단면에 의해 폐지되었다 (Giuliano and Rampin, 2000, Giuliano 등, 2001). 이러한 결과는 요추 - 천골 척수에서 작용하는 옥시토신이 해면부 내압을 증가시키고, 방실 핵의 생리 학적 활성화 동안 방출되는 옥시토신이 해면 성 전립선에 돌출하는 척추 발 달각 뉴런의 강력한 활성제임을 시사한다. 흥미롭게도, 옥시토신이 발기 부전 효과를 발휘하는 발기 부전 뉴런은 수질 형성 세포의 핵 모세 혈관 세포에서 발생하는 세로토닌 성 뉴런으로부터 시냅스 접촉을받는 것으로 알려져있다 (Marson and McKenna, 1992, Tang et al ., 1998). 이러한 세로토닌 성 뉴런의 파괴는 수컷 쥐의 사정과 음경 반사를 촉진시킨다 (Marson and McKenna, 1992, Yells 등, 1992). 5HT2C 수용체를 자극하는 약물은 뇌 실내 뇌실 내로 공급 될 때 음경 발기를 촉진하지만 방실 핵으로는 유입되지 않기 때문에 5HT2C 수용체를 차단하는 약은 도파민 작용제와 옥시토신 유발 음경 발기를 감소 시키지만 도파민 길항제는 5HT2C 작용제 유도 음경 발기를 감소시키지 않는다 Stancampiano 등, 1994 및 그의 참고 문헌 참조), 옥시토신은 요추 - 척수 척수 수준에서 발기 성 5HT2C 수용체의 작용을 촉진하는 것으로 제안되었다 (Stancampiano 등, 1994). 대안으로, 옥시토신은 신경 세포가 발생하는 핵 paragigantocellularis에서 직접 작용함으로써 척추가 하강하는 세로토닌 성 뉴런의 활동에 영향을 미칠 수있다 (Stancampiano et al., 1994 참조).
3. 중추 신경계 및 음경 발기에서 oxytocin, dopamine 및 glutamic acid 사이의 상호 작용
섹션 1에서 언급했듯이, 중추 신경계에 존재하는 모든 옥시토신 성 뉴런은 방실 핵과 주변 구조물에서 유래한다. 이들 뉴런의 활성은 상이한 신경 전달 물질 및 / 또는 신경 펩타이드의 제어하에있다. 방실 대 레벨에서 가장 많이 연구되는 약물로는 도파민, 글루타민산, 감마 - 아미노 부티르산 (GABA), 산화 질소, 엔도 칸 나비 노이드, 오피오이드 펩타이드, 성장 호르몬 방출 펩타이드, VGF 관련 펩타이드 및 옥시토신 자체가 있습니다. GABA, 오피오이드 펩타이드 및 엔도 칸 나비 노이드가 억제 성 인 반면, 도파민, 글루탐산, 성장 호르몬 방출 펩타이드, VGF- 유도 펩타이드 및 옥시토신은 자극적이다. 예를 들어, 이들 화합물 및 그의 작용제는 방실 핵에 주입 될 때 음경 발기를 촉진한다. 또는 그들의 작용제는 음경 발기를 억제한다 (Meisel and Sachs, 1994, Witt and Insel, 1994, Argiolas and Melis, 1995, 2004, 2005, Giuliano and Rampin, 2000, 2004, McKenna, 2000, Andersson, 2001, Hull et al., 2002 참조).
몇 가지 실험 결과는 이러한 옥시토신 성 신경원과 위의 신경 전달 물질과 신경 펩타이드가 다른 생리 학적 맥락에서 발기 기능과 성 행동 조절에 관여 함을 시사한다. 또한, 복부 tegmental 영역, 해마와 그 지역, 편도체 및 척수와 같은 시상 하부 뇌 영역에서 방출 된 옥시토신은 옥시토신 성 시냅스가 충돌하는 뉴런의 활성에 영향을 줄 수 있습니다. 현재 옥시토신 성 시냅스가 부딪히는 음경 발기에 중요한 유일한 뉴런은 확실하게 확인되며, 측부 핵의 껍질로 돌출하는 꼬리 복부 피질 부위의 중뇌 변형 도파민 신경 세포의 세포체이다 (Melis et al., 2007 Succu et al., 2008), 요추 천추에서 해면체로 돌출하는 발기 성 척추 신경 세포 (Giuliano and Rampin, 2000, Giuliano 등, 2001 참조) (2.2 및 2.5 절 참조) . 사실 옥시토신 성 시냅스와 수용체가 복강 내에서 확인되었지만, 편도선 및 척수, 음경 발기에 중요한 영역 (위 참조),이 영역에서 신경 세포에 존재하는 신경 전달 물질의 유형 옥시토신 성 신경 종말이 부딪치며 아직 알려지지 않았다.
이 부분에서는, 꼬리 복부 피 두드러기 영역, 해마 복부 및 척수에 주사 된 옥시토신의 발기 부전 효과의 기전에 관한 최근의 문헌을 간략하게 요약하고있다. 이러한 영역에서 펩타이드와 도파민 및 글루탐산의 상호 작용 및이 상호 작용이 발기 기능의 중앙 제어에서 작용할 수있는 역할에 특히주의를 기울입니다. 발기 기능에 핵심적인 역할을하는 방실 핵의 옥시토신 성 뉴런에 대한 도파민과 글루타민산의 효과에 대한 간략한 요약이 독자들에게이 분야의 초기 연구 상태를 알리기 위해 제공된다. 이 연구는 이미 광범위하게 검토되었다 (Argiolas and Melis, 1995, 2004, 2005, Melis and Argiolas, 2003 참조). 이 경우에도 특히 성기능 (음경 발기 및 교합)뿐만 아니라 성기능에 있어서도 도파민 - 옥시토신 링크와 글루탐산 - 옥시토신 링크 모두에 중요한 역할을하는 가장 최근 결과가 특히 주목됩니다 각성과 성적인 동기 부여.
3.1. 방실 핵에서 도파민 - 옥시토신 상호 작용
XNUMXD덴탈의 중심 옥시토신 성 뉴런을 활성화시킴으로써 음경 발기를 유도하는 도파민 작용제의 능력 옥시토신 수용체 길항제 d (CH1987) 2Tyr (Me) 5-Orn2-vasotocin 주입 된 뇌 실내실 (icv)이 발견되었을 때 아포 몰핀이 방실 핵 (Melis et al., 8)에 주입 될 때 아포 모르핀이 음경 발기를 유도한다는 사실이 발견되었다 옥시토신에 의한 icv뿐만 아니라 아포 모르핀에 의해 유도 된 거의 모든 음경 발기를 피하에 감소시킬 수있다 (Argiolas et al., 1987b). 이러한 결과는 d (CH2) 5Tyr (Me) 2-Orn8-vasotocin이 icv로 주어졌고 아포 몰핀이 방실 핵으로 직접 주어 졌을 때 비슷한 결과를 보이는 다른 연구의 결과가 뒤를이었다 (Melis et al., 1989b), l도파민 작용제가 시상 하부 뇌 영역, 특히 척수에 돌출하는 방실 세 옥시토신 성 뉴런을 활성화시킴으로써 음경 발기를 유도한다는 것을 제안했다 (Argiolas와 Melis, 1995, 2004, 2005 참조). 이 가설에 따라, 마취 된 래트에서, 비 펩타이드 옥시토신 수용체 길항제에 의한 요추 - 천추 옥시토신 성 수용체의 차단은 도파민 작용제 아포 모르핀에 의해 유도 된 항문 주위 압력의 아포 모르핀 유도 된 상승을 폐지 할 수있는 것으로 최근 발견되어, paraventriculo - 척추 옥시토신 성 경로는 음경 발기와 관련이있다 (Baskerville et al., 2009).
연구를 목표로 음경 발기 유도에 관여하는 도파민 수용체의 동정은 방실 핵에서도 관찰되었다. 도파민 수용체 작용제는 D2 계열의 도파민 수용체에 작용하여 음경 발기를 유도한다(Melis et al., 1987, Eaton et al., 1991, Melis and Argiolas, 1995a 참조). 따라서이 시상 하부 핵에 주입 된 선택적 D1 수용체 작용제 인 SKF 2은 아니지만 강력한 DXXUMX / D2 수용체 작용제 인 아포 몰핀과 강력한 선택적 DE38393 수용체 작용제 인 quinpirole은 용량 의존적으로 음경 발기를 유도 할 수있는 것으로 나타났다 이러한 D1 수용체 작용제에 의해 유도 된 성 반응은 haloperidol과 l-sulpiride와 같은 D2 수용체 길항제에 의해 제거되었지만 선택적 D2 수용체 길항제 인 SCH 23390 (Melis et al., 1)에 의한 것은 아니었다. 방실 핵에 주사 할 때 음경 발기를 유도하는 아포 모르핀의 능력은 원격 측정법 연구에 의해 확인되었으며, 방실 핵에 투여 된 도파민 작용제는 전신 혈압을 수정하지 않고도 깨어있는 수컷 랫트에서 음핵 내 압력을 증가시킬 수 있음을 보여 주었다 (Chen et al. , 1987, Giuliano and Allard, 1999), 전신 주사 후 발견 된 것 (Bernabè et al., 2001). 이 연구들 또한 D2 수용체 작용제가 방실 핵에 주입 될 때 대장 내압을 증가시키지 못하는 것으로 보통 발견 되었기 때문에 D1 수용체의 주된 역할이 확인되었다 (Chen 등, 1999).
몇 줄의 실험적 증거가 있었고, 음경 발기를 유도하는 방실의 D2 수용체가 옥시토신 성 뉴런의 세포 기관에 위치한다는 것을 알 수 있었다. 첫째, 방실 핵은 소위 시상 하부의 도파민 성 뉴런에 속하는 도파민 성 신경 말단을 포함합니다. 이 뉴런의 세포 기관은 A13 및 A14 그룹에 위치하고 있습니다 Dahlstrom and Fuxe (1964)는 뇌하수체 및 / 또는 시상 하부 뇌 영역으로 돌출하는 방실 세 옥시토신 성 뉴런 (Buijs et al., 1984, Lindvall et al., 1984)을 포함하여 여러 시상 하부 구조를 광범위하게 자극하고 신경계를 형성한다.
음경 발기와 교미의 제어에서 방실 판 수준에서 이러한 도파민 성 뉴런의 관련성은 그 대사 산물 인 세포 외 도파민과 3,4-dihydroxyphenylacetic acid (DOPAC)의 농도가에서 얻어진 투석액에서 증가한다는 것을 보여주는 미세 투석 연구에 의해 뒷받침된다 접근 할 수없는 난소 적출 된 에스트로겐 + 프로게스테론 - 감작 수용성 여성 (Melis et al., 2003)의 존재 하에서 비접촉 발기를 나타내는 성욕이 강한 수컷 쥐의 방실 핵.
도파민과 DOPAC 농도의 증가는 내측 전 광학 영역 (Hull et al., 2003)과 교근 핵 (Pfaus)에서 발견되는 수용성 여성과의 교합이 허용되었을 때 (Melis et al., 1995) 그리고 Everitt, 1995). 둘째, 여러 연구 결과에 따르면 방실 대 상 D2 수용체의 자극에 의해 유발 된 음경 발기는이 영역에서 방출되는 옥시토신에 의해 매개됩니다. 따라서, 음경 발기를 유도하는 투여 량에서 주어진 아포 모르핀은 랫트 및 원숭이의 혈장뿐만 아니라, 시상 하부의 뇌에서도 옥시토신 농도를 증가시킬 수있는 것으로 밝혀졌다 (Melis 등, 1989a, Cameron 등, 1992) 해마와 같은 영역 (Melis et al., 1990). 이러한 결과와 일치하여, 음경 발기를 유도하는 투여 량에서 방실 핵에 주입 된 아포 모르핀은 최근에 옥시토신 수용체 길항제 d (CH2)에 의해 감소 된 측위 핵에서의 세포 외 도파민 농도를 증가시킬 수있는 것으로 나타났다. 5Tyr (Me) 2-Orn8-vasotocin은 복부 tegmental 영역 (Succu et al., 2007, Melis et al., 2009a)에 주입되었습니다 (섹션 4 참조). 셋째, 외 시상 하부 뇌 영역 (Hawthorn et al., 1985)에서 옥시토신을 거의 완전히 제거하는 양심 실간 핵의 양측 전해질 병변은 아포 모르핀에 의한 음경 발기 (Argiolas et al., 1987a) 및 선택적 옥시토신 수용체 길항제를 폐지한다 측실 심실에 공급되는 것이 아니라 방실 핵에 주입하는 것이 옥시토신 수용체 차단에있어 이들 화합물의 효능과 병행하여 용량 의존적으로 아포 모르핀 유발 음경 발기를 감소시킨다 (Melis et al., 1989b). 옥시토신 수용체 길항제는 또한 옥시토신뿐만 아니라 아포 모르핀 (Argiolas et al., 1988, 1989)에 의해 유도 된 남성의 성행위의 촉진을 감소 시키는데 매우 효과적이다.
도파민 또는 도파민 수용체 작용제에 의해 활성화 된 D2 수용체의 기작에 관해서, 옥시토신 성 뉴런의 활성을 증가시킴으로써 시상 하부 뇌 영역 및 척수에서 옥시토신을 방출하며, 많은 실험 데이터D2 수용체의 자극이 옥시토신 성 뉴런의 세포 내에서 세포 내 Ca2 + 이온의 농도를 증가시켜 nitric oxide-synthase의 활성화를 유도한다는 가설을지지하며, 이러한 세포체에 존재하는 Ca2 + - 칼 모둘 린 의존 효소 (Vincent and Kimura, 1992, Torres 등, 1993, Sanchez 등, 1994, Sato-Suzuki 등, 1998). 증가 된 산화 질소 생산은 차례로 옥시토신 성 뉴런의 활성화를 유발한다. 따라서, (1) 아포 모르핀 유발 음경 발기는 유기 칼슘 채널 차단제 및 N_ 타입의 전압 의존성 Ca2 + 채널 (McCleskey 등, 1987)의 강력하고 선택적 차단제 인 by_-conotoxin GVIA에 의해 예방되었으며, 방실 실 핵 (Argiolas et al., 1990 및 그의 참고 문헌 참조); (2) 아포 몰핀에 의해 유도 된 음경 발기는 방실 핵에 주어진 산화 질소 신타 제 억제제에 의해 예방되었다 (Melis et al., 1994c); (3) 아포 모르핀 및 기타 D2 수용체 작용제는 음경 발기를 유도하는 용량으로 투여하여 대뇌 내 미세 투석으로 얻은 방실 판막에서 산화 질소 생성을 증가 시켰는데, 이는 뇌 실내 미세 산화 투석액에서 감소 된 양으로 방실 형 산화 질소 합성 효소 억제제에 의해 감소되었다 D2 수용체 agonistinduced penile erection (Melis et al., 1996). 가능한 한 데이터가 산화 질소가 세포 내 전달자 역할을하고 guanylate cyclase가 관여하지 않는다는 것을 의미하지만, 산화 질소가 방실 옥시 트립신 뉴런을 활성화시키는 메커니즘은 아직 알려지지 않았다. 사실, cyclic GMP의 활성화 된 포스 포 디에스 테라 제 저항성 유사체 인 8-bromo-cyclic GMP는 방실 핵 (Fig. 2)에 주어질 때 음경 발기를 유도 할 수 없다는 것이 밝혀졌다 (Melis and Argiolas, 1995b 및 그 안의 참고 문헌 참조).
상기 해석은 주로 도파민 D2 수용체의 자극이 상이한 G 단백질 결합 메카니즘을 통해 이들 수용체를 함유하는 뉴런의 세포 기관의 여기보다는 억제에 결합되어 주로 설득력이없는 것으로 간주되어왔다 (Sokoloff와 Schwartz, 1995 참조). 그러나,이 불일치에 대한 가능한 설명은 도파민에 의한 방실 옥시토신 성 뉴런의 직접적인 자극과 일치하며, 최근에는 G 단백질 결합 도파민 D4 수용체, D2 수용체 계열 (D2, D3 및 D4)의 구성원으로,이 수용체 아형의 복제 된 버전을 함유 한 세포 제제 (Moreland et al., 2)를 함유 한 세포 제제에서 Ca2004 + 유입을 증가시키는 자극. 더욱 중요하게는 전신적으로 투여 한 경우 수컷 쥐에서 음경 발기를 유도 할 수있는 선택적 D4 수용체 작용제 (예 : ABT 724) (N- 메틸 -4- (2- 시아 노 페닐) 피 페라 지닐 -3 메틸 벤즈 아미드 말레 에이트)가 발견되었다 (Brioni et al. 2004). 이 효과는 선택적 D2 수용체 아형 작용제 인 PNU-95666E (R-5,6- 디 히드로 -N, N- 디메틸 -4Himidazo [4,5,1-1] 퀴놀린 -5- 아민) (Hsieh 등, 2004)에서는 발견되지 않았다. 또한 D2 수용체 아형 (Brioni et al., 4; Moreland et al., 2004)의 클로닝 된 버전을 함유하는 세포 제제에서 Ca2004 + 유입을 증가시킬 수 없었다. 상기 가설 및 발견과 일치하여, PD168,077 (N- 메틸 -4- (2- 시아 노 페닐) 피페 라지 닐 -3 메틸 벤즈 아미드 말레 에이트), PIP-3EA (2- [4- (2- 메 톡시 페닐) 피페 라진 -1- 일 메틸] 이미 다조 [1,2-a] 피리딘)과 다른 선택적 D4 수용체 작용제 (Heier 등, 1997, Melis 등, 2006b, Löber 등, 2009)는 전신 주입, icv 주입, 방실 핵은 비록 아포 모르핀보다 덜 효과적이지만 이들 D4 수용체 작용제의 발기 부전 효과는 선택적 D745,870 수용체 인 L-3 (4- (1- [클로로 페닐] 피페 라진 -1- 일) - 메틸 -2,3H- 피 롤로 [4-B] 피리딘 트리 하이드로 클로라이드) 길항제 (Patel et al., 1997, Melis et al., 2005, 2006b, Löber et al., 2009).
마지막으로, 상기 D4 수용체 작용제의 발기 부전 효과는 방실 핵에 주어진 산화 질소 신타 제 억제제 및 선택적 옥시토신 수용체 길항제 인 d (CH2) 5Tyr (Me) 2-Orn8- 바소 토신에 의해 감소되었다 주어진 icv는 있지만 방실 핵에서는 그렇지 않다. 이러한 결과는 아포 몰핀 및 고전 D4 작용제 (Melis et al.)에 나타난 바와 같이, D2 수용체 작용제가 산화 질소 합성 효소를 활성화시키고, 시상 하부 뇌 영역에서 옥시토신을 방출함으로써 음경 발기를 촉진시킴으로써 옥시토신 성 뉴런을 자극한다는 가설과 일치한다 ., 2005, 2006b, Loeber et al., 2009).
위의 결과는 또한 도파민이 방실 세 옥시토신 성 뉴런의 세포 기관에있는 D4 수용체에 작용하여 음경 발기를 유도하고 옥시토신 성 뉴런의 세포체에 Ca2 + 유입을 증가시켜 산화 질소 생산을 증가 시킨다는 가설을 뒷받침한다. 일산화 질소는 이미 설명한 바와 같이 옥시토신 성 뉴런을 활성화시켜 옥시토신을 여분 시상 하부 뇌 영역과 척수에서 분비합니다. 이와 관련하여, 방실 핵에서 옥시토신 성 뉴런의 세포체에서 도파민 수용체가 확인되었다는 것이 주목할 만하다 최근에는 높은 선택성 D2, D3 및 D4 수용체 항체 및 옥시토신 항체를 이용한 이중 면역 형광 연구에 의해서만 수행되었다. 이 연구는 방실 핵 (그리고 supraoptic 핵 및 내측 preoptic 영역)에서 oxytocinergic 뉴런의 세포 기관에서 별도로 공동 위치 화 된 세 D2receptor 하위 유형 (D2, D3 및 D4)의 표현을 보여 주었다 (Baskerville Douglas, 2008, Baskerville et al., 2009).
이것은 D2 타입의 도파민과 도파민 수용체 작용제가 상기 언급 된 시외 뇌 영역으로 투영되는 옥시토신 성 뉴런을 직접 활성화시킴으로써 음경 발기를 유도 할 수있는 가능성에 대한 강력한 신경 해부학 적 지원을 제공한다, 예를 들어, 척수, 복부 tegmental 영역, 해마 및 편도체. 그러나 이러한 연구 결과는 발기 부전 반응을 유발하는 D2 수용체 아형의 확인에 도움이되지 않습니다. 불행히도, 방실 핵에서 도파민 수용체 작용제에 의해 활성화 된 옥시토신 성 신경원을 확인하는 것을 목표로 한 연구에서도 도움을 얻을 수 없다. 실제로, 다양한 도파민 수용체 아형에 대한 상이한 활성에도 불구하고, 혼합 된 도파민 수용체 작용제 (예 : 아포 모르핀) 또는 선택적 D2 수용체 작용제 (예 : 모든 D2 수용체 아형에 작용하는 퀸피롤) 또는 선택적 D4 수용체 작용제 방실 핵의 parvocellular oxytocinergic 뉴런에서 FOS 단백질의 증가에 의해 측정 된 바와 같은 옥시토신 성 뉴런의 활성화 (Bitner et al., 2006). 그러나,이 발견은 최근에 심실 옥시토신 성 뉴런의 FOS 단백질 증가가 음경 발기가 D2 및 D3 수용체 아형에 주로 작용하는 quinerolane에 의해 유도되었을 때만 발견되었지만 D168077 수용체 작용제 인 PD 4에 의해서는 일어나지 않아서 발견되었다. 성 반응을 유도하는 두 화합물의 능력에도 불구하고 (Baskerville et al., 2009).
다른 D2 수용체 아형 (주로 D2 및 D3)의 선택적 작용제에 대한 추가 실험은 방실 수준에서 발기 기능의 조절에있어서 각 도파민 수용체 아형의 정확한 역할을 확인하는 데 필요하다. 이와 관련하여 이전에 이미 상기 한 바와 같이 모든 도파민 수용체 아형 (Brioni 등, 2004 및 그 안의 참고 문헌)에서 강력하게 작용하는 아포 모르핀은 방실로 주사 할 때 음경 발기 유도에 D4 수용체 작용제보다 훨씬 더 효과적이다 핵. D4 수용체 작용제와 비교하여 D4 수용체에 대한 아포 모르핀의 친 화성이 더 높거나 D4 수용체 작용제가 D4 수용체 부분 작용제로 작용하거나 아포 모르핀에 의한 상이한 도파민 수용체 아형의 동시 활성화에 의해 설명 될 수있다 D2 수용체 아형의 D4 수용체 아고 니스트에 의한 활성화보다 음경 발기를 중재하는 옥시토신 성 뉴런의보다 높은 활성화를 일으킨다.
도파민 D1과 D2 수용체 사이의 상호 작용은 내측 전 광학 영역 (Hull et al., 1989 참조)의 수준에서 성 행동의 조절에 이미 기술되어있다. 음경 발기를 유도하는 선택적 D2 수용체 작용제의 무능력 (예 : Depoortère et al., 2004 참조)이 확인 될 경우 (예 : 방실 핵에 이들 화합물을 주입 한 후에도) 음경 발기를 중재하는 옥시토신 성 뉴런의 활성화에서 D2009 수용체 단독 또는 D3 수용체의 주요 역할이 상세하게 분석되어야한다 (Baskerville et al., 4 참조). 불행하게도, 선택적인 D2 및 D3 수용체 작용제 (예, 시험 관내에서 최소 4/5 차수의 이들 2 가지 수용체 아형에 대한 친화도가 다른)은 현재 이용 가능하지 않다. 이러한 이유로, D3 수용체가 고전적인 D2 수용체 작용제에 의해 유도 된 음경 발기를 중재하는 최근의 제안은 시험 관내 실험에서 특성화 된 추정 D3 수용체 길항제의 능력에 기초하여, 고전적인 D2 작용제에 의해 유도 된 음경 발기를 감소시키는 것이다 (Colins et al., 2)를 활성화시키는 apomorphine, quinpirole 및 pramipexole은 다른 실험에서 확실히 검증되어야합니다. D4 수용체 작용제의 음경 발기에 대한 효과가 D4 수용체 작용제의 발기 부전 효과를 입증하는 상기 연구의 결과와는 현저히 대조적으로이 연구에서 발견되지 않았기 때문에 이러한 검증이 또한 필요하다. 사실, 아포 모르핀이 야생형 D4 수용체 녹아웃 마우스에서 보이는 것과 동일한 효능을 가진 D4 수용체 녹아웃 마우스에서 음경 발기 (및 하품)를 유도하는 능력 및 D3 수용체 길항제가 이들 동물에서 아포 모르핀 반응을 폐지 할 수있는 능력 Collins 등, 2009)은 D3 수용체 작용제에 의해 유도 된 음경 발기에서 D2 수용체 아형의 선택적 역할에 대한 결정적인 증거로 간주 될 수 없다. 신경 전달 물질 / 신경 펩타이드 및 / 또는 신경 전달 물질 / 신경 펩타이드 수용체 유전자 제거 (신경 전달 물질 / 신경 펩타이드 및 / 또는 신경 전달 물질 / 신경 펩타이드 수용체 녹아웃 동물)에 대한 연구는 일반적으로 신경 전달 물질의 추정되는 성적인 역할을 확인하는 데있어 혼란과 합병증을 더 가중시킵니다. / 또는 신경 펩타이드와 그 수용체. 즉, 옥시토신 유전자 제거는 옥시토신이 교미 및 교미에 불필요한 것처럼 정상적으로 짝짓기하고 교미하는 옥시토신 녹아웃 마우스를 생산합니다. 또한 동형 접합체의 여성 옥시토신 녹아웃 마우스는 정상적인 교미 및 분만을 나타내지 만 우유 낙후의 현저한 장애가있다 (Nishimori et al., 1996, Young et al., 1996). 신경원 산화 질소 신타 제를 코딩하는 유전자의 절제는 또한 정상적으로 교미되고 교미되는 쥐를 노크하는 (Huang et al., 1993) 질소 산화물 합성 효소를 생산한다. 그러나 이러한 결과는 아마도 생식 생리학의 중요한 특징, 즉 중추 및 말초 수준에서의 통제와 관련된 시스템의 중복성을 나타낼 것입니다.
이러한 중복성은 종의 생존을 위해 다음 세대로의 유전자 전달을 보장하기 때문에 분명히 진화론 적 기원을 가지고 있습니다. 따라서 D4 수용체 유전자의 절제가 아포 모르핀의 발기 부전 효과를 변화시키지 않는다는 사실은 옥시토신과 산화 질소와 같은 D4 수용체가 발기 기능을 조절하는 시스템에서 작용하는 매개체 중 일부일 뿐이라는 것을 암시한다. 음경 발기 및 성 행동 조절에있어 이들 수용체에는 아무런 역할도 없음을 시사한다. 다른 계통의 수컷 쥐에게 전신적으로 주어 졌을 때 음경 발기를 유도하지 못하는 D4 작용제는 다른 연구에 의해 최근보고되었다 (Depoortère et al., 2009). 그러나 Collins et al. (2009), 그리고 음경 발기 조절에있어 다른 D2 수용체 아형의 역할에 대한 그림을 만들기 위해이 연구는 전신적으로 주어진 선택적 D3 수용체 길항제가 아포 모르핀 유도 성 음경 발기를 감소시킬 수 없음을 보여줍니다 (2- (741,626- 클로로 페닐) -3- 클로로 페닐) -4- 히드 록시피 페리 딘 (4-4- 히드 록시피 페리 딘)에 의해 성 반응 (및 하품)이 길항되는 동안 아포 모르핀의 발기 부전 효과에 더 민감한 균주의 수컷 쥐 D1 및 D1 수용체보다는 D2 수용체가 D3 작용제에 의해 유도 된 음경 발기에 주요한 역할을한다는 것을 저자에게 제시하게했다 (Depoortere et al., 4). 마지막으로, 음경 발기를 중재하는 옥시토신 성 뉴런에 대한 도파민 수용체 작용제의 흥분 효과가 적어도 부분적으로는 직접적이 아니라 간접적 인 것, 예를 들어 중개되거나 다른 신경 전달 물질의 활성 변화에 의해 영향을받을 가능성이있다. 방실 핵의 옥시토신 성 뉴런은 완전히 배제 할 수 없다.
3.2. 방실 핵에서의 글루탐산 - 옥시토신 상호 작용
시상 하부의 방실 핵은 신경 전달 물질로서 흥분성 아미노산을 포함하는 시냅스가 매우 풍부하다 (예, 글루탐산과 아스파르트 산) (Van Den Pol, 1991). 이 핵의 흥분성 아미노산은 음경 발기 및 성행위 등 다양한 기능에 관여합니다 (Roeling et al., 1991, Melis et al., 1994b, 2000, 2004b). 따라서, (±) -_- 아미노 -3- 히드 록시 -5- 메틸 - 이속 사졸 -4- 프로피온산 (AMPA)이 아닌 NMDA 수용체 아형의 선택적 효능 제인 N- 메틸 -d- 아스파르트 산 (NMDA) , AMPA 수용체 아형의 선택적 작용제 또는 대사 증후 성 수용체 아형의 선택적 작용제 인 (±) - 트랜스 (1) - 아미노 -1,3- 시클로 펜탄 디카 르 복실 산 (ACPD)이 주사 된 경우 음경 발기를 유도 할 수있는 것으로 밝혀졌다 자유롭게 움직이는 쥐의 방실 핵 (meli et al., 1994b). 948 MR Melis, A. Argiolas / Neuroscience 및 Biobehavioral Reviews의 발기 부전 효과 35 (2011) 939-955 NMDA는 비 경쟁적 NMDA 수용체 길항제 인 MK-801에 의해 예방되었습니다 (Woodruff 외., 1987 ), 방실 핵에 주입되었다 (Melis et al., 1994b). NMDA는 깨어 있거나 마비 된 수컷 흰쥐에서 뇌내 압력이 증가 할 때 방실 핵에 주입 될 때 다른 흥분성 아미노산 수용체 아형의 효능 제보다 훨씬 더 활동적인 것으로 밝혀졌다 (Zahran et al. al., 2000, Chen and Chang, 2003).
옥시토신과 도파민에 대해 위에서 제시 한 바와 같이, 흥분성 아미노산 신경 말단이 방실 핵 세포에서 옥시토신 성 세포체에 충돌하기 때문에 음경 발기를 매개하는 NMDA 수용체가 옥시토신 성 뉴런의 세포 체내에 위치 할 가능성이있다 (반 덴 폴, 1991). 도파민 수용체 작용제에서 발견 된 것과 유사하게, NMDA의 발기 부전 효과는 명백히 옥시토신 성 신경 전달의 활성화에 의해 매개되며 옥시토신 길항제 d (CH2) 5Tyr (Me) 2-Orn8-vasotocin에 의해 icv가 폐지되지만, (Argiolas and Melis, 1995, 2004, 2005 및 그 안의 참고 문헌 참조). NMDA에 의해 유발 된 음경 발기가 산화 질소 합성 효소 저해제 (N-Nitro-N-methyll-arginine methyl ester and N-Nitrogen-N-methyll-arginine methyl ester)에 의해 예방되기 때문에 NMDA에 의해 유도 된 옥시토신 성 신경 전달의 활성화는 또한 산화 질소 신타 제의 활성화에 이차적이다. methyl-thio-l-citrulline)과 음경 발기를 유도하는 양 방실 핵에 주입 된 NMDA는 시상 하부 핵에서 산화 질소 생산을 증가시킨다 (Argiolas and Melis, 1995, 2004, 2005 및 그 참고 문헌 참조). ). 도파민 수용체 작용제에 관해서, NMDA 유도 된 산화 질소 생성 효소의 활성화는 Ca2 + 채널 결합 NMDA 수용체를 통한 옥시토신 성 세포체의 증가 된 Ca2 + 유입에 이차적 일 수있다 (리뷰를 위해서는 Snyder, 1992; Southam and Garthwaite, 1993, Schuman and Madison, 1994 및 그 안의 참고 문헌). 산화 질소는 차례로 옥시토신 성 신경 전달을 활성화시킵니다 (위 참조). 음경 발기를 중재하는 방실 세 옥시토신 성 신경 세포를 활성화시키는 글루타메타닌 돌기의 기원은 알려지지 않았지만 일부 해부학 적 및 전기 생리 학적 증거는 해마에서 적어도 부분적으로 유래한다고 제안하고있다 (Saphier and Feldman, 1987, Chen et al., 1992) . 방실 핵에 대한 글루타메라 진의 투영의 기원을 더 잘 특성화하기 위해서는 더 많은 연구가 필요하지만, 음경 발기 및 성 행동의 조절에있어서의 방실 핵의 글루탐산의 참여는 미세 투석 연구에 의해 분명히 뒷받침된다. 따라서, 접근하기 어려운 에스트로겐 + 프로게스테론 - 감작 수용성 암컷 래트 (Melis et al., 2004)의 존재 하에서 비접촉 발기를 나타내는 수컷 쥐의 방실 핵으로부터 얻어진 투석액에서 글루탐산 및 아스파르트 산의 세포 외 농도가 증가 하였다 2004b), 중심 옥시토신 성 전달의 활성화에 의해 매개되는 음경 발기 (Melis et al., 1999a, b). 이러한 증가는 수용성 암컷과의 교접이 허용 될 때 더 높게 나타났다 (Melis et al., 2004a). 음경 발기 및 교합 중에 발기 성 아미노산의 증가 된 활동이 방실 핵에서 발생한다는 가정과 일치하여, 방실 핵 발의 NMDA 수용체의 차단에 의해 비접촉식 발기 및 양성 반응 (발치체 음경 발기시)이 감소된다 , 이러한 감소는 이러한 생리 학적 맥락에서 시상 하부 핵에서 발생하는 산화 질소 생산의 증가를 감소시킨다 (Melis et al., 2000). CB1 길항제 인 SR 1A에 의한 칸 나비 노이드 CB141761 수용체의 차단 후에도 옥시토신 성 세포체와 나란히있는 흥분성 아미노산 성 시냅스에 영향을 미치는 GABA 신경 내분 결에서 GABA 방출의 감소에 이은 세포 외 글루탐산 농도의 증가가 발견되었다. 옆쪽 뇌실로 또는 음경 발기를 유도하는 투여 량으로 방실 핵에 직접 투여된다 (Succu et al., 2006, Castelli et al., 2007 참조). 이러한 증가는 옥시토신 성 뉴런의 세포체에서 산화 질소 신타 아제의 활성화를 유도하여 산화 질소 생산을 증가시켰다. 산화 질소는 위에서 설명한대로 음경 발기를 중재하는 옥시토신 성 뉴런을 활성화시킵니다. SR 141761A 유도 된 음경 발기는 NMDA 수용체의 차단과 nitric oxide-synthase 억제제에 의해 감소되었지만 방실 핵의 도파민 또는 옥시토신 수용체의 차단에 의해 감소되는 반면, 옥시토신 수용체 길항제에 의한 중심 옥시토신 수용체
3.3. 복부 피 두드러기 부위에서의 옥시토신 - 도파민 상호 작용
옥시토신은 복부 피 두드러기 부위의 꼬리 부분에 용량 의존적으로 주사 할 때 음경 발기를 유도한다. (Melis et al., 2007). 일방적으로 주사 된 가장 낮은 활성 선량은 20 ng이었고, 시험 된 최고 선량은 100 ng였다. 옥시토신 효과는 옥시토신 수용체의 활성화에 의해 매개되는데, 이는 성 반응이 꼬리 복부 피 두드러기 영역에서 옥시토신 길항제 d (CH2) 5Tyr (Me) 2-Orn8- 바소 토신의 사전 주사에 의해 폐지되기 때문이다. 이들 수용체는 주로 도란 핵의 껍질에 투사되는 도파민 성 뉴런의 세포 기관에 국한되어있다. 따라서, (1) 이중 면역 형광 연구는 꼬리 복부 피질 영역에서 옥시토신 성 섬유가 도파민 성 신경 세포의 세포체와 밀접하게 접촉하며, 대다수는 티로신 - 히드 록 실라 제에 대하여 양성으로 표지되고 역행성 담 지체 인 플루오로 골드를 이전에 함유하고 있음을 보여준다 (Melis et al., 2007) 및 (2) 복부 피질 영역 옥시토신에 의해 유발 된 음경 발기는 외피에서 얻은 투석액에서 세포 외 도파민 농도의 증가와 함께 발생한다 (Melis et al., 2007). Oxytocin에 의한 penile 발기는 d (CH2) 5Tyr (Me) 2-Orn8-vasotocin뿐만 아니라 nitric oxide synthase inhibitor S-1에 의해 길항되는 두 반응 인 복부 tegmental 영역에서 nitric oxide 생성의 증가와 함께 발생한다. 또한 전압 의존성 Ca2 + channel blocker 인 _-conotoxin과 guanylate의 강력한 억제제 인 ODQ (1H- [1,2,4] oxadiazole [4,3-a] quinoxalin-1-one) cyclase는 옥시토신 (Succu et al., 2008) 전에 꼬리 쪽 복부 teoundal 영역에서 모두 주어진다. 옥시토신 성 섬유와 접촉 한 Fluorogold로 표지 된 도파민 성 세포체 중 많은 수가 꼬리 복부 피질 부분의 티로신 히드 록 실라 제에 양성인 것으로 나타 났으 나 산화 질소 합성 효소와 구아닐산 시클 라제 (Succu et al., 2008), 옥시토신 유도 된 음경 발기는 다음과 같은 메커니즘에 의해 매개 될 수있다. 펩타이드에 의한 도파민 성 세포체에서의 옥시토신 성 수용체의 활성화는 도파민 성 신경 세포의 세포체 내에서 Ca2 + 유입을 증가시킨다. 이것은 Ca2 + -calmodulin 의존 효소 인 nitric oxide-synthase를 활성화 시키므로 nitric oxide 생산을 증가시킨다. 산화 질소는 guanylate cyclase를 차례로 활성화시켜 cyclic GMP의 농도를 증가시킵니다. 사이 클릭 GMP는 도란 세포로 이동하는 도파민 성 뉴런을 활성화시킵니다. 꼬리 쪽 복부 tegmental 영역에 주입 옥시토신에 의해 유도 penile 직립에서 주기적 GMP의 역할도 8 - bromo - cyclic GMP, 순환 GMP의 활성 phosphodiesterase 저항 아날로그의 능력에 의해 penile 직립을 유도 유도 능력에 의해 지원됩니다 꼬리 복부 tegmental 영역, 그리고 투석기에서 세포 외 도파민을 증가시킬 수 있습니다 (Succu 외., 2008, Melis 외., 2009a). 이것은 nitric oxide가 방실 핵에서 oxytocinergic neuron을 활성화시키는 기전과 차이가있다. 8-bromo-cyclic GMP는이 핵 (Melis and Argiolas, 1995b)에 주입 될 때 penile 발기를 유도 할 수 없다. 2). 음경 발기로 이끄는 중추의 도파민에 의해 활성화 된 신경 경로에 대해서는 여전히 알려지지 않았습니다. 그러나, 이용 가능한 데이터는 이러한 경로가 시상 하부 방실 핵의 도파민 신경 전달을 활성화 시킨다는 것을 시사한다. 따라서, 옥시토신에 의해 유도 된 음경 발기는 세포 외 도파민의 증가뿐만 아니라 (paraventricular nucleus)에도 존재하며 도파민 수용체 길항제 인 할로 페리돌 (haloperidol)이 방실 핵 (paraventricular nucleus)에 주입 됨으로써 길항된다 (Melis et al., 2007). 에이함께이 결과는 방실 핵에서 시작하여 꼬리 복부 tegmental 영역으로 돌출하는 oxytocinergic 뉴런이 활성화되면이 영역에서 옥시토신이 방출되어 NO- 사이 클릭 GMP 신호 시스템을 활성화한다는 아이디어를 뒷받침합니다, 차례로 중배엽 도파민 성 뉴런을 활성화시킨다 (Melis et al., 2007, 2009a, Succu et al., 2008). 즉, 도파관에서 방출 된 도파민은 차례로 신경 경로를 활성화시켜 시상 하부의 도파민 성 신경 세포의 활성화를 유도하는데,이 신경 세포는 척수를 중개하는 음경 발기로 진행되는 방실 옥시토신 성 뉴런을 자극한다. 동시에, 방실 핵에 방출 된 도파민은 복부 피 두드러기 영역, 해마, 편도선 및 기타 뇌 영역과 같은 시상 하부 뇌 영역으로 돌출하는 옥시토신 성 뉴런을 활성화시킬 수 있습니다.
위에서 언급 한 것처럼,이 가설에 따라, 음경 발기를 유도하는 투여 량에서 방실 핵에 주입 된 아포 모르핀은 옥시토신 수용체 길항제 d (CH2) 5Tyr (Me)에 의해 감소 된 효과 인 측방 핵에서 세포 외 도파민 농도를 증가시킨다 ) 2-Orn8-vasotocin은 복부 tegmental 영역으로 주입되었다 (Succu et al., 2007, Melis et al., 2009a). 함께 위의 신경 경로는 도파민, 옥시토신 및 기타 신경 전달 물질 (예 : 글루탐산, 아래 참조)을 포함하는 가설적인 신경 회로망을 구성 할 수 있으며 성행위뿐 아니라 성적 동기 부여 및 성적인 보상에 영향을 미칩니다 (섹션 4 참조).
3.4. 해마 복부의 옥시토신 - 글루탐산 상호 작용
옥시토신은 복부에 주사 될 때 음경 발기를 유도하지만, 용량 의존 방식으로 등 지느러미에 주입하지 않는다 (Melis et al., 2009b). 성 반응은 옥시토신 수용체의 자극에 의해 매개되며, 다른 뇌 영역에서 발견되는 옥시토신의 동일한 부위에 주어진 d (CH2) 5Tyr (Me) 2-Orn8- 바소 토신의 이전 주사에 의해 폐지된다 (상기 참조) . 이 수용체들의 국소화에 관해서, 이용 가능한 데이터는 그들이 산화 질소 합성 효소가 풍부한 뉴런의 세포 기관에 국한되어 있음을 시사한다.
따라서, 미세 투석 연구는 옥시토신에 의해 유도 된 음경 발기가 복강 내 산화 질소 생산의 증가와 동시에 발생하고,이 증가는 nitric oxide synthase 억제제 S-methyl-thio-l-citrulline의 이전 주사에 의해서뿐만 아니라 폐지된다는 것을 보여준다 nitric oxide scavenger 헤모글로빈뿐만 아니라 d (CH2) 5Tyr (Me) 2-Orn8-vasotocin (모두 음경 발기를 길항하는 복용량으로 oxytocin의 동일한 부위에 주어진)에 의해 조절된다 (Melis et al., 2010). 보다 중요한 것은 옥시토신에 의해 유발 된 음경 발기가 복강 내 외 세포 글루탐산의 농도 증가와 동시에 발생하며, 이는 비경쟁 NMDA 수용체 길항제 (+) MK-801에 의해 부분 적으로 길항된다. 복부 subiculum (Melis 외., 2010). 함께, 이러한 결과는 새로 형성된 산화 질소가 세포 간 전달자 역할을하여 글루탐산 신경 전달을 활성화시켜 음경 발기를 유도 할 수 있으며, 아마도 복부로부터의 신경 원심성 투상을 통해 가능하다 subiculum에서 extra-hippocampal brain 영역으로 이동한다. 이 가설에 따라, 복강 내로 주사 된 NMDA는 용량 의존적 방식으로 음경 발기를 유도하고,이 효과는 (+) MK-801의 동일한 부위로의 이전 주사에 의해 완전히 길항되지만 S- 메틸 - 티오 -1- 시트룰린에 의한 것은 아니다 , 헤모글로빈 또는 d (CH2) 5Tyr (Me) 2-Orn8- 바소 토신 (Melis et al., 2010). 복강 내에서 흥분성 아미노산 (즉, 글루탐산)에 의해 활성화 된 extra-hippocampal brain 영역으로 돌출하는 신경 원심성 경로에 관해서는, 해마 원심성 투영의 대부분이 glutamatergic 일 가능성이있다. 현재로서는 이러한 돌기가 중배엽 도파민 성 신경 세포의 활동을 조절하고, 방실 핵내의 시상 하부의 도파민 성 신경 세포의 활동을 조절하여 옥시토신 성 신경 세포의 활성화를 유도한다고 제안 할 수있다 이미 논의 된대로 음경 발기 중재 (위 참조).
따라서 복부 산부인과 옥시토신에 의해 유도 된 음경 발기는 측벽 핵의 껍질에있는 세포 외 도파민의 농도 증가와 함께 발생하며 음경 발기와 마찬가지로이 증가는 d (CH2) 5Tyr (Me) 2- Orn8-vasotocin은 옥시토신 (Melis et al., 2009b) 전에 복부 subiculum에 주어진다. 또한, 복부 subiculum 옥시토신 유도 음경 발기는 감소되기 때문에, (+) MK-801가 아니라 핵 중격 의지로 (멜리 외., 2009b), 복측 피개 영역에 주입 및 세포 외의 증가에 수반하여 발생 옥시토신 (2 참조) 이전에 복부 subiculum에 주입 된 d (CH5) 8Tyr (Me) -Orn3-vasotocin에 의해 폐지 된 두 반응이다. mesolimbic dopaminergic 뉴런의 활성화는 복부 tegmental 영역에서 증가 glutamatergic 신경 전달에 보조 가능성이 높습니다. 이는 음경 발기를 조절하는 글루탐산과 도파민의 상호 작용이 복부 피 두드러기 영역에 존재 함을 시사한다. subchulum에서 ventral tegmental 영역으로의 발기 성 원심성 글루타메라 성 경로가 직접 또는 간접적인지, 즉 전두엽 피질 또는 다른 뇌 영역 (Melis et al., 2009b 및 그 안의 참고 문헌 참조)을 통해 진행되는지 여부를 확인하기 위해서는 더 많은 연구가 필요하다. 방실 핵은 또한 해마로부터 글루타메타 진 투영을 받기 때문에 (위와 Saphier and Feldman, 1987 참조), 및 글루탐산은 복부 피 두드러기 영역으로 돌출하는 것을 포함하여 방실 옥시 트립신 뉴런을 활성화시킨다 (Argiolas and Melis, 2005 및 그 참고 문헌 참조). 복부 tegmental 지역 옥시토신은 음경 발기를 유도하고 mesolimbic dopaminergic 뉴런의 활동을 증가시킵니다(위 참조), 그것은 p를 추측하는 유혹을 불러 일으킨다.araventricular oxytocinergic neurons는 적어도 부분적으로는 중배엽 도파민 성 신경 세포의 활성화에 관여한다. 옥시토신은 복강 내로 주입된다 (섹션 4 참조).
4. 끝 맺는 말
위에서 검토 한 연구는 수컷 쥐에서 옥시토신이 시상 하부와 척수의 방실 핵의 수준에서 음경 발기의 중앙 통제에 중요한 역할을한다는 것을 보여주는 초기 발견을 확증하고 연장한다. 특히, 가장 재실행 된옥시토신은 다른 두뇌 영역, 즉 복부 tegmental 영역, 복부 subiculum 및 편도의 posteromedial 피질 핵 행동에 의해 음경 발기에 영향을 미치는 것을 보여줍니다.
방실 대 레벨에서 가장 중요한 새로운 발견은 아마도 방실 핵의 옥시토신 성 뉴런의 세포 기관에서 (그리고 supraoptic nucleus에서 D2 계열 (D2, D3 및 D4)의 모든 도파민 수용체의 발현의 발견 일 것입니다. medial preoptic area) (Baskerville and Douglas, 2008, Baskerville et al., 2009). 이것은 강력한 신경 해부학 적 구조를 제공합니다. 도파민과 도파민 수용체 작용제가 발기 기능에 관여하는 직접 옥시토신 성 뉴런을 활성화시켜 척수뿐만 아니라 시상 하부 뇌 영역까지 돌출시킬 수 있다는 가설을 뒷받침한다. 이와 관련하여, 도파민 수용체 작용제에 의해 유도 된 도내 압력의 증가가 요추 천추 척수에서의 옥시토신 성 수용체의 차단 (Baskerville et al., 2009)에 의해 감소된다는 발견도 중요하다. 실제로, 마취 된 수컷 쥐에서 그러한 증거가 얻어졌지만, 도파민 수용체 작용제에 의해 유도 된 음경 발기와 관련된 양성 척추 - 옥시토신 성 강하 경로의 활성화가 확인되었다. H그러나 옥시토신 성 세포체에 존재하는 도파민 수용체의 자극에 의해 유발되는 음경 발기가 D2 계열 (D2, D3 또는 D4)의 특정 도파민 수용체 아형의 활성화에 이차적 인 것인지 아직 확인되지 않았다. 또는 이들 수용체 아형이 음경 발기가 일어나는 상황에 따라 아마도 발기 반응을 조절하는 데있어 서로 협력한다면 (Moreland et al., 2004; Enguehard-Gueiffier et al., 2006; Melis et al. 2006a, b, Löber et al., 2009, Collins et al., 2009, Depoortre et al., 2009, Baskerville et al., 2009).
또 다른 중요한 새로운 발견은 옥시토신이 방실 핵이나 해마의 CA1 필드뿐만 아니라 복부 tegmental 지역, 복부 subiculum 및 편도의 posteromedial 대뇌 피질 핵에 주입되었을 때 음경 발기를 유도한다는 것입니다. 이 뇌 영역은 초기 연구에서 옥시토신이 남성 쥐에서 자발적 음경 발기를 증가 시켰음을 보여 주었지만, 방실 핵으로부터의 요추 천추와 같은 옥시토신 성 돌연변이와 유사하게 나타났다. Oxytocin은 성숙한 수컷 쥐에서 접근이 가능하거나 접근하기 어려운 수용성 (에스트로겐 - 프로게스테론 뇌척수막) 난소 암컷 쥐의 출현과 같은 성적 자극이없는 성인 남성 쥐에서 발생하는 자발적인 penile erection episodes를 실제로 증가시킬 수있는 것으로 밝혀졌습니다. 해면의 방실 핵, CA1 장에 주입되었을 때 생식기의 조작은 가능 하나 배측의 subiculum, lateral septum, caudate nucleus, medial preoptic area, ventromedial nucleus 및 supraoptic nucleus에서는 그렇지 않다 (Melis et al. , 1986). 이 모든 연구에서 음경 발기는 대개 음경이 실험 중에 직접 주어진 치료법을 알지 못하는 관찰자에 의해 음경 시스에서 나왔을 때 또는 비디오 카메라 장치로 비디오 테이프에 기록 된 실험을 관찰하여 계산되었습니다. 각 음경 발기 에피소드는 0.5-1 분 동안 지속되며 대개 음경 손질 및 / 또는 엉덩이 굴곡을 동반합니다. 성 경험, 나이의 영향을 확인하거나 다른 뇌 영역으로 주입 된 옥시토신의 발기 부전 효과에 대해이 쥐를 낮거나 높은 반응 자로 나눌 수 있는지 여부를 확인하기 위해 이러한 실험에서 일반적으로 실험을 수행하지 않습니다. 이것은 또한 도파민 작용제, 흥분성 아미노산, ACTH-MSH, 헥사 레린 및 VGF 펩타이드를 포함하여 자발적인 음경 발기 에피소드를 증가시키는 다른 신경 펩티드 및 약물의 발기 부전 효과에 관한 대부분의 연구에 적용된다. 그러나 이러한 화합물의 발기 부전 효과는 자발적으로 또는 이러한 경로로 이들 화합물을 전신적으로, 뇌 실내로 또는 투여 한 후에 일어나는 해면 기압의 증가에 의한 음경 발기의 발생을 결정하는 원격 측정법에 의해 반복적으로 확인되었다 (cavernous corpora)에 직접적으로 압력 미세 변환기를 이식 한 후 특정 뇌 핵으로 직접 전달할 수 있습니다 (Bernabé et al., 1999 참조). 복부 tegmental 지역에서 복부 subiculum과 편도의 posteromedial 핵 또한 옥시토신은 oxytocinergic 수용체에 작용하여 음경 발기를 유도합니다. 이것은 복부 피 두드러기 영역에서 시작하여 중추의 껍질로 돌출하는 중배엽 도파민 성 뉴런의 활성화로 이어진다. 말단에있는 도파민 수용체의 차단 후에 발견되는 이들 extra-hypothalamic 영역으로 주입 된 펩타이드에 의해 유도 된 발기 반응의 감소에 의해 측정되었다. (아래 참조). 이러한 뇌 부위에서 옥시토신 성 수용체의 자극에 의해 활성화되는 기전에 관해서는, 중배엽 도파민 성 신경 세포의 활성화 및 음경 발기에 이르는 가장 명확한 것은 꼬리 복부 피 분비 영역에서 일어나는 것들이다. 사실, 여기 약리학 적 및 면역 형광 결과는 옥시토신 신경 말단이 중격 핵의 껍질로 돌출하는 도파민 성 신경 세포의 세포체에 충돌한다는 것을 보여준다 (Melis 등, 2007, 2009a, Succu 등, 2008). 이러한 뉴런의 대부분은 nitric oxide synthase와 guanylate cyclase가 풍부합니다. 이들 도파민 성 뉴런의 세포체에서 옥시토신 성 수용체의 자극은 산화 질소 합성 효소의 활성화를 유발하여 산화 질소 생산을 증가시킨다. 일산화 질소는 guanylate cyclase를 활성화시켜 사이 클릭 GMP의 농도를 증가 시키며, (인트라 - 뇌 미세 투석하여 수득 중격 의지 핵에서 투석액의 세포 외 도파민의 증가에 의해 측정 된이 변연계 도파민 성 신경 세포의 활성화 및 핵 중격 의지 도파민의 방출에 이르게 Succu 외., 2008을 ). 교대 핵에서 방출 된 도파민은 음경 발기로 이끄는 신경 경로를 활성화시킵니다. 이것은 도파민 수용체 길항제 haloperidol 및 / 또는 cis-flupentixol이 복부 tegmental 부위 옥시토신에 의해 유발 된 음경 발기를 줄이기 위해 측벽 핵으로 주입되는 능력에 의해 뒷받침된다 (Succu et al., 2008). 발기 불능 경로 중 하나는 시냅스 - 시상 하부의 도파민 성 뉴런을 활성화시키는 것으로 보이며, 특히 방실 상 옥시토신 성 뉴런의 세포 기관에 투사하는 것이다. 실제로 꼬리 복부 tegmental 영역에 주입 옥시토신은뿐만 아니라, 방실 핵뿐만 아니라 paraventricular 핵에 세포 외 도파민을 증가하고, 방실 핵의 도파민 수용체의 차단은 크게 ventral tegmental 영역 옥시토신 유발 음경 발기 감소 (Succu 외. , 2007, 2008, Melis et al., 2007, 2009a). 이들 중추 신경계의 존재는 도파민 - 뇌실 주위의 도파민 - 뇌실 주위의 옥시토신 - 복부 피질 영역 옥시토신 - 도파민 링크 (PD4)을 방실 핵의 껍질에서 세포 외 도파민을 증가시키기 위해 방실 핵에 주사 한 D168077 수용체 작용제 PDNNX의 능력에 의해 제안된다 (Succu 등, 2007). 이는 복부 tegmental 영역에 주어진 d (CH2) 5Tyr (Me) -Orn8-vasotocin에 의해 폐지된다 (Melis et al., 2009a, 아래 참조). 그러나, 측벽 핵을 암세포 - 시상 하부의 도파민 계통에 연결시키는 신경 경로를 확인하기 위해서는 추가 연구가 필요하다.
옥시토신이 음경 발기를 유도하고 복부 subiculum이나 편도의 posteromedial 핵으로 주입되었을 때 mesolimbic dopaminergic 뉴런을 활성화하는 메커니즘은 부분적으로 만 이해됩니다. 이러한 영역에서도 옥시토신은 산화 질소 생성을 증가시키는 산화 질소 합성 효소의 활성화를 유도하는 자체 수용체를 활성화시킵니다. 산화 질소는 차례로 미지의 원위 돌기를 활성화시켜 복부 피 두드러기 영역에서 글루탐산 동성 신경 전달을 증가시킵니다. 글루탐산은 음경 발기로 이끄는 중배엽 도파민 성 뉴런을 자극한다. 이 가설은 복부 피 두 영역에 extra-cellular glutamic acid를 증가시키기 위해 복부 subiculum에 주입 된 oxytocin의 능력에 의해 주로지지된다 (Fig. 3) 및 복강 내 피질골 부위에 주입 된 비경쟁 NMDA 수용체 길항제 (+) MK-801의 작용기를 포함하고, 복강 내 또는 후 내핵으로 주입 된 옥시토신에 의해 유발 된 음경 발기를 감소시키는 것으로 나타났다 (Melis et al., 2009b). 현재, 복부 subculum 옥시토신 - 유발 음경 발기에 대한 자세한 내용이 있습니다. 여기서 옥시토신에 의해 유도 된 음경 발기는 산화 질소 신타 스 함유 뉴런의 세포 기관에 위치한 옥시토신 성 수용체의 활성화에 이차적 인 것으로 보인다. 이것은 산화 질소 생산의 증가를 일으키는데, 이는 장기간의 증강을 위해 기술 된 것과 유사한 메커니즘을 가진 세포 간 전달자로서 작용하여 글루탐산 동성 신경 전달을 활성화시킨다 (Snyder, 1992, Southam and Garthwaite, 1993, Schuman and Madison, 2004 참조) . 이 가설과 일치하여 옥시토신에 의해 유도 된 음경 발기는 복강 내 투석막에서 세포 외 글루탐산의 증가와 함께 발생하고 NMDA에 의한 복강 내 흥분성 아미노산 수용체의 자극은 음경 발기를 유도한다. 글루탐산은 신경 원심성 투상을 활성화시켜 복부 피 두드러기 영역에서 중배엽 도파민 성 신경 세포의 활성화를 유도한다. 이러한 메커니즘이 작용하는 경우 편도체의 후 내핵에서도 현재 알 수 없다. 또한, 복부 subiculum 및 편도의 posteromedial 핵 (1) oxytocinergic 신경 종말과 수용체가 결국 이러한 뉴런이 (2) 산화 질소 합성 효소를 포함하는 뉴런의 세포 기관에 국한 있다는 것을 증명하기 위해 필요합니다 흥분성 아미노산 (glutamatergic) 시냅스 및 (3) 제어하에 산화 질소에 의해 활성화 된 신호 체계를 확인합니다. 이와 관련하여 옥시토신이 꼬리 복부 tegmental 영역의 dopaminergic 뉴런의 세포체와 복부 subiculum과 편도의 posteromedial 핵에서 아직 알 수없는 뉴런의 세포 기관에서 nitric oxide - synthase 활동을 증가시키는 능력이 회고록은 주목할 만하다 (Musis et al., 1997)에서 옥시토신 성 뉴런의 세포 기관에서 산화 질소 합성 효소를 활성화시키는 옥시토신의 능력. 그러나 복부 tegmental 영역에서 dopaminergic 뉴런의 세포 기관에서 산화 질소의 증가 생산은 guanylate cyclase를 활성화하고 cyclic GMP를 증가시킴으로써 이러한 뉴런의 활성화를 유도하지만 이것은 방실 핵에서는 일어나지 않습니다. 따라서, 방실 핵에 주입 된 8- 브로 모 - 고리 형 GMP는 음경 발기를 유도하지 않고, 복부 피 두드러기 영역에 주사 할 때 발기를 유도한다. 질산화 산화 GMP 시스템과 다른 또 다른 신호 전달 경로는 내인성 및 / 또는 외인성 산화 질소 (Melis and Argiolas, 1995b, Melis et al., 1997)에 의한 음경 발기를 매개하는 옥시토신 성 뉴런의 활성화에있어 방실 수준에서 관련된다 (Fig. . 1). 반면에 복부 tegmental 영역의 cyclic GMP는 mesolimbic dopaminergic neuron의 활성화와 수컷 쥐의 측벽 핵으로부터 얻은 투석액에서 일어나는 세포 외 도파민의 증가에 중요한 역할을하는 것으로 보인다 접근하기 어려운 난소 절제 된 수용성 (에스트로겐 + 프로게스테론 처리) 암컷 쥐의 존재하에 놓을 때 비접촉식 음경 발기를 보이거나 보이지 않기 위해 선택됨. 이러한 실험 조건에서, 비접촉 성 음경 발기를 나타내는 수컷 쥐에서, 세포 외 도파민 농도의 증가가 예상대로 발견되며, 꼬리 복부 피 두드러기 부위에 포스 포다 에스테라아제 억제제에 의해 겸손하게 증가 될 뿐이다 (Sanna et. al., 2009).
복부 tegmental 영역, 복부 subiculum과 편도의 posteromedial 대뇌 피질의 핵에 주입 능력은 음탕 한 발기를 유도하고 mesolimbic dopaminergic 뉴런을 활성화하기 위해, 방실 핵에 주입 된 도파민 작용제와 함께 몇 가지 의견을받을 가치가있다 . 첫째, 음경 발기가 생리 상황 (예 : 음경 발기가 발생할 때)이나 비접촉 음경 발기시와 같은 음경 발기가 일어날 때 상기 한 것과 유사한 기전이 작용할 수 있습니다. 이러한 발기는 성기능이 강한 수컷 쥐를 접근하기 어려운 수용성 (난소 절제술을받은 에스트로겐 + 프로게스테론 뇌척수막) 암컷 쥐의 존재에 넣을 때 발생하는 약물 또는 옥시토신에 의해 유도 된 것과는 구분할 수없는 페로몬 매개 성 음경 발기이며 성행위의 지표로 간주됩니다 각성 (Sachs, 1997, 2007). 사실, 이러한 결과는이 분야의 옥시토신이 생리 학적 상황에서 또는 약물 투여 후에 발생하는 음경 발기에 역할을한다는 것을 입증하지는 못하지만, 초기 뇌파 영역은 옥시토신이 집중적으로 증가하는 역할을하는 것으로 밝혀졌다. 발기 부전 치료제 후에 나타난 자발적인 음경 발기 에피소드뿐 아니라 남성 (및 여성)의 성행위를 개선하기위한 것입니다 (Argiolas and Melis, 2004 및 그 안의 참고서 참조). 따라서 옥시토신 농도를 억제하는 고전적인 도파민 작용제 (Melis et al., 1990) 및 d (CH2) 5Tyr (Me) -Orn8-vasotocin의 발기 전 선량으로 치료 한 수컷 쥐의 해마에서 옥시토신 농도가 증가한다 수용체뿐만 아니라 copulatory 동작을 저해에 (Argiolas 외., 1987a) 매우 효과적이지만 또한 남성 copulatory 거동 아포 모르핀의 facilitatory 효과 (Argiolas 외., 1987b) 성적 강력한 수컷 래트에서, 접합부의 음경 발기되는 동안에 나오다. vasotocin은 성적으로 유력한 수컷 쥐의 비접촉 발기를 줄이는 데에도 매우 효과적이지만 측뇌실에 나노 그램의 양으로 주어 지지만 PVN (Melis et al., 2a)에는 투여되지 않습니다.
둘째, 변연계 도파민 뉴런은 식품, 물, 성행위 천연 보강 자극의 동기 및 보상 특성에 중요한 역할 플레이 (; 와이즈 Rompre, 1988; Fibiger 및 필립스 1989을 Everitt, 1990). 특히, 이러한 뉴런에서 방출 된 도파민은 자연스러운 자극의 동기 부여 측면을 목표 지향 행동으로 바꾸는 것을 중재하는 것으로 생각됩니다. 예를 들어 성행위의 경우 성 파트너와 성교를 찾고 보상과 만족을 얻습니다. (Goto and Grace, 2005). 따라서, 액세스 할 수없는 난소 에스트로겐 + 프로게스테론 - 뇌관을 수용 여성 쥐, 이러한 증가에 노출시 성적으로 강력한 수컷 쥐의 핵 중격 의지에서 투석액의 세포 외 도파민 농도 증가는 수컷 쥐가 받아들이는 여성과 교접 할 수 때 더 높은했다 (Pfaus and Everitt, 1995).
셋째, 현재의 결과는 신경 회로가 방실 핵을 복부 tegmental 영역과 직접 또는 간접적으로 (복부 subiculum 및 / 또는 편도의 posteromedial 피질 핵을 통해) 및 측벽 핵과 연결하고, 여기에서 알려지지 않은 것을 통해 가설 핵을 연결한다는 가설을 뒷받침한다 경로는 다시 방실 핵으로 돌아가서 척수 중개자의 발기와 옥시토신 성 뉴런의 복부 tegmental 영역, 복부 subiculum 및 편도의 posteromedial 대뇌 피질 핵에 돌출되는 것으로 예측 옥시토신 성 뉴런의 활동을 제어하는 방법으로 변조 mesolimbic dopaminergic 뉴런의 활동 (그림 4). 이 복잡한 신경 회로는 생리 컨텍스트에서 남성의 성적 행동의 완성 (발기 성 - 사정) 및 예상 (동기 부여 및 보람) 측면의 제어와 관련된 신경 활동의 통합에 역할을 할 수 있습니다. 실제로 액세스 할 수없는 받아들이는 여성 쥐에 노출시 세포 외 도파민 핵 중격 의지 (Pfaus 및 Everitt, 1995)의 증가 및 성적 강력한 수컷 쥐의 뇌실 핵으로는 비접촉식 발기가 발생했을 때, 더욱 교미가 허용 될 때, 예를 들어, 음경 발기가 발생할 때 (Melis et al., 2003). 따라서, 비 접촉 직립과 성 행동 동안 복부 피 두드러기 영역, 복부 subiculum 및 편도선에서 내인성 옥시토신의 역할을 명확히하기 위해 더 많은 연구가 필요하지만,이 가상의 신경 회로는 성적 행동의 완결적인 측면은 동시에 성 활동의 보람있는 성질을 설명하기위한 신경 기질을 제공하는 중뇌 변형 쇠약 성 도파민 계통을 활성화시킬 수있다 (Everitt, 1990, Pfaus and Everitt, 1995). 이와 관련하여 옥시토신에 의해 활성화 된 중배엽 도파민 계가 복부 피 두 영역으로 주입되는 것은 아편 제, 칸 나비 노이드, 암페타민, 코카인 및 알코올 (Tanda 등, 1997)과 같은 학대 약물에 의해 활성화되는 것과 동일하다 옥시토신은 코카인, 모르핀, 알콜 및 칸 나비 노이드에 대한 내성과 의존성을 감소시킬 수있는 것으로 밝혀졌다 (Kovacs et al., 1998, Cui et al., 2001). 결론적으로 옥시토신은 복부 tegmental 영역뿐만 아니라 복부 subiculum 및 편도의 posteromedial 대뇌 피질 핵 릴리스 성욕의 유익하고 보람있는 효과에 관여 수 있습니다 mesolimbic dopaminergic 뉴런을 활성화 할 수 있습니다 . mesolimbic dopaminergic neurons의 활성화는 mesolimbic dopaminergic neurons의 세포 기관에서 oxytocinergic 수용체를 통해 직접적으로, 또는 복부 tegmental 영역에서 glutamic acid neurotransmission의 활성화를 통해 간접적 일 수 있습니다.
도파민 껍질 핵에서 방출 된 도파민은 방아쇠에서 시상 하부 핵에있는 시상 - 시상 하부의 도파민 성 뉴런의 활동을 차례로 조절하여 음경 발기 (척수로 투사되는 옥시토신 성 신경 세포의 활성화를 통해) 또는 성적 동기 부여 및 보상 (옥시토신 성 복부 tegmental 영역, 복부 subiculum 또는 편도의 posteromedial 피질 핵에 투영 뉴런). 도파민은 생리 학적 맥락에서 음경 발기가 발생할 때 (예 : 비접촉 발기 및 교접) (Succu et al., 2007, Melis et al., 2003, 2007) 도파민이 측벽 핵과 방실 핵에서도 방출되기 때문에 중간 옥시토신 성 뉴론이 중뇌 변성과 시상 하부 - 도파민 성 시스템 사이의 상호 작용을 중재하는 신경 회로에 참여할 가능성이있다. 이러한 신경 회로는 성적 행동 (예 : 음경 발기 및 교합)의 완결 단계뿐만 아니라 성적 동기 부여, 성적 각성 및 성적 보상에도 역할을 수행 할 수 있습니다.
이 장과 이전 보고서의 결과에 의해 제안 된 바와 같이, 성적 동기 부여, 보람과 성적 수행에 영향을 미치는 옥시토신을 포함하는 가상의 신경 회로의 도식적 표현. 예를 들어 도파민과 글루탐산 (다른 신경 전달 물질 및 / 또는 신경 펩타이드)에 의해 활성화 될 때 방실 핵에서 유래하여 척수로 돌출하는 옥시토신 성 뉴런은 척수로 돌출하는 옥시토신 성 뉴런을 활성화시킴으로써 음경 발기 및 성적 수행을 촉진한다. 방실 핵에있는 도파민과 글루타민산 (뿐만 아니라 신경 전달 물질과 신경 펩타이드)은 복부 피 두드러기 영역으로 돌출하는 옥시토신 성 뉴런을 활성화시켜 중추 정강이 도파민 성 뉴런을 활성화시켜 중추 신경계로 돌출시켜 성욕과 보상을 조절합니다. (NAs)에서 방출 된 도파민은 아직 알려지지 않은 신경 경로를 활성화 시켜서, 시냅스 - 시상 하부의 도파민 성 뉴런 (Dahlstrom 및 Fuxe의 A13-A14 그룹에서 유래)의 활성을 증가 시키는데, 이들은 옥시토신 성 뉴런에 영향을 미친다. 음경 발기로 이어지는 척수. 이 회로는 또한 꼬리 복부 tegmental 영역뿐만 아니라 복부 subiculum 및 복부에 직접 또는 간접 glutamatergic 원심 분리기를 통해 paraventricular 핵에서 oxytocinergic innervation을받을 편도선에 주입 옥시토신에 의해 활성화 될 수 있습니다 tegmental 영역, 성적 동기 부여와 음경 발기 모두의 변조로 이어집니다. 마지막으로, 페로몬이 매개하는 비접촉 발기 및 교합 중에 방실 핵과 도관 내 신경 세포에서 세포 외 도파민과 글루탐산이 증가하기 때문에 위의 회로는 성적인 자극과 페로몬에 의해 활성화 될 수있다. 참조 목록).
Acknowledgements이 연구는 부분적으로 대학의 이탈리아 교육부와 AA와 MRM에 대한 연구로부터의 지원에 의해 지원되었다.
참고자료
Andersson, KE, 2001. 음경 발기의 약리학. Pharmacol. 목사 53, 417 - 450. Argiolas, A., 1994. 산화 질소는 음경 발기의 중재자입니다. 신경 약리학 33, 1339-1344. Argiolas, A., 1999. 신경 펩타이드와 성행위. 신경 과학. Biobehav. 목사 23, 1127 - 1142. Argiolas, A., Gessa, GL, 1991. 옥시토신의 중심 기능. 신경 과학. Biobehav. 목사 15, 217 - 231. Argiolas, A., Melis, MR, 1995. 음경 발기의 신경 변조 : 신경 전달 물질과 신경 펩타이드의 역할 개요. 음식물. Neurobiol. 47, 235 - 255. Argiolas, A., Melis, MR, 2004. 남성 포유 동물의 성행위에서 옥시토신과 방실 핵의 역할. Physiol. 행동. 83, 309 - 317. Argiolas, A., Melis, MR, 2005. 음경 발기의 중앙 통제 : 시상 하부의 방실 핵의 역할. 음식물. Neurobiol. 76, 1 - 21. Argiolas, A., Collu, M., Gessa, GL, Melis, MR, Serra, G., 1988. 옥시토신 길항제 d (CH2) 5Tyr (Me) -Orn8- 바소토신은 랫트에서 남성 양성 반응을 길항시킨다. E. J. Pharmacol. 149, 389 - 392. Argiolas, A., Collu, M., D' Aquila, P., Gessa, GL, Melis, MR, Serra, G., 1989. 쥐의 옥시토신 길항제 d (CH2) 5Tyr (Me) -Orn8-vasotocin에 의해 남성의 copulatory 행동의 아포 모르핀 자극이 예방됩니다. Pharmacol. BIOCHEM. 행동. 33, 81 - 83. Argiolas, A., Melis, MR, Gessa, GL, 1985. 심실 내 옥시토신은 쥐의 하품과 음경 발기를 유도합니다. E. J. Pharmacol. 117, 395 - 396. Argiolas, A., Melis, MR, Gessa, GL, 1986. 옥시토신 (Oxytocin) : 수컷 쥐의 음경 발기 및 하품의 매우 강력한 유도제. E. J. Pharmacol. 130, 265 - 272. Argiolas, A., Melis, MR, Mauri, A., Gessa, GL, 1987a. 방실 핵 병변은 아포 모르핀과 옥시토신에 의한 하품과 음경 발기를 방지하지만 쥐의 ACTH에 의한 것은 아닙니다. Brain Res. 421, 349 - 352. Argiolas, A., Melis, MR, Vargiu, L., Mauri, A., Gessa, GL, 1987b. 강력한 옥시토신 길항제 인 바소 토신은 ACTH 2-5가 아니라 옥시토신과 아포 모르핀에 의해 유발 된 음경 발기와 하품을 길항합니다. E. J. Pharmacol. 134, 221 - 224. Argiolas, A., Melis, MR, Stancampiano, R., Gessa, GL, 1990. _ Conotoxin은 남성 쥐에서 아포 모르핀과 옥시토신에 의해 유발 된 음경 발기 및 하품을 예방합니다. Pharmacol. BIOCHEM. 행동. 37, 253 - 257. Arletti, R., Bertolini, A., 1985. 옥시토신은 암컷 쥐의 전 안부 운동을 자극합니다. 신경 펩티드 6, 247-255. Arletti, R., Bazzani, C., Castelli, M., Bertolini, A., 1985. Oxytocin은 랫드에서 남성의 copulatory performance를 향상시킵니다. 호르몬. 행동. 19, 14 - 20. Arletti, R., Benelli, A., Bertolini, A., 1990. 노화 된 수컷 쥐의 성 행동은 옥시토신에 의해 자극됩니다. E. J. Pharmacol. 179, 377 - 382. Arletti, R., Calzà, L., Giardino, L., Benelli, A., Cavazzutti, E., Bertolini, A., 1997. 성기능 발기 부전은 옥시토신 생성 감소와 시상 하부 방실 핵의 오피오이드 펩타이드 생성 증가와 관련이있다. 신경 과학. 레트 사람. 233, 65 - 68. Bancila, M., Giuliano, F., Rampin, O., Mailly, P., Brisorgueil, MJ, Clas, A., Verge, D., 2002. 시상 하부의 방실 핵에서 핵의 paragigantocellularis의 추정 세로토닌 성 뉴런으로의 직접 투영에 대한 증거는 쥐의 발기 조절에 관여합니다. E. J. 신경 과학. 16, 1240 - 1249. Burnett, AL, Lowenstein, CJ, Bredt, DS, 장, TSK, 스나이더, SH, 1992. 산화 질소 (Nitric oxide) : 음경 발기의 생리적 매개체. 과학 257, 401-403. Baskerville, TA, 더글러스, 에이, 2008. 성행위의 조절에서 도파민과 옥시토신 사이의 상호 작용. 음식물. Brain Res. 170, 277 - 289. Baskerville, TA, Allard, J., Wayman, C., Douglas, AJ, 2009. 음경 발기에서 도파민 - 옥시토신 상호 작용. E. J. 신경 과학. 30, 2151 - 2164. Benelli, A., Bertolini, A., Poggioli, R., Cavazzutti, E., Calzà, L., Giardino, L., Arletti, R., 1995. 산화 질소는 쥐의 남성 성 행동에 관여합니다. E. J. Pharmacol. 294, 505 - 510. Bernabè, J., Rampin, O., Sachs, BD, Giuliano, F., 1999. 랫트의 발기시의 인체 내 해마압 : 원격 측정법에 근거한 통합 접근법. 오전. J. Physiol. 276, R441-R449. Bitner, RS, Nikkel, AL, Otte, S., Martino, B., Barlow, EH, Bhatia, P., Stewart, AO, Brioni, JD, Decker, MW, Moreland, RB, 2006. 쥐 방실 hypothalamic 핵에있는 도파민 D4 수용체 신호 : 즉각적인 초기 유전자 유도 및 mitogen 활성화 단백질 키니 아제 인산화를 포함하는 자연 커플 링의 증거. 신경 약리학 50, 521-531. Brioni, JD, Moreland, RB, Cowart, M., Hsieh, GC, Stewart, AO, Hedlund, P., Donnelly-Roberts, DL, Nakane, M., Lynch 3rd., J., Kolasa, T., Polakowski , JS, Osinski, MA, Marsh, K., Andersson, KE, Sullivan, JP, 2004. ABT-4에 의한 도파민 D724 수용체의 활성화는 쥐의 음경 발기를 유도합니다. PROC. Natl. Acad. 과학. 미국 101, 6758 - 6763. Buijs, RM, 1978. 래트의 시상 하부의 바소프레신과 옥시토신 경로 세포 조직 Res. 192, 423 - 435. Buijs, RM, Geffard, M., Pool, CW, Hoorneman, EMD, 1984. supraoptic 및 paraventricular 핵의 dopaminergic innervation. 가벼운 전자 현미경 연구. Brain Res. 323, 65 - 72. Caldwell, JD, Prange, AJ, Pedersen, CA, 1986. 옥시토신은 에스트로겐 처리 된 암컷 쥐의 성적 수용성을 촉진합니다. 신경 펩티드 7, 175-189. 카메론, JL, Pomerantz, SM, Layden, LM, Amico, JA, 1992. 아포 몰핀과 D2 수용체 작용제에 의한 남성과 여성 원숭이의 혈장에서의 옥시토신 농도의 도파민 자극. J. Clin. Endocrinol. Metab. 75, 855 - 860. Canteras, NS, Simerly, RB, Swanson, LW, 1995. 편도의 내핵에서 투사 조직 : 쥐의 PHAL 연구. J. 비교 Neurol. 360, 213 - 245. Carmichael, MS, Humbert, R., Dixen, J., Palmisano, G., Greeleaf, W., Davidson, JM, 1987. 혈장 옥시토신은 인간의 성적 반응에서 증가합니다. J. Clin. Endocrinol. Metab. 64, 27 - 31. 카터, CS, 1992. 옥시토신과 성적 행동. 신경 과학. Biobehav. 목사 16, 131 - 144. Carter, CS, Lederhendler, II, Kirkpatrick, B., 1997. 합병의 상호 작용하는 신경 생물학, 뉴욕 과학 아카데미의 연보, 집. 807. 뉴욕 과학 아카데미, 뉴욕. Castelli, MP, Piras, AP, Melis, T., Succu, S., Sanna, F., Melis, MR, Collu, S., Ennas, MG, Diaz, G., Mackie, K., Argiolas, A. , 2007. 방실 핵의 CB1 수용체 및 음경 발기의 중앙 제어 : 면역 세포 화학, 오토 라디오 그래피 및 행동 연구. 신경 과학 147, 197-206. Chen, KK, Chang, LS, 2003. 쥐의 시상 하부의 방실 핵에 투여 한 후 흥분성 아미노산 수용체 작용제가 음경 발기에 미치는 영향. J. Urol. 62, 575 - 580. 첸, KK, 찬, JYH, 장, LS, 첸, MT, 장, SHH, 1992. 쥐의 해마 형성의 활성화에 따른 음경 발기의 유도. 신경 과학. 레트 사람. 141, 218 - 222. 첸, KK, 찬, JYH, 장, LS, 1999. 쥐의 음경 발기의 중심 조절 시상 하부의 방실 핵에서 도파민 성 신경 전달. J. Urol. 162, 237 - 242. Collins, GT, Truccone, A., Haji-Abdi, F., Newman, AH, Grundt, P., 쌀, KC, 남편, SM, 욕심쟁이, BM, Enguehard-Gueiffer, C., Gueiffer, A. , J., Wang, S., Katz, JL, Grandy, DK, Sunahara, RK, Woods, JH, 2009. dopamineD2 유사 작용제의 발기 부전 효과는 쥐와 생쥐의 D3 수용체에 의해 매개됩니다. J. Pharmacol. 특급. Ther. 329, 210 - 217. Coolen, LM, Allard, J., Truitt, WA, McKenna, KE, 2004. 사정의 중앙 규정. Physiol. 행동. 83, 203 - 215. Cui, SS, Bowen, RC, Gu, GB, Hannesson, BK, Yu, PH, Zhang, X., 2001. 리튬에 의한 카나비노이드 금단 증후군의 예방 : 옥시토신 성 신경 세포 활성화의 관련 J. 신경 과학. 21, 9867 - 9876. Dahlstrom, A., Fuxe, K., 1964. 중추 신경계에서 모노 아민 함유 뉴런의 존재에 대한 증거. I. 뇌간 신경 세포의 세포 기관에서 모노 아민의 증명. Acta Physiol. 스캔. 62 (Suppl. 232), 1-54. Depoortère, R., Bardin, L., Rodrigues, M., Abrial, E., Aliaga, M., Newman-Tancredi, A., 2009. 래트에서 도파민 D2- 유사 수용체 작용제에 의해 유도 된 음경 발기 및 하품 : 도파민 D2의 변형 및 기여의 영향은 있지만 D3 및 D4 수용체의 영향은 없다. 행동. Pharmacol. 20, 303 - 311. Domes, G., Heinrichs, M., Buchel, C., Braus, DF, Herpertz, SC, 2007. 옥시토신은 원자가에 관계없이 감정 얼굴에 편도선 반응을 감쇠시킵니다. Biol. 정신과 62, 11871190. Dominguez, J., Riolo, JV, Xu, Z., Hull, ME, 2001. 교미와 내측 전 광학 도파민 방출의 내측 편도체에 의한 조절. J. 신경 과학. 21, 349 - 355. Donaldson, ZR, Young, LJ, 2009. 옥시토신, 바소프레신 및 사회 신경학. 과학 322, 900-904. Eaton, RG, Markowski, VF, Lumley, LA, Thompson, JT, Moses, J., Hull, EM, 1991. 방실 핵의 D2 수용체는 수컷 쥐의 생식기 반응과 교미를 조절한다. Pharmacol. BIOCHEM. 행동. 39, 177 - 181. Ebner, K., Bosch, OJ, Krömer, SA, Singewald, N., Neumann, ID, 2005. 쥐 중앙 편도선에서 옥시토신의 방출은 스트레스 대처 행동과 흥분성 아미노산의 방출을 조절한다. Neuropsychopharmacology 30, 223-230. Enguehard-Gueiffier, C., Hübner, H., El Hakmaoui, A., Allouchi, H., Gmeiner, P., Argiolas, A., Melis, MR, Gueiffier, A., 2006. 선택적 D2- 리간드로서의 4 - [(1- 페닐 피페 라진 -4- 일) 메틸] 이미 다조 (디) 아진. 2- [4- (2-methoxyphenyl) piperazin-1-ylmethyl] imidazo [1,2-a] 피리딘 (PIP3EA), 강력하고 선택적 D4 작용제에 의한 음경 발기 유도. J. 메드. 화학. 49, 3938 - 3947. Everitt, BJ, 1990. 성욕 동기 : 수컷 랫트의 식욕 돋우는 및 협조적인 반응을 나타내는 메커니즘에 대한 신경 및 행동 분석. 신경 과학. Biobehav. 목사 14, 217 - 232. Fibiger, HC, Phillips, AG, 1988. Mesocorticolimbic 도파민 시스템과 보상. 앤. N. Y. Acad. 과학. 5, 206 - 215. 프랑스어, SJ, Totterdell, S., 2003. 개개의 핵 측부 - 투영 뉴런은 래트에서 측부 편도선과 복부 구 심성 구 심성 모두를 받는다. 신경 과학 119, 19-31. 954 MR Melis, A. Argiolas / Neuroscience 및 Biobehavioral 리뷰 35 (2011) 939-955 Freund-Mercier, MJ, Richard, P., 1981. 쥐의 우유 분사 반사에 oxytocin의 intraventricular 주사의 흥분 효과. 신경 과학. 레트 사람. 23, 193 - 198. Freund-Mercier, MJ, Richard, P., 1984. 옥시토신에 의한 옥시토신 뉴런의 촉진 조절을위한 전기 생리 학적 증거. J. Physiol. (Lond.) 352, 447-466. Freund-Mercier, MJ, Stoeckel, ME, 1995. 옥시토신 뉴런에 대한 Somatodendritic autoreceptors. In : Ivell, R., Russel, JA (Eds.), 옥시토신, 세포 및 분자 접근법에 관한 연구. Adv. 특급. 메드. Biol., 365. Plenum Press, New York and London, pp. 185 - 194. Freund-Mercier, MJ, Stoeckel, ME, Palacios, JM, Pazos, JM, Richard, PH, Porte, A., 1987. Autoradiography에 의해 연구 된 Wistar 쥐의 뇌에서 3H 옥시토신 결합 부위의 약리학 적 특성과 해부학 적 분포. 신경 과학 20, 599-614. Giuliano, F., Rampin, O., 2000. 음경 발기의 중앙 통제. 신경 과학. Biobehav. 목사 24, 517 - 533. Giuliano, F., Allard, J., 2001. 도파민과 성적 기능. 이자. J. 발기 부전 13 (Suppl. 3), 18-28. Giuliano, F., Rampin, O., 2004. 발기의 신경 제어. Physiol. 행동. 83, 189 - 201. Giuliano, F., Bernabè, J., McKenna, KE, Longueville, F., Rampin, O., 2001. 마취 된 쥐에서의 옥시토신의 척추 proerectile 효과. Am J. Physiol. Regul. Integ. 비교 Physiol. 280, R1870-R1877. Goto, Y., Grace, AA, 2005. 목표 지향적 행동에서의 측두근 운동의 도파민 운동 및 도파민 운동의 도파민 성 조절 Nat. 신경 과학. 8, 805 - 812. Hawthorn, J., Ang, VT, Jenkins, JS, 1985. 쥐의 두뇌와 척수에서 바소프레신과 옥시토신에 대한 시상 하부 방실, supraoptic 및 suprachiasmatic 핵에 병변의 영향. Brain Res. 346, 51 - 57. Dichan, Hyplop, DK, Lipton, MF, Martin, LJ, Mauragis, MA, Piercey, MF, Nichols, NF, Schreur, PJ, Smith, MW, Moon, MW, 1997. (R) -5,6- 디 히드로 -N, N- 디메틸 -4H- 이미 다조 [4,5,1-ij] 퀴놀린 -5- 아민) 및 이의 대사 산물의 합성 및 생물학적 활성. J. 메드. 화학. 40, 639 - 646. Hsieh, GC, Hollingsworth, PR, Martino, B., Chang, R., Terranova, MA, O'Neill, AB, Lynch, JJ, Moreland, RB, Donnelly-Roberts, DL, Kolasa, T., Mikusa, JP , McVey, JM, Marsh, KC, Sullivan, JP, Brioni, JD, 2004. 의식이있는 쥐에서 음경 발기를 조절하는 중심 메카니즘 : 아포 모르핀의 후유증 효과와 관련된 도파민 계통. J. Pharmacol. 특급. Ther. 308, 330 - 338. Huang, PL, Dawson, TM, Bredt, DS, Snyder, SH, Fishman, MC, 1993. 신경원 산화 질소 신타 제 유전자의 표적화 된 파괴. 셀 75, 1273-1286. Huber, D., Veinante, P., Stoop, R., 2005. 바소프레신 (vasopressin)과 옥시토신 (oxytocin)은 편도선에서 별개의 신경 세포 집단 (neuronal population)을 자극한다. 과학 308, 245-248. 헐, EM, 워너, RK, Bazzett, TJ, 이튼, RC, 톰슨, JT, 1989. 내측 검사 전 영역에서 D2 / D1 비율은 수컷 쥐의 교미에 영향을 미친다. J. Pharmacol. 특급. Ther. 251, 422 - 427. 선체, EM, Du, J., Lorrain, DS, Matuszewich, L., 1995. 내측 유두 주위에서의 세포 외 도파민 : 성욕과 호르몬 조절에 미치는 영향 J. 신경 과학. 15, 7465 - 7471. Hull, EM, Meisel, RL, Sachs, BD, 2002. 남성의 성적 행동. 있음 : Pfaff, DW, Arnold, AP, Etgen, AM, Fahrbach, SE, Rubin, 실시간 (Eds.), 호르몬, 두뇌 및 행동. Academic Press, New York, pp. 3 - 137. Hurlemann, R., Patin, A., Onur, OA, Cohen, MX, Baumgartner, T., Metzler, S., Dziobek, I., Gallinat, J., Wagner, M., Maier, W., Kendrick, KM, 2010. 옥시토신은 인간 편도체 의존성, 사회적으로 강화 된 학습 및 정서적 공감을 향상시킵니다. J. 신경 과학. 30, 4999 - 5007. Ivell, R., Russel, JA, 1995. 옥시토신 : 의학 및 연구 분야의 세포 및 분자 접근. 실험 의학 및 생물학, vol. 395. Plenum Press, 뉴욕. 켈리, AE, Domesick, VB, 1982. 쥐의 해마 형성에서 핵으로의 돌출부의 분포 : 전두엽 및 역행 - 양 고추 냉이 퍼 옥시다아제 연구. 신경 과학 7, 2321-2335. Kimura, Y., Naitou, Y., Wanibuchi, F., Yamaguchi, T., 2008. 5-HT (2C) 수용체 활성화는 아포 모르핀, 옥시토신 및 멜라노 탄 -2의 후유증 효과에 대한 일반적인 메커니즘입니다. E. J. Pharmacol. 589, 157 - 162. Kondo, Y., Sachs, BD, Sakuma, Y., 1998. 발정 암컷의 원격 자극에 의해 유발 된 쥐의 음경 발기에서 내 편도의 중요성. 행동. Brain Res. 91, 215 - 222. Kovacs, GL, Sarnyai, Z., Szabo, G., 1998. 옥시토신과 중독 : 리뷰. 정신 신경 내분비학 23, 945-962. Lee, HJ, Macbeth, AH, Pagani, JH, Scott Young 3rd, W., 2009. 옥시토신 : 삶의 위대한 촉진제. 음식물. Neurobiol. 88, 127 - 151. Lindvall, O., Bjorklund, A., Skagerberg, G., 1984. 쥐의 두뇌와 종뇌에서 도파민 말단 시스템의 선택적 등표 화학적 시연 : 시상 하부의 신경 분비 핵의 도파민 성 신경 분포에 대한 새로운 증거. Brain Res. 306, 19 - 30. Liu, YC, Salamone, JD, Sachs, BD, 1997. 수컷 쥐의 시상 하부의 방실 핵의 병변 후 성 반응 장애. 행동. 신경 과학. 111, 1361 - 1367. Löber, S., Tschammer, N., Hübner, H., Melis, MR, Argiolas, A., Gmeiner, P., 2009. 소설 bioisostere로 azulene 프레임 워크 : 음경 발기를 유도하는 강력한 도파민 D4 수용체 리간드의 디자인. 화학. 메드. 화학. 4, 325 - 328. McCleskey, EW, Fox, AP, Feldman, DH, Cruz, LJ, Olivera, BM, Tsien, RW, Yoshikami, D., 1987. _-Conotoxin : 근육이 아닌 뉴런의 특정 유형의 칼슘 채널을 직접적으로 지속적으로 봉쇄합니다. Prot. Nat. Acad. 과학. 미국 84, 4327 - 4331. McKenna, KE, 2000. 중추 신경계의 조직에 관한 몇 가지 제안은 음경 발기 제어. 신경 과학. Biobehav. 목사 24, 535 - 540. Marson, L., McKenna, KE, 1992. 척추 성적 반사의 하강 억제에서 5- 하이드 록시 트립 타민의 역할. 특급. Brain Res. 88, 313 - 318. Marson, L., McKenna, KE, 1996. ischiocavernus 및 bulbospongiosus 근육의 조절에 관여하는 CNS 세포군 : pseudorabies 바이러스를 이용한 경간 추적 연구. J. 비교 Neurol. 374, 161 - 179. Meisel, RL, Sachs, BD, 1994. 남성의 성행위의 생리. In : Knobil, E., Neil, J. (Eds.), The Reproduction의 생리학, vol. 2, 두 번째 에디션. Raven Press, New York, pp. 3 - 96. Melin, P., Kihlstrom, JE, 1963. 수컷 토끼에서의 성 행동에 대한 옥시토신의 영향. 내분비학 73, 433-435. Melis, MR, Argiolas, A., 1995a. 도파민과 성적 행동. 신경 과학. Biobehav. 목사 19, 19 - 38. Melis, MR, Argiolas, A., 1995b. 질소 산화물 공여자는 수컷 쥐의 중추 신경계에 주입 될 때 음경 발기 및 하품을 유도합니다. E. J. Pharmacol. 294, 1 - 9. Melis, MR, Argiolas, A., 2003. 중앙 옥시토신 성 신경 전달 물질 : 심인성 발기 부전 치료제 타겟 Curr. 약물은 4, 55-66을 목표로합니다. Melis, MR, Argiolas, A., Gessa, GL, 1986. 옥시토신으로 인한 하품과 음경 발기 : 뇌에서의 활동 부위. Brain Res. 398, 259 - 265. Melis, MR, Argiolas, A., Gessa, GL, 1987. 아포 모르핀 유발 하품과 음경 발기 : 두뇌에서의 활동 장소. Brain Res. 415, 98 - 104. Melis, MR, Argiolas, A., Gessa, GL, 1989a. 아포 몰핀은 쥐의 혈장 옥시토신 수치를 증가시킵니다. 신경 과학. 레트 사람. 98, 351 - 355. Melis, MR, Argiolas, A., Gessa, GL, 1989b. 아포 모르핀이 중추 신경계에서 옥시토신을 방출함으로써 음경 발기 및 하품을 유도한다는 증거. E. J. Phamacol. 164, 565 - 570. Melis, MR, Argiolas, A., Stancampiano, R., Gessa, GL, 1990. 수컷 쥐의 다른 뇌 영역과 혈장에서의 옥시토신 농도에 대한 아포 모르핀의 영향. E. J. Pharmacol. 182, 101 - 107. Melis, MR, Mauri, A., Argiolas, A., 1994a. 아포 몰핀과 옥시토신에 의해 유도 된 penile 발기 및 수태 및 성숙 쥐의 하품 : 성적 스테로이드의 효과 신경 내분비학 59, 349-354. Melis, MR, Stancampiano, R., Argiolas, A., 1994b. 방실 기 NMDA 주사에 의해 유발 된 음경 발기 및 하품은 옥시토신에 의해 매개됩니다. Pharmacol. BIOCHEM. 행동. 48, 203 - 207. Melis, MR, Stancampiano, R., Argiolas, A., 1994c. 아포 모르핀 및 옥시토신에 의해 유도 된 음경 발기 및 하품의 NG- 니트로 -l- 아르기닌 메틸 에스테르에 의한 예방 : 뇌에서의 작용 부위. Pharmacol. BIOCHEM. 행동. 48, 799 - 804. Melis, MR, Succu, S., Argiolas, A., 1996. 도파민 작용제는 시상 하부 방실 핵의 산화 질소 생성을 증가시킨다 : 음경 발기 및 하품과의 상관 관계. E. J. 신경 과학. 8, 2056 - 2063. Melis, MR, Succu, S., Iannucci, U., Argiolas, A., 1997. 옥시토신은 시상 하부 방실 핵의 산화 질소 생성을 증가시킨다 : 음경 발기 및 하품과의 상관 관계. Reg. 펩티드 69, 105-112. Melis, MR, Succu, S., Mauri, A., Argiolas, A., 1998. 산화 질소 생성은 비 접촉 음경 발기와 교미 동안에 수컷 쥐의 시상 하부 방실 핵에서 증가한다. E. J. 신경 과학. 10, 1968 - 1974. Melis, MR, Spano, MS, Succu, S., Argiolas, A., 1999a. 옥시토신 길항제 d (CH2) 5Tyr (Me) 2-Orn8-vasotocin은 수컷 쥐의 비 접촉 성 음경 발기를 감소시킨다. 신경 과학. 레트 사람. 265, 171 - 174. Melis, MR, Succu, S., Spano, MS, Argiolas, A., 1999b. 시상 하부의 방실 핵에 주입 된 모르핀은 비접촉식 발기를 방지하고 교미를 손상시킵니다. 산화 질소가 관여합니다. E. J. 신경 과학. 11, 1857 - 1864. Melis, MR, Spano, MS, Succu, S., Argiolas, A., 2000. 수컷 쥐의 흥분성 아미노산, 도파민 및 옥시토신 수용체 길항제가 비접촉 음경 발기 및 방실산 산화 질소 생산에 미치는 영향 행동. 신경 과학. 114, 849 - 857. Melis, MR, Succu, S., Mascia, MS, Cortis, L., Argiolas, A., 2003. 성적 활동 중에 수컷 쥐의 방실 핵에서 세포 외 도파민이 증가합니다. E. J. 신경 과학. 17, 1266 - 1272. Melis, MR, Succu, S., Mascia, MS, Argiolas, A., 2004a. 수컷 쥐의 방실 핵에있는 칸 나비 노이드 CB1 수용체의 길항 작용은 음경 발기를 유도한다. 신경 과학. 레트 사람. 359, 17 - 20. Melis, MR, Succu, S., Mascia, MS, Cortis, L., Argiolas, A., 2004b. 발기 기능에있어서 NMDA 수용체의 주요 역할 : 성기 활동 중 수컷 쥐의 뇌실 주위 핵에서 세포 외 흥분성 아미노산이 증가합니다. E. J. 신경 과학. 19, 2569 - 2575. Melis, MR, Succu, S., Mascia, MS, Argiolas, A., 2005. 선택적 도파민 D168,077 수용체 작용제 인 PD-4는 수컷 쥐의 방실 핵에 주입 될 때 음경 발기를 유도합니다. 신경 과학. 레트 사람. 379, 59 - 62. Melis, MR, Succu, S., Mascia, MS, Sanna, F., Melis, T., Succu, S., Castelli, MP, Argiolas, A., 2006a. 수컷 쥐에서 SR 141716A에 의해 유발 된 음경 발기 : 방실 glutamic acid와 nitric oxide의 관련성 신경 약리학 50, 219-228. Melis, MR, Succu, S., Sanna, F., Mascia, MS, Melis, T., Enguehard-Gueiffier, C., Hubner, H., Gmenier, P., Gueiffier, A., Argiolas, A., 2006b. 두 개의 선택적 도파민 D3 수용체 작용제 인 PIP168077EA와 PD4는 수컷 랫드에서 음경 발기를 유도합니다 : 뇌에서의 작용과 작용 기전. E. J. 신경 과학. 24, 2021 - 2030. Melis, MR, Melis, T., Cocco, C., Succu, S., Sanna, F., Pillolla, G., Boi, A., Ferri, GL, Argiolas, A., 2007. 복부 tegmental 지역에 주입 옥시토신은 음경 발기 유도하고 측부 핵 MR에서 세포 외 도파민을 증가 Melis, A. Argiolas / Neuroscience and Biobehavioral Reviews 수컷 쥐의 시상 하부의 35 (2011) 939-955 955 및 방실 핵. E. J. 신경 과학. 26, 1026 - 1035. Melis, MR, Sanna, F., Succu, S., Zarone, P., Boi, A., Argiolas, A., 2009a. 수컷 쥐의 성적 행동의 예상 및 만기 단계에서 옥시토신의 역할. 있음 : Jastrow, H., Feuerbach, D. (Eds.), Oxytocin 연구 핸드북 : 합성, 저장 및 방출, 작용 및 약물 형태. Nova Publishers Inc, 뉴욕, 미국, pp. 109 - 125. Melis, MR, Succu, S., Sanna, F., Boi, A., Argiolas, A., 2009b. 편도선의 복부 샘 또는 후 내피 피질 핵에 주사 된 옥시토신은 음경 발기를 유도하고 수컷 쥐의 측벽 핵에서 세포 외 도파민을 증가시킨다. E. J. 신경 과학. 30, 1349 - 1357. Melis, MR, Succu, S., Cocco, C., Caboni, E., Sanna, F., Boi, A., Ferri, GL, Argiolas, A., 2010. 옥시토신은 복부 샘에 주입 될 때 음경 발기를 유도합니다. 산화 질소와 글루타민산의 역할. 신경 약리학 58, 1153-1160. Moreland, RB, Nakane, M., Donnelly-Roberts, DL, Miller, LN, Chang, R., Uchic, ME, Terranova, MA, Gubbins, EJ, Helfrich, RJ, Namovic, MT, El-Kouhen, OF, Masters, JN, Brioni, JD, 2004. Galpha (qo2)를 통한 칼슘 플럭스와 결합 된 인간 도파민 D (5) - 수용체 안정 세포주의 비교 약리학. BIOCHEM. Pharmacol. 68, 761 - 772. Moos, F., Freund-Mercier, MJ, Guerne, Y., Guerne, JM, Stoeckel, ME, Richard, P., 1984. 체외에서 magnocellular nuclei에 의한 oxytocin과 vasopressin의 방출 : 옥시토신의 특이적인 촉진 효과. J. Endocrinol. 102, 63 - 72. Murphy, MR, Seckl, JR, Burton, S., Checkley, SA, Lightman, SL, 1987. 남성의 성 활동 중 옥시토신과 바소프레신 분비의 변화. J. Clin. Endocrinol. Metab. 65, 738 - 741. Nishimori, K., Young, LJ, Guo, Q., Wang, Z., Insel, TR, Matzuk, MM, 1996. 옥시토신은 간호를 위해 필요하지만 분만 또는 생식 행동에 필수적이지 않습니다. PROC. Natl. Acad. 과학. 미국 93, 11699 - 11704. Patel, S., Freedman, S., Chapman, KL, Emms, F., Fletcher, AE, Knowles, M., Marwood, R., Mccallister, G., Myers, J., Curtis, J., Kulagowski, JJ, Leeson, PD, Ridgill, M., Graham, M., Matheson, S., Rathbone, D., Watt, AP, Bristow, LJ, Rupniak, NM, Baskin, E., Lynch, JJ, Ragan, CI , 1997. 도파민 D745,870 수용체에 대한 높은 친 화성을 가진 선택적 길항제 인 L 4의 생물학적 특성. J. Pharmacol. 특급. Ther. 283, 636 - 647. Pedersen, CA, Caldwell, JD, Jirikowski, GF, Insel, TR, 1992. 모체, 성적 및 사회적 행동의 옥시토신, 뉴욕 과학 아카데미 연보, vol. 652. 뉴욕 과학 아카데미, 뉴욕. Petrovic, P., Kalisch, R., Singer, T., Dolan, RJ, 2008. 옥시토신은 컨디션 된 얼굴 및 편도선 활동에 대한 정서적 평가를 약화시킵니다. J. 신경 과학. 28, 6607 - 6615. Pfaus, JG, Everitt, BJ, 1995. 성행위의 정신 약물학. 있음 : Knobil, FE, Kupfer, DJ (Eds.), 정신 약물학 : 진행의 4 세대. Raven Press, New York, pp. 742 - 758. Rajfer, J., Aronson, WJ, 부시, PA, Dorey, FJ, Ignarro, LJ, 1992. 비 아드레날린, 비 콜린성 신경 전달에 대한 해면체 해면체의 완화제로서의 산화 질소. N. Engl. J. 메드. 326, 90 - 94. Roeling, TAP, Van Erp, AMM, Meelis, W., Kruk, MR, Veening, JG, 1991. NMDA의 행동 효과는 쥐의 시상 하부 방실 핵에 주입되었습니다. Brain Res. 550, 220 - 224. Sachs, BD, 1997. 발기 된 암컷의 공기 중 향기에 의해 수컷 쥐에서 발기가 유발되었습니다. Physiol. 행동. 62, 921 - 924. Sachs, BD, 2000. 발기 기능, 발기 부전 및 성적 흥분의 생리 및 분류에 대한 문맥 접근. 신경 과학. Biobehav. 목사 24, 541 - 560. Sachs, BD, 2007. 남성 성적 각성의 맥락 적 정의. 호르몬. 행동. 51, 569 - 578. Sanchez, F., Alonso, JR, Arevalo, R., Blanco, E., Aijon, J., Vazquez, R., 1994. NADPH-diaphorase와 바소프레신 및 옥시토신의 시상 하부의 다낭 신경 세포 분절 핵에서의 공존 세포 조직 Res. 276, 31 - 34. Sanna, F., Succu, S., Boi, A., Melis, MR, Argiolas, A., 2009. 포스 포 디에스 테라 제 타입 5 억제제는 수컷 랫트의 비접촉식 발기를 촉진합니다 : 뇌내 작용 부위와 작용 메커니즘. J. 성별. 메드. 6, 2680 - 2689. Saphier, D., Feldman, S., 1987. 방실 핵 세포 뉴런에 대한 septal 및 hippocampal 자극의 효과. 신경 과학 20, 749-755. Sato-Suzuki, I., Kita, I., Oguri, M., Arita, H., 1998. 쥐의 방실 핵의 전기 및 화학 자극에 의해 야기 된 정형화 된 하품 반응. J. 신경 피시 올. 80, 2765 - 2775. Schuman, EM, Madison, DV, 1994. 산화 질소와 시냅스 기능. 앤. 목사 신경 과학. 17, 153 - 183. Snyder, SH, 1992. 산화 질소 : 신경 전달 물질의 새로운 종류에서 첫째로? 과학 254, 494-496. Sofroniew, MV, 1983. 포유류의 뇌와 척수에서 바소프레신과 옥시토신. Trends Neurosci. 6, 467 - 472. Sokoloff, P., Schwartz, JC, 1995. 반세기가 지난 비약적인 도파민 수용체. Trends Pharmacol. 과학. 16, 270 - 275. Southam, E., Garthwaite, J., 1993. 쥐의 두뇌에있는 산화 질소 순환 GMP 신호 전달 경로. 신경 약리학 32, 1267-1277. Stancampiano, R., Melis, MR, Argiolas, A., 1994. 수컷 쥐에서 5-HT1c 효능 제에 의해 유발 된 음경 발기 및 하품 : 도파민 및 옥시토신 성 전달과의 관계. E. J. Pharmacol. 261, 149 - 155. Succu, S., Mascia, MS, Sanna, F., Melis, T., Argiolas, A., Melis, MR, 2006. 칸 나비 노이드 CB1 수용체 길항제 SR 141716A는 남성 쥐의 방실 핵의 외 세포 글루탐산을 증가시킴으로써 음경 발기를 유도한다. 행동. Brain Res. 169, 274 - 281. Succu, S., Sanna, F., Melis, T., Boi, A., Argiolas, A., Melis, MR, 2007. 수컷 쥐의 시상 하부 방실 핵의 도파민 수용체 자극은 음경 발기를 유도하고 중추의 옥시토신이 관여하는 측위 핵 세포 외 도파민을 증가시킨다. 신경 약리학 52, 1034-1043. Succu, S., Sanna, F., Cocco, C., Melis, T., Boi, A., Ferri, GL, Argiolas, A., Melis, MR, 2008. 옥시토신은 수컷 랫트의 복부 피 두드러기 부위에 주사 할 때 음경 발기를 유도합니다 : 산화 질소 및 사이 클릭 GMP의 역할. E. J. 신경 과학. 28, 813 - 821. Tanda, G., Pontieri, FE, Di Chiara, G., 1997. 일반 mu1 오피오이드 수용체 메커니즘에 의한 중파 변이 도파민 전달의 칸 나비 노이드 및 헤로인 활성화. 과학 276, 2048-2050. Tang, Y., Rampin, O., Calas, A., Facchinetti, P., Giuliano, F., 1998. 수컷 쥐에서 음경 발기를 조절하는 확인 된 요추 신경의 옥시토신 성 및 세로토닌 성 신경 분포. 신경 과학 82, 241-254. 테오 드로 증, DT, 1985. supraoptic nuclei에서 옥시토신 뉴론에 대한 옥시토신 면역 반응성 시냅스. 자연 (런던) 313, 682-684. Tindall, JS, 1974. 옥시토신의 방출을 유발하는 자극. 있음 : Geiger, SR, Knobil, E., Sawyer, WH, Greef, R., Astwood, EB (Eds.), Handbook of Physiology. 분파. 7, Endocrinology, vol. IV. 미국 생리학 협회, 워싱턴 DC, pp. 257 - 267. Torres, G., Lee, S., Rivier, C., 1993. 시상 하부 산화 질소 신타 제의 개체 발생 및 신경 펩타이드와의 동위 원소 화 Mol. 세포. 신경 과학. 4, 155 - 163. Uhl-Bronner, S., Waltisperger, E., Martinez-Lorenzana, G., Condes, LM, Freund-Mercier, MJ, 2005. 쥐의 전뇌 및 척수에서 옥시토신 결합 부위의 성적 이형 형태의 발현 신경 과학 135, 147-154. Vaccari, C., Lolait, SJ, Ostrowski, NL, 1998. 뇌에서 바소프레신 V1b와 옥시토신 수용체 메신저 리보 핵산의 비교 분포. 내분비학 139, 5015-5033. 반 덴 폴, A., 1991. 시상 하부 시냅스 전 축삭에서 글루타메이트와 아스파 테이트 면역 반응성. J. 신경 과학. 11, 2087 - 2101. Veronneau-Longueville, F., Rampin, O., Freund-Mercier, MJ, Tang, Y., Calas, A., Marson, L., McKenna, KE, Stoeckel, ME, Benoit, G., Giuliano, F. , 1999. 쥐의 음경 발기를 조절하는 자율 핵의 옥시토신 성 신경 분포. 신경 과학 93, 1437-1447. Vincent, SR, Kimura, H., 1992. 쥐의 뇌에서 nitric oxide synthase의 조직 학적지도 작성. 신경 과학 46, 755-784. Wagner, CK, Clemens, LG, 1993. 시상 하부의 방실 핵에서 요추의 성적 이형성 핵에 이르는 신경 충진 경로. J. 비교 Neurol. 336, 106 - 116. 윈 슬로, JT, Insel, TR, 1991. 수컷 다람쥐 원숭이의 사회적 지위는 중심 옥시토신 투여에 대한 행동 반응을 결정합니다. J. 신경 과학. 11, 2032 - 2038. Wise, RA, Rompre, P.-P., 1989. 두뇌 도파민과 보상. 앤. 목사 Psychol. 40, 191 - 225. Witt, DM, Insel, TR, 1994. 남성의 성행위는 시상 하부 방실 핵의 옥시토신 뉴런에서 c-fos-like 단백질을 활성화시킵니다. J. 신경 내분비 계. 6, 13 - 18. Witter, MP, 2006. 쥐의 subiculum의 연결 : 원주 및 층류 조직과 관련된 지형. Behav Brain Res. 174, 251 - 264. Woodruff, GN, Foster, AC, Gill, R., Kemp, JA, Wong, EH, Iversen, LL, 1987. N- 메틸 -d- 아스 파르 테이트에 대한 MK-801와 수용체의 상호 작용 : 기능적 결과. 신경 약리학 26, 903-909. Yamashita, H., Shigeru, O., Inenaga, K., Kasai, M., Uesugi, S., Kannan, H., Kaneko, T., 1987. 옥시토신은 생체 외에서 쥐 supraoptic nucleus에서 추정 옥시토신 뉴런을 흥분시킨다. Brain Res. 416, 364 - 368. Yells, DP, Hendricks, SE, Prendergast, MA, 1992. paragigantocellularis 핵의 병변 : 수컷 쥐의 교미 행동에 대한 영향. Brain Res. 596, 73 - 79. Young, WS, Shepard, E., Amico, J., Hennighausen, L., LaMarca, ME, McKinney, C., Ginns, EI, 1996. 마우스 옥시토신이 결핍되면 출산을 막을 수 있지만 출산이나 출산을 막을 수는 없습니다. J. 신경 내분비 계. 8, 847 - 854. Zahran, AR, Vachon, P., Courtois, F., Carrier, S., 2000. 마취 된 래트의 시상 하부 방실 핵에서 흥분성 아미노산 수용체 작용제 주입 후 해면 기 음경 압력이 증가합니다. J. Urol.