의견 : 비만과 음식 중독에 대한 최고 연구원의 리뷰.
볼륨 69, 문제 4, 24 2 월 2011, 페이지 664-679
http://dx.doi.org/10.1016/j.neuron.2011.02.016,
검토
Paul J. Kenny1, ,
1 Behavioral and Molecular Neuroscience, 분자 치료학과, Scripps 연구소, Jupiter, FL 33458, 미국
________________________________________
식품은 항상성 수준에서 에너지 균형을 유지하기 위해 소비됩니다. 또한, 맛있는 음식도 에너지 상태와 무관 한 쾌락 성질 때문에 소비됩니다. 이러한 보상 관련 소비로 인해 칼로리 섭취량이 요구 사항을 초과 할 수 있으며 선진국에서 비만 율이 급속히 증가하는 주요 원인으로 간주됩니다. 항상 섭식의 항상성 메커니즘에 비해 뇌의 쾌락 체계가 음식물 섭취에 어떻게 영향을 미치는지에 대해서는 알려진 바가 거의 없습니다. 흥미롭게도, 맛있은 음식을 과도하게 섭취하면 약물 남용과 유사한 뇌 보상 회로에서 신경 적응 반응을 유발할 수 있습니다. 또한, 뇌 보상 시스템의 유사한 유전 적 취약성은 약물 중독과 비만의 경향을 증가시킬 수 있습니다. 여기, 먹이 행동의 쾌락 적 측면을 조절하는 뇌 회로에 대한 우리의 이해가 최근에 진보 될 것이다. 또한, 비만과 마약 중독이 공통적 인 쾌락 메커니즘을 공유 할 수 있다는 새로운 증거가 또한 고려 될 것이다.
________________________________________
주요 텍스트
"음식에 대한 사랑보다 진실한 사랑이 없습니다."
- 조지 버나드 쇼
개요
30 이상의 체질량 지수 (BMI)로 정의되는 비만은 지방이 비정상적으로 높고 과식증 또는 대사율 감소로 인해 발생할 수있는 상태입니다 (O'Rahilly, 2009). 과도한 지방은 심혈관 질환, 암, 제 2 형 당뇨병 및 기분 관련 장애의 주요 위험 요소이며 비만인 사람들은 종종 사회적 낙인을 찍습니다 ([Bean et al., 2008], [Centers for Disease Control and Prevention, 2009] 및 [Luppino et al., 2010]). 질병 통제 센터 (CDC)에 따르면 1998 년부터 2000 년까지 미국의 비만 관련 의료 비용은 약 213 억 달러였습니다. 또한 미국에서 매년 300,000 명이 과체중 및 비만 관련 질병으로 인해 사망 할 수 있으며 (Allison et al., 1999), 비만은 담배 사용 다음으로 예방 가능한 사망의 두 번째 주요 원인입니다. 그럼에도 불구하고 서구 사회에서 비만의 유병률은 계속해서 극적으로 증가하고 있으며 현재 추정에 따르면 미국 성인의 30 % 이상이 비만입니다 (Flegal et al., 2010).
먹이 섭취 조절에 대한 대부분의 개념화는 두 개의 평행 한 시스템이 음식 섭취에 영향을주기 위해 상호 작용한다고 제안한다 (Hommel et al., 2006, Lutter and Nestler, 2009 및 Morton et al., 2006). 항상성 계는 적절한 수준의 에너지 균형을 유지하기 위해 시상 하부 및 뇌간 회로에 작용하여 먹이를 자극하거나 억제하는 렙틴, 그렐린 및 인슐린과 같은 기아, 포만감 및 호르몬 수준의 호르몬 조절자를 포함한다. 선천성 렙틴 결핍과 같은 항상성 계의 구성 요소의 기능 장애는 긍정적 인 에너지 균형과 비만의 발달을 가져올 수있다 (Campfield et al., 1995, Halaas et al., 1995 및 Pelleymounter et al., 1995]). 굶주림과 포만의 호르몬 조절자가 에너지 항상성을 유지하기 위해 시상 하부 및 뇌간 회로에 작용하는 기작은 다른 곳에서 자세히 기술되어 왔고이 주제에 관심이있는 독자는이 주제에 대한 많은 훌륭한 리뷰를 참조합니다 (예 : [Abizaid 등, 2006a]와 [Gao and Horvath, 2007]).
신진 대사 시스템 외에도 뇌 보상 시스템은 섭식 행동에 중요한 역할을합니다 ([Lutter and Nestler, 2009] 및 [Saper et al., 2002]). 일반적으로 부드러운 맛의 음식은 과도하게 먹지 않는 반면, 맛 좋은 음식은 에너지 요구 사항이 충족 된 후에도 종종 소비됩니다. 맛 좋은 에너지 밀도 식품에 대한 접근 용이성은 비만의 주요 환경 위험 요소로 간주되고 (Volkow and Wise, 2005), 맛 좋은 식품의 과소비는 최근 비만의 급증에 기여하는 주요 요인으로 간주됩니다 ([Finkelstein et al., 2005], [Hill et al., 2003] 및 [Swinburn et al., 2009]). 실제로 맛있는 음식의 즐거운 효과를 얻는 것은 특정 개인에서 항상성 신호를 무시할 수있는 강력한 동기 부여 힘입니다 ([Shomaker et al., 2010], [Sunday et al., 1983] 및 [Zheng et al., 2009]). . 선택권이 주어 졌을 때 쥐는 코카인을자가 투여하기보다는 칼로리가없는 사카린 용액을 섭취하는 것을 압도적으로 선호합니다 (Lenoir et al., 2007). 또한, 잘 먹은 쥐는 자발적으로 극한의 추위 (-15 ° C), 유해한 열 통증 또는 혐오적인 발 충격에 노출되어 쇼트 케이크, 미트 파테, 땅콩 버터, 코카콜라, M & M 사탕, 초콜릿과 같은 맛있는 음식을 얻을 수 있습니다. 맛이 덜한 표준 차우를 자유롭게 이용할 수있는 경우에도 칩 또는 요구르트 방울이 발생합니다 ([Cabanac and Johnson, 1983], [Foo and Mason, 2005] 및 [Oswald et al., 2010]). 이러한 연구 결과는 맛있는 음식에 포함 된 다량 영양소가 칼로리 값과 무관하게 뇌 보상 시스템을 자극 할 수 있는지와 ([Wang et al., 2004a] 및 [Wang et al., 2004b]) 맛있는 음식을 섭취하려는 동기가 얼마나 높을 수 있는지를 강조합니다. 항상성 에너지 요구 사항이없는 경우에도. 코카인이나 니코틴과 같은 남용 약물은 열량이나 영양가가없는 경우에도 마찬가지로 높은 수준의 완성 행동을 유발할 수 있습니다. 사실, 비만에서 과식하는 것과 중독에서 과도한 약물 사용 사이의 많은 유사점 때문에 (Volkow and Wise, 2005), 비만은 뇌 질환으로 간주되어야하며 차기 2007 판에 진단 범주로 포함되어야한다고 주장되어 왔습니다. 정신 장애 진단 및 통계 매뉴얼 (DSM-V) ([Devlin, 2007] 및 [Volkow and O'Brien, XNUMX]). 쾌락 시스템이 음식물 섭취에 어떻게 영향을 미치는지에 대해서는 급식 행동의 항상성 메커니즘과 비교할 때 훨씬 덜 알려져 있습니다. 마찬가지로, 내재적 또는식이 요법이 뇌 보상 시스템의 반응성에 미치는 영향과 이러한 영향이 과식 및 비만에 어떻게 기여하는지는 명확하지 않습니다. 아래에 요약 된 것은 비만의 발달에 기여할 수있는 뇌 보상 활동의식이 요법 및식이 요법으로 인한 변화에 대한 우리의 이해의 발전을 강조하는 최근 데이터입니다.
탁월한 음식에 반응하는 뇌 보상 시스템의 활성화 : 에너지 균형의 호르몬 조절 자와의 상호 작용
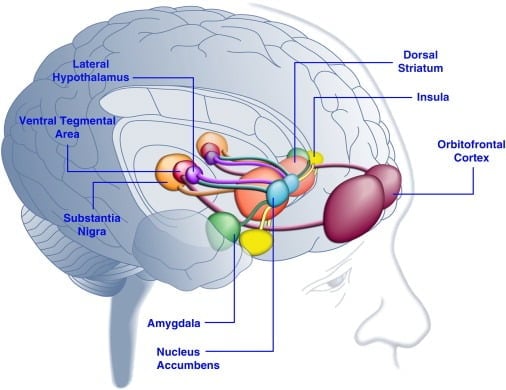
맛있는 음식을 섭취하면 인간의 기분을 좋게 할 수 있고 (Dallman et al., 2003), [Macht and Mueller, 2007] 실험 동물에서 조건부 환경 설정을 지원할 수있다 (Imaizumi et al., 2001) Sclafani et al., 1998]). 이러한 효과는 맛있는 음식 (그림 1)에 의한 뇌 보상 시스템의 자극과 관련이 있습니다. 실제로 인간의 뇌 영상 연구는 음식과 음식과 관련된 시각적 인 또는 후각적인 신호가 보상에 관련된 코르티 직선 및 중추의 뇌 회로, 특히 안와 전두엽 피질 (OFC), 뇌 섬모, 편도, 시상 하부 및 뇌하수체 영역을 활성화시킬 수 있음을 보여주었습니다 (Bragulat et al., 2010), [Pelchat et al., 2004], [Schur et al., 2009] 및 [Simmons et al., 2005]을 포함하는 복부 피질 부분 (VTA)과 substantia nigra (SN) ). striatum, insula, anterior cingulate cortex 및 midbrain 구조는 일반적으로 쾌락 표현에서이 연결 네트워크의 역할과 일치하는 유형 (예 : 음식, 성별, 금전적 보상)에 관계없이 보상의 주관적인 가치를 인코딩합니다 (Sescousse et al. , 2010). 반대로, OFC는 맛있은 음식 ([Man et al., 2009], [Rolls, 2008] 및 [Sescousse et al., 2010])을 포함한 특정 유형의 보상의 가치와 관련된 표현에서 특히 두드러진 역할을하는 것으로 보인다. ). 굶주림은 음식물에 의해 유발되는 식도 괄약근과 중뇌의 활성화를 향상시킬 수있다 (LaBar et al., 2001). 예를 들어, 고 칼로리의 맛있는 음식에 대한 반응으로 복부 striatum, 편도선, insula 및 OFC의 활성화 강도는 인간 피험자가 잘 먹기보다는 배가 고팠을 때 훨씬 더 컸다 (Goldstone et al., 2009). 이것은 굶주림과식이 요법의시기가 맛있은 음식의 "힘"과 "유혹적인"음식에 대한 갈망에 대한 자기보고 등급을 높이는 것과 일치합니다 ([Hofmann et al., 2010] and [Rolls et al., 1983] ). 반대로, 과다 섭취는 특히 섬피 피질과 시상 하부에서 맛있은 음식에 대한 신경 반응을 감소시킬 수 있습니다 (Cornier et al., 2009). 따라서 음식의 쾌락 적 가치는 신진 대사 상태에 영향을 받아 렙틴이나 그렐린과 같은 신진 대사 조절 인자가 뇌의 쾌락 계의 활동에 영향을 미칠 수 있음을 시사한다. 이러한 견해와 일치하여, 렉틴 또는 장 - 유도식이 인자 펩타이드 YY3-36 (PYY) ([Batterham et al., 2007] 및 [Farooqi et al., 2007]) 또는 위 팽창 식사 섭취를 모방 한 것 (Wang et al., 2008)은 보상 관련 뇌 영역에서 활동을 감소시켰다. 반대로, 선천적 인 렙틴 결핍증을 지닌 과증식 환자는 음식의 이미지에 반응하여 섬피 피질과 줄무늬 체에서 증가 된 활성을 보였다 (Baicy et al., 2007, and Farooqi et al., 2007). 이 환자들에서 렙틴 대체 요법은 뇌와 선조체의 활동을 감소시키고자가보고 된 음식 선호도를 감소시켰다 (Baicy et al., 2007, and Farooqi et al., 2007). Leptin 치료는 도파민 수용체 길항제 인 α- flupenthixol (Figlewicz et al., 2001)과 유사한 음식 제한 쥐에서 자당의 보람있는 특성을 차단합니다. 또한, leptin 수용체는 VTA와 SN (Figlewicz 외., 2003)에서 중뇌 도파민 뉴런에 표현되며, leptin은 mesostriatal 도파민 전송의 변조를 통해 먹이 행동의 hedonic 측면에 영향을 미칠 수 있다고 제안합니다. 이 가능성을 확인하면서, VTA에 렙틴 주입은 도파민 뉴런의 활성을 저해하고 쥐의 음식 섭취를 감소시켰다 (Hommel et al., 2006, Krügel et al., 2003 참조). 반대로, VTA에서 leptin 수용체의 knockdown은 쥐 (Hommel 외., 2006)에서 식품 섭취 증가, 향상된 운동 활성 및 맛이 좋은 음식에 대한 선호를 증가시켰다. 따라서 Leptin은 보상과 동기에 크게 관련되어 있지만 에너지 항상성 (de Araujo et al., 2010)과 [Vucetic and Reyes, 2010]에 덜 관여 된 신경 전달 물질 시스템 인 mesoaccumbens dopamine transmission에 억제 영향을 미친다. 최근에 기아와 관련된 호르몬 인 ghrelin (Kojima et al., 1999)과 [Nakazato et al., 2001]는 음식 신호에 반응하여 뇌에서 쾌락 계의 활성화를 강화시키는 것으로 나타났다 (Malik et al. , 2008). 특히, 그렐린은 비만 한 개체에서 매우 맛있는 음식의 그림에 대한 응답으로 OFC, 편도선, insula, striatum, VTA 및 SN의 활성화를 향상 시켰습니다 (Malik 외., 2008). 쥐의 경우, 그렐린은 중뇌 도파민 계통에 자극 효과를 발휘하며 (아브 자이드 등, 2006b), [Jerlhag 등, 2006], [Jerlhag 등, 2007], 맛있은 음식 (Perello et al., 2010).
그림 1. 입맛에 맞는 음식 또는 음식 관련 신호에 대한 반응으로 활성화 된 인간 두뇌 영역. 안와 전두 피질과 편도체는 음식의 보상 가치와 관련된 정보를 인코딩하는 것으로 생각됩니다 ([Baxter and Murray, 2002], [Holland and Gallagher, 2004], [Kringelbach et al., 2003], [O'Doherty et al. , 2002] 및 [Rolls, 2010]). insula는 음식의 맛과 쾌락 적 가치에 관한 정보를 처리합니다 ([Balleine and Dickinson, 2000] 및 [Small, 2010]). 복부 피개 부위와 흑질에서 도파민 성 입력을받는 축 핵과 등쪽 선조체는 음식의 동기 부여 및 인센티브 특성을 조절합니다 ([Baicy et al., 2007], [Berridge, 1996], [Berridge, 2009], [Farooqi et al., 2007], [Malik et al., 2008] 및 [Söderpalm and Berridge, 2000]). 측면 시상 하부는 맛있는 음식에 대한 보상 반응을 조절하고 음식을 찾는 행동을 유도 할 수 있습니다 (Kelley et al., 1996). 이러한 뇌 구조는 음식의 쾌락 적 특성에 대한 학습을 조절하고, 음식 보상을 얻기 위해주의와 노력을 전환하고, 음식 보상의 가용성을 예측하는 환경 자극의 인센티브 가치를 조절하기 위해 협력 방식으로 작용합니다 (Dagher, 2009). 명확성을 위해 이러한 구조 간의 모든 상호 연결이 표시되는 것은 아닙니다.
유사한 뇌 영역은 c-fos, arc 또는 zif268와 같은 직접 초기 유전자 (IEG)의 발현에 의해 측정되는 인간에서 활성화 된 것과 같은 쥐의 뇌에서 맛있는 음식에 의해 활성화됩니다. 실제로, 맛있는 음식은 척수 및 복부 줄무늬, VTA, 외측 시상 하부 (LH) 및 편도 및 보상 관련 피질 구조의 중심 핵을 쥐 ([Angeles-Castellanos et al., 2007], [Park and Carr, 1998] 및 [Schiltz 외., 2007]). 흥미롭게도, Fos 면역 반응은 맛좋은 음식 섭취 후 (LHb) (Park and Carr, 1998) 랫트의 외측 및 내측 habenula에서 실제로 감소되었다. 비인간 영장류에서 LHb는 예상되는 보상의 혐오스러운 자극이나 누락으로 활성화되고 맛있는 주스 보상 (Matsumoto and Hikosaka, 2007)의 전달에 의해 억제됩니다. 또한, LHb 활성은 상완 신경 모세 혈관 핵 (RMTg)을 포함하는 간접 경로를 통해 보상 관련 mesoaccumbens 도파민 - 함유 뉴런을 억제한다 (Jhou 등, 2009). 따라서 Habenular activity는 음식 hedonics와 반비례 관계가 있으며, habenular complex가 비 호이 모 식이기에 영향을 줄 수 있음을 시사한다. 사실, LHb의 활성화는 최근에 쥐의 수크로오스 소비를 감소시키는 반면, LHb의 병변은 수 크로스 추구 행동을 증가시키는 것으로 나타났다 (Friedman et al., 2011). habenular complex가 작고 인간을 식별하고 기능적으로 이미지화하는 것을 고려하면 (Salas et al., 2010), 이것이 맛좋은 음식에 반응하여 인간의 이미징 연구에서 habenular activity의 변화가 왜보고되지 않았는지를 설명 할 수 있습니다.
Hedonic Eating을 조절하는 뇌 회로 : Midbrain Dopamine Systems
메조 아쿰 벤스 도파민 경로는 맛 좋은 음식 또는 식욕을 돋우는 음식 관련 단서와 렙틴, 그렐린 및 기타 식욕 조절제에 대한 반응으로 인간과 실험실 동물에서 활성화됩니다. 이것은 중뇌 도파민 시스템이 맛있는 음식 섭취에 중요한 역할을 함을 시사합니다. 중뇌 도파민 전파가 인간의 입맛에 맞는 음식 섭취에 영향을 미친다는 가장 분명한 징후는 중뇌에서 도파민 함유 뉴런의 퇴화가있는 파킨슨 병 (PD) 환자가 영향을받지 않은 개인보다 음식을 덜 소비하는 경향이 있다는 사실 일 것입니다 (Nirenberg 및 Waters, 2006). 더욱이, 도파민 수용체 작용제를 사용한 PD 환자의 치료는 맛있는 음식의 강박적인 소비를 유발할 수 있습니다 ([Dagher and Robbins, 2009] 및 [Nirenberg and Waters, 2006]). 사실, 도파민 수용체 작용제는 비 PD 개체에서도 쾌락 성 과식을 유도 할 수 있습니다 (Cornelius et al., 2010). 동물에서 맛좋은 자당 용액은 NAc (Hernandez and Hoebel, 1988)에서 도파민 전달을 자극하는데, 이는 인간의 뇌 영상 연구와 일치하는 효과입니다 (Small et al., 2003). 고속 스캔 순환 전압 전류 법을 사용하여 수 크로스 보상 전달 또는 예상치 못한 수 크로스 전달을 예측하는 단서가 NAc에서 도파민 전파를 유발하는 것으로 나타났습니다 ([Roitman et al., 2004] 및 [Roitman et al., 2008]). 또한 유해한 퀴닌 용액의 예상치 못한 전달은 반대 효과를 나타내어 accumbal 도파민 전파를 감소시켰다 (Roitman et al., 2008). 마지막으로, 효소 티로신 하이드 록 실라 제 (TH)가 비활성화되어 도파민이 결핍 된 마우스는 여전히 물과 비교하여 수 크로스 (또는 사카린) 용액에 대한 현저한 선호를 보여 주지만 대조군 마우스보다 더 적은 양의 수 크로스를 소비합니다. Cannon and Palmiter, 2003). 이것은 도파민이 부족한 마우스가 여전히 자당 기호성을 감지 할 수 있고 이러한 용액을 물보다 선호하지만 기호성 용액의 소비를 지속 할 수 없음을 시사합니다. 따라서 메조 아쿰 벤스 도파민 전파는 식량 조달과 관련된 섭식 행동의 동기 부여 측면을 조절하고 다른 신경 전달 물질 시스템이 맛있는 음식 소비의 쾌락 적 측면을 조절할 가능성이 높다고 제안되었습니다.
Hedonic Eating을 조절하는 뇌 회로 : Striatohypothalamic Systems
[D-Ala2-N-Me-Phe4-gly-ol5] - 엔케팔린 (DAMGO)와 같은 μ-opioid 수용체 작용제를 NAc에 주입하면 음식에 자유롭게 접근 할 수있는 쥐의 섭식 행동을 자극한다. [Peciña 및 Berridge, 2005] 및 [Zhang 외., 1998]). 반대로, NAc 내로 주입 된 오피오이드 수용체 길항제는 덜 맛있는 대안의 섭취에 영향을주지 않으면서 바람직한 음식의 소비를 감소시킨다 (Kelley 등, 1996). 이러한 데이터는 선조체 오피오이드 시스템이 맛좋은 음식의 쾌락 성을 조절한다는 견해와 일치한다. NAc의 껍질 부위와 특히 내피의 발 염 부위에있는 냉담한 "뜨거운 반점"([Peciña and Berridge, 2005] 및 [Peciña et al., 2006b])은 비 호이 모유 수유에 특히 중요한 역할을합니다. μ-opioid 수용체 활성화가 NAc에서 중간 가시 신경 뉴런 활성을 억제하기 때문에, NAc 쉘은 맛있는 음식 섭취에 강장제 억제 효과를 발휘한다고 제안되었다 (Kelley et al., 2005). 이러한 견해와 일치하여, NAc 쉘에서 억제 성 GABAA 또는 GABAB 수용체 (Basso and Kelley, 1999) 및 Stratford and Kelley, 1997) 또는 흥분성 이온 성 글루타메이트 수용체 (Maldonado-Irizarry et al., 1995)의 자극 음식 소비를 증가시킵니다. 비슷하게, NAc 쉘의 흥분 독성 병변은 또한 음식 섭취를 증가시키고 식량 보상에 대한 민감도를 증가시킨다. (Johnson et al., 1996, Maldonado-Irizarry and Kelley, 1995). 특히, 에너지 밀도가 높은 맛있는 음식의 섭취는 이러한 조작 (Basso and Kelley, 1999), [Kelley et al., 2005] 및 [Zhang et al., 1998]에 의해 우선적으로 촉발된다.
평온 섭식에 대한 accumbal 신호 전달의 주요 영향을 고려할 때 Thompson and Swanson (2010)은 회로 추적 절차를 사용하여 NAc가 맛있는 음식 소비에 영향을 미칠 수있는 정확한 해부학 네트워크를 정확하게 식별했습니다. 이 우아한 연구에서 랫트는 NAc 껍질의 부위에 전이 / 역행 추적자 (COIN이라고 함)를 두 번 겹치지 않게 주사하여 맛있는 음식 섭취에 강력하게 영향을 미치고 구 심 / 원심성 연결이 확인되었습니다. NAc의 수유 관련 부위가 전방 LH와 복부 팔리 덤 (VP) (톰슨과 스완 손, 2010)에 주로 억제 영향을 미치는 것으로 나타났다. VTA에 밀집 해있는 NAc의 나머지와는 달리, NAc 쉘의 음식 관련 쾌락 핫스팟은 IFN (interfascicular nucleus)으로 진행하며, VTA에 인접하여 도파민 작용을 돌연변이 방식으로 연장하는 구조이다. NAc 쉘 (Thompson and Swanson, 2010). 더 나아가, 앞쪽에있는 LH는 LHb (Thompson and Swanson, 2010)에 투영되며, 이는 habenular complex가 음식 기분 변화 (hedonics, Friedman et al., 2011)에서 역할을 할 수 있음을 시사한다.
상기 데이터는 LH가 맛좋은 음식 섭취에 강장제 억제 영향을 미치는 NAc 사이트로부터 현저한 억제 인자를 받았다는 것을 보여준다. LH는 또한 OFC, insula 및 amygdala와 같은 맛있는 음식 (그림 1)을 얻기위한 행동을 조직하고 지시하는 것과 관련된 다른 피질 및 변연 뇌 부위와 기능적으로 연결됩니다. 중요하게, LH의 불활 화는 음식 섭취에 대한 NAc 조작의 자극 효과를 폐지한다 (Maldonado-Irizarry et al., 1995 및 Will et al., 2003). 또한, NAc 껍질의 불 활성화는 Fos 면역 반응 ([Baldo et al., 2004] 및 [Stratford and Kelley, 1999)에 의해 측정 된 바와 같이 신경 펩타이드 하이포크 레틴 (또한 오렉신으로도 알려짐)을 합성하는 LH 뉴런, 특히 LH 뉴런의 활성을 향상시킨다 ]). 실제로 μ-opioid 수용체 작용제 DAMGO를 NAc 껍질에 주입하면 시상 하부에서 hypocretin을 포함하는 뉴런을 활성화시키고 (Zheng et al., 2007), VTA에서 hypocretin 전달의 붕괴는 NAc DAMGO 주입으로 유발되는식이 섭취를 막는다 (Zheng et al., 2007). 따라서 NAc 껍질의 쾌락 열점은 LH 뉴런, 특히 hypocretin 함유 뉴런 (Louis et al., 2010)에 강장제 억제 효과를 발휘하여 맛있은 음식 섭취를 제한한다. 예를 들어 강화 된 opioid 수용체 신호 전달을 통해이 교착 상태의 "정지 신호"가 중단되면식이 조절이 가능한 음식 (그림 2)의 비 정상 항성 섭취를 유도하는 LH 활동이 강화됩니다.
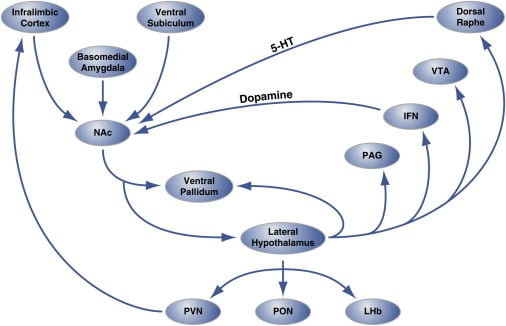
그림 2. Hedonic 먹는 것을 조절하는 핵 조 직 껍질에있는 Hedonic "핫스팟"의 회로 수준 조직
측위 핵 (NAc)의 껍질 부위는 대뇌 피질 및 변연 뇌 부위에서 신경 분포를 받아 시상 하부 및 복부 팔리 덤쪽으로 돌출합니다. 차례로 측면 시상 하부 또한 복부 pallidum 및 PAG, IFN, VTA 및 등쪽 raphe 핵에 투사됩니다. IFN과 등쪽 연골은 도파민 성 및 세로토닌 성 돌연변이를 각각 NAc로 확장시킵니다. 측면 시상 하부는 또한 시상 (PVN 및 PON) 및 에피 타 라믹 (LHb) 구조를 자극한다. 외 시상 하부에서 중격 뇌 영역으로의 작은 돌기는 보이지 않습니다. 5-HT, 세로토닌; IFN, 계간 핵; LHb, 외측 habenula; PON, 수술 전 핵; PVN, 시상의 방실 핵; VTA, 복부 tegmental 영역. 그림은 톰슨과 스완슨 (2010)의 허락을 받아 수정되었습니다.
Hedonic Eating을 조절하는 뇌 회로 : Striatopallidal Systems
LH 외에도 NAc 쉘 뉴런도 VP (그림 2)에 투사합니다. 흥미로운 일련의 실험에서, VP와 LH에 대한 측부 돌출부가 비 호이 모식이의 해리 양상을 조절할 수 있다는 것이 밝혀졌다 (Smith and Berridge, 2007). NAc 셸 또는 VP에 대한 DAMGO 주입은 쥐의 반응 (예 : 기호성 반응)과 음식 섭취 증가 (Smith and Berridge, 2007)를 반영하기 위해 가정 된 자당 용액에 대한 orofacial 반응을 증가 시켰습니다. naloxone을 NAc 나 VP에 주입하면 수유에 대한 얼굴 선호 반응이 감소되어 NAc와 VP의 동기화 된 아편 유사 물질 전달이 정보 관련 식품 기호성을 처리하는 데 필요하다는 것을 알 수있다. 그러나, NAc에 주입 된 나일로 존은 비 호이 모식 식사를 감소 시켰고 (NAnx), 비 호이스트식이가 NAc → VP 연결성과 무관하게 발생하고 대신 NAc → LH 경로에 의존 할 가능성이 있음을 시사했다 (Smith and Berridge, 2007). Berridge, 2007] 및 [Taha 외., 2009]). nonhomeostatic 먹는 것의 측면이 분리 될 수 있다는 개념과 일치하여 단일 단위 기록은 NAc 뉴런 집단이 음식의 상대적 강화 특성 (즉, 기호성)과 관련된 정보를 선택적으로 인코딩하는 것으로 나타났습니다 (Taha and Fields, 2005) . 동일한 래트에서, NAc 뉴런의 두 번째 개체군에서의 활동 변화는 먹이 행동의 시작과 일치하는 것처럼 보였다 (Taha and Fields, 2005).
Hedonic Eating을 조절하는 뇌 회로 : Amygdalar Systems
nonhomeostatic 식사의 양상이 해리 될 수 있다는 개념을 뒷받침하고, NAc 껍질이나 부사장으로의 나 로크 옥시 주입 (basalateral amygdala (BLA)이 아닌)은 자당 용액의 맛을 감소시켰다 (Wassum et al., 2009). 그러나 μ- 오피오이드 수용체 길항제 나 로크 론이나 CTOP가 BLA에는 주입되었지만 NAc 쉘이나 VP에는 주입되지 않았을 때 배고픈 상태에서 전형적으로 볼 수있는 자당 용액에 대한 반응에 대한 동기 부여가 현저히 감소했다 (Wassum et al ., 2011] 및 [Wassum et al., 2009]). 이는 자당의 인센티브 (incentive) 특성이 편도체 (amygdalar) 회로에 의해 규제된다는 것을 시사한다. 전반적으로 위의 결과는 식욕을 풍기는 음식에 대한 정보 처리와 같은 쾌락 적 식습의 다양한 측면이 배고픈 동물의 자극적 인 음식의 인센티브 가치의 증가가 개별적인 미세 회로에 의해 차별적으로 규제된다는 것을 보여준다. 더 큰 corticolimbic-striatopallidal-hypothalamic-thalamocortical 회로 (그림 2).
두뇌 헤 도닉 회로의 적응이 강박 적 식사를 유도합니까?
NAc 쉘에서의 쾌락 핫스팟의 기능적 관련성과 뇌의 더 넓은 먹이 관련 회로에 대한 영향이 Kelley et al. (2005). 그들은 상류와 하류의 조절 뇌 영역 (그림 2)과 함께 NAc 셸 → LH 경로가 "센티넬"목적 (Kelley 외, 2005)을 제공한다고 가정합니다. 특히, 그들은 배고픈 동물 에서조차 먹을 거리가 강할 때 환경으로부터의 위협에 대비하여 먹이 행동을 중단 할 수있는 능력을 유지해야한다고 제안합니다 (Kelley et al., 2005). 이와 같이, NAc 껍질 뉴런의 활성화 및 LH 뉴런의 동시 억제는 계속적인 급식을 방해 할 수 있으며, 동결 또는 탈출과 같은보다 적절한 적응 반응으로 행동의 전환을 촉진시킬 수있다 (Kelley 등, 2005). 이것이 사실이라면이 NAc 껍질 → LH 조절 경로가 맛좋은 음식의 과다 섭취에 의해 또는 비만에 취약한 유전 적 요인에 의해 손상되는지 여부를 조사하는 것이 중요 할 것이다. 이러한 사실을 염두에두고 연구실과 다른 연구자들은 맛좋은 칼로리 밀도가 높은 식품의 과소 섭취가 쥐의 강박제 섭식 행동의 출현과 관련이 있다고보고했다 (Johnson and Kenny, 2010, Latagliata 외., 2010). [Oswald et al., 2010]). 구체적으로, 우리는 뚱뚱한 쥐의 맛있는 음식 섭취가 부정적 결과 (전기 발걸음)를 예측하는 혐오적인 조건 자극에 의한 방해에 저항한다는 것을 발견했다 (Johnson and Kenny, 2010). 따라서 과식과 과식에 의해 유발 된 NAC 껍질 → LH 조절 경로의 결손이 과체중 및 비만인이 자신의 정상적인 행동의 유해한 결과에 관한 정보를 활용하여 식량 섭취를 완화시키는 데 실패했는지 여부를 부분적으로 시험하는 것이 중요 할 것이다 .
비만의 두뇌 보상 활동 변화 : 인간 뇌 영상 검사
뇌 보상 시스템에 맛있는 음식의 자극 효과를 얻는 것은 과식에 기여하는 중요한 동기 부여 요소로 간주됩니다. 따라서 중요한 질문은 두뇌 보상 기능의 변화가 비만의 발달에 기여하는지 여부이다. 직관적 인 예측은 맛있는 음식에 대한 뇌 보상 시스템의 향상된 구성적인 반응이 과식과 체중 증가를 초래한다는 것입니다. 이 가설과 일치하여, 특성 보상 수준이 높은 사람들은 초콜릿 케이크와 피자와 같은 맛있는 음식에 노출되면 NAc, 편도선, OFC 및 VP를 비롯한 음식 보상에 연루된 뇌 영역의 활동이 향상되었다 (Beaver et al. , 2006). 뚱뚱한 사람들은 마찬가지로 린 컨트롤 (Gautier et al., 2000), [Karhunen et al., 1997], [Rothemund et al., 2007]과 비교하여 맛있은 음식이나 음식 관련 신호에 반응하여 뇌 보상 회로의 활성화가 증가하는 것을 보여줍니다. ]). 특성 보상 감도의 높은 수준은 또한 인간 피험자 (Davis et al., 2004)와 [Franken and Muris, 2005]의 체중 증가와 상관 관계가 있었다. 그러나 중요한 것은 비만 여성 (BMI> 30)이 과체중 여성 (BMI> 25 <30)보다 더 높은 수준의 무감각증 (즉, 보상에 대한 기준 민감도 감소)을 나타 냈습니다 (Davis et al., 2004). 유사하게, Stice와 동료 (2008b)는 비만 한 청소년 소녀가 희박한 대조군과 비교하여 맛있은 음식이나 음식 관련 신호에 반응하여 insula와 다른 피질의 뇌 영역의 활성화를 증가 시켰지만, striatum은 비만 환자에서 BMI와 역 상관 관계가 있었다. 더욱이 6 개월 동안 체중이 증가한 여성은 체중이 증가하지 않은 여성에 비해이 기간 동안 맛있는 음식에 반응하여 선조체 활동이 현저히 감소했다 (Stice et al., 2010a). 이 모든 것을 종합 해 볼 때 보상 회로의 과민 반응은 개인에게 과식과 체중 증가의 원인이 될 수 있습니다 (Stice et al., 2010b). 그러나 체중 증가가 증가하면 뇌 보상 시스템의 특정 구성 요소, 특히 선조체의 활동에 적자가 발생하기 시작할 수 있습니다. 보상 상실감의이 상태의 출현은 그러한 보상 적자를 극복하기 위해 맛있는 음식의 과소 섭취를 영속시킬 수 있다고 제안되어왔다 (Stice et al., 2008a and [Wang et al., 2002]). 따라서 너무 적거나 너무 많은 음식 보상은 과식과 비만에 대한 취약성을 증가시키는 것으로 보인다 (Stoeckel, 2010). 이러한 명백하게 반대되는 견해를 조화시키기위한 매력적인 개념적 틀은 식량 보상을 얻고 예상되는 미래의 식량 보상에 대한 예측을하는 행동을 조직화하는 것과 관련된 피질 대체 운동 영역이 과체중 인 사람과 비만이있는 사람들에게 과민 반응을 일으킬 수 있다는 것입니다. 반대로, 쾌락의 쾌락의 경험을 실제적으로 처리하는 선조체 뇌 부위는 동일한 개인에서 점차 기능이 저하 될 수 있습니다. 따라서 맛있은 음식의 상대적 동기 부여 가치는 비만 발병 기간 동안 증가 할 것으로 예상되며, 동시에 맛좋은 음식 섭취로 얻는 쾌락 가치가 감소합니다.
비만의 두뇌 보상 활동 변화 : 설치류 연구
맛있는 음식 섭취가 뇌 보상 시스템에 미치는 영향은 뇌 자극 보상 (BSR) 절차를 사용하여 실험 동물에서 직접 평가되었습니다. accumbal hedonic hot spot (그림 2)에서 강장제 억제 입력을받는 LH의 전기적 자극은 매우 보람이 있으며 쥐는 뇌 영역을 자기 자극하기 위해 열심히 노력할 것입니다 (Markou and Frank, 1987 ). 자기 자극 행동을 지원하는 것 외에도, LH의 전기적 자극은 급식 행동 (Margules and Olds, 1962)의 강렬한 발작을 유도 할 수 있으며, LH 자극의 보람있는 성질은 이것의 내재적 역할과 관련이있을 수 있다고 제안되어왔다 음식의 유혹적이고 유인적인 성질의 두뇌 사이트 (Margules and Olds, 1962). 배고픔과 체중 감량은 쥐가 LH 자기 자극 (Blundell and Herberg, 1968), Carr and Simon, 1984, Margules and Olds, 1962)에 대한 감도를 증가시킨다. 이는 렙틴의 뇌 실내 주입에 의해 차단 될 수있다 (Fulton et al., 2000). 반대로, LH의 전기적 자기 자극은 사육 된 동물에서 억제된다 (Wilkinson and Peele, 1962). 실제로 위장관 (Hoebel and Teitelbaum, 1962), 위 팽창 또는 식후 포만을 흉내내는 정맥 내 글루카곤 주입 (Hoebel and Balagura, 1969)과 [Mount and Hoebel, 1967] ), 모두 LH 자극에 대한 반응을 약화시킵니다. 사실, 이전에 LH 자극을 보람있게 반응시킨 쥐들은이 자극이 음식물 섭취 나 비만 발달 후에는 혐오 스럽다고 반응합니다 (Hoebel and Thompson, 1967). 따라서 만성적 음식 제한과 체중 감량은 과다 섭취가 감소하는 반면 LH의 보상 관련 사이트의 민감도는 향상됩니다. 따라서 전기 자기 자극에 대한 LH 뉴런의 민감성은 음식에 대한 쾌락 적 반응을 조절하는 뇌 회로의 기능에 대한 중요한 통찰력을 제공 할 수 있습니다.
에너지 밀도가 높은 음식물에 쉽게 접근 할 수 있고 결과적으로 과량 섭취하는 것이 비만에 기여하는 주요 환경 요인으로 간주되므로 (Volkow and Wise, 2005), 우리 연구소는 최근 BSR 절차를 활용하여 쥐의 뇌에 대한 보상 활동을 평가했다. . 특히 우리는 맛있는 음식에 매일 자유롭게 접근 할 수있는 쥐에게 LH의 전기적 자극에 대한 반응을 기록했다. 18-23 시간과 결합하여식이 요법에 매일 접근했다. 이 다이어트는 치즈 케이크, 베이컨, 소시지 및 기타 식욕을 자극하는 식품 (Johnson and Kenny, 2010)으로 구성되었습니다. 우리는 맛있은 음식에 대한 접근성이 더 큰 쥐가 빠르게 상당한 체중을 얻었으며 뇌의 보상 적자가 점차적으로 악화되었음을 알게되었습니다. (존슨 앤 케니, 2010, Figure 3). 이것은식이 요법으로 유발 된 비만의 발달이 LH (Johnson and Kenny, 2010)에서 보상 사이트의 반응성이 점진적으로 감소하는 것과 관련이 있음을 나타냅니다. 보상 신호의 결함은 청소년기에 자당이나 고지방 음식에 무제한으로 접근 할 수 있었던 성인 쥐에서도보고되었다 (Teegarden et al., 2009, Vendruscolo et al., 2010a and Vendruscolo et al. 2010b]). 랫트에서의 이러한 효과는 6 개월 동안 체중을 얻었을 때 인간 피험자에서 위에 기술 된 식량 보상에 대한 반응으로 감소 된 선조체 활성화를 연상시킨다 (Stice et al., 2010a, 그림 4 참조). 과체중 인 랫트 및 아마도 체중이 증가하는 사람의식이 요법으로 인한 보상 적자는 식량 보상 회로에서 대용적인 반응을 반영 할 가능성이있다 (Johnson and Kenny, 2010). 이 발견의 중요한 측면은 코카인이나 헤로인을 과잉 섭취 한 쥐에서도 보상 기능의 유사한 결손이 검출된다는 것이다 (Ahmed et al., 2002, Kenny et al., 2006, Markou and Koob, 1991); 그림 3). 실제로, 약에 의해 유도 된 보상 기능 장애는 지속적인 감소 된 보상 상태를 완화하기 위해 약물을 소비 할 동기 부여의 새로운 원천을 제공함으로써 통제 된 약물 사용으로부터 통제되지 않은 약물 사용으로의 전환에 기여할 수 있다는 가설을 세웠다 (Ahmed and Koob , 2005]와 [Koob and Le Moal, 2008]). 따라서 과식에 의해 유도 된 LH에서 보상 부위 감수성의 결핍은 과도한 체중을 가진 음식에 대한식이 선호를 음의 지속 상태를 완화시키기 위해 과체중 인 래트에서 식용 가능한 음식 섭취의 장기 지속성을 증가시킬 수있다 보상.
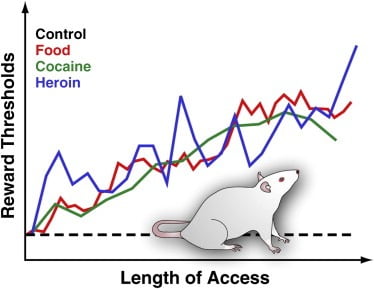
그림 3. Palatable 음식, 코카인, 또는 헤로인에 매일 연장 액세스와 쥐의 한계 값 보상
보상 임계 값을 측정하기 위해 자극 전극을 외과 적으로 전기 자극이 강력하게 보람을 느끼며 급식 행동의 강렬한 발작을 유발할 수있는 쥐의 시상 하부에 이식합니다. 회복 후, 동물은 바퀴를 돌려서이 부위를 스스로 자극 할 수 있습니다. 안정된 자기 자극 행동이 확립 된 후, 자기 자극 행동을 유지하는 최소 자극 강도가 결정됩니다 (즉, 보상 임계 값). 이 보상 기준 액은 보상 시스템 활동의 운영 측정치를 제공합니다. 보상 한계점은 표준 실험실 음식에 접근 할 수있는 약 쥐 에게서도 안정적이며 변화가 없으며 마약에 노출되어 있지 않습니다. 그러나 맛있는 음식 품목 (예 : 치즈 케이크, 베이컨, 초콜릿 등)으로 구성된 에너지 밀도가 높은식이 요법 식 식단을 하루 종일 이용할 경우 쥐에서 한계점이 점차 높아집니다. 마찬가지로 정맥 내 코카인이나 헤로인 주입에 매일 접근하는 쥐에서 보상 한계점이 점차 증가했다. 높은 보상 임계 값은 뇌 보상 시스템의 감도 감소를 반영하여 해석됩니다. 이러한 효과는 맛있은 음식의 과량 섭취와 관련 체중 증가가 중독성 약물의 과도한 섭취에 의해 유도 된 것과 유사한 뇌 보상에 심한 결핍을 유도 할 수 있음을 시사한다
그림 4. 성체 가소성은 체질량 지수 (fMRI)로 측정 한식이 성 음식에 대한 선조체 활성화의 감소와 인간의 선조체 도파민 D2 수용체 (D2R) 이용 가능성의 감소와 관련이 있습니다 (자세한 내용은 본문 참조).
비만 한 도파민 D2 수용체 신호 결핍
몇몇 최근의 보고서는 비만이 발달하는 동안 맛있은 음식의 과량 섭취에 대응하여 보상 적자가 나타날 수있는 잠재적 메커니즘을 밝혀 냈습니다. 위에서 언급했듯이, 6 개월 동안 체중을 얻은 여성은 체중이 증가하지 않은 여성에 비해이 기간 동안 맛있는 음식에 대한 응답으로 선조체 활동이 현저하게 감소했습니다 (Stice et al., 2010a, Figure 4). 식욕을 돋우는 사람들이 좋아하는 식사를하도록 허용 된 사람들은 선조체에서 도파민 D2 수용체 (D2R) 길항제 raclopride의 결합 수준이 낮았으며 (Small et al., 2003), D2R 신호가 맛있는 음식 섭취에 반응하여 감소한다는 것을 암시한다. 사실, 비만인은 희박한 대조군 (Barnard et al., 2), [Stice et al., 2009a] 및 [Wang et al., 2008]과 비교하여 선천성 D2001R 유용성이 낮 으면서 체중 감소 는 비만 환자에서 선조체 D4R 밀도의 증가와 관련이있다 (Wang et al., 2). 선조체 도파민 전달이 쾌락 섭식을 조절하는데 핵심적인 역할을한다는 것을 고려하면, D2R 신호의 적응성 감소는 비만인 개인의 맛있는 음식에 대한 줄무늬의 반응성 감소에 기여할 수있다. 이 가능성을 시험하기 위해, Small과 동료들은 대조 개인과 TaqIA A1 대립 유전자 (Felsted et al., 2010)를 보유하고있는 사람들의 입맛에 맞는 밀크 셰이크에 대한 반응으로 뇌 보상 회로에서의 활동을 조사했습니다. TaqIA 제한 단편 길이 다형성은 D2R 유전자 (Neville et al., 2004)의 하류에 있으며 다형성의 A1 대립 유전자를 지닌 개체는 대립 유전자가없는 개체들에 비해 30 % -40 % 적은 선조체 D2R을 갖는다 (Jonson 1999], [Ritchie and Noble, 2003] 및 [Stice et al., 2010b]). 또한, A1 대립 유전자 운반자는 식품에 대한 쾌락 성 반응과 관련된 선조체 및 피질 두뇌 영역에서 포도당 대사를 감소시켰다 (Jönsson et al., 1999). TaqIA A1 대립 유전자를 가진 개체는 비만 인구에서 과장되어있다 (Barnard et al., 2009, Stice et al., 2008a and [Wang et al., 2001]). 또한 A1 대립 유전자는 알코올, 오피오이드 및 정신 운동 자극제 중독에 대한 취약성을 증가시킨다 (Lawford et al., 2000, Noble et al., 1993 및 Noble et al., 2000). striatum에 dopaminergic 입력을 제공하는 VTA 및 SN을 포함하는 중뇌 영역이 대조군에서 맛이 좋은 밀크 쉐이크에 반응하여 활성화된다는 것이 발견되었다 (Felsted 등, 2010). 반대로, 이러한 뇌 부위의 활동은 실제로 A1 대립 유전자 운반자 (Felsted et al., 2010)의 음식 보상에 반응하여 감소되었다. 시냅스 및 피질 뇌 부위에서도 A1 allelic carrier와 noncarriers 사이의 뇌 활성화에서 유사한 역 반응이 검출되었다 (Felsted et al., 2010). 이러한 데이터는 맛좋은 음식에 대한 중간 태아 반응에 대한 조절에서 D2Rs의 주요 역할과 매우 일치합니다. Stice와 동료 (2008a)는 인간 환자에서 맛있는 초콜렛 밀크 셰이크에 반응하여 BMI와 striatum (caudate 및 putamen)의 활성화간에 역 상관 관계를 발견했습니다. 또한,이 역관계는 TaqIA A1 대립 유전자 (Stice et al., 2008a)가있는 개체에서 가장 뚜렷했습니다. 초기 뇌 이미징 후 1 년 동안 측정 된 이들 개인의 향후 체중 증가는 맛있은 음식에 대한 선조체 활성화의 정도가 A1 대립 유전자를 가진 피험자의 체중 증가와 음의 상관 관계가 있고 A1이 아닌 대립 유전자 피험자에서 양의 상관 관계가 있음을 보여주었습니다 Stice et al., 2008a). 추적 관찰 연구에서 A1 대립 유전자를 가진 피험자에서 실제 음식 섭취량과 상반되는 맛있는 음식 섭취에 대한 선조체 활성화의 양은 다음 해에 비해 체중 증가와 반비례 관계가 있다는 것이 긍정적으로보고되었다 비 A1 대립 형질 피험자 (Stice et al., 2010b)에서 상관 관계가있다. 이러한 결과는 D2R이 맛있은 음식물에 대한 선조체 반응성을 조절하고 체중 증가 또는 유전 적 요인에 의해 유발 된 D2R 신호의 감소가 비만에 대한 취약성을 증가시킬 수 있음을 시사한다.
D2R 시그널링 결함으로 비만에서 결점 보충에 기여
비만 한 대상자에서 하향 조절 된 선조체 D2R 수준과 유사하게 D2R 수준은 맛이 좋은식이를 섭취 한 생쥐와 쥐에서 또한 낮아진다 (Colantuoni et al., 2001, Geiger et al., 2009 및 Johnson and Kenny , 2010]) 및 비만에 유전 학적으로 잘 적응한 쥐에서 (Zucker rats) (Thanos et al., 2008). 우리 연구실은 일반적으로 손상된 선조체 도파민 전달에 대한 역할을 직접 조사했으며 D2R 신호 전달은 특히 비만 발달 동안 중독과 같은 보상 적자에서 감소했습니다 (그림 5 참조). 특히 우리는 바이러스 성 매개 RNA 간섭을 사용하여 쥐에서 선조체 D2Rs의 발현을 감소시키는 효과를 시험 한 다음, 쥐가 단지 고지에 18-23 시간과 결합하여 초우 또는 초에 접근 할 때 BSR 역치를 평가했다 다이어트 (즉, 카페테리아 식단) (Johnson and Kenny, 2010). 우리는 보충 LH 자극에 대한 반응이 D2R knockdown 쥐 (Canneteria diet)에 노출되면 거의 즉시 감소하기 시작한다는 것을 발견했다 (Johnson and Kenny, 2010, Figure 5). 선조체 D2R 수준의 감소는 따라서 매우 맛있은 음식에 대한 접근성이 확장 된 쥐에서 보상 기능 장애의 출현을 빠르게 가속화하는데, 이는 일반적으로식이 요법으로의 확장 된 접근으로 대조군 쥐에서 나타나는 데 수주가 걸리는 과정이다. 그러나 뇌에 접근 할 수있는 선조체 D2Rs의 넉다운 만 보충 LH 자극에 대한 반응을 변화시키지 않았으며, 뇌척수염 D2R 신호가 뇌의 보상 회로에서 다른식이 유도 성 적응 반응과 상호 작용하여 감 상 감작을 유발했다. 낮추어 진 D2R 수준 이외에, 선조체 도파민 성 전달의 다른 양상은 또한 뚱뚱한 쥐의 두뇌에서 바뀐다. 예를 들어, Sprague-Dawley 래트는 체중 증가에 저항성이있는 래트 (비만 저항성 래트)보다 고 에너지식이 (비만 경향이있는 래트)에서 급속히 체중 증가를위한 선택도를 자란다. al., 2008, Rada et al., 2010 참조). 비만 경향이있는 쥐도 도파민 생합성 및 저장 기계의 수준이 감소하여 도파민의 생산과 방출에 실패하면 뚱뚱한 쥐의 도파민 도파민 전달 장애를 일으킨다 (Geiger et al., 2008). 맛있은 고 에너지식이의 과다 섭취를 통해 비만을 일으킨 쥐들도 표준 ow에만 접근 할 수있는 쥐와 비교하여 NAc에서 낮은 기저와 도파민 수치를 보였다 (Davis et al., 2008). [Geiger et al. 2009]). 중요한 밥의 식사는 대조 쥐의 NAc에서 도파민 수치를 증가시키기에 충분했지만 맛이 좋은 음식에 대한 접근성이 높은 뚱뚱한 쥐에서는 고도의 맛이 좋은 음식물 만이 족저 도파민 방출을 유발하기에 충분했다 (가이거 (Geiger) 등, 2009). 이러한 결과는 쥐에서 비만의 발달이 중간 선조체 도파민 전달에서 역기능과 관련되어 있음을 보여 주며, 선조체 D2R에서 가장 두드러지게 나타나며, D2R 신호 결핍은 쥐의 비만 발생시 보상 적자의 출현에 기여한다. 이는 선조체 D2R의 하향 조절이 인간의 체중 증가에 대한 주목할만한 신경 적응 반응이며 (Barnard et al., 2009), [Stice et al., 2008a] 및 [Wang et al., 2001] 결핍 된 선조체 D2R 신호 전달은 인간 피험자의 쾌락 식품에 대한 선조체 반응을 둔화시켜 향후 체중 증가로 이어질 수있다 (Stice et al., 2008a and [Wang et al., 2001]).
그림 5. D2 도파민 수용체, 보상 기능 장애 및 비만의 강박성 – 쥐 선조체의 도파민 D2 수용체 (D2R) 녹다운은 맛 좋은 음식에 대한 접근이 확장 된 쥐에서 보상 기능 장애 및 강박 적 식사의 출현을 가속화합니다..
D2R 신호가 부족하면 비만에서 강박 적 식사가 유발 될 수 있습니다
비만은 지나치게 과도한 소비로 인한 심한 부정적 건강 및 사회적 결과에 대한 소비와 지식을 제한하려는 욕구에도 불구하고 과식에 의해 특징 지워진다 (Booth et al., 2008, Delin et al., 1997 and Puhl et al., 2008]). 이것은 많은 비만 환자들이 체중 조절을 위해 잠재적으로 위험한 bariatric (위 우회술) 수술을받을 것이고 (Yurcisin 외., 2009), 수술이 주관적인 등급의 굶주림을 감소 시키더라도 과식으로 재발하는 경우가 많으며 (Kalarchian et al., 2002)와 [Saunders, 2001]). 마약 중독은 잠재적으로 치명적인 건강, 사회적 또는 재정적 결과 (DSM-IV, 미국 정신 의학 협회, 1994)에 대한 인식에도 불구하고 마약 소비에 대한 억제 통제의 상실과 습관의 지속성과 유사하게 정의됩니다. 따라서 비만과 마약 중독은 유해한 대안 행동의 유용성에도 불구하고 소비를 완화하고 소비를 지속시키기 위해 미래의 유해한 결과에 관한 정보를 사용하는 것이 현저하게 실패한다는 점에서 강박 장애의 특징을 공유합니다.
강박 적 약물 복용은 설치류에서 처벌을 예측하는 환경 적 자극이나 징벌에 의한 억제에 저항하는 소비로 운영되고있다 (Pelloux et al., 2007, and Vanderschuren and Everitt, 2004). 코카인과 다른 약물 남용에 대한 장기간의 접근은 쥐 ([Ahmed and Koob, 1998], [Deroche-Gamonet 외, 2004], [Vanderschuren and Everitt, 2004])의 강박적인 약물 복용 행동의 출현을 유도 할 수있다. ). 사실, 광범위한 코카인 소비의 역사를 가진 쥐는 부정적인 결과 (예를 들어, 험악한 발걸음의 전달을 예언하는 신호등)를 예측하는 혐오 상태 자극 (CS)에 의한 방해에 저항하는 섭취량을 나타낸다 [Belin et al., 2008] 와 [Vanderschuren and Everitt, 2004]). 반대로, 동일한 혐오성 CS는 약물에 대한 접근이 비교적 제한적인 래트에서 약물 탐색 반응을 심하게 감소시킬 수 있습니다. 중독에서의 약물 사용과 비만에서의 과식과의 유사점을 고려하여, 우리는 최근 비만 한 쥐가 강렬한 방식으로 맛있은 음식을 섭취하는지, 선조체 인 D2R이이 과정에서 역할을하는지 조사했다 (Johnson and Kenny, 2010). 우리는 쇠약해진 발걸음의 전달을 예측하는 유해 CS (가벼운 신호)가있는 곳에서도 맛있은 음식에 대한 접근성이 확장 된 뚱뚱한 생쥐가 맛있는 음식을 계속 먹는 것을 발견했습니다 (Johnson and Kenny, 2010). 대조적으로, 동일한 혐오성 CS는 에너지 밀도가 높은 맛있는 음식에 매우 제한된 노출을 가진 희박한 쥐에서 맛있는 음식 섭취를 방해했다. 식욕을 동반 한 음식 섭취는 코카인 섭취가 강박 할 수있는 것과 거의 같은 방식으로 비만 한 쥐에게 강박 관념이 될 수 있습니다. 이 데이터의 해석과 일관되게 이전에 맛이 좋은 고지방식이 요법에 접근했던 쥐들은 이전에식이 요법 경험이 없었던 쥐들보다 맛이 좋은 음식을 얻기 위해 혐오적인 환경에서 (밝은 조명으로) 더 많은 시간을 보냈다 (Teegarden and Bale , 2007). 포식에 대한 두려움 때문에, 밝게 불이 켜진 열린 경기장은 쥐에게 매우 혐오 적이다 (Suarez and Gallup, 1981). 따라서 마우스는 먹이를 먹는 행동의 잠재적 인 부정적인 결과에 내성을 갖게되고 훨씬 낮은 위험에 처해질 가능성이 적은 음식을 먹을 수있을지라도 맛있는 음식을 얻기위한 포식의 위험에 처하게됩니다.
흥미롭게도, 맛이있는 음식 (Stice et al., 1a)에 대한 반응으로 선조체 D2R 밀도 (Noble, 2000) 및 둔화 된 선조체 활성화를 초래하는 TaqIA 다형성의 A2008 대립 유전자는 또한 부정적인 결과 (Klein et al., 2007). 비만 한 사람들의 강박식이의 발달에 기여할 수있는 과식의 미래 부정적인 결과와 관련된 정보를 활용하는 것은 정확하게이 유형의 실패입니다. 우리는 맛좋은 음식에 접근 할 수있는 쥐에서의 강박 유사 식사의 출현이 striatal D2R knockdown (Johnson and Kenny, 2010)에 이어 극적으로 가속화된다는 것을 발견했다. 실제로, 선천성 D2R knockdown을 가진 쥐들은 이전에 14 일 동안 에너지가 풍부한 맛이 좋은 음식에 오래 동안 접근했을 때 혐오적인 CS에 의한 방해에 저항력이있는 맛있는 음식 섭취를 보였습니다 (Johnson and Kenny, 2010, Figure 5). 그러나, 맛있은 음식에 대한 제한된 노출의 14 일 기간은 통제 쥐 (Johnson and Kenny, 2010)에서 강제적 인 식사를 유도하기에 충분하지 않았습니다. 이러한 결과는 비만인 쥐에서 중독성 음식물을 강박 적으로 섭취 할 수 있음을 시사한다. 더욱이, 식욕을 돋우는 음식 과잉 섭취에 대한 보상 감각의 출현을 가속화시키는 선조체 결핍 D2R 신호 전달은 강박과 같은식이 요법의 출현을 가속화한다 (그림 5).
D2Rs와 비만의 에너지 균형의 호르몬 조절제 사이의 상호 작용
VTA에 투여 된 외인성 렙틴은 mesoaccumbens 도파민 전달 및 급식 행동을 억제한다 (Hommel et al., 2006 및 Krügel et al., 2003). 중뇌 도파민 시스템에 대한 급성 억제 효과 외에도 강장제 렙틴 신호가 중간 수준의 도파민 신호 전달의 적절한 수준을 유지하는 데 필요할 수도 있다는 축적 된 증거가있다. Flier와 동료들은 ob / ob 마우스가 도파민의 생합성에서 주요 효소 인 중뇌의 도파민 뉴런에서 티로신 하이드 록실 라제의 수준을 낮춘다는 것을 발견했다 (Fulton et al., 2006). 또한 ob / ob 마우스는 NAc (Fulton 등, 2006) 로의 도파민 방출을 감소 시켰고 VTA 및 SN (Roseberry 등, 2007)에서는 도파민의 somatodendritic vesicular 매장을 감소시켰다. ob / ob 마우스의 도파민 생산 및 신호 전달 장치의 결함은 leptin (Fulton et al., 2006) 및 [Pfaffly et al., 2010]을 사용한 치료로 교정되었다. 실제로, LH에만 주입 된 leptin은 ob / ob 마우스에서 기능 장애가있는 도파민 전달을 교정하기에 충분했으며 (Leinninger et al., 2009), LH에서 leptin 수용체를 발현하는 세포가 적절한 수준의 도파민 신호를 유지한다고 제안했습니다. ob / ob 마우스는 도파민의 생성 및 방출이 감소됨에 따라 striatum에서 D2R 발현 수준이 낮아지는 경향이 있었다 (Pfaffly et al., 2010). 더욱이, 렙틴 신호에 대한 무감각 (즉, 렙틴 내성)을 일으키는 요법에 따른 외인성 렙틴 치료는 야생형 마우스에서 선조체 D2R 수준을 현저히 낮추었다 (Pfaffly et al., 2010). 비만 한 랫트는 VTA에서 leptin 내성을 보이며 (VAS에서 TH의 낮은 수치, striatum에서의 도파민 방출의 감소, 선조체 D2011R 수치의 감소 가이거 (Matarny et al., 2010) 및 Scarpace et al., 2) et al., 2008). 종합적으로 말하자면, 이러한 데이터는 렙틴이 중뇌 도파민 시스템에 복잡한 작용을한다는 것을 입증합니다. 한편, VTA에서 leptin 수용체의 급성 활성화는 mesoaccumbens dopamine transmission에 대한 억제 효과를 나타내며 수유 거동을 억제 할 수있다 (Hommel et al., 2006, and Krügel et al., 2003). 반면에, 중뇌에서의 렙틴 신호는 적절한 도파민 생산 및 신호 전달을 유지하는데 필요하며, 렙틴 신호의 유전 적 결핍 또는 비만에서의 렙틴 내성의 발달은 중등도의 도파민 시스템을 심각하게 파괴시킨다. 이와 같이 중성 지방의 도파민 성 신경 세포에서 렙틴 저항성의 발달이 중독과 같은 보상 기능 장애 및 강박적인 과식의 출현을 유도하는 선조체 D2R 신호 전달의 중추적 인 역할을 할 수 있다는 것은 흥미로운 가능성이다. (그림 5) 비만 쥐.
mesestriatal dopaminergic transmission에 leptin 신호 전달의 복잡한 효과 외에도, D2Rs가 leptin signaling을 조절할 수 있다는 증거가 축적되고있다. D2R agonist bromocriptine은 leptin의 순환 수준을 감소 시키며 (D2002), [Kok et al., 2006] 및 [Mastronardi et al., 2001], 이는 D2R이 렙틴 수준에 억제 영향을 미친다는 것을 시사한다. 또한 D2R 유전자에서 돌연변이가없는 생쥐는 시상 하부에서 렙틴 신호 전달을 강화 시켰으며 렙틴의 식욕 부진 효과에 더 민감했다 (Kim et al., 2010). 비만이 진행되는 동안 (렙틴 수치가 증가 함) 잘 알려져 있지만 렙틴 신호에 대한 민감도 (즉, 렙틴 내성)가 동시에 감소합니다 (Hamilton et al., 1995). 따라서 비만 발병 기간 동안 선조체 D2R 신호 전달의 감소가 맛있는 음식물의 과다 섭취에 대한 보상 반응을 나타내며 렙틴 저항성의 발달을 극복하기 위해 신호 전달 효율을 증가시키는 흥미로운 가능성이있다. 이러한 작용은 맛있은 음식 (Farooqi et al., 2007), [Fulton et al., 2006] 및 [Hommel et al., 2006]에 대한 반응성을 조절하는 선조체 시스템에 대한 leptin의 억제 효과를 향상 시켜서 맛좋은 음식에 대한 쾌락 적 반응을 약화시킨다. 이 발견을 위에 기술 된 D2R에 대한 leptin의 규제 역할과 함께 넣으면 leptin과 D2R 신호가 먹이 행동의 항상성과 쾌락 적 측면을 조절하는 상호 방식으로 결합 될 것으로 보인다.
비만에서의 조절되지 않은 뇌 스트레스 시스템
중뇌에서의 렙틴 신호는 mesoaccumbens dopamine 전달과 쾌락 식품에 대한 반응을 조절하는 역할을합니다. 그러나 Leptin 수용체를 발현하는 VTA의 신경 세포는 NAc에 드문 드문하게 돌출하여 편도선의 중심핵 (Leshan et al., 2010)의 중심 핵에 더 돌출되어있다. 섭식 행동의 맥락에서, CeA는 음식 섭취에 대한 유해한 환경 자극의 억제 효과를 조절하는 것으로 알려져있다 (Petrovich et al., 2009). 구체적으로, 측부 편도체 (basalateral amygdala, BLA)가 아닌 CeA의 병변은 발 경험에 기초한 발걸음 - 조건부 자극의 억제 효과를 없애고, CeA는 환경 결과를 예측하는 부정적인 결과에 대한 반응으로 먹이 행동을 억제하는 데 중요하다. Petrovich et al., 2009). 선천성 D2R 유전자 고침 및 맛있는 음식에 대한 접근성을 가진 비만 한 랫트 또는 비 쥐는 혐오적인 CS의 존재 하에서 강박 관념의 방식으로 맛있은 음식을 섭취한다. 이러한 효과는 CeA 손상된 쥐에서 혐오성 CS에 대한 반응성의 파괴와 현저하게 유사하다 (Petrovich et al., 2009). 따라서, 중간 뇌에서 선조체 D2R의 downregulation이나 leptin 저항성의 발달로 인한 CeA 활성의 변화가 비만 쥐에서 강박 관념의 섭취의 원인이되는지를 결정하는 것이 중요 할 것이다.
섭식 행동에 대한 유해한 환경 자극의 영향을 조절하는 것 외에도 CeA는 스트레스 관련 쾌락 성 식사에서 중요한 역할을 할 수 있습니다. 인간의 경우 스트레스는 칼로리 필요와 관계없이 에너지가 풍부한 맛있는 음식을 선택하고 소비하도록 강력한 동기를 부여합니다 ([Gluck et al., 2004], [Kandiah et al., 2006] 및 [O'Connor et al., 2008]). , 비만은 스트레스 관련 글루코 코르티코이드 분비 상승과 관련이 있습니다 ([Björntorp and Rosmond, 2000] 및 [la Fleur, 2006]). 환경 및 사회적 스트레스 요인은 또한 설치류와 원숭이에서 에너지가 풍부한 음식의 과식을 유발하며, 맛있는 음식 섭취는 잠재적으로 스트레스의 부작용을 약화시킵니다 ([Dallman et al., 2003], [Dallman et al., 2006], [Pecoraro et al. al., 2004] 및 [Wilson et al., 2008]). 또한, 스트레스 유발 약물 인 yohimbine은 쥐에서 이전에 꺼 졌던 맛 좋은 음식 탐색 반응 (레버 누름)을 복원 할 수 있으며, 이는 코르티코 트로 핀 방출 인자 -1 (CRF-1) 수용체 길항제 안 탈라 민에 의해 약화 된 효과입니다 (Ghitza et al., 2006). ). 인간과 실험 동물의 식품 소비에 대한 스트레스의 정확한 영향은 스트레스 요인의 특성과 정도, 섭취 가능한 식품의 유형 (맛있음 대 단맛), 체중 및 성별 (Dallman)에 따라 달라진다는 점을 지적하는 것이 중요합니다. , 2010).
맛좋은 고지방식이 요법으로 연장 된 쥐는 CeA에서 스트레스 호르몬 CRF의 발현을 감소시켰다 (Teegarden and Bale, 2007). 반대로, 맛있은 식단에서 "철수"를 경험 한 마우스는 CeA에서 CRF 발현이 증가했다 (Teegarden and Bale, 2007). 이 후자의 효과는 모든 주요 약물 남용 (Koob, 2010)에서 철수 한 쥐에서 검출 된 CeA의 증가 된 CRF 발현과 매우 유사합니다. 추가 약물 사용은 마약 철수에 대한이 혐오 신경 생물학적 반응을 정상화 할 수 있기 때문에 CeA 및 다른 변연계 구조에서 과민성 CRF 전염이 강박 약물 사용의 발전을 촉진 할 수 있다는 가설이있다 (Koob and Zorrilla, 2010). 이 견해와 일치하여, CeA에서 CRF 수치가 증가한 맛이 좋은 에너지 밀도가 높은 음식물에서 철수 한 쥐들은 음식에 대한 사전 경험이없는 쥐들보다 맛이 좋은 음식을 얻기 위해 끔찍한 (밝은 조명의) 환경에서 훨씬 더 많은 시간을 보냈다. 덜 거친 환경 (Teegarden and Bale, 2007)에서는 덜 맛이 좋았지 만 따라서 마우스는 먹이 섭취의 잠재적 인 부정적인 결과에 내성을 갖게되고 CeA (Teegarden and Bale, 2007)의 CRF 전이를 부분적으로 감소시키기 위해 맛이 덜한 음식을 훨씬 낮은 위험에서 사용할 수있을지라도 맛있는 음식을 얻는 약탈을 위험에 빠지게됩니다. 여러 가지 증거가 강박 식량 섭취에서 CRF 전염의 역할을 뒷받침합니다. 특히, 최근의 연구에서는 CRF-1 수용체 길항제 인 R121919이식이 요법에 순환 변화를 보이는 쥐의 음식 섭취에 미치는 영향을 평가했다. 주당 표준 쇠고기 5 일을 섭취하고 맛있는 설탕 섭취량은 2 일 주 (Cottone 외., 2009). 7 주 후에식이 요법이 반복되는 동안 R121919은 고도로식이 가능한식이 요법의 과도한 섭취를 약화 시켰으며 부드러운 음식 (Cottone et al., 2009)의 섭취를 증가 시켰습니다. 또한, CeA에서 CRF 발현 수준은식이 요법으로부터 회수되는 동안 순환 된 래트에서 증가되었지만, 맛이 좋은식이에 재 노출 된 후에는 기준선 수준으로 되돌아 갔다 (Cottone et al., 2009). 마지막으로, CeA에서의 GABA 성 전달에 대한 CRF 조절은 이전에 단순한 동물에만 접근 할 수있는 대조 쥐와 비교하여 맛있은식이에서 철수하는 사이클링 쥐에서 강화되었으며, R121919이 붕괴 됨으로써 GABAergic 억제 성 시냅스 후 잠재력이 유발되었다는 사실에 반영되었다. CeA는 대조군 쥐 (Cottone et al., 2009)로부터의 슬라이스에서 투과성을 변화시키지 않는 농도로 사이클링 된 래트로부터 슬라이스한다. 흥미롭게도, CeA에서의 GABA 성 전달에 대한 CRF의 유사한 효과는 만성 에탄올 노출로부터의 철회를받는 래트에서 관찰되었다 (Roberto 등, 2010). 마지막으로 CeA, stria terminalis (BNST)의 침대핵 및 NAc 껍질은 "연장 편도체"라고 불리는 더 큰 연속 구조를 구성합니다. 쾌락 섭식을 자극하는 위치에서 NAc 껍질에 CRF를 주입하면 환경의 동기 부여가 향상됩니다 이전에는 맛있는 음식 (Peciña et al., 2006a)의 유용성과 쌍을 이룬 큐. 따라서 스트레스는 NAc 쉘 뉴런의 활성을 조절함으로써 식품 - 결합 된 환경 단서의 중요성을 향상시킬 수있다. 종합적으로 볼 때, 이러한 결과는 과도한 소비성 음식이나 약물 남용이 뇌의 외 시상 하부 스트레스 경로에 유사한 신경 적응 반응을 유도 할 수 있으며, 이는 강박적인 행동에 기여할 수 있음을 시사한다.
결론
최근에 맛있는 음식의 쾌락 효과와 맛있는 음식의 과잉 섭취 및 체중 증가에 대한 반응으로 이러한 회로에서 발생하는 적응과 관련된 뇌 시스템을 식별하는 데 많은 진전이 이루어졌습니다. 맛있는 음식과 중독성 약물의 섭취에 대한 반응으로 유사한 뇌 시스템과 일반적인 적응 반응이 촉발된다는 것은 놀랍습니다. 특히, 맛있는 음식이나 약물 남용의 과잉 섭취는 뇌 보상 시스템의 반응성에 유사한 결함을 유발합니다. 맛좋은 음식과 중독성 약물은 선조체 도파민 전파 및 선조체 D2R의 발현에 적자를 유도합니다. 입맛에 맞는 음식과 중독성 약물은 또한 설치류에서 강박적인 완결 적 행동의 출현을 촉발하고 시상 하부 외 스트레스 반응에 관여합니다. 마지막으로, 뇌 보상 시스템의 일반적인 유전 적 취약성은 개인이 과식, 비만, 약물 사용 및 중독을 유발할 수 있습니다. 실제로 비만과 약물 중독의 유사점을 기반으로 비만은 향후 DSM-V의 진단 범주로 포함되어야한다고 주장되어 왔습니다 ([Devlin, 2007] 및 [Volkow and O'Brien, 2007] ). 이를 염두에두고 미래의 연구를위한 중요한 영역은 강박 과식과 약물 사용 사이의 잠재적 인 신경 생물학적 중복을 조사하는 것을 포함 할 것입니다. 예를 들어, 약물 중독이 선조체 리모델링 및 습관 유사 약물 탐색의 출현과 관련이있을 수있는 것과 동일한 방식으로 비만이 등쪽 선조체의 가소성으로 인한 습관 유사 완결 행동의 발달과 관련이 있는지 테스트하는 것이 중요합니다. 행동 ([Everitt and Robbins, 2005], [Hollander et al., 2010] 및 [Kasanetz et al., 2010]). 또한 실행 제어 및 의사 결정 (즉, 전전두엽 피질) 및 인터 셉 티브 처리 (인 슐라 피질)와 관련된 피질 뇌 영역은 약물 중독과 크게 관련되어 있습니다 ([Everitt et al., 2008], [Fineberg et al., 2010 ], [Koob and Volkow, 2010] 및 [Naqvi and Bechara, 2009]), 강박 식과 비만에서 정확한 역할에 대해서는 알려진 바가 거의 없습니다 ([Nair et al., 2011] 및 [Volkow et al. , 2009]). 종합 해보면, 위에서 검토 한 데이터는 비만과 약물 중독이 뇌 보상 회로의 유사한 신경 적응 반응에서 발생할 수 있다는 개념을 뒷받침하며 알려진 중독 메커니즘이 비만을 이해하기위한 경험적 프레임 워크를 제공 할 수 있음을 시사합니다.
감사의
저자는 NIDA (National Institute for Drug Abuse)의 보조금으로 지원됩니다. 저자는 폴 존슨 (Paul Johnson)과 크리스티 파울러 (Christie Fowler)에게 감사의 말씀을 전합니다. 이것은 스크립스 연구소 (Scripps Research Institute)의 원고 번호 21042입니다.
참고자료
1.
o Abizaid 등, 2006a
o A. Abizaid, Q. Gao, TL Horvath
음식에 대한 생각 : 뇌 메커니즘 및 주변 에너지 균형
o Neuron, 51 (2006), pp. 691-702
o
2.
o Abizaid 등, 2006b
A. Abizaid, ZW Liu, ZB Andrews, M. Shanabrough, E. Borok, JD Elsworth, RH Roth, MW Sleeman, MR Picciotto, MH Tschöp 등.
그렐린은 식욕을 촉진하면서 중뇌 도파민 뉴런의 활동과 시냅스 입력 구성을 조절합니다
J. Clin. Invest., 116 (2006), pp. 3229-3239
o
3.
o Ahmed와 Koob, 1998
o SH Ahmed, GF Koob
o 중등도에서 과다 약물 섭취로의 전환 : 쾌락 설정 점의 변화
과학, 282 (1998), pp. 298-300
o
4.
o Ahmed와 Koob, 2005
o SH Ahmed, GF Koob
약물 중독으로의 전환 : 보상 기능의 알로 스테 틱 감소에 근거한 부정적인 보강 모델
o Psychopharmacology (Berl.), 180 (2005), pp. 473-490
o
5.
o Ahmed 외., 2002
o SH Ahmed, PJ Kenny, GF Koob, A. Markou
코카인 사용 증가와 관련된 쾌락 알로 스테 o의 신경 생물학적 증거
시에. Neurosci., 5 (2002), pp. 625-626
o
6.
o Allison et al., 1999
o DB Allison, KR Fontaine, JE Manson, J. Stevens, TB VanItallie
o 미국의 비만으로 인한 연간 사망
o JAMA, 282 (1999), pp. 1530-1538
o
7.
o 미국 정신과 학회, 1994
o 미국 정신과 학회
o 정신 장애 진단 및 통계 매뉴얼
o (제 4 판) 미국 정신 의학 협회, 워싱턴 DC (1994)
o
8.
o Angeles-Castellanos et al., 2007
o M. M. Angeles-Castellanos, J. Mendoza, C. Escobar
제한된 사료 섭취는 c-Fos의 일일 리듬과 랫트의 코르티 오 롬빗 (corticolimbic) 부위에서 단백질 Per1 면역 반응
o 신경 과학, 144 (2007), pp. 344-355
o
9.
O Baicy 등, 2007
O K. Baicy, ED 런던, J. Monterosso, ML Wong, T. Delibasi, A. Sharma, J. Licinio
Leptin 대체는 유 전적으로 leptin이 결핍 된 성인의 음식 단서에 대한 뇌의 반응을 변화시킨다.
o Proc. Natl. Acad. Sci. 미국, 104 (2007), pp. 18276-18279
o
10.
발도 (Baldo) 등, 2004
BA Bardo, L. Gual-Bonilla, K. Sijapati, RA Daniel, CF Landry, AE Kelley
o GABA A 수용체가 중추 신경계 세포 껍질을 억제하지만 orexin / hypocretin을 포함하는 시상 하부 신경 세포의 부분 모집단을 활성화 시키지만 새로운 환경에 노출시키는 것은 아닙니다
o Eur. J. Neurosci., 19 (2004), pp. 376-386
o
11.
o Balleine과 Dickinson, 2000
BW Balleine, A. Dickinson
o기구적인 조절에 대한 섬피 피질의 병변의 영향 : 인센티브 기억에서의 역할에 대한 증거
o J. Neurosci., 20 (2000), pp. 8954-8964
o
12.
o Barnard 등, 2009
o ND Barnard, EP Noble, T. Ritchie, J. Cohen, DJ Jenkins, G. Turner-McGrievy, L. Gloede, AA Green, H. Ferdowsian
o D2 도파민 수용체 Taq1A 2 당뇨병 유형의 다형성, 체중 및식이 섭취량
o 영양, 25 (2009), pp. 58-65
o
13.
o 바소와 켈리, 1999
o AM Basso, AE Kelley
GABA (A) 수용체 자극에 의해 유도 된 먹이기 : 수족 핵과 껍질 : 다량 영양소 및 맛 선호도의 지역적지도 작성 및 특성 분석
o 행동. Neurosci., 113 (1999), pp. 324-336
o
14.
o Batterham et al., 2007
o RL Batterham, DH ffytche, JM Rosenthal, FO Zelaya, GJ Barker, DJ Withers, SC Williams
피질 및 시상 하부 뇌 영역의 PYY 변조는 인간의 먹이 행동을 예측합니다
o Nature, 450 (2007), pp. 106-109
o
15.
o 박스터와 머레이, 2002
o MG 박스터, EA 머레이
o 편도체와 보상
시에. Neurosci 목사., 3 (2002), pp. 563-573
o
16.
Bean et al., 2008
o MK Bean, K. Stewart, ME Olbrisch
o 미국의 비만 : 임상 및 건강 심리학자들에게 시사하는 바
J. Clin. Psychol. Med. 설정, 15 (2008), pp. 214-224
o
17.
o Beaver et al., 2006
o JD Beaver, AD Lawrence, J. van Ditzhuijzen, MH Davis, A. Woods, AJ Calder
o 보상의 개인차는 음식의 이미지에 대한 신경 반응을 예측합니다.
o J. Neurosci., 26 (2006), pp. 5160-5166
o
18.
Belin et al., 2008
o D. Belin, AC Mar, JW Dalley, TW Robbins, BJ Everitt
o 강한 충동은 코카인 복용으로의 전환을 예측합니다.
과학, 320 (2008), pp. 1352-1355
o
19.
Berridge, 1996
KC Berridge
o 음식 보상 : 원하는 것과 좋아하는 뇌의 기질
신경 과학. Biobehav. Rev., 20 (1996), pp. 1-25
o
20.
Berridge, 2009
KC Berridge
o 음식 섭취에 대한 '좋아하는'음식과 '원하시는 음식': 뇌의 기질과 역할
Physiol. 행동, 97 (2009), pp. 537-550
o
21.
o Björntorp와 Rosmond, 2000
P.Björntorp, R. Rosmond
o 비만과 코티솔
o 영양, 16 (2000), pp. 924-936
o
22.
블론 델과 허버그, 1968
JE Blundell, LJ Herberg
o 측면 시상 하부의 전기 자기 자극 속도에 대한 영양 결핍 및 박탈 기간의 상대적 효과
o Nature, 219 (1968), pp. 627-628
o
23.
o Booth 외, 2008
o ML 부스, RL Wilkenfeld, DL Pagnini, SL 부스, LA King
o 과체중 및 비만에 대한 청소년의 인식 : 의견 조사의 중요성
J. Paediatr. 아동 건강, 44 (2008), pp. 248-252
o
24.
o Bragulat 등, 2010
o 브래지어, M. Dzemidzic, C. 브루노, 캘리포니아 콕스, T. Talavage, RV Considine, DA Kareken
기아 중 두뇌 보상 회로의 음식 관련 냄새 검사 : 파일럿 fMRI 연구
o 비만, 실버 스프링, 메릴랜드 (2010)
o
25.
o Cabanac과 Johnson, 1983
M. M. Cabanac, KG Johnson
o 쥐의 식욕 감퇴와 감기 노출 사이의 충돌 분석
Physiol. 행동, 31 (1983), pp. 249-253
o
26.
o Campfield et al., 1995
o LA Campfield, FJ Smith, Y. Guisez, R. Devos, P. Burn
o 재조합 마우스 OB 단백질 : 지방과 중앙 신경 네트워크를 연결하는 주변 신호의 증거
과학, 269 (1995), pp. 546-549
o
27.
o 캐논과 팔미 터, 2003
CM 캐넌, RD 팔미 터
o 도파민없는 보상
o J. Neurosci., 23 (2003), pp. 10827-10831
o
28.
o Carr와 Simon, 1984
o KD Carr, EJ Simon
o 굶주림에 의한 보상의 증대는 아편 제를 매개로한다.
o Brain Res., 297 (1984), pp. 369-373
o
29.
o 질병 통제 및 예방 센터, 2009
o 질병 통제 및 예방 센터 (2009). 미국 비만 동향 (애틀란타 : 질병 통제 및 예방 센터).
o
30.
콜란 투 오니 (Colantuoni) 등, 2001
C. Colantuoni, J. Schwenker, J. McCarthy, P. Rada, B. Ladenheim, JL Cadet, GJ Schwartz, TH Moran, BG Hoebel
과도한 설탕 섭취는 뇌의 도파민과 뮤 오피오이드 수용체와 결합한다
o Neuroreport, 12 (2001), pp. 3549-3552
o
31.
코넬리우스 (Cornelius) 등, 2010
o JR 고넬료, 티피만 - 피케 르트, NL 슬로 콤, CF 프리츠, MH 실버
하지 불안 증후군에서 도파민 제를 사용하는 충동 조절 장애 : 환자 - 대조군 연구
o 수면, 33 (2010), pp. 81-87
o
32.
o Cornier et al., 2009
o MA Cornier, AK Salzberg, DC 최종, DH Bessesen, DC Rojas, JR Tregellas
얇고 감소 된 비만인의 시각적 음식 단서에 대한 신경 반응에 과다 섭취가 미치는 영향
o PLoS ONE, 4 (2009), p. e6310 http://dx.doi.org/10.1371/journal.pone.0006310
o
33.
o Cottone 외, 2009
P. Cottone, V. Sabino, M. Roberto, M. Bajo, L. Pockros, JB Frihauf, EM Fekete, L. Steardo, KC Rice, DE Grigoriadis 등
CRF 시스템 모집은 강박 식습관의 어두운 측면을 중재합니다.
o Proc. Natl. Acad. Sci. 미국, 106 (2009), pp. 20016-20020
o
34.
Dagher, 2009
A. 다거
식욕의 신경 생물학 : 중독으로서의 굶주림
o Int. J. Obes. (Lond.), 33 (Suppl 2) (2009), pp. S30-S33
o
35.
o Dagher와 Robbins, 2009
A. A. Dagher, TW Robbins
o 성격, 중독, 도파민 : 파킨슨 병의 통찰력
o Neuron, 61 (2009), pp. 502-510
o
36.
o Dallman, 2010
o MF Dallman
o 스트레스에 의한 비만과 감정 신경계
o 동향 Endocrinol. Metab., 21 (2010), pp. 159-165
o
37.
o Dallman et al., 2003
o MF Dallman, N. Pecoraro, SF Akana, SE La Fleur, F. Gomez, H. Houshyar, ME Bell, S. Bhatnagar, KD Laugero, S. Manalo
o 만성 스트레스와 비만 : "위안 식품"에 대한 새로운 시각
o Proc. Natl. Acad. Sci. 미국, 100 (2003), pp. 11696-11701
o
38.
o Dallman et al., 2006
o MF Dallman, NC Pecoraro, SE La Fleur, JP Warne, AB Ginsberg, SF Akana, KC Laugero, H. Houshyar, AM Strack, S. Bhatnagar, ME Bell
o 글루코 코르티코이드, 만성 스트레스 및 비만
o Prog. Brain Res., 153 (2006), pp. 75-105
o
39.
Davis et al., 2004
C. 데이비스, S. 스트라 찬, M. 버크 손
o 보상에 대한 감도 : 과식과 과체중에 대한 시사점
o 식욕, 42 (2004), pp. 131-138
o
40.
Davis et al., 2008
o JF Davis, AL Tracy, JD Schurdak, MH Tschöp, JW Lipton, DJ Clegg, SC Benoit
o식이 지방량의 증가는 쥐의 정신 자극제 보상과 중 간 변이 도파민 회전율을 감소시킨다.
o 행동. Neurosci., 122 (2008), pp. 1257-1263
o
41.
o de Araujo et al., 2010
IE de Araujo, X. Ren, JG Ferreira
o 뇌 도파민 시스템에서의 신진 대사 감지
o 결과 Probl. 셀 차이점, 52 (2010), pp. 69-86
o
42.
o Delin et al., 1997
o CR Delin, JM Watts, JL Saebel, PG Anderson
병적 인 비만에 대한 위 우회 수술 후 먹는 행동과 기아 경험
o Obes. Surg., 7 (1997), pp. 405-413
o
43.
o Deroche-Gamonet 등, 2004
V. Deroche-Gamonet, D. Belin, PV 광장
o 쥐의 중독과 같은 행동에 대한 증거
과학, 305 (2004), pp. 1014-1017
o
44.
o Devlin, 2007
MJ 데블린
o DSM-V에는 비만의 장소가 있습니까?
o Int. J. Eat. Disord., 40 (Suppl) (2007), pp. S83-S88
o
45.
o Doknic 등, 2002
M. Doknic, S. Pekic, M. Zarkovic, M. Medic-Stojanoska, C. Dieguez, F. Casanueva, V. Popovic
o 도파민 성 색조 및 비만 : 브로 모 크립 틴으로 치료 한 프로락틴 종의 통찰
o Eur. J. Endocrinol., 147 (2002), pp. 77-84
o
46.
o Everitt와 Robbins, 2005
BJ Everitt, TW Robbins
o 마약 중독에 대한 보강의 신경 시스템 : 행동에서 습관에 이르기까지
시에. Neurosci., 8 (2005), pp. 1481-1489
o
47.
o Everitt et al., 2008
BJ Everitt, D. Belin, D. Economidou, Y. Pelloux, JW Dalley, TW Robbins
o 검토. 이 취약점을 근본적으로 다루는 신경 메커니즘으로 인해 강박적인 마약 습관과 중독이 발생합니다.
Philos. Trans. R. Soc. 론. B Biol. Sci., 363 (2008), pp. 3125-3135
o
48.
o Farooqi 등, 2007
o IS Farooqi, E. Bullmore, J. Keogh, J. Gillard, S. O'Rahilly, PC Fletcher
Leptin은 줄무늬 지역과 인간의 먹는 행동을 조절한다.
과학, 317 (2007), p. 1355
o
49.
o Felsted 등, 2010
o JA Felsted, X. Ren, F. Chouinard-Decorte, DM Small
o 1 차 음식 보상에 대한 뇌 반응의 유 전적으로 결정된 차이
o J. Neurosci., 30 (2010), pp. 2428-2432
o
50.
o Figlewicz et al., 2001
DP Figlewicz, MS Higgins, SB Ng-Evans, PJ Havel
Leptin은식이 제한 생쥐에서 자당 조절 된 장소 선호도를 역전시킨다.
Physiol. 행동, 73 (2001), pp. 229-234
o
51.
o Figlewicz et al., 2003
o DP Figlewicz, SB Evans, J. Murphy, M. Hoen, DG Baskin
o 쥐의 복부 tegmental 지역 / substantia nigra (VTA / SN)에있는 인슐린과 렙틴을위한 수용체의 표정
o Brain Res., 964 (2003), pp. 107-115
o
52.
o Fineberg 등, 2010
NA Fineber, MN Potenza, SR Chamberlain, HA Berlin, L. Menzies, A. Bechara, BJ Sahakian, TW Robbins, ET Bullmore, E. Hollander
o 동물 모델에서 endophenotypes에 대한 강박적이고 충동적인 행동 조사 : 서술 검토
o 신경 정신 약물학, 35 (2010), pp. 591-604
o
53.
o Finkelstein 등, 2005
o EA Finkelstein, CJ Ruhm, KM Kosa
o 비만의 경제적 인 원인과 결과
Annu. 공중 보건 목사, 26 (2005), pp. 239-257
o
54.
o Flegal 외., 2010
o KM Flegal, MD Carroll, CL Ogden, LR Curtin
o 미국 성인 1999-2008 사이 비만의 보급과 동향
o JAMA, 303 (2010), pp. 235-241
o
55.
o Foo와 Mason, 2005
H. 푸, P. 메이슨
o 수유 중 감각 억제
o Proc. Natl. Acad. Sci. 미국, 102 (2005), pp. 16865-16869
o
56.
o Franken과 Muris, 2005
o IH Franken, P. Muris
o 보상 민감도의 개인차는 건강한 여성의 음식 갈망 및 상대 체중과 관련이있다
o 식욕, 45 (2005), pp. 198-201
o
57.
프리드먼 (Friedman) 등, 2011
O. 프리드먼, E. 락스, Y. Dikshtein, L. 아브라함, Y. Flaumenhaft, E. Sudai, M. Ben-Tzion, G. Yadid
수평 habenula의 전기 자극은 자당 자체 관리에 억제 효과를 생산
o 신경 약리학, 60 (2011), pp. 381-387
o
58.
o Fulton et al., 2000
o S. Fulton, B. Woodside, P. Shizgal
Leptin에 의한 뇌 보상 회로의 조절
과학, 287 (2000), pp. 125-128
o
59.
o Fulton et al., 2006
S. Fulton, P. Pissios, RP Manchon, L. Stiles, L. Frank, EN Pothos, E. Maratos-Flier, JS Flier
o mesoaccumbens 도파민 경로의 Leptin 조절
o Neuron, 51 (2006), pp. 811-822
o
60.
가오와 호르 바트, 2007
Q. 가오, TL 호르 바스
o 수유 및 에너지 소비의 신경 생물학
Annu. Neurosci 목사., 30 (2007), pp. 367-398
o
61.
o Gautier 등, 2000
JF Gautier, K. Chen, AD Salbe, D. Bandy, RE Pratley, M. Heiman, E. Ravussin, EM Reiman, PA Tataranni
o 비만하고 마른 사람의 포만감에 대한 차별적 인 뇌 반응
o 당뇨병, 49 (2000), pp. 838-846
o
62.
o 가이거 (Geiger) 등, 2008
o BM Geiger, GG Behr, LE Frank, AD 칼데라 - 시우, MC Beinfeld, EG Kokkotou, EN Pothos
o 비만 경향이있는 쥐에서 mesplimbic dopamine exocytosis의 결핍에 대한 증거
o FASEB J., 22 (2008), pp. 2740-2746
o
63.
o 가이거 (Geiger) 등, 2009
o BM Geiger, M. Haburcak, NM Avena, MC Moyer, BG Hoebel, EN Pothos
o 랫트식이 비만에서 중파 변이 도파민 신경 전달 결핍
o 신경 과학, 159 (2009), pp. 1193-1199
o
64.
o Ghitza 외., 2006
o UE Ghitza, SM Grey, DH Epstein, KC Rice, Y. Shaham
o 신경 정신 약물학
o 불안 증후군 약물 요함 빈은 쥐의 재발 모델에서 맛있는 음식을 찾는다 : CRF (1) 수용체의 역할, 33 (2006), pp. 2188-2196
o
65.
Gluck 등, 2004
o ME Gluck, A. Geliebter, J. Hung, E. Yahav
o 폭식증이있는 비만 여성의 코르티솔, 굶주림 및 냉증에 대한 냉담한 스트레스 테스트
Psychosom. Med., 66 (2004), pp. 876-881
o
66.
o Goldstone 외., 2009
AP Goldstone, CG Prechtl de Hernandez, JD Beaver, K. Muhammed, C. Croese, G. Bell, G.Durighel, E. Hughes, AD Waldman, G. Frost, JD Bell
o 단식은 고 칼로리 식품쪽으로 뇌 보상 시스템을 편향시킨다.
o Eur. J. Neurosci., 30 (2009), pp. 1625-1635
o
67.
o Halaas 등, 1995
JL Halaas, KS Gajiwala, M. Maffei, SL Cohen, BT Chait, D. Rabinowitz, RL Lallone, SK Burley, JM Friedman
o 비만 유전자에 의해 암호화 된 혈장 단백질의 체중 감소 효과
과학, 269 (1995), pp. 543-546
o
68.
해밀턴 (Hamilton) 등, 1995
o BS Hamilton, D. Paglia, AY Kwan, M. Deitel
비만 한 사람에게서 추출한 omental 지방 세포의 비만 mRNA 발현 증가
시에. Med., 1 (1995), pp. 953-956
o
69.
o Hernandez와 Hoebel, 1988
O. L. Hernandez, BG Hoebel
o 음식 보상과 코카인은 미세 투석으로 측정 한 것과 같이 측핵 핵에서 세포 외 도파민을 증가시킨다.
o Life Sci., 42 (1988), pp. 1705-1712
o
70.
o Hill 외, 2003
JO Hill, HR Wyatt, GW Reed, JC Peters
o 비만과 환경 : 우리는 여기서 어디로 가야합니까?
과학, 299 (2003), pp. 853-855
o
71.
o 호벨, 1969
o BG Hoebel
o 먹이기와 자기 자극
o Ann. NY Acad. Sci., 157 (1969), pp. 758-778
o
72.
o 호벨과 발라 구라, 1967
o BG Hoebel, S. Balagura
인슐린과 글루카곤에 의해 변형 된 시상 하부의 자기 자극
Physiol. 행동, 2 (1967), pp. 337-340
o
73.
o Hoebel과 Teitelbaum, 1962
BGHoebel, P. Teitelbaum
시상 하부의 수유 및 자기 자극 조절
과학, 135 (1962), pp. 375-377
o
74.
o 호벨과 톰슨, 1969
o BG Hoebel, RD Thompson
위 내시경 또는 비만으로 인한 시상 하부 자극에 대한 혐오감
J. Comp. Physiol. Psychol., 68 (1969), pp. 536-543
o
75.
o Hofmann et al., 2010
o W. Hofmann, GM van Koningsbruggen, W. Stroebe, S. Ramanathan, H. Aarts
o 즐거움이 펼쳐지 듯 : 유혹하는 음식에 대한 쾌활한 반응
Psychol. Sci., 21 (2010), pp. 1863-1870
o
76.
o 네덜란드와 갤러거, 2004
o PC Holland, M. Gallagher
o 편도선 - 정면 상호 작용 및 보상 기대
Curr. Opin. Neurobiol., 14 (2004), pp. 148-155
o
77.
o Hollander et al., 2010
오 JA 홀 랜더, 에이치 아이, 알 아메리 오, J. 코 세라, 발리, Q. 루, D. 윌로우 비, C. 와렐 슈트, MD 콘 라이트, PJ 케니
선조체 microRNA는 CREB 신호 전달을 통해 코카인 섭취를 조절합니다
o Nature, 466 (2010), pp. 197-202
o
78.
o Hommel 등, 2006
o JD Hommel, R. Trinko, RM Sears, D. Georgescu, ZW Liu, XB Gao, JJ Thurmon, M. Marinelli, RJ DiLeone
중뇌 도파민 뉴런에서 Leptin 수용체 신호가 사료 공급을 조절 함
o Neuron, 51 (2006), pp. 801-810
o
79.
o Imaizumi et al., 2001
M. Imaizumi, M. Takeda, A. Suzuki, S. Sawano, T. Fushiki
o 생쥐에서 고지방 음식에 대한 선호도 : 튀긴 감자와 삶은 감자 비교
o 식욕, 36 (2001), pp. 237-238
o
80.
o Jerlhag 등, 2006
o E. Jerlhag, E. Egecioglu, SL Dickson, M. Andersson, L. Svensson, JA Engel
그렐린은 생쥐의 중심 콜린성 계통을 통해 운동 활성과 협착 도파민 - 오버플로를 자극합니다 : 뇌 보상에 관여한다는 의미
o 중독자. Biol., 11 (2006), pp. 45-54
o
81.
o Jerlhag 등, 2007
o E. Jerlhag, E. Egecioglu, SL Dickson, A. Douhan, L. Svensson, JA Engel
티 그날 영역으로의 그렐린 투여는 운동 활성을 자극하고, 측쇄 핵에서 도파민의 세포 외 농도를 증가시킨다
o 중독자. Biol., 12 (2007), pp. 6-16
o
82.
o Jhou 등, 2009
o TC Jhou, HL Fields, MG Baxter, CB Saper, PC Holland
o 중뇌에서 도파민 뉴런에 대한 GABA 신경 구 심성 (GPA) 성 구 심성 피질 핵 (reprodialial tegmental nucleus, RMTg)은 혐오적인 자극을 인코딩하고 운동 반응을 억제합니다
o Neuron, 61 (2009), pp. 786-800
o
83.
존슨과 케니, 2010
PM 존슨, PJ 케니
뚱뚱한 쥐의 중독과 같은 보상 기능 장애 및 강박식이 요법에서 도파민 D2 수용체
시에. Neurosci., 13 (2010), pp. 635-641
o
84.
o Johnson 등, 1996
o PI Johnson, MA Parente, JR Stellar
NMDA에 의해 유도 된 교실 핵 또는 복부 팔리 덤의 손상은 쥐를 박탈 한 음식에 대한 보람있는 효능을 증가시킨다.
o Brain Res., 722 (1996), pp. 109-117
o
85.
o Jonson 등, 1999
o EG Jönsson, MM Nöthen, F. Grünhage, L. Farde, Y. Nakashima, P. Propping, GC Sedvall
o 도파민 D2 수용체 유전자의 다형성과 건강한 지원자의 선조체 도파민 수용체 밀도와의 관계
o Mol. Psychiatry, 4 (1999), pp. 290-296
o
86.
o Kalarchian et al., 2002
o MA Kalarchian, MD Marcus, GT Wilson, EW Labouvie, RE Brolin, LB LaMarca
o 장기 추적 관찰시 위장 우회 환자에서 과민증
o Obes. Surg., 12 (2002), pp. 270-275
o
87.
o Kandiah 등, 2006
J. Kandiah, M. Yake, J. Jones, M. Meyer
o 스트레스는 대학 여성들의 식욕과 편한 음식 선호에 영향을 미친다.
o Nutr. Res., 26 (2006), pp. 118-123
o
88.
카룬 (Karhunen) 등, 1997
o LJ Karhunen, RI Lappalainen, EJ Vanninen, JT Kuikka, MI Uusitupa
o 비만 및 정상 체중 여성에서 식품 노출 중 뇌 대뇌 혈류
o 두뇌, 120 (1997), pp. 1675-1684
o
89.
o Kasanetz 등, 2010
F. Kasanetz, V. Deroche-Gamonet, N. Berson, E. Balado, M. Lafourcade, O. Manzoni, PV Piazza
중독으로의 전환은 시냅스 가소성의 지속적인 손상과 관련이있다
과학, 328 (2010), pp. 1709-1712
o
90.
켈리 (Kelley) 등, 1996
o AE Kelley, EP Bless, CJ Swanson
o 쥐의 수유 및 자당 음주에 대해 교대 핵에 주입 된 마약 길항제의 효과에 대한 조사
J. Pharmacol. 특급. Ther., 278 (1996), pp. 1499-1507
o
91.
켈리 (Kelley) 등, 2005
o AE 켈리, 학사 발도, 우리 프랫, MJ 윌
Corticostriatal - 시상 하부 회로와 음식 동기 : 에너지, 행동 및 보상의 통합
Physiol. 행동, 86 (2005), pp. 773-795
o
92.
Kenny 외., 2006
o PJ Kenny, SA Chen, O. Kitamura, A. Markou, GF Koob
o 조건부 철수는 헤로인 소비를 유도하고 보상 민감도를 감소시킵니다.
o J. Neurosci., 26 (2006), pp. 5894-5900
o
93.
Kim et al., 2010
김윤수, 윤윤호, 이진희, 윤윤호, 김신호, 신신호, 안재원, 김식호, 최신식, W. Sun, JH Baik
도파민 D2 수용체가 결핍 된 생쥐에서 시상 하부 렙틴 신호 증가
J. Biol. Chem., 285 (2010), pp. 8905-8917
o
94.
클라인 (Klein) 등, 2007
o TA Klein, J. Neumann, M. Reuter, J. Hennig, DY 폰 Cramon, M. Ullsperger
o 오류와 학습의 유 전적으로 결정된 차이
과학, 318 (2007), pp. 1642-1645
o
95.
코지마 (Kojima) 등, 1999
M. Kojima, H. Hosoda, Y. Date, M. Nakazato, H. Matsuo, K. Kangawa
o 그렐린은 성장 호르몬 분비 성 아 실화 펩타이드이다.
o Nature, 402 (1999), pp. 656-660
o
96.
o Kok 등, 2006
P. Kok, F. Roelfsema, M. Frölich, J. van Pelt, AE Meinders, H. Pijl
o 도파민 D2 수용체의 활성화는 비만 여성의 일주기 렙틴 농도를 낮춘다.
J. Clin. Endocrinol. Metab., 91 (2006), pp. 3236-3240
o
97.
o Koob, 2010
o GF Koob
중독의 어두운 측면에서 CRF 및 CRF 관련 펩타이드의 역할
o Brain Res., 1314 (2010), pp. 3-14
o
98.
o Koob과 Le Moal, 2008
o GF Koob, M. Le Moal
o 중독과 뇌 방어 시스템
Annu. Rev. Psychol., 59 (2008), pp. 29-53
o
99.
o Koob과 Volkow, 2010
o GF Koob, ND Volkow
o 중독의 신경 회로학
o 신경 정신 약물학, 35 (2010), pp. 217-238
o
100.
o Koob과 Zorrilla, 2010
o GF Koob, EP Zorrilla
중독의 신경 생물학 메커니즘 : 코르티코 트로 핀 방출 인자에 중점을 둠
Curr. Opin. Investig. 마약, 11 (2010), pp. 63-71
o
101.
o Kringelbach 등, 2003
o ML Kringelbach, J. O'Doherty, ET Rolls, C. Andrews
o 인간 안와 전두 피질의 액체 음식 자극에 대한 활성화는 그것의 주관적 쾌감과 상관 관계가있다
o Cereb. Cortex, 13 (2003), pp. 1064-1071
o
102.
o Krügel 등, 2003
O. Krügel, T. Schraft, H. Kittner, W. Kiess, P. Illes
o 쥐의 중격 쥐의 기초 및 수유 유발 도파민 방출은 렙틴에 의해 저하됩니다
o Eur. J. Pharmacol., 482 (2003), pp.185-187
o
103.
라 플레어, 2006
o SE la Fleur
쥐의 먹이 행동에 대한 글루코 코르티코이드의 영향
Physiol. 행동, 89 (2006), pp. 110-114
o
104.
o LaBar 등, 2001
o KS LaBar, DR Gitelman, TB Parrish, YH Kim, AC Nobre, MM Mesulam
기아는 인간의 음식 자극에 대뇌 피질의 활성화를 선택적으로 조절합니다
o 행동. Neurosci., 115 (2001), pp. 493-500
o
105.
o Latagliata 외., 2010
o EC Latagliata, E. Patrono, S. Puglisi-Allegra, R. Ventura
o 유해한 결과에도 불구하고 음식을 구하는 것은 전두엽 피질 노르 아드레날린 조절하에있다.
o BMC Neurosci., 11 (2010), p. 15
o
106.
Lawford 외., 2000
o BR Lawford, RM Young, EP Noble, J. Sargent, J. Rowell, S. Shadforth, X. Zhang, T. Ritchie
o D (2) 도파민 수용체 A (1) 대립 유전자 및 오피오이드 의존성 : 헤로인 사용과 메타돈 치료에 대한 반응과의 관련성
오. J. Med. Genet., 96 (2000), pp. 592-598
o
107.
Leinninger et al., 2009
o GM Leinninger, YH Jo, RL Leshan, GW Louis, H. Yang, JG Barrera, H. Wilson, DM Opland, MA Faouzi, Y. Gong 외.
Leptin은 중배엽 도파민 계를 조절하고 수유를 억제하기 위해 렙틴 수용체를 발현하는 외측 시상 하부 뉴런을 통해 작용한다
세포 Metab., 10 (2009), pp. 89-98
o
108.
o Lenoir 외., 2007
o M. Lenoir, F. Serre, L. Cantin, SH Ahmed
강렬한 단맛이 코카인 보상을 능가한다.
o PLoS ONE, 2 (2007), p. e698 http://dx.doi.org/10.1371/journal.pone.0000698
o
109.
o Leshan 등, 2010
RL Leshan, DM Opland, GW Louis, GM Leinninger, CM Patterson, CJ Rhodes, H. Münzberg, MG Myers Jr.
복부 tegmental 영역 렙틴 수용체 뉴런은 확장 된 중앙 편도의 코카인 및 암페타민 조절 된 전사 뉴런에 특별히 투사하고이를 조절한다
o J. Neurosci., 30 (2010), pp. 5713-5723
o
110.
o 루이스 (Louis) 등, 2010
GW 루이, GM Leinninger, CJ Rhodes, MG Myers Jr.
외측 시상 하부 LepRb 뉴런에 의한 orexin 뉴런의 직접 신경 분포 및 조절
o J. Neurosci., 30 (2010), pp. 11278-11287
o
111.
Luppino 등, 2010
o FS Luppino, LM de Wit, PF Bouvy, T. Stijnen, P. Cuijpers, BW Penninx, FG Zitman
과체중, 비만 및 우울 : 장기적인 연구에 대한 체계적인 검토 및 메타 분석
아치. Gen. Psychiatry, 67 (2010), pp. 220-229
o
112.
o Lutter와 Nestler, 2009
M. Lutter, EJ Nestler
o 항상성과 쾌락 신호는 음식물 섭취의 조절과 상호 작용한다.
o J. Nutr., 139 (2009), pp. 629-632
o
113.
o Macht and Mueller, 2007
M. M. Macht, J. Mueller
o 실험적으로 유발 된 기분 상태에 대한 초콜릿의 즉각적인 영향
o 식욕, 49 (2007), pp. 667-674
o
114.
o Maldonado-Irizarry와 Kelley, 1995
CS Maldonado-Irizarry, AE Kelley
o 핵의 코어 및 껍질 아 부위의 흥분성 병변은 쥐의 체중 조절 및 운동 활성을 차별적으로 방해한다
o Brain Res. Bull., 38 (1995), pp. 551-559
o
115.
o Maldonado-Irizarry 등, 1995
CS Maldonado-Irizarry, CJ Swanson, AE Kelley
o 핵 내의 글루타메이트 수용체는 측부 시상 하부를 통해 조개 껍질 조절 행동을 가라 앉힌다.
o J. Neurosci., 15 (1995), pp. 6779-6788
o
116.
o Malik 등, 2008
S. Malik, F. McGlone, D. Bedrossian, A. Dagher
그렐린은 식욕 억제 행동을 조절하는 영역에서 뇌 활동을 조절합니다
세포 Metab., 7 (2008), pp. 400-409
o
117.
o Man 외., 2009
o MS 맨, HF 클라크, AC 로버트
o 음식 보상에 대한 선행 반응의 조절에있어서 안와 전두엽 피질과 내측 선조체의 역할
o Cereb. Cortex, 19 (2009), pp. 899-906
o
118.
o 마굴과 노인, 1962
o DL Margules, J. Olds
o 쥐의 시상 하부의 동일한 "수유"및 "보람있는"시스템
과학, 135 (1962), pp. 374-375
o
119.
o Markou와 Frank, 1987
o A. Markou, RA Frank
o 자기 자극 열차 지속 시간 반응 기능에 대한 조작자 및 전극 배치 효과
Physiol. 행동, 41 (1987), pp. 303-308
o
120.
o Markou and Koob, 1991
o A. Markou, GF Koob
Postcocaine anhedonia. 코카인 퇴치 동물 모델
o 신경 정신 약물학, 4 (1991), pp. 17-26
o
121.
o Mastronardi 등, 2001
o CA Mastronardi, WH Yu, VK Srivastava, WL Dees, SM McCann
o 리포 폴리 사카 라이드 - 유도 렙틴 방출은 신경 제어 됨
o Proc. Natl. Acad. Sci. 미국, 98 (2001), pp. 14720-14725
o
122.
Matheny 등, 2011
M. M. Matheny, A. Shapiro, N. Tumer, PJ Scarpace
o 지방 특이식이 유도 및 렙틴 - 유도 세포 렙틴 내성은 래트의 복부 피 두드러기 영역을 포함한다
o 신경 약리학 (2011) http://dx.doi.org/10.1016/j.neuropharm.2010.11.002. 온라인 11 월 5, 2010 게시
o
123.
o 마츠모토 (Matsumoto)와 히코 사카 (Hikosaka), 2007
엠 마츠모토 (Matsumoto), 히코 사카 (O. Hikosaka)
o 도파민 뉴런의 음성 보상 신호의 원천 인 측부 habenula
o Nature, 447 (2007), pp. 1111-1115
o
124.
o 모튼 (Morton) 등, 2006
o GJ Morton, DE Cummings, DG Baskin, GS Barsh, MW Schwartz
o 음식 섭취와 체중의 중추 신경계 조절
o Nature, 443 (2006), pp. 289-295
o
125.
o 산과 호벨, 1967
G. Mount, BG Hoebel
o 측부 시상 하부 자기 자극 : 음식물 섭취에 의해 증가하는 자기 결정 역치
Psychon. Sci., 9 (1967), pp. 265-266
o
126.
o Nair 외., 2011
o SG Nair, BM Navarre, C. Cifani, CL Pickens, JM Bossert, Y. Shaham
o 불안 증후군 약물에 의해 유도 된 고지 방식 음식에 대한 재발에서 내측 전두엽 피질 도파민 인 D1 계열 수용체의 역할
o 신경 정신 약물학, 36 (2011), pp. 497-510
o
127.
o Nakazato 등, 2001
o M. Nakazato, N. Murakami, Y. Date, M. Kojima, H. Matsuo, K. Kangawa, S. Matsukura
o 수유의 중앙 규정에서 그렐린의 역할
o Nature, 409 (2001), pp. 194-198
o
128.
o Naqvi와 Bechara, 2009
o NH Naqvi, A. Bechara
o 숨겨진 중독의 섬 : insula
o Trends Neurosci., 32 (2009), pp. 56-67
o
129.
o Neville 외, 2004
o MJ Neville, EC Johnstone, RT Walton
o ANKK1의 동정과 특성 분석 : 염색체 밴드 2q11상의 DRD23.1와 밀접하게 연결된 새로운 키나아제 유전자
오. 흠. Mutat., 23 (2004), pp. 540-545
o
130.
o Nirenberg와 Waters, 2006
엠제이 Nirenberg, C. Waters
도파민 작용제 사용과 관련된 강박 적 식사 및 체중 증가
o Mov. 불일치., 21 (2006), pp. 524-529
o
131.
o 귀족, 2000
EP 귀족
o D2 도파민 수용체 유전자의 다형성을 통한 중독과 보상 과정
o Eur. Psychiatry, 15 (2000), pp. 79-89
o
132.
o Noble 외., 1993
EP Noble, K. Blum, ME Khalsa, T. Ritchie, A. Montgomery, RC Wood, RJ Fitch, T. Ozkaragoz, PJ Sheridan, MD Anglin et al.
o D2 도파민 수용체 유전자와 코카인 의존성의 관련성
o 약물 알코올 의존., 33 (1993), pp. 271-285
o
133.
o Noble 외., 2000
o EP Noble, X. Zhang, TL Ritchie, RS Sparkes
DRD2 좌위에서의 Haplotypes 및 심각한 알코올 중독
오. J. Med. Genet., 96 (2000), pp. 622-631
o
134.
o O'Connor et al., 2008
o DB O'Connor, F. Jones, M. Conner, B. McMillan, E. Ferguson
o 매일의 번거 로움과 먹는 스타일이 먹는 행동에 미치는 영향
건강 Psychol., 27 (1, Suppl) (2008), pp. S20-S31
o
135.
o O'Doherty et al., 2002
o JP O'Doherty, R. Deichmann, HD Critchley, RJ Dolan
o 1 차 맛의 보상을 기대하는 동안의 신경 반응
o Neuron, 33 (2002), pp. 815-826
o
136.
o O'Rahilly, 2009
o S. O'Rahilly
o 인간 유전학은 대사성 질환에 대한 경로를 밝힙니다.
o Nature, 462 (2009), pp. 307-314
o
137.
Oswald 등, 2010
o KD 오스왈드, DL Murdaugh, VL 킹, MM Boggiano
폭식증의 동물 모델에서 결과에도 불구하고 맛있는 음식에 대한 동기 부여
o Int. J. Eat. Disord. (2010) http://dx.doi.org/10.1002/eat.20808. 온라인 2 월 22, 2010 발행
o
138.
Park and Carr, 1998
TH Park, KD Carr
o 생리 식염수 및 나프탈렌 처리 된 쥐에서 맛이 좋은 식사와 식사가 짝을 이룬 환경에서 유도 된 fos와 같은 면역 반응의 신경 해부학 적 패턴
o Brain Res., 805 (1998), pp. 169-180
o
139.
o Peciña와 Berridge, 2005
o S. Peciña, KC Berridge
o 핵 안의 여드름 덩어리가 껍질을 벗긴다. 뮤 오피오이드는 단맛의 쾌락에 대한 영향을 증가시킨다.
o J. Neurosci., 25 (2005), pp. 11777-11786
o
140.
o Peciña 등, 2006a
o S. Peciña, J. Schulkin, KC Berridge
o 자궁 내핵은 corticotropin 분비 인자가 자당 보상에 대한 신호 유발 동기 부여를 증가시킨다 : 역설적 인 긍정적 인 장려 효과?
o BMC Biol., 4 (2006), p. 8
o
141.
o Peciña 등, 2006b
o S. Peciña, KS Smith, KC Berridge
o 두뇌의 헤로 닉 핫스팟
o 신경 과학자, 12 (2006), pp. 500-511
o
142.
o Pecoraro et al., 2004
o N. Pecoraro, F. Reyes, F. Gomez, A. Bhargava, MF Dallman
만성 스트레스는 맛있는 음식 섭취를 촉진하여 스트레스의 징후를 줄입니다. 만성 스트레스의 피드 포워드 및 피드백 효과
o 내분비학, 145 (2004), pp. 3754-3762
o
143.
o Pelchat et al., 2004
o ML Pelchat, A. Johnson, R. Chan, J. Valdez, JD Ragland
o 욕망의 이미지 : fMRI 동안 음식 탐욕 활성화
o Neuroimage, 23 (2004), pp. 1486-1493
o
144.
o Pelleymounter et al., 1995
o MA Pelleymounter, MJ Cullen, MB Baker, R. Hecht, D. Winters, T. Boone, F. Collins
ob / ob 마우스의 체중 조절에 대한 비만 유전자 생성물의 영향
과학, 269 (1995), pp. 540-543
o
145.
o Pelloux 등, 2007
o Y. Pelloux, BJ Everitt, A. Dickinson
o 처벌하에 쥐가 강요하는 약물 : 약물 복용의 효과
o Psychopharmacology (Berl.), 194 (2007), pp. 127-137
o
146.
o Perello 등, 2010
o M. Perello, I. Sakata, S. Birnbaum, JC Chuang, S. Osborne-Lawrence, SA Rovinsky, J. Woloszyn, M. Yanagisawa, M. Lutter, JM Zigman
o 그렐린은 고지 방식의 보람있는 가치를 오렉신 의존적 방식으로 증가시킵니다
o Biol. Psychiatry, 67 (2010), pp. 880-886
o
147.
o Petrovich et al., 2009
o GD Petrovich, CA Ross, P. Mody, PC Holland, M. Gallagher
o 편도체가 아닌 중심부, 편도선은 혐오 된 학습 단서에 의한 급식 통제에 중요하다
o J. Neurosci., 29 (2009), pp. 15205-15212
o
148.
o Pfaffly 등, 2010
o J. Pfaffly, M. Michaelides, GJ 왕, JE Pessin, ND Volkow, PK Thanos
o Leptin은 leptin-deficient obese (ob / ob) 마우스에서 선조체 도파민 D2 수용체 결합을 증가시킵니다
o 시냅스, 64 (2010), pp. 503-510
o
149.
Puhl 등, 2008
o RM Puhl, CA Moss-Racusin, MB Schwartz, KD Brownell
과체중 및 비만 성인의 시각
o 건강 교육. Res., 23 (2008), pp. 347-358
o
150.
o Rada et al., 2010
o P. Rada, ME Bocarsly, JR Barson, BG Hoebel, SF Leibowitz
지방 과다식이를 과식하는 경향이있는 Sprague-Dawley 쥐의 도브라민 감소
Physiol. 행동, 101 (2010), pp. 394-400
o
151.
o 리치와 노블, 2003
o T. Ritchie, EP Noble
o D2 도파민 수용체 유전자의 7 가지 다형성과 뇌 수용체 결합 특성의 연관성
Neurochem. Res., 28 (2003), pp. 73-82
o
152.
o Roberto 등, 2010
o M. Roberto, MT Cruz, NW Gilpin, V. Sabino, P. Schweitzer, M. Bajo, P. Cottone, SG Madamba, DG Stouffer, EP Zorrilla et al.
o 부 신피질 자극 호르몬 방출 인자 유도 편도선 감마 - 아미노 부티르산 방출은 알코올 의존에서 중요한 역할을한다.
o Biol. Psychiatry, 67 (2010), pp. 831-839
o
153.
o Roitman et al., 2004
o MF Roitman, GD Stuber, PE Phillips, RM Wightman, RM Carelli
o 도파민은 음식 추구의 하위 초조기로 작용합니다.
o J. Neurosci., 24 (2004), pp. 1265-1271
o
154.
o Roitman et al., 2008
o MF Roitman, RA Wheeler, RM Wightman, RM Carelli
o 교대 핵의 실시간 화학 반응은 보람과 혐오감을 차별화합니다.
시에. Neurosci., 11 (2008), pp. 1376-1377
o
155.
롤, 2008
o 동부 표준시 롤스
o 맛, 후각, 식욕 및 감정에서의 안와 전두엽 및 전직 대뇌 피질의 기능
Acta Physiol. Hung., 95 (2008), pp. 131-164
o
156.
롤, 2010
o 동부 표준시 롤스
o 맛, 후각 및 식품 질감 보상은 뇌 및 비만 치료
o Int. J. Obes. (Lond.) (2010) http://dx.doi.org/10.1038/ijo.2010.155 언론에서. 온라인 8 월 3, 2010 게시
o
157.
롤스 외., 1983
o ET 롤, BJ 롤, EA Rowe
o 사람의 음식과 물의 시력과 맛에 대한 감각적 특이성과 동기 부여 특이성
Physiol. 행동, 30 (1983), pp. 185-192
o
158.
o Roseberry et al., 2007
o AG Roseberry, T. Painter, GP Mark, JT Williams
o 렙틴 결핍 마우스에서 소포 성 체성 수 인성 도파민 저장량 감소
o J. Neurosci., 27 (2007), pp. 7021-7027
o
159.
o Rothemund 등, 2007
o Y. Rothemund, C. Preuschhof, G. Bohner, HC Bauknecht, R. Klingebiel, H. Flor, BF Klapp
o 비만 한 개인의 고 칼로리 시각 음식 자극에 의한 등쪽 선조의 차동 활성화
o Neuroimage, 37 (2007), pp. 410-421
o
160.
Salas 등, 2010
o R. Salas, P. Baldwin, M. de Biasi, PR Montague
인간 habenula의 부정적인 보상 예측 오류에 대한 과도한 응답
o 앞. 흠. Neurosci., 4 (2010), p. 36
o
161.
o Saper 등, 2002
o CB Saper, TC Chou, JK Elmquist
o 먹이기 필요성 : 항상성과 쾌락 조절
o Neuron, 36 (2002), pp. 199-211
o
162.
o 손더스, 2001
O. R. 손 더스
o 강박식이 요법과 위장 우회 수술 : 기아와 그 치료는 무엇을해야합니까?
o Obes. Surg., 11 (2001), pp. 757-761
o
163.
Scarpace 등, 2010
PJ Scarpace, M. Matheny, Y. Zhang
o 휠 달리기는 고지방 선호도를 제거하고 복부 피 두드러기 영역에서 렙틴 신호 전달을 향상시킵니다.
Physiol. 행동, 100 (2010), pp. 173-179
o
164.
Schiltz 등, 2007
o CA Schiltz, QZ Bremer, CF Landry, AE Kelley
o 음식 관련 단서는 즉각적인 초기 유전자 및 프로 엔클린 (proenkephalin) 발현으로 평가 한 바와 같이 전뇌 기능 연결성을 변화시킨다.
o BMC Biol., 5 (2007), p. 16
o
165.
Schur et al., 2009
EA Schur, NM Kleinhans, J. Goldberg, D. Buchwald, MW Schwartz, K. Maravilla
o 음식 신호에 의한 뇌 에너지 조절 및 보상 센터의 활성화는 시각적 자극의 선택에 따라 다릅니다
o Int. J. Obes. (Lond.), 33 (2009), pp. 653-661
o
166.
Sclafani 등, 1998
A. A. Sclafani, RJ Bodnar, AR Delamater
o 식품 조건 설정의 약리학
o 식욕, 31 (1998), p. 406
o
167.
o Sescousse 등, 2010
G.Sescousse, J. Redouté, JC Dreher
인간 orbitofrontal 대뇌 피질에서 보상 값 코딩의 아키텍처
o J. Neurosci., 30 (2010), pp. 13095-13104
o
168.
Shomaker 등, 2010
LB Shomaker, M. Tanofsky-Kraff, JM Zocca, A. Courville, M. Kozlosky, KM Columbo, LE Wolkoff, SM Brady, MK Crocker, AH Ali 등.
o 청소년기에 굶주림이 없을 때 먹는다 : 표준 식사 후 큰 식사를 한 후에 섭취한다.
오. J. Clin. Nutr., 92 (2010), pp. 697-703
o
169.
Simmons 등, 2005
o WK Simmons, A. Martin, LW Barsalou
o 식욕을 돋 우는 음식의 그림은 맛과 보상을 위해 맛있는 대뇌 피질을 활성화합니다.
o Cereb. Cortex, 15 (2005), pp. 1602-1608
o
170.
o 작음, 2010
DM 작은
o 인간 insula에있는 맛 대표
o 뇌 구조. Funct., 214 (2010), pp. 551-561
o
171.
o Small 외., 2003
DM Small, M. Jones-Gotman, A. Dagher
o 등쪽 striatum에서 먹이로 유도 된 도파민 분비는 건강한 인간 지원자의 식사 쾌감 등급과 관련이있다.
o Neuroimage, 19 (2003), pp. 1709-1715
o
172.
Smith와 Berridge, 2007
KS Smith, KC Berridge
o 보상을위한 오피오이드 변연 회로 : 측쇄 핵과 복부 팔달뚝의 쾌락 적 (hedonic) 핫스팟 간의 상호 작용
o J. Neurosci., 27 (2007), pp. 1594-1605
o
173.
o Söderpalm과 Berridge, 2000
o AH Söderpalm, KC Berridge
o diazepam, 모르핀, 또는 muscimol 투여 후 음식물 섭취 : 미세 주사 내측 핵
Pharmacol. Biochem. 행동, 66 (2000), pp. 429-434
o
174.
Stice 등, 2008a
o E. Stice, S. Spoor, C. Bohon, DM Small
o TaqIA A1 대립 유전자가 비만과 음식에 대한 둔감 한 선조체 반응을 조절하는지 여부
과학, 322 (2008), pp. 449-452
o
175.
Stice 등, 2008b
o E. Stice, S. Spoor, C. Bohon, MG Veldhuizen, DM Small
o 음식물 섭취 및 예상되는 음식 섭취로 인한 비만에 대한 보상의 관계 : 기능성 자기 공명 영상 연구
J. Abnorm. Psychol., 117 (2008), pp. 924-935
o
176.
Stice 등, 2010a
o E. Stice, S. Yokum, K. Blum, C. Bohon
o 체중 증가는 맛있는 음식에 대한 선조체 반응 감소와 관련이있다.
o J. Neurosci., 30 (2010), pp. 13105-13109
o
177.
Stice 등, 2010b
o E. Stice, S. Yokum, C. Bohon, N. Marti, A. Smolen
o 음식에 대한 반응 회로 반응은 향후 몸 질량의 증가를 예측합니다. DRD2 및 DRD4의 조절 효과
o Neuroimage, 50 (2010), pp. 1618-1625
o
178.
o Stoeckel, 2010
Stoeckel, LE (2010). 비만의 Goldilocks 원리. Scientific American. 6 월 8, 2010. http://www.scientificamerican.com/article.cfm?id=the-goldilocks-principle-obesity.
o
179.
o Stratford와 Kelley, 1997
o TR Stratford, AE Kelley
GABA는 수족 운동의 핵심 규칙에 참여한다.
o J. Neurosci., 17 (1997), pp. 4434-4440
o
180.
o Stratford와 Kelley, 1999
o TR Stratford, AE Kelley
o 수족 조절 행동을 조절하는 측벽과 시상 하부의 기능적 관계에 대한 증거
o J. Neurosci., 19 (1999), pp. 11040-11048
o
181.
Suarez와 Gallup, 1981
o SD 수아레스, GGJ 갤럽
o 쥐와 생쥐의 개방 장 행동에 대한 윤리적 분석
o 배우십시오. 동기, 12 (1981), pp. 342-363
o
182.
o 일요일 외., 1983
o 일요일 일요일, SA Sanders, G. Collier
o 입 냄새와 식사 패턴
Physiol. 행동, 30 (1983), pp. 915-918
o
183.
Swinburn 등, 2009
B. Swinburn, G. Sacks, E. Ravussin
o 식량 공급 증가는 미국의 비만 유행을 설명하기에 충분하다.
오. J. Clin. Nutr., 90 (2009), pp. 1453-1456
o
184.
o 타하와 필즈, 2005
o SA Taha, HL 분야
o 교실 핵에서 뚜렷한 연결 집단에 의한 기호성 및 식욕 행동의 부호화
o J. Neurosci., 25 (2005), pp. 1193-1202
o
185.
o 타하 (Taha) 등, 2009
SA Taha, Y. Katsuura, D. Noorvash, A. Seroussi, HL Fields
o 직렬, 선조체 및 pallidal 회로가 아닌, 집중적이고 오피오이드에 의한 음식물 섭취를 조절한다.
o 신경 과학, 161 (2009), pp. 718-733
o
186.
Teegarden과 베일, 2007
o SL 테 가든, TL 베일
o식이 선호도가 감소하면 감정이 증가하고식이 재발 위험이 증가한다.
o Biol. Psychiatry, 61 (2007), pp. 1021-1029
o
187.
Teegarden et al., 2009
o SL Teegarden, AN Scott, TL Bale
o 고지방 식습관에 일생기 노출은식이 선호도 및 중앙 보상 신호의 장기적인 변화를 촉진합니다
o 신경 과학, 162 (2009), pp. 924-932
o
188.
o Thanos 외., 2008
o PK Thanos, M. Michaelides, YK Piyis, GJ Wang, ND Volkow
o 생체 내 muPET 영상 ([2C] raclopride) 및 체외 ([2H] spiperone) 자동 방사선 촬영으로 평가 한 바와 같이, 비만의 래트 모델에서 도파민 D11 수용체 (D3R)
o 시냅스, 62 (2008), pp. 50-61
o
189.
o 톰슨과 스완 손, 2010
o RH Thompson, LW Swanson
o 가설 기반의 구조적 연결성 분석은 두뇌 아키텍처의 계층 적 모델을 통한 네트워크를 지원합니다.
o Proc. Natl. Acad. Sci. 미국, 107 (2010), pp. 15235-15239
o
190.
o Vanderschuren과 Everitt, 2004
o LJ Vanderschuren, BJ Everitt
장기간 코카인 자체 투여 후 약물 탐색이 강박해진다.
과학, 305 (2004), pp. 1017-1019
o
191.
o Vendruscolo 등, 2010a
o LF Vendruscolo, AB Gueye, M. Darnaudéry, SH Ahmed, M. Cador
청소년기의 설탕 과다 복용은 성인 쥐의 동기 부여와 보상 기능을 선택적으로 바꾼다.
o PLoS ONE, 5 (2010), p. e9296 http://dx.doi.org/10.1371/journal.pone.0009296
o
192.
o Vendruscolo 등, 2010b
o LF Vendruscolo, AB Gueye, JC Vendruscolo, KJ Clemens, P. Mormède, M. Darnaudéry, M. Cador
o 청소년기에 자당에 노출 된 성인 쥐의 음주량 감소
o 신경 약리학, 59 (2010), pp. 388-394
o
193.
o Volkow와 O'Brien, 2007
o ND Volkow, CP O'Brien
o DSM-V의 문제점 : 비만이 뇌 질환으로 포함되어야 하는가?
오. J. Psychiatry, 164 (2007), pp. 708-710
o
194.
Volkow and Wise, 2005
o ND Volkow, RA 현자
o 마약 중독은 우리가 비만을 이해하는 데 어떻게 도움이 될 수 있습니까?
시에. Neurosci., 8 (2005), pp. 555-560
o
195.
Volkow 등, 2009
ND Volkow, GJ Wang, F. Telang, JS Fowler, RZ Goldstein, N. Alia-Klein, J. Logan, C. Wong, PK Thanos, Y. Ma, K. Pradhan
o 건강한 성인의 BMI와 전두엽 대사 활동 사이의 역관계
o 비만 (은 봄), 17 (2009), pp. 60-65
o
196.
o Vucetic and Reyes, 2010
o Z. Vucetic, TM Reyes
음식 섭취와 보상을 조절하는 중추 도파민 성 회로 : 비만 조절에 대한 함의
o Wiley Interdiscip. 목사님. Biol. Med., 2 (2010), pp. 577-593
o
197.
o Wang 외, 2001
o GJ Wang, ND Volkow, J. Logan, NR Pappas, CT Wong, W. Zhu, N. Netusil, JS Fowler
o 뇌 도파민과 비만
o 란셋, 357 (2001), pp. 354-357
o
198.
o Wang 외, 2002
o GJ Wang, ND Volkow, JS Fowler
인간의 음식에 대한 동기 부여에서 도파민의 역할 : 비만에 대한 함의
o 전문가 의견. 테러. 목표, 6 (2002), pp. 601-609
o
199.
왕 (Wang) 등, 2004a
o GJ Wang, ND Volkow, F. Telang, M. Jayne, J. Ma, M. Rao, W. Zhu, CT Wong, NR Pappas, A. Geliebter, JS Fowler
식욕을 자극하는 음식 자극에 노출되면 사람의 두뇌가 현저하게 활성화됩니다.
o Neuroimage, 21 (2004), pp. 1790-1797
o
200.
o Wang et al., 2004b
o GJ Wang, ND Volkow, PK Thanos, JS Fowler
o 신경 기능 영상 검사로 평가 한 비만과 약물 중독의 유사성 : 개념 검토
J. Addict. Dis., 23 (2004), pp. 39-53
o
201.
o Wang 외, 2008
o GJ Wang, D. Tomasi, W. Backus, R. Wang, F. Telang, A. Geliebter, J. Korner, A. Bauman, JS Fowler, PK Thanos, ND Volkow
위 팽창은 인간 두뇌의 포만 회로를 활성화시킵니다.
o Neuroimage, 39 (2008), pp. 1824-1831
o
202.
o Wassum 외, 2009
o KM Wassum, SB Ostlund, NT Maidment, BW Balleine
뚜렷한 오피오이드 회로가 기호성을 결정하고 보상하는 바람직 함
o Proc. Natl. Acad. Sci. 미국, 106 (2009), pp. 12512-12517
o
203.
o Wassum 외, 2011
o KM Wassum, IC Cely, BW Balleine, NT Maidment
측부 편도선에서의 μ-Opioid 수용체 활성화는 증가의 학습을 매개하지만 음식 보상의 인센티브 가치의 감소를 매개하지는 않는다
o J. Neurosci., 31 (2011), pp. 1591-1599
o
204.
Wilkinson과 Peele, 1962
HA Wilkinson, TL Peele
굶주림에 의한 두개 내 자기 자극의 변화
오. J. Physiol., 203 (1962), pp. 537-540
o
205.
o Will 외., 2003
o MJ Will, EB Franzblau, AE Kelley
o 핵 내측 뮤 오피오이드는 분산 된 두뇌 네트워크의 활성화를 통해 고지 방식의 섭취를 조절한다
o J. Neurosci., 23 (2003), pp. 2882-2888
o
206.
Wilson et al., 2008
o ME Wilson, J. Fisher, A. Fischer, V. Lee, RB Harris, TJ Bartness
o 사회적으로 사육 된 원숭이의 음식 섭취량 정량화 : 칼로리 소비에 대한 사회적 지위 영향
Physiol. 행동, 94 (2008), pp. 586-594
o 기사 | PDF (553 K) |
Scopus에서 레코드보기
| Scopus (22)에서 인용
207.
o Yurcisin et al., 2009
o BM Yurcisin, MM Gaddor, EJ DeMaria
o 비만 및 비만 수술
o Clin. 가슴 Med., 30 (2009), pp. 539-553, ix
o
208.
o Zhang et al., 1998
o M. Zhang, BA Gosnell, AE Kelley
o 고지방 음식의 섭취는 측위 핵 내의 μ opioid 수용체 자극에 의해 선택적으로 향상됩니다
J. Pharmacol. 특급. Ther., 285 (1998), pp. 908-914
o Scopus의 레코드보기
| Scopus (148)에서 인용
209.
o Zheng 외., 2007
H. Zheng, LM Patterson, HR Berthoud
복부 tegmental 지역 orexin 신호가 높은 지방 식욕에 대한 교대 핵의 opioid 자극에 의해 유도에 필요합니다
o J. Neurosci., 27 (2007), pp. 11075-11082
o Scopus의 레코드보기
| Scopus (64)에서 인용
210.
o Zheng 외., 2009
o H. Zheng, NR Lenard, AC 신, HR Berthoud
현대 세계에서 식욕 조절과 에너지 균형 조절 : 보상 중심의 뇌가 충만 신호를 무시
o Int. J. Obes. (Lond.), 33 (Suppl 2) (2009), pp. S8-S13
o Scopus의 레코드보기
| Scopus (34)에서 인용