과학 보고서 음량 9, 문서 번호: 16918 (2019)
추상
과도한 자당 소비는 비만 전염병을 뒷받침 할 수있는 중독과 같은 갈망을 유발합니다. 오피오이드와 도파민은 남용 약물의 유익한 효과와 맛있는 음식과 같은 자극으로부터의 자연적인 보상의 효과를 중재합니다. []로 PET 이미징을 사용하여 자당의 효과를 조사했습니다.11C] 카르 펜타닐 (μ- 오피오이드 수용체 작용제) 및 [112 마리의 여성 마취 된 괴팅겐 미니 피그에서 C] 라 클로 프리드 (도파민 D3 / 12 수용체 길항제). 이어서 24 일 연속으로 XNUMX 시간 동안 자당 용액에 미니 피그에 대한 액세스를 부여하고 최종 자당 액세스 후 XNUMX 시간에 다시 이미징을 수행 하였다. 미니 피그 XNUMX 개로 구성된 작은 샘플에서 추가 [11첫 번째 자당 노출 후 C] 카 펜타닐 PET 세션. 복셀 단위의 결합 전위 (BP)를 계산했습니다.ND) 소뇌를 변위 불가능한 결합 영역으로 사용하고 통계적 비모수 적 맵핑으로 차이를 분석하고 지역 분석을 수행했습니다. 자당 접근 12 일 후, BPND 두 추적자의 수는 선조체, 핵 축적, 시상, 편도, 싱귤러 피질 및 전전 두 피질에서 수용체 밀도의 하향 조절과 일치하여 현저하게 감소 하였다. 자당에 대한 단일 노출 후, 우리는 [11오피오이드 분비와 일치하는 핵 축적 및 피질을 응고하는 C] 카르 펜타닐. 오피오이드 및 도파민 수용체의 낮은 이용 가능성은 자당 섭취와 관련된 중독 가능성을 설명 할 수있다.
개요
세계 인구의 XNUMX %가 임상 적으로 비만입니다1. 대사 증후군의 특징 인 비만은 2 형 당뇨병, 심혈관 질환, 호흡기 문제, 우울증 및 치매의 위험과 관련이 있습니다.2. 에너지 밀도가 높은 음식의 소비가 증가함에 따라 식량 부족으로 인한 항상성 굶주림과 박탈이없는 상태에서 발생하는 정신적 굶주림 또는 "갈망"사이의 생리적 차이가 과장되었습니다.3,4. 항상성 규제만으로는 현재 비만의 증가를 설명 할 수 없으므로, 맛이 좋은 음식의 중독성 속성에 대한 보상과 즐거움의 뇌 메커니즘에 미치는 영향을 테스트하는 것이 필수적입니다.
자당 소비는 비만과 관련이 있으며 자당은 점점 중독성 물질로 간주되고 있습니다.5. 음식에 대한 음식 맛 반응에서 음식 맛이 나지 않는 음식 소비를 분리하고 가공 식품의 중독성 성분을 결정하는 데 어려움이 있고 음식이 자연 경로를 통해 뇌 회로를 변경시키는 다양한 메커니즘으로 인해 일부 결과는이 주장과 차이가 있습니다.6. 그럼에도 불구하고, 특정 상황에서, 자당 섭취는 중독성 약물에 의해 유발 된 것과 비슷한 크기로 보상과 갈망을 유발하여 과도한 소비와 비만으로 이어집니다.6,7.
기아는 다수의 보상 환경에서 도파민 성 신경 전달의 영향과 밀접한 관련이있는 "원하는 (wanting)"과 관련이있다8그러나 도파민 (DA)의 작용이 강박 식에 대한 반응으로 어떻게 조절되는지는 아직 확실하지 않다. 맛좋은 음식 섭취는 주로 내인성 오피오이드 시스템, 특히 μ- 오피오이드 수용체 (μOR)에 의해 매개되는 "적합"에 연결됩니다9,10규제가 해제되면 과소비를 촉진 할 수 있습니다. 현재 보고서에서 우리는 자당이 opOR 및 DA D2 / 3 수용체의 가용성을 낮추는 오피오이드 및 도파민 방출로 이어지는 주장을 테스트합니다. 이용 가능성은 트레이서 결합에 이용 가능한 비 점유 수용체의 수의 지수이며 원칙적으로 리간드 점유와 수용체 밀도를 구별하지 않는다11.
강박 식사의 시작은 여러 가지 요인에 달려 있으며 인간의 인과 연구는 윤리적 문제를 제기합니다. 따라서 대부분의 연구는 쥐의 사료 공급 행동에 중점을 둡니다.12. 쥐는 "달콤한 치아"를 가지고 있지만 체중 증가, 신진 대사 및 지방 축적 유형에 중요한 그들의 항상성 메커니즘은 인간의 것과 상당히 다릅니다. 괴팅겐 미니 피그 (Göttingen minipig)는 잘 발달 된 비뇌 뇌를 가진 큰 잡식성 동물로 충분한 해상도로 이미지를 찍을 수 있습니다. 잘 정의 된 subcortical과 prefrontal cortical region13 인간의 뇌 기능에보다 직접적인 번역을 가능하게합니다. 여기, 우리는 양전자 방출 단층 촬영 (PET) 이미징을 사용하여 테스트 생체내에서 서브 크로 닉 슈 크로스 노출의 미니 피그 모델에서 μOR 및 DA D2 / 3 가용성. 더 작은 샘플에서, 우리는 자당에 처음 노출 된 후 μOR 점유율에 대한 즉각적인 영향을 조사했습니다. 마지막으로, 우리는 두 추적자의 수용체 가용성의 변화 사이의 관계를 테스트했습니다.
결과
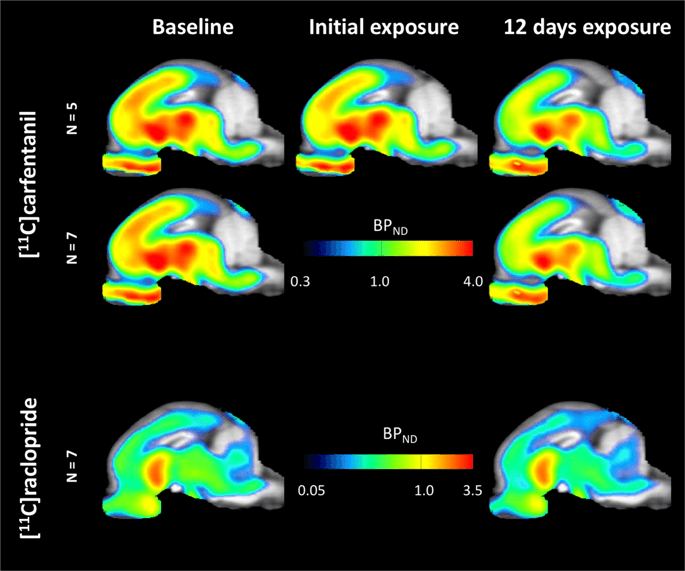
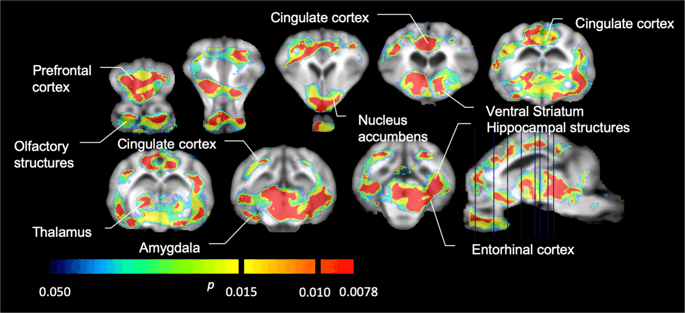
[의 평균 파라 메트릭 맵11C] 카르 펜타닐 및 [11C] 라 클로 프라이드 결합 전위 (BP)ND)가 그림에 표시됩니다. 1. 기준선과 비교하여 12 개의 미니 피그에서 첫 번째 자당 노출 후 발생하는 변화와 XNUMX 일 후의 하루의 변화를 분석th 기준선과 비교하여 XNUMX 개의 미니 피그에서 자당 접근, 우리는 순열 이론 및 비-지역적으로 제한된 전체 뇌 분석,이 크기의 샘플에 대해 선호되는 방법을 사용했습니다.14.
복셀 형 평균 비 변위 결합 전위 (BP)ND) 시상보기에서 MRI 이미지에 중첩 된지도. 데이터가 [11C] 카르 펜타닐 BPND 초기 자당에 노출 된 후 및 5 일의 자당 노출 후 (기준 열)베이스 라인에서 이미지화 된 12 개의 미니 피그 중 하나. [11C] 카르 펜타닐 BPND 베이스 라인에서 이미지화되고 7 일의 자당 접근 후 12 개의 미니 피그 중 XNUMX 개가 중간 줄에 제시되어있다. [11C] raclopride BPND 베이스 라인에서 이미지화되고 7 일의 자당 접근 후 12 개의 미니 피그 중 모든 것이 하단 행에 도시되어있다. 컬러 스케일은 [11C] raclopride BPND 외곽 지역에서.
초기 자당 노출
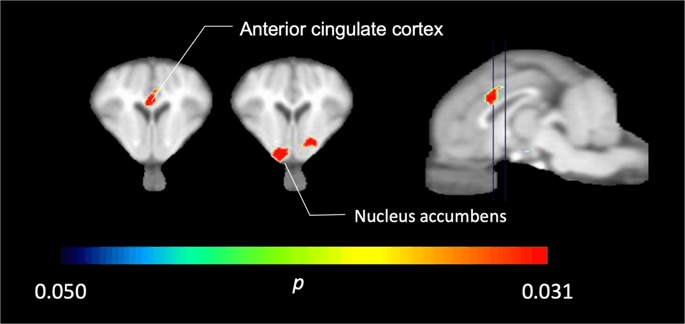
미니 피그 XNUMX 개로 [11C] 카 펜타닐은 기준선에서 그리고 첫 번째 자당 노출 직후에 자당에 대한 반응으로 앞쪽 피질 피질과 핵 축적에서 트레이서 결합이 상당히 감소 된 것을 발견했다 (도 XNUMX의 컬러로 표시됨). 2, p <0.05를 나타냅니다. 기준선과 비교하여 두 영역 모두에서 추적자 결합이 14 % 감소했습니다.
자당 접근 12 일
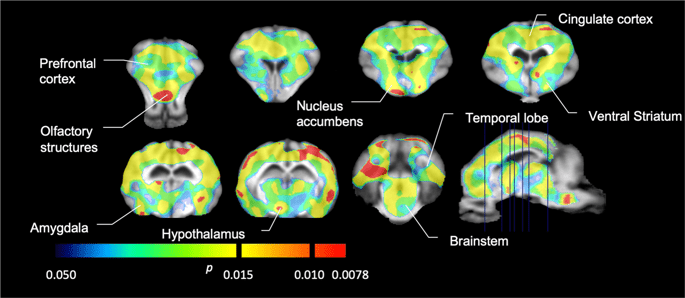
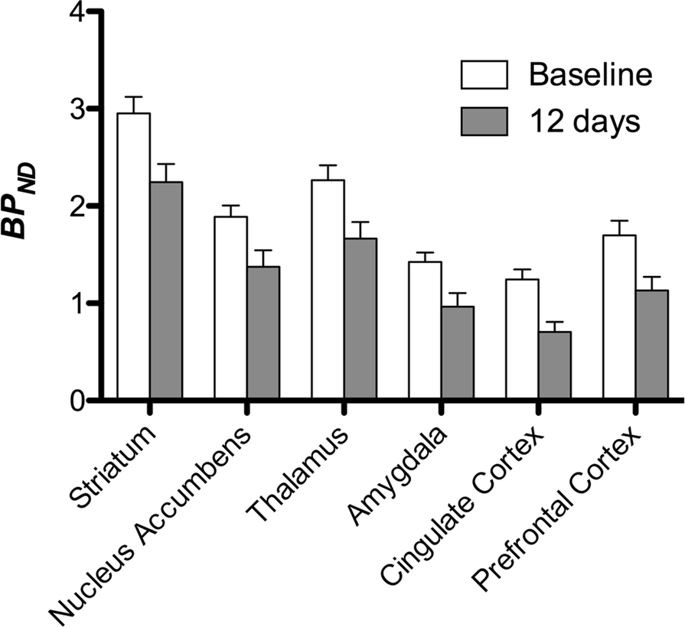
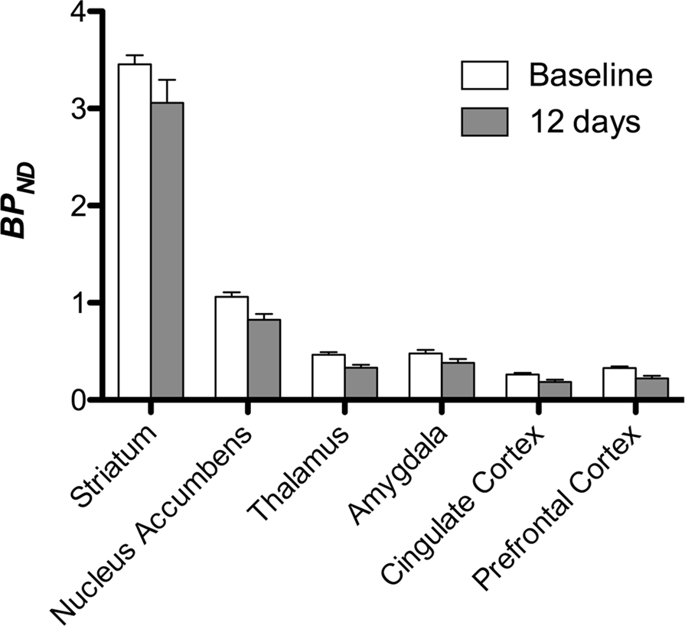
그런 다음 [11C] 카 펜타닐은 기준선에서 그리고 12 일의 자당 접근 후 기준선과 비교하여 자당에 노출 된 동물에서 현저하게 감소 된 트레이서 결합을 발견 하였다. 가장 크게 영향을받은 지역은 그림에서 빨간색으로 표시됩니다. 3 (p <0.01) 후각 구조의 일부, 축축 핵 / 복부 선조체 및 측두엽 피질 / 엽을 포함하고 그 뒤에 전두엽 피질, 대상 피질, 편도체 및 뇌간을 포함하는 노란색 영역 (p <0.015)이 포함됩니다. . BP를 얻기 위해ND 우리는 지역 분석을 수행하고 기준선에서 그리고 자당 소비 후 각 지역에서 평균값을 얻었습니다 (그림. 4).
우리는 사용했었다 [11C] raclopride는 기준 시점 및 자당 접근 2 일 후 미니 피그의 선조체 및 체외 뇌 영역에서 DA D3 / 12 수용체의 추적자이다 (그림. 1). 우리는 전전두엽 피질, 핵 축받이 / 복부 선조체, 대뇌 피질, 편도체, 시상, 중뇌, 해마 부위 및 후각 부위에서 가장 큰 효과 (p <0.01)를 갖는 기준선과 비교하여 자당에 노출 된 동물에서 추적자 결합 감소를 발견했습니다. (무화과. 5). 지역 분석의 데이터는 Fig. 6.
사이의 상관 관계11C] raclopride 및 [11C] 카 펜타닐 데이터
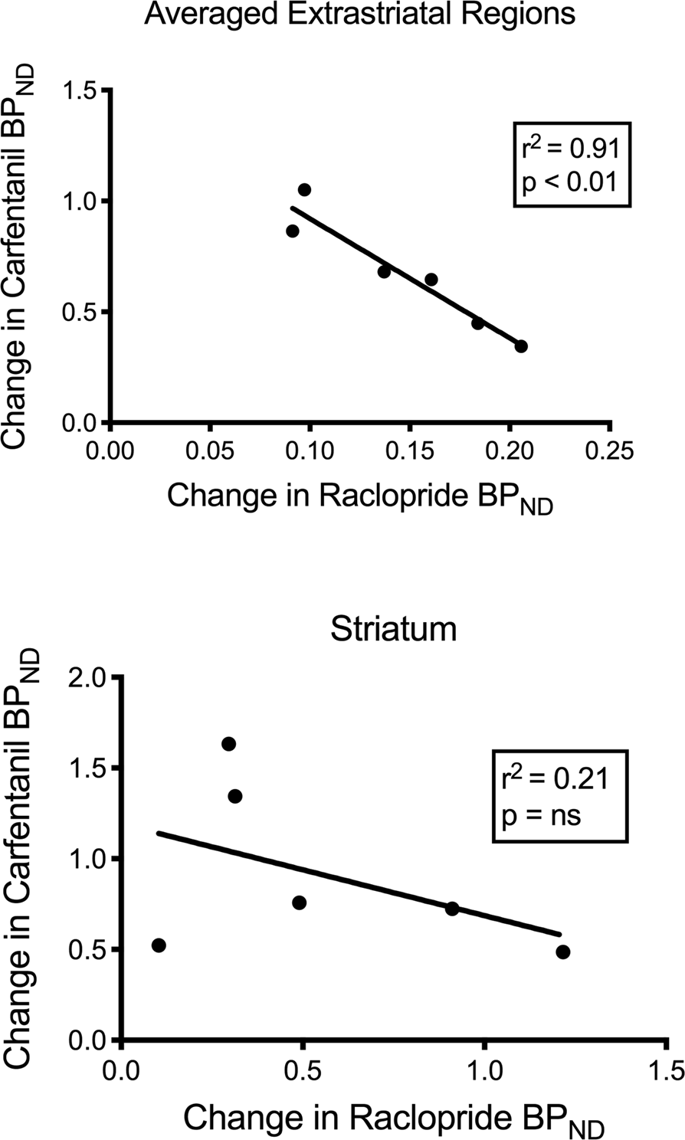
[11C] raclopride 및 [11C] BP의 카 펜타닐 값ND 기준 시점 및 자당 섭취 12 일 후 미니 피그의 선조체 및 비-스트리 아탈 영역에서 연관성이 관찰되지 않았다. 그런 다음 추적 프로그램 바인딩 감소가 상관 관계가 있는지 테스트하고 BP의 변화를 비교했습니다.ND [11BP의 변화에 따른 C] racloprideND [11C] 카르 펜타닐은 BP가 낮은 미니 피그에서만ND 자당 섭취 후 두 추적자 모두 (n = 6). 우리는 평균 외막 외 (r)에서 유의 한 음의 상관 관계를 발견했습니다.2 = 0.91, p <0.01), 그러나 선조체 지역은 아닙니다 (그림. 7).
토론
포유류 뇌에서 opioid 및 DA neurotransmission에 자당에 반복 된 간헐적 인 액세스의 효과 결정했습니다. 종 방향 생체내에서 μOR 및 DA D2 / 3 수용체의 PET 영상화는 핵 축적, 전전두엽 피질 및 전측 피질 피질을 포함하여 보상 회로 전반에 걸쳐 감소 된 수용체 이용 가능성을 나타냈다. 결과는 자당이 남용 약물과 유사한 방식으로 보상 메커니즘에 영향을 미친다는 것을 분명히 보여줍니다.
맛좋은 물질로 자당을 섭취하면 DA를 방출하고 설치류의 의존성을 유발하는 것으로 알려져 있습니다.15특정 상황에서 설치류의 코카인보다 자당이 훨씬 더 즐거워지는 것으로 나타났습니다. 따라서 설치류는 음식이 부족한 경우에도 코카인보다 자당을 얻기 위해 더 열심히 일합니다.5. 그러나 자당의 효과는 항상성 시스템과 hedonic 보상 회로에 의해 조절됩니다.16,17 자당 작용의 영양 적 측면과 hedonic 측면의 차이를 중재 할 수있는18. 쥐의 이전 연구에서 간헐적 일정으로 일일 접근 첫 시간 동안 더 높은 섭취량을 보였기 때문에“빙”을 촉진하기 위해 하루 XNUMX 시간 일정을 선택했습니다.15,19. 음식 섭취에 대한 행동 연구는 종종 음식 제한 동물을 대상으로하지만, 디자인은 반드시 비만에서 활동하는 동일한 신경 메커니즘을 반영하지 않을 수도 있습니다. 현재의 연구에서 돼지는 음식 제한이 없었으며 자당에 접근 할 수있을뿐만 아니라 정상적인 양의 정상적인식이를 먹였습니다.
오피오이드 수용체 (OR)는 뇌에서, 특히 식사와 보상 과정을 조절하는 것으로 알려진 구조에서 널리 표현됩니다20. OR은 코카인의 보람 및 재발 효과에 중요한 것으로 나타났습니다21,22,23,24. 결합의 변화는 또한 먹는 음식에 대한 항상성 반응과 맛있는 음식과 관련된 즐거움과 관련이 있습니다.25. 특히, 음식의 "적합"은 내인성 오피오이드 시스템, 특히 μOR에 연결됩니다9,10 핵 축적과 복강의 껍데기에26. 핵 어 큐벤 및 복부 pallidum의 별개의 부분으로의 μOR 작용제 주입은 음식의 맛좋은 섭취를 증가시킨 후 혀 돌출부와 발 핥기를 포함하여“적합한”행동을 강하게 향상시킵니다.27,28,29. hedonic 조절 과정에서 오피오이드 신호에 대한 추가 증거는 μOR 길항제에서 나온다. 광고 무제한먹이와 음식 제한 동물, 그러나 맛좋은 표준 펠렛의 섭취에 더 제한적인 영향30,31. 인간에서, μOR 길항제는 단기 음식 섭취를 줄이고 맛좋은 음식의 즐거움을 줄입니다.32,33,34. 기저 편도 편도에서의 오피오이드 신호 전달은 보상 추구 및 식품의 인센티브 가치의 조절을 통해 식품 "원하는"에 기여합니다35.
[11C] carfentanil, 우리는 μOR 수준과 내인성 오피오이드의 뇌 방출에 민감한 추적자 결합의 이미지를 얻었습니다.36,37. 우리는 XNUMX 개의 미니 피그에 의해 자당의 초기 소비 후 내인성 오피오이드 방출과 일치하여, 핵 어 큐벤 및 전 cingulate 피질, 보상 경로의 특정 뇌 영역에서 μOR 가용성의 즉각적인 손실을 검출 하였다. 이전 연구에 따르면 맛있는 음식이 즐거움을 줄 수 있음이 밝혀졌습니다38 오피오이드 분비를 자극함으로써. 자당 접근 12 일 후, 우리는 [11C] 카르 펜타닐 결합, 몇 가지 가능한 설명이 있음39 내인성 오피오이드 방출 및 μOR에 대한 결합, 증가 된 오피오이드 결합의 결과로서의 μOR 내재화, 및 증가 된 DA D2 / 3 수용체 활성화를 포함하여 μOR의 이질성 탈감작 화40.
현재의 발견을 뒷받침하기 위해 [11C] 폭식증 환자의 카르 펜타닐 연구41, 비만42,43,44및 폭식 장애45, 감소 된 수용체 이용 가능성을 보여준다. 그러나 미니 피그는 12 일 동안 자당 만 섭취하는 반면, 이는 만성적 인 상태입니다. 건강한 남성의 급성 수유 행동에 대한 연구에서, 수유는 헤 모니 아의 존재 및 부재 하에서 강력하고 널리 퍼진 내인성 뇌 오피오이드 방출을 유발했으며, 이는 오피오이드 방출이 신진 대사 반응뿐만 아니라 대사 및 항상성 반응을 반영 함을 시사한다25. 이 연구는 초콜릿 맛이 나는 액체 식사 후 환자를 촬영 한 다른 연구와 함께44, 첫 자당 노출 후 12 마리의 미니 피그의 급성 연구와 직접 관련이 있지만, 감소 된 수용체 이용 가능성이 반복 된 과자 극 및 수반되는 μOR의 하향 조절을보다 잘 반영하는 XNUMX 일 동안의 서브 크로 닉 자당-노출 연구와는 다르다.
전전두엽 피질은 의사 결정 및 항목에 대한 가치 상승에 중요하므로 전두엽 전 피질의 μOR은 식품의 유효성을 변경하여 식품의 중독 가능성을 높일 수 있습니다. 우리는 고지방식이가 전전두엽 피질에서 μOR mRNA의 수준을 감소 시킨다는 것을 보여주는 이전 연구와 일치하는 전전두엽 피질에서의 결합 감소를 발견했다.46 전전두엽 피질에 μOR 작용제의 주입은 단 음식 섭취를 증가시킵니다.47. 그러나 다시 말하지만, 고지방식이가 단기 자당 공급 디자인과 비교하여 수용체 다운 조절을 중재하는 더 만성적 인 상태인지 여부가 발생합니다. 자당 12 일 후에도.
DA는 약물과 행동으로 인한 보상에 연루되어 있습니다. 만성 코카인 사용은 DA 신호 전달을 억제하는 것으로 밝혀졌습니다48. DA D1 및 D2 / 3 수용체 수준은 돼지 뇌의 니코틴에 의해 변경됩니다49코카인 남용의 역사를 가진 비인간 영장류50, 인간 코카인 중독자의 뇌에서 D2 / 3 수용체의 하향 조절과 일치51,52. 남용 약물에 관해서, 자당은 DA D1 수용체를 상향 조절하는 것으로 나타났습니다19 DA 릴리스 증가53, 맛좋은 음식과 관련하여 "원하는"에서 DA의 역할을 강화합니다. 이전 PET 연구는 병적 비만에서 평균 체중에 대한 선조체 DA D2 / 3 수용체 이용률의 감소를 입증 하였다54,55약물 중독 환자의 감소와 비슷한 정도56비만 모델이있는 동물57. 설치류 연구에서, 선조체의 D2 / 3 수용체 녹다운은 맛좋은 음식에 접근 할 수있는 쥐에서 강박 음식을 찾는 것을 촉진합니다57.
돼지의 D2 / 3 수용체 가용성 감소에 대한 우리의 관찰은 DA가 남용 약물 및 다른 유쾌한 약물의 요구의 일부로서 방출되기 때문에 자당 섭취와 관련된 인센티브 경감에 대한 DA 수준의 증가를 나타낼 수있다52,58,59,60. 돼지가 영상화 동안 마취되고 24 시간 내에 자당을받지 못함에 따라 감소 된 D2 / 3 BPND 12 일의 자당 접근 각각에서 DA 방출의 연장 된 증가에 반응하여 수용체의 수의 감소를 반영 할 가능성이 더 높다. 감소는 선조체 DA D2 수용체의 하향 조절과 관련된 뇌 보상 역치를 상승시킬 수있다. 이것은 코카인에 대한 과민증, 저용량 암페타민 후 과잉 행동, 수 크로스를 절제 할 때 알코올 섭취 증가 및 아편 제의 진통 효과에 대한 내성을 유발하는 수 크로스를 과식하는 쥐의 이전 연구에서 볼 수있는 남용 약물에 대한 감수성이 증가한 것을 설명 할 수 있습니다6.
괴팅겐 미니 피그 (Göttingen minipig)에서의 비만에 대한 이전의 연구는 뇌의 단일 광자 방출 컴퓨터 단층 촬영 (SPECT)과 함께 핵 축적, 복부 Tegmental Area (VTA) 및 전전두엽 피질에서의 뇌 혈류 감소를 확인했습니다.61. 이러한 결과와 일치 하여, 우리는 핵 accumbens를 포함 하여 뇌와 전 두 엽 피 질에서 DA D2 / 3 바인딩 감소 관찰. DA의 세포 외 수준은 미세 투석을받는 자유롭게 움직이는 쥐에서 자당 섭취 후 핵 축적에서 3 배 증가합니다62. 자당 의존 동물에서 반복 자당 섭취는 핵 축적의 껍질에서 DA의 방출로 이어질 수 있습니다63. 자당에 대한 접근이 제한된 제한된식이를 섭취 한 동물은 핵 축적 쉘 및 등쪽 선조에서 DA D2 수용체 결합이 낮았다64. 제한된 고지방 및 자당식이 요법은 핵 축적에서 D1 및 D2 수용체 mRNA의 하향 조절을 유발할 수 있습니다.65. 맛좋은 음식의 효과에 대한 미세 투석 연구는 음식이 여전히 참신한 것으로 여겨졌을 때 핵 축적과 전전두엽 피질의 DA 방출 증가를 보여주었습니다. 일단 쥐가 새로운 음식에 익숙해지면, 증가 된 방출이 핵 축적에 둔화되었지만 전전두엽 피질에서는 그렇지 않았다66. 두 지역에서 활동의 조절 및 조절에 대한 감수성 감수성은 XNUMX 일 후에 진기함을 잃어버린 동일한 맛좋은 물질에 노출 된 미니 피그의 핵 축적에 비해 전두엽 피질에서 관찰 된 더 큰 증가를 설명 할 수있다. 그러나 미니 피그 이미지를 [11첫 번째 자당 투여 후 C) raclopride는 이러한 설명이 추측 적이다.
전두엽 피질은 집행 기능, 의사 결정 및 자기 통제를 조절합니다.67. 전전두엽 피질의 기능 장애 DA 신경 전달은 보상 처리의 변조를 손상시켜, 비만인 개인의 집행 기능 및 의사 결정 능력의 장애를 시사한다68,69. 또한, 인간 PET 연구는 비만에서 감소 된 선조체 D2 결합과 함께 감소 된 전두엽 피질 대사를 상관시켰다70. 여기, 자당 요법에 노출 된 돼지의 orbitofrontal 피 질을 포함 하여 전 두 엽 피 질에서 감소 된 D2 / 3 수용 체 가용성을 찾을 수 있습니다.
VTA의 도파민 성 뉴런은 해마와 편도에 투영을 보내서 습관과 같은 행동을 지원합니다.71 컨디셔닝의 인코딩 및 검색을 약물로 중재72,73 음식 신호74,75. 인간의 두뇌 이미징 음식 갈망 및 시음에 대한 응답으로 해마 활성화를 보여76. 자당, 인간 뇌 매핑에 대한 응답으로 감소 된 해마 및 편도 D2 / 3 수용체 가용성에 대한 우리의 연구 결과와 일치18F] fallypride는 편도 및 해마에서 코카인 큐 유도 DA 방출을 보여 주었다77. 설치류 뇌에서 코카인 큐 노출은 편도에서 DA 방출을 유발했습니다.78, 편도 DA 수준의 변경 큐 유발 코카인 추구 행동에 영향을 미쳤다79.
비만인 개인에 대한 연구에서, 희박한 사람의 선조 영역에 존재하는 것으로 알려진 D2 / 3와 μOR 이용률 사이의 연관성은 복부 선조에서 파괴되었다80. BP의 가치를 비교했습니다ND 데이터가이 효과를 재현했는지 테스트하기 위해 두 추적 프로그램 중 하나입니다. 희박한 사람과는 달리, 현재의 돼지 뇌는 혈압의 값 사이에 상관 관계가 없었다ND 기준선에서 또는 자당에 노출 된 후 두 추적자 중 하나. 추적 추적기 raclopride 바인딩의 가장 큰 감소를 가진 동물 추적 추적기 carfentanil 바인딩의 가장 큰 감소를 가질 지 여부를 테스트하지만 대신 평균 외 외 지역에서 부정적인 상관 관계를 발견했다의 바인딩 잠재력의 가장 큰 변경 제안 tracer raclopride는 tracer carfentanil의 결합력 변화가 가장 낮았습니다. 변화들 간의 역의 관계는 각각의 수용체의 가용성에 대한 자당 섭취의 효과가 반대 방향으로 조절됨을 시사한다. 맛좋은 음식 또는 약물의 과도한 소비는 원하거나 취향에 따라 또는 두 가지 모두에 의해 유발 될 수 있음이 알려져 있습니다60,81. 도파민에 의해 구동되는 원하는 정도가 오피오이드에 의해 유발 된 선호도를 무효화하거나 그 반대 일 수도있다. 최근 증거는 GABA의 역할을 지적A VTA의 수용체 및 선조체 및 아마도 피질의 콜린성 말단에서 오피오이드 작용의 도파민-의존적 및 도파민-의존적 메카니즘 사이의 스위치로서 작용 함82,83 여기에서 결정된 돼지 외막 외 영역에서 도파민과 오피오이드 효과의 상호성을 설명 할 수 있습니다.
비교적 큰 동물에서도 PET의 단점은 음식 관련 행동에 관여하는 작은 뇌 영역의 결과에 영향을주는 단층 촬영의 제한된 공간 해상도입니다. 그러나 이러한 우려에도 불구하고 [11C] 라 클로 프라이드 결합은 이전에 선조 및 외측 영역 모두에서 기록되었다84,85,86,87. [의 사용11동일한 유형의 수용체를 표지하기위한 C] 라 클로 크라이 드는 상이한 영역에서 동일한 수용체에 대한 별개의 트레이서의 사용에 영향을 줄 수있는 잠재적 친화력 차이에 대한 우려를 제기하지 않는다. 최근의 연구는 [11C] 라 클로 프라이드. 알라 쿠티 외. 대뇌 피질에서 중등도에서 중등도의 재현성과 함께, 선조체에서 선조체 라 클로 프라이드 결합의 측정의 우수한 재현성을 발견 함85. 이후 연구에서 Svensson 외. 의 사용에 영향을 미치는 몇 가지 문제에 대해 논의했습니다.11피질에서의 재현성 불량 및 D2 / 3 차단제에 대한 반응으로 전두엽 피질의 체외 결합의 제한된 감소를 포함하여 건강한 인간의 연구에서 외인성 D2 / 3 수용체의 마커로서의 C] raclopride88. 시험-재시험 비교는 선조체에서 4-7 %, 대뇌 피질 영역에서 13-59 %의 변동성을 보여 주었지만, 대부분의 연구에서 20-1 일 동안 정보를 제공하는 것과는 달리 시험 간격은 평균 2 일이었다. 그러한 피험자들의 삶에서 여러 가지 요인이 발견에 영향을 미쳤을 수도 있습니다. 실제로, 우리는 12 일 동안 아침 루틴에 자당 소비를 추가하는 것이 XNUMX 주 후에 얻은 바인딩 조치에 영향을 줄 수 있음을 여기에서 보여줍니다. 비디오 게임, 쇼핑, 새로운 낭만적 인 관계 및 성적인 활동, 약물 사용,식이 요법 및 운동 변경과 같은 기타 요인은 심층적 인 도파민 수치에 영향을 미쳐서 다양한 데이터 세트가 변형 될 수 있습니다. 미니 피그에 대한 현재의 연구는식이에서의 자당의 유무에 대한 유일한 변수 인 잘 통제 된 설정을 소개했다. 이와 관련하여, XNUMX 마리 동물로부터의 데이터는 자당에 반응하여 통계적으로 유의미한 결합 감소를 확인하기 위해 관련 외 심장 영역에서 충분히 낮은 가변성을 가졌다.
현재의 연구의 한계는 치료 중 부동성을 보장하기 위해 필요한 마취제의 사용입니다 생체내에서 동물의 영상. 특정 마취제의 효과와 약물 또는 기타 중재와의 상호 작용은 방사성 리간드의 결합을 혼란스럽게 할 수 있습니다89,90. 케타민은 마취제 용량에서 빠른 항우울제 효과가있는 항 글루타민 성 약물입니다.91,92,93, 그것은 striatal을 감소시키지 않습니다 [11C] 인간에서의 라 클로 프라이드 결합94. 그러나, S- 케타민은 의식적인 비인간 영장류의 선조체에서 도파민 D2 / 3 수용체의 결합 이용 가능성을 감소시키는 것으로 밝혀졌다95. 이소 플루 란은 동물 PET에서 일반적인 마취제이다. 이전 연구에서 우리는 [11C] SCH23390, 도파민 D1 수용체의 방사성 리간드, 프로포폴보다는 이소 플루 란으로 마취 된 미니 피그에서 유의하게 더 높음으로써 마취 효과에 대한 도파민 성 신경 전달의 감수성을 시사 함96. 현재의 연구에서, 모든 미니 피그는 케타민 예비 의약품 및 이소 플루 란 마취하에 두 시점 모두에서 이미지화되어 현재 비교가 유효하다.
결론
맛좋은 음식을 과도하게 섭취하면 비만으로 인한 건강에 직접적인 영향을 미쳐 중독을 유발할 수 있습니다. 우리는 오피오이드와 도파민이 생존과 약물 남용에 중요한 보상을 중재한다는 주장을 테스트했습니다. 연속 12 일 동안 자당 용액에 간헐적으로 접근 할 수있는 미니 피그는 선조체 및 뇌외 뇌 영역에서 도파민 D2 / 3 및 μ- 오피오이드 수용체 이용률이 감소 함을 보여주었습니다. 소비됩니다. 자당에 대한 최초의 단일 노출은 보상이 활발한 뇌 영역에서 오피오이드 방출과 일치 하였다. 오피오이드 및 도파민 가용성의 변화는 과량으로 섭취되는 자당의 중독 가능성을 설명합니다.
재료 및 방법
동물 윤리
이 연구는 Danish Animal Experiments Inspectorate에 의해 승인되고 규제되었으며 모든 실험은 2010 / 63 / EU 유럽 의회 및 과학 목적으로 사용되는 동물 보호위원회 및 ARRIVE 지침의 6 / 2 / EU 지침에 따라 수행되었습니다. 우리는 XNUMX 개월 된 암컷 괴팅겐 미니 돼지 (덴마크 담세 오스 엘레 가드)를 XNUMX 개월 동안 사용했습니다. 미니 피그는 수돗물을 이용할 수있는 펠렛 다이어트 (매일 XNUMX 회, 매일 XNUMX 회, 스페셜 다이어트 서비스, 덴마크 오르후스)를 먹였습니다. 광고 무제한. 환경 온도는 20–22 ° C, 상대 습도는 50–55 %이며 공기는 매시간 XNUMX 번 변경되었습니다.
간헐적 인 자당 소비
미니 피그 XNUMX 개를 [11C] raclopride 및 [11C] 카르 펜타닐은 기준선에서, 그리고 12 일 연속 자당 수 노출 후 500 일에 다시. 자당 노출은 2 일 동안 매일 12 시간의 자당 (자당, Dansukker, 덴마크 코펜하겐) 물 접근 (2 리터의 물에 XNUMXg의 자당)으로 이루어졌습니다. 자당 섭취량을 기록하고 모든 미니 피그는 매일 XNUMX 리터를 소비했습니다. 또한 동일한 미니 피그 XNUMX 개를 [11급성 오피오이드 방출을 연구하기 위해 첫 번째 자당 접근 30 분 후 C] 카 펜타닐.
미니 돼지는 13.6 일 자당 노출 후 기준선에서 25.4kg (± 0.73SEM)에서 28.9kg (± 0.69SEM)까지 평균 12 % 체중 증가했으며, 이는 상당히 높았습니다 (단측 t- 검정, p < 0.001) 이전 연구에서 얻은 대조군 미니 피그 샘플에서 관찰 된 증가보다, 동일한 발달 기간 동안 체중이 평균 4.9 % 만 증가했습니다.
뇌 PET 영상
이미징 전에 물에 자유롭게 접근하여 돼지를 하룻밤 금식시켰다. 우리는 앞에서 설명한 미니 피그를 미리 약화하고 마취 시켰습니다.97 PET / CT 장치 (Siemens Biograph 64 Truepoint PET)에 앙와위로 배치했습니다. PET 방출 데이터의 해부학 적 정의 및 감쇠 보정을 위해 각 PET 획득 전에 저용량 CT 스캔을 수행했습니다. 우리는 정맥 주사11C] 기준 시점 (360 ± 18 MBq, 비 활동 77 ± 76 GBq / μmol, 주입 된 질량 0.12 ± 0.08 μg / kg) 및 12 일 자당 후 (374 ± 54 MBq, 비 활동 127 ± 85 GBq / μmol, 주입 된 질량 0.06 ± 0.05 μg / kg) 및 [11C] 기준선에서의 카 펜타닐 (377 ± 43 MBq, 비 활동 311 ± 195 GBq / μmol, 주입 된 질량 0.03 ± 0.02 μg / kg) 및 자당 12 일 후 (337 ± 71 MBq, 비 활동 177 ± 157 GBq / μmol, 0.06 분 스캔의 첫 번째 분 동안 귀 정맥을 통해 0.08 mL 식염수로 질량 10 ± 90 μg / kg)을 주사 하였다. 우리는 3 × 3, 21 × 256, 256 × 109의 시간 프레임 구조를 사용하여 TrueX 2D OSEM (5 회 반복, 60 개 서브 세트), 3 × 300 × 4 매트릭스 및 600mm 가우스 필터를 사용하여 PET 데이터를 재구성했습니다. , 2 × 900 초 (총 14 프레임, 90 분). 기준시 및 자당 12 일 후, 미니 피그의 반감기로 인해, 최소 100 분 간격으로 주사 된 두 트레이서로 미니 피그를 촬영 하였다.11C] PET 트레이서. 최종 PET 세션이 완료되면, 우리는 펜 토바 비탈 (100 mg / kg)의 정맥 내 과다 복용으로 심부 마취 하에서 미니 피그를 안락사시켰다.
정량 분석 및 통계
PMOD 3.7 (PMOD Technologies Ltd, 스위스 취리히, 스위스)을 사용하여 전처리 단계를 수행했습니다. 시간 평균 PET 이미지에서 정위 변환 매개 변수를 정의하기 위해 리간드 관련 템플릿을 사용했습니다. 생성 된 변환 매트릭스와 워핑 필드를 해당 동적 PET 시계열에 적용했습니다. [의 파라 메트릭 이미지를 생성했습니다11C] 라 클로 프라이드 결합 전위 (BP)ND) Ichise 및 동료의 다중 선형 기준 조직 방법98. 우리는 무시할 수있는 DA D2 / 3 수용체 밀도의 영역에서 시간이 지남에 따라 소뇌 조직 방사능을 얻기 위해 정자를 배제한 소뇌의 맞춤형 마스크를 만들었습니다. [의 파라 메트릭 이미지를 생성했습니다11로건 참조 조직 모델의 구현을 이용한 C] 카 펜타닐99,100 t * = 30 분 [의 연구11인간 뇌에서 C] 카 펜타닐 결합은 후두 피질을 기준 영역으로 사용 하였다36; 그러나 돼지에서 시간 활동 곡선에 따르면, 변위 불가능한 결합은 후두 피질에서보다 소뇌에서 더 낮았으며, 쥐의자가 방사선학 연구 결과와 일치 하였다.101. 따라서 본 연구에서 소뇌를 기준 영역으로 선택했다.
통계 분석
통계적 비모수 적 매핑 (SnPM v13.01, http://warwick.ac.uk/snpm) 비모수 순열 이론을 활용하여 통계적 추론을위한 프레임 워크를 제공하는 SPM 도구 상자14 앞서 설명한대로 적용102. 돼지 신경 해부학 전문가 (DO)는 결과 이미지를 5 % 중요도 수준으로 임계 값을 고해상도 괴팅겐 미니 돈 아틀라스와 비교했습니다.103,104 감소 된 DA D2 / 3 및 μOR BP의 영역을 정의하고 라벨링ND 기준선에서 자당 후 상태로. 그런 다음 BP를 추출하기 위해 관심 영역 (ROI) 분석을 수행했습니다.ND 선조체, 핵 축적, 시상, 편도, 결막 피질 및 전두엽 피질을 포함하여 SnPM 분석에 기초하여 관심이있는 것으로 밝혀진 특정 영역의 값. 이러한 영역이 SnPM을 사용하여 이미 유의미한 것으로 확인되었으므로 ROI 분석에 대한 추가 통계는 수행되지 않았습니다.
참고자료
- 1.
Smyth, S. & Heron, A. 당뇨병과 비만 : 쌍둥이 전염병. 냇 메드 1275-80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL & Curtin, LR 미국 성인의 비만 유병률 및 경향, 1999-2008. JAMA 303235-241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
캘리포니아 데이비스 외. “소망”에 대한 도파민과“수동”에 대한 오피오이드 : 폭식이 있거나없는 비만 성인의 비교. 비만 (실버 스프링) 171220-1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. 비만 및 음식 환경 :식이 에너지 밀도 및식이 비용. 예방 의학의 미국 저널 27154-162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. & Ahmed, SH 강렬한 단맛이 코카인 보상을 능가합니다. PLoS의 하나 2, e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. & Guillem, K. In 21 세기의 신경 과학 (ed. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS 음식과 중독의 신경 생물학에 대한 추가 발전 : 과학 상태에 대한 업데이트. 영양소 28341-343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
레이튼 뇌의 즐거움 (eds Kringelbach, ML & Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ & Bullmore, ET 미각 쾌락에서 동기 부여에 이르기까지 : 중앙 뮤 오피오이드 수용체 및 폭식 행동. Int J Neuropsychopharmacol 12995-1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, KC Food 보상 : 원하고 좋아하는 두뇌 기질. 신경 과학 및 생물 행동 리뷰 20, 1-25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. 직장에서의 신경 수용체 매핑 : 20 년의 발전 후 결합 잠재력의 정의 및 해석. Int Rev Neurobiol 631-20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG 설탕 및 지방 폭식의 동물 모델 : 음식 중독 및 체중 증가와의 관계. Mol Biol 방법 829351-365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
젤싱, J. 외. Gottingen minipig 뇌의 전전두엽 피질은 신경 투영 기준과 세포 구조에 의해 정의됩니다. 브레인 Res Bull 70322-336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE & Holmes, AP 기능적 신경 영상을위한 비모수 적 순열 테스트 : 예제가 포함 된 입문서. 흠 브레인 맵 15, 1-25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG 설탕 중독에 대한 증거 : 간헐적이고 과도한 설탕 섭취의 행동 및 신경 화학적 효과. 신경 과학 및 생물 행동 리뷰 3220-39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
알론소 알론소, M. 외. 식품 보상 시스템 : 현재의 관점과 미래의 연구 요구. 너트 레브 73296-307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Sucrose자가 투여 및 쥐에서 CNS 활성화. Am J Physiol Regul Integr Comp Physiol 300, R876–884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
텔레 즈, LA 외. 별도의 회로는 설탕의 영양 적 및 영양 적 가치를 인코딩합니다. 자연 신경 과학 19465-470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
콜란 투 오니, C. 외. 과도한 설탕 섭취는 뇌의 도파민 및 뮤 오피오이드 수용체에 대한 결합을 변경합니다. Neuroreport 12, 3549-3552 (2001).
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Opiate 수용체 : 쥐 뇌의자가 방사선 국소화. Proc Natl Acad Sci USA 73, 3729-3733 (1976).
- 21.
Soderman, AR & Unterwald, EM 코카인 보상 및 쥐의 과잉 활동 : 뮤 오피오이드 수용체 조절 부위. 신경 과학 1541506-1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ & Roberts, DC Beta-funaltrexamine은 강화의 점진적 비율 일정에 따라 반응하는 쥐의 코카인자가 투여에 영향을 미칩니다. 약리학, 생화학 및 행동 75, 301-307 (2003).
- 23.
슈뢰더, JA 외. 코카인으로 유도 된 활성, 감작 및 래트에서의 보상에서 뮤 오피오이드 수용체에 대한 역할. 정신 약리학 195265-272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW 코카인에 의한 복원은 복부 팔리 둠에서 mu-opioid 수용체의 내인성 자극을 필요로합니다. 신경 과학 저널 : 신경 과학회 공식 저널 254512-4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
JJ 투 울리 외. 먹이는 인간의 내인성 오피오이드를 방출합니다. J 신경 과학 378284-8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS & Berridge, KC Opioid limbic circuit for reward : hedonic hotspots of nucleus accumbens and ventral pallidum 사이의 상호 작용. J 신경 과학 271594-1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, KC 오피오이드 부위는 껍데기 핵에서 음식을 먹고 쾌락적인 '좋아요'를 매개합니다 : 미세 주입 Fos 깃털을 기반으로 한지도. 뇌 해상도 863, 71-86 (2000).
- 28.
Zhang, M. & Kelley, AE 사카린, 소금 및 에탄올 용액의 섭취는 뮤 오피오이드 작용제를 축핵에 주입함으로써 증가합니다. 정신 약리학 159415-423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA & Kelley, AE 고지방 식품의 섭취는 핵 축적 내 뮤 오피오이드 수용체 자극에 의해 선택적으로 향상됩니다. 약리학 및 실험 치료제 285, 908-914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP & Billington, CJ Naloxone은 식품 제한 쥐의 단 맛으로 인한 사료 공급을 차단합니다. Am J Physiol 268, R248–252(1995).
- 31.
Glass, MJ, Billington, CJ & Levine, AS Opioids 및 음식 섭취 : 분산 된 기능적 신경 경로? Neuropeptides 33360-368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. & Apfelbaum, M. 오피오이드 길항제 인 날트렉손은 인간의 자당 선호도를 감소시킵니다. Am J Physiol 251, R91–96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS 맛 감지 및 인식 임계 값에 대한 날트렉손의 효과. 식욕 32241-249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, 아편 차단제 인 BA Naloxone은 비만 및 마른 여성 폭식을하는 사람들의 달콤한 고지방 음식 섭취를 줄입니다. Am J Clin Nutr 61, 1206-1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW 고유 한 오피오이드 회로는 보상 이벤트의 기호성과 선호도를 결정합니다. Proc Natl Acad Sci USA 10612512-12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
콜라 산티, A. 외. 인간 암 보상 시스템에서 내인성 오피오이드 방출은 급성 암페타민 투여에 의해 유도된다. BIOL 정신과 72371-377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
믹, 나 외. 암페타민은 [11C] 카르 펜타닐 PET로 검출 된 인간 뇌에서 내인성 오피오이드 방출을 유도 하였다 : 독립적 코호트에서의 복제. Int J Neuropsychopharmacol1-6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Gray, RW 오피오이드 펩타이드 및 인간의 섭취 행동 제어. 신경 과학 및 생물 행동 리뷰 26, 713-728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. & Tolle, TR 학습 내용 생체내에서 opioidergic 뇌 영상? Eur J 통증 9117-121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM & Cuntapay, M. 쥐 선조체에서의 도파민-오피오이드 상호 작용 : 델타 오피오이드 수용체 매개 신호 전달에서 도파민 D1 수용체에 대한 조절 역할. 신경 약리학 39, 372-381 (2000).
- 41.
벤치 레 리프, B. 외. 절연성 피질에서의 국소 뮤 오피오이드 수용체 결합은 신경성 폭식증에서 감소되고 공복 행동과 반비례한다. 핵 의학 저널 : 핵 의학회 공식 간행물 46, 1349-1351 (2005).
- 42.
칼슨, 홍콩 외. 비만은 뇌에서 감소 된 뮤 오피오이드이지만 변경되지 않은 도파민 D2 수용체 이용과 관련이있다. J 신경 과학 353959-3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
칼슨, 홍콩 외. 비만 수술 후 체중 감량은 병적 비만에서 뇌 오피오이드 수용체를 정상화합니다. 몰 정신과 211057-1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, JK 내인성 오피오이드 메커니즘은 인간의 비만 및 체중 감소와 관련이 있습니다. J Clin Endocrinol Metab 1003193-3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
마주 리 외. 행동 중독에서 도파민과 Opioid Neurotransmission : 병리학 도박 및 폭식에 비교 애완 동물 연구. Neuropsychopharmacology 421169-1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM 만성 고지방 식단은 뇌에서 mu-opioid 수용체의 출생 후 후 성적 조절을 유도합니다. 신경 정신 약리학 : 미국 신경 정신 약리학 전문 학교의 공식 출판 361199-1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA 전두엽 피질의 외접 부위에서 mu-opioid 수용체 자극에 의한 과식 및 탄수화물 섭취 유도. 신경 과학 저널 : 신경 과학회 공식 저널 313249-3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. 만성 코카인은 코카인 중독 동안 도파민 신호 전달을 약화시키고 D1 수용체 신호에 대한 D2의 불균형을 조절합니다. 신경 과학 저널 : 신경 과학회 공식 저널 3315827-15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
커밍, P. 외. 돼지 뇌에서 도파민 D11 수용체에 대한 혈역학 및 [2,3C] 라 클로 프리드의 결합에 대한 급성 니코틴의 효과. NeuroImage 19, 1127-1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP 히말라야 원숭이의 도파민 D2 수용체에 대한 코카인자가 투여의 효과. 시냅스 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
볼 코브, 노스 다코타 주 외. 등쪽 선조에있는 코카인 큐와 도파민 : 코카인 중독에서 갈망의 메커니즘. 신경 과학 저널 : 신경 과학회 공식 저널 266583-6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
DF, DF 외. 큐 유발 코카인 갈망 중 인간 선조체에서 도파민 수용체의 점유율 증가. Neuropsychopharmacology 312716-2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP & Norgren, R. 구강 자당 자극은 쥐에서 도파민 축적을 증가시킵니다. Am J Physiol Regul Integr Comp Physiol 286, R31–37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. & Telang, F. Imaging 도파민이 약물 남용과 중독에 미치는 역할. 신경 약리학 56(공급 1), 3-8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
왕지 제 외. 두뇌 도파민과 비만. 랜싯 357, 354-357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS 신경 기능 영상으로 평가 한 비만과 약물 중독의 유사성 : 개념 검토. 중독성 질환 2339-53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM & Kenny, PJ Dopamine D2 수용체는 중독과 같은 보상 기능 장애와 비만 쥐의 강박적인 식사에 있습니다. 자연 신경 과학 13635-641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC & Kringelbach, ML 쾌락의 정서적 신경 과학 : 인간과 동물의 보상. 정신 약리학 199457-480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC & Kringelbach, ML 뇌의 즐거움 시스템. 신경 86646-664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. 도파민 뉴런의 예측 보상 신호. J 신경 피시 올 801-27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH식이 요법으로 인한 비만 후 뇌 활동의 변화. 비만 19749-756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. & Norgren, R. Accumbens 도파민의 자당 섭취 메커니즘. 뇌 해상도 904, 76-84 (2001).
- 63.
Rada, P., Avena, NM & Hoebel, BG Daily는 설탕에 대한 폭식을 반복하면 accumbens 껍질에서 도파민을 방출합니다. 신경 과학 134737-744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR & Hajnal, A. 반복적 인 자당 접근은 선조체의 도파민 D2 수용체 밀도에 영향을 미칩니다. Neuroreport 13, 1575-1578 (2002).
- 65.
알시오 외. 도파민 D1 수용체 유전자 발현은 맛좋은 음식에 장기간 노출 될 때 핵 축적에서 감소하며 쥐의식이 유발 비만 표현형에 따라 다릅니다. 신경 과학 171779-787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. & Di Chiara, G. 자유를 먹인 쥐의 음식 자극에 대한 전두엽 및 축축 도파민 전달의 반응성에 대한 연관 및 비 연관 학습 메커니즘의 차동 영향. J 신경 과학 17, 851-861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD 중독의 불균형 신경 회로. Curr Opin Neurobiol 23639-648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. & Pignatti, R. 거식증, 과식증 및 비만 : Iowa Gambling Task (IGT)에 대한 의사 결정 적자 공유. J Int Neuropsychol Soc 16711-715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL 의사 결정 적자 및 과식 : 비만의 위험 모델. Obes Res 12929-935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
볼 코브, 노스 다코타 주 외. 낮은 도파민 선조체 D2 수용체는 비만 환자의 전전두엽 대사와 관련이있다 : 가능한 기여 인자. NeuroImage 421537-1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, BW 편도체 중심핵은 등측 선조체와 상호 작용하여 습관 획득을 조절합니다. J 신경 과학 321073-1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
그랜트 외. 큐 유발 코카인 갈망 중 메모리 회로 활성화. Proc Natl Acad Sci USA 93, 12040-12045 (1996).
- 73.
차일드리스, AR 외. 큐 유발 코카인 갈망 중 변연 활성화. Am J Psychiatry 15611-18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV & Berridge, KC 무엇을 언제 "원"해야합니까? 편도체 기반의 설탕과성에 대한 인센티브 부각. 정신 약리학 221407-426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF & Volkow, ND Neurobiology of addiction : a neurocircuitry analysis. 바소 정신과 3760-773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. 배고픔과 포만감의 생리적 상태 동안 순수한 맛 자극에 대한 반응으로 피질 활성화. NeuroImage 441008-1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
포트로스, A. 외. 편도 및 해 마에서 코카인 큐 유도 도파민 출시 : 코카인 종속 참가자에서 고해상도 PET [(1) (8) F] fallypride 연구. Neuropsychopharmacology 381780-1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. 외. 쥐에서 약물 관련 자극에 의해 코카인을 찾는 행동의 제어 : 편도 및 핵 accumbens에서 소멸 된 오퍼레이터-반응 및 세포 외 도파민 수준의 회복에 미치는 영향. Proc Natl Acad Sci USA 97, 4321-4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE 기저 측 편도체 내 도파민 D1 또는 D2 수용체 길항 작용은 코카인 탐색의 큐 유도 복원에 필요한 코카인-큐 연관의 획득을 차별적으로 변경합니다. 신경 과학 137699-706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
투미 넨, L. 외. 비만에서 비정상적인 mesolimbic dopamine-opiate 상호 작용 NeuroImage 12280-86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Schultz, W. 행동 도파민 신호. 트렌드 신경 과학 30203-210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR & van der Kooy, D. 아편 제 동기의 신경 생물학. 차가운 봄 Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Nicotinic 및 선조체 도파민 D2 수용체 매개 전달의 오피오이드 수용체 조절. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
노무라 Y 외. 비-스트리 아형 인간 뇌 영역에서 [C-2] 라 클로 프리드로 측정 된 도파민 D3 / 11 수용체 이용 가능성의 연령 관련 감소 : XNUMX 가지 방법의 비교. NeuroImage 41, T133–T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
알라 쿠 르티, K. 외. striatal 및 extrastriatal 도파민 D2 / 3 수용 체 바인딩의 장기 테스트 재시험 신뢰성 : [(11) Cracracride 및 고해상도 PET 연구. J Cereb Blood Flow Metab 351199-1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ 파킨슨 병의 약리학 적 도전 후 내인성 도파민 방출. 앤 뉴롤 53647-653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
N. 사와 모토 외. 파킨슨 병의인지 결핍 및 선조체 도파민 방출. 뇌 1311294-1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
JE 스벤손 외. 살아있는 인간 두뇌에서 extrastriatal [(11) C] raclopride 바인딩 정량화의 유효성과 신뢰성. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
츠 카다 외. 이소 플루 란 마취는 도파민 수송 체에 대한 코카인 및 GBR12909의 억제 효과를 향상시킨다 : 원숭이 뇌에서 미세 투석과 병용 한 PET 연구. 뇌 해상도 849, 85-96 (1999).
- 90.
하순, W. 외. 깨어있는 고양이의 선조체에서 [11C] raclopride 결합에 대한 PET 연구 : 마취 효과와 뇌 혈류의 역할. 핵 의학 및 분자 영상의 유럽 저널 30141-148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. 치료 저항성 우울증에서 케타민의 역할 : 체계적인 검토. Curr Neuropharmacol 12444-461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
버먼, RM 외. 우울증 환자에서 케타민의 항우울제 효과. BIOL 정신과 47, 351-354 (2000).
- 93.
Browne, CA & Lucki, I. 케타민의 항우울제 효과 : 빠르게 작용하는 새로운 항우울제의 기본 메커니즘. 프론트 파마 콜 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
알토, S. 외. 케타민은 사람의 선조체 도파민 D2 수용체 결합을 감소시키지 않습니다. 정신 약리학 164401-406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. & Tsukada, H. R- 케타민이 아닌 에스 케타민을 단일 투여 한 후 선조체에서 도파민 D2 / 3 수용체 결합 감소 : PET 의식이있는 원숭이에서 공부합니다. 유르 아치 정신과 클린 뉴로시 267173-176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
알 스트 럽, AK 외. 방사성 리간드의 흡수 또는 결합에 대한 마취 및 종의 영향 생체내에서 괴팅겐 미니 돼지에서 BioMed 연구 국제 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
TP (Lillethorup) 외. 미니 피그에서 만성 프로 테아 좀 억제의 종 방향 모노 아 민성 PET 영상화. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE 선형 회귀 분석에 의한 신경 수용체 매개 변수 추정을 개선하기위한 전략. J Cereb Blood Flow Metab 221271-1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
로건, 제이 외. PET 데이터의 그래픽 분석에서 혈액 샘플링없이 분포 부피 비율. J Cereb Blood Flow Metab 16834-840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ [11C] carfentanil을 사용한 뇌 뮤 오피오이드 수용체의 정량화 : 참조 조직 방법. Nucl Med Biol 30, 177-186 (2003).
- 101.
Panksepp, J. & Bishop, P. 쥐 뇌에서 (3H) 디 프레 노르 핀 결합의자가 방사선지도 : 사회적 상호 작용의 효과. 브레인 Res Bull 7, 405-410 (1981).
- 102.
란다 우, AM 외. Electroconvulsive 자극 돼지 뇌에서 대뇌 피 질의 및 피 질의 11HT100,907A 수용 체에 [(5) C] MDL2 바인딩에 차동 영향을 미칩니다. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. Gottingen minipig의 종뇌, 세포 구조 및 피질 표면 해부학. 뇌 구조 기능 2222093-2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR Gottingen minipig 뇌의 온라인 조직학 아틀라스. 헬리 욘 5, e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
감사의 글
AML에 대한 오르후스 대학교“AU Ideas Project Development Grant”는이 연구에 자금을 지원했습니다. 우리는 동물의 치료에 도움을 주신 오르후스 대학교 병원 PET 센터와 오르후스 대학교 농장 직원의 기술 지원에 감사드립니다. 이러한 연구의 시작에 도움을 주신 Morgen Kringelbach 교수, Jørgen Scheel-Kruger 교수 및 Arne Møller 부교수에게 감사드립니다.
윤리 선언
경쟁 관심
저자는 경쟁적 이익을 선언하지 않습니다.
추가정보
발행인 메모 Springer Nature는 게시 된지도 및 기관 제휴에서 관할권 주장과 관련하여 중립적입니다.
권리와 권한
오픈 액세스 이 문서는 Creative Commons Attribution 4.0 국제 라이센스에 따라 라이센스가 부여됩니다.이 라이센스는 원작자와 소스에 적절한 크레딧을 제공하는 한 매체 나 형식에 관계없이 사용, 공유, 적응, 배포 및 복제 할 수 있습니다. Creative Commons 라이센스에 연결하고 변경 여부를 나타냅니다. 이 기사의 이미지 또는 기타 제 XNUMX 자 자료는 해당 자료에 대한 신용 한도에 달리 명시되지 않는 한 기사의 크리에이티브 커먼즈 라이센스에 포함됩니다. 기사의 Creative Commons 라이센스에 자료가 포함되어 있지 않으며 의도 된 사용이 법정 규정에 의해 허용되지 않거나 허용 된 사용을 초과하는 경우 저작권 소유자로부터 직접 허가를 받아야합니다. 이 라이센스의 사본을 보려면 다음을 방문하십시오 http://creativecommons.org/licenses/by/4.0/.