핵 accumbens 도파민은 일부일처 설치류 종에서 암페타민에 의한 사회적 결합의 손상을 매개한다
핵 accumbens 도파민은 일부일처 설치류 종에서 암페타민에 의한 사회적 결합의 손상을 매개한다
Proc Natl Acad Sci US A. Jan 19, 2010; 107 (3) : 1217–1222입니다.
온라인 Dec 29, 2009 게시. doi : 10.1073 / pnas.0911998107
PMCID : PMC2824263
신경 과학
얀 리우,a,b 브랜든 제이 아라 고나,c 킴벌리 에이 영,a,b 데이비드 M. 디 에츠,b,d,e 모하메드 카바 즈,b,d 미셸 마제이 로비슨,e 에릭 제이 네슬러,e 및 왕 주 옥신a,b,1
이 기사는 인용구 : PMC의 다른 기사
추상
대초원 들쥐 (Microtus ochrogaster)는 짝짓기 후 쌍 결합을 형성하는 사회적 일부일처 설치류 종으로서, 중심 도파민 (DA)이 연루된 행동이다. 여기, 남성 프레리들 쥐를 사용 하여 페어 본딩 및 관련 신경 회로에 약물 노출의 영향을 조사했다. 우리의 첫 번째 실험에서, 암페타민 (AMPH) 동기 행동은 조건부 장소 선호도 (CPP) 패러다임을 사용하여 조사되었으며 D1- 유사 DA 수용체의 활성화에 의해 매개되는 것으로 나타났다. 다음으로, 페어 본딩에 대한 AMPH 노출의 반복 효과를 조사했습니다. CPP를 유도하는데 효과적인 용량으로 AMPH로 전처리 된 수컷은 교배-유도 된 파트너 선호도를 나타내지 않는 반면, 온전한 및 식염수 전처리 된 대조군 수컷은 짝짓기-유도 파트너 선호도를 나타냈다. 이러한 AMPH 처리는 또한 핵 축적 (NAcc)에서의 D1, DA 수용체 발현을 향상 시키지는 않았다. 또한, NAcc에서 D2- 유사 DA 수용체의 약리학 적 차단은 AMPH- 처리 된 수컷에서 짝짓기 유발 파트너 선호도를 구제 하였다. 함께, 우리의 데이터 AMPH 노출 반복 NAcc DA 수용 체 특정 메커니즘을 통해 남성 프레리 밭의 행동 레퍼토리를 좁힐 수 있습니다 쌍 결합 형성의 장애를 나타냅니다.
체력을 증진시키는 동기 부여 및 정서적 행동은 mesolimbic dopamine (DA) 시스템을 포함한 뇌 보상 회로에 의해 규제된다는 것이 널리 인정되고 있습니다.1, 2). 이 시스템은 종종 음식 섭취와 성행위와 관련이 있지만 (3, 4), 청소년 간의 사회적 놀이 및 부모와 자손 간의 사회적 유대와 같은 자연적으로 발생하는 다른 행동에 연루되어있다.5-9). 종종 연구에서 대표자 사이에 형성되는 사회적 유대, 즉 페어 본드가 부족합니다. 사회적으로 일부일처 쥐 설치류 종인 프레리 볼을 사용한 최근 조사 (Microtus ochrogaster()10-12), 쌍 결합 형성 및 유지에 기초한 많은 신경 조절이 핵 축적 (NAcc) 내에서 발생한다는 것을 나타낸다 (13-15) — 동기 부여 된 행동을 중재하는 데 중요한 중음부 뇌 영역 (1, 2, 16).
동기 부여 회로가 급식, 교배 및 사회적 유대와 같은 체력 향상 행동을 촉진하기 위해 진화했지만 (1, 17), 그것은 남용의 약물에 의한 인공 발작에 취약하다.8). 예를 들어, 코카인 및 암페타민 (AMPH)과 같은 남용의 정신 자극 약물을 투여하면 mesolimbic DA 활동이 지속적으로 변경됩니다 (18, 19). 이것들과 다른 중독성 약물에 의한이 회로에 대한 강한 영향은 자연적 인센티브의인지 된 가치를 감소시키는 것으로 제안되었습니다 (20), 사회적 특성을 포함하여 (8). 마약 중독자가 사회적 행동을 방해하는 것으로 알려져 있지만 (21), 약물 경험과 사회적 애착 사이의 상호 작용에 대한 신경 조절은 잘 이해되지 않았다. 이는 성인 상호 작용 사이에 사회적 유대를 나타내지 않는 전통적인 실험실 설치류에서 부분적으로 이러한 상호 작용을 모델링하기 어렵 기 때문입니다.
이러한 사회적 부착의 신경 생물학, 특히 성인 간의 쌍 결합은 대초원에서 광범위하게 연구되었습니다 (10-12) 최근에이 종은 AMPH의 동기 부여 가치를 조사하기위한 실용적인 모델로 확립되었습니다.22). 또한, 페어 본드 형성 및 AMPH 강화는 NAcc 내에서 DA 전송에 의해 적어도 부분적으로 매개된다 (14, 15, 23). 따라서, 본 연구는 프레리 볼 모델을 사용하여 사회적 결합에 대한 약물 노출의 영향을 연구하기위한 행동 분석을 확립하고 이러한 행동 효과의 근본 인 신경 메카니즘을 밝혀 내기 위해 NAcc DA 신호 시스템에 초점을 맞추었다.
결과
AMPH- 유도 조건부 환경 설정 (CPP)은 수용체 별 방식으로 DA에 의해 조정됩니다.
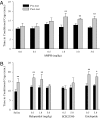
CPP의 형성은 시험 전과 비교하여 3 일의 AMPH 컨디셔닝 후, 시험 후 AMPH- 페어 케이지에서 소비 된 시간의 현저한 증가에 의해 정의되었다. 식염수 주사 또는 두 가지 최저 복용량의 AMPH를 함유 한 식염수 (0.1 및 0.5 mg / kg)가 케이지 환경 설정을 변경하지 않았습니다 (Fig. 1A). 그러나 수컷은 1.0 (t = 2.87, P <0.01), 3.0 (t = 3.63, P <0.01) 또는 5.0mg / kg (t = 3.03, P <0.01), 표시된 CPP (Fig. 1A).
AMPH가 대초원 밭에서 DA 신경 전달을 유의하게 증가시키기 때문에 (24), DA는 다른 종에서 AMPH 강화를 중재합니다 (23), 우리는 다음 남성 프레리 voles에서 AMPH 유발 CPP의 DA 수용 체 (DAR) 규제 검사. 1.0 일 동안 컨디셔닝하는 동안 AMPH (3 mg / kg) 주사 전에 상이한 용량의 비 선택적 DAR 길항제 (할로페리돌)를 함유하는 식염수 또는 식염수로 처리 된 CPP 패러다임에서 대상체를 사전 시험 한 후, 사후 시험에서 CPP를 시험 하였다. 식염수로 치료 한 대상 (t = 2.69, P <0.01) 또는 0.1 개의 가장 낮은 용량의 할로페리돌을 함유하는 식염수 (XNUMX mg / kg; t = 3.62, P <0.01; 1.0 mg / kg; t = 3.89, P <0.01) AMPH 컨디셔닝 이전에는 AMPH 유도 CPP가 나타 났고, 5.0mg / kg의 haloperidol은 AMPH 유도 CPP를 차단하여 AMPH의 행동 효과에 DAR이 관여 함을 보여줍니다 (Fig. 1B). AMPH- 유도 된 CPP를 매개하는 DAR 서브 타입을 결정하기 위해, 본 발명자들은 컨디셔닝 동안 D1- 유사 특정 길항제 (SCH23390) 또는 D2- 유사 특정 길항제 (eticlopride)를 투여 하였다. D2- 유사 길항 작용은 AMPH- 유도 CPP를 차단하지 않았다 (t = 3.15, P 0.01 mg / kg의 경우 <0.5 및 t = 2.60, P 0.05 mg / kg 에티 클로라이드의 경우 5.0 미만) D1 유사 수용체 차단은 AMPH 유도 CPP를 제거했습니다 (Fig. 1B), AMPH- 유도 된 CPP가 남성 프레리 밭에서 D1- 유사, D2- 유사 수용체의 활성화에 의해 매개됨을 입증한다.
AMPH 경험은 짝짓기 유도 파트너 선호도 형성을 변경합니다.
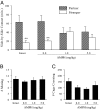
AMPH- 유도 CPP가 D1- 유사 수용체의 활성화를 요구했지만 (Fig. 1B), 우리는 D1- 유사 수용체의 활성화가 교합-유도 된 쌍 결합 형성을 막는 것을 이전에 보여 주었다 (14). 따라서, 우리는 AMPH 전처리가 남성 프레리 밭에서 짝짓기 유도 쌍 결합을 방해 할 것이라는 가설을 세웠다. 수컷을 1.0 일 동안 주사 (무 손상), 식염수 주사, 또는 5.0 또는 3 mg / kg AMPH 주사 (CPP를 유도하기에 충분한 주사 패러다임)를받지 않은 4 개의 그룹으로 나누었다. 넷째 날, 모든 수컷은 24 h에 대해 성적으로 수용되는 암컷과 짝을 지어 파트너 선호도를 테스트했습니다. 이전 연구와 일치14, 25-27), 짝짓기 전 3 일 동안 식염수 주사를받은 온전한 수컷 및 수컷은 짝짓기 유발 파트너 선호도 (완전한 수컷; t = 3.05, P <0.01, 식염수 주입 수컷; t = 3.21, P <0.01; Fig. 2A). 그러나 짝짓기 전 3 일 동안 AMPH를 복용 한 남성은 파트너의 선호도를 보여주지 못했습니다 (Fig. 2A). 중요하게도, AMPH 전처리는 동거 기간 동안 결합 빈도에 영향을 미치지 않았다 (F(3, 26) = 0.26, P = 0.85; Fig. 2B) 또는 파트너 선호도 테스트 중 운동 활동 (F(3, 26)= 2.34, P = 0.10; Fig. 2C), AMPH가 짝짓기 유도 파트너 선호도를 직접 방해했음을 나타냅니다.
AMPH 경험은 NAcc에서 D1 수용체를 높입니다.
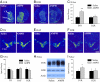
AMPH 사전 노출로 인해 파트너 선호도가 손상되고 AMPH로 유도 된 CPP (위 참조)와 페어 본딩 (14)는 NAcc DA에 의해 규제되며, AMPH가 남성 프레리 밭에서 mesolimbic DA 회로를 크게 변화시킬 것이라는 가설을 세웠다. 상기 언급 된 행동 실험으로부터 대상체의 뇌를 DA 마커 mRNA의 인시 튜 라벨링을 위해 처리 하였다. AMPH (1.0 mg / kg)로 처리 된 수컷은 D1 수용체 (D1R; t = 3.06, P <0.01), 그러나 D2 수용체 (D2R)는 아니지만, 식염수 전처리를받은 수컷과 비교하여 NAcc 내 mRNA 표지 (Fig. 3 A-C). 그러나 NAcc에 2 차 도파민 성 입력을 제공하는 뇌 영역 인 VTA (ventral tegmental area) 내 티로신 하이드 록 실라 제 (TH), DA 수송 체 (DAT) 또는 DXNUMXR에 대한 mRNA 라벨링의 밀도에서 그룹 차이가 발견되지 않았습니다 (Fig. 3 D-G). NAcc에서 D1R의 증가 된 발현은 웨스턴 블 롯팅에 의해 추가로 확인되었다 (t = 1.90, P <0.05; Fig. 3 H 및 I). 함께, 이들 데이터는 AMPH 노출이 수컷 프레리 밭의 mesolimbic DA 시스템에 수용체 및 부위-특이 적 영향을 미침으로써 NAcc에서 D1R의 수준을 증가 시킨다는 것을 나타낸다.
NAcc의 D1 수용체는 파트너 기본 설정의 AMPH 장애를 중재합니다.
우리는 이전에 남성 프레리 밭에서 NAcc 내에서 D1R의 활성화가 파트너 선호도 형성을 막는 것을 보여주었습니다.14), 현재 연구에 따르면 AMPH 노출이 NAcc에서 D1R을 상향 조절한다는 것이 입증되었습니다 (Fig. 3). 따라서, AMPH에 의해 파트너 선호도의 손상이 NAcc 내의 D1R에 의해 매개된다는 가설을 검정 하였다. 수컷은 NAcc 포탄을 양측으로 향한 고정 관념 캐뉼라를 받았다 (Fig. 4A). 상이한 용량의 D1- 유사 수용체 길항제 SCH23390를 함유하는 인공 뇌척수액 (CSF) 단독 또는 CSF를 컨디셔닝 1.0 일 동안 AMPH 주사 (3 mg / kg) 전에 NAcc에 주사 하였다. 그 후, 피험자들은 24 h 동안 암컷과 짝을 지어 파트너 선호도를 테스트했습니다. 위의 실험과 마찬가지로 (Fig. 2), AMPH 노출은 CSF의 NACC 내 주사 또는 저용량의 SCH23390를받은 남성에서 짝-유도 파트너 선호도를 방지 하였다 (Fig. 4B). 그러나 고용량의 SCH23390 (100 ng / kg)를 주사 한 남성은 파트너 선호도를 표시했습니다 (t = 2.55, P <0.05), 이는 NAcc에서 D1R 차단이 AMPH로 인한 파트너 선호 형성의 손상을 제거했음을 나타냅니다 (Fig. 4B). 파트너 선호도 테스트 중 동거 또는 운동 활동 중 짝짓기 빈도에서 그룹 차이가 발견되지 않았습니다.
토론
이 연구에서 우리는 AMPH 노출이 남성 프레리 밭에서 CPP를 유도한다는 이전의 발견을 반복한다.22) 및 NAcc에서 D1R 활성화가이 행동에 필요하다는 것을 증명하고, 다른 설치류 종의 연구와 일치하는 결과 (28). 이 연구는 이전 연구와 함께 NAcc의 고유 한 DAergic 메커니즘이 AMPH 및 파트너 동기 동작을 조절 함을 제안합니다. AMPH 동기 동작 (CPP)은 D1R에 의해 조정되는 반면 파트너 동기 동작 (파트너 기본 설정)은 D2R에 의해 촉진됩니다 NAcc 내에서 D1R 활성화에 의해 활성화 및 억제됨 (13-15). [NAcc에서 D2R 활성화는 특정 조건에서 약물 유발 CPP를 매개한다는 점에 유의해야합니다.29) 및 D1R 활성화는 자손을 향한 행동과 같은 다른 사회적 동기 행동에 관여합니다 (7, 30)].
CPP의 차별적 DAergic 조절 및 파트너 선호도 형성은 상이한 DAR 서브 타입을 활성화시키는 자극 유발 DA 농도의 정도의 차이에 의해 달성 될 수있다. 결합 친화 성의 차이로 인해, 낮은 친화력 D1R을 활성화시키기 위해서는 DA 농도의 강력한 상승이 요구되는 반면, DA 농도의 완만 한 증가는 높은 친화력 D2R을 우선적으로 활성화시킨다31). 대초원에서, AMPH는 DA 농도의 훨씬 더 큰 증가를 일으킨다 (24)가 짝짓기 (15, 25). 이 데이터는 사회적 상호 작용 동안 DA 농도가 비교적 완만하게 증가 함을 시사합니다 (15, 25) 고친 화도 D2R의 특이 적 활성화를 허용하여 쌍 결합 형성을 용이하게한다. 반대로, AMPH 투여 후 DA 농도의 강력한 증가는 저 친화도 D1R을 활성화시키기에 충분하여 AMPH- 유도 된 CPP를 촉진시킨다.
DA에 의한 수용체 특이 적 행동 조절은 약물 및 자연 자극이 NAcc 내의 별개의 뉴런 집단에 의해 처리됨을 보여주는 자유롭게 움직이는 쥐에서의 세포 외 전기 생리 학적 연구와 일치한다.32). 이러한 전기 생리 학적 연구가 개별 뉴런에서 발현 된 DA 수용체의 아형을 식별 할 수는 없지만 해부학 적 연구는 NAcc가 공 발현이 거의없는 D1R 또는 D2R을 발현하는 프로젝션 뉴런으로 구성되어 있음을 보여줍니다 (33). Psychostimulants는 우선적으로 D1Rs에서 신호 전달 분자의 증가 된 인산화에 의해 결정되는 세포 내 신호 전달 경로를 활성화시킵니다.34) 이전에 이러한 신호 경로의 활성화가 파트너 선호도 형성을 방해하는 것으로 나타났습니다 (35). 따라서 비록 NAcc 내에서 DA 전송이 AMPH에 대한 반응과 파트너 선호도의 형성에 중요한 역할을하지만, 이러한 행동은 선조 투영 시스템을 구성하는 별개의 미세 회로를 통해 매개 될 수있다.33, 36). 이는 쌍 결합 형성이 우선적으로 배쪽 팔지에 투영되는 D2R- 발현 뉴런의 활성화에 의해 매개되기 때문에 특히 중요하다 (33), 페어 본딩에 중요한 또 다른 뇌 영역 (26).
이 연구에서 우리는 AMPH 경험이 짝짓기 유도 쌍 결합을 막는 증거를 제공합니다. 이들 실험에서 파트너 선호도 시험이 마지막 AMPH 노출 후 (즉, 약물이 완전히 대사 된 후) 48 시간에 수행됨에 따라, 이들 데이터는 AMPH가 사회적 결합에 대한 지속적인 영향을 시사한다. 다른 종에서 AMPH의 영향과 일치하는 하나의 잠재적 메커니즘37, 38)에 의해 AMPH가 페어 결합을 손상시킬 수있는 것은 NAcc 내에서 D1R 발현의 증가를 통한 것이다. 이 개념은 파트너 선호도 형성에서 NAcc D1R의 길항 적 역할에 의해 뒷받침됩니다 (14, 24) 및 AMPH- 처리 된 동물에서 NACC D1R 차단에 의한 짝-유도 파트너 선호의 구조를 입증하는 현재 데이터에 의해 (Fig. 4). 흥미롭게도, 우리는 이전에 남성 프레리 밭에서 1 주 페어 본딩 후 NAcc D2R의 상향 조절이 성적 수용 여성을 포함하여 특정 낯선 사람에 대한 선택적 침략을 촉진한다는 것을 보여 주었다.이 신경 가소성은 남성 신경이 진화하는 메커니즘임을 암시 이미 확립 된 페어 본드 유지 (14). 현재의 연구는 AMPH가 인위적으로이 신경 가소성을 유발하여 AMPH- 페어 결합의 결손으로 이어진다 고 제안한다. AMPH- 치료 된 수컷은 암컷을 혐오 상태 인 AMPH 철수와 연관시킬 수 있으며, 따라서 이러한 부정적인 연관은 AMPH 쌍 결합의 손상의 기초가 될 수있다. 이전의 연구에 따르면 d- 암페타민의 증가하는 복용량 일정에서 철수하면 수컷 쥐의 성적 행동이 손상되는 것으로 나타났습니다.39). 그러나 우리의 연구에서, 다른 치료군의 들쥐는 비슷한 짝짓기를 보여 주었다 (Fig. 2B), 아마도 암페타민에서 철수 상태가 아님을 나타냅니다. 그럼에도 불구하고이 가능성은 추가 조사가 필요합니다.
약물에 의한 신경 가소성은 약물 중독의 기본이라는 것이 잘 확립되어있다 (40). 정신 자극제는 mesolimbic DA 시스템에서 구조적 가소성을 극적으로 변화시킵니다.41) D1 발현 뉴런에서 이러한 변화가 더 오래 지속됨을 암시하는 증거가 있습니다 (37). 또한 전기 생리학 연구에 따르면 코카인 경험은 NAcc 내에서 후속 신경 가소성을 줄일 수 있음을 보여주었습니다.42). 실제로, NAcc의 약물-유도 된 신경 재구성은 복잡한 환경에 신규 노출 후 자연적으로 발생하는 신경 재구성을 약화시킨다 (43). 따라서 약물 중독은 학습과 기억의 장애로 널리 인식되지만 (1, 40, 44), mesolimbic circuits에서 추가적인 변경 가능성의 약물로 인한 손실이 중독에 필수적 일 수 있다고 종종 인식되지 않는다. 이러한 가소성의 감소는 약물 구제에 대한 행동 레퍼토리를 제한 할 수있다. 따라서 AMPH- 처리 된 용적이 감소 된 쌍 결합 거동을 나타내는 것은 놀라운 일이 아니다. 페어 본딩에 대한 AMPH 노출의 현재 효과는 모성 행동을 포함한 다른 사회적 행동에 대한 정신 자극제의 유해한 효과를 보여주는 이전 연구와 일치합니다 (45-47) 및 소셜 플레이 (48-50). 이러한 연구는 약물과 사회적 자극이 뇌에서 어떻게 상호 작용하는지에 대한 시험이 인간의 사회적 행동과 약물 사용 사이의 강한 상호 작용에 대한 이해를 크게 확장시킬 수 있다는 약속을 제공한다21).
재료 및 방법
제목.
피험자들은 실험실 번식 식민지에서 성적으로 순진한 남성 프레리 밭이었다. 피험자들은 21 일령에 젖을 먹었고 물과 음식이 임의로 제공되는 플라스틱 케이지 (12 × 28 × 16 cm)에 동성 형제 쌍으로 수용되었습니다. 모든 케이지는 14 : 10 명암 주기로 유지되었고 온도는 대략 20 ° C였다. 모든 피험자는 시험했을 때 약 90 일이었습니다. DA 약물의 정위 적 캐뉼 레이션 및 부위-특이 적 주입은 다른 곳에서 상세하게 설명되어있다 (14).
행동 테스트.
CPP 테스트는 앞에서 설명한대로 수행되었습니다 (22)에 따라 다음과 같은 예외가 있습니다. 각 피험자에 대한 초기 케이지 선호도는 30 일에 1- 분 전 시험에서 결정되었다. 이어서, 40 분 세션 동안, 피험자를 비선호 케이지에 AMPH 및 선호 케이지에 식염수를 사용하여 컨디셔닝 하였다 (AMPH 및 식염수 주사 모두 6 h 간격으로) 3 연속 일 (2-4 일) 동안. 그 후, 5 일에 CPP의 존재에 대해 대상체를 시험 (사후 시험) 하였다.
파트너 선호도 테스트는 앞에서 설명한대로 수행되었습니다 (14). 간단히, 시험 장치는 중공 튜브 (12 × 28 cm)에 의해 각각 자극 동물을 수용하는 2 개의 평행 한 동일한 케이지에 연결된 중앙 케이지 (16 × 7.5 × 16 cm)로 구성되었다. 자극 동물은 친숙한 "파트너"(피험자의 여성 메이트)와 서로 직접 접촉하지 않고 별도의 케이지 내에서 느슨하게 묶인 낯선 "낯선 사람"(이전에 피험자와 접촉하지 않은 여성)이었습니다. 3-h 테스트를 시작할 때, 대상체를 중앙 케이지에 놓고 장치 전체에서 자유롭게 움직일 수있게 하였다. 타임 랩스 비디오 녹화 시스템을 사용하여 동작을 기록했습니다. 조작을 맹인 한 실험자들은 테이프를 검토하고 대상의 행동을 기록했다. 파트너 선호도는 샘플이 표시 한 것처럼 대상이 낯선 사람보다 파트너와 나란히 접촉하는 데 더 많은 시간을 소비하는 것으로 정의되었습니다. t 테스트 (27).
현장 하이브리드 화 및 웨스턴 면역 블 롯팅.
특정 안티센스 리보 로브 (표 1)를 D1R, D2R, TH 및 DAT in situ mRNA 표지에 사용 하였다. 라벨링은 35앞에서 설명한대로 각 DA 마커에 대한 S- 표지 프로브 및 감지 mRNA 컨트롤 (51). 웨스턴 블 롯팅 분석을 위해, DAR 단백질을 NAcc 조직 펀치의 상청액으로부터 추출하고 전술 한 바와 같이 분석 하였다 (52).
데이터 수량화 및 분석.
CPP 및 파트너 선호도는 샘플 쌍으로 결정 t 테스트. 파트너 선호도 테스트 동안 암컷 및 케이지 항목과의 첫 번째 6 h 쌍 동안 짝짓기 시합에서의 그룹 차이는 ANOVA로 분석되었습니다. NAcc에서의 D1R 및 D2R mRNA 라벨링뿐만 아니라 VTA에서의 TH, DAT 및 D2R mRNA 라벨링의 광학 밀도는 컴퓨터 화 된 이미지 프로그램 (NIH IMAGE 1.64)을 사용하여 오토 라디오 그램으로부터 정량화되었다. 식염수 대조군의 평균 변화 백분율로 데이터를 제시하였고, 그룹 차이는 다음과 같이 분석 하였다 : t 테스트. 마지막으로, 웨스턴 블 롯팅 실험으로부터의 x- 레이 필름상의 D1R 및 D2R 라벨링의 광학 밀도는 t 테스트.
실험적 설계.
실험 1a는 AMPH- 유도 CPP에 대한 용량-반응 곡선을 확립했다. 1 일에 CPP 장치에서 피 험체를 사전 시험하였고, 상이한 농도의 AMPH를 함유하는 식염수의 ip (ip) 주사를받은 6 개의 실험 그룹 중 하나에 무작위로 할당 하였다 [0 (n = 12), 0.1 (n = 8), 0.5 (n = 9), 1.0 (n = 12), 3.0 (n = 12) 또는 5.0 mg / kg (n = 13)]) 3 일 (2–4 일) 컨디셔닝 기간 동안 5 일의 사후 테스트에서 CPP를 테스트했습니다.
실험 1b는 AMPH- 유도 CPP에서 DA 수용체의 역할을 밝혀냈다. CPP 장치에서 대상체를 사전 시험하고 식염수의 sc (sc) 주사를받은 8 개의 실험 그룹 중 하나에 무작위로 배정 하였다 (n 상이한 농도의 비 선택적 DA 수용체 길항제 [할로페리돌; 10 (n = 8), 1.0 (n = 8) 또는 5.0mg / kg (n = 8)] 또는 D1와 유사한 특정 (SCH23390; 0.5 (n = 7) 또는 5.0 mg / kg (n = 7)] 또는 D2- 유사 특이 적 DA 수용체 길항제 [에티로 프라이드; 0.5 (n = 8) 또는 5.0 mg / kg (n = 8)]. 30 분 후, 실험 1.0a에서 CPP를 유도 한 AMPH (1mg / kg)의 역치 용량을 AMPH 컨디셔닝에 사용 하였다. AMPH 컨디셔닝 3 일 후, 모든 대상체는 CPP 포스트 테스트를 받았다.
실험 2는 AMPH 경험이 페어 본딩을 방해하는지 여부를 조사했습니다. 식염수의 ip 주사를받은 3 개의 실험군 중 하나에 피험자를 무작위로 배정 하였다 (n = 8) 또는 1.0 mg / kg 함유 식염수 (n = 8) 또는 5.0 mg / kg (n = 7) 3 연속 일 동안 하루에 한 번 AMPH-남성 프레리 밭에서 CPP를 유도하는 패러다임. 넷째 날, 대상체를 24 h 동안 에스트로겐-프라임 된 암컷과 짝을 이루었다 (14) 다음 3-h 파트너 환경 설정 테스트에서 테스트되었습니다. 주사를받지 않은 온전한 수컷의 네 번째 실험 그룹 인 페어 본딩에 대한 주사의 잠재적 영향을 제어하기 위해 (n = 6)를 24 h 동안 에스트로겐 프라이밍 된 암컷과 짝을 지어 파트너 선호도에 대해 테스트했습니다. 모든 행동 테스트는 짝짓기 검증을 위해 비디오로 녹화되었습니다. 파트너 및 낯선 사람과 나란히 접촉하는 대상의 기간을 정량화 하였다. 또한, 6-h 파트너 선호도 테스트 동안 페어링 및 운동 활동의 첫 번째 3 h 동안의 교합 시합 빈도 (케이지 교차로 표시)를 정량화 하였다. 파트너 선호도 테스트 후 대상은 즉시 사망했습니다. 모든 뇌를 수거하고, 드라이 아이스에서 냉동시키고, DA 마커 mRNA의 인시 튜 하이브리드 화 표지를 위해 -80 ℃에 저장 하였다.
실험 3는 AMPH- 손상 페어 결합이 mesolimbic DA 활동의 변화와 관련이 있는지를 조사했다. 식염수를받은 대상체의 뇌 (n = 8) 또는 1.0 mg / kg AMPH (n 실험에서 8) 2를 극저온 / 플러스 슬라이드 (Fisher Scientific) 상에 해동 된 코로 날 섹션 (14 μm 두께)으로 크라이 오 스타트에서 절단 하였다. D98R, D1R, TH 및 DAT mRNA의 인시 튜 하이브리드 화 라벨링을 위해 2-μm 간격에서의 뇌 절편을 처리 하였다. 1.0 mg / kg AMPH 경험이있는 덩굴은 식염수 주입 대조군과 비교하여 NAcc의 mRNA 표지 인 D1R이 아닌 D2R의 증가를 보여 주었기 때문에, 식염수 주사를받는 두 개의 추가 대상 군이 생성되었습니다 (n = 6) 또는 1.0 mg / kg AMPH (n = 6), 24 h of mating 및 위에서 설명한 파트너 선호도 테스트입니다. 대상체를 탈락시키고 뇌를 300 μm 두께의 극저온에서 슬라이스 하였다. NAcc로부터 양측으로 취해진 조직 펀치를 D1R 및 D2R 웨스턴 블 롯팅을 위해 처리 하였다.
실험 4는 NAcc에서 D1- 유형 수용체의 활성화가 페어 결합의 AMPH- 손상을 담당했는지 여부를 조사 하였다. NAcc 포탄을 겨냥한 가이드 캐뉼라를 양측으로 이식 하였다. 3 일의 회복 후, 그들은 3 개의 실험 그룹 중 하나에 무작위로 할당되었고, 여기서 그들은 CSF (200 nL / side, n = 11) 또는 0.4 (n = 6) 또는 100 ng / side (n = 7) SCH23390. 30 분 후, 그들은 1.0 mg / kg AMPH의 ip 주사를 받았다. 이 절차는 3 일 동안 반복되었습니다. 4 일째에, 대상체를 24 h 동안 에스트로겐-프라임 된 암컷과 짝을 지어 파트너 선호도를 테스트 하였다.
감사의
필자는이 사본을 비판적으로 읽은 Kyle Gobrogge, Claudia Lieberwirth, Kelly Lei 및 Melissa Martin에게 감사합니다. 이 작업은 National Institutes of Health Grants MHR01-58616, DAR01-19627 및 DAK02-23048 to ZW에서 지원했습니다.
참고자료