Dialog Clin Neurosci. 2013 Dec;15(4):431-43.
Abstrak
Terlepas dari pentingnya berbagai faktor psikososial, pada intinya, kecanduan narkoba melibatkan proses biologis: kemampuan paparan berulang terhadap penyalahgunaan obat untuk mendorong perubahan pada otak yang rentan yang mendorong pencarian dan pengambilan obat secara kompulsif, dan kehilangan kendali. lebih dari penggunaan narkoba, yang menentukan keadaan kecanduan. Di sini, kami meninjau jenis adaptasi molekuler dan seluler yang terjadi di wilayah otak tertentu untuk memediasi kelainan perilaku terkait kecanduan. Ini termasuk perubahan dalam ekspresi gen yang dicapai sebagian melalui mekanisme epigenetik, plastisitas dalam fungsi neurofisiologis neuron dan sinapsis, dan plastisitas terkait dalam morfologi neuron dan sinaptik yang dimediasi sebagian oleh perubahan pensinyalan faktor neurotropik. Masing-masing jenis modifikasi yang diinduksi obat ini dapat dilihat sebagai bentuk "memori seluler atau molekuler." Selain itu, sangat mengejutkan bahwa sebagian besar bentuk plastisitas yang terkait kecanduan sangat mirip dengan jenis plastisitas yang telah dikaitkan dengan bentuk “memori perilaku” yang lebih klasik, mungkin mencerminkan repertoar terbatas dari mekanisme adaptif yang tersedia untuk neuron ketika dihadapkan dengan lingkungan. tantangan. Akhirnya, adaptasi molekuler dan seluler yang terkait dengan kecanduan melibatkan sebagian besar wilayah otak yang sama yang memediasi bentuk memori yang lebih klasik, konsisten dengan pandangan bahwa ingatan abnormal adalah pendorong penting dari sindrom kecanduan. Tujuan dari penelitian ini yang bertujuan untuk menjelaskan dasar molekuler dan seluler dari kecanduan obat adalah untuk akhirnya mengembangkan tes diagnostik berbasis biologis, serta perawatan yang lebih efektif untuk gangguan kecanduan.
Pengantar
Kecanduan narkoba, yang dapat didefinisikan sebagai pencarian dan pengambilan obat secara kompulsif meskipun ada konsekuensi yang mengerikan atau hilangnya kendali atas penggunaan narkoba, disebabkan oleh perubahan yang disebabkan oleh obat yang berlangsung lama yang terjadi di daerah otak tertentu.1 Namun, hanya beberapa orang yang menyerah pada kecanduan dalam menghadapi paparan obat berulang-ulang, sementara yang lain mampu menggunakan obat dengan santai dan lolos dari sindrom kecanduan. Faktor genetik menyumbang sekitar 50% dari variabilitas individu ini dalam kerentanan kecanduan, dan derajat heritabilitas ini berlaku untuk semua kelas utama obat adiktif, termasuk stimulan, opiat, alkohol, nikotin, dan kanabinoid.2 Belum dimungkinkan untuk mengidentifikasi sebagian besar gen yang mengandung risiko genetik ini, kemungkinan karena keterlibatan mungkin ratusan variasi genetik yang meringkas dalam satu individu untuk memberi kerentanan kecanduan (atau, pada individu lain, resistensi).
50% risiko kecanduan lainnya disebabkan oleh sejumlah faktor lingkungan, yang terjadi sepanjang hidup, yang berinteraksi dengan komposisi genetik seseorang untuk membuatnya rentan terhadap kecanduan pada tingkat yang lebih besar atau lebih kecil. Beberapa jenis faktor lingkungan telah terlibat dalam kecanduan, termasuk stres psikososial, tetapi sejauh ini faktor yang paling kuat adalah paparan penyalahgunaan obat itu sendiri. Obat-obatan "pintu gerbang" tertentu, khususnya nikotin, telah terbukti meningkatkan kerentanan seseorang terhadap kecanduan obat lain.3 Selain itu, ada semakin banyak bukti bahwa, meskipun ada berbagai risiko genetik untuk kecanduan di seluruh populasi, paparan dosis obat yang cukup tinggi untuk jangka waktu yang lama dapat mengubah seseorang yang memiliki muatan genetik yang relatif lebih rendah menjadi pecandu..4
Kemajuan besar telah dibuat selama dua dekade terakhir dalam mengidentifikasi daerah diskrit otak yang penting dalam memediasi sindrom kecanduan, serta jenis perubahan pada tingkat molekuler dan seluler yang diinduksi obat di kawasan ini untuk mendasari aspek-aspek utama kecanduan.1,5 Sirkuit yang paling banyak mendapat perhatian disebut sebagai sistem dopamin mesolimbik, yang melibatkan neuron dopamin di area ventral tegmental (VTA) otak tengah yang menginervasi neuron berduri sedang dalam nucleus accumbens (NAc, bagian dari ventral striatum). Neuron VTA ini juga menginervasi banyak daerah otak depan lainnya, termasuk hippocampus, amygdala, dan prefrontal cortex (PFC).
Masuk akal untuk mempertimbangkan mekanisme kecanduan yang diinduksi obat ini dalam memori ini karena tiga alasan yang tumpang tindih.6
- Pertama, semua adaptasi yang diinduksi obat dapat dilihat sebagai jenis "memori molekul atau seluler:" sel saraf yang mengalami perubahan tersebut berbeda sebagai akibat dari paparan obat dan karenanya merespons secara berbeda terhadap obat yang sama, untuk obat lain, atau sejumlah rangsangan lainnya sebagai hasilnya.
- Kedua, menarik bahwa banyak, mungkin sebagian besar, dari jenis perubahan yang telah dikaitkan dengan keadaan kecanduan (misalnya, transkripsi gen yang diubah, epigenetik, plastisitas sinaptik dan seluruh sel, dan morfologi neuron dan mekanisme neurotropik) juga terlibat dalam bentuk tradisional "memori perilaku" seperti memori spasial, pengkondisian rasa takut, dan pengkondisian operan, antara lain.
- Ketiga, di antara daerah otak yang dipengaruhi oleh penyalahgunaan obat-obatan adalah yang merupakan substrat saraf utama untuk memori perilaku, termasuk hippocampus, amygdala, dan PFC. Ini bertepatan dengan meningkatnya kesadaran bahwa beberapa fitur kecanduan yang paling penting terlihat secara klinis (misalnya, keinginan dan kekambuhan obat) mencerminkan kelainan dalam sirkuit memori tradisional, dengan ingatan jangka panjang dari pengalaman obat yang berfungsi sebagai pendorong kuat patologi kecanduan.4,7,8 Sebaliknya, wilayah penghargaan otak (misalnya, VTA dan NAc) secara potensial memengaruhi memori perilaku.
Artikel ini memberikan ikhtisar tentang jenis utama perubahan molekuler dan seluler yang terjadi di beberapa daerah otak pada model hewan yang kecanduan, berkonsentrasi pada nukleus accumbens yang saat ini sebagian besar informasi tersedia. Yang penting, semakin mungkin untuk memvalidasi beberapa perubahan pada pecandu manusia berdasarkan studi otak postmortem. Terlepas dari kenyataan bahwa obat-obatan pelecehan memiliki struktur kimia yang berbeda dan bertindak berdasarkan target protein yang berbeda, sangat mengejutkan bahwa banyak adaptasi terkait kecanduan yang umum bagi banyak orang, dan dalam beberapa kasus semua, obat pelecehan dan kemungkinan berkontribusi pada fitur bersama dari suatu sindrom kecanduan.4,9 Sebaliknya, banyak adaptasi yang diinduksi obat khusus untuk obat yang diberikan dan dapat memediasi aspek yang lebih unik dari kecanduan yang diberikan. Kami fokus di sini pada obat pelecehan stimulan dan opiat, yang menghasilkan efek yang lebih dramatis pada model hewan dibandingkan dengan obat lain. Kami juga menyoroti bidang-bidang penting untuk penelitian masa depan yang selanjutnya akan meningkatkan pengetahuan kami tentang sindrom kecanduan dan menerjemahkan kemajuan ini ke dalam tes diagnostik dan perawatan yang lebih baik.
Mekanisme transkripsi dan epigenetik
Pengetahuan bahwa pecandu dapat tetap pada risiko yang lebih tinggi untuk kambuh meskipun bertahun-tahun pantang berarti bahwa kecanduan melibatkan perubahan yang disebabkan oleh obat di otak yang bisa sangat stabil. Ini telah menyebabkan beberapa kelompok mempertimbangkan perubahan dalam ekspresi gen sebagai komponen penting dari proses kecanduan (Gambar 1). Dengan demikian, studi tentang kandidat gen atau investigasi genome-wide yang melibatkan microarray DNA dan baru-baru ini RNA-seq (sekuensing throughput tinggi dari RNA yang diekspresikan) telah mengidentifikasi banyak gen yang ekspresinya diubah di wilayah otak tertentu dalam model kecanduan tikus dan primata dan pada pecandu manusia (mis. ref 10-17). Contoh-contoh gen tersebut dibahas pada bagian selanjutnya dari tinjauan ini.
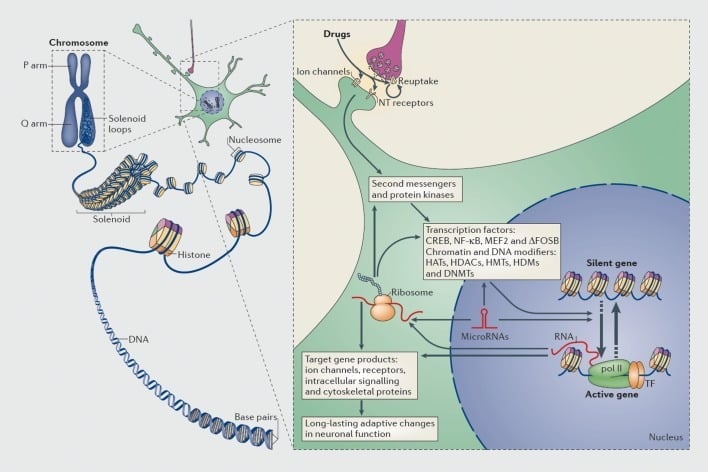
Mekanisme regulasi transkripsional dan epigenetik oleh penyalahgunaan obat. Dalam sel eukariotik, DNA diatur dengan membungkus oktomer histone untuk membentuk nukleosom, yang kemudian diatur lebih lanjut dan dikondensasi untuk membentuk kromosom (bagian kiri). Hanya dengan menguraikan kromatin yang dipadatkan untuk sementara waktu, DNA dari gen tertentu dapat diakses oleh mesin transkripsi. Narkoba penyalahgunaan bertindak melalui target sinaptik seperti mekanisme reuptake, saluran ion, dan reseptor neurotransmitter (NT) untuk mengubah kaskade pensinyalan intraseluler (bagian kanan). Ini mengarah pada aktivasi atau penghambatan faktor transkripsi (TF) dan banyak target nuklir lainnya, termasuk protein pengatur kromatin (ditunjukkan oleh panah tebal); mekanisme terperinci yang terlibat dalam regulasi sinaptik protein pengatur kromatin masih kurang dipahami. Proses-proses ini pada akhirnya menghasilkan induksi atau represi gen tertentu, termasuk yang untuk RNA nonkode seperti microRNA; ekspresi yang diubah dari beberapa gen ini pada gilirannya dapat mengatur lebih lanjut transkripsi gen. Diusulkan bahwa beberapa perubahan yang diinduksi obat pada tingkat kromatin sangat stabil dan karenanya mendasari perilaku jangka panjang yang mendefinisikan kecanduan. CREB, protein pengikat elemen responsif AMP siklik; DNMT, DNA methyltransferases; HATs, histone acetyltransferases; HDACs, histone deacetylases; HDM, demethylases histone; HMT, histone methyltransferases; MEF2, faktor penambah spesifik miosit 2; NF-kB, faktor nuklir-KB; pol II, RNA polimerase II. Direproduksi dari ref 44: Robison AJ, Nestler EJ. Mekanisme kecanduan transkripsi dan epigenetik. Nat Rev Neurosci. 2011; 12: 623-637.
Demikian juga, banyak jenis faktor transkripsi — protein yang berikatan dengan daerah pengatur gen dan dengan demikian meningkatkan atau menurunkan transkripsi gen tersebut — telah terlibat dalam memediasi efek jangka panjang dari penyalahgunaan obat terhadap ekspresi gen di otak.. Contoh-contoh yang menonjol termasuk CREB (protein pengikat elemen respons cAMP), osFosB (faktor transkripsi keluarga Fos), NFkB (faktor nuklir kB), MEF2 (faktor peningkat miosit-2), dan reseptor glukokortikoid, di antara beberapa lainnya.5,10,18-22 Semakin mungkin untuk memahami jalur pensinyalan seluler di mana obat-obatan yang disalahgunakan mengaktifkan faktor transkripsi tertentu di otak dan secara kausal menghubungkan aktivasi tersebut dengan gen target faktor transkripsi dan aspek perilaku tertentu dari kecanduan (lihat Gambar 1). Kemajuan ini diilustrasikan dengan pertimbangan CREB dan ΔFosB, yang merupakan faktor transkripsi terbaik yang dipelajari dalam model kecanduan.
cAMP Protein pengikat elemen respons
Obat perangsang dan opiat penyalahgunaan diaktifkan CREB di beberapa daerah otak yang penting untuk kecanduan, termasuk di NAc.23,24 CREB diketahui diaktifkan di sistem lain oleh cAMP, Ca2+, dan jalur faktor pertumbuhan,25 dan belum diketahui yang mana yang memediasi aktivasi di NAc oleh penyalahgunaan obat. Aktivasi obat CREB di NAc telah terbukti mewakili mekanisme umpan balik negatif klasik, dimana CREB berfungsi untuk mengurangi kepekaan hewan terhadap efek bermanfaat dari obat-obatan ini (toleransi) dan untuk menengahi keadaan emosional negatif selama penghentian obat (ketergantungan).18,26,27 Efek ini telah ditunjukkan baru-baru ini untuk mendorong peningkatan pemberian obat secara mandiri dan kambuh, mungkin melalui proses penguatan negatif.28 Tindakan-tindakan CREB ini tampaknya melibatkan kedua subtipe utama neuron berduri sedang NAc, yang mengekspresikan terutama D1 versus D2 reseptor dopamin.24 Iyang menarik, sejumlah besar literatur telah menunjukkan bahwa CREB, bertindak dalam hippocampus dan amygdala, adalah molekul kunci dalam memori perilaku.29-31 Peran luas ini dalam kecanduan dan memori perilaku kemungkinan mencerminkan fakta bahwa neuron diilhami dengan sejumlah mekanisme molekuler yang dapat digunakan untuk beradaptasi dengan lingkungan yang terus berubah.
Gen target untuk CREB yang memediasi fenotip perilaku ini telah diidentifikasi melalui tes genome-wide serta upaya yang lebih dipilih.10,18,32 Salah satu contohnya adalah opioid peptide dynorphin: stimulan induksi ekspresi dinorphin di neuron NAc, dimediasi melalui CREB, meningkatkan aktivasi dinorfin dari reseptor opioid k pada neuron dopamin VTA dan dengan demikian menekan transmisi dopaminergik ke NAc dan merusak hadiah.18 Beberapa target CREB lainnya telah terbukti penting untuk plastisitas sinaptik yang diinduksi oleh obat, seperti yang dibahas di bawah ini. Sementara CREB juga diaktifkan di beberapa daerah otak lainnya oleh stimulan dan opiat,23,24 sedikit yang diketahui tentang konsekuensi perilaku dari efek ini dan gen target tempat terjadinya efek ini. Demikian juga, sedikit yang diketahui tentang peran CREB dalam menengahi tindakan penyalahgunaan obat lain.19
ΔFosB
Paparan akut terhadap hampir semua obat pelecehan menginduksi semua faktor transkripsi keluarga Fos di NAc dan beberapa daerah otak lainnya. Induksi ini cepat tetapi juga sangat sementara, dengan kadar protein Fos kembali normal dalam jam 8 ke 12. Unik di antara protein-protein keluarga Fos ini adalah ΔFosB, produk terpotong dari gen FosB, yang berdasarkan stabilitas yang tidak biasa, secara bertahap terakumulasi melalui paparan obat berulang dan menjadi protein Fos dominan yang diekspresikan dalam kondisi ini.22,33 Selain itu, karena stabilitas ini, kadar ,FosB bertahan selama berminggu-minggu setelah penghentian obat. Induksi kronis ΔFosB seperti itu telah dibuktikan untuk semua penyalahgunaan obat34 dan, untuk sebagian besar obat, selektif untuk neuron NAc tipe Dl.34,35 Ini juga terjadi ditunjukkan pada pecandu manusia.35 Sejumlah besar literatur telah menunjukkan bahwa induksi ΔFB dalam D1-neuron tipe NAc meningkatkan kepekaan hewan terhadap obat serta penghargaan alami dan mendorong pemberian obat sendiri, mungkin melalui proses penguatan positif (lihat referensi 34 ke 38). Menariknya, induksi obat ΔFosB di NAc lebih dramatis pada hewan remaja, masa kerentanan kecanduan yang lebih besar,39 dan induksi oleh nikotin telah terbukti memediasi peningkatan hadiah kokain yang seperti gerbang nikotin.40
Adapun CREB, banyak gen target untuk ΔFosB telah diidentifikasi dalam NAc dengan menggunakan kandidat gen dan pendekatan genome-wide.10,32 Sementara CREB menginduksi dynorphin, ΔFosB menekannya, yang berkontribusi pada efek pro-reward ΔFosB.38 Target ΔFosB lainnya adalah cFos: karena ΔFosB terakumulasi dengan paparan obat berulang-ulang, ia menekan c-Fos dan berkontribusi pada pergantian molekuler di mana ΔFosB secara selektif diinduksi dalam keadaan kronis yang diobati dengan obat..41 Banyak target osFosB lainnya telah terbukti memediasi kemampuan obat-obatan tertentu dari penyalahgunaan untuk menginduksi plastisitas sinaptik dalam NAc dan perubahan terkait dalam arendisasi dendritik neuron berduri medium NAc, seperti yang akan dibahas di bawah ini.
Konsekuensi fungsional dari induksi osFosB di daerah otak lain kurang dipahami dengan baik, meskipun induksi di orbitofrontal cortex (OFC) telah dipelajari secara rinci. Di sini, osFosB memediasi toleransi yang terjadi pada efek mengganggu kognitif dari kokain selama paparan kronis, dan adaptasi ini dikaitkan dengan peningkatan pemberian kokain secara mandiri.42,43
Tes Genome-wide telah menyarankan beberapa gen target potensial yang memediasi efek ini.42 Meskipun sifat temporal ΔFosB unik, dan pengetahuan bahwa hal itu diinduksi dalam sirkuit memori tradisional (misalnya, hipokampus), belum ada eksplorasi peran ΔFosB dalam memori perilaku, subjek yang menarik untuk penelitian di masa depan.
Mekanisme epigenetik
Dalam beberapa tahun terakhir, studi transkripsi telah didorong selangkah lebih maju ke epigenetik44 (Lihat Gambar 1), yang secara luas dapat didefinisikan sebagai perubahan ekspresi gen yang terjadi tanpa adanya perubahan urutan DNA. Mekanisme epigenetik mengontrol pengemasan DNA dalam inti sel melalui interaksinya dengan histones dan banyak jenis protein nuklir lainnya, yang bersama-sama terdiri dari kromatin. Ekspresi gen dikendalikan oleh keadaan kemasan ini melalui modifikasi kovalen histones, protein lain, dan DNA itu sendiri. Sebagai hanya beberapa contoh, asetilasi histone cenderung mendorong aktivasi gen, metilasi histone dapat meningkatkan aktivasi gen atau represi tergantung pada residu Lys yang mengalami modifikasi ini, dan metilasi DNA umumnya dikaitkan dengan represi gen walaupun ada beberapa varian metilasi ( misalnya, 5-hidroksimetilasi) dapat dikaitkan dengan aktivasi gen.
Epigenetik adalah mekanisme yang menarik karena, dalam sistem lain, misalnya, biologi perkembangan dan kanker, modifikasi epigenetik tertentu dapat bersifat permanen. Untuk alasan ini, epigenetik telah dikejar baik dalam model pembelajaran dan memori (misalnya, ref 45-48) serta kecanduan;44,49 dalam kedua sistem perubahan besar telah dilaporkan dalam asetilasi dan metilasi histon dan dalam metilasi DNA. Sebagai satu contoh saja, histone methyltransferase, G9a, terlibat dalam kedua memori50 dan kecanduan.51,52 Dalam model kecanduan, Ekspresi G9a diturunkan regulasi di NAc sebagai respons terhadap obat stimulan atau opiat dari penyalahgunaan dan tini telah terbukti meningkatkan efek bermanfaat dari obat-obatan ini.51,52 Menariknya, penekanan kokain terhadap G9a dimediasi oleh ΔFosB. G9a mengkatalisasi dimetilasi Lys9 dari histone H3 (H3K9me2), mediator utama represi gen. ChIP-chip atau ChIP-seq (diikuti imunopresipitasi chromatin, masing-masing, oleh chip promotor atau sekuensing throughput tinggi) telah digunakan untuk memperoleh peta genome-wide gen dalam NAc yang menampilkan perubahan H3K9me2 setelah stimulan atau paparan opiat.32,52,53 Dengan tumpang tindih daftar gen ini dengan daftar perubahan ekspresi gen di seluruh genom, dan dengan peta seluruh genome dari banyak bentuk modifikasi epigenetik lainnya (misalnya, ΔFosB mengikat, mengikat CREB, modifikasi histone lainnya, dll),32,53 harus mungkin untuk mengidentifikasi seperangkat gen yang semakin lengkap yang diatur oleh penyalahgunaan obat-obatan dan untuk memahami mekanisme epigenetik yang mendasarinya.
Bentuk lain dari pengaturan epigenetik yang terlibat dalam memori dan kecanduan adalah pembentukan microRNA. RNA kecil dan nonkode ini berikatan dengan daerah mRNA komplementer dan dengan demikian menekan terjemahannya atau menginduksi degradasinya. Penghapusan Argonaut, protein yang penting untuk pemrosesan miRNA, mengubah respons perilaku terhadap kokain, dengan efek berbeda yang diamati untuk neuron berduri medium tipe D1 versus D2.54 Beberapa miRNA spesifik juga telah terbukti diatur oleh pajanan obat dan, pada gilirannya, memengaruhi respons perilaku terhadap obat (misalnya, ref 55,56). Ini akan menarik dalam penelitian di masa depan untuk mengidentifikasi target mRNA miRNA ini dan mengkarakterisasi bagaimana mereka mempengaruhi proses kecanduan.
Plastisitas sinaptik
Jenis umum modifikasi sinaptik yang sama di sinapsis glutamatergik, yang telah terlibat dalam hippocampus dan amygdala dalam memori perilaku (lihat artikel lain dalam masalah ini), juga telah terbukti terjadi di daerah hadiah otak dalam model kecanduan dan menjadi penting dalam mediasi proses kecanduan.57,58 Plastisitas sinaptik yang diinduksi obat tersebut telah dijelaskan di beberapa daerah otak, namun, kami berkonsentrasi di sini pada NAc di mana sebagian besar penelitian telah difokuskan hingga saat ini. (Gambar 2).
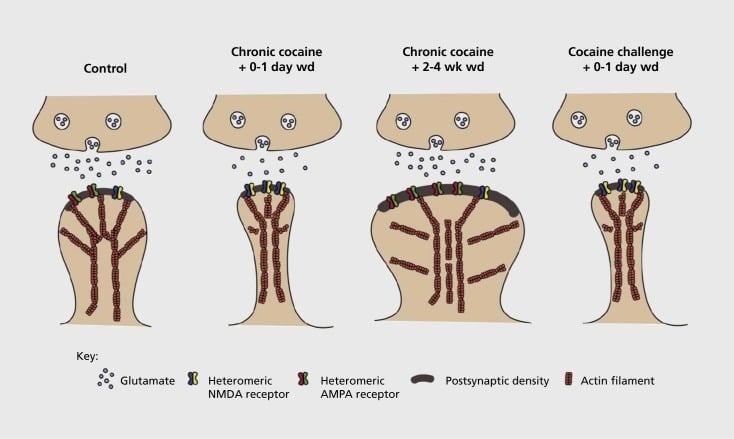
Model plastisitas sinaptik dan struktural terkait kecanduan di nucleus accumbens (NAc). Paparan kronis terhadap kokain menghasilkan reorganisasi α-amino-3-hidroksi-5-metil-4-metil-XNUMX-asam isoksazolepropionat (AMPA) yang tergantung waktu dan sementara pada reseptor glutamat pada medium NAc spiny neuron (MSN) sinapsis, serta perubahan struktural di kepala tulang belakang NAN MSNs yang berkorelasi dengan bentuk plastisitas sinaptik yang berbeda. Sebagai contoh, kokain kronis menginduksi ekspresi permukaan reseptor NMDA, pembentukan sinapsis sunyi dan depresi jangka panjang (LTD) pada titik waktu penarikan awal. Selama penarikan lebih lama (wd), perubahan sinaptik ini terbalik dengan akibat peningkatan ekspresi reseptor AMPA permukaan, konsolidasi sinapsis menjadi tulang belakang berbentuk jamur dan potensiasi jangka panjang (LTP). Efek ini dengan cepat kembali lagi setelah terpapar dosis tantangan kokain yang mengarah pada penataan tulang belakang menjadi duri tipis dan depresi kekuatan sinaptik.
Eksperimen awal menunjukkan bahwa paparan berulang terhadap obat stimulan penyalahgunaan menginduksi keadaan mirip LTD (depresi jangka panjang) di sinapsis glutamatergik di NAc.59 Namun, pekerjaan yang lebih baru telah menunjukkan plastisitas seperti itu sangat tergantung waktu, dengan LTD terjadi lebih awal setelah paparan kokain terakhir berkembang menjadi lebih seperti LTP (potensiasi jangka panjang) seperti keadaan setelah titik waktu penarikan yang lebih lama.60,61 Pekerjaan ini, yang sampai saat ini telah dilakukan terutama menggunakan penyelidik yang diberikan - bukan obat yang dikelola sendiri - telah mendefinisikan perlunya penyelidikan yang lebih sistematis dalam model pemberian sendiri yang melacak bentuk plastisitas sinaptik yang terjadi pada sinapsis glutamatergik di Tidak ada selama periode waktu yang rinci dari akuisisi administrasi diri untuk pemeliharaannya, melalui berbagai waktu penarikan dan kepunahan, dan dalam menanggapi rangsangan yang membangkitkan kambuh. Pekerjaan sampai saat ini juga telah mendefinisikan beberapa mekanisme molekuler yang berkontribusi terhadap plastisitas sinaptik yang diinduksi obat ini, termasuk perdagangan reseptor AMPA ke sinaps yang mungkin dimediasi sebagian melalui CaMKII (Ca2+/ fosforilasi protein kinase II yang tergantung-tenangodulin dari subunit reseptor AMPA tertentu serta ekspresi yang diubah dari subunit reseptor AMPA (misalnya, 60,62-65, Angka 2 dan 3). Peran untuk CREB dan osFosB telah terlibat dalam fenomena ini, serta dalam perubahan terkait dalam morfologi sinapsis glutamatergik (lihat di bawah). Sebagai contoh, GluAl adalah target untuk CREB di NAc, di mana GluA2 dan CaMKII keduanya adalah target dari ΔFosB, di wilayah otak ini .35,36,66,67 Ke depan, penting untuk menghubungkan adaptasi spesifik dengan perubahan tergantung waktu dalam fungsi sinaptik dan fitur perilaku kecanduan.
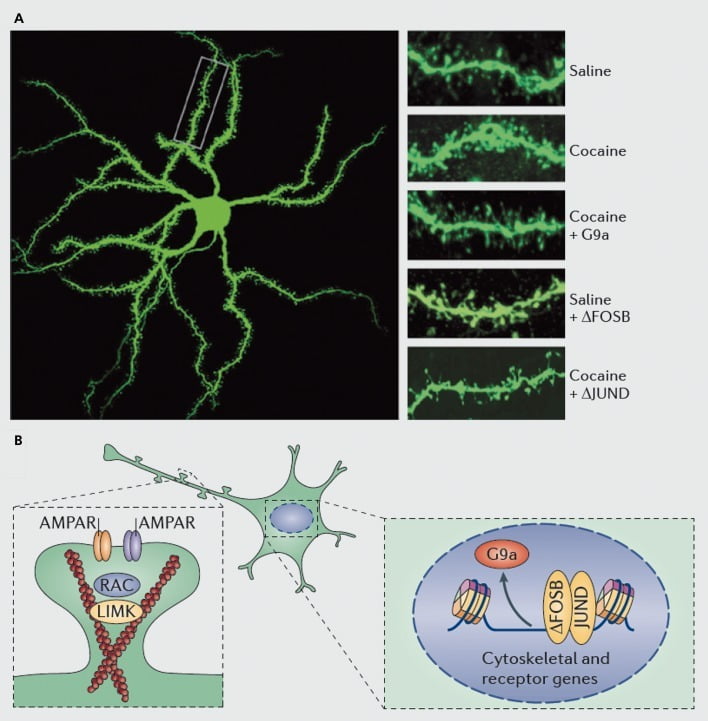
Mekanisme molekuler yang mendasari induksi kokain duri dendritik pada neuron berduri medium nucleus accumbens (NAc). A) menunjukkan peningkatan jumlah tulang belakang dendritik yang diinduksi kokain yang dapat diblokir oleh ekspresi berlebih virus dari G9a atau JunD (antagonis dari transkripsi yang dimediasi AP1), atau ditiru oleh ekspresi berlebih dari FosB oleh virus. B) Peraturan perdagangan reseptor AMPA (AMPAR) dan sitoskeleton aktin (kiri), serta peraturan transkripsi reseptor glutamat dan protein pengatur aktin (misalnya, sebagaimana dimediasi melalui ΔFosB, kanan) telah terbukti memainkan peran penting dalam memediasi regulasi kokain dari kepadatan tulang belakang dendritik NAc. UMK, kinase domain LIM; RAC, substrat toksin botulinum C3 terkait Ras.
Alat eksperimental baru memungkinkan untuk pertama kalinya untuk mendefinisikan dengan presisi yang meningkat sirkuit tertentu menampilkan bentuk plastisitas sinaptik ini dan kelainan perilaku apa yang mereka mediasikan. Misalnya, tShell dan subkelompok inti dari NAc menunjukkan perbedaan dalam plastisitas sinaptik yang diinduksi oleh obat, seperti halnya neuron berduri medium tipe D1 versus D2 dalam setiap subregion.60,63,64,67 Demikian juga, percobaan optogenetik telah memberikan wawasan baru mengenai kontribusi bentuk plastisitas sinaptik tertentu (misalnya, LTD) pada populasi spesifik sinapsis glutamatergik dalam NAc, misalnya, yang timbul dari medial PFC versus amigdala basolateral versus subkulum ventral (keluaran utama) dari hippocampus).68-70 Pada akhirnya, perlu untuk melapisi adaptasi molekuler yang diinduksi obat di masing-masing neuron aferen ini dengan adaptasi khusus sinaps yang terjadi di dendrit postsinaptik mereka untuk mengumpulkan pemahaman lengkap tentang bagaimana penyalahgunaan obat mengubah sirkuit otak untuk mendorong aspek tertentu dari keadaan kecanduan. Upaya ini akan membutuhkan apresiasi yang lebih besar terhadap plastisitas yang diinduksi obat pada sinapsis penghambat di dalam wilayah otak yang sama ini, area yang hanya menerima sedikit perhatian hingga saat ini.65
Plastisitas sel utuh
Sementara sebagian besar penelitian yang melibatkan perubahan neurofisiologis dalam neuron dalam fenomena penyalahgunaan obat, seperti dalam fenomena belajar dan memori, telah berfokus pada plastisitas sinaptik, ada juga bukti yang meningkat untuk pentingnya plastisitas sel secara keseluruhan juga. Plastisitas sel utuh, juga disebut plastisitas homeostatis,71 melibatkan perubahan rangsangan intrinsik seluruh sel saraf dengan cara yang tidak spesifik sinaps. Mengingat bahwa fitur tertentu dari kecanduan obat melibatkan peningkatan atau pengurangan kepekaan terhadap suatu obat, masuk akal bahwa peningkatan atau pengurangan rangsangan listrik dari sel-sel saraf tertentu berkontribusi terhadap adaptasi perilaku ini..5
Grafik Contoh terbaik plastisitas sel keseluruhan untuk obat pelecehan adalah kemampuan opiat kronis untuk meningkatkan rangsangan intrinsik dari neuron noradrenergik dari locus coeruleus (LC).).72 Peningkatan rangsangan ini dimediasi melalui CREB dan induksi isoform tertentu dari adenylyl cyclase, yang mendorong peningkatan penembakan neuron LC mungkin melalui induksi saluran Na +.72-75 Hyperexcitabilty dari neuron LC ini mewakili mekanisme klasik dari toleransi dan ketergantungan dan mendorong beberapa tanda dan gejala penarikan opiat. Menariknya, CREB memediasi bentuk plastisitas seluruh sel yang serupa pada neuron berduri sedang NAc, yang juga dianggap hiperekskuler oleh paparan kronis terhadap obat penyalahgunaan melalui CREB.76 Oleh karena itu akan sangat penting dalam penyelidikan masa depan untuk memahami bagaimana plastisitas sinaptik dimediasi-CRE sinapsis glutamatergik pada neuron berduri medium NAc65,66 meringkas dengan hyperexcitability intrinsik yang dimediasi CREB dari neuron ini76 untuk mengontrol fitur perilaku kecanduan.
Contoh lain plastisitas sel keseluruhan dalam model kecanduan adalah hipereksitabilitas neuron dopamin VTA yang terjadi setelah paparan kronis terhadap obat opiat abus.danGambar 4).77,78 Adaptasi ini, yang telah dikaitkan dengan perubahan morfologis dalam sel-sel saraf ini (lihat bagian berikutnya), tidak dimediasi oleh CREB tetapi dicapai melalui regulasi kaskade pensinyalan neurotropik, seperti dijelaskan di bawah ini.

Model kerja adaptasi morfin kronis yang diinduksi pada neuron dopamin area ventral tegmental (VTA). Morfin kronis mengurangi ukuran soma VTA dopamin (DA) namun meningkatkan rangsangan saraf, sementara transmisi dopamin ke nukleus accumbens berkurang. Efek bersih dari morfin adalah jalur hadiah yang kurang responsif, yaitu toleransi hadiah. Downregulasi pensinyalan IRS2-AKT di VTA memediasi efek morfin kronis pada ukuran soma dan rangsangan listrik; efek pada rangsangan dimediasi melalui penurunan arus asam γ-aminobutirat (GABA) A dan penekanan ekspresi saluran K '. Downregulation yang diinduksi morfin dari aktivitas mTORC2 di VTA sangat penting untuk adaptasi morfologis dan fisiologis yang diinduksi morfin ini serta untuk toleransi hadiah. Berbeda dengan mT0RC2, morfin kronis meningkatkan aktivitas mTORCI, yang tidak mempengaruhi adaptasi yang diinduksi morfin ini. BDNF, faktor neurotropik yang diturunkan dari otak; IRS, zat reseptor insulin; mTORC, kompleks mTOR; AKT, protein kinase B Direproduksi dari ref 77
Plastisitas morfologis dan mekanisme neurotropik
Semakin banyak bukti, sebagian besar dari studi neuron kortikal hippocampal dan serebral, telah menunjukkan bahwa perubahan plastisitas sinaptik berhubungan dengan perubahan morfologis di sinapsis. Sebagai contoh, LTD dan generasi sinapsis diam dikaitkan dengan pembentukan duri dendritik tipis atau gemuk, sedangkan LTP dikaitkan dengan duri yang lebih besar, berbentuk jamur.79,80 Dengan demikian menarik bahwa bidang penyalahgunaan narkoba telah difokuskan pada perubahan duri dendritik yang disebabkan obat selama> 15 tahun. Paparan kronis terhadap obat stimulan penyalahgunaan meningkatkan kepadatan tulang dendritik neuron berduri sedang dari NAc, perubahan yang mendominasi neuron tipe-Dl.67,81,82 Induksi duri telah dikaitkan sebagian besar dengan respon perilaku peka terhadap obat ini, meskipun beberapa bukti bertentangan dengan pandangan ini.
Seperti halnya penelitian plastisitas sinaptik, bagaimanapun, jauh lebih banyak pekerjaan diperlukan untuk secara sistemik menentukan perubahan duri dendritik yang terjadi selama pemberian obat secara mandiri, penarikan, dan kambuh. SSampai saat ini, melibatkan obat yang diberikan oleh penyelidik dan yang diberikan sendiri, menyarankan perubahan tulang belakang yang sangat berbeda yang terjadi pada titik waktu penarikan yang berbeda dan dalam shell NAc versus subkawasan inti.83-86 Penting juga untuk menentukan mekanisme molekuler yang tepat di mana kokain atau stimulan lain menghasilkan efek khusus yang tergantung waktu dan tipe sel ini. ΔFosB telah terbukti diperlukan dan cukup untuk induksi duri yang belum matang pada neuron NAc tipe Dl.35,51,67 Regulasi tersebut terjadi bersamaan dengan kokain dan regulasi ΔFosB dari beberapa protein yang diketahui mengendalikan reorganisasi sitoskeleton aktin. Sebagai satu contoh saja, regulasi transkripsional dari beberapa faktor pertukaran nukleotida guanin dan protein pengaktif GTPase membuat Rac1, GTPase kecil, untuk penurunan transien dalam aktivitas sebagai respons terhadap setiap paparan kokain, dan penurunan pulsatil dalam aktivitas Rac1 telah ditunjukkan, menggunakan kontrol optogenetik. dari Rac1, untuk menengahi induksi duri yang belum matang.87 Efek-efek Racl ini mungkin terjadi melalui kontrolnya terhadap cofilin dan protein-protein pengatur aktin lainnya, yang juga telah terbukti memediasi regulasi kokain untuk pertumbuhan tulang belakang.87,88 Namun, penting untuk ditekankan bahwa ini hanyalah satu jalur yang terlibat dalam regulasi kokain pada duri yang belum matang, karena beberapa protein lain telah terbukti memainkan peran penting juga, termasuk CDK5 (cyclin-dependent kinase-5), CaMKII, NFkB , MEF2, CREB, G9a, dan DNMT3 (DNA methyltransf erase 3a), untuk beberapa nama.20,21,35,51,67,89,90 Menariknya, regulasi kokain dari beberapa gen ini, termasuk induksi CDK5, CaMKII, dan NFkB, dan represi G9a, juga dimediasi melalui ΔFosB.20,35,51,91
Anehnya, obat opiat penyalahgunaan memberikan efek sebaliknya dan mengurangi kepadatan tulang dendritik neuron berduri sedang NAc.81 Sedikit yang diketahui tentang konsekuensi perilaku dari adaptasi ini dan mekanisme molekuler yang mendasarinya. Fenomena ini adalah, Namun, mengejutkan, mengingat bahwa CREB dan ΔFosB diinduksi oleh stimulan dan opiat dan keduanya terlibat dalam induksi yang dimediasi oleh stimulan kepadatan tulang belakang dendritik NAc.. Hal ini menimbulkan pertanyaan tentang bagaimana opiat menekan kepadatan tulang belakang NAc meskipun mereka diinduksi oleh faktor-faktor ini.
Bentuk utama plastisitas morfologis lain yang terlihat dalam model penyalahgunaan obat adalah pengurangan fisik dalam ukuran sel soma neuron dopamin VTA yang diinduksi oleh pemberian opiat kronis..77,92,93 Adaptasi serupa terjadi sebagai respons terhadap kanabinoid.94 Penyusutan neuron dopamin VTA ini, yang terjadi dengan opiat pemberian sendiri93 dan telah didokumentasikan pada pecandu heroin manusia yang diperiksa postmortem,77 tampaknya memediasi toleransi hadiah dan dikaitkan dengan penurunan pelepasan dopamin di NAc. Bukti yang cukup banyak sekarang mengindikasikan bahwa pengurangan ukuran soma sel ini dimediasi oleh penekanan opiat terhadap faktor neurotropik turunan otak (BDNF) di dalam neuron-neuron ini. Kami telah secara langsung menghubungkan penarikan dukungan BDNF yang diinduksi opiat ini, dan penyusutan neuron VTA, ke penurunan aktivitas kaskade pensinyalan BDNF hilir dalam neuron dopamin VTA, khususnya aktivitas IRS2 yang berkurang (substrat reseptor insulin-2), AKT (a serine-threonine) kinase), dan TORC2 (target rapamycin-2, yang tidak sensitif terhadap rapamycin).77,93 Kami juga mengaitkan downregulasi BDNF pensinyalan ini secara langsung dengan peningkatan rangsangan yang diinduksi morfin dalam neuron-neuron ini, seperti disebutkan sebelumnya.77,78 Memang, ukuran sel soma yang menurun dan peningkatan rangsangan yang erat, karena induksi satu mengarah ke yang lain dan sebaliknya. Kontrol atas rangsangan sel ini melibatkan penekanan K+ saluran dan GABAA saat ini di neuron ini.
Peran BDNF dalam mengendalikan respons morfin pada tingkat VTA ini kontras dengan keterlibatannya yang sangat berbeda dalam aksi kokain dan stimulan lainnya. Stimulan menginduksi pensinyalan BDNF ke NAc, sebuah efek karena peningkatan sintesis BDNF lokal serta peningkatan pelepasan dari beberapa daerah aferen.95 Selain itu, peningkatan pensinyalan BDNF dalam NAc, tetapi tidak dalam VTA, telah terbukti meningkatkan efek perilaku obat-obatan ini termasuk pemberiannya sendiri.95,96 Regulasi berlawanan dari pensinyalan BDNF di jalur VTA-NAc oleh opiat versus stimulan meningkatkan kemungkinan bahwa perbedaan tersebut memediasi regulasi berlawanan obat pada duri dendritik NAc, sebuah kemungkinan yang sekarang sedang diselidiki.
Arah masa depan
Narasi di atas menggarisbawahi kemajuan luar biasa yang telah dibuat dalam memahami adaptasi molekuler dan seluler yang terjadi di daerah hadiah otak sebagai respons terhadap paparan berulang terhadap obat pelecehan, dan dalam menghubungkan adaptasi individu dengan fitur perilaku tertentu dari sindrom kecanduan pada model hewan. . Terlepas dari kemajuan ini, pertanyaan utama tetap ada. Sebagian besar pengetahuan kita saat ini berfokus pada VTA dan NAc, dengan informasi yang tersedia lebih sedikit tentang daerah otak limbik kunci lainnya yang juga penting untuk kecanduan narkoba. Selain itu, semua demonstrasi eksperimental peran kausal dari adaptasi molekuler-seluler dalam perilaku terkait obat telah memanipulasi adaptasi individu satu per satu. Untuk memanipulasi banyak adaptasi pada saat yang sama jelas jauh lebih sulit, tetapi juga penting, karena kita tahu bahwa obat menghasilkan sejumlah besar jenis perubahan yang berbeda bahkan di dalam neuron individu, yang kemungkinan meringkas dengan cara yang rumit untuk mempengaruhi perilaku. Pendekatan sistem biologi seperti itu akan sangat penting untuk akhirnya memecahkan dasar-dasar biologis kecanduan. Akhirnya, upaya untuk memahami mekanisme molekuler-seluler dari ingatan yang berkaitan dengan kecanduan menemukan diri mereka pada titik di mana semua upaya lain untuk memahami dasar biologis dari ingatan perilaku sekarang berjuang: kemampuan kita untuk menghubungkan fenomena biologis dengan ingatan perilaku kompleks tetap sangat sulit. Mengatasi perpecahan ini mungkin merupakan tantangan terbesar dalam ilmu saraf.
Ucapan Terima Kasih
Pekerjaan ini didukung oleh dana dari Institut Nasional Penyalahgunaan Narkoba.
Singkatan dan akronim yang dipilih
- Lahir
- nukleus accumbens
- CREB
- protein pengikat elemen respons cAMP
- ΔFosB
- faktor transkripsi keluarga Fos
- VTA
- daerah tegmental ventral
- AMPA
- α-amino-3-hidroksi-5-metil-4-asam isoksazolepropionat
- LTD
- depresi jangka panjang
- LTP
- perlindungan jangka panjang
- BDNF
- faktor neurotropika yang diturunkan dari otak
- NKkB
- faktor nuklir kB
REFERENSI