Komentar: Ulasan ini dibuat oleh kepala NIDA, Nora Volkow, dan timnya. Tidak ada keraguan bahwa kecanduan kimia dan kecanduan perilaku memiliki mekanisme dan sirkuit saraf yang sama atau serupa. Ini masuk akal karena kecanduan bahan kimia membajak sirkuit saraf untuk ikatan, seks, dan makan. Karena seks melepaskan dopamin dua kali lebih banyak daripada memakan makanan favorit Anda, dan pengguna pornografi dapat terus meningkatkan dopamin selama berjam-jam, gila untuk mengusulkan bahwa kecanduan porno tidak bisa ada.
Curr Top Behav Neurosci. 2011 Okt 21.
Volkow ND, Wang GJ, Fowler JS, Tomasi D, Baler R.
sumber
Institut Nasional Penyalahgunaan Narkoba, 6001 Executive Boulevard 6001, Kamar 5274, Bethesda, MD, 20892, AS, [email dilindungi].
Abstrak
Baik kecanduan narkoba dan obesitas dapat didefinisikan sebagai gangguan di mana nilai arti-penting dari satu jenis hadiah (masing-masing obat dan makanan) menjadi meningkat secara tidak normal relatif terhadap, dan dengan mengorbankan yang lain. Model ini konsisten dengan fakta bahwa obat dan makanan memiliki efek penguat yang kuat - sebagian dimediasi oleh peningkatan dopamin dalam sistem limbik - yang, dalam keadaan tertentu atau pada individu yang rentan, dapat membanjiri mekanisme kontrol homeostatis otak. Paralel semacam itu telah menghasilkan minat yang signifikan dalam memahami kerentanan dan lintasan bersama antara kecanduan dan obesitas. Sekarang, penemuan pencitraan otak telah mulai mengungkap fitur-fitur umum antara kedua kondisi ini dan untuk menggambarkan beberapa sirkuit otak yang tumpang tindih yang disfungsi mungkin menjelaskan stereotip dan defisit perilaku terkait pada subyek manusia. THasil ini menunjukkan bahwa individu yang mengalami obesitas dan kecanduan obat mengalami gangguan dalam jalur dopaminergik yang mengatur sistem saraf yang terkait tidak hanya dengan sensitivitas hadiah dan motivasi insentif, tetapi juga dengan pengkondisian (memori / pembelajaran), kontrol impuls (penghambatan perilaku), reaktivitas stres, reaktivitas stres , dan kesadaran interokeptif. Di sini, kami mengintegrasikan temuan yang sebagian besar berasal dari positron emission tomography yang menjelaskan peran dopamin dalam kecanduan narkoba dan obesitas, dan mengusulkan model kerja yang diperbarui untuk membantu mengidentifikasi strategi perawatan yang mungkin menguntungkan kedua kondisi ini.
1 Latar Belakang
2 Peran Dopamin dalam Hadiah Akut untuk Obat dan Makanan
3 Pencitraan DA sebagai Respons terhadap Narkoba dan Isyarat Terkondisikan dalam Kecanduan
4 Dampak Disfungsi pada Pengendalian Hambat
5 Keterlibatan Sirkuit Motivasi
6 Keterlibatan Sirkuit Interoceptive
7 Sirkuit Aversi
8 Obat dan Hadiah Makanan Patologis: Model Kerja yang Diperbarui
1 Latar Belakang
Dopamin (DA) dianggap sebagai kunci efek hadiah dari penghargaan alami dan obat-obatan. Namun, perannya dalam kehilangan kontrol dan perilaku kompulsif yang terkait dengan kecanduan dan obesitas jauh kurang jelas. Studi PET telah memainkan peran penting dalam mengkarakterisasi peran sistem DA otak dalam kecanduan (di samping perannya dalam pemberian obat) dan dalam obesitas. Memang, penyalahgunaan obat-obatan (termasuk alkohol) dikonsumsi oleh manusia atau diberikan sendiri oleh hewan laboratorium karena mereka secara inheren bermanfaat, efek yang dimediasi melalui sifat penambah DA mereka dalam sistem mesolimbik (Wise 2009). However, dalam kasus kecanduan, studi pencitraan telah mengungkapkan bahwa gangguan tidak hanya mempengaruhi sirkuit hadiah DA tetapi juga jalur DA lainnya yang terlibat dalam modulasi pengkondisian / kebiasaan, motivasi, dan fungsi eksekutif (kontrol penghambatan, atribusi arti-penting, dan keputusan) -membuat), dan bahwa defisit DA juga dapat berpartisipasi dalam peningkatan reaktivitas stres dan gangguan kesadaran interokeptif terkait dengan kecanduan. Studi praklinis dan klinis juga mengungkapkan neurotransmiter lain (dan neuropeptida) yang memainkan peran penting dalam pemberian dan kecanduan obat. (yaitu, cannabinoid, opioid) dan sangat terlibat dalam perubahan neuroplastik yang mengikuti penggunaan obat berulang (yaitu, glutamat, opioid, GABA, faktor pelepas kortikotropin). Sistem glutamatergik sangat menonjol dalam hal ini karena memediasi gangguan baik dalam potensiasi jangka panjang dan depresi jangka panjang yang telah diamati pada model hewan dalam pemberian obat kronis. (Thomas et al. 2008). Ulasan yang berkaitan dengan sistem tambahan ini dapat ditemukan di tempat lain (Kalivas 2009; Koob 1992).
Karena obat mengaktifkan sistem hadiah yang sama yang mendasari pemberian makanan, tidak sepenuhnya tak terduga bahwa, secara umum, studi pencitraan otak telah mendukung gagasan bahwa gangguan pada sirkuit yang dimodulasi DA juga terlibat dalam perilaku patologis, perilaku makan kompulsif.. Isyarat makanan, seperti isyarat obat, meningkatkan DA ekstraseluler striatal dan mendorong motivasi untuk terlibat dalam perilaku yang diperlukan untuk mendapatkan dan memakan makanan, memberikan bukti untuk keterlibatan DA tidak hanya dalam hadiah makanan tetapi juga dalam motivasi non-hedonis. sifat makanan (yaitu, persyaratan kalori) dan penurunan kontrol penghambatan terlihat pada makan berlebihan kompulsif (Avena et al. 2008; Volkow et al. 2008a).
Di sini, kami meninjau temuan dari studi pencitraan yang secara khusus fokus pada tumpang tindih di sirkuit otak yang terganggu pada obesitas dan kecanduan narkoba. Perlu diingat, bahwa pengaturan perilaku asupan makanan jauh lebih kompleks daripada regulasi asupan obat. Yang terakhir ini sebagian besar dimediasi oleh efek obat yang menguntungkan sedangkan yang pertama dimodulasi tidak hanya oleh efek yang menguntungkan (faktor hedonis) tetapi juga oleh beberapa faktor perifer dan pusat yang merasakan kebutuhan nutrisi dalam tubuh yang diperlukan untuk bertahan hidup (faktor homeostatik). Menariknya, ada bukti yang berkembang bahwa faktor homeostatik (misalnya, insulin, leptin, ghrelin) memodulasi asupan makanan sebagian dengan meningkatkan atau mengurangi sensitivitas sirkuit hadiah otak terhadap rangsangan makanan (Volkow et al. 2011a).
2 Peran Dopamin dalam Hadiah Akut untuk Obat dan Makanan
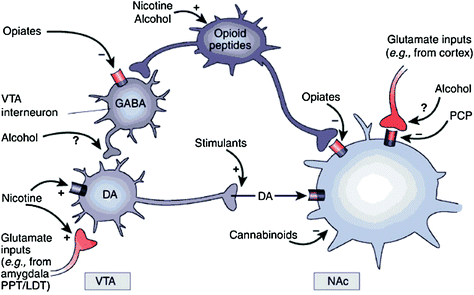
Baik secara langsung maupun tidak langsung, semua obat adiktif menunjukkan kemampuan untuk meningkatkan DA dalam nucleus accumbens (NAc) melalui interaksi spesifik dengan target molekul yang berbeda (Nestler 2004) (Gbr. 1). Jalur DA mesolimbik [sel DA di ventral tegmental area (VTA) yang diproyeksikan ke NAc] tampaknya sangat penting untuk pemberian obat (Wise 2009). Namun, seperti yang dijelaskan di bawah ini, jalur DA lainnya [mesostriatal (sel DA dalam substantia nigra memproyeksikan ke dorsal striatum) dan mesokortikal (sel DA dalam VTA memproyeksikan ke korteks frontal)] juga berkontribusi terhadap pemberian obat dan kecanduan (Wise 2009). Secara keseluruhan, nampak bahwa efek pemberian dan pemberian obat pada obat-obatan sebagian besar didorong oleh penembakan sel DA fasik, yang mengarah ke peningkatan DA yang besar dan sementara. Sebaliknya, perubahan hilir dalam fungsi eksekutif yang terjadi dalam kecanduan dikaitkan dengan perubahan dalam penembakan sel DA tonik dan menghasilkan tingkat DA yang lebih rendah tetapi lebih stabil (Grace). 2000; Wanat et al. 2009). Hal ini, pada gilirannya, menunjuk pada reseptor D1 (D1R), yang merupakan reseptor DA afinitas rendah yang merangsang pensinyalan AMP siklik, karena terlibat baik dalam pemberian obat akut maupun dalam pengkondisian, karena ini terkait dengan konsentrasi DA yang tinggi yang diperlukan. untuk merangsang D1R. Sebaliknya, D2R, yang menghambat pensinyalan AMP siklik, distimulasi oleh DA fasik dan tonik. Perhatikan bahwa, karena kurangnya radiotracers spesifik untuk pencitraan PET dari reseptor DA dari D1, D3, D4, dan tipe D5, sebagian besar penelitian tentang efek obat penyalahgunaan dan kecanduan di otak manusia berfokus pada D2Rs.
Ara. 1 Obat-obatan pelecehan bertindak pada sirkuit hadiah dan tambahan melalui mekanisme yang berbeda, namun, semuanya mengarah pada efek dopaminergik serupa di VTA dan NAc. Dengan demikian, stimulan meningkatkan DA asumbal secara langsung, sementara opiat melakukan ini dengan menurunkan nada penghambatan interneuron GABAergik pada DA yang memberi sinyal baik dalam VTA atau di kemudian NAc. Sementara mekanisme penyalahgunaan obat lain kurang jelas, ada bukti yang menunjukkan bahwa nikotin dapat mengaktifkan VTA DA secara langsung melalui reseptor nikotinik asetilkolin (nAChR) pada neuron-neuron tersebut dan secara tidak langsung melalui stimulasi reseptornya pada terminal saraf glutamatergik yang menginervasi sel DA. Alkohol tampaknya menghambat terminal GABAergic di VTA, yang mengarah ke disinhibisi neuron DA di VTA. Cannabinoid bertindak, antara lain, melalui aktivasi reseptor CB1 pada terminal saraf glutamatergik dan GABAergik di NAc, dan pada neuron NAc sendiri. Phencyclidine (PCP) dapat bertindak dengan menghambat reseptor NMDA glutamat postynaptic di NAc. Selain itu, ada beberapa bukti yang menunjukkan bahwa nikotin dan alkohol juga dapat berinteraksi dengan jalur opioid dan kanabinoid endogen (tidak ditunjukkan). PPT / LDT, pedmentular pontine tegmentum / tegmentum dorsal lateral. Dicetak ulang dengan izin Nestler (2005)
Pada manusia, penelitian PET telah menunjukkan bahwa beberapa obat [stimulan (Drevets et al. 2001; Volkow et al. 1999b), nikotin (Brody et al. 2009), alkohol (Boileau et al. 2003), dan ganja (Bossong et al. 2009)] meningkatkan DA pada dorsal dan ventral striatum (di mana NAc berada). Studi-studi ini mengambil keuntungan dari beberapa radiotracers, seperti [11C] raclopride, yang mengikat D2R tetapi hanya ketika ini tidak mengikat DA endogen (tidak dihuni), yang dalam kondisi dasar sesuai dengan 85-90% dari D2R striatal (Abi-Dargham et al. 1998). Dengan demikian, perbandingan antara [11C] pengikatan raclopride setelah plasebo dan setelah pemberian obat dapat membantu kami memperkirakan penurunan ketersediaan D2R yang disebabkan oleh obat (atau rangsangan lain yang dapat meningkatkan DA). Penurunan ini dalam [11C] pengikatan raclopride sebanding dengan peningkatan DA (Breier et al. 1997). Studi-studi ini telah menunjukkan bahwa peningkatan DA yang diinduksi obat di striatum sebanding dengan intensitas pengalaman subjektif euforia atau "tinggi" [lihat ulasan (Volkow et al. 2009a)] (Gbr. 2).
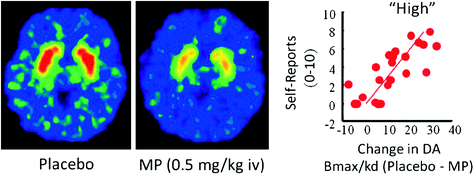
Ara. 2 Efek methylphenidate (MP) intravena dalam pengikatan raclopride dan hubungan antara peningkatan striatal DA yang diinduksi oleh MP dalam striatum dan laporan diri dari "tinggi". Dimodifikasi dari Volkow et al. (1999b)
Studi PET juga mengungkapkan hubungan yang jelas dan langsung antara profil farmakokinetik obat (yaitu, kecepatan masuknya dan meninggalkan otak) dan efek penguatnya. Secara khusus, semakin cepat suatu obat mencapai tingkat puncak di otak semakin kuat "tinggi" (Volkow et al. 2009a). Misalnya, untuk tingkat setara kokain yang mencapai otak (dinilai melalui PET), ketika kokain masuk ke otak dengan cepat (merokok atau pemberian iv), ia menimbulkan "tinggi" yang lebih kuat daripada ketika ia masuk dengan kecepatan yang lebih lambat (mendengus) (Volkow et al. 2000). Ini konsisten dengan studi praklinis yang menunjukkan korelasi yang serupa antara profil farmakokinetik obat dan sifat penguatnya (Balster dan Schuster 1973). sayaAdalah masuk akal untuk berhipotesis bahwa peningkatan DA yang tiba-tiba dan besar seperti yang dipicu oleh penyalahgunaan obat-obatan dapat meniru peningkatan DA yang cepat dan besar yang dihasilkan dari penembakan DA secara phasic yang telah dikaitkan, di otak, dengan pemrosesan informasi tentang hadiah dan arti-penting (Schultz 2010). Peningkatan DA yang diinduksi obat tersebut dalam NAc mungkin diperlukan untuk kecanduan, tetapi fakta bahwa mereka terjadi juga pada orang yang tidak kecanduan menunjukkan bahwa mereka tidak cukup untuk menjelaskan karakteristik penggunaan narkoba yang impulsif dan kompulsif dari kecanduan.
Sekarang ada bukti bahwa respons dopaminergik yang sebanding terkait dengan imbalan makanan dan bahwa mekanisme ini juga cenderung berperan dalam konsumsi makanan berlebih dan obesitas. Telah diketahui bahwa makanan tertentu, terutama yang kaya akan gula dan lemak, sangat bermanfaat (Lenoir et al. 2007). Makanan berkalori tinggi dapat mendorong makan berlebih (makan yang tidak terpisahkan dari kebutuhan energetik) dan memicu hubungan yang dipelajari antara stimulus dan hadiah (pengkondisian). Dalam istilah evolusi, sifat makanan yang enak ini dulu menguntungkan di lingkungan di mana sumber makanan langka dan / atau tidak dapat diandalkan, karena memastikan makanan dimakan ketika tersedia, memungkinkan energi disimpan dalam tubuh (sebagai lemak) untuk digunakan di masa depan. . Sayangnya, dalam masyarakat seperti kita, di mana makanan berlimpah dan selalu tersedia, adaptasi ini telah menjadi kewajiban.
Beberapa neurotransmiter, termasuk DA, kanabinoid, opioid, dan serotonin, serta hormon dan neuropeptida yang terlibat dalam pengaturan asupan makanan homeostatik, seperti insulin, orexin, leptin, dan ghrelin, telah terlibat dalam efek makanan yang menguntungkan (Atkinson 2008; Cason et al. 2010; Cota et al. 2006). Dari jumlah tersebut, DA adalah yang paling diselidiki secara menyeluruh dan merupakan ciri terbaik. Eksperimen pada hewan pengerat telah menunjukkan bahwa, pada paparan pertama terhadap hadiah makanan, penembakan neuron DA dalam VTA meningkat dengan peningkatan yang dihasilkan dalam pelepasan DA pada NAc (Norgren et al. 2006). Demikian pula, pada subyek manusia yang sehat dan berbobot normal, konsumsi makanan yang enak terlihat untuk melepaskan DA pada striatum dorsal sesuai dengan peringkat kenikmatan makan (Small et al. 2003) (Gbr. 3). Namun, dan seperti yang terlihat dalam penelitian dengan penyalahguna narkoba, peningkatan makanan yang disebabkan oleh DA striatal saja tidak dapat menjelaskan perbedaan antara asupan makanan normal dan konsumsi makanan kompulsif yang berlebihan karena ini juga terjadi pada individu sehat yang tidak makan berlebihan. Jadi, seperti halnya kecanduan, adaptasi hilir cenderung terlibat dalam hilangnya kontrol atas asupan makanan.
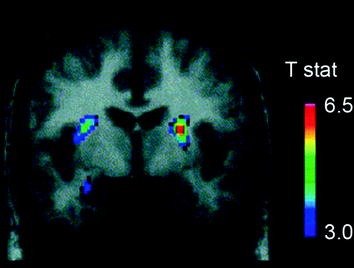
Ara. 3 Pelepasan dopamin diinduksi dengan makan. Bagian koronal dari T-peta pengurangan signifikan secara statistik dalam [11C] potensi pengikatan raclopride (BP) setelah menyusui. Bilah warna mewakili nilai statistik t. (Dicetak ulang dengan izin Small et al. 2003)
3 Pencitraan DA sebagai Respons terhadap Narkoba dan Isyarat Terkondisikan dalam Kecanduan
Peran DA dalam penguatan lebih kompleks dari sekadar mengkodekan untuk hadiah per se (kesenangan hedonis); misalnya, rangsangan yang mendorong peningkatan DA yang cepat dan besar juga memicu respons terkondisi dan mendapatkan motivasi insentif untuk mendapatkannya (Owesson-White et al. 2009). Ini penting karena, melalui proses pengkondisian, rangsangan netral yang terkait dengan penguat (apakah penguat alami atau obat) memperoleh kemampuan sendiri untuk meningkatkan DA dalam striatum (termasuk NAc) dalam mengantisipasi hadiah, sehingga menimbulkan motivasi yang kuat untuk mencari obat (Owesson-White et al. 2009). Namun, mekanisme hadiah dan pengondisian yang tidak terpisahkan dalam proses kecanduan obat lebih menantang daripada untuk konsumsi makanan karena obat-obatan pelecehan, melalui efek farmakologisnya, secara langsung mengaktifkan neuron DA (yaitu, nikotin) atau meningkatkan pelepasan DA (yaitu, amfetamin).
Studi pencitraan otak yang membandingkan peningkatan DA yang diinduksi oleh stimulan obat methylphenidate (MP) atau amphetamine (AMPH) di antara subyek yang kecanduan kokain vs kontrol menunjukkan atenuasi yang ditandai dari peningkatan DA yang diinduksi MP atau AMPH dalam striatum (50% lebih rendah pada pelaku penyalahgunaan detoksifikasi) dan 80% pada penyalahguna aktif) dan laporan diri yang lebih rendah dari efek hadiah obat relatif terhadap kontrol yang tidak menyalahgunakan narkoba (Martinez et al. 2007; Volkow et al. 1997) (Gbr. 4). Ini mengejutkan karena MP dan AMPH secara farmakologis mirip dengan kokain dan metamfetamin, dan penyalahguna obat tidak dapat membedakan di antara mereka ketika mereka diberikan secara intravena. Karena pengurangan yang ditandai dalam peningkatan DA yang diinduksi obat diamati apakah penyalahguna kokain telah didetoksifikasi atau tidak, ini menunjukkan bahwa keadaan penarikan bukanlah faktor pembaur (Volkow et al. 2011b). Ini dan hasil terkait (Volkow et al. 2009a) konsisten dengan hipotesis bahwa respons hedonis menjadi kurang pada individu yang kecanduan obat, dan semakin memperkuat gagasan bahwa efek peningkatan farmakologis akut DA pada obat dalam NAc tidak dapat menjelaskan dengan sendirinya peningkatan motivasi untuk mengkonsumsinya.
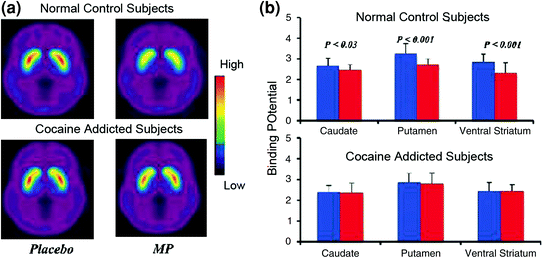
Ara. 4 Perubahan DA yang diinduksi oleh iv MP pada kontrol dan pada subyek yang kecanduan kokain aktif. gambar rata-rata potensial tidak mengikat tempat duduk (BPND) dari [11C] raclopride pada subjek yang kecanduan kokain aktif (n = 19) dan pada kontrol (n = 24) diuji setelah plasebo dan setelah iv MP. b Ketersediaan D2R (BPND) pada caudate, putamen, dan ventral striatum setelah plasebo (biru) dan setelah MP (merah) pada kontrol dan pada subjek yang kecanduan kokain. MP mengurangi D2R pada kontrol tetapi tidak pada subjek yang kecanduan kokain. Perhatikan bahwa pelaku penyalahgunaan kokain menunjukkan penurunan dalam ketersediaan D2R striatal awal (ukuran plasebo) dan penurunan pelepasan DA ketika diberikan iv MP (diukur sebagai penurunan ketersediaan D2R dari awal). Meskipun orang dapat mempertanyakan sejauh mana ketersediaan D2R striatal yang rendah pada subjek yang kecanduan kokain membatasi kemampuan untuk mendeteksi penurunan lebih lanjut dari MP, fakta bahwa subyek yang kecanduan kokain menunjukkan pengurangan ketersediaan D2R ketika terpapar pada isyarat kokain menunjukkan bahwa efek yang dilemahkan MP di [11C] pengikatan raclopride mencerminkan penurunan rilis DA. Dicetak ulang dengan izin (Volkow et al. 1997; Wang et al. 2010)
Respons neuron VTA DA terhadap perubahan rangsangan bermanfaat dengan paparan berulang.
Sementara sel-sel DA menembaki paparan pertama terhadap hadiah baru, paparan berulang terhadap DA menyebabkan neuron berhenti menembak pada konsumsi hadiah dan memecat ketika mereka terkena rangsangan yang memprediksi hadiah. (Schultz et al. 1997). Ini kemungkinan mendasari peran DA dalam pembelajaran dan pengkondisian. Memang, pensinyalan DA phasic yang diinduksi obat akhirnya dapat memicu neuroadaptations di sirkuit tambahan yang terkait dengan pembentukan kebiasaan dan pengkondisian perilaku. Tperubahan-perubahan ini sebagian besar disebabkan oleh pensinyalan D1R dan perubahan sinaptik dalam reseptor NMDA dan AMPA yang dimodulasi glutamat (Luscher dan Malenka 2011; Zweifel et al. 2009). Perekrutan sirkuit ini penting dalam perkembangan penyakit karena tanggapan terkondisi berikutnya membantu menjelaskan keinginan kuat untuk obat (keinginan) dan penggunaan kompulsif yang terjadi ketika subyek yang kecanduan terpapar pada isyarat terkait obat. Hipotesis ini konsisten dengan pengamatan independen (Volkow et al. 2006b; Wong et al. 2006) yang menunjukkan kekuatan paparan isyarat terkait-kokain untuk meningkatkan kadar DA dalam striatum punggung dan memicu peningkatan yang bersamaan dalam pengalaman subjektif dari keinginan dalam pelecehan kokain yang didetoksifikasi (Gbr. 5). Karena dorsal striatum berperan dalam pembelajaran kebiasaan (Belin et al. 2009; Yin et al. 2004), asosiasi tersebut kemungkinan mencerminkan penguatan kebiasaan seiring dengan semakin kronisnya kecanduan. Hal ini menunjukkan bahwa gangguan mendasar pada kecanduan mungkin berhubungan dengan respons AC yang dipicu oleh DA yang menghasilkan kebiasaan yang mengarah pada keinginan kuat dan konsumsi obat kompulsif. Menariknya, dalam secara aktif menggunakan subyek yang kecanduan kokain, peningkatan DA yang dipicu oleh isyarat terkondisi tampaknya bahkan lebih besar daripada yang diproduksi oleh obat stimulan itu sendiri yang dinilai dalam dua kelompok subjek yang berbeda (Volkow et al. 2011b, 2006b), menunjukkan bahwa tanggapan terkondisi dapat mendorong pensinyalan DA yang mempertahankan motivasi untuk mengambil obat bahkan ketika efek farmakologisnya tampaknya berkurang. Dengan demikian, walaupun obat-obatan pada awalnya dapat menginduksi perasaan imbalan langsung melalui pelepasan DA di ventral striatum, dengan penggunaan berulang, dan ketika kebiasaan berkembang, tampaknya ada pergeseran dari obat ke stimulus terkondisi. Menurut penelitian pada hewan laboratorium, proyeksi glutamatergic dari prefrontal cortex dan dari amygdala ke VTA / SN dan NAc memediasi respon terkondisi ini (Kalivas 2009). Dengan cara ini, prediksi semata-mata akan hadiah pada akhirnya bisa menjadi hadiah yang memotivasi perilaku yang diperlukan untuk konsumsi obat-obatan (atau makanan).
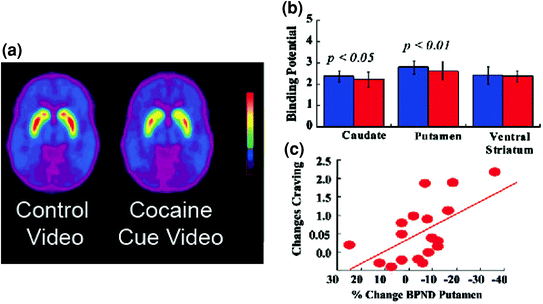
Ara. 5 Perubahan DA yang disebabkan oleh isyarat terkondisikan pada subjek yang kecanduan kokain aktif. gambar rata-rata potensi pengikatan non-tempat tidur (BPND) dari [11C] raclopride pada subjek yang kecanduan kokain (n = 17) diuji saat melihat video netral (adegan alam) dan sambil menonton video isyarat-isyarat kokain (subjek yang mengelola kokain). b Ketersediaan D2R (BPND) dalam caudate, putamen, dan ventral striatum untuk video netral (biru) dan video isyarat-kokain (merah). Isyarat kokain menurunkan D2R pada caudate dan putamen. c Korelasi antara perubahan D2R (mencerminkan peningkatan DA) dan laporan diri dari keinginan kokain yang disebabkan oleh video isyarat-kokain. Dimodifikasi dari ref. (Volkow et al. 2006b)
Interestically, jenis "switch" fungsional ini juga telah dilaporkan untuk penguat alami, yang kemungkinan akan mendorong perubahan setara dan bertahap dalam peningkatan DA, dari ventral ke daerah dorsal lebih banyak striatum selama transisi dari stimulus baru yang secara inheren menghargai dengan isyarat terkait yang memprediksi itu. Transisi ini disampaikan melalui pensinyalan DA, yang muncul sebagai kode untuk "kesalahan prediksi hadiah" (Schultz 2010). Aferen glutamatergik yang luas untuk neuron DA dari daerah yang terlibat dalam pemrosesan sensorik (insula atau korteks gustatory primer), homeostatis (hipotalamus), hadiah (NAc), emosional (amygdala dan hippocampus), dan multimodal (korteks orbitofrontal untuk informasi penting) , memodulasi aktivitas mereka sebagai respons terhadap hadiah dan isyarat terkondisi (Geisler dan Wise 2008). Lebih khusus, proyeksi dari amigdala dan korteks orbitofrontal (OFC) ke neuron DA dan ke NAc terlibat dalam respon terkondisi terhadap makanan (Petrovich 2010). Memang, studi pencitraan menunjukkan bahwa ketika subjek laki-laki non-obesitas diminta untuk menghentikan keinginan mereka untuk makanan - sementara terkena isyarat makanan-, mereka menunjukkan penurunan aktivitas metabolisme di amigdala dan OFC (serta di hippocampus), insula dan striatum, dan bahwa penurunan OFC dikaitkan dengan penurunan keinginan makanan (Wang et al. 2009). Suatu penghambatan serupa dari aktivitas metabolik dalam OFC (dan juga dalam NAc) telah diamati pada pengguna kokain ketika mereka diminta untuk menghentikan keinginan obat mereka pada saat terpapar pada isyarat kokain (Volkow et al. 2009b).
Namun, munculnya keinginan kuat isyarat terkondisi seperti itu, yang untuk makanan juga terjadi pada individu sehat yang tidak makan berlebihan, tidak akan begitu menghancurkan seandainya mereka tidak ditambah dengan defisit yang semakin besar dalam kemampuan otak untuk menghambat perilaku maladaptif.
4 Dampak Disfungsi pada Pengendalian Hambat
Kapasitas untuk menghambat respons yang masuk akal terikat untuk berkontribusi pada kemampuan individu untuk menghindari perilaku yang tidak pantas, seperti menggunakan obat-obatan atau makan melewati titik kenyang, dan dengan demikian meningkatkan kerentanannya terhadap kecanduan (atau obesitas) (Volkow dan Fowler) 2000; Volkow et al. 2008a).
Studi PET telah menemukan pengurangan signifikan dalam ketersediaan D2R dalam striatum subyek yang kecanduan yang bertahan selama berbulan-bulan setelah detoksifikasi berlarut-larut [diulas dalam (Volkow et al. 2009a)]. Demikian pula, penelitian praklinis pada primata hewan pengerat dan non-manusia telah menunjukkan bahwa paparan obat berulang dikaitkan dengan penurunan tingkat D2R striatal (Nader et al. 2006; Thanos et al. 2007; Volkow et al. 2001). Dalam striatum, D2R memediasi pensinyalan dalam jalur tidak langsung striatal yang memodulasi daerah prefrontal; dan downregulasinya telah terbukti meningkatkan kepekaan terhadap efek obat pada model hewan (Ferguson et al. 2011). Pada manusia yang kecanduan obat, pengurangan D2R striatal dikaitkan dengan penurunan aktivitas daerah prefrontal yang dibuktikan dengan penurunan metabolisme glukosa dasar (penanda fungsi otak) di OFC, anterior cingulate gyrus (ACC), dan dorsolateral prefrontal cortex (DLPFC) ) (Volkow et al. 2001, 1993, 2007) (Gbr. 6). Sejauh OFC, ACC, dan DLPFC terlibat dengan atribusi arti-penting, kontrol penghambatan / regulasi emosi, dan pengambilan keputusan, masing-masing, telah dipostulatkan bahwa regulasi mereka yang tidak tepat oleh pensinyalan DA yang dimediasi D2R pada subjek yang kecanduan dapat mendasari peningkatan nilai motivasi obat dalam perilaku mereka dan hilangnya kontrol atas asupan obat (Volkow dan Fowler 2000). Selain itu, karena gangguan pada OFC dan ACC dikaitkan dengan perilaku kompulsif dan impulsif (Fineberg et al. 2009), Modulasi gangguan DA dari wilayah ini cenderung berkontribusi pada asupan obat kompulsif dan impulsif yang terlihat dalam kecanduan (Goldstein dan Volkow 2002). Memang, pada penyalahguna metamfetamin, D2R striatal rendah dikaitkan dengan impulsif (Lee et al. 2009), dan juga memprediksi pemberian kokain kompulsif pada tikus (Everitt et al. 2008). Skenario terbalik, di mana kerentanan awal untuk penggunaan obat yang sudah ada sebelumnya di daerah prefrontal, dan di mana penggunaan obat berulang memicu penurunan lebih lanjut dalam D2R striatal, juga mungkin. Memang, sebuah penelitian yang dilakukan pada subjek yang, meskipun memiliki risiko tinggi untuk alkoholisme (riwayat keluarga positif alkoholisme) bukan alkoholik, mengungkapkan ketersediaan D2R striatal yang lebih tinggi dari normal yang dikaitkan dengan metabolisme normal di OFC, ACC, dan DLPFC (Volkow) et al. 2006a). Hal ini menunjukkan bahwa, pada subjek yang berisiko terhadap alkoholisme, fungsi prefrontal normal dikaitkan dengan peningkatan sinyal D2R striatal, yang pada gilirannya mungkin telah melindungi mereka dari penyalahgunaan alkohol.
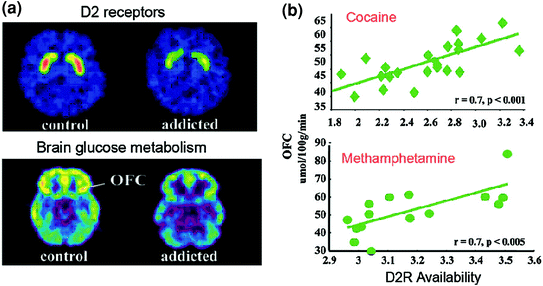
Ara. 6 Korelasi antara ketersediaan D2R striatal dan metabolisme di daerah otak prefrontal. gambar otak aksial untuk kontrol dan untuk kecanduan kokain untuk gambar dasar ketersediaan D2R di striatum (diperoleh dengan [11C] raclopride) dan metabolisme glukosa otak dalam OFC (diperoleh dengan [18FDG). b Korelasi antara D2R striatal dan metabolisme dalam OFC pada subyek yang kecanduan kokain dan kecanduan metamfetamin. Dicetak ulang dari Volkow et al. (2009a) Hak Cipta (2009), dengan izin dari Elsevier
Bisa ditebak, bukti disregulasi dalam sirkuit kontrol juga telah ditemukan di antara individu yang obesitas. Kedua studi praklinis dan klinis telah memberikan bukti penurunan pensinyalan D2R striatal, yang, sebagaimana disebutkan di atas, terkait dengan hadiah (NAc) tetapi juga dengan pembentukan kebiasaan dan rutinitas (dorsal striatum) pada obesitas.y (Geiger et al. 2009; Wang et al. 2001). Yang penting, penurunan ketersediaan D2R striatal telah dikaitkan dengan asupan makanan kompulsif pada tikus obesitas (Johnson dan Kenny 2010) dan dengan penurunan aktivitas metabolik dalam OFC dan ACC pada manusia gemuk (Volkow et al. 2008b) (Gbr. 7a – c). Mengingat bahwa disfungsi dalam OFC dan ACC menghasilkan kompulsif [lihat review (Fineberg et al. 2009)], ini mungkin menjadi bagian dari mekanisme dimana pensinyalan D2R striatal yang rendah memfasilitasi hyperphagia (Davis et al. 2009). Selain itu, karena penurunan pensinyalan terkait D2R juga cenderung mengurangi sensitivitas terhadap imbalan alami lainnya, defisit pada individu yang obesitas ini mungkin juga berkontribusi pada kompensasi makan berlebihan. (Geiger et al. 2008).
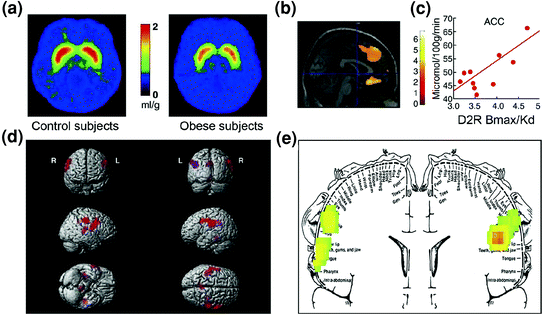
Ara. 7 Hyperphagia dapat dihasilkan dari upaya untuk mengkompensasi sirkuit hadiah yang melemah (diproses melalui sirkuit kortikostriatal yang diatur dopamin) dikombinasikan dengan sensitivitas yang semakin tinggi terhadap palatabilitas (sifat hedonis makanan yang diproses sebagian melalui korteks somatosensori). a Gambar rata-rata untuk ketersediaan reseptor DA D2 (D2R) dalam kontrol (n = 10) dan pada subjek obesitas yang tidak sehat (n = 10). b Hasil dari (Pemetaan Parametrik Statistik) SPM yang mengidentifikasi area di otak di mana D2R dikaitkan dengan metabolisme glukosa, ini termasuk OFC medial, ACC, dan PFC dorsolateral (wilayah tidak ditampilkan). c Kemiringan regresi antara D2R striatal dan aktivitas metabolik di ACC pada subjek obesitas. d Gambar SPM yang ditampilkan secara tiga dimensi menunjukkan area dengan metabolisme yang lebih tinggi pada pasien obesitas dibandingkan subjek kurus (P <0.003, tidak dikoreksi). e Hasil SPM kode warna ditampilkan dalam bidang koronal dengan diagram tumpang tindih dari somatosensory homunculus. Hasil (nilai z) disajikan menggunakan skala pelangi dimana merah> kuning> hijau. Jika dibandingkan dengan subjek kurus, subjek obesitas memiliki metabolisme dasar yang lebih tinggi di area somatosensori di mana mulut, bibir, dan lidah terwakili dan yang terlibat dalam pemrosesan palatabilitas makanan. Dimodifikasi, dengan izin, dari Volkow et al. (2008a) (a – c) dan Wang et al. (2002) (d, e)
Hipotesis ini konsisten dengan bukti preklinis yang menunjukkan bahwa penurunan aktivitas DA dalam VTA menghasilkan peningkatan dramatis dalam konsumsi makanan berlemak tinggi (Stoeckel et al. 2008). Demikian pula, dibandingkan dengan individu dengan berat badan normal, individu obesitas yang disajikan dengan gambar makanan berkalori tinggi (rangsangan yang dikondisikan) menunjukkan peningkatan aktivasi saraf di daerah yang merupakan bagian dari sirkuit penghargaan dan motivasi (NAc, striatum dorsal, OFC , ACC, amygdala, hippocampus, dan insula) (Killgore dan Yurgelun-Todd 2005). Sebaliknya, dalam kontrol berat badan normal, aktivasi ACC dan OFC (daerah yang terlibat dalam atribusi arti-penting yang diproyeksikan ke dalam NAc) selama penyajian makanan berkalori tinggi ditemukan berkorelasi negatif dengan indeks massa tubuh mereka (BMI) ( Stice et al. 2008b). Ini menunjukkan interaksi yang dinamis antara jumlah makanan yang dimakan (tercermin sebagian dalam BMI) dan reaktivitas daerah hadiah terhadap makanan berkalori tinggi (tercermin dalam aktivasi OFC dan ACC) pada individu dengan berat normal, yang hilang pada kegemukan.
Anehnya, individu yang obesitas menunjukkan lebih sedikit aktivasi sirkuit hadiah dari konsumsi makanan aktual (disebut sebagai hadiah makanan konsumtif) daripada individu kurus, sedangkan mereka menunjukkan aktivasi yang lebih besar dari daerah kortikal somatosensori yang memproses palatabilitas ketika mereka mengantisipasi konsumsi (Stice et al. 2008b). Pengamatan terakhir berhubungan dengan daerah di mana penelitian sebelumnya telah mengungkapkan peningkatan aktivitas pada subjek obesitas yang diuji pada awal (non stimulasi) (Wang et al. 2002) (Gbr. 7d, e). Peningkatan aktivitas daerah yang memproses palatabilitas dapat membuat subyek obesitas lebih menyukai makanan daripada penguat alami lainnya, sedangkan penurunan aktivasi target dopaminergik oleh konsumsi makanan yang sebenarnya dapat menyebabkan konsumsi berlebihan sebagai cara untuk mengkompensasi sinyal lemah yang dimediasi D2R (Stice et al. 2008a). Respon yang berkurang dari sirkuit hadiah ini terhadap konsumsi makanan pada subjek yang obesitas mengingatkan pada peningkatan DA yang dipicu oleh konsumsi obat pada individu yang kecanduan dibandingkan dengan subjek yang tidak kecanduan.
Korteks prefrontal (PFC) memainkan peran penting dalam fungsi eksekutif, termasuk kontrol penghambatan (Miller dan Cohen 2001). Proses-proses ini dimodulasi oleh D1R dan D2R (mungkin juga D4R) dan dengan demikian, penurunan aktivitas dalam PFC, baik dalam kecanduan dan obesitas, cenderung berkontribusi pada kontrol yang buruk dan kompulsivitas tinggi. Ketersediaan D2R yang lebih rendah dari normal dalam striatum individu gemuk, yang telah dikaitkan dengan penurunan aktivitas di PFC dan ACC (Volkow et al. 2008b) karena itu cenderung berkontribusi terhadap kurangnya kontrol mereka terhadap asupan makanan. Memang, korelasi negatif antara BMI dan striatal D2R dilaporkan dalam obesitas (Wang et al. 2001) dan kelebihan berat badan (Haltia et al. 2007a) individu mendukung ini. Pemahaman yang lebih baik tentang mekanisme yang menyebabkan fungsi PFC terganggu pada obesitas (atau kecanduan) dapat memfasilitasi pengembangan strategi untuk memperbaiki, atau bahkan mungkin membalikkan, gangguan spesifik dalam domain kognitif penting. Misalnya, penundaan diskonto, yang merupakan kecenderungan untuk mendevaluasi hadiah sebagai fungsi dari penundaan temporal pengirimannya, adalah salah satu operasi kognitif yang paling banyak diselidiki terkait dengan gangguan yang terkait dengan impulsif dan kompulsif. Penundaan diskon telah diselidiki paling mendalam pada penyalahguna narkoba yang menunjukkan preferensi berlebihan untuk hadiah kecil tapi langsung daripada hadiah besar tapi tertunda (Bickel et al. 2007). Namun, beberapa penelitian yang dilakukan dengan individu yang obesitas juga telah menemukan bukti preferensi untuk imbalan yang tinggi dan langsung, meskipun ada peningkatan kemungkinan menderita kerugian yang lebih tinggi di masa depan (Brogan et al. 2010; Weller et al. 2008). Dan baru-baru ini, penelitian lain menemukan korelasi positif antara BMI dan diskon hiperbolik, di mana hadiah negatif di masa depan didiskon kurang dari hadiah positif di masa depan (Ikeda et al. 2010). Menariknya, penundaan diskon tampaknya tergantung pada fungsi ventral striatum (Gregorios-Pippas et al. 2009) dan PFC, termasuk lateral OFC (Bjork et al. 2009), dan sensitif terhadap manipulasi DA (Pine et al. 2010). Secara khusus, meningkatkan pensinyalan DA (dengan pengobatan L DOPA) meningkatkan impulsif dan diskon temporal.
5 Keterlibatan Sirkuit Motivasi
Pensinyalan dopaminergik juga memodulasi motivasi. Ciri-ciri perilaku seperti semangat, kegigihan, dan investasi upaya berkelanjutan untuk mencapai tujuan, semuanya tunduk pada modulasi oleh DA yang bertindak melalui beberapa wilayah sasaran, termasuk NAc, ACC, OFC, DLPFC, amygdala, dorsal striatum, dan ventral pallidum (Salamone et al. 2007). Pensinyalan DA yang tidak teratur dikaitkan dengan peningkatan motivasi untuk mendapatkan obat-obatan, ciri khas kecanduan, itulah sebabnya mengapa orang yang kecanduan narkoba sering terlibat dalam perilaku ekstrem untuk mendapatkan obat-obatan, bahkan ketika mereka memerlukan konsekuensi berat dan merugikan yang diketahui (Volkow dan Li) 2005). Karena penggunaan narkoba menjadi dorongan motivasi utama dalam kecanduan narkoba (Volkow et al. 2003), subjek yang kecanduan dibangkitkan dan dimotivasi oleh proses mendapatkan obat tetapi cenderung menjadi ditarik dan apatis ketika terpapar pada kegiatan yang tidak terkait dengan obat. Pergeseran ini telah dipelajari dengan membandingkan pola aktivasi otak yang terjadi dengan paparan isyarat terkondisi dengan yang terjadi tanpa adanya isyarat tersebut. Berbeda dengan penurunan aktivitas prefrontal yang dilaporkan pada pengguna kokain yang didetoksifikasi ketika tidak distimulasi dengan obat atau isyarat obat [lihat ulasan (Volkow et al. 2009a)], daerah-daerah prefrontal ini menjadi aktif ketika para pelaku kokain terpapar pada rangsangan pemicu keinginan (baik obat atau isyarat) (Grant et al. 1996; Volkow et al. 1999a; Wang et al. 1999). Hasil ini mengingatkan pada pengamatan bahwa pelaku penyalahgunaan kokain, yang dipelajari tidak lama setelah episode penggunaan kokain, menunjukkan peningkatan aktivitas metabolik dalam OFC dan ACC (juga dorsal striatum) yang dikaitkan dengan keinginan (Volkow et al. 1991).
Selain itu, ketika tanggapan terhadap iv MP dibandingkan antara individu yang kecanduan kokain dan non-kecanduan, yang pertama merespons dengan peningkatan metabolisme dalam ACC ventral dan medial OFC (efek yang terkait dengan keinginan), sedangkan yang terakhir menunjukkan tanggapan yang berlawanan, yaitu menurun metabolisme di wilayah ini (Volkow et al. 2005). Ini menunjukkan bahwa aktivasi daerah-daerah prefrontal dengan paparan obat mungkin spesifik untuk kecanduan dan terkait dengan peningkatan keinginan untuk obat. Selain itu, sebuah penelitian yang mendorong subyek kecanduan kokain untuk secara sengaja menghambat keinginan ketika terpapar pada isyarat obat menunjukkan bahwa subyek yang berhasil menghambat keinginan menunjukkan penurunan metabolisme dalam OFC medial (yang memproses nilai motivasi dari penguat) dan NAc (yang memprediksi hadiah) (Volkow et al. 2009b). Temuan ini semakin menguatkan keterlibatan OFC, ACC, dan striatum dalam meningkatkan motivasi untuk mendapatkan obat yang terlihat dalam kecanduan.
Dapat diprediksi, OFC juga telah terlibat dalam menghubungkan nilai arti-penting dengan makanan (Grabenhorst et al. 2008; Rolls dan McCabe 2007), membantu menilai kesenangan yang diharapkan dan palatabilitas sebagai fungsi dari konteksnya. Studi PET dengan FDG untuk mengukur metabolisme glukosa otak pada individu dengan berat badan normal melaporkan bahwa paparan isyarat makanan meningkatkan aktivitas metabolisme di OFC, yang merupakan efek yang terkait dengan persepsi kelaparan dan keinginan untuk makan (Wang et al. 2004). Peningkatan aktivasi OFC oleh stimulasi makanan cenderung mencerminkan efek dopaminergik hilir dan berpartisipasi dalam keterlibatan DA dalam upaya untuk konsumsi makanan. OFC berperan dalam mempelajari asosiasi dan penguatan stimulus-penguatan (Cox et al. 2005; Gallagher et al. 1999), mendukung pemberian makan dengan isyarat yang dikondisikan (Weingarten 1983), dan mungkin berkontribusi terhadap makan berlebih terlepas dari sinyal kelaparan (Ogden dan Wardle 1990). Memang, disfungsi OFC telah dikaitkan dengan makan berlebihan (Machado dan Bachevalier 2007).
Terlepas dari beberapa inkonsistensi di antara studi, data pencitraan otak juga mendukung gagasan bahwa perubahan struktural dan fungsional di daerah otak yang terlibat dalam fungsi eksekutif (termasuk kontrol penghambatan) dapat dikaitkan dengan BMI yang tinggi pada orang yang sehat. Sebagai contoh, sebuah studi MRI yang dilakukan pada wanita lanjut usia, menggunakan morfometri berbasis voxel, menemukan korelasi negatif antara BMI dan volume materi abu-abu (termasuk daerah frontal), yang, dalam OFC, dikaitkan dengan gangguan fungsi eksekutif (Walther et al. 2010). Menggunakan PET untuk mengukur metabolisme glukosa otak dalam kontrol yang sehat, kami melaporkan korelasi negatif antara BMI dan aktivitas metabolisme di DLPFC, OFC, dan ACC. Dalam penelitian ini, aktivitas metabolisme di daerah prefrontal memprediksi kinerja subjek dalam tes fungsi eksekutif (Volkow et al. 2009c). Demikian pula, studi spektroskopi resonansi magnetik nuklir (NMR) pada usia paruh baya dan kontrol lansia yang sehat menunjukkan bahwa BMI berhubungan negatif dengan kadar N-asetil-aspartat (penanda integritas neuron) di korteks frontal dan ACC (Gazdzinski et al. 2008; Volkow et al. 2009c).
Studi pencitraan otak yang membandingkan individu gemuk dan kurus juga melaporkan kepadatan materi abu-abu yang lebih rendah di daerah frontal (operkulum frontal dan girus frontal tengah) dan di girus dan putamen post-sentral (Pannacciulli et al. 2006). Studi lain, tidak menemukan perbedaan dalam volume materi abu-abu antara subjek yang gemuk dan kurus, itu memang mencatat korelasi positif antara volume materi putih dalam struktur otak basal dan rasio pinggang ke pinggul, tren yang sebagian dibalik oleh diet (Haltia et al. 2007b). Menariknya, area kortikal, seperti DPFC dan OFC yang terlibat dalam pengendalian penghambatan, juga telah ditemukan menjadi aktif dalam diet yang sukses dalam menanggapi konsumsi makanan (DelParigi et al. 2007), menyarankan target potensial untuk pelatihan kembali perilaku dalam pengobatan obesitas (dan juga dalam kecanduan).
6 Keterlibatan Sirkuit Interoceptive
Penelitian neuroimaging telah mengungkapkan bahwa insula tengah memainkan peran penting dalam mengidam makanan, kokain, dan rokok. (Bonson et al. 2002; Pelchat et al. 2004; Wang et al. 2007). Pentingnya insula telah disorot oleh sebuah penelitian yang melaporkan bahwa perokok dengan kerusakan pada daerah ini (tetapi tidak mengontrol perokok yang menderita lesi ekstra-insular) dapat berhenti merokok dengan mudah dan tanpa mengidam atau kambuh (Naqvi et al. . 2007). Insula, khususnya daerah yang lebih anterior, secara timbal balik terhubung ke beberapa daerah limbik (misalnya, korteks prefrontal ventromedial, amygdala, dan ventri striatum) dan tampaknya memiliki fungsi interoceptive, mengintegrasikan informasi otonom dan visceral dengan emosi dan motivasi, sehingga memberikan kesadaran sadar akan desakan ini (Naqvi dan Bechara 2009). Memang, studi lesi otak menunjukkan bahwa PFC dan insula ventromedial merupakan komponen penting dari sirkuit terdistribusi yang mendukung pengambilan keputusan emosional (Clark et al. 2008). Konsisten dengan hipotesis ini, studi pencitraan secara konsisten menunjukkan aktivasi diferensial insula selama keinginan (Brody et al. 2009; Goudriaan et al. 2010; Naqvi dan Bechara 2009; Wang et al. 1999). Dengan demikian, reaktivitas wilayah otak ini telah disarankan untuk berfungsi sebagai biomarker untuk membantu memprediksi kekambuhan (Janes et al. 2010).
Insula juga merupakan area gustatory primer, yang berpartisipasi dalam banyak aspek perilaku makan, seperti rasa. Selain itu, insulasi rostral (terhubung ke korteks rasa primer) memberikan informasi kepada OFC yang memengaruhi representasi multimodalnya tentang nilai kesenangan atau hadiah makanan yang masuk (Rolls). 2008). Karena keterlibatan insula dalam rasa interoceptive tubuh, dalam kesadaran emosional (Craig 2003) dan dalam motivasi dan emosi (Rolls 2008), kontribusi gangguan insular pada obesitas dapat diharapkan. Memang, distensi lambung menghasilkan aktivasi posterior insula, yang cenderung mencerminkan perannya dalam kesadaran keadaan tubuh (dalam hal ini kepenuhan) (Wang et al. 2008). Selain itu, pada lean, tetapi tidak pada subjek obesitas, distensi lambung mengakibatkan aktivasi amigdala dan penonaktifan insula anterior (Tomasi et al. 2009). Kurangnya respons amigdala pada subjek yang obesitas dapat mencerminkan kesadaran interoseptif yang tumpul dari keadaan tubuh yang dihubungkan dengan rasa kenyang (perut penuh). Meskipun modulasi aktivitas insular oleh DA telah diselidiki dengan buruk, diakui bahwa DA terlibat dalam respon terhadap mencicipi makanan yang enak yang dimediasi melalui insula (Hajnal dan Norgren 2005). Studi pencitraan manusia telah menunjukkan bahwa mencicipi makanan lezat mengaktifkan area insula dan otak tengah (DelParigi et al. 2005; Frank et al. 2008). Namun, pensinyalan DA mungkin juga diperlukan untuk merasakan kandungan kalori dari makanan. Misalnya, ketika wanita dengan berat badan normal merasakan pemanis dengan kalori (sukrosa), area insula dan otak tengah dopaminergik menjadi aktif, sedangkan mencicipi pemanis bebas kalori (sucralose) hanya mengaktifkan insula (Frank et al. 2008). Subjek obesitas menunjukkan aktivasi insular yang lebih besar daripada kontrol normal ketika mencicipi makanan cair yang terdiri dari gula dan lemak (DelParigi et al. 2005). Sebaliknya, subjek yang telah pulih dari anoreksia nervosa menunjukkan lebih sedikit aktivasi di insula ketika mencicipi sukrosa dan tidak ada hubungan perasaan senang dengan aktivasi insular seperti yang diamati pada kontrol normal (Wagner et al. 2008). Ketika dikombinasikan, hasil-hasil ini memungkinkan disregulasi insula sebagai respons terhadap rangsangan rasa mungkin terlibat dalam gangguan kontrol berbagai perilaku nafsu makan.
7 Sirkuit Aversi
Seperti disebutkan sebelumnya, pelatihan (pengkondisian) pada isyarat yang memprediksi hadiah menyebabkan sel dopaminergik menembak sebagai respons terhadap prediksi hadiah, dan bukan pada hadiah itu sendiri. Di sisi lain, dan konsisten dengan logika ini, telah diamati bahwa sel dopaminergik akan terbakar kurang dari normal jika hadiah yang diharapkan gagal terwujud (Schultz et al. 1997). Bukti kumulatif (Christoph et al. 1986; Lisoprawski et al. 1980; Matsumoto dan Hikosaka 2007; Nishikawa et al. 1986) menunjuk ke habenula sebagai salah satu daerah yang mengontrol penurunan penembakan sel dopaminergik dalam VTA yang mungkin mengikuti kegagalan untuk menerima hadiah yang diharapkan (Kimura et al. 2007). Dengan demikian, peningkatan sensitivitas habenula, sebagai akibat dari paparan obat kronis, dapat mendasari reaktivitas yang lebih besar terhadap isyarat obat. Memang, aktivasi habenula, pada subyek yang kecanduan kokain, telah dikaitkan dengan kekambuhan perilaku terhadap penggunaan obat setelah paparan isyarat (Brown et al. 2011; Zhang et al. 2005). Dalam kasus nikotin, reseptor nikotinat α5 di habenula tampaknya memodulasi respons permusuhan terhadap dosis besar nikotin (Fowler et al. 2011); dan reseptor α5 dan α2 di habenula terlibat dalam penarikan nikotin (Salas et al. 2009). Karena respons habenula yang berlawanan dengan neuron DA terhadap hadiah (penonaktifan) dan pengaktifannya setelah terpapar rangsangan permusuhan, kami merujuk ke sini pada sinyal habenula ketika seseorang menyampaikan input "antireward".
Habenula tampaknya memainkan peran yang sama sehubungan dengan hadiah makanan. Diet makanan yang sangat enak dapat menyebabkan obesitas pada tikus, dengan kenaikan berat badan berkorelasi dengan peningkatan μ-opioid peptida yang mengikat di amoldala basolateral dan basomedial. Menariknya, habenula medial menunjukkan pengikatan peptida μ-opioid yang lebih tinggi secara signifikan (sekitar 40%) setelah terpapar pada makanan yang enak pada tikus yang bertambah berat badan (yang mengonsumsi lebih banyak makanan) tetapi tidak pada yang tidak (Smith et al. 2002). Ini menunjukkan bahwa habenula mungkin terlibat dalam makan berlebih dalam kondisi ketersediaan makanan yang enak. Selain itu, neuron dalam nukleus tegmental rostromedial, yang menerima input utama dari habenula lateral, diproyeksikan ke neuron VTA DA dan diaktifkan setelah kekurangan makanan (Jhou et al. 2009). Temuan ini konsisten dengan peran habenula dalam memediasi respons terhadap rangsangan permusuhan atau keadaan seperti yang terjadi selama diet atau penghentian obat.
Keterlibatan habenula sebagai pusat antireward dalam jaringan emosional konsisten dengan model teoritis sebelumnya dari kecanduan yang mendalilkan respons anti-hadiah peka (dimediasi melalui peningkatan sensitivitas amygdala dan peningkatan pensinyalan melalui faktor pelepasan kortikotropin) sebagai penggerak asupan obat dalam kecanduan. (Koob dan Le Moal 2008). Respons antireward serupa juga dapat menyebabkan konsumsi makanan berlebih pada obesitas.
8 Obat dan Hadiah Makanan Patologis: Model Kerja yang Diperbarui
TKemampuan untuk menahan keinginan untuk menggunakan obat atau makan melewati titik kenyang membutuhkan berfungsinya sirkuit neuronal yang terlibat dalam kontrol top-down untuk menentang respons terkondisi yang memprediksi imbalan dari menelan makanan / obat dan keinginan untuk menelan makanan / obat-obatan. Di sini, kami menyoroti enam dari rangkaian ini: penghargaan / arti-penting, pengondisian / kebiasaan, kontrol penghambatan / fungsi eksekutif, motivasi / dorongan, intersepsi, dan penghindaran keengganan / reaktivitas stres (Gbr. 8). Berdasarkan data pencitraan yang disajikan di sini, kami mendalilkan bahwa perbedaan antara harapan untuk efek obat / makanan (tanggapan terkondisi) dan efek neurofisiologis tumpul yang mempertahankan pengambilan obat atau konsumsi makanan yang berlebihan dalam upaya untuk mencapai hadiah yang diharapkan. Juga, apakah diuji selama periode awal atau berlarut-larut pantang / diet, kecanduan / subjek obesitas menunjukkan D2R lebih rendah di striatum (termasuk NAc), yang berhubungan dengan penurunan aktivitas dasar di daerah otak frontal yang terlibat dalam atribusi saliensi (kortofrontal korteks) dan penghambatan control (ACC dan DLPFC), yang gangguannya menghasilkan kompulsif dan impulsif. Fpada awalnya, bukti juga telah muncul tentang peran sirkuit interoceptive dan aversive dalam ketidakseimbangan sistemik yang mengakibatkan konsumsi kompulsif baik obat atau makanan.
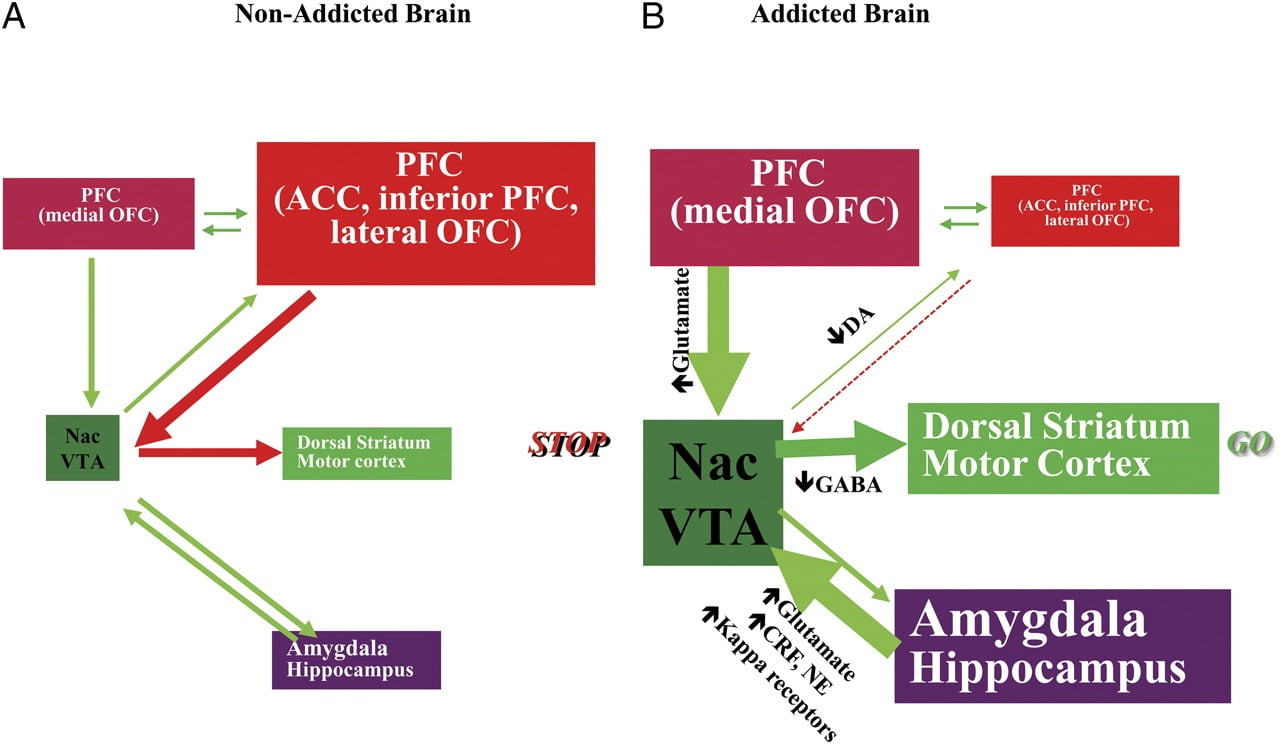
Ara. 8 Model yang mengusulkan jaringan sirkuit yang berinteraksi, gangguan yang berkontribusi pada serangkaian perilaku stereotip yang mendasari kecanduan obat dan makan berlebihan kronis: hadiah (nucleus accumbens, VTA, dan ventral pallidum), pengkondisian / memori (amigdala, OFC medial untuk atribusi arti-penting, hippocampus, dan striatum punggung untuk kebiasaan), kontrol eksekutif (DLPFC, ACC, korteks frontal inferior, dan lateral OFC), motivasi / dorongan (medial OFC untuk atribusi arti-penting, ACC ventral, VTA, SN, striatum punggung, dan korteks motorik). Nac, nucleus accumbens, interoception (Insula dan ACC), dan keengganan / penghindaran (Habenula). a Ketika sirkuit ini seimbang, ini menghasilkan kontrol penghambatan dan pengambilan keputusan yang tepat. b Selama kecanduan, ketika nilai ekspektasi yang ditingkatkan dari obat dalam sirkuit hadiah, motivasi, dan memori mengatasi sirkuit kontrol, mendukung loop umpan balik positif yang dimulai oleh konsumsi obat dan diabadikan dengan peningkatan aktivasi motivasi / dorongan. dan sirkuit memori. Sirkuit ini juga berinteraksi dengan sirkuit yang terlibat dalam pengaturan suasana hati, termasuk reaktivitas stres (yang melibatkan amigdala, hipotalamus, habenula) dan interokeption (yang melibatkan insula dan ACC dan berkontribusi terhadap kesadaran keinginan). Beberapa neurotransmiter terlibat dalam neuroadaptations ini, termasuk glutamat, GABA, norepinefrin, faktor pelepas kortikotropin, dan reseptor opioid. CRF, faktor pelepas kortikotropin; NE, norepinefrin. Dimodifikasi dengan izin dari Volkow et al. (2011b)
Sebagai konsekuensi dari gangguan berurutan dalam sirkuit ini, individu dapat mengalami 1) nilai motivasi yang ditingkatkan dari obat / makanan (sekunder untuk asosiasi yang dipelajari melalui pengkondisian dan kebiasaan) dengan mengorbankan penguat lainnya (sekunder untuk penurunan sensitivitas sirkuit hadiah) ), 2) gangguan kemampuan untuk menghambat tindakan yang disengaja (diarahkan pada tujuan) yang dipicu oleh keinginan kuat untuk mengambil obat / makanan (sekunder untuk fungsi eksekutif yang terganggu) yang menghasilkan obat / makanan kompulsif, dan 3) meningkatkan reaktivitas stres dan penghindaran permusuhan yang menghasilkan obat impulsif untuk melarikan diri dari keadaan permusuhan.
Model ini menyarankan pendekatan terapi yang beragam untuk kecanduan yang dirancang untuk mengurangi sifat penguat obat / makanan, membangun kembali / meningkatkan sifat bermanfaat dari penguat alami, menghambat asosiasi belajar terkondisi, meningkatkan motivasi untuk kegiatan yang tidak terkait dengan obat / makanan, mengurangi reaktivitas stres , meningkatkan mood, dan memperkuat kontrol penghambatan tujuan umum.
Ucapan Terima Kasih
Penulis ingin mengucapkan terima kasih atas dukungan program intramural NIAAA dari National Institutes of Health.
Referensi