Laporan Ilmiah volume 9, Nomor artikel: 16918 (2019)
Abstrak
Konsumsi sukrosa yang berlebihan memunculkan kecanduan seperti kecanduan yang dapat menopang epidemi obesitas. Opioid dan dopamin memediasi efek bermanfaat dari penyalahgunaan obat, dan penghargaan alami dari rangsangan seperti makanan yang enak. Kami meneliti efek sukrosa menggunakan pencitraan PET dengan [11C] carfentanil (agonis reseptor opioid) dan [11C] raclopride (antagonis reseptor dopamin D2 / 3) pada tujuh minipigs Göttingen yang dibius betina. Kami kemudian memberi minipig akses ke larutan sukrosa selama satu jam pada 12 hari berturut-turut dan melakukan pencitraan lagi 24 jam setelah akses sukrosa akhir. Dalam sampel yang lebih kecil dari lima minipig, kami melakukan tambahan [11C] sesi PET carfentanil setelah paparan sukrosa pertama. Kami menghitung potensi pengikatan voxel-wise (BPND) menggunakan otak kecil sebagai wilayah pengikatan yang tidak dapat dipindahkan, menganalisis perbedaan dengan pemetaan statistik non-parametrik, dan melakukan analisis regional. Setelah 12 hari akses sukrosa, BPND dari kedua pelacak telah menurun secara signifikan pada striatum, nucleus accumbens, thalamus, amygdala, cingulate cortex dan prefrontal cortex, konsisten dengan penurunan regulasi kepadatan reseptor. Setelah satu paparan sukrosa, kami menemukan penurunan ikatan [11C] carfentanil dalam nucleus accumbens dan cingulate cortex, konsisten dengan pelepasan opioid. Ketersediaan yang lebih rendah dari reseptor opioid dan dopamin dapat menjelaskan potensi kecanduan terkait dengan asupan sukrosa.
Pengantar
Lima persen populasi dunia secara klinis mengalami obesitas1. Sebagai ciri khas sindrom metabolik, obesitas dikaitkan dengan diabetes tipe 2, penyakit kardiovaskular, masalah pernapasan, dan risiko depresi dan kemungkinan demensia.2. Meningkatnya konsumsi makanan padat energi telah melebih-lebihkan perbedaan fisiologis antara kelaparan homeostatis yang mengikuti kekurangan makanan, dan kelaparan hedonis, atau "keinginan", yang terjadi tanpa adanya kekurangan.3,4. Karena peraturan homeostatis saja tidak dapat menjelaskan kenaikan obesitas saat ini, adalah wajib untuk menguji efek pada mekanisme otak penghargaan dan kesenangan dari sifat adiktif dari makanan yang sangat enak.
Konsumsi sukrosa dikaitkan dengan obesitas, dan sukrosa semakin dianggap sebagai zat adiktif5. Beberapa temuan berbeda dengan klaim ini karena kesulitan dalam memisahkan konsumsi makanan yang tidak enak dari respon makanan hedonis, dan dalam menentukan bahan adiktif dalam makanan olahan, serta mekanisme yang berbeda dimana makanan mengubah sirkuit otak melalui jalur alami6. Namun demikian, dalam konteks tertentu, asupan sukrosa memang menginduksi penghargaan dan keinginan, sebanding dalam besarnya dengan yang diinduksi oleh obat adiktif, yang mengarah pada konsumsi berlebihan dan akhirnya obesitas.6,7.
Kelaparan dikaitkan dengan "keinginan" yang terkait erat dengan efek neurotransmisi dopaminergik dalam sejumlah keadaan penghargaan8, tetapi masih belum jelas bagaimana tindakan dopamin (DA) dimodulasi dalam menanggapi makan kompulsif. Konsumsi makanan enak dikaitkan dengan "menyukai", dimediasi terutama oleh sistem opioid endogen, terutama reseptor μ-opioid (μOR)9,10, yang dapat mempromosikan konsumsi berlebihan ketika dideregulasi. Dalam laporan ini, kami menguji klaim bahwa sukrosa mengarah pada pelepasan opioid dan dopamin yang menurunkan ketersediaan reseptor μOR dan DA D2 / 3. Ketersediaan adalah indeks jumlah reseptor yang tidak dihuni yang tersedia untuk penjejakan pelacak dan pada prinsipnya tidak membedakan antara hunian ligan dan kepadatan reseptor.11.
Permulaan makan kompulsif tergantung pada beberapa faktor, dan studi kausal pada manusia meningkatkan masalah etika. Karena itu, sebagian besar penelitian berfokus pada perilaku makan pada tikus12. Meskipun tikus memiliki "gigi manis", mekanisme homeostasisnya penting untuk pertambahan berat badan, metabolisme, dan jenis penumpukan lemak, berbeda secara signifikan dari manusia. Göttingen minipig adalah hewan omnivora besar dengan otak gyrencephalic yang berkembang dengan baik, yang dapat dicitrakan pada resolusi yang cukup. Daerah kortikal subkortikal dan prefrontal yang terdefinisi dengan baik13 memungkinkan terjemahan yang lebih langsung ke fungsi otak manusia. Di sini, kami menggunakan pencitraan positron emission tomography (PET) untuk menguji in vivo Ketersediaan μOR dan DA D2 / 3 dalam model minipig dari paparan sukrosa subkronik. Dalam sampel yang lebih kecil, kami menyelidiki efek langsung pada hunian μOR setelah paparan sukrosa pertama. Akhirnya, kami menguji hubungan antara perubahan dalam ketersediaan reseptor dari dua pelacak.
Hasil
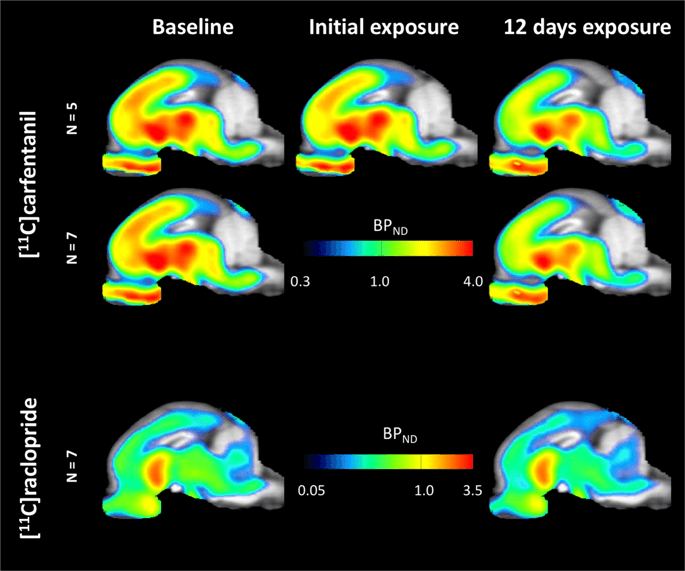
Peta parametrik rata-rata dari [11C] carfentanil dan [11C] potensi pengikatan raclopride (BPND) ditunjukkan pada Gambar. 1. Untuk menganalisis perubahan yang terjadi setelah paparan sukrosa pertama di lima minipig dibandingkan dengan baseline, dan satu hari setelah 12th akses sukrosa dalam tujuh minipig dibandingkan dengan baseline, kami menggunakan teori permutasi dan analisis seluruh otak terbatas, yang lebih disukai untuk sampel ukuran ini14.
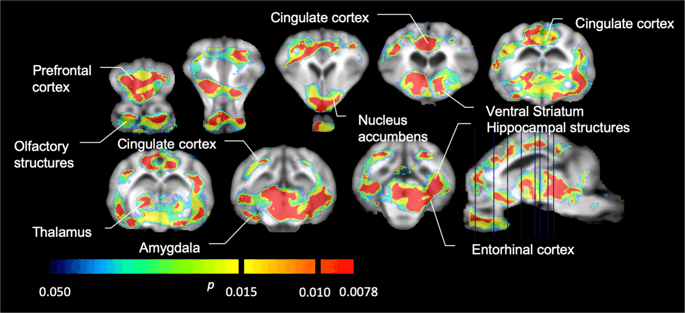
Rata-rata potensi pengikatan yang tidak dapat dipindahkan (BPND) peta yang ditumpangkan pada gambar MRI dalam tampilan sagital. Data disajikan untuk [11C] carfentanil BPND dari 5 minipig dicitrakan pada awal, setelah paparan awal sukrosa dan setelah 12 hari paparan sukrosa (baris atas). [11C] carfentanil BPND dari semua 7 minipig yang dicitrakan pada awal dan setelah 12 hari akses sukrosa disajikan di baris tengah. [11C] raclopride BPND dari semua 7 minipig yang dicitrakan pada awal dan setelah 12 hari akses sukrosa ditunjukkan di baris bawah. Perhatikan bahwa skala warna eksponensial untuk menyorot [11C] raclopride BPND di daerah ekstrastriatal.
Paparan sukrosa awal
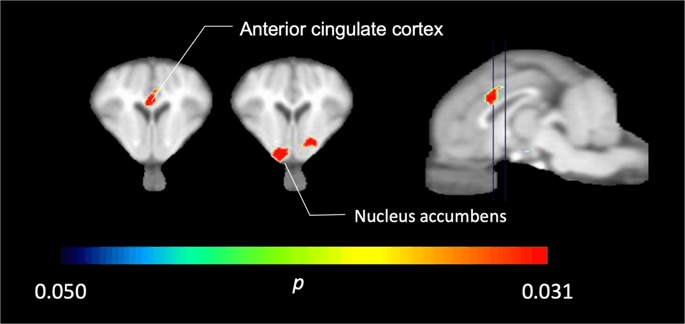
Dalam lima minipig dicitrakan dengan [11C] carfentanil pada awal dan segera setelah paparan sukrosa pertama, kami menemukan ikatan pelacak berkurang secara signifikan di korteks cingulate anterior dan nukleus accumbens dalam menanggapi sukrosa, ditunjukkan dalam warna pada Gambar. 2, menunjukkan p <0.05. Kami mendeteksi sebanyak 14% penurunan tracer binding di kedua area dibandingkan dengan baseline.
Penurunan signifikan dalam [11C] carfentanil BPND setelah paparan air sukrosa pertama dibandingkan dengan baseline (n = 5). Hanya voxel dengan signifikan (p Penurunan <0.05) ditunjukkan sebagai area berwarna yang diproyeksikan ke pemotongan T1 weighted MRI pada tingkat anterior cingulate cortex (kiri) dan nukleus accumbens (tengah) dari atlas otak minipig stereotaxic. Perhatikan bahwa tingkat signifikansi maksimum yang dapat dicapai dengan 5 hewan adalah 2-5 ≈ 0.031 (lihat bilah warna). Data disajikan pada bagian koronal otak babi pada level yang ditunjukkan pada gambar sagital (kanan).
12 hari akses sukrosa
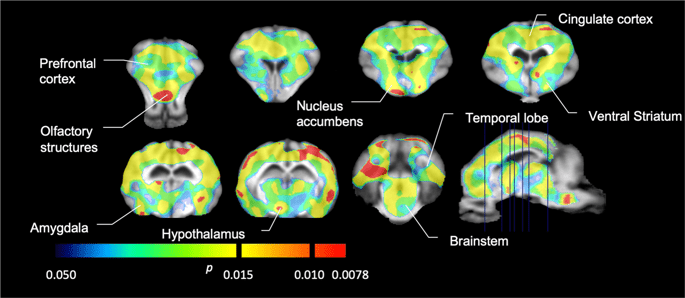
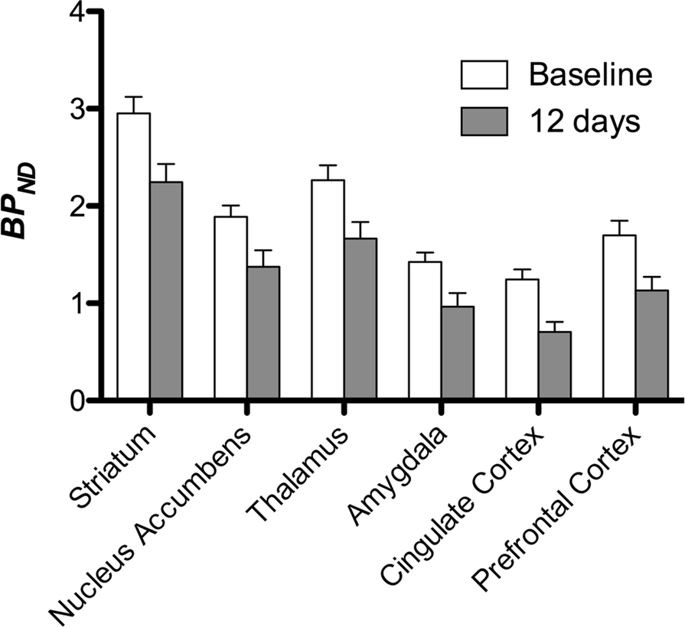
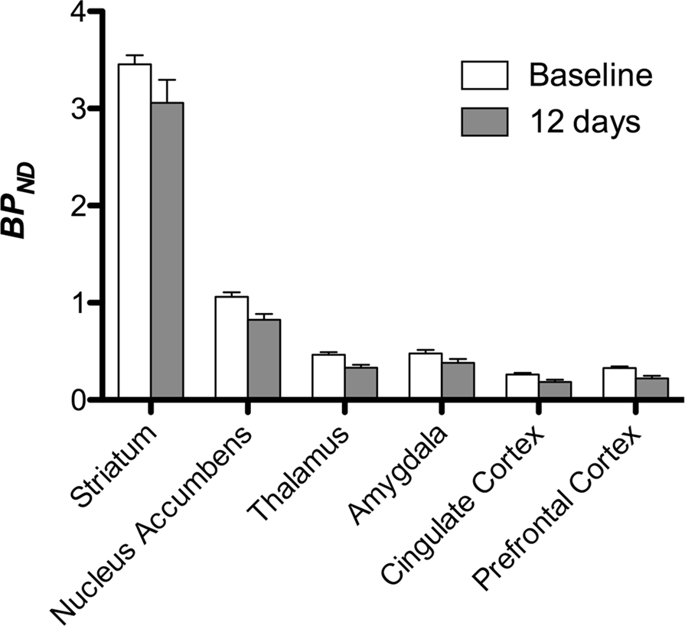
Kami kemudian melakukan analisis tujuh minipig yang dicitrakan dengan [11C] carfentanil pada awal dan setelah 12 hari akses sukrosa dan menemukan ikatan pelacak berkurang secara signifikan pada hewan yang terpapar sukrosa dibandingkan dengan awal. Daerah yang paling terpengaruh secara signifikan ditunjukkan dengan warna merah pada Gambar. 3 (p <0.01) dan termasuk bagian dari struktur penciuman, nukleus accumbens / ventral striatum dan korteks / lobus temporal, diikuti oleh area yang ditunjukkan dengan warna kuning (p <0.015) yang meliputi bagian dari korteks prefrontal, korteks cingulate, amigdala dan batang otak . Untuk mendapatkan BPND nilai dan menilai perubahan persen, kami melakukan analisis regional dan memperoleh nilai rata-rata di setiap daerah pada awal dan setelah konsumsi sukrosa (Gbr. 4).
Penurunan signifikan dalam [11C] potensi pengikatan carfentanil (BPND) antara baseline dan setelah 12 hari paparan air sukrosa (n = 7). The voxels dengan signifikan (p <0.05) penurunan ditampilkan sebagai area berwarna yang diproyeksikan ke pemotongan T1 tertimbang MRI dari atlas otak minipig stereotaxic. Data disajikan pada bagian otak koronal pada tingkat yang ditunjukkan pada gambar sagital (kanan bawah). Perhatikan bahwa tingkat signifikansi maksimum yang dapat dicapai dengan 7 hewan adalah 2-7 ≈ 0.0078 (lihat bilah warna).
Kami menggunakan [11C] raclopride sebagai pelacak reseptor DA D2 / 3 di daerah otak striatal dan ekstrastriatal pada minipig pada awal dan setelah 12 hari akses sukrosa (Gbr. 1). Kami menemukan penurunan ikatan pelacak pada hewan yang terpapar sukrosa, dibandingkan dengan baseline dengan efek terbesar (p <0.01) di area korteks prefrontal, nukleus accumbens / ventral striatum, korteks cingulate, amigdala, thalamus, mesencephalon, regio hipokampus, dan area olfaktorius. (Ara. 5). Data dari analisis regional disajikan pada Gambar. 6.
Penurunan signifikan dalam [11C] potensi pengikatan raclopride (BPND) antara baseline dan setelah 12 hari paparan air sukrosa (n = 7). The voxels dengan signifikan (p <0.05) penurunan ditampilkan sebagai area berwarna yang diproyeksikan ke pemotongan T1 tertimbang MRI dari atlas otak minipig stereotaxic. Data disajikan pada bagian koronal otak babi pada tingkat yang ditunjukkan pada gambar sagital (kanan bawah). Perhatikan bahwa tingkat signifikansi maksimum yang dapat dicapai dengan 7 hewan adalah 2-7 ≈ 0.0078 (lihat bilah warna).
Korelasi antara [11C] raclopride dan [11C] data carfentanil
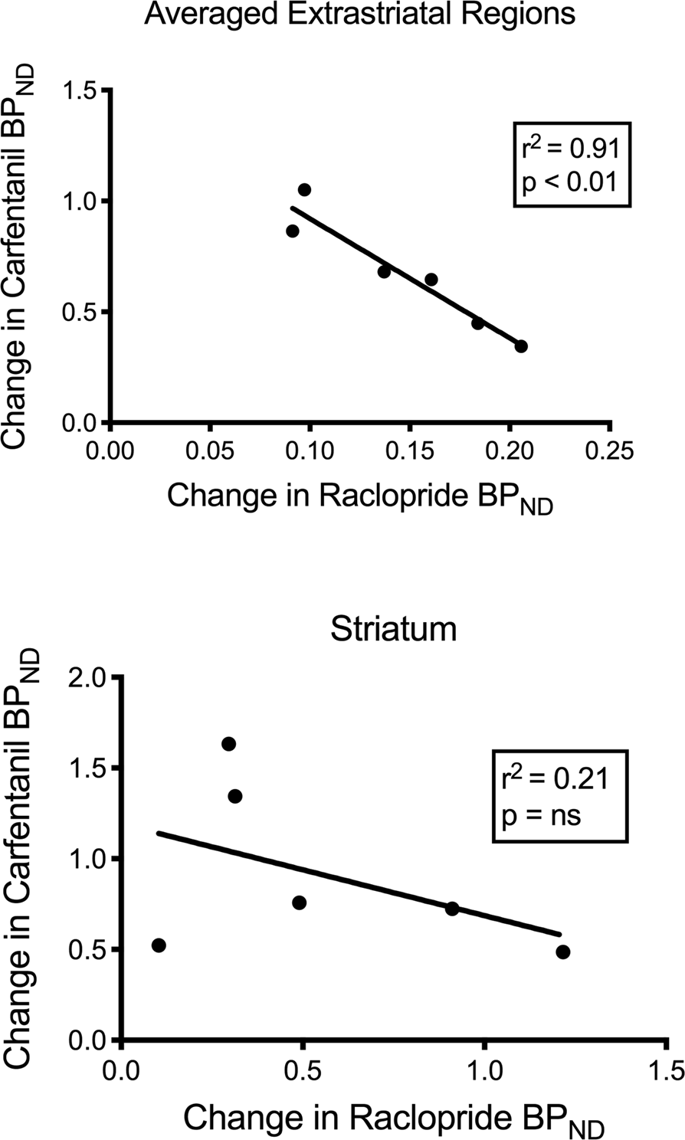
Kami menguji potensi korelasi antara [11C] raclopride dan [11C] nilai carfentanil dari BPND di daerah striatal dan non-striatal di minipig pada awal dan setelah 12 hari asupan sukrosa, tanpa asosiasi yang diamati. Kami kemudian menguji apakah penurunan pengikatan pelacak berkorelasi, dan kami membandingkan perubahan BPND untuk [11C] raclopride dengan perubahan BPND untuk [11C] carfentanil hanya pada minipig yang memiliki BP lebih rendahND dari kedua pelacak setelah asupan sukrosa (n = 6). Kami menemukan korelasi negatif yang signifikan dalam rata-rata extrastriatal (r2 = 0.91, p <0.01), tetapi tidak di daerah striatal (Gbr. 7).
Korelasi antara pra-minus pasca-penurunan [11C] raclopride dan [11C] potensi pengikatan carfentanil (BPND) pada minipig dengan penurunan tracer binding setelah asupan sukrosa (n = 6). Data dari rata-rata wilayah ekstrastriatal (atas) dan striatum (bawah) disajikan. Koefisien determinasi (r2) dan nilai p ditunjukkan untuk setiap grafik.
Diskusi
Kami menentukan efek dari akses intermiten berulang ke sukrosa pada opioid dan DA neurotransmisi di otak mamalia. Membujur in vivo Pencitraan PET dari reseptor μOR dan DA D2 / 3 mengungkapkan berkurangnya ketersediaan reseptor di seluruh rangkaian hadiah, termasuk nucleus accumbens, prefrontal cortex, dan anterior cingulate cortex. Hasilnya jelas menunjukkan bahwa sukrosa mempengaruhi mekanisme imbalan dengan cara yang mirip dengan penyalahgunaan narkoba.
Asupan sukrosa sebagai zat yang enak diketahui untuk melepaskan DA dan menyebabkan ketergantungan pada tikus15, dengan sukrosa terbukti lebih menyenangkan daripada kokain pada tikus dalam konteks tertentu. Dengan demikian, tikus bekerja lebih intens untuk mendapatkan sukrosa daripada kokain, bahkan tanpa adanya kekurangan makanan5. Namun, efek sukrosa diatur baik oleh sistem homeostatis maupun oleh sirkuit hadiah hedonis16,17 yang dapat memediasi perbedaan antara aspek gizi dan hedonis dari tindakan sukrosa18. Kami memilih jadwal satu jam per hari untuk mempromosikan "binging", karena penelitian sebelumnya pada tikus telah mengungkapkan asupan yang lebih tinggi selama jam pertama akses harian dalam jadwal yang terputus-putus.15,19. Studi perilaku asupan makanan sering menargetkan hewan yang dibatasi makanan, tetapi desain mungkin tidak mencerminkan mekanisme saraf yang sama yang aktif dalam obesitas. Babi dalam penelitian ini tidak dibatasi makanan dan diberi makan dalam jumlah biasa dari makanan normal mereka selain akses ke sukrosa.
Reseptor opioid (OR) secara luas diekspresikan di otak, khususnya pada struktur yang diketahui memodulasi proses makan dan hadiah20. OR telah terbukti penting dalam efek bermanfaat dan kambuh dari kokain21,22,23,24. Perubahan dalam ikatan juga dikaitkan dengan respons homeostatis terhadap makan dan kesenangan yang terkait dengan makanan yang enak25. Secara khusus, "menyukai" makanan terkait dengan sistem opioid endogen, terutama μOR9,10 di kulit nukleus accumbens dan ventral pallidum26. Infus agonis μOR ke bagian-bagian berbeda dari nucleus accumbens dan ventral pallidum sangat meningkatkan perilaku "menyukai", termasuk tonjolan lidah dan menjilati cakar, mengikuti peningkatan asupan makanan yang enak27,28,29. Bukti lebih lanjut untuk pensinyalan opioid dalam pemrosesan regulasi hedonis berasal dari μOR antagonis yang menipiskan konsumsi chow enak di kedua ad libitummakanan terbatas dan makanan terbatas, tetapi dengan efek yang lebih terbatas pada asupan pelet standar yang tidak enak30,31. Pada manusia, antagonis μOR mengurangi asupan makanan jangka pendek dan mengurangi kenikmatan makanan yang enak32,33,34. Pensinyalan opioid dalam amigdala basolateral juga berkontribusi pada “keinginan” makanan melalui modulasi pencarian imbalan dan nilai insentif makanan35.
Dengan [11C] carfentanil, kami memperoleh gambar pengikatan pelacak yang sensitif baik pada level μOR dan pelepasan opioid endogen otak.36,37. Kami mendeteksi kehilangan segera ketersediaan μOR di area nukleus accumbens dan anterior cingulate cortex, wilayah otak spesifik dari jalur hadiah, setelah konsumsi awal sukrosa oleh lima minipig, konsisten dengan pelepasan opioid endogen. Studi sebelumnya telah menunjukkan bahwa makanan yang enak dapat menyebabkan perasaan senang38 dengan merangsang pelepasan opioid. Setelah 12 hari akses sukrosa, kami mengamati penurunan [11C] carfentanil binding, yang memiliki beberapa kemungkinan penjelasan39 termasuk pelepasan opioid endogen dan pengikatan μOR, μOR internalisasi sebagai akibat dari peningkatan pengikatan opioid, dan peningkatan aktivasi reseptor DA D2 / 3 yang mengarah pada desensitisasi heterogen heterogen μOR40.
Untuk mendukung temuan ini, [11C] carfentanil mempelajari pasien dengan bulimia41, obesitas42,43,44, dan gangguan pesta-makan45, menunjukkan penurunan ketersediaan reseptor. Namun, ini adalah kondisi kronis sedangkan minipig hanya menerima sukrosa selama 12 hari. Dalam sebuah studi tentang perilaku makan akut pada pria sehat, pemberian makan menyebabkan pelepasan opioid serebral endogen yang kuat dan luas, baik di hadapan maupun tidak ada hedonia, menunjukkan bahwa pelepasan opioid mencerminkan respons metabolik dan homeostatis, serta hedonis.25. Penelitian ini, bersama dengan penelitian lain yang mencitrakan pasien setelah makan cairan rasa coklat44, secara langsung relevan dengan studi akut lima minipig setelah paparan sukrosa pertama, tetapi berbeda dari studi paparan sukrosa subkronik selama 12 hari di mana ketersediaan reseptor berkurang lebih cenderung mencerminkan pengulangan stimulasi berlebih dan downregulasi μOR berulang.
Korteks prafrontal penting dalam pengambilan keputusan dan menganggap nilai item dan oleh karena itu μOR dalam korteks prafrontal mungkin bertanggung jawab atas perubahan evaluasi arti-penting makanan, yang dapat meningkatkan potensi kecanduan makanan. Kami telah menemukan penurunan pengikatan pada korteks prefrontal, konsisten dengan penelitian sebelumnya yang menunjukkan bahwa diet tinggi lemak mengurangi kadar μOR mRNA dalam korteks prefrontal.46 dan infus agonis μOR dalam korteks prefrontal meningkatkan asupan makanan manis47. Namun, sekali lagi, muncul masalah apakah diet tinggi lemak adalah kondisi yang lebih kronis yang lebih memediasi regulasi reseptor, dibandingkan dengan desain pemberian makan sukrosa jangka pendek, menunjukkan pelepasan berkelanjutan opioid endogen yang menggantikan pelacak carfentanil yang terikat dengan μOR , bahkan setelah 12 hari sukrosa.
DA telah terlibat dalam penghargaan baik dari obat-obatan dan perilaku. Penggunaan kokain kronis telah ditemukan untuk menghambat pensinyalan DA48. Tingkat reseptor DA D1 dan D2 / 3 diubah oleh nikotin dalam otak babi49, dan pada primata non-manusia dengan riwayat penyalahgunaan kokain50, konsisten dengan downregulation reseptor D2 / 3 dalam otak pecandu kokain manusia51,52. Adapun obat-obatan pelecehan, sukrosa telah terbukti mengatur reseptor DA D119 dan meningkatkan rilis DA53, memperkuat peran DA dalam "keinginan" dalam kaitannya dengan makanan yang enak. Studi PET sebelumnya telah menunjukkan penurunan ketersediaan reseptor DA D2 / 3 striatal pada obesitas morbid vs berat rata-rata54,55, serupa besarnya dengan pengurangan pasien kecanduan narkoba56, dan pada hewan dengan model obesitas57. Dalam studi hewan pengerat, knockdown reseptor D2 / 3 di striatum mempromosikan pengembangan pencarian makanan kompulsif pada tikus dengan akses ke makanan enak57.
Pengamatan kami terhadap penurunan ketersediaan reseptor D2 / 3 babi dapat menunjukkan peningkatan kadar DA sebagai respons terhadap arti-penting insentif yang terkait dengan asupan sukrosa sejak DA dilepaskan sebagai bagian dari keinginan obat penyalahgunaan dan kegiatan menyenangkan lainnya.52,58,59,60. Karena babi dibius selama pencitraan, dan belum menerima sukrosa dalam 24 jam, penurunan D2 / 3 BPND lebih mungkin mencerminkan pengurangan jumlah reseptor dalam menanggapi peningkatan pelepasan DA yang berkepanjangan pada masing-masing 12 hari akses sukrosa. Pengurangan ini dapat meningkatkan ambang batas imbalan otak, terkait dengan regulasi reseptor DA D2 striatal. Ini mungkin menjelaskan peningkatan kerentanan terhadap obat-obatan pelecehan yang terlihat dalam penelitian sebelumnya tentang sukrosa yang makan berlebihan pada tikus yang menyebabkan sensitisasi silang pada kokain, hiperaktif setelah amfetamin dosis rendah, peningkatan asupan alkohol ketika tidak mengonsumsi sukrosa, dan toleransi terhadap efek analgesik opiat.6.
Sebuah penelitian sebelumnya tentang obesitas dalam minipig Göttingen mengidentifikasi penurunan aliran darah otak pada nucleus accumbens, area ventral tegmental (VTA) dan korteks prefrontal, dengan foton tunggal yang dihitung dengan computed tomography (SPECT) otak61. Konsisten dengan temuan ini, kami mengamati berkurangnya ikatan DA D2 / 3 di daerah ventroforebrain yang mengandung nukleus accumbens dan di prefrontal cortex. Kadar DA ekstraseluler meningkat 3 kali lipat dalam nukleus accumbens setelah asupan sukrosa pada tikus yang bergerak bebas yang menjalani mikrodialisis62. Pada hewan yang bergantung pada sukrosa, asupan sukrosa berulang dapat menyebabkan pelepasan DA dari cangkang nukleus accumbens63. Hewan yang diberi makan makanan terbatas dengan akses terbatas ke sukrosa memiliki ikatan reseptor DA D2 yang lebih rendah dalam nukleus accumbens shell dan striatum punggung.64. Diet tinggi lemak dan sukrosa yang dibatasi dapat menyebabkan penurunan regulasi berkelanjutan dari mRNA reseptor D1 dan D2 dalam nucleus accumbens65. Sebuah studi mikrodialisis tentang efek makanan yang enak mengungkapkan peningkatan pelepasan DA pada nucleus accumbens dan prefrontal cortex ketika makanan itu masih dianggap baru; begitu tikus terbiasa dengan makanan baru, peningkatan pelepasan tumpul pada nukleus accumbens, tetapi tidak pada korteks prefrontal66. Kerentanan diferensial terhadap habituasi dan pengkondisian aktivitas di dua wilayah dapat menjelaskan peningkatan yang lebih besar yang diamati pada korteks prefrontal dibandingkan pada nucleus accumbens dari minipig yang terpapar pada bahan yang sama enaknya yang hilang karena kebaruan setelah XNUMX hari. Namun, karena kami tidak gambar minipig dengan [11C] raclopride setelah pemberian sukrosa pertama, penjelasan ini bersifat spekulatif.
Korteks prefrontal memodulasi fungsi eksekutif, pengambilan keputusan, dan kontrol diri67. Neurotransmisi DA yang disfungsional dalam korteks prefrontal merusak modulasi pemrosesan hadiah, menunjukkan gangguan fungsi eksekutif dan keterampilan pengambilan keputusan pada individu yang obesitas68,69. Selain itu, penelitian PET pada manusia berkorelasi dengan penurunan metabolisme korteks frontal dengan penurunan striatal D2 yang mengikat pada obesitas70. Di sini, kami menemukan berkurangnya ketersediaan reseptor D2 / 3 di korteks prefrontal termasuk korteks orbitofrontal babi yang terpapar rejimen sukrosa.
Neuron dopaminergik dari VTA mengirim proyeksi ke hippocampus dan amygdala, di mana mereka mendukung perilaku seperti kebiasaan71 dan memediasi pengkodean dan pengambilan pengkondisian obat72,73 dan isyarat makanan74,75. Pencitraan otak manusia telah menunjukkan aktivasi hippocampal sebagai respons terhadap keinginan dan rasa makanan76. Konsisten dengan temuan kami tentang berkurangnya ketersediaan reseptor hippocampal dan amygdalar D2 / 3 sebagai respons terhadap sukrosa, pemetaan otak manusia dengan [18F] fallypride menunjukkan pelepasan DA yang diinduksi isyarat kokain di amigdala dan hippocampus77. Pada otak tikus, paparan isyarat kokain memicu pelepasan DA di amigdala78, dan perubahan tingkat amigdala DA mempengaruhi perilaku mencari kokain yang diinduksi oleh isyarat79.
Dalam sebuah penelitian terhadap individu yang mengalami obesitas, hubungan antara ketersediaan D2 / 3 dan μOR, diketahui ada di daerah striatal pada individu kurus, terganggu di ventral striatum.80. Kami membandingkan nilai-nilai BPND dari dua pelacak untuk menguji apakah data mereproduksi efek ini. Tidak seperti manusia tanpa lemak, otak babi saat ini tidak memiliki korelasi antara nilai BPND dari dua pelacak, pada awal atau setelah paparan sukrosa. Kami kemudian menguji apakah hewan dengan penurunan terbesar dari pengikatan tracer raclopride juga akan memiliki penurunan pengikatan tracer carfentanil terbesar, tetapi sebaliknya kami menemukan korelasi negatif di wilayah extrastriatal rata-rata, yang menunjukkan bahwa hewan dengan perubahan terbesar dari potensi pengikatan tracer raclopride memiliki perubahan terendah dari potensi ikatan tracer carfentanil. Hubungan terbalik antara perubahan menunjukkan bahwa efek asupan sukrosa pada ketersediaan masing-masing reseptor diatur dalam arah yang berlawanan. Diketahui bahwa konsumsi berlebihan makanan enak, atau obat-obatan, dapat didorong oleh keinginan atau kesukaan, atau keduanya60,81. Ada kemungkinan bahwa besarnya keinginan yang didorong oleh dopamin meniadakan besarnya rasa menyukai yang didorong oleh opioid, atau sebaliknya. Bukti terbaru menunjukkan peran GABAA reseptor di VTA dan terminal kolinergik di striatum dan mungkin korteks yang bertindak sebagai sakelar antara mekanisme aksi opioid yang bergantung dopamin dan independen dopamin.82,83 yang dapat menjelaskan hubungan timbal balik dopamin dan efek opioid di daerah ekstrastriatal babi yang ditentukan di sini.
Kekurangan PET, juga pada hewan yang relatif besar, adalah resolusi spasial terbatas dari tomografi yang mempengaruhi hasil dari daerah otak kecil yang terlibat dalam perilaku yang berhubungan dengan makanan. Namun, terlepas dari kekhawatiran ini, [11C] pengikatan raclopride sebelumnya dicatat baik di daerah striatal dan ekstrastriatal84,85,86,87. Penggunaan [11C] raclopride untuk melabeli jenis reseptor yang sama tidak menimbulkan kekhawatiran tentang perbedaan afinitas potensial yang dapat mempengaruhi penggunaan pelacak terpisah untuk reseptor yang sama di wilayah yang berbeda. Studi terbaru termasuk catatan dari pengikatan ekstrastriatal [11C] raclopride. Alakurtti et al. menemukan reproduksibilitas yang baik dari ukuran pengikatan raclopride striatal di striatum, dengan hanya reproduktifitas yang baik sampai sedang di korteks85. Dalam penelitian selanjutnya, Svensson et al. membahas beberapa masalah yang mempengaruhi penggunaan [11C] raclopride sebagai penanda reseptor D2 / 3 ekstrastriatal dalam penelitian terhadap manusia sehat, termasuk reproduktifitas yang buruk di korteks dan penurunan terbatas pengikatan ekstrastriatal di korteks frontal sebagai respons terhadap agen penghambat D2 / 388. Perbandingan tes-retest mengungkapkan variabilitas 4-7% di striatum dan 13-59% di daerah kortikal, tetapi waktu antara pemeriksaan rata-rata 20 hari, tidak seperti yang lebih informatif 1-2 hari dari sebagian besar studi. Sejumlah faktor dalam kehidupan subjek-subjek itu mungkin memiliki waktu untuk memengaruhi temuan. Memang, kami menunjukkan di sini bahwa hanya menambahkan konsumsi sukrosa ke rutinitas pagi selama 12 hari mungkin telah memengaruhi tindakan mengikat yang diperoleh dua minggu kemudian. Faktor-faktor lain yang umum seperti bermain video game, berbelanja, memasuki hubungan romantis baru dan aktivitas seksual, menggunakan obat-obatan atau mengubah diet dan olahraga dapat memengaruhi tingkat dopamin ekstrastriatal dengan potensi untuk variasi data yang sangat besar. Penelitian saat ini pada minipig memperkenalkan pengaturan yang terkontrol dengan baik dengan satu-satunya variabel adalah tidak adanya atau adanya sukrosa dalam makanan. Dalam konteks ini, data dari tujuh hewan memiliki variabilitas yang cukup rendah di daerah ekstrastriatal yang relevan untuk mengidentifikasi pengurangan pengikatan yang signifikan secara statistik dalam menanggapi sukrosa.
Keterbatasan penelitian saat ini adalah penggunaan anestesi yang diperlukan untuk memastikan imobilitas selama in vivo pencitraan hewan. Efek anestesi spesifik, dan interaksinya dengan obat atau intervensi lain, dapat mengacaukan ikatan radioligand89,90. Ketamine adalah obat anti-glutamatergic dengan efek antidepresan yang cepat dalam dosis sub-anestesi91,92,93, itu tidak mengurangi striatal [11C] pengikatan raclopride pada manusia94. Namun, S-ketamin ditemukan untuk mengurangi ketersediaan ikatan reseptor dopamin D2 / 3 dalam striatum dari primata non-manusia sadar95. Isoflurane adalah anestesi umum pada hewan PET. Dalam penelitian sebelumnya, kami menemukan akumulasi striatal dari [11C] SCH23390, radioligand dari reseptor dopamin D1 secara signifikan lebih tinggi pada minipig yang dianestesi dengan isofluran daripada propofol, menunjukkan kerentanan transmisi neuron dopaminergik terhadap efek anestesi96. Dalam studi saat ini, semua minipig dicitrakan pada kedua titik waktu di bawah ketamin pra-pengobatan dan anestesi isoflurane, membuat perbandingan ini valid.
Kesimpulan
Konsumsi makanan enak yang berlebihan dapat menyebabkan, dan menjadi akibat dari, kecanduan dengan konsekuensi langsung terhadap kesehatan oleh obesitas. Kami menguji klaim bahwa opioid dan dopamin memediasi hadiah, penting untuk kelangsungan hidup serta penyalahgunaan obat-obatan. Minipig dengan akses intermiten ke larutan sukrosa pada 12 hari berturut-turut menunjukkan penurunan dopamin D2 / 3 dan ketersediaan reseptor opioid di daerah otak striatal dan ekstrastriatal, menyiratkan bahwa makanan yang kaya sukrosa mempengaruhi sirkuit hadiah otak dengan cara yang mirip dengan yang diamati ketika obat adiktif dikonsumsi. Paparan tunggal tunggal terhadap sukrosa konsisten dengan pelepasan opioid di daerah otak yang aktif sebagai hadiah. Perubahan ketersediaan opioid dan dopamin menjelaskan potensi kecanduan sukrosa yang dikonsumsi secara berlebihan.
Bahan dan Metode
Etika hewan
Studi ini disetujui dan diatur oleh Inspektorat Eksperimen Hewan Denmark dan semua percobaan dilakukan sesuai dengan arahan Parlemen Eropa 2010/63 / EU dan Dewan Perlindungan Hewan yang Digunakan untuk Tujuan Ilmiah dan pedoman ARRIVE. Kami menggunakan tujuh minipig Göttingen betina berumur empat belas bulan (Ellegaard, Dalmose, Denmark). Minipig diberi makan diet pelet (6 dL, 2 kali sehari, Layanan Diet Khusus, Aarhus, Denmark) dengan keran air yang tersedia ad libitum. Suhu lingkungan adalah 20-22 ° C, kelembaban relatif 50–55%, dan udara berubah delapan kali setiap jam.
Konsumsi sukrosa berselang
Kami mencitrakan tujuh minipig dengan [11C] raclopride dan [11C] carfentanil pada awal, dan sekali lagi satu hari setelah 12 hari berturut-turut paparan air sukrosa. Paparan sukrosa terdiri dari satu jam akses air sukrosa (sukrosa, Dansukker, Kopenhagen, Denmark) (500 gram sukrosa dalam 2 liter air), setiap hari selama periode 12 hari. Jumlah asupan sukrosa dicatat dan semua minipig mengkonsumsi 2 liter setiap hari. Kami juga mencitrakan lima minipig yang sama dengan [11C] carfentanil, 30 menit setelah akses sukrosa pertama, untuk mempelajari pelepasan opioid akut.
Minipigs memperoleh rata-rata 13.6% berat badan dari 25.4 kg (± 0.73 SEM) pada awal menjadi 28.9 kg (± 0.69 SEM) setelah paparan sukrosa 12 hari, yang secara signifikan lebih tinggi (uji-t satu sisi, p < 0.001) dari peningkatan yang diamati dalam sampel minipig kontrol yang diperoleh dalam penelitian sebelumnya, di mana bobot meningkat rata-rata hanya 4.9%, selama periode perkembangan yang sama.
Pencitraan PET Otak
Kami berpuasa semalaman babi dengan akses gratis ke air sebelum pencitraan. Kami melakukan pra-medikasi dan anestesi seperti yang dijelaskan sebelumnya97 dan menempatkan mereka terlentang dalam perangkat PET / CT (Siemens Biograph 64 Truepoint PET). Kami melakukan pemindaian CT dosis rendah sebelum setiap akuisisi PET untuk definisi anatomi dan koreksi atenuasi data emisi PET. Kami secara intravena memberikan [11C] raclopride pada awal (360 ± 18 MBq, aktivitas spesifik 77 ± 76 GBq / μmol, massa yang disuntikkan 0.12 ± 0.08 μg / kg) dan setelah 12 hari sukrosa (374 ± 54 MBq, aktivitas spesifik 127 ± 85 GBq / μmol, massa yang disuntikkan 0.06 ± 0.05 μg / kg), dan [11C] carfentanil pada awal (377 ± 43 MBq, aktivitas spesifik 311 ± 195 GBq / μmol, massa yang disuntikkan 0.03 ± 0.02 μg / kg) dan setelah 12 hari sukrosa (337 ± 71 MBq, aktivitas spesifik 177 ± 157 GBq / μmol, massa yang disuntikkan 0.06 ± 0.08 μg / kg) melalui vena telinga, dalam saline 10 mL, selama menit pertama scan 90 menit. Kami merekonstruksi data PET menggunakan TrueX 3D OSEM (3 iterasi, 21 himpunan bagian), matriks 256 × 256 × 109, dan filter Gauss 2 mm, menggunakan struktur kerangka waktu 5 × 60, 3 × 300, 4 × 600 , 2 × 900 detik (total 14 bingkai, 90 menit). Pada awal dan setelah 12 hari sukrosa, minipig dicitrakan dengan kedua pelacak yang disuntikkan setidaknya 100 menit, karena waktu paruh dari [11C] pelacak PET. Setelah menyelesaikan sesi PET terakhir, kami menidurkan minipig di bawah anestesi mendalam dengan overdosis pentobarbital (100 mg / kg) secara intravena.
Analisis dan statistik kuantitatif
Kami melakukan langkah-langkah preproses menggunakan PMOD 3.7 (PMOD Technologies Ltd, Zurich, Swiss). Untuk menentukan parameter transformasi stereotactic dari gambar PET rata-rata waktu, kami menggunakan templat khusus ligan. Kami menerapkan matriks transformasi yang dihasilkan dan bidang bengkok ke dalam seri waktu PET dinamis yang sesuai. Kami menghasilkan gambar parametrik [11C] potensi pengikatan raclopride (BPND) dengan menggunakan metode jaringan referensi multilinear dari Ichise dan rekan kerja98. Kami menciptakan topeng cerebellum yang dibuat khusus yang mengecualikan vermis untuk mendapatkan radioaktivitas jaringan serebelar dari waktu ke waktu di daerah kepadatan reseptor DA D2 / 3 yang dapat diabaikan. Kami menghasilkan gambar parametrik [11C] carfentanil menggunakan implementasi model jaringan referensi Logan99,100 dengan t * = 30 mnt. Studi tentang [11C] carfentanil yang mengikat dalam otak manusia telah menggunakan korteks oksipital sebagai wilayah referensi36; Namun, pada babi, menurut kurva aktivitas waktu, ikatan yang tidak dapat dipindahkan lebih rendah di otak kecil daripada di korteks oksipital, konsisten dengan temuan dari studi autoradiografi tikus.101. Karena itu kami memilih otak kecil sebagai wilayah referensi dalam penelitian ini.
Analisis statistik
Kami melakukan peta analisis yang bijaksana dengan Pemetaan Statistik Non-Parametrik (SnPM v13.01, http://warwick.ac.uk/snpm) SPM toolbox yang menggunakan teori permutasi non-parametrik untuk menyediakan kerangka kerja untuk inferensi statistik, sebuah pendekatan yang terbukti bekerja dengan baik untuk sampel kecil karena kontrol ketat terhadap positif palsu14 dan diterapkan seperti yang dijelaskan sebelumnya102. Seorang ahli dalam babi neuroanatomi (DO) membandingkan gambar yang dihasilkan di ambang batas hingga tingkat signifikansi 5% ke atlas Göttingen minipig resolusi tinggi103,104 untuk menentukan dan memberi label wilayah penurunan DA D2 / 3 dan μOR BPND dari baseline ke kondisi pasca-sukrosa. Kami kemudian melakukan analisis wilayah kepentingan (ROI) untuk mengekstraksi BPND nilai-nilai daerah tertentu ditemukan menjadi menarik berdasarkan analisis SnPM, termasuk striatum, nucleus accumbens, thalamus, amygdala, cingulate cortex dan prefrontal cortex. Tidak ada statistik tambahan yang dilakukan pada analisis ROI, karena wilayah ini sudah ditemukan signifikan menggunakan SnPM.
Referensi
- 1.
Smyth, S. & Heron, A. Diabetes dan obesitas: epidemi kembar. Nat Med 12, 75 – 80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL & Curtin, LR Prevalensi dan tren obesitas di antara orang dewasa AS, 1999-2008. JAMA 303, 235 – 241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, CA et al. Dopamin untuk "keinginan" dan opioid untuk "suka": perbandingan orang dewasa gemuk dengan dan tanpa pesta makan. Obesitas (Silver Spring) 17, 1220 – 1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. Obesitas dan lingkungan makanan: kepadatan energi makanan dan biaya diet. Jurnal Amerika tentang pengobatan pencegahan 27, 154 – 162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. & Ahmed, SH Rasa manis yang intens melebihi hadiah kokain. PLoS satu 2, e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. & Guillem, K. In Ilmu Saraf di Abad ke-21 (ed. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Perkembangan lebih lanjut dalam neurobiologi makanan dan kecanduan: pembaruan tentang keadaan sains. makanan 28, 341 – 343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M.In Kesenangan Otak (eds Kringelbach, ML & Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ & Bullmore, ET Dari hedonik rasa hingga dorongan motivasi: reseptor mu-opioid pusat dan perilaku makan pesta. Int J Neuropsychopharmacol 12, 995 – 1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, hadiah makanan KC: substrat otak dari keinginan dan kesukaan. Ulasan Neuroscience dan biobehavioral 20, 1 – 25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Pemetaan neuroreseptor di tempat kerja: pada definisi dan interpretasi potensi pengikatan setelah 20 tahun kemajuan. Int Rev Neurobiol 63, 1 – 20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG Model hewan dari pesta gula dan lemak: hubungan dengan kecanduan makanan dan peningkatan berat badan. Metode Mol Biol 829, 351 – 365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Jesing, J. et al. Korteks prefrontal dalam otak minipig Gottingen ditentukan oleh kriteria proyeksi saraf dan arsitektur mikro. Brain Res Bull 70, 322 – 336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE & Holmes, AP Tes permutasi nonparametrik untuk pencitraan saraf fungsional: primer dengan contoh. Hum Brain Mapp 15, 1 – 25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG Bukti kecanduan gula: efek perilaku dan neurokimia dari asupan gula yang terputus-putus dan berlebihan. Ulasan Neuroscience dan biobehavioral 32, 20 – 39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Alonso-Alonso, M. et al. Sistem hadiah makanan: perspektif saat ini dan kebutuhan penelitian di masa depan. Nutr Rev 73, 296 – 307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Sukrosa swakelola dan aktivasi SSP pada tikus. Am J Physiol Regul Integr Comp Physiol 300, R876–884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA et al. Sirkuit terpisah menyandikan nilai hedonis dan nutrisi dari gula. Ilmu saraf alam 19, 465 – 470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Colantuoni, C. et al. Asupan gula berlebihan mengubah ikatan pada reseptor dopamin dan mu-opioid di otak. Neuroreport 12, 3549 – 3552 (2001).
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Reseptor opiat: lokalisasi autoradiografik di otak tikus. Proc Natl Acad Sci USA 73, 3729 – 3733 (1976).
- 21.
Soderman, AR & Unterwald, EM Hadiah kokain dan hiperaktif pada tikus: situs modulasi reseptor opioid mu. Neuroscience 154, 1506 – 1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ & Roberts, DC Beta-funaltrexamine mempengaruhi pemberian sendiri kokain pada tikus yang menanggapi jadwal penguatan rasio progresif. Farmakologi, biokimia, dan perilaku 75, 301 – 307 (2003).
- 23.
Schroeder, JA et al. Peran reseptor opioid mu dalam aktivitas yang diinduksi kokain, kepekaan, dan hadiah pada tikus. Psychopharmacology 195, 265 – 272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW Pemulihan yang diinduksi kokain membutuhkan stimulasi endogen reseptor mu-opioid di ventral pallidum. The Journal of neuroscience: jurnal resmi Society for Neuroscience 25, 4512 – 4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ et al. Memberi Makan Rilis Opioid Endogen pada Manusia. J Neurosci 37, 8284 – 8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS & Berridge, KC Opioid limbic circuit untuk hadiah: interaksi antara hotspot hedonik nukleus accumbens dan ventral pallidum. J Neurosci 27, 1594 – 1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, KC Opioid site di nucleus accumbens shell menengahi makan dan hedonis 'menyukai' makanan: peta berdasarkan mikroinjeksi bulu Fos. Otak Res 863, 71 – 86 (2000).
- 28.
Zhang, M. & Kelley, AE Asupan larutan sakarin, garam, dan etanol ditingkatkan dengan infus agonis opioid mu ke dalam nukleus accumbens. Psychopharmacology 159, 415 – 423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA & Kelley, AE Asupan makanan tinggi lemak secara selektif ditingkatkan oleh stimulasi reseptor opioid mu di dalam nucleus accumbens. Jurnal farmakologi dan terapi eksperimental 285, 908 – 914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP & Billington, CJ Nalokson memblokir porsi makan yang didorong oleh rasa manis pada tikus yang dibatasi makanan. Am J Physiol 268, R248–252 (1995).
- 31.
Glass, MJ, Billington, CJ & Levine, AS Opioid dan asupan makanan: jalur saraf fungsional terdistribusi? Neuropeptida 33, 360 – 368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. & Apfelbaum, M. Antagonis opioid, naltrexone, mengurangi preferensi sukrosa pada manusia. Am J Physiol 251, R91–96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS Pengaruh naltrexone pada deteksi rasa dan ambang pengenalan. Nafsu makan 32, 241 – 249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, BA Naloxone, penghambat opiat, mengurangi konsumsi makanan manis berlemak tinggi pada pemakan pesta wanita gemuk dan kurus. Am J Clin Nutr 61, 1206 – 1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW Sirkuit opioid yang berbeda menentukan palatabilitas dan keinginan acara yang bermanfaat. Proc Natl Acad Sci USA 106, 12512 – 12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Kolanti, A. et al. Pelepasan opioid endogen dalam sistem penghargaan otak manusia yang disebabkan oleh pemberian amfetamin akut. Psikiatri Biol 72, 371 – 377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Mick, aku et al. Amphetamine menginduksi pelepasan opioid endogen di otak manusia yang terdeteksi dengan [11C] carfentanil PET: replikasi dalam kelompok independen. Int J Neuropsychopharmacol, 1 – 6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Grey, RW Opioid peptida dan kontrol perilaku menelan manusia. Ulasan Neuroscience dan biobehavioral 26, 713 – 728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. & Tolle, TR Apa yang dipelajari in vivo pencitraan otak opioidergik? Eur J Pain 9, 117 – 121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM & Cuntapay, M. Interaksi dopamin-opioid di striatum tikus: peran modulatori untuk reseptor dopamin D1 dalam transduksi sinyal yang dimediasi reseptor opioid delta. Neurofarmakologi 39, 372 – 381 (2000).
- 41.
Bencherif, B. et al. Ikatan reseptor mu-opioid regional pada korteks insular menurun pada bulimia nervosa dan berkorelasi terbalik dengan perilaku puasa. Jurnal kedokteran nuklir: publikasi resmi, Society of Nuclear Medicine 46, 1349 – 1351 (2005).
- 42.
Karlsson, HK et al. Obesitas dikaitkan dengan penurunan ketersediaan reseptor dopamin D2 mu-opioid tetapi tidak berubah di otak. J Neurosci 35, 3959 – 3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Karlsson, HK et al. Penurunan berat badan setelah operasi bariatrik menormalkan reseptor opioid otak pada obesitas yang tidak sehat. Psikiatri Mol 21, 1057 – 1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, Mekanisme Opioid Endogen JK Diimplikasikan dalam Obesitas dan Penurunan Berat Badan pada Manusia. J Clin Endocrinol Metab 100, 3193 – 3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Majuri, J. et al. Dopamin dan Neurotransmisi Opioid dalam Kecanduan Perilaku: Studi PET Komparatif dalam Pertaruhan Patologis dan Pemakan Binge. Neuropsychopharmacology 42, 1169 – 1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM Diet tinggi lemak kronis mendorong regulasi epigenetik postnatal reseptor mu-opioid di otak. Neuropsychopharmacology: publikasi resmi American College of Neuropsychopharmacology 36, 1199 – 1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA Induksi hiperfagia dan asupan karbohidrat oleh stimulasi reseptor mu-opioid di daerah terbatas korteks frontal. The Journal of neuroscience: jurnal resmi Society for Neuroscience 31, 3249 – 3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. Kokain kronis meredam sinyal dopamin selama keracunan kokain dan ketidakseimbangan D1 melalui pensinyalan reseptor D2. The Journal of neuroscience: jurnal resmi Society for Neuroscience 33, 15827 – 15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Cumming, hal. et al. Efek nikotin akut pada hemodinamik dan pengikatan [11C] raclopride ke dopamin D2,3, XNUMX reseptor di otak babi. NeuroImage 19, 1127 – 1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP Pengaruh pemberian sendiri kokain pada reseptor dopamin D2 pada monyet rhesus. Sinaps 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND et al. Isyarat kokain dan dopamin dalam dorsal striatum: mekanisme keinginan dalam kecanduan kokain. The Journal of neuroscience: jurnal resmi Society for Neuroscience 26, 6583 – 6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Wong, DF et al. Peningkatan hunian reseptor dopamin di striatum manusia selama keinginan kokain yang timbul. Neuropsychopharmacology 31, 2716 – 2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP & Norgren, R. Stimulasi sukrosa oral meningkatkan accumbens dopamine pada tikus. Am J Physiol Regul Integr Comp Physiol 286, R31–37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. & Telang, F. Pencitraan peran dopamin dalam penyalahgunaan dan kecanduan narkoba. Neurofarmakologi 56(Sup 1), 3–8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Wang, GJ et al. Dopamin otak dan obesitas. Lanset 357, 354 – 357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS Kesamaan antara obesitas dan kecanduan obat yang dinilai oleh pencitraan neurofungsional: tinjauan konsep. Jurnal penyakit adiktif 23, 39 – 53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM & Kenny, PJ Dopamine D2 reseptor di disfungsi hadiah seperti kecanduan dan makan kompulsif pada tikus gemuk. Ilmu saraf alam 13, 635 – 641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC & Kringelbach, ML Neuroscience afektif kesenangan: penghargaan pada manusia dan hewan. Psychopharmacology 199, 457 – 480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC & Kringelbach, ML Sistem kesenangan di otak. Neuron 86, 646 – 664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. Sinyal hadiah prediktif neuron dopamin. J Neurophysiol 80, 1 – 27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH Perubahan aktivitas otak setelah obesitas yang diinduksi oleh diet. Kegemukan 19, 749 – 756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. & Norgren, R. Accumbens mekanisme dopamin dalam asupan sukrosa. Otak Res 904, 76 – 84 (2001).
- 63.
Rada, P., Avena, NM & Hoebel, BG Setiap hari makan gula secara berlebihan melepaskan dopamin dalam cangkang accumbens. Neuroscience 134, 737 – 744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR & Hajnal, A. Akses sukrosa berulang mempengaruhi kepadatan reseptor dopamin D2 di striatum. Neuroreport 13, 1575 – 1578 (2002).
- 65.
Alsi, J. et al. Ekspresi gen reseptor Dopamin D1 menurun pada nukleus accumbens pada pajanan jangka panjang pada makanan yang enak dan berbeda tergantung pada fenotip obesitas yang disebabkan oleh diet pada tikus. Neuroscience 171, 779 – 787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. & Di Chiara, G. Pengaruh diferensial mekanisme pembelajaran asosiatif dan non-asosiatif pada daya tanggap transmisi dopamin prefrontal dan akumbal terhadap rangsangan makanan pada tikus yang diberi makan ad libitum. J Neurosci 17, 851 – 861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Sirkuit saraf tidak seimbang dalam kecanduan. Curr Opin Neurobiol 23, 639 – 648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. & Pignatti, R. Anorexia, bulimia, dan obesitas: defisit pengambilan keputusan bersama pada Tugas Perjudian Iowa (IGT). J Int Neuropsychol Soc 16, 711 – 715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL Defisit pengambilan keputusan dan makan berlebihan: model risiko untuk obesitas. Obes Res 12, 929 – 935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND et al. Reseptor D2 striatal dopamin rendah dikaitkan dengan metabolisme prefrontal pada subjek obesitas: faktor yang berkontribusi. NeuroImage 42, 1537 – 1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, BW Inti pusat Amygdala berinteraksi dengan dorsolateral striatum untuk mengatur perolehan kebiasaan. J Neurosci 32, 1073 – 1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Hibah, S. et al. Aktivasi sirkuit ingatan selama hasrat kokain yang timbul. Proc Natl Acad Sci USA 93, 12040 – 12045 (1996).
- 73.
Childress, AR et al. Aktivasi limbik selama keinginan isyarat kokain diinduksi. Am J Psikiatri 156, 11 – 18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV & Berridge, KC Apa dan kapan harus "menginginkan"? Fokus berbasis amigdala pada arti-penting insentif pada gula dan seks. Psychopharmacology 221, 407 – 426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF & Volkow, ND Neurobiology of addiction: a neurocircuitry analysis. Lancet Psikiatri 3, 760 – 773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. Aktivasi kortikal sebagai respons terhadap rangsangan rasa murni selama keadaan fisiologis kelaparan dan kenyang. NeuroImage 44, 1008 – 1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Fotro, A. et al. Pelepasan dopamin yang diinduksi isyarat kokain di amigdala dan hippocampus: PET resolusi tinggi [(1) (8) F] studi fallypride pada peserta yang tergantung pada kokain. Neuropsychopharmacology 38, 1780 – 1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. et al. Kontrol perilaku mencari kokain oleh stimuli terkait obat pada tikus: efek pada pemulihan respons operan yang merespons dan tingkat dopamin ekstraseluler di amigdala dan nucleus accumbens. Proc Natl Acad Sci USA 97, 4321 – 4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Dopamin D1 atau antagonisme reseptor D2 dalam amigdala basolateral secara berbeda mengubah akuisisi asosiasi isyarat kokain yang diperlukan untuk pemulihan pencarian kokain yang diinduksi isyarat. Neuroscience 137, 699 – 706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Tuominen, L. et al. Interaksi dopamin-opiat mesolimbik yang menyimpang pada obesitas. NeuroImage 122, 80 – 86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Schultz, W. Sinyal dopamin perilaku. Tren Neurosci 30, 203 – 210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR & van der Kooy, D. Neurobiologi motivasi opiat. Cold Spring Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Nicotinic dan regulasi reseptor opioid dari transmisi dimediasi reseptor dopamin D2 striatal. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Nomura, Y. et al. Penurunan terkait ketersediaan reseptor dopamin D2 / 3 terkait usia diukur dengan raclopride [C-11] di daerah otak manusia non-striatal: Perbandingan empat metode. NeuroImage 41, T133 – T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Alkurti, K. et al. Uji-retest reliabilitas jangka panjang dari reseptor dopamin D2 / 3 striatal dan extrastriatal: studi dengan [(11) C] raclopride dan PET resolusi tinggi. J Cereb Blood Flow Metab 35, 1199 – 1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ pelepasan dopamin endogen setelah tantangan farmakologis pada penyakit Parkinson. Ann Neurol 53, 647 – 653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Sawamoto, N. et al. Defisit kognitif dan pelepasan dopamin striato-frontal pada penyakit Parkinson. Otak 131, 1294 – 1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE et al. Validitas dan reliabilitas kuantifikasi pengikat raclopride [11] C] ekstrastriatal dalam otak manusia yang hidup. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Tsukada,H. et al. Anestesi isofluran meningkatkan efek penghambatan kokain dan GBR12909 pada transporter dopamin: studi PET yang dikombinasikan dengan mikrodialisis di otak monyet. Otak Res 849, 85 – 96 (1999).
- 90.
Hasun, W. et al. Studi PET tentang ikatan [11C] raclopride pada striatum kucing yang terjaga: efek anestesi dan peran aliran darah otak. Jurnal Eropa kedokteran nuklir dan pencitraan molekuler 30, 141 – 148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. Peran ketamin dalam pengobatan-tahan depresi: tinjauan sistematis. Curr Neuropharmacol 12, 444 – 461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Berman, RM et al. Efek antidepresan ketamin pada pasien depresi. Psikiatri Biol 47, 351 – 354 (2000).
- 93.
Browne, CA & Lucki, I. Efek antidepresan ketamin: mekanisme yang mendasari antidepresan novel kerja cepat. Pharmacol depan 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Alto, S. et al. Ketamin tidak mengurangi ikatan reseptor D2 striatal dopamin pada manusia. Psychopharmacology 164, 401 – 406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. & Tsukada, H.Pengurangan ikatan reseptor dopamin D2 / 3 di striatum setelah pemberian tunggal esketamin, tetapi tidak R-ketamine: PET belajar pada monyet yang sadar. Eur Arch Klinik Psikiatri Neurosci 267, 173 – 176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Alstrup, AK et al. Efek anestesi dan spesies pada pengambilan atau pengikatan radioligand in vivo dalam minipig Gottingen. Riset BioMed internasional 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP et al. Pencitraan PET monoaminergik longitudinal dari penghambatan proteasome kronis pada minipig. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE Strategi untuk meningkatkan estimasi parameter neuroreseptor dengan analisis regresi linier. J Cereb Blood Flow Metab 22, 1271 – 1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Logan, J. et al. Rasio volume distribusi tanpa pengambilan sampel darah dari analisis grafis data PET. J Cereb Blood Flow Metab 16, 834 – 840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Kuantifikasi reseptor mu-opioid otak dengan [11C] carfentanil: metode referensi-jaringan. Nucl Med Biol 30, 177 – 186 (2003).
- 101.
Panksepp, J. & Bishop, P. Peta autoradiografik (3H) ikatan diprenorfin di otak tikus: efek interaksi sosial. Brain Res Bull 7, 405 – 410 (1981).
- 102.
Landau, AM et al. Stimulasi electroconvulsive secara berbeda mempengaruhi [(11) C] MDL100,907, 5 mengikat reseptor 2HTXNUMXA kortikal dan subkortikal di otak babi. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. Telencephalon dari Minipig Gottingen, cytoarchitecture dan anatomi permukaan kortikal. Fungsi Struktur Otak 222, 2093 – 2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR Online histologis atlas otak minipig Gottingen. Heliyon 5, e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Ucapan Terima Kasih
Universitas Aarhus "Hibah Pengembangan Proyek Ide AU" untuk AML mendanai penelitian ini. Kami berterima kasih atas dukungan teknis dari staf di PET Centre Rumah Sakit Universitas Aarhus dan Pertanian Universitas Aarhus untuk bantuan dalam perawatan hewan. Kami berterima kasih kepada Profesor Morten Kringelbach, Profesor Jørgen Scheel-Kruger dan Profesor Rekanan Arne Møller untuk bantuan dengan inisiasi studi ini.
Deklarasi etika
Bersaing kepentingan
Para penulis menyatakan tidak ada kepentingan yang bersaing.
Informasi tambahan
Catatan penerbit Springer Nature tetap netral sehubungan dengan klaim yurisdiksi dalam peta yang diterbitkan dan afiliasi institusional.
Hak dan izin
Buka Akses Artikel ini dilisensikan di bawah Lisensi Internasional Creative Commons Attribution 4.0, yang memungkinkan penggunaan, berbagi, adaptasi, distribusi, dan reproduksi dalam media atau format apa pun, selama Anda memberikan kredit yang sesuai kepada penulis asli dan sumbernya, menyediakan tautan ke lisensi Creative Commons, dan tunjukkan jika ada perubahan. Gambar atau materi pihak ketiga lainnya dalam artikel ini termasuk dalam lisensi Creative Commons artikel, kecuali dinyatakan sebaliknya dalam batas kredit materi. Jika materi tidak termasuk dalam lisensi Creative Commons artikel dan penggunaan yang Anda maksudkan tidak diizinkan oleh peraturan perundang-undangan atau melebihi penggunaan yang diizinkan, Anda perlu mendapatkan izin langsung dari pemegang hak cipta. Untuk melihat salinan lisensi ini, kunjungi http://creativecommons.org/licenses/by/4.0/.