ธรรมชาติ (2019) | ดาวน์โหลดเอกสารอ้างอิง
นามธรรม
การฉายภาพโดปามีนจากบริเวณหน้าท้อง (VTA) ไปยังนิวเคลียส accumbens (NAc) มีความสำคัญอย่างยิ่งต่อแรงจูงใจในการทำงานเพื่อผลตอบแทนและการเรียนรู้ที่ได้รับรางวัล โดปามีนสนับสนุนฟังก์ชันทั้งสองอย่างไรยังไม่ชัดเจน การเพิ่มขึ้นอย่างรวดเร็วของเซลล์โดปามีนสามารถเข้ารหัสข้อผิดพลาดในการทำนายซึ่งเป็นสัญญาณการเรียนรู้ที่สำคัญในทฤษฎีการคำนวณเกี่ยวกับพฤติกรรมการปรับตัว ในทางตรงกันข้ามโดปามีนจะปล่อยออกมาเพิ่มขึ้นเมื่อสัตว์เข้าใกล้รางวัลสะท้อนให้เห็นถึงความคาดหวังของรางวัล ความไม่ตรงกันนี้อาจสะท้อนถึงความแตกต่างในงานด้านพฤติกรรมการเปลี่ยนแปลงที่ช้าลงในการเพิ่มขึ้นของเซลล์โดปามีนหรือการปรับการปลดปล่อยโดปามีนที่ไม่ขึ้นกับเข็ม ที่นี่เราเปรียบเทียบการเพิ่มขึ้นของเซลล์ VTA dopamine ที่ระบุกับการปลดปล่อย NAc dopamine ในงานการตัดสินใจเดียวกัน สัญญาณที่บ่งบอกถึงรางวัลที่กำลังจะมาถึงเพิ่มขึ้นอย่างรวดเร็วและการเปิดตัว อย่างไรก็ตามการปลดปล่อยโดปามีนหลักของ NAc ยังทำงานร่วมกับความคาดหวังของรางวัลที่พัฒนาแบบไดนามิกโดยไม่มีการเปลี่ยนแปลงที่สอดคล้องกันในการเพิ่มขึ้นของเซลล์ VTA dopamine ผลลัพธ์ของเราชี้ให้เห็นถึงความแตกต่างพื้นฐานในการควบคุมการปลดปล่อยโดปามีนเพื่อให้ได้ฟังก์ชันที่แตกต่างกัน: สัญญาณกระจายการออกอากาศส่งเสริมการเรียนรู้ในขณะที่การควบคุมในพื้นที่จะกระตุ้นแรงจูงใจ
หลัก
โดปามีนเกี่ยวข้องกับ 'รางวัล' - แต่จริง ๆ แล้วเป็นอย่างไร ฟังก์ชั่นหนึ่งเกี่ยวข้องกับการเรียนรู้จากรางวัลที่ไม่คาดคิด การเพิ่มขึ้นโดยย่อในข้อผิดพลาดการทำนายการให้รางวัลการเข้ารหัสเซลล์โดปามีน (RPE)1,2,3- รับสัญญาณสำหรับการปรับพฤติกรรมที่จูงใจในอนาคต การปรับโดปามีนอาจส่งผลกระทบต่อการเรียนรู้ราวกับว่ากำลังเปลี่ยน RPEs4,5,6แต่ก็มีผลต่อพฤติกรรมที่กระตุ้นทันทีเช่นโดปามีนส่งสัญญาณความคาดหวัง (ตามตัวอักษร)5. นอกจากนี้ NAc โดปามีนยังเพิ่มขึ้นในระหว่างวิธีการกระตุ้นซึ่งสอดคล้องกับค่าการเข้ารหัสโดปามีน7,8,9,10,11.
มีข้อยกเว้นเล็กน้อย2,12,13การตรวจโดปามีนในสมองส่วนกลางได้รับการตรวจสอบระหว่างการปรับสภาพแบบดั้งเดิมในสัตว์ที่จับจ้อง3,14ซึ่งแตกต่างจากการปล่อยโดพามีน forebrain เราจึงเปรียบเทียบการเผาด้วยการปล่อยภายใต้เงื่อนไขเดียวกัน เราพบเซลล์ประสาทโดปามีน VTA โดยใช้การติดแท็ก optogenetic3,13. ในการวัดการปลดปล่อยโดปามีนของ NAc เราใช้วิธีการอิสระสามวิธี ได้แก่ การทำไมโครไดโอด, โวลแทมเมทรีและออปติคัลเซนเซอร์ dLight15- พร้อมผลลัพธ์แบบลู่เข้า ข้อสรุปเบื้องต้นของเราคือแม้ว่าการระเบิดโดปามีน VTA ที่ลดขนาดของ RPE จะทำให้เกิดการเปลี่ยนแปลงอย่างฉับพลันในการปลดปล่อยโดปามีนที่เหมาะสมสำหรับการเรียนรู้ แต่ความผันผวนของโดปามีน NAc
โดพามีนติดตามแรงจูงใจในตำแหน่งที่สำคัญ
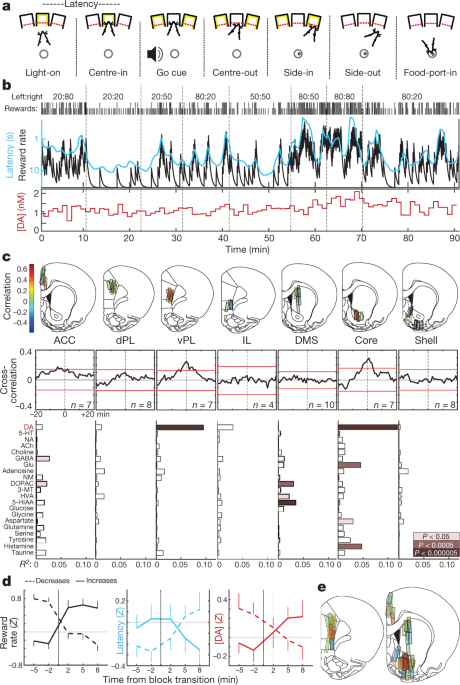
เราฝึกหนูในภารกิจ 'โจร'5 (มะเดื่อ. 1a, b). ในการทดลองแต่ละครั้งการส่องสว่างของช่องจมูก ('Light-on') จะแจ้งให้เข้าใกล้และเข้า ('Center-in') หลังจากช่วงเวลาพักตัวแปร (0.5–1.5 วินาที) เสียงสีขาว ('Go cue') ทำให้หนูถอนตัว ('Center-out') และโผล่พอร์ตที่อยู่ติดกัน ('Side-in') ในการทดลองที่ได้รับรางวัลงาน Side-in นี้มาพร้อมกับการคลิกถังอาหารที่กระตุ้นให้หนูเข้าใกล้ท่าเรืออาหาร ('Food-port-in') เพื่อรวบรวมเม็ดน้ำตาล การเลือกไปทางซ้ายและทางขวาแต่ละครั้งจะได้รับรางวัลเป็นความน่าจะเป็นอิสระซึ่งบางครั้งอาจเปลี่ยนแปลงโดยไม่มีการเตือนล่วงหน้า เมื่อหนูมีแนวโน้มที่จะได้รับรางวัลมากขึ้นพวกเขามีแรงจูงใจในการปฏิบัติงานมากขึ้น สิ่งนี้เห็นได้ชัดใน 'เวลาในการตอบสนอง' - เวลาระหว่าง Light-on และ Center-in-ซึ่งมีความอ่อนไหวต่อผลลัพธ์ของการทดลองสองสามครั้งก่อนหน้า (Extended Data Fig 1) และปรับอัตราส่วนผกผันด้วยอัตราผลตอบแทน (รูปที่. 1b).
aเหตุการณ์โจร - งาน bตัวอย่างเซสชั่น แถวบนสุดให้รางวัลความน่าจะเป็นในแต่ละบล็อก (ซ้าย: ขวา); แถวที่สองขีดบ่งบอกผลลัพธ์ของการทดลองแต่ละครั้ง (สูงได้รับรางวัลสั้นไม่ได้รับรางวัล); แถวที่สามการประเมินอัตราการรวมข้อมูลรั่ว (สีดำ) และค่าเฉลี่ยของเวลาแฝง (สีฟ้ามาตราส่วนล็อกกลับด้าน) แถวล่างโดพามีนหลัก NAc ในเซสชันเดียวกัน (ตัวอย่าง 1 นาที) DA, โดปามีน cตำแหน่งสูงสุด microdialysis ในเยื่อหุ้มสมองส่วนหน้าตรงกลางและ striatum (ดูรูปเพิ่มเติมของข้อมูล 1). n = ตำแหน่งของหัววัด 51 ตำแหน่งจากหนู 12 ตัวโดยแต่ละตัวมีการตรวจด้วยเครื่องไตเทียม 2 ตัวที่ลดระดับลงระหว่างการตรวจ สีของแท่งแสดงถึงความสัมพันธ์ระหว่างโดปามีนและอัตราการให้รางวัล ACC, เยื่อหุ้มสมองส่วนหน้า cingulate; dPL, คอร์เทกซ์ prelimbic หลัง; vPL, เยื่อหุ้มสมอง prelimbic หน้าท้อง; IL, เยื่อหุ้มสมอง infralimbic; DMS, dorsal-medial striatum ค่าเฉลี่ยข้ามสหสัมพันธ์ระหว่างโดปามีนและอัตราการให้รางวัล แถบสีแดงแสดงช่วงความเชื่อมั่น 99% จากอนุกรมเวลาแบบสุ่ม ด้านล่างความสัมพันธ์ระหว่างสารเคมีทางระบบประสาทและอัตราการให้รางวัล (การถดถอยพหุคูณ) NA, noradrenaline; 5-HT, เซโรโทนิน; ACh อะซิติลโคลีน; กาบากรดγ-aminobutyric; กลู, กลูตาเมต; NM, นอร์เมทอะดรีนาลีน; DOPAC, กรด 3,4-dihydroxyphenylacetic; 3-MT, 3-methoxytyramine; HVA, กรด homovanillic; 5-HIAA, กรด 5-hydroxyindoleacetic d, ผลของการเปลี่ยนบล็อกต่ออัตราผลตอบแทน (ซ้าย), ความหน่วง (กลาง) และโดปามีนแกน NAc (ขวา) ช่วงการเปลี่ยนภาพถูกจำแนกตามว่าอัตรารางวัลที่มีประสบการณ์เพิ่มขึ้นหรือไม่n = 25) หรือลดลง (n = 33) ข้อมูลมาจากเซสชันทั้งหมด 14 ครั้งที่มีการวัด NAc core dopamine (หนึ่งตัวต่อหนูรวมข้อมูลจากข้อมูลใหม่และรายงานก่อนหน้านี้5 สัตว์) และพล็อตเป็นค่าเฉลี่ย± sem e, แผนที่คอมโพสิตของความสัมพันธ์ระหว่างโดปามีนและอัตราผลตอบแทน (n = หนู 19 ตัว 33 เซสชัน 58 ตำแหน่งโพรบ) โครงร่างแผนที่สมองในรูปนี้ทำซ้ำโดยได้รับอนุญาตจาก Paxinos และ Watson, 200551.
ก่อนหน้านี้เราได้รายงาน5 ความสัมพันธ์ระหว่างการปลดปล่อยโดปามีน NAc กับอัตราผลตอบแทนสอดคล้องกับบทบาทที่สร้างแรงบันดาลใจของโดปามีน mesolimbic16. ที่นี่เราแรกมีวัตถุประสงค์เพื่อตรวจสอบว่ามีการสังเกตความสัมพันธ์นี้ตลอดเป้าหมาย forebrain สอดคล้องกับการส่งสัญญาณโดพามีน 'ทั่วโลก'17หรือ จำกัด เฉพาะภูมิภาคย่อยเท่านั้น เราตั้งสมมติฐานเพิ่มเติมว่าการเปลี่ยนแปลงของโดปามีนเหล่านี้จะแตกต่างกันระหว่าง striatum และ cortex เนื่องจากโครงสร้างเหล่านี้มีโดพามีนที่ชัดเจน18 และอาจใช้โดปามีนสำหรับฟังก์ชั่นที่แตกต่างกัน19,20.
ด้วยการใช้ microdialysis กับโครมาโตกราฟีของเหลวประสิทธิภาพสูง (HPLC – MS) เราทำการสำรวจเยื่อหุ้มสมองส่วนหน้าตรงกลางและ striatum (รูปที่ 8) 1cขยายข้อมูลรูปที่ 1) เราทำการตรวจสอบสารสื่อประสาทและสาร metabolites ของ 21 พร้อมกับการแก้ปัญหาเวลา 1 นาทีและใช้การถดถอยเพื่อเปรียบเทียบอนุกรมเวลาเคมีกับตัวแปรพฤติกรรม (รูปที่ขยายข้อมูล 2).
เราจำลองความสัมพันธ์ระหว่างอัตราการให้รางวัลกับ NAc โดปามีนซึ่งตรงกันข้ามกับสารสื่อประสาทอื่น ๆ (รูปที่ 1c, d) อย่างไรก็ตามความสัมพันธ์นี้ได้รับการแปลเป็นภาษาหลักของ NAc และไม่ได้อยู่ใน NAc shell หรือ dorsal – medial striatum ตรงกันข้ามกับสมมุติฐานของเราเราสังเกตว่ารูปแบบของอวกาศคล้ายกันในสมองส่วนหน้า: การหลั่งโดปามีนมีความสัมพันธ์กับอัตราการให้รางวัลในเยื่อหุ้มสมองส่วนหน้าท้อง แต่ไม่ได้อยู่ในภูมิภาคย่อยหลังหรือหน้าท้องมากขึ้น (รูปที่ 1c, e) แม้ว่าจะมีสิ่งที่ไม่คาดคิดมาก่อน 'ฮอตสปอต' คู่ของการปล่อยโดปามีนที่เกี่ยวข้องกับค่ามีคู่ขนานที่น่าสนใจใน neuroimaging ของมนุษย์: สัญญาณขึ้นอยู่กับระดับออกซิเจนในเลือดมีความสัมพันธ์กับค่าส่วนตัวโดยเฉพาะใน NAc และ ventral – medial21.
การยิง VTA นั้นไม่เกี่ยวข้องกับแรงจูงใจ
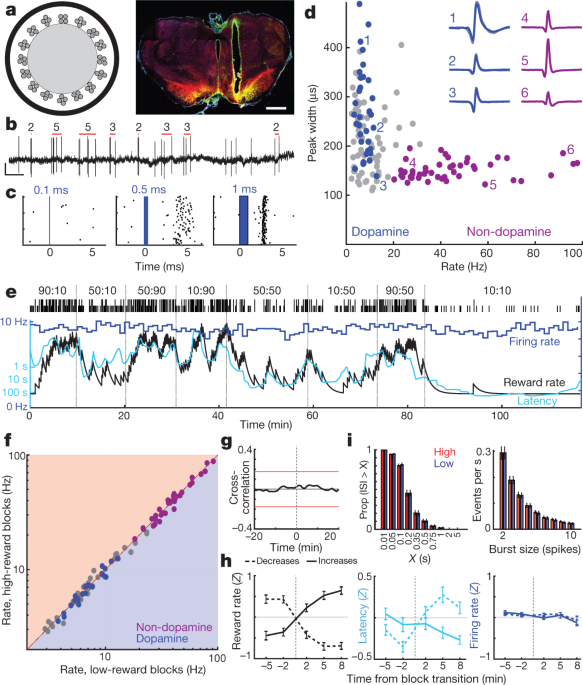
ต่อไปเราจะพูดถึงว่าโดปามีนที่เกี่ยวข้องกับแรงจูงใจนี้เกิดขึ้นจากการเผาที่แปรผันของเซลล์โดปามีนในสมอง แกน NAc ได้รับอินพุตโดปามีนจากส่วนด้านข้างของ VTA (VTA-l)6,22,23. ในหนูหัวตายตัวเซลล์ประสาทโดปามีน VTA-l มีรายงานว่ามีการตอบสนองต่อสิ่งกระตุ้นปรับอากาศเหมือน RPE3. ในการบันทึกเซลล์โดปามีน VTA-l เราติดเชื้อ VTA ด้วย adeno-related virus (AAV) สำหรับการแสดงออกของ cre-dependent ของ channelrhodopsin (AAV-DIO-ChR2) ในหนูที่แสดง Cre recombinase ภายใต้ tyrosine hydroxylase (TH) วิธีการ) Optrodes (รูปที่ 2a, b) บันทึกการตอบสนองแบบหน่วยเดียวต่อพัลส์เลเซอร์สีฟ้าสั้น ๆ (รูปที่ 2cขยายข้อมูลมะเดื่อ 3, 4, รูปเพิ่มเติม 1) เราพบเซลล์ VTA-l ที่แยกได้ของ 27 ที่มีหนามแหลมแบบหน่วงเวลาสั้น ๆ ที่เชื่อถือได้และระบุว่าเป็นเซลล์ประสาทโดปามีน
a, ซ้าย, แผนผัง optrode พร้อม 16 tetrodes รอบเส้นใยแก้วนำแสง 200 µm ใช่ตัวอย่างของการจัดวาง Optrode ภายใน VTA ด้านข้าง สเกลบาร์ 1 มม. สีแดงเครื่องหมายเซลล์โดปามีนไทโรซีนไฮดรอกซิเลส; สีเขียว, ChR2 – EYFP; สีเหลืองทับซ้อนกัน สำหรับตำแหน่งทั้งหมดดูที่ Extended Data Fig 3. b, VTA dopamine เซลล์แหลม แถบสีแดงหมายถึงการระเบิดที่ตรวจพบและจำนวนครั้งในแต่ละครั้ง (ดูที่ วิธีการ). ขนาด 0.5 วินาที 0.5 mV cตัวอย่างการตอบสนองของเซลล์ประสาทต่อแสงเลเซอร์ในระยะเวลาที่เพิ่มขึ้น dอัตราการยิงทั้งเซสชันกับความกว้างขัดขวาง (ที่ครึ่งสูงสุด) สำหรับแต่ละเซลล์ VTA เซลล์โดพามีนสีน้ำเงินที่ติดแท็ก สีม่วงกลุ่มที่แตกต่างของเซลล์ประสาทที่ไม่ใช่โดปามีนที่สันนิษฐาน ภาพประกอบตัวอย่างของรูปคลื่นโดยเฉลี่ย (แรงดันลบขึ้นไป) e, อัตราการยิง (สีน้ำเงิน; ถังขยะ 1 นาที) ของเซลล์ประสาทโดปามีน VTA ระหว่างงานโจร ความล่าช้า (สีฟ้า) covaries ที่มีอัตรารางวัล แต่อัตราการยิงไม่ได้ f, อัตราการยิงสำหรับเซลล์ประสาท VTA ทั้งหมด (สีน้ำเงิน, โดปามีน, สีม่วง, ไม่มีโดปามีน, สีเทา, ไม่จัดประเภท) ในบล็อกที่มีอัตราผลตอบแทนต่ำเมื่อเทียบกับ ไม่มีความแตกต่างที่มีนัยสำคัญ (วิลคอกซันลงนามทดสอบระดับโดยใช้ถังขยะ 1-min ทั้งหมด P > 0.05 หลังจากแก้ไขสำหรับการเปรียบเทียบหลายรายการ) gความสัมพันธ์ข้ามโดยเฉลี่ยระหว่างการเผาโดปามีนเซลล์และอัตราการให้รางวัลแสดงว่าไม่มีความสัมพันธ์ที่มีนัยสำคัญ hการวิเคราะห์อัตราการเผาโดปามีนที่ช่วงการเปลี่ยนภาพ (รูปแบบเดียวกับรูปที่ 1d). n = 95 รางวัลเพิ่มขึ้น 76 ลดลง i. การแจกแจงของ inter-spike-intervals (ISIs, ซ้าย) และ spike bursts (ขวา) ไม่มีการเปลี่ยนแปลงระหว่างบล็อกอัตรารางวัลที่สูงขึ้นและต่ำลง (สถิติ Kolmogorov – Smirnov: ISIs, 0.138, P = 0.92; ระเบิด 0.165 P = 0.63)
เซลล์ประสาทโดปามีนทั้งหมดทำงานได้ดีโดยมีอัตราการยิงค่อนข้างต่ำ (เฉลี่ย 7.7 เฮิรตซ์ช่วง 3.7–12.9 เฮิรตซ์เทียบกับเซลล์ประสาท VTA-l ทั้งหมดที่บันทึกร่วมกับเซลล์โดปามีน P <0.001 การทดสอบ Mann – Whitney ทางเดียว) นอกจากนี้ยังมีรูปคลื่นขัดขวางระยะเวลาที่ยาวนานขึ้น (P <5 × 10-6การทดสอบ Mann – Whitney แบบหางเดียวแม้ว่าจะมีข้อยกเว้น (รูปที่ 2d) ซึ่งยืนยันว่าระยะเวลารูปคลื่นเป็นตัวบ่งชี้เซลล์โดปามีนในร่างกายไม่เพียงพอ3,24. กลุ่มของเซลล์ประสาท VTA-l ที่แตกต่างกัน (n = 38 จากเซสชันเดียวกัน) ที่มีรูปคลื่นสั้น ๆ และอัตราการยิงที่สูงขึ้น (> 20 Hz หมายถึง 41.3 Hz ช่วง 20.1–97.1 Hz) ไม่รวมเซลล์โดพามีนที่ติดแท็ก เราสันนิษฐานว่าเซลล์ที่ยิงเร็วเหล่านี้คือ GABAergic และ / หรือ glutamatergic3,25และอ้างถึงพวกเขาว่า 'ไม่ต้องโดปามีน' ด้านล่าง
เราบันทึกเซลล์โดปามีนชนิดเดียวกันในหลาย ๆ พฤติกรรม เซลล์โดปามีน VTA-l ตอบสนองอย่างยิ่งต่อการคลิกที่กระโดดอาหารที่กำหนดเวลาแบบสุ่มและมีความก้าวหน้าน้อยลงเมื่อการคลิกเหล่านี้สามารถคาดการณ์ได้มากขึ้นโดยการชี้นำก่อนหน้า (รูปที่ขยายข้อมูล 5) สิ่งนี้สอดคล้องกับการเข้ารหัสแบบคล้าย RPE ซึ่งเป็นที่ยอมรับโดยเซลล์โดปามีนในงาน Pavlovian2,3,26.
บนพื้นฐานของหลักฐานจากสัตว์ที่ไม่ได้รับความรู้สึกก่อนหน้านี้เคยเป็นที่ถกเถียงกันอยู่ว่าการเปลี่ยนแปลงระดับโดพามีนที่วัดด้วยการฟอกไตเกิดจากการเปลี่ยนแปลงของอัตราการยิงโทนิคของเซลล์โดปามีน27 และ / หรือสัดส่วนของโดปามีนที่ใช้งานกับเซลล์ประสาทที่ไม่ได้ใช้งาน28. อย่างไรก็ตามในภารกิจโจรเซลล์โดพามีนซึ่งเป็นโทนิกที่เผาในแต่ละช่วงของการทดลองนั้นไม่สนใจอัตราผลตอบแทน 2e, g) ไม่มีการเปลี่ยนแปลงอย่างมีนัยสำคัญในอัตราการยิงของแต่ละเซลล์โดปามีนหรือเซลล์ประสาท VTA-l อื่น ๆ ระหว่างบล็อกที่สูงขึ้นและต่ำลง (รูปที่ 12) 2f, ห่า; ดูอ้างอิงด้วย 29 เพื่อให้ได้ผลลัพธ์ที่สอดคล้องกันในเมาส์คงที่) นอกจากนี้ยังไม่มีการเปลี่ยนแปลงโดยรวมในอัตราที่เซลล์โดพามีนยิงออกมาจากแหลม (รูปที่ 2i) นอกจากนี้เราไม่ได้สังเกตเห็นเซลล์โดปามีนใด ๆ ที่สลับไปมาระหว่างสถานะแอคทีฟและแอ็คทีฟ สัดส่วนของเซลล์โดปามีนที่ใช้ไปกับการไม่ได้ใช้งาน (ช่วงระยะเวลาระหว่างเข็มยาว) นั้นต่ำมากและไม่เปลี่ยนแปลงระหว่างบล็อกที่สูงขึ้นและต่ำลง 2i).
กายวิภาคของการฉายโดปามีนแบบ VTA-NAc ได้รับการตรวจสอบอย่างละเอียด6,22,23แต่ - เนื่องจากการทำงานที่ไม่ชัดเจนนี้ระหว่างการยิงและการปล่อยตัว - เรายืนยันอีกครั้งว่าเรากำลังบันทึกจากส่วนที่ถูกต้องของ VTA การฉีดอหิวาตกโรคสารพิษถอยหลังเข้าคลอง (CTb) เล็ก ๆ น้อย ๆ เข้าสู่แกนกลางทำให้เกิดการติดฉลากหนาแน่นของ TH+ เซลล์ประสาทภายในพื้นที่ VTA-l เช่นเดียวกับการบันทึก optrode ของเรา (รูปที่ขยายข้อมูล 3) ภายในเขตการบันทึกโดยประมาณ 21% ของ TH+ เซลล์ยังเป็น CTb+และนี่น่าจะเป็นส่วนที่ต่ำกว่าสัดส่วนของเซลล์โดปามีนที่คาดการณ์ไว้ของ VTA-l เนื่องจากการฉีดสารติดตามของเราไม่ได้เติมแกน NAc อย่างสมบูรณ์ ดังนั้นตัวอย่างของเรา n = 27 เซลล์ที่ติดแท็ก VTA dopamine (บวกเซลล์ที่ไม่ได้ติดแท็กอื่น ๆ อีกมากมาย) เกือบจะรวมถึงเซลล์ประสาทที่ฉายภาพหลักของ NAc สุดท้ายในหนูเพิ่มเติมเราได้บันทึกเซลล์โดพามีน VTA-l ที่ติดแท็กสองเซลล์หลังจากใส่ AAV ลงในแกน NAc (Extended Data Fig. 3). เซลล์ที่ติดเชื้อย้อนยุคทั้งสองมีรูปแบบการยิงที่คล้ายกับเซลล์โดปามีนที่ติดแท็กอื่น ๆ ทุกประการรวมถึงการขาดการเปลี่ยนแปลงการยิงยาชูกำลังด้วยอัตราผลตอบแทนที่แตกต่างกัน (รูปเสริม 1) เราสรุปได้ว่าการเปลี่ยนแปลงในการปล่อยโดปามีน VTA-l ในโทนิคจะไม่รับผิดชอบต่อการเปลี่ยนแปลงที่เกี่ยวข้องกับแรงจูงใจในการปล่อยโดพามีน forebrain
การติดตามการเปิดตัวในหลายครั้ง
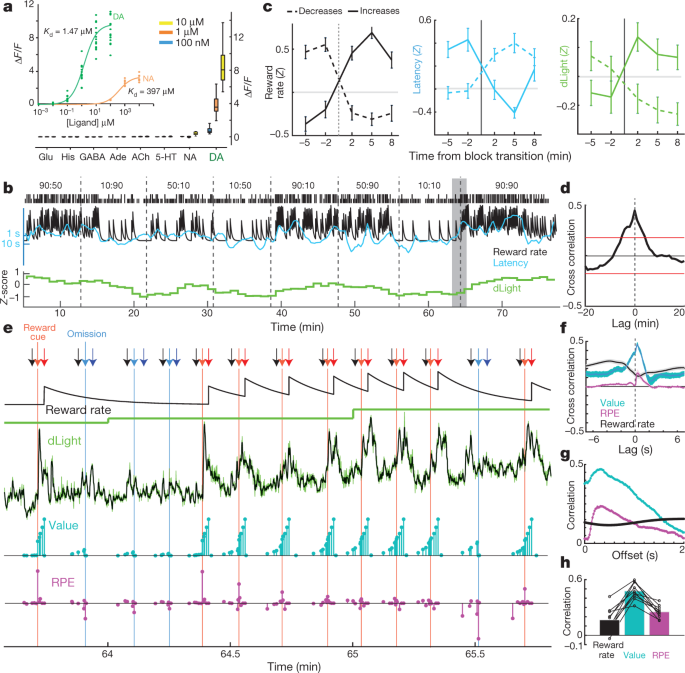
NAc โดปามีนปล่อยอัตราการติดตามรางวัลต่อ se หรือไม่ตามที่แนะนำในบางทฤษฎี30หรือความสัมพันธ์นี้ขับเคลื่อนโดยความผันผวนแบบไดนามิกในการปลดปล่อยโดปามีนที่เร็วเกินไปที่จะแก้ไขด้วยการเกิด microdialysis เราแย้งกับความเป็นไปได้ในภายหลังบนพื้นฐานของข้อมูลแรงดันไฟฟ้า5แต่ขอการยืนยันโดยใช้มาตรการอิสระของการปลดปล่อยโดปามีนที่สามารถขยายช่วงเวลาที่แตกต่างกัน ชุด dLight1 ของตัวบ่งชี้โดปามีนออพติคอลที่เข้ารหัสทางพันธุกรรมได้รับการออกแบบโดยการใส่ GFP ที่เปลี่ยนรูปแบบวงกลมลงใน dopamine D1 รีเซพเตอร์15. การผูกโดปามีนทำให้มีการเรืองแสงเพิ่มขึ้นอย่างมาก 3a) เราใส่ AAV ลงใน NAc เพื่อแสดง dLight1.1 (ตำแหน่ง NAc ที่ผ่านการตรวจสอบสี่ตำแหน่งจากหนูสามตัว) หรือตัวแปรที่สว่างกว่า dLight1.3b (ตำแหน่ง NAc ที่ตรวจสอบแล้วหกตำแหน่งจากหนูสี่ตัว) และตรวจสอบการเรืองแสงด้วยเส้นใยแสง เราสังเกตเห็นการตอบสนองโดปามีนที่ชัดเจนของ NAc ต่อตัวชี้นำการทำนายผลรางวัล Pavlovian เช่นเดียวกับการยิงเซลล์โดปามีน VTA (รูปแบบข้อมูลเพิ่มเติม 5).
a, การตอบสนองเรืองแสงของ dLight1.3b สิ่งที่ใส่เข้าไป, การไตเตรทของโดปามีน (n = 15 ภูมิภาคที่น่าสนใจ (ROI)) และ noradrenaline (n = 9) รูปหลักสารสื่อประสาทที่ใช้อาบน้ำ (ทั้งหมด n = 12 ROI) ฮิสตามีนของเขา bตัวอย่างเซสชันโจรรวมถึงสัญญาณ NAc dLight1.3b ปกติ (ถังขยะ 1-min) c, dLight เปลี่ยนสัญญาณด้วยการเปลี่ยนบล็อก n = 35 อัตรารางวัลเพิ่มขึ้น 45 ลดลง dข้ามความสัมพันธ์ระหว่าง dLight และอัตราผลตอบแทน e, มุมมองที่ใกล้ชิดของส่วนที่แรเงาของ b. ลูกศร: สีดำตรงกลางจมูก สีแดงอ่อน Side-in (ได้รับรางวัล); สีฟ้าอ่อน Side-in (ไม่ได้รับรางวัล); สีแดงเข้ม Food-port-in (ได้รับรางวัล); สีน้ำเงินเข้ม Food-port-in (ไม่ได้รับรางวัล) แถวถัดไป: การประเมินอัตราผลตอบแทนที่รั่วไหล dLight ที่ความละเอียดต่ำ (1 นาที); dLight ที่ความละเอียดสูง (50 Hz, สีเขียว; ค่ามัธยฐานห้าจุดกรองสีดำ); ค่าสถานะแบบจำลอง (สีฟ้า); และ RPEs (สีม่วงแดง) หลังจากการทดลองที่ไม่ได้รับรางวัลหลายครั้งค่าของรัฐในช่วงต้นของการทดลองอยู่ในระดับต่ำจากนั้นการให้รางวัลจะทำให้เกิด RPE ในเชิงบวกและโดพามีนที่เพิ่มขึ้นอย่างรวดเร็ว การทดลองที่ได้รับรางวัลอย่างต่อเนื่องจะลด RPE ลง แต่เพิ่มค่าสถานะพร้อมกับการเพิ่มขึ้นของโดพามีน fcrosscorrelations สั้น timescale แสดงความสัมพันธ์ใกล้ชิดระหว่าง dLight และค่าและความสัมพันธ์ที่มีขนาดเล็กลงเพื่อ RPE gความสัมพันธ์ภายในการทดลองระหว่างตัวแปรแบบจำลองและ dLight ที่มีความล่าช้าต่างกัน ความสัมพันธ์กับทั้งสองค่าและ RPE นั้นแข็งแกร่งที่สุดถึง dLight ประมาณ 0.3 วินาทีในภายหลัง h, ในทุกเซสชัน, ค่าสหสัมพันธ์สูงสุดสำหรับค่ามากกว่า RPE หรืออัตราผลตอบแทน
สำหรับภารกิจโจรก่อนอื่นเราตรวจสอบสัญญาณ dLight ในถังขยะ 1-min (รูปที่ 3b) เพื่อเปรียบเทียบกับ microdialysis เราเห็นความสัมพันธ์ที่ชัดเจนระหว่างการปล่อยโดปามีน NAc และอัตราการให้รางวัลทั้งความสัมพันธ์ข้ามและการวิเคราะห์การเปลี่ยนบล็อก (รูปที่ 4) 3c, d) ต่อไปเราจะตรวจสอบอย่างใกล้ชิดว่าความสัมพันธ์นี้เกิดขึ้นได้อย่างไร มากกว่าการเปลี่ยนแปลงอย่างช้าๆในช่วงเวลาหนึ่งนาทีสัญญาณ dLight แสดงให้เห็นถึงความผันผวนแบบไดนามิกสูงภายในและระหว่างการทดลองแต่ละครั้ง (รูปที่ 3e) เราเปรียบเทียบความผันผวนเหล่านี้กับค่าสถานะในทันทีและ RPE ที่ประเมินจากแบบจำลองการเรียนรู้เสริม (กระบวนการตัดสินใจกึ่งมาร์คอฟ5) ตามที่รายงานไว้ก่อนหน้านี้โดยใช้ voltammetry5โดปามีน NAc ในแต่ละขณะมีความสัมพันธ์กับค่าสถานะ (รูปที่ 14) 3f) มองเห็นได้ราวกับกำลังกระโจนขึ้นภายในการทดลองเมื่อคาดหวังรางวัล (รูปที่ 3e) เรายังเห็นการเพิ่มขึ้นชั่วคราวด้วยการส่งมอบรางวัลที่คาดหวังน้อยลงซึ่งสอดคล้องกับ RPE (ตรวจสอบด้านล่าง) ในทุกเซสชั่น dLight โดพามีนมีความสัมพันธ์กับค่ามากกว่า RPE หรืออัตราผลตอบแทน (รูปที่ 14) 3hขยายข้อมูลรูปที่ 6). ความสัมพันธ์กับทั้งค่าสถานะและ RPE มีค่าสูงสุดเมื่อเทียบกับสัญญาณ dLight ~ 0.3 วินาทีในภายหลังซึ่งสอดคล้องกับความล่าช้าสั้น ๆ ที่เกิดจากการประมวลผลประสาทของตัวชี้นำและเวลาตอบสนองของเซ็นเซอร์ (รูปที่ 3g; ด้วยโวลต์มิเตอร์เรารายงานความล่าช้า 0.4–0.5 วินาที)5.
การยิงโดปามีนไม่ได้อธิบายการปลดปล่อย
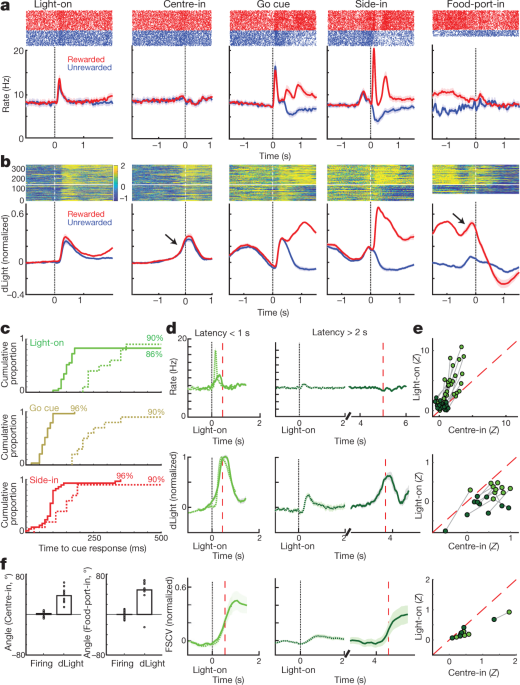
เราเปรียบเทียบการโดปามีนเซลล์ต่อไปและการปล่อยรอบเหตุการณ์โจร - งาน สิ่งเร้าภายนอกที่ Light-on, Go cue และให้รางวัล Side-in (คลิกที่ food-hopper click) แต่ละครั้งทำให้เกิดการยิงเพิ่มขึ้นอย่างรวดเร็ว (รูปที่. 4a) การตอบสนองเหล่านี้พบได้ในเซลล์โดปามีนส่วนใหญ่ 4c) แม้ว่าขนาดสัมพัทธ์ของการตอบสนองต่อสัญญาณที่ต่างกันนั้นแตกต่างกันไปในแต่ละเซลล์รูปเพิ่มเติม 1) สัญญาณ NAc dLight ตอบสนองอย่างรวดเร็วและเชื่อถือได้กับสัญญาณชี้นำที่เด่นชัดเหล่านี้ (รูปที่ 4b, c) สอดคล้องกับการระเบิดของเซลล์โดปามีนซึ่งเป็นตัวผลักดันการปลดปล่อยโดปามีน
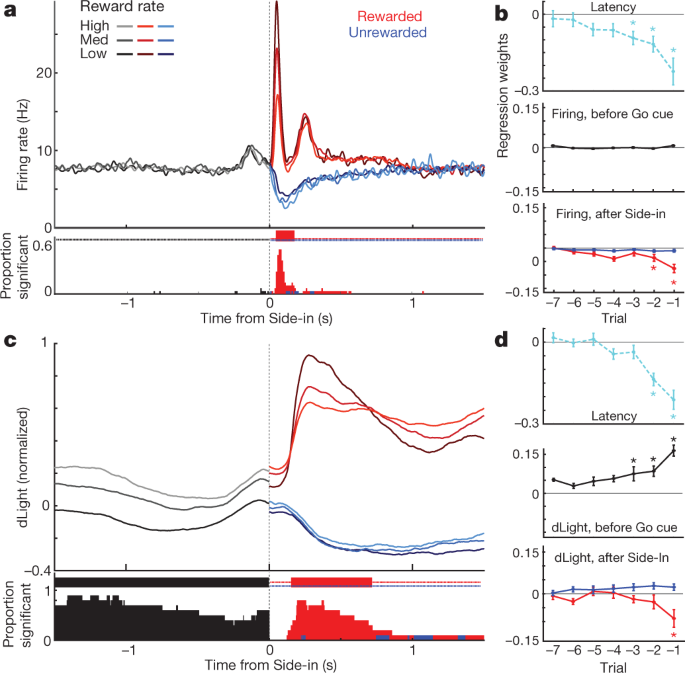
a, กิจกรรมที่จัดกิจกรรมของเซลล์โดปามีน VTA-l ด้านบนที่แหลมสำหรับหนึ่งเซลล์ตัวแทน ด้านล่าง, อัตราขัดขวางเฉลี่ย (n = 29) ในแผงควบคุมทั้งหมดแถบแสดงข้อผิดพลาดจะระบุ± sem bNAc dLight ที่จัดกิจกรรม เซสชันตัวแทนยอดนิยม ด้านล่างโดยเฉลี่ย (n = 10) ปรับให้เป็นมาตรฐานเพื่อตอบสนองด้านข้างที่ได้รับรางวัลสูงสุด ตลอดรูปนี้สัญญาณ dLight จะแสดงเมื่อเทียบกับยุคพื้นฐาน 2 วินาทีที่สิ้นสุด 1 วินาทีก่อน Center-in หมายเหตุเพิ่มขึ้น (ลูกศร) ไม่นานก่อน Center-in และ Food-port-in c, การแจกแจงแบบสะสมของเวลาที่ใช้สำหรับเซลล์โดปามีน (ของแข็ง; n = 29), dLight (ประ; n = 10) เพื่อเพิ่ม cue onsets ต่อไปนี้ (การทดสอบแบบสุ่มเทียบกับพื้นฐาน, 10,000 shuffles, P <0.01 แก้ไขการเปรียบเทียบหลายรายการ) สำหรับ Light-on จะรวมเฉพาะเวลาแฝง <1 วินาทีเท่านั้น สำหรับการทดลองที่ได้รับรางวัลแบบ Side-in เท่านั้น เวลาแฝงเฉลี่ย (จาก sigmoid fit): เปิดไฟ, ยิง 152 ms, dLight 266 ms; ไปคิวยิง 67 ms, dLight 212 ms; ด้านข้างยิง 85 ms, dLight 129 ms โดยทั่วไปแล้วเซลล์ที่ไม่ใช่โดปามีนจะไม่สนใจกับคิวออนเซ็ต (Extended Data Fig. 8). dเปิดตัวโดปามีนที่เกี่ยวข้องกับวิธีการที่แตกต่างกัน การถ่ายโดปามีนเซลล์เฉลี่ยสูงสุด (n = 29); dLight กลางค่าเฉลี่ย (n = 10); ด้านล่างโวลต์มิเตอร์ (n = 6) ปรับให้เป็นมาตรฐานเพื่อตอบสนองต่อ Light-on ระยะเวลาแฝงสั้นสูงสุด แผงด้านซ้ายเวลาในการตอบสนอง <1 วินาทีขวาเวลาแฝง> 2 วินาที ข้อมูลจะถูกจัดแนวบน Light-on (solid) หรือ Center-in (dotted); เส้นประสีแดงค่ามัธยฐานเวลาแฝง สำหรับเวลาในการตอบสนองที่นานขึ้นจะไม่มีการเพิ่มขึ้นของการยิงที่อยู่ใกล้ Center-in แต่ dLight และ voltammetry จะเพิ่มขึ้นอย่างชัดเจน eพล็อตกระจายเมื่อเปรียบเทียบสัญญาณสูงสุดที่จัดบน Light-on (y แกน) หรือ Center-in (x แกน). สำหรับแต่ละเซลล์เส้นที่เชื่อมต่อเซสชันจะระบุข้อมูลสำหรับช่วงเวลาแฝงที่แตกต่างกัน (<1 วินาที> 2 วินาที) การยิงโดปามีน (ด้านบน) แสดงการตอบสนองของ Light-on อย่างสม่ำเสมอสำหรับการทดลองระยะสั้น (การวิเคราะห์ความแปรปรวนแบบสองทาง (ANOVA), การจัดตำแหน่ง×ปฏิสัมพันธ์เวลาแฝง, F = 7.47, P = 0.0008) สัญญาณ dLight (กลาง), voltammetry (ด้านล่าง) สอดคล้องกับ Center-in ที่ดีกว่าอย่างต่อเนื่อง (ความแปรปรวนสองทางสำหรับ dLight: การจัดตำแหน่ง×การโต้ตอบเวลาแฝง, F = 9.28, P = 0.0043) fโดปามีนเพิ่มขึ้นเมื่อเข้าใกล้ปริมาณเป็นมุมทางลาด (ดู วิธีการ) วงกลมบ่งบอกถึงเซลล์โดพามีนแต่ละตัว (n = 29), เซสชัน dLight (n = 10)
นอกจากนี้เรายังเห็นการเพิ่มขึ้นอย่างชัดเจนของการปล่อยโดปามีน NAc เมื่อหนูเข้าใกล้พอร์ตเริ่มต้น (ก่อนตรงกลาง) และพอร์ตอาหาร (ก่อนหน้าอาหารพอร์ตเข้า) สิ่งนี้สอดคล้องกับวรรณกรรมโวลแทมเมทรีที่กว้างขวางซึ่งแสดงให้เห็นว่าพฤติกรรมการกระตุ้นมีมาพร้อมกับการเพิ่มขึ้นอย่างรวดเร็วของโดปามีนแกน NAc5,7,8,9,10,11. อย่างไรก็ตามประชากรโดพามีนเซลล์ VTA-l ไม่ได้แสดงการยิงที่เพิ่มขึ้นในช่วงเวลาดังกล่าว (รูปที่ 14) 4a; ดูรูปที่ข้อมูลเพิ่มเติม 7 สำหรับการเปรียบเทียบเพิ่มเติมรวมถึงเซลล์ที่ไม่ใช่โดปามีน)
เพื่อแยกการทำงานของโดพามีนที่ทำให้เกิดคิวและกิจกรรมที่เกี่ยวข้องกับแนวทางได้ดีขึ้นเราได้แยกการทดลองด้วยเวลาแฝงสั้น (<1 วินาที) และยาว (> 2 วินาที) (รูปที่ 4d, e) การเพิ่มขึ้นของการยิงเซลล์โดปามีนถูกล็อคอย่างต่อเนื่องเพื่อเริ่มการคิวที่แสง - บนโดยเฉพาะอย่างยิ่งสำหรับการทดลองระยะสั้น เซลล์โดปามีน 25 ทั้งหมดที่มีอัตราการเผาเพิ่มขึ้นอย่างมีนัยสำคัญหลังจาก Light-on สอดคล้องกับ Light-on ได้ดีกว่า Center-in (รูปที่ 4e) ในทางตรงกันข้ามการเพิ่มขึ้นของโดปามีน NAc ก่อนที่ Center-in จะแตกต่างจากการปลดปล่อยโดปามีนในคิว 4d, e) สัญญาณ dLight เพิ่มขึ้นอย่างต่อเนื่องก่อนที่จะเข้าศูนย์ในการทดลองระยะยาว (สิบในสิบครั้ง) และก่อนอาหารเข้าพอร์ต (เก้าในสิบครั้ง) โดยไม่ต้องเพิ่มการยิงโดปามีน (รูปที่ 10) 4f).
ในที่สุดเราก็พิจารณาว่าสัญญาณโดปามีนที่เกี่ยวข้องกับเหตุการณ์นั้นขึ้นอยู่กับประวัติรางวัลเมื่อเร็ว ๆ นี้ ในช่วงต้นของการทดลองแต่ละครั้งการเผาโดปามีนเซลล์ไม่ได้ขึ้นอยู่กับอัตราการให้รางวัล 5a) แม้จะมีอิทธิพลของอัตรารางวัลต่อแรงจูงใจ (รูปที่ 5b). ต่อจากนั้นการตอบสนองขั้นตอนต่อคิวรางวัลที่ Side-in นั้นแข็งแกร่งขึ้นอย่างน่าเชื่อถือเมื่ออัตรารางวัลต่ำกว่า (รูปที่. 5a) สอดคล้องกับการเข้ารหัส RPE เชิงบวก เมื่อละเว้นคิวรางวัลนี้เซลล์โดปามีนหยุดการยิงชั่วคราวแม้ว่าการเข้ารหัส RPE เชิงลบจะอ่อนแอหรือขาดหายไปมากไม่ว่าจะตรวจสอบในระดับประชากร (รูปที่ 5a, b) หรือเป็นเซลล์แต่ละเซลล์ (Extended Data Fig. 8). ก่อนหน้านี้มีการเสนอว่า RPE เชิงลบถูกเข้ารหัสในช่วงเวลาที่โดปามีนหยุดชั่วคราว31แต่สิ่งนี้พบในเซลล์ประสาทเพียง 2 ใน 29 เซลล์ ได้ผลลัพธ์ที่คล้ายกันหากมีการประมาณความคาดหวังของรางวัลในรูปแบบอื่น ๆ รวมถึงแบบจำลองการเรียนรู้แบบเน้นการทดลอง (นักแสดง - นักวิจารณ์และ Q-learning) หรือเพียงแค่นับรางวัลล่าสุด (Extended Data Fig 8).
a, อัตราการยิงเฉลี่ยของเซลล์โดปามีน (เฉลี่ย)n = 29) จัดชิดกับ Side-in แยกตามอัตรารางวัล (Terciles คำนวณแยกกันสำหรับแต่ละเซลล์) ก่อน Side-in กิจกรรมไม่ได้ขึ้นอยู่กับการคาดหวังรางวัล หลังจากการทดลองรางวัลด้านข้าง (สีแดง) และที่ยังไม่ได้รับรางวัล (สีน้ำเงิน) จะแสดงแยกกัน การตอบสนองต่อการคลิกอาหารจะแข็งแกร่งขึ้นเมื่ออัตรารางวัลต่ำสอดคล้องกับการเข้ารหัส RPE เชิงบวก ด้านล่างเศษของเซลล์โดปามีนแต่ละเซลล์ที่มีอัตราการยิงที่แตกต่างกันอย่างมีนัยสำคัญตามอัตรารางวัลในแต่ละช่วงเวลา (การทดสอบแบบสุ่ม P <0.01 แก้ไขการเปรียบเทียบหลายรายการ) เครื่องหมายขีดที่ด้านบนระบุเวลาที่เศษส่วนนี้สูงกว่าโอกาสอย่างมีนัยสำคัญ (ทวินาม, P <0.01) หลังจาก Side-in แล้วจะมีการทดสอบเฉพาะความสัมพันธ์เชิงลบนั่นคือการเข้ารหัส RPE ที่เป็นไปได้ bพล็อตการถดถอยสำหรับเซสชันที่มีเซลล์โดปามีนที่บันทึกไว้แสดงผลของประวัติรางวัลเมื่อเร็ว ๆ นี้เกี่ยวกับ (log-) เวลาแฝง (บน) และโดปามีน เครื่องหมายดอกจันระบุน้ำหนักการถดถอยที่สำคัญ (t-ทดสอบ, P <0.05) ในช่วง 0.5 วินาทีก่อนเริ่มคิว (ในขณะที่หนูต้องรักษาจมูกให้คงที่เพื่อทดลองดำเนินการต่อไป) dopamine spiking จะไม่ได้รับผลกระทบจากประวัติการให้รางวัล (กลาง) สิ่งนี้จะเปลี่ยนแปลงเมื่อผลลัพธ์ถูกเปิดเผย (ด้านล่างการประเมินจุดสูงสุดหรือช่วงของกิจกรรมใน 0.5 วินาทีหลังจาก Side-in) แต่สำหรับการทดลองที่ได้รับรางวัลเท่านั้น c, dเช่นเดียวกับข้างต้นยกเว้นสำหรับ dLight (ทำให้เป็นปกติถึงการตอบกลับไซด์สูงสุด) โดปามีนที่ปล่อยออกมาจะถูกปรับขนาดด้วยอัตราผลตอบแทนที่เชื่อถือได้แม้กระทั่งก่อนไซด์อิน
การปล่อยโดปามีนที่ Side-in ยังแสดงให้เห็นการเข้ารหัส RPEs ที่เป็นบวกและชัดเจน แต่ไม่ได้เป็น RPE เชิงลบ (รูปที่ 5c, d) การตอบสนอง dLight นี้ล่าช้าเล็กน้อยและเป็นเวลานานเมื่อเทียบกับการยิงซึ่งสอดคล้องกับเวลาที่ใช้ในการปล่อยและการเก็บใหม่32แต่ยังคงเป็นปรากฏการณ์ที่สอง ซึ่งแตกต่างจากการยิงอย่างไรก็ตามสัญญาณ dLight ในช่วงต้นของการทดลองแต่ละครั้งยิ่งใหญ่กว่าเมื่อการทดลองครั้งล่าสุดได้รับรางวัล (รูปที่ 5c) สอดคล้องกับการเข้ารหัสค่า เราสังเกตเห็นการพึ่งพาประวัติรางวัลนี้แม้ว่าหนูจะไม่เคลื่อนไหวอย่างแข็งขัน แต่ก็ยังคงให้จมูกโผล่ที่ช่องตรงกลางในขณะที่รอคิว Go (รูปที่. 5d) โดยรวมแล้วเราสรุปว่าการปล่อยโดปามีน NAc สะท้อนให้เห็นถึงการตอบสนองคิวและการคาดหวังผลตอบแทนและการที่โดปามีนเซลล์ VTA-l สามารถทำได้ในอดีตเท่านั้น
การสนทนา
VTA-l เป็นแหล่งที่มาของโดปามีนหลักของ NAc6,23,24. เซลล์โดปามีน VTA-l รวมถึงเซลล์นั้นที่ไปยังแกน NAc แสดงการระเบิด RPE ที่เข้ารหัสอย่างสม่ำเสมอ3,12. VTA bursts เป็นเรื่องสำคัญอย่างยิ่งสำหรับการขับ NAc dopamine32และแน่นอนเราพบว่าการระเบิดของ VTA ที่ถ่ายทอดออกมาถูกจับคู่โดยการปล่อย NAc อย่างไรก็ตามเรายังค้นพบรูปแบบที่เกี่ยวข้องกับคุณค่าของการปล่อยโดปามีน NAc ที่ไม่ได้เกิดจากการยิงเซลล์โดปามีน VTA-l ทั้งบนยาว (โทนิค) หรือสั้น (เฟส) ระยะเวลา (เฟส) ประชากรโดพามีนอื่น ๆ อาจมีสัญญาณที่ชัดเจน13,33,34และเราไม่สามารถแยกแยะความเป็นไปได้ที่การยิงประชากรย่อยของเซลล์โดปามีนที่ไม่ได้บันทึกจากที่นี่จะสร้างโดปามีนที่เกี่ยวข้องกับมูลค่าในแกน NAc อย่างไรก็ตามไม่เคยมีรายงานการยิงที่เกี่ยวข้องกับมูลค่าสำหรับเซลล์โดปามีนใด ๆ ในการศึกษาที่หลากหลาย ผลลัพธ์ของเราชี้ให้เห็นว่าพลวัตของ NAc dopamine ถูกควบคุมในรูปแบบที่แตกต่างกันในเวลาที่ต่างกันและสำหรับหน้าที่ที่แตกต่างกันและการบันทึกเซลล์โดพามีนมีความสำคัญ แต่ไม่เพียงพอสำหรับการทำความเข้าใจสัญญาณโดพามีน35.
การปลดปล่อยจากโดปามีนนั้นได้รับอิทธิพลอย่างมากจากกลไกท้องถิ่นที่ไม่ไวต่อแรงกระตุ้น36,37,38,39,40. ยกตัวอย่างเช่นการปล่อยโดปามีน NAc ถูกมอดูเลต basolateral amygdala แม้ว่า VTA spiking จะถูกระงับทางเภสัชวิทยา41,42. เป็นที่ทราบกันมานานหลายทศวรรษแล้วว่าการควบคุมโดปามีนในท้องถิ่นอาจทำให้ฟังก์ชั่นแตกต่างจากโดปามีนในเซลล์36,43แต่สิ่งนี้ไม่ได้รวมอยู่ในมุมมองทางทฤษฎีของโดปามีน ภูมิภาคย่อยที่แตกต่างกันมีส่วนช่วยในการตัดสินใจประเภทต่างๆและอาจมีอิทธิพลต่อการปลดปล่อยโดปามีนของพวกเขาเองตามความต้องการ44. ยังคงต้องพิจารณาว่าการควบคุมการปลดปล่อยโดพามีนเป็นภาษาท้องถิ่นได้อย่างไร ข้อ จำกัด อย่างหนึ่งที่ใช้ร่วมกันโดย 3 วิธีที่เราวัดการปลดปล่อยโดปามีนคือพวกมันทั้งหมดสุ่มตัวอย่างในระดับพื้นที่อย่างน้อย 100 µm ในขณะที่กล้องจุลทรรศน์ในร่างกายแสดงให้เห็นว่าการปลดปล่อยโดปามีนอาจต่างกันในระดับที่เล็กกว่า15.
ผลลัพธ์ของเราไม่สนับสนุนการมีอยู่ของสัญญาณโดพามีนแบบโทนิกแยกซึ่งสามารถเป็นสื่อกลางในการสร้างแรงจูงใจของโดปามีน แต่จะเปลี่ยนโดปามีนที่ปรากฏช้าถ้าวัดช้า (ด้วย microdialysis) จะเปลี่ยนเป็นความผันผวนอย่างรวดเร็วหากวัดอย่างรวดเร็ว (ด้วยโวลแทมเมทหรือ dLight) นอกจากนี้การบันทึกเซลล์โดปามีน VTA ที่ระบุด้วยตัวเราเองและคนอื่น ๆ30 ให้หลักฐานที่แข็งแกร่งต่อความคิด29 การเปลี่ยนแปลงในเซลล์โดพามีนซึ่งเป็นยาชูกำลังขับการเปลี่ยนแปลงในโทนิคด้วยการปล่อยโดปามีน แม้ว่าการยิงยาชูกำลังสามารถเปลี่ยนแปลงได้โดยแผลหรือยาเสพติด28เราไม่ทราบถึงการเปลี่ยนแปลงอย่างต่อเนื่องของอัตราการยิงในงานด้านพฤติกรรมใด ๆ การยิงสามารถลดระดับลงในช่วงเวลาประมาณ 1 วินาทีในระหว่างการคาดการณ์เหตุการณ์ที่เกี่ยวข้องกับแรงจูงใจ45,46. อย่างไรก็ตามการลดลงนี้เป็นสิ่งที่ตรงกันข้ามกับสิ่งที่จะต้องเพิ่มการปล่อยโดปามีนด้วยการคาดหวังผลตอบแทนและแทนที่จะมีความคล้ายคลึงกับลำดับของข้อผิดพลาดในการทำนายเชิงลบชั่วคราว47. แม้ว่าสัญญาณที่ยั่งยืนซึ่งเข้ารหัสอัตราผลตอบแทนอย่างต่อเนื่องอาจมีประโยชน์ในการคำนวณ30โดปามีนให้สัญญาณข้อผิดพลาดและค่าที่ผันผวนอย่างรวดเร็วแทน ยังคงมีความเป็นไปได้ที่จะคำนวณสัญญาณที่ยั่งยืนในขั้นตอนต่อไปโดยการส่งสัญญาณเซลล์ภายในทางเดินล่องของตัวรับโดปามีน
หลายกลุ่มสังเกตว่าการปล่อยโดปามีนแบบ ramping เป็นวิธีการให้รางวัลแก่หนู5,7,8,9,10,11สอดคล้องกับการเข้ารหัสความคาดหวังของรางวัลที่เพิ่มขึ้น บางคนแย้งว่าโดปามีนเหล่านี้สะท้อนให้เห็นถึง RPE เพียงอย่างเดียวโดยสมมติว่าหนูนั้นลืมค่าอย่างรวดเร็ว48 หรือว่าพวกเขามีชุดตัวแทนของรัฐที่บิดเบือน49. ความคิดหลังนี้ไม่ได้รับการสนับสนุนจากการสังเกตของเราว่าการปรับเพิ่มขึ้นอย่างรวดเร็วจากการทดลองไปสู่การทดลองบนพื้นฐานของความคาดหวังของรางวัลที่ได้รับการปรับปรุงให้แข็งแกร่งขึ้นภายในลำดับสั้น ๆ ของการให้รางวัลต่อเนื่อง 3e) โดยทั่วไปแล้วทฤษฎีใดก็ตามที่โดปามีนบ่งบอกถึง RPEs (สัญญาณการเรียนรู้) เพียงอย่างเดียวไม่สามารถอธิบายได้ว่ามีการเชื่อมต่อที่ดีระหว่าง Mesopimbic Dopamine และแรงจูงใจ16. แกน NAc ไม่จำเป็นสำหรับการตอบสนองที่ได้รับการฝึกฝนมาอย่างดีต่อสิ่งเร้าที่มีเงื่อนไข50. แกนโดปามีนของ NAc ดูเหมือนจะให้สัญญาณแบบไดนามิกที่สำคัญว่ามันคุ้มค่าที่จะจัดสรรเวลาและความพยายามในการทำงาน5,44แม้ว่าสัญญาณนี้จะไม่ปรากฏในการยิงเซลล์โดพามีน VTA
วิธีการ
สัตว์
ขั้นตอนการเลี้ยงสัตว์ทั้งหมดได้รับการอนุมัติจากคณะกรรมการสถาบัน University of Michigan หรือ University of California San Francisco เกี่ยวกับการใช้และการดูแลสัตว์ หนูตัวผู้ (300–500 กรัมทั้ง Long-Evans หรือ TH-Cre+ ด้วยพื้นหลังแบบยาว - อีแวนส์52) ได้รับการบำรุงรักษาบนไฟถอยหลัง 12: 12: รอบมืดและทดสอบในช่วงมืด หนูถูกตัดอาหารอย่างอ่อนโยนรับ 15 กรัมของห้องปฏิบัติการมาตรฐานหนูเชาเชาทุกวันนอกเหนือจากรางวัลอาหารที่ได้รับระหว่างการปฏิบัติงาน ไม่มีการคำนวณขนาดตัวอย่างล่วงหน้า ผู้วิจัยไม่ได้ถูกมองข้ามไปยังการจัดสรรระหว่างการทดลองและการประเมินผลลัพธ์
พฤติกรรม
การเตรียมการและการทดสอบจะดำเนินการในห้องปฏิบัติการ Med Associates ที่ควบคุมด้วยคอมพิวเตอร์ (25 ซม. × 30 ซม. ที่จุดที่กว้างที่สุด) โดยแต่ละห้องมีผนังเจาะรูจมูกห้ารูตามที่อธิบายไว้ก่อนหน้านี้5. Bandit-task เซสชันใช้พารามิเตอร์ต่อไปนี้: ความยาวของบล็อกคือการทดลอง 35-45 เลือกแบบสุ่มสำหรับแต่ละบล็อก พักไว้ก่อน Go cue คือ 500 – 1,500 ms (การกระจายแบบสม่ำเสมอ); ความน่าจะเป็นรางวัลด้านซ้าย - ขวาคือ 10, 50 และ 90% (สำหรับ electrophysiology, photometry, voltammetry และหนู microdialysis รายงานก่อนหน้านี้5) หรือ 20, 50 และ 80% (หนูที่เพิ่งได้รับการตรวจด้วยเครื่องไตเทียม)
อัตราการให้รางวัลในปัจจุบันถูกประเมินโดยใช้ตัวรวมรั่วตามเวลา53. อัตรารางวัลเพิ่มขึ้นทุกครั้งที่ได้รับรางวัลและสลายตัวชี้แจงในอัตราที่กำหนดโดยพารามิเตอร์ τ (เวลาเป็น s สำหรับอัตรารางวัลจะลดลง ~ 63% นั่นคือ 1 − 1 / e) สำหรับการวิเคราะห์ทั้งหมด τ ได้รับการคัดเลือกบนพื้นฐานของพฤติกรรมของหนูโดยเพิ่มความสัมพันธ์ (ลบ) ระหว่างอัตรารางวัลและบันทึก (เวลาแฝง) ในแต่ละเซสชัน ความสัมพันธ์ระหว่างโดพามีน forebrain และอัตราผลตอบแทนนั้นไม่ไวต่อตัวเลือกนี้มากนัก τ (รูปขยายข้อมูล 1).
ในการจัดประเภทช่วงการเปลี่ยนภาพเป็น 'เพิ่มขึ้น' หรือ 'ลดลง' ในอัตราผลตอบแทนเราเปรียบเทียบอัตรารางวัลโดยรวมที่รั่วไหลในช่วง 5 นาทีสุดท้ายของบล็อกกับอัตราผลตอบแทนเฉลี่ยในช่วง 8 นาทีแรกของบล็อกถัดไป
หนูที่ใช้สำหรับ electrophysiology และ photometry ยังทำภารกิจแนวทาง Pavlovian ในห้องปฏิบัติการเดียวกันโดยมีการจัดแสงในบ้านตลอดเซสชั่น สัญญาณการได้ยินสามตัว (2 kHz, 5 kHz และ 9 kHz) มีความสัมพันธ์กับความน่าจะเป็นของการส่งอาหารที่แตกต่างกัน (ถ่วงดุลระหว่างหนู) คิวจะเล่นเป็นจังหวะของโทนปิ๊ป (เปิด 100 มิลลิวินาที, ปิด 50 มิลลิวินาที) เป็นระยะเวลารวม 2.6 วินาทีตามด้วยระยะหน่วงเวลา 500 มิลลิวินาที ตัวชี้นำและการส่งมอบรางวัลที่ไม่ได้คาดการณ์ถูกจัดส่งตามลำดับหลอกสุ่มโดยมีช่วงเวลาระหว่างการทดลองที่แปรผัน (15–30 วินาที, การแจกแจงแบบสม่ำเสมอ)
Microdialysis
ศัลยกรรม
หนูถูกฝังทั้งสองข้างด้วย cannulae Guide (CMA, 830 9024) ในเยื่อหุ้มสมองและ striatum กลุ่มหนึ่ง (n = 8) ได้รับคำแนะนำ cannula 3.2 อันที่กำหนดเป้าหมาย prelimbic และ infralimbic cortex (anteroposterior (AP) +0.6 mm, mediolateral (ML) 1.4 mm เมื่อเทียบกับ bregma; และ dorsoventral (DV) 1.3 mm ใต้ผิวสมอง) และอีกอันที่กำหนดเป้าหมาย dorsomedial striatum และ nucleus accumbens ในซีกตรงข้าม (AP +1.9, ML 3.4 และ DV 5) รากฟันเทียมทั้งสองทำมุมห่างจากกัน XNUMX องศาตามแนวระนาบหางตา กลุ่มที่สอง (n = 4) ได้รับ cannula คำแนะนำหนึ่งอันที่กำหนดเป้าหมายไปยัง cingulate cortex ด้านหน้า (AP +1.6, ML 0.8 และ DV 0.8) และอีกอันที่กำหนดเป้าหมาย accumbens (แกน / เปลือกในซีกตรงข้ามที่ AP +1.6, ML 1.4 และ DV 5.5 (n = 2) หรือ AP +1.6, ML 1.9 และ DV 5.7 (n = 2). ด้านของรากเทียมถูกถ่วงดุลระหว่างหนู สัตว์ได้รับอนุญาตให้พักฟื้นเป็นเวลาหนึ่งสัปดาห์ก่อนที่จะฝึกใหม่
สารเคมี
น้ำเมทานอลและอะซิโทไนไตรล์สำหรับเฟสเคลื่อนที่เป็นเกรด HPLC ของ Burdick & Jackson ที่ซื้อจาก VWR (Radnor) สารเคมีอื่น ๆ ทั้งหมดซื้อจาก Sigma Aldrich เว้นแต่จะระบุไว้เป็นอย่างอื่น น้ำไขสันหลังเทียม (aCSF) ประกอบด้วย 145 mM NaCl, 2.68 mM KCl, 1.40 mM CaCl2, 1.01 mM MgSO4, 1.55 mM Na2HPO4 และ 0.45 mM NaH2PO4ปรับค่า pH เป็น 7.4 ด้วย NaOH เพิ่มแอสคอร์บิคแอซิด (250 nM ความเข้มข้นสุดท้าย) เพื่อลดการเกิดออกซิเดชันของ analytes
การเก็บตัวอย่างและ HPLC-MS
ในวันทดสอบสัตว์จะถูกนำไปวางไว้ในห้องผ่าตัดพร้อมกับเปิดไฟ โพลีอะคริโลไนไตรล์เมมเบรนที่กำหนดเองทำโพรบ microdialysis (1-mm dialysing เมมเบรน AN69; Hospal) ถูกแทรกสองข้างเข้าไปใน cannula คู่มือและ perfused อย่างต่อเนื่อง (Chemyx, Fusion 400) ด้วย aCSF ที่ 2 µl / นาทีสำหรับ 90 นาที หลังจากคอลเลคชั่นพื้นฐานของ 5-min ไฟดับก็ดับลงเพื่อให้สัตว์ใช้งานได้ การเก็บตัวอย่างดำเนินการต่อในช่วงเวลา 1 นาทีขั้นต่ำและกลุ่มตัวอย่างได้รับการดัดแปลงทันที54 ด้วยโซเดียมคาร์บอเนต 1.5 µl, 100 mM; 1.5 µl benzoyl chloride (2% (v / v) benzoyl chloride ใน acetonitrile); และส่วนผสมมาตรฐานภายในที่ติดฉลากด้วยไอโซโทป 1.5 µl เจือจางในอะซิโทไนไตรล์ 50% (v / v) ที่มีกรดซัลฟิวริก 1% (v / v) และแทงด้วย ACh และโคลีน (ไอโซโทป C / D / N) ที่มีความเข้มข้นสุดท้าย 20 นาโนเมตร การเก็บชุดตัวอย่างสลับไปมาระหว่างโพรบทั้งสองในช่วงเวลา 30 วินาทีในแต่ละครั้งจาก 26 เซสชันยกเว้นเซสชันหนึ่งที่เมมเบรนที่แตกทำให้ได้เพียงชุดเดียว (ทั้งหมด 51 ชุดตัวอย่าง) วิเคราะห์ตัวอย่างโดยใช้ระบบ Thermo Scientific UHPLC (Accela หรือ Vanquish Horizon เชื่อมต่อกับเครื่องสเปกโตรมิเตอร์มวลควอนตัมอัลตร้าสามเท่าสี่เท่าที่ติดตั้งหัววัด HESI II ESI) ซึ่งทำงานในการตรวจสอบปฏิกิริยาหลายอย่าง ตัวอย่างห้าไมโครลิตรถูกฉีดลงบนคอลัมน์ Phenomenex core-shell biphenyl Kinetex HPLC (2.1 มม. × 100 มม.) เฟสเคลื่อนที่ A คือแอมโมเนียม 10 mM ในรูปแบบด้วยกรดฟอร์มิก 0.15% และเฟสเคลื่อนที่ B คืออะซิโทไนไตร เฟสเคลื่อนที่ได้รับการไล่ระดับการชะล้างที่ 450 µl / นาทีดังนี้เริ่มต้น 0% B; 0.01 นาที 19% B; 1 นาที 26% B; 1.5 นาที 75% B; 2.5 นาที 100% B; 3 นาที 100% B; 3.1 นาที 5% B; และ 3.5 นาที 5% B. Thermo Xcalibur QuanBrowser (Thermo Fisher Scientific) ถูกใช้เพื่อประมวลผลและรวมยอดโดยอัตโนมัติ แต่ละยอด> 100,000 ยอดถูกตรวจสอบด้วยสายตาเป็นรายบุคคลเพื่อให้แน่ใจว่ามีการผสานรวมที่เหมาะสม
การวิเคราะห์
ข้อมูลความเข้มข้นทางประสาทวิทยาทั้งหมดถูกทำให้ราบรื่นด้วยค่าเฉลี่ยเคลื่อนที่สามจุด (y′= [0.25 × (y−1) + 0.5y + 0.25 × (y+ 1)]) และ z- ให้คะแนนปกติภายในแต่ละเซสชันเพื่ออำนวยความสะดวกในการเปรียบเทียบระหว่างเซสชัน สำหรับแต่ละภูมิภาคเป้าหมายจะมีการสร้าง cross-correlogram สำหรับแต่ละเซสชันและมีการพล็อตค่าเฉลี่ยของเซสชัน ขอบเขตความเชื่อมั่นร้อยละหนึ่งถูกสร้างขึ้นสำหรับแต่ละแผนภาพย่อยโดยการสับชุดครั้งเดียว 100,000 ครั้งและสร้างการแจกแจงค่าสัมประสิทธิ์สหสัมพันธ์สำหรับแต่ละเซสชัน แบบจำลองการถดถอยหลายแบบถูกสร้างขึ้นโดยใช้ฟังก์ชันการถดถอยใน MATLAB โดยมี neurochemical เป็นตัวแปรผลลัพธ์และตัวชี้วัดพฤติกรรมเป็นตัวทำนาย ค่าสัมประสิทธิ์การถดถอยถูกกำหนดอย่างมีนัยสำคัญที่ระดับอัลฟาสามระดับ (0.05, 0.0005 และ 0.000005) หลังจากการแก้ไขด้วย Bonferroni สำหรับการเปรียบเทียบหลายรายการ (alpha / (สารเคมี 21 ตัว× 7 ภูมิภาค× 9 ตัวปรับพฤติกรรม) สำหรับการวิเคราะห์ข้อมูลการเปลี่ยนบล็อกถูกทิ้งไว้ในช่วงเวลา 3 นาทีโดยทิ้งตัวอย่างที่รวมเวลาการเปลี่ยน
electrophysiology
หนู (n = 25) ได้รับการปลูกถ่ายด้วยออปโตรด์ที่ออกแบบเองได้ซึ่งแต่ละอันประกอบด้วย 16 tetrodes (สร้างจากลวดนิโครมขนาด 12.5 µm, Sandvik) ติดกาวที่ด้านข้างของใยแก้วนำแสง 200 µm และขยายได้ถึง 500 µm ใต้ปลายเส้นใย ในระหว่างการผ่าตัดครั้งเดียวกันเราฉีด AAV1 / 2-EF5a-DIO-ChR1 (H2R) -EYFP 134 l เข้าไปใน VTA ด้านข้าง (AP 5.6, ML 0.8, DV 7.5) หรือแกน NAc (AP 1.6, ML 1.6, DV 6.4) . สัญญาณสมองแบบไวด์แบนด์ (1–9,000 เฮิรตซ์) ได้รับการสุ่มตัวอย่าง (30,000 ตัวอย่างต่อวินาที) โดยใช้อินทันดิจิทัลเฮดสเตจ Optrodes ลดลงอย่างน้อย 80 µm เมื่อสิ้นสุดการบันทึกแต่ละครั้ง แต่ละหน่วยถูกแยกออฟไลน์โดยใช้ MATLAB การใช้งาน MountainSort55 ตามด้วยการตรวจสอบด้วยตนเองอย่างระมัดระวัง
การจัดหมวดหมู่
เพื่อระบุว่าหน่วย VTA-l ที่แยกได้เป็นโดปามินอจิค (TH)+) เราใช้การทดสอบความหน่วงแฝงที่เกี่ยวข้อง56. กล่าวโดยสรุปในตอนท้ายของการทดลองแต่ละครั้งเราเชื่อมโยง optrode กับเลเซอร์ไดโอดและส่งรถไฟพัลส์แสงที่มีความกว้างและความถี่ที่แตกต่างกัน สำหรับหน่วยที่จะระบุว่าตอบสนองแสงจะต้องถึงระดับความสำคัญของ P <0.001 สำหรับรถไฟพัลส์ 5 มิลลิวินาทีและ 10 มิลลิวินาที นอกจากนี้เรายังเปรียบเทียบรูปคลื่นที่เกิดจากแสง (ภายใน 10 มิลลิวินาทีของการเริ่มต้นของพัลส์เลเซอร์) กับค่าเฉลี่ยทั้งเซสชัน หน่วยที่ทำให้เกิดแสงทั้งหมดมีค่าสัมประสิทธิ์สหสัมพันธ์แบบเพียร์สัน> 0.9 เซลล์ประสาทโดปามีนได้รับการบันทึกสำเร็จจากหนูสี่ตัวที่มีการฉีด VTA-l AAV (IM657, 1 หน่วย; IM1002, 3 หน่วย; IM1003, 15 หน่วย; IM1037, 9 หน่วย) และหนูหนึ่งตัวที่มี NAc core AAV (IM-1078, 2 หน่วย) . ความกว้างสูงสุดถูกกำหนดให้เป็นค่าสูงสุดเต็มความกว้างครึ่งหนึ่งขององค์ประกอบเชิงลบที่โดดเด่นที่สุดของรูปคลื่นขัดขวางโดยเฉลี่ย เซลล์ประสาท VTA ที่ไม่ติดแท็กที่มีอัตราการยิงทั้งเซสชัน> 20 เฮิรตซ์และความกว้างสูงสุด <200 µ ถูกจัดว่าเป็นเซลล์ที่ไม่ใช่โดปามีน เพื่อให้แน่ใจว่าเรากำลังเปรียบเทียบเซลล์โดปามีนและเซลล์ที่ไม่ใช่โดปามีนภายในภูมิภาคย่อยเดียวกันเราจะวิเคราะห์เฉพาะเซลล์ที่ไม่ใช่โดปามีนที่บันทึกไว้ในระหว่างการประชุมที่มีเซลล์โดพามีนที่ติดแท็กอย่างน้อยหนึ่งเซลล์
การวิเคราะห์
ตรวจพบการระเบิดอย่างรวดเร็วด้วยวิธีการ 'ต้นแบบ 80 / 160'57: ทุกครั้งที่เกิด inter-spike-interval ที่ 80 ms หรือน้อยกว่า spikes เหล่านี้และที่ตามมาจะถือเป็นส่วนหนึ่งของการระเบิดจนกว่าจะมีช่วง 160 ms ขึ้นไป สำหรับการเปรียบเทียบการยิง 'ยาชูกำลัง' กับอัตราการให้รางวัล dopamine spikes ถูกนับในถังขยะ 1 นาที เพื่อตรวจสอบการเปลี่ยนแปลงที่เร็วขึ้นฟังก์ชันความหนาแน่นของเข็มถูกสร้างขึ้นโดยการโน้มน้าวรถไฟขัดขวางด้วยเคอร์เนล Gaussian ที่มีความแปรปรวน 20 ms ในการตรวจสอบว่าเซลล์ประสาทตอบสนองต่อคิวที่กำหนดเร็วเพียงใดเราใช้ถังขยะ 40 มิลลิวินาที (เลื่อนในขั้นตอนที่ 20 มิลลิวินาที) และใช้การทดสอบแบบสุ่ม (10,000 การสับเปลี่ยน) สำหรับแต่ละครั้งที่มีการเปรียบเทียบอัตราการยิงหลังจากเริ่มคิวกับอัตราการยิงใน 250 ms นำหน้าคิวทันที ถังแรกที่อัตราการยิงหลังคิวมีนัยสำคัญ (P <0.01 การแก้ไขสำหรับการเปรียบเทียบหลายรายการ) ที่มากกว่าการยิงพื้นฐานถือเป็นเวลาในการกำหนดคิวการตอบสนอง
อัตราการยิงสูงสุดถูกคำนวณเป็นอัตราการยิงสูงสุด (แบบเกาส์เนียน) ของแต่ละการทดลองในหน้าต่าง 250-ms หลังจากเข้าข้างสำหรับการทดลองที่ได้รับรางวัลและหุบเขาถูกคำนวณเป็นอัตราการยิงขั้นต่ำในหน้าต่าง 2-s เริ่มต้น หนึ่งวินาทีหลังจากการเข้าข้างเพื่อการทดลองที่ไม่ได้รับการตอบกลับ
ในการคำนวณมุมทางลาดในระหว่างการเข้าใกล้เราปรับอัตราการยิงด้วยเคอร์เนล Gaussian 50-ms ตรวจพบสูงสุด / ต่ำสุดของสัญญาณที่เกิดขึ้นในหน้าต่าง 0.5-s ก่อนแต่ละเหตุการณ์ (กึ่งกลางหรือด้านอาหารเข้า) ) และวัดมุมที่เซ็นชื่อซึ่งเชื่อมต่อทั้งสอง extrema เพื่อเปรียบเทียบอัตราการยิงในบล็อกรางวัล 'สูง' และ 'ต่ำ' สำหรับแต่ละเซสชั่นเราได้ทำการแบ่งค่าเฉลี่ยของอัตราการรั่วไหลของผู้รวบรวมรวมเฉลี่ยในแต่ละบล็อก
แบบจำลองเชิงปริมาตรและการคำนวณ
ผลการวิเคราะห์โวลแทมเมทรีแบบวงกลมที่สแกนอย่างรวดเร็วแสดงที่นี่เพื่อวิเคราะห์ข้อมูลที่แสดงรายละเอียดก่อนหน้านี้อีกครั้ง5. การประมาณภายในการทดลองของค่าสถานะและข้อผิดพลาดในการทำนายผลตอบแทนถูกคำนวณโดยใช้รูปแบบการเรียนรู้เสริมกระบวนการตัดสินใจกึ่งมาร์คอฟตามที่อธิบายไว้ก่อนหน้านี้5.
วัดแสง
เราใช้วิธีการทางไวรัสเพื่อแสดงเซ็นเซอร์แสงโดปามีนที่เข้ารหัสทางพันธุกรรม dLight15. ภายใต้การระงับความรู้สึกแบบ isoflurane, 1 μlของ AAV9-CAG-dLight (1 × 1012 จีโนมของไวรัสต่อมิลลิลิตร UC Davis vector core) ถูกฉีดอย่างช้าๆ (100 nl / min) (Nanoject III, Drummond) ผ่านไมโครปิเปตแก้วขนาด 30 µm ในหน้าท้อง striatum ทั้งสองข้าง (AP: 1.7 mm, ML: 1.7 mm, DV: −7.0 mm) ในระหว่างการผ่าตัดใยแก้วนำแสงแบบเดียวกัน (แกน 400 มม., เส้นผ่านศูนย์กลางรวม 430 มม.) ที่ติดกับปลอกโลหะ (Doric) ถูกใส่เข้าไป (ความลึกของเป้าหมายสูงกว่า AAV 200 µm) และประสานเข้าที่ มีการรวบรวมข้อมูล> สามสัปดาห์ต่อมาเพื่ออนุญาตให้มีการแสดงออกของ dLight
สำหรับไฟกระตุ้น dLight สีน้ำเงิน (470 นาโนเมตร) และสีม่วง (405 นาโนเมตร; การควบคุม) LED ถูกมอดูเลตแบบไซน์ที่ความถี่ต่างกัน (211 เฮิร์ตซ์และ 531 เฮิร์ตซ์ตามลำดับ58). ทั้งสัญญาณกระตุ้นและการปล่อยสัญญาณที่ส่งผ่านตัวกรองมินิคิวบ์ (Doric) และการเรืองแสงจำนวนมากถูกวัดด้วยเครื่องตรวจจับ femtowatt (Newport รุ่น 2151) ที่ 10 kHz Demodulation สร้างสัญญาณ 470 nm (dopamine) และ 405 nm (control) แยกจากกันซึ่งจะถูกปรับขนาดให้เข้ากันโดยใช้รูปสี่เหลี่ยมจัตุรัสน้อยที่สุด58. สัญญาณเรืองแสงแบบเศษส่วน (dF/F) ถูกกำหนดให้เป็น (470–405_fit) / 405_fit สำหรับการวิเคราะห์ทั้งหมดสัญญาณนี้ลดลงเป็น 50 Hz และปรับให้เรียบด้วยฟิลเตอร์ค่ามัธยฐานห้าจุด สำหรับการนำเสนอสัญญาณ 470 nm และ 405 nm แยกกันโปรดดู Extended Data Fig 7.
ข้อมูลจากการวางตำแหน่งใยแก้วนำแสงถูกรวมอยู่ในการวิเคราะห์ว่าปลายไฟเบอร์อยู่ใน NAc และการตอบสนองเรืองแสงต่อคิวงานอย่างน้อยหนึ่งคิวมี z- คะแนน> 1 เกณฑ์เหล่านี้ไม่รวมหนู 1065 ตัวและให้หนูสามตัว / สี่ตำแหน่ง (IM1066 ซ้าย IM1089 ทวิภาคี IM1.1 ขวา) สำหรับ dLight1088 และหนูสี่ตัว / หกตำแหน่ง (IM1105- ทวิภาคี IM1106 ขวา IM1107 ทวิภาคี IM1.3-right) สำหรับ dLight1.1b. ได้ผลลัพธ์ที่คล้ายกันสำหรับ dLight1.3 และ dLightXNUMX (Extended Data Fig. 7) ดังนั้นข้อมูลถูกรวมเข้าด้วยกัน
ในการคำนวณมุมทางลาดในระหว่างพฤติกรรมของวิธีการเราตรวจพบสูงสุด / ต่ำสุดของสัญญาณที่เกิดขึ้นในหน้าต่าง 0.5-s ก่อนแต่ละเหตุการณ์ (กึ่งกลางหรือด้านอาหารพอร์ต) และวัดมุมที่เซ็นชื่อซึ่งเชื่อมต่อสอง extrema
ความเกี่ยวข้องและความจำเพาะของโมเลกุลของ dLight1.3b
ทำการวัดในหลอดทดลองตามที่อธิบายไว้ก่อนหน้านี้15. กล่าวโดยสรุปเซลล์ HEK293T (ATCC CRL # 1573) ได้รับการเพาะเลี้ยงและแปลงสภาพด้วยการเข้ารหัสพลาสมิด dlight1.3b ที่ขับเคลื่อนโดย CMV ก่อการและล้างด้วย HBSS (Life Technologies) เสริมด้วย Ca2+ (4mM) และ Mg2+ (2 mM) ก่อนถ่ายภาพ การถ่ายภาพดำเนินการโดยใช้วัตถุประสงค์ที่ใช้น้ำมัน 40 ×บนกล้องจุลทรรศน์คอนโฟคอล Zeiss Observer LSN710 แบบกลับด้านที่มีความยาวคลื่น 488 นาโนเมตร / 513 นาโนเมตร (การกระตุ้น / การปล่อย) สำหรับการทดสอบการตอบสนองการเรืองแสงของเซ็นเซอร์สารสื่อประสาทจะถูกนำไปใช้โดยตรงกับอ่างอาบน้ำในระหว่างการถ่ายภาพตามเวลาในการทดลองอิสระอย่างน้อยสองครั้ง การไตเตรทของ dopamine และ noradrenaline ได้มาจากการเจือจางแบบอนุกรม 100 เท่าเพื่อให้ได้ความเข้มข้นที่แตกต่างกันแปดระดับ สารสื่อประสาทอื่น ๆ ทั้งหมดได้รับการทดสอบที่ความเข้มข้นตามลำดับสามระดับ (1 nM, 10 µM และ 1 µM) ความเข้มข้นของสารสื่อประสาททั้งหมดได้มาจากการเจือจางจากความเข้มข้นของสต็อก XNUMX mM ใน HBSS ซึ่งเตรียมสด ความเข้มของการเรืองแสงดิบจากการถ่ายภาพตามเวลาถูกวัดปริมาณบนฟิจิ ROI แต่ละตัวถูกวาดด้วยตนเองบนเยื่อหุ้มเซลล์ การเปลี่ยนพับเรืองแสง (ΔF/F) คำนวณเป็น F จุดสูงสุด (ความเข้มของการเรืองแสงเฉลี่ยที่สี่เฟรม) - F basal (ค่าเฉลี่ยความเข้มแสงฟลูออเรสเซนต์ของสี่เฟรมก่อนเติมแกนด์) /F เป็นมูลฐาน กราฟและการวิเคราะห์ทางสถิติได้ดำเนินการโดยใช้ GraphPad Prism 6 มีการวิเคราะห์จุดข้อมูลด้วยเส้นโค้งการโยงเฉพาะที่พอดีเพื่อรับ Kd ค่า ในพล็อตแบบกล่องและมัสสุกล่องจะครอบคลุมช่วง 25% ถึง 75% และหนวดจะขยายจากค่าต่ำสุดไปเป็นค่าสูงสุด
สรุปการรายงาน
ข้อมูลเพิ่มเติมเกี่ยวกับการออกแบบการวิจัยมีอยู่ใน สรุปรายงานการวิจัยธรรมชาติ เชื่อมโยงกับบทความนี้
ความพร้อมใช้งานของข้อมูล
ไวรัส AAV.Synapsin.dLight1.3b ที่ใช้ในการศึกษาครั้งนี้ได้ถูกฝากไว้กับ Addgene (หมายเลข 125560; http://www.addgene.org). ข้อมูลทั้งหมดจะพร้อมใช้งานผ่านทางเว็บไซต์แบ่งปันข้อมูลการวิจัยทางประสาทวิทยาคอมพิวเตอร์ (Collaborative Research in Computational Neuroscience) (https://doi.org/110.6080/K0VQ30V9).
รหัสห้องว่าง
รหัส MATLAB ที่กำหนดเองสามารถขอได้จาก JDB
ข้อมูลเพิ่มเติม
หมายเหตุของสำนักพิมพ์: Springer Nature ยังคงเป็นกลางเกี่ยวกับการอ้างสิทธิ์ในเขตอำนาจศาลในแผนที่ที่ตีพิมพ์และหน่วยงานสังกัด
อ้างอิง
- 1.
Schultz, W. , Dayan, P. & Montague, PR พื้นผิวประสาทของการทำนายและการให้รางวัล วิทยาศาสตร์ 275, 1593 – 1599 (1997)
- 2.
Pan, WX, Schmidt, R. , Wickens, JR & Hyland, เซลล์ BI Dopamine ตอบสนองต่อเหตุการณ์ที่คาดการณ์ไว้ในระหว่างการปรับสภาพแบบคลาสสิก: หลักฐานสำหรับการติดตามการมีสิทธิ์ในเครือข่ายการเรียนรู้ที่ได้รับรางวัล J. Neurosci. 25, 6235 – 6242 (2005)
- 3.
Cohen, JY, Haesler, S. , Vong, L. , Lowell, BB & Uchida, N. สัญญาณเฉพาะชนิดของเซลล์ประสาทสำหรับการให้รางวัลและการลงโทษในบริเวณหน้าท้อง ธรรมชาติ 482, 85 – 88 (2012)
- 4.
Steinberg, EE และคณะ การเชื่อมโยงเชิงสาเหตุระหว่างข้อผิดพลาดในการทำนายเซลล์โดปามีนและการเรียนรู้ ชัยนาท Neurosci. 16, 966 – 973 (2013)
- 5.
ฮามิด, AA และคณะ โดปามีน Mesolimbic ส่งสัญญาณค่าของการทำงาน ชัยนาท Neurosci. 19, 117 – 126 (2016)
- 6.
Saunders, BT, Richard, JM, Margolis, EB & Janak, PH Dopamine neurons สร้างสิ่งเร้าแบบ Pavlovian ที่มีคุณสมบัติสร้างแรงบันดาลใจที่กำหนดโดยวงจร ชัยนาท Neurosci. 21, 1072 – 1083 (2018)
- 7.
Phillips, PE, Stuber, GD, Heien, ML, Wightman, RM & Carelli, RM Subsecond dopamine release ส่งเสริมการแสวงหาโคเคน ธรรมชาติ 422, 614 – 618 (2003)
- 8.
Roitman, MF, Stuber, GD, Phillips, PE, Wightman, RM & Carelli, RM Dopamine ทำงานเป็นโมดูเลเตอร์รองลงมาของการแสวงหาอาหาร J. Neurosci. 24, 1265 – 1271 (2004)
- 9.
Wassum, KM, Ostlund, SB & Maidment, NT Phasic mesolimbic dopamine ส่งสัญญาณนำหน้าและทำนายประสิทธิภาพของภารกิจลำดับการดำเนินการที่เริ่มต้นด้วยตนเอง Biol จิตเวช 71, 846 – 854 (2012)
- 10.
Howe, MW, Tierney, PL, Sandberg, SG, Phillips, PE & Graybiel, AM การส่งสัญญาณโดปามีนเป็นเวลานานในสัญญาณ striatum ความใกล้เคียงและมูลค่าของรางวัลที่อยู่ห่างไกล ธรรมชาติ 500, 575 – 579 (2013)
- 11.
Syed, EC และคณะ การเริ่มต้นแอคชั่นมีรูปแบบการเข้ารหัสโดปามีน mesolimbic ของรางวัลในอนาคต ชัยนาท Neurosci. 19, 34 – 36 (2016)
- 12.
Morris, G. , Nevet, A. , Arkadir, D. , Vaadia, E. & Bergman, H. เซลล์ประสาทโดปามีนของ Midbrain เข้ารหัสการตัดสินใจสำหรับการกระทำในอนาคต ชัยนาท Neurosci. 9, 1057 – 1063 (2006)
- 13.
da Silva, JA, Tecuapetla, F. , Paixão, V. & Costa, RM กิจกรรมของเซลล์ประสาทโดปามีนก่อนที่จะเริ่มดำเนินการประตูและกระตุ้นการเคลื่อนไหวในอนาคต ธรรมชาติ 554, 244 – 248 (2018)
- 14.
Fiorillo, CD, Tobler, PN & Schultz, W. การเข้ารหัสแบบไม่ต่อเนื่องของความน่าจะเป็นของรางวัลและความไม่แน่นอนโดยเซลล์ประสาทโดปามีน วิทยาศาสตร์ 299, 1898 – 1902 (2003)
- 15.
Patriarchi, T. , Cho, JR, Merten, K. , Howe, MW, et al. การถ่ายภาพเซลล์ประสาทเร็วมากของโดปามีนพร้อมด้วยเซ็นเซอร์เข้ารหัสทางพันธุกรรมที่ออกแบบมา วิทยาศาสตร์ 360, eaat4422 (2018)
- 16.
Salamone, JD & Correa, M. หน้าที่สร้างแรงบันดาลใจลึกลับของ mesolimbic dopamine เซลล์ประสาท 76, 470 – 485 (2012)
- 17.
Schultz, W. สัญญาณรางวัล Predictive ของเซลล์ประสาทโดปามีน J. Neurophysiol. 80, 1 – 27 (1998)
- 18.
Garris, PA & Wightman, RM จลนศาสตร์ที่แตกต่างกันควบคุมการส่งผ่าน dopaminergic ใน amygdala, prefrontal cortex และ striatum: การศึกษาโวลแทมเมทริกในร่างกาย J. Neurosci. 14, 442 – 450 (1994)
- 19.
Frank, MJ, Doll, BB, Oas-Terpstra, J. & Moreno, F. ยีนโดปามิเนอร์จิกส่วนหน้าและส่วนหน้าทำนายความแตกต่างของแต่ละบุคคลในการสำรวจและการแสวงหาผลประโยชน์ ชัยนาท Neurosci. 12, 1062 – 1068 (2009)
- 20.
St Onge, JR, Ahn, S. , Phillips, AG & Floresco, SB ความผันผวนแบบไดนามิกของ dopamine efflux ในเปลือกนอกส่วนหน้าและนิวเคลียสเกิดขึ้นในระหว่างการตัดสินใจตามความเสี่ยง J. Neurosci. 32, 16880 – 16891 (2012)
- 21.
Bartra, O. , McGuire, JT & Kable, JW ระบบการประเมินค่า: การวิเคราะห์เมตาดาต้าตามพิกัดของการทดลอง BOLD fMRI ที่ตรวจสอบความสัมพันธ์ทางประสาทของค่าอัตนัย Neuroimage 76, 412 – 427 (2013)
- 22.
Ikemoto, S. Dopamine ให้รางวัลวงจร: สองระบบการฉายภาพจากหน้าท้องส่วนกลางไปจนถึงนิวเคลียส accumbens-olfactory tubercle ที่ซับซ้อน ความต้านทานของสมอง ความต้านทานของสมอง การหมุนรอบ. 56, 27 – 78 (2007)
- 23.
Breton, JM และคณะ การมีส่วนร่วมและการทำแผนที่ของโดปามีนพื้นที่หน้าท้องและเซลล์ประสาท GABA โดยการฉายภาพเป้าหมายในหนู J. คอมพ์ Neurol. (2018)
- 24.
Ungless, MA, Magill, PJ & Bolam, JP การยับยั้งเซลล์ประสาทโดพามีนในบริเวณหน้าท้องโดยสิ่งเร้าที่ไม่ชอบ วิทยาศาสตร์ 303, 2040 – 2042 (2004)
- 25.
Morales, M. & Margolis, EB Ventral tegmental area: cellular heterogeneity, connectivity and behavior. ชัยนาท รายได้ Neurosci. 18, 73 – 85 (2017)
- 26.
Morris, G. , Arkadir, D. , Nevet, A. , Vaadia, E. & Bergman, H. บังเอิญ แต่เป็นข้อความที่แตกต่างกันของโดพามีนในสมองส่วนกลางและเซลล์ประสาทที่ใช้งานโทนเสียง striatal เซลล์ประสาท 43, 133 – 143 (2004)
- 27.
Floresco, SB, West, AR, Ash, B. , Moore, H. & Grace, การมอดูเลตของเซลล์ประสาทโดปามีน AA Afferent จะควบคุมการส่งผ่านโทนิคและเฟสโดพามีน ชัยนาท Neurosci. 6, 968 – 973 (2003)
- 28.
เกรซ, AA การกำจัดของระบบโดปามีนในพยาธิสรีรวิทยาของโรคจิตเภทและภาวะซึมเศร้า ชัยนาท รายได้ Neurosci. 17, 524 – 532 (2016)
- 29.
Cohen, JY, Amoroso, MW & Uchida, N. เซลล์ประสาท Serotonergic ส่งสัญญาณให้รางวัลและการลงโทษในหลายช่วงเวลา eLife 4, e06346 (2015)
- 30.
Niv, Y. , Daw, N. & Dayan, P. ทำงานเร็วแค่ไหน: ตอบสนองแรงกระตุ้นและโทนิคโดพามีน Adv ระบบประสาท กระบวนการ. Syst. 18, 1019 (2006)
- 31.
Bayer, HM, Lau, B. & Glimcher, PW สถิติของเซลล์ประสาทโดปามีนสมองส่วนกลางขัดขวางรถไฟในเจ้าคณะที่ตื่นตัว J. Neurophysiol. 98, 1428 – 1439 (2007)
- 32.
Chergui, K. , Suaud-Chagny, MF & Gonon, F. Neuroscience 62, 641 – 645 (1994)
- 33.
ปาร์กเกอร์, NF และคณะ การให้รางวัลและการเข้ารหัสทางเลือกในขั้วของเซลล์ประสาทโดปามีนในสมองส่วนกลางนั้นขึ้นอยู่กับเป้าหมายของการตาย ชัยนาท Neurosci. 19, 845 – 854 (2016)
- 34.
Menegas, W. , Babayan, BM, Uchida, N. & Watabe-Uchida, M. ตรงข้ามกับการเริ่มต้นกับสัญญาณใหม่ในการส่งสัญญาณโดปามีนในหน้าท้องและหลัง striatum ในหนู eLife 6, e21886 (2017)
- 35.
Trulson, ME บันทึกพร้อมกันของเซลล์ประสาท substantia nigra และการปล่อยโดปามีนใน voltammetric ในหางแมวที่มีพฤติกรรม ความต้านทานของสมอง วัว. 15, 221 – 223 (1985)
- 36.
Glowinski, J. , Chéramy, A. , Romo, R. & Barbeito, L. ระเบียบ Presynaptic ของการแพร่กระจาย dopaminergic ใน striatum เซลล์ mol Neurobiol. 8, 7 – 17 (1988)
- 37.
Zhou, FM, Liang, Y. & Dani, JA กิจกรรม cholinergic ของนิโคตินภายนอกควบคุมการปลดปล่อยโดปามีนใน striatum ชัยนาท Neurosci. 4, 1224 – 1229 (2001)
- 38.
Threlfell, S. และคณะ การปลดปล่อยโดปามีนใน Striatal นั้นเกิดขึ้นจากการซิงโครไนซ์ของกิจกรรมใน cholinergic interneurons เซลล์ประสาท 75, 58 – 64 (2012)
- 39.
Cachope, R. et al. การกระตุ้นการเลือกใช้งานของ cholinergic interneurons ช่วยเพิ่มการปล่อยสาร dopamine phasic accumbal: การตั้งค่าเสียงสำหรับการประมวลผลรางวัล รายงานเซลล์ 2, 33 – 41 (2012)
- 40.
Sulzer, D. , Cragg, SJ & Rice, ME Striatal dopamine neurotransmission: การควบคุมการปลดปล่อยและการดูดซึม Basal Ganglia 6, 123 – 148 (2016)
- 41.
Floresco, SB, Yang, CR, Phillips, AG & Blaha, CD Basolateral amygdala กระตุ้นกระตุ้นให้เกิด dopamine ที่ขึ้นกับตัวรับ glutamate ในนิวเคลียส accumbens ของหนูที่ไม่ได้รับยาสลบ Eur J. Neurosci. 10, 1241 – 1251 (1998)
- 42.
Jones, JL และคณะ amygdala basolateral ปรับการปล่อยโดปามีนขั้วในนิวเคลียส accumbens และการตอบสนองปรับอากาศ Biol จิตเวช 67, 737 – 744 (2010)
- 43.
Schultz, W. การตอบสนองของเซลล์ประสาทโดปามีนในสมองส่วนกลางเพื่อกระตุ้นการกระตุ้นพฤติกรรมในลิง J. Neurophysiol. 56, 1439 – 1461 (1986)
- 44.
Berke, JD โดปามีนหมายถึงอะไร? ชัยนาท Neurosci. 21, 787 – 793 (2018)
- 45.
Bromberg-Martin, ES, Matsumoto, M. & Hikosaka, O. ยาชูกำลังที่แตกต่างและกิจกรรมที่คาดว่าจะเป็นเฟสใน habenula ด้านข้างและเซลล์ประสาทโดปามีน เซลล์ประสาท 67, 144 – 155 (2010)
- 46.
Pasquereau, B. & Turner, เซลล์ประสาท RS Dopamine เข้ารหัสข้อผิดพลาดในการทำนายการเกิดทริกเกอร์การเคลื่อนไหว J. Neurophysiol. 113, 1110 – 1123 (2015)
- 47.
Fiorillo, CD, Newsome, WT & Schultz, W. ความแม่นยำชั่วคราวของการทำนายรางวัลในเซลล์ประสาทโดปามีน ชัยนาท Neurosci. 11, 966 – 973 (2008)
- 48.
Morita, K. & Kato, A. การขึ้นลงของโดพามีน Striatal อาจบ่งบอกถึงการเรียนรู้การเสริมแรงที่ยืดหยุ่นโดยลืมในวงจรปมประสาทของคอร์ติโก - เบส ด้านหน้า วงจรประสาท 8, 36 (2014)
- 49.
Gershman, SJ Dopamine เป็นผลมาจากข้อผิดพลาดในการทำนายรางวัล การคำนวณของระบบประสาท. 26, 467 – 471 (2014)
- 50.
Nicola, SM สมมติฐานที่ยืดหยุ่น: การรวมกันของความพยายามและสมมติฐานตอบสนองคิวสำหรับบทบาทของนิวเคลียส accumbens โดปามีนในการเปิดใช้งานของพฤติกรรมการแสวงหารางวัล J. Neurosci. 30, 16585 – 16600 (2010)
- 51.
Paxinos, G. & Watson, C. สมองหนูในพิกัด stereotaxic 5th edn (Elsevier Academic, 2005)
- 52.
Witten, IB และคณะ Recombinase-driver rat lines: เครื่องมือเทคนิคและการใช้ออพโตเจติคเพื่อเสริมแรงโดปามีน เซลล์ประสาท 72, 721 – 733 (2011)
- 53.
Sugrue, LP, Corrado, GS & Newsome, WT Matching behavior และการแทนค่าในเยื่อหุ้มสมองข้างขม่อม วิทยาศาสตร์ 304, 1782 – 1787 (2004)
- 54.
วงศ์ JM และอัล Benzoyl คลอไรด์ derivatization ด้วยของเหลว chromatography - มวลสารสำหรับเป้าหมาย metabolomics ของ neurochemicals ในตัวอย่างทางชีวภาพ J. Chromatogr 1446, 78 – 90 (2016)
- 55.
Chung, JE และคณะ วิธีการแบบอัตโนมัติเต็มรูปแบบเพื่อขัดขวางการจัดเรียง เซลล์ประสาท 95, 1381 – 1394 (2017)
- 56.
Kvitsiani, D. และคณะ พฤติกรรมที่แตกต่างและเครือข่ายมีความสัมพันธ์กับสองประเภท interneuron ในเยื่อหุ้มสมอง prefrontal ธรรมชาติ 498, 363 – 366 (2013)
- 57.
Grace, AA & Bunney, BS การควบคุมรูปแบบการยิงในเซลล์ประสาทโดพามีนนิกรัล: การยิงระเบิด J. Neurosci. 4, 2877 – 2890 (1984)
- 58.
Lerner, TN และคณะ การวิเคราะห์ในสมองและสมองเปิดเผยข้อมูลที่แตกต่างที่ดำเนินการโดย SNC dopamine subcircuits เซลล์ 162, 635 – 647 (2015)
กิตติกรรมประกาศ
เราขอขอบคุณ P. Dayan, H. Fields, L. Frank, C. Donaghue และ T. Faust สำหรับความคิดเห็นของพวกเขาเกี่ยวกับต้นฉบับฉบับแรกและ V. Hetrick, R. Hashim และ T. Davidson สำหรับความช่วยเหลือและคำแนะนำทางเทคนิค งานนี้ได้รับการสนับสนุนจากสถาบันยาเสพติดแห่งชาติสถาบันสุขภาพจิตแห่งชาติสถาบันแห่งชาติด้านความผิดปกติของระบบประสาทและโรคหลอดเลือดสมองมหาวิทยาลัยมิชิแกนแอนอาร์เบอร์และมหาวิทยาลัยแคลิฟอร์เนียซานฟรานซิสโก
ข้อมูลผู้ตรวจสอบ
ธรรมชาติ ขอบคุณ Margaret Rice และผู้ตรวจสอบที่ไม่ระบุตัวตนคนอื่น ๆ สำหรับความคิดเห็นของพวกเขาที่มีต่อผู้เขียนรีวิวงานนี้