ความคิดเห็น: ความคิดเห็นที่ยอดเยี่ยมของการวิจัยที่เกี่ยวข้องเกือบทั้งหมดในตัวรับแอนโดรเจนโดพามีนและการทำงานทางเพศ การวาดภาพที่ยอดเยี่ยมความสัมพันธ์วงจร hypothalamus- รางวัล
Horm Behav 2008 พฤษภาคม; 53(5):-647 658
เผยแพร่ออนไลน์ 2008 กุมภาพันธ์ 13 ดอย: 10.1016 / j.yhbeh.2008.01.010
นามธรรม
วัยรุ่นมีความสัมพันธ์กับการเพิ่มขึ้นของพฤติกรรมการแสวงหาความสุขซึ่งในที่สุดก็มีรูปร่างโดยการเปิดใช้งาน pubertal ของแกน hypothalamo-pituitary-gonadal ในรูปแบบสัตว์ของพฤติกรรมที่ให้ผลตอบแทนตามธรรมชาติเช่นเพศลูกอัณฑะแอนโดรเจนมีส่วนช่วยในการพัฒนาและแสดงออกของพฤติกรรมในเพศชาย เพื่อให้เกิดการเจริญเติบโตของพฤติกรรมสมองได้รับการเปลี่ยนแปลงอย่างมีนัยสำคัญในช่วงวัยรุ่นและการเปลี่ยนแปลงหลายอย่างก็มีความไวเช่นกันกับแอนโดรเจนซึ่งอาจทำหน้าที่ผ่านตัวรับแอนโดรเจน (AR) ด้วยปฏิสัมพันธ์ที่ละเอียดอ่อนของฮอร์โมนอวัยวะสืบพันธุ์และการพัฒนาสมองจึงไม่น่าแปลกใจที่การหยุดชะงักของระดับฮอร์โมนในช่วงเวลาที่อ่อนไหวนี้จะส่งผลต่อพฤติกรรมของวัยรุ่นและผู้ใหญ่ ในแฮมสเตอร์เพศชายจำเป็นต้องมีการสัมผัสกับฮอร์โมนเทสโทสเตอโรนในช่วงวัยรุ่นโดยปกติจะแสดงพฤติกรรมทางเพศของผู้ใหญ่ เพศที่ถูกปราศจากแอนโดรเจนในช่วงวัยแรกรุ่นแสดงการขาดดุลอย่างยั่งยืนในการผสมพันธุ์ ในทางกลับกันแอนโดรเจนเพียงอย่างเดียวไม่เพียงพอที่จะชักนำให้เกิดการผสมพันธุ์ในเพศชายที่เป็น prepubertal แม้ว่า AR ของสมองจะมีอยู่ก่อนวัยแรกรุ่น ในบริบทนี้การใช้สเตียรอยด์ชนิดแอนอะโบลิกและแอนโดรเจน (AAS) ในช่วงวัยรุ่นเป็นปัญหาที่สำคัญ การละเมิดของ AAS มีศักยภาพที่จะเปลี่ยนทั้งจังหวะและระดับของแอนโดรเจนในเพศชายของวัยรุ่น ในแฮมสเตอร์การได้รับ AAS ของวัยรุ่นจะเพิ่มความก้าวร้าวและทำให้เกิดการเปลี่ยนแปลงที่ยั่งยืนในระบบสารสื่อประสาท นอกจากนี้ AAS ยังเป็นตัวเสริมแรงดังที่เห็นได้จากการบริหารตนเองของฮอร์โมนเพศชายและ AAS อื่น ๆ อย่างไรก็ตามหลักฐานล่าสุดแสดงให้เห็นว่าผลเสริมแรงของแอนโดรเจนอาจไม่จำเป็นต้องใช้ AR คลาสสิก ดังนั้นการตรวจสอบการมีปฏิสัมพันธ์ระหว่างแอนโดรเจนต่อไปและพฤติกรรมการให้รางวัลในสมองของวัยรุ่นจึงเป็นสิ่งจำเป็นเพื่อความเข้าใจที่ดีขึ้นเกี่ยวกับการใช้ AAS ในทางที่ผิด
ขององค์กร
วัยรุ่นตื่นขึ้นสมองทั้งความสุขและความเสี่ยง ในวัยรุ่นมนุษย์มักใช้รูปแบบของการทดลองกับยาเสพติดและเพศ ในสหรัฐอเมริกาอายุมัธยฐานของการมีเพศสัมพันธ์ครั้งแรกในเพศชายคือ 16.4 ปีและ 65% มีเพศสัมพันธ์โดย 12th เกรด (มูลนิธิครอบครัวไกเซอร์ 2005) ในทำนองเดียวกันประชากรกลุ่มนี้มีอัตราการใช้ยาที่ผิดกฎหมายมากที่สุดในสหรัฐอเมริกา จากการสำรวจ 2004 แห่งชาติว่าด้วยการใช้ยาและสุขภาพ 38% ของผู้ชายวัย 18 – 25 ใช้ยาผิดกฎหมายในปีที่ผ่านมา (SAMHSA / OAS, 2005) นอกจากนี้ 31% ของวัยรุ่นชายใช้ยาเสพติดหรือแอลกอฮอล์ในระหว่างการมีเพศสัมพันธ์ครั้งสุดท้ายของพวกเขา (มูลนิธิครอบครัวไกเซอร์ 2005) นอกจากนี้วัยรุ่นเป็นเวลาที่สำคัญในสาเหตุของโรคจิตบางอย่างเช่นภาวะซึมเศร้าความวิตกกังวลการรับประทานที่ไม่เป็นระเบียบและพฤติกรรมที่ผิดปกติ เราวางตัวว่าการหลั่ง pubertal ของฮอร์โมนอวัยวะสืบพันธุ์การเปิดใช้งานของตัวรับสเตียรอยด์ในสมองและการทำงานร่วมกันระหว่างฮอร์โมนและประสบการณ์ในการพัฒนาสมองของวัยรุ่นมีส่วนทำให้เกิดการเปลี่ยนแปลงพฤติกรรมที่เห็นในช่วงวัยรุ่น
เป้าหมายของเราในที่นี้คือการตรวจสอบหลักฐานที่อวัยวะสืบพันธุ์แอนโดรเจนเป็นสื่อกลางในการเติบโตของวัยรุ่นและพฤติกรรมผู้ใหญ่ที่มีแรงจูงใจเช่นเดียวกับคุณสมบัติที่คุ้มค่าของพฤติกรรมเหล่านี้ นอกจากนี้เรายังนำเสนอหลักฐานว่าฮอร์โมนเทสโทสเตอโรนนั้นให้ผลตอบแทนซึ่งน่าจะนำไปสู่การเปลี่ยนแปลงในพฤติกรรมของแรงจูงใจในช่วงวัยรุ่นเมื่อระดับเทสโทสเทอโรนพุ่งสูงขึ้น บทความนี้มุ่งเน้นไปที่การศึกษาวงจรประสาทที่เกี่ยวข้องกับพฤติกรรมทางเพศของผู้ชายโดยเฉพาะในหนูแฮมสเตอร์ซีเรียโดยเน้นไปที่การทำงานร่วมกันระหว่างเทสโทสเตอโรนและโดปามีน (DA) เราเสนอให้แอนโดรเจนแบบ pubertal มีผลทั้งชั่วคราวและระยะยาวต่อวงจรรางวัลและพฤติกรรมที่สร้างแรงจูงใจ เราตั้งสมมติฐานเพิ่มเติมว่าการเสริมด้วยแอนโดรเจนภายนอกในรูปแบบของแอนอะโบลิก - แอนโดรเจนและสเตียรอยด์ (AAS) ช่วยเพิ่มอิทธิพลปกติของแอนโดรเจนแอนโดรเจนและทำให้เกิดผลเสียต่อการพัฒนาสมองและพฤติกรรมวัยรุ่น
วัยรุ่นเป็นช่วงเวลาที่อ่อนไหวต่อการพัฒนาสมอง
ในที่สุดสมองเป็นทั้งตัวกระตุ้นและเป้าหมายสำหรับการกระทำของแอนโดรเจนในช่วงวัยรุ่น ในเด็กเล็ก (<12 ปี) และหนูแฮมสเตอร์อายุน้อย (อายุ <28 วัน) การหมุนเวียนของแอนโดรเจนและโกนาโดโทรปินจะอยู่ในระดับพื้นฐาน เมื่อการหลั่งของฮอร์โมนลูทีไนซ์จากต่อมใต้สมองส่วนหน้าเพิ่มขึ้นเพื่อตอบสนองต่อฮอร์โมนที่ปล่อยฮอร์โมนโกนาโดโทรปินในระดับไฮโปทาลามิกความเข้มข้นของฮอร์โมนเทสโทสเตอโรนที่หมุนเวียนจะเพิ่มขึ้นอย่างมีนัยสำคัญ สิ่งนี้เกิดขึ้นโดย Tanner stage II / III (14 ปี) ในเด็กผู้ชายและอายุ 28 วันในหนูแฮมสเตอร์ เมื่อเด็กชายถึง Tanner ระยะ IV / V (แคลิฟอร์เนียอายุ 16 ปี) หรือเมื่อหนูแฮมสเตอร์อายุ 50–60 วันฮอร์โมนเพศชายจากภายนอกจะอยู่ในช่วงตัวผู้ที่โตเต็มวัย การหลั่งฮอร์โมนในวัยแรกรุ่นเกิดขึ้นพร้อมกับช่วงวัยรุ่นซึ่งเกิดขึ้นตั้งแต่อายุประมาณ 12 ถึง 20 ปีในมนุษย์ ฮอร์โมนวัยแรกรุ่นไม่เพียงทำหน้าที่ในเนื้อเยื่อส่วนปลายเพื่อทำให้เกิดลักษณะทางเพศทุติยภูมิซึ่งเป็นสัญญาณที่ชัดเจนของวัยแรกรุ่นเท่านั้น แต่ยังทำหน้าที่เป็นศูนย์กลางในการมีอิทธิพลต่อทั้งการเปลี่ยนแปลงของสมองวัยรุ่นและการเจริญเติบโตทางพฤติกรรม นอกจากนี้การเปลี่ยนแปลงทางสรีรวิทยาและระบบประสาทที่เกิดจากฮอร์โมนวัยแรกรุ่นนำไปสู่การเปลี่ยนแปลงที่สำคัญในประสบการณ์ของแต่ละบุคคลซึ่งสามารถเปลี่ยนแปลงแนวทางการพัฒนาสมองได้อย่างลึกซึ้ง ดังนั้นการเพิ่มขึ้นของฮอร์โมนสเตียรอยด์ทางเพศในวัยแรกรุ่นซึ่งได้รับแรงหนุนจากการเจริญเติบโตตามกำหนดเวลาของการเจริญเติบโตของแกนประสาทระบบสืบพันธุ์จึงทำให้พัฒนาการทางพฤติกรรมของวัยรุ่นมีผลทั้งทางตรงและทางอ้อมต่อระบบประสาท
ในปัจจุบันวัยรุ่นของมนุษย์ได้รับการยอมรับว่าเป็นช่วงเวลาสำคัญของการพัฒนาระบบประสาทในระหว่างที่วงจรพฤติกรรมนั้นได้รับการออกแบบและปรับปรุงใหม่ แม้ว่าสมองของเด็กอายุ 5 อยู่แล้ว 90% ของขนาดผู้ใหญ่แล้ว (เดคาบัน, 1978) ยังคงมีการเปลี่ยนแปลงครั้งใหญ่ แนวคิดนี้เกิดขึ้นจากการวิจัยทั้งในมนุษย์และสัตว์ซึ่งบันทึกไว้ว่ากระบวนการพัฒนาพื้นฐานหลายอย่างที่เกิดขึ้นระหว่างการพัฒนาสมองปริกำเนิดนั้นเกิดขึ้นอีกครั้งในช่วงวัยรุ่น กระบวนการเหล่านี้รวมถึง neurogenesis (Eckenhoff และ Rakic, 1988; เขาและทีมงาน 2007; Pinos, Collado, Rodriguez-Zafra, Rodriguez, Segovia และ Guillamon, 2001; Rankin, Partlow, McCurdy, Giles, และ Fisher, 2003) การตายของเซลล์ที่ตั้งโปรแกรม (Nunez, Lauschke และ Juraska, 2001; Nunez, Sodhi และ Juraska, 2002) การทำรายละเอียดและการตัดแต่งกิ่งของดอกเรนดิคริทและซินเนส (Andersen, Rutstein, Benzo, Hostetter และ Teicher, 1997; Huttenlocher และ Dabholkar, 1997; Lenroot และ Giedd, 2006; Sowell, Thompson, Leonard, Welcome, Kan, และ Toga, 2004) myelination (Benes, Turtle, Khan, และ Farol, 1994; Paus, Collins, Evans, Leonard, Pike และ Zijdenbos, 2001; Sowell, Thompson, Tessner และ Toga, 2001) และความแตกต่างทางเพศ (Chung, De Vries และ Swaab, 2002; Davis, Shryne และ Gorski, 1996; Nunez et al., 2001) ดังนั้นวิถีการพัฒนาของสมองหลังคลอดไม่ได้เป็นเชิงเส้น แต่เป็นลักษณะแทนโดยการระเบิดของการเปลี่ยนแปลงอย่างรวดเร็วของวัยรุ่นและเกี่ยวข้องกับเหตุการณ์ที่เกิดขึ้นทั้งก้าวหน้าและถอยหลัง ตามที่นักชีววิทยาพัฒนาการรู้ช่วงเวลาของการเปลี่ยนแปลงการพัฒนาอย่างรวดเร็วส่งสัญญาณความไวและความอ่อนไหวต่อการเปลี่ยนแปลงที่ขึ้นกับทั้งประสบการณ์และผลที่ไม่พึงประสงค์จากการก่อกวนและดูถูกเหยียดหยามและไม่มีเหตุผลที่จะคิดว่าการพัฒนาสมองของวัยรุ่นAndersen, 2003; หอก 2000) ดังนั้นการรบกวนในช่วงเวลาของฮอร์โมน pubertal ที่มีผลต่อสมองของวัยรุ่นจะถูกทำนายว่าจะมีผลกระทบระยะยาวต่อพฤติกรรมของผู้ใหญ่
แอนโดรเจนและวงจรประสาทสำหรับพฤติกรรมที่กระตุ้น
เนื่องจากวัยรุ่นเป็นช่วงชั่วคราวของการพัฒนาจึงเป็นการยากที่จะประเมินสมองวัยรุ่นและพฤติกรรมในการแยก เพื่อเป็นการชื่นชมกับลักษณะเฉพาะของวัยรุ่นมันจะเป็นประโยชน์ในการเปรียบเทียบกับสมองและพฤติกรรมของผู้ใหญ่ที่เป็นผู้ใหญ่ ดังนั้นด้วยการมุ่งเน้นของบทความนี้เกี่ยวกับพฤติกรรมทางเพศชายและรางวัลมันเป็นสิ่งสำคัญที่นี่เพื่อแนะนำวงจรประสาทสำหรับการมีเพศสัมพันธ์และแรงจูงใจทางเพศในเพศชายผู้ใหญ่รวมถึงบทบาทของฮอร์โมน Gonoid เตียรอยด์ในการกระตุ้นพฤติกรรมและการกระจายของผู้รับแอนโดรเจน (AR) และเอสโตรเจน (ER)
AR มีอยู่ในกลุ่มเซลล์ที่สร้างวงจรประสาทซึ่งเป็นสื่อกลางในการให้รางวัลพฤติกรรมทางสังคมเช่นเพศ นอกจากนี้สมองของ AR จะแสดงออกมาก่อนวัยหนุ่มสาวในแฮมสเตอร์และถูกควบคุมโดยแอนโดรเจนทั้งในเด็กและผู้ใหญ่Kashon, Hayes, Shek และ Sisk, 1995; ถ่อมตนโรมิโอโนวัคและซิสก์ 1997) ในสมองหนูนั้นมีการกระจายตัวของ AR และ ER ค่อนข้างซ้ำซ้อนไม้และนิวแมน 1995) และ aromatase (Celotti, Negri-Cesi และ Poletti, 1997) รวมทั้งรูปแบบαและ of ของตัวรับเอสโตรเจน (Shughrue, Lane และ Merchenthaler, 1997) เมื่อเชื่อมโยงกับแกนด์ฟังก์ชัน AR และ ER แบบ "คลาสสิค" เป็นปัจจัยการถอดความเพื่อกระตุ้นให้เกิดการถอดรหัสและการสังเคราะห์โปรตีนใหม่ ไม่น่าแปลกใจที่ผลกระทบเหล่านี้เป็นไปตามช่วงเวลาที่ค่อนข้างช้าพร้อมกับเริ่มมีอาการล่าช้า การกระตุ้นเตียรอยด์ของพฤติกรรมทางเพศของหนูแฮมสเตอร์เพศชาย (โนเบิลและอัลซุม 1975) สอดคล้องกับการกระทำผ่านการกระทำจีโนมแบบดั้งเดิม ตัวอย่างเช่นจำเป็นต้องใช้ 2 สัปดาห์ของการเปิดรับสเตียรอยด์เพื่อเรียกคืนการผสมพันธุ์ในระยะยาว การศึกษาเมื่อเร็ว ๆ นี้ในหนูยังแสดงให้เห็นถึงผลกระทบของเซลล์อย่างรวดเร็วของแอนโดรเจนในบริเวณสมองที่มีตัวรับคลาสสิกเพียงไม่กี่ตัว (Mermelstein, Becker และ Surmeier, 1996) การกระทำสเตียรอยด์เหล่านี้มีความคิดที่จะไกล่เกลี่ยโดยผู้รับที่ไม่ใช่จีโนม ในขณะที่การแจกแจงของคลาสสิก AR และ ER ในสมองหนูแฮมสเตอร์ค่อนข้าง จำกัด (Wood and Swann, 1999) เป้าหมายของสมองที่เป็นไปได้สำหรับแอนโดรเจนที่ไม่ใช่จีโนมนั้นกว้างกว่ามาก
พื้นที่ preoptic ตรงกลาง (MPOA) มีบทบาทสำคัญในการมีเพศสัมพันธ์ในผู้ชายจากปลาทองกับมนุษย์ (ตรวจสอบใน ฮัลล์, ไม้, และ McKenna, 2006) ยิ่งไปกว่านั้น MPOA หนูแฮมสเตอร์ส่งฮอร์โมน gonadal เตียรอยด์ผ่านทาง AR และ ER มากมายและการปลูกถ่ายฮอร์โมนเพศชายใน MPOA นั้นเพียงพอที่จะฟื้นฟูกิจกรรมทางเพศในระยะยาว (Wood and Swann, 1999) ในหนูตัวผู้สเตอรอยด์อวัยวะสืบพันธุ์ทำหน้าที่ใน MPOA เพื่อควบคุมการปลดปล่อย DA ฐาน (Putnam, Sato และ Hull, 2003) และกระตุ้นการผสมพันธุ์ฮัลล์ดูลอเรนและมาตุสเซวิช 1995) เริ่มแรกมีการเพิ่มขึ้นเล็กน้อยใน DA เมื่อผู้หญิงแสดงหลังหน้าจอ ในระหว่างการสังวาส MPOA DA เพิ่มขึ้นอีก (+ 50% ของ baseline) และเอฟเฟกต์นี้ต้องใช้แอนโดรเจน (ฮัลล์และอัล 1995; Putnam et al., 2003) ไม่น่าประหลาดใจในผู้ชายที่ไม่ได้ผสมพันธุ์กัน MPOA DA จะไม่เพิ่มขึ้น (ฮัลล์และอัล 1995) มันค่อนข้างยากที่จะตีความผลลัพธ์นี้เนื่องจากการขาดการปล่อยตัว DA ถูกทำให้สับสนโดยไม่มีกิจกรรมทางเพศ อย่างไรก็ตามการเปิดตัว DA ใน MPOA มีความสัมพันธ์กับการสูญเสียคู่ในระยะสั้นฮัลล์และอัล 1995) และด้วยการฟื้นฟูฮอร์โมนเพศชายที่เกิดจากกิจกรรมทางเพศในระยะยาว castrates (Du, Lorrain และ Hull, 1998; Putnam, Du, Sato และ Hull, 2001).
ภายใน MPOA หนู, สารแอนโดรเจนและฮอร์โมนเอสโตรเจนของฮอร์โมนเพศชายมีบทบาทเฉพาะในการควบคุมการผสมพันธุ์ (Putnam et al., 2003; Putnam, Sato, Riolo และ Hull, 2005) ความหน่วงในการเริ่มต้นการสังวาส (เพิ่มขึ้นหรือ intromit) เป็นหนึ่งในแรงจูงใจทางเพศ ความหน่วงต่อกิจกรรมทางเพศนั้นไวต่อเอสโตรเจนผ่านการบำรุงรักษา MPOA nitric oxide synthase ซึ่งจะรักษาระดับ DA พื้นฐาน เอสโตรเจนที่ได้รับการรักษานั้นแสดงระดับฐาน DA สูงซึ่งสัมพันธ์อย่างมากกับความสามารถในการเริ่มมีเพศสัมพันธ์ อย่างไรก็ตามพวกเขาล้มเหลวในการเพิ่มการปลดปล่อย DA และเพศหญิงที่เกิดจากการมีเพศสัมพันธ์ซึ่งสัมพันธ์กับการมีเพศสัมพันธ์อย่างมาก ดังนั้นสมรรถภาพทางเพศของพวกเขาจึงต่ำกว่าระดับที่ไม่เป็นอันตราย ในทางตรงกันข้าม castrates ที่ได้รับการรักษาด้วยแอนโดรเจนที่ไม่ทำให้เกิดการอักเสบเพียงอย่างเดียวจะไม่แสดงระดับ DA ฐานที่สูงขึ้นและพวกเขาล้มเหลวในการเริ่มมีเพศสัมพันธ์ สำหรับการมีเพศสัมพันธ์ตามปกติดังนั้นจำเป็นต้องใช้ทั้งเอสโตรเจนและแอนโดรเจน ประสิทธิภาพทางเพศมักจะแสดงออกมาเป็นตัวชี้วัดความถี่ของการเมานท์, การคาดคะเนและการหลั่ง เฉพาะเมื่อมีการเปลี่ยนทั้งเอสโตรเจนและแอนโดรเจนเพศชายตอนล่างจะแสดงระดับ DA ที่สูงขึ้น (และมาตรการแฝงที่สั้นกว่า) และ DA ที่เพิ่มขึ้นจากเพศหญิงและการมีเพศสัมพันธ์ที่เพิ่มขึ้น (และมาตรการความถี่ที่เพิ่มขึ้น) ด้วยวิธีนี้เอสโตรเจนใน MPOA มีส่วนช่วยสร้างแรงจูงใจทางเพศและทั้งเอสโตรเจนและแอนโดรเจนต่อสมรรถภาพทางเพศ
แม้ว่าฮอร์โมนเทสโทสเตอโรนจำเป็นสำหรับการปล่อย MPOA DA ระหว่างพฤติกรรมการมีเพศสัมพันธ์ของผู้ชายและการผสมพันธุ์ของตัวเองฮอร์โมนเทสโทสเตอโรนและการผสมพันธุ์เพียงอย่างเดียวไม่สามารถดึงดูด DA ใน MPOA ได้ แต่จำเป็นต้องมีตัวชี้นำทางเคมีจากผู้หญิงที่สมคบคิดเช่นกันสำหรับการปลดปล่อย DA ใน MPOA ในหนูสิ่งกระตุ้นทางเคมีบำบัดเป็นวิธีการทางประสาทสัมผัสเบื้องต้นในการเริ่มต้นพฤติกรรมทางเพศของผู้ชาย (มะเดื่อ. 1) Chemosensory ชี้นำจะถูกส่งจากหัวจมูกหลอดไปยัง MPOA ผ่านนิวเคลียส amygdaloid อยู่ตรงกลางและนิวเคลียสเตียงของ stria terminalis, โครงสร้างที่มีมากมาย AR และ ER (Wood and Swann, 1999) เพื่อตรวจสอบบทบาทของตัวชี้นำทางเคมีใน DA ที่เกิดจากการผสมพันธุ์เราทำการวัด MPOA DA ในระหว่างการผสมพันธุ์ในแฮมสเตอร์ตัวผู้ที่ไม่สมบูรณ์ด้วยการผ่าจมูกหลอดข้างเดียว (UBx, Triemstra, Nagatani และ Wood, 2005) แม้ว่าการกำจัดจมูกหลอดในระดับทวิภาคีจะช่วยกำจัดกิจกรรมทางเพศและการปล่อย MPOA DA แต่ bulbectomy ฝ่ายเดียวก็ไม่ได้รบกวนการผสมพันธุ์ ในการศึกษานี้การมีเพศสัมพันธ์เหนี่ยวนำให้เกิดการปลดปล่อย MPOA DA เมื่อวัด contralateral กับหลอดดมกลิ่นที่ถูกบาดแผล แต่ไม่อยู่ในซีกโลกของ ipsilateral (มะเดื่อ. 2) ผลที่คล้ายกันถูกพบในหนูเพศผู้ที่มีรอยโรคของ amygdala อยู่ตรงกลาง (Dominguez, Riolo, Xu และ Hull, 2001) ในการศึกษาที่เกี่ยวข้องการกระตุ้นทางเคมีของ amygdala อยู่ตรงกลางในหนูทำให้เกิดการปลดปล่อย MPOA DA เทียบเท่ากับในระหว่างการมีเพศสัมพันธ์ (Dominguez และ Hull, 2001) เมื่อนำมารวมกันข้อมูลเหล่านี้ชี้ให้เห็นว่าฮอร์โมนเทสโทสเตอโรนสร้างสภาพแวดล้อมที่เอื้ออำนวยที่ช่วยให้สิ่งเร้าทางประสาทสัมผัสภายนอกเข้าถึง MPOA และทำให้เกิดการปลดปล่อย DA ในระหว่างมีเพศสัมพันธ์

มะเดื่อ. 2
ในที่สุดพฤติกรรมทางเพศและผลตอบแทนตามธรรมชาติอื่น ๆ เปิดใช้งานเส้นทางการให้รางวัลประสาท วงจร DA mesocorticolimbic ประกอบด้วย ventral tegmental area (VTA), นิวเคลียส accumbens (Acb), และ prefrontal cortex (Pfc) โดปามีนเซลล์ร่างกายที่อาศัยอยู่ในโครงการ VTA ตามหลักการ Acb และ Pfc (Koob และ Nestler, 1997) ในหนู DA ถูกปล่อยเข้าสู่ Acb ในระหว่างมีเพศสัมพันธ์ (Pfaus, Damsma, Nomikos, Wenkstern, Blaha, Phillips และ Fibiger, 1990) ยาเสพติดจำนวนมากยังใช้ระบบ mesolimbic DA เพื่อเพิ่มการปลดปล่อย DA (ยาบ้า) หรือยับยั้ง DA reuptake (โคเคน Di Chiara และ Imperato, 1988) จึงช่วยเสริมคุณสมบัติการเสพติดของพวกเขา ในลักษณะนี้ฮอร์โมนเพศชายมีศักยภาพที่จะส่งผลกระทบต่อการเปิดตัวของ DA ใน Acb ทั้งผ่านการเสริมสร้างพฤติกรรมทางเพศและผ่านการกระทำของมันเป็นยาเสพติดของการละเมิด (ดูด้านล่าง)
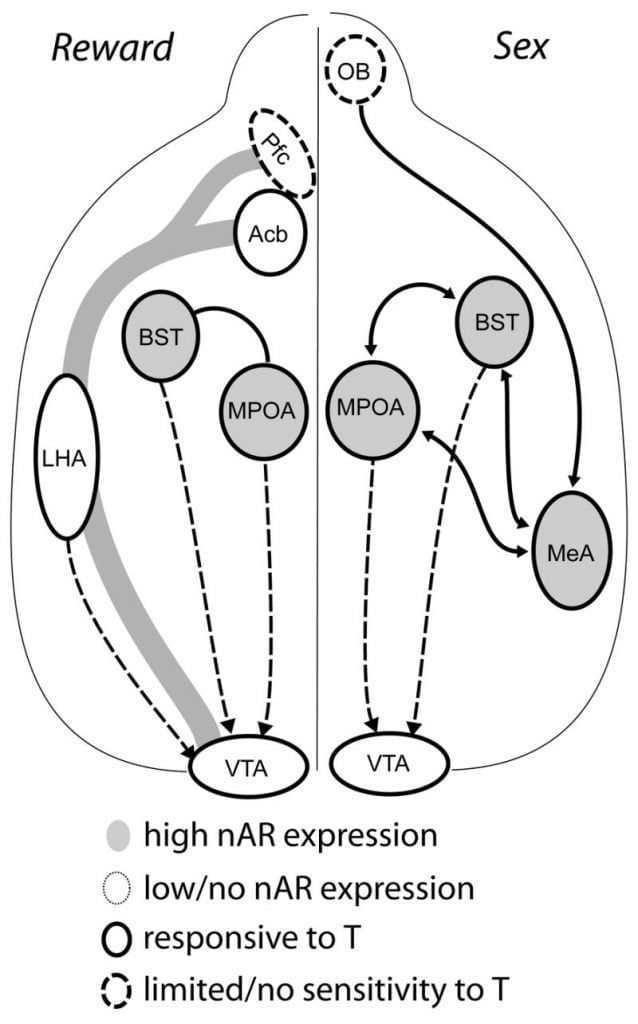
หลักฐานปัจจุบันแสดงให้เห็นว่าระบบ DA mesocorticolimbic ครบกำหนดในช่วงวัยรุ่น ความหนาแน่นของเส้นใย Acb DA เพิ่มขึ้นอย่างมากในช่วงวัยรุ่นใน gerbils แสดงให้เห็นว่าการเจริญเติบโตอย่างมีนัยสำคัญของการคาดการณ์ dopaminergic VTA ของ Acb ที่เกิดขึ้นในช่วงวัยรุ่น (Lesting, Neddens และ Teuchert-Noodt, 2005) นอกจากนี้การเติมสาร dopaminergic ไปยัง GABA (กรด am-aminobutyric) - เซลล์พลังงานในเยื่อหุ้มสมอง prefrontal cortex หนูอยู่ในระดับกลางและสูงขึ้นและปรับโดยระบบ serotonergic ในระหว่างการพัฒนา pubertal (Benes, Taylor และ Cunningham, 2000) และการจัดการแอนโดรเจนในหนูที่โตเต็มวัยจะนำไปสู่การเปลี่ยนแปลงของความหนาแน่น dopaminergic axon ภายในเยื่อหุ้มสมองส่วนหน้า (Kritzer, 2003) Pfc, Acb และ VTA มี AR หรือ ER เพียงเล็กน้อยแม้ว่าERβจะมีอยู่ใน VTA (Shughrue และคณะ, 1997) ดังนั้นดูเหมือนว่าแอนโดรเจนจะส่งผลกระทบต่อระบบ mesocorticolimbic DA ผ่านอวัยวะรับความรู้สึกแอนโดรเจนหรือผ่านERβใน VTA เช่นเดียวกับในมลรัฐ (Handa et al., ปัญหานี้) ข้อมูลของเราแสดงให้เห็นว่าเซลล์ที่ไวต่อแอนโดรเจนในโครงการแฮมสเตอร์เพศชายสู่ VTA จากโครงสร้างที่เกี่ยวข้องกับพฤติกรรมที่ไวต่อสารสเตียรอยด์ ตัวอย่างเช่น MPOA และนิวเคลียส bed ของ stria terminalis (BST) มีเซลล์ AR-positive จำนวนมากที่ฉายไปยัง VTA (Sato and Wood, 2006) ventral pallidum ซึ่งเป็นเป้าหมายสำคัญของ Acb efferent (Zahm และ Heimer, 1990) ยังมีเซลล์ AR-positive จำนวนมากที่ฉายไปยัง VTA ประมาณการเหล่านี้ให้โอกาสสำหรับแอนโดรเจนในการปรับเปลี่ยนกิจกรรมของระบบ mesocorticolimbic DA
องค์กรที่ขึ้นอยู่กับพฤติกรรมของเตียรอยด์ในช่วงวัยรุ่น
มุมมองแบบดั้งเดิมของการกระทำของฮอร์โมนในพฤติกรรมวัยรุ่นจะขึ้นอยู่กับผลกระทบของกิจกรรมของฮอร์โมนเตียรอยด์ซึ่งหมายถึงความสามารถของเตียรอยด์เพื่ออำนวยความสะดวกพฤติกรรมในบริบททางสังคมที่เฉพาะเจาะจงโดยการกระทำภายในเซลล์เป้าหมายในวงจรประสาท ผลกระทบจากการเปิดใช้งานนั้นชั่วคราวในแง่ที่ว่าพวกเขามาและไปกับการมีอยู่และไม่มีฮอร์โมนและพวกเขามักจะเกี่ยวข้องกับการแสดงออกของพฤติกรรมผู้ใหญ่ ในทางตรงกันข้ามผลกระทบขององค์กรหมายถึงความสามารถของสเตียรอยด์ในการสร้างโครงสร้างระบบประสาทในระหว่างการพัฒนา การจัดโครงสร้างอย่างถาวรยังคงมีอยู่เกินระยะเวลาของการสัมผัสกับฮอร์โมนและกำหนดระบบประสาทและพฤติกรรมตอบสนองต่อเตียรอยด์ในวัยผู้ใหญ่ ความเข้าใจของเราเกี่ยวกับความสัมพันธ์ในการพัฒนาระหว่างผลกระทบขององค์กรกับการกระตุ้นฮอร์โมนสเตียรอยด์นั้นมีการพัฒนาในช่วง 50 ปีที่ผ่านมา ฟีนิกซ์และเพื่อนร่วมงานเสนอเป็นครั้งแรกว่าการตอบสนองเชิงพฤติกรรมของผู้ใหญ่ต่อการสร้างสเตียรอยด์ฮอร์โมนนั้นได้รับการตั้งโปรแกรม (จัดระเบียบ) โดยสเตียรอยด์ฮอร์โมนในช่วงระยะเวลาที่สำคัญที่สุดของการพัฒนาปริกำเนิดPhoenix, Goy, Gerall และ Young, 1959) ต่อมาสกอตต์และเพื่อนร่วมงานได้วางรากฐานทางทฤษฎีสำหรับการดำรงอยู่ของช่วงเวลาที่อ่อนไหวหลายครั้งสำหรับการจัดระบบที่ก้าวหน้าของระบบประสาทและสังเกตว่าช่วงเวลาที่อ่อนไหวมักจะเกิดขึ้นในช่วงเวลาของการเปลี่ยนแปลงพัฒนาการอย่างรวดเร็ว ต่อจากนั้นอาร์โนลด์และ Breedlove ชี้ให้เห็นว่าองค์กรที่ขึ้นอยู่กับสเตียรอยด์ของสมองสามารถเกิดขึ้นได้นอกช่วงเวลาที่อ่อนไหวของการพัฒนา (อาร์โนลด์และ Breedlove, 1985) ในช่วง 15 ปีที่ผ่านมาการวิจัยใช้รูปแบบสัตว์และระบบพฤติกรรมที่หลากหลายทำให้ชัดเจนว่าสมองของวัยรุ่นมีความไวต่อผลกระทบเชิงกิจกรรมและการจัดการของสเตอรอยด์อวัยวะสืบพันธุ์ (ตรวจสอบใน Sisk และ Zehr, 2005) และเช่นเดียวกับช่วงเวลาอื่น ๆ ของการเปลี่ยนแปลงอย่างรวดเร็วการพัฒนาวัยรุ่นแสดงถึงหน้าต่างแห่งโอกาสที่กำหนดไว้สำหรับการเปลี่ยนแปลงสมองด้วยสเตียรอยด์
งานของเราโดยใช้หนูแฮมสเตอร์เป็นแบบจำลองสัตว์แสดงหลักฐานว่าพฤติกรรมทางสังคมของผู้ชายได้รับการแก้ไขโดยสเตอรอยด์ในช่วงวัยรุ่น (Schulz, Menard, Smith, Albers และ Sisk, 2006; Schulz และ Sisk, 2006) ก่อนเข้าสู่วัยหนุ่มสาวการรักษาเทสโทสเทอโรนไม่สามารถกระตุ้นพฤติกรรมทางเพศในแฮมสเตอร์แนะนำว่ากระบวนการครบวงจรที่ทำให้วงจรประสาทไวต่อการกระตุ้นหรือองค์กรโดยฮอร์โมนสเตียรอยด์ยังไม่เกิดขึ้น (ถ่อมตน, 1997; Romeo, Richardson และ Sisk, 2002a). ในทางกลับกัน ในขณะที่การแสดงออกอย่างเปิดเผยของพฤติกรรมการสืบพันธุ์ของผู้ชายในวัยผู้ใหญ่ไม่จำเป็นต้องมีสเตียรอยด์จากอวัยวะสืบพันธุ์ในช่วงวัยรุ่นอย่างแน่นอน แต่การแสดงออกถึงพฤติกรรมสูงสุดก็เป็นเช่นนั้น เมื่อเปรียบเทียบพฤติกรรมการสืบพันธุ์ของผู้ชายตอนก่อนวัยเจริญพันธุ์ (NoT@P) หรือหลังวัยเจริญพันธุ์ (T@P) แล้วรับการรักษาด้วยฮอร์โมนเทสโทสเตอโรนในวัยผู้ใหญ่ การตอนของผู้ชายก่อนวัยเจริญพันธุ์ NoT@P มีพฤติกรรมของผู้ชายขาดอย่างน้อย 50% เมื่อเทียบกับผู้ชายตอนหลังวัยรุ่น (มะเดื่อ. 3, Schulz, Richardson, Zehr, Osetek, Menard และ Sisk, 2004) ยิ่งกว่านั้นการขาดดุลในพฤติกรรมการสืบพันธุ์นั้นยาวนานและไม่สามารถเอาชนะได้ด้วยการรักษาด้วยฮอร์โมนเทสโทสเตอโรนนานหรือจากประสบการณ์ทางเพศในวัยผู้ใหญ่ (Schulz et al., 2004). ในทำนองเดียวกัน หลังจากการรักษาด้วยฮอร์โมนเอสโตรเจนและโปรเจสเตอโรน ผู้ชาย NoT@P จะแสดงความล่าช้าของภาวะลอร์ดโดซิสที่สั้นกว่าและระยะเวลาของภาวะลอร์ดโดซิสที่นานกว่าผู้ชายที่ตอนเป็นผู้ใหญ่ (Schulz et al., 2004) ชี้ให้เห็นว่าตอนล่าง prepubertal มีน้อย defeminized กว่าเพศชายที่สัมผัสกับฮอร์โมนเพศชาย pubertal

มะเดื่อ. 3
อาจเป็นไปได้ว่าผู้ชาย NoT@P มีแรงจูงใจทางเพศลดลง วิธีหนึ่งในการตอบคำถามนี้คือการเปรียบเทียบเวลาแฝงในการสืบสวนทั้งบริเวณอวัยวะเพศ (AGI) และการเพิ่มจำนวนขึ้นระหว่างชายที่ตัดอวัยวะก่อน (NoT@P) และหลังวัยแรกรุ่น (T@P) หากแรงจูงใจทางเพศขึ้นอยู่กับการสัมผัสฮอร์โมนอวัยวะสืบพันธุ์ในช่วงวัยรุ่น เราจะคาดการณ์ว่าพฤติกรรมทางเพศในผู้ชาย NoT@P จะมีเวลาแฝงที่นานขึ้น แท้จริงแล้ว ด้วยการสัมผัสกับตัวเมียที่เป็นสัดซ้ำๆ ตัวผู้ NoT@P ใช้เวลาในการเริ่มต้น AGI นานกว่าและเพิ่มขึ้นเมื่อเทียบกับตัวผู้ T@P (มะเดื่อ. 4). ดังนั้น นอกเหนือจากการจัดแง่มุมต่างๆ ของสมรรถภาพทางเพศแล้ว ดูเหมือนว่าฮอร์โมนในวัยแรกรุ่นยังจัดระเบียบแง่มุมต่างๆ ที่คุ้มค่าของพฤติกรรมทางเพศด้วย เพื่อสนับสนุนความเป็นไปได้นี้ การบริหารส่วนกลางของ DA agonist apomorphine ในวัยผู้ใหญ่จะฟื้นฟูพฤติกรรมที่เพิ่มขึ้นของเพศชาย NoT@P ให้อยู่ในระดับปกติของผู้ใหญ่ โดยแนะนำว่าฮอร์โมนเพศชายในช่วงวัยรุ่นมักจะจัดวงจรประสาทโดปามีน (Salas-Ramirez, Montalto และ Sisk, 2006 ). อย่างไรก็ตาม ยังคงมีคำถามที่น่าสนใจมากมาย ผู้ชาย NoT@P จะกดบาร์สำหรับผู้หญิงที่เป็นสัดหรือพัฒนาสถานที่ที่มีเงื่อนไขสำหรับสถานที่ผสมพันธุ์หรือไม่? การวิจัยในอนาคตจะสำรวจบทบาทของฮอร์โมนในวัยแรกรุ่นในการสร้างแรงจูงใจทางเพศและสมรรถภาพทางเพศ

มะเดื่อ. 4
เวลาแฝงและระยะเวลาของการตรวจสอบอวัยวะเพศ (AGI) ที่แสดงโดยหนูแฮมสเตอร์ตัวผู้ gonadectomy ก่อนวัยแรกรุ่น (NoT@P) หรือหลังวัยแรกรุ่น (T@P) ผู้ชายทุกคนได้รับฮอร์โมนเทสโทสเทอโรนในวัยผู้ใหญ่ 7 สัปดาห์หลังการผ่าตัดอวัยวะสืบพันธุ์ และหนึ่งสัปดาห์ก่อนการทดสอบพฤติกรรมครั้งแรก A. ตัวผู้ T@P แสดงค่าหน่วงเวลา AGI ที่คล้ายกันในการทดสอบทั้งสามครั้งกับตัวเมียที่เป็นสัด ในขณะที่ตัวผู้ NoT@P เพิ่มค่าหน่วงเวลา AGI ในระหว่างการทดสอบครั้งที่สามกับตัวเมียที่เป็นสัด B. ตัวผู้ T@P ลดเวลาแฝงในการติดตั้งในการทดสอบพฤติกรรมทั้งสามครั้งกับตัวเมียที่เป็นสัด ในขณะที่ตัวผู้ noT@P ไม่แสดงการเปลี่ยนแปลงของเวลาแฝงในการทดสอบพฤติกรรมทั้งสามครั้ง ข้อมูลเหล่านี้ชี้ให้เห็นว่าฮอร์โมนอวัยวะสืบพันธุ์ในวัยแรกรุ่นมีผลระยะยาวและอำนวยความสะดวกต่อแรงจูงใจของผู้ชายที่เป็นผู้ใหญ่ในการมีพฤติกรรมทางเพศกับผู้หญิง (ข้อมูลที่ไม่ได้เผยแพร่จากวิชาสัตว์ใน Schulz, KM, Richardson, HN, Zehr, JL, Osetek, AJ, Menard, TA, และ Sisk, CL, 2004).
การตอบสนองต่อพฤติกรรมของเตียรอยด์ที่เตรียมไว้ล่วงหน้า
หนึ่งในปริศนาที่ยืนยงของการพัฒนาพฤติกรรมของวัยรุ่นคือเหตุผลที่เปิดใช้งานพฤติกรรมการสืบพันธุ์ในการตอบสนองต่อการสัมผัสกับสารสเตียรอยด์ในตัวผู้แฮมสเตอร์ก่อนวัย หากระดับต่ำของแอนโดรเจนก่อนวัยแรกรุ่น จำกัด การแสดงออกของพฤติกรรมทางเพศชายในเพศชาย prepubertal แล้วเสริมแอนโดรเจนภายนอกในเพศชายก่อนวัยอันควรควรล้วงผสมพันธุ์ สิ่งนี้ไม่เป็นเช่นนั้น (ถ่อมตน, 1997; Romeo, Cook-Wiens, Richardson และ Sisk, 2001; Romeo, Wagner, Jansen, Diedrich และ Sisk, 2002b) ทั้งๆที่ความจริงที่ว่าจำนวนและการกระจายของ AR และ ER ตลอดวงจรการผสมพันธุ์มีความคล้ายคลึงกันในการรักษาด้วยฮอร์โมน prepubertal และผู้ใหญ่ตอน (ถ่อมตน, 1997; Romeo, Diedrich และ Sisk, 1999; Romeo et al., 2002a) ดังนั้นปรากฏว่าแอนโดรเจนและ AR จำเป็น แต่ไม่เพียงพอสำหรับการแสดงออกของพฤติกรรมทางเพศของผู้ชาย
ความพยายามในการระบุปัจจัยที่ จำกัด กิจกรรมทางเพศก่อนวัยแรกรุ่นได้รับการผสม การตอบสนองต่อการชี้นำทางเคมีบำบัดจากผู้หญิงที่เป็นสัดนั้นคล้ายกันในหนูแฮมสเตอร์ prepubertal และผู้ใหญ่ (Romeo, Parfitt, Richardson และ Sisk, 1998) ข้อมูลเหล่านี้แสดงให้เห็นว่ากลไกการรับรู้ทางประสาทสัมผัสนั้นมีความสมบูรณ์ก่อนวัยแรกรุ่น ดังนั้นเด็กและเยาวชนจึงสามารถตรวจจับสัญญาณทางเคมีจากเพศหญิง พวกเขาแตกต่างจากผู้ใหญ่อย่างไรในการตอบสนองต่อสัญญาณเหล่านั้น คำอธิบายที่เป็นไปได้ข้อหนึ่งคือผู้ชายไม่ได้รับแรงบันดาลใจจากพฤติกรรมทางเพศ เราพบว่าหนูแฮมสเตอร์ prepubertal ไม่แสดงการตอบสนองของโดปามีนเพิ่มขึ้นใน MPOA ในการตอบสนองต่อฟีโรโมนเพศหญิงในขณะที่เพศผู้ใหญ่ - naïveผู้ใหญ่เพศแสดงการตอบสนองของโดปามีนที่แข็งแกร่ง MPOA dopaminergicมะเดื่อ. 5, Schulz, Richardson, Romeo, Morris, Lookland และ Sisk, 2003) ในทำนองเดียวกัน prepubertal ตัวผู้ล้มเหลวในการแสดงการเพิ่มขึ้นของฮอร์โมนเทสโทสเตอโรนในผู้ใหญ่โดยทั่วไปตามการสัมผัสกับฟีโรโมนเพศหญิง (Parfitt, Thompson, Richardson, Romeo และ Sisk, 1999) ดังนั้นฟีโรโมนเพศหญิงดูเหมือนจะเป็นตัวกระตุ้นอย่างไม่มีเงื่อนไขสำหรับการตอบสนองทางประสาทและระบบประสาทในผู้ใหญ่ แต่ไม่ใช่เพศชายแบบ preubertal แสดงให้เห็นว่าการเปลี่ยนแปลงของสิ่งเร้าทางประสาทสัมผัสทางสังคมที่เกี่ยวข้องกับการพัฒนาของ pubertal อาจเกี่ยวข้องกับการได้มาซึ่งคุณสมบัติ นอกจากนี้แม้ว่าฮอร์โมนเทสโทสเตอโรนจะช่วยให้ AGI ของผู้หญิงในเพศชายที่เป็น prepubertal ได้ผลนี้ขึ้นอยู่กับว่าผู้ชายนั้นเคยสัมผัสกับผู้หญิงที่เป็นสัดหรือไม่ บางทีการรักษาด้วยฮอร์โมนเทสโทสเทอโรนอาจลดความหน่วงและเพิ่มระยะเวลาของ AGI ในเพศชายที่ไม่ได้รับยาล่วงหน้าเท่านั้นมะเดื่อ. 6) นอกจากนี้เพศชายที่มีประสบการณ์ก่อนหน้าหนึ่งกับผู้หญิงที่แสดง AGI latencies AGI นานกว่าและระยะเวลา AGI ที่สั้นกว่าเพศชายที่มีปฏิสัมพันธ์กับผู้หญิงที่เปิดกว้างเป็นครั้งแรก (มะเดื่อ. 6) ข้อมูลเหล่านี้ชี้ให้เห็นว่าการมีปฏิสัมพันธ์กับผู้หญิงที่เป็นสัดนั้นเป็นเรื่องน่ารังเกียจมากกว่าการให้รางวัลก่อนวัยแรกรุ่นดังนั้นจึงกำจัดผลกระทบของฮอร์โมนเทสโทสเตอโรนต่อ AGI ระหว่างการมีปฏิสัมพันธ์กับผู้หญิง มันจะน่าสนใจที่จะรู้ว่าพฤติกรรมเชิงลบที่เกิดจากการสัมผัสกับผู้หญิงที่เป็นสัดยังคงอยู่ในช่วงวัยรุ่นและวัยผู้ใหญ่โดยเฉพาะอย่างยิ่งเนื่องจากมีการสัมผัสซ้ำ ๆ กับผู้หญิงที่เป็นสัด ในระหว่าง วัยรุ่นโดยทั่วไปอำนวยความสะดวกในการแสดงออกของพฤติกรรมการสืบพันธุ์เพศชาย (Molenda-Figueira, Salas-Ramirez, Schulz, Zehr, Montalto และ Sisk, 2007).

มะเดื่อ. 5
Prepubertal และผู้ใหญ่ preoptic พื้นที่อยู่ตรงกลาง (MPOA) dopaminergic ตอบสนองต่อฟีโรโมนหญิงที่มีอยู่ในสารคัดหลั่งในช่องคลอด ผู้ใหญ่เพศชายเพิ่มขึ้นในกิจกรรม dopaminergic MPOA กับการสัมผัสกับสารคัดหลั่งในช่องคลอดหญิงในขณะที่เพศชาย prepubertal ไม่แสดง MPOA เพิ่มขึ้นการตอบสนอง dopaminergic MPOA กับฟีโรโมนหญิง วาดใหม่จาก Schulz, KM, ริชาร์ดสัน, HN, Romeo, RD, มอร์ริส, JA, Lookingland, KJ และ Sisk, CL, 2003).

แม้ว่าการรักษาด้วยแอนโดรเจนก่อนล่วงหน้าไม่สามารถกระตุ้นให้เกิดการสังวาสได้ แต่งานล่าสุดจากห้องปฏิบัติการของเราชี้ให้เห็นว่าระบบประสาทหนูแฮมสเตอร์มีความอ่อนไหวต่อการจัดระบบฮอร์โมนเพศชายในพฤติกรรมการสืบพันธุ์ก่อนวัยรุ่นSchulz, Zehr, Salas-Ramirez และ Sisk, 2007) ตอนที่บวกกับ 19 วันของการเปิดรับฮอร์โมนเพศชายก่อนหรือระหว่าง แต่ไม่หลังจากวัยรุ่นช่วยอำนวยความสะดวกพฤติกรรมการติดตั้งเมื่อฮอร์โมนเพศชายถูกแทนที่ด้วยวัย เพศชายที่สัมผัสกับฮอร์โมนเพศชาย prepubertally ยังแสดง intromissions มากขึ้นในผู้ใหญ่กว่าเพศชายที่สัมผัสกับฮอร์โมนเพศชายในช่วงหรือหลังวัยแรกรุ่น (Schulz et al., 2007) ข้อมูลเหล่านี้ชี้ให้เห็นว่าความสามารถของเทสโทสเตอโรนในการจัดระเบียบวงจรประสาทพฤติกรรมลดลงตามอายุและวัยรุ่นเป็นจุดสิ้นสุดของช่วงเวลาหลังคลอดที่อ่อนไหวต่อการได้รับฮอร์โมนเทสโทสเตอโรน
เภสัชแอนโดรเจน
ข้อมูลก่อนหน้านี้ชี้ให้เห็นว่าสเตอรอยด์อวัยวะสืบพันธุ์ปรับปรุงพฤติกรรมกระตุ้นในช่วงวัยรุ่น ตอนนี้จะเกิดอะไรขึ้นถ้าผู้ดูแลแอนโดรเจนหนึ่งตัวที่ระดับความเข้มข้นทางสรีรวิทยาปกติของ 100x เท่ากัน? นี่เป็นปัญหาของการละเมิด anabolic-androgenic เตียรอยด์ (AAS) (ตรวจสอบใน Brower, 2002; คลาร์กและเฮนเดอร์สัน 2003) การพูดนอกเรื่องสั้น ๆ มีความเหมาะสมที่นี่: AAS ทั้งหมดเป็นอนุพันธ์ของฮอร์โมนเพศชาย, AAS ทั้งหมดมีโครงกระดูกคาร์บอนที่มีวงแหวนหลอมรวมของ 4, ส่วนใหญ่มีคาร์บอน 19 AAS ใช้เป็นหลักสำหรับผลกระทบ anabolic (การสร้างกล้ามเนื้อ) อย่างไรก็ตามตามชื่อของมันหมายถึง AAS ยังมีคุณสมบัติ androgenic เทสโทสเตอโรนเป็นตัวเลือกที่มีเหตุผลในการศึกษาสัตว์เพื่อสำรวจกลไกพื้นฐานของรางวัลแอนโดรเจน มันยังคงเป็นตัวเลือกยอดนิยมสำหรับผู้ใช้ที่เป็นมนุษย์เช่นกันส่วนใหญ่มักอยู่ในรูปแบบของฮอร์โมนเพศชายที่มีฤทธิ์ยาวนานเช่น ใน 2006 เทสโทสเตอโรนเป็นสารต้องห้ามที่พบได้บ่อยที่สุดในการตรวจปัสสาวะที่ห้องปฏิบัติการที่ได้รับการรับรอง WADA (WADA, 2006) ฮอร์โมนเพศชายคิดเป็นสัดส่วนที่ใหญ่ที่สุด (34%) ของการทดสอบปัสสาวะ AAS บวกที่ 2000 Sydney Olympic Games (Van Eenoo และ Delbeke, 2003) ในทำนองเดียวกันในการทดสอบปัสสาวะของผู้ใช้ AAS, 41% ทดสอบบวกสำหรับฮอร์โมนเพศชาย (Brower, Catlin, Blow, Eliopulos, Beresford, 1991) ในขนาดที่สูง AAS จะทำการเปลี่ยนแปลงพฤติกรรมอย่างมีนัยสำคัญ โดยเฉพาะอย่างยิ่งเนื่องจากความสัมพันธ์ใกล้ชิดกับฮอร์โมนเพศชายการใช้ AAS ในช่วงวัยรุ่นนั้นดูเหมือนจะรบกวนสภาพแวดล้อมสเตียรอยด์ตามปกติของระบบประสาทของวัยรุ่นที่กำลังพัฒนาซึ่งรวมถึงปริมาณเวลาและประเภทของการสัมผัสกับสเตียรอยด์
เช่นเดียวกับยาเสพติดอื่น ๆ การละเมิด AAS ของมนุษย์เป็นปัญหาของวัยรุ่น จากการสำรวจครัวเรือน 1994 แห่งชาติเรื่องการใช้ยาSAMHSA / OAS, 1996) สเตียรอยด์ใช้ยอดเขาในวัยรุ่นตอนปลายที่อายุ 18 ปี นอกจากนี้ในการติดตามการสำรวจในอนาคต (Johnston, O'Malley และ Bachman, 2003) อุบัติการณ์อายุการใช้งานสเตียรอยด์ในผู้สูงอายุระดับมัธยม (2.7%) เทียบได้กับโคเคนร้าว (3.5%) หรือเฮโรอีน (1.4%) การใช้สเตียรอยด์นั้นพบได้บ่อยในวัยเด็ก: นักเรียนเกรด 2.5% 8% (13 – 14 ปี) ใช้สเตอรอยด์คล้ายกับการแตก (2.5%) และการใช้เฮโรอีน (1.6%) แนวโน้มที่มีต่อการใช้ AAS ในวัยรุ่นตอนต้นนั้นเป็นปัญหาโดยเฉพาะอย่างยิ่งในแง่ของความกังวล 1) ที่วัยรุ่นอาจมีความเสี่ยงต่อการละเมิด AAS และ 2) โดยเฉพาะอย่างยิ่งที่วัยรุ่นสัมผัสกับ AAS ในระดับเภสัชวิทยามีแนวโน้มที่จะเปลี่ยนแปลง พฤติกรรมในการผลิตการตอบสนองทางสัณฐานวิทยาและพฤติกรรมที่พูดเกินจริงอย่างรุนแรงและเรื้อรัง
การรุกรานที่ไม่เหมาะสมคือการตอบสนองเชิงพฤติกรรมซึ่งส่วนใหญ่มักเกี่ยวข้องกับการใช้ AAS ในทางที่ผิด ในรายงานผู้ป่วยที่ตีพิมพ์การใช้สเตียรอยด์นั้นมีส่วนเกี่ยวข้องในคดีฆาตกรรมหลายครั้งConacher และคนงาน 1989; สมเด็จพระสันตะปาปาและ Katz, 1990; Pope, Kouri, Powell, Campbell และ Katz, 1996; Schulte, Hall และ Boyer, 1993) ในการสำรวจผู้ใช้ AAS ในปัจจุบันความก้าวร้าวและความหงุดหงิดที่สูงขึ้นเป็นผลข้างเคียงที่พบได้บ่อยที่สุดจากการใช้ AAS (บอนด์ชอยและพระสันตะปาปา 1995; Galligani, Renck และ Hansen, 1996; Midgley, Heather และ Davies, 2001; Parrott, Choi และ Davies, 1994; Perry, Kutscher, Lund, Yates, Holman และ Demers, 2003) อย่างไรก็ตามด้วยช่วงของการเปิดรับแอนโดรเจนความหลากหลายของอาการทางจิตเวชและความเป็นไปได้ของความผิดปกติทางจิตเวชที่มีอยู่ก่อนมันเป็นเรื่องยากที่จะกำหนดบทบาทที่แม่นยำของ AAS ในกรณีเหล่านี้ของการรุกรานของมนุษย์ ผลลัพธ์จากการศึกษาในอนาคตของอาสาสมัครมนุษย์ที่ได้รับการฉีด AAS นั้นได้รับการผสม: Tricker et al (1996) และ O'Connor et al (2004) รายงานไม่เพิ่มพฤติกรรมโกรธในขณะที่การศึกษาอื่น ๆ ได้สังเกตเห็นการรุกรานที่เพิ่มขึ้น (Daly, Su, Schmidt, Pickar, Murphy และ Rubinow, 2001; Hannan, Friedl, Zold, Kettler และ Plymate, 1991; Kouri, Lukas, Pope, และ Oliva, 1995; สมเด็จพระสันตะปาปาและ Katz, 1994; Su, Pagliaro, Schmidt, Pickar, Wolkowitz และ Rubinow, 1993) อย่างไรก็ตามมันเป็นสิ่งสำคัญที่ต้องจำไว้ว่าปริมาณยาที่ให้แก่อาสาสมัครของมนุษย์นั้นต่ำกว่าปริมาณที่ได้รับการสนับสนุนบนเว็บไซต์สร้างร่างกายและระยะเวลาการรักษาโดยทั่วไปจะสั้น ดังนั้นในเรื่องความสมดุลดูเหมือนว่ายุติธรรมที่จะสรุปว่า AAS มีศักยภาพที่จะปรับปรุงพฤติกรรมแบบ agonistic อย่างน้อยในบุคคลที่มีความอ่อนไหว สมเด็จพระสันตะปาปาและคณะ (1994) พบว่า AAS ล้วงเอาอาการทางจิตเวชในบุคคลที่มีช่องโหว่
การศึกษาสัตว์ยังได้ให้หลักฐานที่น่าสนใจสำหรับการรุกรานของ AAS แฮมสเตอร์เพศชายวัยรุ่นที่ได้รับการรักษาด้วยสเตียรอยด์ขนาดสูงนั้นมีระยะเวลาในการโจมตีสั้นกว่าและมีการโจมตีและกัดจำนวนมากต่อผู้บุกรุกเพศชายเมื่อเปรียบเทียบกับเพศชายที่ไม่ได้รับการรักษาHarrison, Connor, Nowak, Nash, และ Melloni, 2000; Melloni, Connor, Hang, Harrison, และ Ferris, 1997) ในทำนองเดียวกันการยั่วยุที่ไม่รุนแรง (หาง - เหน็บแนม) ก่อให้เกิดความก้าวร้าวในหนูชายวัยรุ่นเพิ่มขึ้นอย่างต่อเนื่องรวมถึงการรุกรานต่อผู้หญิง (คันนิงแฮมและ McGinnis, 2006) จากความกังวลที่มากยิ่งขึ้นการได้รับ AAS ของวัยรุ่นในแฮมสเตอร์ทำให้พฤติกรรม agonistic เพิ่มขึ้นอย่างต่อเนื่องซึ่งยังคงมีอยู่หลังจากการใช้สเตียรอยด์ถูกยกเลิก (Grimes and Melloni, 2006) การเปลี่ยนแปลงพฤติกรรมเหล่านี้จะมาพร้อมกับการเปลี่ยนแปลงของวงจรประสาทในมลรัฐด้านหน้า โดยเฉพาะอย่างยิ่งการได้รับ AAS ของวัยรุ่นในแฮมสเตอร์ช่วยเพิ่ม arginine vasopressin (AVP, Grimes and Melloni, 2006) และ downregulates serotonin และ serotonergic 5HT1A และ 5HT1B ตัวรับ (Ricci, Rasakham, Grimes, และ Melloni, 2006) ไม่น่าแปลกใจที่ AAS จะเปลี่ยนระดับสมองของ AR เช่นกัน การได้รับฮอร์โมนเทสโทสเตอโรนหรือนันโรลโลนเรื้อรังทำให้เซลล์ AR ของนิวเคลียสเพิ่มขึ้นในหนูตัวผู้ (เมนาร์ดและฮาร์ลาน 1993; Wesson and McGinnis, 2006) ดังนั้นจึงมีความเป็นไปได้ที่ AAS จะปรับปรุงพฤติกรรมที่ขึ้นกับแอนโดรเจนทั้งโดยการเสริมแอนโดรเจนภายนอกและโดยการเพิ่มการตอบสนองแอนโดรเจนผ่านการแสดงออกของ AR ที่เพิ่มขึ้น
เมื่อเทียบกับพฤติกรรมทาง agonistic, AAS มีผลกระทบน้อยกว่าพฤติกรรมการผสมพันธุ์ในหนูตัวผู้และการตอบสนองขึ้นอยู่กับเตียรอยด์เฉพาะที่ใช้ (ดูใน คลาร์กและเฮนเดอร์สัน 2003) ในหนูแฮมสเตอร์เพศชายที่บริโภคฮอร์โมนเทสโทสเตอโรนในสารละลายในช่องปากการหลั่งออกมาจะเพิ่มขึ้นในลักษณะที่ขึ้นกับขนาดของยา (ไม้ 2002) อย่างไรก็ตามฮอร์โมนเพศชายและ nandrolone ไม่ได้ปรับปรุงการผสมพันธุ์ในหนูตัวผู้วัยรุ่น Stanozolol ซึ่งเป็น AAS ที่มีศักยภาพน้อยกว่าที่มีกิจกรรมแอนโดรเจนน้อยที่สุดยับยั้งการผสมพันธุ์และการรุกราน (Farrell and McGinnis, 2003) จริง ๆ แล้วน่าจะลดระดับแอนโดรเจนและภายนอก
เป็นสิ่งสำคัญโดยเฉพาะอย่างยิ่งที่จะต้องทราบว่าวัยรุ่นและแฮมสเตอร์สำหรับผู้ใหญ่สามารถแสดงพฤติกรรมตอบสนองต่อการสัมผัส AAS ที่แตกต่างกัน ในขณะที่ AAS ปรับปรุงพฤติกรรมทาง agonistic อย่างเห็นได้ชัดในวัยรุ่นชายการรักษาแบบเดียวกันในผู้ใหญ่ก็เพิ่มขึ้นเล็กน้อยในพฤติกรรมก้าวร้าวและลดพฤติกรรมทางเพศลงอย่างมาก (Salas-Ramirez, Montaldo และ Sisk, 2008) สิ่งนี้สอดคล้องกับแนวคิดของวัยรุ่นว่าเป็นช่วงเวลาอ่อนไหวสำหรับการกระทำของแอนโดรเจน ยิ่งกว่านั้นเช่นเดียวกับแฮมสเตอร์เพศชายที่เป็นผู้ใหญ่ได้รับความอดทนต่อฮอร์โมนเทสโทสเตอโรนภายนอกปีเตอร์สและไม้ 2005) เราเชื่อว่าการพัฒนาเพศชายได้รับความอดทนต่อฮอร์โมนเพศชายเมื่อพวกเขาโตเต็มที่ ดังนั้นผลของการเปลี่ยนแปลง AAS ในการพัฒนาของวัยรุ่นและการเปิดรับ AAS ของวัยรุ่นสามารถทำให้เกิดรูปแบบพฤติกรรมก้าวร้าวและพฤติกรรมทางเพศที่มากเกินไปซึ่งอาจคงอยู่ในวัยผู้ใหญ่
การเสริมฤทธิ์ของแอนโดรเจน
การผสมพันธุ์และการต่อสู้นั้นเป็นสิ่งที่คุ้มค่า (อย่างน้อยถ้าคุณชนะการต่อสู้) หนูตัวผู้จะกดคันโยกซ้ำ ๆ เพื่อที่จะมีเพศสัมพันธ์กับผู้หญิง (Everitt และ Stacey, 1987) ในทำนองเดียวกันหนูแฮมสเตอร์ตัวผู้และตัวเมียจะสร้างสถานที่ตามที่กำหนด (CPP) สำหรับสถานที่ที่พวกเขาเคยชนะการต่อสู้มาก่อน (Martinez, Guillen-Salazar, Salvador และ Simon, 1995; Meisel และ Joppa, 1994) หาก AAS สามารถปรับปรุงพฤติกรรมทางสังคมที่ให้ผลตอบแทนสูงกว่าระดับปกติที่พบในผู้ชายที่มีอวัยวะสืบพันธุ์เหมือนกันมันก็สมเหตุสมผลที่จะคาดหวังว่าฮอร์โมนเพศชายเองนั้นอาจให้ผลตอบแทน สิ่งนี้ได้รับการทดสอบโดยใช้แบบจำลองสัตว์ที่ได้รับการยอมรับอย่างดีสำหรับการให้รางวัลและการเสริมกำลัง: CPP และการดูแลตนเอง ผลการศึกษาเหล่านี้แสดงให้เห็นว่าฮอร์โมนเทสโทสเตอโรนเสริมแรงในบริบทของการทดลองที่ไม่มีผลกระทบด้านอนาโบลิกและประสิทธิภาพของการกีฬา ด้วย CPP สารทดสอบจะถูกจับคู่ซ้ำ ๆ กับสภาพแวดล้อมที่ไม่ซ้ำกัน (ตัวอย่างเช่นห้องเฉพาะในอุปกรณ์ทดสอบ) เมื่อสัตว์เชื่อมโยงสารทดสอบที่เสริมเข้ากับสภาพแวดล้อมนั้นเขาจะค้นหาสภาพแวดล้อมแม้ว่าจะไม่ได้รับรางวัลก็ตาม รายงานครั้งแรกของรางวัลแอนโดรเจนในสัตว์ทดลองใช้การฉีดฮอร์โมนเทสโทสเตอโรนเพื่อกระตุ้น CPP ในหนูตัวผู้ (Arnedo, Salvador, Martinez-Sanchis และ Gonzalez-Bono, 2000; Arnedo, Salvador, Martinez-Sanchis และ Pellicer, 2002) และหนู (Alexander, Packard และ Hines, 1994; de Beun, Jansen, Slangen และ Van de Poll, 1992) ต่อจากนั้นห้องปฏิบัติการของเราใช้ฮอร์โมนเทสโทสเตอโรนด้วยตนเองเพื่อแสดงการเสริมแอนโดรเจน (จอห์นสันและวูด 2001) เราพบว่าแฮมสเตอร์เพศผู้จะบริโภคสารละลายเทสโทสเตอโรนด้วยวิธีสมัครใจโดยใช้ทั้งการทดสอบทางเลือกขวด 2 และการดื่มที่เกิดจากอาหาร ในการศึกษาต่อมาเราได้สาธิตการบริหารตนเองของหนูตัวผู้และหนูแฮมสเตอร์ (Wood, Johnson, Chu, Schad และ Self, 2004) การให้ทางหลอดเลือดดำช่วยลดผลกระทบที่อาจเกิดขึ้นกับรสชาติหรือไส้ในการเติมแอนโดรเจน
ในบริบทของการละเมิด AAS มันเป็นสิ่งสำคัญที่จะแยกความแตกต่างระหว่างกลางและผลต่อพ่วงของแอนโดรเจน เนื่องจากฮอร์โมนเทสโทสเตอโรนมีผลอย่างกว้างขวางทั่วร่างกายจึงอาจเป็นที่ถกเถียงกันอยู่ว่าการให้รางวัลและการเสริมแรงด้วยการฉีดเทสโทสเทอโรนระบบเป็นสิ่งรองลงมาจากการกระทำของระบบโบลิคและแอนโดรเจน อาจกล่าวได้ว่าฮอร์โมนเทสโทสเตอโรนช่วยลดความเมื่อยล้าของกล้ามเนื้อและช่วยปรับปรุงการทำงานของข้อต่อเพื่อให้สัตว์เพียง รู้สึก ดีกว่า อันที่จริงคำอธิบายนี้ถูกนำมาใช้ในวรรณคดีทางคลินิก (แม้ว่าจะไม่มีหลักฐานการทดลอง) เพื่อโต้เถียงกับศักยภาพในการพึ่งพาและติดยาเสพติดไปยัง AAS (DiPasquale, 1998) อย่างไรก็ตาม Packard et al (Packard, Cornell และ Alexander, 1997) พบว่าการฉีดฮอร์โมนเทสโทสเตอโรนลงในสมองหนูโดยตรงสามารถทำให้เกิด CPP ในทำนองเดียวกันห้องปฏิบัติการของเราได้แสดงให้เห็นถึงการจัดการด้วยตนเองในเทสโทสเตอโรน (ICV) intracerebroventricular (แฮมสเตอร์ชาย) (ไม้และคณะ 2004) Intracerebral CPP และ icv การบริหารตนเองด้วยฮอร์โมนเพศชายโต้แย้งสำหรับเป้าหมายกลางไกล่เกลี่ยการเสริมแรง androgen
เป็นที่น่าสังเกตว่าการเสริมเทสโทสเทอโรนไม่จำเป็นต้องทำตามกลไกเดิมที่กำหนดไว้ก่อนหน้าสำหรับผลสเตียรอยด์ต่อพฤติกรรมทางเพศ ดังที่ได้กล่าวไปก่อนหน้านี้ MPOA เป็นเว็บไซต์ที่สำคัญสำหรับการจัดระเบียบพฤติกรรมทางเพศของหนูเพศผู้ (Hull, Meisel และ Sachs, 2002) ในแฮมสเตอร์ MPOA มีตัวรับสเตียรอยด์มากมายและการปลูกถ่ายเทสโทสเทอโรนใน MPOA คืนค่ากิจกรรมทางเพศในระยะยาวWood and Swann, 1999) ระยะเวลาของผลของสเตียรอยด์เหล่านี้ช้า: พฤติกรรมการติดตั้งยังคงมีอยู่หลายสัปดาห์หลังการผ่าตัดกล้วยไม้และการเปิดรับสเตียรอยด์แบบขยายจำเป็นต้องเรียกคืนการผสมพันธุ์ในระยะยาวโนเบิลและอัลซุม 1975) อย่างไรก็ตามการฉีดฮอร์โมนเทสโทสเตอโรนลงใน MPOA ของหนูตัวผู้ไม่สามารถชักนำให้เกิด CPP (King, Packard และ Alexander, 1999) นี่แสดงให้เห็นว่าสมองส่วนอื่นมีความสำคัญต่อการเสริมแอนโดรเจน
ในทางตรงกันข้ามหนูเพศผู้จะสร้าง CPP เพื่อฉีดฮอร์โมนเทสโทสเตอโรนใน Acb (Packard et al., 1997) เช่นเดียวกับยาเสพติดอื่น ๆ ในทางที่ผิด DA มีแนวโน้มว่าจะเป็นสารสื่อประสาทสำคัญสำหรับการเสริมฮอร์โมนเพศชาย: CPP ที่เกิดจากการฉีดฮอร์โมนเทสโทสเตอโรนระบบถูกบล็อกโดย D1 และ D2 dopamine receptor antagonists (ชโรเดอร์และแพคการ์ด 2000) อย่างไรก็ตามแตกต่างจากยาเสพติดอื่น ๆ ของการละเมิดการศึกษาของเราในแฮมสเตอร์แนะนำว่าฮอร์โมนเพศชายไม่ได้ทำให้เกิดการปล่อย Acb DA (Triemstra, Sato และ Wood ในการกด) การศึกษาของหนูเพศผู้แสดงให้เห็นว่าแอนโดรเจนไม่มีผลต่อระดับ DA พื้นฐานหรือการปลดปล่อยแอมเฟตามีนBirgner, Kindlundh-Hogberg, Nyberg และ Bergstrom, 2006; แต่ยังเห็น Clark, Lindenfeld และ Gibbons, 1996) นอกจากนี้ฮอร์โมนเพศชายยังมีอิทธิพลเล็กน้อยต่อระดับเนื้อเยื่อ Acb DA (Thiblin, Finn, Ross และ Stenfors, 1999) ร่วมกันข้อมูลเหล่านี้ชี้ให้เห็นว่าถึงแม้ว่าการเสริมฮอร์โมนเพศชายในที่สุดอาจเปลี่ยนแปลงกิจกรรม DA ใน Acb กลไกอาจแตกต่างจากโคเคนหรือสารกระตุ้นอื่น ๆ ในเรื่องนี้ข้อมูลล่าสุดชี้ให้เห็นว่าการได้รับ AAS เรื้อรังอาจเปลี่ยนความไวต่อ DA โดยการเปลี่ยนการเผาผลาญ DAKurling, Kankaanpaa, Ellermaa, Karila และ Seppala, 2005) ระดับของตัวรับ DA (Kindlundh, Lindblom, Bergstrom, Wikberg และ Nyberg, 2001; Kindlundh, Lindblom และ Nyberg, 2003) หรือผู้ขนส่ง DA (Kindlundh, Bergstrom, Monazzam, Hallberg, Blomqvist, Langstrom และ Nyberg, 2002).
ในปัจจุบันไม่ทราบสัญญาณสเตียรอยด์ตัวรับและไซต์สมองของการดำเนินการสำหรับการเสริมฮอร์โมนเพศชายโดยเฉพาะ จากการศึกษาล่าสุดของแฮมสเตอร์จากห้องปฏิบัติการของเราผลเสริมของฮอร์โมนเพศชายดูเหมือนจะไกล่เกลี่ยโดยทั้งแอนโดรเจนและเอสโตรเจน (DiMeo และไม้ 2006) AAS ที่ใช้กันทั่วไปที่ถูกทารุณกรรมรวมถึงแอนโดรเจนทั้งแบบ aromatizable และ non-aromatizable (Gallaway, 1997; WADA, 2006) นี่ก็หมายความว่าทั้ง AR และ ER อาจสร้างสิ่งเร้า steroidal เพื่อให้รางวัล มีความเป็นไปได้เพิ่มเติมที่การเสริมแรงฮอร์โมนเทสโทสเตอโรนอาจเป็นสื่อกลางโดยการรวมกันของตัวรับแบบดั้งเดิมและแบบที่ไม่ใช่จีโนม
หลักฐานหลายบรรทัดชี้ไปที่การกระทำของตัวรับที่ไม่ใช่จีโนมในผลเสริมแรงของ AAS นอกเหนือจากการกระจาย AR แบบเบาบางใน Acb และ VTA แล้วการเสริมแรงของแอนโดรเจนยังเร็ว (<30 นาที) และการประมวลผลสัญญาณผ่าน AR แบบคลาสสิกอาจไม่เร็วพอสำหรับการเสริมแรง ดังนั้นเพื่อทดสอบบทบาทของ AR ที่ไม่ใช่จีโนมในการเสริมแรง AAS เราใช้เทคนิคเสริมสองอย่าง (มะเดื่อ. 7) ในหนึ่งการทดสอบSato, Johansen, Jordan และ Wood, 2006) เราอนุญาตให้หนูที่มีการกลายพันธุ์ของลูกอัณฑะหญิง (Tfm, ดูปัญหานี้) ไปยังการดูแลตนเอง dihydrotestosterone (DHT), แอนโดรเจนที่ไม่สามารถสังเคราะห์ได้ การกลายพันธุ์ Tfm ช่วยลดการยึดเกาะแกนด์ที่ AR อย่างมาก อย่างไรก็ตามหนู Tfm และพี่น้องเพศชายในป่าของพวกเขาจัดการด้วยตนเองในปริมาณที่เท่ากันของ DHT เรื่องนี้ระบุว่าไม่ใช่ผลกระทบของจีโนม - DHT ในการศึกษาครั้งต่อไปเราได้พิจารณาแล้วว่าหนูแฮมสเตอร์เพศชายจะดูแล DHT ด้วยตนเองกับวัวซีรัมอัลบูมิน (BSA) หรือไม่ มะเดื่อ. 8, Sato and Wood, 2007) คอนจูเกต DHT-BSA เป็นเมมเบรนที่ไม่สามารถซึมผ่านได้ ดังนั้นผลของมันจะถูก จำกัด ที่ผิวเซลล์ แฮมสเตอร์ DHT ที่บริหารจัดการตนเองดังที่แสดงไว้ก่อนหน้านี้ (DiMeo และไม้ 2006) พวกเขาแสดงให้เห็นถึงการตั้งค่าที่คล้ายกันสำหรับคอนจูเกต DHT-BSA แต่ล้มเหลวในการจัดการ BSA ด้วยตนเองเพียงอย่างเดียว

มะเดื่อ. 7

มะเดื่อ. 8
ข้อมูลเหล่านี้ชี้ไปที่บทบาทสำคัญสำหรับ ARs ของเซลล์ผิวในการเสริมแอนโดรเจน ปัจจุบันยังไม่ทราบลักษณะที่แน่นอนของผู้รับดังกล่าว มีการแนะนำว่าแอนโดรเจนอาจทำหน้าที่ที่ผิวเซลล์ผ่านการจับกับเยื่อหุ้มเซลล์ AR (Thomas, Dressing, Pang, Berg, Tubbs, Benninghoff และ Doughty, 2006และดูปัญหานี้ด้วย) นี่อาจเป็นรูปแบบของอาวุธนิวเคลียร์คลาสสิก AR ที่รายงานในฮิบโป (Sarkey et al., ในฉบับนี้) อีกทางเลือกหนึ่งการศึกษาก่อนหน้านี้ยังได้อธิบายไซต์สเตียรอยด์ที่มีผลผูกพันกับระบบสารสื่อประสาทอื่น ๆ โดยเฉพาะฮอร์โมนสเตียรอยด์หลากหลายชนิดรวมถึง AAS สามารถปรับระดับตัวรับ GABA-A ได้เฮนเดอร์สัน, 2007; Lambert, Belelli, Peden, Vardy และ Peters, 2003) neurosteroids ที่มีซัลเฟตในทำนองเดียวกันสามารถปรับเปลี่ยนกิจกรรมของ N-methyl-D- แยกประเภทย่อยตัวรับ (Malayev, Gibbs และ Farb, 2002) ผู้รับ นี่เป็นพื้นที่สำคัญสำหรับการวิจัยในอนาคต
ทำไมต้องมีพังผืด AR? ตามที่กล่าวไว้ก่อนหน้านี้มีการเชื่อมโยงอย่างใกล้ชิดระหว่างการหลั่งแอนโดรเจนกับพฤติกรรมทางสังคมที่คุ้มค่า เราสามารถคาดการณ์ได้ว่าการหลั่งฮอร์โมนเทสโทสเตอโรนที่เพิ่มขึ้นหลังจากการผสมพันธุ์หรือการต่อสู้จะช่วยเสริมสร้างพฤติกรรม ถ้าเป็นเช่นนั้นจำเป็นต้องมีการมีเพศสัมพันธ์อย่างรวดเร็วของการกระตุ้น (พฤติกรรม) และรางวัล (ฮอร์โมนเพศชาย) สิ่งนี้สามารถทำได้ดีที่สุดผ่านการผูกกับเยื่อหุ้มเซลล์ AR ในเรื่องนี้มันจะเป็นที่สนใจเพื่อตรวจสอบว่าการหลั่งแอนโดรเจนในระหว่างการผสมพันธุ์จะช่วยลดผลกระทบของพฤติกรรมทางเพศที่คุ้มค่าหรือไม่
สรุป
ที่นี่เราตรวจสอบหลักฐานที่ว่าแอนโดรเจนเป็นผู้ไกล่เกลี่ยที่มีศักยภาพของพฤติกรรมที่ได้รับแรงบันดาลใจสำหรับผู้ใหญ่และยิ่งกว่านั้นเวลาของการเปิดรับแอนโดรเจนในระหว่างการพัฒนาโปรแกรมและพฤติกรรมที่ขึ้นอยู่กับแรงจูงใจในวัยผู้ใหญ่ อะนาโบลิคสเตียรอยด์กลายเป็นยายอดนิยมสำหรับวัยรุ่นในสหรัฐอเมริกา ในขณะที่ AAS อาจไม่มีโคเคนหรือเฮโรอีนที่รุนแรง แต่เราเพิ่งเริ่มเข้าใจถึงศักยภาพในการเสริมและติดแอนโดรเจน โดยเฉพาะอย่างยิ่งเมื่อกีฬาเยาวชนเริ่มมีการแข่งขันมากขึ้นจึงมีแรงกดดันเพิ่มขึ้นในการพัฒนานักกีฬาให้ใช้สเตอรอยด์โดยเริ่มตั้งแต่อายุยังน้อย แนวโน้มนี้เป็นปัญหาในมุมมองของหลักฐานใหม่สำหรับการสุกของระบบประสาทสเตียรอยด์ที่มีความอ่อนไหวในวัยรุ่น
แม้จะมีการรับรู้เพิ่มขึ้นทั้งในที่สาธารณะและชุมชนวิทยาศาสตร์เกี่ยวกับการเปลี่ยนแปลงของระบบประสาทที่ลึกซึ้งพร้อมกับวัยรุ่นการศึกษาทดลองของระบบประสาทวิทยาพัฒนาการของวัยแรกรุ่นได้ถูก จำกัด แบบจำลองสัตว์ของการพัฒนาวัยรุ่นมีความจำเป็นในการตรวจสอบว่าระยะเวลาของการเปิดรับฮอร์โมนในระหว่างการพัฒนาเพิ่มความเสี่ยงของแต่ละบุคคลสำหรับโรคจิตและการใช้ยาและประเภทของประสบการณ์ที่บรรเทาหรือขยายผลกระทบพฤติกรรมของการเบี่ยงเบนในช่วงเวลา ตัวอย่างเช่นปัจจัยทางสังคมเช่นอิทธิพลเพียร์ทำให้รุนแรงขึ้นผลกระทบของระยะเวลา pubertal สำหรับการใช้สารและแอลกอฮอล์ (Biehl, Natsuaki และ Ge, 2007; Patton, Novy, Lee และ Hickok, 2004; Simons-Morton และ Haynie, 2003; Wichstrom และ Pedersen, 2001) แบบจำลองสัตว์ของระยะเวลา pubertal จะแจ้งความพยายามในการวิจัยของมนุษย์และอาจนำไปสู่การแทรกแซงการรักษาที่มีประสิทธิภาพมากขึ้นในช่วงวัยรุ่น
กิตติกรรมประกาศ
เราขอขอบคุณ Eleni Antzoulatos, Cortney Ballard, Lucy Chu, Kelly Peters, Jennifer Triemstra, Jane Venier, Lisa Rogers และ Pamela Montalto สำหรับความช่วยเหลือในการศึกษาเหล่านี้ งานนี้สนับสนุนโดยทุนจาก NIH (DA12843 ถึง RIW, MH68764 ถึง CLS และ MH070125 ถึง KMS)
เชิงอรรถ
ข้อจำกัดความรับผิดชอบของผู้จัดพิมพ์: นี่เป็นไฟล์ PDF ของต้นฉบับที่ไม่มีการแก้ไขซึ่งได้รับการยอมรับให้ตีพิมพ์ เพื่อเป็นการบริการลูกค้าของเราเรากำลังจัดทำต้นฉบับฉบับแรกนี้ ต้นฉบับจะได้รับการคัดลอกเรียงพิมพ์และตรวจสอบหลักฐานที่เป็นผลลัพธ์ก่อนที่จะเผยแพร่ในรูปแบบที่อ้างอิงได้สุดท้าย โปรดทราบว่าในระหว่างกระบวนการผลิตข้อผิดพลาดอาจถูกค้นพบซึ่งอาจส่งผลกระทบต่อเนื้อหาและการปฏิเสธความรับผิดชอบทางกฎหมายทั้งหมดที่ใช้กับวารสารที่เกี่ยวข้อง
อ้างอิง
- Alexander GM, Packard MG, Hines M. Testosterone มีคุณสมบัติทางอารมณ์ในหนูเพศผู้: ความหมายสำหรับพื้นฐานทางชีวภาพของแรงจูงใจทางเพศ ประสาทวิทยาศาสตร์เชิงพฤติกรรม. 1994;108: 424 8- [PubMed]
- Andersen SL เส้นทางการพัฒนาสมอง: จุดอ่อนหรือหน้าต่างแห่งโอกาส? ความคิดเห็นเกี่ยวกับประสาทและชีวพฤติกรรม 2003;27: 3 18- [PubMed]
- Andersen SL, Rutstein M, Benzo JM, Hostetter JC, Teicher MH ความแตกต่างทางเพศในการรับและการกำจัดโดปามีนมากเกินไป Neuroreport 1997;8: 1495 8- [PubMed]
- MT Arnedo, ซัลวาดอร์, มาร์ติเนซ - ซันชิสเอส, กอนซาเลซ - โบโนอีคุณสมบัติของเทสโทสเตอโรนในหนูเพศผู้: การศึกษานำร่อง เภสัชวิทยาชีวเคมีและพฤติกรรม 2000;65: 327 32-
- MT Arnedo, Salvador A, Martinez-Sanchis S, Pellicer O. ผลตอบแทนที่คล้ายคลึงกันของเทสโทสเตอโรนในหนูจัดอันดับในระยะสั้นและระยะยาว ชีววิทยาของการเสพติด 2002;7: 373 9- [PubMed]
- Arnold AP, Breedlove SM ผลกระทบระดับองค์กรและการเปิดใช้งานของสเตอรอยด์ทางเพศต่อสมองและพฤติกรรม: การวิเคราะห์ซ้ำ ฮอร์โมนและพฤติกรรม 1985;19: 469 98- [PubMed]
- Benes FM, Taylor JB, Cunningham MC การบรรจบกันและความเป็นพลาสติกของระบบ monoaminergic ในเยื่อหุ้มสมอง prefrontal ที่อยู่ตรงกลางในช่วงหลังคลอด: ผลกระทบต่อการพัฒนาของโรคจิต Cortex สมอง 2000;10: 1014 27- [PubMed]
- Benes FM, Turtle M, Khan Y, Farol P. Myelination ของเขตการถ่ายทอดสำคัญในรูปแบบ hippocampal เกิดขึ้นในสมองของมนุษย์ในช่วงวัยเด็กวัยรุ่นและวัยผู้ใหญ่ จดหมายเหตุของจิตเวชทั่วไป 1994;51: 477 84- [PubMed]
- Biehl MC, Natsuaki MN, Ge XJ อิทธิพลของจังหวะเวลาผับต่อการใช้แอลกอฮอล์และวิถีการดื่มหนัก วารสารเยาวชนและวัยรุ่น 2007;36: 153 167-
- Birgner C, Kindlundh-Hogberg AM, Nyberg F, Bergstrom L. จดหมายประสาทวิทยา 2006 การเปลี่ยนแปลงระดับ extracellular ของ DOPAC และ HVA ในหนูนิวเคลียส accumbens เชลล์ในการตอบสนองต่อการบริหาร nandrolone ย่อยเรื้อรังและความท้าทายแอมเฟตามีนที่ตามมา
- ตราสารหนี้ AJ, Choi PY, Pope HG., Jr การประเมินความลำเอียงและอารมณ์ในผู้ใช้และผู้ที่ไม่ใช้สเตียรอยด์แอนโบลิกและแอนโดรเจน การพึ่งพายาและแอลกอฮอล์ 1995;37: 241 5- [PubMed]
- Brower KJ Anabolic เตียรอยด์และการพึ่งพา รายงานจิตเวชศาสตร์ปัจจุบัน 2002;4: 377 87- [PubMed]
- Brower KJ, Catlin DH, Blow FC, Eliopulos GA, Beresford TP การทดสอบทางคลินิกและการทดสอบปัสสาวะสำหรับการใช้สเตียรอยด์ anabolic-androgenic และการพึ่งพาอาศัยกัน American Journal of Drug & Alcohol Abuse. 1991;17: 161 171- [PubMed]
- Celotti F, Negri-Cesi P, Poletti A. การเผาผลาญสเตียรอยด์ในสมองของสัตว์เลี้ยงลูกด้วยนม: 5alpha-reduction และ aromatization ประกาศการวิจัยสมอง 1997;44: 365 75- [PubMed]
- Chung WC, De Vries GJ, Swaab DF ความแตกต่างทางเพศของนิวเคลียสเตียงของ stria terminalis ในมนุษย์อาจขยายไปสู่วัยผู้ใหญ่ วารสารประสาทวิทยา 2002;22: 1027 33- [PubMed]
- Clark AS, Henderson LP การตอบสนองเชิงพฤติกรรมและสรีรวิทยาต่อเตียรอยด์แอนโบลิกและแอนโดรเจน ความคิดเห็นเกี่ยวกับประสาทและชีวพฤติกรรม 2003;27: 413 36- [PubMed]
- Clark AS, Lindenfeld RC, ชะนี CH Anabolic-androgenic เตียรอยด์และรางวัลสมอง เภสัชวิทยาชีวเคมีและพฤติกรรม 1996;53: 741 5-
- Conacher GN คนงาน DG อาชญากรรมรุนแรงอาจเกี่ยวข้องกับการใช้สเตียรอยด์โบลิค วารสารจิตเวชอเมริกัน 1989;146: 679 [PubMed]
- คันนิงแฮม RL, McGinnis MY การยั่วยุทางกายภาพของสเตียรอยด์อะนาโบลิคแอนโดรเจนและแอนโดรเจนที่สัมผัสกับหนูตัวผู้ทำให้เกิดการรุกรานต่อผู้หญิง ฮอร์โมนและพฤติกรรม 2006;50: 410 6- [PubMed]
- Daly RC, Su TP, Schmidt PJ, Pickar D, Murphy DL, Rubinow DR ของเหลวในสมองและการเปลี่ยนแปลงพฤติกรรมหลังจากการบริหาร methyltestosterone: การค้นพบเบื้องต้น จดหมายเหตุของจิตเวชทั่วไป 2001;58: 172 7- [PubMed]
- EC Davis, Shryne JE, Gorski RA dimorphisms ทางเพศโครงสร้างในนิวเคลียส anteroventral periventricular ของหนู hypothalamus มีความไวต่อสเตียรอยด์อวัยวะสืบพันธุ์ perinatally แต่พัฒนา peripubertally neuroendocrinology 1996;63: 142 8- [PubMed]
- de Beun R, Jansen E, สแลงเจแอล, แวนเดลโพล เทสโทสเตอโรนเป็นตัวกระตุ้นและกระตุ้นการเลือกปฏิบัติในหนู: ผลกระทบทางเพศและยาขึ้นอยู่กับปริมาณ สรีรวิทยาและพฤติกรรม. 1992;52: 629 34- [PubMed]
- เดคาบันเอเอส การเปลี่ยนแปลงของน้ำหนักสมองในช่วงชีวิตมนุษย์: ความสัมพันธ์ของน้ำหนักสมองกับความสูงของร่างกายและน้ำหนักของร่างกาย พงศาวดารของประสาทวิทยา 1978;4: 345 56- [PubMed]
- Di Chiara G, Imperato A. ยาเสพติดที่ถูกทารุณกรรมโดยมนุษย์เพิ่มความเข้มข้นของโดปามีนใน synaptic dopamine ในระบบ mesolimbic ของหนูที่เคลื่อนไหวอย่างอิสระ การดำเนินการของ National Academy of Sciences ของสหรัฐอเมริกา 1988;85: 5274 8- [บทความฟรี PMC] [PubMed]
- DiMeo AN, Wood RI การบริหารตนเองของสโตรเจนและ dihydrotestosterone ในแฮมสเตอร์เพศชาย ฮอร์โมนและพฤติกรรม 2006;49: 519 26- [PubMed]
- DiPasquale M. เตียรอยด์ Anabolic ใน: Tarter RE, Ammerman RT, Ott PJ, Editors คู่มือการใช้สารเสพติด กด Plenum; นิวยอร์ก: 1998 pp. 547 – 565
- Dominguez J, Riolo JV, Xu Z, Hull EM ระเบียบโดย amygdala อยู่ตรงกลางของการมีเพศสัมพันธ์และการปลดปล่อยโดพามีนอยู่ตรงกลาง วารสารประสาทวิทยา 2001;21: 349 355- [PubMed]
- Dominguez JM, Hull EM การกระตุ้นของ amygdala อยู่ตรงกลางช่วยเพิ่มการปลดปล่อยโดพามีนอยู่ตรงกลาง: ผลกระทบต่อพฤติกรรมทางเพศของหนูเพศชาย การวิจัยสมอง 2001;917: 225 229- [PubMed]
- Du J, Lorrain DS, Hull EM ตอนลดลง extracellular แต่เพิ่มเซลล์โดพามีนในพื้นที่ preoptic อยู่ตรงกลางของหนูเพศผู้ การวิจัยสมอง 1998;782: 11 17- [PubMed]
- Eckenhoff MF, Rakic P. ธรรมชาติและชะตากรรมของเซลล์ proliferative ในฮิพโพแคมปัส dentate gyrus ในช่วงชีวิตของลิงจำพวก วารสารประสาทวิทยา 1988;8: 2729 47- [PubMed]
- Everitt BJ, Stacey P. การศึกษาพฤติกรรมเครื่องมือพร้อมการเสริมแรงทางเพศในหนูตัวผู้ (Rattus norvegicus): II. ผลของรอยโรคบริเวณ preoptic การตัดอัณฑะและฮอร์โมนเพศชาย วารสารจิตวิทยาเปรียบเทียบ. 1987;101: 407 19- [PubMed]
- Gallaway S. พระคัมภีร์เตียรอยด์ เบลล์อินเตอร์เนชั่นแนลเพรส; แซคราเมนโตแคลิฟอร์เนีย: 1997
- Galligani N, Renck A, Hansen S. ข้อมูลส่วนตัวของผู้ชายที่ใช้สเตียรอยด์แอนโดรโบลิกและแอนโดรเจน ฮอร์โมนและพฤติกรรม 1996;30: 170 5- [PubMed]
- กริมส์ JM, Melloni RH., จูเนียร์การเปลี่ยนแปลงเป็นเวลานานในระบบประสาท serotonin หลังจากการหยุดชะงักของการสัมผัสเตียรอยด์ anabolic-androgenic วัยรุ่นในแฮมสเตอร์ (Mesocricetus auratus) ประสาทวิทยาศาสตร์เชิงพฤติกรรม. 2006;120: 1242 51- [PubMed]
- Hannan CJ, Jr, Friedl KE, Zold A, Kettler TM, Plymate SR การเปลี่ยนแปลงของกรด homovanillic ทางจิตวิทยาและเซรั่มในผู้ชายที่ได้รับยาแอนโดรเจน Psychoneuroendocrinology 1991;16: 335 43- [PubMed]
- Harrison RJ, Connor DF, Nowak C, Nash K, Melloni RH., การรักษาด้วยสเตียรอยด์ anabolic-androgenic anabolic แอนโดรลิกเรื้อรังระหว่างวัยรุ่นเพิ่มขึ้น vasopressin ล่วงหน้าและการรุกรานในแฮมสเตอร์ที่ไม่บุบสลาย Psychoneuroendocrinology 2000;25: 317 38- [PubMed]
- เขาเจทีมงาน FT Neurogenesis ลดลงในระหว่างการสุกของสมองจากวัยรุ่นไปจนถึงวัยผู้ใหญ่ เภสัชวิทยาชีวเคมีและพฤติกรรม 2007;86: 327 33-
- ห้างหุ้นส่วนจำกัดเฮนเดอร์สัน การปรับสเตียรอยด์ของการส่งผ่านตัวกลางรับ GABAA ในมลรัฐ: ผลต่อการทำงานของระบบสืบพันธุ์ Neuropharmacology 2007;52: 1439 53- [บทความฟรี PMC] [PubMed]
- Hull EM, Du J, Lorrain DS, Matuszewich L. โดปามีน extracellular ในพื้นที่ preoptic อยู่ตรงกลาง: ความหมายสำหรับแรงจูงใจทางเพศและการควบคุมฮอร์โมนของการมีเพศสัมพันธ์ วารสารประสาทวิทยา 1995;15: 7465 7471- [PubMed]
- ฮัลล์ EM, Meisel RL, Sachs BD พฤติกรรมทางเพศชาย ใน: Pfaff DW, Arnold AP, Etgen AM, Fahrbach SE, Rubin RT, บรรณาธิการ ฮอร์โมนสมองและพฤติกรรม สื่อวิชาการ; นิวยอร์ก: 2002 pp. 3 – 137
- ฮัลล์ EM, Wood RI, McKenna KE ชีววิทยาของพฤติกรรมทางเพศชาย ใน: Neill JD, editor สรีรวิทยาการสืบพันธุ์ ฉบับ 1 Elsevier Press; นิวยอร์ก: 2006 pp. 1729 – 1824
- Huttenlocher PR, Dabholkar AS ความแตกต่างในระดับภูมิภาคใน synaptogenesis ในเปลือกสมองมนุษย์ วารสารประสาทวิทยาเปรียบเทียบ 1997;387: 167 78- [PubMed]
- Johnson LR, Wood RI เทสโทสเตอโรนรับประทานด้วยตนเองในแฮมสเตอร์ชาย neuroendocrinology 2001;73: 285 92- [PubMed]
- Johnston LD, O'Malley PM, Bachman JG นักเรียนมัธยม (NIH สิ่งพิมพ์หมายเลข 03 – 5375) I. Bethesda, MD: สถาบันยาเสพติดแห่งชาติ; 2003 การติดตามผลการสำรวจระดับชาติในอนาคตเรื่องการใช้ยา 1975 – 2002
- มูลนิธิครอบครัวไกเซอร์ กิจกรรมทางเพศของวัยรุ่นสหรัฐฯ 2005 pp. # 3040 – 02
- Kashon ML, Hayes MJ, Shek PP, Sisk CL กฎระเบียบของระบบภูมิคุ้มกันของแอนโดรเจนในสมองกับตัวรับแอนโดรเจนโดยแอนโดรเจน ชีววิทยาการสืบพันธุ์ 1995;52: 1198 205- [PubMed]
- Kindlundh AM, Bergstrom M, Monazzam A, Hallberg M, Blomqvist G, Langstrom B, Nyberg F. ผล Dopaminergic หลังการรักษาเรื้อรังด้วย nandrolone ที่มองเห็นได้ในสมองของหนูโดยการถ่ายภาพเอกซเรย์โพซิตรอน ความก้าวหน้าใน NeuroPsychopharmacology & Biological Psychiatry 2002;26: 1303 8-
- Kindlundh AM, Lindblom J, Bergstrom L, Wikberg JE, Nyberg F. anabolic-androgenic steroid nandrolone decanoate ส่งผลกระทบต่อความหนาแน่นของตัวรับโดปามีนในสมองหนูตัวผู้ วารสารประสาทวิทยาศาสตร์แห่งยุโรป 2001;13: 291 6- [PubMed]
- Kindlundh AM, Lindblom J, Nyberg F. การบริหารเรื้อรังด้วย nandrolone decanoate ทำให้เกิดการเปลี่ยนแปลงในเนื้อหายีน - การบันทึกของ dopamine D (1) - และ D (2) - ตัวรับในสมองของหนู การวิจัยสมอง 2003;979: 37 42- [PubMed]
- King BE, Packard MG, Alexander GM คุณสมบัติทางอารมณ์ของการฉีดฮอร์โมนเทสโทสเตอโรนในหนูตัวผู้ จดหมายประสาทวิทยา 1999;269: 149 52- [PubMed]
- Koob GF, Nestler EJ ชีววิทยาของการติดยาเสพติด วารสาร Neuropsychiatry & Clinical Neurosciences. 1997;9: 482 97- [PubMed]
- Kouri EM, Lukas SE, สมเด็จพระสันตะปาปา HG, Jr, Oliva PS เพิ่มการตอบสนองเชิงรุกในอาสาสมัครชายหลังจากการบริหารปริมาณฮอร์โมนเทสโทสเตอโรน การพึ่งพายาและแอลกอฮอล์ 1995;40: 73 9- [PubMed]
- Kritzer MF การผ่าตัดอวัยวะสืบพันธุ์ระยะยาวมีผลต่อความหนาแน่นของไทโรซีนไฮดรอกซีเลส - แต่ไม่ใช่โดปามีน - เบต้า - ไฮดรอกซี -, โคลีนอะเซทิลทรานเฟอเฟอเรส - หรือซอนเซโรโทนิน Cortex สมอง 2003;13: 282 296- [PubMed]
- Kurling S, Kankaanpaa A, Ellermaa S, Karila T, Seppala T. ผลของการรักษาด้วย nandrolone decanoate สำหรับโรคเรื้อรังที่มีต่อระบบประสาทของโดปามีนและเซโรโทจิกในสมองของหนู การวิจัยสมอง 2005;1044: 67 75- [PubMed]
- Lambert JJ, Belelli D, Peden DR, Vardy AW, Peters JA การปรับ Neurosteroid ของผู้รับ GABAA ความก้าวหน้าทางประสาทชีววิทยา 2003;71: 67 80- [PubMed]
- Lenroot RK, Giedd JN การพัฒนาสมองในเด็กและวัยรุ่น: ข้อมูลเชิงลึกจากการถ่ายภาพด้วยคลื่นสนามแม่เหล็กทางกายวิภาค ประสาทวิทยาศาสตร์และชีวพฤติกรรม 2006;30: 718 29-
- Lesting J, Neddens J, Teuchert-Noodt G. Ontogeny ของโดปามีนปกคลุมด้วยเส้นประสาทในนิวเคลียส accumbens ของเจอร์บิล การวิจัยสมอง 2005;1066: 16 23- [PubMed]
- Malayev A, Gibbs TT, Farb DH การยับยั้งการตอบสนองของ NMDA โดย pregnenolone ซัลเฟตเผยให้เห็นการปรับเลือกย่อยของตัวรับ NMDA โดยเตียรอยด์ซัลเฟต วารสารเภสัชวิทยาอังกฤษ. 2002;135: 901 9- [บทความฟรี PMC] [PubMed]
- Martinez M, Guillen-Salazar F, Salvador A, Simon VM การรุกรานระหว่างดวงที่ประสบความสำเร็จและความพึงพอใจของสถานที่ที่กำหนดไว้ในหนู สรีรวิทยาและพฤติกรรม. 1995;58: 323 8- [PubMed]
- ถ่อมตน LR, Romeo RD, วัค CM, Sisk CL การกระทำของเทสโทสเตอโรนในหนูแฮมสเตอร์ prepubertal และ postpubertal: การแยกตัวของผลกระทบต่อพฤติกรรมการสืบพันธุ์และสมอง ฮอร์โมนและพฤติกรรม 1997;31: 75 88-
- Meisel RL, Joppa MA การตั้งค่าสถานที่ที่กำหนดไว้ในแฮมสเตอร์หญิงตามการเผชิญหน้าที่ก้าวร้าวหรือทางเพศ สรีรวิทยาและพฤติกรรม. 1994;56: 1115 8- [PubMed]
- Melloni RH, Jr, Connor DF, Hang PT, Harrison RJ, Ferris CF การได้รับสเตียรอยด์แบบอะนาโบลิกและแอนโดรเจนในช่วงวัยรุ่นและพฤติกรรมก้าวร้าวในแฮมสเตอร์ทองคำ สรีรวิทยาและพฤติกรรม 1997;61: 359 64- [PubMed]
- Menard C, Harlan R. การควบคุมแอนโดรเจนรีแอคติวิตี้ของแอนโดรเจนในสมองของหนูด้วยแอนโดรเจนแอนโดรลิคและแอนโดรเจน การวิจัยสมอง 1993;622: 226 236- [PubMed]
- Mermelstein PG, Becker JB, Surmeier DJ Estradiol ช่วยลดกระแสแคลเซียมในเซลล์ประสาทหนูหนูผ่านทางตัวรับเมมเบรน วารสารประสาทวิทยา 1996;16: 595 604- [PubMed]
- Midgley SJ, Heather N, Davies JB ระดับความก้าวร้าวในกลุ่มผู้ใช้เตียรอยด์ anabolic-androgenic การแพทย์วิทยาศาสตร์และกฎหมาย 2001;41: 309 14-
- Molenda-Figueira HN, Salas-Ramirez KY, Schulz KM, Zehr JL, Montalto PR, Sisk CL ประสบการณ์ทางสังคมของวัยรุ่นคืนค่าพฤติกรรมอุทานผู้ใหญ่ในแฮมสเตอร์ซีเรียเพศชายที่ขาดฮอร์โมนเทสโทสเตอโรน สมาคมเพื่อระบบประสาทพฤติกรรม แปซิฟิกโกรฟ, แคลิฟอร์เนีย: 2007
- Noble RG, Alsum PB. ฮอร์โมนที่สัมพันธ์กับฮอร์โมนเพศหญิงในหนูแฮมสเตอร์สีทอง (Mesocricetus auratus) สรีรวิทยาและพฤติกรรม. 1975;14: 567 74- [PubMed]
- Nunez JL, Lauschke DM, Juraska JM การตายของเซลล์ในการพัฒนาเยื่อหุ้มสมองหลังในหนูตัวผู้และตัวเมีย วารสารประสาทวิทยาเปรียบเทียบ 2001;436: 32 41- [PubMed]
- Nunez JL, Sodhi J, Juraska JM ฮอร์โมนที่เกี่ยวกับรังไข่หลังจากวันที่ 20 หลังคลอดลดจำนวนเซลล์ประสาทในเยื่อหุ้มสมองภาพหนูหลัก วารสารชีววิทยา 2002;52: 312 21- [PubMed]
- O'Connor DB, Archer J, Wu FC ผลของฮอร์โมนเทสโทสเตอโรนต่ออารมณ์ความก้าวร้าวและพฤติกรรมทางเพศในชายหนุ่ม: การศึกษาแบบ double-blind, placebo-controlled, cross-over study วารสาร Clinical Endocrinology & Metabolism. 2004;89: 2837 45- [PubMed]
- Packard MG, Cornell AH, Alexander GM ให้รางวัลคุณสมบัติทางอารมณ์ของนิวเคลียส accumbens การฉีดฮอร์โมนเพศชาย ประสาทวิทยาศาสตร์เชิงพฤติกรรม. 1997;111: 219 24- [PubMed]
- Parfitt DB, Thompson RC, Richardson HN, Romeo RD, Sisk CL GnRH mRNA เพิ่มขึ้นกับวัยแรกรุ่นในสมองหนูแฮมสเตอร์ซีเรียเพศผู้ วารสารประสาทวิทยา 1999;11: 621 7- [PubMed]
- Parrott AC, Choi PY, Davies M. การใช้เตียรอยด์ Anabolic โดยนักกีฬาสมัครเล่น: ผลกระทบต่อสภาวะอารมณ์ทางจิตวิทยา วารสารเวชศาสตร์การกีฬาและสมรรถภาพทางกาย. 1994;34: 292 8- [PubMed]
- Patton PE, Novy MJ, Lee DM, Hickok LR การวินิจฉัยและผลการสืบพันธุ์หลังการผ่าตัดมดลูกที่สมบูรณ์, ปากมดลูกที่ซ้ำซ้อนและเยื่อบุโพรงมดลูก วารสารสูติศาสตร์และนรีเวชวิทยาอเมริกัน. 2004;190: 1669 75- 1675 8- [PubMed]
- Paus T, Collins DL, Evans AC, Leonard G, Pike B, Zijdenbos A. การสุกของสสารสีขาวในสมองของมนุษย์: การทบทวนการศึกษาด้วยคลื่นสนามแม่เหล็ก ประกาศการวิจัยสมอง 2001;54: 255 66- [PubMed]
- Perry PJ, Kutscher EC, Lund BC, Yates WR, Holman TL, Demers L. มาตรการความก้าวร้าวและการเปลี่ยนแปลงทางอารมณ์ในนักยกน้ำหนักชายที่มีและไม่มีการใช้เตียรอยด์แอนโดรโบนิกแอนโดรลิก วารสารนิติวิทยาศาสตร์. 2003;48: 646 51- [PubMed]
- ปีเตอร์ KD KD ไม้ RI การพึ่งพาแอนโดรเจนในแฮมสเตอร์: การให้ยาเกินขนาด, ความอดทน, และกลไกการเกิด opioidergic ประสาท 2005;130: 971 81- [PubMed]
- Pfaus JG, Damsma G, Nomikos GG, Wenkstern DG, Blaha CD, Phillips AG, Fibiger HC พฤติกรรมทางเพศช่วยเพิ่มการส่งโดปามีนส่วนกลางในหนูตัวผู้ การวิจัยสมอง 1990;530: 345 348- [PubMed]
- Phoenix CH, Goy RW, Gerall AA, Young WC การจัดระเบียบการกระทำของฮอร์โมนเทสโทสเตอโรนที่ได้รับการเตรียม prenatally ในเนื้อเยื่อที่เป็นสื่อกลางพฤติกรรมการผสมพันธุ์ในหนูตะเภาหญิง การศึกษาเกี่ยวกับต่อมไร้ท่อ 1959;65: 369 82- [PubMed]
- Pinos H, Collado P, Rodriguez-Zafra M, Rodriguez C, Segovia S, Guillamon A. การพัฒนาความแตกต่างทางเพศในสถานที coeruleus ของหนู ประกาศการวิจัยสมอง 2001;56: 73 8- [PubMed]
- สมเด็จพระสันตะปาปา HG, Jr, Katz DL คดีฆาตกรรมและคดีใกล้ตัวโดยผู้ใช้ anabolic steroid [ดูความคิดเห็น] วารสารคลินิกจิตเวช 1990;51: 28 31- [PubMed]
- สมเด็จพระสันตะปาปา HG, Jr, Katz DL ผลกระทบทางจิตเวชและทางการแพทย์จากการใช้เตียรอยด์ anabolic-androgenic การศึกษาควบคุมของนักกีฬา 160 จดหมายเหตุของจิตเวชทั่วไป 1994;51: 375 82- [PubMed]
- สมเด็จพระสันตะปาปา HG, Jr, Kouri EM, Powell KF, Campbell C, Katz DL การใช้เตียรอยด์ Anabolic-androgenic ในหมู่นักโทษ 133 จิตเวชที่ครอบคลุม 1996;37: 322 7- [PubMed]
- Putnam SK, Du J, Sato S, Hull EM การคืนค่าเทสโทสเตอโรนของพฤติกรรมการมีส่วนร่วมมีความสัมพันธ์กับการปลดปล่อยโดพามีนในระดับปานกลางในหนูตัวผู้ตอน ฮอร์โมนและพฤติกรรม 2001;39: 216 224- [PubMed]
- Putnam SK, Sato S, Hull EM ผลของฮอร์โมนเทสโทสเตอโรนต่อการมีเพศสัมพันธ์และการปลดปล่อยโดพามีนอยู่ตรงกลางในหนูเพศผู้ตอน ฮอร์โมนและพฤติกรรม 2003;44: 419 26- [PubMed]
- Putnam SK, Sato S, Riolo JV, Hull EM ผลของฮอร์โมนเทสโทสเตอโรนต่อการมีเพศสัมพันธ์, โดพามีนอยู่ตรงกลาง, และ NOS-immunoreactivity ในหนูเพศผู้ตอน ฮอร์โมนและพฤติกรรม 2005;47: 513 522- [PubMed]
- Rankin SL, Partlow GD, McCurdy RD, Giles ED, ฟิชเชอร์ KR neurogenesis หลังคลอดใน vasopressin และนิวเคลียสที่มี oxytocin ของหมู hypothalamus การวิจัยสมอง 2003;971: 189 96- [PubMed]
- Ricci LA, Rasakham K, Grimes JM, Melloni RH., Jr Serotonin-1A กิจกรรมของตัวรับและการแสดงออกปรับการรุกรานของสเตอรอยด์สเตียรอยด์ที่ก่อให้เกิดปฏิกิริยา anabolic / androgenic ในแฮมสเตอร์ เภสัชวิทยาชีวเคมีและพฤติกรรม 2006;85: 1 11-
- Romeo RD, Cook-Wiens E, Richardson HN, Sisk CL Dihydrotestosterone เปิดใช้งานพฤติกรรมทางเพศในแฮมสเตอร์ชายผู้ใหญ่ แต่ไม่ได้อยู่ในวัยรุ่น สรีรวิทยาและพฤติกรรม. 2001;73: 579 84- [PubMed]
- Romeo RD, Diedrich SL, Sisk CL เอสโตรเจนรีแอคทีฟอิมมูเรียติวิตี้ในหนูแฮมสเตอร์ซีเรียก่อนและหลังโตเต็มวัย จดหมายประสาทวิทยา 1999;265: 167 70- [PubMed]
- Romeo RD, Parfitt DB, Richardson HN, Sisk CL ฟีโรโมนทำให้ระดับ Fos-immunoreactivity เทียบเท่าในแฮมสเตอร์ซีเรียที่เตรียมไว้และตัวเต็มวัย ฮอร์โมนและพฤติกรรม 1998;34: 48 55- [PubMed]
- Romeo RD, Richardson HN, Sisk CL วัยแรกรุ่นและการสุกของสมองชายและพฤติกรรมทางเพศ: การหล่อหลอมศักยภาพทางพฤติกรรม ความคิดเห็นเกี่ยวกับประสาทและชีวพฤติกรรม 2002a;26: 381 91- [PubMed]
- Romeo RD, Wagner CK, Jansen HT, Diedrich SL, Sisk CL Estradiol ก่อให้เกิดตัวรับฮอร์โมนโปรเจสเตอโรน แต่ไม่ได้เปิดใช้งานพฤติกรรมการผสมพันธุ์ในแฮมสเตอร์เพศชาย (Mesocricetus auratus) ก่อนวัยแรกรุ่น ประสาทวิทยาศาสตร์เชิงพฤติกรรม. 2002b;116: 198 205- [PubMed]
- Salas-Ramirez KY, Montalto PR, Sisk CL อะนาโบลิคแอนโดรเจนเตียรอยด์ (AAS) ส่งผลกระทบต่อพฤติกรรมทางสังคมในแฮมสเตอร์ซีเรียวัยรุ่นและผู้ใหญ่ชาย ฮอร์โมนและพฤติกรรม 2008 ในการกด
- SAMHSA / OAS DHHS เอกสารเผยแพร่ (SMA) 1996 ผลสำรวจครัวเรือน 1994 แห่งชาติเรื่องการใช้ยาเสพติด pp. 1994 – 96
- SAMHSA / OAS ผลจากการสำรวจแห่งชาติ 2004 เรื่องการใช้ยาและสุขภาพ: ผลการวิจัยระดับชาติ 2005 ซีรี่ส์ NSDUH H-28, DHHS เลขที่เผยแพร่ SMA 05 – 4062
- Sato SM, Johansen J, Jordan CL, Wood RI Androgen จัดการด้วยตนเองในหนู Tfm การประชุมประจำปีครั้งที่ 10 ของสมาคมจิตวิทยาระบบประสาทพฤติกรรม.
- Sato SM, Wood RI การบริหารตนเองของสเตียรอยด์ที่ไม่สามารถซึมผ่านเยื่อบุ Anabolic-androgenic (aas) ในแฮมสเตอร์ซีเรีย การประชุมประจำปีครั้งที่ 11 ของสังคม fof ระบบประสาทพฤติกรรม
- ชโรเดอร์เจพีแพคการ์ด MG บทบาทของโดปามีนชนิดย่อยตัวรับในการได้รับการตั้งค่าฮอร์โมนเพศชายในหนู จดหมายประสาทวิทยา 2000;282: 17 20- [PubMed]
- Schulte HM, Hall MJ, Boyer M. ความรุนแรงในครอบครัวที่เกี่ยวข้องกับการใช้สเตียรอยด์ anabolic วารสารจิตเวชอเมริกัน 1993;150: 348 [PubMed]
- Schulz KM, Menard TA, Smith DA, Albers HE, Sisk CL การได้รับฮอร์โมนของลูกอัณฑะในช่วงวัยรุ่นจัดพฤติกรรมการทำเครื่องหมายด้านข้างและตัวรับ vasopressin ที่มีผลผูกพันในกะบังด้านข้าง ฮอร์โมนและพฤติกรรม 2006;50: 477 83- [PubMed]
- Schulz KM, Richardson HN, Romeo RD, Morris JA, เลคแลนด์ KJ, Sisk CL พื้นที่ preoptic ตรงกลางตอบสนองโดพามีนกับฟีโรโมนหญิงพัฒนาในช่วงวัยแรกรุ่นในหนูแฮมสเตอร์ซีเรียชาย การวิจัยสมอง 2003;988: 139 45- [PubMed]
- Schulz KM, Richardson HN, Zehr JL, Osetek AJ, Menard TA, Sisk CL ฮอร์โมน Gonadal สร้างความเข้มแข็งให้กับพฤติกรรมการสืบพันธุ์ในช่วงวัยแรกรุ่นในหนูแฮมสเตอร์ซีเรีย ฮอร์โมนและพฤติกรรม 2004;45: 242 9- [PubMed]
- Schulz KM, Sisk CL ฮอร์โมน Pubertal สมองวัยรุ่นและการพัฒนาพฤติกรรมทางสังคม: บทเรียนจากหนูแฮมสเตอร์ซีเรีย ต่อมไร้ท่อโมเลกุลและเซลล์ 2006:254–255. 120–6.
- Schulz KM, Zehr JL, Salas-Ramirez KY, Sisk CL นักวางแผนการประชุมทางประสาท Sandiego, CA: สมาคมประสาทวิทยาศาสตร์; 2007 วัยรุ่นเป็นช่วงเวลาที่อ่อนไหวเป็นครั้งที่สองสำหรับการจัดผลของเทสโทสเทอโรนต่อพฤติกรรมการสืบพันธุ์เพศชายของผู้ใหญ่ 2007 ออนไลน์
- Scott JP, Stewart JM, De Ghett VJ ช่วงเวลาที่สำคัญในการจัดระบบ จิตวิทยาพัฒนาการ 1974;7: 489 513- [PubMed]
- Shughrue PJ, Lane MV, Merchenthaler I. การเปรียบเทียบการกระจายตัวของฮอร์โมนเอสโตรเจน - อัลฟาและ -beta mRNA ในระบบประสาทส่วนกลางของหนู วารสารประสาทวิทยาเปรียบเทียบ 1997;388: 507 25- [PubMed]
- Simons-Morton BG, Haynie DL พยากรณ์ทางจิตสังคมของขั้นตอนการสูบบุหรี่ที่เพิ่มขึ้นในหมู่นักเรียนระดับประถมที่หก วารสารพฤติกรรมสุขภาพอเมริกัน 2003;27: 592 602- [PubMed]
- Sisk CL, Zehr JL. ฮอร์โมน Pubertal จัดระเบียบสมองและพฤติกรรมของวัยรุ่น พรมแดนในระบบประสาท 2005;26: 163 74- [PubMed]
- Sowell ER, Thompson PM, Leonard CM, ยินดีต้อนรับ SE, Kan E, Toga AW การทำแผนที่ระยะยาวของความหนาของเยื่อหุ้มสมองและการเติบโตของสมองในเด็กปกติ วารสารประสาทวิทยา 2004;24: 8223 31- [PubMed]
- Sowell ER, Thompson PM, Tessner KD, Toga AW การทำแผนที่การเติบโตของสมองอย่างต่อเนื่องและการลดความหนาแน่นของสสารสีเทาในเยื่อหุ้มสมองส่วนหน้าหลัง: ความสัมพันธ์แบบผกผันระหว่างการเจริญเติบโตของสมองหลังวัยหมดประจำเดือน วารสารประสาทวิทยา 2001;21: 8819 29- [PubMed]
- หอก LP สมองวัยรุ่นและอาการทางพฤติกรรมที่เกี่ยวข้องกับอายุ ประสาทวิทยาศาสตร์และชีวพฤติกรรม 2000;24: 417 63-
- Su TP, Pagliaro M, Schmidt PJ, Pickar D, Wolkowitz O, Rubinow DR ผลทางประสาทวิทยาของสเตียรอยด์อะนาโบลิกในอาสาสมัครปกติชาย. JAMA 1993;269: 2760 4- [PubMed]
- Thiblin I, Finn A, Ross SB, Stenfors C เพิ่มกิจกรรม dopaminergic และ 5-hydroxytryptaminergic ในสมองของหนูตัวผู้หลังจากการรักษาระยะยาวด้วยสเตียรอยด์แอนโบลิกและแอนโดรเจน วารสารเภสัชวิทยาอังกฤษ. 1999;126: 1301 6- [บทความฟรี PMC] [PubMed]
- Thomas P, Dressing G, Pang Y, Berg H, Tubbs C, Benninghoff A, Doughty K. Progestin, ฮอร์โมนเอสโตรเจนและแอนโดรเจน G-protein ควบคู่กับตัวรับคู่ในอวัยวะสืบพันธุ์ปลา เตียรอยด์ 2006;71: 310 6- [PubMed]
- Tricker R, Casaburi R, Storer TW, Clevenger B, Berman N, Shirazi A, Bhasin S. ผลของการใช้ฮอร์โมนเทสโทสเตอโรนในปริมาณที่ไม่เหมาะสมต่อพฤติกรรมโกรธในผู้ชายที่มีสุขภาพดี - การศึกษาของศูนย์วิจัยทางคลินิก วารสาร Clinical Endocrinology & Metabolism. 1996;81: 3754 8- [PubMed]
- Triemstra JL, Nagatani S, Wood RI ตัวบ่งชี้ทางเคมีเป็นสิ่งจำเป็นสำหรับการปลดปล่อยโดปามีนที่เกิดจากการผสมพันธุ์ใน MPOA ของแฮมสเตอร์ซีเรียเพศผู้ Neuropsychopharmacology 2005;30: 1436 42- [PubMed]
- Triemstra JL, Sato SM, Wood RI เทสโทสเตอโรนและนิวเคลียสมีโดปามีนในหนูแฮมสเตอร์ซีเรียเพศผู้ Psychoneuroendocrinology (ในการกด)
- Van Eenoo P, Delbeke FT ความชุกของยาสลบในแฟลนเดอร์สเมื่อเปรียบเทียบกับความชุกของยาสลบในกีฬาระหว่างประเทศ วารสารนานาชาติเวชศาสตร์การกีฬา 2003;24: 565 570- [PubMed]
- WADA ผลการวิเคราะห์เชิงลบรายงานโดยห้องปฏิบัติการที่ได้รับการรับรอง 2006. http://www.wada-ama.org.
- Wesson DW, McGinnis MY การสะสมแอนโบลิคแอนโดรเจนและสเตียรอยด์ (AAS) ในช่วงวัยแรกรุ่นในหนู: การประเมินระบบประสาทและพฤติกรรม เภสัชวิทยาชีวเคมีและพฤติกรรม 2006;83: 410 9-
- Wichstrom L, Pedersen W. การใช้สเตียรอยด์แอนโดรโบลิกและแอนโดรเจนในวัยรุ่น: ชนะดูดีหรือไม่ดี? วารสารการศึกษาเกี่ยวกับแอลกอฮอล์ 2001;62: 5 13- [PubMed]
- Wood RI, จอห์นสัน LR, Chu L, Schad C, DW ตนเอง การเสริมฮอร์โมนเทสโทสเตอโรน: การจัดการตนเองทางหลอดเลือดดำและ intracerebroventricular ในหนูและหนูแฮมสเตอร์ เภสัช 2004;171: 298 305- [PubMed]
- Wood RI, Newman SW ตัวรับ Androgen และเอสโตรเจนอยู่ร่วมกับเซลล์ประสาทส่วนบุคคลในสมองของหนูแฮมสเตอร์ซีเรีย neuroendocrinology 1995;62: 487 97- [PubMed]
- Wood RI, Swann JM การรวมกันของเซลล์ประสาทของสัญญาณทางเคมีและฮอร์โมนที่ควบคุมพฤติกรรมทางเพศของผู้ชาย ใน: Wallen K, Schneider JS, บรรณาธิการ การสืบพันธุ์ในบริบท กด MIT; เคมบริดจ์: 1999 pp. 423 – 444
- Zahm DS, Heimer L. สองวิถี transpallidal ที่เกิดขึ้นในนิวเคลียสหนู วารสารประสาทวิทยาเปรียบเทียบ 1990;302: 437 46- [PubMed]