ความคิดเห็น: บทวิจารณ์นี้จัดทำโดยหัวหน้า NIDA, Nora Volkow และทีมของเธอ ทำให้มีข้อสงสัยเล็กน้อยว่าการเสพติดสารเคมีและพฤติกรรมเสพติดมีกลไกและวงจรประสาทที่เหมือนกันหรือคล้ายกัน สิ่งนี้ทำให้รู้สึกที่สมบูรณ์แบบเนื่องจากการเสพติดสารเคมีจี้วงจรประสาทสำหรับพันธะเพศและการรับประทานอาหาร เนื่องจากการมีเพศสัมพันธ์จะปล่อยโดปามีนมากเป็นสองเท่าของการกินอาหารที่คุณชื่นชอบและผู้ใช้สื่อลามกสามารถเพิ่มโดปามีนได้ในระดับสูงเป็นเวลาหลายชั่วโมง
Curr Top Behav Neurosci 2011 ต.ค. 21
Volkow ND, วัง GJ, นักล่านก JS, Tomasi D, Baler R.
แหล่ง
สถาบันยาเสพติดแห่งชาติ, 6001 Executive Boulevard 6001, ห้อง 5274, Bethesda, MD, 20892, สหรัฐอเมริกา, [ป้องกันอีเมล].
นามธรรม
ทั้งการติดยาเสพติดและโรคอ้วนนั้นสามารถนิยามได้ว่าเป็นความผิดปกติที่ค่าความหอมของรางวัลประเภทหนึ่ง (ยาและอาหารตามลำดับ) จะเพิ่มขึ้นอย่างผิดปกติเมื่อเทียบกับค่าใช้จ่ายของผู้อื่น แบบจำลองนี้สอดคล้องกับข้อเท็จจริงที่ว่าทั้งยาและอาหารมีผลในการเสริมแรงที่มีประสิทธิภาพซึ่งเป็นสื่อกลางบางส่วนโดยการเพิ่มขึ้นของโดปามีนในระบบลิมบิกซึ่งภายใต้สถานการณ์บางอย่างหรือในผู้ที่มีความเสี่ยงอาจทำให้กลไกการควบคุมสภาวะสมดุลของสมองครอบงำ แนวดังกล่าวได้สร้างความสนใจที่สำคัญในการทำความเข้าใจช่องโหว่ที่ใช้ร่วมกันและเส้นทางการเคลื่อนที่ระหว่างการเสพติดและโรคอ้วน ตอนนี้การค้นพบการถ่ายภาพสมองได้เริ่มค้นพบคุณสมบัติทั่วไประหว่างสองเงื่อนไขนี้และเพื่ออธิบายวงจรสมองที่คาบเกี่ยวกันซึ่งความผิดปกติอาจอธิบายถึงการขาดดุลพฤติกรรมและพฤติกรรมที่เกี่ยวข้องในวิชามนุษย์ Tผลการศึกษาชี้ให้เห็นว่าบุคคลที่เป็นโรคอ้วนและผู้ติดยาเสพติดต้องทนทุกข์ทรมานจากความบกพร่องในเส้นทางที่มีสาร dopaminergic ซึ่งควบคุมระบบประสาทที่เกี่ยวข้องไม่เพียง แต่กับความไวของรางวัลและแรงจูงใจแรงจูงใจ แต่ยังมีเงื่อนไข (หน่วยความจำ / การเรียนรู้) และการรับรู้ interoceptive ที่นี่เรารวมการค้นพบที่ได้รับส่วนใหญ่มาจากเอกซเรย์ปล่อยโพซิตรอนที่ให้ความกระจ่างเกี่ยวกับบทบาทของโดปามีนในการติดยาเสพติดและโรคอ้วนและเสนอรูปแบบการทำงานที่ทันสมัยเพื่อช่วยระบุกลยุทธ์การรักษาที่อาจเป็นประโยชน์ต่อทั้งสองเงื่อนไข
1 พื้นหลัง
2 บทบาทของโดปามีนในการให้รางวัลแบบเฉียบพลันต่อยาและอาหาร
3 การถ่ายภาพ DA ในการตอบสนองต่อยาเสพติดและตัวชี้นำที่มีเงื่อนไขในการเสพติด
4 ผลกระทบของความผิดปกติในการควบคุมการยับยั้ง
5 การมีส่วนร่วมของวงจรแรงจูงใจ
6 การมีส่วนร่วมของ Interoceptive Circuitry
7 วงจรแห่งความเกลียดชัง
8 พยาธิวิทยายาและรางวัลอาหาร: รูปแบบการทำงานที่ได้รับการปรับปรุง
1 พื้นหลัง
โดปามีน (DA) ถือเป็นกุญแจสำคัญในการให้รางวัลจากธรรมชาติและรางวัลยา อย่างไรก็ตามบทบาทของมันในการสูญเสียการควบคุมและพฤติกรรมบีบบังคับที่เกี่ยวข้องกับการติดยาเสพติดและโรคอ้วนมีความชัดเจนน้อยกว่ามาก การศึกษา PET มีบทบาทสำคัญในการกำหนดบทบาทของระบบสมอง DA ในการติดยาเสพติด (นอกเหนือจากบทบาทในรางวัลยาเสพติด) และโรคอ้วน อันที่จริงยาเสพติด (รวมถึงแอลกอฮอล์) ถูกใช้โดยมนุษย์หรือสัตว์ทดลองด้วยตนเองเนื่องจากสัตว์ทดลองได้รับผลตอบแทนที่ได้รับจากการใช้คุณสมบัติเพิ่มประสิทธิภาพ DA ในระบบ mesolimbic (Wise) 2009) Hในกรณีของการติดการศึกษาเกี่ยวกับการถ่ายภาพได้เปิดเผยว่าความผิดปกตินั้นมีผลต่อวงจรรางวัล DA แต่ยังรวมถึงวิถีชีวิต DA อื่น ๆ ที่เกี่ยวข้องกับการปรับสภาพ / นิสัยแรงจูงใจและหน้าที่ของผู้บริหาร (การควบคุมการยับยั้ง - การทำ) และการขาดดุลของ DA อาจมีส่วนร่วมในปฏิกิริยาความเครียดที่เพิ่มขึ้นและการหยุดชะงักของการรับรู้ interoceptive ที่เกี่ยวข้องกับการติดยาเสพติด พรีคลินิกและการศึกษาทางคลินิกได้เปิดเผยสารสื่อประสาทอื่น ๆ (และนิวโรเปปไทด์) ที่มีบทบาทสำคัญในการให้รางวัลและการติดยา (เช่น cannabinoids, opioids) และมีส่วนร่วมอย่างใกล้ชิดในการเปลี่ยนแปลง neuroplastic ที่ติดตามการใช้ยาซ้ำ ๆ (เช่นกลูตาเมต, opioids, GABA, corticotropin - ปัจจัยการปลดปล่อย) ระบบกลูตาแมทเทอริกมีความโดดเด่นเป็นพิเศษในเรื่องนี้เพราะมันเป็นสื่อกลางในการหยุดชะงักทั้งในระยะยาวและระยะยาวที่พบในแบบจำลองสัตว์ของการบริหารยาเรื้อรัง (โธมัสและคณะ 2008) ความคิดเห็นเกี่ยวกับระบบเพิ่มเติมเหล่านี้สามารถพบได้ที่อื่น (Kalivas 2009; Koob 1992).
เนื่องจากยาเสพติดเปิดใช้งานระบบการให้รางวัลแบบเดียวกันกับที่รองรับรางวัลอาหารมันไม่ได้คาดหวังเลยว่าโดยทั่วไปการศึกษาการถ่ายภาพสมองได้สนับสนุนแนวคิดที่ว่าความบกพร่องในวงจร DA-modulated นั้นมีส่วนเกี่ยวข้องในพฤติกรรมการรับประทานอาหารที่ก่อโรค. ตัวชี้นำอาหารเช่นตัวชี้นำยาเพิ่ม DA extracellular striatal และผลักดันแรงจูงใจให้มีส่วนร่วมในพฤติกรรมที่จำเป็นในการจัดหาและกินอาหารให้หลักฐานการมีส่วนร่วมของ DA ไม่เพียง แต่ในรางวัลอาหาร แต่ยังอยู่ในแรงจูงใจที่ไม่ใช่ hedonic คุณสมบัติของอาหาร (เช่นความต้องการแคลอรี่) และการลดลงของการควบคุมการยับยั้งที่เห็นในการกินมากเกินไปบังคับ (Avena et al. 2008; Volkow และคณะ 2008a).
ที่นี่เราตรวจสอบข้อค้นพบจากการศึกษาการถ่ายภาพที่มุ่งเน้นเฉพาะการทับซ้อนในวงจรสมองที่ถูกรบกวนในโรคอ้วนและในการติดยาเสพติด มันเป็นความทรงจำที่คุ้มค่าอย่างไรก็ตามว่าการควบคุมพฤติกรรมการบริโภคอาหารนั้นซับซ้อนกว่าการควบคุมการบริโภคยา ส่วนหลังนั้นเป็นสื่อกลางที่ได้รับอิทธิพลจากผลตอบแทนของยาเสพติดในขณะที่ยาในอดีตนั้นถูกปรับไม่เพียง แต่จากผลของการให้รางวัล (ปัจจัยทางความชอบ) แต่โดยปัจจัยต่อพ่วงและปัจจัยกลางหลายอย่างที่สัมผัสกับความต้องการสารอาหารในร่างกาย ที่น่าสนใจมีหลักฐานเพิ่มขึ้นว่าปัจจัย homeostatic (เช่นอินซูลิน leptin, ghrelin) ปรับปริมาณอาหารในส่วนของการเพิ่มหรือลดความไวของวงจรรางวัลสมองเพื่อกระตุ้นอาหาร (Volkow et al. 2011a).
2 บทบาทของโดปามีนในการให้รางวัลแบบเฉียบพลันต่อยาและอาหาร
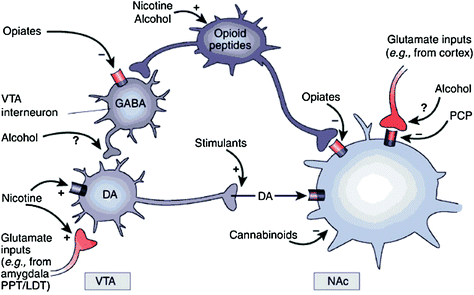
ไม่ว่าโดยตรงหรือโดยอ้อมยาเสพติดทั้งหมดแสดงความสามารถในการเพิ่ม DA ในนิวเคลียส accumbens (NAc) ผ่านการโต้ตอบเฉพาะกับเป้าหมายโมเลกุลที่แตกต่างกัน (Nestler 2004) (รูปที่ 1) ทางเดิน DA mesolimbic [เซลล์ DA ในพื้นที่หน้าท้อง (VTA) ที่โครงการเข้าสู่ NAc] น่าจะเป็นสิ่งสำคัญสำหรับรางวัลยาเสพติด (Wise) 2009) อย่างไรก็ตามดังที่อธิบายไว้ด้านล่างเส้นทางเดิน DA อื่น ๆ [mesostriatal (เซลล์ DA ใน substantia nigra ที่ฉายไปที่ dorsal striatum) และ mesocortical (เซลล์ DA ใน VTA ที่ฉายเข้าไปในเยื่อหุ้มสมองส่วนหน้า)] ก็มีส่วนช่วยให้รางวัลยาและการติดยา 2009) โดยรวมแล้วดูเหมือนว่าผลของการให้รางวัลและการปรับสภาพของยาเสพติดได้รับแรงผลักดันจากการยิงเซลล์ DA แบบ phasic ซึ่งนำไปสู่การเพิ่ม DA ขนาดใหญ่และชั่วคราว ในทางตรงกันข้ามการเปลี่ยนแปลงดาวน์สตรีมในฟังก์ชั่นผู้บริหารที่เกิดขึ้นในการเสพติดนั้นเชื่อมโยงกับการเปลี่ยนแปลงในการเผาเซลล์ DA โทนิคและส่งผลให้ระดับ DA ต่ำลง แต่มีเสถียรภาพมากขึ้น 2000; วานัตและคณะ 2009) ในทางกลับกันให้ชี้ไปที่ตัวรับ D1 (D1R) ซึ่งเป็นตัวรับ DA ที่มีความสัมพันธ์ต่ำซึ่งกระตุ้นการส่งสัญญาณแอมป์ไซคลิกวงจรทั้งที่เกี่ยวข้องกับการให้รางวัลยาเสพติดเฉียบพลันและในสภาพร่างกายเนื่องจากเกี่ยวข้องกับความเข้มข้น DA สูง เพื่อกระตุ้น D1R ในทางตรงกันข้าม D2Rs ซึ่งยับยั้งสัญญาณไซโคลแอมป์ถูกกระตุ้นโดย DA และ phasic และยาชูกำลัง โปรดทราบว่าเนื่องจากการขาดเรดิโอเคอเรเตอร์เฉพาะสำหรับการถ่ายภาพ PET ของตัวรับ DA ของประเภท D1, D3, D4 และ D5 การศึกษาส่วนใหญ่เกี่ยวกับผลกระทบของยาเสพติดและการติดยาเสพติดในสมองของมนุษย์ได้มุ่งเน้นไปที่ D2R
มะเดื่อ. 1 ยาเสพติดทำผิดกฎเกี่ยวกับการให้รางวัลและวงจรเสริมผ่านกลไกที่แตกต่างกัน แต่พวกเขาทั้งหมดนำไปสู่ผลกระทบที่คล้ายกัน dopaminergic ใน VTA และ NAc. ดังนั้นสารกระตุ้นกระตุ้น acumbal DA โดยตรงในขณะที่หลับในทำเช่นนี้โดยการลดเสียงยับยั้ง GABAergic interneurons บน DA ส่งสัญญาณทั้งใน VTA หรือ NAc ในขณะที่กลไกของยาเสพติดอื่น ๆ ของการละเมิดมีความชัดเจนน้อยกว่ามีหลักฐานชี้ให้เห็นว่านิโคตินอาจเปิดใช้งาน VTA DA โดยตรงผ่านตัวรับนิโคติน acetylcholine รับ (nAChR) ในเซลล์ประสาทเหล่านั้นและทางอ้อมผ่านการกระตุ้นของผู้รับในกลูตาแมทช์ แอลกอฮอล์ดูเหมือนจะยับยั้งขั้ว GABAergic ใน VTA ซึ่งนำไปสู่การทำลายเซลล์ประสาท DA ใน VTA พระราชบัญญัติ Cannabinoids และอื่น ๆ ผ่านการเปิดใช้งานตัวรับ CB1 บนขั้วประสาท glutamatergic และ GABAergic ใน NAc และเซลล์ประสาท NAc Phencyclidine (PCP) อาจทำหน้าที่ยับยั้งโพรซิสแนปทิก NMDA กลูตาเมตผู้รับใน NAc นอกจากนี้ยังมีหลักฐานบางอย่างที่บ่งบอกว่านิโคตินและแอลกอฮอล์อาจมีผลกระทบต่อวิถีทางเดินภายใน opioid และ cannabinoid (ไม่แสดง) PPT / LDT, pontine tegmentum / ด้านหลัง tegmentum ด้านข้าง พิมพ์ซ้ำโดยได้รับอนุญาตจาก Nestler (2005)
ในมนุษย์การศึกษา PET แสดงให้เห็นว่ายาหลายชนิด (ยากระตุ้น (Drevets และคณะ) 2001; Volkow และคณะ 1999b) นิโคติน (Brody et al. 2009) แอลกอฮอล์ (Boileau และคณะ 2003) และกัญชา (Bossong et al. 2009)] เพิ่ม DA ในหลังและ ventral striatum (ซึ่งเป็นที่ตั้งของ NAc) การศึกษาเหล่านี้ใช้ประโยชน์จากผู้รักษาด้วยโรคเรื้อนหลายคนเช่น [11C] raclopride ที่เชื่อมโยงกับ D2R แต่เมื่อสิ่งเหล่านี้ไม่มีผลผูกพัน DA ภายนอก (ไม่ว่าง) ซึ่งภายใต้เงื่อนไขพื้นฐานที่สอดคล้องกับ 85 – 90% ของ striat D2R (Abi-Dargham et al 1998) ดังนั้นการเปรียบเทียบ [11C] raclopride ที่มีผลผูกพันหลังจากยาหลอกและหลังจากการให้ยาสามารถช่วยให้เราประเมินการลดลงของความพร้อมใช้งานของ D2R ที่เกิดจากยา (หรือสิ่งเร้าอื่น ๆ ที่สามารถเพิ่ม DA) สิ่งเหล่านี้ลดลงใน [11C] การโยงของ raclopride เป็นสัดส่วนกับการเพิ่มของ DA (Breier และคณะ 1997) การศึกษาเหล่านี้แสดงให้เห็นว่าการเพิ่มขึ้นของ DA ที่เกิดจากยาใน striatum นั้นเป็นสัดส่วนกับความรุนแรงของประสบการณ์ส่วนตัวของความรู้สึกสบายหรือ "สูง" [ดูความคิดเห็น (Volkow et al. 2009a)] (รูปที่ 2).
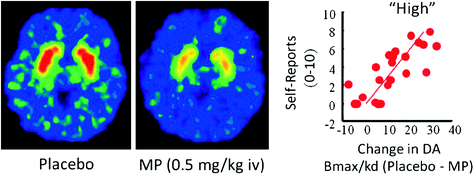
มะเดื่อ. 2 ผลของ methylphenidate ทางหลอดเลือดดำ (MP) ในการจับกับ raclopride และความสัมพันธ์ระหว่าง striatal DA เพิ่มขึ้นเนื่องจาก MP ใน striatum และรายงานตนเองของ“ สูง” ดัดแปลงจาก Volkow et al. (1999b)
การศึกษา PET ยังเผยให้เห็นความสัมพันธ์ที่ชัดเจนและชัดเจนระหว่างข้อมูลทางเภสัชจลนศาสตร์ของยา (เช่นความเร็วที่มันเข้าและออกจากสมอง) และผลเสริมแรง โดยเฉพาะยาที่เร็วขึ้นถึงระดับสูงสุดในสมองยิ่งรุนแรง "สูง" (Volkow et al 2009a) ตัวอย่างเช่นโคเคนในระดับที่เทียบเท่ากับสมอง (ประเมินผ่าน PET) เมื่อโคเคนเข้าสู่สมองอย่างรวดเร็ว (รมควันหรือการบริหาร iv) มันออกมา "สูง" ที่รุนแรงกว่าเมื่อเข้าสู่อัตราช้ากว่า (snorted) (Volkow et al. 2000) ซึ่งสอดคล้องกับการศึกษาพรีคลินิกแสดงความสัมพันธ์ที่คล้ายกันระหว่างโปรไฟล์เภสัชจลนศาสตร์ของยาและคุณสมบัติเสริม (Balster and Schuster) 1973) ผมt มีเหตุผลที่จะตั้งสมมติฐานว่าการเพิ่มขึ้นอย่างฉับพลันและขนาดใหญ่ของ DA ที่ถูกทริกเกอร์โดยยาเสพติดอาจเป็นการเลียนแบบการเพิ่ม DA ที่รวดเร็วและขนาดใหญ่ซึ่งเป็นผลมาจากการยิง DA แบบเฟสเซอร์ที่เกี่ยวข้องในสมองด้วยการประมวลผลข้อมูล (ชูลท์ซ 2010) การเพิ่มขึ้นของ DA ที่เกิดจากยาใน NAc อาจจำเป็นสำหรับการติดยาเสพติด แต่ความจริงที่ว่าพวกเขาเกิดขึ้นในคนที่ไม่ติดยาเสพติดบ่งชี้ว่าพวกเขาไม่เพียงพอที่จะอธิบายลักษณะการใช้ยาที่กระตุ้นและบีบบังคับ
ขณะนี้มีหลักฐานที่แสดงว่าการตอบสนองโดปามีนแบบเปรียบเทียบนั้นเชื่อมโยงกับรางวัลอาหารและกลไกเหล่านี้น่าจะมีบทบาทในการบริโภคอาหารและโรคอ้วนมากเกินไป เป็นที่ทราบกันดีว่าอาหารบางชนิดโดยเฉพาะอย่างยิ่งผู้ที่อุดมไปด้วยน้ำตาลและไขมันนั้นมีประโยชน์อย่างมาก (Lenoir et al. 2007) อาหารแคลอรี่สูงสามารถส่งเสริมการกินมากเกินไป (การกินที่ไม่จำเป็นจากความต้องการพลัง) และกระตุ้นให้เกิดความสัมพันธ์ระหว่างการกระตุ้นและการให้รางวัล (การปรับสภาพ) ในแง่วิวัฒนาการคุณสมบัติของอาหารอร่อยที่เคยเป็นข้อได้เปรียบในสภาพแวดล้อมที่แหล่งอาหารขาดแคลนและ / หรือไม่น่าเชื่อถือเพราะทำให้มั่นใจได้ว่าอาหารถูกกินเมื่อพร้อมใช้งานทำให้พลังงานถูกเก็บไว้ในร่างกาย (เป็นไขมัน) สำหรับใช้ในอนาคต . น่าเสียดายที่ในสังคมเช่นของเราที่มีอาหารมากมายและมีอยู่ตลอดเวลาการปรับตัวนี้กลายเป็นความรับผิดชอบ
สารสื่อประสาทหลายชนิดรวมถึง DA, cannabinoids, opioids และ serotonin เช่นเดียวกับฮอร์โมนและสาร neuropeptides ที่เกี่ยวข้องกับการควบคุมอาหารจากการบริโภคอาหารเช่นอินซูลิน orexin, leptin และ ghrelin 2008; Cason และคณะ 2010; Cota และคณะ 2006) ในบรรดาเหล่านี้ DA ได้รับการตรวจสอบอย่างละเอียดที่สุดและเป็นลักษณะที่ดีที่สุด การทดลองในหนูได้แสดงให้เห็นว่าเมื่อได้รับรางวัลอาหารครั้งแรกการยิงของเซลล์ประสาท DA ใน VTA เพิ่มขึ้นด้วยการเพิ่มการปล่อย DA ใน NAc (Norgren et al) 2006) ในทำนองเดียวกันในคนที่มีน้ำหนักปกติและมีสุขภาพดีการบริโภคอาหารที่อร่อยได้ถูกแสดงเพื่อปลดปล่อย DA ใน dorsal striatum ตามสัดส่วนของการจัดอันดับความพอใจของมื้ออาหาร (Small et al. 2003) (รูปที่ 3) อย่างไรก็ตามและจากการศึกษากับผู้ใช้ยาเสพติดพบว่าการเพิ่มขึ้นของอาหารใน striatal DA เพียงอย่างเดียวไม่สามารถอธิบายความแตกต่างระหว่างการรับประทานอาหารปกติกับการบริโภคอาหารมากเกินไปเนื่องจากสิ่งเหล่านี้เกิดขึ้นในบุคคลที่มีสุขภาพดีที่ไม่ได้กินมากเกินไป ดังนั้นในกรณีของการติดยาเสพติดการปรับตัวแบบปลายน้ำมีแนวโน้มที่จะเกี่ยวข้องกับการสูญเสียการควบคุมการบริโภคอาหาร
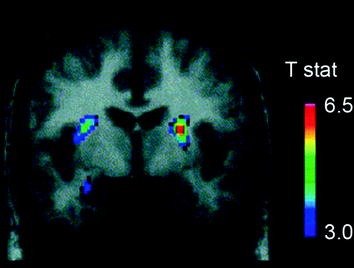
มะเดื่อ. 3 โดปามีนปลดปล่อยจากการให้อาหาร ส่วนเวียนจาก T-map ของการลดลงอย่างมีนัยสำคัญทางสถิติใน [11C] raclopride's potential potential (BP) หลังจากให้อาหาร แถบสีแสดงถึงค่าสถิติ t (พิมพ์ซ้ำโดยได้รับอนุญาต Small et al. 2003)
3 การถ่ายภาพ DA ในการตอบสนองต่อยาเสพติดและตัวชี้นำที่มีเงื่อนไขในการเสพติด
บทบาทของ DA ในการเสริมกำลังนั้นมีความซับซ้อนมากกว่าการเข้ารหัสเพื่อให้รางวัลต่อความสุข ตัวอย่างเช่นสิ่งเร้าที่ชักนำให้เพิ่ม DA อย่างรวดเร็วและมีขนาดใหญ่ยังก่อให้เกิดการตอบสนองตามเงื่อนไขและกระตุ้นแรงจูงใจในการจัดหาสิ่งเหล่านั้น (Owesson-White et al. 2009) สิ่งนี้เป็นสิ่งสำคัญเพราะผ่านกระบวนการปรับสภาพสิ่งเร้าที่เป็นกลางที่เชื่อมโยงกับผู้สั่งการ (ไม่ว่าจะเป็นยาธรรมชาติหรือยาเสริม) ได้รับความสามารถของตัวเองในการเพิ่ม DA ใน striatum (รวมถึง NAc) ในการรอรับรางวัล แรงจูงใจที่แข็งแกร่งในการค้นหายาเสพติด (Owesson-White et al. 2009) อย่างไรก็ตามการให้รางวัลที่ไม่ จำกัด และกลไกการปรับสภาพในกระบวนการติดยามีความท้าทายมากกว่าการบริโภคอาหารเพราะยาเสพติดผ่านทางเภสัชวิทยากระตุ้นการทำงานของเซลล์ประสาท DA โดยตรง (เช่นนิโคติน) หรือเพิ่มการปลดปล่อย DA (เช่นยาบ้า)
การศึกษาเกี่ยวกับการถ่ายภาพสมองที่เปรียบเทียบการเพิ่มขึ้นของ DA ที่เกิดจากยากระตุ้น methylphenidate (MP) หรือแอมเฟตามีน (AMPH) ในกลุ่มผู้ติดโคเคนกับการควบคุมแสดงให้เห็นว่าการลดลงของ MP หรือ AMPH-induced และ 50% ในผู้ใช้ที่ใช้งานอยู่) และลดการรายงานผลของยาที่สัมพันธ์กับการใช้ยาที่ไม่เหมาะสม (Martinez et al.) 2007; Volkow และคณะ 1997) (รูปที่ 4) สิ่งนี้น่าประหลาดใจเนื่องจาก MP และ AMPH มีลักษณะทางเภสัชวิทยาคล้ายกับโคเคนและยาบ้าตามลำดับและผู้ใช้ยาไม่สามารถแยกแยะความแตกต่างระหว่างพวกเขาเมื่อพวกเขาได้รับการฉีดเข้าเส้นเลือดดำ เนื่องจากการลดลงอย่างชัดเจนของการเพิ่มขึ้นของ DA ที่เกิดจากยาถูกตั้งข้อสังเกตว่าผู้ใช้ยาเสพติดโคเคนถูกล้างพิษหรือไม่สิ่งนี้บ่งชี้ว่าสถานะการถอนตัวไม่ได้เป็นปัจจัยที่ทำให้สับสน (Volkow et al 2011b). ผลลัพธ์เหล่านี้และที่เกี่ยวข้อง (Volkow et al. 2009a) มีความสอดคล้องกับสมมติฐานที่ว่าการตอบสนองทางความสุขนั้นไม่เพียงพอในผู้ติดยาและเสริมสร้างความเชื่อที่ว่าฤทธิ์ทางเภสัชวิทยาเฉียบพลันของยาใน NAc นั้นไม่สามารถอธิบายแรงกระตุ้นที่เพิ่มขึ้นเพื่อบริโภคได้
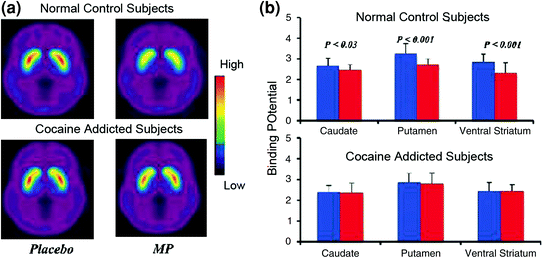
มะเดื่อ. 4 การเปลี่ยนแปลง DA ที่เกิดจาก iv MP ในการควบคุมและในเรื่องที่ติดโคเคน. ค่าเฉลี่ยรูปภาพที่อาจเกิดขึ้น (BPND) ที่ไม่อาจแทนที่ได้ของรูปภาพ [[11C] raclopride ในอาสาสมัครที่ติดยาเสพติดโคเคน (n = 19) และในการควบคุม (n = 24) ผ่านการทดสอบหลังจากยาหลอกและหลังจาก MP MP b ความพร้อมใช้งาน D2R (BPND) ใน caudate, putamen และ ventral striatum หลังจากยาหลอก (สีน้ำเงิน) และหลัง MP (สีแดง) ในการควบคุมและในเรื่องที่ติดโคเคน MP ลด D2R ในส่วนควบคุม แต่ไม่อยู่ในกลุ่มที่ติดโคเคน โปรดทราบว่าผู้ใช้โคเคนแสดงการลดลงของความพร้อมใช้งาน D2R พื้นฐาน (การวัดแบบหลอก) และการลดลงของการปลดปล่อย DA เมื่อได้รับ iv MP (วัดตามการลดลงของความพร้อมใช้งาน D2R จากพื้นฐาน) ถึงแม้ว่าใครจะสงสัยว่าระดับความพร้อมในการเกิด D2R ของผู้ที่ติดโคเคนในระดับต่ำนั้นจำกัดความสามารถในการตรวจจับการลดลงของ MP ต่อไป แต่ความจริงที่ว่าผู้เสพติดโคเคนแสดงการลดลงของความพร้อมใช้งาน D2R ของ MP ใน [11C] raclopride การเชื่อมโยงสะท้อนลดการปล่อย DA พิมพ์ซ้ำได้รับอนุญาต (Volkow et al. 1997; วังและคณะ 2010)
การตอบสนองของเซลล์ประสาท VTA DA ต่อการเปลี่ยนแปลงสิ่งเร้าด้วยการให้รางวัลซ้ำ ๆ
ในขณะที่เซลล์ DA ยิงเมื่อได้รับรางวัลนวนิยายครั้งแรกการสัมผัสซ้ำ ๆ กับ DA ทำให้เซลล์ประสาทหยุดยิงตามการบริโภคของรางวัลและไฟแทนเมื่อพวกเขาได้สัมผัสกับสิ่งเร้าที่ทำนายรางวัล (ชูลท์ซและคณะ 1997) สิ่งนี้มีแนวโน้มที่จะรองรับบทบาทของ DA ในการเรียนรู้และเงื่อนไข อันที่จริงยากระตุ้นสัญญาณ phasic DA ในที่สุดสามารถกระตุ้น neuroadaptations ในวงจรเสริมที่เกี่ยวข้องกับการสร้างนิสัยและการปรับพฤติกรรม Tการเปลี่ยนแปลง hese นั้นเกิดจากการส่งสัญญาณ D1R และการเปลี่ยนแปลง synaptic ในตัวรับ NMDA และแอมป์ที่มีกลูตาเมต (Luscher และ Malenka 2011; Zweifel และคณะ 2009) การรับสมัครวงจรเหล่านี้มีความสำคัญในการพัฒนาของโรคเพราะการตอบสนองแบบมีเงื่อนไขช่วยอธิบายความต้องการที่รุนแรงสำหรับยา (ความอยาก) และการใช้งานที่เกิดขึ้นเมื่ออาสาสมัครที่ติดยาได้สัมผัสกับยาที่เกี่ยวข้อง สมมติฐานนี้สอดคล้องกับการสังเกตอย่างอิสระ (Volkow et al. 2006b; วงศ์และคณะ 2006) ที่แสดงพลังของการสัมผัสคิวโคเคนที่เกี่ยวข้องกับการเพิ่มระดับ DA ใน striatum หลังและเรียกเพิ่มขึ้นด้วยกันในประสบการณ์ส่วนตัวของความอยากในผู้เสพโคเคนล้างพิษ (รูปที่ 5) เนื่องจาก striatum ด้านหลังมีบทบาทในการเรียนรู้นิสัย (Belin et al. 2009; หยินและคณะ 2004) สมาคมมีแนวโน้มที่จะสะท้อนให้เห็นถึงความเข้มแข็งของนิสัยเป็นนิสัยของการติดยาเสพติดดำเนินไป สิ่งนี้ชี้ให้เห็นว่าการหยุดชะงักขั้นพื้นฐานในการติดยาเสพติดอาจเกี่ยวข้องกับการตอบสนองที่ถูกกระตุ้นโดย DA ซึ่งส่งผลให้เกิดพฤติกรรมที่นำไปสู่ความอยากอย่างแรงกล้าและการบริโภคยาเสพติด ที่น่าสนใจในการใช้ยาเสพติดโคเคนอย่างแข็งขันการเพิ่ม DA ที่ถูกกระตุ้นโดยการชี้นำแบบปรับอากาศดูเหมือนจะยิ่งใหญ่กว่าการผลิตโดยยากระตุ้นซึ่งประเมินโดยกลุ่มอาสาสมัครสองกลุ่ม (Volkow et al 2011b, 2006b) แนะนำว่าการตอบสนองแบบมีเงื่อนไขอาจผลักดันการส่งสัญญาณ DA ที่รักษาแรงจูงใจในการใช้ยาแม้ว่าผลทางเภสัชวิทยาของมันจะลดลง. ดังนั้นแม้ว่ายาในตอนแรกอาจชักนำความรู้สึกของรางวัลทันทีผ่านการเปิดตัว DA ในช่องท้อง striatum ด้วยการใช้ซ้ำและเป็นนิสัยพัฒนาดูเหมือนจะมีการเปลี่ยนแปลงจากยาเสพติดเพื่อกระตุ้นปรับอากาศ จากการศึกษาในสัตว์ทดลองคาดการณ์กลูตามาเทกิกจากเยื่อหุ้มสมอง prefrontal และจาก amygdala เป็น VTA / SN และ NAc ไกล่เกลี่ยตอบสนองปรับอากาศเหล่านี้ (Kalivas 2009) ด้วยวิธีนี้การทำนายผลตอบแทนเพียงอย่างเดียวอาจกลายเป็นรางวัลที่กระตุ้นพฤติกรรมที่จำเป็นสำหรับการบริโภคยา (หรืออาหาร)
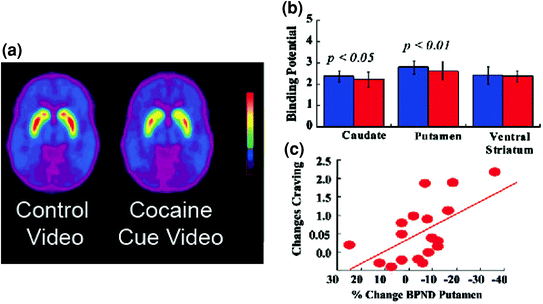
มะเดื่อ. 5 การเปลี่ยนแปลง DA เกิดจากการชี้นำที่มีเงื่อนไขในวิชาที่ติดโคเคน. ค่าเฉลี่ยการเชื่อมโยงที่อาจเกิดขึ้นไม่ได้ (BPND) ภาพของ [11C] raclopride ในอาสาสมัครที่ติดโคเคน (n = 17) ทดสอบในขณะที่ดูวิดีโอที่เป็นกลาง (ฉากธรรมชาติ) และในขณะที่ดูวิดีโอโคเคน - โคเคน b ความพร้อมใช้งานของ D2R (BPND) เป็นแบบ caudate, putamen และ ventral striatum สำหรับวิดีโอที่เป็นกลาง (สีน้ำเงิน) และวิดีโอ cocaine-cues (สีแดง) ตัวชี้นำโคเคนลดลง D2R ในหางและ putamen c ความสัมพันธ์ระหว่างการเปลี่ยนแปลงใน D2R (สะท้อนถึงการเพิ่มขึ้นของ DA) และการรายงานตนเองเกี่ยวกับความอยากโคเคนที่เกิดจากวิดีโอโคเคน ดัดแปลงจากการอ้างอิง (Volkow et al. 2006b)
Interestingly, ประเภทของ "สวิตช์" การทำงานนี้ยังได้รับการรายงานสำหรับ reinforcers ธรรมชาติซึ่งมีแนวโน้มที่จะกระตุ้นให้เกิดการเปลี่ยนแปลงที่เท่าเทียมกันและค่อยเป็นค่อยไปในการเพิ่ม DA จากหน้าท้องไปยังภูมิภาคหลังของ striatum ระหว่างการเปลี่ยนจากการกระตุ้นใหม่ที่เป็นเนื้อแท้ ให้รางวัลกับตัวชี้นำที่เกี่ยวข้องที่ทำนายไว้ การเปลี่ยนแปลงนี้ถ่ายทอดผ่านการส่งสัญญาณ DA ซึ่งดูเหมือนจะเป็นรหัสสำหรับ "ข้อผิดพลาดในการทำนายผลตอบแทน" (Schultz 2010) อวัยวะกลูตามาเทอจิคที่กว้างขวางไปยังเซลล์ประสาท DA จากภูมิภาคที่เกี่ยวข้องในการประมวลผลของประสาทสัมผัส (insula หรือเยื่อหุ้มสมองอักเสบหลัก), homeostatic (มลรัฐ), รางวัล (NAc), อารมณ์ (amygdala และฮิปโปแคมปัส) และ multimodal (orbitofrontal cortex ปรับกิจกรรมของพวกเขาเพื่อตอบสนองต่อรางวัลและการชี้นำที่มีเงื่อนไข (Geisler และ Wise 2008) โดยเฉพาะอย่างยิ่งการคาดการณ์จาก amygdala และ orbitofrontal cortex (OFC) ถึง DA neurons และ NAc มีส่วนร่วมในการตอบสนองต่อเงื่อนไขของอาหาร (Petrovich 2010) จากการศึกษาด้านการถ่ายภาพแสดงให้เห็นว่าเมื่ออาสาสมัครชายที่ไม่เป็นโรคอ้วนถูกถามเพื่อยับยั้งความอยากอาหารขณะที่สัมผัสกับอาหารพวกเขาแสดงกิจกรรมการเผาผลาญที่ลดลงใน amygdala และ OFC (เช่นเดียวกับฮิบโป), insula และ striatum และการลดลงของ OFC นั้นสัมพันธ์กับการลดลงของความอยากอาหาร (วังและคณะ 2009) การยับยั้งกิจกรรมเมตาบอลิซึมที่คล้ายกันใน OFC (และใน NAc) ถูกพบในผู้ใช้โคเคนเมื่อพวกเขาถูกขอให้ยับยั้งความอยากยาของพวกเขาเมื่อสัมผัสกับโคเคน -cues (Volkow et al. 2009b).
ถึงกระนั้นการเกิดขึ้นของความอยากอย่างแรงคิวที่มีพลังเช่นนี้ซึ่งสำหรับอาหารก็เกิดขึ้นในคนที่มีสุขภาพที่ไม่กินมากเกินไปจะไม่เป็นการทำลายล้างหากพวกเขาไม่ได้ควบคู่ไปกับการขาดดุลที่เพิ่มขึ้นในความสามารถของสมอง
4 ผลกระทบของความผิดปกติในการควบคุมการยับยั้ง
ความสามารถในการยับยั้งการตอบสนองแบบเร่งด่วนนั้นมีส่วนช่วยให้ความสามารถของแต่ละบุคคลในการหลีกเลี่ยงพฤติกรรมที่ไม่เหมาะสมเช่นการกินยาหรือการกินผ่านจุดที่เต็มไปด้วยความเต็มอิ่มและเพิ่มความเสี่ยงต่อการติดยาเสพติด (หรือโรคอ้วน) 2000; Volkow และคณะ 2008a).
การศึกษา PET ได้เปิดเผยถึงการลดลงอย่างมีนัยสำคัญของความพร้อมใช้งาน D2R ในกลุ่มผู้ติดยาเสพติดที่ยังคงมีอยู่เป็นเวลาหลายเดือนหลังจากการล้างพิษที่ยืดเยื้อ [ทบทวนใน (Volkow et al. 2009a)] ในทำนองเดียวกันการศึกษาพรีคลินิกในไพรเมอร์หนูและไม่ใช่มนุษย์ได้แสดงให้เห็นว่าการสัมผัสกับยาซ้ำ ๆ มีความสัมพันธ์กับการลดลงของระดับ D2R ในทารกแรกเกิด (Nader et al. 2006; ธานอสและคณะ 2007; Volkow และคณะ 2001) ใน striatum, D2Rs เป็นสื่อกลางในการส่งสัญญาณทางเดินทางอ้อม striatal ที่ modulates ภูมิภาค prefrontal; และการลดลงของมันแสดงให้เห็นว่าเพิ่มความไวต่อผลกระทบของยาในสัตว์ทดลอง (เฟอร์กูสันและคณะ 2011) ในมนุษย์ที่ติดยาเสพติดการลดลงของ DXRUM ในทารกแรกเกิดมีความสัมพันธ์กับกิจกรรมที่ลดลงของภูมิภาค prefrontal เป็นหลักฐานโดยการลดลงในการเผาผลาญกลูโคสพื้นฐาน (เครื่องหมายของการทำงานของสมอง) ใน OFC, gying cingulate ก่อนหน้า ) (Volkow et al. 2001, 1993, 2007) (รูปที่ 6) อีกทั้ง OFC, ACC และ DLPFC มีส่วนเกี่ยวข้องกับการระบุความสำคัญการควบคุมการยับยั้ง / การควบคุมอารมณ์และการตัดสินใจตามลำดับ มันได้รับการตั้งสมมติฐานว่ากฎระเบียบที่ไม่เหมาะสมของพวกเขาโดยการส่งสัญญาณ DA ที่เป็นสื่อกลางของ D2R ในอาสาสมัครที่ติดยาเสพติดสามารถรองรับค่าแรงจูงใจที่เพิ่มขึ้นของยาเสพติดในพฤติกรรมของพวกเขาและการสูญเสียการควบคุมการบริโภคยา 2000). นอกจากนี้เนื่องจากความบกพร่องใน OFC และ ACC มีความสัมพันธ์กับพฤติกรรมบีบบังคับและแรงกระตุ้น (Fineberg et al. 2009) การปรับความบกพร่องของ DA ของภูมิภาคเหล่านี้มีแนวโน้มที่จะมีส่วนร่วมในการบริโภคยาเสพติดซึ่งต้องกระทำและห่ามที่เห็นในการเสพติด (Goldstein และ Volkow 2002) อันที่จริงแล้วในผู้ทำยาบ้า methamphetamine นั้น D2R ที่เกี่ยวกับทารกแรกเกิดต่ำมีความเกี่ยวข้องกับแรงกระตุ้น (Lee et al. 2009) และยังทำนายการบริหารโคเคนที่ต้องปฏิบัติในหนู (Everitt และคณะ 2008) สถานการณ์ย้อนกลับซึ่งเป็นช่องโหว่เริ่มต้นสำหรับผู้ใช้ยาเสพติดก่อนหน้านี้ในภูมิภาค prefrontal และโดยที่การใช้ยาซ้ำ ๆ ทำให้เกิดการลดลงของการเกิด striat D2R ต่อไป อันที่จริงการศึกษาที่ทำในวิชาที่แม้จะมีความเสี่ยงสูงต่อโรคพิษสุราเรื้อรัง (ประวัติครอบครัวเชิงบวกของโรคพิษสุราเรื้อรัง) ไม่ติดสุราเปิดเผยสูงกว่าปกติ D2R striatal ว่างที่เกี่ยวข้องกับการเผาผลาญปกติใน OFC, ACC และ DLPFC (Volkow et al. 2006a) สิ่งนี้ชี้ให้เห็นว่าในวิชาเหล่านี้มีความเสี่ยงต่อการติดเหล้าฟังก์ชั่น prefrontal ปกติจะเชื่อมโยงกับสัญญาณ D2R striatal ที่ปรับปรุงแล้วซึ่งอาจป้องกันพวกเขาจากการใช้แอลกอฮอล์ในทางที่ผิด
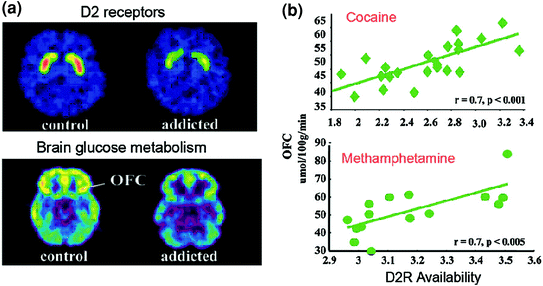
มะเดื่อ. 6 ความสัมพันธ์ระหว่างความพร้อมในการเกิด D2R ของ striatal กับการเผาผลาญในบริเวณสมองส่วนหน้า ภาพสมอง Axial สำหรับการควบคุมและเรื่องที่ติดโคเคนสำหรับภาพพื้นฐาน ของความพร้อมใช้งานของ D2R ใน striatum (รับด้วย [11C] raclopride) และการเผาผลาญกลูโคสในสมองใน OFC (ได้ด้วย [18FDG) b ความสัมพันธ์ระหว่าง D2R striatal กับเมตาบอลิซึมของ OFC ในผู้ติดโคเคนและผู้ติดยาบ้า พิมพ์ซ้ำจาก Volkow et al. (2009a) ลิขสิทธิ์ (2009) ได้รับอนุญาตจาก Elsevier
หลักฐานของ dysregulation ในวงจรควบคุมก็ถูกพบในคนอ้วน ทั้งการศึกษาทางคลินิกและ preclinical ได้ให้หลักฐานของการลดลงของสัญญาณ D2R striatal ซึ่งดังกล่าวข้างต้นมีการเชื่อมโยงกับรางวัล (NAc) แต่ยังมีการจัดตั้งนิสัยและกิจวัตร (dorsal striatum) ใน obesity (Geiger et al. 2009; วังและคณะ 2001) ที่สำคัญการมีอยู่ของ D2R แบบ striatal ที่ลดลงนั้นเชื่อมโยงกับการบริโภคอาหารที่จำเป็นในหนูที่เป็นโรคอ้วน (Johnson and Kenny) 2010) และลดกิจกรรมการเผาผลาญใน OFC และ ACC ในคนอ้วน (Volkow et al. 2008b) (รูปที่ 7A-c) ระบุว่าความผิดปกติใน OFC และ ACC ส่งผลให้เกิดการบังคับ [ดูรีวิว (Fineberg et al. 2009)] นี่อาจเป็นส่วนหนึ่งของกลไกที่การส่งสัญญาณ D2R ในระดับต่ำจะช่วยอำนวยความสะดวกให้กับภาวะ hyperphagia (Davis et al. 2009). นอกจากนี้เนื่องจากการส่งสัญญาณที่เกี่ยวข้องกับ D2R ที่ลดลงก็มีแนวโน้มที่จะลดความไวต่อการให้รางวัลตามธรรมชาติอื่น ๆ การขาดดุลนี้ในบุคคลที่เป็นโรคอ้วนก็อาจนำไปสู่การชดเชยการกินมากเกินไป (Geiger และคณะ 2008).
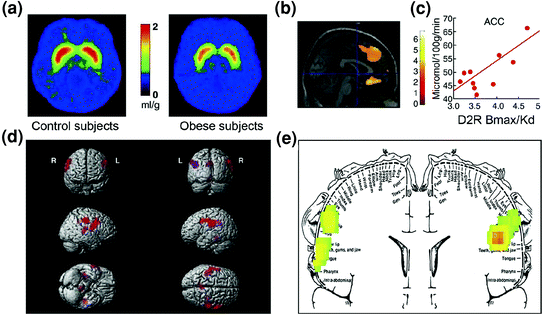
มะเดื่อ. 7 Hyperphagia อาจเป็นผลมาจากการขับเพื่อชดเชยวงจรรางวัลที่อ่อนแรง (ประมวลผลผ่านวงจร corticostriatal ที่ควบคุมด้วยโดปามีน) รวมกับความไวที่เพิ่มขึ้นต่อความน่ากิน (คุณสมบัติทางความน่าเชื่อถือของอาหารที่แปรรูปส่วนหนึ่งผ่านเยื่อหุ้มเซลล์ somatosensory). ภาพเฉลี่ยสำหรับความพร้อมใช้งานตัวรับ DA D2 (D2R) ในการควบคุม (n = 10) และในผู้ป่วยที่เป็นโรคอ้วน (n = 10) b ผลลัพธ์จาก (การทำแผนที่พารามิเตอร์เชิงสถิติ) SPM ระบุพื้นที่ในสมองที่ D2R เกี่ยวข้องกับการเผาผลาญน้ำตาลกลูโคสซึ่งรวมถึง OFC ตรงกลาง ACC และ PFC ด้านหลัง (ไม่แสดงพื้นที่) c ความชันของการถดถอยระหว่าง striatal D2R และกิจกรรมการเผาผลาญใน ACC ในผู้ป่วยที่เป็นโรคอ้วน d ภาพ SPM ที่แสดงผลแบบสามมิติแสดงพื้นที่ที่มีการเผาผลาญในคนอ้วนสูงกว่าในวัตถุที่ไม่ติดมัน (P <0.003 ไม่ได้แก้ไข) e ผลลัพธ์ SPM รหัสสีที่แสดงในระนาบโคโรนาพร้อมกับแผนภาพที่ซ้อนทับของโฮมุนคิวลัสโซมาโตเซนโซรี ผลลัพธ์ (ค่า z) แสดงโดยใช้ระดับรุ้งโดยที่สีแดง> เหลือง> เขียว เมื่อเปรียบเทียบกับผู้ป่วยที่ไม่ติดมันผู้ป่วยที่เป็นโรคอ้วนจะมีการเผาผลาญพื้นฐานที่สูงกว่าในบริเวณที่มีการสัมผัสทางประสาทสัมผัสซึ่งเป็นตัวแทนของปากริมฝีปากและลิ้นและเกี่ยวข้องกับการแปรรูปอาหารที่น่ารับประทาน ดัดแปลงโดยได้รับอนุญาตจาก Volkow et al. (2008a) (a – c) และ Wang et al (2002) (d, e)
สมมติฐานนี้สอดคล้องกับหลักฐานพรีคลินิกแสดงว่ากิจกรรม DA ที่ลดลงใน VTA ส่งผลให้การบริโภคอาหารไขมันสูงเพิ่มขึ้นอย่างมาก (Stoeckel และคณะ 2008) ในทำนองเดียวกันเมื่อเทียบกับบุคคลที่มีน้ำหนักปกติคนอ้วนที่ถูกนำเสนอด้วยรูปภาพของอาหารแคลอรี่สูง (สิ่งเร้าที่พวกเขาถูกปรับสภาพ) แสดงการกระตุ้นประสาทในพื้นที่ที่เป็นส่วนหนึ่งของวงจรรางวัลและแรงจูงใจ (NAc, dorsal striatum, OFC) , ACC, amygdala, hippocampus และ insula) (Killgore และ Yurgelun-Todd 2005) ในทางกลับกันในการควบคุมน้ำหนักปกติการเปิดใช้งาน ACC และ OFC (ภูมิภาคที่เกี่ยวข้องกับการระบุลักษณะที่น่าสนใจที่โครงการเข้าสู่ NAc) ระหว่างการนำเสนออาหารแคลอรี่สูงพบว่ามีความสัมพันธ์เชิงลบกับดัชนีมวลกาย (BMI) Stice และคณะ 2008b) สิ่งนี้แสดงให้เห็นการมีปฏิสัมพันธ์แบบไดนามิกระหว่างปริมาณอาหารที่รับประทาน (สะท้อนบางส่วนในค่าดัชนีมวลกาย) และปฏิกิริยาของรางวัลภูมิภาคกับอาหารแคลอรี่สูง (สะท้อนจากการกระตุ้น OFC และ ACC) ในบุคคลที่มีน้ำหนักปกติซึ่งหายไปใน ความอ้วน
น่าแปลกที่บุคคลที่เป็นโรคอ้วนแสดงการกระตุ้นวงจรการให้รางวัลน้อยลงจากการบริโภคอาหารจริง (เรียกว่ารางวัลอาหารการกิน) กว่าผู้ที่มีน้ำหนักน้อยในขณะที่พวกเขาแสดงให้เห็นการกระตุ้นของภูมิภาคเยื่อหุ้มสมอง somatosensory 2008b) การสังเกตหลังนั้นสอดคล้องกับภูมิภาคที่การศึกษาก่อนหน้านี้เปิดเผยกิจกรรมที่ปรับปรุงแล้วในเรื่องโรคอ้วนที่ทดสอบที่ระดับพื้นฐาน (ไม่มีการกระตุ้น) (Wang et al) 2002) (รูปที่ 7d, e) กิจกรรมที่ได้รับการพัฒนาของภูมิภาคที่ความน่าพอใจของกระบวนการสามารถทำให้ผู้ที่เป็นโรคอ้วนชอบอาหารมากกว่าสารเสริมธรรมชาติอื่น ๆ ในขณะที่การกระตุ้นการทำงานของเป้าหมายโดปามิเนอร์จิคลดลงจากการบริโภคอาหารที่แท้จริงอาจนำไปสู่ 2008a) การตอบสนองที่ลดลงของวงจรการให้รางวัลต่อการบริโภคอาหารในวิชาที่เป็นโรคอ้วนนั้นเป็นการระลึกถึงการเพิ่ม DA ที่ลดลงซึ่งเกิดจากการบริโภคยาเสพติดในผู้ติดยาเสพติดเมื่อเปรียบเทียบกับผู้ที่ไม่ได้ติดยา
เยื่อหุ้มสมองส่วนหน้า (PFC) มีบทบาทสำคัญในการทำงานของผู้บริหารรวมถึงการควบคุมการยับยั้ง (มิลเลอร์และโคเฮน) 2001) กระบวนการเหล่านี้ได้รับการดัดแปลงโดย D1R และ D2R (ซึ่งสันนิษฐานว่าเป็น D4R) และกิจกรรมที่ลดลงใน PFC ทั้งในการติดยาเสพติดและโรคอ้วนมีแนวโน้มที่จะนำไปสู่การควบคุมที่ไม่ดีและการบังคับสูง ความพร้อมใช้งานที่ต่ำกว่าปกติของ D2R ใน striatum ของบุคคลที่เป็นโรคอ้วนซึ่งเกี่ยวข้องกับกิจกรรมที่ลดลงใน PFC และ ACC (Volkow et al. 2008b) จึงมีแนวโน้มที่จะมีส่วนร่วมในการควบคุมการขาดอาหารของพวกเขา อันที่จริงค่าสหสัมพันธ์เชิงลบระหว่าง BMI และ striatal D2R รายงานเป็นโรคอ้วน (Wang et al. 2001) และในภาวะน้ำหนักเกิน (Haltia et al. 2007a) บุคคลสนับสนุนสิ่งนี้ ความเข้าใจที่ดีขึ้นเกี่ยวกับกลไกที่นำไปสู่การทำงานของ PFC ที่บกพร่องในโรคอ้วน (หรือการติดยาเสพติด) สามารถช่วยในการพัฒนากลยุทธ์เพื่อแก้ไขปัญหาหรืออาจย้อนกลับแม้แต่ความบกพร่องเฉพาะในโดเมนที่สำคัญ ตัวอย่างเช่นการลดราคาล่าช้าซึ่งเป็นแนวโน้มที่จะลดคุณค่าของรางวัลในฐานะหน้าที่ของการเลื่อนเวลาชั่วคราวของการส่งมอบเป็นหนึ่งในการดำเนินงานทางปัญญาที่ได้รับการตรวจสอบอย่างกว้างขวางมากที่สุดเกี่ยวกับความผิดปกติที่เกี่ยวข้องกับการกระตุ้น การลดราคาล่าช้าได้รับการตรวจสอบอย่างละเอียดที่สุดในผู้ใช้ยาเสพติดที่แสดงความพึงพอใจเกินจริงสำหรับรางวัลเล็ก ๆ แต่ในทันทีมากกว่ารางวัลใหญ่ แต่ล่าช้า (Bickel et al. 2007) อย่างไรก็ตามการศึกษาน้อยที่ดำเนินการกับบุคคลที่เป็นโรคอ้วนยังได้ค้นพบหลักฐานของการตั้งค่าสำหรับผลตอบแทนสูงและทันทีแม้จะมีโอกาสเพิ่มขึ้นของการสูญเสียในอนาคตที่สูงขึ้น (Brogan และคณะ 2010; Weller และคณะ 2008) และเมื่อเร็ว ๆ นี้การศึกษาอื่นพบว่าความสัมพันธ์เชิงบวกระหว่าง BMI และการผ่อนชำระซึ่งเกินความจริงซึ่งการจ่ายเงินติดลบในอนาคตจะลดลงน้อยกว่าการจ่ายในเชิงบวกในอนาคต (Ikeda et al 2010) น่าสนใจการลดราคาล่าช้านั้นขึ้นอยู่กับหน้าที่ของ ventral striatum (Gregorios-Pippas et al. 2009) และของ PFC รวมถึง OFC ด้านข้าง (Bjork et al. 2009) และไวต่อการเปลี่ยนแปลง DA (Pine et al. 2010) โดยเฉพาะการเสริมสร้างการส่งสัญญาณ DA (ด้วยการรักษา L DOPA) เพิ่มแรงกระตุ้นและลดราคาชั่วคราว
5 การมีส่วนร่วมของวงจรแรงจูงใจ
การส่งสัญญาณโดปามีนยังช่วยปรับแรงจูงใจ ลักษณะพฤติกรรมเช่นความแข็งแรงความเพียรและการลงทุนอย่างต่อเนื่องเพื่อให้บรรลุเป้าหมายนั้นล้วน แต่เป็นการปรับโดย DA ที่กระทำผ่านหลายภูมิภาคเป้าหมาย รวมถึง NAc, ACC, OFC, DLPFC, amygdala, dorsal striatum และ ventral pallidum (Salamone et al. 2007) สัญญาณ Dysregulated DA นั้นเกี่ยวข้องกับแรงจูงใจที่เพิ่มขึ้นในการจัดหายาซึ่งเป็นจุดเด่นของการติดยาเสพติดซึ่งเป็นสาเหตุที่บุคคลที่ติดยาเสพติดมักจะมีส่วนร่วมในพฤติกรรมที่รุนแรงเพื่อรับยาแม้ในขณะที่พวกเขาได้รับผลกระทบรุนแรง 2005). เพราะการเสพยากลายเป็นแรงผลักดันหลักในการติดยาเสพติด (Volkow et al. 2003) ผู้ที่ติดยาเสพติดถูกกระตุ้นและกระตุ้นโดยกระบวนการรับยา แต่มีแนวโน้มที่จะถูกถอนออกและไม่แยแสเมื่อสัมผัสกับกิจกรรมที่ไม่เกี่ยวข้องกับยา การเปลี่ยนแปลงนี้ได้รับการศึกษาโดยการเปรียบเทียบรูปแบบการกระตุ้นสมองที่เกิดขึ้นจากการสัมผัสกับสัญญาณที่มีเงื่อนไขกับที่เกิดขึ้นในกรณีที่ไม่มีตัวชี้นำดังกล่าว ตรงกันข้ามกับการลดลงของกิจกรรม prefrontal รายงานใน abusers โคเคนล้างพิษเมื่อไม่ถูกกระตุ้นด้วยตัวชี้นำยาหรือยา [ดูความคิดเห็น (Volkow et al. 2009a)] ภูมิภาค prefrontal เหล่านี้จะถูกเปิดใช้งานเมื่อผู้ใช้โคเคนโคเคนเผชิญกับสิ่งกระตุ้นความอยาก (สิ่งเสพติดหรือตัวชี้นำ) (Grant et al. 1996; Volkow และคณะ 1999a; วังและคณะ 1999) ผลลัพธ์นี้ทำให้ระลึกถึงการสังเกตว่าผู้เสพโคเคนที่ศึกษาไม่นานหลังจากเกิดเหตุการณ์โคเคน binging แสดงให้เห็นว่ากิจกรรมการเผาผลาญเพิ่มขึ้นใน OFC และ ACC (เช่นหลัง striatum) ที่เกี่ยวข้องกับความอยาก (Volkow et al. 1991).
ยิ่งกว่านั้นเมื่อเปรียบเทียบการตอบสนองต่อ iv MP ระหว่างผู้ติดโคเคนและไม่ติดผู้ป่วยอดีตตอบสนองด้วยการเผาผลาญที่เพิ่มขึ้นใน ventral ACC และ medial OFC (ผลกระทบที่เกี่ยวข้องกับความอยาก) ในขณะที่หลังพบการตอบสนองตรงกันข้าม การเผาผลาญอาหารในภูมิภาคเหล่านี้ (Volkow et al. 2005) สิ่งนี้ชี้ให้เห็นว่าการเปิดใช้งานของบริเวณ prefrontal เหล่านี้ที่มีการสัมผัสกับยาอาจมีลักษณะเฉพาะสำหรับการติดและเกี่ยวข้องกับความปรารถนาที่เพิ่มขึ้นสำหรับยา นอกจากนี้การศึกษาที่กระตุ้นให้ผู้ติดยาเสพติดโคเคนยับยั้งความอยากอย่างเด็ดเดี่ยวเมื่อสัมผัสกับยาเสพติดแสดงให้เห็นว่าผู้ที่ประสบความสำเร็จในการยับยั้งความอยากแสดงการเผาผลาญลดลงใน medial OFC (ซึ่งเป็นกระบวนการสร้างแรงจูงใจค่าของ reinforcer) และ NAc รางวัล) (Volkow et al. 2009b) การค้นพบเหล่านี้ยังยืนยันการมีส่วนร่วมของ OFC, ACC และ striatum ในแรงจูงใจที่เพิ่มขึ้นเพื่อจัดหายาเสพติดที่เห็นในการติดยาเสพติด
คาดการณ์ได้ OFC ยังมีส่วนเกี่ยวข้องในการคิดค่าความนิยมต่ออาหาร (Grabenhorst และคณะ 2008; ก้อนและ McCabe 2007) ช่วยประเมินความพึงพอใจและความพอใจที่คาดว่าจะได้รับในฐานะหน้าที่ของบริบท การศึกษา PET กับ FDG เพื่อวัดการเผาผลาญกลูโคสในสมองในบุคคลที่มีน้ำหนักปกติรายงานว่าการได้รับสารอาหารเพิ่มกิจกรรมการเผาผลาญใน OFC ซึ่งเป็นผลกระทบที่เกี่ยวข้องกับการรับรู้ถึงความหิวโหยและความต้องการอาหาร (Wang et al) 2004) การเปิดใช้งาน OFC ที่ได้รับการปรับปรุงโดยการกระตุ้นอาหารมีแนวโน้มที่จะสะท้อนถึงผลกระทบของสารโดปามินเนอร์จิคในปลายน้ำ OFC มีบทบาทในการเรียนรู้การเชื่อมโยงกับการกระตุ้นและเสริมแรง (Cox et al.) 2005; Gallagher และคณะ 1999) รองรับการให้อาหารตามคิว (Weingarten) 1983) และอาจก่อให้เกิดการกินมากเกินไปโดยไม่คำนึงถึงสัญญาณความหิว (Ogden และ Wardle 1990) แท้จริงแล้วความผิดปกติของ OFC นั้นเชื่อมโยงกับการกินมากเกินไป (Machado และ Bachevalier) 2007).
ข้อมูลการถ่ายภาพสมองยังสนับสนุนความคิดที่ว่าการเปลี่ยนแปลงเชิงโครงสร้างและหน้าที่ในบริเวณสมองที่เกี่ยวข้องในการทำงานของผู้บริหาร (รวมถึงการควบคุมการยับยั้ง) อาจเกี่ยวข้องกับค่าดัชนีมวลกายสูงในบุคคลที่มีสุขภาพดี ตัวอย่างเช่นการศึกษา MRI ในหญิงสูงอายุโดยใช้ morphometry ที่ยึดตาม voxel พบว่ามีความสัมพันธ์เชิงลบระหว่างปริมาณ BMI และปริมาณสสารสีเทา (รวมถึงบริเวณด้านหน้า) ซึ่งใน OFC มีความสัมพันธ์กับการทำงานของผู้บริหารที่บกพร่อง 2010) การใช้ PET เพื่อวัดการเผาผลาญกลูโคสในสมองในการควบคุมสุขภาพเราได้รายงานความสัมพันธ์เชิงลบระหว่าง BMI และกิจกรรมการเผาผลาญใน DLPFC, OFC และ ACC ในการศึกษานี้กิจกรรมการเผาผลาญในภูมิภาค prefrontal ทำนายประสิทธิภาพของอาสาสมัครในการทดสอบการทำงานของผู้บริหาร (Volkow และคณะ 2009c) ในทำนองเดียวกันการศึกษาด้วยคลื่นแม่เหล็กไฟฟ้าด้วยนิวเคลียร์ (NMR) ในวัยกลางคนที่มีสุขภาพดีและการควบคุมผู้สูงอายุพบว่าค่าดัชนีมวลกายมีความสัมพันธ์เชิงลบกับระดับของ N-acetyl-aspartate (เครื่องหมายของความสมบูรณ์ของเซลล์ประสาท) ในเยื่อหุ้มสมองด้านหน้าและ ACC 2008; Volkow และคณะ 2009c).
การศึกษาเกี่ยวกับการถ่ายภาพสมองเมื่อเปรียบเทียบกับคนที่เป็นโรคอ้วนและคนผอมก็รายงานความหนาแน่นของสสารสีเทาต่ำกว่าในส่วนหน้า (เพอคิวลัมหน้าผากและไจรัลหน้าผากกลาง) และในโพสต์กลาง - กลางและ putamen (Pannacciulli และคณะ 2006) การศึกษาอื่นพบว่าปริมาณสสารสีเทาไม่แตกต่างกันระหว่างกลุ่มที่เป็นโรคอ้วนและไม่ติดมัน มันบันทึกความสัมพันธ์เชิงบวกระหว่างปริมาณสสารสีขาวในโครงสร้างสมองพื้นฐานและอัตราส่วนเอวต่อสะโพกซึ่งเป็นแนวโน้มที่ตรงกันข้ามบางส่วนจากการอดอาหาร (Haltia et al. 2007b) ที่น่าสนใจคือบริเวณเยื่อหุ้มสมองเช่น DPFC และ OFC ที่เกี่ยวข้องกับการควบคุมการยับยั้งได้รับการค้นพบว่าสามารถกระตุ้นการทำงานของ dieters ที่ประสบความสำเร็จในการตอบสนองต่อการบริโภคอาหาร (DelParigi และคณะ 2007) แนะนำเป้าหมายที่เป็นไปได้สำหรับการฝึกอบรมพฤติกรรมในการรักษาโรคอ้วน (และในการติดยาเสพติด)
6 การมีส่วนร่วมของ Interoceptive Circuitry
การศึกษาเกี่ยวกับระบบประสาทได้เปิดเผยว่า insula กลางมีบทบาทสำคัญในความอยากอาหารโคเคนและบุหรี่ (Bonson และคณะ 2002; Pelchat และคณะ 2004; วังและคณะ 2007) ความสำคัญของการ insula ได้รับการเน้นโดยการศึกษาที่รายงานว่าผู้สูบบุหรี่ที่มีความเสียหายในภูมิภาคนี้ (แต่ไม่ควบคุมผู้สูบบุหรี่ที่ได้รับความเดือดร้อนบาดแผลพิเศษโดดเดี่ยว) สามารถหยุดสูบบุหรี่ได้อย่างง่ายดายและโดยไม่ประสบความอยากหรือกำเริบ . 2007) โดยเฉพาะอย่างยิ่งบริเวณหน้าของ insula ซึ่งเชื่อมโยงกับส่วนต่าง ๆ ของบริเวณ limbic ซึ่งกันและกัน (เช่น ventromedial prefrontal cortex, amygdala และ ventral striatum) และดูเหมือนจะมีฟังก์ชั่น interoceptive รวมข้อมูลเกี่ยวกับระบบประสาทส่วนกลางและอวัยวะภายในด้วยอารมณ์และแรงจูงใจ ความตระหนักรู้ถึงสิ่งกระตุ้นเหล่านี้ (Naqvi และ Bechara 2009) อันที่จริงการศึกษารอยโรคในสมองแสดงให้เห็นว่า PFC ventromedial และ insula เป็นองค์ประกอบที่จำเป็นของวงจรกระจายที่สนับสนุนการตัดสินใจทางอารมณ์ (Clark et al.) 2008) สอดคล้องกับสมมติฐานนี้การศึกษาการถ่ายภาพแสดงการเปิดใช้งาน insula ที่แตกต่างกันอย่างต่อเนื่องในระหว่างความอยาก (Brody et al. 2009; Goudriaan และคณะ 2010; Naqvi และ Bechara 2009; วังและคณะ 1999). ดังนั้นปฏิกิริยาของบริเวณสมองนี้จึงได้รับการแนะนำให้ทำหน้าที่เป็นไบโอมาร์คเกอร์เพื่อช่วยทำนายการกำเริบของโรค (Janes et al. 2010).
Insula ยังเป็นพื้นที่รับเลี้ยงบุตรบุญธรรมหลักซึ่งมีส่วนร่วมในหลาย ๆ ด้านของพฤติกรรมการกินเช่นรสชาติ นอกจากนี้ rostral insula (เชื่อมต่อกับเยื่อหุ้มสมองรสหลัก) ให้ข้อมูลแก่ OFC ที่มีอิทธิพลต่อการแสดงออกหลายรูปแบบของความรื่นรมย์หรือค่าตอบแทนของอาหารที่เข้ามา (Rolls 2008) เนื่องจากการมีส่วนร่วมของ insula ในความรู้สึก interoceptive ของร่างกายในการรับรู้ทางอารมณ์ (Craig 2003) และในแรงจูงใจและอารมณ์ (Rolls 2008) คาดว่าจะมีส่วนร่วมของการด้อยค่าโดดเดี่ยวในโรคอ้วน อันที่จริงผลการตรวจกระเพาะอาหารในการเปิดใช้งานของ insula หลังซึ่งมีแนวโน้มที่จะสะท้อนให้เห็นถึงบทบาทในการรับรู้ของรัฐร่างกาย (ในกรณีของความแน่น) (Wang et al. 2008) ยิ่งไปกว่านั้นในผู้ป่วยที่มีรูปร่างผอม แต่ไม่อ้วนผู้ที่มีอาการท้องอืดส่งผลให้มีการเปิดใช้งานของ amygdala และการเสื่อมของ insula ด้านหน้า (Tomasi et al. 2009) การขาดการตอบสนองของ amygdala ในผู้ที่เป็นโรคอ้วนอาจสะท้อนถึงการรับรู้ interoceptive ของรัฐทางร่างกายที่เชื่อมโยงกับความเต็มอิ่ม (เต็มท้อง) แม้ว่าการดัดแปลงของกิจกรรมโดดเดี่ยวโดย DA ได้รับการตรวจสอบไม่ดี แต่ก็เป็นที่ยอมรับว่า DA มีส่วนเกี่ยวข้องในการตอบสนองต่อการชิมอาหารอร่อยที่ผ่านการพิจารณาผ่าน Insula (Hajnal และ Norgren 2005) การศึกษาเกี่ยวกับการถ่ายภาพของมนุษย์แสดงให้เห็นว่าการชิมอาหารอร่อย ๆ ทำให้พื้นที่ insula และสมองส่วนกลาง (DelParigi และคณะ 2005; แฟรงค์และคณะ 2008) อย่างไรก็ตามการส่งสัญญาณ DA อาจจำเป็นสำหรับการรับรู้ปริมาณแคลอรี่ของอาหาร ตัวอย่างเช่นเมื่อผู้หญิงที่น้ำหนักปกติได้ลิ้มรสสารให้ความหวานที่มีแคลอรี่ (ซูโครส) ทั้งบริเวณ insula และ dopaminergic midbrain ก็เปิดใช้งานในขณะที่การได้รับสารให้ความหวานที่ปราศจากแคลอรี่ 2008) ผู้ที่เป็นโรคอ้วนแสดงการกระตุ้นแบบโดดเดี่ยวมากกว่าการควบคุมแบบปกติเมื่อชิมอาหารเหลวที่ประกอบด้วยน้ำตาลและไขมัน (DelParigi และคณะ 2005) ในทางตรงกันข้ามผู้ที่หายจากอาการเบื่ออาหารแสดงการกระตุ้นน้อยลงใน insula เมื่อชิมซูโครสและไม่มีความสัมพันธ์ของความรู้สึกสบายใจกับการกระตุ้นการทำงานแบบโดดเดี่ยวตามที่สังเกตในการควบคุมปกติ (Wagner et al. 2008) เมื่อรวมกันผลลัพธ์เหล่านี้ทำให้มีแนวโน้มว่า dysregulation ของ insula ในการตอบสนองต่อสิ่งเร้ารสชาติอาจมีส่วนร่วมในการควบคุมความบกพร่องของพฤติกรรมการทานอาหารที่หลากหลาย
7 วงจรแห่งความเกลียดชัง
ดังที่ได้กล่าวไว้ก่อนหน้านี้การฝึกอบรม (การปรับสภาพ) บนคิวที่ทำนายรางวัลนำไปสู่เซลล์โดปามิเนจิกที่ถูกยิงเพื่อตอบสนองต่อการทำนายผลรางวัลและไม่ใช่เพื่อรางวัล ในทางตรงกันข้ามและสอดคล้องกับตรรกะนี้มันได้รับการตั้งข้อสังเกตว่าเซลล์โดปามีนจะยิงน้อยกว่าปกติถ้ารางวัลที่คาดหวังล้มเหลวในการเกิดขึ้นจริง (Schultz et al. 1997) หลักฐานสะสม (Christoph และคณะ 1986; Lisoprawski และคณะ 1980; Matsumoto และ Hikosaka 2007; นิชิกาว่าและคณะ 1986) ชี้ไปที่ habenula ว่าเป็นหนึ่งในภูมิภาคที่ควบคุมการลดลงของการเผาเซลล์ dopaminergic ใน VTA ซึ่งอาจเกิดจากความล้มเหลวในการรับรางวัลที่คาดหวัง (Kimura et al.) 2007) ดังนั้นความไวที่เพิ่มขึ้นของ habenula ซึ่งเป็นผลมาจากการสัมผัสกับยาเสพติดเรื้อรังสามารถรองรับปฏิกิริยาที่มากขึ้นกับตัวชี้นำยา แท้จริงแล้วการเปิดใช้งานของ habenula ในวิชาที่ติดโคเคนมีความสัมพันธ์กับการกำเริบของพฤติกรรมการเสพยาเสพติดเมื่อสัมผัสคิว (Brown et al. 2011; จางและคณะ 2005) ในกรณีของนิโคตินตัวรับนิโคตินของα5ใน habenula ดูเหมือนจะปรับการตอบสนอง aversive กับนิโคตินในปริมาณที่มาก (Fowler et al. 2011); และตัวรับα5และα2ใน habenula นั้นเกี่ยวข้องกับการถอนนิโคติน (Salas et al. 2009). เนื่องจากการตอบสนองที่ตรงข้ามกับ habenula ของเซลล์ประสาท DA เพื่อให้รางวัล (การปิดใช้งาน) และการกระตุ้นเมื่อสัมผัสกับสิ่งเร้า aversive เราจึงอ้างถึง habenula ที่ส่งสัญญาณว่าเป็นสื่อที่นำเข้า "antireward".
habenula ดูเหมือนจะมีบทบาทที่คล้ายกันเกี่ยวกับรางวัลอาหาร อาหารที่มีความน่ากินสูงสามารถกระตุ้นความอ้วนในหนูด้วยการเพิ่มน้ำหนักสัมพันธ์กับการเพิ่มขึ้นของเปปไทด์μ-opioid ที่มีผลผูกพันใน amygdala basolateral และ basomedial ที่น่าสนใจ meden habenula แสดงให้เห็นการรวมตัวของเปปไทด์μ-opioid สูงขึ้นอย่างมีนัยสำคัญ (ประมาณ 40%) หลังจากสัมผัสกับอาหารที่อร่อยในหนูที่ได้รับน้ำหนัก (ผู้ที่บริโภคอาหารมากกว่า) แต่ไม่ใช่ในคนที่ไม่ได้ (Smith et al) 2002) สิ่งนี้ชี้ให้เห็นว่า habenula อาจมีส่วนร่วมในการกินมากเกินไปภายใต้เงื่อนไขความพร้อมของอาหารที่อร่อย ยิ่งไปกว่านั้นเซลล์ประสาทในนิวเคลียส rostromedial ซึ่งได้รับข้อมูลที่สำคัญจาก habenula ด้านข้างโครงการ VTA DA เซลล์ประสาทและเปิดใช้งานหลังจากการกีดกันอาหาร (Jhou et al 2009) การค้นพบเหล่านี้สอดคล้องกับบทบาทของ habenula ในการเป็นสื่อกลางในการตอบสนองต่อสิ่งเร้าหรือสิ่งเร้าที่เกิดขึ้นเช่นสิ่งที่เกิดขึ้นระหว่างการอดอาหารหรือถอนตัวยา
การมีส่วนร่วมของ habenula เป็นศูนย์กลาง antireward ภายในเครือข่ายทางอารมณ์มีความสอดคล้องกับรูปแบบทางทฤษฎีก่อนหน้าของการติดยาเสพติดที่ได้รับการตั้งสมมติฐานไวตอบสนองต่อต้านรางวัล (ไกล่เกลี่ยผ่านการปรับปรุงความไวของ amygdala และส่งสัญญาณเพิ่มขึ้นแม้ว่า corticotropin (Koob และ Le Moal) 2008) การตอบสนองที่คล้ายกันก่อนหน้านี้อาจนำไปสู่การบริโภคอาหารมากเกินไปในโรคอ้วน
8 พยาธิวิทยายาและรางวัลอาหาร: รูปแบบการทำงานที่ได้รับการปรับปรุง
Tความสามารถในการต่อต้านการกระตุ้นให้ใช้ยาหรือกินผ่านจุดที่เต็มอิ่มต้องการการทำงานที่เหมาะสมของวงจรประสาทที่เกี่ยวข้องกับการควบคุมจากบนลงล่างเพื่อคัดค้านการตอบสนองที่มีเงื่อนไขซึ่งทำนายผลรางวัลจากการบริโภคอาหาร / ยาและความปรารถนาที่จะ อาหาร / ยาเสพติด ที่นี่เราเน้นหกวงจรเหล่านี้: รางวัล / ความดีเลิศการปรับสภาพ / นิสัยการควบคุมการยับยั้ง / ฟังก์ชั่นผู้บริหารแรงจูงใจ / ไดรฟ์การขัดขวางและปฏิกิริยาการหลีกเลี่ยง / ความเกลียดชังความเครียด (รูปที่ 6) 8) จากข้อมูลการถ่ายภาพที่นำเสนอในที่นี้เรายืนยันว่ามันเป็นความแตกต่างระหว่างความคาดหวังของผลกระทบของยา / อาหาร (การตอบสนองแบบมีเงื่อนไข) และผลกระทบ neurophysiological ทื่อที่รักษาการใช้ยาหรือ overconsumption ของอาหารในความพยายาม รางวัลที่คาดหวัง นอกจากนี้ไม่ว่าจะมีการทดสอบในช่วงต้นหรือช่วงเวลาที่ยืดเยื้อของการเลิกบุหรี่ / การอดอาหารผู้ติดยา / โรคอ้วนแสดง D2R ที่ต่ำกว่าใน striatum (รวมถึง NAc) ซึ่งเกี่ยวข้องกับการลดลงของกิจกรรมพื้นฐานในพื้นที่สมองส่วนหน้า การควบคุม (ACC และ DLPFC) ซึ่งผลการหยุดชะงักใน compulsivity และ impulsivity Fภายในหลักฐานยังได้รับการเกิดขึ้นกับบทบาทของวงจร interoceptive และ aversive ในความไม่สมดุลของระบบที่ส่งผลให้การบริโภคของยาเสพติดหรืออาหารซึ่งต้องกระทำ
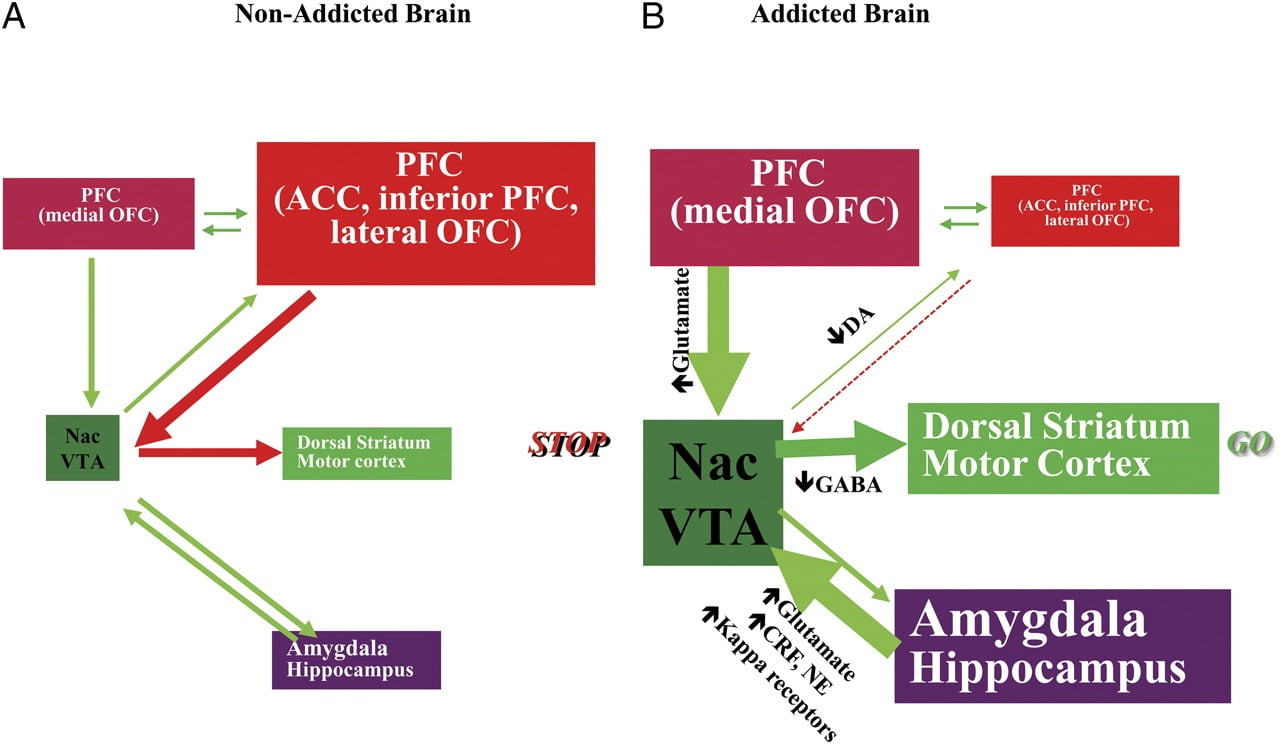
มะเดื่อ. 8 รูปแบบการนำเสนอเครือข่ายของวงจรโต้ตอบการหยุดชะงักซึ่งนำไปสู่ชุดที่ซับซ้อนของพฤติกรรมแบบแผนพื้นฐานการติดยาเสพติดและการกินมากเกินไปเรื้อรัง: รางวัล (นิวเคลียส accumbens, VTA, และ ventral pallidum), การปรับสภาพ / ความจำ (amygdala, medial OFC สำหรับการแสดงลักษณะของความมีชีวิตชีวา, ฮิบโปแคมตัส, และ striatum หลังสำหรับนิสัย), การควบคุมผู้บริหาร (DLPFC, ACC, รองสมองส่วนหน้า แรงจูงใจ / ขับรถ (ค่ามัธยฐาน OFC สำหรับการบ่งบอกถึงความสำคัญของช่องท้อง ACC, VTA, SN, striatum หลังและมอเตอร์เยื่อหุ้มสมอง) Nac, นิวเคลียส accumbens, การสกัดกั้น (Insula และ ACC), และความเกลียดชัง / การหลีกเลี่ยง (Habenula) a เมื่อวงจรเหล่านี้มีความสมดุลผลการควบคุมและการตัดสินใจที่เหมาะสม b ระหว่างการติดยาเสพติดเมื่อค่าความคาดหวังที่เพิ่มขึ้นของยาในรางวัลแรงจูงใจและวงจรความทรงจำเอาชนะวงจรควบคุมนิยมห่วงข้อเสนอแนะในเชิงบวกที่ริเริ่มโดยการบริโภคของยาเสพติดและ perpetuated โดยการเปิดใช้งานแรงจูงใจ / ไดรฟ์ และวงจรหน่วยความจำ วงจรเหล่านี้ยังมีปฏิสัมพันธ์กับวงจรที่เกี่ยวข้องกับการควบคุมอารมณ์รวมถึงการเกิดปฏิกิริยาความเครียด (ซึ่งเกี่ยวข้องกับ amygdala, hypothalamus, habenula) และ interoception (ซึ่งเกี่ยวข้องกับ insula และ ACC และก่อให้เกิดการรับรู้ถึงความอยาก) สารสื่อประสาทหลายชนิดมีส่วนเกี่ยวข้องในการปรับระบบประสาทเหล่านี้รวมถึงกลูตาเมต, GABA, norepinephrine, corticotropin-releasing factor และตัวรับ opioid ปัจจัย CRF, corticotropin ปล่อย; NE, norepinephrine แก้ไขโดยได้รับอนุญาตจาก Volkow และคณะ (2011b)
อันเป็นผลมาจากการหยุดชะงักตามลำดับในวงจรเหล่านี้บุคคลอาจประสบ 1) การสร้างแรงบันดาลใจที่เพิ่มขึ้นของค่ายา / อาหาร (รองจากสมาคมการเรียนรู้ผ่านการปรับสภาพและนิสัย) ที่ค่าใช้จ่ายของผู้สนับสนุนอื่น ๆ ), 2) ความสามารถที่บกพร่องในการยับยั้งการกระทำโดยเจตนา (มุ่งไปยังเป้าหมาย) ที่เกิดจากความปรารถนาอันแรงกล้าที่จะใช้ยา / อาหาร (การทำงานของผู้บริหารระดับรองไปยังผู้บกพร่อง) ซึ่งส่งผลให้เกิดการบังคับใช้ยา / อาหารและ 3) และหลีกเลี่ยง aversive ที่ส่งผลในการใช้ยาหุนหันพลันแล่นเพื่อหนีรัฐ aversive.
แบบจำลองนี้เสนอวิธีการบำบัดแบบหลายวิธีในการติดยาเสพติดที่ออกแบบมาเพื่อลดคุณสมบัติการเสริมแรงของยา / อาหารฟื้นฟู / เสริมคุณสมบัติการให้รางวัลของสารเสริมธรรมชาติยับยั้งความสัมพันธ์ที่เรียนรู้แบบมีเงื่อนไขยับยั้งแรงจูงใจสำหรับกิจกรรมที่ไม่เกี่ยวข้องกับยา / อาหาร ปรับปรุงอารมณ์และเสริมสร้างการควบคุมการยับยั้งวัตถุประสงค์ทั่วไป
กิตติกรรมประกาศ
ผู้เขียนขอขอบคุณการสนับสนุนโครงการ NIAAA ภายในสถาบันสุขภาพแห่งชาติ
อ้างอิง