รายงานทางวิทยาศาสตร์ ปริมาณ 9, หมายเลขบทความ: 16918 (2019)
นามธรรม
การบริโภคซูโครสมากเกินไปทำให้เกิดความอยากติดยาเสพติดซึ่งอาจเป็นต้นเหตุของการแพร่ระบาดของโรคอ้วน Opioids และโดปามีนเป็นสื่อกลางในการให้รางวัลผลกระทบของยาเสพติดและรางวัลตามธรรมชาติจากสิ่งเร้าเช่นอาหารอร่อย เราตรวจสอบผลกระทบของซูโครสโดยใช้ภาพสัตว์เลี้ยงด้วย [11C] carfentanil (μ-opioid receptor agonist) และ [11C] raclopride (โดปามีน D2 / 3 ตัวรับศัตรู) ในยาดมยาสลบGöttingen minipigs เจ็ดหญิง จากนั้นเราก็ให้ minipigs เข้าถึงซูโครสสารละลายเป็นเวลาหนึ่งชั่วโมงใน 12 วันติดต่อกันและทำการถ่ายภาพอีกครั้ง 24 ชั่วโมงหลังจากการเข้าถึงซูโครสสุดท้าย ในตัวอย่างเล็ก ๆ ห้า minipigs เราได้ทำการเพิ่ม [11C] เซสชัน PET carfentanil หลังจากได้รับซูโครสครั้งแรก เราคำนวณศักยภาพการผูกด้วย voxel (BP)ND) ใช้ cerebellum เป็นขอบเขตของการเชื่อมโยงที่ไม่สามารถแทนที่ได้วิเคราะห์ความแตกต่างด้วยการทำแผนที่สถิติแบบไม่อิงพารามิเตอร์และทำการวิเคราะห์ภูมิภาค หลังจากการเข้าถึงซูโครส 12 วัน BPND ของ tracers ทั้งสองได้ลดลงอย่างมีนัยสำคัญใน striatum นิวเคลียส accumbens, ฐานดอก, amygdala, เยื่อหุ้มสมอง cingulate และเยื่อหุ้มสมอง prefrontal, สอดคล้องกับการควบคุมความหนาแน่นของตัวรับลง หลังจากได้รับซูโครสเพียงครั้งเดียวเราพบว่าการจับตัวของ [11C] carfentanil ในนิวเคลียส accumbens และเยื่อหุ้มสมอง cingulate สอดคล้องกับ opioid ปล่อย ความพร้อมใช้งานที่ต่ำลงของตัวรับ opioid และ dopamine อาจอธิบายถึงศักยภาพในการติดที่เกี่ยวข้องกับการบริโภคซูโครส
บทนำ
ห้าเปอร์เซ็นต์ของประชากรโลกเป็นโรคอ้วนในทางคลินิก1. ในฐานะที่เป็นจุดเด่นของโรคที่เกี่ยวกับเมแทบอลิซึมโรคอ้วนนั้นสัมพันธ์กับโรคเบาหวานประเภท 2 โรคหัวใจและหลอดเลือดปัญหาระบบทางเดินหายใจและความเสี่ยงของภาวะซึมเศร้าและอาจเป็นโรคสมองเสื่อม2. การบริโภคที่เพิ่มขึ้นของอาหารที่มีพลังงานสูงทำให้ความแตกต่างทางสรีรวิทยาระหว่างความหิวโหย homeostatic ที่ตามมาจากการกีดกันอาหารและความหิว hedonic หรือ "ความอยาก" ซึ่งเกิดขึ้นในกรณีที่ไม่มีการกีดกัน3,4. เนื่องจากกฎระเบียบของ homeostatic เพียงอย่างเดียวไม่สามารถอธิบายถึงการเพิ่มขึ้นของโรคอ้วนในปัจจุบันได้จึงจำเป็นต้องทดสอบผลกระทบต่อกลไกสมองของการให้รางวัลและความสุขของคุณสมบัติเสพติดของอาหารที่น่ารับประทานอย่างมาก
การบริโภคซูโครสนั้นสัมพันธ์กับความอ้วนและซูโครสนั้นถือว่าเป็นสารเสพติดมากขึ้นเรื่อย ๆ5. การค้นพบบางอย่างขัดแย้งกับคำกล่าวอ้างนี้เนื่องจากความยากลำบากในการแยกการบริโภคอาหารที่ไม่น่ากินออกจากการตอบสนองของอาหารที่มีความชอบและการกำหนดส่วนประกอบที่เสพติดในอาหารแปรรูปเช่นเดียวกับกลไกต่าง ๆ ที่อาหารเปลี่ยนวงจรสมองผ่านเส้นทางธรรมชาติ6. อย่างไรก็ตามในบริบทเฉพาะการบริโภคซูโครสจะกระตุ้นให้เกิดการให้รางวัลและความอยากเทียบเคียงกับขนาดที่เกิดจากยาเสพติดที่นำไปสู่การ overconsumption และโรคอ้วนในที่สุด6,7.
ความหิวเกี่ยวข้องกับ“ ความต้องการ” ที่มีความสัมพันธ์อย่างใกล้ชิดกับผลกระทบของสารสื่อประสาทโดปามิคกี้ในหลายสถานการณ์ของรางวัล8แต่ก็ยังไม่ชัดเจนว่าการกระทำของโดปามีน (DA) นั้นถูกปรับในการตอบสนองต่อการรับประทานอาหารที่ต้องกระทำ การบริโภคอาหารที่อร่อยถูกเชื่อมโยงกับ“ ความชอบ” ซึ่งเป็นสื่อกลางโดยระบบ opioid ภายนอกโดยเฉพาะตัวรับμ-opioid (μOR)9,10ซึ่งสามารถส่งเสริม overconsumption เมื่อ deregulated ในรายงานปัจจุบันเราทดสอบการอ้างว่าซูโครสนำไปสู่การปล่อย opioid และโดปามีนซึ่งช่วยลดความพร้อมใช้งานของตัวรับμORและ DA D2 / 3 ความพร้อมใช้งานเป็นดัชนีของจำนวนตัวรับที่ไม่ว่างที่มีอยู่สำหรับการติดตามตัวยึดและในหลักการไม่แยกความแตกต่างระหว่างการยึดครองลิแกนด์และความหนาแน่นของตัวรับ11.
การเริ่มต้นของการรับประทานอาหารที่ต้องกระทำขึ้นอยู่กับหลายปัจจัยและการศึกษาเชิงสาเหตุในมนุษย์ทำให้เกิดปัญหาด้านจริยธรรม การศึกษาส่วนใหญ่จึงมุ่งเน้นไปที่พฤติกรรมการให้อาหารในหนู12. ถึงแม้ว่าหนูจะมี“ ฟันหวาน” แต่กลไก homeostatic สำคัญต่อการเพิ่มน้ำหนักการเผาผลาญอาหารและการสะสมไขมันแตกต่างจากมนุษย์อย่างเห็นได้ชัด Göttingen minipig เป็นสัตว์กินเนื้อทุกชนิดขนาดใหญ่ที่มีสมอง gyrencephalic ที่พัฒนาอย่างดีซึ่งสามารถถ่ายภาพด้วยความละเอียดที่เพียงพอ ภูมิภาคเยื่อหุ้มสมอง subcortical และ prefrontal กำหนดชัดเจน13 เปิดใช้งานการแปลโดยตรงกับฟังก์ชั่นสมองของมนุษย์ ที่นี่เราใช้การถ่ายภาพเอกซเรย์ปล่อยโพซิตรอน (PET) เพื่อทดสอบ ในร่างกาย ความพร้อมใช้งานμORและ DA D2 / 3 ในแบบจำลองขนาดเล็กของการได้รับซูโครส subchronic ในตัวอย่างขนาดเล็กเราตรวจสอบผลกระทบทันทีต่อการเข้าพักของμORหลังจากได้รับซูโครสครั้งแรก ในที่สุดเราได้ทดสอบความสัมพันธ์ระหว่างการเปลี่ยนแปลงความพร้อมใช้งานของเครื่องรับ tracers สองตัว
ผลสอบ
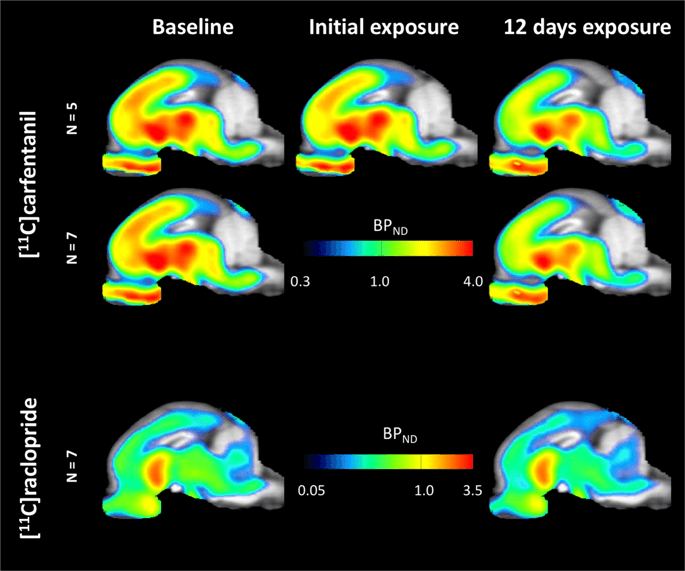
ค่าเฉลี่ยพารามิเตอร์แผนที่ของ [11C] carfentanil และ [11C] raclopride ที่มีศักยภาพในการผูก (BPND) จะแสดงในรูปที่ 1. เพื่อวิเคราะห์การเปลี่ยนแปลงที่เกิดขึ้นหลังจากการสัมผัสซูโครสครั้งแรกในห้านาทีเมื่อเทียบกับพื้นฐานและหนึ่งวันหลังจาก 12th การเข้าถึงซูโครสในเจ็ดนาทีเมื่อเทียบกับพื้นฐานเราใช้ทฤษฎีการเปลี่ยนแปลงและการวิเคราะห์ทั้งสมองแบบไม่ จำกัด ภูมิภาควิธีที่ต้องการสำหรับตัวอย่างของขนาดนี้14.
ค่าเฉลี่ยการดูดซับ voxel-wise ที่ไม่สามารถแทนที่ได้ (BP)ND) แผนที่ซ้อนทับกับภาพ MRI ในมุมมองทัล นำเสนอข้อมูลสำหรับ [11C] carfentanil BPND ของ 5 minipigs ถ่ายที่ระดับ baseline หลังจากได้รับซูโครสเริ่มแรกและหลังจากได้รับซูโครส 12 วัน (แถวบนสุด) [11C] carfentanil BPND ของ minipigs ทั้งหมด 7 ภาพที่ baseline และหลังจากการเข้าถึงซูโครส 12 วันจะปรากฏในแถวกลาง [11C] raclopride BPND ของ minipigs ทั้งหมด 7 ภาพที่ baseline และหลังจากการเข้าถึงซูโครส 12 วันจะแสดงในแถวด้านล่าง โปรดทราบว่าสเกลสีนั้นมีความหมายเพื่อเน้น [11C] raclopride BPND ในภูมิภาคนอกเขต
การได้รับซูโครสเริ่มต้น
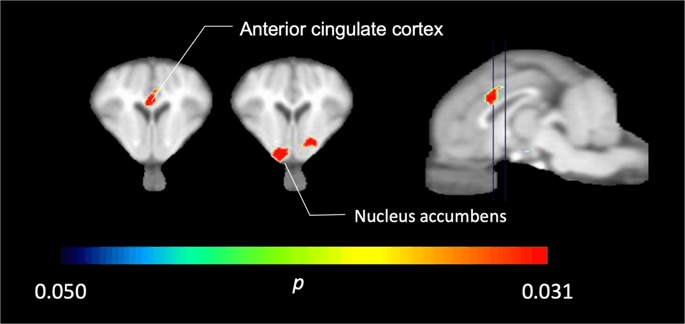
ในห้า minipigs ถ่ายด้วย [11C] carfentanil ที่ baseline และทันทีหลังจากที่ได้รับซูโครสครั้งแรกเราพบว่ามีการลดการจับตัวของ tracer ในคอร์เทกซ์เยื่อหุ้มสมองด้านหน้าและนิวเคลียส accumbens ในการตอบสนองซูโครสอย่างมีนัยสำคัญ 2แสดง p <0.05 เราตรวจพบการเชื่อมโยง Tracer ลดลงมากถึง 14% ในทั้งสองพื้นที่เมื่อเทียบกับค่าพื้นฐาน
การลดลงอย่างมีนัยสำคัญใน [11C] carfentanil BPND หลังจากการสัมผัสน้ำซูโครสครั้งแรกเมื่อเทียบกับระดับพื้นฐาน (n = 5) เฉพาะ voxels ที่มีนัยสำคัญ (p <0.05) การลดลงจะแสดงเป็นพื้นที่สีที่คาดการณ์ไว้บนการตัด MRI แบบถ่วงน้ำหนัก T1 ที่ระดับของเยื่อหุ้มสมอง cingulate ด้านหน้า (ซ้าย) และนิวเคลียส accumbens (กลาง) จากแผนที่สมองมินิปิกสเตียรอย โปรดทราบว่าระดับนัยสำคัญสูงสุดที่ทำได้กับสัตว์ 5 ตัวคือ 2-5 ≈ 0.031 (ดูแถบสี) ข้อมูลจะถูกนำเสนอในส่วนเวียนของสมองหมูในระดับที่ระบุไว้ในภาพทัล (ขวา)
การเข้าถึงซูโครส 12 วัน
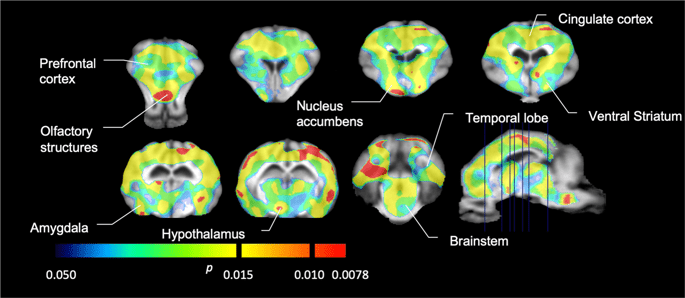
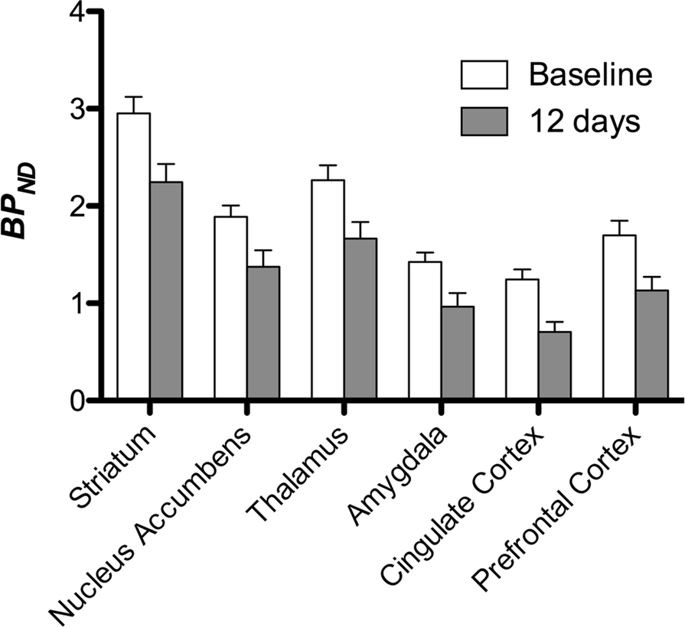
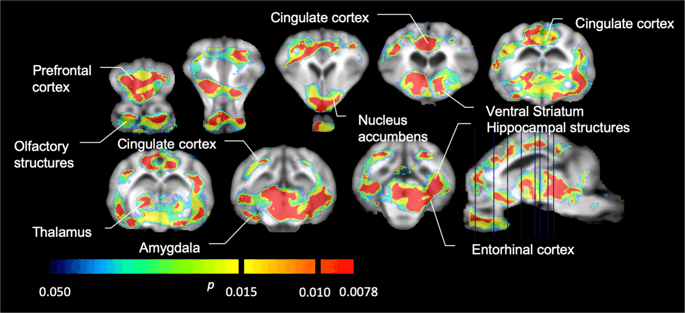
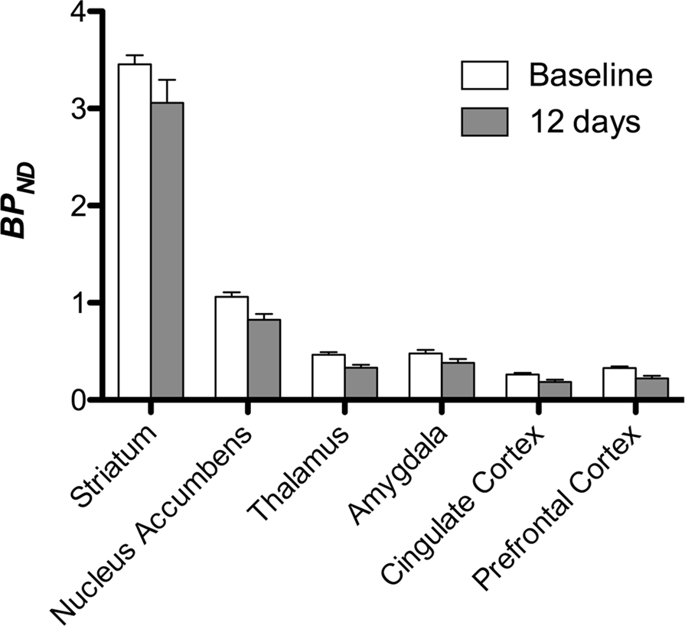
จากนั้นเราทำการวิเคราะห์เจ็ด minipigs ที่ถ่ายด้วย [11C] carfentanil ที่ baseline และหลังจาก 12 วันของการเข้าถึงซูโครสและพบว่ามีผลผูกพันลดลงอย่างมากในสัตว์ที่สัมผัสกับซูโครสเมื่อเปรียบเทียบกับเบส ภูมิภาคที่ได้รับผลกระทบสูงที่สุดจะแสดงเป็นสีแดงในรูปที่ 3 (p <0.01) และรวมถึงบางส่วนของโครงสร้างการรับกลิ่นนิวเคลียส accumbens / ventral striatum และเยื่อหุ้มสมอง / กลีบขมับตามด้วยบริเวณที่แสดงเป็นสีเหลือง (p <0.015) ซึ่งรวมถึงส่วนของเปลือกนอกส่วนหน้า, คอร์เทกซ์ cingulate, อะมิกดาลาและก้านสมอง . เพื่อให้ได้ BPND ค่าและประเมินการเปลี่ยนแปลงร้อยละเราทำการวิเคราะห์ภูมิภาคและได้รับค่าเฉลี่ยในแต่ละภูมิภาคที่พื้นฐานและหลังการบริโภคซูโครส (รูปที่ 4).
การลดลงอย่างมีนัยสำคัญใน [11C] carfentanil ที่มีผลผูกพัน (BPND) ระหว่างเส้นฐานและหลังจากได้รับน้ำซูโครส 12 วัน (n = 7) The voxels ที่มีนัยสำคัญ (p <0.05) การลดลงจะแสดงเป็นพื้นที่สีที่ฉายบนการตัด MRI แบบถ่วงน้ำหนัก T1 จากแผนที่สมองแบบ stereotaxic minipig ข้อมูลจะถูกนำเสนอในส่วนของหลอดเลือดหัวใจในระดับที่ระบุไว้ในภาพทัล (ด้านล่างขวา) โปรดทราบว่าระดับนัยสำคัญสูงสุดที่ทำได้กับสัตว์ 7 ตัวคือ 2-7 ≈ 0.0078 (ดูแถบสี)
เราใช้ [11C] raclopride ในฐานะผู้ตามรอยของตัวรับ DA2 / 3 ในบริเวณสมองส่วนนอกและส่วนล่างของสมองในมินิกส์ที่ฐานและหลังจากการเข้าถึงซูโครส 12 วัน 1). เราพบว่ามีการจับตัวตามรอยในสัตว์ที่สัมผัสซูโครสลดลงเมื่อเทียบกับการตรวจวัดพื้นฐานที่มีผลกระทบมากที่สุด (p <0.01) ในบริเวณของเปลือกนอกส่วนหน้านิวเคลียสแอคคัมเบน / สไตรเทอรัลหน้าท้องซิงซูลคอร์เทกซ์อะมิกดาลาฐานดอกเมเซนซ์ฟาลอนบริเวณม้าน้ำและบริเวณรับกลิ่น (รูปที่. 5) ข้อมูลจากการวิเคราะห์ภูมิภาคแสดงในรูป 6.
การลดลงอย่างมีนัยสำคัญใน [11C] raclopride ที่มีศักยภาพในการผูก (BPND) ระหว่างเส้นฐานและหลังจากได้รับน้ำซูโครส 12 วัน (n = 7) The voxels ที่มีนัยสำคัญ (p <0.05) การลดลงจะแสดงเป็นพื้นที่สีที่ฉายบนการตัด MRI แบบถ่วงน้ำหนัก T1 จากแผนที่สมองแบบ stereotaxic minipig ข้อมูลจะถูกนำเสนอในส่วนของหลอดเลือดหัวใจของสมองหมูในระดับที่ระบุไว้ในภาพทัล (ด้านล่างขวา) โปรดทราบว่าระดับนัยสำคัญสูงสุดที่ทำได้กับสัตว์ 7 ตัวคือ 2-7 ≈ 0.0078 (ดูแถบสี)
ความสัมพันธ์ระหว่าง [11C] raclopride และ [11C] ข้อมูล carfentanil
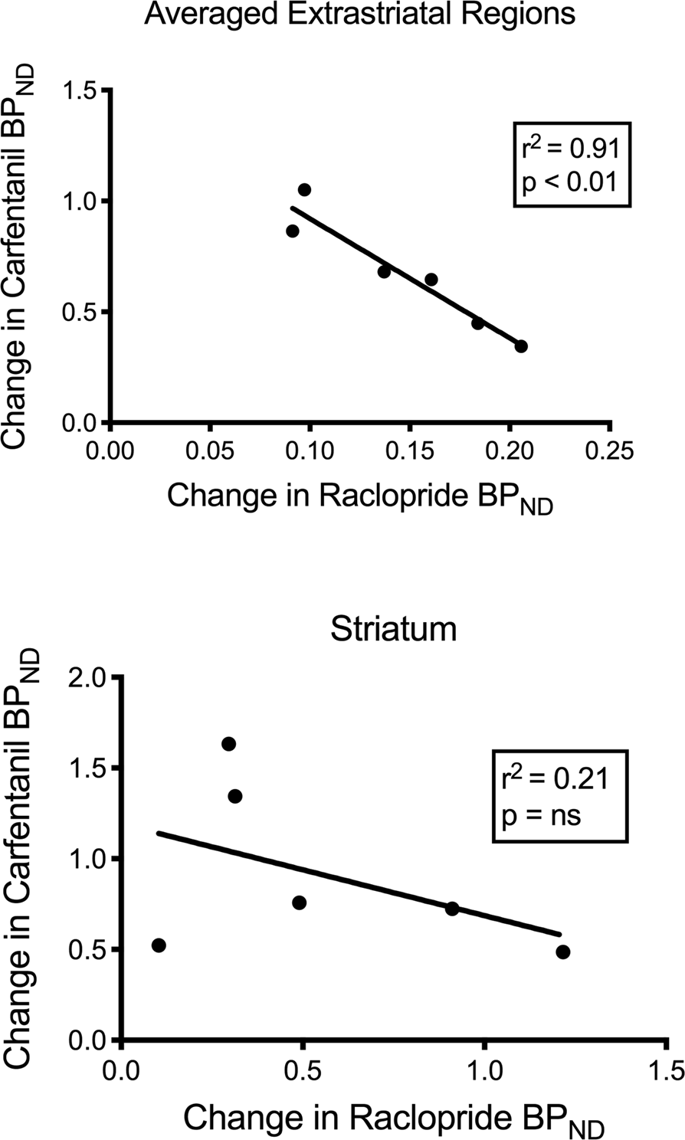
เราทดสอบความสัมพันธ์ที่อาจเกิดขึ้นระหว่าง [11C] raclopride และ [11C] ค่า carfentanil ของ BPND ในภูมิภาค striatal และ non-striatal ใน minipigs ที่ baseline และหลังจากการบริโภคซูโครส 12 วันโดยไม่พบความสัมพันธ์ใด ๆ จากนั้นเราทดสอบว่าการลดลงของการผูกติดตามมีความสัมพันธ์หรือไม่และเราเปรียบเทียบการเปลี่ยนแปลงของ BPND สำหรับ [11C] raclopride พร้อมกับการเปลี่ยนแปลงของ BPND สำหรับ [11C] carfentanil เฉพาะใน minipigs ที่มีความดันโลหิตต่ำND ของ tracers ทั้งสองหลังจากการบริโภคซูโครส (n = 6) เราพบว่ามีความสัมพันธ์เชิงลบอย่างมีนัยสำคัญในค่าเฉลี่ยความเปรียบต่าง (r2 = 0.91, p <0.01) แต่ไม่อยู่ใน striatal ภูมิภาค (รูปที่ 7).
ความสัมพันธ์ระหว่างก่อนลบหลังการลดลงของ [11C] raclopride และ [11C] carfentanil มีผลผูกพัน (BPND) ใน minipigs ที่มีผลผูกพันติดตามลดลงหลังจากปริมาณน้ำตาลซูโครส (n = 6) ข้อมูลจากขอบเขต extrastriatal เฉลี่ย (บนสุด) และ striatum (ล่าง) จะถูกนำเสนอ สัมประสิทธิ์การตัดสินใจ (r2) และค่า p จะแสดงสำหรับกราฟแต่ละกราฟ
การสนทนา
เราพิจารณาถึงผลกระทบของการเข้าถึงน้ำตาลซูโครสซ้ำ ๆ ซ้ำ ๆ ต่อ opioid และ DA neurotransmission ในสมองของสัตว์เลี้ยงลูกด้วยนม ตามยาว ในร่างกาย การถ่ายภาพสัตว์เลี้ยงของตัวรับμORและ DA D2 / 3 เปิดเผยความพร้อมใช้งานของตัวรับที่ลดลงตลอดวงจรรางวัลรวมถึงนิวเคลียส accumbens, เยื่อหุ้มสมองส่วนหน้าก่อนหน้าและเยื่อหุ้มสมองด้านหน้าส่วนหน้า ผลลัพธ์แสดงให้เห็นอย่างชัดเจนว่าซูโครสส่งผลกระทบต่อกลไกการให้รางวัลในลักษณะที่คล้ายคลึงกับยาเสพติด
การบริโภคซูโครสในฐานะที่เป็นสารที่น่ากินนั้นเป็นที่รู้จักกันดีในการปลดปล่อย DA และเหนี่ยวนำให้เกิดการพึ่งพาในหนู15แสดงให้เห็นว่าซูโครสมีความพึงพอใจมากกว่าโคเคนในสัตว์ฟันแทะในบางบริบท ดังนั้นหนูจึงทำงานอย่างหนักเพื่อให้ได้ซูโครสมากกว่าโคเคนแม้ในช่วงที่ไม่มีอาหาร5. อย่างไรก็ตามผลกระทบของซูโครสจะถูกควบคุมทั้งโดยระบบ homeostatic และโดยวงจรรางวัลผลตอบแทน16,17 ที่อาจเป็นสื่อกลางความแตกต่างระหว่างด้านโภชนาการและความชอบของการกระทำของซูโครส18. เราเลือกใช้ตารางเวลาหนึ่งชั่วโมงต่อวันเพื่อส่งเสริม“ การกัด” เนื่องจากการศึกษาก่อนหน้านี้ในหนูได้เปิดเผยปริมาณที่เพิ่มขึ้นในช่วงชั่วโมงแรกของการเข้าถึงประจำวันในตารางต่อเนื่อง15,19. การศึกษาพฤติกรรมของการบริโภคอาหารมักจะเป็นเป้าหมายของสัตว์ที่มีข้อ จำกัด ในอาหาร แต่การออกแบบอาจไม่จำเป็นต้องสะท้อนถึงกลไกประสาทแบบเดียวกับที่ใช้กับโรคอ้วน สุกรในการศึกษาปัจจุบันไม่ได้ถูก จำกัด อาหารและได้รับอาหารตามปกติในปริมาณที่นอกเหนือไปจากการเข้าถึงน้ำตาลซูโครส
ตัวรับ Opioid (OR) มีการแสดงออกอย่างกว้างขวางในสมองโดยเฉพาะในโครงสร้างที่รู้จักกันในการปรับการรับประทานอาหารและกระบวนการให้รางวัล20. ออร์ได้แสดงให้เห็นว่ามีความสำคัญในการให้รางวัลและผลกระทบของโคเคน21,22,23,24. การเปลี่ยนแปลงที่มีผลผูกพันยังเชื่อมโยงกับการตอบสนองแบบ homeostatic ต่อการกินและความสุขที่เกี่ยวข้องกับอาหารที่อร่อย25. โดยเฉพาะอย่างยิ่ง "ความชอบ" ของอาหารเชื่อมโยงกับระบบ opioid ภายนอกโดยเฉพาะอย่างยิ่งμOR9,10 ในเปลือกของนิวเคลียส accumbens และ pallidum หน้าท้อง26. การผสมกันของμOR agonist ในส่วนที่แตกต่างของนิวเคลียส accumbens และ ventral pallidum อย่างยิ่งช่วยเพิ่มพฤติกรรม "ความชอบ" อย่างมากรวมถึงการยื่นออกมาของลิ้นและการเลียเท้าหลังจากการบริโภคอาหารที่เพิ่มขึ้นอย่างน่าพอใจ27,28,29. หลักฐานเพิ่มเติมสำหรับการส่งสัญญาณ opioid ในการประมวลผลของกฎระเบียบด้านความปลอดภัยนั้นมาจากคู่อริμORที่ลดทอนการบริโภค Chow ที่น่าพอใจทั้งคู่ โฆษณาฟรีสัตว์ปีกและอาหารที่ถูก จำกัด อาหาร แต่มีผล จำกัด มากขึ้นในการบริโภคเม็ดมาตรฐานที่ไม่น่ากิน30,31. ในมนุษย์คู่อริμORลดการรับประทานอาหารในระยะสั้นและลดความพึงพอใจของอาหารที่น่ากิน32,33,34. Opioid การส่งสัญญาณใน amygdala basolateral ยังก่อให้เกิดอาหาร“ ต้องการ” ผ่านการปรับของการแสวงหารางวัลและคุณค่าของอาหาร35.
ด้วย [11C] carfentanil เราได้ภาพของตัวจับยึดที่ไวต่อระดับμORและการปล่อย opioids จากภายนอกของสมอง36,37. เราตรวจพบการสูญเสียความพร้อมใช้งานμORทันทีในส่วนของนิวเคลียส accumbens และเยื่อหุ้มสมองด้านหน้า cingulate บริเวณสมองที่เฉพาะเจาะจงของเส้นทางการให้รางวัลหลังจากการบริโภคเริ่มต้นของซูโครสห้า minipigs สอดคล้องกับการปล่อย opioid ภายนอก การศึกษาก่อนหน้าแสดงให้เห็นว่าอาหารที่อร่อยสามารถนำไปสู่38 โดยกระตุ้นการปล่อย opioid หลังจากการเข้าถึงซูโครส 12 วันเราสังเกตเห็นว่าลดลง [11C] carfentanil ปกซึ่งมีหลายคำอธิบายที่เป็นไปได้39 รวมถึงการปล่อย opioid จากภายนอกและการจับกับμOR, μOR internalization ซึ่งเป็นผลมาจากการเพิ่ม opioid ผูกพันและเพิ่มการเปิดใช้งานตัวรับ DA D2 / 3 ที่นำไปสู่การ desensitization ที่ต่างกันของμOR40.
เพื่อสนับสนุนการค้นพบในปัจจุบัน [11C] carfentanil การศึกษาของผู้ป่วยที่มี bulimia41, โรคอ้วน42,43,44และความผิดปกติของการกินการดื่มสุรา45แสดงการมีอยู่ของตัวรับที่ลดลง อย่างไรก็ตามสิ่งเหล่านี้เป็นภาวะเรื้อรังในขณะที่ minipigs ได้รับซูโครสเพียง 12 วัน ในการศึกษาพฤติกรรมการให้อาหารแบบเฉียบพลันในผู้ชายที่มีสุขภาพการให้อาหารนำไปสู่การปล่อยสาร opioid ในสมองทั้งในที่ที่มีและไม่มี hedonia แนะนำว่าการปล่อย opioid นั้นสะท้อนการเผาผลาญและ homeostatic รวมถึง hedonic25. การศึกษาครั้งนี้ร่วมกับผู้ป่วยอื่นที่ถ่ายภาพผู้ป่วยหลังอาหารเหลวรสช็อกโกแลต44มีความเกี่ยวข้องโดยตรงกับการศึกษาแบบเฉียบพลันของ 12 minipigs หลังจากการสัมผัสซูโครสครั้งแรก แต่แตกต่างจากการศึกษา subchronic-exposure suchrose มากกว่า XNUMX วันที่การรับความพร้อมใช้งานที่ลดลงสะท้อนให้เห็นถึงการใช้ซ้ำเกินปกติ
เยื่อหุ้มสมองส่วนหน้ามีความสำคัญในการตัดสินใจและกำหนดคุณค่าของสิ่งของและดังนั้นμORในเยื่อหุ้มสมองด้านหน้า prefrontal อาจต้องรับผิดชอบต่อการประเมินการเปลี่ยนแปลงของความมีชีวิตชีวาของอาหารซึ่งสามารถเพิ่มศักยภาพการเสพติดของอาหาร เราพบว่าการจับตัวลดลงในเยื่อหุ้มสมอง prefrontal สอดคล้องกับการศึกษาก่อนหน้านี้แสดงให้เห็นว่าอาหารที่มีไขมันสูงลดระดับของμOR mRNA ในเยื่อหุ้มสมอง prefrontal46 และการแช่ตัวของμORตัวเอกในเยื่อหุ้มสมอง prefrontal เพิ่มปริมาณของอาหารหวาน47. อย่างไรก็ตามปัญหาที่เกิดขึ้นไม่ว่าจะเป็นอาหารที่มีไขมันสูงเป็นภาวะเรื้อรังมากขึ้นซึ่งมีแนวโน้มว่าไกล่เกลี่ยรับระเบียบ - ระเบียบเมื่อเทียบกับการออกแบบการให้อาหารระยะสั้น - ซูโครสแนะนำการปล่อย opioids ภายนอกที่ยั่งยืน แม้หลังจากซูโครส 12 วัน
DA มีส่วนเกี่ยวข้องในการให้รางวัลทั้งจากยาเสพติดและพฤติกรรม พบการใช้โคเคนเรื้อรังเพื่อยับยั้งการส่งสัญญาณ DA48. ระดับตัวรับ DA D1 และ D2 / 3 จะถูกเปลี่ยนโดยนิโคตินในสมองหมู49และในบิชอพที่ไม่ใช่มนุษย์ที่มีประวัติของการละเมิดโคเคน50สอดคล้องกับการลดลงของตัวรับ D2 / 3 ในสมองของผู้เสพโคเคน51,52. ในส่วนของยาเสพติดมีการใช้ซูโครสเพื่อควบคุมตัวรับ DA D119 และเพิ่มการปล่อย DA53ตอกย้ำบทบาทของ DA ในการ“ ต้องการ” ที่เกี่ยวข้องกับอาหารอร่อย การศึกษา PET ก่อนหน้านี้แสดงให้เห็นว่าการลดลงของความพร้อมใช้งานของตัวรับ striatal DA D2 / 3 ในโรคอ้วนผิดปกติกับน้ำหนักเฉลี่ย54,55ขนาดใกล้เคียงกับการลดลงของผู้ป่วยติดยา56และในสัตว์ที่มีรูปแบบของโรคอ้วน57. ในการศึกษาของสัตว์ฟันแทะ, ตัวรับ D2 / 3 ที่ล้มลงใน striatum ส่งเสริมการพัฒนาของอาหารที่ต้องหาในหนูที่สามารถเข้าถึงอาหารที่อร่อย57.
การสังเกตว่าการมีตัวรับ D2 / 3 ที่ลดลงของหมูอาจบ่งบอกถึงระดับ DA ที่เพิ่มขึ้นในการตอบสนองต่อสิ่งกระตุ้นที่เกี่ยวข้องกับการบริโภคน้ำตาลซูโครสเนื่องจาก DA ถูกปล่อยออกมาซึ่งเป็นส่วนหนึ่งของความต้องการยาเสพติดและกิจกรรมอื่น ๆ52,58,59,60. เนื่องจากสุกรได้รับการดมยาสลบระหว่างการถ่ายภาพและไม่ได้รับซูโครสใน 24 ชั่วโมงการลดลงของ D2 / 3 BPND มีแนวโน้มมากขึ้นสะท้อนให้เห็นถึงการลดลงของจำนวนผู้รับในการตอบสนองต่อการเพิ่มขึ้นของการเปิดตัว DA ในแต่ละ 12 วันของการเข้าถึงซูโครส การลดลงนี้สามารถเพิ่มเกณฑ์การให้รางวัลแก่สมองซึ่งสัมพันธ์กับการควบคุมดาวน์ของผู้รับ DA2 แบบ striatal สิ่งนี้อาจอธิบายถึงความไวต่อยาเสพติดที่เพิ่มขึ้นในการศึกษาก่อนหน้านี้ของหนูที่กินน้ำตาลซูโครสมากเกินไปซึ่งนำไปสู่การไวต่อยาเสพติดโคเคน, สมาธิสั้นหลังจากแอมเฟตามีนขนาดต่ำ, การดื่มแอลกอฮอล์เพิ่มขึ้นเมื่องดน้ำตาลซูโครส6.
การศึกษาก่อนหน้าของโรคอ้วนในGöttingen minipig ระบุการไหลเวียนของเลือดในสมองลดลงในนิวเคลียส accumbens, พื้นที่หน้าท้อง tegmental (VTA) และเยื่อหุ้มสมอง prefrontal กับการฉายรังสีโฟตอนเดียว (SPECT) ของสมอง61. สอดคล้องกับการค้นพบนี้เราสังเกตว่าการลดปริมาณของ DA D2 / 3 ในพื้นที่ ventroforebrain ที่ประกอบด้วยนิวเคลียส accumbens และใน prefrontal cortex ระดับ extracellular ของ DA จะเพิ่มขึ้น 3 เท่าในนิวเคลียส accumbens หลังจากการบริโภคซูโครสในหนูที่เคลื่อนไหวอย่างอิสระภายใต้ microdialysis62. ในสัตว์ที่ต้องพึ่งพาน้ำตาลซูโครสการบริโภคน้ำตาลซูโครสซ้ำ ๆ อาจนำไปสู่การปลดปล่อย DA จากเปลือกของนิวเคลียส accumbens63. สัตว์ที่ได้รับอาหารที่ถูก จำกัด โดยมีการ จำกัด การเข้าถึงน้ำตาลซูโครสมีตัวรับ DA D2 ที่ต่ำกว่าในเปลือกนิวเคลียส accumbens และด้านหลัง striatum64. อาหารที่มีไขมันและซูโครสที่มีข้อ จำกัด สูงสามารถนำไปสู่การลดระดับการรับอย่างต่อเนื่องของตัวรับ m1 r2 ตัวรับ DXNUMX และ DXNUMX ในนิวเคลียส accumbens65. การศึกษา microdialysis ผลของอาหารอร่อยเปิดเผยเพิ่มการปล่อย DA ในนิวเคลียส accumbens และเยื่อหุ้มสมอง prefrontal เมื่ออาหารยังถือว่าเป็นนวนิยาย; เมื่อหนูคุ้นเคยกับอาหารใหม่การปล่อยที่เพิ่มขึ้นถูกทื่อในนิวเคลียส accumbens แต่ไม่ได้อยู่ในเยื่อหุ้มสมอง prefrontal66. ความแตกต่างของความไวต่อการทำให้เกิดความเคยชินและการปรับสภาพของกิจกรรมในสองภูมิภาคอาจอธิบายการเพิ่มขึ้นที่สังเกตได้ในเยื่อหุ้มสมองส่วนหน้ามากกว่าในนิวเคลียส accumbens ของ minipigs ที่สัมผัสกับสารที่น่าพึงพอใจแบบเดียวกัน อย่างไรก็ตามเนื่องจากเราไม่ได้คิดภาพ minipigs ด้วย [11C] raclopride หลังจากการบริหารซูโครสครั้งแรกคำอธิบายนี้เป็นการเก็งกำไร
เยื่อหุ้มสมองส่วนหน้าปรับเปลี่ยนหน้าที่ผู้บริหารการตัดสินใจและการควบคุมตนเอง67. สารสื่อประสาทผิดปกติ DA ผิดปกติในเยื่อหุ้มสมอง prefrontal บั่นทอนการปรับกระบวนการให้รางวัลชี้ให้เห็นถึงการทำงานของผู้บริหารที่บกพร่องและทักษะการตัดสินใจในคนอ้วน68,69. นอกจากนี้การศึกษา PET ของมนุษย์มีความสัมพันธ์ลดลงการเผาผลาญเยื่อหุ้มสมองด้านหน้าด้วยการลดลง D2 striatal ผูกพันในโรคอ้วน70. ที่นี่เราพบความพร้อมของตัวรับ D2 / 3 ที่ลดลงในเยื่อหุ้มสมอง prefrontal รวมถึงเยื่อหุ้มสมอง orbitofrontal ของหมูที่สัมผัสกับระบบการย่อยซูโครส
Dopaminergic neurons ของ VTA ส่งการคาดการณ์ไปยังฮิบโปและ amygdala ซึ่งพวกมันสนับสนุนพฤติกรรมที่คล้ายกับนิสัย71 และไกล่เกลี่ยการเข้ารหัสและการดึงการปรับสภาพยา72,73 และตัวชี้นำอาหาร74,75. การถ่ายภาพสมองของมนุษย์แสดงให้เห็นว่ามีการกระตุ้นด้วยฮิปโปแคมปัสเพื่อตอบสนองต่อความอยากอาหารและการชิม76. สอดคล้องกับการค้นพบของเราในการลดความพร้อมรับ hippocampal และ amygdalar D2 / 3 ในการตอบสนองต่อซูโครสการทำแผนที่สมองของมนุษย์ด้วย [18F] fallypride แสดงการปลดปล่อยโคเคนที่เกิดจากคิวใน amygdala และ hippocampus77. ในสมองของสัตว์ฟันแทะการสัมผัสด้วยโคเคนทำให้เกิดการปลดปล่อย DA ใน amygdala78และการปรับเปลี่ยนระดับ amygdala DA มีอิทธิพลต่อพฤติกรรมการแสวงหาโคเคนเนื่องจากคิว79.
ในการศึกษาบุคคลที่เป็นโรคอ้วนความสัมพันธ์ระหว่าง D2 / 3 และμORความพร้อมใช้งานซึ่งรู้กันว่ามีอยู่ในภูมิภาค striatal ของบุคคลที่มีสภาพลีนถูกรบกวนใน ventral striatum80. เราเปรียบเทียบค่าของ BPND ของผู้ติดตามสองคนเพื่อทดสอบว่าข้อมูลมีการทำซ้ำเอฟเฟกต์นี้หรือไม่ สมองหมูในปัจจุบันไม่มีความสัมพันธ์กันระหว่างค่าของ BPND ของสอง tracers ที่พื้นฐานหรือหลังจากการสัมผัสกับซูโครส จากนั้นเราทดสอบว่าสัตว์ที่มีการหดตัวของ tracer raclopride ที่ใหญ่ที่สุดนั้นจะมีการลดลงของ tracer carfentanil ที่ใหญ่ที่สุดหรือไม่ แต่เรากลับพบความสัมพันธ์เชิงลบในภูมิภาคที่มีการเปลี่ยนแปลงโดยเฉลี่ยแสดงให้เห็นว่าสัตว์ที่มีการเปลี่ยนแปลง Tracer raclopride มีการเปลี่ยนแปลงที่ต่ำที่สุดของศักยภาพในการจับของ trafic carfentanil ความสัมพันธ์แบบผกผันระหว่างการเปลี่ยนแปลงแสดงให้เห็นว่าผลกระทบของการบริโภคน้ำตาลซูโครสในความเป็นประโยชน์ของผู้รับที่เกี่ยวข้องจะถูกควบคุมในทิศทางตรงกันข้าม เป็นที่ทราบกันดีว่าการบริโภคอาหารหรือยาเสพติดที่น่ากินมากเกินไปอาจเกิดจากความต้องการหรือความชอบหรือทั้งสองอย่าง60,81. เป็นไปได้ว่าขนาดของความต้องการที่ถูกขับเคลื่อนโดยโดปามีนนั้นทำให้ขนาดของความชอบลดลงโดย opioids หรือในทางกลับกัน หลักฐานล่าสุดชี้ไปที่บทบาทของ GABAA ตัวรับในขั้ว VTA และขั้ว cholinergic ใน striatum และ cortex ที่อาจทำหน้าที่เป็นตัวสลับระหว่างกลไกการพึ่งพาโดพามีนและโดปามีนอิสระจากการกระทำ opioid82,83 ที่อาจอธิบายถึงการแลกเปลี่ยนกลับกันของโดปามีนและโอปิอิดเอฟเฟ็กต์ในบริเวณที่มีการแสดงออกของเมือก
สัตว์เลี้ยงที่มีข้อบกพร่องคือสัตว์ที่มีขนาดค่อนข้างใหญ่เมื่อเปรียบเทียบกับการถ่ายภาพเอกซเรย์ที่ จำกัด ซึ่งส่งผลต่อผลลัพธ์จากบริเวณสมองเล็ก ๆ ที่เกี่ยวข้องกับพฤติกรรมที่เกี่ยวข้องกับอาหาร อย่างไรก็ตามแม้จะมีข้อกังวลเหล่านี้11C] การรวมตัวของ raclopride ก่อนหน้านี้ถูกบันทึกทั้งในส่วนของ striatal และ extrastriatal84,85,86,87. การใช้ [11C] raclopride เพื่อติดฉลากตัวรับชนิดเดียวกันทำให้ไม่ต้องกังวลเกี่ยวกับความแตกต่างของความสัมพันธ์ที่อาจเกิดขึ้นซึ่งอาจส่งผลต่อการใช้ตัวติดตามแยกสำหรับตัวรับเดียวกันในภูมิภาคต่างๆ การศึกษาล่าสุดรวมถึงบันทึกของการมีผลผูกพันกับ extrastriatal [11C] raclopride Alakurtti อัล et. พบว่าการทำซ้ำที่ดีของมาตรการของ striatal raclopride ผูกพันใน striatum มีเพียงการทำซ้ำที่ดีถึงปานกลางในเยื่อหุ้มสมอง85. ในการศึกษาต่อมา Svensson อัล et. กล่าวถึงปัญหาต่าง ๆ ที่มีผลต่อการใช้11C] raclopride เป็นเครื่องหมายของผู้รับ extrastriatal D2 / 3 ในการศึกษาของมนุษย์ที่มีสุขภาพดีรวมถึงการทำซ้ำที่น่าสงสารในเยื่อหุ้มสมองและการลดลงของการ จำกัด extrastriatal ผูกพันในเยื่อหุ้มสมองด้านหน้าในการตอบสนองต่อตัวแทนบล็อก D2 / 388. การเปรียบเทียบการทดสอบการทดสอบพบความแปรปรวนของ 4-7% ใน striatum และ 13–59% ในภูมิภาคเยื่อหุ้มสมอง แต่เวลาระหว่างการสอบเฉลี่ย 20 วันซึ่งแตกต่างจากการศึกษามากที่สุด 1-2 วัน ปัจจัยจำนวนหนึ่งในชีวิตของอาสาสมัครเหล่านั้นอาจมีเวลาที่จะมีอิทธิพลต่อการค้นพบ อันที่จริงเราแสดงให้เห็นว่าเพียงเพิ่มการบริโภคซูโครสในกิจวัตรตอนเช้าเป็นเวลา 12 วันอาจมีผลต่อมาตรการผูกพันที่ได้รับในอีกสองสัปดาห์ต่อมา ปัจจัยอื่น ๆ เช่นการเล่นวิดีโอเกมการช็อปปิ้งการเข้าสู่ความสัมพันธ์โรแมนติกและกิจกรรมทางเพศการใช้ยาหรือการเปลี่ยนอาหารและการออกกำลังกายอาจส่งผลต่อระดับโดพามีนนอกร่างกายที่มีศักยภาพในการเปลี่ยนแปลงของชุดข้อมูล การศึกษาล่าสุดใน minipigs แนะนำการตั้งค่าที่ควบคุมอย่างดีโดยตัวแปรเพียงอย่างเดียวคือการขาดหรือการมีน้ำตาลซูโครสในอาหาร ในบริบทนี้ข้อมูลจากสัตว์เจ็ดตัวมีความแปรปรวนต่ำพอสมควรในส่วนที่เกี่ยวกับอวัยวะภายในที่เกี่ยวข้อง
ข้อ จำกัด ของการศึกษาในปัจจุบันคือการใช้ยาชาที่จำเป็นเพื่อให้แน่ใจว่าไม่สามารถเคลื่อนไหวได้ในระหว่าง ในร่างกาย ภาพสัตว์ ผลกระทบของยาชาเฉพาะและการมีปฏิสัมพันธ์กับยาหรือการแทรกแซงอื่น ๆ สามารถทำให้เกิดความสับสนของการแผ่รังสี89,90. Ketamine เป็นยาต่อต้านกลูตามาเทอจิคที่มีฤทธิ์ต้านซึมเศร้าอย่างรวดเร็วในขนาดยาชาย่อย91,92,93ที่ไม่ลด striatal [11C] raclopride มีผลผูกพันกับมนุษย์94. อย่างไรก็ตามพบว่า S-ketamine ลดความพร้อมใช้งานของตัวรับ dopamine D2 / 3 ใน striatum ของไพรเมตที่ไม่ใช่มนุษย์95. Isoflurane เป็นยาชาทั่วไปในสัตว์เลี้ยง PET จากการศึกษาก่อนหน้านี้เราพบว่า11C] SCH23390, radioligand ของตัวรับ Dopamine D1 จะสูงขึ้นอย่างมีนัยสำคัญใน minipigs anesthetized กับ isoflurane มากกว่า propofol, แนะนำความไวของโดปามีนส่งผลต่อการระงับความรู้สึก96. ในการศึกษาปัจจุบัน minipigs ทั้งหมดถูกถ่ายที่ timepoints ทั้งสองภายใต้ยาคีตามีนและยาระงับความรู้สึก isoflurane ทำให้การเปรียบเทียบในปัจจุบันใช้ได้
สรุป
การบริโภคอาหารที่มีประโยชน์มากเกินไปอาจทำให้ทั้งสองอย่างและกลายเป็นผลของการติดกับผลกระทบโดยตรงต่อสุขภาพจากโรคอ้วน เราทดสอบการอ้างสิทธิ์ว่า opioids และโดปามีนเป็นสื่อกลางให้รางวัลสำคัญต่อการอยู่รอดรวมถึงการใช้ยาในทางที่ผิด มินิกส์ที่มีการเข้าถึงสารละลายซูโครสเป็นระยะเวลา 12 วันติดต่อกันแสดงให้เห็นว่าโดปามีน D2 / 3 และตัวรับ opiid ลดลงในพื้นที่ที่มีการเต้นของสมองในขณะที่อยู่ในระดับสูงและใกล้เคียงกับที่สังเกตได้เมื่อยาเสพติด มีการบริโภค การได้รับซูโครสครั้งแรกนั้นสอดคล้องกับการปล่อย opioid ในบริเวณสมองที่ทำงานอยู่เพื่อรับรางวัล การเปลี่ยนแปลงของความพร้อมใช้ opioid และโดปามีนอธิบายถึงศักยภาพในการเสพติดของซูโครสที่บริโภคเกิน
วัสดุและวิธีการ
จริยธรรมของสัตว์
การศึกษาครั้งนี้ได้รับการอนุมัติและควบคุมโดยผู้ตรวจการทดลองสัตว์ในประเทศเดนมาร์กและการทดลองทั้งหมดได้ดำเนินการตามคำสั่ง 2010/63 / EU ของรัฐสภายุโรปและสภาว่าด้วยการคุ้มครองสัตว์ที่ใช้เพื่อวัตถุประสงค์ทางวิทยาศาสตร์และแนวทาง ARRIVE เราใช้ minipigs Göttingenหญิงอายุสิบสี่เดือน (Ellegaard, Dalmose, Denmark) Minipigs ได้รับอาหารเม็ด (6 dL, 2 ครั้งต่อวัน, บริการอาหารพิเศษ, Aarhus, เดนมาร์ก) พร้อมน้ำประปา โฆษณาฟรี. อุณหภูมิสิ่งแวดล้อมอยู่ที่ 20-22 ° C ความชื้นสัมพัทธ์ 50–55% และอากาศเปลี่ยนแปดครั้งทุกชั่วโมง
การบริโภคซูโครสไม่สม่ำเสมอ
เราถ่ายเจ็ด minipigs ด้วย [11C] raclopride และ [11C] carfentanil ที่ baseline และอีกหนึ่งวันหลังจาก 12 วันติดต่อกันของการสัมผัสน้ำซูโครส การสัมผัสซูโครสประกอบด้วยหนึ่งชั่วโมงของซูโครส (ซูโครส, Dansukker, โคเปนเฮเกน, เดนมาร์ก) การเข้าถึงน้ำ (500 กรัมซูโครสในน้ำ 2 ลิตร) ทุกวันในช่วงระยะเวลา 12 วัน ปริมาณซูโครสที่บันทึกไว้และมินิพีกทั้งหมดบริโภค 2 ลิตรต่อวัน เรายังถ่ายภาพ minipigs เดียวกันห้ารายการด้วย [11C] carfentanil 30 นาทีหลังจากการเข้าถึงน้ำตาลซูโครสครั้งแรกเพื่อศึกษาการปลดปล่อย opioid แบบเฉียบพลัน
minipigs มีน้ำหนักตัวเฉลี่ย 13.6% จาก 25.4 กก. (± 0.73 SEM) ที่ค่าพื้นฐานเป็น 28.9 กก. (± 0.69 SEM) หลังจากได้รับซูโครส 12 วันซึ่งสูงขึ้นอย่างมีนัยสำคัญ 0.001) มากกว่าการเพิ่มขึ้นที่สังเกตได้ในตัวอย่างของ minipigs ควบคุมที่ได้รับในการศึกษาก่อนหน้านี้โดยที่น้ำหนักเพิ่มขึ้นโดยเฉลี่ยเพียง 4.9% ในช่วงพัฒนาการเดียวกัน
ภาพสัตว์เลี้ยงสมอง
เราอดอาหารหมูค้างคืนด้วยการเข้าถึงน้ำฟรีก่อนที่จะถ่ายภาพ เรา minipigs ยาและวิสัญญีตามที่อธิบายไว้ก่อนหน้านี้97 และวางมันไว้ในอุปกรณ์ PET / CT (Siemens Biograph 64 Truepoint PET) เราทำการสแกน CT ขนาดต่ำก่อนการซื้อ PET แต่ละครั้งสำหรับคำจำกัดความทางกายวิภาคและการแก้ไขการลดทอนข้อมูลการปล่อย PET เราบริหารทางหลอดเลือดดำ [11C] raclopride ที่พื้นฐาน (360 ± 18 MBq กิจกรรมเฉพาะ 77 ± 76 GBq / μmolมวลที่ฉีด 0.12 ± 0.08 μg / kg) และหลังจากซูโครส 12 วัน (374 ± 54 MBq, กิจกรรมเฉพาะ 127 ± 85 GBq / μmol, มวลที่ฉีด 0.06 ± 0.05 μg / kg) และ [11C] carfentanil ที่ baseline (377 ± 43 MBq, กิจกรรมเฉพาะ 311 ± 195 GBq / μmol, มวลที่ฉีด 0.03 ± 0.02 μg / kg) และหลังจากซูโครส 12 วัน (337 ± 71 MBq, กิจกรรมเฉพาะ 177 ± 157 GBq / μmol, มวลฉีด 0.06 ± 0.08 μg / kg) ผ่านทางหลอดเลือดดำหูในน้ำเกลือ 10 มล. ในช่วงนาทีแรกของการสแกน 90 นาที เราสร้างข้อมูล PET ใหม่โดยใช้ TrueX 3D OSEM (3 ซ้ำ, 21 ชุดย่อย), 256 × 256 × 109 เมทริกซ์และตัวกรองเกาส์ 2 มม. โดยใช้โครงสร้างกรอบเวลา 5 × 60, 3 × 300, 4 × 600 , 2 × 900 วินาที (รวม 14 เฟรม, 90 นาที) ที่เบสพื้นฐานและหลังจากซูโครส 12 วัน, minipigs จะถูกถ่ายภาพด้วย tracers ทั้งสองฉีดกันอย่างน้อย 100 นาทีเนื่องจากครึ่งชีวิตของ [11C] ตัวติดตามสัตว์เลี้ยง เมื่อสิ้นสุดขั้นตอนการผลิต PET ครั้งสุดท้ายเราทำการขุด minipigs ภายใต้การดมยาสลบโดยการให้ยา pentobarbital เกินขนาดทางหลอดเลือดดำ (100 mg / kg)
การวิเคราะห์เชิงปริมาณและสถิติ
เราดำเนินการขั้นตอนก่อนการประมวลผลโดยใช้ PMOD 3.7 (PMOD Technologies Ltd, ซูริก, สวิตเซอร์แลนด์) ในการกำหนดพารามิเตอร์การแปลงสเตริโอจากแล็คเกอร์จากอิมเมจ PET โดยเฉลี่ยเราใช้เทมเพลตเฉพาะแกนด์ เราใช้เมทริกซ์การแปลงและการแปรปรวนที่สร้างขึ้นบนอนุกรมเวลา PET ที่สอดคล้องกัน เราสร้างภาพพารามิเตอร์ของ [11C] raclopride ที่มีศักยภาพในการผูก (BPND) โดยใช้วิธีการอ้างอิงเนื้อเยื่อหลายชั้นของ Ichise และเพื่อนร่วมงาน98. เราสร้างหน้ากากที่ทำขึ้นเองของซีรีเบลลัมซึ่งไม่รวม vermis เพื่อให้ได้กัมมันตภาพรังสีของเนื้อเยื่อสมองน้อยในช่วงเวลาหนึ่งในภูมิภาคที่มีความหนาแน่นของตัวรับ DA2 / 3 เล็กน้อย เราสร้างภาพพารามิเตอร์ของ [11C] carfentanil โดยใช้โมเดลเนื้อเยื่ออ้างอิงของ Logan99,100 ด้วย t * = 30 นาที การศึกษาของ [11C] carfentanil ผูกพันในสมองของมนุษย์ได้ใช้เยื่อหุ้มสมองท้ายทอยเป็นภูมิภาคอ้างอิง36; อย่างไรก็ตามในหมูตามเส้นโค้งของกิจกรรมเวลาความผูกพันที่ไม่สามารถแทนที่ได้ในสมองน้อยกว่าในเยื่อหุ้มสมองท้ายทอยซึ่งสอดคล้องกับผลการวิจัยจากการศึกษาอัตชีวประวัติของหนู101. ดังนั้นเราจึงเลือก cerebellum เป็นพื้นที่อ้างอิงในการศึกษาปัจจุบัน
การวิเคราะห์ทางสถิติ
เราได้แผนที่เพื่อการวิเคราะห์ด้วย voxel-wise ด้วยการทำแผนที่สถิติที่ไม่ใช่พารามิเตอร์ (SnPM v13.01, http://warwick.ac.uk/snpm) กล่องเครื่องมือ SPM ที่ใช้ทฤษฎีการเปลี่ยนแปลงแบบไม่อิงพารามิเตอร์เพื่อเป็นกรอบในการอนุมานเชิงสถิติวิธีที่แสดงให้เห็นว่าทำงานได้ดีสำหรับตัวอย่างขนาดเล็กเนื่องจากการควบคุมอย่างเข้มงวดของผลบวกเท็จ14 และนำไปใช้ตามที่อธิบายไว้ก่อนหน้า102. ผู้เชี่ยวชาญในหมู neuroanatomy (DO) เปรียบเทียบภาพที่ได้รับมีระดับนัยสำคัญถึง 5% กับแผนที่ความละเอียดสูงGöttingen minipig103,104 เพื่อกำหนดและทำเครื่องหมายภูมิภาคของ DA D2 / 3 และμOR BP ที่ลดลงND จากพื้นฐานถึงสภาพหลังน้ำตาลซูโครส จากนั้นเราทำการวิเคราะห์ภูมิภาคที่น่าสนใจ (ROI) เพื่อดึง BPND ค่าของภูมิภาคเฉพาะที่พบว่าเป็นที่น่าสนใจตามการวิเคราะห์ SnPM รวมถึง striatum นิวเคลียส accumbens, ฐานดอก, amygdala, เยื่อหุ้มสมอง cingulate และเยื่อหุ้มสมอง prefrontal ไม่มีสถิติเพิ่มเติมเกี่ยวกับการวิเคราะห์ ROI เนื่องจากภูมิภาคเหล่านี้พบว่ามีความสำคัญในการใช้ SnPM
อ้างอิง
- 1.
Smyth, S. & Heron, A. โรคเบาหวานและโรคอ้วน: โรคระบาดแฝด ชัยนาทเมธา 12, 75 – 80, https://doi.org/10.1038/nm0106-75 (2006)
- 2.
Flegal, KM, Carroll, MD, Ogden, CL & Curtin, LR ความชุกและแนวโน้มของโรคอ้วนในผู้ใหญ่ในสหรัฐอเมริกา พ.ศ. 1999–2008 JAMA 303, 235 – 241, https://doi.org/10.1001/jama.2009.2014 (2010)
- 3.
เดวิส, แคลิฟอร์เนีย อัล et. โดปามีนสำหรับ "ความต้องการ" และ opioids สำหรับ "ความชอบ": การเปรียบเทียบของผู้ใหญ่ที่เป็นโรคอ้วนที่มีและไม่มีการดื่มสุรา โรคอ้วน (ซิลเวอร์สปริง) 17, 1220 – 1225, https://doi.org/10.1038/oby.2009.52 (2009)
- 4.
Drewnowski, A. ความอ้วนและสิ่งแวดล้อมทางอาหาร: ความหนาแน่นของพลังงานในอาหารและต้นทุนอาหาร วารสารการแพทย์ป้องกันแบบอเมริกัน 27, 154 – 162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004)
- 5.
Lenoir, M. , Serre, F. , Cantin, L. & Ahmed, SH ความหวานเข้มข้นเหนือรางวัลโคเคน PloS หนึ่ง 2,e698, https://doi.org/10.1371/journal.pone.0000698 (2007)
- 6.
Ahmed, S. , Avena, NM, Berridge, KC, Gearhardt, A. & Guillem, K. In ประสาทวิทยาศาสตร์ในศตวรรษที่ 21 (ed. Phaff, DW) (Springer, 2012)
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS พัฒนาการเพิ่มเติมในระบบประสาทของอาหารและการเสพติด: อัปเดตเกี่ยวกับสถานะของวิทยาศาสตร์ โภชนาการ 28, 341 – 343, https://doi.org/10.1016/j.nut.2011.11.002 (2012)
- 8.
Leyton, M. ใน ความสุขของสมอง (eds Kringelbach, ML & Berridge, KC) (Oxford University Press, 2010)
- 9.
Nathan, PJ & Bullmore, ET จากการลิ้มรส hedonics ไปจนถึงแรงผลักดันที่สร้างแรงบันดาลใจ: ตัวรับ mu-opioid ส่วนกลางและพฤติกรรมการกินเหล้า Int J Neuropsychopharmacol 12, 995 – 1008, https://doi.org/10.1017/S146114570900039X (2009)
- 10.
Berridge, รางวัลอาหาร KC: สารตั้งต้นในสมองที่ต้องการและชื่นชอบ ประสาทวิทยาศาสตร์และชีวจิตรีวิว 20, 1 – 25 (1996)
- 11.
Gjedde, A. , Wong, DF, Rosa-Neto, P. & Cumming, P. Mapping neuroreceptors ในที่ทำงาน: เกี่ยวกับคำจำกัดความและการตีความศักยภาพในการผูกพันหลังจาก 20 ปีของความก้าวหน้า Int Rev Neurobiol 63, 1 – 20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005)
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG รูปแบบของน้ำตาลและไขมันจากสัตว์: ความสัมพันธ์กับการติดอาหารและน้ำหนักตัวที่เพิ่มขึ้น วิธีการ Mol Biol 829, 351 – 365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012)
- 13.
เจลซิง, เจ อัล et. เยื่อหุ้มสมองส่วนหน้าในสมอง Minipig ของ Gottingen ที่ถูกกำหนดโดยเกณฑ์การฉายประสาทและ cytoar Architecture Brain Res Bull 70, 322 – 336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006)
- 14.
Nichols, TE & Holmes, AP การทดสอบการเปลี่ยนแปลงแบบไม่ใช้พารามิเตอร์สำหรับ neuroimaging ที่ใช้งานได้: ไพรเมอร์พร้อมตัวอย่าง Hum Brain Mapp 15, 1 – 25 (2002)
- 15.
Avena, NM, Rada, P. & Hoebel, BG หลักฐานการติดน้ำตาล: ผลกระทบทางพฤติกรรมและทางประสาทเคมีของการบริโภคน้ำตาลที่ไม่ต่อเนื่องและมากเกินไป ประสาทวิทยาศาสตร์และชีวจิตรีวิว 32, 20 – 39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008)
- 16.
อลอนโซ่ - อลอนโซ่ม. อัล et. ระบบการให้รางวัลอาหาร: มุมมองปัจจุบันและความต้องการการวิจัยในอนาคต Nutr Rev 73, 296 – 307, https://doi.org/10.1093/nutrit/nuv002 (2015)
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S. , Sipols, AJ & Zavosh, A. การบริหารตนเองของซูโครสและการกระตุ้นระบบประสาทส่วนกลางในหนู Am J Physiol Regul Integr Comp Physiol 300, R876–884, https://doi.org/10.1152/ajpregu.00655.2010 (2011)
- 18.
Tellez, LA อัล et. วงจรแยกจะเข้ารหัสค่าความชอบและคุณค่าทางโภชนาการของน้ำตาล ประสาทวิทยาศาสตร์ธรรมชาติ 19, 465 – 470, https://doi.org/10.1038/nn.4224 (2016)
- 19.
โคลันทูโอนี, ซี. อัล et. การบริโภคน้ำตาลมากเกินไปจะเปลี่ยนไปผูกกับตัวรับ dopamine และ mu-opioid ในสมอง Neuroreport 12, 3549 – 3552 (2001)
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Opiate receptor: autoradiographic localization ในสมองหนู Proc Natl Acad Sci สหรัฐอเมริกา 73, 3729 – 3733 (1976)
- 21.
Soderman, AR & Unterwald, รางวัล EM โคเคนและสมาธิสั้นในหนู: ไซต์ของการมอดูเลตตัวรับ mu opioid Neuroscience 154, 1506 – 1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008)
- 22.
Ward, SJ, Martin, TJ & Roberts, DC Beta-funaltrexamine มีผลต่อการบริหารโคเคนด้วยตนเองในหนูที่ตอบสนองต่อตารางการเสริมแรงในอัตราส่วนก้าวหน้า เภสัชวิทยาชีวเคมีและพฤติกรรม 75, 301 – 307 (2003)
- 23.
ชโรเดอร์ JA อัล et. บทบาทของตัวรับ mu opioid ในกิจกรรมที่กระตุ้นให้เกิดโคเคนความไวต่อความรู้สึกและการให้รางวัลในหนู Psychopharmacology 195, 265 – 272, https://doi.org/10.1007/s00213-007-0883-z (2007)
- 24.
Tang, XC, McFarland, K. , Cagle, S. & Kalivas, การคืนสถานะที่เกิดจากโคเคนของ PW ต้องการการกระตุ้นจากภายนอกของตัวรับ mu-opioid ในช่องท้อง pallidum วารสารประสาทวิทยาศาสตร์: วารสารทางการของสมาคมประสาทวิทยาศาสตร์ 25, 4512 – 4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005)
- 25.
Tuulari, JJ อัล et. การให้อาหารเผยแพร่ Opioids จากภายนอกในมนุษย์ Neurosci J 37, 8284 – 8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017)
- 26.
Smith, KS & Berridge, KC Opioid limbic circuit เพื่อเป็นรางวัล: ปฏิสัมพันธ์ระหว่างจุดสำคัญทางพันธุกรรมของนิวเคลียส accumbens และ ventral pallidum Neurosci J 27, 1594 – 1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007)
- 27.
Pecina, S. & Berridge, KC Opioid site ในนิวเคลียส accumbens เชลล์เป็นสื่อกลางในการกินและ 'ความชอบ' ในอาหาร: แผนที่ขึ้นอยู่กับ microinjection Fos plumes สมอง Res 863, 71 – 86 (2000)
- 28.
Zhang, M. & Kelley, AE การบริโภคขัณฑสกร, เกลือและสารละลายเอทานอลจะเพิ่มขึ้นโดยการใส่ตัวเร่งปฏิกิริยา mu opioid เข้าไปในนิวเคลียส accumbens Psychopharmacology 159, 415 – 423, https://doi.org/10.1007/s00213-001-0932-y (2002)
- 29.
Zhang, M. , Gosnell, BA & Kelley, AE การบริโภคอาหารที่มีไขมันสูงได้รับการปรับปรุงโดยการกระตุ้นตัวรับ mu opioid ภายในนิวเคลียส accumbens วารสารเภสัชวิทยาและการบำบัดเชิงทดลอง 285, 908 – 914 (1998)
- 30.
Levine, AS, Weldon, DT, Grace, M. , Cleary, JP & Billington, CJ Naloxone บล็อกส่วนของการให้อาหารที่ขับเคลื่อนด้วยรสหวานในหนูที่ถูก จำกัด อาหาร Am J Physiol 268, R248–252 (1995)
- 31.
Glass, MJ, Billington, CJ & Levine, AS Opioids และการบริโภคอาหาร: ระบบประสาททำงานแบบกระจาย? neuropeptides 33, 360 – 368, https://doi.org/10.1054/npep.1999.0050 (1999)
- 32.
Fantino, M. , Hosotte, J. & Apfelbaum, M. สารต่อต้าน opioid ชื่อ naltrexone ช่วยลดความชื่นชอบซูโครสในมนุษย์ Am J Physiol 251, R91–96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986)
- 33.
Arbisi, PA, Billington, CJ & Levine, AS ผลของ naltrexone ต่อเกณฑ์การตรวจจับและการรับรู้รสชาติ ความอยากอาหาร 32, 241 – 249, https://doi.org/10.1006/appe.1998.0217 (1999)
- 34.
Drewnowski, A. , Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, BA Naloxone ซึ่งเป็นตัวป้องกันยาเสพติดช่วยลดการบริโภคอาหารที่มีไขมันสูงหวานในผู้ที่รับประทานอาหารที่เป็นผู้หญิงที่เป็นโรคอ้วนและไม่ติดมัน Am J Clin Nutr 61, 1206 – 1212 (1995)
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW วงจร opioid ที่แตกต่างกันเป็นตัวกำหนดความน่ารับประทานและความปรารถนาของกิจกรรมที่ให้รางวัล Proc Natl Acad Sci สหรัฐอเมริกา 106, 12512 – 12517, https://doi.org/10.1073/pnas.0905874106 (2009)
- 36.
Colasanti, อ. อัล et. การปล่อย opioid จากภายนอกในระบบการให้รางวัลสมองของมนุษย์เนื่องจากการบริหารแอมเฟตามีนเฉียบพลัน จิตเวช Biol 72, 371 – 377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012)
- 37.
มิกฉัน อัล et. แอมเฟตามีนที่เกิดจากการปล่อย opioid จากภายนอกในสมองมนุษย์ที่ตรวจพบด้วย [11C] carfentanil PET: การจำลองแบบในกลุ่มคนอิสระ Int J Neuropsychopharmacol, 1 – 6, https://doi.org/10.1017/S1461145714000704 (2014)
- 38.
Yeomans, MR & Grey, RW Opioid เปปไทด์และการควบคุมพฤติกรรมการกินของมนุษย์ ประสาทวิทยาศาสตร์และชีวจิตรีวิว 26, 713 – 728 (2002)
- 39.
Sprenger, T. , Berthele, A. , Platzer, S. , Boecker, H. & Tolle, TR สิ่งที่ต้องเรียนรู้จาก ในร่างกาย การถ่ายภาพสมอง opioidergic? ปวด Eur J 9, 117 – 121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005)
- 40.
Unterwald, EM & Cuntapay, M. ปฏิกิริยาระหว่าง Dopamine-opioid ในหนู rat striatum: บทบาทในการปรับตัวของตัวรับ dopamine D1 ในการส่งสัญญาณแบบ delta opioid receptor-mediated Neuropharmacology 39, 372 – 381 (2000)
- 41.
เบ็นเชอรีฟบี. อัล et. ตัวรับ mu-opioid ในระดับภูมิภาคมีผลทำให้เยื่อหุ้มสมองลดลงในบูลิเมียเนียสซาและมีความสัมพันธ์เชิงลบกับพฤติกรรมการอดอาหาร วารสารเวชศาสตร์นิวเคลียร์: สิ่งพิมพ์อย่างเป็นทางการ, สมาคมเวชศาสตร์นิวเคลียร์ 46, 1349 – 1351 (2005)
- 42.
Karlsson, HK อัล et. โรคอ้วนนั้นสัมพันธ์กับการลดลงของ mu-opioid แต่ไม่มีโดปามีน dopamine D2 receptor ที่มีอยู่ในสมองที่ไม่เปลี่ยนแปลง Neurosci J 35, 3959 – 3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015)
- 43.
Karlsson, HK อัล et. การสูญเสียน้ำหนักหลังการผ่าตัดลดความอ้วนช่วยทำให้สมอง opioid ผู้รับปกติเป็นโรคอ้วน จิตเวชศาสต 21, 1057 – 1062, https://doi.org/10.1038/mp.2015.153 (2016)
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, JK กลไก Opioid ภายนอกมีความสำคัญต่อโรคอ้วนและการลดน้ำหนักในมนุษย์ J Clin Endocrinol Metab 100, 3193 – 3201, https://doi.org/10.1210/jc.2015-1783 (2015)
- 45.
มาจูรีเจ. อัล et. โดพามีนและสารสื่อประสาทประสาท Opioid ในการเสพติดพฤติกรรม: การศึกษาเปรียบเทียบ PET ในการเล่นการพนันทางพยาธิวิทยาและการรับประทานการดื่มสุรา Neuropsychopharmacology 42, 1169 – 1177, https://doi.org/10.1038/npp.2016.265 (2017)
- 46.
Vucetic, Z. , Kimmel, J. & Reyes, TM อาหารไขมันสูงเรื้อรังทำให้เกิดการควบคุม epigenetic หลังคลอดของตัวรับ mu-opioid ในสมอง Neuropsychopharmacology: ประกาศอย่างเป็นทางการของ American College of Neuropsychopharmacology 36, 1199 – 1206, https://doi.org/10.1038/npp.2011.4 (2011)
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA การชักนำให้เกิดภาวะ hyperphagia และปริมาณคาร์โบไฮเดรตโดยการกระตุ้นตัวรับ mu-opioid ในบริเวณที่มีการล้อมรอบของเยื่อหุ้มสมองส่วนหน้า วารสารประสาทวิทยาศาสตร์: วารสารทางการของสมาคมประสาทวิทยาศาสตร์ 31, 3249 – 3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011)
- 48.
Park, K. , Volkow, ND, Pan, Y. & Du, C. โคเคนเรื้อรังช่วยลดการส่งสัญญาณของโดปามีนในระหว่างการมึนเมาโคเคนและความไม่สมดุลของ D1 เหนือสัญญาณตัวรับ D2 วารสารประสาทวิทยาศาสตร์: วารสารทางการของสมาคมประสาทวิทยาศาสตร์ 33, 15827 – 15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013)
- 49.
คัมมิงพี อัล et. ผลของนิโคตินแบบเฉียบพลันต่อการไหลเวียนโลหิตและการจับตัวของ [11C] ราโคลโลไดรด์ต่อตัวรับโดปามีน D2,3 ในสมองหมู. NeuroImage 19, 1127 – 1136 (2003)
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP ผลของการบริหารโคเคนด้วยตนเองต่อตัวรับ dopamine D2 ในลิงชนิดหนึ่ง ไซแนปส์ 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND อัล et. ตัวชี้นำโคเคนและโดปามีนในแถบหลัง: กลไกของความอยากในการติดโคเคน วารสารประสาทวิทยาศาสตร์: วารสารทางการของสมาคมประสาทวิทยาศาสตร์ 26, 6583 – 6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006)
- 52.
วงศ์ DF อัล et. เพิ่มปริมาณการรับโดปามีนใน striatum ของมนุษย์ในช่วงที่มีความอยากโคเคน Neuropsychopharmacology 31, 2716 – 2727, https://doi.org/10.1038/sj.npp.1301194 (2006)
- 53.
Hajnal, A. , Smith, GP & Norgren, R. การกระตุ้นซูโครสในช่องปากจะเพิ่มโดพามีนในหนู Am J Physiol Regul Integr Comp Physiol 286, R31–37, https://doi.org/10.1152/ajpregu.00282.2003 (2004)
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. & Telang, F. การถ่ายภาพบทบาทของโดปามีนในการใช้ยาเสพติดและการเสพติด Neuropharmacology 56(ข้อ 1), 3–8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009)
- 55.
วังจีเจ อัล et. โดปามีนสมองและโรคอ้วน มีดหมอ 357, 354 – 357 (2001)
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS ความคล้ายคลึงกันระหว่างโรคอ้วนและการติดยาที่ประเมินโดยการถ่ายภาพเซลล์ประสาท: การทบทวนแนวคิด วารสารโรคติดเชื้อ 23, 39 – 53, https://doi.org/10.1300/J069v23n03_04 (2004)
- 57.
Johnson, PM & Kenny, PJ Dopamine D2 receptors ในความผิดปกติของการให้รางวัลเหมือนการเสพติดและการกินโดยบังคับในหนูที่เป็นโรคอ้วน ประสาทวิทยาศาสตร์ธรรมชาติ 13, 635 – 641, https://doi.org/10.1038/nn.2519 (2010)
- 58.
Berridge, KC & Kringelbach, ML ประสาทสัมผัสแห่งความสุข: รางวัลในมนุษย์และสัตว์ Psychopharmacology 199, 457 – 480, https://doi.org/10.1007/s00213-008-1099-6 (2008)
- 59.
Berridge, KC & Kringelbach, ML ระบบความสุขในสมอง เซลล์ประสาท 86, 646 – 664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015)
- 60.
Schultz, W. สัญญาณรางวัล Predictive ของเซลล์ประสาทโดปามีน J Neurophysiol 80, 1 – 27, https://doi.org/10.1152/jn.1998.80.1.1 (1998)
- 61.
Val-Laillet, D. , Layec, S. , Guerin, S. , Meurice, P. & Malbert, CH การเปลี่ยนแปลงของการทำงานของสมองหลังจากโรคอ้วนที่เกิดจากอาหาร ความอ้วน 19, 749 – 756, https://doi.org/10.1038/oby.2010.292 (2011)
- 62.
Hajnal, A. & Norgren, R. Accumbens กลไกโดปามีนในการบริโภคน้ำตาลซูโครส สมอง Res 904, 76 – 84 (2001)
- 63.
Rada, P. , Avena, NM & Hoebel, BG ทุกวันการกินน้ำตาลซ้ำ ๆ จะปล่อยสารโดพามีนในเปลือกแอคคัมเบนส์ Neuroscience 134, 737 – 744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005)
- 64.
Bello, NT, Lucas, LR & Hajnal, A. การเข้าถึงซูโครสซ้ำ ๆ มีอิทธิพลต่อความหนาแน่นของตัวรับโดปามีน D2 ใน striatum Neuroreport 13, 1575 – 1578 (2002)
- 65.
อัลซีโอเจ อัล et. Dopamine D1 receptor การแสดงออกของยีนลดลงในนิวเคลียส accumbens เมื่อได้รับอาหารเป็นเวลานานและแตกต่างกันไปขึ้นอยู่กับฟีโนไทป์ของโรคอ้วนที่เกิดจากอาหารในหนู Neuroscience 171, 779 – 787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010)
- 66.
Bassareo, V. & Di Chiara, G. อิทธิพลที่แตกต่างกันของกลไกการเรียนรู้แบบเชื่อมโยงและไม่สัมพันธ์กันต่อการตอบสนองของการส่งโดพามีนส่วนหน้าและส่วนหน้าไปยังสิ่งเร้าในอาหารในหนูที่เลี้ยงด้วย ad libitum Neurosci J 17, 851 – 861 (1997)
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD วงจรเซลล์ประสาทที่ไม่สมดุลในการเสพติด Curr Minnes Neurobiol 23, 639 – 648, https://doi.org/10.1016/j.conb.2013.01.002 (2013)
- 68.
Brogan, A. , Hevey, D. & Pignatti, R. Anorexia, bulimia และโรคอ้วน: การตัดสินใจร่วมกันในการขาดดุลในงานการพนันของรัฐไอโอวา (IGT) J Int Neuropsychol Soc 16, 711 – 715, https://doi.org/10.1017/S1355617710000354 (2010)
- 69.
Davis, C. , Levitan, RD, Muglia, P. , Bewell, C. & Kennedy, JL การขาดดุลในการตัดสินใจและการกินมากเกินไป: แบบจำลองความเสี่ยงสำหรับโรคอ้วน Obes Res 12, 929 – 935, https://doi.org/10.1038/oby.2004.113 (2004)
- 70.
Volkow, ND อัล et. ผู้รับ dopamine striatal ต่ำ D2 มีความสัมพันธ์กับการเผาผลาญ prefrontal ในวิชาอ้วน: ปัจจัยที่เป็นไปได้ NeuroImage 42, 1537 – 1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008)
- 71.
Lingawi, NW & Balleine, BW Amygdala central nucleus โต้ตอบกับ dorsolateral striatum เพื่อควบคุมการได้มาซึ่งนิสัย Neurosci J 32, 1073 – 1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012)
- 72.
ให้, S. อัล et. การเปิดใช้งานวงจรหน่วยความจำในช่วงที่อยากโคเคน Proc Natl Acad Sci สหรัฐอเมริกา 93, 12040 – 12045 (1996)
- 73.
ชิลเดรส, AR อัล et. การเปิดใช้งาน Limbic ระหว่างความอยากโคเคนที่เกิดจากคิว ฉันคือจิตเวชศาสตร์ 156, 11 – 18, https://doi.org/10.1176/ajp.156.1.11 (1999)
- 74.
Mahler, SV & Berridge, KC "ต้องการ" อะไรและเมื่อไหร่? การมุ่งเน้นไปที่ Amygdala โดยเน้นที่การกระตุ้นให้เกิดน้ำตาลและเพศ Psychopharmacology 221, 407 – 426, https://doi.org/10.1007/s00213-011-2588-6 (2012)
- 75.
Koob, GF & Volkow, ND Neurobiology of addiction: การวิเคราะห์ระบบประสาท มีดหมอจิตเวช 3, 760 – 773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016)
- 76.
Haase, L. , Cerf-Ducastel, B. & Murphy, C. การกระตุ้นของเยื่อหุ้มสมองเพื่อตอบสนองต่อสิ่งเร้าที่มีรสชาติบริสุทธิ์ในระหว่างสภาวะทางสรีรวิทยาของความหิวและความอิ่ม NeuroImage 44, 1008 – 1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009)
- 77.
โฟโตส, เอ. อัล et. การปลดปล่อยโดปามีนจากคิวโคเคนใน amygdala และฮิบโปแคมปัส: สัตว์เลี้ยงที่มีความละเอียดสูง [(1) (8) F] การศึกษา fallypride ในผู้มีส่วนร่วมในโคเคน Neuropsychopharmacology 38, 1780 – 1788, https://doi.org/10.1038/npp.2013.77 (2013)
- 78.
ไวส์, F. อัล et. การควบคุมพฤติกรรมการแสวงหาโคเคนโดยสิ่งเร้าที่เกี่ยวข้องกับยาเสพติดในหนู: ผลกระทบต่อการฟื้นตัวของระดับโดปามีนที่หยุดทำงานและนอกเซลล์ในระดับ amygdala และนิวเคลียส accumbens Proc Natl Acad Sci สหรัฐอเมริกา 97, 4321 – 4326 (2000)
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Dopamine D1 หรือ D2 receptor antagonism ภายใน amygdala basolateral จะเปลี่ยนแปลงการได้มาของความสัมพันธ์โคเคน - คิวที่จำเป็นสำหรับการคืนสถานะของการแสวงหาโคเคนที่กระตุ้นให้เกิดคิว Neuroscience 137, 699 – 706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006)
- 80.
ทูโอมิเนน, แอล. อัล et. dopamine-opiate ปฏิสัมพันธ์อธัย mesolimbic ในโรคอ้วน NeuroImage 122, 80 – 86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015)
- 81.
Schultz, W. สัญญาณโดปามีนเชิงพฤติกรรม เทรนด์ Neurosci 30, 203 – 210, https://doi.org/10.1016/j.tins.2007.03.007 (2007)
- 82.
Ting, AKR และ van der Kooy, D. ประสาทชีววิทยาของแรงจูงใจจากยาเสพติด Cold Spring Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012)
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Nicotinic และการควบคุมตัวรับ opioid ของการส่งผ่านสื่อกลางของ striatal dopamine D2-receptor Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016)
- 84.
โนมูระวาย อัล et. การลดลงของอายุที่เกี่ยวข้องกับโดปามีน D2 / 3 ความพร้อมใช้งานของตัวรับที่วัดด้วย [C-11] แร็กโลพอดในสมองส่วนที่ไม่ใช่ของมนุษย์: การเปรียบเทียบสี่วิธี NeuroImage 41, T133 – T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008)
- 85.
อลาคุตตี, เค. อัล et. ความน่าเชื่อถือของการทดสอบซ้ำในระยะยาวของการยึดติดของตัวรับและการรับสาร dopamine D2 / 3: การศึกษากับ [(11) C] raclopride และ PET ความละเอียดสูง J Cereb การไหลของเลือด 35, 1199 – 1205, https://doi.org/10.1038/jcbfm.2015.53 (2015)
- 86.
Piccini, P. , Pavese, N. & Brooks, DJ Endogenous dopamine ปล่อยหลังจากความท้าทายทางเภสัชวิทยาในโรคพาร์คินสัน Ann Neurol 53, 647 – 653, https://doi.org/10.1002/ana.10526 (2003)
- 87.
Sawamoto, N อัล et. การขาดความรู้ความเข้าใจและการปลดปล่อยโดปามีนในสมองส่วนหน้าในโรคพาร์กินสัน ของเล่นเพิ่มพัฒนาสมอง 131, 1294 – 1302, https://doi.org/10.1093/brain/awn054 (2008)
- 88.
Svensson, JE อัล et. ความถูกต้องและความน่าเชื่อถือของ extrastriatal [(11) C] raclopride มีผลผูกพันปริมาณในสมองมนุษย์ที่มีชีวิต NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019)
- 89.
สึคาดะเอช อัล et. การฉีดยาชา Isoflurane ช่วยเพิ่มผลการยับยั้งโคเคนและ GBR12909 ต่อการขนส่งโดพามีน: การศึกษา PET ร่วมกับ microdialysis ในสมองลิง สมอง Res 849, 85 – 96 (1999)
- 90.
ฮัสซูน, ดับเบิลยู. อัล et. การศึกษา PET ของ [racersoprride] [11C] ที่จับอยู่ใน striatum ของแมวตื่นตัว: ผลของยาชาและบทบาทของการไหลเวียนของเลือดในสมอง วารสารยุโรปของเวชศาสตร์นิวเคลียร์และการถ่ายภาพระดับโมเลกุล 30, 141 – 148, https://doi.org/10.1007/s00259-002-0904-4 (2003)
- 91.
Serafini, G. , Howland, RH, Rovedi, F. , Girardi, P. & Amore, M. บทบาทของคีตามีนในภาวะซึมเศร้าที่ดื้อต่อการรักษา: การทบทวนอย่างเป็นระบบ Curr Neuropharmacol 12, 444 – 461, https://doi.org/10.2174/1570159X12666140619204251 (2014)
- 92.
Berman, RM อัล et. ฤทธิ์ต้านซึมเศร้าของคีตามีนในผู้ป่วยซึมเศร้า. จิตเวช Biol 47, 351 – 354 (2000)
- 93.
Browne, CA & Lucki, I. ผลของยากล่อมประสาทของคีตามีน: กลไกที่เป็นพื้นฐานของยากล่อมประสาทชนิดใหม่ที่ออกฤทธิ์เร็ว Front Pharmacol 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013)
- 94.
อัลโต, เอส. อัล et. คีตามีนไม่ได้ลด dopamine D2 receptor ของตัวรับในผู้ชาย Psychopharmacology 164, 401 – 406, https://doi.org/10.1007/s00213-002-1236-6 (2002)
- 95.
Hashimoto, K. , Kakiuchi, T. , Ohba, H. , Nishiyama, S. & Tsukada, H. การลดตัวรับ dopamine D2 / 3 ใน striatum หลังจากให้ esketamine เพียงครั้งเดียว แต่ไม่ใช่ R-ketamine: a PET ศึกษาในลิงที่มีสติ โรงพยาบาลจิตเวช Eur Arch 267, 173 – 176, https://doi.org/10.1007/s00406-016-0692-7 (2017)
- 96.
Alstrup, AK อัล et. ผลของการระงับความรู้สึกและสปีชีส์ที่มีต่อการดูดซับหรือการแผ่รังสีของเรดิโอ ในร่างกาย ใน minipig Gottingen BioMed วิจัยนานาชาติ 2013, 808713, https://doi.org/10.1155/2013/808713 (2013)
- 97.
Lillethorup, TP อัล et. การถ่ายภาพสัตว์ด้วย monoaminergic ตามยาวของการยับยั้ง proteasome เรื้อรังใน minipigs Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018)
- 98.
Ichise, M. , Toyama, H. , Innis, RB & Carson, RE Strategies เพื่อปรับปรุงการประมาณค่าพารามิเตอร์ของ neuroreceptor โดยการวิเคราะห์การถดถอยเชิงเส้น J Cereb การไหลของเลือด 22, 1271 – 1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002)
- 99.
โลแกนเจ อัล et. อัตราส่วนปริมาณการกระจายโดยไม่มีการสุ่มตัวอย่างเลือดจากการวิเคราะห์เชิงกราฟของข้อมูล PET J Cereb การไหลของเลือด 16, 834 – 840, https://doi.org/10.1097/00004647-199609000-00008 (1996)
- 100.
Endres, CJ, Bencherif, B. , Hilton, J. , Madar, I. & Frost, JJ ปริมาณของตัวรับ mu-opioid ในสมองด้วย carfentanil [11C]: วิธีการอ้างอิงเนื้อเยื่อ Nucl Med Biol 30, 177 – 186 (2003)
- 101.
Panksepp, J. & Bishop, P. แผนที่อัตชีวประวัติของ (3H) ที่มีผลผูกพัน diprenorphine ในสมองหนู: ผลของปฏิสัมพันธ์ทางสังคม Brain Res Bull 7, 405 – 410 (1981)
- 102.
Landau, AM อัล et. การกระตุ้นด้วยไฟฟ้าส่งผลกระทบที่แตกต่างกัน [(11) C] MDL100,907 จับกับเยื่อหุ้มสมองและ subcortical 5HT2A ผู้รับในสมองหมู J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019)
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D. , Sorensen, JCH และ Palomero-Gallagher, N. ฟังก์ชั่นโครงสร้างของสมอง 222, 2093 – 2114, https://doi.org/10.1007/s00429-016-1327-5 (2017)
- 104.
Orlowski, D. , Glud, AN, Palomero-Gallagher, N. , Sorensen, JCH & Bjarkam, CR Online แผนที่ทางจุลชีววิทยาของสมองมินิปิก Gottingen Heliyon 5,e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019)
กิตติกรรมประกาศ
มหาวิทยาลัย Aarhus“ โครงการสนับสนุนแนวคิดการพัฒนาโครงการ AU Ideas” ให้กับ AML ได้รับทุนสนับสนุนการศึกษา เราขอขอบคุณสำหรับการสนับสนุนทางเทคนิคจากพนักงานที่ศูนย์ PET โรงพยาบาลมหาวิทยาลัย Aarhus และ Aarhus University Farm เพื่อขอความช่วยเหลือในการรักษาสัตว์ เราขอขอบคุณศาสตราจารย์ Morten Kringelbach ศาสตราจารย์Jørgen Scheel-Kruger และรองศาสตราจารย์ Arne Møllerสำหรับความช่วยเหลือในการริเริ่มการศึกษาเหล่านี้
ประกาศจริยธรรม
สนใจการแข่งขัน
ผู้เขียนไม่มีส่วนได้เสียในการแข่งขัน
ข้อมูลเพิ่มเติม
หมายเหตุของสำนักพิมพ์ Springer Nature ยังคงเป็นกลางเกี่ยวกับการอ้างสิทธิ์ในเขตอำนาจศาลในแผนที่ที่ตีพิมพ์และหน่วยงานสังกัด
สิทธิและการอนุญาต
เปิดการเข้าถึง บทความนี้ได้รับอนุญาตภายใต้สัญญาอนุญาตครีเอทีฟคอมมอนส์แบบแสดงที่มา 4.0 นานาชาติซึ่งอนุญาตให้ใช้แบ่งปันปรับเปลี่ยนแจกจ่ายและทำซ้ำในสื่อหรือรูปแบบใด ๆ ตราบใดที่คุณให้เครดิตที่เหมาะสมแก่ผู้เขียนต้นฉบับและแหล่งที่มา ลิงก์ไปยังใบอนุญาตครีเอทีฟคอมมอนส์และระบุว่ามีการเปลี่ยนแปลงหรือไม่ รูปภาพหรือเนื้อหาบุคคลที่สามอื่น ๆ ในบทความนี้รวมอยู่ในใบอนุญาตครีเอทีฟคอมมอนส์ของบทความเว้นแต่จะระบุไว้เป็นอย่างอื่นในวงเงินเครดิตของวัสดุ หากเนื้อหาไม่รวมอยู่ในใบอนุญาตครีเอทีฟคอมมอนส์ของบทความและการใช้งานที่คุณตั้งใจไม่ได้รับอนุญาตตามกฎหมายหรือเกินกว่าการใช้ที่ได้รับอนุญาตคุณจะต้องได้รับอนุญาตโดยตรงจากเจ้าของลิขสิทธิ์ หากต้องการดูสำเนาสัญญาอนุญาตนี้โปรดไปที่ http://creativecommons.org/licenses/by/4.0/.