Diyaloglar Clin Neurosci. 2013 Dec;15(4):431-43.
Özet
Çok sayıda psikososyal faktörün önemine rağmen, özünde, uyuşturucu bağımlılığı biyolojik bir süreç içermektedir: zorlayıcı bir beyinde, zorlayıcı bir arayışı ve uyuşturucu almaya zorlayan ve kontrol kaybını tetikleyen değişiklikleri tetiklemek için bir uyuşturucu bağımlılığına tekrar tekrar maruz kalma kabiliyeti uyuşturucu kullanımı yüzünden, bu bir bağımlılık halini tanımlar. Burada, bağımlılıkla ilişkili davranışsal anormalliklere aracılık etmek için belirli beyin bölgelerinde meydana gelen moleküler ve hücresel adaptasyon türlerini gözden geçiriyoruz. Bunlara kısmen epigenetik mekanizmalar yoluyla ulaşılan gen ekspresyonunda değişiklikler, nöronların ve sinapsların nörofizyolojik fonksiyonunda plastisite ve kısmen değişmiş nörotrofik faktör sinyallemesinin aracılık ettiği nöronal ve sinaptik morfolojideki ilişkili plastisite dahildir. Bu tür ilaca bağlı modifikasyonların her biri bir "hücresel veya moleküler hafıza" formunda görülebilir. Ayrıca, bağımlılıkla ilgili plastiklik formlarının çoğunun, daha klasik “davranışsal bellek” formlarıyla ilişkilendirilen plastiklik türlerine çok benzer olması ve belki de çevre ile karşı karşıya kaldıklarında nöronların elverişli olan sonlu adaptif mekanizmalarını yansıtması dikkat çekicidir. zorluklar. Son olarak, bağımlılıkla ilgili moleküler ve hücresel adaptasyonlar, anormal hatıraların bağımlılık sendromlarının önemli itici güçleri olduğu görüşü ile tutarlı olarak, daha klasik hafıza biçimlerine aracılık eden aynı beyin bölgelerinin çoğunu içerir. Uyuşturucu bağımlılığının moleküler ve hücresel temelini açıklamayı amaçlayan bu çalışmaların amacı, sonunda biyolojik olarak bağımlı tanı testlerinin yanı sıra bağımlılık bozuklukları için daha etkili tedaviler geliştirmektir.
Giriş
Zorlu sonuçlara veya uyuşturucu kullanımı üzerindeki kontrol kaybına rağmen, zorlayıcı arayış ve ilaç olarak tanımlanabilecek uyuşturucu bağımlılığı, belirli beyin bölgelerinde meydana gelen uzun süreli uyuşturucu kaynaklı değişikliklerden kaynaklanmaktadır.1 Bununla birlikte, sadece bazı kişiler, tekrarlanan ilaca maruz kalma karşısında bağımlılığa maruz kalırken, diğerleri ise bir ilacı rasgele kullanabiliyor ve bir bağımlılık sendromundan kaçabiliyor. Genetik faktörler, bağımlılık kırılganlığındaki bu bireysel değişkenliğin kabaca% 50'ini oluşturur ve bu kalıtım derecesi, uyarıcılar, afyonlar, alkol, nikotin ve kanabinoidler dahil olmak üzere tüm ana bağımlılık ilaç sınıfları için geçerlidir..2 Bu genetik riski oluşturan genlerin çoğunun tanımlanması henüz mümkün olmamıştır, muhtemelen bağımlılık kırılganlığını (veya diğer bireylerde, direnç) ortaya çıkarmak için belki de tek bir bireyde toplanan yüzlerce genetik varyasyonun dahil edilmesinden kaynaklanmaktadır.
Bağımlılık riskinin diğer% 50'si, bir bireyin genetik bileşimi ile etkileşime giren ve onu bağımlılığa karşı savunmasız hale getiren bir yaşam boyu ortaya çıkan bir dizi çevresel faktörden kaynaklanmaktadır. Bağımlılıkta psikososyal stresler de dahil olmak üzere çeşitli çevresel faktörler rol oynamıştır, ancak açık ara en güçlü faktör bir uyuşturucu madde kullanımına maruz kalmaktır. Bazı “geçit” ilaçlarının, özellikle nikotinin, birinin başka bir uyuşturucuya bağımlılığa karşı savunmasızlığını artırdığı gösterilmiştir.3 Ayrıca, popülasyondaki bağımlılık için bir dizi genetik risk olmasına rağmen, yeterince uzun süre boyunca yüksek miktarda bir ilaca maruz kalmanın, nispeten düşük bir genetik yüklemeye sahip birini bağımlıya dönüştürebileceğine dair artan bir kanıt vardır..4
Geçtiğimiz yirmi yılda, hem bir bağımlılık sendromuna aracılık etmede önemli olan ayrık beyin bölgelerinin, hem de bu bölgelerde ilaçların moleküler ve hücresel seviyelerde meydana geldiği değişiklik türlerinin ve temel yönlerin altında yatan faktörlerin belirlenmesi konusunda büyük ilerleme kaydedilmiştir. bağımlılığı.1,5 En fazla dikkati çeken devre, orta beynin ventral tegmental alanındaki (VTA) dopamin nöronları (VTA), nukleus accumbens'in (NAc, ventral striatumun bir parçası) sinir bozucu orta sivri nöronları içeren mesolimbik dopamin sistemi olarak adlandırılır. Bu VTA nöronları ayrıca, hipokampus, amigdala ve prefrontal korteks (PFC) dahil olmak üzere birçok diğer ön bölgeye de zarar vermektedir.
Bu ciltteki uyuşturucuyla ilişkili bağımlılık mekanizmalarını hafızada üç örtüşen nedenden ötürü düşünmek mantıklıdır.6
- İlk olarak, ilaca bağlı tüm adaptasyonlar “moleküler veya hücresel hafıza” tipleri olarak görülebilir: bu gibi değişiklikler geçiren sinir hücresi ilaca maruz kalma sonucu farklıdır ve dolayısıyla aynı ilaca farklı tepkiler verir, diğer ilaçlara ya da sonuç olarak diğer uyaranlara.
- İkincisi, çoğu, belki de en çok, bağımlılık durumuyla ilişkilendirilen değişiklik türlerinin ilginç olması ilginçtir. (örneğin, değiştirilmiş gen transkripsiyonu, epigenetik, sinaptik ve bütün hücre plastisitesi ve nöronal morfoloji ve nörotrofik mekanizmalar) ayrıca, mekansal hafıza, korku koşullandırma ve operant koşullandırma gibi geleneksel “davranışsal hafıza” biçimlerine de dahil edilirler.
- Üçüncüsü, suiistimal ilaçlarından etkilenen beyin bölgeleri arasında, hipokampus, amigdala ve PFC dahil olmak üzere davranışsal hafıza için anahtar sinirsel substratlar bulunmaktadır. Bu, klinik olarak görülen bağımlılığın en önemli özelliklerinden bazılarının (örn., İlaç özlemi ve nüks) bazılarının, geleneksel bağımlılık devrelerinde anormallikleri yansıttığı ve bağımlılık patolojisinin güçlü itici güçleri olarak uzun süredir devam eden uyuşturucu deneyimlerinin anılarını yansıttığı gerçeği ile çakışmaktadır.4,7,8 Tersine, beynin ödül bölgeleri (örneğin, VTA ve NAc) davranışsal hafızayı güçlü bir şekilde etkiler.
Bu makale, birçok beyin bölgesinde, bağımlılık hayvan modellerinde meydana gelen ve şu anda çoğu bilginin mevcut olduğu çekirdek katmanlar üzerine yoğunlaşan başlıca moleküler ve hücresel değişiklik türlerine genel bir bakış sunmaktadır. Önemli olarak, postmortem beyinlerin çalışmalarına dayanarak, insan bağımlılarındaki bu değişikliklerin bazılarının doğrulanması giderek daha fazla mümkün olmuştur. Kötüye kullanım ilaçlarının farklı kimyasal yapılara sahip olmalarına ve farklı protein hedeflerine etki etmelerine rağmen, birçok bağımlılık bağımlılığı ile ilgili uyarlamanın birçok kişi için ortak olduğu ve bazı durumlarda, istismar ilaçlarının ve muhtemelen ortak özelliklerin ortak özelliklerine katkıda bulunduğu dikkat çekicidir. bağımlılık sendromu.4,9 Buna karşılık, birçok başka ilaca bağlı uyarlama, belirli bir ilaca özgüdür ve verilen bir bağımlılığın daha kendine özgü yönlerine aracılık edebilir. Burada hayvan modellerinde diğer ilaçlarla karşılaştırıldığında daha çarpıcı etkiler yaratan suistimal ve uyarıcı ilaçlara odaklanıyoruz. Ayrıca, bağımlılık sendromları konusundaki bilgilerimizi daha da artıracak ve bu gelişmeleri gelişmiş teşhis testleri ve tedavilerine çevirecek gelecekteki araştırmalar için önemli alanları vurguladık.
Transkripsiyonel ve epigenetik mekanizmalar
Yıllarca süren yokluğa rağmen bağımlıların artma riski altında kalacağı bilgisi, bağımlılığın beyinde çok kararlı olabilen ilaca bağlı değişiklikleri içerdiği anlamına gelir. Bu birkaç grubun gen ekspresyonundaki değişiklikleri bağımlılık sürecinin önemli bir bileşeni olarak görmesine neden olmuştur. (Şekil 1). Buna göre, DNA mikrodizileri ve daha yakın zamanda RNA-seq (eksprese edilmiş RNA'ların yüksek verimli dizilimi) içeren aday genler veya genom çapında araştırmalar Kemirgen ve primat bağımlılık modellerinde ve insan bağımlılarında belirli bir beyin bölgesinde ifadesini değiştiren çok sayıda gen tanımlamıştır. (örneğin, 10-17). Bu genlerin örnekleri, bu derlemenin sonraki bölümlerinde ele alınmıştır.
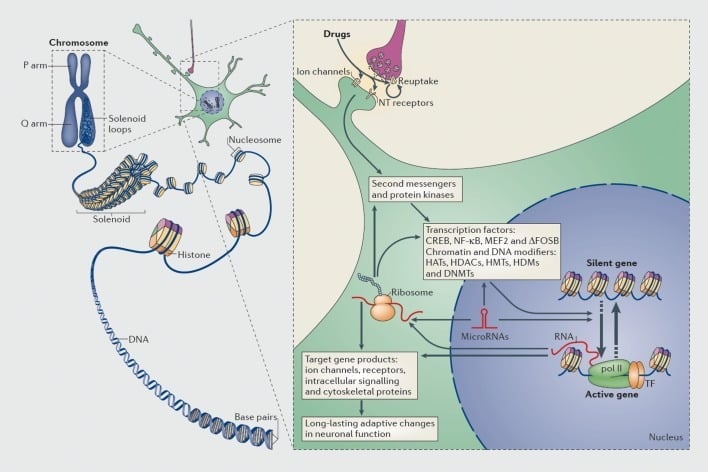
Kötüye kullanılan ilaçların transkripsiyonel ve epigenetik düzenleme mekanizmaları. Ökaryotik hücrelerde DNA, nükleozomlar oluşturmak üzere histon oktomerlerin etrafına sarılarak düzenlenir, bu daha sonra kromozomlar (sol kısım) oluşturmak üzere daha da organize edilir ve yoğunlaştırılır. Sadece geçici olarak sıkıştırılmış kromatinin çözülmesiyle, spesifik bir genin DNA'sı transkripsiyonel makinelere erişilebilir hale getirilebilir. Kötüye kullanılan ilaçlar, hücre içi sinyal kaskadlarını (sağ kısım) değiştirmek için yeniden alım mekanizmaları, iyon kanalları ve nörotransmitter (NT) reseptörleri gibi sinaptik hedefler yoluyla etki eder. Bu, kromatin düzenleyici proteinler (kalın oklarla gösterilmiştir) dahil olmak üzere, transkripsiyon faktörlerinin (TF'ler) ve diğer birçok nükleer hedefin aktivasyonuna veya inhibisyonuna yol açar; Kromatin düzenleyici proteinlerin sinaptik düzenlemesinde yer alan detaylı mekanizmalar hala anlaşılmamıştır. Bu işlemler sonuçta, mikroRNA'lar gibi kodlamayan RNA'lar da dahil olmak üzere, belirli genlerin indüklenmesi veya baskılanmasıyla sonuçlanır; Bu genlerin bazılarının değişmiş ekspresyonu, sırayla gen transkripsiyonunu da düzenleyebilir. Kromatin seviyesindeki ilaç kaynaklı bu değişikliklerin bazılarının son derece stabil olduğu ve dolayısıyla bağımlılığı tanımlayan uzun süreli davranışların altında olduğu öne sürülmektedir. CREB, siklik AMP'ye cevap veren element bağlayıcı protein; DNMT'ler, DNA metiltransferazlar; HAT'ler, histon asetil transferazlar; HDAC'ler, histon deasetilazlar; HDM'ler, histon demetilazlar; HMT'ler, histon metiltransferazlar; MEF2, miyosit spesifik geliştirici faktör 2; NF-kB, nükleer faktör-KB; pol II, RNA polimeraz II. Ref 44'ten üretilmiştir: Robison AJ, Nestler EJ. Transkripsiyonel ve epigenetik bağımlılık mekanizmaları. Nat Rev Neurosci. 2011; 12: 623-637.
Benzer şekilde, birçok transkripsiyon faktörü türü - genlerin düzenleyici bölgelerine bağlanan ve böylece bu genlerin transkripsiyonunu artıran veya azaltan proteinler - kötüye kullanılan ilacın beyindeki gen ekspresyonu üzerindeki uzun vadeli etkilerine aracılık etmede rol oynamaktadır.. Önde gelen örnekler arasında CREB (cAMP tepki elemanı bağlayıcı protein), ΔFosB (bir Fos ailesi transkripsiyon faktörü), NFkB (nükleer faktör kB), MEF2 (miyosit arttırıcı faktör-2) ve glukokortikoid reseptörleri bulunur.5,10,18-22 Kötüye kullanım ilaçlarının beyindeki belirli bir transkripsiyon faktörünü etkinleştirdiği hücresel sinyal yollarını anlamak ve bu tür aktivasyonu nedensel olarak bu transkripsiyon faktörünün hedef genlerine ve bağımlılığın belirli davranışsal yönlerine bağlamak giderek daha fazla mümkün hale gelmiştir (bkz. Şekil 1). Bu gelişme, bağımlılık modellerinde en iyi çalışılan transkripsiyon faktörleri olan CREB ve ΔFosB'un dikkate alınmasıyla gösterilmiştir.
cAMP Tepki elemanı bağlayıcı protein
Uyarıcı ve afyonlu suistimal ilaçları aktive eder CREB NAc'da belirgin bir şekilde dahil olmak üzere bağımlılık için önemli birkaç beyin bölgesinde.23,24 CREB'in diğer sistemlerde cAMP, Ca ile aktive edildiği bilinmektedir.2+ve büyüme faktörü yolları,25 ve bunların hangisinin NAc'de suistimal edilen ilaçlarla aktivasyonuna aracılık ettiği henüz bilinmemektedir. NAc'de CREB'nin ilaç aktivasyonunun, klasik bir negatif geri besleme mekanizmasını temsil ettiği gösterilmiştir., CREB, bir hayvanın bu ilaçların ödüllendirici etkilerine (tolerans) duyarlılığını azaltmaya ve ilacın kesilmesi sırasında olumsuz bir duygusal duruma (bağımlılık) aracılık etmeye hizmet eder..18,26,27 Bu etkilerin yakın zamanda ilaçların kendi kendine verilişini arttırdığı ve muhtemelen olumsuz bir pekiştirme işlemi yoluyla nüksettiği gösterilmiştir.28 CREB'nin bu eylemleri, ağırlıklı olarak D ifade eden NAc orta dikenli nöronların her iki büyük alt tipini de içeriyor gibi görünmektedir.1 D'ye karşı2 dopamin reseptörleri.24 Iİlginç bir şekilde, geniş bir literatür topluluğu hipokampus ve amigdalada rol alan CREB'in davranışsal bellekte anahtar bir molekül olduğunu göstermiştir..29-31 Bağımlılık ve davranışsal hafızadaki bu geniş rol, nöronların sürekli değişen bir ortama uyum sağlayabilecekleri sınırlı sayıda moleküler mekanizma içerdiği gerçeğini yansıtmaktadır.
Bu davranış fenotipine aracılık eden CREB için hedef genler, genom çapında deneylerin yanı sıra daha fazla çaba gösterilerek tanımlandı.10,18,32 Bir örnek, opioid peptidi dynorphin'dir: CREB aracılı NAc nöronlarında dynorphin ekspresyonunun uyarıcı indüksiyonu, VTA dopamin nöronlarında k opioid reseptörlerinin dynorphin aktivasyonunu arttırır ve böylece NAc'ye dopaminerjik iletimi baskılar ve ödül bozar.18 Diğer bazı CREB hedeflerinin aşağıda tartışıldığı gibi ilaca bağlı sinaptik plastisite için önemli olduğu gösterilmiştir. CREB ayrıca diğer birkaç beyin bölgesinde uyarıcılar ve afyonlarla aktive edilirken,23,24 Bu etkinin davranışsal sonuçları ve bunların meydana geldiği hedef genler hakkında daha az şey bilinmektedir. Benzer şekilde, CREB'in diğer uyuşturucuların istismar edici eylemlerine aracılık etmedeki rolü hakkında daha az şey bilinmektedir.19
ΔFosB
Neredeyse herhangi bir suiistimal ilacına akut maruz kalma, NAc ve diğer bazı beyin bölgelerinde tüm Fos ailesi transkripsiyon faktörlerini indükler. Bu indüksiyon hızlıdır, fakat aynı zamanda geçicidir, Fos protein seviyeleri 8 ile 12 saat arasında normale döner. Bu Fos ailesi proteinleri arasında benzersiz olarak FosB geninin kesilmiş bir ürünü olan ΔFosB, Alışılmadık stabilitesi sayesinde, tekrar tekrar ilaca maruz kalma süresi boyunca biriken ve bu koşullar altında ifade edilen baskın Fos proteini haline gelir.22,33 Ayrıca, bu stabilite nedeniyle, BFosB seviyeleri ilacın geri çekilmesinden sonra haftalarca devam eder. BFosB'nin bu gibi kronik indüksiyonunun, hemen hemen bütün kötüye kullanım ilaçları için kanıtlandığı görülmüştür.34 ve çoğu ilaç için, Dl tipi NAc nöronları için seçicidir.34,35 Ayrıca insan bağımlılarında gösterildi.35 Çok sayıda literatür D’de suchFosB indüksiyonunun olduğunu göstermiştir.1-NAc tipi nöronlar, bir hayvanın ilaca duyarlılığının yanı sıra doğal ödülleri de arttırır ve muhtemelen olumlu bir pekiştirme süreci yoluyla kendi kendine ilaç vermeyi teşvik eder. (bkz. ref 34 - 38). İlginçtir, NAc'de ΔFosB'nin ilaçla indüksiyonu, ergen hayvanlarda, daha fazla bağımlılık kırılganlığı yaşandığı bir zamanda daha çarpıcıdır.,39 ve nikotin tarafından indüksiyonunun, nikotinin ağ geçidi benzeri kokain ödülünü artırmasına aracılık ettiği gösterilmiştir..40
CREB'ye gelince, aday gen ve genom çapında yaklaşımlar kullanılarak NAc'de ΔFosB için sayısız hedef gen tanımlanmıştır.10,32 CREB dinorfini indüklerken, ΔFosB onu bastırır, bu da ΔFosB'nin pro-ödül etkilerine katkıda bulunur..38 Bir başka osFosB hedefi cFos'tur: ΔFosB tekrarlanan ilaç maruziyeti ile biriktiğinden, c-Fos'i bastırır ve ΔFosB'nin seçici olarak kronik ilaçla tedavi edilen durumda indüklendiği moleküler anahtara katkıda bulunur.41 Diğer birçok ΔFosB hedefinin, bazı kötüye kullanılan ilaçların NAc'de sinaptik plastisiteye neden olma kabiliyetine ve NAc orta sivri nöronların dendritik arborizasyonunda ilişkili değişikliklere aracılık ettiği gösterilmiştir.
BrainFosB indüksiyonunun diğer beyin bölgelerindeki fonksiyonel sonuçları orbitofrontal kortekste (OFC) indüksiyonu biraz detaylı çalışılmış olmasına rağmen daha iyi anlaşılmamıştır. Burada, ΔFosB, kronik maruz kalma seyri sırasında kokainin bilişsel bozucu etkilerine karşı oluşan toleransı aracılık eder ve bu adaptasyon, artan kokain kendi kendine uygulaması ile ilişkilidir..42,43
Genom çapında analizler, bu etkilere aracılık eden birkaç potansiyel hedef gen önermiştir.42 ΔFosB'nin benzersiz zamansal özelliklerine ve geleneksel bellek devrelerinde (örneğin hipokampus) indüklendiği bilgisine rağmen, FosB'nin davranışsal bellekteki rolü, gelecekteki araştırmalar için ilginç bir konu olan henüz araştırılmamıştır.
Epigenetik mekanizmalar
Son yıllarda, transkripsiyon çalışmaları epigenetiğe bir adım daha itti44 (görmek Şekil 1)DNA genişlemesinde bir değişiklik olmadığında meydana gelen gen ifadesinde bir değişiklik olarak tanımlanabilir. Epigenetik mekanizmalar, bir hücre çekirdeği içindeki DNA'nın, birlikte kromatin içeren histonlarla ve birçok başka nükleer protein türleriyle etkileşimleri yoluyla paketlenmesini kontrol eder. Gen ekspresyonu, histonların, diğer proteinlerin ve DNA'nın kendisinin kovalent modifikasyonu yoluyla bu ambalajlamanın durumu tarafından kontrol edilir. Bazı örneklerde olduğu gibi, histonların asetilasyonu, gen aktivasyonunu destekleme eğilimindedir, histonların metilasyonu, bu modifikasyona tabi tutulan Lys tortusuna bağlı olarak gen aktivasyonunu veya represyonunu teşvik edebilir ve DNA'nın metilasyonu, genellikle belirli metilasyon formları olmasına rağmen gen represyonuyla ilişkilendirilir ( örneğin, 5-hidroksimetil), gen aktivasyonu ile ilişkilendirilebilir.
Epigenetik çekici bir mekanizmadır, çünkü diğer sistemlerde, örneğin gelişimsel ve kanser biyolojisi, bazı epigenetik modifikasyonlar kalıcı olabilir. Bu yüzden, epigenetik hem öğrenme hem de bellek modellerinde (örneğin, refs 45-48) ve bağımlılıkta takip edilmiştir;44,49 Her iki sistemde de, histon asetilasyonunda ve metilasyonunda ve DNA metilasyonunda köklü değişiklikler bildirilmiştir. Sadece bir örnek olarak, histon metiltransferaz, G9a, her iki hafızaya da dahil edilmiştir.50 ve bağımlılık.51,52 Bağımlılık modellerinde, G9a ifadesi aşağı regüle edildi NAc’de, suiistimal veonun bu ilaçların ödüllendirici etkilerini arttırdığı gösterilmiştir.51,52 İlginç bir şekilde, G9a'nın kokain baskılanmasına ΔFosB aracılık eder. G9a, gen represyonunun ana bir aracı olan histonu H9'in (H3K3me9) Lys2'in dimetilasyonunu katalize eder. Uyarıcı veya afyon maruziyetinden sonra değiştirilmiş H3K9meUMNUMX'ten sonra değiştirilmiş H2KXNUMXmeUMNUMX genlerinin genom haritalarını elde etmek için ChIP-yonga veya ChIP-seq (sırasıyla, promotör çipleri veya yüksek verimli sekanslama ile takip edilen kromatin immünopresipitasyonunu) kullanılmıştır.32,52,53 Bu gen listelerini, genom genişliğindeki gen ekspresyonu değişiklik listeleriyle ve diğer birçok epigenetik modifikasyon formunun (örneğin, (FosB bağlama, CREB bağlama, diğer histon modifikasyonları, vb.) Genom haritası ile örterek,32,53 Kötüye kullanım ilaçları tarafından düzenlenen ve giderek artan bir şekilde bir dizi gen tanımlamak ve bunun altında yatan epigenetik mekanizmaları anlamak mümkün olmalıdır.
Hafıza ve bağımlılığa karışan bir başka epigenetik düzenleme şekli de microRNA'ların üretilmesidir. Bu küçük, kodlayıcı olmayan RNA'lar, mRNA'ların tamamlayıcı bölgelerine bağlanır ve böylece translasyonlarını baskılar veya bozulmalarını indükler. MiRNA'ların işlenmesi için çok önemli olan bir protein olan Argonaut'un silinmesi, D1'e karşı D2 tipi orta dikenli nöronlar için gözlenen farklı etkilerle kokaine davranışsal tepkileri değiştirir.54 Bazı spesifik miRNA'ların benzer şekilde ilaca maruz kalma ile düzenlendiği ve ardından ilaçlara davranışsal tepkileri etkilediği (örneğin, ref. 55,56) gösterilmiştir. Gelecekteki çalışmalarda bu miRNA'ların mRNA hedeflerini belirlemek ve bağımlılık sürecini nasıl etkilediklerini belirlemek heyecan verici olacaktır.
Sinaptik plastisite
Davranışsal hafızada hipokampus ve amigdala ile ilgili olan glutamaterjik sinapslardaki aynı genel sinaptik modifikasyon türlerinin (bu konudaki diğer makalelere bakınız) benzer şekilde bağımlılık modellerinde beyin ödül bölgelerinde meydana geldiği ve bağımlılıkta önemli olduğu gösterilmiştir. bağımlılık süreci.57,58 Bu tür ilaca bağlı sinaptik plastisite, birkaç beyin bölgesinde tanımlanmıştır, ancak, burada araştırmanın çoğunun bugüne odaklandığı NAc'ye odaklanıyoruz. (Şekil 2).
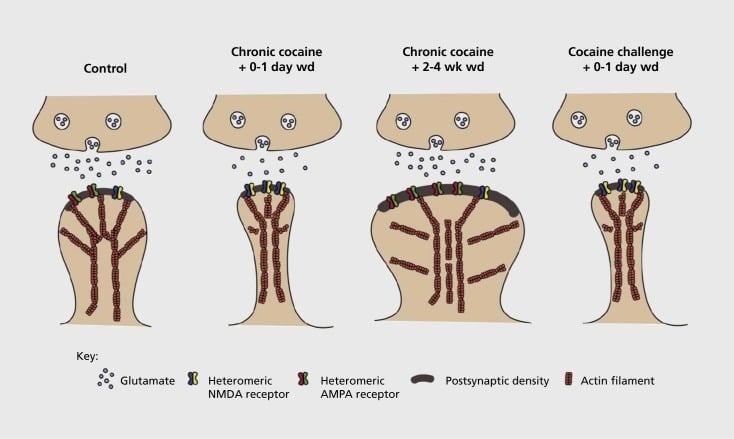
Çekirdekteki accumbens'te bağımlılıkla ilişkili sinaptik ve yapısal plastiklik modeli (NAc). Kokaine kronik olarak maruz kalma, a-amino-3-hidroksi-5-metil-4-izoksazolepropiyonik asit (AMPA) ve N-metil-D-aspartik asit (NMDA) glutamat reseptörlerinin NAc ortamında zamana bağlı ve geçici olarak yeniden düzenlenmesi ile sonuçlanır Spiny nöron (MSN) sinapslarının yanı sıra, farklı sinaptik plastisite formları ile korelasyon gösteren NAc MSN'lerin omurga başındaki yapısal değişiklikler. Örneğin, kronik kokain, NMD reseptörlerinin yüzey ekspresyonunu, sessiz sinaps oluşumunu ve erken geri çekilme zaman noktalarında uzun süreli depresyonu (LTD) indükler. Daha uzun süreli çekme (wd) sırasında, bu sinaptik değişiklikler, yüzey AMPA reseptörlerinin ekspresyonunun artması, sinapsın mantar şeklindeki bir omurgada konsolidasyonu ve uzun süreli güçlenme (LTP) ile sonuçlanmasıyla tersine dönmektedir. Bu etkiler, omurganın ince dikenlere yeniden yapılandırılmasına ve sinaptik kuvvetin bir depresyonuna yol açan zorlu bir kokain dozuna maruz kaldığında tekrar hızla geri döner.
İlk deneyler, istismarın uyarıcı ilaçlarına tekrar tekrar maruz kalmanın, NAc'de glutamaterjik sinapslarda bir LTD (uzun süreli depresyon) benzeri bir duruma yol açtığını göstermiştir.59 Bununla birlikte, daha yakın tarihli bir çalışma, son zamandaki kokaine maruz kalmadan hemen sonra ortaya çıkan LTD ile daha uzun geri çekilme zaman noktalarından sonra LTP (uzun süreli güçlenme) benzeri durumdan daha fazla evrimleşen LTD ile birlikte, zamana bağlı olarak bu tür plastikliği göstermiştir.60,61 Bugüne kadar esas olarak yönetilen araştırmacı - kendi kendine verilen ilaçların aksine - yürütülen bu çalışma, Glutamaterjik sinapslarda meydana gelen sinaptik plastisite formlarını izleyen kendi kendine uygulanan modellerde daha sistematik araştırmalara olan ihtiyacı tanımlamıştır. NAc, kendi kendine idarenin edinilmesinden bakımına, farklı geri çekilme ve yok olma zamanlarına ve nüksetmeye neden olan uyaranlara cevap olarak, detaylı bir zaman süreci boyunca. Bugüne kadar yapılan çalışmalar, AMPA reseptörlerinin belki de kısmen CaMKII (Ca aracılığıyla aracılık ettiği sinapsla ticareti) dahil olmak üzere, ilaca bağlı sinaptik plastisiteye katkıda bulunan bazı moleküler mekanizmaların da tanımını yapmıştır.2+/ kalmodulin bağımlı protein kinaz II) AMPA reseptör alt birimlerinin fosforilasyonu ve AMPA reseptör alt birimlerinin (örneğin, 60,62-65, Şekiller 2 ve 3). CREB ve ΔFosB için bir rol, bu fenomenlerde ve ayrıca glutamaterjik sinapsların morfolojisindeki ilişkili değişikliklerde ortaya çıkmıştır (aşağıya bakınız). Örneğin, GluAl NAc’da CREB için bir hedef, burada GluA2 ve CaMKII bu beyin bölgesinde hem ΔFosB’nin hedefleridir. .35,36,66,67 İlerlerken, belirli uyarlamaları sinaptik fonksiyondaki zamana bağlı değişikliklere ve bağımlılığın davranış özelliklerine bağlamak önemlidir.
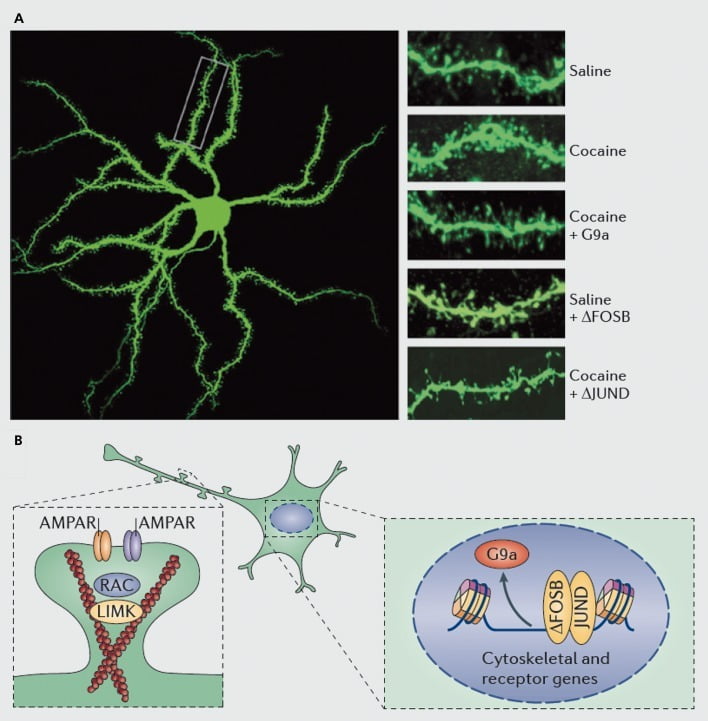
Nukleus accumbens (NAc) orta dikenli nöronlarda dendritik dikenlerin kokain indüksiyonunun altında yatan moleküler mekanizmalar. A), Dendritik omurga sayısında, G9a veya JunD'nin (AP1 aracılı transkripsiyonun bir antagonisti) viral aşırı ekspresyonu ile bloke edilebilen veya FosB'nin viral aşırı ekspresyonu ile taklit edilebilen kokain kaynaklı artışları gösterir. B) AMPA reseptörü (AMPAR) trafiğinin ve aktin hücre iskeletinin (solda) düzenlenmesinin yanı sıra, glutamat reseptörlerinin ve aktin düzenleyici proteinlerin transkripsiyonunun düzenlenmesinin (örneğin, ΔFosB aracılığıyla, sağda) önemli roller oynadığı gösterilmiştir. kokainin NAc dendritik omurga yoğunluğu düzenlemesine aracılık etmek. UMK, LIM alan kinazı; RAC, Ras ile ilişkili C3 botulinum toksin substratı.
Yeni deneysel araçlar ilk kez, belirli devrelerin bu sinaptik plastisite formlarını ve hangi davranışsal anormallikleri gösterdiğini belirleyen artan hassasiyetle tanımlamayı mümkün kılıyor. Örneğin, tNAc'nin kabuk ve çekirdek alt bölgeleri, her bir alt bölgedeki D1'e karşı D2 tipi orta dikenli nöronlar gibi ilaca bağlı sinaptik plastisitede farklılıklar gösterir.60,63,64,67 Benzer şekilde, optogenetik deneyler, NAc'daki belirli glutamaterjik sinaps popülasyonlarında, örneğin, ventral subikulumdan (bazik çıkıştan bazolateral amigdalaya karşı gelenler), NAc'da belirli glutamaterjik sinaps popülasyonlarında, belirli bir sinaptik plastisite formuna (örn., LTD) katkı konusunda yeni bir bakış açısı sağlamıştır. Hipokampus68-70 Nihayetinde, kötüye kullanım ilaçlarının beynin devrelerini belirli yönlerini yönlendirmek için nasıl değiştirdiğinin tam bir anlayışını derlemek için, bu afferent nöronların her birinde ilaca bağlı moleküler adaptasyonları, postsinaptik dendritlerinde meydana gelen sinaps spesifik adaptasyonlarla kaplamak gerekli olacaktır bağımlılık durumu. Bu çaba, bugüne kadar çok az ilgi gören bir alan olan bu aynı beyin bölgelerindeki inhibe edici sinapslarda ilaç kaynaklı plastisitenin daha fazla değerlendirilmesini gerektirecektir.65
Tüm hücre plastisite
Uyuşturucu bağımlılığı olaylarındaki nöronlardaki nörofizyolojik değişimleri içeren araştırmaların çoğunluğu, öğrenme ve hafıza olaylarında olduğu gibi, sinaptik plastisiteye odaklanmış olmasına rağmen, tüm hücre plastisitesinin önemi için artan kanıtlar vardır. Bütün hücre plastisitesi, aynı zamanda homeostatik plastisite olarak da adlandırılır,71 Tüm sinir hücresinin kendine özgü uyarılma kabiliyetinde sinaps spesifik olmayan bir şekilde değişiklikler içerir. Uyuşturucu bağımlılığının belirli özelliklerinin, bir ilaca karşı arttırılmış veya azaltılmış duyarlılık içerdiği göz önüne alındığında, belirli sinir hücrelerinin arttırılmış veya azaltılmış elektriksel uyarılabilirliğinin bu davranışsal adaptasyonlara katkıda bulunduğu anlaşılmaktadır..5
The Kötüye kullanım ilacı için tüm hücre plastisitesinin en iyi örneklerinden biri, kronik afyonların, locus coeruleus'un (LC) noradrenerjik nöronlarının içsel uyarılabilirliğini arttırma kabiliyetidir.).72 Bu artan eksitabilite, CREB ve bununla birlikte belki de Na + kanallarının indüklenmesi yoluyla LC nöronlarının ateşlenmesini arttıran bazı adenilil siklaz izoformlarının indüklenmesine aracılık eder.72-75 LC nöronlarının bu hipereksitabilitesi, klasik bir tolerans ve bağımlılık mekanizmasını temsil eder ve opiat çekilmesinin bazı belirti ve semptomlarını yönlendirir. İlginç bir şekilde CREB, NAc ortamı dikenli nöronlarda benzer bir tam hücre plastisitesi formuna aracılık eder ve bu da CREB yoluyla kötüye kullanım ilaçlarına kronik maruz kalmayla aşırı derecede zorlaştırılabilir hale gelir.76 Bu nedenle, gelecekteki araştırmalarda NAB besiyerinde sivri nöronlarda CREB aracılı glutamaterjik sinapsların sinaptik plastisitesinin nasıl olduğunu anlamak kritik olacaktır.65,66 Bu nöronların CREB aracılı intrinsik hipereksitabilitesi olan özetler76 bağımlılığın davranış özelliklerini kontrol etmek.
Bağımlılık modellerinde bütün hücre plastisitesinin bir başka örneği, abusun opiat ilaçlarına kronik maruz kalmadan sonra ortaya çıkan VTA dopamin nöronlarının aşırı derecede stabilitesidir.ve (Şekil 4).77,78 Bu sinir hücrelerinde morfolojik değişikliklerle bağlantılı olan bu adaptasyon (bir sonraki bölüme bakınız), CREB'ye aracılık etmez, ancak bunun yerine aşağıda tarif edildiği gibi nörotrofik sinyalleşme kaskadlarının düzenlenmesiyle başarılır.

Ventral tegmental alanda (VTA) dopamin nöronlarında kronik morfine bağlı adaptasyonların çalışma modeli. Kronik morfin, VTA dopamin (DA) soma boyutunu azaltırken, nöronal eksitabiliteyi arttırırken, nükleus akumbensine dopamin iletimi azalır. Morfinin net etkisi daha az duyarlı bir ödül yolu, yani ödül toleransıdır. VTA'da IRS2-AKT sinyalinin aşağı regüle edilmesi, kronik morfinin soma büyüklüğü ve elektriksel uyarılabilirlik üzerindeki etkilerine aracılık eder; uyarılabilirlik üzerindeki etkiye, azalmış γ-aminobütirik asit (GABA) A akımları ve K 'kanal ifadesinin bastırılması aracılık eder.. VTA'daki mTORC2 aktivitesinin morfine bağlı aşağı regülasyonu, bu morfine bağlı morfolojik ve fizyolojik adaptasyonlar için olduğu kadar ödül toleransı için de çok önemlidir. MT0RC2’in aksine, kronik morfin, morfin kaynaklı uyarlamaları etkilemeyen mTORCI aktivitesini arttırır. BDNF, beyin kaynaklı nörotrofik faktör; IRS, insülin reseptörü maddesi; mTORC, mTOR kompleksi; AKT, protein kinaz B ref 77'ten üretildi
Morfolojik plastisite ve nörotrofik mekanizmalar
Hipokampal ve serebral kortikal nöronların çalışmalarından elde edilen kanıtların artması, sinaptik plastisitedeki değişikliklerin sinapslardaki morfolojik değişikliklerle ilişkili olduğunu göstermiştir. Örneğin, LTD ve sessiz sinapsların oluşumu ince ya da güdük dendritik dikenlerin oluşumu ile ilişkiliyken, LTP daha büyük, mantar şeklindeki dikenler ile ilişkilidir.79,80 Bu nedenle, uyuşturucu kullanımı alanının, 15 yıldan uzun süredir dendritik dikenlerde uyuşturucuya bağlı değişikliklere odaklanmış olması ilginçtir. Kronik maruz kalma Kötüye kullanımı teşvik edici ilaçlar, NAc'nin orta dikenli nöronlarının dendritik omurga yoğunluğunu arttırır, bu da Dl tipi nöronlar için baskın olan bir değişikliktir.67,81,82 Omurgaların uyarılması çoğu zaman bu ilaçlara karşı duyarlılaştırılmış davranışsal tepkilerle ilişkilendirilmiştir, ancak bazı kanıtlar bu görüşle çelişmektedir.
Bununla birlikte, sinaptik plastisite çalışmalarında olduğu gibi, bir ilacın kendi kendine tatbikatı, geri çekilmesi ve nüksetmesi sırasında meydana gelen dendritik dikenlerdeki değişiklikleri sistematik olarak tanımlamak için çok daha fazla çalışmaya ihtiyaç vardır. SAraştırmacı ve kendi kendine verilen ilacı içeren bugüne kadarki araştırmalar, farklı geri çekilme zaman noktalarında ve NAc kabuğunda çekirdek alt bölgelere karşı ortaya çıkan çok farklı omurga değişikliklerini önerir..83-86 Ayrıca, kokainin veya başka bir uyarıcının bu zamana bağlı ve hücre tipi spesifik etkileri ürettiği kesin moleküler mekanizmaları tanımlamak da önemli olacaktır. OsFosB'nin Dl tipi NAc nöronları üzerindeki olgunlaşmamış dikenlerin uyarılması için hem gerekli hem de yeterli olduğu gösterilmiştir..35,51,67 Bu düzenleme, aktin hücre iskeletinin yeniden düzenlenmesini kontrol ettiği bilinen bazı proteinlerin kokainin ve ΔFosB düzenlemesiyle birlikte gerçekleşir. Sadece bir örnek olarak, birkaç guanin nükleotid değişim faktörünün ve GTPase aktive edici proteinlerin transkripsiyonel regülasyonu, her bir kokaine maruz kalmada cevaben geçici düşüşler için küçük bir GTPaz olan Rac1'i ortaya çıkarmaktadır ve Rac1 aktivitesinde optojenetik kontrol kullanılarak bu tür pulsatil azalmalar gösterilmiştir. Rac1, olgunlaşmamış dikenlerin indüksiyonuna aracılık eder.87 Racl'nin bu etkileri, muhtemelen, aynı zamanda, omurga büyümesinin kokain düzenlemesine aracılık ettiği kanıtlanan kofilin ve diğer aktin düzenleyici proteinlerin kontrolü ile ortaya çıkar.87,88 Bununla birlikte, CDK5 (sikline bağımlı kinaz-5), CaMKII, NFkB dahil olmak üzere diğer birkaç proteinin de önemli bir rol oynadığı gösterildiğinden, bunun kokainin olgunlaşmamış dikenlerin düzenlenmesinde rol oynayan yalnızca bir yol olduğunu vurgulamak önemlidir. , MEF2, CREB, G9a ve DNMT3 (DNA metiltransf silme 3a).20,21,35,51,67,89,90 İlginç bir şekilde, CDK5, CaMKII ve NFkB'nin indüklenmesi ve G9a'nın baskılanması da dahil olmak üzere bu genlerin bazılarının kokain düzenlemesine de ΔFosB yoluyla aracılık edilir.20,35,51,91
Şaşırtıcı bir şekilde, opiat kötüye kullanım ilaçları tam tersi bir etki göstermektedir ve NAc orta dikenli nöronların dendritik omurga yoğunluğunu azaltır.81 Bu adaptasyonun davranışsal sonuçları ve ilgili moleküler mekanizmalar hakkında çok az şey bilinmektedir. Bu fenomen, Bununla birlikte, CREB ve ΔFosB'nin hem uyarıcılar hem de afyonlar tarafından uyarıldığı ve her ikisinin de NAc dendritik omurga yoğunluğunun uyarıcı aracılı indüksiyonunda yer alması şaşırtıcıdır.. Bu, opiatların bu faktörlerin indüklenmesine rağmen NAc omurga yoğunluğunu nasıl baskıladığı sorusunu gündeme getirmektedir.
Uyuşturucu bağımlılığı modellerinde görülen diğer bir önemli morfolojik plastisite şekli, kronik opiat uygulaması tarafından indüklenen VTA dopamin nöronlarının hücre soma boyutunda fiziksel azalmadır..77,92,93 Kannabinoidlere cevap olarak benzer bir adaptasyon meydana gelir.94 Opiat kendi kendine yönetimi ile oluşan VTA dopamin nöronlarının bu büzülmesi93 ve ölüm sonrası incelenen insan eroin bağımlılarında belgelenmiştir,77 ödül toleransına aracılık ediyor gibi görünüyor ve NAc'de düşük dopamin salınımı ile ilişkili. Şimdi önemli kanıtlar, hücre soma büyüklüğündeki bu azalmanın, bu nöronlar içindeki beyin kaynaklı nörotrofik faktör (BDNF) ifadesinin afyonla bastırılmasının aracılık ettiğini göstermektedir. Bu opiat ile indüklenen BDNF desteğinin ve VTA nöron büzülmesinin, VTA dopamin nöronlarındaki akış aşağı BDNF sinyal kaskadlarının azaltılmış aktivitesine, özellikle IRS2'in (insülin alıcısı substrat-2) aktivitesinin, AKT'nin (bir serin-treonin-akne) doğrudan bağlanmasını sağladık. kinaz) ve TORC2 (rapamisine duyarlı olmayan rapamisin-2 hedefi).77,93 Ayrıca, daha önce belirtildiği gibi, BDNF sinyalinin bu aşağı regülasyonunu doğrudan morfinin bu nöronlarda meydana getirdiği uyarılabilirlik düzeyine bağladık.77,78 Aslında, azalmış hücre soma büyüklüğü ve artan uyarılabilirlik, birinin endüksiyona yol açtığı ve bunun tersi olduğu için sıkıca birleştirilir. Hücre uyarılabilirliği üzerindeki bu kontrol, K'nın baskılanmasını içerir.+ kanalları ve GABA’nınA Bu nöronlarda mevcut.
BDNF'nin VTA düzeyindeki morfin tepkilerini kontrol etmedeki rolü, kokain ve diğer uyarıcıların etkilerine çok farklı katılımı ile çelişmektedir. Uyarıcılar, BDNF'nin artan yerel sentezinin yanı sıra birkaç afferent bölgesinden artan salım nedeniyle bir etki olan NAc'ye BDNF sinyalini indükler.95 Dahası, NAc'de, ancak VTA'da olmayan BDNF sinyallerinin artmasının, kendi ilaçları dahil olmak üzere, bu ilaçların davranışsal etkilerini arttırdığı gösterilmiştir.95,96 Uyarıcılara karşı VTA-NAc yolunda BDNF sinyallemesinin zıt düzenlemesi, bu tür farklılıkların ilaçların NAc dendritik dikenlerin zıt düzenlemesine aracılık etme olasılığını ortaya çıkarmaktadır; bu, şu anda araştırılmaktadır.
Gelecekteki yönlendirmeler
Yukarıdaki anlatı, bir kötüye kullanım ilacına tekrar tekrar maruz kalmaya yanıt olarak beyin ödül bölgelerinde meydana gelen moleküler ve hücresel adaptasyonları anlamada ve hayvan modellerinde bağımlılık sendromlarının belirli davranış özelliklerine bireysel adaptasyonları ilişkilendirme konusunda yapılan muazzam ilerlemeleri vurgulamaktadır. . Bu gelişmelere rağmen, büyük sorular devam etmektedir. Mevcut bilgimizin çoğu VTA ve NAc'a odaklanır ve uyuşturucu bağımlılığı için de önemli olan diğer önemli limbik beyin bölgeleri hakkında daha az bilgi bulunur. Ek olarak, uyuşturucuya bağlı bir davranışta bir moleküler hücresel adaptasyonun nedensel rolünün tüm deneysel gösterimleri, bireysel uyarlamaları birer birer manipüle etmiştir. Çok sayıda uyarlamayı aynı anda manipüle etmek açıkça çok daha zordur, ancak aynı zamanda zorunludur, çünkü ilaçların bireysel nöronlar dahilinde bile davranışları etkilemenin karmaşık yollardan toplanmasına neden olan çok sayıda farklı türde değişiklik ürettiğini biliyoruz. Böyle bir sistem biyolojisi yaklaşımı, bağımlılığın biyolojik temellerini nihayetinde kırmak için çok önemli olacaktır. Son olarak, bağımlılıkla ilgili hatıraların moleküler-hücresel mekanizmalarını anlama çabaları kendilerini davranışsal hafızanın biyolojik temelini anlamak için tüm diğer çabaların şimdi mücadele ettiği noktada bulur: biyolojik olayları karmaşık davranış hafızası ile ilişkilendirme yeteneğimiz son derece zor. Bu bölünmenin üstesinden gelmek, sinirbilimlerindeki belki de en büyük zorluğu temsil ediyor.
Teşekkürler
Bu çalışma, Ulusal Uyuşturucu Bağımlılığı Enstitüsünden alınan bağışlarla desteklenmiştir.
Seçilmiş kısaltmalar ve kısaltmalar
- Nac
- çekirdek accumbens
- CREB
- cAMP tepki elemanı bağlayıcı protein
- ΔFosB
- Fos ailesi transkripsiyon faktörü
- VTA
- ventral tegmental alan
- AMPA
- a-amino-3-hidroksi-5-metil-4-izoksazolepropiyonik asit
- LTD
- uzun vadeli depresyon
- LTP
- uzun süreli bozulma
- BDNF
- beyinden türetilen nörotropik faktör
- NKkB
- nükleer faktör kB
REFERANSLAR