Dialogue Clin Neurosci. 2013 Dec;15(4):431-43.
Abstract
Ten spyte van die belangrikheid van talle psigososiale faktore, behels dwelmverslawing in sy kern 'n biologiese proses: die vermoë van herhaalde blootstelling aan 'n dwelmmiddel om veranderinge in 'n kwesbare brein te veroorsaak wat die kompulsiewe soek en neem van dwelms dryf, en verlies aan beheer oor dwelmgebruik, wat 'n toestand van verslawing definieer. Hier hersien ons die tipes molekulêre en sellulêre aanpassings wat in spesifieke breinstreke voorkom om verslawing-geassosieerde gedragsafwykings te bemiddel. Dit sluit in veranderinge in geenuitdrukking wat deels bereik word via epigenetiese meganismes, plastisiteit in die neurofisiologiese funksionering van neurone en sinapse, en gepaardgaande plastisiteit in neuronale en sinaptiese morfologie wat deels deur veranderde neurotrofiese faktorsein bemiddel word. Elkeen van hierdie tipe dwelm-geïnduseerde modifikasies kan beskou word as 'n vorm van "sellulêre of molekulêre geheue." Boonop is dit opvallend dat die meeste verslawingverwante vorme van plastisiteit baie soortgelyk is aan die tipes plastisiteit wat met meer klassieke vorme van "gedragsgeheue" geassosieer is, wat miskien die eindige repertorium van aanpasbare meganismes wat beskikbaar is aan neurone weerspieël wanneer hulle met die omgewing gekonfronteer word. uitdagings. Laastens behels verslawingverwante molekulêre en sellulêre aanpassings die meeste van dieselfde breinstreke wat meer klassieke vorme van geheue bemiddel, in ooreenstemming met die siening dat abnormale herinneringe belangrike drywers van verslawingsindroom is. Die doel van hierdie studies wat daarop gemik is om die molekulêre en sellulêre basis van dwelmverslawing te verduidelik, is om uiteindelik biologies-gebaseerde diagnostiese toetse te ontwikkel, sowel as meer effektiewe behandelings vir verslawingsversteurings.
Inleiding
Dwelmverslawing, wat gedefinieer kan word as die kompulsiewe soek en neem van dwelms ten spyte van verskriklike gevolge of verlies van beheer oor dwelmgebruik, word veroorsaak deur langdurige dwelm-geïnduseerde veranderinge wat in sekere breinstreke plaasvind.1 Slegs sommige individue swig egter aan verslawing in die lig van herhaalde dwelmblootstelling, terwyl ander in staat is om 'n dwelm terloops te gebruik en 'n verslawingsindroom te ontsnap. Genetiese faktore is verantwoordelik vir ongeveer 50% van hierdie individuele variasie in verslawingskwesbaarheid, en hierdie mate van oorerflikheid geld vir alle groot klasse verslawende middels, insluitend stimulante, opiate, alkohol, nikotien en cannabinoïede.2 Dit was nog nie moontlik om die meeste van die gene wat hierdie genetiese risiko uitmaak, te identifiseer nie, waarskynlik as gevolg van die betrokkenheid van miskien honderde genetiese variasies wat in 'n enkele individu opgesom word om verslawingkwesbaarheid (of, in ander individue, weerstand) te verleen.
Die ander 50% van die risiko vir verslawing is te wyte aan 'n magdom omgewingsfaktore, wat deur 'n leeftyd voorkom, wat in wisselwerking is met 'n individu se genetiese samestelling om hom of haar kwesbaar te maak vir verslawing in 'n mindere of meerdere mate. Verskeie tipes omgewingsfaktore is by verslawing betrokke, insluitend psigososiale stres, maar verreweg die kragtigste faktor is blootstelling aan 'n dwelmmiddel self. Daar is getoon dat sekere "poort"-middels, veral nikotien, 'n mens se kwesbaarheid vir 'n verslawing aan 'n ander dwelm verhoog.3 Boonop is daar toenemende bewyse dat, ten spyte van 'n reeks genetiese risiko's vir verslawing oor die hele bevolking, blootstelling aan voldoende hoë dosisse van 'n dwelm vir lang tydperke iemand wat 'n relatief laer genetiese lading het in 'n verslaafde kan verander..4
Groot vordering is gemaak oor die afgelope twee dekades in die identifisering van beide die diskrete streke van die brein wat belangrik is in die bemiddeling van 'n verslawingsindroom, sowel as die tipe veranderinge op die molekulêre en sellulêre vlakke wat dwelms in hierdie streke veroorsaak om sleutelaspekte te onderlê. van verslawing.1,5 Die stroombaan wat die meeste aandag geniet het, word na verwys as die mesolimbiese dopamienstelsel, wat dopamienneurone in die ventrale tegmentale area (VTA) van die middelbrein behels wat medium stekelrige neurone in die nucleus accumbens (NAc, 'n deel van ventrale striatum) innerverend. Hierdie VTA-neurone innerveer ook baie ander voorbreinstreke, insluitend hippokampus, amigdala en prefrontale korteks (PFC).
Dit maak sin om hierdie dwelm-geïnduseerde verslawingmeganismes in hierdie volume oor geheue te oorweeg vir drie oorvleuelende redes.6
- Eerstens kan alle dwelm-geïnduseerde aanpassings gesien word as tipes "molekulêre of sellulêre geheue:" die senuweesel wat sulke veranderinge ondergaan is anders as gevolg van dwelmblootstelling en reageer dus verskillend op daardie selfde geneesmiddel, na ander dwelms, of aan 'n magdom ander stimuli as gevolg daarvan.
- Tweedens is dit interessant dat baie, miskien die meeste, van die tipe veranderinge wat met 'n toestand van verslawing geassosieer is (bv. veranderde geentranskripsie, epigenetika, sinaptiese en heelselplastisiteit, en neuronale morfologie en neurotrofiese meganismes) word ook geïmpliseer in tradisionele vorme van "gedragsgeheue" soos onder andere ruimtelike geheue, vreeskondisionering en operante kondisionering.
- Derdens, onder die breinstreke wat deur dwelmmiddels geraak word, is dié wat sleutel neurale substrate vir gedragsgeheue is, insluitend hippokampus, amigdala en PFC. Dit val saam met die toenemende besef dat sommige van die belangrikste kenmerke van verslawing wat klinies gesien word (bv. dwelm-drang en terugval) abnormaliteite in tradisionele geheuekringe weerspieël, met langtermynherinneringe van die dwelmervaring wat as kragtige drywers van verslawingpatologie dien.4,7,8 Omgekeerd beïnvloed die brein se beloningstreke (bv. VTA en NAc) gedragsgeheue kragtig.
Hierdie artikel bied 'n oorsig van die belangrikste tipes molekulêre en sellulêre veranderinge wat in verskeie breinstreke in dieremodelle van verslawing voorkom, en konsentreer op die nucleus accumbens waarvoor die meeste inligting tans beskikbaar is. Dit is belangrik dat dit toenemend moontlik was om sommige van hierdie veranderinge in menslike verslaafdes te bekragtig op grond van studies van nadoodse breine. Ten spyte van die feit dat dwelmmiddels verskillende chemiese strukture het en op verskillende proteïenteikens inwerk, is dit opvallend dat baie prominente verslawingverwante aanpassings algemeen is vir baie, en in sommige gevalle almal, dwelmmiddels en waarskynlik bydra tot gedeelde kenmerke van 'n verslawing sindroom.4,9 Daarteenoor is baie ander dwelm-geïnduseerde aanpassings spesifiek vir 'n gegewe dwelm en kan meer unieke aspekte van 'n gegewe verslawing bemiddel. Ons fokus hier op stimulante en opiaatmiddels van misbruik, wat meer dramatiese effekte in diermodelle lewer in vergelyking met ander dwelms. Ons beklemtoon ook belangrike gebiede vir toekomstige navorsing wat ons kennis van verslawingsindroom verder sal verhoog en hierdie vooruitgang sal vertaal in verbeterde diagnostiese toetse en behandelings.
Transkripsionele en epigenetiese meganismes
Die wete dat verslaafdes 'n groter risiko vir terugval kan bly ondanks jare van onthouding, beteken dat verslawing dwelm-geïnduseerde veranderinge in die brein behels wat baie stabiel kan wees. Dit het daartoe gelei dat verskeie groepe veranderinge in geenuitdrukking as 'n belangrike komponent van die verslawingsproses oorweeg het (Figuur 1). Gevolglik, studies van kandidaatgene of genoomwye ondersoeke wat DNA-mikroskikkings en meer onlangs RNA-volgorde (hoë-deurset-volgordebepaling van uitgedrukte RNA's) behels het talle gene geïdentifiseer waarvan die uitdrukking in 'n gegewe breinstreek in knaagdier- en primaatmodelle van verslawing en in menslike verslaafdes verander word (bv. verwysings 10-17). Voorbeelde van sulke gene word in die volgende afdelings van hierdie oorsig bespreek.
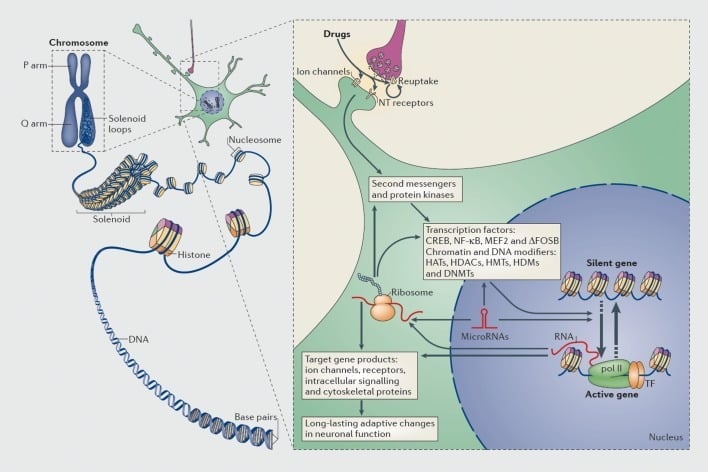
Meganismes van transkripsionele en epigenetiese regulering deur dwelmmiddels. In eukariotiese selle word DNS georganiseer deur om histoon-oktomere te draai om nukleosome te vorm, wat dan verder georganiseer en gekondenseer word om chromosome te vorm (linkerdeel). Slegs deur die tydelike ontrafeling van gekompakteerde chromatien kan die DNA van 'n spesifieke geen toeganklik gemaak word vir die transkripsionele masjinerie. Dwelms van misbruik werk deur sinaptiese teikens soos heropnamemeganismes, ioonkanale en neurotransmitter (NT) reseptore om intrasellulêre seinkaskades (regter deel) te verander. Dit lei tot die aktivering of inhibisie van transkripsiefaktore (TF's) en van baie ander kernteikens, insluitend chromatienregulerende proteïene (getoon deur dik pyle); die gedetailleerde meganismes betrokke by die sinaptiese regulering van chromatien-regulerende proteïene bly swak verstaan. Hierdie prosesse lei uiteindelik tot die induksie of onderdrukking van bepaalde gene, insluitend dié vir niekoderende RNAs soos mikroRNAs; veranderde uitdrukking van sommige van hierdie gene kan op sy beurt geentranskripsie verder reguleer. Daar word voorgestel dat sommige van hierdie dwelm-geïnduseerde veranderinge op die chromatienvlak uiters stabiel is en daardeur die langdurige gedrag onderlê wat verslawing definieer. CREB, sikliese AMP-responsiewe element bindende proteïen; DNMT's, DNA-metieltransferases; HAT'e, histoon-asetieltransferases; HDAC's, histoon deacetilases; HDM's, histoondemetielases; HMT's, histoonmetieltransferases; MEF2, miosiet-spesifieke versterker faktor 2; NF-kB, kernfaktor-KB; pol II, RNA-polimerase II. Weergegee vanaf ref 44: Robison AJ, Nestler EJ. Transkripsionele en epigenetiese meganismes van verslawing. Nat Rev Neurosci. 2011 ;12:623-637.
Net so is baie tipes transkripsiefaktore - proteïene wat aan regulatoriese streke van gene bind en daardeur die transkripsie van daardie gene verhoog of verminder - geïmpliseer in die bemiddeling van die langtermyn-effekte van dwelmmisbruik op geenuitdrukking in die brein. Prominente voorbeelde sluit in CREB (cAMP respons element bindende proteïen), ΔFosB ('n Fos familie transkripsie faktor), NFkB (kern faktor kB), MEF2 (miosiet versterkende faktor-2), en glukokortikoïed reseptore, onder verskeie ander.5,10,18-22 Dit is toenemend moontlik om die sellulêre seinweë te verstaan waardeur dwelmmiddels 'n gegewe transkripsiefaktor in die brein aktiveer en om so 'n aktivering oorsaaklik te koppel aan daardie transkripsiefaktor se teikengene en aan spesifieke gedragsaspekte van verslawing (sien Figuur 1). Hierdie vordering word geïllustreer deur oorweging van CREB en ΔFosB, wat die beste bestudeerde transkripsiefaktore in verslawingsmodelle is.
cAMP Response element bindende proteïen
Stimulante en opiaatmiddels van misbruik aktiveer CREB in verskeie breinstreke wat belangrik is vir verslawing, insluitend prominent in die NAc.23,24 Dit is bekend dat CREB in ander stelsels geaktiveer word deur cAMP, Ca2+en groeifaktor-paaie,25 en dit is nog nie bekend watter van hierdie die aktivering daarvan in NAc deur middel van misbruik bemiddel nie. Daar is getoon dat geneesmiddelaktivering van CREB in NAc 'n klassieke negatiewe terugvoermeganisme verteenwoordig, waardeur CREB dien om 'n dier se sensitiwiteit vir die lonende effekte van hierdie middels (verdraagsaamheid) te verminder en om 'n negatiewe emosionele toestand tydens dwelmonttrekking (afhanklikheid) te bemiddel..18,26,27 Daar is onlangs getoon dat hierdie effekte verhoogde dwelm self-administrasie en terugval aandryf, vermoedelik deur 'n proses van negatiewe versterking.28 Hierdie aksies van CREB blyk beide hoofsubtipes van NAc medium stekelrige neurone te betrek, dié wat hoofsaaklik D uitdruk.1 teenoor D2 dopamienreseptore.24 IInteressant genoeg het 'n groot hoeveelheid literatuur getoon dat CREB, wat in hippokampus en amygdala optree, 'n sleutelmolekule in gedragsgeheue is.29-31 Hierdie breë rol in verslawing en gedragsgeheue weerspieël waarskynlik die feit dat neurone deurdrenk is van 'n eindige aantal molekulêre meganismes waarmee hulle by 'n voortdurend veranderende omgewing kan aanpas.
Teikengene vir CREB wat hierdie gedragsfenotipe bemiddel, is geïdentifiseer deur genoomwye toetse sowel as meer geselekteerde pogings.10,18,32 Een voorbeeld is die opioïed peptied dynorfien: stimulant induksie van dynorfien uitdrukking in NAc neurone, bemiddel via CREB, verhoog dynorfienaktivering van k opioïedreseptore op VTA dopamienneurone en onderdruk daardeur dopaminerge transmissie na die NAc en benadeel beloning.18 Daar is getoon dat verskeie ander CREB-teikens belangrik is vir dwelm-geïnduseerde sinaptiese plastisiteit, soos hieronder bespreek. Terwyl CREB ook in verskeie ander breinstreke geaktiveer word deur stimulante en opiate,23,24 minder is bekend oor die gedragsgevolge van hierdie effek en die teikengene waardeur dit voorkom. Net so is minder bekend oor CREB se rol in die bemiddeling van die optrede van ander dwelmmiddels.19
ΔFosB
Akute blootstelling aan feitlik enige dwelmmiddel veroorsaak alle Fos-familie transkripsiefaktore in NAc en verskeie ander breinstreke. Hierdie induksie is vinnig, maar ook hoogs verbygaande, met Fos-proteïenvlakke wat binne 8 tot 12 uur na normaal terugkeer. Uniek onder hierdie Fos-familieproteïene is ΔFosB, 'n afgeknotte produk van die FosB-geen, wat as gevolg van sy ongewone stabiliteit, geleidelik ophoop deur 'n kursus van herhaalde geneesmiddelblootstelling en word die oorheersende Fos-proteïen wat onder hierdie toestande uitgedruk word.22,33 Verder, as gevolg van hierdie stabiliteit, bly vlakke van ΔFosB vir weke na geneesmiddelonttrekking voort. Sulke chroniese induksie van ΔFosB is gedemonstreer vir feitlik alle dwelmmiddels34 en, vir die meeste dwelms, is dit selektief vir Dl-tipe NAc neurone.34,35 Dit was ook gedemonstreer in menslike verslaafdes.35 'n Groot hoeveelheid literatuur het getoon dat sulke ΔFosB-induksie in D1-tipe NAc neurone verhoog 'n dier se sensitiwiteit vir dwelms sowel as natuurlike belonings en bevorder dwelm self-administrasie, vermoedelik deur 'n proses van positiewe versterking (sien verwysings 34 tot 38). Interessant genoeg is dwelminduksie van ΔFosB in NAc meer dramaties in adolessente diere, 'n tyd van groter kwesbaarheid vir verslawing,39 en die induksie daarvan deur nikotien is getoon om nikotien se gateway-agtige verbetering van kokaïenbeloning te bemiddel.40
Wat CREB betref, is talle teikengene vir ΔFosB in NAc geïdentifiseer deur gebruik te maak van kandidaatgeen en genoomwye benaderings.10,32 Terwyl CREB dynorfien induseer, onderdruk ΔFosB dit, wat bydra tot ΔFosB se pro-beloningseffekte.38 Nog 'n ΔFosB-teiken is cFos: soos ΔFosB ophoop met herhaalde geneesmiddelblootstelling, onderdruk dit c-Fos en dra by tot die molekulêre skakelaar waardeur ΔFosB selektief geïnduseer word in die chroniese geneesmiddelbehandelde toestand.41 Daar is getoon dat baie ander ΔFosB-teikens die vermoë van sekere dwelmmiddels bemiddel om sinaptiese plastisiteit in die NAc en gepaardgaande veranderinge in die dendritiese arborisering van NAc-medium stekelrige neurone te bewerkstellig, soos hieronder bespreek sal word.
Die funksionele gevolge van ΔFosB-induksie in ander breinstreke word minder goed verstaan, hoewel die induksie daarvan in orbitofrontale korteks (OFC) in 'n mate bestudeer is. Hier bemiddel ΔFosB verdraagsaamheid wat voorkom vir die kognitief-ontwrigtende effekte van kokaïen tydens 'n kursus van chroniese blootstelling, en hierdie aanpassing word geassosieer met verhoogde kokaïen-selfadministrasie.42,43
Genoomwye toetse het verskeie potensiële teikengene voorgestel wat hierdie effekte bemiddel.42 Ten spyte van ΔFosB se unieke tydelike eienskappe, en die wete dat dit in tradisionele geheuekringe (bv. hippokampus) geïnduseer word, was daar nog nie 'n verkenning van die rol van ΔFosB in gedragsgeheue nie, 'n interessante onderwerp vir toekomstige navorsing.
Epigenetiese meganismes
In meer onlangse jare is studies van transkripsie een stap verder na epigenetika gestoot44 (Sien Figuur 1), wat breedweg gedefinieer kan word as 'n verandering in geenuitdrukking wat plaasvind in die afwesigheid van 'n verandering in DNS-volgorde. Epigenetiese meganismes beheer die verpakking van DNA binne 'n selkern via sy interaksies met histone en baie ander tipes kernproteïene, wat saam chromatien uitmaak. Geenuitdrukking word beheer deur die toestand van hierdie verpakking deur die kovalente modifikasie van histone, ander proteïene en DNA self. As slegs 'n paar voorbeelde, asetilering van histone is geneig om geenaktivering te bevorder, metilering van histone kan óf geenaktivering óf onderdrukking bevorder afhangende van die Lys-residu wat hierdie modifikasie ondergaan, en metilering van DNA word oor die algemeen geassosieer met geen-onderdrukking alhoewel sekere variante vorme van metilering ( bv. 5-hidroksimielering) kan met geenaktivering geassosieer word.
Epigenetika is 'n aantreklike meganisme, want in ander stelsels, byvoorbeeld ontwikkelings- en kankerbiologie, kan sekere epigenetiese modifikasies permanent wees. Vir hierdie rede, epigenetika is nagestreef in beide leer- en geheuemodelle (bv. refs 45-48) sowel as in verslawing;44,49 in beide sisteme is ingrypende veranderinge in histoon-asetilering en -metilering en in DNA-metilering aangemeld. As slegs een voorbeeld, is die histoonmetieltransferase, G9a, in beide geheue geïmpliseer50 en verslawing.51,52 In verslawing modelle, G9a uitdrukking is afgereguleer in NAc in reaksie op stimulante of opiaatmiddels van misbruik en tDaar is getoon dat dit die lonende uitwerking van hierdie middels verbeter.51,52 Interessant genoeg word kokaïenonderdrukking van G9a deur ΔFosB bemiddel. G9a kataliseer die dimetielering van Lys9 van histoon H3 (H3K9me2), 'n belangrike bemiddelaar van geenonderdrukking. ChIP-chip of ChIP-seq (chromatien-immunopresipitasie, onderskeidelik gevolg deur promotorskyfies of hoë-deurset-volgordebepaling) is gebruik om genoomwye kaarte van die gene in NAc te verkry wat veranderde H3K9me2 vertoon na blootstelling aan stimulante of opiaat.32,52,53 Deur hierdie geenlyste te oorvleuel met genoomwye lyste van geenuitdrukkingveranderinge, en met genoomwye kaarte van baie ander vorme van epigenetiese modifikasies (bv. ΔFosB-binding, CREB-binding, ander histoonmodifikasies, ens.),32,53 dit behoort moontlik te wees om 'n toenemend volledige stel gene te identifiseer wat deur dwelmmiddels gereguleer word en om die onderliggende epigenetiese meganismes wat betrokke is te verstaan.
Nog 'n vorm van epigenetiese regulering wat by geheue en verslawing betrokke is, is die generering van mikroRNA's. Hierdie klein, nie-koderende RNA's bind aan komplementêre streke van mRNA's en onderdruk daardeur hul translasie of veroorsaak hul degradasie. Die verwydering van Argonaut, 'n proteïen wat noodsaaklik is vir die verwerking van miRNA's, verander gedragsreaksies op kokaïen, met duidelike effekte waargeneem vir D1- teenoor D2-tipe medium stekelrige neurone.54 Verskeie spesifieke miRNAs is eweneens getoon om gereguleer te word deur dwelmblootstelling en op sy beurt gedragsreaksies op die dwelms te beïnvloed (bv. refs 55,56). Dit sal opwindend wees in toekomstige studies om die mRNA-teikens van hierdie miRNAs te identifiseer en te karakteriseer hoe hulle die verslawingsproses beïnvloed.
Sinaptiese plastisiteit
Dieselfde algemene tipes sinaptiese modifikasies by glutamatergiese sinapse, wat by hippokampus en amygdala in gedragsgeheue geïmpliseer is (sien ander artikels in hierdie uitgawe), is insgelyks getoon dat dit in breinbeloningstreke in verslawingsmodelle voorkom en belangrik is in bemiddeling die verslawingsproses.57,58 Sulke dwelm-geïnduseerde sinaptiese plastisiteit is in verskeie breinstreke beskryf, maar ons konsentreer hier op NAc waar die meeste van die navorsing tot dusver gefokus het (Figuur 2).
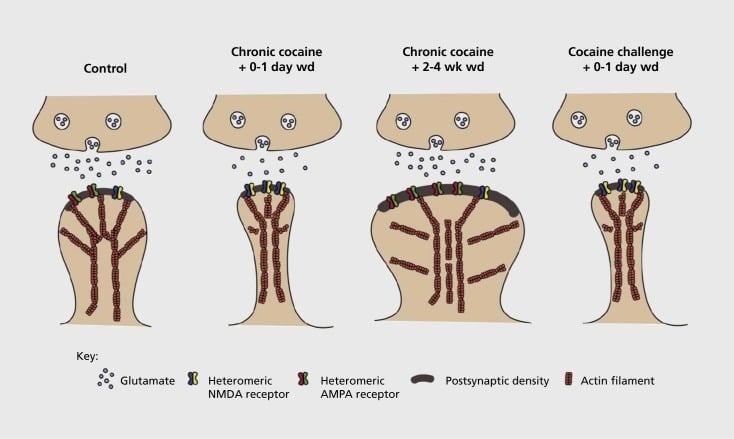
Model van verslawingverwante sinaptiese en strukturele plastisiteit in nucleus accumbens (NAc). Chroniese blootstelling aan kokaïen lei tot 'n tydafhanklike en verbygaande herorganisasie van α-amino-3-hidroksi-5-metiel-4-isoksasoolpropionzuur (AMPA) en N-metiel-D-asparaginesuur (NMDA) glutamaatreseptore by NAc-medium spiny neuron (MSN) sinapse, sowel as strukturele veranderinge in die ruggraat kop van NAc MSNs wat korreleer met verskillende vorme van sinaptiese plastisiteit. Chroniese kokaïen veroorsaak byvoorbeeld oppervlakuitdrukking van NMDA-reseptore, stille sinapsvorming en langtermyndepressie (LTD) by vroeë onttrekkingstydpunte. Tydens meer langdurige onttrekking (wd), keer hierdie sinaptiese veranderinge om met die gevolg dat verhoogde uitdrukking van oppervlak AMPA-reseptore, 'n konsolidasie van die sinaps in 'n sampioenvormige ruggraat en langtermyn potensiasie (LTP) is. Hierdie effekte keer vinnig weer terug na blootstelling aan 'n uitdagingsdosis kokaïen wat lei tot die herstrukturering van die ruggraat in dun stekels en 'n depressie van sinaptiese krag.
Aanvanklike eksperimente het getoon dat herhaalde blootstelling aan stimulante dwelms van misbruik 'n LTD (langtermyn depressie)-agtige toestand by glutamatergiese sinapse in die NAc veroorsaak.59 Meer onlangse werk het egter getoon dat sulke plastisiteit hoogs tydafhanklik is, met LTD wat vroeg ná die laaste kokaïenblootstelling plaasgevind het, wat ontwikkel het na 'n meer van 'n LTP (langtermyn potensiasie)-agtige toestand na langer onttrekkingstydpunte.60,61 Hierdie werk, wat tot op hede hoofsaaklik uitgevoer is deur middel van ondersoeker toegediende - in teenstelling met self-toegediende - dwelms, het die behoefte gedefinieer vir meer sistematiese ondersoeke in selfadministrasiemodelle wat die vorme van sinaptiese plastisiteit naspoor wat by glutamatergiese sinapse voorkom. NAc oor 'n gedetailleerde tydsverloop vanaf die verkryging van selfadministrasie tot die instandhouding daarvan, deur verskillende tye van onttrekking en uitsterwing, en in reaksie op stimuli wat terugval oproep. Werk tot op hede het ook sommige van die molekulêre meganismes gedefinieer wat bydra tot hierdie dwelm-geïnduseerde sinaptiese plastisiteit, insluitend die verhandeling van AMPA-reseptore na die sinaps wat miskien gedeeltelik deur CaMKII (Ca) bemiddel word.2+/kalmodulien-afhanklike proteïenkinase II) fosforilering van sekere AMPA-reseptorsubeenhede sowel as veranderde uitdrukking van AMPA-reseptorsubeenhede (bv. 60,62-65, Syfers 2 en 3). 'n Rol vir CREB en ΔFosB is by hierdie verskynsels geïmpliseer, sowel as in gepaardgaande veranderinge in die morfologie van glutamatergiese sinapse (sien hieronder). GluAl is byvoorbeeld 'n teiken vir CREB in NAc, waar GluA2 en CaMKII beide teikens van ΔFosB is, in hierdie breinstreek .35,36,66,67 Om vorentoe te beweeg, sal dit belangrik wees om spesifieke aanpassings te koppel aan tydafhanklike veranderinge in sinaptiese funksie en gedragskenmerke van verslawing.
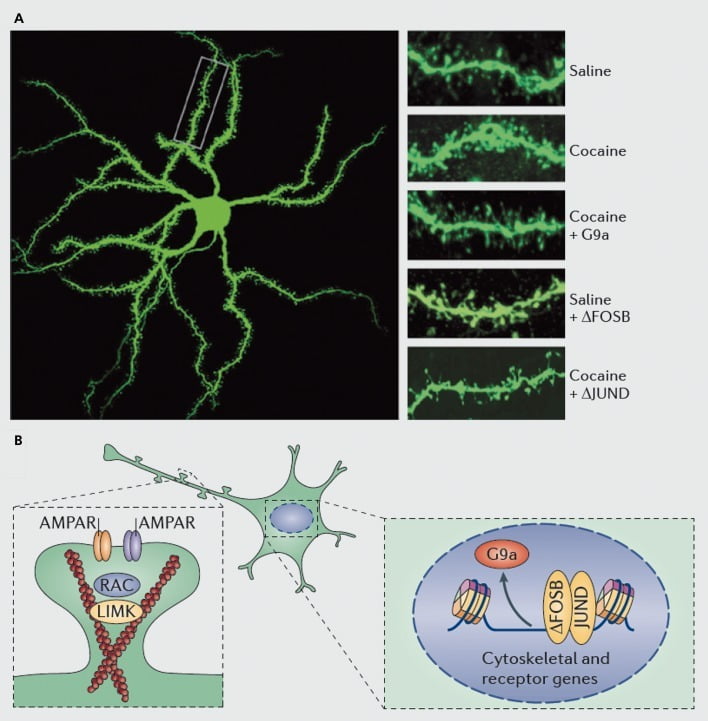
Molekulêre meganismes onderliggend aan kokaïeninduksie van dendritiese stekels op nucleus accumbens (NAc) medium stekelrige neurone. A) toon kokaïen-geïnduseerde toenames in dendritiese ruggraatgetal wat geblokkeer kan word deur virale ooruitdrukking van G9a of JunD ('n antagonis van AP1-gemedieerde transkripsie), of nageboots deur virale ooruitdrukking van FosB. B) Regulering van AMPA-reseptor (AMPAR)-handel en van die aktien-sitoskelet (links), sowel as regulering van die transkripsie van glutamaatreseptore en aktien-regulerende proteïene (bv. soos bemiddel via ΔFosB, regs) is getoon om belangrike rolle te speel in die bemiddeling van kokaïen se regulering van NAc dendritiese ruggraatdigtheid. UMK, LIM domein kinase; RAC, Ras-verwante C3 botulinum toksien substraat.
Nuwe eksperimentele instrumente maak dit vir die eerste keer moontlik om met toenemende akkuraatheid te definieer watter spesifieke stroombane hierdie vorme van sinaptiese plastisiteit vertoon en watter gedragsabnormaliteite hulle bemiddel. Byvoorbeeld, tDie dop- en kernsubstreke van NAc vertoon verskille in dwelm-geïnduseerde sinaptiese plastisiteit, net soos D1- teenoor D2-tipe medium stekelrige neurone binne elke substreek.60,63,64,67 Optogenetiese eksperimente het eweneens nuwe insig verskaf in die bydrae van 'n bepaalde vorm van sinaptiese plastisiteit (bv. LTD) by spesifieke populasies van glutamatergiese sinapse in NAc, byvoorbeeld dié wat voortspruit uit mediale PFC versus basolaterale amygdala versus ventrale subikulum (die belangrikste uitset). van die hippokampus).68-70 Uiteindelik sal dit nodig wees om dwelm-geïnduseerde molekulêre aanpassings in elk van hierdie afferente neurone te bedek met sinaps-spesifieke aanpassings wat in hul postsinaptiese dendriete voorkom om 'n volledige begrip saam te stel van hoe dwelmmiddels die brein se stroombaan verander om bepaalde aspekte van die verslaafde staat. Hierdie poging sal 'n groter waardering vereis van dwelm-geïnduseerde plastisiteit by inhiberende sinapse binne dieselfde breinstreke, 'n gebied wat tot dusver baie min aandag geniet het.65
Heelselplastisiteit
Terwyl die meerderheid navorsing wat neurofisiologiese veranderinge in neurone in dwelmmisbruikverskynsels behels, soos in leer- en geheueverskynsels, op sinaptiese plastisiteit gefokus het, is daar ook toenemende bewyse vir die belangrikheid van heelselplastisiteit. Heelselplastisiteit, ook na verwys as homeostatiese plastisiteit,71 behels veranderinge in die intrinsieke prikkelbaarheid van 'n hele senuweesel op 'n wyse dat dit nie sinaps-spesifiek is nie. Aangesien sekere kenmerke van dwelmverslawing verhoogde of verminderde sensitiwiteit vir 'n dwelm behels, maak dit sin dat verhoogde of verminderde elektriese prikkelbaarheid van sekere senuweeselle bydra tot hierdie gedragsaanpassings.5
Die beste gevestigde voorbeeld van heelselplastisiteit vir 'n dwelmmiddel is die vermoë van chroniese opiate om die intrinsieke prikkelbaarheid van noradrenerge neurone van die locus coeruleus (LC) te verhoog.).72 Hierdie verhoogde prikkelbaarheid word bemiddel via CREB en sy induksie van sekere isovorme van adenielsiklase, wat verhoogde afvuur van LC neurone dryf, miskien deur die induksie van Na+ kanale.72-75 Hierdie hiperprikkelbaarheid van LC-neurone verteenwoordig 'n klassieke meganisme van verdraagsaamheid en afhanklikheid en dryf sommige van die tekens en simptome van opiaatonttrekking aan. Interessant genoeg bemiddel CREB 'n soortgelyke vorm van heelselplastisiteit in NAc-medium stekelrige neurone, wat ook hiperprikkelbaar gemaak word deur chroniese blootstelling aan dwelmmiddels via CREB.76 Dit sal dus van kritieke belang wees in toekomstige ondersoeke om te verstaan hoe CREB-gemedieerde sinaptiese plastisiteit van glutamatergiese sinapse op NAc medium stekelrige neurone65,66 som op met CREB-gemedieerde intrinsieke hiperprikkelbaarheid van hierdie neurone76 om gedragskenmerke van verslawing te beheer.
Nog 'n voorbeeld van heelselplastisiteit in verslawingsmodelle is die hiperprikkelbaarheid van VTA dopamienneurone wat plaasvind na chroniese blootstelling aan opiaatmiddels van misbruiken (Figuur 4).77,78 Hierdie aanpassing, wat gekoppel is aan morfologiese veranderinge in hierdie senuweeselle (sien volgende afdeling), word nie deur CREB bemiddel nie, maar word eerder bereik deur regulering van neurotrofiese seinkaskades, soos hieronder beskryf.

Werksmodel van chroniese morfien-geïnduseerde aanpassings in ventrale tegmentale area (VTA) dopamienneurone. Chroniese morfien verminder VTA dopamien (DA) soma-grootte, maar verhoog neuronale prikkelbaarheid, terwyl dopamienoordrag na die nucleus accumbens verminder word. Die netto effek van morfien is 'n minder responsiewe beloningsweg, dit wil sê, beloningverdraagsaamheid. Afregulering van IRS2-AKT sein in VTA bemiddel die effekte van chroniese morfien op soma grootte en elektriese prikkelbaarheid; die effek op prikkelbaarheid word bemiddel deur verminderde γ-aminobottersuur (GABA)A-strome en onderdrukking van K'-kanaaluitdrukking. Morfien-geïnduseerde afregulering van mTORC2-aktiwiteit in VTA is van kardinale belang vir hierdie morfien-geïnduseerde morfologiese en fisiologiese aanpassings sowel as vir beloningverdraagsaamheid. In teenstelling met mT0RC2, verhoog chroniese morfien mTORCI aktiwiteit, wat nie hierdie morfien-geïnduseerde aanpassings beïnvloed nie. BDNF, brein-afgeleide neurotrofiese faktor; IRS, insulienreseptorstof; mTORC, mTOR kompleks; AKT, proteïenkinase B Weergegee vanaf ref 77
Morfologiese plastisiteit en neurotrofiese meganismes
Toenemende bewyse, baie daarvan uit studies van hippokampale en serebrale kortikale neurone, het getoon dat veranderinge in sinaptiese plastisiteit geassosieer word met morfologiese veranderinge by sinapse. Byvoorbeeld, LTD en die generering van stille sinapse word geassosieer met die vorming van dun of stomp dendritiese stekels, terwyl LTP geassosieer word met groter, sampioenvormige stekels.79,80 Dit is dus interessant dat die dwelmmisbruik veld meer as 15 jaar lank gefokus het op dwelm-geïnduseerde veranderinge in dendritiese stekels. Chroniese blootstelling aan stimulant dwelms van misbruik verhoog die dendritiese ruggraatdigtheid van medium stekelrige neurone van die NAc, 'n verandering wat oorheers vir Dl-tipe neurone.67,81,82 Induksie van stekels is vir die grootste deel geassosieer met sensitiewe gedragsreaksies op hierdie middels, hoewel sommige bewyse in stryd is met hierdie siening.
Soos met studies van sinaptiese plastisiteit, is daar egter baie meer werk nodig om sistemies die veranderinge in dendritiese stekels te definieer wat plaasvind tydens 'n kursus van dwelm self-toediening, onttrekking en terugval. SStudies tot op hede, wat ondersoeker- en selftoegediende geneesmiddel behels, dui op baie verskillende ruggraatveranderinge wat by verskillende onttrekkingstydpunte en in NAc-dop teenoor kernsubstreke plaasvind.83-86 Dit sal ook belangrik wees om die presiese molekulêre meganismes te definieer waardeur kokaïen of 'n ander stimulant hierdie tydafhanklike en seltipe spesifieke effekte produseer. Daar is getoon dat ΔFosB beide nodig en voldoende is vir die induksie van onvolwasse stekels op Dl-tipe NAc neurone.35,51,67 Sulke regulering vind plaas in ooreenstemming met kokaïen- en ΔFosB-regulering van verskeie proteïene wat bekend is om die herorganisasie van die aktien-sitoskelet te beheer. As slegs een voorbeeld, transkripsionele regulering van verskeie guanien-nukleotied-uitruilfaktore en GTPase-aktiverende proteïene maak Rac1, 'n klein GTPase, gereed vir verbygaande afname in aktiwiteit in reaksie op elke kokaïenblootstelling, en sulke pulserende afnames in Rac1-aktiwiteit is getoon met behulp van optogenetiese beheer van Rac1, om induksie van onvolwasse stekels te bemiddel.87 Hierdie effekte van Racl vind vermoedelik plaas deur sy beheer van kofilien en ander aktien-regulerende proteïene, wat ook getoon is om kokaïenregulering van ruggraatgroei te bemiddel.87,88 Dit is egter belangrik om te beklemtoon dat dit net een pad is wat betrokke is by kokaïen se regulering van onvolwasse stekels, aangesien verskeie ander proteïene ook 'n noodsaaklike rol speel, insluitend CDK5 (siklienafhanklike kinase-5), CaMKII, NFkB , MEF2, CREB, G9a en DNMT3 (DNA methyltransf erase 3a), om 'n paar te noem.20,21,35,51,67,89,90 Interessant genoeg word kokaïenregulering van verskeie van hierdie gene, insluitend induksie van CDK5, CaMKII en NFkB, en onderdrukking van G9a, ook bemiddel via ΔFosB.20,35,51,91
Verbasend genoeg oefen opiaatmiddels van misbruik die teenoorgestelde effek uit en verminder die dendritiese ruggraatdigtheid van NAc medium stekelige neurone.81 Min is bekend oor die gedragsgevolge van hierdie aanpassing en die onderliggende molekulêre meganismes wat betrokke is. Hierdie verskynsel is, egter verbasend, aangesien CREB en ΔFosB deur beide stimulante en opiate geïnduseer word en beide betrokke is by stimulant-gemedieerde induksie van NAc dendritiese ruggraatdigtheid. Dit laat die vraag ontstaan hoe opiate NAc-ruggraatdigtheid onderdruk ondanks hul induksie van hierdie faktore.
Die ander hoofvorm van morfologiese plastisiteit wat in dwelmmisbruikmodelle gesien word, is die fisiese vermindering in selsomagrootte van VTA dopamienneurone wat deur chroniese opiaattoediening geïnduseer word..77,92,93 'n Soortgelyke aanpassing vind plaas in reaksie op cannabinoïden.94 Hierdie inkrimping van VTA dopamienneurone, wat plaasvind met opiaat selftoediening93 en is gedokumenteer in menslike heroïenverslaafdes wat nadoodse ondersoek is,77 blyk beloningverdraagsaamheid te bemiddel en word geassosieer met verminderde dopamienvrystelling in die NAc. Heelwat bewyse dui nou daarop dat hierdie vermindering in selsoma-grootte bemiddel word deur opiaatonderdrukking van brein-afgeleide neurotrofiese faktor (BDNF) uitdrukking binne hierdie neurone. Ons het hierdie opiaat-geïnduseerde onttrekking van BDNF-ondersteuning en VTA-neuronkrimping direk gekoppel aan verminderde aktiwiteit van stroomafwaartse BDNF-seinkaskades in VTA-dopamienneurone, spesifiek verminderde aktiwiteit van IRS2 (insulienreseptor-substraat-2), AKT ('n serien-treonien). kinase), en TORC2 (teiken van rapamisien-2, wat onsensitief is vir rapamisien).77,93 Ons het ook hierdie afregulering van BDNF-sein direk gekoppel aan die verhoogde prikkelbaarheid wat morfien in hierdie neurone veroorsaak, soos vroeër genoem.77,78 Inderdaad, die verminderde selsoma-grootte en verhoogde prikkelbaarheid is styf gekoppel, aangesien induksie van die een tot die ander lei en omgekeerd. Hierdie beheer oor selopwekking behels onderdrukking van K+ kanale en van GABAA stroom in hierdie neurone.
Hierdie rol vir BDNF in die beheer van morfienreaksies op die vlak van die VTA kontrasteer met sy baie verskillende betrokkenheid by die aksies van kokaïen en ander stimulante. Stimulante veroorsaak BDNF-sein na die NAc, 'n effek as gevolg van verhoogde plaaslike sintese van BDNF sowel as verhoogde vrystelling van verskeie afferente streke.95 Boonop is getoon dat verhoogde BDNF-sein in NAc, maar nie in die VTA nie, die gedragseffekte van hierdie middels, insluitend hul selfadministrasie, bevorder.95,96 Die teenoorgestelde regulering van BDNF-sein in die VTA-NAc-weg deur opiate teenoor stimulante verhoog die moontlikheid dat sulke verskille die middels se teenoorgestelde regulering van NAc dendritiese stekels bemiddel, 'n moontlikheid wat nou ondersoek word.
Toekomstige aanwysings
Die bogenoemde narratief onderstreep die geweldige vordering wat gemaak is in die begrip van die molekulêre en sellulêre aanpassings wat in breinbeloningstreke plaasvind in reaksie op herhaalde blootstelling aan 'n dwelmmiddel, en in die verband van individuele aanpassings met sekere gedragskenmerke van verslawingsindroom in dieremodelle . Ten spyte van hierdie vooruitgang bly daar groot vrae. Die meeste van ons bestaande kennis fokus op die VTA en NAc, met baie minder inligting beskikbaar oor ander belangrike limbiese breinstreke wat ook noodsaaklik is vir dwelmverslawing. Daarbenewens het alle eksperimentele demonstrasies van die oorsaaklike rol van 'n molekulêre-sellulêre aanpassing in 'n dwelmverwante gedrag individuele aanpassings een op 'n slag gemanipuleer. Om talle aanpassings op dieselfde tyd te manipuleer is duidelik baie moeiliker, maar dit is ook noodsaaklik, aangesien ons weet dat dwelms 'n groot aantal uiteenlopende tipes veranderinge veroorsaak, selfs binne individuele neurone, wat waarskynlik op ingewikkelde maniere opsom om gedrag te beïnvloed. So 'n sisteembiologie-benadering sal deurslaggewend wees om uiteindelik die biologiese onderbou van verslawing te kraak. Laastens, pogings om die molekulêre-sellulêre meganismes van herinneringe wat verband hou met verslawing te verstaan, bevind hulself op die punt waarop alle ander pogings om die biologiese basis van gedragsgeheue te verstaan, nou sukkel: ons vermoë om biologiese verskynsels met komplekse gedragsgeheue in verband te bring, bly uiters moeilik. Om hierdie kloof te oorkom, verteenwoordig miskien die grootste uitdaging in die neurowetenskappe.
Erkennings
Hierdie werk is ondersteun deur toelaes van die Nasionale Instituut vir Dwelmmisbruik.
Geselekteerde afkortings en akronieme
- of
- kern accumbens
- CREB
- cAMP respons element bindende proteïen
- ΔFosB
- 'n Fos familie transkripsie faktor
- VTA
- ventrale tegmentale area
- AMPA
- α-amino-3-hidroksi-5-metiel-4-isoksasoolpropionzuur
- LTD
- langtermyn depressie
- LTP
- langtermyn beskerming
- BDNF
- brein-afgeleide neurotrofe faktor
- NKkB
- kernfaktor kB
Verwysings