حوارات كلينيك Neurosci. 2013 Dec;15(4):431-43.
ملخص
على الرغم من أهمية العديد من العوامل النفسية الاجتماعية ، إلا أن إدمان المخدرات ينطوي في جوهره على عملية بيولوجية: القدرة على التعرض المتكرر لدواء من تعاطي لإحداث تغييرات في الدماغ الضعيف الذي يدفع البحث القهري وتناول الأدوية ، وفقدان السيطرة على تعاطي المخدرات ، التي تحدد حالة من الإدمان. هنا ، نستعرض أنواع التكيفات الجزيئية والخلوية التي تحدث في مناطق معينة من الدماغ للتوسط في التشوهات السلوكية المرتبطة بالإدمان. وتشمل هذه التعديلات في التعبير الجيني التي تحققت في جزء عبر آليات جينية، ليونة في أداء العصبي للخلايا العصبية والمشابك، واللدونة المرتبطة في التشكل العصبية ومتشابك بوساطة جزئيا غيرت عامل إشارات عصبية. يمكن اعتبار كل من هذه الأنواع من التعديلات التي يسببها الدواء شكلاً من "الذاكرة الخلوية أو الجزيئية". علاوة على ذلك ، من اللافت للنظر أن معظم أشكال اللدونة المرتبطة بالادمان تشبه إلى حد بعيد أنواع اللدونة التي ارتبطت بأشكال أكثر كلاسيكية من "الذاكرة السلوكية" ، ربما تعكس المرجع المصغر للآليات التكيفية المتوفرة للخلايا العصبية عند مواجهة البيئة. التحديات. وأخيرًا ، تتضمن التعديلات الجزيئية والخلوية المرتبطة بالإدمان معظم مناطق الدماغ نفسها التي تتوسط أشكالًا أكثر كلاسيكية من الذاكرة ، بما يتفق مع وجهة النظر التي مفادها أن الذكريات غير الطبيعية هي محركات مهمة لمتلازمات الإدمان. الهدف من هذه الدراسات التي تهدف إلى تفسير الأساس الجزيئي والخلوي للإدمان على المخدرات هو تطوير اختبارات تشخيصية قائمة على أساس بيولوجي ، بالإضافة إلى علاجات أكثر فاعلية لاضطرابات الإدمان.
المُقدّمة
إن إدمان المخدرات ، الذي يمكن تعريفه على أنه البحث القهري عن المخدرات والأخذ بها على الرغم من العواقب الرهيبة أو فقدان السيطرة على تعاطي المخدرات ، ينتج عن تغيرات طويلة الأمد تحدث في بعض مناطق الدماغ.1 ومع ذلك ، فإن بعض الأفراد فقط يخضعون للإدمان في مواجهة التعرض المتكرر للمخدرات ، في حين أن البعض الآخر قادر على استخدام عقار عرضي وهروب من متلازمة الإدمان. تمثل العوامل الوراثية تقريبًا نسبة 50٪ من هذا التباين الفردي في ضعف الإدمان ، وهذه الدرجة من التوريث تنطبق على جميع الفئات الرئيسية من العقاقير المسببة للإدمان ، بما في ذلك المنشطات والأفيونات والكحول والنيكوتين والقنب..2 لم يكن من الممكن حتى الآن تحديد معظم الجينات التي تشكل هذه المخاطر الجينية ، ويرجع ذلك على الأرجح إلى مشاركة مئات الاختلافات الجينية التي تم جمعها في فرد واحد لإضفاء ضعف على الإدمان (أو ، في مقاومة الأفراد الآخرين).
ترجع نسبة الـ 50٪ الأخرى من مخاطر الإدمان إلى مجموعة من العوامل البيئية ، التي تحدث طوال العمر ، والتي تتفاعل مع التركيب الجيني للفرد لتجعله عرضة للإدمان بدرجة أكبر أو أقل. هناك عدة أنواع من العوامل البيئية متورطة في الإدمان ، بما في ذلك الضغوط النفسية والاجتماعية ، ولكن العامل الأقوى إلى حد بعيد هو التعرض لعقار من تعاطي المخدرات نفسه. لقد ثبت أن بعض العقاقير "المدمرة" ، ولا سيما النيكوتين ، تزيد من تعرض المرء لإدمان مخدرات أخرى.3 علاوة على ذلك ، هناك أدلة متزايدة على أنه ، على الرغم من مجموعة من المخاطر الجينية للإدمان عبر السكان ، يمكن أن يؤدي التعرض لجرعات عالية بما فيه الكفاية من دواء لفترات طويلة إلى تحويل شخص لديه تحميل جيني أقل نسبياً إلى مدمن..4
لقد تم إحراز تقدم كبير خلال العقدين الماضيين في تحديد مناطق الدماغ المنفصلة ذات الأهمية في التوسط في متلازمة الإدمان ، فضلاً عن أنواع التغيرات في المستويات الجزيئية والخلوية التي تحفزها العقاقير في هذه المناطق لإبراز الجوانب الرئيسية. من الإدمان.1,5 يشار إلى الدائرة التي تلقت أكبر قدر من الاهتمام باسم نظام الدوبامين mesolimbic ، الذي ينطوي على الخلايا العصبية الدوبامين في المنطقة tegmental البطنية (VTA) من الخلايا العصبية المتوسطة شوكي تعصب المتوسطة في النواة المتكئة (NAc ، وهو جزء من المخطط البطني). هذه الخلايا العصبية VTA أيضا يعصب العديد من المناطق الدماغية الأخرى ، بما في ذلك الحصين ، اللوزة ، والقشرة الجبهية (PFC).
من المنطقي النظر في آليات الإدمان الناجمة عن المخدرات في هذا المجلد على الذاكرة لثلاثة أسباب متداخلة.6
- أولاً ، يمكن اعتبار جميع التكييفات المستحثة بالأدوية أنواعًا من "الذاكرة الجزيئية أو الخلوية:" تختلف الخلايا العصبية التي تخضع لهذه التغييرات نتيجة التعرض للعقاقير ، وبالتالي تستجيب بشكل مختلف لهذا الدواء نفسه ، إلى أدوية أخرى ، أو لمجموعة من المحفزات الأخرى نتيجة لذلك.
- ثانيا ، من المثير للاهتمام أن العديد من ، وربما أكثر ، من أنواع التغييرات التي ارتبطت بحالة من الإدمان (على سبيل المثال ، النسخ الجيني المتغير ، وعلم الوراثة المتخلِّفة ، اللدونة المشبكية الكاملة للخلية ، والتشكيل العصبي ، والآليات العصبية) يتورط أيضًا في الأشكال التقليدية "للذاكرة السلوكية" مثل الذاكرة المكانية ، وتكييف الخوف ، والتكيف الفعال ، من بين أمور أخرى.
- ثالثًا ، من بين المناطق الدماغية التي تتأثر بعقاقير الإساءة تلك التي هي ركائز عصبية رئيسية للذاكرة السلوكية ، بما في ذلك الحصين ، اللوزة ، والـ PFC. ويتزامن هذا مع الإدراك المتزايد بأن بعض أهم سمات الإدمان التي يمكن رؤيتها سريريًا (على سبيل المثال شغف المخدرات وانتكاسها) تعكس تشوهات في دوائر الذاكرة التقليدية ، مع ذكريات طويلة المدى لتجارب المخدّرات تعمل كدوافع قوية لعلم أمراض الإدمان.4,7,8 على العكس من ذلك ، تؤثر مناطق المكافأة في الدماغ (على سبيل المثال ، VTA و NAc) بشكل فعال على الذاكرة السلوكية.
تقدم هذه المقالة لمحة عامة عن الأنواع الرئيسية للتغييرات الجزيئية والخلوية التي تحدث في العديد من مناطق الدماغ في نماذج حيوانية من الإدمان ، مع التركيز على النواة المتكئة التي تتوفر بها معظم المعلومات حاليًا. الأهم من ذلك ، كان من الممكن بشكل متزايد للتحقق من صحة بعض هذه التغييرات في المدمنين على البشر استنادا إلى دراسات أدمغة بعد الوفاة. على الرغم من حقيقة أن تعاطي المخدرات له هياكل كيميائية متميزة ويعمل على أهداف بروتينية متميزة ، فمن اللافت للنظر أن العديد من عمليات التكيف ذات الصلة بالإدمان المرتفعة شائعة للعديد من ، وفي بعض الحالات ، تعاطي المخدرات ، ومن المحتمل أن تساهم في ميزات مشتركة متلازمة الإدمان.4,9 وعلى النقيض من ذلك ، فإن العديد من التعديلات الأخرى التي يستحثها الدواء تكون خاصة بدواء معين وقد تتوسط جوانب أكثر فريدة لإدمان معين. نحن نركز هنا على المخدرات المنشطة والأفيونية للإساءة ، والتي تنتج المزيد من الآثار المثيرة في النماذج الحيوانية مقارنة مع الأدوية الأخرى. كما نسلط الضوء على مجالات مهمة للبحث في المستقبل والتي ستزيد من معرفتنا بمتلازمات الإدمان وترجمة هذه التطورات إلى اختبارات تشخيصية وعلاجات محسنة.
آليات النسخ والتخلق
إن معرفة أن المدمنين يمكن أن يظلوا في خطر متزايد للانتكاس على الرغم من سنوات الامتناع يعني أن الإدمان ينطوي على تغييرات ناتجة عن المخدرات في الدماغ يمكن أن تكون مستقرة للغاية. وقد أدى هذا إلى عدة مجموعات للنظر في التغييرات في التعبير الجيني كعنصر مهم في عملية الإدمان (الشكل 1). وبناءً على ذلك ، فإن الدراسات حول الجينات المرشحة أو تحقيقات الجينوم على نطاق واسع تشمل microarrays DNA و RNA-seq (تسلسل عالي الإنتاجية لسلسلة RNAs) حددت العديد من الجينات التي تم تغيير تعبيرها في منطقة معينة في الدماغ في نماذج القوارض والرئيسيات من الإدمان والمدمنين على الإنسان (على سبيل المثال ، refs 10-17). وتناقش أمثلة من هذه الجينات في الأقسام اللاحقة من هذا الاستعراض.
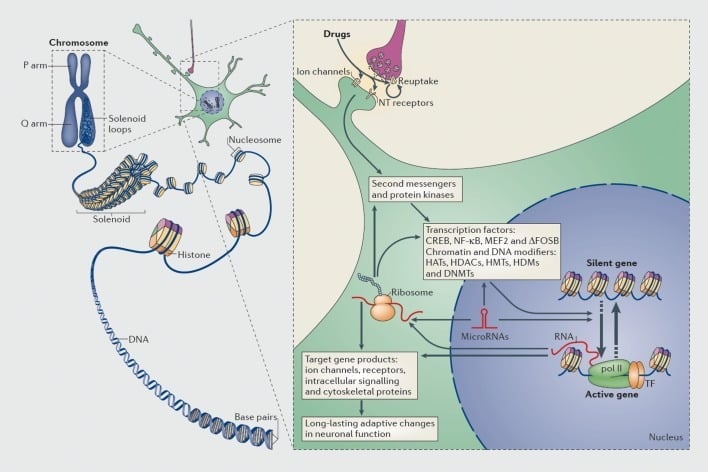
آليات تنظيم النسخ والتخلق اللاجيني بواسطة تعاطي المخدرات. في الخلايا حقيقية النواة ، يتم تنظيم الحمض النووي عن طريق التفاف حول ثماني هيستون لتكوين nucleosomes ، والتي يتم بعد ذلك تنظيمها وتكثيفها لتشكيل كروموسومات (الجزء الأيسر). فقط من خلال تفكيك لونين مضغوطين مؤقتًا ، يمكن جعل الحمض النووي لجين معين متاحًا لآلية النسخ. تعمل عقاقير الإساءة من خلال الأهداف المشبكية مثل آليات الاسترداد ، وقنوات الأيونات ، ومستقبلات الناقل العصبي (NT) لتغيير سلاسل الإشارات داخل الخلايا (الجزء الأيمن). وهذا يؤدي إلى تنشيط أو تثبيط عوامل النسخ (TFs) والعديد من الأهداف النووية الأخرى ، بما في ذلك البروتينات التنظيرية للكروماتين (التي تظهر من خلال الأسهم السميكة) ؛ الآليات التفصيلية التي ينطوي عليها تنظيم متشابك من البروتينات تنظيط الكروماتين تبقى غير مفهومة بشكل جيد. هذه العمليات تؤدي في نهاية المطاف إلى تحريض أو قمع جينات معينة ، بما في ذلك تلك الخاصة بالـ RNAs غير المشفرة مثل الرنا الميكروي. والتعبير المتغير لبعض هذه الجينات يمكن أن يؤدي بدوره إلى تنظيم عملية النسخ الجيني. يقترح أن بعض هذه التغيرات التي يسببها الدواء على مستوى الكروماتين تكون مستقرة للغاية ، وبالتالي تكمن وراء السلوكيات طويلة الأمد التي تحدد الإدمان. CREB ، بروتين ربط عنصر استجابة AMP- دوري. DNMTs، DNA methyltransferases؛ HATs ، أسيتيل ترانسفيريز هيستون ؛ HDACs ، هيستون deacetylases. HDMs ، demethylases هيستون. HMTs ، methyltransferases هيستون. MEF2 ، عامل مُحسِّن لعضويات محددة 2 ؛ NF-kB، nuclear factor KB؛ pol II، RNA polymerase II. مستنسخة من المرجع 44: Robison AJ، Nestler EJ. آليات النسخ والابيجينية للإدمان. نات ريف نيوروسكي. 2011 ؛ 12: 623-637.
وبالمثل ، فإن العديد من أنواع عوامل النسخ - وهي بروتينات ترتبط بمناطق جينية تنظيمية ، وبالتالي تزيد أو تنقص نسخ تلك الجينات - قد تورطت في التوسط في الآثار طويلة الأجل لدواء الإساءة على التعبير الجيني في الدماغ.. تتضمن الأمثلة البارزة CREB (بروتين ربط عنصر استجابة cAMP) ، ΔFosB (عامل نسخ لعائلة Fos) ، NFkB (العامل النووي kB) ، MEF2 (عامل تعزيز العضل- 2) ، ومستقبلات جلايكورتيكيد ، بين عدة أشخاص آخرين.5,10,18-22 لقد أصبح من الممكن بشكل متزايد فهم مسارات الإشارات الخلوية التي من خلالها تنشط العقاقير المخدرة عامل نسخ معين في الدماغ وربط هذا التنشيط سببيًا بالجينات المستهدفة لعامل النسخ هذا والجوانب السلوكية المحددة للإدمان (انظر الشكل شنومكس). ويتضح هذا التقدم من خلال النظر في CREB و ΔFosB ، التي تعتبر أفضل عوامل النسخ المدروسة في نماذج الإدمان.
cAMP Response element protein protein
المخدرات المنشطات والأفيونية من سوء المعاملة تفعيل CREB في العديد من مناطق الدماغ الهامة للإدمان ، بما في ذلك بشكل بارز في NAc.23,24 ومن المعروف أن CREB يتم تفعيله في أنظمة أخرى من خلال cAMP، Ca2+ومسارات عامل النمو25 وليس من المعروف بعد أي منها يتوسط تنشيطه في NAc من تعاطي المخدرات. وقد ثبت أن تفعيل دواء CREB في NAc يمثل آلية ردود فعل سلبية كلاسيكية, حيث يعمل CREB على تقليل حساسية الحيوان للتأثيرات المجزية لهذه الأدوية (التسامح) والتوسط في حالة عاطفية سلبية أثناء الانسحاب من المخدرات (الاعتماد).18,26,27 وقد أظهرت هذه التأثيرات مؤخرًا لزيادة الإدارة الذاتية للدواء والانتكاس ، على الأرجح من خلال عملية التعزيز السلبي.28 يبدو أن هذه الإجراءات من CREB تنطوي على كل من الأنواع الفرعية الرئيسية للخلايا العصبية الشوكية المتوسطة NAc ، تلك التي تعبر في الغالب D1 مقابل د2 مستقبلات الدوبامين.24 Iمن ناحية أخرى ، أظهرت مجموعة كبيرة من الأدبيات أن CREB ، الذي يتصرف في قرن آمون واللوزة ، هو جزيء رئيسي في الذاكرة السلوكية.29-31 هذا الدور الواسع في الإدمان والذاكرة السلوكية يعكس على الأرجح حقيقة أن الخلايا العصبية مشبعة بعدد محدود من الآليات الجزيئية التي تتكيف مع بيئة متغيرة باستمرار.
تم تحديد الجينات المستهدفة لـ CREB التي تتوسط هذا النمط الظاهري السلوكي من خلال فحوصات الجينوم على نطاق أوسع بالإضافة إلى المزيد من الجهود المختارة.10,18,32 مثال واحد هو dynetvin الببتيد أفيوني: الحث المنشطة لتعبير dynorphin في الخلايا العصبية NAc ، بوساطة عبر CREB ، يزيد من تنشيط dynorphin لمستقبلات k opioid على الخلايا العصبية الدوبامين VTA وبالتالي يمنع انتقال الدوبامين إلى NAc ويضعف المكافأة.18 وقد ثبت أن العديد من أهداف CREB الأخرى مهمة للدونة المشبكية المحرضة بالمخدرات ، كما هو موضح أدناه. في حين يتم تنشيط CREB أيضا في العديد من مناطق الدماغ الأخرى من خلال المنشطات والمواد الأفيونية ،23,24 لا يُعرف الكثير عن العواقب السلوكية لهذا التأثير والجينات المستهدفة التي تحدث من خلالها. وبالمثل ، لا يُعرف الكثير عن دور CREB في التوسط في تصرفات العقاقير الأخرى المتعاطفة.19
ΔFosB
التعرّض الحادّ لأيّ عقار من سوء الاستخدام يُحثّ جميع عوامل نسخ عائلة فوس في NAc والعديد من مناطق الدماغ الأخرى. هذا الاستقراء سريع ولكن أيضا عابر للغاية ، مع مستويات بروتين فوس تعود إلى طبيعتها في غضون 8 إلى 12 ساعة. فريد بين هذه البروتينات عائلة فوس هو ΔFosB ، وهو منتج مقتطعة من الجينات FosB ، التي تتراكم تدريجيا من خلال استقرارها غير العادي من خلال مسار التعرض المتكرر للمخدرات ويصبح بروتين Fos السائد في ظل هذه الظروف.22,33 علاوة على ذلك ، وبسبب هذا الاستقرار ، فإن مستويات ΔFosB تستمر لأسابيع بعد سحب الأدوية. وقد تم إثبات هذا الحث المزمن لـ ΔFosB على جميع عقاقير الإدمان تقريباً34 ، وبالنسبة لمعظم المخدرات ، هو انتقائي لخلايا العصبية من نوع NAc Dlc.34,35 لقد كان كذلك أظهر في المدمنين على البشر.35 وقد أظهرت مجموعة كبيرة من الأدب أن مثل هذا التعريفي ΔFosB في D1-تزيد الخلايا العصبية من نوع NAc من حساسية الحيوان للأدوية وكذلك المكافآت الطبيعية وتعزز الإدارة الذاتية للعقار ، ويفترض من خلال عملية التعزيز الإيجابي (راجع الحكام 34 إلى 38). من المثير للاهتمام ، تحريض الدواء لـ ΔFosB في NAc هو أكثر دراماتيكية في حيوانات المراهقين ، وهو وقت زيادة ضعف الإدمان,39 وقد ثبت أن تحريضه عن طريق النيكوتين يتوسط في تعزيز النيكوتين مثل بوابة مكافأة الكوكايين.40
وبالنسبة لـ CREB ، فقد تم تحديد العديد من الجينات المستهدفة لـ ΔFosB في NAc عن طريق استخدام الجينات المرشحة وطرق الجينوم.10,32 بينما يحفز CREB مادة dynorphin ، يقوم ΔFosB بقمعه ، مما يساهم في تأثيرات ΔFosB المؤيدة للمكافأة.38 هناك هدف آخر لـ ΔFosB هو cFos: حيث يتراكم ΔFosB مع التعرض المتكرر للعقار فإنه يقمع c-Fos ويساهم في التبديل الجزيئي حيث يتم تحفيز Δ FosB بشكل انتقائي في الحالة المزمنة المعالجة بالمخدرات.41 وقد أظهرت العديد من الأهداف الأخرى ΔFosB للتوسط في قدرة بعض الأدوية من تعاطي للحث على اللدونة متشابك في NAc والتغيرات المرتبطة بها في التشجير من الخلايا العصبية الشوكية المتوسطة NAc ، كما سيتم مناقشته أدناه.
النتائج الوظيفية لتحريض ΔFOSB في مناطق أخرى من الدماغ غير مفهومة بشكل جيد ، على الرغم من أن تحريضها في القشرة الأمامية المدارية (OFC) قد تمت دراسته بشيء من التفصيل. وهنا ، يتوسط ΔFOSB التسامح الذي يحدث مع الآثار المدمرة للكوكايين المعرّض للإدراك أثناء مسار التعرض المزمن ، ويرتبط هذا التكيف بزيادة الإدارة الذاتية للكوكايين..42,43
اقترحت الاختبارات على نطاق الجينوم عدة جينات محتملة مستهدفة تتوسط هذه التأثيرات.42 على الرغم من الخصائص الزمنية الفريدة لـ ΔFosB ، والمعرفة التي يتم تحفيزها في دوائر الذاكرة التقليدية (على سبيل المثال ، الحصين) ، لم يكن هناك حتى الآن استكشاف لدور ΔFosB في الذاكرة السلوكية ، وهو موضوع مثير للاهتمام للبحث في المستقبل.
آليات جينية
في السنوات الأخيرة ، تم دفع الدراسات من النسخ خطوة واحدة أخرى لعلم الوراثة44 (انظر الشكل شنومكس)والتي يمكن تعريفها على نطاق واسع كتغيير في التعبير الجيني الذي يحدث في غياب تغيير في تسلسل الحمض النووي. تتحكم الآليات الوراثية في تغليف الحمض النووي داخل نواة الخلية من خلال تفاعلاتها مع الهستونات والعديد من الأنواع الأخرى من البروتينات النووية ، والتي تتكون معًا من لونين. يتم التحكم في التعبير الجيني من خلال حالة هذه العبوة من خلال التعديل التساهمي للهيستونات والبروتينات الأخرى والحمض النووي نفسه. على سبيل المثال لا الحصر ، يميل الأستلة من الهستونات إلى تنشيط تنشيط الجينات ، يمكن لمثلثات الهيستونات أن تعزز تنشيط الجينات أو قمعها اعتمادًا على بقايا ليز التي تخضع لهذا التعديل ، ويرتبط عموما ميثيلا الحمض النووي بقمع الجينات على الرغم من وجود أشكال مختلفة من المثيلة ( على سبيل المثال ، 5-hydroxymethylation) قد يترافق مع تنشيط الجينات.
تعد Epigenetics آلية جذابة لأنه ، في الأنظمة الأخرى ، على سبيل المثال ، علم الأحياء التنموي والسرطان ، يمكن أن تكون بعض التعديلات المتخللة دائمة. لهذا السبب، وقد تم متابعة علم الوراثة (epigenetics) في كل من نماذج التعلم والذاكرة (على سبيل المثال ، الحواسب 45-48) وكذلك في الإدمان ؛44,49 في كلا النظامين تم الإبلاغ عن تغييرات عميقة في أستلة الهيستون ومثيلته وفي مثيلة الحمض النووي. وكمثال واحد فقط ، فإن methyltransferase هيستون ، G9a ، متورط في كلتا الذاكرة50 والإدمان.51,52 في نماذج الإدمان ، تعبير G9a غير منظم في NAc ردا على المنبهات أو المخدرات الأفيونية من سوء المعاملة وروقد ثبت له أن يعزز من الآثار المجزية لهذه الأدوية.51,52 ومن المثير للاهتمام ، يتم التوسط الكوكايين قمع G9a من قبل ΔFosB. G9a يحفز dimethylation من Lys9 من هيستون H3 (H3K9me2) ، وهو وسيط رئيسي للقمع الجيني. رقاقة (ChIP-chip) أو (ChIP-seq) (متبوع مناعي chromatin ، على التوالي ، من خلال رقائق المحفز أو التسلسل عالي الإنتاجية) تم استخدامه للحصول على خرائط الجينوم على نطاق واسع للجينات في NAc التي يتم فيها تعديل H3K9me2 بعد التعرض للمنشطات أو الأفيون.32,52,53 من خلال تداخل قوائم الجينات هذه مع قوائم تغييرات الجينوم على نطاق الجينوم ، مع خرائط شاملة للجينوم للعديد من الأشكال الأخرى من التعديلات اللاجينية (مثل ، ΔFosB binding ، CREB binding ، وتعديلات هيستون أخرى ، الخ) ،32,53 يجب أن يكون من الممكن تحديد مجموعة كاملة من الجينات التي يتم تنظيمها من خلال تعاطي المخدرات ، وفهم الآليات الجينية المتضمنة.
شكل آخر من أشكال التنظيم اللاجيني المتورط في الذاكرة والإدمان هو توليد الرنا الميكروي. ترتبط هذه الرناوات الصغيرة غير المكوِّدة للـ RNAs بمناطق مكملة من mRNAs ومن ثم تقمع ترجمتها أو تحفز تدهورها. إن حذف ال Argروتينوت Argonaut ، وهو بروتين حاسم لمعالجة جزيئات الحمض الريبوزي (miRNAs) ، يغير الاستجابات السلوكية للكوكايين ، مع تأثيرات متميزة ملاحظتها للعصبونات الشوكية المتوسطة من النوع D1- مقابل D2.54 وبالمثل ، ثبت أن الجزيئات المجهرية المحددة تخضع للتنظيم من خلال التعرض للعقاقير ، وبالتالي ، التأثير على الاستجابات السلوكية للأدوية (على سبيل المثال ، الحكام 55,56). سيكون من المثير في الدراسات المستقبلية تحديد أهداف mRNA لهذه الجزيئات المجهرية وتوصيف كيفية تأثيرها على عملية الإدمان.
اللدونة متشابك
نفس الأنواع العامة من التعديلات المشبكية في المشابك الجلوتاماتية ، والتي تم توريطها في قرن آمون واللوزة في الذاكرة السلوكية (انظر مقالات أخرى في هذه المسألة) ، تم بشكل مشابه أن تظهر في مناطق مكافآت الدماغ في نماذج الإدمان وأن تكون مهمة في الوساطة عملية الإدمان.57,58 وقد وصفت هذه اللدونة متشابك المخدرات الناجمة عن المخدرات في عدة مناطق الدماغ ، ومع ذلك ، نركز هنا على NAc حيث ركزت معظم البحوث حتى الآن (الشكل 2).
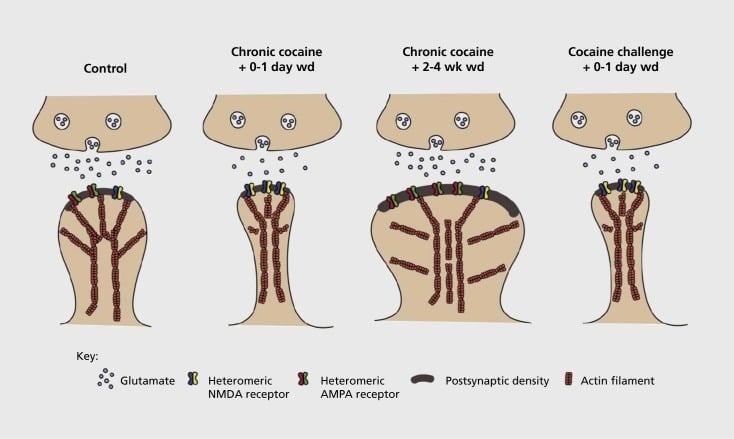
نموذج اللدونة المتشابكة والهيكلية المرتبطة بالإدمان في النواة المتكئة (NAc). التعرّض المزمن للكوكايين ينتج عنه إعادة تنظيم زمني واعتباطي لمستقبلات حمض ألفا أمينو- 3-hydroxy-5-methyl-4-isoxazolepropionic (AMPA) و N-methyl-D-aspartic acid (NMDA) في وسط NAc المشابك العصبية الشوكية (MSN) ، وكذلك التغييرات الهيكلية في رأس العمود الفقري من NAc MSNs التي ترتبط مع أشكال متميزة من اللدونة متشابك. على سبيل المثال ، يحفز الكوكايين المزمن التعبير السطحي لمستقبلات NMDA ، وتشكيل المشبك الصامت والاكتئاب طويل الأجل (LTD) عند نقاط وقت الانسحاب المبكر. أثناء الانسحاب لفترة طويلة (wd) ، فإن هذه التغيرات المشبكية تتعكس مع زيادة التعبير عن مستقبلات AMPA السطحية ، وتوحيد المشبك إلى العمود الفقري على شكل عيش الغراب ، والتكثيف على المدى الطويل (LTP). هذه الآثار تعود بسرعة مرة أخرى عند التعرض لجرعة التحدي من الكوكايين مما يؤدي إلى إعادة هيكلة العمود الفقري في العمود الفقري رقيقة وكآبة من قوة متشابك.
أثبتت التجارب الأولية أن التعرض المتكرر للعقاقير المنشطة من الإساءة يدفع إلى حدوث حالة (مثل الاكتئاب طويل الأمد) شبيهة بالمشابك الجلوتاماتية في NAc.59 ومع ذلك ، فقد أثبتت الأبحاث الحديثة أن مثل هذه اللدونة تعتمد بشكل كبير على الوقت ، مع حدوث المحدودية في وقت مبكر بعد أن يتطور التعرض الأخير للكوكايين ليصبح أكثر من حالة LTP (تقوية طويلة الأجل) على غرار حالة وقت أطول للانسحاب.60,61 هذا العمل ، الذي تم إجراءه حتى الآن بشكل أساسي باستخدام المحقق المُدار - على عكس العقاقير ذاتية الإدارة - حدد الحاجة إلى المزيد من التحريات المنهجية في نماذج الإدارة الذاتية التي تتعقب أشكال اللدونة المشبكية التي تحدث عند نقاط التشابك الجلوتاماتي في NAc على دورة زمنية مفصلة من اكتساب الإدارة الذاتية لصيانتها ، من خلال أوقات مختلفة من الانسحاب والانقراض ، وردا على المنبهات التي تستثير الانتكاس. وقد حدد العمل حتى الآن بعض الآليات الجزيئية التي تسهم في هذه اللدونة المشبكية التي يسببها الدواء ، بما في ذلك الاتجار بمستقبلات AMPA إلى المشبك ربما بوساطة جزئية عبر CaMKII (Ca)2+/ بروتين كيناز II المعتمد على الهدنة - الفسفرة لبعض وحدات مستقبلات AMPA بالإضافة إلى التعبير المتغير لوحدات مستقبلات AMPA (على سبيل المثال ، 60,62-65 ، أرقام شنومكس و شنومكس). وقد تورط دور CREB و ΔFosB في هذه الظواهر ، وكذلك في التغييرات المرتبطة في مورفولوجيا المشابك الجلوتاماتي (انظر أدناه). على سبيل المثال ، GluAl هو هدف لـ CREB في NAc ، حيث يكون كل من GluA2 و CaMKII هدفين لـ ΔFosB ، في منطقة الدماغ هذه .35,36,66,67 من خلال المضي قدمًا ، سيكون من المهم ربط تعديلات معيّنة بالتغييرات المعتمدة على الوقت في الوظيفة المشبكية والسلوك السلوكي للإدمان.
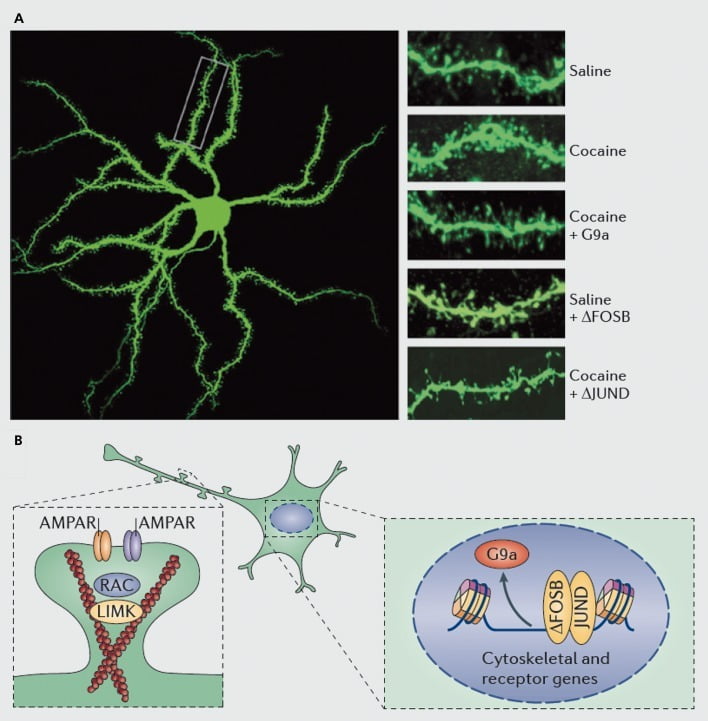
الآليات الجزيئية الكامنة وراء تحريض الكوكايين من العمود الفقري الشجيري على النواة المتكئة (NAc) الخلايا العصبية الشوكية المتوسطة. أ) يُظهر الزيادات التي يسببها الكوكايين في عدد العمود الفقري الشجيري الذي يمكن حظره عن طريق الإفراط في التعبير الفيروسي لـ G9a أو JunD (أحد مناهض النسخ بوساطة AP1) ، أو يحاكيها الإفراط في التعبير الفيروسي عن FosB. ب) تم إثبات أن تنظيم تهريب مستقبلات AMPA (AMPAR) والهيكل الخلوي الأكتين (يسار) ، بالإضافة إلى تنظيم نسخ مستقبلات الغلوتامات والبروتينات المنظمة للأكتين (على سبيل المثال ، كما تم التوسط عبر ΔFosB ، يمين) يلعبان أدوارًا مهمة في التوسط في تنظيم الكوكايين لكثافة العمود الفقري التغصني NAc. UMK ، LIM المجال كيناز ؛ RAC ، ركيزة توكسين البوتولينوم C3 المرتبطة برأس.
إن الأدوات التجريبية الجديدة تجعل من الممكن لأول مرة تعريفها بدقة متزايدة والتي تعرض دوائر معينة هذه الأشكال من اللدونة المشبكية وما هي التشوهات السلوكية التي تتوسط بها. على سبيل المثال ، رويظهر في هذه الدراسة فروقاً في المنطقة دون الإقليمية من الفروق في عرض NAc في اللدونة المشبكية المستحثة بالمخدرات ، كما تفعل D1- مقابل الخلايا العصبية المتوسطة من النوع D2 داخل كل منطقة فرعية.60,63,64,67 على نحو مماثل ، قدمت تجارب optogenetic رؤية جديدة لمساهمة شكل معين من اللدونة المشبكية (على سبيل المثال ، LTD) في مجموعات محددة من نقاط الاشتباك العصبي الجلدي في NAc ، على سبيل المثال ، تلك التي تنشأ من PFC البيني مقابل basyateral الوحشي مقابل subiculum البطني (الناتج الرئيسي من الحصين).68-70 في النهاية ، سيكون من الضروري تراكب التكيفات الجزيئية التي يسببها الدواء في كل من هذه الخلايا العصبية الواردة مع التكيفات الخاصة بالمشابك التي تحدث في التشعبات بعد المشبكي لتجميع فهم كامل لكيفية تعديل تعاطي المخدرات لدوائر الدماغ لدفع جوانب معينة من دولة مدمنة. سيتطلب هذا المسعى تقديرًا أكبر للدونة التي يسببها الدواء في نقاط الاشتباك العصبي المثبطة داخل مناطق الدماغ نفسها ، وهي المنطقة التي لم تحظ باهتمام كبير حتى الآن.65
اللدونة خلية كاملة
في حين أن غالبية البحوث التي تشمل التغيرات العصبية الفسيولوجية في الخلايا العصبية في ظاهرة سوء استخدام العقاقير ، كما هو الحال في ظواهر التعلم والذاكرة ، قد ركزت على اللدونة المشبكية ، هناك أدلة متزايدة على أهمية اللدونة كاملة الخلية كذلك. اللدونة خلية كاملة ، ويشار أيضا إلى اللدونة التوطنية ،71 ينطوي على تغييرات في استثارة جوهرية للخلية العصبية بأكملها بطريقة لا تكون محددة المشبك. بالنظر إلى أن بعض سمات إدمان المخدرات تتضمن حساسية معززة أو مخففة للدواء ، فمن المنطقي أن الاستثارة الكهربائية المُحسَّنة أو المُخفَّضة لبعض الخلايا العصبية تسهم في هذه التكيفات السلوكية..5
• أفضل مثال على اللدونة خلية كاملة لدواء من تعاطي هو قدرة المواد الأفيونية المزمنة لزيادة استثارة الجوهرية من الخلايا العصبية النورادرينية من موضع coeruleus (LC).72 يتم توسط هذه الاستثارة المتزايدة عبر CREB وتحريضها لبعض الأشكال الإسوية من adenylyl cyclase ، والتي تدفع إلى زيادة إطلاق النار من الخلايا العصبية LC ربما من خلال تحريض القنوات Na +.72-75 هذا hyperxycitabilty من الخلايا العصبية LC يمثل آلية كلاسيكية من التسامح والاعتماد ويدفع بعض علامات وأعراض الانسحاب الأفيونية. ومن المثير للاهتمام ، أن CREB يتوسط شكل مماثل من لدنة الخلايا الكاملة في الخلايا العصبية الشوكية المتوسطة NAc ، والتي يتم أيضًا تقديمها بشكل مفرط من خلال التعرض المزمن لعقاقير الإساءة عبر CREB.76 وبالتالي سيكون من الأهمية بمكان في التحقيقات في المستقبل لفهم كيف مرتكز CREB بوساطة متشابك من المشابك الجلوتاماتي على الخلايا العصبية الشوكية المتوسطة NAC65,66 تلخص مع hyperbercicability الجوهرية CREB بوساطة هذه الخلايا العصبية76 للتحكم في السمات السلوكية للإدمان.
مثال آخر على مرونة الخلايا الكاملة في نماذج الإدمان هو فرط الاستقطاب للخلايا العصبية الدوبامين VTA التي تحدث بعد التعرض المزمن للأفيونات من المخدراته (الشكل 4).77,78 هذا التكيف ، الذي تم ربطه بالتغييرات المورفولوجية في هذه الخلايا العصبية (انظر القسم التالي) ، لا يتم توسطه بواسطة CREB ولكنه يتحقق بدلاً من ذلك عن طريق تنظيم سلاسل الإشارات العصبية ، كما هو موضح أدناه.

نموذج العمل من التكيفات المزمنة التي يسببها المورفين في الخلايا العصبية الدوبامين المنطقة tegmental (VTA). المورفين المزمنة يقلل من حجم soma الدوبامين (DA) بعد يزيد من استثارة الخلايا العصبية ، في حين ينخفض انتقال الدوبامين إلى النواة المتكئة. التأثير الصافي للمورفين هو مسار مكافأة أقل استجابة ، أي تحمل الثواب. يقلل من تنظيم إشارات IRS2-AKT في VTA تأثيرات المورفين المزمنة على حجم soma والإثارة الكهربائية ؛ يتم التوسط في التأثير على الاستثارة عن طريق انخفاض تيارات حمض-aminobutyric (GABA) A وقمع تعبير قناة K. يعد خفض نشاط mTORC2 الناجم عن المورفين أمرًا حاسمًا في هذه التكيّفات المورفولوجية والفسيولوجية الناتجة عن المورفين فضلاً عن تحمّل المكافأة. وعلى النقيض من mT0RC2 ، يزيد المورفين المزمن من نشاط mTORCI ، الذي لا يؤثر على هذه التعديلات التي يسببها المورفين. BDNF ، عامل التغذية العصبي المشتق من الدماغ ؛ IRS ، مادة مستقبلات الأنسولين. mTORC، mTOR complex؛ AKT ، بروتين كيناز B مستنسخ من المرجع 77
اللدونة المورفولوجية وآليات التغذية العصبية
وأظهرت أدلة متزايدة ، والكثير منها من دراسات الخلايا العصبية القشرية الدماغية والقرنية ، أن التغييرات في اللدونة متشابك مرتبط بالتغيرات المورفولوجية في نقاط الاشتباك العصبي. على سبيل المثال ، ترتبط الذكورة المحدودة وتوليد المشابك الصامتة بتكوين أشواك شجيرية رقيقة أو ضيقة ، في حين ترتبط LTP بأشواك أكبر على شكل فطر.79,80 وبالتالي فمن المثير للاهتمام أن مجال تعاطي المخدرات قد ركز على التغيرات التي يسببها الدواء في العمود الفقري الشجيري لأكثر من 15 عامًا. التعرض المزمن ل العقاقير المنشطة من تعاطي يزيد من كثافة العمود الفقري شجيري من الخلايا العصبية الشوكية المتوسطة من NAc ، وهو التغيير الذي يسيطر على الخلايا العصبية من نوع Dl.67,81,82 ارتبطت تحريض العمود الفقري في الغالب بتدخلات سلوكية حساسة لهذه الأدوية ، على الرغم من أن بعض الأدلة تتعارض مع هذا الرأي.
كما هو الحال مع دراسات اللدونة متشابك ، ومع ذلك ، هناك حاجة إلى مزيد من العمل لتحديد النظام بشكل منتظم التغييرات في العمود الفقري شجيري التي تحدث أثناء مسار إدارة المخدرات الذاتية ، والانسحاب ، والانتكاس. Sيشير مصطلح "التحريسات" حتى الآن ، والذي يتضمن دواء محقق وعقار ذاتي ، إلى تغييرات مختلفة جدًا في العمود الفقري تحدث عند نقاط زمنية مختلفة للانسحاب وفي منطقة NAc shell مقابل المناطق الفرعية الأساسية.83-86 كما سيكون من المهم تحديد الآليات الجزيئية الدقيقة التي ينتج عنها الكوكايين أو أي منبه آخر هذه التأثيرات المحددة من النوع الخلوي. وقد تبين ΔFosB أن تكون ضرورية وكافية على حد سواء لتحريض العمود الفقري غير الناضجة على الخلايا العصبية من نوع NAc Dlc.35,51,67 يحدث هذا التنظيم بالتنسيق مع الكوكايين وتنظيم ΔFOSB للعديد من البروتينات المعروفة بالتحكم في إعادة تنظيم الهيكل الخلوي للأكتين. وكمثال واحد فقط ، فإن التنظيم النسخي لعديد من عوامل تبادل النوكليوتيدات الغوانية وبروتينات تنشيط GTPase يربح Rac1 ، وهو GTPase صغير ، للإنخفاض النقصي في النشاط استجابة لكل تعرض للكوكايين ، وقد تم إظهار هذا الانخفاض النابض في نشاط Rac1 ، باستخدام التحكم optogenetic من Rac1 ، للتوسط تحريض العمود الفقري غير الناضج.87 من المفترض أن تحدث هذه التأثيرات من خلال السيطرة على cofilin والبروتين التنظيمي الأخرى ، والتي ثبت أيضا أنها تتوسط تنظيم الكوكايين لنمو العمود الفقري.87,88 ومع ذلك ، من المهم التأكيد على أن هذا مجرد مسار واحد يشارك في تنظيم الكوكايين للأشواك غير الناضجة ، حيث ثبت أن العديد من البروتينات الأخرى تلعب دورًا أساسيًا أيضًا ، بما في ذلك CDK5 (كيناز 5 المعتمد على السيكلين) ، CaMKII ، NFkB و MEF2 و CREB و G9a و DNMT3 (DNA methyltransf erase 3a) ، على سبيل المثال لا الحصر.20,21,35,51,67,89,90 ومن المثير للاهتمام أن تنظيم الكوكايين للعديد من هذه الجينات ، بما في ذلك تحريض CDK5 ، و CaMKII ، و NFkB ، وقمع G9a ، يتم أيضًا توسطه عبر ΔFosB.20,35,51,91
والمثير للدهشة أن تعاطي المخدرات الأفيونية يمارس التأثير المعاكس ويقلل كثافة العمود الفقري الشجيري للخلايا العصبية الشوكية المتوسطة NAc..81 لا يعرف إلا القليل عن العواقب السلوكية لهذا التكيف والآليات الجزيئية الأساسية المعنية. هذه الظاهرة هي ومع ذلك ، من المستغرب ، بالنظر إلى أن CREB و ΔFosB يتم تحفيز كل من المنشطات والمواد الأفيونية وكلاهما متورط في تحريض بوساطة المنشطة من NEC شدة العمود الفقري dendritic. هذا يثير السؤال عن كيفية قمع المواد الأفيونية كثافة العمود الفقري NAc على الرغم من تحريض هذه العوامل.
الشكل الرئيسي الآخر من اللدونة المورفولوجية في نماذج تعاطي المخدرات هو الانخفاض المادي في حجم سوما الخلايا في الخلايا العصبية للدوبامين VTA المستحث بإدارة الأفيون المزمن..77,92,93 يحدث تكيف مماثل استجابة للقنب.94 هذا الانكماش من الخلايا العصبية الدوبامين VTA ، والذي يحدث مع الإدارة الذاتية الأفيونية93 وقد تم توثيقها في مدمني الهيروين البشري فحصت بعد الوفاة ،77 يبدو أنها تتوسط تحمل الثواب وترتبط بانخفاض إطلاق الدوبامين في NAc. تشير الأدلة الكبيرة الآن إلى أن هذا الانخفاض في حجم سوما الخلية يتوسط بواسطة قمع الأفيون لعامل عامل التغذية العصبي المشتق من الدماغ (BDNF) داخل هذه العصبونات. لقد ربطنا مباشرة هذا السحب الناجم عن الأفيون من دعم BDNF ، وتقلص الخلايا العصبية VTA ، إلى انخفاض النشاط في مجموعات الإشارات BDNF في اتجاه الأسفل في الخلايا العصبية الدوبامين VTA ، وتحديدا انخفاض نشاط IRS2 (مستقبلة الأنسولين substrate-2) ، AKT (سيرين ثريونين kinase) ، و TORC2 (هدف rapamycin-2 ، وهو غير حساس ل rapamycin).77,93 لقد ربطنا أيضًا هذا الانخفاض في إشارات BDNF مباشرة إلى زيادة الإثارة التي يسببها المورفين في هذه العصبونات ، كما أشرنا سابقًا.77,78 في الواقع ، يقترن بإحكام حجم سوما الخلية وانخفاض زيادة استثارة ، كما يؤدي الحث واحد إلى الآخر والعكس بالعكس. هذه السيطرة على استثارة الخلية ينطوي على قمع K.+ قنوات و GABAA الحالي في هذه الخلايا العصبية.
هذا الدور لـ BDNF في السيطرة على استجابات المورفين على مستوى VTA يتناقض مع مشاركته المختلفة جدا في تصرفات الكوكايين والمنبهات الأخرى. تقوم المنشطات بدفع إشارات BDNF إلى NAc ، وهو تأثير ناجم عن زيادة التركيب المحلي لـ BDNF بالإضافة إلى زيادة الإفرازات من مناطق مختلفة.95 وعلاوة على ذلك ، فقد تبين أن زيادة إشارات BDNF في NAc ، ولكن ليس في VTA ، تعزز التأثيرات السلوكية لهذه الأدوية بما في ذلك إدارتها الذاتية.95,96 يثير التنظيم المعاكس لإشارات BDNF في مسار VTA-NAc بواسطة المواد الأفيونية مقابل المنشطات احتمال أن تتوسط هذه الاختلافات في التنظيم المعاكس للعقاقير لأشواك NAc المتغصنة ، وهو احتمال قيد التحقيق الآن.
الاتجاهات المستقبلية
تؤكد السرد أعلاه على التقدم الهائل الذي تم إحرازه في فهم التكيّفات الجزيئية والخلوية التي تحدث في مناطق مكافآت الدماغ استجابة للتعرض المتكرر لدواء من تعاطي ، وفي ربط التكيفات الفردية لبعض السمات السلوكية لمتلازمات الإدمان في النماذج الحيوانية . على الرغم من هذه التطورات ، لا تزال هناك أسئلة رئيسية. تركز معظم معرفتنا الحالية على VTA و NAc ، مع توفر معلومات أقل بكثير عن مناطق الدماغ الحوفي الرئيسية الأخرى التي تعتبر ضرورية أيضًا لإدمان المخدرات. بالإضافة إلى ذلك ، فإن جميع العروض التجريبية للدور السببي للتكيف الجزيئي الخلوي في السلوك المتعلق بالمخدرات قد تلاعبت بالتكيفات الفردية في وقت واحد. ومن الواضح أن التلاعب بالعديد من التعديلات في نفس الوقت أمر أكثر صعوبة ، ولكنه أمر أساسي أيضًا ، لأننا نعلم أن العقاقير تنتج عددًا كبيرًا من أنواع التغييرات المتباينة حتى داخل الخلايا العصبية الفردية ، والتي من المرجح أن تختلط بطرق معقدة للتأثير على السلوك. سيكون مثل هذا النهج البيولوجى للأنظمة حاسما في القضاء على الأسس البيولوجية للإدمان. وأخيراً ، فإن الجهود الرامية إلى فهم الآليات الخلوية الجزيئية للذكريات المرتبطة بالإدمان تجد نفسها عند النقطة التي تكافح فيها جميع الجهود الأخرى لفهم الأساس البيولوجي للذاكرة السلوكية: فقدرتنا على ربط الظواهر البيولوجية بالذاكرة السلوكية المعقدة تظل صعبة للغاية. التغلب على هذه الفجوة ربما يمثل أكبر تحد في علم الأعصاب.
الاختصارات المختصرة والاختصارات
- NAC
- النواة المتكئة
- CREB
- بروتين ربط عنصر بروتين cAMP
- ΔFosB
- عامل نسخ عائلة فوس
- VTA
- منطقة tegmental بطني
- AMPA
- α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid
- LTD
- الاكتئاب على المدى الطويل
- LTP
- بروتوكولات طويلة الأجل
- BDNF
- عامل التغذية العصبية المشتق من الدماغ
- NKkB
- العامل النووي kB
المراجع