تعليق: أنتج هذا الاستعراض من قبل رئيس NIDA ، نورا Volkow ، وفريقها. ولا يترك مجالاً للشك في أن الإدمان الكيميائي والإدمان السلوكي يتشاركان في نفس الآليات أو ما شابهها والدارات العصبية. هذا يجعل من المنطقي تماما لأن الإدمان الكيميائي يختطف الدوائر العصبية للرابطة والجنس والأكل. بما أن الجنس يطلق ضعف كمية الدوبامين عند تناول الطعام المفضل لديك ، ويمكن لمستخدم إباحي أن يحافظ على ارتفاع الدوبامين لساعات ، فإنه من الجنون أن يقترح أن الإدمان الإباحي لا يمكن أن يوجد.
Curr Top Behav Neurosci. 2011 Oct 21.
Volkow ND، Wang GJ، Fowler JS، Tomasi D، Baler R.
مصدر
المعهد الوطني لتعاطي المخدرات ، 6001 Executive Boulevard 6001، Room 5274، Bethesda، MD، 20892، USA، [البريد الإلكتروني محمي].
ملخص
يمكن تعريف كل من إدمان المخدرات والبدانة على أنها اضطرابات تتحسن فيها قيمة الصلاحيات لنوع واحد من المكافأة (الأدوية والأغذية ، على التوالي) بالنسبة إلى ، وعلى حساب الآخرين. يتوافق هذا النموذج مع حقيقة أن كلا من الأدوية والطعام لهما تأثيرات تقوية قوية - تتوسطها جزئيًا زيادات الدوبامين في الجهاز الحوفي - والتي ، في ظل ظروف معينة أو في الأفراد الضعفاء ، يمكن أن تطغى على آليات التحكم في التماثل الساكن في الدماغ. وقد أوجد مثل هذا التشابه اهتماما كبيرا في فهم نقاط الضعف المشتركة والمسارات بين الإدمان والسمنة. والآن ، بدأت اكتشافات تصوير الدماغ بكشف الملامح المشتركة بين هذين الشرطين وتحديد بعض من دوائر الدماغ المتداخلة التي قد تفسر اختلالات وظيفية القصور النمطية والسلوكية المرتبطة بها في المواد البشرية. تيتشير النتائج إلى أن كلا من الأفراد الذين يعانون من السمنة والمدمنين على المخدرات يعانون من ضعف في مسارات الدوبامين التي تنظم النظم العصبية المرتبطة ليس فقط مع حساسية المكافأة والحافز الحافز ، ولكن أيضا مع تكييف (الذاكرة / التعلم) ، والتحكم في الاندفاع (تثبيط سلوكي) ، والتفاعل الإجهاد والوعي البيني. هنا ، نقوم بدمج النتائج التي تم الحصول عليها في الغالب من التصوير المقطعي للانبعاثات البوزيترونية التي تلقي الضوء على دور الدوبامين في إدمان المخدرات والسمنة ، واقتراح نموذج عمل محدث للمساعدة في تحديد استراتيجيات العلاج التي قد تفيد كلا من هذه الشروط.
1 خلفيّة
2 دور الدوبامين في المكافأة الحادة للأدوية والمواد الغذائية
3 التصوير DA في الاستجابة للأدوية وإلى إشارات الشرط في الإدمان
4 تأثير الخلل في التحكم التثبيطي
5 إشراك دوائر التحفيز
6 إشراك الدوائر الدائرية
7 دائرة النفور
8 مكافأة الدواء والغذاء الباثولوجي: نموذج عمل محدث
1 خلفيّة
يعتبر الدوبامين (DA) مفتاحًا للآثار المجزية للمكافآت الطبيعية والدوائية. ومع ذلك ، فإن دورها في فقدان السيطرة والسلوكيات القهرية التي ترتبط بالإدمان والسمنة أقل وضوحا. وقد لعبت الدراسات PET دورا حاسما في وصف دور أنظمة DA الدماغ في الإدمان (بالإضافة إلى دورها في مكافأة الدواء) والسمنة. في الواقع ، يتم استهلاك أدوية تعاطي (بما في ذلك الكحول) من قبل البشر أو تدار من قبل الحيوانات المختبرية ذاتيا لأنها مجزية بطبيعتها ، وهو التأثير الذي يتم بوساطة من خلال تحسين خصائص DA في النظام mesolimbic (الحكيم 2009). Hفي حالة الإدمان ، كشفت دراسات التصوير أن هذا الاضطراب لا يؤثر على دائرة المكافأة DA فحسب ، بل يؤثر أيضًا على مسارات DA الأخرى المستخدمة في تعديل التكييف / العادات ، والدوافع ، والوظائف التنفيذية (التحكم المثبط ، وإحالة البوق ، والقرار -العمل) ، وأن العجز في DA قد يشارك أيضًا في تفاعل الضغط المعزز وتعطيل الوعي البيني المرتبط بالإدمان. كما كشفت الدراسات السريرية قبل السريرية عن وجود ناقلات عصبية أخرى (ونيوروببتيد) التي تلعب أدوارًا مهمة في مكافآت الأدوية والإدمان. (أي ، القنب ، المواد الأفيونية) وتشارك بشكل وثيق في التغيرات العصبية التي تتبع تعاطي المخدرات المتكرر (على سبيل المثال ، الغلوتامات ، المواد الأفيونية ، GABA ، عامل إطلاق الكورتيكوتروبين). إن نظام الجلوتاميرات هو بارز بشكل خاص في هذا الصدد لأنه يتوسط الاضطرابات في كل من التكيّف طويل الأمد والاكتئاب طويل المدى الذي لوحظ في النماذج الحيوانية للإدارة المزمنة للمخدرات (توماس وآخرون. 2008). يمكن العثور على المراجعات المتعلقة بهذه الأنظمة الإضافية في مكان آخر (Kalivas 2009. كووب 1992).
بما أن الأدوية تُفعِّل أنظمة المكافآت نفسها التي تكمن وراء المكافأة الغذائية ، فليس من غير المتوقع تمامًا أن تكون دراسات تصوير الدماغ ، بشكل عام ، قد دعمت فكرة أن الاضطرابات في الدارات المضبوطة DA تكون متورطة أيضًا في سلوكيات الأكل المرضية والقهرية.. إشارات الغذاء ، مثل إشارات المخدرات ، تزيد من DA خارج الخلوية الحافز ودفع الدافع للانخراط في السلوكيات اللازمة لشراء وتناول الطعام ، وتقديم أدلة على إشراك DA ليس فقط في مكافأة الغذاء ولكن أيضا في تحفيزية غير hedonic خصائص الغذاء (أي متطلبات السعرات الحرارية) وانخفاض في التحكم المثبط في فرط الإكراه القهري (Avena et al. 2008. فولكو وآخرون. 2008a).
هنا ، نستعرض النتائج من الدراسات التصويرية التي تركز على وجه التحديد على التداخلات في دوائر الدماغ التي تعطلت في السمنة وإدمان المخدرات. ومع ذلك ، تجدر الإشارة إلى أن تنظيم سلوكيات تناول الطعام أكثر تعقيدًا بكثير من تنظيم تناول الدواء. يتوسط هذا الأخير من خلال التأثيرات المكافئة للأدوية ، في حين أن التأثير الأول لا يتشكل فقط من خلال التأثيرات المجزية (العوامل المؤثرة) ، ولكن أيضًا بالعديد من العوامل المحيطية والمركزية التي تستشعر متطلبات المغذيات في الجسم الضروري للبقاء (العوامل المثبطة). ومن المثير للاهتمام ، أن هناك أدلة متزايدة على أن العوامل التمازئية (مثل الأنسولين ، واللبتين ، والغريلين) تعدل كمية الطعام المتناولة جزئياً عن طريق زيادة أو تقليل حساسية دارات مكافآت الدماغ إلى المنبهات الغذائية (Volkow et al. 2011a).
2 دور الدوبامين في المكافأة الحادة للأدوية والمواد الغذائية
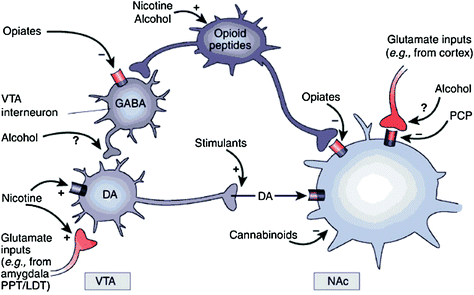
سواء بشكل مباشر أو غير مباشر ، فإن جميع الأدوية المدمنة تظهر قدرة على زيادة DA في النواة المتكئة (NAc) عبر تفاعلات محددة مع أهداف جزيئية مختلفة (Nestler 2004) (تين. 1). مسار DA mesolimbic [يبدو أن خلايا DA في منطقة tegmental البطنية (VTA) التي تبرز في NAc) تكون حاسمة لمكافأة العقاقير (Wise) 2009). ومع ذلك ، كما هو موضح أدناه ، تساهم مسارات DA الأخرى [mesostriatal (خلايا DA في إسقاط المادة السوداء في المخطط الظهري) و mesocortical (خلايا DA في VTA التي تسقط في القشرة الأمامية)] أيضًا في مكافئة العقاقير والإدمان (Wise) 2009). بشكل عام ، يبدو أن تأثيرات المكافأة والتكيف من المخدرات هي مدفوعة في الغالب عن طريق إطلاق الخلية DA طوري ، مما يؤدي إلى زيادات كبيرة وعابرة DA. على النقيض من ذلك ، ترتبط التغييرات في اتجاه التنفيذ في الوظيفة التنفيذية التي تحدث في حالة الإدمان بالتغييرات في إطلاق DA للخلايا المنشط وتؤدي إلى مستويات DA أقل ولكنها أكثر استقرارًا (Grace 2000. وانات وآخرون. 2009). هذا ، بدوره ، يشير إلى مستقبلات D1 (D1R) ، وهي مستقبلات DA منخفضة التقارب التي تحفز تشوير AMP الدوري ، كما تشارك في كل من المكافأة الدوائية الحادة وكذلك في التكييف ، لأن هذه ترتبط بتركيزات DA عالية ضرورية لتحفيز D1R. في المقابل ، يتم تحفيز D2Rs ، التي تمنع إشارات AMP الحلقية ، من خلال كل من DA الطوري والمنشط. لاحظ أنه نظرًا لعدم وجود أجهزة إشعاع خاصة لتصوير PET لمستقبلات DA من D1 و D3 و D4 و D5 ، فقد ركزت معظم الدراسات حول تأثيرات تعاطي المخدرات والإدمان في الدماغ البشري على D2R.
التين 1 تتعاطى أدوية إساءة المعاملة على المكافآت والدارات المساعدة من خلال آليات مختلفة ، ومع ذلك ، فإنها تؤدي جميعها إلى تأثيرات دوبامين مماثلة في VTA و NAc. وهكذا ، فإن المنشطات تزيد من الأضداد DA مباشرة ، في حين تقوم الأفيونات بذلك عن طريق خفض النغمة المثبطة لـ GABAergic interneurons على DA التي تشير إما في VTA أو في NAc. في حين أن آليات تعاطي المخدرات الأخرى أقل وضوحًا ، هناك أدلة تشير إلى أن النيكوتين قد ينشط VTA DA مباشرة من خلال مستقبلات أستيل النيكوتين (nAChR) على تلك الخلايا العصبية وبشكل غير مباشر عن طريق تحفيز مستقبلاتها على محطات العصب الجلوتيرماتي التي تعصب خلايا DA. يبدو أن الكحول يمنع المطاريف GABAergic في VTA ، مما يؤدي إلى إزالة الخلايا العصبية DA العصبية في VTA. يعمل الكانابينويدز ، من بين أمور أخرى ، من خلال تفعيل مستقبلات CB1 على أطراف العصب الجلدي و GABAergic في NAc ، وعلى الخلايا العصبية NAc نفسها. Phencyclidine (PCP) قد يعمل عن طريق تثبيط مستقبلات الغلوتامات NMDA ما بعد المشبك في NAc. بالإضافة إلى ذلك ، هناك بعض الأدلة التي تشير إلى أن النيكوتين والكحول قد يتفاعلان أيضًا مع مسارات المواد الأفيونية والقنبية الذاتية المنشأ (غير موضحة). PPT / LDT ، عقرب pontine tegmentum / tegmentum ظهري جانبي. أعيد طبعها بإذن Nestler (2005)
في البشر ، أظهرت دراسات PET أن العديد من الأدوية [المنشطات (Drevets et al. 2001. فولكو وآخرون. 1999b) ، والنيكوتين (برودي وآخرون. 2009) ، الكحول (Boileau et al. 2003) والماريجوانا (Bossong et al. 2009)] زيادة DA في المخطط الظهري والبطني (حيث يوجد NAc). تستفيد هذه الدراسات من العديد من أجهزة الإشارة الراديوية ، مثل [11C] raclopride ، التي ترتبط بـ D2R ولكن فقط عندما تكون هذه غير مرتبطة بـ DA (غير مشغول) ، والذي يتوافق مع شروط خط الأساس 85 - 90٪ من المخطط D2R (Abi-Dargham et al. 1998). وبالتالي ، فإن المقارنة بين [11C] يمكن أن يساعدنا ربط راكلوبرايد بعد العلاج الوهمي وبعد إعطاء الدواء في تقدير النقص في توافر D2R الناجم عن العقار (أو المحفزات الأخرى التي يمكن أن تزيد DA). هذه النقصان في [11C] ربط raclopride تتناسب مع زيادات DA (Breier et al. 1997). وقد أظهرت هذه الدراسات أن زيادات DA التي يسببها الدواء في المخطط هي متناسبة مع شدة التجربة الذاتية للنشوة أو "عالية" [راجع مراجعة (Volkow et al. 2009a)] (تين. 2).
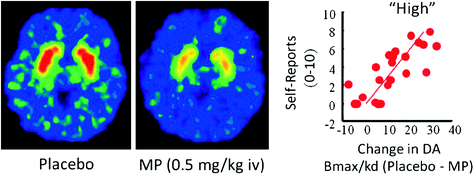
التين 2 آثار الميثيلفينيديت (الوريد) في الوريد في ملزمة راكليوبرايد والعلاقة بين الزيادات DA سترد الناجمة عن النائب في المخطط والتقارير الذاتية من "عالية". معدلة من فولكو وآخرون. (1999b)
وكشفت دراسات PET أيضًا عن علاقة واضحة ومباشرة بين الملف الدوائي للدواء (أي السرعة التي يدخل بها ويخرجها الدماغ) وتأثيراتها التعزيزية. على وجه التحديد ، كلما كان الدواء أسرع يصل إلى مستويات الذروة في الدماغ كلما كان "عاليًا" أكثر كثافة (Volkow et al. 2009a). على سبيل المثال ، بالنسبة لمستوى مكافئ من الكوكايين يصل إلى الدماغ (تم تقييمه من خلال PET) ، عندما دخل الكوكايين الدماغ بسرعة (إدارة المدخنة أو 4) ، فإنه أثار "ارتفاعًا" أكثر كثافة مما كان عند دخوله بمعدل أبطأ (شخير) (فولكو وآخرون. 2000). ويتسق هذا مع الدراسات قبل السريرية التي تظهر وجود ارتباط مماثل بين الملف الدوائي للدواء وخصائصه التعزيزية (Balster and Schuster 1973). أنامن المعقول أن نفترض أن مثل هذه الزيادات المفاجئة والكبيرة في DA كما تسببها تعاطي المخدرات قد تحاكي الزيادات السريعة والكبيرة في DA التي تنجم عن إطلاق DA طوري التي ارتبطت ، في الدماغ ، بمعالجة المعلومات حول المكافأة والصلاحية (شولتز 2010). قد تكون هذه الزيادات في DA التي يسببها الدواء في NAc ضرورية للإدمان ، ولكن حقيقة أنها تحدث أيضا في الأفراد غير المدمنين تشير إلى أنها غير كافية لشرح استخدام المخدرات المندفع والقسري الذي يميز الإدمان.
هناك الآن دليل على أن الاستجابات المشابهة للدوبامين مرتبطة بمكافأة الغذاء وأن هذه الآليات من المحتمل أن تلعب دوراً في الاستهلاك المفرط للغذاء والبدانة. من المعروف أن بعض الأطعمة ، خاصة تلك الغنية بالسكريات والدهون ، تكون مجزية بشكل كبير (Lenoir et al. 2007). يمكن للأطعمة ذات السعرات الحرارية العالية أن تشجع على الإفراط في الأكل (الأكل غير المفصول عن الاحتياجات الحيوية) وتحفز الارتباطات المعرفية بين المنبه والمكافأة (التكييف). من الناحية التطورية ، كانت خاصية الأغذية المستساغة مفيدة في البيئات التي كانت فيها مصادر الغذاء نادرة و / أو غير موثوقة ، لأنها تضمن تناول الطعام عند توفره ، مما مكن من تخزين الطاقة في الجسم (كدهن) للاستخدام في المستقبل . لسوء الحظ ، في مجتمعات مثل مجتمعنا ، حيث يتوفر الغذاء بكثرة ومتوفر باستمرار ، أصبح هذا التكيف مسؤولية.
هناك العديد من الناقلات العصبية ، بما في ذلك DA ، و cannabinoids ، والمواد الأفيونية ، والسيروتونين ، بالإضافة إلى الهرمونات و neuropeptides المتضمنة في تنظيم التثبيط من المتحصلات الغذائية ، مثل الأنسولين ، orexin ، leptin ، و ghrelin ، وقد تورطوا في الآثار المجزية للأغذية (Atkinson) 2008. Cason وآخرون. 2010. كوتا وآخرون. 2006). ومن بين هذه ، كان DA هو الأكثر بحثًا بدقة وهو أفضل وصف. وقد أظهرت التجارب في القوارض أنه عند التعرض الأول لمكافأة الطعام ، يزداد إطلاق الخلايا العصبية DA في VTA مع زيادة ناتجة في إطلاق DA في NAc (Norgren et al. 2006). وبالمثل ، في موضوعات بشرية سليمة وذات وزن طبيعي ، أظهر تناول طعام مستساغ ليطلق DA في المخطط الظهري بما يتناسب مع درجات متعة وجبة الطعام (Small et al. 2003) (تين. 3). ومع ذلك ، وكما رأينا في الدراسات التي أجريت مع متعاطي المخدرات ، فإن الزيادات التي يسببها الغذاء في الغدة الدنا المحنك يمكن فقط أن تفسر الفرق بين الاستهلاك الغذائي الطبيعي والإفراط في استهلاك الغذاء القهري لأن هذه تحدث أيضا في الأفراد الأصحاء الذين لا يأكلون بشكل مفرط. وهكذا ، كما هو الحال بالنسبة للإدمان ، من المحتمل أن تكون التكيفات في اتجاه المصب تشارك في فقدان السيطرة على مدخول الطعام.
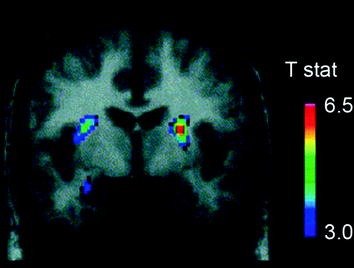
التين 3 إفراز الدوبامين الناجم عن التغذية. قسم الاكليلية من T-map من تخفيضات ذات دلالة إحصائية في [11C] احتمال ربط راكلوبرايد (BP) بعد التغذية. يمثل شريط الألوان قيم إحصاء t. (أعيد طبعها بإذن Small et al. 2003)
3 التصوير DA في الاستجابة للأدوية وإلى إشارات الشرط في الإدمان
إن دور DA في التعزيز أكثر تعقيدًا من مجرد الترميز من أجل المكافأة في حد ذاتها (متعة المتعة) ؛ على سبيل المثال ، تؤدي المحفزات التي تحفز زيادة DA السريعة والكبيرة أيضًا إلى استجابات مشروطة وتثير دافعًا محفزًا للحصول عليها (Owesson-White et al. 2009). وهذا أمر مهم لأنه ، من خلال عملية التكييف ، تكون المنبهات المحايدة المرتبطة بالدعم المعزّز (سواء الطبيعي أو معزز المخدرات) تكتسب القدرة في حد ذاتها على زيادة DA في المخطط (بما في ذلك NAc) تحسبًا للمكافأة ، وهكذا دافع قوي للبحث عن الدواء (Owesson-White et al. 2009). ومع ذلك ، فإن المكافأة غير المكافئة وآليات التكييف في عملية إدمان المخدرات هي أكثر تحديا من استهلاك الغذاء لأن أدوية الإدمان ، من خلال تأثيراتها الدوائية ، تنشط مباشرة عصبونات DA (أي النيكوتين) أو تزيد من إطلاق DA (أي الأمفيتامين).
أظهرت دراسات تصوير الدماغ التي قارنت زيادات DA التي يسببها عقار المنشطة methylphenidate (MP) أو الأمفيتامين (AMPH) بين مدمني الكوكايين مقابل عناصر التحكم توهينًا ملحوظًا للـ MP أو AMPH التي يسببها زيادات DA في المخطط (50٪ أقل في المسيئين الذين يزيلون السموم و 80٪ في المتعاطيين النشطين) وتقارير ذاتية أقل عن التأثيرات المجزية للعقار مقارنةً بالضوابط غير المسيطرة على المخدرات (Martinez et al. 2007. فولكو وآخرون. 1997) (تين. 4). كان هذا مفاجئًا لأن MP و AMPH يشبهانًا من الناحية الصيدلانية الكوكايين والميثامفيتامين ، على التوالي ، ولا يمكن لمدمني المخدرات التمييز بينهم عندما يتم إعطائهم عن طريق الوريد. منذ أن لوحظت التخفيضات الملحوظة في زيادة DA المستحثة بالمخدرات فيما إذا كان منتهكي الكوكايين قد تمت إزالة سمومهم أم لا ، فإن هذا يشير إلى أن حالة الانسحاب ليست عاملًا مربكًا (Volkow et al. 2011b). هذه والنتائج ذات الصلة (Volkow وآخرون. 2009a) تتفق مع الفرضية القائلة بأن الاستجابة hedonic تصبح ناقص في الأفراد المدمنين على المخدرات ، وزيادة تعزيز فكرة أن التأثيرات الدوائية الحادة DA تعزيز المخدرات في NAC لا يمكن أن يفسر من تلقاء نفسها الدافع المتزايد لاستهلاكها.
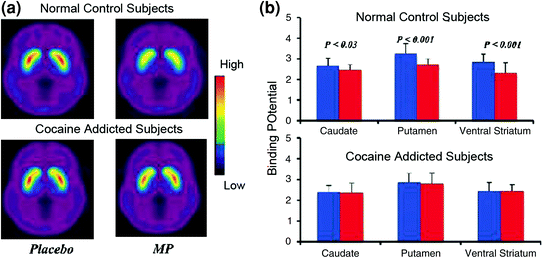
التين 4 التغييرات DA الناجمة عن النائب الرابع في الضوابط وفي موضوعات نشطة مدمن على الكوكايين. عدد صور إمكانات الإضافة غير المنتظمة (BPND)11C] raclopride في موضوعات نشطة المدمنين على الكوكايين (ن = 19) وفي الضوابط (ن = 24) اختبار بعد الغفل وبعد الرابع النائب. (ب) توافر D2R (BPND) في المذنبات ، والبوتامين ، والمخاطية البطنية بعد الغفل (الأزرق) وبعد MP (أحمر) في الضوابط وفي مدمني الكوكايين. خفض MP D2R في الضوابط ولكن ليس في مدمني المخدرات الكوكايين. لاحظ أن المتعاطين للكوكايين يظهران كل من النقصان في توافر خط الأساس D2R الأساسي (مقياس الغفل) وينقص في إصدار DA عند إعطاء iv MP (يتم قياسه كنقص في تيسر D2R من خط الأساس). على الرغم من أنه يمكن للمرء أن يشكك في المدى الذي يحدده انخفاض نسبة D2R في مادة مدمن الكوكايين في القدرة على اكتشاف المزيد من الانخفاضات من MP ، حقيقة أن المواد المدمنة على الكوكايين تظهر انخفاضًا في توافر D2R عند تعرضها لعشائر الكوكايين تشير إلى أن التأثيرات الموهنة من النائب على [11C] تعكس raclopride تجليد DA الافراج عنهم. أعيد طبعها بإذن (Volkow et al. 1997. وانج وآخرون. 2010)
استجابة الخلايا العصبية VTA DA لمكافأة محفزات التغييرات مع التعرض المتكرر.
بينما تطلق خلايا DA على أول تعرض لمكافأة جديدة ، يتسبب التعرض المتكرر لـ DA في توقف الخلايا العصبية عن إطلاق النار على المكافأة والاستهلاك بدلاً من ذلك عندما يتعرضون للمؤثرات التي تنبأت بالمكافأة. (شولتز وآخرون. 1997). من المحتمل أن يكون هذا هو أساس دور DA في التعلم والتكييف. وفي الواقع ، يمكن أن يؤدي التشوير الطوري DA الذي يسببه الدواء إلى تحفيز الخلايا العصبية في الدارات الإضافية المرتبطة بتكوين العادات والتكيف السلوكي. تييتم إحداث تغييرات hese في الغالب من قبل إشارات D1R والتغيرات متشابك في مستقبلات NMDA و AMPA تشكيل الغلوتامات (Luscher and Malenka 2011. زويفل وآخرون. 2009). إن توظيف هذه الدارات مهم في تطور المرض لأن الاستجابات الشرطية التالية تساعد على تفسير الرغبة الشديدة في الدواء (الشهوة) والاستخدام القهري الذي يحدث عندما يتعرض الأشخاص المدمنون إلى الإشارات المرتبطة بالعقاقير. تتفق هذه الفرضية مع الملاحظات المستقلة (Volkow et al. 2006b. وونغ وآخرون. 2006) التي تُظهر قوة التعرض المصاحب للكوكايين لرفع مستويات DA في المخطط الظهري وإحداث زيادة ملازمة في التجربة الذاتية للشغف بمدمني الكوكايين المدمنين (الشكل 2). 5). بما أن المخطط الظهاري يلعب دوراً في تعلم العادة (Belin et al. 2009. يين وآخرون. 2004) ، من المرجح أن تعكس الجمعية تقوية العادات مع تقدم الإدمان المزمن. هذا يشير إلى أن الاختلال الأساسي في الإدمان قد يرتبط باستجابات مشروطة DA-triggered التي تؤدي إلى عادات تؤدي إلى الرغبة الشديدة واستهلاك المخدرات القهري. ومن المثير للاهتمام ، في الاستخدام الفعال لموضوعات مدمن الكوكايين ، فإن زيادات DA التي تسببها الإشارات المكيفة تبدو أكبر من تلك التي أنتجها العقار المنبّه نفسه كما تم تقييمه في مجموعتين منفصلتين من الموضوعات (Volkow et al. 2011b, 2006b) ، مما يشير إلى أن الاستجابات المشروطة قد تدفع إشارات DA التي تحافظ على الدافع لتناول الدواء حتى عندما يبدو أن التأثيرات الدوائية لها أقل. وهكذا ، على الرغم من أن المخدرات قد تحفز في البداية على الشعور بالمكافأة الفورية من خلال إطلاق DA في المخطط البطني ، مع الاستخدام المتكرر ، ومع تطور العادة ، يبدو أن هناك تحولًا من الدواء إلى التحفيز المشروط. ووفقًا لدراسات أجريت في حيوانات المختبر ، فإن الإسقاطات الغلوتومية من القشرة المخية قبل الجبهية ومن اللوزة المخية إلى VTA / SN و NAc تتوسط هذه الاستجابات المكيفة (Kalivas). 2009). وبهذه الطريقة ، قد يصبح مجرد التنبؤ بالمكافأة هو المكافأة التي تحفز السلوك الضروري لاستهلاك الدواء (أو الغذاء).
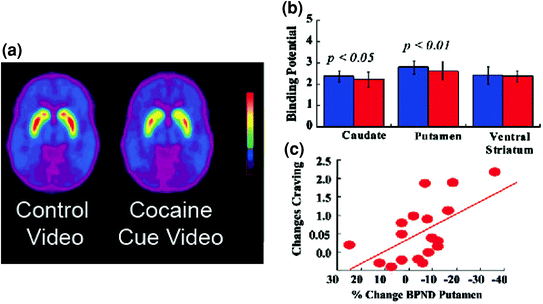
التين 5 تغييرات DA الناجمة عن إشارات مشروطة في موضوعات نشطة مدمن على الكوكايين. تم اختبار متوسط قدرة الربط غير المعقدة (BPND) لـ [11C] raclopride في مدمني الكوكايين (n = 17) أثناء مشاهدة فيديو محايد (مشاهد طبيعية) وبينما يشاهدون شريط فيديو عن الكوكايين (موضوعات تدار كوكائين). (ب) توافر D2R (BPND) في المذنبات ، والبوثامين ، والبنت المخططة للفيديو المحايدة (الأزرق) وعنصر فيديو الكوكايين (الأحمر). انخفضت عوامات الكوكايين D2R في المذنبات والبوتامين. (ج) الارتباطات بين التغيرات في D2R (التي تعكس زيادات DA) والتقارير الذاتية عن شغف الكوكايين الناجم عن فيديو الكوكايين. معدلة من المرجع. (فولكو وآخرون. 2006b)
Iومما يبعث على التفاؤل ، أن هذا النوع من "التبديل" الوظيفي قد تم الإبلاغ عنه أيضًا للعوامل المعززة الطبيعية ، والتي من المحتمل أن تحفز على حدوث تحول مكافئ وتدريجي في زيادات DA ، من البطين إلى المناطق الظهارية أكثر من المخطط خلال الانتقال من حافز جديد يكون في الأصل مكافأة على ذلك من الإشارات المرتبطة التي تتنبأ بها. يتم نقل هذا الانتقال من خلال إشارات DA ، والتي يبدو أنها ترمز إلى "خطأ في التنبؤ بالمكافأة" (شولتز 2010). الاعفاءات الغلوتومية الموسعة لعصبات DA من المناطق التي تشارك في معالجة الحواس (insula أو القشرة الذوقية الأولية) ، التوازي (hypothalamus) والمكافأة (NAc) والعاطفي (amygdala و hippocampus) ، و multimodal (cortex orbitofrontal cortex) تعديل نشاطها استجابة للمكافآت والمنبهات المكيفة (Geisler and Wise 2008). وبشكل أكثر تحديدًا ، فإن الإسقاطات من اللوزة والقشرة الأوربية الأمامية (OFC) إلى الخلايا العصبية DA و NAc تشارك في استجابات مشروطة للغذاء (بتروفيتش 2010). في الواقع ، أظهرت الدراسات التصويرية أنه عندما طُلب من الرجال غير البدينين أن يثبطوا شغفهم بالطعام - في الوقت الذي يتعرضون فيه لإشارات الطعام - أظهروا نشاطًا استقلابيًا منخفضًا في اللوزة المخية و OFC (وكذلك في الحصين) ، insula و striatum ، وأن الانخفاض في OFC كان مرتبطا بتخفيضات في شغف الطعام (Wang et al. 2009). وقد لوحظ تثبيط مماثل للنشاط الأيضي في OFC (وكذلك في NAc) في متعاطي الكوكايين عندما طُلب منهم تثبيط شغفهم المخدرات عند التعرض لعرائس الكوكايين (Volkow et al. 2009b).
ومع ذلك ، فإن ظهور مثل هذه الرغبة الشديدة القوية ، والتي تحدث للأطعمة الصحية لدى الأفراد الذين لا يتناولون وجبة خفيفة ، لن يكون مدمراً إذا لم يقترنوا بعجز متزايد في قدرة الدماغ على تثبيط السلوكيات غير المؤثرة.
4 تأثير الخلل في التحكم التثبيطي
من المؤكد أن القدرة على منع الاستجابات البؤرية تسهم في قدرة الفرد على تجنب الانخراط في سلوكيات غير ملائمة ، مثل تعاطي المخدرات أو تناولها بعد نقطة الشبع ، وبالتالي زيادة ضعفه / إصابتها بالإدمان (أو السمنة) (Volkow و Fowler) 2000. فولكو وآخرون. 2008a).
كشفت دراسات PET عن انخفاض كبير في توافر D2R في موضوعات مدمنة تستمر لأشهر بعد إزالة السموم الممتدة [تمت مراجعتها في (Volkow et al. 2009a)]. وبالمثل ، أظهرت الدراسات قبل السريرية في الرئيسيات القوارض وغير البشرية أن التعرض المتكرر للمخدرات يرتبط بالتخفيضات في مستويات D2R المخطط (Nader et al. 2006. ثانوس وآخرون. 2007. فولكو وآخرون. 2001). في المخطط ، تتوسط D2Rs الإشارات في المسار غير المخطط للجناح الذي ينظم المناطق قبل الجبهية ؛ وقد ثبت أن خفضه يؤدي إلى تعزيز التوعية بآثار المخدرات في النماذج الحيوانية (Ferguson et al. 2011). في البشر المدمنين على المخدرات ، يرتبط انخفاض معدل الجين D2R بانخفاض نشاط مناطق الفص الجبهي كما يتضح من النقصان في استقلاب الجلوكوز الأساسي (علامة دالة الدماغ) في OFC ، التلفيف الحزامي الأمامي (ACC) ، والقشرة الأمامية الجبهية الظهرية (DLPFC) ) (فولكو وآخرون. 2001, 1993, 2007) (تين. 6). بما أن OFC و ACC و DLPFC متورطة في إسناد البراعة والتحكم المثبط / تنظيم العواطف وصنع القرار على التوالي ، وقد افترض أن تنظيمها غير المناسب من خلال إشارة DA D2R بوساطة موضوعات مدمنة يمكن أن تكمن وراء القيمة التحفيزية المعززة للعقاقير في سلوكها وفقد السيطرة على تناول الدواء (Volkow و Fowler) 2000). بالإضافة إلى ذلك ، لأن الإعاقات في OFC و ACC مرتبطة بالسلوكيات القهرية والاندفاعية (Fineberg et al. 2009) ، من المرجح أن تساهم التعديلات المعطلة في هذه المناطق في DA في تعاطي المخدرات القهري والمندفع في الإدمان (Goldstein و Volkow 2002). في الواقع ، في متعاطي الميثامفيتامين ، كانت نسبة الدنا المنخفضة D2R مرتبطة بالاندفاع (Lee et al. 2009) ، وتوقع أيضا إدارة الكوكايين القهري في القوارض (Everitt et al. 2008). سيناريو عكسي ، والذي يمكن أن يحدث فيه أيضا ضعف أولي لاستخدام الدواء في السابق في المناطق قبل الجبهية ، وحيث يتكرر تعاطي المخدرات يؤدي إلى مزيد من الانخفاض في مخطط D2R ، ممكن أيضا. في الواقع ، أجريت دراسة في الأشخاص الذين ، على الرغم من وجود مخاطر عالية للإدمان على الكحول (التاريخ العائلي الإيجابي للإدمان على الكحول) لم تكن مدمنين على الكحول ، وكشفت أعلى من المعدل الطبيعي D2R توافر التي ارتبطت مع الأيض الطبيعي في OFC ، ACC ، و DLPFC (Volkow وآخرون. 2006a). هذا يشير إلى أنه ، في هذه المواضيع المعرضة لخطر إدمان الكحول ، تم ربط الوظيفة الجبهية العادية مع إشارة D2R المعززة المحسنة ، والتي بدورها قد تحميهم من تعاطي الكحول.
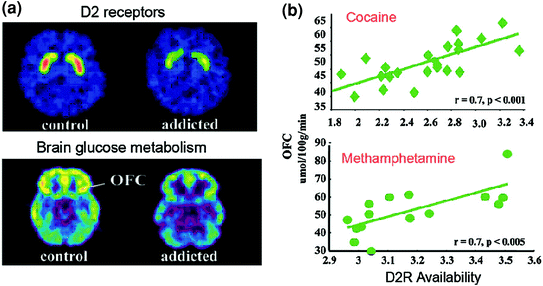
التين 6 الارتباط بين توافر D2R في الجسم والأيض في مناطق الدماغ قبل الجبهية. صور دماغية محورية للتحكم في مادة مدمن على الكوكايين للحصول على صور خط الأساس من توافر D2R في المخطط (تم الحصول عليه باستخدام [11C] raclopride) واستقلاب جلوكوز الدماغ في OFC (تم الحصول عليه باستخدام [18FDG). (ب) الارتباطات بين الـ D2R ومثيل الأيض في OFC في مدمني الكوكايين والمدمنين على الميثامفيتامين. أعيد طبعه من فولكو وآخرون. (2009a) حقوق الطبع والنشر (2009) ، بإذن من Elsevier
بشكل متوقع ، تم العثور على أدلة على خلل في دارات التحكم بين الأفراد الذين يعانون من السمنة المفرطة. قدمت كل من الدراسات قبل السريرية والسريرية دليلا على انخفاض إشارة D2R مخططية ، والتي ، كما ذكر أعلاه ، ترتبط بالمكافأة (NAc) ولكن أيضا مع وضع العادات والروتين (المخطط الظهري) في البدانةy (Geiger et al. 2009. وانج وآخرون. 2001). الأهم من ذلك ، فقد تم الربط بين انخفاض توافر النسيج D2R إلى تناول الطعام القهري في القوارض البدينة (جونسون وكيني 2010) مع انخفاض النشاط الاستقلابي في OFC و ACC في البشر البدينين (Volkow et al. 2008b) (تين. 7من أ إلى ج). بالنظر إلى أن الخلل الوظيفي في OFC و ACC يؤدي إلى الإكراه [انظر مراجعة (Fineberg et al. 2009)] ، قد يكون هذا جزءًا من الآلية التي يسهِّل بها إرسال D2R المنخفض المخطط للجثث فرط البؤس (Davis et al. 2009). بالإضافة إلى ذلك ، نظرًا لأن انخفاض التشوير المتصل بـ D2R من المرجح أيضًا أن يقلل من الحساسية للمكافآت الطبيعية الأخرى ، فإن هذا العجز في الأفراد البدناء قد يساهم أيضًا في إفراط تعويضي (جيجر وآخرون. 2008).
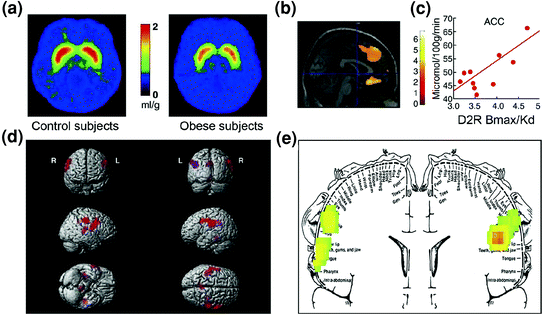
التين 7 يمكن أن ينتج فرط البلعمة من محرك للتعويض عن دائرة المكافأة الضعيفة (التي تتم معالجتها من خلال دوائر الكورتيكوستريبات الخاضعة للرقابة من الدوبامين) إلى جانب الحساسية الشديدة للاستساغة (الخصائص الغذائية للأطعمة المعالجة جزئياً من خلال القشرة الحسية الجسدية).. أ متوسط الصور لتوافر مستقبلات DA D2 (D2R) في عناصر التحكم (ن = 10) وفي الأشخاص الذين يعانون من السمنة المفرطة (ن = 10). ب النتائج من (الخرائط الإحصائية البارامترية) SPM التي تحدد المناطق في الدماغ حيث ارتبط D2R بعملية التمثيل الغذائي للجلوكوز ، وشملت هذه النتائج الوسطية OFC و ACC و PFC الظهراني (المنطقة غير معروضة). ج منحدر الانحدار بين D2R المخطط والنشاط الأيضي في ACC في الأشخاص الذين يعانون من السمنة المفرطة. د صور SPM ثلاثية الأبعاد تُظهر المناطق ذات التمثيل الغذائي العالي في السمنة مقارنة بالموضوعات الخالية من الدهون (P <0.003 ، غير مصححة). يتم عرض نتائج SPM المرمزة بالألوان في مستوى إكليلي مع رسم تخطيطي متراكب من الحسية الجسدية. يتم تقديم النتائج (قيمة z) باستخدام مقياس قوس قزح حيث الأحمر> الأصفر> الأخضر. عند مقارنتها مع الأشخاص النحيفين ، كان لدى الأشخاص الذين يعانون من السمنة المفرطة معدل استقلاب أساسي أعلى في المناطق الحسية الجسدية حيث يتم تمثيل الفم والشفتين واللسان والتي تشارك في معالجة استساغة الطعام. تم التعديل بإذن من Volkow et al. (2008a) (a – c) and Wang et al. (2002) (د ، هـ)
تتفق هذه الفرضية مع الأدلة قبل السريرية التي تبين أن انخفاض نشاط DA في VTA يؤدي إلى زيادة كبيرة في استهلاك الأطعمة الغنية بالدهون (Stoeckel et al. 2008). وبالمثل ، بالمقارنة مع الأفراد ذوي الوزن الطبيعي ، أظهر الأفراد الذين يعانون من السمنة المفرطة الذين تم تقديمهم مع صور الغذاء ذات السعرات الحرارية العالية (المنبهات التي يتم تكييفها) زيادة التنشيط العصبي في المناطق التي هي جزء من دوائر المكافأة والدوافع (NAc ، المخطط الظهري OFC ، OFC و ACC و amygdala و hippocampus و insula) (Killgore and Yurgelun-Todd 2005). على النقيض من ذلك ، في ضوابط الوزن الطبيعي ، وجد أن تنشيط الـ ACC و OFC (المناطق التي تشارك في إحالة البراعة التي تصل إلى NAc) أثناء عرض الطعام عالي السعرات يرتبط ارتباطًا سلبيًا بمؤشر كتلة الجسم (BMI) ( Stice et al. 2008b). وهذا يشير إلى تفاعل ديناميكي بين كمية الطعام التي يتم تناولها (التي تنعكس في جزء منها في مؤشر كتلة الجسم) وتفاعل مناطق المكافأة مع الطعام ذي السعرات الحرارية العالية (ينعكس في تنشيط OFC و ACC) في الأفراد ذوي الوزن الطبيعي ، والذي يتم فقده في بدانة.
من المثير للدهشة أن الأفراد الذين يعانون من السمنة أظهروا تنشيطًا أقل لدارات المكافأة من الاستهلاك الفعلي للأغذية (يُشار إليهم كمكافأة غذائية تكميلية) من الأفراد الهزيلين ، في حين أظهروا زيادة في تفعيل المناطق القشرية الحسية الجسدية التي تعالج الاستساغة عندما يتوقعون الاستهلاك (Stice et al. 2008b). تتطابق الملاحظة الأخيرة مع المناطق التي كشفت فيها دراسة سابقة عن نشاط معزز في موضوع بدين تم اختباره عند خط الأساس (عدم التحفيز) (Wang et al. 2002) (تين. 7د ، هـ). يمكن أن يؤدي النشاط المعزز للمناطق التي تعالج استساغة الجسم إلى جعل المواد السمينة تفضل تناول الطعام على المعززات الطبيعية الأخرى ، في حين أن انخفاض تفعيل الأهداف الدوبامينية من خلال الاستهلاك الفعلي للأغذية قد يؤدي إلى زيادة الاستهلاك كوسيلة للتعويض عن إشارات ضعيفة بوساطة D2R (Stice et al. 2008a). ويذكر هذا الرد المنخفض لدائرة المكافأة على استهلاك الطعام في المواد السمينة بالزيادات المخفضة في DA الناجمة عن استهلاك المخدرات لدى الأفراد المدمنين بالمقارنة مع الأشخاص غير المدمنين.
تلعب القشرة الجبهية الأمامية (PFC) دوراً حاسماً في الوظيفة التنفيذية ، بما في ذلك التحكم المثبط (Miller and Cohen). 2001). يتم تشكيل هذه العمليات من قبل D1R و D2R (يفترض أيضا D4R) وبالتالي ، فإن النشاط المنخفض في PFC ، سواء في الإدمان أو في السمنة ، من المرجح أن يساهم في ضعف السيطرة والالتهابية العالية. التوافر الأقل من المعتاد لـ D2R في مخطط الأفراد البدينين ، والذي ارتبط بانخفاض النشاط في PFC و ACC (Volkow et al. 2008bلذلك من المرجح أن تساهم في سيطرتهم الناقصة على تناول الطعام. في الواقع ، فإن العلاقة السلبية بين مؤشر كتلة الجسم ومعدلات D2R في البدانة (Wang et al. 2001) والوزن الزائد (Haltia et al. 2007a) يدعم الأفراد هذا. إن الفهم الأفضل للآليات التي تؤدي إلى اختلال وظيفة PFC في السمنة (أو الإدمان) يمكن أن ييسر تطوير استراتيجيات لتحسين أو ربما عكس إعاقات محددة في المجالات الإدراكية الحاسمة. على سبيل المثال ، يعتبر خصم التأخير ، وهو الميل إلى تخفيض قيمة المكافأة كدالة للتأخير الزمني لإيصالها ، من أكثر العمليات الإدراكية التي يتم بحثها على نطاق واسع فيما يتعلق بالاضطرابات المرتبطة بالاندفاع والاقتباس. وقد تم إجراء فحص للتخفيض بشكل أكثر شمولاً في متعاطي المخدرات الذين يظهرون تفضيل مبالغ فيه مقابل مكافآت كبيرة ولكن فورية (Bickel et al. 2007). ومع ذلك ، فإن الدراسات القليلة التي أجريت مع الأفراد البدينين قد كشفت أيضًا عن دليل على تفضيل مكافآت عالية ومباشرة ، على الرغم من تزايد احتمال معاناة خسائر مستقبلية أعلى (Brogan et al. 2010. ويلر وآخرون. 2008). ومؤخراً ، وجدت دراسة أخرى وجود علاقة إيجابية بين مؤشر كتلة الجسم والخصم الزائدي ، حيث يتم تخفيض المكاسب السلبية المستقبلية أقل من المكاسب الإيجابية المستقبلية (Ikeda et al. 2010). ومن المثير للاهتمام ، يبدو أن التخفيض التأخير يعتمد على وظيفة المخطط البطني (Gregorios-Pippas et al. 2009) و PFC ، بما في ذلك OFC الجانبي (Bjork et al. 2009) ، وحساسية لتلاعب DA (Pine et al. 2010). على وجه التحديد ، زاد تعزيز التشوير DA (مع العلاج L DOPA) الاندفاع والخصم الزمني.
5 إشراك دوائر التحفيز
الإشارات الدوبامينية أيضا تعدل الدوافع. إن الصفات السلوكية مثل النشاط والاستمرار واستثمار الجهد المستمر نحو تحقيق هدف ، كلها تخضع للتشكيل بواسطة DA تعمل من خلال عدة مناطق مستهدفة ، بما في ذلك NAc، ACC، OFC، DLPFC، amygdala، dorsal striatum، and ventral pallidum (Salamone et al. 2007). ويرتبط إشارات DA Dysregulated مع الدوافع المعززة لشراء الأدوية ، وهي السمة المميزة للإدمان ، وهذا هو السبب في أن الأفراد المدمنين على المخدرات غالباً ما ينخرطون في السلوكيات المتطرفة للحصول على الأدوية ، حتى عندما تنطوي على عواقب وخيمة وعميقة معروفة (Volkow and Li 2005). لأن أخذ المخدرات يصبح الدافع الرئيسي لتحفيز إدمان المخدرات (Volkow et al. 2003) ، يتم إثارة الموضوعات المدمنة وتحفيزها من خلال عملية الحصول على الدواء ولكنها تميل إلى أن تصبح مسرفة وغير مبالية عندما تتعرض للأنشطة غير المتعلقة بالمخدرات. وقد تمت دراسة هذا التحول من خلال مقارنة أنماط تنشيط الدماغ التي تحدث مع التعرض لمنبهات مشروطة مع تلك التي تحدث في غياب مثل هذه العظة. على النقيض من الانخفاضات في النشاط قبل الجبهي المبلغ عنها في منتهكي تعاطي الكوكايين المخلوط من السموم عندما لا يتم تحفيزها باستخدام العقاقير أو العقاقير [انظر مراجعة (Volkow et al. 2009a]] ، يتم تنشيط هذه المناطق قبل الجبهية عندما يتعرض المتعاطين للكوكايين لمثيرات تحفز الرغبة الشديدة (سواء المخدرات أو العظة) (Grant et al. 1996. فولكو وآخرون. 1999a. وانج وآخرون. 1999). هذه النتيجة تذكرنا بملاحظة أن منتهكي الكوكايين ، الذين درسوا بعد فترة قصيرة من نوبة تعاطي الكوكايين ، أظهروا زيادة في النشاط الاستقلابي في OFC و ACC (وهو أيضًا المخطط الظهري) الذي ارتبط بالحنان (Volkow et al. 1991).
علاوة على ذلك ، عندما تتم مقارنة الاستجابات لبروتين iv بين الأفراد المدمنين على الكوكايين وغير المدمنين ، استجاب الأول بزيادة الأيض في ACC البطنية و OFAL OFC (وهو تأثير مرتبط بالشغف) ، بينما أظهر الأخير استجابة معاكسة ، وهي أقل الأيض في هذه المناطق (Volkow et al. 2005). هذا يشير إلى أن تفعيل هذه المناطق قبل الجبهية مع التعرض للعقاقير قد يكون محددا للإدمان ويرتبط مع الرغبة المعززة للدواء. بالإضافة إلى ذلك ، أظهرت دراسة حثت مدمني الكوكايين على إعاقة الرغبة الشديدة عند تعرضهم لعقاقير ، أن هؤلاء الأشخاص الذين نجحوا في تثبيط شغفهم أظهروا انخفاض في عملية التمثيل الغذائي في الـ OFC الإنسي (الذي يعالج القيمة التحفيزية للمعزز) و NAc (الذي يتنبأ مكافأة) (Volkow وآخرون. 2009b). هذه النتائج تؤكد بشكل أكبر على تورط OFC ، لجنة التنسيق الإدارية ، والمخطط في الدوافع المعززة لشراء المخدرات ينظر في الإدمان.
ومن المتوقع أن يكون OFC متورطًا أيضًا في تحديد قيمة الملوحة في الغذاء (Grabenhorst et al. 2008. رولز ومكابي 2007) ، مما يساعد على تقييم اللطف والمتعة المتوقعة كدالة في سياقها. وأظهرت دراسات PET مع FDG لقياس أيض الجلوكوز في الدماغ لدى الأفراد ذوي الوزن الطبيعي أن التعرض لعواصف الغذاء يزيد من النشاط الاستقلابي في OFC ، وهو تأثير يرتبط بإدراك الجوع والرغبة في الغذاء (Wang et al. 2004). ومن المرجح أن يعكس التنشيط المحسّن لـ OFC بواسطة التحفيز الغذائي تأثيرات الدوبامين في المصب وأن يشارك في مشاركة DA في الدفع نحو استهلاك الغذاء. يلعب OFC دورًا في تعلم جمعيات تعزيز التحفيز والتكيف (Cox et al. 2005. Gallagher et al. 1999) ، ويدعم التغذيه المشروطة - تلقي الغذاء (Weingarten 1983) ، وربما يساهم في الإفراط في تناول الطعام بغض النظر عن إشارات الجوع (Ogden and Wardle) 1990). في الواقع ، تم ربط خلل في OFC بالإفراط في تناول الطعام (Machado و Bachevalier) 2007).
على الرغم من بعض التناقضات بين الدراسات ، تدعم بيانات تصوير الدماغ فكرة أن التغيرات البنيوية والوظيفية في مناطق الدماغ المتورطة في الوظيفة التنفيذية (بما في ذلك السيطرة المثبطة) قد ترتبط بارتفاع مؤشر كتلة الجسم لدى الأفراد الأصحاء. على سبيل المثال ، وجدت دراسة التصوير بالرنين المغناطيسي التي أجريت في النساء المسنات ، باستخدام morphometry القائم على voxel ، وجود علاقة سلبية بين BMI وحجم المادة الرمادية (بما في ذلك المناطق الأمامية) ، والتي ، في OFC ، كانت مرتبطة بوظيفة تنفيذية ضعيفة (Walther et al. 2010). باستخدام PET لقياس استقلاب الجلوكوز في الدماغ في الضوابط الصحية ، أبلغنا عن وجود علاقة سلبية بين مؤشر كتلة الجسم والنشاط الأيضي في DLPFC ، OFC ، و ACC. في هذه الدراسة ، تنبأ النشاط الأيضي في المناطق قبل الجبهية بأداء المشاركين في اختبارات الوظيفة التنفيذية (Volkow et al. 2009c). وبالمثل ، أظهرت دراسة طيفية للرنين المغناطيسي النووي (NMR) في منتصف العمر السليم وضوابط كبار السن أن مؤشر كتلة الجسم يرتبط ارتباطًا سلبيًا بمستويات N-acetyl-aspartate (علامة على سلامة الخلايا العصبية) في القشرة الأمامية و ACC (Gazdzinski et al. 2008. فولكو وآخرون. 2009c).
كما أظهرت دراسات تصوير الدماغ التي تُقارن بين الأفراد البدينين والليناء انخفاض كثافة المادة الرمادية في المناطق الأمامية (operculum الجبهي والوسط التلفيف الجبهي) وفي التلفيف والبوتام ما بعد المركزية (Pannacciulli et al. 2006). وجدت دراسة أخرى ، لا توجد فروق في حجم المادة الرمادية بين الموضوعات السمنة والنحافة ، ومع ذلك ، فقد سجلت علاقة إيجابية بين حجم المادة البيضاء في هياكل الدماغ القاعدية والخصر إلى معدلات الورك ، وهو اتجاه انعكس جزئيا عن طريق اتباع نظام غذائي (Haltia et al. 2007b). ومن المثير للاهتمام ، أن المناطق القشرية ، مثل DPFC و OFC التي تشارك في التحكم المثبط ، قد تم اكتشاف أنها قد تم تنشيطها في الحميات الناجحة استجابة لاستهلاك الوجبات (DelParigi et al. 2007) ، مما يشير إلى هدف محتمل لإعادة التدريب السلوكي في علاج السمنة (وكذلك في الإدمان).
6 إشراك الدوائر الدائرية
وقد أظهرت دراسات التصوير العصبي أن الطبقة الوسطى تلعب دورا حاسما في الرغبة الشديدة في الغذاء والكوكايين والسجائر (بونسون وآخرون. 2002. Pelchat وآخرون. 2004. وانج وآخرون. 2007). وقد أبرزت أهمية insula من خلال دراسة ذكرت أن المدخنين الذين يعانون من أضرار في هذه المنطقة (ولكن لا يسيطرون على المدخنين الذين عانوا من آفات خارج العزلة) تمكنوا من التوقف عن التدخين بسهولة ودون التعرض لأي شهوة أو انتكاس (Naqvi et al . 2007). تتصل القشرة ، وخصوصًا مناطقها الأمامية الأكثر ، بشكل متبادل مع العديد من المناطق الحوفية (على سبيل المثال ، قشرة الفص الجبهي البطني ، اللوزة المخية ، والجناح البطني) ويبدو أن لها وظيفة تفاعلية ، ودمج المعلومات المستقلّة والحشوية مع المشاعر والتحفيز ، وبالتالي توفير الوعي الواعي لهذه الحوافز (Naqvi و Bechara 2009). في الواقع ، تشير دراسات الآفة الدماغية إلى أن مكونات PFC البطنية ventromedial و insula هي مكونات ضرورية للدارات الموزعة التي تدعم اتخاذ القرار العاطفي (Clark et al. 2008). بالتوافق مع هذه الفرضية ، تظهر الدراسات التصويرية باستمرار التنشيط التفاضلي للإنسولا أثناء الحنين (برودي وآخرون. 2009. جودريان وآخرون. 2010. نقوي وبشارة 2009. وانج وآخرون. 1999). وبناءً على ذلك ، فقد تم اقتراح تفاعل منطقة الدماغ هذه كمؤشر حيوي للمساعدة في التنبؤ بالانعكاس (Janes et al. 2010).
إن إنسولا هي أيضا منطقة ذوقية أولية ، والتي تشارك في العديد من جوانب سلوكيات الأكل ، مثل الذوق. بالإضافة إلى ذلك ، توفر اللطخة المنعزلة (المتصلة بقشرة اللقاح الأساسي) معلومات إلى OFC تؤثر على تمثيلها المتعدد الوسائط لقيمة الطعام أو المذاق الوارد منها (Rolls) 2008). بسبب إشراك insula في بالمعنى البيني للجسم ، في الوعي العاطفي (كريج 2003) وفي التحفيز والعاطفة (Rolls 2008) ، يمكن توقع مساهمة من ضعف في السمنة insularity. في الواقع ، يؤدي انتفاخ المعدة إلى تنشيط القناة الخلفية ، التي من المرجح أن تعكس دورها في إدراك حالات الجسد (في حالة الامتلاء هذه) (Wang et al. 2008). وعلاوة على ذلك ، في الهزيل ، ولكن ليس في المواد السمنة ، أدى انتفاخ المعدة إلى تنشيط اللوزة المخية وإبطال الوعاء الأمامي (Tomasi et al. 2009). يمكن أن يعكس عدم استجابة اللوزة المخية في المواد السمينة إدراكًا بيولوجيًا معقدًا للحالات الجسدية المرتبطة بالشبع (المعدة بالكامل). على الرغم من أن تحوير النشاط الانعزالي من قبل DA قد تم بحثه بشكل سيئ ، إلا أنه من المعترف به أن DA يشارك في الاستجابة لتذوق الأطعمة المستساغة التي يتم توسطها من خلال insula (Hajnal و Norgren 2005). وقد أظهرت دراسات التصوير البشري أن تذوق الأطعمة المستساغة ينشط المناطق الموجودة في الدماغ والدماغ (DelParigi et al. 2005. فرانك وآخرون. 2008). ومع ذلك ، قد يكون من الضروري أيضًا استخدام إشارات DA لاستشعار محتوى الطعام من السعرات الحرارية. على سبيل المثال ، عندما يذوق وزن المرأة الطبيعي التحلية بالسعرات الحرارية (السكروز) ، يتم تنشيط مناطق الدماغ المتوسط insula و dopaminergic ، في حين أن التذوق للتحلية الخالية من السعرات الحرارية (السكرالوز) ينشط فقط الوعاء (Frank et al. 2008). وتعرض المواد السمينة نشاطًا أكبر من التفعيل المعزول مقارنة بالضوابط العادية عند تذوق وجبة سائلة تتكون من السكر والدهون (DelParigi et al. 2005). وعلى النقيض من ذلك ، فإن الأشخاص الذين تعافوا من فقدان الشهية العصبي يظهرون نشاطًا أقل في الحالة العصبية عند تذوق السكروز وعدم ارتباطهم بمشاعر السرور مع التنشيط النبضي كما هو ملاحظ في الضوابط العادية (Wagner et al. 2008). عند الجمع ، فإن هذه النتائج تجعل من المحتمل أن يكون خلل الانتظام في insula استجابة لمثيرات الذوق قد يكون ضالعا في التحكم في ضعف السلوكيات الشهية المختلفة.
7 دائرة النفور
كما ذكر من قبل ، التدريب (تكييف) على جديلة تتنبأ بمكافأة يؤدي إلى إطلاق خلايا الدوبامين استجابة للتنبؤ بالمكافأة ، وليس إلى المكافأة نفسها. من ناحية أخرى ، وتماشيا مع هذا المنطق ، لوحظ أن خلايا الدوبامين ستطلق أقل من المعتاد إذا فشلت المكافأة المتوقعة (Schultz et al. 1997). الدليل التراكمي (Christoph et al. 1986. Lisoprawski وآخرون. 1980. ماتسوموتو و هيكوساكا 2007. نيشيكاوا وآخرون. 1986) يشير إلى habenula باعتبارها واحدة من المناطق التي تسيطر على الانخفاض في إطلاق النار من الخلايا الدوبامين في VTA التي قد تتبع الفشل في الحصول على مكافأة المتوقعة (Kimura et al. 2007). وهكذا ، فإن الحساسية المعززة للحنجرة ، كنتيجة للتعرض المزمن للمخدرات ، يمكن أن تكمن وراء تفاعل أكبر مع الإشارات الدوائية. في الواقع ، تم ربط تفعيل habenula ، في مدمني المخدرات الكوكايين ، مع الانتكاس السلوكي لاتخاذ المخدرات على التعرض جديلة (براون وآخرون. 2011. زانج وآخرون. 2005). في حالة النيكوتين ، يبدو أن مستقبلات النيكوتين α5 في الهابنولا تعدل الاستجابات المكافئة للجرعات الكبيرة من النيكوتين (Fowler et al. 2011)؛ وتورط مستقبلات α5 و α2 في هابنولا في انسحاب النيكوتين (Salas et al. 2009). وبسبب الاستجابة المعاكسة للعازلة إلى استجابة الخلايا العصبية DA لمكافأة (التنشيط) وتفعيلها عند التعرض للمنبهات المضايقة ، فإننا نشير هنا إلى إشارة habenula باعتبارها واحدة تنقل مدخلاً "معادًا".
يبدو أن habenula تلعب دورا مماثلا فيما يتعلق بمكافأة الطعام. يمكن لنظام غذائي غذائي مستساغ للغاية لحث على السمنة في الفئران ، مع زيادة الوزن ترتبط بزيادة في الببتيد μ-opioid ملزمة في اللوزة القاعدية basoledateral و basomedial. ومن المثير للاهتمام ، أظهرت هوسولا الإنسالية أعلى بكثير من ربط الببتيد الأفيوني (بنسبة 40٪ تقريبًا) بعد التعرض للطعام المستساغ في الفئران التي اكتسبت وزنا (تلك التي تستهلك المزيد من الطعام) ولكن ليس في تلك التي لم تفعل ذلك (سميث وآخرون. 2002). هذا يشير إلى أن habenula قد تشارك في الإفراط في تناول الطعام تحت ظروف توافر الغذاء مستساغ. وعلاوة على ذلك ، فإن الخلايا العصبية في النواة الجزئية الرسوبية ، التي تتلقى مدخلات رئيسية من الحَبَوية الجانبية ، تُنَفِّذ إلى الخلايا العصبية VTA DA ويتم تنشيطها بعد الحرمان من الغذاء (Jhou et al. 2009). هذه النتائج تتفق مع دور للعازفة في التوسط في استجابات المنبهات المضايقة أو الحالات مثل تلك التي تحدث أثناء الحمية أو سحب الأدوية.
يتشابه ارتباط هابينولا كمركز معاكس في الشبكات العاطفية مع النماذج النظرية السابقة للإدمان التي افترضت استجابات حساسة مضادة للمكافأة (توسطت من خلال حساسية معززة من اللوزة المخية وزيادة التشوير على الرغم من عامل إطلاق الكورتيكوتروبين) كدفع تناول الدواء في الإدمان (كوب و لو موال 2008). قد تساهم الاستجابات المضادة المضادّة أيضًا في الإفراط في استهلاك الطعام في السمنة.
8 مكافأة الدواء والغذاء الباثولوجي: نموذج عمل محدث
Tإن قدرته على مقاومة الرغبة في استخدام دواء ما أو تناول الطعام بعد نقطة الشبع تتطلب الأداء السليم للدوائر العصبية المشاركة في التحكم من أعلى لأسفل لمعارضة الاستجابات المشروطة التي تتنبأ بمكافأة تناول الطعام / الدواء والرغبة في استيعاب الغذاء / المخدرات. هنا ، أبرزنا ستة من هذه الدوائر: المكافأة / الملاءمة ، التكييف / العادات ، التحكم المثبط / الوظيفة التنفيذية ، الدافع / الدافع ، الإحاطة ، تجنب النفور / تفاعل الإجهاد (الشكل. 8). استنادًا إلى بيانات التصوير المقدمة هنا ، نفترض أنه التناقض بين توقع تأثيرات الدواء / الطعام (الاستجابات المشروطة) والتأثيرات العصبية الفيروسية التي تحافظ على تناول الأدوية أو الاستهلاك المفرط للأطعمة في محاولة لتحقيق المكافأة المتوقعة. أيضا ، سواء تم اختبارها في فترات مبكرة أو طويلة من الامتناع عن ممارسة الجنس / اتباع نظام غذائي ، تظهر المواد المدمنة / السمينة انخفاض D2R في المخطط (بما في ذلك NAc) ، والتي ترتبط مع انخفاض في نشاط خط الأساس في مناطق الدماغ الأمامية المتورطة في إسناد البراعة (القشرة الأمامية الأمامية) والتثبيط السيطرة (لجنة التنسيق الإدارية و DLPFC) ، التي يؤدي اضطراب في الإكراه والاندفاع. Fوقد ظهر دليل على دور الدوائر البينية والمنافسة في الاختلالات النظامية التي تؤدي إلى الاستهلاك القهري لأي من الأدوية أو الغذاء.
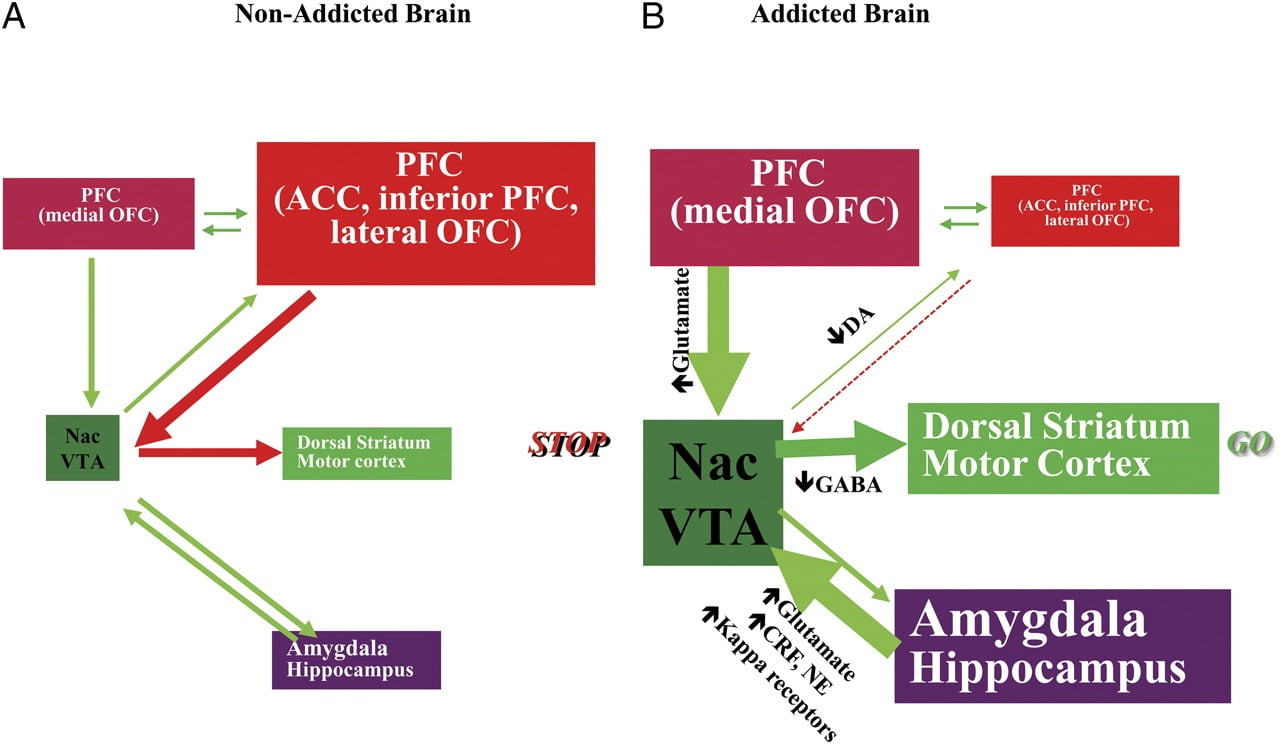
التين 8 نموذج يقترح شبكة من الدوائر المتفاعلة ، الاضطرابات التي تساهم في المجموعة المعقدة من السلوكيات النمطية الكامنة وراء إدمان المخدرات والإفراط المزمن: المكافأة (النواة المتكئة ، VTA ، والبطانة الشاحبة) ، والتكييف / الذاكرة (اللوزة ، وسطي OFC لإسناد الصلاحية ، hippocampus ، والمخطط الظهري للعادات) ، والتحكم التنفيذي (DLPFC ، ACC ، القشرة الأمامية الجبهية ، و OFC الجانبي) ، الدافع / محرك (أوفال الإنسيابي لإسناد salinency ، ACC البطنية ، VTA ، SN ، المخطط الظهري ، والقشرة الحركية). Nac، nucleus accumbens، interoception (Insula and ACC)، and depersion / avoidance (Habenula). (أ) عندما تكون هذه الدارات متوازنة ، يؤدي ذلك إلى السيطرة المثبطة الصحيحة واتخاذ القرارات. (ب) أثناء الإدمان ، عندما تتجاوز قيمة التوقع المعززة للدواء في دارات المكافأة والدوافع والذاكرة دائرة التحكم ، مع تفضيل حلقة التغذية الراجعة الإيجابية التي بدأها استهلاك الدواء واستمرارها من خلال تفعيل المحفز الدافع / الدافع ودوائر الذاكرة. تتفاعل هذه الدوائر أيضًا مع الدوائر المعنية بتنظيم المزاج ، بما في ذلك تفاعل الإجهاد (الذي يشمل اللوزة المخية ، الوطاء ، habenula) و interoception (الذي ينطوي على insula و ACC ويساهم في إدراك الرغبة الشديدة). هناك العديد من الناقلات العصبية المتورطة في هذه العمليات العصبية ، بما في ذلك الغلوتامات وغابا والنوربينفرين وعامل إطلاق الكورتيكوتروبين ومستقبلات الأفيون. CRF ، عامل إطلاق الكورتيكوتروبين ؛ NE ، بافراز. تم التعديل بإذن من Volkow et al. (2011b)
نتيجة للاضطراب المتسلسل في هذه الدارات ، قد يعاني الأفراد من 1) قيمة تحفيزية معزّزة للدواء / الغذاء (ثانوي للجمعيات المتعلمة من خلال التكييف والعادات) على حساب معززات أخرى (ثانوية إلى انخفاض حساسية دائرة المكافأة) ) ، 2) قدرة ضعيفة على تثبيط الإجراءات المتعمدة (المرتكزة على الأهداف) التي تنجم عن الرغبة القوية في تناول الدواء / الغذاء (الثانوي إلى الوظيفة التنفيذية الضعيفة) التي تؤدي إلى تناول الدواء القهري / الطعام ، و 3) وتجنب المجاملة التي تؤدي إلى تناول المخدرات الاندفاعية للهروب من حالة تكره.
يقترح هذا النموذج مقاربة علاجية متعددة الأوجه للإدمان تهدف إلى تقليل خصائص تعزيز الدواء / الغذاء ، وإعادة تأسيس / تعزيز خصائص المكافأة للمعززات الطبيعية ، وتثبيط الجمعيات المعرفة ، وتعزيز الدوافع للأنشطة غير المتعلقة بالأدوية / الغذاء ، وتقليل تفاعل الإجهاد. ، وتحسين المزاج ، وتعزيز السيطرة المثبطة للأغراض العامة.
شكر وتقدير
يود المؤلفون أن يشكروا دعم برنامج NIAAA الداخلي للمعاهد الوطنية للصحة.
مراجع حسابات