التعليقات: مراجعة من قبل كبير الباحثين عن السمنة وإدمان الطعام.
Volume 69 ، الإصدار 4 ، 24 February 2011 ، Pages 664 – 679
http://dx.doi.org/10.1016/j.neuron.2011.02.016,
التقيم
بول ج. كينيكسومكس ، ,
مختبر 1 لعلم الأعصاب السلوكي والجزيئي ، قسم العلاج الجزيئي ، معهد بحوث سكريبس ، جوبيتر ، FL 33458 ، الولايات المتحدة الأمريكية
________________________________________
يتم استهلاك الطعام من أجل الحفاظ على توازن الطاقة عند مستويات التثبيط. بالإضافة إلى ذلك ، يتم استهلاك الطعام المستساغ أيضا لخصائصه الهيدونية بغض النظر عن حالة الطاقة. يمكن أن يؤدي هذا الاستهلاك المرتبط بالمكافأة إلى تجاوز السعرات الحرارية للمتطلبات ، ويعتبر أحد الأسباب الرئيسية في معدلات السمنة المتزايدة في البلدان المتقدمة. مقارنة بآليات التغذية المتجانسة ، لا نعرف الكثير عن كيفية تأثير الأنظمة السرطانية في الدماغ على مدخول الطعام. ومن المثير للاهتمام أن الاستهلاك المفرط للطعام المستساغ يمكن أن يؤدي إلى استجابات عصبية في دوائر دماغية شبيهة بعقاقير الإدمان. علاوة على ذلك ، يمكن أن تؤدي نقاط الضعف الجينية المماثلة في أنظمة المكافأة الدماغية إلى زيادة الاستعداد لإدمان المخدرات والسمنة. هنا ، سيتم استعراض التطورات الحديثة في فهمنا لدارات الدماغ التي تنظم الجوانب اللذيذة لسلوك التغذية. أيضا ، الأدلة الواضحة التي تشير إلى أن السمنة وإدمان المخدرات قد يشتركان في آليات مشتركة مألوفة.
________________________________________
النص الرئيسي
"ليس هناك حب صادق من حب الطعام."
—George Bernard Shaw
المُقدّمة
السمنة ، التي تُعرّف على أنها مؤشر كتلة الجسم (BMIs) أكبر من 30 ، هي حالة تكون فيها السمنة مرتفعة بشكل غير طبيعي ويمكن أن تنتج عن فرط البلع أو انخفاض معدل الأيض (O'Rahilly ، 2009). السمنة المفرطة هي أحد عوامل الخطر الرئيسية لأمراض القلب والأوعية الدموية والسرطان والسكري من النوع 2 والاضطرابات المرتبطة بالمزاج ، حيث يعاني الأفراد المصابون بالسمنة من وصمة اجتماعية ([Bean et al. ، 2008] ، [Centers for Disease Control and Prevention، 2009] و [لوبينو وآخرون ، 2010]). وفقًا لمركز السيطرة على الأمراض (CDC) ، بلغت نفقات الرعاية الصحية المتعلقة بالسمنة في الولايات المتحدة بين عامي 1998 و 2000 حوالي 213 مليار دولار. علاوة على ذلك ، يمكن أن تُعزى 300,000 حالة وفاة في الولايات المتحدة كل عام إلى زيادة الوزن والأمراض المرتبطة بالسمنة (أليسون وآخرون ، 1999) ، حيث تعتبر السمنة السبب الرئيسي الثاني للوفاة التي يمكن الوقاية منها بعد استخدام التبغ. ومع ذلك ، يستمر انتشار السمنة في المجتمعات الغربية في الزيادة بشكل كبير ، مع التقديرات الحالية التي تشير إلى أن أكثر من 30٪ من البالغين في الولايات المتحدة يعانون من السمنة (Flegal et al.، 2010).
تقترح معظم تصورات تنظيم التغذية أن نظامين متوازيين يتفاعلان للتأثير على كمية الطعام ([Hommel et al.، 2006]، [Lutter and Nestler، 2009] و [Morton et al.، 2006]). يشمل النظام المتجانس المنظمين الهرمونيين للجوع ، والشبع ، ومستويات السمنة ، مثل الليبتين ، الغريلين ، والأنسولين ، والتي تعمل على الدارات الخلقية والمائية لتحفيز أو تثبيط التغذية من أجل الحفاظ على مستويات مناسبة من توازن الطاقة. يمكن أن يؤدي الاختلال الوظيفي في مكونات النظام المتجانس ، مثل نقص الليبتين الخلقي ، إلى حالة مستمرة من توازن الطاقة الإيجابي وتطوير السمنة ([كامبفيلد وآخرون ، 1995] ، [Halaas et al. ، 1995] و [Pelleymounter وآخرون ، 1995]). إن الآليات التي يعمل من خلالها المنظمين الهرمونيين للجوع والشبع على الدارات الخلقية والدماغ للمحافظة على استتباب الطاقة قد تم وصفها بالتفصيل في مكان آخر ، ويشار للقراء المهتمين بهذا الموضوع إلى العديد من الآراء الممتازة حول هذا الموضوع (على سبيل المثال ، [Abizaid] وآخرون ، 2006a] و [Gao و Horvath ، 2007]).
بالإضافة إلى أنظمة التمثيل الغذائي ، تلعب أنظمة مكافأة الدماغ أيضًا دورًا مهمًا في سلوك التغذية ([Lutter and Nestler ، 2009] و [Saper et al. ، 2002]). بشكل عام ، لا يتم الإفراط في تناول الأطعمة ذات المذاق الخفيف ، في حين أن الأطعمة الشهية غالبًا ما يتم استهلاكها حتى بعد تلبية متطلبات الطاقة. تعتبر سهولة الوصول إلى الأطعمة الشهية الغنية بالطاقة عامل خطر بيئي رئيسي للسمنة (Volkow and Wise ، 2005) ، ويعتبر الاستهلاك المفرط للطعام المستساغ عاملاً رئيسياً يساهم في الارتفاع الأخير في السمنة ([Finkelstein et al.، 2005] و [Hill et al.، 2003] و [Swinburn et al.، 2009]). في الواقع ، يعد الحصول على التأثيرات الممتعة للطعام المذاق قوة محفزة قوية يمكن لبعض الأفراد تجاوز إشارات الاستتباب ([Shomaker et al. ، 2010] ، [Sunday et al. ، 1983] و [Zheng et al. ، 2009]) . عند تقديم خيار ، تفضل الفئران بأغلبية ساحقة تناول محلول السكرين الخالي من السعرات الحرارية بدلاً من حقن الكوكايين في الوريد ذاتيًا (Lenoir et al. ، 2007). علاوة على ذلك ، فإن الفئران التي تتغذى جيدًا ستعرض نفسها طواعية للبرودة الشديدة (−15 درجة مئوية) ، أو آلام الحرارة الضارة أو الصدمة الشديدة للحصول على مواد غذائية مستساغة ، مثل الكعك القصير ، فطيرة اللحم ، زبدة الفول السوداني ، كوكاكولا ، حلوى M&M ، الشوكولاتة الرقائق ، أو قطرات الزبادي ، حتى عندما يكون الطعام القياسي غير المستساغ متاحًا مجانًا ([Cabanac and Johnson ، 1983] ، [Foo and Mason ، 2005] و [Oswald et al. ، 2010]). تسلط هذه النتائج الضوء على مدى شدة المغذيات الكبيرة في الطعام الذي يمكن أن تحفزه أنظمة المكافأة في الدماغ بغض النظر عن قيمتها الحرارية ([Wang et al.، 2004a] and [Wang et al.، 2004b]) ومدى ارتفاع الحافز لاستهلاك الطعام المستساغ. حتى في حالة عدم وجود متطلبات الطاقة المتوازنة. يمكن أن تؤدي العقاقير المخدرة مثل الكوكايين أو النيكوتين إلى مستويات عالية من السلوك التكميلي على الرغم من أنها خالية من السعرات الحرارية أو القيمة الغذائية. في الواقع ، نظرًا للعديد من أوجه التشابه بين الإفراط في تناول الطعام في حالة السمنة والإفراط في تعاطي المخدرات في الإدمان (Volkow and Wise ، 2005) ، فقد قيل إن السمنة يجب اعتبارها اضطرابًا في الدماغ وإدراجها كفئة تشخيصية في الإصدار الخامس القادم من الدليل التشخيصي والإحصائي للاضطرابات العقلية (DSM-V) ([Devlin ، 2007] و [Volkow and O'Brien ، 2007]). بالمقارنة مع آليات التماثل الساكن لسلوك التغذية ، لا يُعرف الكثير عن كيفية تأثير أنظمة المتعة على تناول الطعام. وبالمثل ، فإن تأثير التعديلات الجوهرية أو التي يسببها النظام الغذائي على استجابة أنظمة المكافأة في الدماغ ، وكيف تساهم هذه التأثيرات في الإفراط في تناول الطعام والسمنة ، لا يزال غير واضح. لخص أدناه البيانات الحديثة التي تسلط الضوء على التقدم في فهمنا لآليات المتعة في الأكل والتعديلات التي يسببها النظام الغذائي في نشاط مكافأة الدماغ التي قد تسهم في تطور السمنة
تفعيل أنظمة المكافأة الدماغية في الاستجابة للأغذية مستساغ: التفاعلات مع المنظمين الهرموني لتوازن الطاقة
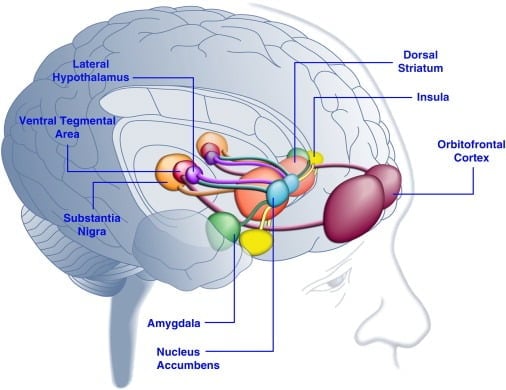
يمكن أن يعزز استهلاك الطعام المستساغ المزاج لدى البشر ([دالمان وآخرون ، 2003] و [Macht و Mueller، 2007]) ويدعم إنشاء تفضيل المكان المشروط في حيوانات المختبرات ([Imaizumi et al.، 2001] و [ Sclafani وآخرون ، 1998]). من المحتمل أن تكون هذه التأثيرات مرتبطة بتحفيز أنظمة المكافأة الدماغية بواسطة طعام مستساغ (الشكل 1). في الواقع ، أظهرت دراسات تصوير الدماغ البشري أن الإشارات البصرية أو الشمولية المتعلقة بالغذاء والأغذية يمكن أن تُنشِّط دارات دماغية متشابكة في القشرة الدماغية ووسط متشابكة في المكافأة ، وأبرزها القشرة الأمامية الأمامية (OFC) ، و insula ، و amygdala ، و hypothalamus ، و striatum ، و midbrain region. بما في ذلك منطقة tegmental البطنية (VTA) والأغشية (SN) ([Bragulat et al.، 2010]، [Pelchat et al.، 2004]، [Schur et al.، 2009] و [Simmons et al.، 2005] ). يشكّل المخطط ، والقشرة ، والقشرة الحزامية الأمامية ، وهياكل الدماغ المتوسط القيمة الذاتية للمكافآت بغض النظر عن نوعها (على سبيل المثال ، الغذاء ، الجنس ، المكافآت النقدية) ، بما يتوافق مع دور هذه الشبكة العصبية في التمثيل العام للتمريض (Sescousse et al. ، 2010). وعلى النقيض من ذلك ، يبدو أن OFC تلعب دورًا بارزًا بشكل خاص في التمثيل المتعلق بقيمة أنواع معينة من المكافآت بما في ذلك الطعام المستساغ ([Man et al. و 2009] و [Rolls و 2008] و [Sescousse et al. و 2010] ). يمكن أن يعزز الجوع التنشيط المستحث بالأغذية للمناطق القشرية و الدماغ الوسطى في البشر (LaBar et al.، 2001). على سبيل المثال ، كانت كثافة تفعيل المخطط البطني ، واللوزة ، والعزل ، و OFC استجابة للأطعمة ذات السعرات الحرارية العالية أكبر بكثير عندما كان البشر يعانون من الجوع بدلاً من التغذية الجيدة (غولدستون وآخرون ، 2009). ويتسق هذا مع حقيقة أن فترات الجوع واتباع نظام غذائي تزيد من التقييم الذاتي لـ "قوة" الطعام المستساغ والشغف للطعام "المغري" ([Hofmann et al.، 2010] و [Rolls et al.، 1983] ). وعلى العكس من ذلك ، يمكن للإفراط في التغذية أن يحد من الاستجابات العصبية للطعام المستساغ ، خاصة في القشرة المعزولة وطيال الوطاء (Cornier et al.، 2009). وبالتالي ، فإن القيمة الغذائية للأطعمة تتأثر بالحالة الأيضية ، مما يوحي بأن منظمي الأيض مثل الليبتين والجريلين قد يؤثران على نشاط الأنظمة الطفيلية في الدماغ. بما يتفق مع هذا الرأي ، يتم التعامل مع المواد البشرية باستخدام الليبتين أو الببتيد العامل المستمد من الأمعاء YY3-36 (PYY) ([Batterham et al.، 2007] و [Farooqi et al.، 2007]) أو تلك التي خضعت لعملية انتفاخ معوي كان تقليد تناول الوجبة (Wang et al.، 2008) قد قلل من النشاط في مناطق الدماغ ذات الصلة بالمكافأة. على العكس من ذلك ، أظهر المرضى الذين يعانون من فرط في النمو مع نقص اللبتين الخلقي زيادة النشاط في القشرة الدماغية والمخطط المخطط استجابة لصور الطعام ([Baicy et al.، 2007] و [Farooqi et al.، 2007]). في هؤلاء الأفراد ، خفف العلاج ببدائل الليبتين من النشاط المعزول والعضوي المحسّن وقلل من الإعجاب بالطعام ([Baicy et al.، 2007] و [Farooqi et al.، 2007]). كما يعمل علاج الليبتين أيضًا على منع الخواص المكافئة للسكروز في الجرذان المقيَّدة بالمواد الشبيهة بخصائص مستقبلات الدوبامين α-flupenthixol (Figlewicz et al.، 2001). وعلاوة على ذلك ، يتم التعبير عن مستقبلات الليبتين على الخلايا العصبية الدوبامين في الدماغ الوسطى في VTA و SN (Figlewicz et al.، 2003) ، مما يشير إلى أن الليبتين قد يؤثر على الجوانب الملحية لسلوك التغذية من خلال تعديل انتقال الدوبامين في الميزوستريات. وتأكيدًا على هذه الإمكانية ، أدى تثبيط الليبتين في VTA إلى تثبيط نشاط الخلايا العصبية الدوبامين وانخفاض استهلاك الطعام في الجرذان (Hommel et al.، 2006 ؛ انظر أيضًا Krügel et al.، 2003). وعلى العكس من ذلك ، أدت ضربة قاضية لمستقبلات اللبتين في الـ VTA إلى زيادة استهلاك الغذاء ، والنشاط الحركي المعزز ، وزيادة التفضيل للطعام المستساغ في الجرذان (Hommel et al.، 2006). ولذلك يمارس Leptin تأثيرًا مثبطًا على انتقال الدوبامين عبر الطبلة المتوسطة ، وهو نظام ناقل عصبي متورط بشدة في المكافأة والحافز ولكن أقل في توازن الطاقة ([de Araujo et al.، 2010] و [Vucetic and Reyes، 2010]). وفي الآونة الأخيرة ، ظهر أن هورمون جريلين المرتبط بالجوع ([كوجيما وآخرون ، إكسنومكس] و [ناكازاتو وآخرون ، إكسنومكس] أظهر تحفيزًا لتنشيط أنظمة المتعة في الدماغ استجابة لمنبهات الغذاء (Malik et al. ، 1999). على وجه التحديد ، عزز جريلين تنشيط OFC ، اللوزة ، insula ، striatum ، VTA ، و SN ردا على صور الغذاء مستساغ للغاية في الأفراد يعانون من السمنة المفرطة (مالك وآخرون ، 2008). في الجرذان ، يمارس جريلين تأثيرًا تحفيزيًا على أنظمة دوبامين ثنائية الدماغ ([Abizaid et al.، 2006b]، [Jerlhag et al.، 2006] و [Jerlhag et al.، 2007]) ويزيد من القيمة المجزية للطعام المستساغ (Perello وآخرون ، 2010).
الرقم 1. تنشيط مناطق الدماغ البشري استجابةً للطعام المستساغ أو الإشارات المرتبطة بالغذاء. يُعتقد أن القشرة الأمامية المدارية واللوزة المخية تقوم بترميز المعلومات المتعلقة بقيمة مكافأة الطعام ([Baxter and Murray، 2002]، [Holland and Gallagher، 2004]، [Kringelbach et al.، 2003]، [O'Doherty et al. ، 2002] و [رولز ، 2010]). تعالج الإنسولا المعلومات المتعلقة بمذاق الطعام وتقييمه اللذيذ ([Balleine and Dickinson، 2000] and [Small، 2010]). النواة المتكئة والمخطط الظهري ، التي تتلقى مدخلات الدوبامين من منطقة السقيفة البطنية والمادة السوداء ، تنظم الخصائص التحفيزية والحافزة للغذاء ([Baicy et al. ، 2007] ، [Berridge ، 1996] ، [Berridge ، 2009] ، [Farooqi et al.، 2007]، [Malik et al.، 2008] and [Söderpalm and Berridge، 2000]). قد ينظم الوطاء الجانبي الاستجابات المجزية للطعام اللذيذ ويقود سلوكيات البحث عن الطعام (Kelley et al. ، 1996). تعمل هياكل الدماغ هذه بطريقة منسقة لتنظيم التعلم عن الخصائص الممتعة للطعام ، وتحويل الانتباه والجهد نحو الحصول على مكافآت غذائية وتنظيم القيمة التحفيزية للمحفزات البيئية التي تتنبأ بتوافر المكافآت الغذائية (داغر ، 2009). من أجل الوضوح ، لم يتم عرض جميع الترابطات بين هذه الهياكل.
يتم تنشيط مناطق الدماغ مماثلة من قبل الغذاء مستساغ في الدماغ الفئران كما تلك تنشيطها في البشر ، كما تقاس بالتعبير عن الجينات المبكرة الفورية (IEG) مثل c-fos أو arc أو zif268. في الواقع ، ينشط الطعام المستساغ المخطط الظهري والبطني ، و VTA ، و hypothalamus الوحشي (LH) ، ونواة مركزية و basolateral من اللوزة المخية والهيئات القشرية ذات الصلة في الجرذان ([أنجلس - كاستيلانوس وآخرون ، 2007] ، [بارك و Carr، 1998] و [Schiltz et al.، 2007]). ومن المثير للاهتمام ، فقد انخفض في الواقع immunoreactivity الفوس في habenula الوحشي والوسيط في الفئران بعد استهلاك الطعام مستساغ (LHb) (بارك وكار ، 1998). في الرئيسيات غير البشرية ، يتم تنشيط LHb عن طريق محفز مكره أو إغفال من المكافآت المتوقعة ويثبط من قبل تقديم مكافأة عصير مستساغ (ماتسوموتو و Hikosaka ، 2007). بالإضافة إلى ذلك ، يعمل نشاط LHb على تثبيط الخلايا العصبية التي تحتوي على الدوبامين وذات الصلة بالمكافئات من خلال مسار غير مباشر يتضمن النواة الجزئية للرسغلات (RMTg) (Jhou et al.، 2009). لذلك ، يرتبط النشاط العضلي بطريقة عكسية مع المواد الغذائية السامة ، مما يشير إلى أن مركب الهيبنول قد يؤثر على الأكل غير الغذائي. في الواقع ، تبين أن تفعيل LHb في الآونة الأخيرة يقلل من استهلاك السكروز في الفئران ، في حين أن الآفات من LHb تزيد من سلوك السكروز السعي (فريدمان وآخرون ، 2011). مع الأخذ بعين الاعتبار أن مجمع الحبابين صغير وصعب لتحديد صورة وظيفية للإنسان (Salas et al.، 2010) ، قد يفسر هذا سبب عدم حدوث تغيرات في النشاط العضوي في دراسات التصوير البشري استجابة للأغذية المستساغة.
دارة دماغية تنظم تناول الطعام الهيدوني: Midbrain Dopamine Systems
يتم تنشيط مسار الدوبامين mesoaccumbens في البشر وحيوانات المختبر استجابةً للطعام المستساغ أو الإشارات المتعلقة بالأغذية الشهية والليبتين والجريلين والمنظمين الآخرين لنشاط الشهية في هذا النظام. يشير هذا إلى أن أنظمة الدوبامين في الدماغ المتوسط تلعب دورًا مهمًا في استهلاك الطعام المستساغ. ربما يكون أوضح مؤشر على أن انتقال الدوبامين في الدماغ المتوسط يؤثر على تناول الطعام اللذيذ لدى البشر هو حقيقة أن مرضى باركنسون (PD) ، حيث يوجد تنكس في الخلايا العصبية المحتوية على الدوبامين في الدماغ المتوسط ، يميلون إلى استهلاك طعام أقل من الأفراد غير المصابين (Nirenberg and ووترز ، 2006). علاوة على ذلك ، يمكن أن يؤدي علاج مرضى داء باركنسون الذين يعانون من ناهضات مستقبلات الدوبامين إلى تناول طعام شبيه بالقهري ([Dagher and Robbins، 2009] and [Nirenberg and Waters، 2006]). في الواقع ، يمكن أن تحفز ناهضات مستقبلات الدوبامين على الإفراط في تناول الطعام حتى لدى الأفراد غير المصابين بمرض باركنسون (كورنيليوس وآخرون ، 2010). في الحيوانات ، تحفز محاليل السكروز المستساغة انتقال الدوبامين في NAc (Hernandez and Hoebel ، 1988) ، وهو تأثير يتوافق مع دراسات تصوير الدماغ البشري (Small et al. ، 2003). باستخدام قياس الجهد الدوري سريع المسح ، تبين أن الإشارات التي تتنبأ بتسليم مكافأة السكروز أو التسليم غير المتوقع للسكروز قد أثارت انتقال الدوبامين في NAc ([Roitman et al. ، 2004] و [Roitman et al. ، 2008]). علاوة على ذلك ، كان للتسليم غير المتوقع لمحاليل الكينين الضارة تأثير معاكس ، حيث قلل من انتقال الدوبامين المتراكم (Roitman et al. ، 2008). أخيرًا ، لا تزال الفئران التي تم فيها تعطيل إنزيم التيروزين هيدروكسيلاز (TH) ، مما تسبب في نقص الدوبامين ، تُظهر تفضيلًا ملحوظًا لمحاليل السكروز (أو السكرين) مقارنةً بالماء ولكنها تستهلك كميات أقل من السكروز من الفئران الضابطة ( كانون وبالميتر ، 2003). يشير هذا إلى أن الفئران التي تعاني من نقص الدوبامين لا تزال قادرة على اكتشاف استساغة السكروز وتفضل هذه الحلول على الماء ولكنها غير قادرة على الحفاظ على استهلاك الحلول المستساغة. لذلك فقد تم اقتراح أن انتقال الدوبامين المتناثر المتوسط ينظم الجوانب التحفيزية لسلوك التغذية التي تشارك في شراء الغذاء وأن أنظمة الناقل العصبي الأخرى من المحتمل أن تنظم جوانب المتعة في استهلاك الطعام المستساغ.
دارة دماغية تنظم تناول الطعام الهضمي: أنظمة ستوتوهيبوتلالميك
تسريب ناهضات مستقبلات op-opioid مثل [D-Ala2-N-Me-Phe4-gly-ol5] -nkephalin (DAMGO) في NAc يحفز سلوك التغذية في الجرذان مع وصول لمحتوى libitum إلى الغذاء (أي تغذية nonhomeostatic) ( [Peciña and Berridge، 2005] and [Zhang et al.، 1998]). وعلى العكس من ذلك ، فإن مضادات مستقبلات الأفيون التي يتم إدخالها في NAc تقلل من استهلاك الطعام المفضل دون التأثير على تناول بدائل أقل استساغة (Kelley et al.، 1996). تتسق هذه البيانات مع وجهة النظر القائلة بأن أنظمة الأفيون الجسدية المنظمة تنظم الخواص الوديانية للطعام المستساغ. تلعب منطقة الصدف الخاصة بـ NAc وبصفة خاصة "البقع الساخنة" في المنطقة الرسغية للقشرة الإنسية ([Peciña and Berridge، 2005] و [Peciña et al.، 2006b]) دورًا مهمًا بشكل خاص في التغذية غير المزدحمة. ونظرًا لأن تنشيط مستقبلات الأفيون results يؤدي إلى تثبيط نشاط الخلايا العصبية الشوكية المتوسطة في NAc ، فقد اقترح أن قذيفة NAc تمارس تأثيرا مثبطا للتأثير على استهلاك الطعام المستساغ (Kelley et al.، 2005). بالتوافق مع هذا الرأي ، تحفيز مستقبلات GABAA أو GABAB المثبطة ([باسو وكيلي ، 1999] و [Stratford و Kelley ، 1997]) أو حصار مستقبلات الغلوتامات الأيونية الخلقية الاستثارية (Maldonado-Irizarry et al. ، 1995) في غلاف NAc يزيد من استهلاك الغذاء. وبالمثل ، تزيد آفة التسمم المثيرة أيضًا من استهلاك الطعام وتعزز الحساسية لمكافأة الطعام ([جونسون وزملاؤه ، و 1996] و [مالدونادو-اريزاري وكيلي ، و 1995]). على وجه الخصوص ، يتم تفضيل استهلاك الطعام المستساغ الكثيف للطاقة بشكل تفضيلي من خلال هذه التلاعبات ([باسو وكيلي ، 1999] ، [كيلي وآخرون ، 2005] و [تشانغ وآخرون ، 1998]).
وبالنظر إلى التأثير الرئيسي للإشارات التراكمية على التغذية المتعة ، استخدم طومسون وسوانسون (2010) إجراء تتبع الدائرة لتحديد بدقة الشبكات التشريحية دقيقة من خلالها قد تؤثر على NAc استهلاك الطعام مستساغ. في هذه الدراسات الأنيقة ، تلقت الفئران حقنتين غير متداخلتين من متتبعات ارتدادية / ارتجالية (تدعى COINs) إلى مواقع غلاف NAc التي تؤثر بقوة على استهلاك الطعام المستساغ ، وتم تحديد التوصيلات اللاحقة / الفعالة. وقد تبين أن المواقع ذات الصلة بالتغذية في NAc تمد الإسقاطات المثبطة في الغالب إلى LH الأمامي والبطني الباطن (VP) (طومسون وسوانسون ، 2010). بخلاف ما تبقى من NAc ، التي تعمل بشكل مكثف على VTA ، البقع الساخنة hedonic ذات الصلة بالأغذية في مشروع NAc قذيفة إلى النواة بين الأجناس (IFN) ، وهي بنية تقع بالقرب من VTA التي تمتد التوقعات الدوبامين بطريقة متبادلة مرة أخرى إلى NAc shell (Thompson and Swanson، 2010). علاوة على ذلك ، فإن مشاريع LH الأمامية إلى LHb (Thompson و Swanson، 2010) تشير مرة أخرى إلى أن مجمع habenular قد يلعب دورًا في المواد الغذائية (Friedman et al.، 2011).
تظهر البيانات المذكورة أعلاه أن LH يتلقى مدخلات مثبطة بارزة من مواقع في NAc التي تمارس تأثير كابح منشط على استهلاك الطعام المستساغ. لدى LH أيضًا اتصال وظيفي بمواقع دماغية قشرية وحاجية أخرى متورطة في تنظيم وتوجيه السلوك نحو الحصول على طعام مستساغ (الشكل 1) ، مثل OFC ، insula ، و amygdala. والأهم من ذلك ، أن تعطيل LH يلغي التأثيرات التحفيزية لتلاعب NAc على تناول الطعام ([Maldonado-Irizarry et al.، 1995] و [Will et al.، 2003]). علاوة على ذلك ، يعطل تعطل قشرة NAc نشاط LH ، وخاصة الخلايا العصبية LH التي تقوم بتوليف hypocretin neuropeptide (المعروف أيضا باسم orexin) ، كما تم قياسه من قبل Fos immunoreactivity ([Baldo et al.، 2004] و [Stratford and Kelley، 1999 ]). في الواقع ، إن ضخ ناهض المستقبلات الأفيونية DAMGO إلى غلاف NAc ينشط الخلايا العصبية المحتوية على hypocretin في الوطاء (Zheng et al.، 2007) ، وتعطل نقل hypocretin في VTA يلغي الاستهلاك الغذائي المستساغ الذي تسببه عمليات التسريب DAMGO داخل NAc (Zheng et al.، 2007). وهكذا ، فإن البقع الساخنة في قشرة NAc تؤثر على تأثير تثبيطي منشط على الخلايا العصبية LH ، وعلى وجه الخصوص الخلايا العصبية المحتوية على hypocretin (لويس وآخرون ، 2010) ، مما يحد من استهلاك الطعام المستساغ. إن تعطيل "إشارة التوقف" التراكمية هذه ، من خلال تعزيز تشفير مستقبلات الأفيون على سبيل المثال ، يؤدي إلى تعزيز نشاط الهرمون اللوتيني الذي يدفع الاستهلاك غير المصنوغ للأغذية المستساغة (الشكل 2).
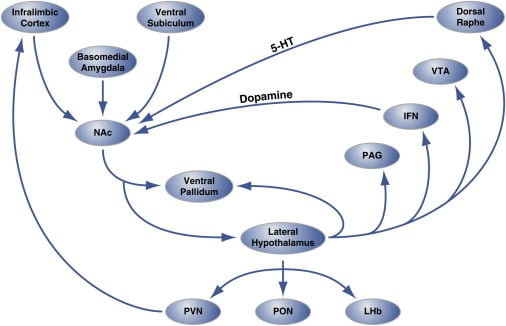
الشكل 2. على مستوى الدائرة منظمة من "النقاط الساخنة" Hedonic في Nucleus Accumbens Shell التي تنظم تناول الطعام
تستلم منطقة الصدف من النواة المتكئة (NAc) التعصيب من مواقع ومشاريع الدماغ القشرية والحابضية إلى الهايبوتلاموس الوحشي والبطني الباطن. بالمقابل ، فإن المهاد الجانبي يساهم أيضًا في الشرايين البطنية وأيضاً PAG ، و IFN ، و VTA ، ونواة راش الظهرية dorral raphe nucleus. توسع موجة IFN وموجبة الظهر الظهريين إسقاطات الدوبامينية والسيروتونين ، على التوالي ، إلى NAc. كما تحتل المهاد الجانبي أيضًا بنى مهادية (PVN و PON) و epithalamic (LHb). لا تظهر هي التوقعات الطفيفة من الهايبوتلاموس الجانبي إلى مناطق الدماغ. 5-HT، serotonin؛ IFN ، نواة بين الأوعية ؛ LHb، habenula الأفقي؛ PON ، النواة preoptic ؛ PVN ، نواة بارافينتريكولار المهاد ؛ VTA ، منطقة tegmental بطني. تم تكييف الشكل بإذن من Thompson و Swanson (2010).
داءارات الدماغ التي تنظم تناول الطعام في حالة الهضم: أنظمة Striatopallidal
بالإضافة إلى LH ، الخلايا العصبية قذيفة NAC أيضا مشروع ل VP (الشكل 2). في سلسلة من التجارب المثيرة للاهتمام ، تبين أن الإسقاطات التراكمية لنائب الرئيس و LH قد تنظم جوانب غير قابلة للاختلاط في تناول الطعام غير المصاب (مثل Smith و Berridge و 2007). دفعت DAMGO إلى إما NAc shell أو VP تفاعلات فموية زائدة لمحاليل السكروز مفترضًا لتعكس تفاعلات "متشابهة" في الفئران (أي استجابة استساغة) وكذلك زيادة استهلاك الطعام (Smith و Berridge و 2007). انخفضت دفعات النالوكسون إلى NAc أو VP عن تفاعلات تروق الوجه لسكروز ، مما يشير إلى أن إرسال الأفيون المتزامن في NAc و VP ضروري لمعالجة المعلومات المتعلقة باستساقة الطعام. ومع ذلك ، قلل النالوكسون في NAc ، ولكن ليس VP ، انخفاض في الطعام nonhomeostatic (سميث و Berridge ، 2007) ، مما يشير إلى أن الأكل nonhomeostatic يحدث مستقلة عن هذا الاتصال NAc → VP وبدلا من ذلك يعتمد على مسار NAc → LH ([سميث و Berridge، 2007] و [Taha et al.، 2009]). تمشيا مع الفكرة القائلة بأنه يمكن فصل جوانب تناول الطعام غير المصاب بالضغط ، فقد أظهرت تسجيلات الوحدة الواحدة أن مجموعة من الخلايا العصبية في NAc تظهر تشفيرًا انتقائيًا للمعلومات المتعلقة بخصائص تقوية النسبية للغذاء (أي ، استساغة) (طه و فيلدز ، 2005) . في نفس الفئران ، يبدو أن التغيرات في نشاط مجموعة ثانية من الخلايا العصبية NAc تتزامن مع بدء سلوك التغذية (Taha and Fields، 2005).
دارة الدماغ التي تنظم تناول الطعام الهادي: Amygdalar Systems
مزيد من الدعم لمفهوم أن جوانب من الطعام nonhomeostatic منفصلة ، naloxone ضخ في NAc شل أو نائب الرئيس ، ولكن ليس اللوزية basolateral (BLA) ، انخفضت استساغة حلول السكروز (Wassum وآخرون ، 2009). ومع ذلك ، عندما تم إدخال مضادات مستقبلات op-opioid النالوكسون أو CTOP في BLA ، ولكن ليس NAc shell أو VP ، كان هناك توهين ملحوظ للدافع المتزايد للرد على حلول السكروز التي تظهر عادة في حالة الجوع ([Wassum et al . ، 2011] و [Wassum et al. ، 2009]). هذا يشير إلى أن خصائص الحوافز من السكروز تنظمها دوائر اللوزة. بشكل عام ، تظهر النتائج المذكورة أعلاه أن الجوانب المختلفة للأكل المتعة ، مثل معالجة المعلومات المتعلقة باستساغة الطعام ، سلوكيات السلوك ، والزيادات في القيمة التحفيزية للأغذية المستساغة في الحيوانات الجائعة ، يتم تنظيمها بشكل مختلف من خلال دوائر دقيقة متناهية الصغر في سياق أكبر corticolimbic - striatopallidal - ما تحت المهاد - الدوائر المثلثية (الشكل 2).
هل التكييفات في داء الدماغ الهايدوني تدفع الأكل القهري؟
تم النظر في الصلة الوظيفية للبؤر الساخنة في قشرة NAc وتأثيرها على دارات ذات صلة بالتغذية على نطاق أوسع في الدماغ بواسطة كيلي وآخرون. (2005). يفترضوا أن مسار NAc shell → LH ، إلى جانب مناطق الدماغ التنظيمية المنبع والمصب (الشكل 2) ، يخدم غرض "حارس" (كيلي وآخرون ، 2005). على وجه التحديد ، يقترحون أنه حتى في الحيوانات الجائعة عندما يكون الدافع لتناول الطعام قويًا ، يجب الإبقاء على القدرة على إيقاف سلوك التغذية في حالة وجود تهديدات من البيئة (كيلي وآخرون ، 2005). وعلى هذا النحو ، قد يؤدي تنشيط الخلايا العصبية في NAc والتثبيط المصاحب للعصبونات LH إلى تعطيل التغذية المستمرة وتسهيل تبديل السلوك إلى استجابات تكيفية أكثر ملاءمة ، مثل التجميد أو الهروب (Kelley et al.، 2005). إذا كانت هذه هي الحالة بالفعل ، فعندئذ سيكون من المهم التحقيق فيما إذا كان مسار التحكم في قذيفة NAc → → LH معرضًا للخطر بسبب الاستهلاك المفرط للطعام المستساغ أو العوامل الوراثية التي تؤثر على التعرض للسمنة. مع وضع هذا في الاعتبار ، ذكر مختبرنا وآخرون في الآونة الأخيرة أن الاستهلاك المفرط للطعام ذي السعرات الحرارية المرتفعة يترافق مع ظهور سلوك تغذية يشبه القهري في الفئران ([Johnson and Kenny، 2010]، [Latagliata et al.، 2010] and [أوزوالد وآخرون ، 2010]). على وجه التحديد ، وجدنا أن استهلاك الطعام مستساغًا في الجرذان السمينة كان مقاومًا للاضطراب من خلال حافز مشرط مكشوف تنبأ بالنتيجة السلبية (footshock الكهربائية) (Johnson and Kenny، 2010). وبالتالي ، سيكون من المهم اختبار ما إذا كانت أوجه القصور في مسار التحكم في NAc → → LH الناتج عن الإفراط في تناول الطعام ، يساهم جزئيًا على الأقل في الفشل الواضح لدى الأشخاص الذين يعانون من السمنة المفرطة والسمنة في استخدام المعلومات المتعلقة بالعواقب الضارة لسلوكهم الكمومي لتخفيف استهلاكهم الغذائي. .
تغيير نشاط الدماغ في السمنة: دراسات تصوير الدماغ البشري
يعتبر الحصول على التأثيرات التحفيزية للطعام المستساغ على أنظمة مكافآت الدماغ عامل تحفيزي مهم يسهم في الإفراط في تناول الطعام. وبالتالي ، فإن السؤال المهم هو ما إذا كانت التغييرات في وظيفة المكافأة الدماغية قد تسهم في تطور السمنة. إن التنبؤ الحدسي هو أن تعزيز الاستجابة التأسيسية لنظم مكافآت الدماغ للأغذية المستساغة يمكن أن يؤدي إلى الإفراط في الأكل وزيادة الوزن. بالتوافق مع هذه الفرضية ، يظهر الأفراد ذوي المستويات العالية من حساسية مكافأة الميزة نشاطًا محسّنًا في مناطق الدماغ المتورطة في المكافأة الغذائية ، بما في ذلك NAc ، و amygdala ، و OFC ، و VP عند التعرض للطعام اللذيذ مثل كعكة الشوكولاتة والبيتزا (Beaver et al. ، 2006). وبالمثل ، يثبت الأفراد البدينين زيادة تنشيط دارات الثواب في الدماغ استجابة للطعام اللذيذ أو الإشارات المرتبطة بالأطعمة مقارنةً بالضوابط الخالية من الدهون ([Gautier et al.، 2000]، [Karhunen et al.، 1997] و [Rothemund et al.، 2007 ]). ارتبطت مستويات عالية من حساسية مكافأة سمة أيضا مع زيادة وزن الجسم في المواد البشرية ([ديفيس وآخرون ، 2004] و [فرانكن وموريس ، 2005]). الأهم من ذلك ، أن النساء البدينات (مؤشر كتلة الجسم> 30) لديهن مستويات أعلى من انعدام التلذذ (أي انخفاض حساسية خط الأساس للمكافأة) مقارنة بالنساء البدينات (مؤشر كتلة الجسم> 25 <30) (Davis et al. ، 2004). وبالمثل ، أظهرت Stice وزملاء العمل (2008b) أن الفتيات المراهقات البدينات قد زادن من تنشيط المنطقة القشرية ومناطق الدماغ القشرية الأخرى استجابةً للطعام اللذيذ أو العظة المرتبطة بالأطعمة مقارنةً بالموضوعات الخاضعة للتحكم في الدهون ، ولكن هذا التنشيط في المنطقة المقيمة كان مخططا ردا على طعام مستساغ مرتبطا عكسيا مع مؤشر كتلة الجسم في المواد السمنة. علاوة على ذلك ، كان لدى النساء اللواتي اكتسبن وزناً خلال فترة شهر 6 انخفاضاً ملحوظاً في النشاط المخطط للجسم استجابة لتناول الطعام المستساغ خلال هذه الفترة الزمنية مقارنةً بالنساء اللواتي لم يكتسبن وزناً (Stice et al.، 2010a). مع كل هذا معا ، يبدو أن فرط الحساسية لدوائر المكافأة قد يؤهب الفرد للإفراط في الوزن وزيادة الوزن (Stice et al.، 2010b). ومع ذلك ، مع زيادة زيادة الوزن ، قد يبدأ العجز في نشاط مكونات محددة من نظام مكافأة الدماغ ، وخاصة المخطط ، في الظهور. وقد اقترح أن ظهور هذه الحالة من مكافأة التحلل قد يؤدي إلى استمرار الاستهلاك المفرط للطعام من أجل التغلب على أوجه القصور هذه الثواب ([Stice et al.، 2008a] و [Wang et al.، 2002]). وبالتالي ، يبدو أن المكافأة الغذائية ضئيلة جدًا أو أكثر من اللازم تزيد من التعرض للإفراط في تناول الطعام والسمنة (Stoeckel، 2010). إن الإطار المفاهيمي الجذاب للتوفيق بين وجهات النظر هذه المتعارضة على ما يبدو هو أن المناطق القشرية التي تشارك في تنظيم السلوك نحو الحصول على مكافآت الغذاء والتنبؤات حول المكافأة الغذائية المتوقعة في المستقبل قد تصبح مفرطة النشاط في الأشخاص الذين يعانون من زيادة الوزن والذين يميلون إلى السمنة. وعلى العكس من ذلك ، قد تصبح مواقع الدماغ المخطط للدم التي تعالج التجربة الفعلية للمتعة من تناول الطعام المتعة أقل وظيفية بشكل تدريجي في هؤلاء الأفراد. لذلك ، من المتوقع أن تزيد القيمة التحفيزية النسبية للطعام المستساغ أثناء نمو السمنة في نفس الوقت الذي تنخفض فيه قيمة المتعة التي يتم الحصول عليها من استهلاك الغذاء المستساغ.
تغيير نشاط الدماغ في السمنة: دراسات القوارض
تم تقييم آثار استهلاك الطعام المستساغ على أنظمة مكافآت الدماغ بشكل مباشر في الحيوانات المختبرية باستخدام إجراء مكافأة الدماغ (BSR). من المعروف أن التحفيز الكهربائي لـ LH ، والذي يتلقى مدخلات تثبيط منشط من البقع الساخنة hedonic التراكمية (الشكل 2) ، هو مجزي للغاية وسوف تعمل الجرذان بجد لتحفيز منطقة الدماغ هذه ، على سبيل المثال ، (Markou و Frank و 1987 ). بالإضافة إلى دعم سلوك التحفيز الذاتي ، فإن التحفيز الكهربائي لـ LH يمكن أن يؤدي أيضًا إلى نوبات مكثفة من سلوك التغذية (Margules and Olds، 1962) ، وقد تم اقتراح أن تكون الخصائص المكافأة لتحفيز LH مرتبطة بالدور الجوهري لهذا موقع الدماغ في الخصائص الشهية والمحفزة للمواد الغذائية (Margules and Olds، 1962). بالتوافق مع هذا الرأي ، فإن الجوع وفقدان الوزن يزيدان من حساسية الجرذان لتحفيز القيمة الذاتية LH المكافئة ([Blundell and Herberg، 1968]، [Carr and Simon، 1984] و [Margules and Olds، 1962]) ، وهو تأثير التي يمكن سدها عن طريق ضخ intracerebroventricular من اللبتين (فولتون وآخرون ، 2000). على العكس ، يتم تحفيز التحفيز الذاتي الكهربائي لل LH في الحيوانات المغلفة (Wilkinson and Peele، 1962). في الواقع ، الإفراط في إفراز الجرذان من خلال أنبوب التغذية داخل المعدة (Hoebel و Teitelbaum ، 1962) ، انتفاخ المعدة ، أو حقن الغلوكاغون عن طريق الوريد الذي يحاكي شبع ما بعد الأكل ([هوبل ، 1969] ، [هوبل وبلجورا ، 1967] و [جبل و Hoebel ، 1967] ) ، كل توهين الاستجابة لتحفيز LH. في الواقع ، سوف تستجيب الجرذان التي استجابت بقوة في السابق لمكافأة تحفيض LH كما لو كان هذا التحفيز مكرهًا بعد تناول الطعام أو تطور السمنة (Hoebel and Thompson، 1969). ومن ثم ، فإن القيود الغذائية المزمنة وفقدان الوزن يعزز ، في حين أن الإفراط في التغذية يقلل من حساسية المواقع ذات الصلة بالمكافأة في LH. ولذلك فإن حساسية الخلايا العصبية LH لمكافأة التحفيز الذاتي الكهربائي قد توفر رؤى مهمة حول سير دارات الدماغ التي تنظم الاستجابات الغذائية للأطعمة.
نظرًا لأن سهولة الوصول إلى الطعام المستساغ الكثيف للطاقة والاستهلاك الزائد الناتج عن ذلك يعتبر عاملاً بيئياً رئيسياً يسهم في السمنة (Volkow and Wise، 2005) ، استخدم مختبرنا مؤخرًا إجراء BSR لتقييم نشاط مكافآت الدماغ في الجرذان مع وصول ممتد إلى الطعام المستساغ . على وجه التحديد ، قمنا بتسجيل استجابة للتحفيز الكهربائي من LH في الفئران التي لديها وصول libitum إلى التغذية الغذائية وحدها أو تشاو جنبا إلى جنب مع 18-23 hr الوصول اليومي إلى نظام غذائي مستساغ. يتكون هذا النظام الغذائي من الجبن ولحم الخنزير المقدد والسجق وغيرها من المواد الغذائية فاتح للشهية (جونسون وكيني ، 2010). لقد وجدنا أن الفئران التي لديها وصول موسّع إلى الطعام المستساغ بسرعة اكتسبت كميات كبيرة من الوزن وأظهرت نقصًا مفاجئًا في عجز الدماغ (وهو ما انعكس على أنه تناقص في الاستجابة لتحفيز مكافأة LH) (جونسون وكيني ، 2010 ، الشكل 3). هذا يشير إلى أن تطوير السمنة الناجمة عن النظام الغذائي يرتبط مع انخفاض تدريجي في استجابة مواقع مكافأة في LH (جونسون وكيني ، 2010). كما تم الإبلاغ عن حالات العجز في إشارات المكافأة في الجرذان البالغة التي كانت في السابق تتمتع بإمكانية الوصول غير المحدود إلى السكروز أو الأطعمة الغنية بالدهون خلال فترة المراهقة ([Teegarden et al.، 2009]، [Vendruscolo et al.، 2010a] و [Vendruscolo et al.، 2010b]). تذكر هذه التأثيرات في الفئران بتدني التنشيط القاعدي استجابة لمكافأة الطعام الموصوفة أعلاه في الأجسام البشرية حيث اكتسبت وزناً خلال فترة شهر 6 (Stice et al.، 2010a ؛ انظر الشكل 4). مثل عجز المكافأة الناتج عن النظام الغذائي في الجرذان الزائدة الوزن ، وربما لدى البشر الذين يكتسبون وزناً ، من المحتمل أن يعكس استجابة مضادة للتكيف في دوائر المكافآت الغذائية لمعارضة تحفيزهم الزائد بالأغذية المستساغة (جونسون وكيني ، 2010). من الجوانب المهمة في هذا الاستنتاج أنه يتم الكشف عن أوجه نقص مماثلة في وظيفة المكافأة في الجرذان التي تتغذى على الكوكايين أو الهيروين ([أحمد وآخرون ، 2002] ، [كيني وآخرون ، 2006] و [ماركو وكوب ، 1991] ؛ الشكل 3). في الواقع ، تم الافتراض بأن الخلل الوظيفي للمخدر الذي يسببه الدواء يمكن أن يسهم في الانتقال من السيطرة على المخدرات إلى السيطرة عليها من خلال توفير مصدر جديد للدوافع لاستهلاك الدواء من أجل التخفيف من الحالة المستمرة للمكافأة المتخلفة ([أحمد وكوب و 2005] و [Koob و Le Moal و 2008]). لذلك ، من الممكن أن العجز في حساسية مواقع المكافأة في LH الناجم عن الإفراط في تناول الطعام قد يزيد من استمرارية استهلاك الطعام المستساغ على المدى الطويل في الجرذان الزائدة عن طريق تحويل تفضيل النظام الغذائي إلى الغذاء مع تأثير أكبر على التخفيف من حدة الحالة السلبية مكافأة.
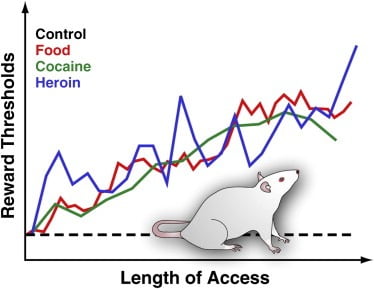
الشكل 3. عتبات المكافأة في الجرذان مع الوصول اليومي الممتد للطعام المستساغ أو الكوكايين أو الهيروين
لقياس عتبة المكافأة ، يتم زرع قطب محفز جراحيًا في المهاد الجانبي للفئران ، وهي منطقة يكون فيها التحفيز الكهربائي مجزًا بقوة ويمكن أن يؤدي إلى نوبات مكثفة من سلوك التغذية. بعد الشفاء ، يُسمح للحيوانات بتنشيط هذه المنطقة عن طريق تدوير العجلة. بعد إنشاء سلوك التحفيز الذاتي المستقر ، يتم تحديد الحد الأدنى لشدة التحفيز التي تحافظ على سلوك التحفيز الذاتي (أي عتبة المكافأة). توفر عتبة المكافأة هذه قياسًا عمليًا لنشاط نظام المكافآت. وتبقى عتبات المكافأة ثابتة وغير قابلة للتغيير في فئران السيطرة التي تتمتع بإمكانية الوصول إلى المعيار القياسي ، وهي تبقى ساذجة للأدوية. ومع ذلك ، ترتفع العتبات تدريجياً في الجرذان مع وصول يومي ممتد إلى نظام غذائي مستساغ كثيف الطاقة يتكون من مواد غذائية لذيذة (مثل كعكة الجبن ولحم الخنزير المقدد والشوكولاتة ، إلخ). وبالمثل ، ارتفعت عتبات المكافأة تدريجياً في الجرذان التي زادت من الوصول اليومي إلى الكوكايين الوريدي أو حقن الهيروين. يتم تفسير عتبة المكافآت المرتفعة لتعكس انخفاض حساسية نظام مكافأة الدماغ. تشير هذه التأثيرات إلى أن الاستهلاك المفرط للطعام المستساغ والاكتساب المرتبط بالوزن يمكن أن يسبب عجزًا عميقًا في مكافأة الدماغ مماثلة لتلك الناجمة عن الاستهلاك المفرط للعقاقير المسببة للإدمان
الشكل 4. الاستمرارية للبدانة في السمنة إن زيادة الكفاءة ترتبط بانخفاض التنشيط القاعدي استجابة للأغذية المستساغة ، كما تم قياسه بواسطة الرنين المغناطيسي الوظيفي ، ومستويات أقل لمستقبل مستقبل الدوبامين D2 (D2R) لدى البشر (انظر النص للحصول على التفاصيل).
نقص في الدوبامين D2 مستقبلات الإشارات في السمنة
وكشفت عدة تقارير حديثة عن آليات محتملة يمكن أن تظهر من خلالها حالات العجز في المكافأة استجابة للإفراط في الاستهلاك من الطعام المستساغ أثناء تطور السمنة. كما لوحظ أعلاه ، كان لدى النساء اللواتي اكتسبن وزناً خلال فترة شهر 6 انخفاضاً ملحوظاً في النشاط المخطط للجسم استجابة لتناول طعام مستساغ خلال هذه الفترة الزمنية مقارنةً بالنساء اللواتي لم يكتسبن الوزن (Stice et al. ، 2010a ؛ الشكل 4). كان لدى الأفراد الصائمين المسموح لهم بتناول وجبتهم المفضلة للشبع مستويات منخفضة من الارتباط لمستقبلات الدوبامين D2 (D2R) raclopride في المخطط (Small et al.، 2003) ، مما يشير إلى أن إشارات D2R تنخفض استجابة لاستهلاك الطعام المستساغ. في الواقع ، لدى الأفراد البدينين مستويات أقل من توافر D2R المخطط مقارنةً بالضوابط الخالية من الدهون ([Barnard et al.، 2009]، [Stice et al.، 2008a] و [Wang et al.، 2001] ؛ الشكل 4) ، في حين أن فقدان الوزن في المرضى الذين يعانون من السمنة المفرطة ترتبط بزيادة كثافة D2R مخطط (وانغ وآخرون ، 2008). وبالنظر إلى أن انتقال الدوبامين المقذوف يلعب دورًا رئيسيًا في تنظيم تناول الطعام ، يمكن أن يسهم الانخفاض التكيّفي في تشوير D2R في انخفاض استجابة الجسم المخطط للأطعمة المستساغة لدى الأفراد البدينين. لاختبار هذا الاحتمال ، قام زملاؤه وزملاؤهم في دراسة النشاط في دارات الثواب في الدماغ استجابة لمخفوق حليب مستساغ لدى الأفراد الذين يتحكمون في الأليل Taqia A1 (Felsted et al.، 2010). إن طول تعدد أشكال تقييد طقيا مقيد من جين D2R (Neville et al.، 2004) ، والأفراد الذين يحملون أليل A1 من تعدد الأشكال بين 30٪ - 40٪ أقل من الـ D2Rs المخطط مقارنة مع أولئك الذين لا يحملون الأليل ([Jönsson et al.، 1999]، [Ritchie and Noble، 2003] and [Stice et al.، 2010b]). بالإضافة إلى ذلك ، فإن ناقلات الأليل A1 تقوم أيضًا بتقليل استقلاب الجلوكوز في مناطق الدماغ المخطط والقلبي التي تشارك في الاستجابات الملحوظة للطعام (Jönsson et al.، 1999). يتم تمثيل الأفراد الذين لديهم آليل طقيا أكسنومكس بشكل زائد في المجموعات السامة ([برنار وآخرون ، 1] ، [Stice et al. ، 2009a] و [Wang et al.، 2008]). علاوة على ذلك ، يزيد أيضًا الأليل A1 من قابلية التعرض للإدمان على الكحول والإدمان الأفيوني والحركي النفسي ([Lawford et al. و 2000] و [Noble et al. و 1993] و [Noble et al.، 2000]). وقد وجد أن مناطق الدماغ المتوسط التي تشمل على الأرجح VTA و SN ، والتي توفر مدخلات الدوبامينية للمخطط المخطط ، تم تنشيطها استجابةً لمخفوق الحليب المستساغ في الأفراد المتحكمين (Felsted et al.، 2010). وبالعكس ، فقد انخفض النشاط في هذه المواقع الدماغية استجابة لمكافأة الطعام في ناقلات الأليل A1 (Felsted et al.، 2010). كما تم الكشف عن استجابات عكسية مماثلة في تنشيط الدماغ بين ناقلات الأليلات A1 و noncarriers في مواقع الدماغ المهادية والقشرية (Felsted et al.، 2010). هذه البيانات متناسقة إلى حد كبير مع الدور الرئيسي لـ D2Rs في تنظيم استجابة mesostriatal للطعام المستساغ. وجدت Stice وزملاؤها (2008a) علاقة عكسية بين مؤشر كتلة الجسم وتنشيط المخطط (الميلاتة والبوتامين) استجابة لمخمرة اللبن الشائغ في المرضى من البشر. علاوة على ذلك ، كانت هذه العلاقة العكسية أكثر وضوحا في الأفراد الذين يحملون أليل طقيا A1 (Stice et al.، 2008a). أظهرت زيادة الوزن في المستقبل لدى هؤلاء الأفراد ، بعد قياس 1 سنة بعد التصوير الأولي للدماغ ، أن حجم التنشيط الجسدي استجابة للأغذية المستساغة كان مرتبطا سلبيا مع زيادة الوزن في الأشخاص الذين لديهم أليل A1 وارتبط بشكل إيجابي في موضوعات الأليل غير A1 ( Stice et al.، 2008a). في دراسة متابعة ، تم الإبلاغ عن أن حجم التنشيط المخطط للرد على تناول الطعام المتخيل من الطعام مستساغ ، بدلا من استهلاكه الفعلي ، كان مرتبطا عكسيا مع زيادة الوزن خلال السنة التالية في المواضيع مع أليل A1 ولكن إيجابيا يرتبط في الموضوعات غير A1 الأليل (Stice et al.، 2010b). تشير هذه النتائج إلى أن D2Rs تنظم الاستجابة التقويمية للطعام المستساغ ، وأن تقلص إشارات D2R الناجمة عن زيادة الوزن أو العوامل الوراثية قد تزيد من التعرض للسمنة.
تشاؤم D2R Signoring تساهم في مكافأة العجز في السمنة
مماثلة لمستويات D2R المخطط لها في الجسم البشري الخفيف ، يتم أيضًا خفض مستويات D2R في الفئران والجرذان التي تغذت على نظام غذائي مستساغ (على سبيل المثال ، [Colantuoni et al. و 2001] و [Geiger et al. و 2009] و [Johnson and Kenny ، 2010]) وفي الفئران الموروثة وراثيا للبدانة (زوكر الفئران) (ثانوس وآخرون ، 2008). قام مختبرنا بالتحقق بشكل مباشر من دور تعطيل انتقال الدوبامين المخطط بشكل عام ، وانخفاض في تشوير D2R بشكل خاص ، في حالات العجز التي تشبه الإدمان والتي تظهر في الجرذان أثناء تطور السمنة (انظر الشكل 5). على وجه التحديد ، قمنا باختبار تأثيرات تقليل التعبير عن D2R في جسم المريض باستخدام الفئران باستخدام تداخل RNA بوساطة فيروسية ، ثم تقييم عتبات BSR عند وصول الفئران إلى chow فقط أو تشاو جنبًا إلى جنب مع 18 – 23 hr الوصول اليومي إلى طاقة عالية الطاقة مستساغة النظام الغذائي (أي حمية الكافتيريا) (جونسون وكيني ، 2010). وجدنا أن الاستجابة لتحفيز مكافأة LH بدأت تنخفض على الفور تقريبا عند التعرض لحمية الكافتيريا في الجرذان D2R ضربة قاضية (جونسون وكيني ، 2010 ، الشكل 5). وبالتالي ، فإن الانخفاض في مستويات D2R في مخطط الجذور يسرع بشكل سريع من ظهور نقص الوظيفة في الجرذان مع وصول ممتد إلى طعام مستساغ للغاية ، وهي عملية تستغرق عادة أسابيع عديدة لتظهر في فئران التحكم مع وصول ممتد إلى نظام غذائي مستساغ. ومع ذلك ، فإن ضربة قاضية من D2Rs مخطط الجراثيم في الفئران مع الوصول إلى تشاو فقط لا يغير الاستجابة لتحفيز مكافأة LH ، مما يشير إلى أن تتضاءل إشارة D2R المخففة المتراكمة مع غيرها من الاستجابات التكيفية التي يسببها النظام الغذائي في الدوائر مكافأة الدماغ لتحريك مكافأة الحساسية. بالإضافة إلى خفض مستويات D2R ، يتم أيضًا تغيير جوانب أخرى من انتقال الدوبامينات في الجسم في أدمغة الجرذان البدناء. على سبيل المثال ، ولدت الجرذان Sprague-Dawley الانتقائية لزيادة الوزن بسرعة على نظام غذائي عالي الطاقة (الجرذان المعرضة للسمنة) لديها مستويات قاعدية منخفضة وأثار الدوبامين في NAc من الفئران التي تقاوم زيادة الوزن (الجرذان المقاومة للسمنة) (Geiger et al.، 2008؛ see also Rada et al.، 2010). كما أن لدى الجرذان المعرضة للسمنة مستويات منخفضة من آلات الدوبامين للتخليق الأحيائي والتخزين ، مما يشير إلى أن الفشل في إنتاج وإفراز الدوبامين يسهم في حالات النقص في انتقال الدوبامين المضطرب في الجرذان البدانة (جيجر وآخرون ، 2008). كما أن الجرذان التي طورت السمنة من خلال الاستهلاك المفرط لنظام غذائي عالي الطاقة مستساغ كانت لديها أيضًا قاعدة قاعدية منخفضة وأثار مستويات الدوبامين في NAc مقارنة بالفئران التي كان لها وصول فقط إلى الطعام القياسي ([Davis et al.، 2008] و [Geiger et al.، 2009]). والأهم من ذلك ، أن وجبة من الطعام القياسي كانت كافية لزيادة مستويات الدوبامين في NAc لفئران التحكم ، في حين أن المواد الغذائية المستساغة فقط كانت كافية لإطلاق إطلاق الدوبامين المتراكم في الجرذان البدانة التي كان لها تاريخ ممتد في الوصول إلى الطعام المستساغ. (Geiger et al.، 2009). هذه النتائج تدل على أن تطوير السمنة في الفئران يرتبط مع خلل في انتقال الدوبامين mesostriatal ، وأبرزها في D2Rs مخطط ، وأن ناقصة D2R إشارة يساهم في ظهور العجز مكافأة أثناء تطوير السمنة في الفئران. ويتسق هذا مع حقيقة أن خفض مستوى D2Rs الجهازي هو استجابة عصبية ملحوظة لزيادة اكتساب الوزن لدى البشر ([Barnard et al.، 2009]، [Stice et al.، 2008a] و [Wang et al.، 2001])، وأن إشارة D2R غير المخططة قد تقوّض الاستجابات المخططة للطعام الهادي في المواد البشرية ، وبالتالي تؤهب الفرد إلى زيادة الوزن في المستقبل ([Stice et al.، 2008a] و [Wang et al.، 2001]).
الشكل 5. مستقبلات الدوبامين D2 ، واختلال المكافأة ، والقهرية في السمنة - الضربة القاضية لمستقبلات الدوبامين D2 (D2R) في مخطط الجرذان تسرع من ظهور اختلال وظيفي في المكافأة والأكل القهري في الفئران مع وصول ممتد إلى الطعام المستساغ.
ناقصة قد إشارات D2R الزناد الأكل في السمنة
تتميز السمنة بالإفراط في الأكل على الرغم من الرغبة في الحد من الاستهلاك ومعرفة العواقب الصحية والاجتماعية السلبية العميقة للاستهلاك المفرط المستمر ([Booth et al.، 2008]، [Delin et al.، 1997] و [Puhl et آل. ، 2008]). يتجلى ذلك في حقيقة أن العديد من المرضى البدناء سيخضعون لجراحة السمنة (عملية جراحية في المعدة) خطرة محتملة للتحكم في وزنهم (Yurcisin et al.، 2009) ، ولكن في كثير من الأحيان يعودون إلى الإفراط في تناول الطعام على الرغم من أن الجراحة تقلل من التقييم الشخصي للجوع وتقلل من القدرة على استهلاك كميات كبيرة من الطعام ([Kalarchian et al.، 2002] و [Saunders، 2001]). ويعرف الإدمان على المخدرات بالمثل على أنه فقدان السيطرة المثبطة على استهلاك المخدرات والمثابرة في العادة على الرغم من الوعي بالعواقب الصحية أو الاجتماعية أو المالية المدمرة المحتملة (DSM-IV ؛ الجمعية الأمريكية للطب النفسي ، 1994). على هذا النحو ، فإن السمنة وإدمان المخدرات يشتركان في العلامات المميزة للاضطرابات القهرية في وجود فشل واضح في استخدام المعلومات المتعلقة بالعواقب الضارة في المستقبل إلى الاستهلاك المعتدل والثبات في الاستهلاك على الرغم من توافر سلوكيات بديلة أقل ضررا.
وقد تم تعريف تعاطي المخدرات القهري بشكل عملي في القوارض على أنه استهلاك مقاوم للقمع من خلال العقاب أو منبهات بيئية تتنبأ بالعقاب ([Pelloux et al.، 2007] و [Vanderschuren and Everitt، 2004]). يمكن أن تؤدي فترات الوصول الممتد إلى الكوكايين وغيره من أدوية الإساءة إلى ظهور سلوكيات إجبارية لتعاطي المخدرات في الجرذان ([أحمد وكوب ، 1998] ، [Deroche-Gamonet et al. ، 2004] و [Vanderschuren و Everitt ، 2004] ). في الواقع ، تظهر الجرذان التي لها تاريخ من استهلاك الكوكايين المكثف مدخولًا مقاومًا للاضطراب من قبل حافز مشرع مكره (CS) يتنبأ بالنتيجة السلبية (بمعنى ، ضوء جديلة يتنبأ بتسليم حشرات مضايقة) ([Belin et al.، 2008] و [Vanderschuren و Everitt، 2004]). وعلى العكس من ذلك ، يمكن أن يقلل التناقص الحاد في نفس المجال من استجابات البحث عن المخدرات في الجرذان مع وصول محدود نسبيا إلى العقار. وبالنظر إلى أوجه التشابه بين تعاطي المخدرات القهري في الإدمان والإفراط في تناول السمنة ، فقد قمنا مؤخرًا بالتحقيق في ما إذا كانت الجرذان السمينة تستهلك طعامًا مستساغًا بطريقة محبوبة وإذا لعبت دوراسوماكس (D2Rs) دورًا في هذه العملية (Johnson and Kenny، 2010). وجدنا أن الجرذان البدناء التي لها تاريخ من الوصول الممتد إلى الطعام المستساغ استمرت في أكل الطعام المستساغ حتى في وجود CS الوديع (إشارة جاذبة) التي تنبأت بإيصال ملاحقة مشاكسة (Johnson and Kenny، 2010). وعلى النقيض من ذلك ، أدى اضطراب التغذية المكافئة ذاته إلى تعطيل استهلاك الطعام المستساغ في الجرذان الخالية من الدهون مع التعرض المحدود جدًا للطعام ذي الطاقة كثيفة الاستهلاك. وبالتالي يمكن أن يصبح استهلاك الطعام المستساغ إلزاميًا في الجرذان البدينين بنفس الطريقة التي يمكن أن يصبح بها استهلاك الكوكايين إلزاميًا. تماشيا مع هذا التفسير للبيانات ، قضت الفئران التي كانت تتمتع في السابق بإمكانية الحصول على نظام غذائي عالي الدهون مستساغًا مزيدًا من الوقت في بيئة مفعمة بالحيوية (إضاءة مضاءة) للحصول على الطعام المستساغ من الفئران التي لم تكن لديها خبرة سابقة في النظام الغذائي (Teegarden and Bale ، 2007). بسبب الخوف من الافتراس ، تكون الساحات المفتوحة ذات الإضاءة الزاهية عالية على الفئران (سواريز و Gallup ، 1981). ولذلك ، تصبح الفئران مقاومة للعواقب السلبية المحتملة لسلوكها في البحث عن الطعام ، وسوف تخاطر بالافتراس للحصول على طعام مستساغ ، حتى عندما يكون الغذاء الأقل استساغة متاحًا في خطر أقل بكثير.
ومن المثير للاهتمام ، أن أليل A1 لتعدد الأشكال TqIA الذي ينتج عنه انخفاض كثافة D2R المخطط (النبيلة ، 2000) والتنشيط اللفظي المستجيب استجابة للأغذية المستساغة (Stice et al. ، 2008a) يرتبط أيضًا بالعجز في تعلم تجنب الإجراءات التي لها العواقب السلبية (Klein et al.، 2007). هذا النوع من الفشل على وجه التحديد هو استخدام المعلومات المتعلقة بالعواقب السلبية المستقبلية للإفراط في الأكل والتي قد تساهم في نمو الأكل القهري لدى الأفراد البدينين. وجدنا أن ظهور مثل الأكل القهري في الفئران مع الوصول إلى الغذاء مستساغ تسارعت بشكل كبير في أعقاب ضربة قاضية D2R مخطط (جونسون وكيني ، 2010). في الواقع ، أظهرت الجرذان التي لديها ضربة قاضية من نوع D2R من قبل ، والتي كانت في السابق فقط أيام 14 من الوصول الممتد إلى الطعام المستساغ الكثيف للطاقة ، استهلاكًا غذائيًا مستساغًا كان مقاومًا للاضطراب من قبل CS المليء بالحيوية (Johnson and Kenny، 2010؛ Figure 5). ومع ذلك ، فإن فترة اليوم 14 من التعرض المحدود للغذاء المستساغ لم تكن كافية للحث على تناول الطعام القهري في فئران التحكم (Johnson and Kenny، 2010). هذه النتائج تشير إلى أن تناول القهري مثل الإدمان من الغذاء مستساغ يمكن أن تظهر في الجرذان يعانون من السمنة المفرطة. علاوة على ذلك ، فإن تأخر إشارة D2R المخططة ، التي تسرع ظهور حساسية فرط المكافأة استجابة لاستهلاك الطعام المستساغ ، تسرع أيضًا من ظهور الأكل القهري (الشكل 5).
التفاعلات بين D2Rs والهيئات الهرمونية لموازنة الطاقة في السمنة
يثبط الليبتين الخارجي المنشأ في الـ VTA عمليات نقل الدوسامين (mesoaccumbens) وسلوك التغذية ([Hommel et al.، 2006] و [Krügel et al.، 2003]). بالإضافة إلى تأثيره المثبط الحاد على أنظمة دوبامين الدماغ المتوسط ، هناك أدلة تراكمية على أن إشارات الليبتين التنشيطية قد تكون ضرورية أيضًا للحفاظ على مستويات مناسبة من إشارات الدوبامين في الميزوستريات. وجد <فلير> وزملاؤه أن الفئران / ob ob كانت ذات مستويات أقل من هيدروكسيلاز التيروزين في الخلايا العصبية الدوبامين الدماغية الوسطى ، وهو إنزيم رئيسي في التخليق الحيوي للدوبامين (Fulton et al.، 2006). وبالإضافة إلى ذلك ، خفضت الفئران ob / ob إطلاق إطلاق الدوبامين في NAc (فولتون وآخرون ، 2006) وانخفاض مخازن حويصلات السوماتودندريتيك من الدوبامين في VTA و SN (Roseberry وآخرون ، 2007). تم تصحيح هذه القصور في إنتاج الدوبامين وآلات نقل الإشارات في الفئران ob / ob عن طريق العلاج مع اللبتين ([فولتون وآخرون ، 2006] و [Pfaffly وآخرون ، 2010]). في الواقع ، كان الليبتين الممزوج فقط في LH كافياً لتصحيح انتقال الدوبامين المختل في فئران ob / ob (Leinninger et al. ، 2009) ، مما يشير إلى أن خلايا مستقبلات الليبتين المعرب عنها في LH تعمل على الحفاظ على مستويات مناسبة من إشارات الدوبامين. بالإضافة إلى تضاؤل إنتاج وإفراز الدوبامين ، تميل فئران ob / ob أيضًا إلى انخفاض مستويات تعبير D2R في المخطط (Pfaffly et al.، 2010). وعلاوة على ذلك ، فإن علاج الليبتين الخارجي في ظل نظام ينجم عنه تطور حساسية للإشارة إلى الليبتين (أي مقاومة اللبتين) يقلل بشكل ملحوظ مستويات D2R في الفئران من النوع البري (Pfaffly et al.، 2010). تظهر الجرذان البدينة مقاومة لبتين في الـ VTA ([Matheny et al.، 2011] و [Scarpace et al.، 2010]) ولديها أيضًا مستويات أقل من TH في الـ VTA ، وتقلص إفراز الدوبامين في المخطط ، وانخفاض مستويات D2R في الجسم (جيجر) وآخرون ، 2008). مجتمعة ، تُظهِر هذه البيانات أن لبتين لديه إجراءات معقدة في أنظمة دوبامين الدماغ المتوسط. من ناحية ، فإن التنشيط الحاد لمستقبلات اللبتين في الـ VTA يُحدث تأثيراً مثبطاً على انتقال الدوبامين عبر القنوات المتوسطة ويمكن أن يمنع سلوك التغذية ([Hommel et al.، 2006] و [Krügel et al.، 2003]). ومن ناحية أخرى ، من الضروري أن تكون إشارة الليبتين في الدماغ المتوسط ضرورية للمحافظة على إنتاج الدوبامين ونقل الإشارات ، كما أن العجز الوراثي في الإشارة إلى الليبتين أو تطوير مقاومة الليبتين في السمنة يؤدي إلى عرقلة النظم الدوبامينية المتوسطة بشكل عميق. على هذا النحو ، من المحتمل أن يكون تطور مقاومة الليبتين في الخلايا العصبية الدوبامينية الوسطى أثناء نمو السمنة دورًا محوريًا في تعطيل إشارات D2R المخططة التي يبدو أنها تدفع بظهور اختلال المكافأة على غرار الإدمان والإفراط في الأكل (الشكل 5) في الجرذان يعانون من السمنة المفرطة.
بالإضافة إلى التأثيرات المعقدة للإشارة إلى الليبتين على انتقال الدوبامينات الدقيقي ، هناك أدلة متراكمة على أن D2Rs قد تقوم بدورها بتنظيم إشارات leptin. يقلل بروموكريبتين ناهض D2R من مستويات تعميم الليبتين ([Doknic et al.، 2002]، [Kok et al.، 2006] و [Mastronardi et al.، 2001]) ، مما يوحي بأن D2Rs تمارس تأثيرا مثبطا على مستويات الليبتين. وعلاوة على ذلك ، فقد عززت الفئران ذات الطفرات اللاجئة في جين D2R الإشارة إلى الليبتين في الوطاء وهي أكثر حساسية للتأثيرات الشرجية لليبتين (كيم وآخرون ، 2010). من المعروف أن مستويات الليبتين تزداد أثناء نمو السمنة (فرط بلتيم الدم) ، ومع ذلك هناك تناقص مصاحب في الحساسية للإشارة إلى الليبتين (أي مقاومة اللبتين) (Hamilton et al.، 1995). وبالتالي ، فمن الاحتمالات المثيرة للاهتمام أن الانخفاض في تنبيهات D2R الجينية خلال تطور السمنة قد يمثل استجابة تعويضية للإفراط في استهلاك الطعام وزيادة الوزن ، مما يزيد من انتشار مستويات الليبتين ويزيد من كفاءة الإشارة للتغلب على تطور مقاومة اللبتين. قد يؤدي مثل هذا الإجراء إلى تعزيز التأثيرات المثبطة لللتهاب الليبتين على الأنظمة الجوفية التي تنظم الاستجابة للأطعمة المستساغة ([فاروقي وآخرون ، و 2007] ، و [فولتون وآخرون ، و 2006] و [هومل وآخرين ، و 2006]) ، وبالتالي يتصرفون لتخفيف الاستجابات الملحوظة للطعام المستساغ. وضع هذه النتيجة جنبا إلى جنب مع الدور التنظيمي لليبتين على D2Rs الموصوف أعلاه ، يبدو أنه يمكن أن يقترن leptin و D2R الإشارة بطريقة متبادلة لتنظيم الجوانب التماثل والمتعطش للسلوك التغذية.
نظم الإجهاد الدماغ غير منظم في السمنة
إشارات Leptin في الدماغ المتوسط تعمل على تنظيم نقل الدوسامين (mesoaccumbens) والاستجابة للطعام الملوتيني. ومع ذلك ، الخلايا العصبية في VTA التي تعبر عن مشروع مستقبلات اللبتين قليلة إلى NAc ، وبدلاً من ذلك تظهر المزيد من التوقعات البارزة للنواة المركزية للاللوزة (CeA) (Leshan et al.، 2010). في سياق سلوك التغذية ، من المعروف أن الـ CeA تنظم التأثيرات المثبطة للمحفزات البيئية الضارة على استهلاك الغذاء (Petrovich et al.، 2009). على وجه التحديد ، فإن آفات الـ CeA ، وليس الـ amygdala basolateral (BLA) ، تلغي التأثيرات المثبطة لمحفز مشروط مرتبط بالقرص المضغوط على التغذية ، مما يشير إلى أن الـ CeA ضروري للتحكم المثبط في سلوك التغذية استجابة إلى الإشارات البيئية التي تتنبأ بالنتائج السلبية ( بتروفيتش وآخرون ، 2009). تستمر الجرذان البدينة ، أو الجرذان غير النونية مع ضربة قاضية D2R الجسمية والوصول إلى الطعام المستساغ ، في استهلاك الطعام المستساغ بطريقة تشبه القهري في وجود CS مغرم. هذه التأثيرات تشبه إلى حد مذهل تعطل التفاعل إلى فئران مكروه في الجرذان المصابة بمضادات الفيروسات القهقرية (Petrovich et al.، 2009). وبالتالي ، سيكون من المهم تحديد ما إذا كانت التغيرات في نشاط الـ CeA ، ربما كنتيجة لتدني معدل D2R المخطط أو تطوير مقاومة اللبتين في الدماغ المتوسط ، تساهم في ظهور تناول شبيه بالقسطرة في الجرذان السمانين.
بالإضافة إلى تنظيم تأثيرات المنبهات البيئية الضارة على سلوك التغذية ، قد تلعب CEA أيضًا دورًا رئيسيًا في تناول الطعام الملذات المرتبط بالإجهاد. عند البشر ، يحفز الإجهاد بقوة اختيار واستهلاك الأطعمة المستساغة كثيفة الطاقة بغض النظر عن الحاجة إلى السعرات الحرارية ([Gluck et al. ، 2004] ، [Kandiah et al. ، 2006] و [O'Connor et al. ، 2008]) ، والسمنة مرتبطة بارتفاع إفراز الجلوكورتيكويد المرتبط بالإجهاد ([Björntorp and Rosmond ، 2000] و [la Fleur ، 2006]). تؤدي الضغوطات البيئية والاجتماعية أيضًا إلى حدوث فرط أكل للأطعمة المستساغة كثيفة الطاقة في القوارض والقردة ، مع استهلاك طعام مستساغ يحتمل أن يخفف الآثار الضارة للإجهاد ([Dallman et al. ، 2003] ، [Dallman et al. ، 2006] ، [Pecoraro et آل ، 2004] و [ويلسون وآخرون ، 2008]). علاوة على ذلك ، يمكن لعقار يوهمبين المثير للإجهاد أن يعيد استجابات الطعام المستساغة التي تم إطفاءها سابقًا (الضغط بالرافعة) في الفئران ، وهو تأثير يخفف من مضادات مستقبلات الكورتيوتروبين -1 (CRF-1) antalarmin (Ghitza et al. ، 2006 ). من المهم الإشارة إلى أن التأثيرات الدقيقة للضغط على استهلاك الغذاء لدى البشر وحيوانات المختبر تعتمد على طبيعة وحجم عامل الضغط ونوع الطعام المتاح للاستهلاك (مستساغ مقابل لطيف) ووزن الجسم والجنس (دالمان) ، 2010).
وقد انخفضت الفئران مع وصول موسعة إلى نظام غذائي عالي الدهون مستساغ للتعبير عن هرمون التوتر CRF في CEA (Teegarden و Bale ، 2007). وعلى العكس من ذلك ، فإن الفئران التي تجري "الانسحاب" من النظام الغذائي المستساغ قد زادت من تعبير CRF في الـ CeA (Teegarden و Bale ، 2007). هذا التأثير الأخير مشابه جدا لتعبير CRF المتزايد في CeA المكتشفة في الجرذان الخاضع للانسحاب من جميع الأدوية الرئيسية للإساءة (Koob، 2010). ولما كان من الممكن أن يؤدي المزيد من تعاطي المخدرات إلى إعادة هذه الاستجابة العصبية الباهظة إلى سحب الأدوية ، فقد تم الافتراض بأن انتقال CRF المفرط في الـ CeA والهياكل الحوفيّة الأخرى قد يسهل تطوير تعاطي المخدرات القهرية (Koob و Zorrilla و 2010). تمشيا مع هذا الرأي ، قضت الفئران التي تجري سحبها من الطعام الكثيف الطاقة المستساغ ، والتي كانت قد ارتفعت مستويات CRF في سي أي أيه ، وقتًا أطول بكثير في بيئة مكررة (مضيئة) للحصول على طعام مستساغ من الفئران دون تجربة سابقة للطعام ، حتى على الرغم من أن أقل مستساغا كانت متاحة في بيئة غير مضاءة (مظلمة مضاءة) (Teegarden و Bale ، 2007). ولذلك ، تصبح الفئران مقاومة للعواقب السلبية المحتملة لسلوكها في الطعام ، وتخاطر بالافتراس للحصول على طعام مستساغ حتى عندما يكون الطعام الأقل استساغة متاحًا في خطر أقل بكثير ، وذلك جزئياً لتخفيف انتقال CRF في الـ CeA (Teegarden and Bale، 2007). هناك عدة أدلة أخرى تدعم دورًا في انتقال CRF في الأكل القهري. على وجه الخصوص ، قامت دراسة حديثة بتقييم تأثيرات مضادات مستقبلات CRF-1 R121919 على استهلاك الغذاء في الجرذان التي تشهد تغيراً دوريًا في نظامهم الغذائي حيث يمكنهم الوصول إلى أيام 5 التجريبية القياسية في الأسبوع والدخول إلى نظام غذائي مستساغ للسكر 2 أيام لكل الأسبوع (Cottone et al.، 2009). بعد أسابيع 7 من هذا التغير الدوري في النظام الغذائي ، خفّض R121919 الاستهلاك المفرط للنظام الغذائي المستساغ للغاية وزيادة استهلاك الطعام الشهي (Cottone et al.، 2009). علاوة على ذلك ، تم زيادة مستويات تعبير CRF في الـ CeA في الجرذان المعاد تدويرها أثناء الانسحاب من النظام الغذائي المستساغ ، ولكنها عادت إلى مستويات خط الأساس بعد إعادة التعرض إلى النظام الغذائي المستساغ (Cottone et al.، 2009). وأخيرا ، تم تعزيز تنظيم CRF من انتقال GABAergic في سي أي إيه في الفئران المعاد تدويرها التي انسحبت من النظام الغذائي مستساغ مقارنة مع الفئران السيطرة التي كانت في السابق الوصول فقط إلى تشاو لطيف ، ينعكس في حقيقة أن R121919 تعطلت إمكانات GABAergic المثبطة بعد المشبكية أثار في شرائح CA من الفئران المعاد تدويرها في التركيز الذي لم يغير الانتقال في شرائح من جرذان التحكم (Cottone et al.، 2009). ومن المثير للاهتمام ، لوحظ تأثير مماثل من CRF على انتقال GABAergic في CEA أيضا في الفئران التي تمر بانسحاب من التعرض للإيثانول المزمن (روبرتو وآخرون ، 2010). وأخيرًا ، فإن CA ، نواة سطوح المحطة الطرفية (BNST) ، و NAc shell تشكل بنية متجاورة أكبر تسمى "اللوزة الموسعة". إن ضخ CRF في غلاف NAc في المواقع التي تحفز تناول الطعام من أجل المتعة يحسن من الباعثة التحفيزية للبيئة جديلة سبق أن تم إقرانها مع توافر طعام مستساغ (Peciña et al.، 2006a). وبالتالي ، فإن الإجهاد قد يزيد من أهمية الإشارات البيئية المقترنة بالأغذية من خلال تعديل نشاط الخلايا العصبية في NAc shell. مجتمعة ، تشير هذه النتائج إلى أن الاستهلاك المفرط للطعام أو المخدرات من تعاطي قد تحفز الاستجابات neuroadaptive مماثلة في مسارات الإجهاد extrahypothalamic في الدماغ ، والتي قد تسهم في السلوكيات consummatory القهري.
استنتاجات
لقد تم إحراز تقدم كبير مؤخرًا في تحديد أنظمة الدماغ التي تشارك في التأثيرات الممتعة للطعام المستساغ والتكيفات التي تحدث في هذه الدوائر استجابةً للاستهلاك المفرط للطعام وزيادة الوزن. من اللافت للنظر أن أنظمة الدماغ المماثلة والاستجابات التكيفية الشائعة يتم تشغيلها استجابةً لاستهلاك كل من الطعام المستساغ والعقاقير المسببة للإدمان. على وجه الخصوص ، يؤدي الاستهلاك المفرط للأطعمة أو الأدوية المستساغة إلى عجز مماثل في استجابة أنظمة المكافأة في الدماغ. يتسبب الطعام المستساغ والعقاقير المسببة للإدمان في حدوث عجز في انتقال الدوبامين القاتل والتعبير عن D2Rs القاتل. يتسبب الطعام المستساغ والعقاقير المسببة للإدمان أيضًا في ظهور سلوك إجباري يشبه القهري في القوارض ويشترك في استجابات الإجهاد خارج المهاد. أخيرًا ، قد تؤدي نقاط الضعف الوراثية الشائعة في أنظمة المكافآت الدماغية للأفراد إلى الإفراط في تناول الطعام والسمنة وكذلك تعاطي المخدرات والإدمان. في الواقع ، بناءً على أوجه التشابه هذه وغيرها بين السمنة وإدمان المخدرات ، فقد قيل إنه يجب إدراج السمنة كفئة تشخيصية في DSM-V القادم ([Devlin ، 2007] و [Volkow and O'Brien ، 2007] ). مع وضع ذلك في الاعتبار ، ستشمل المجالات الحاسمة للبحث في المستقبل مزيدًا من التحقيق في التداخلات العصبية الحيوية المحتملة بين الإفراط في تناول الطعام القهري وتعاطي المخدرات. على سبيل المثال ، سيكون من المهم اختبار ما إذا كانت السمنة مرتبطة بتطور السلوك الإجباري الشبيه بالعادة الناتج عن اللدونة في المخطط الظهري بنفس الطريقة التي قد يرتبط بها إدمان المخدرات بإعادة البناء المخطط وظهور البحث عن العقاقير الشبيهة بالعادة السلوكيات ([Everitt and Robbins، 2005]، [Hollander et al.، 2010] and [Kasanetz et al.، 2010]). أيضًا ، مناطق الدماغ القشرية المشاركة في التحكم التنفيذي واتخاذ القرار (على سبيل المثال ، قشرة الفص الجبهي) والمعالجة الداخلية (القشرة الجزرية) متورطة بشدة في إدمان المخدرات ([Everitt et al. ، 2008] ، [Fineberg et al. ، 2010 ] ، [Koob and Volkow ، 2010] و [Naqvi and Bechara ، 2009]) ، ومع ذلك لا يُعرف سوى القليل عن دورها الدقيق في الأكل القهري والسمنة ، على سبيل المثال ، ([Nair et al. ، 2011] و [Volkow et al. ، 2009]). مجتمعة ، تدعم البيانات التي تمت مراجعتها أعلاه فكرة أن السمنة وإدمان المخدرات قد ينشأان من استجابات تكيفية عصبية مماثلة في دوائر المكافأة الدماغية ، وتشير إلى أن الآليات المعروفة للإدمان قد توفر إطارًا إرشاديًا لفهم السمنة.
شكر وتقدير
ويدعم المؤلف من المنح المقدمة من المعهد الوطني لتعاطي المخدرات (NIDA). المؤلف ممتن لبولسون جونسون وكريستي فاولر لأفكار وتعليقات قيمة على المخطوطة. هذا هو رقم مخطوط 21042 من معهد أبحاث سكريبس.
مراجع حسابات
1.
o Abizaid et al.، 2006a
أ. أبي زيد ، ج. غاو ، تل هورفاث
o أفكار للطعام: آليات الدماغ وتوازن الطاقة المحيطية
o Neuron، 51 (2006)، pp. 691 – 702
o
2.
o Abizaid et al.، 2006b
o A. Abizaid، ZW Liu، ZB Andrews، M. Shanabrough، E. Borok، JD Elsworth، RH Roth، MW Sleeman، MR Picciotto، MH Tschöp et al.
o يقوم Ghrelin بتنظيم النشاط وتنظيم المدخلات متشابك من الخلايا العصبية الدوبامين الدماغ المتوسط في حين تشجيع الشهية
يا J. كلين. Invest.، 116 (2006)، pp. 3229 – 3239
o
3.
o أحمد وكوب ، 1998
o SH Ahmed، GF Koob
o الانتقال من تناول الدواء المعتدل إلى المفرط: التغيير في نقطة ضبط hedonic
o Science، 282 (1998)، pp. 298 – 300
o
4.
o أحمد وكوب ، 2005
o SH Ahmed، GF Koob
o الانتقال إلى إدمان المخدرات: نموذج تقويمي سلبي قائم على نقص في التثبيط في وظيفة المكافأة
o Psychopharmacology (Berl.)، 180 (2005)، pp. 473 – 490
o
5.
o أحمد وآخرون ، 2002
o SH Ahmed، PJ Kenny، GF Koob، A. Markou
o دليل بيولوجي بيولوجي للأبروستيد المتلازم المصاحب لتعاطي الكوكايين المتصاعد
يا نات. Neurosci.، 5 (2002)، pp. 625 – 626
o
6.
o أليسون وآخرون ، 1999
o DB Allison، KR Fontaine، JE Manson، J. Stevens، TB VanItallie
o الوفيات السنوية التي تعزى إلى السمنة في الولايات المتحدة
o JAMA، 282 (1999)، pp. 1530 – 1538
o
7.
o جمعية الطب النفسي الأمريكية ، 1994
جمعية الطب النفسي الأمريكية
الدليل التشخيصي والإحصائي للاضطرابات العقلية
o (الطبعة الرابعة) الجمعية الأمريكية للطب النفسي ، واشنطن العاصمة (1994)
o
8.
o Angeles-Castellanos et al.، 2007
o M. Angeles-Castellanos، J. Mendoza، C. Escobar
o جداول الإطعام المقيدة طور التحول اليومي للإيقاعات اليومية لـ c-Fos والبروتينات Per1 في المناطق القشرية في الفئران.
o Neuroscience، 144 (2007)، pp. 344 – 355
o
9.
o Baicy وآخرون ، 2007
o K. Baicy، ED London، J. Monterosso، ML Wong، T. Delibasi، A. Sharma، J. Licinio
o استبدال اللبتين يغير استجابة الدماغ لمنبهات الغذاء في البالغين الذين يعانون من نقص في لبتين وراثيا
س بروك. NATL. أكاد. الخيال العلمي. USA، 104 (2007)، pp. 18276 – 18279
o
10
o Baldo et al.، 2004
o BA Baldo، L. Gual-Bonilla، K. Sijapati، RA Daniel، CF Landry، AE Kelley
o تنشيط مجموعة فرعية من الخلايا العصبية التي تحتوى على أويكسين / ناقلة hypocretin بواسطة تثبيط مستقبل GABAA لنواة متكئة النواة ، ولكن ليس بالتعرض لبيئة جديدة
يورو. J. Neurosci.، 19 (2004)، pp. 376 – 386
o
11
o Balleine و Dickinson، 2000
o BW Balleine، A. Dickinson
o تأثير آفات القشرة المعزولة على تكييف الأدوات: دليل على دور في الذاكرة الحافزة
o J. Neurosci.، 20 (2000)، pp. 8954 – 8964
o
12
o Barnard et al.، 2009
o ND Barnard، EP Noble، T. Ritchie، J. Cohen، DJ Jenkins، G. Turner-McGrievy، L. Gloede، AA Green، H. Ferdowsian
س D2 مستقبلات الدوبامين Taq1A تعدد الأشكال ، ووزن الجسم ، والمقدار الغذائي في نوع مرض السكري 2
o Nutrition، 25 (2009)، pp. 58 – 65
o
13
o باسو وكيلي ، 1999
يا باسو ، إيه كيلي
o التغذية الناتجة عن تحفيز مستقبلات GABA (A) داخل قشرة النواة المتكئة: التخطيط الإقليمي وتوصيف تفضيل المغذيات الكبيرة وتفضيل الذوق
يا بيهاف. Neurosci.، 113 (1999)، pp. 324 – 336
o
14
س Batterham وآخرون ، 2007
o RL Batterham، DH ffytche، JM Rosenthal، FO Zelaya، GJ Barker، DJ Withers، SC Williams
o PYY تعديل من مناطق الدماغ القشرية والوطنية يتنبأ السلوك التغذية في البشر
o Nature، 450 (2007)، pp. 106 – 109
o
15
o باكستر وموراي ، 2002
o MG Baxter، EA Murray
يا اللوزة والمكافأة
يا نات. Rev. Neurosci.، 3 (2002)، pp. 563 – 573
o
16
o Bean et al.، 2008
o MK Bean، K. Stewart، ME Olbrisch
o السمنة في أمريكا: الآثار المترتبة على علماء النفس السريري والصحة
يا J. كلين. Psychol. ميد. Settings، 15 (2008)، pp. 214 – 224
o
17
o بيفر وآخرون ، 2006
o JD Beaver، AD Lawrence، J. van Ditzhuijzen، MH Davis، A. Woods، AJ Calder
o الفروق الفردية في مكافأة المكافأة تتنبأ بالاستجابات العصبية لصور الطعام
o J. Neurosci.، 26 (2006)، pp. 5160 – 5166
o
18
o Belin et al.، 2008
o D. Belin، AC Mar، JW Dalley، TW Robbins، BJ Everitt
o الاندفاع العالي يتنبأ بالتبديل إلى تعاطي الكوكايين القهري
o Science، 320 (2008)، pp. 1352 – 1355
o
19
o Berridge ، 1996
o KC Berridge
o مكافأة الطعام: ركائز الدماغ من الرغبة وتروق
يا neurosci. Biobehav. Rev.، 20 (1996)، pp. 1 – 25
o
20
o Berridge ، 2009
o KC Berridge
o "الإعجاب" و "الرغبة" في المكافآت الغذائية: ركائز الدماغ وأدواره في اضطرابات الأكل
يا فسيولوج. Behav.، 97 (2009)، pp. 537 – 550
o
21
o Björntorp و Rosmond ، 2000
o P. Björntorp، R. Rosmond
السمنة والكورتيزول
o Nutrition، 16 (2000)، pp. 924 – 936
o
22
o Blundell and Herberg، 1968
o JE Blundell، LJ Herberg
o الآثار النسبية للعجز الغذائي وفترة الحرمان على معدل التحفيز الذاتي الكهربائي للهايب الوحشي
o Nature، 219 (1968)، pp. 627 – 628
o
23
o Booth et al.، 2008
o ML Booth، RL Wilkenfeld، DL Pagnini، SL Booth، LA King
o تصورات المراهقين حول زيادة الوزن والبدانة: وزن دراسة الرأي
يا J. Paediatr. Child Health، 44 (2008)، pp. 248 – 252
o
24
o Bragulat et al.، 2010
o V. Bragulat، M. Dzemidzic، C. Bruno، CA Cox، T. Talavage، RV Considine، DA Kareken
تحقيقات حول الروائح المتعلقة بالأغذية في دارات مكافأة الدماغ أثناء الجوع: دراسة تجريبية لأشعة الرنين المغناطيسي الوظيفي
o السمنة ، Silver Spring ، MD (2010)
o
25
o Cabanac and Johnson، 1983
o M. Cabanac، KG Johnson
o تحليل التضارب بين الاستساغة والتعرض للبرودة في الجرذان
يا فسيولوج. Behav.، 31 (1983)، pp. 249 – 253
o
26
o Campfield et al.، 1995
o LA Campfield، FJ Smith، Y. Guisez، R. Devos، P. Burn
o البروتين المؤتلف الماوس OB: دليل لإشارة محيطية تربط السمنة والشبكات العصبية المركزية
o Science، 269 (1995)، pp. 546 – 549
o
27
o المدفع والميتير ، 2003
o CM Cannon، RD Palmiter
o مكافأة بدون الدوبامين
o J. Neurosci.، 23 (2003)، pp. 10827 – 10831
o
28
يا كار وسيمون ، 1984
o د. كار كار ، إي جيه سايمون
o تقوية المكافأة عن طريق الجوع هو مادة أفيونية بوساطة
o Brain Res.، 297 (1984)، pp. 369 – 373
o
29
o مراكز مكافحة الأمراض والوقاية منها ، 2009
o مراكز مكافحة الأمراض والوقاية منها (2009). الولايات المتحدة اتجاهات السمنة (أتلانتا: مراكز السيطرة على الأمراض والوقاية منها).
o
30
o Colantuoni et al.، 2001
o C. Colantuoni، J. Schwenker، J. McCarthy، P. Rada، B. Ladenheim، JL Cadet، GJ Schwartz، TH Moran، BG Hoebel
o مدخول السكر المفرط يغير الارتباط بمستقبلات الدوبامين ومو-آيو-آيويد في الدماغ
o Neuroreport، 12 (2001)، pp. 3549 – 3552
o
31
o Cornelius et al.، 2010
o JR Cornelius، M. Tippmann-Peikert، NL Slocumb، CF Frerichs، MH Silber
o اضطرابات السيطرة على الاندفاع مع استخدام عوامل الدوبامين في متلازمة تململ الساقين: دراسة الحالات والشواهد
o Sleep، 33 (2010)، pp. 81 – 87
o
32
o Cornier et al.، 2009
o MA Cornier، AK Salzberg، DC Endly، DH Bessesen، DC Rojas، JR Tregellas
o آثار الإفراط في التغذية على الاستجابة العصبية لمنبهات الغذاء المرئية لدى الأفراد الذين يعانون من السمنة المفرطة
o PLoS ONE، 4 (2009)، p. e6310 http://dx.doi.org/10.1371/journal.pone.0006310
o
33
o Cottone et al.، 2009
o P. Cottone، V. Sabino، M. Roberto، M. Bajo، L. Pockros، JB Frihauf، EM Fekete، L. Steardo، KC Rice، DE Grigoriadis et al.
o يتوسط توظيف نظام CRF الجانب المظلم من الأكل القهري
س بروك. NATL. أكاد. الخيال العلمي. USA، 106 (2009)، pp. 20016 – 20020
o
34
يا داغر ، 2009
يا. داغر
o علم الأعصاب الشهية: الجوع كإدمان
يا Int. ج. (Lond.)، 33 (Suppl 2) (2009)، pp. S30 – S33
o
35
o داغر وروبنز ، 2009
o A. Dagher، TW Robbins
o الشخصية ، والإدمان ، والدوبامين: رؤى من مرض باركنسون
o Neuron، 61 (2009)، pp. 502 – 510
o
36
يا دالمان ، 2010
س MF Dallman
س السمنة الناجمة عن الإجهاد والجهاز العصبي العاطفي
اتجاهات الغدد الصماء. Metab.، 21 (2010)، pp. 159 – 165
o
37
يا دالمان وآخرون ، 2003
o MF Dallman، N. Pecoraro، SF Akana، SE La Fleur، F. Gomez، H. Houshyar، ME Bell، S. Bhatnagar، KD Laugero، S. Manalo
o الإجهاد المزمن والسمنة: رؤية جديدة لـ "طعام الراحة"
س بروك. NATL. أكاد. الخيال العلمي. USA، 100 (2003)، pp. 11696 – 11701
o
38
يا دالمان وآخرون ، 2006
o MF Dallman، NC Pecoraro، SE La Fleur، JP Warne، AB Ginsberg، SF Akana، KC Laugero، H. Houshyar، AM Strack، S. Bhatnagar، ME Bell
س Glucocorticoids ، والإجهاد المزمن ، والسمنة
يا بروغ. Brain Res.، 153 (2006)، pp. 75 – 105
o
39
o Davis وآخرون ، 2004
o C. Davis، S. Strachan، M. Berkson
o الحساسية للمكافأة: الآثار المترتبة على الإفراط في تناول الطعام وزيادة الوزن
o Appetite، 42 (2004)، pp. 131 – 138
o
40
o Davis وآخرون ، 2008
o JF Davis، AL Tracy، JD Schurdak، MH Tschöp، JW Lipton، DJ Clegg، SC Benoit
o التعرض لمستويات مرتفعة من الدهون الغذائية يخفف من المكافأة الذهانية والدوران الوسطي للدوبامين في الجرذان.
يا بيهاف. Neurosci.، 122 (2008)، pp. 1257 – 1263
o
41
o de Araujo et al.، 2010
o IE de Araujo، X. Ren، JG Ferreira
o الاستشعار الأيضي في أنظمة الدوبامين في الدماغ
س النتائج Probl. Cell Differ.، 52 (2010)، pp. 69 – 86
o
42
o Delin et al.، 1997
o CR Delin، JM Watts، JL Saebel، PG Anderson
o سلوك الأكل وتجربة الجوع بعد جراحة لتغيير شرايين المعدة للسمنة المرضية
يا سمنة. Surg.، 7 (1997)، pp. 405 – 413
o
43
o Deroche-Gamonet et al.، 2004
o V. Deroche-Gamonet، D. Belin، PV Piazza
Ev دليل على السلوك الشبيه بالإدمان في الجرذان
o Science، 305 (2004)، pp. 1014 – 1017
o
44
o Devlin ، 2007
يا MJ Devlin
o هل يوجد مكان للبدانة في DSM-V؟
يا Int. ج. Disord.، 40 (Suppl) (2007)، pp. S83 – S88
o
45
o Doknic et al.، 2002
o M. Doknic، S. Pekic، M. Zarkovic، M. Medic-Stojanoska، C. Dieguez، F. Casanueva، V. Popovic
o لهجة الدوبامين والسمنة: نظرة من البرولاكتينوما المعالجة بالبروموكريبتين
يورو. J. Endocrinol.، 147 (2002)، pp. 77 – 84
o
46
o Everitt و Robbins، 2005
o BJ Everitt، TW Robbins
o الأنظمة العصبية للتعزيز من أجل إدمان المخدرات: من الأفعال إلى العادات إلى الإكراه
يا نات. Neurosci.، 8 (2005)، pp. 1481 – 1489
o
47
o Everitt et al.، 2008
o BJ Everitt، D. Belin، D. Economidou، Y. Pelloux، JW Dalley، TW Robbins
مراجعة. الآليات العصبية الكامنة وراء ضعف لتطوير العادات القهرية تسعى المخدرات والإدمان
يا فيلوس. عبر. ر. وند. ب بيول. Sci.، 363 (2008)، pp. 3125 – 3135
o
48
o فاروقي وآخرون ، 2007
o IS Farooqi، E. Bullmore، J. Keogh، J. Gillard، S. O'Rahilly، PC Fletcher
o ينظم الليبتين المناطق المخطط لها وسلوك تناول الطعام البشري
o Science، 317 (2007)، p. 1355
o
49
o Felsted وآخرون ، 2010
o JA Felsted، X. Ren، F. Chouinard-Decorte، DM Small
o الاختلافات المحددة وراثيا في استجابة الدماغ لمكافأة الطعام الأولية
o J. Neurosci.، 30 (2010)، pp. 2428 – 2432
o
50
o Figlewicz et al.، 2001
o DP Figlewicz، MS Higgins، SB Ng-Evans، PJ Havel
o يعكس Leptin تفضيل مكان السكروز الموصى به في الجرذان المقيدة بالغذاء
يا فسيولوج. Behav.، 73 (2001)، pp. 229 – 234
o
51
o Figlewicz et al.، 2003
o DP Figlewicz، SB Evans، J. Murphy، M. Hoen، DG Baskin
o التعبير عن مستقبلات الأنسولين واللبتين في المنطقة القطبية البطنية / المادة السوداء (VTA / SN) للفئران.
o Brain Res.، 964 (2003)، pp. 107 – 115
o
52
o Fineberg et al.، 2010
o NA Fineberg، MN Potenza، SR Chamberlain، HA Berlin، L. Menzies، A. Bechara، BJ Sahakian، TW Robbins، ET Bullmore، E. Hollander
سسبر السلوكيات القهرية والاندفاعية ، من النماذج الحيوانية إلى نماذج endophenotypes: مراجعة سردية
o Neuropsychopharmacology، 35 (2010)، pp. 591 – 604
o
53
o Finkelstein et al.، 2005
o EA Finkelstein، CJ Ruhm، KM Kosa
o الأسباب والنتائج الاقتصادية للسمنة
يا آنو. Rev. Public Health، 26 (2005)، pp. 239 – 257
o
54
o Flegal et al.، 2010
o KM Flegal، MD Carroll، CL Ogden، LR Curtin
o انتشار واتجاهات السمنة بين البالغين في الولايات المتحدة ، 1999-2008
o JAMA، 303 (2010)، pp. 235 – 241
o
55
o Foo and Mason، 2005
o H. Foo، P. Mason
س قمع الحسي أثناء التغذية
س بروك. NATL. أكاد. الخيال العلمي. USA، 102 (2005)، pp. 16865 – 16869
o
56
o Franken and Muris، 2005
o IH Franken، P. Muris
o ترتبط الفروق الفردية في حساسية المكافأة بشغف الطعام ووزن الجسم النسبي لدى النساء الأصحاء
o Appetite، 45 (2005)، pp. 198 – 201
o
57
o فريدمان وآخرون ، 2011
o A. Friedman، E. Lax، Y. Dikshtein، L. Abraham، Y. Flaumenhaft، E. Sudai، M. Ben-Tzion، G. Yadid
التحفيز الكهربائي للحنجرة الجانبية ينتج تأثيرا مثبطا على الإدارة الذاتية للسكروز
o علم الأعصاب ، 60 (2011) ، الصفحات. 381 – 387
o
58
o Fulton et al.، 2000
o S. Fulton، B. Woodside، P. Shizgal
o تعديل دارة الثواب في الدماغ عن طريق الليبتين
o Science، 287 (2000)، pp. 125 – 128
o
59
o Fulton et al.، 2006
o S. Fulton، P. Pissios، RP Manchon، L. Stiles، L. Frank، EN Pothos، E. Maratos-Flier، JS Flier
o تنظيم الليبتين لمسار الدوبامين المسلفن
o Neuron، 51 (2006)، pp. 811 – 822
o
60
o Gao و Horvath و 2007
o Q. Gao، TL Horvath
o علم الأعصاب من التغذية ونفقات الطاقة
يا آنو. Rev. Neurosci.، 30 (2007)، pp. 367 – 398
o
61
o Gautier et al.، 2000
o JF Gautier، K. Chen، AD Salbe، D. Bandy، RE Pratley، M. Heiman، E. Ravussin، EM Reiman، PA Tataranni
o استجابات الدماغ التفاضلية للإشباع لدى البدناء والرجال العجاف
o Diabetes، 49 (2000)، pp. 838 – 846
o
62
o Geiger et al.، 2008
o BM Geiger، GG Behr، LE Frank، AD Caldera-Siu، MC Beinfeld، EG Kokkotou، EN Pothos
دليل على وجود عيوب الدوبامين الضيقة في الميزان في الجرذان المعرضة للسمنة
o FASEB J.، 22 (2008)، pp. 2740 – 2746
o
63
o Geiger et al.، 2009
o BM Geiger، M. Haburcak، NM Avena، MC Moyer، BG Hoebel، EN Pothos
o عجز الناقل العصبي الدوبامين الميزوبيمبي في السمنة الغذائية للفئران
o Neuroscience، 159 (2009)، pp. 1193 – 1199
o
64
o Ghitza et al.، 2006
o UE Ghitza، SM Gray، DH Epstein، KC Rice، Y. Shaham
o علم الأعصاب النفسية
o يعيد يوهمبين المخدرات المضادة للتأكسج الغذاء المستساغ الذي يسعى في نموذج الانتكاس الفئران: دور مستقبلات CRF (1) ، 33 (2006) ، الصفحات. 2188 – 2196
o
65
o Gluck et al.، 2004
o ME Gluck، A. Geliebter، J. Hung، E. Yahav
o الكورتيزول والجوع والرغبة في الإفراط في تناول الطعام بعد اختبار الإجهاد البارد لدى النساء البدينات مع اضطراب الأكل بنهم
يا Psychosom. Med.، 66 (2004)، pp. 876 – 881
o
66
o غولدستون وآخرون ، 2009
o AP Goldstone، CG Prechtl de Hernandez، JD Beaver، K. Muhammed، C. Croese، G. Bell، G. Durighel، E. Hughes، AD Waldman، G. Frost، JD Bell
o الصيام يتحيز أنظمة المكافأة الدماغية نحو الأطعمة ذات السعرات الحرارية العالية
يورو. J. Neurosci.، 30 (2009)، pp. 1625 – 1635
o
67
o Halaas et al.، 1995
o JL Halaas، KS Gajiwala، M. Maffei، SL Cohen، BT Chait، D. Rabinowitz، RL Lallone، SK Burley، JM Friedman
تأثيرات خفض الوزن لبروتينات البلازما المشفرة بواسطة الجين البدين
o Science، 269 (1995)، pp. 543 – 546
o
68
o Hamilton et al.، 1995
o BS Hamilton، D. Paglia، AY Kwan، M. Deitel
زيادة تعبير مرنا البدينة في الخلايا الدهنية الوهمية من البشر يعانون من السمنة المفرطة
يا نات. Med.، 1 (1995)، pp. 953 – 956
o
69
o Hernandez و Hoebel ، 1988
o L. Hernandez، BG Hoebel
o مكافأ الطعام والكوكايين يزيدان الدوبامين خارج الخلوي في النواة المتكئة كما يقاس بواسطة التحليل الصغري
o Life Sci.، 42 (1988)، pp. 1705 – 1712
o
70
o Hill et al.، 2003
o JO Hill، HR Wyatt، GW Reed، JC Peters
السمنة والبيئة: أين نذهب من هنا؟
o Science، 299 (2003)، pp. 853 – 855
o
71
o Hoebel ، 1969
o BG Hoebel
o التغذية والتحفيز الذاتي
يا آن. نيويورك أكاد. Sci.، 157 (1969)، pp. 758 – 778
o
72
o Hoebel and Balagura، 1967
o BG Hoebel، S. Balagura
o التحفيز الذاتي للهايبتالالس الوحشي المعدل بواسطة الأنسولين والجلوكاجون
يا فسيولوج. Behav.، 2 (1967)، pp. 337 – 340
o
73
o Hoebel و Teitelbaum ، 1962
o BG Hoebel، P. Teitelbaum
o التحكم الطناني في التغذية والتحفيز الذاتي
o Science، 135 (1962)، pp. 375 – 377
o
74
o Hoebel و Thompson، 1969
o BG Hoebel، RD Thompson
o النفور من التحفيز الموضعي الجانبي الناتج عن التغذية داخل المعدة أو السمنة
يا J. شركات. الفيزيولوجيا. Psychol.، 68 (1969)، pp. 536 – 543
o
75
o Hofmann et al.، 2010
o W. Hofmann، GM van Koningsbruggen، W. Stroebe، S. Ramanathan، H. Aarts
o كما تتكشف المتعة: استجابات مفعمة بالحيوية للغذاء المغري
يا سيكول. Sci.، 21 (2010)، pp. 1863 – 1870
o
76
o هولندا و Gallagher ، 2004
o PC Holland، M. Gallagher
o تفاعلات اللوزة الجبهية ومكافأة التوقع
يا كور. أوبان. Neurobiol.، 14 (2004)، pp. 148 – 155
o
77
o هولاندر وآخرون ، 2010
o JA Hollander، HI Im، AL Amelio، J. Kocerha، P. Bali، Q. Lu، D. Willoughby، C. Wahlestedt، MD Conkright، PJ Kenny
س microRNA striatal يتحكم في كمية الكوكايين من خلال إشارات CREB
o Nature، 466 (2010)، pp. 197 – 202
o
78
o هوميل وآخرون ، 2006
o JD Hommel، R. Trinko، RM Sears، D. Georgescu، ZW Liu، XB Gao، JJ Thurmon، M. Marinelli، RJ DiLeone
س التشعب مستقبلات Leptin في الخلايا العصبية الدوبامين الدماغ المتوسط ينظم التغذية
o Neuron، 51 (2006)، pp. 801 – 810
o
79
o Imaizumi وآخرون ، 2001
o M. Imaizumi، M. Takeda، A. Suzuki، S. Sawano، T. Fushiki
o تفضيل الأغذية الغنية بالدهون في الفئران: البطاطا المقلية مقارنة بالبطاطا المسلوقة
o Appetite، 36 (2001)، pp. 237 – 238
o
80
o Jerlhag وآخرون ، 2006
o E. Jerlhag، E. Egecioglu، SL Dickson، M. Andersson، L. Svensson، JA Engel
o يحفز الغريلين النشاط الحركي وتراكم الدوبامين عبر النظم الكولينية المركزية في الفئران: الآثار المترتبة على مشاركته في مكافأة الدماغ
o مدمن. Biol.، 11 (2006)، pp. 45 – 54
o
81
o Jerlhag وآخرون ، 2007
o E. Jerlhag، E. Egecioglu، SL Dickson، A. Douhan، L. Svensson، JA Engel
· إعطاء الجريلين إلى المناطق الجزئية يحفز النشاط الحركي ويزيد من تركيز الدوبامين خارج الخلايا في النواة المتكئة
o مدمن. Biol.، 12 (2007)، pp. 6 – 16
o
82
o Jhou et al.، 2009
o TC Jhou، HL Fields، MG Baxter، CB Saper، PC Holland
o نواة tegmental rostromedial (RMTg) ، وارد GABAergic إلى الخلايا العصبية الدوبامين الدماغ المتوسط ، يشفر المنبهات مكره ويثبط ردود الفعل الحركية
o Neuron، 61 (2009)، pp. 786 – 800
o
83
o Johnson and Kenny، 2010
س جونسون ، PJ كيني
مستقبلات الدوبامين D2 في ضعف المكافأة مثل الإدمان والأكل القهري في الجرذان البدينين
يا نات. Neurosci.، 13 (2010)، pp. 635 – 641
o
84
o Johnson et al.، 1996
o PI Johnson، MA Parente، JR Stellar
o الآفات الناجمة عن NMDA للنواة المتكئة أو الشفافة البطنية تزيد من نجاعة الطعام المجزية للفئران المحرومة
o Brain Res.، 722 (1996)، pp. 109 – 117
o
85
o Jönsson et al.، 1999
o EG Jönsson، MM Nöthen، F. Grünhage، L. Farde، Y. Nakashima، P. Propping، GC Sedvall
o تعدد الأشكال في جين مستقبلات الدوبامين D2 وعلاقاتها بكثافة مستقبلات الدوبامين المخطط لها للمتطوعين الأصحاء
يا مول. Psychiatry، 4 (1999)، pp. 290 – 296
o
86
o Kalarchian et al.، 2002
o MA Kalarchian، MD Marcus، GT Wilson، EW Labouvie، RE Brolin، LB LaMarca
س الأكل بنهم بين المرضى تجاوز المعدة في المتابعة على المدى الطويل
يا سمنة. Surg.، 12 (2002)، pp. 270 – 275
o
87
o كانديا وآخرين ، 2006
o J. Kandiah، M. Yake، J. Jones، M. Meyer
يؤثر الإجهاد على الشهية وتفضيلات الطعام المريحة في كلية البنات
يا نوتر. Res.، 26 (2006)، pp. 118 – 123
o
88
o Karhunen et al.، 1997
o LJ Karhunen، RI Lappalainen، EJ Vanninen، JT Kuikka، MI Uusitupa
o تدفق الدم الدماغي الإقليمي أثناء التعرض الغذائي عند النساء البدينات والوزن الطبيعي
o Brain، 120 (1997)، pp. 1675 – 1684
o
89
o Kasanetz et al.، 2010
o F. Kasanetz، V. Deroche-Gamonet، N. Berson، E. Balado، M. Lafourcade، O. Manzoni، PV Piazza
o يرتبط الانتقال إلى الإدمان بانخفاض مستمر في اللدونة المشبكية
o Science، 328 (2010)، pp. 1709 – 1712
o
90
o كيلي وآخرون ، 1996
o AE Kelley، EP Bless، CJ Swanson
o دراسة تأثيرات مضادات الأفيون التي تم دمجها في النواة المتكئة على التغذية وشرب السكروز في الجرذان.
يا J. Pharmacol. إكسب. Ther.، 278 (1996)، pp. 1499 – 1507
o
91
o كيلي وآخرون ، 2005
o AE Kelley، BA Baldo، WE Pratt، MJ Will
o داء كورتيكوسترياتال-ما تحت المهاد والدافع الغذائي: تكامل الطاقة والعمل والمكافأة
يا فسيولوج. Behav.، 86 (2005)، pp. 773 – 795
o
92
o كيني وآخرون ، 2006
o PJ Kenny، SA Chen، O. Kitamura، A. Markou، GF Koob
س الانسحاب مشروط يدفع استهلاك الهيروين ويقلل من حساسية مكافأة
o J. Neurosci.، 26 (2006)، pp. 5894 – 5900
o
93
o كيم وآخرون ، 2010
o KS Kim، YR Yoon، HJ Lee، S. Yoon، SY Kim، SW Shin، JJ An، MS Kim، SY Choi، W. Sun، JH Baik
o تعزيز الإشارات الليبتين المناعية في الفئران التي تفتقر إلى مستقبلات الدوبامين D2
يا J. بيول. Chem.، 285 (2010)، pp. 8905 – 8917
o
94
o Klein et al.، 2007
o TA Klein، J. Neumann، M. Reuter، J. Hennig، DY von Cramon، M. Ullsperger
o الاختلافات المحددة وراثيا في التعلم من الأخطاء
o Science، 318 (2007)، pp. 1642 – 1645
o
95
o كوجيما وآخرون ، 1999
o M. Kojima، H. Hosoda، Y. Date، M. Nakazato، H. Matsuo، K. Kangawa
o Ghrelin عبارة عن ببتيد مكتمل النمو من هرمون النمو من المعدة
o Nature، 402 (1999)، pp. 656 – 660
o
96
o كوك وآخرون ، 2006
o P. Kok، F. Roelfsema، M. Frölich، J. van Pelt، AE Meinders، H. Pijl
o تفعيل مستقبلات الدوبامين D2 يخفض تراكيز اللبتين اليومي عند النساء البدينات
يا J. كلين. Endocrinol. Metab.، 91 (2006)، pp. 3236 – 3240
o
97
o Koob ، 2010
o GF Koob
o دور CRF والببتيدات ذات الصلة CRF في الجانب المظلم من الإدمان
o Brain Res.، 1314 (2010)، pp. 3 – 14
o
98
o Koob و Le Moal، 2008
o GF Koob، M. Le Moal
o الإدمان ونظام الدماغ المضطرب
يا آنو. Rev. Psychol.، 59 (2008)، pp. 29 – 53
o
99
o Koob و Volkow ، 2010
o GF Koob، ND Volkow
o أطباء عصبيون من الإدمان
o Neuropsychopharmacology، 35 (2010)، pp. 217 – 238
o
100
o Koob و Zorrilla و 2010
o GF Koob، EP Zorrilla
o الآليات العصبية الحيوية للإدمان: التركيز على عامل إطلاق الكورتيكوتروبين
يا كور. أوبان. Investig. Drugs، 11 (2010)، pp. 63 – 71
o
101
o Kringelbach et al.، 2003
o ML Kringelbach ، J. O'Doherty ، ET Rolls ، C. Andrews
o ترتبط عملية تنشيط القشرة الدماغية المرافقة للإنسان بحافز غذائي سائل بسعادته الذاتية
يا سيريب. Cortex، 13 (2003)، pp. 1064 – 1071
o
102
o Krügel et al.، 2003
o U. Krügel، T. Schraft، H. Kittner، W. Kiess، P. Illes
o يتم إفراز إفراز الدوبامين المستحث بإطعامه القاعدي في النواة المتكئة للفئران بواسطة اللبتين.
يورو. J. Pharmacol.، 482 (2003)، pp. 185 – 187
o
103
يا لا فلور ، 2006
يا سي لا فلور
تأثيرات الجلوكوكورتيكويد على سلوك التغذية في الجرذان
يا فسيولوج. Behav.، 89 (2006)، pp. 110 – 114
o
104
يا لابار وآخرون ، 2001
o KS LaBar، DR Gitelman، TB Parrish، YH Kim، AC Nobre، MM Mesulam
o يقوم الجوع بشكل انتقائي بتنظيم تنشيط corticolimbic للمحفزات الغذائية عند البشر
يا بيهاف. Neurosci.، 115 (2001)، pp. 493 – 500
o
105
o Latagliata وآخرون ، 2010
o EC Latagliata، E. Patrono، S. Puglisi-Allegra، R. Ventura
س الغذاء تسعى على الرغم من عواقب ضارة تحت سيطرة نورادريني القشرية قبل الجبهية
o BMC Neurosci.، 11 (2010)، p. 15
o
106
o Lawford وآخرون ، 2000
o BR Lawford، RM Young، EP Noble، J. Sargent، J. Rowell، S. Shadforth، X. Zhang، T. Ritchie
o مستقبل الدوبامين D (2) الدوبامين A (1) وأليل الاعتماد على الأفيون: الارتباط مع استخدام الهيروين والاستجابة للعلاج بالميثادون
يا صباحا. جى ميد Genet.، 96 (2000)، pp. 592 – 598
o
107
o Leinninger et al.، 2009
o GM Leinninger، YH Jo، RL Leshan، GW Louis، H. Yang، JG Barrera، H. Wilson، DM Opland، MA Faouzi، Y. Gong et al.
o يعمل الليبتين عبر مستقبلات الليبتين معربا عن الخلايا العصبية المهادية الجانبية لتحوير نظام الدوبامين الليمفاوي وقمع التغذية.
o Cell Metab.، 10 (2009)، pp. 89 – 98
o
108
o Lenoir et al.، 2007
o Lenoir، F. Serre، L. Cantin، SH Ahmed
o حلاوة مكثفة تفوق المكافأة الكوكايين
o PLoS ONE، 2 (2007)، p. e698 http://dx.doi.org/10.1371/journal.pone.0000698
o
109
o Leshan et al.، 2010
o RL Leshan، DM Opland، GW Louis، GM Leinninger، CM Patterson، CJ Rhodes، H. Münzberg، MG Myers Jr.
o المنطقة البطنية tegmental neptin neurons neurons neurons بالتحديد تعمل على تنظيم وتنظيم الخلايا العصبية المنقولة من الكوكايين والأمفيتامين من اللوزة الوسطى الممتدة.
o J. Neurosci.، 30 (2010)، pp. 5713 – 5723
o
110
o Louis et al.، 2010
o GW Louis، GM Leinninger، CJ Rhodes، MG Myers Jr.
o التعصيب المباشر وتعديل الخلايا العصبية orexin عن طريق الخلايا العصبية LepRb المهاد الجانبي
o J. Neurosci.، 30 (2010)، pp. 11278 – 11287
o
111
o Luppino et al.، 2010
o FS Luppino، LM de Wit، PF Bouvy، T. Stijnen، P. Cuijpers، BW Penninx، FG Zitman
o زيادة الوزن والسمنة والاكتئاب: مراجعة منهجية وتحليل تلوي للدراسات الطولية
يا القوس. Gen. Psychiatry، 67 (2010)، pp. 220 – 229
o
112
o Lutter و Nestler ، 2009
o م. لوتير ، إي
o تتفاعل إشارات التوحيد والاستبداد في تنظيم استهلاك الغذاء
o J. Nutr.، 139 (2009)، pp. 629 – 632
o
113
o Macht و Mueller ، 2007
o M. Macht، J. Mueller
o الآثار الفورية للشوكولاته على حالات المزاج المستحث تجريبيا
o Appetite، 49 (2007)، pp. 667 – 674
o
114
o مالدونادو-إيريزاري وكلي ، 1995
o CS Maldonado-Irizarry، AE Kelley
o آفات انتقامية في مناطق القلب والأقسام الفرعية للنواة المتكئة تفسد بشكل تفاضلي تنظيم وزن الجسم والنشاط الحركي في الفئران.
يا الدماغ الدقة. Bull.، 38 (1995)، pp. 551 – 559
o
115
o مالدونادو - إريزاري وآخرون ، 1995
o CS Maldonado-Irizarry، CJ Swanson، AE Kelley
o مستقبلات ال Glلوتامات في النواة المتكئة تتحكم في سلوك التغذية عبر المهاد الجانبي
o J. Neurosci.، 15 (1995)، pp. 6779 – 6788
o
116
o مالك وآخرون ، 2008
o S. Malik، F. McGlone، D. Bedrossian، A. Dagher
o يقوم غريلين بتنظيم نشاط الدماغ في المناطق التي تتحكم في السلوك التفاعلي
o Cell Metab.، 7 (2008)، pp. 400 – 409
o
117
o رجل وآخرون ، 2009
o MS Man، HF Clarke، AC Roberts
o دور القشرة المدارية الأمامية والأنسجة الوسطى في تنظيم الاستجابات البؤرية لمكافآت الطعام
يا سيريب. Cortex، 19 (2009)، pp. 899 – 906
o
118
o Margules and Olds، 1962
o DL Margules، J. Olds
o نظم "التغذية" المتطابقة و "المكافئة" في الوطاء الجانبي للفئران
o Science، 135 (1962)، pp. 374 – 375
o
119
o ماركو وفرانك ، 1987
o A. Markou، RA Frank
o تأثير التنبيه الفعال والإلكترود على وظائف استجابة مدة التنبيه الذاتي
يا فسيولوج. Behav.، 41 (1987)، pp. 303 – 308
o
120
o Markou و Koob ، 1991
o A. Markou، GF Koob
س Postcocaine anhedonia. نموذج حيواني لسحب الكوكايين
o Neuropsychopharmacology، 4 (1991)، pp. 17 – 26
o
121
o Mastronardi et al.، 2001
o CA Mastronardi، WH Yu، VK Srivastava، WL Dees، SM McCann
س الليبتين التي يسببها الافراج عن الليبتين هو السيطرة neurally
س بروك. NATL. أكاد. الخيال العلمي. USA، 98 (2001)، pp. 14720 – 14725
o
122
o Matheny وآخرون ، 2011
o M. Matheny، A. Shapiro، N. Tumer، PJ Scarpace
o مقاومة الليبتين الخلوية المستحثة بالنظام الغذائي الخاصة بالمنطقة ومقاومة الليبتين تشمل المنطقة القطبية البطنية في الفئران.
o علم الأعصاب (2011) http://dx.doi.org/10.1016/j.neuropharm.2010.11.002 في الصحافة. نشرت على الانترنت نوفمبر 5 ، 2010
o
123
o ماتسوموتو و Hikosaka و 2007
o ماتسوموتو ، أو. هيكوساكا
س habeneula الوحشي كمصدر إشارات مكافأة سلبية في الخلايا العصبية الدوبامين
o Nature، 447 (2007)، pp. 1111 – 1115
o
124
o مورتون وآخرون ، 2006
o GJ Morton، DE Cummings، DG Baskin، GS Barsh، MW Schwartz
o السيطرة على الجهاز العصبي المركزي من تناول الطعام ووزن الجسم
o Nature، 443 (2006)، pp. 289 – 295
o
125
o جبل و Hoebel ، 1967
o G. Mount، BG Hoebel
س التحفيز الذاتي المهاد الذاتي الجانبي: زيادة العتبة المحددة الذاتي من تناول الطعام
يا Psychon. Sci.، 9 (1967)، pp. 265 – 266
o
126
o ناير وآخرون ، 2011
o SG Nair، BM Navarre، C. Cifani، CL Pickens، JM Bossert، Y. Shaham
o دور الظهارية الظهارية الوسطى القشرة الدوبامين D1-family receptors in relapse to high-fat food seeking induced by anxiogenic drug yohimbine
o Neuropsychopharmacology، 36 (2011)، pp. 497 – 510
o
127
o ناكازاتو وآخرون ، 2001
o M. Nakazato، N. Murakami، Y. Date، M. Kojima، H. Matsuo، K. Kangawa، S. Matsukura
o دور ghrelin في التنظيم المركزي للتغذية
o Nature، 409 (2001)، pp. 194 – 198
o
128
o Naqvi و Bechara ، 2009
o NH Naqvi، A. Bechara
o جزيرة الإدمان المخفية: إنسولا
o Trends Neurosci.، 32 (2009)، pp. 56 – 67
o
129
o نيفيل وآخرون ، 2004
o MJ Neville، EC Johnstone، RT Walton
o تحديد وتوصيف ANKK1: جين كيناز جديد مرتبط بشكل وثيق مع DRD2 على نطاق الكروموسوم 11q23.1
يا هم. Mutat.، 23 (2004)، pp. 540 – 545
o
130
o Nirenberg and Waters، 2006
o MJ Nirenberg، C. Waters
o الأكل القهري وزيادة الوزن المتعلقة باستخدام ناهض الدوبامين
يا موف. Disord.، 21 (2006)، pp. 524 – 529
o
131
o نوبل ، 2000
o EP Noble
o الإدمان ومكافأته من خلال تعدد أشكال جين مستقبل الدوبامين D2: مراجعة
يورو. Psychiatry، 15 (2000)، pp. 79 – 89
o
132
o نوبل وآخرون ، 1993
o EP Noble، K. Blum، ME Khalsa، T. Ritchie، A. Montgomery، RC Wood، RJ Fitch، T. Ozkaragoz، PJ Sheridan، MD Anglin et al.
o ارتباط الأليلات لجين مستقبل الدوبامين D2 بالاعتماد على الكوكايين
o تعاطي الكحول ، 33 (1993) ، ص. 271 – 285
o
133
o نوبل وآخرون ، 2000
o EP Noble، X. Zhang، TL Ritchie، RS Sparkes
س Haplotypes في موضع DRD2 والإدمان على الكحول الشديدة
يا صباحا. جى ميد Genet.، 96 (2000)، pp. 622 – 631
o
134
o O'Connor et al.، 2008
o DB O'Connor، F. Jones، M. Conner، B. McMillan، E. Ferguson
o آثار المتاعب اليومية وأسلوب تناول الطعام على سلوك تناول الطعام
o Health Psychol.، 27 (1، Suppl) (2008)، pp. S20 – S31
o
135
o O'Doherty et al.، 2002
o JP O'Doherty، R. Deichmann، HD Critchley، RJ Dolan
س الاستجابات العصبية أثناء توقع مكافأة الذوق الأساسي
o Neuron، 33 (2002)، pp. 815 – 826
o
136
أورايلي ، 2009
o S. O'Rahilly
o علم الوراثة البشرية ينير الطريق إلى الأمراض الأيضية
o Nature، 462 (2009)، pp. 307 – 314
o
137
o Oswald et al.، 2010
o د. أوزوالد ، دي إل موردو ، في إل كينغ ، إم بي بوجيانو
o الدافع للطعام المستساغ على الرغم من العواقب في نموذج حيواني من الأكل بنهم
يا Int. ج. Disord. (2010) http://dx.doi.org/10.1002/eat.20808 في الصحافة. نشرت على الانترنت فبراير 22 ، 2010
o
138
o Park and Carr، 1998
ث بارك ، د. كار
o الأنماط العصبية التشنجيّة للخواص المناعيّة الشبيهّة بفيروس الإلتهاب المفترسة المستحثّة بوجبة مستساغة وبيئة الإقتران بالوجبات في الجرذان المعالجة بالمحلول الملحي والنرتيكسون
o Brain Res.، 805 (1998)، pp. 169 – 180
o
139
o Peciña و Berridge ، 2005
o S. Peciña، KC Berridge
o البقعة الساخنة المتعفنة في قشرة النواة المتكئة: أين تسبب المواد الأفيونية الأفيونية زيادة تأثير المتعة على الحلاوة؟
o J. Neurosci.، 25 (2005)، pp. 11777 – 11786
o
140
o Peciña et al.، 2006a
o S. Peciña، J. Schulkin، KC Berridge
س nucleus accumbens-catericotropin-release فاعلية زيادة الدوافع المحفزة لجائزة السكروز: التأثيرات الحافزة الإيجابية المتناقضة في الإجهاد؟
o BMC Biol.، 4 (2006)، p. 8
o
141
o Peciña et al.، 2006b
o S. Peciña، KS Smith، KC Berridge
o البقع الساخنة في الدماغ
o Neuroscientist، 12 (2006)، pp. 500 – 511
o
142
o Pecoraro et al.، 2004
o N. Pecoraro، F. Reyes، F. Gomez، A. Bhargava، MF Dallman
o التوتر المزمن يعزز التغذية المستساغة ، مما يقلل من علامات التوتر: تأثيرات التغذية الراجعة والتغذية الراجعة من الإجهاد المزمن
o Endocrinology، 145 (2004)، pp. 3754 – 3762
o
143
o Pelchat et al.، 2004
o ML Pelchat، A. Johnson، R. Chan، J. Valdez، JD Ragland
o صور من الرغبة: تنشيط الغذاء حنين خلال الرنين المغناطيسي الوظيفي
o Neuroimage، 23 (2004)، pp. 1486 – 1493
o
144
o Pelleymounter et al.، 1995
o MA Pelleymounter، MJ Cullen، MB Baker، R. Hecht، D. Winters، T. Boone، F. Collins
o تأثيرات منتج الجين البدين على تنظيم وزن الجسم في فئران ob / ob
o Science، 269 (1995)، pp. 540 – 543
o
145
o Pelloux et al.، 2007
o Y. Pelloux، BJ Everitt، A. Dickinson
س المخدرات القهري تسعى من الفئران تحت العقاب: آثار تاريخ تناول المخدرات
o Psychopharmacology (Berl.)، 194 (2007)، pp. 127 – 137
o
146
o Perello et al.، 2010
o M. Perello، I. Sakata، S. Birnbaum، JC Chuang، S. Osborne-Lawrence، SA Rovinsky، J. Woloszyn، M. Yanagisawa، M. Lutter، JM Zigman
o يزيد Ghrelin القيمة المجزية للنظام الغذائي عالي الدهون بطريقة تعتمد على orexin
يا بيول. Psychiatry، 67 (2010)، pp. 880 – 886
o
147
o بتروفيتش وآخرون ، 2009
o GD Petrovich، CA Ross، P. Mody، PC Holland، M. Gallagher
o اللوزة المركزية ، ولكن ليست basolateral ، أمر بالغ الأهمية للتحكم في التغذية من قبل تلميحات مستفادة مكره
o J. Neurosci.، 29 (2009)، pp. 15205 – 15212
o
148
o بفافلي وآخرون ، 2010
o J. Pfaffly، M. Michaelides، GJ Wang، JE Pessin، ND Volkow، PK Thanos
- يزيد الليبتين من مستقبلات الدوبامين D2 المستقبلة في الفئران المصابة بسماحة لايبتين (ob / ob).
o Synapse، 64 (2010)، pp. 503 – 510
o
149
o Puhl et al.، 2008
o RM Puhl، CA Moss-Racusin، MB Schwartz، KD Brownell
o الوزن وصمة العار والحد من التحيز: وجهات نظر زيادة الوزن والبدناء البالغين
س التثقيف الصحي. Res.، 23 (2008)، pp. 347 – 358
o
150
o رادا وآخرون ، 2010
o P. Rada، ME Bocarsly، JR Barson، BG Hoebel، SF Leibowitz
o يقلل الدوبامين المتكثف في جرذان Sprague-Dawley المعرضين للإفراط في تناول وجبة غنية بالدهون
يا فسيولوج. Behav.، 101 (2010)، pp. 394 – 400
o
151
o ريتشي ونوبل ، 2003
o T. Ritchie، EP Noble
o رابطة سبعة أشكال متعددة لجين مستقبلات الدوبامين D2 مع خصائص ارتباط مستقبلات الدماغ
يا Neurochem. Res.، 28 (2003)، pp. 73 – 82
o
152
o Roberto et al.، 2010
o M. Roberto، MT Cruz، NW Gilpin، V. Sabino، P. Schweitzer، M. Bajo، P. Cottone، SG Madamba، DG Stouffer، EP Zorrilla et al.
س الإفراج عن حامض amygdala gamma-aminobutyric المسببة للعامل تحرير الإفراج عن الكورتيكوتروبين يلعب دورا رئيسيا في الاعتماد على الكحول
يا بيول. Psychiatry، 67 (2010)، pp. 831 – 839
o
153
o Roitman وآخرون ، 2004
o MF Roitman، GD Stuber، PE Phillips، RM Wightman، RM Carelli
o يعمل الدوبامين كمحول ثانوي للبحث عن الطعام
o J. Neurosci.، 24 (2004)، pp. 1265 – 1271
o
154
o Roitman وآخرون ، 2008
o MF Roitman، RA Wheeler، RM Wightman، RM Carelli
الاستجابات الكيميائية في الوقت الحقيقي في النواة المتكئة تفرق بين المحفزات المجزية والمحفوفة
يا نات. Neurosci.، 11 (2008)، pp. 1376 – 1377
o
155
س رولز ، 2008
س ET رولز
o وظائف من القشرة الحزبية الأمامية والعصبية في الذوق ، والشم ، والشهية والعاطفة
يا Acta Physiol. Hung.، 95 (2008)، pp. 131 – 164
o
156
س رولز ، 2010
س ET رولز
المذاق ، الشمة والمواد الغذائية مكافأة مكافأة المعالجة في الدماغ والبدانة
يا Int. ج. (Lond.) (2010) http://dx.doi.org/10.1038/ijo.2010.155 في الصحافة. نشرت على الانترنت أغسطس 3 ، 2010
o
157
o Rolls et al.، 1983
o ET Rolls، BJ Rolls، EA Rowe
o الشبع الحسي المحدد والدافع الخاص لرؤية ومذاق الطعام والماء في الإنسان
يا فسيولوج. Behav.، 30 (1983)، pp. 185 – 192
o
158
o Roseberry et al.، 2007
o AG Roseberry، T. Painter، GP Mark، JT Williams
o انخفاض مخزونات الدوبامين الحويصلية الجسدية في الفئران التي تفتقر إلى الليبتين
o J. Neurosci.، 27 (2007)، pp. 7021 – 7027
o
159
o Rothemund وآخرون ، 2007
o Y. Rothemund، C. Preuschhof، G. Bohner، HC Bauknecht، R. Klingebiel، H. Flor، BF Klapp
o التفعيل التفاضلي للمخطط الظهري بواسطة محفزات الطعام المرتفعة السعرات الحرارية لدى الأفراد البدينين
o Neuroimage، 37 (2007)، pp. 410 – 421
o
160
س Salas وآخرون ، 2010
o R. Salas، P. Baldwin، M. de Biasi، PR Montague
س ردود BOLD لأخطاء التنبؤ مكافأة سلبية في habenula الإنسان
يا الجبهة. همهمة. Neurosci.، 4 (2010)، p. 36
o
161
o Saper et al.، 2002
o CB Saper، TC Chou، JK Elmquist
o الحاجة إلى إطعام: السيطرة على التوحيد والاستبداد من الأكل
o Neuron، 36 (2002)، pp. 199 – 211
o
162
س سوندرز ، 2001
يا R. سوندرز
o الأكل القهري وجراحة المعدة: ما الذي يجب أن يفعله الجوع؟
يا سمنة. Surg.، 11 (2001)، pp. 757 – 761
o
163
o Scarpace et al.، 2010
o PJ Scarpace، M. Matheny، Y. Zhang
o يعمل عجلة الجري على تفضيل الدهون العالية ويعزز تشوير الليبتين في المنطقة القطبية البطنية
يا فسيولوج. Behav.، 100 (2010)، pp. 173 – 179
o
164
o Schiltz et al.، 2007
o CA Schiltz، QZ Bremer، CF Landry، AE Kelley
o ﺗﺆدي اﻟﻌﻠﻤﺎت اﻟﻤﺮﺗﺒﻄﺔ ﺑﺎﻷﻏﺬﻳﺔ إﻟﻰ ﺗﻐﻴﻴﺮ اﻟﺘﻮﺻﻴﻞ اﻟﻮﻇﻴﻔﻲ ﻷﻣﺮاض اﻟ ﻌﺮب آﻤﺎ ﺗﻢ ﺗﻘﻴﻴﻤﻪ ﺑﻮاﺳﻄﺔ اﻟﺠﻴﻦ اﻟﻤﺒﻜﺮ واﻟﺘﻌﺒﻴﺮ اﻟﻤﺒﺎﺷﺮ
o BMC Biol.، 5 (2007)، p. 16
o
165
o Schur et al.، 2009
o EA Schur، NM Kleinhans، J. Goldberg، D. Buchwald، MW Schwartz، K. Maravilla
o يختلف التنشيط في تنظيم طاقة الدماغ ومراكز المكافأة حسب إشارات الطعام باختيار المنبه البصري
يا Int. ج. (Lond.)، 33 (2009)، pp. 653 – 661
o
166
o Sclafani وآخرون ، 1998
o A. Sclafani، RJ Bodnar، AR Delamater
o علم الصيدلة للأفضليات الغذائية
o الشهية ، 31 (1998) ، ص. 406
o
167
o Sescousse et al.، 2010
o G. Sescousse، J. Redouté، JC Dreher
o بنية ترميز قيمة المكافأة في القشرة الأمامية للمضاد البشري
o J. Neurosci.، 30 (2010)، pp. 13095 – 13104
o
168
o Shomaker et al.، 2010
o LB Shomaker، M. Tanofsky-Kraff، JM Zocca، A. Courville، M. Kozlosky، KM Columbo، LE Wolkoff، SM Brady، MK Crocker، AH Ali et al.
o تناول الطعام في غياب الجوع لدى المراهقين: تناول كمية كبيرة من الوجبة بعد تناول وجبة معيارية
يا صباحا. جى كلين Nutr.، 92 (2010)، pp. 697 – 703
o
169
o سيمونز وآخرون ، 2005
o WK Simmons، A. Martin، LW Barsalou
o صور الأطعمة الشهية تنشط القشور الذوقية من أجل الذوق والمكافأة
يا سيريب. Cortex، 15 (2005)، pp. 1602 – 1608
o
170
o صغير ، 2010
o DM Small
س تمثيل الطعم في insula الإنسان
يا بنية الدماغ. Funct.، 214 (2010)، pp. 551 – 561
o
171
o Small et al.، 2003
o DM Small، M. Jones-Gotman، A. Dagher
o إطلاق الدوبامين المستحث بالإطعام في المخطط الظهري يرتبط بتقييم اللذة في متطوعين أصحاء.
o Neuroimage، 19 (2003)، pp. 1709 – 1715
o
172
o Smith و Berridge، 2007
o KS Smith، KC Berridge
o الدائرة الحوفية الأفيونية للمكافأة: التفاعل بين النقاط الساخنة من النواة المتكئة والبطنية الشاحبة
o J. Neurosci.، 27 (2007)، pp. 1594 – 1605
o
173
o Söderpalm و Berridge ، 2000
o AH Söderpalm، KC Berridge
س تناول الطعام بعد الديازيبام ، المورفين أو muscimol: Microinjections في قذيفة المتكئين نواة
يا Pharmacol. الكيميائية الحيوية. Behav.، 66 (2000)، pp. 429 – 434
o
174
o Stice et al.، 2008a
o E. Stice، S. Spoor، C. Bohon، DM Small
o ترتبط العلاقة بين السمنة والاستجابة الحادة تجاه الغذاء بالأليل Taqia A1
o Science، 322 (2008)، pp. 449 – 452
o
175
o Stice et al.، 2008b
o E. Stice، S. Spoor، C. Bohon، MG Veldhuizen، DM Small
o العلاقة بين المكافأة الغذائية وتناول الطعام المتوقع للبدانة: دراسة التصوير بالرنين المغناطيسي الوظيفي
يا J. Abnorm. Psychol.، 117 (2008)، pp. 924 – 935
o
176
o Stice et al.، 2010a
o E. Stice، S. Yokum، K. Blum، C. Bohon
o ﯾرﺗﺑط زﯾﺎدة اﻟوزن ﺑﺎﻻﺳﺗﺟﺎﺑﺔ اﻟﻣﺧﻔﺿﺔ ﻟﻟﻣﺧطط ﻟﻸطﻌﻣﺔ اﻟﻘﺎﺑﻟﺔ ﻟﻟﻘﺑل
o J. Neurosci.، 30 (2010)، pp. 13105 – 13109
o
177
o Stice et al.، 2010b
o E. Stice، S. Yokum، C. Bohon، N. Marti، A. Smolen
o تقدير استجابة الدوائر لدقة الأغذية يتنبأ بزيادة مستقبلية في كتلة الجسم: تأثيرات التنسيق على DRD2 و DRD4
o Neuroimage، 50 (2010)، pp. 1618 – 1625
o
178
o Stoeckel ، 2010
o Stoeckel، LE (2010). The Goldilocks Principle of Obesity. مجلة Scientific American. يونيو 8 ، 2010. http://www.scientificamerican.com/article.cfm؟id=the-goldilocks-principle-obesity.
o
179
o Stratford و Kelley و 1997
o TR Stratford، AE Kelley
o GABA في قشرة النواة المتكئة تشارك في التنظيم المركزي لسلوك التغذية
o J. Neurosci.، 17 (1997)، pp. 4434 – 4440
o
180
o Stratford و Kelley و 1999
o TR Stratford، AE Kelley
دليل على وجود علاقة وظيفية بين النواة المتكئة في النواة و hypothalamus الجانبي الذي يخضع لسيطرة سلوك التغذية
o J. Neurosci.، 19 (1999)، pp. 11040 – 11048
o
181
س Suarez و Gallup ، 1981
o SD Suarez، GGJ Gallup
o تحليل متسلسل للسلوكيات المفتوحة في الجرذان والفئران
o تعلم. Motiv.، 12 (1981)، pp. 342 – 363
o
182
o Sunday et al.، 1983
o SR Sunday، SA Sanders، G. Collier
س استساغة وأنماط وجبة
يا فسيولوج. Behav.، 30 (1983)، pp. 915 – 918
o
183
o Swinburn et al.، 2009
o B. Swinburn، G. Sacks، E. Ravussin
o زيادة إمدادات الطاقة الغذائية أكثر من كافية لشرح وباء الولايات المتحدة للسمنة
يا صباحا. جى كلين Nutr.، 90 (2009)، pp. 1453 – 1456
o
184
o طه و فيلدز ، 2005
o SA Taha، HL Fields
o تشفير الاستساغة والسلوكيات الشهية بواسطة مجموعات عصبية متميزة في النواة المتكئة
o J. Neurosci.، 25 (2005)، pp. 1193 – 1202
o
185
o طه وآخرون ، 2009
o SA Taha، Y. Katsuura، D. Noorvash، A. Seroussi، HL Fields
o تقوم الدارات المتقاربة ، وليست المتسلسلة ، والفتاتية والباطنة بتنظيم مدخول الطعام الذي يسببه الأفيون
o Neuroscience، 161 (2009)، pp. 718 – 733
o
186
o Teegarden و Bale ، 2007
o SL Teegarden، TL Bale
· يؤدي انخفاض تفضيلات النظام الغذائي إلى زيادة الشعور بالعاطفة وخطر الانتكاس الغذائي
يا بيول. Psychiatry، 61 (2007)، pp. 1021 – 1029
o
187
o Teegarden et al.، 2009
o SL Teegarden، AN Scott، TL Bale
o التعرض المبكر للحمية الغنية بالدهون يعزز التغييرات طويلة الأجل في التفضيلات الغذائية وإشارات المكافأة المركزية
o Neuroscience، 162 (2009)، pp. 924 – 932
o
188
o Thanos وآخرون ، 2008
o PK Thanos، M. Michaelides، YK Piyis، GJ Wang، ND Volkow
o تقييد الطعام يزيد بشكل ملحوظ مستقبلات الدوبامين D2 (D2R) في نموذج جرذ السمنة كما تم تقييمه باستخدام تصوير in-vivo muPET ([11C] raclopride) والمختبر الذاتي ([3H] spiperone) autoradiography
o Synapse، 62 (2008)، pp. 50 – 61
o
189
o طومسون وسوانسون ، 2010
o RH Thompson، LW Swanson
o يدعم تحليل التوصيل الهيكلي القائم على فرضية الشبكة عبر نموذج هرمي من بنية الدماغ
س بروك. NATL. أكاد. الخيال العلمي. USA، 107 (2010)، pp. 15235 – 15239
o
190
o Vanderschuren و Everitt ، 2004
o LJ Vanderschuren، BJ Everitt
o يصبح البحث عن المخدرات قهريًا بعد فترة طويلة من تعاطي الكوكايين ذاتيًا
o Science، 305 (2004)، pp. 1017 – 1019
o
191
o Vendruscolo et al.، 2010a
o LF Vendruscolo، AB Gueye، M. Darnaudéry، SH Ahmed، M. Cador
o الاستغراق المفرط للسكر خلال فترة المراهقة يغير بشكل انتقائي وظيفة الدوافع والثواب في الجرذان البالغة
o PLoS ONE، 5 (2010)، p. e9296 http://dx.doi.org/10.1371/journal.pone.0009296
o
192
o Vendruscolo et al.، 2010b
o LF Vendruscolo، AB Gueye، JC Vendruscolo، KJ Clemens، P. Mormède، M. Darnaudéry، M. Cador
o انخفاض تناول الكحول في الفئران البالغة عرضة للسكروز خلال فترة المراهقة
o علم الأعصاب ، 59 (2010) ، الصفحات. 388 – 394
o
193
o Volkow and O'Brien، 2007
o ND Volkow ، CP O'Brien
o مشكلات DSM-V: هل يجب إدراج السمنة كاضطراب دماغي؟
يا صباحا. J. Psychiatry، 164 (2007)، pp. 708 – 710
o
194
o Volkow و Wise ، 2005
o ND Volkow، RA Wise
o كيف يساعدنا إدمان المخدرات على فهم السمنة؟
يا نات. Neurosci.، 8 (2005)، pp. 555 – 560
o
195
o Volkow et al.، 2009
o ND Volkow، GJ Wang، F. Telang، JS Fowler، RZ Goldstein، N. Alia-Klein، J. Logan، C. Wong، PK Thanos، Y. Ma، K. Pradhan
o العلاقة العكسية بين مؤشر كتلة الجسم والنشاط الأيضي قبل الجبهي لدى البالغين الأصحاء
o السمنة (Silver Spring) ، 17 (2009) ، الصفحات. 60 – 65
o
196
o Vucetic و Reyes، 2010
o Z. Vucetic، TM Reyes
o الدوبامين المركزي المركزي المتحكم في مدخول الطعام ومكافأته: الآثار المترتبة على تنظيم السمنة
يا وايلي Interdiscip. القس سيست. بيول. Med.، 2 (2010)، pp. 577 – 593
o
197
o Wang et al.، 2001
o GJ Wang، ND Volkow، J. Logan، NR Pappas، CT Wong، W. Zhu، N. Netusil، JS Fowler
o الدوبامين في الدماغ والسمنة
o Lancet، 357 (2001)، pp. 354 – 357
o
198
o Wang et al.، 2002
o GJ Wang، ND Volkow، JS Fowler
o دور الدوبامين في الدوافع للأغذية في البشر: الآثار المترتبة على السمنة
رأي الخبراء. ذر. Targets، 6 (2002)، pp. 601 – 609
o
199
o Wang et al.، 2004a
o GJ Wang، ND Volkow، F. Telang، M. Jayne، J. Ma، M. Rao، W. Zhu، CT Wong، NR Pappas، A. Geliebter، JS Fowler
o يؤدي التعرض لمحفزات الطعام الشهية إلى تنشيط الدماغ البشري بشكل ملحوظ
o Neuroimage، 21 (2004)، pp. 1790 – 1797
o
200
o Wang et al.، 2004b
o GJ Wang، ND Volkow، PK Thanos، JS Fowler
o التشابه بين السمنة وإدمان المخدرات حسب تقييم التصوير العصبي: مراجعة المفهوم
يا مدمن. Dis.، 23 (2004)، pp. 39 – 53
o
201
o Wang et al.، 2008
o GJ Wang، D. Tomasi، W. Backus، R. Wang، F. Telang، A. Geliebter، J. Korner، A. Bauman، JS Fowler، PK Thanos، ND Volkow
o انتفاخ المعدة ينشط دائرة التشبع في الدماغ البشري
o Neuroimage، 39 (2008)، pp. 1824 – 1831
o
202
o Wassum et al.، 2009
o KM Wassum، SB Ostlund، NT Maidment، BW Balleine
o تحدد الدوائر الأفيونية المتميزة استساغة واستحسان الأحداث المكافئة
س بروك. NATL. أكاد. الخيال العلمي. USA، 106 (2009)، pp. 12512 – 12517
o
203
o Wassum et al.، 2011
o KM Wassum، IC Cely، BW Balleine، NT Maidment
o تنشيط مستقبلات الأفيون في اللوزة الوحشية الجانبية يتوسط تعلم الزيادات ولكن لا ينقص في القيمة التحفيزية لمكافأة الطعام
o J. Neurosci.، 31 (2011)، pp. 1591 – 1599
o
204
o Wilkinson and Peele، 1962
o HA Wilkinson، TL Peele
o تعديل التحفيز الذاتي داخل الجمجمة عن طريق شبع الجوع
يا صباحا. J. Physiol.، 203 (1962)، pp. 537 – 540
o
205
o Will et al.، 2003
o MJ Will، EB Franzblau، AE Kelley
o ينظم Nucleus accumbens mu-opioids كمية من النظام الغذائي عالي الدهون عبر تنشيط شبكة دماغية موزعة
o J. Neurosci.، 23 (2003)، pp. 2882 – 2888
o
206
o Wilson et al.، 2008
o ME Wilson، J. Fisher، A. Fischer، V. Lee، RB Harris، TJ Bartness
o تحديد كمية الطعام في القرود التي توجد في المساكن الاجتماعية: آثار الوضع الاجتماعي على استهلاك السعرات الحرارية
يا فسيولوج. Behav.، 94 (2008)، pp. 586 – 594
المادة | PDF (553 K) |
عرض سجل في Scopus
| استشهد بها في Scopus (22)
207
o Yurcisin et al.، 2009
o BM Yurcisin، MM Gaddor، EJ DeMaria
o جراحة السمنة وجراحة السمنة
س كلين Chest Med.، 30 (2009)، pp. 539 – 553، ix
o
208
o Zhang et al.، 1998
o M. Zhang، BA Gosnell، AE Kelley
o يتم تحسين تناول الأطعمة الغنية بالدهون بشكل انتقائي عن طريق تحفيز مستقبلات الأفيون في داخل النواة المتكئة
يا J. Pharmacol. إكسب. Ther.، 285 (1998)، pp. 908 – 914
س عرض سجل في Scopus
| استشهد بها في Scopus (148)
209
o Zheng et al.، 2007
o H. Zheng، LM Patterson، HR Berthoud
o مطلوب إشارات Orexin في منطقة tegmental البطنية للشهية عالية الدهون الناجمة عن التحفيز الأفيوني للنواة المتكئة
o J. Neurosci.، 27 (2007)، pp. 11075 – 11082
س عرض سجل في Scopus
| استشهد بها في Scopus (64)
210
o Zheng et al.، 2009
o H. Zheng، NR Lenard، AC Shin، HR Berthoud
o التحكم في الشهية وتنظيم توازن الطاقة في العالم الحديث: يتغلب الدماغ المدفوع بمكافأة على إشارات التوسّع
يا Int. ج. (Lond.)، 33 (Suppl 2) (2009)، pp. S8 – S13
س عرض سجل في Scopus
| استشهد بها في Scopus (34)