تقارير علمية حجم 9، رقم المقالة: 16918 (2019)
ملخص
الإفراط في تناول السكروز يثير الرغبة الشبيهة بالإدمان التي قد تدعم وباء السمنة. تعمل المواد الأفيونية والدوبامين على التوسط في التأثيرات المجزية لعقاقير الإساءة والمكافآت الطبيعية من المنبهات مثل الطعام المستساغ. لقد بحثنا في آثار السكروز باستخدام التصوير المقطعي المحوسب باستخدام [11C] كارفنتانيل (ناهض مستقبلات الأفيون) و [11C] raclopride (مضادات مستقبلات الدوبامين D2 / 3) في سبعة أنسجة صغيرة من غوتنغن مخدر. ثم منحنا minipigs الوصول إلى محلول السكروز لمدة ساعة واحدة في 12 يومًا متتاليًا وأجري التصوير مرة أخرى بعد 24 ساعة من وصول السكروز النهائي. في عينة أصغر من خمسة minipigs ، أجرينا [إضافية11C] كارفنتانيل جلسة PET بعد التعرض السكروز الأول. حسبنا إمكانات ملزم فوكسل (BPND) استخدام المخيخ كمنطقة ملزمة غير قابلة للاستبدال ، وتحليل الاختلافات مع رسم الخرائط الإحصائية غير البارامترية ، وإجراء تحليل إقليمي. بعد 12 يوما من وصول السكروز ، BPND من كلا المستكشفين قد انخفض بشكل كبير في المخطط ، النواة المتكئة ، المهاد ، اللوزة ، القشرة الحزامية والقشرة قبل الجبهية ، بما يتماشى مع التنظيم السفلي لكثافات المستقبلات. بعد تعرض واحد للسكروز ، وجدنا انخفاض الارتباط بـ [11C] carfentanil في النواة تتكثف والقشرة الحزامية ، بما يتفق مع إطلاق المواد الأفيونية. انخفاض توافر مستقبلات الأفيونيات والدوبامين قد يفسر احتمال الإدمان المرتبطة بتناول السكروز.
المُقدّمة
خمسة في المئة من سكان العالم يعانون من السمنة المفرطة1. باعتبارها سمة مميزة لمتلازمة التمثيل الغذائي ، ترتبط السمنة بمرض السكري من النوع 2 ، وأمراض القلب والأوعية الدموية ، ومشاكل الجهاز التنفسي ، وخطر الاكتئاب وربما الخرف2. أدى الاستهلاك المتزايد للأغذية الكثيفة الطاقة إلى المبالغة في التمييز الفسيولوجي بين الجوع المتجانس الذي يتبع الحرمان من الطعام ، والجوع المتهيج ، أو "الشغف" ، الذي يحدث في غياب الحرمان3,4. نظرًا لأن تنظيم التماثل السرطاني وحده لا يمكن أن يفسر الارتفاع الحالي في السمنة ، فمن الضروري اختبار التأثير على آليات المخ في الثواب والمتعة لخصائص الإدمان على الطعام المستساغ للغاية.
يرتبط استهلاك السكروز بالسمنة ، ويعتبر السكروز مادة إدمانية بشكل متزايد5. تتعارض بعض النتائج مع هذا الادعاء بسبب الصعوبات في فصل استهلاك الأغذية غير المستساغة عن استجابات الطعام المتمايزة ، وفي تحديد المكون المسبب للإدمان في الأغذية المصنعة ، وكذلك الآليات المختلفة التي يغير بها الطعام دارات الدماغ عبر مسارات طبيعية6. ومع ذلك ، في سياقات محددة ، فإن تناول السكروز يحث على المكافأة والشغف ، مقارنة بحجم تلك التي تسببها العقاقير التي تسبب الإدمان ، والتي تؤدي إلى الاستهلاك المفرط والسمنة في نهاية المطاف6,7.
يرتبط الجوع بـ "الرغبة" المرتبطة ارتباطًا وثيقًا بآثار النقل العصبي الدوباميني في عدد من ظروف المكافأة8، ولكن يبقى من غير الواضح كيف يتم تحوير عمل الدوبامين (DA) استجابة للأكل القهري. يرتبط استهلاك الطعام المستساغة بـ "الإعجاب" ، بوساطة في المقام الأول عن طريق نظام الأفيون الداخلي ، وخاصة مستقبلات الأفيونيات (μOR)9,10، والتي يمكن أن تعزز الاستهلاك الزائد عند تحريرها. في هذا التقرير ، نقوم باختبار الادعاء بأن السكروز يؤدي إلى إطلاق الأفيونيات والدوبامين مما يقلل من توافر مستقبلات μOR و DA D2 / 3. التوافر هو مؤشر لعدد المستقبلات غير المشغولة المتاحة لربط التتبع ، ومن حيث المبدأ ، لا يميز بين كثافة الارتباط ويجند المستقبلات11.
تعتمد بداية تناول الطعام القهري على عوامل متعددة ، وتثير الدراسات السببية في البشر قضايا أخلاقية. لذلك تركز معظم الدراسات على سلوك التغذية لدى الفئران12. على الرغم من أن الفئران لها "سن حلوة" ، إلا أن آلياتها التماثلية الهامة لزيادة الوزن والتمثيل الغذائي ونوع تراكم الدهون ، تختلف اختلافًا كبيرًا عن تلك الموجودة لدى البشر. غوتينجن minipig هو حيوان كبير النهمة ولديه دماغ متطور متطور ، والذي يمكن تصويره بدقة كافية. في المناطق القشرية القشرية والجبهة محددة جيدا13 تمكين ترجمة أكثر مباشرة لوظيفة الدماغ البشري. هنا ، نستخدم التصوير المقطعي بالإصدار البوزيتروني (PET) للتصوير في الجسم الحي توفر andOR و DA D2 / 3 في نموذج minipig للتعرض للسكروز دون المزمنة. في عينة أصغر ، درسنا التأثيرات الفورية على شغل μOR بعد التعرض الأول للسكروز. أخيرًا ، قمنا باختبار العلاقة بين التغييرات في توافر المستقبلات لجهازي التتبع.
النتائج
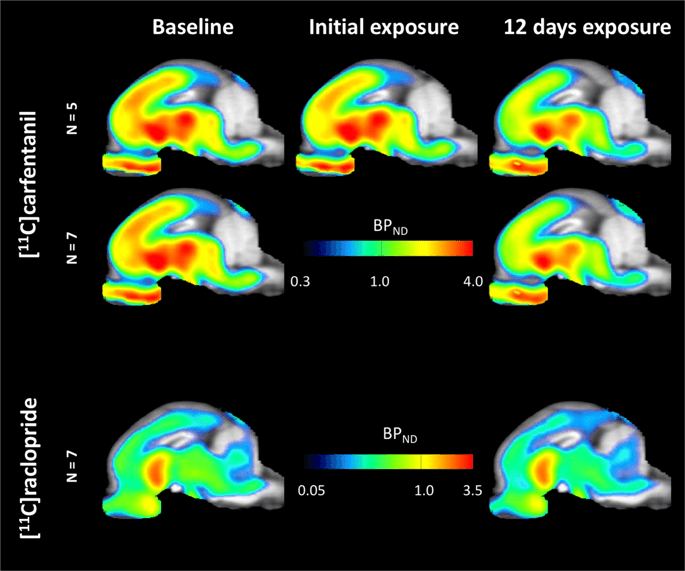
متوسط خرائط حدودي من [11C] carfentanil و [11C] raclopride ملزمة المحتملة (BPND) تظهر في الشكل. 1. لتحليل التغييرات التي تحدث بعد تعرض السكروز لأول مرة في خمسة minipigs مقارنة مع خط الأساس ، ويوم واحد بعد 12th وصول السكروز في سبعة minipigs مقارنة مع خط الأساس ، استخدمنا نظرية التقليب وتحليل الدماغ كله غير المقيدة إقليميا ، الطريقة المفضلة لعينات من هذا الحجم14.
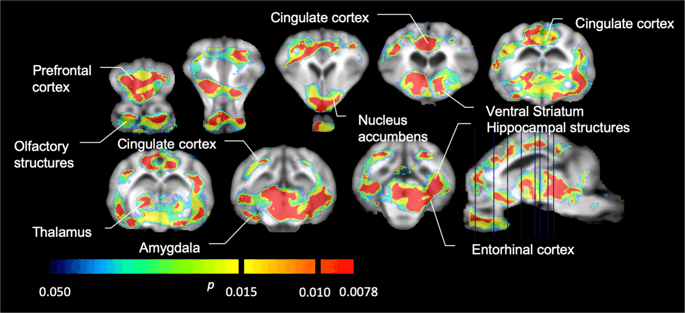
متوسط إمكانات الربط غير قابلة للاستبدال من فوكسل (BPND) الخرائط المتراكبة على صور التصوير بالرنين المغناطيسي في عرض سهمي. يتم تقديم البيانات لـ [11C] carfentanil BPND من 5 minipigs تصويرها في الأساس ، بعد التعرض الأولي للسكروز وبعد 12 يوما من التعرض للسكروز (الصف العلوي). [11C] carfentanil BPND كل 7 minipigs تصويرها في الأساس وبعد 12 يوما من وصول السكروز وترد في الصف الأوسط. [11C] Raclopride BPND جميع 7 minipigs تصويرها في الأساس وبعد 12 يوما من وصول السكروز وتظهر في الصف السفلي. لاحظ أن مقياس اللون أسي لتمييز [11C] Raclopride BPND في المناطق خارج الخلية.
التعرض الأولي للسكروز
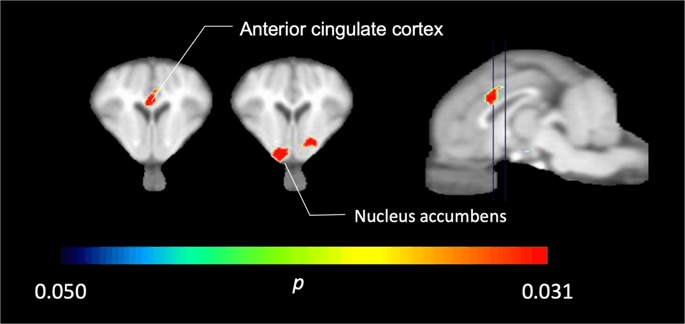
في خمسة minipigs تصويرها مع [11C] carfentanil في الأساس وبعد التعرض للسكروز مباشرة ، وجدنا ارتباطًا مخفضًا بدرجة كبيرة في القشرة الحزامية الأمامية وتتراكم النواة استجابة للسكروز ، كما هو موضح بالألوان في الشكل. 2، مشيرا إلى p <0.05. اكتشفنا ما يصل إلى 14٪ انخفض ارتباط التتبع في كلا المجالين مقارنة بخط الأساس.
انخفاض كبير في [11C] carfentanil BPND بعد التعرض الأول لمياه السكروز مقارنةً بخط الأساس (ن = 5). فوكسل فقط مع كبير (p <0.05) تظهر النقصان كمناطق ملونة مسقطة على قطع التصوير بالرنين المغناطيسي T1 الموزونة على مستوى القشرة الحزامية الأمامية (يسار) والنواة المتكئة (وسط) من أطلس الدماغ المصغر التجسيمي. لاحظ أن الحد الأقصى لمستوى الأهمية الذي يمكن تحقيقه باستخدام 5 حيوانات هو 2-5 0.031 XNUMX (انظر شريط اللون). يتم تقديم البيانات على أقسام الاكليلية من دماغ الخنزير في المستويات المبينة على الصورة السهمي (يمين).
12 يوما من وصول السكروز
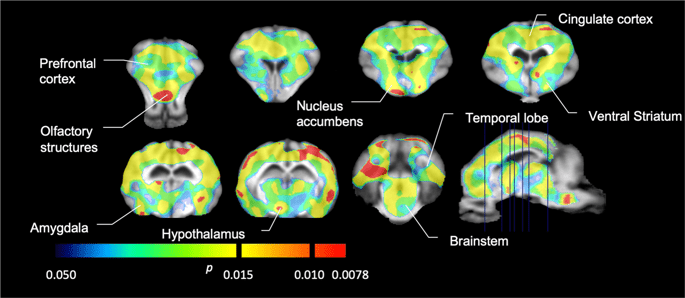
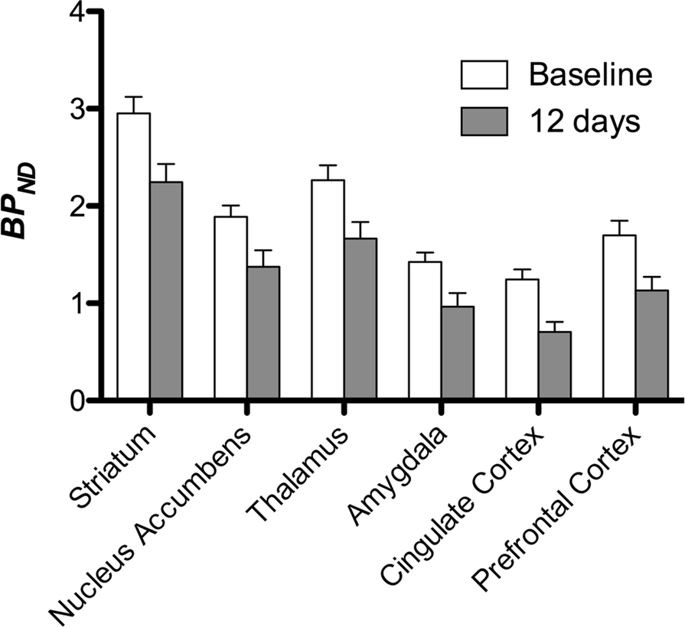
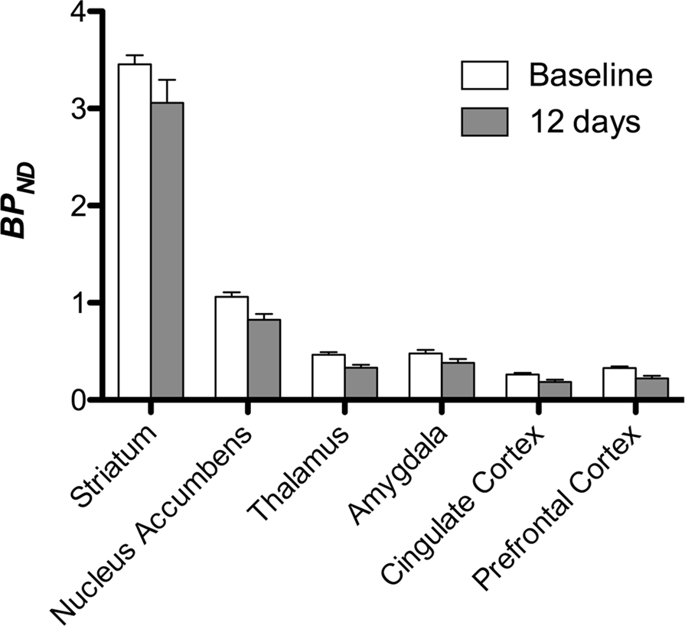
ثم أجرينا تحليل سبعة minipigs تصويرها مع [11C] carfentanil في الأساس وبعد 12 يومًا من وصول السكروز ووجد انخفاضًا ملحوظًا في ارتباط الحيوانات المصابة بالسكروز مقارنة مع خط الأساس. تظهر المناطق الأكثر تأثراً بدرجة كبيرة باللون الأحمر في الشكل. 3 (p <0.01) وتشمل أجزاء من الهياكل الشمية ، والنواة المتكئة / المخطط البطني والقشرة / الفص الصدغي ، تليها المناطق الموضحة باللون الأصفر (p <0.015) والتي تضم أجزاء من قشرة الفص الجبهي ، والقشرة الحزامية ، واللوزة الدماغية ، وجذع الدماغ . من أجل الحصول على BPND قيم وتقييم التغير في المئة ، أجرينا التحليل الإقليمي وحصلنا على متوسط القيم في كل منطقة في الأساس وبعد استهلاك السكروز (الشكل. 4).
انخفاض كبير في [11C] كارفنتانيل ملزمة المحتملة (BPND) بين خط الأساس وبعد 12 يومًا من التعرض لمياه السكروز (ن = 7). voxels مع كبير (p <0.05) تظهر النقصان كمساحات ملونة مسقطة على قطع التصوير بالرنين المغناطيسي T1 الموزونة من أطلس الدماغ المصغر التجسيمي. يتم عرض البيانات على أقسام الدماغ الإكليلية عند المستويات المشار إليها في الصورة السهمية (أسفل اليمين). لاحظ أن أقصى مستوى للدلالة يمكن تحقيقه مع 7 حيوانات هو 2-7 0.0078 XNUMX (انظر شريط اللون).
كنا [11C] raclopride كتتبع لمستقبلات DA D2 / 3 في مناطق الدماغ القاتلة وخارج الخلية في minipigs في الأساس وبعد 12 يوما من وصول السكروز (الشكل. 1). وجدنا انخفاضًا في ارتباط التتبع في الحيوانات المعرضة للسكروز ، مقارنة بخط الأساس ذي التأثيرات الأكبر (p <0.01) في مناطق قشرة الفص الجبهي ، والنواة المتكئة / المخطط البطني ، والقشرة الحزامية ، واللوزة ، والمهاد ، والدماغ المتوسط ، ومناطق الحصين ، ومناطق الشم. (تين. 5). يتم عرض البيانات من التحليل الإقليمي في الشكل. 6.
انخفاض كبير في [11C] raclopride ملزمة المحتملة (BPND) بين خط الأساس وبعد 12 يومًا من التعرض لمياه السكروز (ن = 7). voxels مع كبير (p <0.05) تظهر النقصان كمناطق ملونة مسقطة على قطع التصوير بالرنين المغناطيسي الموزونة T1 من أطلس الدماغ المصغر التجسيمي. يتم تقديم البيانات على المقاطع الإكليلية لدماغ الخنزير بالمستويات الموضحة في الصورة السهمية (أسفل اليمين). لاحظ أن أقصى مستوى للدلالة يمكن تحقيقه مع 7 حيوانات هو 2-7 0.0078 XNUMX (انظر شريط اللون).
العلاقات بين [11C] raclopride و [11ج] كارفنتانيل البيانات
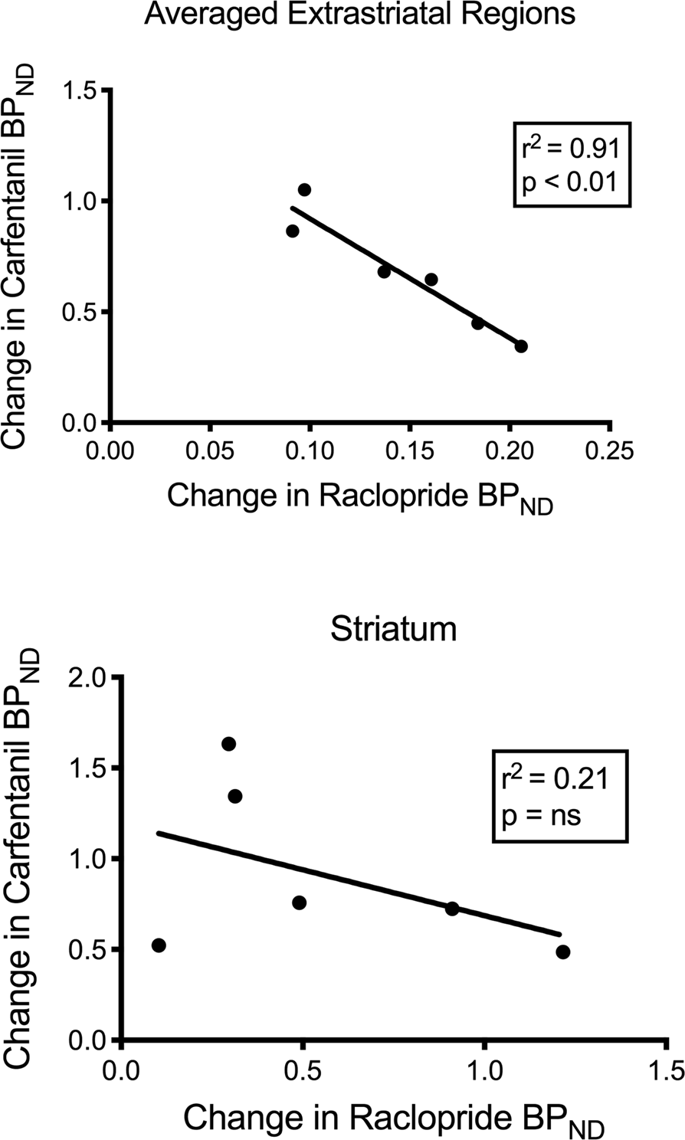
اختبرنا العلاقة المحتملة بين [11C] raclopride و [11C] carfentanil قيم BPND في المناطق القاتلة وغير القاتلة في minipigs في الأساس وبعد 12 يومًا من تناول السكروز ، دون ملاحظة أي ارتباطات. ثم قمنا باختبار ما إذا كانت ارتباطات ارتباط التتبع مرتبطة ، وقمنا بمقارنة تغييرات BPND إلى عن على [11C] raclopride مع تغييرات BPND إلى عن على [11C] كارفنتانيل فقط في minipigs التي كانت أقل BPND لكلا الراسمين بعد تناول السكروز (ن = 6). وجدنا ارتباطات سلبية كبيرة في المتوسط خارج المجرى (ص2 = 0.91 ، ف <0.01) ، ولكن ليس في مناطق المخطط (الشكل. 7).
مناقشة
لقد قررنا آثار الوصول المتقطع للسكروز على النقل العصبي الأفيوني و DA في دماغ الثدييات. طولي في الجسم الحي كشف التصوير PET لمستقبلات μOR و DA D2 / 3 انخفاض توافر المستقبلات في جميع أنحاء دائرة المكافآت ، بما في ذلك النواة المتكئة ، القشرة الأمامية ، وقشرة الحزامية الأمامية. توضح النتائج بوضوح أن السكروز يؤثر على آليات المكافأة بطريقة مماثلة لتلك المستخدمة في تعاطي المخدرات.
من المعروف أن تناول السكروز كمادة مستساغة يطلق سراح DA ويحفز التبعية في القوارض15، مع السكروز الذي يظهر أنه أكثر متعة من الكوكايين في القوارض في سياقات معينة. وبالتالي ، فإن القوارض تعمل بكثافة للحصول على السكروز من الكوكايين ، حتى في غياب الحرمان من الطعام5. ومع ذلك ، يتم تنظيم آثار السكروز على حد سواء عن طريق نظام التماثل الساكن ودوائر المكافأة المتعة16,17 التي قد تتوسط في التمييز بين الجوانب التغذوية والمتحركة لعمل السكروز18. لقد اخترنا جدولًا مدته ساعة واحدة يوميًا من أجل تعزيز "الإزعاج" ، حيث كشفت الدراسات السابقة التي أجريت على الفئران عن وجود كمية أعلى خلال الساعة الأولى من الوصول اليومي في جدول متقطع15,19. غالبًا ما تستهدف الدراسات السلوكية لتناول الطعام الحيوانات المقيدة للغذاء ، لكن التصميم قد لا يعكس بالضرورة نفس الآليات العصبية النشطة في السمنة. لم تكن الخنازير في هذه الدراسة مقيدة بالأغذية وتم إطعامها بالكميات المعتادة من نظامها الغذائي الطبيعي بالإضافة إلى الحصول على السكروز.
يتم التعبير عن مستقبلات الأفيون (OR) على نطاق واسع في الدماغ ، وتحديدا في الهياكل المعروفة لتعديل عمليات الأكل والمكافأة20. أثبتت نسب الأرجحية أن تكون مهمة في آثار مجزية والانتعاش من الكوكايين21,22,23,24. تم ربط التعديلات في التجليد أيضًا بالاستجابات المتساوية للأكل والمتعة المرتبطة بالأطعمة المستساغة25. على وجه الخصوص ، يرتبط "تروق" الطعام بالنظام الأفيوني الداخلي ، وخاصة μOR9,10 في قشرة النواة تتكوم والشاحنة البطنية26. دفعات ناهض μOR إلى أجزاء مميزة من النواة المتكئة والشاحنة البطنية تعزز بقوة سلوكيات "الإعجاب" ، بما في ذلك نتوءات اللسان ولعق مخلب ، بعد زيادة تناول الطعام المستساغة27,28,29. يأتي دليل إضافي على إشارة الأفيونيات في معالجة التنظيم المتناهي من مضادات μOR التي تخفف استهلاك تشاو المستساغ في كل من libitum الإعلانيةالحيوانات المقيدة والغذاء مقيدة ، ولكن مع تأثير أكثر محدودية على تناول الكريات القياسية غير المستساغة30,31. في البشر ، يقلل مضادات μOR من تناول الطعام على المدى القصير ويقلل من ملاءمة الأطعمة المستساغة32,33,34. تساهم الإشارة الأفيونية في اللوزة السفلية أيضًا في "الرغبة" في الغذاء من خلال تعديل السعي للحصول على المكافأة وقيمة الحوافز الغذائية35.
مع [11C] carfentanil ، حصلنا على صور لربط التتبع الحساسة لمستويات bothOR وإفراز دماغ الأفيونيات الداخلية36,37. اكتشفنا فقدانًا فوريًا لتوافر μOR في مناطق النواة المتكئة والقشرة الحزامية الأمامية ، ومناطق دماغية محددة من مسار المكافأة ، بعد الاستهلاك الأولي للسكروز من خلال خمسة minipigs ، بما يتوافق مع إطلاق الأفيونيات الذاتية. أظهرت الدراسات السابقة أن الطعام المستساغة يمكن أن يؤدي إلى الشعور بالسعادة38 عن طريق تحفيز الافراج عن المواد الأفيونية. بعد 12 يومًا من وصول السكروز ، لاحظنا انخفاضًا [11C] carfentanil ملزمة ، والتي لديها عدة تفسيرات محتملة39 بما في ذلك إطلاق الأفيون الداخلي والتجليد في μOR ، μOR الداخلي نتيجة لزيادة الربط الأفيوني ، وزيادة تنشيط مستقبلات DA D2 / 3 مما يؤدي إلى إزالة الحساسية غير المتجانسة لـ μOR40.
دعما للنتائج الحالية ،11C] carfentanil دراسات المرضى الذين يعانون من الشره المرضي41، بدانة42,43,44، واضطراب الأكل بنهم45، تظهر انخفاض توافر مستقبلات. ومع ذلك ، فهذه هي الحالات المزمنة في حين أن minipigs تلقى السكروز فقط لمدة 12 يوما. في دراسة عن سلوك التغذية الحاد لدى الرجال الأصحاء ، أدت التغذية إلى إطلاق مادة أفيونية دماغية قوية وواسعة النطاق ، سواء في وجود وغياب الهاليدونيا ، مما يوحي بأن الإطلاق الأفيوني يعكس استجابات التمثيل الغذائي والتساوي ، وكذلك المتعة.25. هذه الدراسة ، مع دراسة أخرى صورت المرضى بعد تناول وجبة سائلة بنكهة الشوكولاتة44، يرتبط مباشرة بالدراسة الحادة لخمس minipigs بعد التعرض للسكروز لأول مرة ، ولكنه يختلف عن دراسة التعرض للسكروز تحت المزمنة على مدى 12 يومًا حيث يعكس احتمال توفر المستقبلات المخفّضة على الأرجح الإفراط في التحفيز المتكرر والتنظيم المصاحب المصاحب لـ μOR.
إن قشرة الفص الجبهي مهمة في صنع القرار وإسناد القيمة إلى العناصر ، وبالتالي قد تكون مسؤولة في القشرة المخية قبل الجبهية مسؤولة عن التقييم المتغير لملوحة الطعام ، والتي يمكن أن تزيد من إمكانية الإدمان على الطعام. لقد وجدنا انخفاض الارتباط في قشرة الفص الجبهي ، بما يتفق مع الدراسات السابقة التي تبين أن النظام الغذائي عالي الدهون يقلل من مستويات مرنا μOR في قشرة الفص الجبهي46 وهذا التسريب من ناهض μOR في قشرة الفص الجبهي يزيد من تناول الطعام الحلو47. مرة أخرى ، تبرز المشكلة فيما إذا كانت الحمية الغذائية عالية الدهون هي حالة مزمنة أكثر عرضة للتوسط في تنظيم مستقبلات المستقبلات ، مقارنةً بالتصميم القصير الأجل للتغذية بالسكروز ، مما يشير إلى إطلاق مستدام للأفيونيات الذاتية التي تزيح carfentanil tracer المرتبطة بـ μOR ، حتى بعد 12 يوما من السكروز.
وقد تورط DA في المكافآت سواء من المخدرات والسلوك. تم العثور على استخدام الكوكايين المزمن لمنع إشارات DA48. يتم تغيير مستويات مستقبلات DA D1 و D2 / 3 بواسطة النيكوتين في دماغ الخنازير49وفي الرئيسيات غير البشرية التي لها تاريخ من تعاطي الكوكايين50، بما يتسق مع تقليص مستقبلات D2 / 3 في أدمغة مدمني الكوكايين البشري51,52. أما بالنسبة للعقاقير المخدرة ، فقد ثبت أن السكروز ينظم مستقبلات DA D119 وزيادة الإفراج DA53، وتعزيز دور DA في "الرغبة" فيما يتعلق بالأغذية المستساغة. أظهرت دراسات PET السابقة انخفاضًا في توافر مستقبلات DA D2 / 3 الفتاك في السمنة المرضية مقابل متوسط الوزن54,55، مماثلة في حجم الانخفاض في المرضى الذين يدمنون المخدرات56وفي الحيوان مع نماذج السمنة57. في دراسات القوارض ، تشجع ضربة قاضية لمستقبلات D2 / 3 في المخطط على تطوير طعام إلزامي يبحث في الفئران مع إمكانية الوصول إلى الطعام المستساغ57.
قد تشير ملاحظاتنا حول انخفاض توافر مستقبلات D2 / 3 للخنزير إلى زيادة مستويات DA استجابةً لمدى الحافز المرتبط بتناول السكروز حيث يتم إصدار DA كجزء من الرغبة في تعاطي المخدرات وغيرها من الأنشطة الممتعة52,58,59,60. كما تم تخدير الخنازير أثناء التصوير ، ولم يتلق السكروز في غضون 24 ساعة ، انخفض D2 / 3 BPND على الأرجح يعكس انخفاض عدد المستقبلات استجابة للزيادة المطولة في إطلاق DA في كل من الأيام الـ 12 من وصول السكروز. هذا التخفيض يمكن أن يرفع عتبات مكافأة الدماغ ، المرتبطة بتنظيم مستقبلات DA D2 الهجومية. هذا قد يفسر زيادة التعرض لأدوية سوء المعاملة التي لوحظت في الدراسات السابقة عن تناول الفئران للسكروز مما أدى إلى زيادة الحساسية للكوكايين ، وفرط النشاط بعد تناول جرعة منخفضة من الأمفيتامين ، وزيادة تناول الكحول عند الامتناع عن السكروز ، والتسامح مع الآثار المسكنة للأفيونيات.6.
كشفت دراسة سابقة للسمنة في غوتنغن minipig انخفاض تدفق الدم في الدماغ في النواة تتكوم ، منطقة tegmental البطني (VTA) وقشرة الفص الجبهي ، مع التصوير المقطعي بالانبعاث الفوتون واحد (SPECT) من الدماغ61. تمشيا مع هذه النتائج ، لاحظنا انخفاض DA D2 / 3 ملزمة في منطقة فرينوفوريبرين تحتوي على النواة تتكوم وفي قشرة الفص الجبهي. يتم زيادة مستويات خارج الخلية من DA 3 أضعاف في تتراكم النواة بعد تناول السكروز في الفئران التي تتحرك بحرية تخضع للتحلل الجزئي62. في الحيوانات التي تعتمد على السكروز ، يمكن أن يؤدي تناول السكروز المتكرر إلى إطلاق DA من قشرة النواة المتكئة63. كانت الحيوانات التي تتغذى على نظام غذائي مقيد مع وصول محدود إلى السكروز لديها مستقبلات DA D2 أقل ملزمة في النواة المتكئة قذيفة و المخطط الظهري64. يمكن أن تؤدي الأنظمة الغذائية المحظورة التي تحتوي على نسبة عالية من الدهون والسكروز إلى تقليل التنظيم المستمر لمستقبلات D1 و D2 في الحمض النووي الريبي في النواة المتكئة65. كشفت دراسة عن التحليل الجزئي لآثار الطعام المستساغ عن زيادة إفراز DA في النواة المتكئة وقشرة الفص الجبهي عندما كان الطعام لا يزال يعتبر مبتكرًا ؛ بمجرد اعتياد الفئران على الطعام الجديد ، تم تخفيف زيادة الإطلاق في النواة المتكئة ، ولكن ليس في قشرة الفص الجبهي66. قد تفسر القابلية التفاضلية للتأقلم وتهيئة النشاط في منطقتين الزيادة الأكبر التي لوحظت في القشرة قبل الجبهية مقارنةً بالنواة المتكافلة من minipigs المعرضة لنفس المادة المستساغة التي فقدت الجدة بعد اثني عشر يومًا. ومع ذلك ، كما لم نقم بتصوير minipigs مع [11C] raclopride بعد إدارة السكروز الأولى ، وهذا التفسير هو المضاربة.
تقوم قشرة الدماغ الأمامية بتنسيق الوظيفة التنفيذية وصنع القرار والتحكم الذاتي67. إن النقل العصبي DA غير الوظيفي في قشرة الفص الجبهي يعرقل تعديل معالجة المكافآت ، مما يشير إلى ضعف الوظيفة التنفيذية ومهارات صنع القرار لدى الأفراد البدينين68,69. علاوة على ذلك ، فإن دراسة الإنسان للحيوانات الأليفة ترتبط انخفاض الأيض القشرة الأمامية مع انخفاض D2 مهاجمة ملزمة في السمنة70. هنا ، نجد انخفاضًا في توافر مستقبلات D2 / 3 في القشرة المخية قبل الجبهية بما في ذلك القشرة الأمامية المدارية للخنازير المعرضة لنظام السكروز.
ترسل الخلايا العصبية الدوبامينية في VTA توقعات إلى الحصين واللوزة ، حيث تدعم السلوكيات الشبيهة بالعادة71 والتوسط في ترميز واسترجاع تكييف المخدرات72,73 والعظة الغذائية74,75. أظهر تصوير الدماغ البشري تنشيط الحصين استجابة لشغف الطعام وتذوقه76. تمشيا مع النتائج التي توصلنا إليها من انخفاض مستقبلات الحصين والأميغالدار D2 / 3 استجابة للسكروز ، ورسم خرائط الدماغ البشري مع [18F] أظهرت fallypride إطلاق الكوكايين DA الناجم عن جديلة في اللوزة والحصين77. في أدمغة القوارض ، تسبب التعرض للكوكايين في إطلاق DA في اللوزة78، والتغيرات في مستويات amygdala DA أثرت على سلوك الباحثين عن الكوكايين79.
في دراسة أجريت على أفراد يعانون من السمنة المفرطة ، تعطلت العلاقة بين البطينين D2 / 3 و ailOR ، المعروف أنهما موجودان في المناطق القاتلة للأفراد الهزيلين ، في المخطط البطني80. قارنا قيم BPND من اثنين من الراسمات لاختبار ما إذا كانت البيانات مستنسخة هذا التأثير. على عكس البشر الهزيل ، فإن أدمغة الخنازير الحالية ليس لها علاقة بين قيم BPND من اثنين من الراسمات ، في الأساس أو بعد التعرض للسكروز. قمنا بعد ذلك باختبار ما إذا كانت الحيوانات التي لديها أكبر انخفاضات في ارتباط راكوبريد التتبع سيكون لها أيضًا أكبر انخفاضات في ارتباط كارفنتانيل التتبع ، ولكن بدلاً من ذلك وجدنا ارتباطًا سلبيًا في المناطق الخارجة عن المتوسط ، مما يشير إلى أن الحيوانات ذات أكبر تغيير في الإمكانات الملزمة للرابط. كان لدى راكلوبريد التتبع أدنى تغيير في الإمكانات الملزمة لتتبع كارفنتانيل. تشير العلاقة العكسية بين التغييرات إلى أن تأثيرات تناول السكروز على وفرة المستقبلات المعنية يتم تنظيمها في اتجاهين متعاكسين. من المعروف أن الاستهلاك المفرط للطعام المستساغة ، أو المخدرات ، يمكن أن يكون مدفوعًا بالرغبة أو الرغبة ، أو كليهما60,81. من المحتمل أن يكون حجم الرغبة التي يقودها الدوبامين ينفي حجم الإعجاب الذي تحركه المواد الأفيونية ، أو العكس. تشير الدلائل الحديثة إلى أدوار GABAA مستقبلات في VTA ومحطات الكوليني في المخطط وربما القشرة التي تعمل كمفاتيح بين آليات تعتمد على الدوبامين والآلية المستقاة من الدوبامين82,83 التي قد تفسر المعاملة بالمثل من آثار الدوبامين والأفيونيات في المناطق خارج الرحم الخنازير المحددة هنا.
أحد أوجه القصور في الحيوانات الأليفة ، أيضًا في الحيوانات الكبيرة نسبيًا ، هو الدقة المكانية المقطعية للتصوير المقطعي الذي يؤثر على نتائج مناطق الدماغ الصغيرة المرتبطة بالسلوكيات المرتبطة بالغذاء. ومع ذلك ، على الرغم من هذه المخاوف ، [11C] raclopride ملزم سابقا تم تسجيله سواء في المناطق القاتلة وخارجها84,85,86,87. استخدام [11C] راكلوبريد لتسمية نفس النوع من المستقبلات لا يثير أي قلق بشأن اختلافات التقارب المحتملة التي قد تؤثر على استخدام أدوات التتبع المنفصلة لنفس المستقبلات في مناطق مختلفة. تضمنت الدراسات الحديثة سجلات ملزمة خارج [11C] raclopride. ألاكورتي وآخرون. وجدت استنساخ جيد للتدابير من raclopride الفتاك ملزمة في المخطط ، مع استنساخ جيدة فقط إلى معتدلة في القشرة85. في دراسة لاحقة ، سفينسون وآخرون. ناقش العديد من القضايا التي تؤثر على استخدام [11C] raclopride كعلامة لمستقبلات D2 / 3 خارج الخلية في دراسة عن البشر الأصحاء ، بما في ذلك التكاثر الضعيف في القشرة والانحدار المحدود للربط خارج القشرة في القشرة الأمامية استجابةً لعامل حجب D2 / 388. كشفت مقارنات اختبار إعادة الاختبار عن وجود متغيرات تتراوح بين 4 إلى 7٪ في المخطط و 13-59٪ في المناطق القشرية ، ولكن متوسط الفترة بين الامتحانات بلغ 20 يومًا ، على عكس الأيام الأكثر إفادة في معظم الدراسات من 1-2 يوم. قد يكون لدى عدد من العوامل في حياة هؤلاء الأشخاص وقت للتأثير على النتائج. في الواقع ، نظهر هنا أن مجرد إضافة استهلاك السكروز إلى روتين الصباح لمدة 12 يومًا قد يكون له تأثير على الإجراءات الملزمة التي تم الحصول عليها بعد أسبوعين. قد تؤثر عوامل أخرى شائعة مثل لعب ألعاب الفيديو والتسوق وإدخال علاقات رومانسية جديدة وممارسة النشاط الجنسي أو استخدام العقاقير أو تغيير النظام الغذائي وممارسة التمارين الرياضية على مستويات الدوبامين خارج الخلية مع احتمال حدوث تباين كبير في مجموعات البيانات. قدمت الدراسة الحالية في minipigs مجموعة جيدة التحكم مع المتغير الوحيد هو عدم وجود أو وجود السكروز في النظام الغذائي. في هذا السياق ، كان للبيانات من سبعة حيوانات تباين منخفض بما فيه الكفاية في المناطق ذات الصلة خارج المجرى الخارجي لتحديد انخفاض ذي دلالة إحصائية للربط استجابة للسكروز.
وجود قيود على الدراسة الحالية هو استخدام التخدير اللازم لضمان عدم الحركة أثناء في الجسم الحي تصوير الحيوانات. آثار التخدير النوعي ، وتفاعلاتها مع العقاقير أو التدخلات الأخرى ، يمكن أن تربك ارتباط الأشعة الراديوية89,90. الكيتامين هو دواء مضاد للجلوتامينات له تأثيرات مضادة للاكتئاب السريعة في الجرعات شبه المخدرة91,92,93، وهذا لا يقلل من الهجوم11C] ملزمة raclopride في البشر94. ومع ذلك ، تم العثور على S-ketamine للحد من توفر ملزم لمستقبلات الدوبامين D2 / 3 في المخطط من الرئيسيات غير البشرية واعية95. Isoflurane هو مخدر شائع في الحيوانات الأليفة. في الدراسات السابقة ، وجدنا تراكمًا خطيرًا لـ [11C] SCH23390 ، هو عبارة عن إشارة إشعاعية لمستقبلات الدوبامين D1 لتكون أعلى بكثير في minipigs تخدير مع الأيزوفلورين بدلا من البروبوفول ، مما يشير إلى قابلية للإرسال العصبي الدوبامين لآثار التخدير96. في الدراسة الحالية ، تم تصوير جميع minipigs في كل من النقاط الزمنية تحت الكيتامين قبل الأدوية والتخدير الأيزوفلورين ، مما يجعل المقارنات الحالية صالحة.
وفي الختام
قد يؤدي الإفراط في تناول الطعام المستساغ إلى إدمان عواقب مباشرة على الصحة بسبب السمنة ، ويصبح نتيجة لذلك. اختبرنا الادعاء بأن المواد الأفيونية والدوبامين تتوسط في المكافآت ، وهي مهمة للبقاء على قيد الحياة وكذلك لتعاطي المخدرات. أظهرت Minipigs ذات الوصول المتقطع إلى محلول السكروز في 12 يومًا متتاليًا انخفاض توافر مستقبلات الدوبامين D2 / 3 و io −ovio في مناطق الدماغ القاتلة وخارج الخلية ، مما يعني ضمناً أن الأطعمة التي تحتوي على نسبة عالية من السكروز تؤثر على دوائر مكافأة الدماغ بطرق مماثلة لتلك التي لوحظت عند إدمان المخدرات يتم استهلاكها. كان التعرض الأولي للسكروز متسقًا مع إطلاق الأفيونيات في مناطق المخ النشطة في المكافأة. التغييرات في توافر المواد الأفيونية والدوبامين تفسر إمكانات الإدمان للسكروز المستهلكة الزائدة.
مواد وطرق
أخلاقيات الحيوان
تمت الموافقة على هذه الدراسة وتنظيمها من قِبل مفتشية التجارب على الحيوانات الدنماركية ، وتم إجراء جميع التجارب وفقًا لتوجيهات الاتحاد الأوروبي 2010/63 / EU الصادرة عن البرلمان الأوروبي ومجلس حماية الحيوانات المستخدمة للأغراض العلمية وإرشادات ARRIVE. استخدمنا سبعة minipigs غوتنغن الإناث البالغ من العمر أربعة عشر شهرا (Ellegaard ، Dalmose ، الدنمارك). تم إطعام الحنطة الصغيرة (الحنطة الصغيرة) بنظام حبيبي (6 مل ، مرتين يوميًا ، خدمات الحمية الخاصة ، آرهوس ، الدنمارك) مع توفر مياه الصنبور libitum الإعلانية. كانت درجة الحرارة البيئية 20-22 درجة مئوية ، والرطوبة النسبية 50-55 ٪ ، وتغير الهواء ثماني مرات كل ساعة.
استهلاك السكروز المتقطع
قمنا بتصوير سبعة minipigs مع [11C] raclopride و [11C] carfentanil في الأساس ، ومرة أخرى بعد يوم واحد من 12 يومًا متتاليًا من التعرض لمياه السكروز. تأثر التعرض للسكروز بساعة واحدة من السكروز (سكروز ، دانسوكير ، كوبنهاغن ، الدنمارك) للوصول إلى المياه (500 جرام من السكروز في 2 لتر من الماء) ، يوميًا خلال فترة 12 يومًا. تم تسجيل كمية من السكروز واستهلكت جميع minipigs 2 لتر في كل يوم. قمنا أيضًا بتصوير خمسة من نفس minipigs باستخدام [11C] كارفنتانيل ، بعد 30 دقيقة من وصول السكروز لأول مرة ، من أجل دراسة إطلاق المواد الأفيونية الحادة.
اكتسبت minipigs متوسط 13.6 ٪ من وزن الجسم من 25.4 كجم (± 0.73 SEM) عند خط الأساس إلى 28.9 كجم (± 0.69 SEM) بعد التعرض للسكروز لمدة 12 يومًا ، والذي كان أعلى بكثير (اختبار t وحيد الذيل ، p < 0.001) من الزيادات الملحوظة في عينة من minipigs الضابطة التي تم الحصول عليها في الدراسات السابقة ، حيث زادت الأوزان في المتوسط بنسبة 4.9 ٪ فقط ، خلال نفس فترة النمو.
تصوير الدماغ PET
صومنا الخنازير بين عشية وضحاها مع حرية الوصول إلى المياه قبل التصوير. نحن minipigs قبل العلاج والتخدير كما هو موضح سابقا97 ووضعها ضعيفًا في جهاز PET / CT (Siemens Biograph 64 Truepoint PET). أجرينا فحص CT جرعة منخفضة قبل كل اكتساب PET للتعريف التشريحي وتصحيح التوهين من بيانات الانبعاثات PET. نحن تدار عن طريق الوريد [11C] raclopride في الأساس (360 ± 18 MBq ، نشاط محدد 77 ± 76 GBq / μmol ، الكتلة المحقونة 0.12 ± 0.08 ميكروغرام / كجم) وبعد 12 يومًا من السكروز (374 ± 54 MBq ، نشاط محدد 127 ± 85 GBq / μmol ، الكتلة المحقونة 0.06 ± 0.05 ميكروغرام / كغ) ، و [11C] carfentanil في الأساس (377 ± 43 ميغابايت في المليون ، نشاط محدد 311 ± 195 GBq / μmol ، الكتلة المحقونة 0.03 ± 0.02 ميكروغرام / كيلوغرام) وبعد 12 يومًا من السكروز (337 ± 71 ميغابايت ، النشاط المحدد 177 ± 157 GBq / μmol ، الكتلة المحقونة 0.06 ± 0.08 ميكروغرام / كجم) عن طريق الوريد الأذن ، في 10 مل ملحي ، خلال الدقيقة الأولى من المسح لمدة 90 دقيقة. قمنا بإعادة بناء بيانات PET باستخدام TrueX 3D OSEM (3 تكرارات ، 21 مجموعة فرعية) ، مصفوفة 256 × 256 × 109 ، ومرشح Gauss 2 مم ، باستخدام هيكل إطار زمني يبلغ 5 × 60 ، 3 × 300 ، 4 × 600 ، 2 × 900 ثانية (إجمالي 14 إطارًا ، 90 دقيقة). في الأساس وبعد 12 يومًا من السكروز ، تم تصوير minipigs مع حقن كل من الراسمين على الأقل 100 دقيقة ، بسبب عمر النصف لـ [11ج] مقتطفات PET. عند الانتهاء من الجلسة النهائية للحيوانات الأليفة ، قمنا بتخسيس الحيوانات المصغرة تحت التخدير العميق من خلال جرعة زائدة من الوريد بنتوباربيتال (100 ملغ / كلغ).
التحليلات الكمية والإحصاءات
أجرينا خطوات ما قبل المعالجة باستخدام PMOD 3.7 (PMOD Technologies Ltd ، زيورخ ، سويسرا). لتحديد معلمات التحول التجسيمي من الصور PET متوسط الوقت ، استخدمنا قوالب يجند محددة. طبقنا مصفوفات التحويل المولدة وحقول التزييف على السلسلة الزمنية الديناميكية المقابلة لـ PET. لقد أنشأنا صورًا حدوديًا لـ [11C] raclopride ملزمة المحتملة (BPND) عن طريق طريقة الأنسجة المرجعية متعددة الخطوط من Ichise وزملاء العمل98. لقد أنشأنا قناعًا مخصصًا للمخيخ استبعد الفصيلة للحصول على النشاط الإشعاعي للأنسجة المخيخية بمرور الوقت في منطقة ذات كثافة مستقبلات DA D2 / 3 لا تُذكر. لقد أنشأنا صورًا حدوديًا لـ [11C] كارفنتانيل باستخدام تطبيق نموذج الأنسجة المرجعية لوغان99,100 مع ر * = 30 دقيقة. دراسات [11C] carfentanil ملزمة في الدماغ البشري قد استخدمت القشرة القذالية كمنطقة مرجعية36. ومع ذلك ، في الخنازير ، وفقًا لمنحنيات النشاط الزمني ، كان الارتباط غير القابل للاستبدال أقل في المخيخ منه في القشرة القذالية ، بما يتوافق مع النتائج التي توصلت إليها دراسة تصوير أشعة الفئران101. لذلك اخترنا المخيخ كمنطقة مرجعية في الدراسة الحالية.
تحليل احصائي
خضعنا الخرائط لتحليل فوكسل باستخدام الخرائط الإحصائية غير البارامترية (SnPM v13.01 ، http://warwick.ac.uk/snpmصندوق أدوات SPM الذي يستخدم نظرية التقليب غير البارامترية لتوفير إطار للاستدلال الإحصائي ، وهو نهج يظهر للعمل بشكل جيد للعينات الصغيرة بسبب السيطرة الصارمة على الإيجابيات الخاطئة14 وتطبيقها كما هو موضح سابقا102. قارن خبير في التشريح العصبي للخنازير (DO) الصور الناتجة ذات العتبة بمستوى دلالة 5 ٪ إلى أطلس Göttingen minipig عالي الدقة103,104 لتحديد وتسمية مناطق انخفضت DA D2 / 3 و μOR BPND من الأساس إلى حالة ما بعد السكروز. ثم أجرينا تحليلًا لمنطقة الاهتمام (ROI) لاستخراج BPND قيم المناطق المحددة التي تم تحديدها ذات أهمية بناءً على تحليل SnPM ، بما في ذلك المخطط ، النواة المتكئة ، المهاد ، اللوزة ، القشرة الحزامية وقشرة الفص الجبهي. لم يتم إجراء أي إحصاءات إضافية على تحليل العائد على الاستثمار ، حيث تم بالفعل العثور على هذه المناطق لتكون مهمة باستخدام SnPM.
مراجع حسابات
- 1.
Smyth، S. & Heron، A. مرض السكري والسمنة: وباء التوأم. نات ميد 12، 75 – 80 ، https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal، KM، Carroll، MD، Ogden، CL & Curtin، LR انتشار واتجاهات السمنة بين البالغين في الولايات المتحدة ، 1999-2008. JAMA 303، 235 – 241 ، https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
ديفيس ، كاليفورنيا وآخرون. الدوبامين عن "الرغبة" والمواد الأفيونية لـ "الإعجاب": مقارنة بين البالغين الذين يعانون من السمنة المفرطة مع أو بدون تناول الشراهة. السمنة (الربيع الفضي) 17، 1220 – 1225 ، https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski ، A. السمنة والبيئة الغذائية: كثافة الطاقة الغذائية وتكاليف النظام الغذائي. المجلة الأمريكية للطب الوقائي 27، 154 – 162 ، https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir ، M. ، Serre ، F. ، Cantin ، L. & Ahmed ، SH الحلاوة الشديدة تفوق مكافأة الكوكايين. بلوس واحد 2، 698 ، https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed، S.، Avena، NM، Berridge، KC، Gearhardt، A. & Guillem، K. In علم الأعصاب في القرن الحادي والعشرين (ed. Phaff، DW) (Springer، 2012).
- 7.
Avena، NM، Gold، JA، Kroll، C. & Gold، MS تطورات أخرى في البيولوجيا العصبية للأغذية والإدمان: تحديث عن حالة العلم. ركن المعلومات الغذائية 28، 341 – 343 ، https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
ليتون ، م متعة الدماغ (محرران Kringelbach ، ML & Berridge ، KC) (مطبعة جامعة أكسفورد ، 2010).
- 9.
Nathan، PJ & Bullmore، ET من مذاق مذاق المتعة إلى الدافع التحفيزي: مستقبلات ميو الأفيونية المركزية وسلوك الأكل بنهم. الباحث J Neuropsychopharmacol 12، 995 – 1008 ، https://doi.org/10.1017/S146114570900039X (2009).
- 10
Berridge ، مكافأة الغذاء KC: ركائز الدماغ من الرغبة وتروق. علم الأعصاب والمراجعات biobehavioral 20، 1 – 25 (1996).
- 11
Gjedde، A.، Wong، DF، Rosa-Neto، P. & Cumming، P. رسم خرائط المستقبلات العصبية في العمل: حول تعريف وتفسير إمكانات الربط بعد 20 عامًا من التقدم. Int Rev Neurobiol 63، 1 – 20 ، https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12
Avena، NM، Bocarsly، ME & Hoebel، BG نماذج حيوانية من السكر والدهون: العلاقة مع الإدمان على الطعام وزيادة وزن الجسم. طرق مول بيول 829، 351 – 365 ، https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13
جيلسينج ، ج. وآخرون. قشرة الفص الجبهي في دماغ جوتينجن minipig المعرّفة بمعايير الإسقاط العصبي والهندسة الإلكترونية. الدماغ الدقة الثور 70، 322 – 336 ، https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14
Nichols، TE & Holmes، AP اختبارات التقليب اللامعلمية للتصوير العصبي الوظيفي: كتاب تمهيدي مع أمثلة. هموم الدماغ ماب 15، 1 – 25 (2002).
- 15
Avena، NM، Rada، P. & Hoebel، BG دليل على إدمان السكر: التأثيرات السلوكية والكيميائية العصبية للإفراط في تناول السكر بشكل متقطع. علم الأعصاب والمراجعات biobehavioral 32، 20 – 39 ، https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16
ألونسو ألونسو وآخرون. نظام المكافآت الغذائية: المنظورات الحالية واحتياجات البحوث المستقبلية. نوت آر 73، 296 – 307 ، https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17
Figlewicz ، DP ، Bennett-Jay ، JL ، Kittleson ، S. ، Sipols ، AJ & Zavosh ، A. الإدارة الذاتية للسكروز وتفعيل الجهاز العصبي المركزي في الفئران. Am J Physiol Regul Integr Comp Physiol 300، R876 - 884 ، https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18
Tellez، LA وآخرون. دوائر منفصلة ترميز القيم الغذائية والتغذوية للسكر. علم الأعصاب الطبيعة 19، 465 – 470 ، https://doi.org/10.1038/nn.4224 (2016).
- 19
كولانتوني ، سي. وآخرون. يغيّر تناول السكر المفرط الارتباط بمستقبلات الدوبامين ومفيونيات الأفيون في المخ. Neuroreport 12، 3549 – 3552 (2001).
- 20
Pert ، CB ، Kuhar ، MJ & Snyder ، SH مستقبلات الأفيون: التوطين الذاتي في دماغ الفئران. Proc Natl Acad Sci USA 73، 3729 – 3733 (1976).
- 21
Soderman ، AR & Unterwald ، مكافأة الكوكايين وفرط النشاط في الفئران: مواقع تعديل مستقبلات الأفيون. علم الأعصاب 154، 1506 – 1516 ، https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22
يؤثر Ward ، SJ ، Martin ، TJ & Roberts ، DC Beta-funaltrexamine على الإدارة الذاتية للكوكايين في الفئران التي تستجيب وفقًا لجدول معدل تدريجي للتعزيز. الصيدلة والكيمياء الحيوية والسلوك 75، 301 – 307 (2003).
- 23
شرودر ، JA وآخرون. دور لمستقبلات الأفيونيات مو في النشاط الناجم عن الكوكايين ، والتوعية ، والمكافأة في الفئران. علم الادوية النفسية 195، 265 – 272 ، https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24
Tang، XC، McFarland، K.، Cagle، S. & Kalivas، PW يتطلب إعادة الحالة التي يسببها الكوكايين تحفيزًا داخليًا لمستقبلات mu-opioid في الشاحبة البطنية. مجلة علم الأعصاب: الجريدة الرسمية لجمعية علم الأعصاب 25، 4512 – 4520 ، https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25
Tuulari ، JJ وآخرون. إصدارات التغذية الأفيونيات الذاتية في البشر. J Neurosci 37، 8284 – 8291 ، https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26
سميث ، KS & Berridge ، KC دائرة حوفية أفيونية للمكافأة: التفاعل بين النقاط الساخنة اللذيذة للنواة المتكئة والشاحبة البطنية. J Neurosci 27، 1594 – 1605 ، https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27
Pecina، S. & Berridge، KC موقع المواد الأفيونية في nucleus accumbens shell يتوسط الأكل و "الإعجاب" اللذيذ للطعام: الخريطة على أساس أعمدة الحقن المجهري. الدماغ الدقة 863، 71 – 86 (2000).
- 28
Zhang، M. & Kelley، AE يتم زيادة تناول محاليل السكرين والملح والإيثانول عن طريق ضخ ناهض أفيوني مو في النواة المتكئة. علم الادوية النفسية 159، 415 – 423 ، https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29
Zhang ، M. ، Gosnell ، BA & Kelley ، AE يتم تحسين تناول الأطعمة الغنية بالدهون بشكل انتقائي عن طريق تحفيز مستقبلات الأفيون داخل النواة المتكئة. مجلة الصيدلة والعلاجات التجريبية 285، 908 – 914 (1998).
- 30
Levine، AS، Weldon، DT، Grace، M.، Cleary، JP & Billington، CJ Naloxone يحجب هذا الجزء من التغذية مدفوعًا بالمذاق الحلو في الفئران المقيدة بالطعام. انا J Physiol 268، R248-252 (1995).
- 31
Glass، MJ، Billington، CJ & Levine، AS المواد الأفيونية وتناول الطعام: مسارات عصبية وظيفية موزعة؟ نيوروببتيد 33، 360 – 368 ، https://doi.org/10.1054/npep.1999.0050 (1999).
- 32
Fantino، M.، Hosotte، J. & Apfelbaum، M. يقلل أحد مضادات الأفيون ، النالتريكسون ، من تفضيل السكروز في البشر. انا J Physiol 251، R91 - 96 ، https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33
Arbisi، PA، Billington، CJ & Levine، AS تأثير النالتريكسون على اكتشاف التذوق والتعرف عليه. شهية 32، 241 – 249 ، https://doi.org/10.1006/appe.1998.0217 (1999).
- 34
Drewnowski ، A. ، Krahn ، DD ، Demitrack ، MA ، Nairn ، K. & Gosnell ، BA Naloxone ، وهو مانع للأفيون ، يقلل من استهلاك الأطعمة الغنية بالدهون الحلوة في النساء البدينات والأكل بنهم. J صباحا كلين نوتر 61، 1206 – 1212 (1995).
- 35
تحدد دوائر Wassum و KM و Ostlund و SB و Maidment و NT و Balleine و BW استساغة واستحسان الأحداث المجزية. Proc Natl Acad Sci USA 106، 12512 – 12517 ، https://doi.org/10.1073/pnas.0905874106 (2009).
- 36
كولاسانتي ، أ. وآخرون. إطلاق المواد الأفيونية الذاتية في نظام المكافآت في الدماغ البشري الناجم عن تناول الأمفيتامين الحاد. بيول الطب النفسي 72، 371 – 377 ، https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37
ميك ، اولا وآخرون. تسبب الأمفيتامين في إطلاق الأفيونيات الذاتية في الدماغ البشري المكتشف بواسطة [11C] كارفنتانيل PET: التكرار في مجموعة مستقلة. الباحث J Neuropsychopharmacol، 1 – 6 ، https://doi.org/10.1017/S1461145714000704 (2014).
- 38
Yeomans ، MR & Gray ، RW الببتيدات الأفيونية والتحكم في سلوك الابتلاع البشري. علم الأعصاب والمراجعات biobehavioral 26، 713 – 728 (2002).
- 39
Sprenger، T.، Berthele، A.، Platzer، S.، Boecker، H. & Tolle، TR ما الذي يمكن التعلم منه في الجسم الحي تصوير الدماغ opioidergic؟ EUR J الألم 9، 117 – 121 ، https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40
Unterwald، EM & Cuntapay، M. تفاعلات الدوبامين-الأفيونية في مخطط الفئران: دور تعديل لمستقبلات الدوبامين D1 في نقل الإشارات بوساطة مستقبلات الأفيون في دلتا. الجهاز العصبي 39، 372 – 381 (2000).
- 41
بن شريف ، ب. وآخرون. انخفاض مستقبلة mu-opioid الإقليمية في القشرة المعزولة في الشره المرضي العصبي ويرتبط عكسيا مع سلوك الصيام. مجلة الطب النووي: منشور رسمي ، جمعية الطب النووي 46، 1349 – 1351 (2005).
- 42
كارلسون ، هونج كونج وآخرون. ترتبط السمنة بانخفاض مستوى مستقبلات الدوبامين D2 غير المتغيرة ولكن دون تغيير في المخ. J Neurosci 35، 3959 – 3965 ، https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43
كارلسون ، هونج كونج وآخرون. فقدان الوزن بعد جراحة لعلاج البدانة تطبيع مستقبلات الأفيون في المخ في السمنة المرضية. الطب النفسي للمل 21، 1057 – 1062 ، https://doi.org/10.1038/mp.2015.153 (2016).
- 44
Burghardt ، PR ، Rothberg ، AE ، Dykhuis ، KE ، Burant ، CF & Zubieta ، JK آليات المواد الأفيونية الذاتية متورطة في السمنة وفقدان الوزن عند البشر. J Clin Endocrinol Metab 100، 3193 – 3201 ، https://doi.org/10.1210/jc.2015-1783 (2015).
- 45
ماجوري ، ج. وآخرون. الدوبامين والأفيونيات العصبية في الإدمان السلوكي: دراسة PET مقارنة في القمار المرضي والأكل بنهم. Neuropsychopharmacology 42، 1169 – 1177 ، https://doi.org/10.1038/npp.2016.265 (2017).
- 46
Vucetic، Z.، Kimmel، J. & Reyes، TM يؤدي النظام الغذائي المزمن عالي الدهون إلى التنظيم اللاجيني لما بعد الولادة لمستقبلات الأفيون في الدماغ. علم الأدوية العصبية: منشور رسمي للكلية الأمريكية لعلم الأدوية العصبية 36، 1199 – 1206 ، https://doi.org/10.1038/npp.2011.4 (2011).
- 47
Mena، JD، Sadeghian، K. & Baldo، BA تحريض فرط الأكل وتناول الكربوهيدرات عن طريق تحفيز مستقبلات ميو أفيونية المفعول في المناطق المقيدة من القشرة الأمامية. مجلة علم الأعصاب: الجريدة الرسمية لجمعية علم الأعصاب 31، 3249 – 3260 ، https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48
Park، K.، Volkow، ND، Pan، Y. & Du، C. يثبط الكوكايين المزمن إشارات الدوبامين أثناء تسمم الكوكايين وعدم التوازن D1 فوق إشارات مستقبلات D2. مجلة علم الأعصاب: الجريدة الرسمية لجمعية علم الأعصاب 33، 15827 – 15836 ، https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49
كومينغ ، P. وآخرون. آثار النيكوتين الحاد على ديناميكا الدم وربط [11C] رايزلوبريد لمستقبلات الدوبامين D2,3،XNUMX في الدماغ الخنازير. NeuroImage 19، 1127 – 1136 (2003).
- 50
Moore، RJ، Vinsant، SL، Nader، MA، Porrino، LJ & Friedman، DP تأثير تعاطي الكوكايين الذاتي على مستقبلات الدوبامين D2 في قرود الريسوس. المشبك 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51
فولكو ، إن دي وآخرون. إشارات الكوكايين والدوبامين في المخطط الظهري: آلية الرغبة في إدمان الكوكايين. مجلة علم الأعصاب: الجريدة الرسمية لجمعية علم الأعصاب 26، 6583 – 6588 ، https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52
وونغ ، DF وآخرون. زيادة شغل مستقبلات الدوبامين في المخطط البشري أثناء شغف الكوكايين الناشئ عن الإشعال. Neuropsychopharmacology 31، 2716 – 2727 ، https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53
Hajnal، A.، Smith، GP & Norgren، R. يزيد تحفيز السكروز الفموي من الدوبامين المتكئ في الفئران. Am J Physiol Regul Integr Comp Physiol 286، R31 - 37 ، https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54
فولكو ، إن دي ، فاولر ، جي إس ، وانج ، جي جي ، بالير ، آر وتيلانج ، إف تصوير دور الدوبامين في تعاطي المخدرات والإدمان. الجهاز العصبي 56(ملحق 1) ، 3-8 ، https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55
وانج ، جي وآخرون. دماغين دماغ و السمنة. مبضع 357، 354 – 357 (2001).
- 56
Wang ، GJ ، Volkow ، ND ، Thanos ، PK & Fowler ، JS التشابه بين السمنة وإدمان المخدرات كما تم تقييمه بواسطة التصوير الوظيفي العصبي: مراجعة المفهوم. مجلة أمراض الادمان 23، 39 – 53 ، https://doi.org/10.1300/J069v23n03_04 (2004).
- 57
Johnson، PM & Kenny، PJ Dopamine D2 مستقبلات في ضعف المكافأة الشبيه بالإدمان والأكل القهري في الفئران البدينة. علم الأعصاب الطبيعة 13، 635 – 641 ، https://doi.org/10.1038/nn.2519 (2010).
- 58
Berridge، KC & Kringelbach، ML علم الأعصاب الوجداني للمتعة: المكافأة في البشر والحيوانات. علم الادوية النفسية 199، 457 – 480 ، https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59
Berridge، KC & Kringelbach، ML أنظمة المتعة في الدماغ. الخلايا العصبية 86، 646 – 664 ، https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60
شولتز ، دبليو إشارة تنبؤية مكافأة من الخلايا العصبية الدوبامين. ي Neurophysiol 80، 1 – 27 ، https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61
Val-Laillet، D.، Layec، S.، Guerin، S.، Meurice، P. & Malbert، CH التغيرات في نشاط الدماغ بعد السمنة التي يسببها النظام الغذائي. • السمنة . 19، 749 – 756 ، https://doi.org/10.1038/oby.2010.292 (2011).
- 62
Hajnal، A. & Norgren، R. Accumbens آليات الدوبامين في تناول السكروز. الدماغ الدقة 904، 76 – 84 (2001).
- 63
Rada، P.، Avena، NM & Hoebel، BG يؤدي الإفراط في تناول السكر يوميًا بشكل متكرر إلى إطلاق الدوبامين في الغلاف المتكئ. علم الأعصاب 134، 737 – 744 ، https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64
Bello، NT، Lucas، LR & Hajnal، A. يؤثر الوصول المتكرر للسكروز على كثافة مستقبلات الدوبامين D2 في المخطط. Neuroreport 13، 1575 – 1578 (2002).
- 65
ألسو ، ج. وآخرون. يتناقص التعبير الجيني لمستقبل الدوبامين D1 في النواة المتكاثرة عند التعرض الطويل الأمد للأطعمة المستساغة ويختلف تبعًا للنمط الظاهري للسمنة الذي يسببه النظام الغذائي في الفئران. علم الأعصاب 171، 779 – 787 ، https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66
Bassareo، V. & Di Chiara، G. التأثير التفاضلي لآليات التعلم النقابي وغير الترابطي على استجابة انتقال الدوبامين قبل الجبهية والتراكم إلى المحفزات الغذائية في الفئران التي تتغذى على الشهرة. J Neurosci 17، 851 – 861 (1997).
- 67
Volkow ، ND ، Wang ، GJ ، Tomasi ، D. & Baler ، RD الدوائر العصبية غير المتوازنة في الإدمان. Curr Opin Neurobiol 23، 639 – 648 ، https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68
Brogan ، A. ، Hevey ، D. & Pignatti ، R. Anorexia ، الشره المرضي ، والسمنة: عجز صنع القرار المشترك في مهمة Iowa للمقامرة (IGT). J Int Neuropsychol Soc 16، 711 – 715 ، https://doi.org/10.1017/S1355617710000354 (2010).
- 69
Davis، C.، Levitan، RD، Muglia، P.، Bewell، C. & Kennedy، JL عجز اتخاذ القرار والإفراط في الأكل: نموذج خطر للسمنة. البدائل الدقة 12، 929 – 935 ، https://doi.org/10.1038/oby.2004.113 (2004).
- 70
فولكو ، إن دي وآخرون. ترتبط انخفاض مستقبلات الدوبامين D2 الفتاك مع الأيض قبل الجبهي في الأشخاص الذين يعانون من السمنة المفرطة: العوامل المساهمة المحتملة. NeuroImage 42، 1537 – 1543 ، https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71
تتفاعل النواة المركزية Lingawi، NW & Balleine، BW Amygdala مع المخطط الظهري الجانبي لتنظيم اكتساب العادات. J Neurosci 32، 1073 – 1081 ، https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72
منح. وآخرون. تنشيط دوائر الذاكرة أثناء حنين الكوكايين الناشئ عن الإشارات. Proc Natl Acad Sci USA 93، 12040 – 12045 (1996).
- 73
تشايلدرس ، AR وآخرون. تفعيل الحوفي أثناء شغف الكوكايين الناجم عن جديلة. صباحا J الطب النفسي 156، 11 – 18 ، https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74
Mahler، SV & Berridge، KC ماذا ومتى "تريد"؟ التركيز القائم على Amygdala على بروز الحافز على السكر والجنس. علم الادوية النفسية 221، 407 – 426 ، https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75
Koob، GF & Volkow، ND Neurobiology of addiction: a neurocircuit تحليل. انسيت الطب النفسي 3، 760 – 773 ، https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76
Haase، L.، Cerf-Ducastel، B. & Murphy، C. التنشيط القشري استجابة لمحفزات التذوق النقية أثناء الحالات الفسيولوجية للجوع والشبع. NeuroImage 44، 1008 – 1021 ، https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77
فوتروس ، أ. وآخرون. إطلاق الدوبامين الناجم عن الكوكايين في اللوزة والحصين: دراسة عالية الدقة PET [(1) (8) F] في المشاركين المعتمدين على الكوكايين. Neuropsychopharmacology 38، 1780 – 1788 ، https://doi.org/10.1038/npp.2013.77 (2013).
- 78
وايس ، واو وآخرون. السيطرة على سلوك الباحثين عن الكوكايين من خلال المنبهات المرتبطة بالمخدرات لدى الفئران: التأثيرات على استرداد مستويات الدوبامين المستجيبة للإجهاض المستنفذ ومستويات الدوبامين خارج الخلوي في اللوزة النواة المتكئة. Proc Natl Acad Sci USA 97، 4321 – 4326 (2000).
- 79
Berglind، WJ، Case، JM، Parker، MP، Fuchs، RA & See، RE Dopamine D1 أو D2 مستقبلات العداء داخل اللوزة الجانبية القاعدية يغير بشكل تفاضلي اكتساب جمعيات الكوكايين الضرورية لإعادة البحث عن الكوكايين المستحثة. علم الأعصاب 137، 699 – 706 ، https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80
تومينين ، إل. وآخرون. الشاذ الميزولاميك الدوبامين - الأفيون التفاعل في السمنة. NeuroImage 122، 80 – 86 ، https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81
شولتز ، دبليو إشارات الدوبامين السلوكية. اتجاهات neurosci 30، 203 – 210 ، https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82
تينج ، أكر وفان دير كوي ، د. البيولوجيا العصبية لتحفيز الأفيون. البرد الربيع حرب Perspect ميد 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83
Mamaligas ، AA ، Cai ، Y. & Ford ، تنظيم مستقبلات النيكوتين والأفيون CP لانتقال مستقبلات الدوبامين D2 بوساطة. جمهورية التشيك 6، 37834، https://doi.org/10.1038/srep37834 (2016).
- 84
نومورا ، ي. وآخرون. الانخفاض المرتبط بالعمر في توافر مستقبلات الدوبامين D2 / 3 المقاسة بـ [C-11] raclopride في مناطق الدماغ البشرية غير الهجومية: مقارنة بين أربع طرق. NeuroImage 41، T133 – T133 ، https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85
ألاكرتي ، ك. وآخرون. موثوقية طويلة الأجل لإعادة اختبار الاختبار لمدى مستقبل مستقبلات الدوبامين D2 / 3 الموصلة وخارجها: دراسة باستخدام [(11) C] raclopride و PET عالية الدقة. J Cereb Blood Flow Metab 35، 1199 – 1205 ، https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86
Piccini ، P. ، Pavese ، N. & Brooks ، DJ إطلاق الدوبامين الذاتية بعد التحديات الدوائية في مرض باركنسون. آن Neurol 53، 647 – 653 ، https://doi.org/10.1002/ana.10526 (2003).
- 87
ساواموتو ، ن. وآخرون. العجز المعرفي وإطلاق الدوبامين المهاجم في جبهة الشلل الرعاش. دماغ 131، 1294 – 1302 ، https://doi.org/10.1093/brain/awn054 (2008).
- 88
سفينسون ، JE وآخرون. صحة وموثوقية الكمي (11) جيم] الكربوهيدرات ملزمة في الدماغ البشري الحي. NeuroImage، 116143، https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89
تسوكادا ، هـ. وآخرون. التخدير Isoflurane يعزز الآثار المثبطة للكوكايين و GBR12909 على نقل الدوبامين: دراسات PET بالاشتراك مع غسيل الكلى في الدماغ القرد. الدماغ الدقة 849، 85 – 96 (1999).
- 90
حسون ، و. وآخرون. دراسة PET لربط [11C] raclopride في مخطط القط المستيقظ: آثار التخدير ودور تدفق الدم في المخ. المجلة الأوروبية للطب النووي والتصوير الجزيئي 30، 141 – 148 ، https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91
Serafini، G.، Howland، RH، Rovedi، F.، Girardi، P. & Amore، M. دور الكيتامين في الاكتئاب المقاوم للعلاج: مراجعة منهجية. Curr Neuropharmacol 12، 444 – 461 ، https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92
بيرمان ، آر إم وآخرون. الآثار المضادة للاكتئاب من الكيتامين في المرضى الذين يعانون من الاكتئاب. بيول الطب النفسي 47، 351 – 354 (2000).
- 93
Browne، CA & Lucki، I. الآثار المضادة للاكتئاب للكيتامين: الآليات الكامنة وراء مضادات الاكتئاب الجديدة سريعة المفعول. الجبهة Pharmacol 4، 161، https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94
أالتو ، س. وآخرون. الكيتامين لا يقلل من مستقبلات الدوبامين D2 المميتة في الإنسان. علم الادوية النفسية 164، 401 – 406 ، https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95
هاشيموتو ، K. ، Kakiuchi ، T. ، Ohba ، H. ، Nishiyama ، S. & Tsukada ، H. تقليل ارتباط مستقبلات الدوبامين D2 / 3 في المخطط بعد تناول واحد من الإسكيتامين ، ولكن ليس R-ketamine: PET الدراسة في القرود الواعية. يورو ارش الطب النفسي كلينيك Neurosci 267، 173 – 176 ، https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96
Alstrup ، حزب العدالة والتنمية وآخرون. آثار التخدير والأنواع على امتصاص أو الربط من radioligands في الجسم الحي في غوتينجن minipig. BioMed البحوث الدولية 2013، 808713، https://doi.org/10.1155/2013/808713 (2013).
- 97
ليلثوروب ، TP وآخرون. التصوير PET أحادي الأمين الطولي للتثبيط البروتيني المزمن في minipigs. جمهورية التشيك 8، 15715، https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98
Ichise ، M. ، Toyama ، H. ، Innis ، RB & Carson ، استراتيجيات RE لتحسين تقدير معلمات المستقبلات العصبية عن طريق تحليل الانحدار الخطي. J Cereb Blood Flow Metab 22، 1271 – 1281 ، https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99
لوغان ، ج. وآخرون. نسب حجم التوزيع دون أخذ عينات دم من التحليل الرسومي لبيانات PET. J Cereb Blood Flow Metab 16، 834 – 840 ، https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100
Endres، CJ، Bencherif، B.، Hilton، J.، Madar، I. & Frost، JJ القياس الكمي لمستقبلات الأفيون في الدماغ باستخدام [11C] carfentanil: طرق الأنسجة المرجعية. Nucl Med Biol 30، 177 – 186 (2003).
- 101
Panksepp، J. & Bishop، P. خريطة autoradiographic of (3H) diprenorphine ملزم في دماغ الفئران: آثار التفاعل الاجتماعي. الدماغ الدقة الثور 7، 405 – 410 (1981).
- 102
لانداو وآخرون. يؤثر التحفيز بالصدمة الكهربائية تفاضليًا [(11) C] MDL100,907،5 ملزمة لمستقبلات 2HTXNUMXA القشرية وتحت القشرية في دماغ الخنزير. ي Psychopharmacol، 269881119836212، https://doi.org/10.1177/0269881119836212 (2019).
- 103
Bjarkam ، CR ، Glud ، AN ، Orlowski ، D. ، Sorensen ، JCH & Palomero-Gallagher ، N. The telencephalon من Gottingen minipig ، الهندسة الخلوية وتشريح السطح القشري. العقل الهيكل 222، 2093 – 2114 ، https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104
أورلوسكي ، دي ، جلود ، إيه إن ، بالوميرو غالاغر ، إن. ، سورنسن ، جي سي إتش وبياركام ، سي آر أطلس النسيج على الإنترنت لدماغ جوتنجن الصغير. Heliyon 5، 01363 ، https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
شكر وتقدير
قامت جامعة آرهوس "منحة تطوير مشروع أفكار الاتحاد الأفريقي" لـ AML بتمويل الدراسة. نحن ممتنون للدعم الفني من فريق العمل في مستشفى PET في مستشفى آرهوس الجامعي ومزرعة جامعة آرهوس للمساعدة في علاج الحيوانات. نشكر البروفيسور مورتن كرنباخ والأستاذ يورغن شيل كروغر والأستاذ المشارك آرني مولر للمساعدة في بدء هذه الدراسات.
تصريحات الأخلاق
تضارب المصالح
المؤلفون لا يعلنون عن مصالح متنافسة.
تفاصيل اضافية
ملاحظة الناشر تظل Springer Nature محايدة فيما يتعلق بالمطالبات القضائية في الخرائط المنشورة والانتساب المؤسسي.
الحقوق والأذونات
فتح وصول تم ترخيص هذه المقالة بموجب ترخيص Creative Commons Attribution 4.0 الدولي ، الذي يسمح بالاستخدام والمشاركة والتكيف والتوزيع والاستنساخ بأي وسيلة أو تنسيق ، طالما أنك تمنح الائتمان المناسب للمؤلف (المؤلفين) الأصليين والمصدر الأصلي ، الارتباط برخصة المشاع الإبداعي ، واذكر ما إذا كانت التغييرات قد أجريت. يتم تضمين الصور أو مواد الطرف الثالث الأخرى في هذه المقالة في ترخيص المشاع الإبداعي الخاص بالمقال ، ما لم يرد خلاف ذلك في حد الائتمان للمادة. إذا لم يتم تضمين المواد في ترخيص المشاع الإبداعي للمقالة وكان استخدامك المقصود غير مسموح به بموجب اللوائح القانونية أو يتجاوز الاستخدام المسموح به ، فستحتاج إلى الحصول على إذن من مالك حقوق النشر مباشرةً. لعرض نسخة من هذا الترخيص ، تفضل بزيارة http://creativecommons.org/licenses/by/4.0/.