Neurosci Biobehav Rev. 2011 Jan; 35 (3): 939-55. doi: 10.1016 / j.neubiorev.2010.10.014. Epub 2010 Nov 2.
- 1Bernard B. Brodie Neurotieteen laitos, Cagliarin yliopisto, Cittadella Universitaria, 09042 Monserrato, CA, Italia. [sähköposti suojattu]
ABSTRAKTI
Oksitosiini on voimakas peniksen erektio, kun sitä injektoidaan keskushermostoon. Urosrotilla oksitosiinin ennalta erektiohoidon vaikutukselle herkin aivojen alue on hypotalamuksen paraventrikulaarinen ydin. Tämä ydin ja ympäröivät alueet sisältävät kaikkien oksitosinergisten neuronien solukappaleet, jotka ulottuvat hypotalamuksen ulkopuolisiin aivojen alueisiin ja selkäytimeen. Tämä tarkastelu osoittaa, että oksitosiini indusoi peniksen erektiota myös silloin, kun sitä injektoidaan joillakin näistä alueista (esim. Ventral tegmental -alue, hippokampuksen ventral subiculum, amygdala- ja toraco-lumban selkäydin posteromediaalinen kortikaalinen ydin). Mikroinjektiotutkimukset yhdistettynä aivojen sisäiseen mikrodialyysiin ja kaksoisimmunofluoresenssitutkimuksiin viittaavat siihen, että oksitosiini näillä alueilla aktivoituu suoraan tai epäsuorasti (pääasiassa glutamiinihapon kautta) mesolimbisilla dopaminergisilla neuroneilla. Ydinvoimalle vapautunut dopamiini puolestaan aktivoi hermosoluja, jotka johtavat incerto-hypotalamisten dopaminergisten neuronien aktivoitumiseen paraventrikulaariseen ytimeen. Tämä aktivoi ei vain selkäytimeen ulottuvia ja peniksen erektiota välittäviä oksitosinergisiä neuroneita, vaan myös niitä, jotka ulottuvat edellä mainittuihin epän hypotalamuksiin, moduloimalla suoraan tai välillisesti (glutamiinihapon kautta) mesolimbisten dopaminergisten neuronien aktiivisuutta, jotka ohjaavat motivaatiota ja palkkioita. Nämä hermoradat voivat yhdessä muodostaa monimutkaisen hypoteettisen piirin, jolla on merkitystä paitsi seksuaalisen aktiivisuuden kulutusvaiheessa (erektiohäiriö ja kopulaatio), myös seksuaalisen käyttäytymisen ennakointivaiheen motivoivissa ja palkitsevissa näkökohdissa.
1.Introduction
Peniksen erektio on miesten seksuaalinen vaste, jolla on keskeinen rooli nisäkkäiden, myös ihmisen, lisääntymisessä, ja se voidaan havaita myös erilaisissa tilanteissa kuin ne, jotka liittyvät tiukasti lisääntymiseen. Riippuen kontekstista, jossa peniksen erektio tapahtuu, sen säätelyyn osallistuvat erilaiset keskus- ja perifeeriset hermo- ja / tai humoraaliset mekanismit (ks. Meisel ja Sachs, 1994; Argiolas ja Melis, 1995, 2004, 2005; Sachs, 2000, 2007; McKenna, 2000; 2000: Giuliano ja Rampin, 2004, 2001, Andersson, 1995, Melis ja Argiolas, 2003a, 2002, Hull et ai., XNUMX). Keskeisimpiä välittäjäaineita ja neuropeptidejä, jotka kontrolloivat peniksen erektiota, tunnetaan parhaiten dopamiini, serotoniini, kiihottavat aminohapot, typpioksidi, adrenokortikotropiini, oksitosiini ja opioidipeptidit. Ne voivat helpottaa tai estää peniksen erektiota vaikuttamalla useisiin aivojen alueisiin, eli mediaalinen preoptinen alue, hypotalamuksen paraventrikulaarinen ydin, ventral tegmentaalialue, hippokampus, amygdala, stria terminaliksen sängyn ydin, ydin accumbens, medulla oblongata ja selkäydin (Taulukko 1) (katso Meisel ja Sachs, 1994; Witt ja Insel, 1994; Stancampiano et ai., 1994; Argiolas ja Melis, 1995, 2005; Argiolas, 1999; Bancila et ai., 2002; Giuliano ja Rampin, 2000; McKenna, 2000, Andersson, 2001, Hull et ai., 2002, Coolen et ai., 2004).
Oksitosiini, neurohypofyysinen peptidi, joka on tunnettu hormonaalisesta roolistaan imetyksessä ja synnytyksessä, on läsnä naisilla ja miehillä, ei vain neuroneissa, joissa on soluelimiä, jotka sijaitsevat neurohypofyysiin suuntautuvassa hypotalamuksen paraventricular- ja supraoptic-ytimissä, vaan myös neuroneissa, jotka ulottuvat paraventrikulaarisesta ytimestä ja ympäröivistä rakenteista extrahypothalamic-aivojen alueille (eli väliseinälle, ventral tegmental -alueelle, hippokampukselle, amygdalalle, medulla oblongatalle ja selkäytimelle). Näiden neuronien uskotaan osallistuvan useisiin keskeisiin toimintoihin, kuten muistiin, oppimiseen, affiliativiseen ja sosio-seksuaaliseen käyttäytymiseen, mukaan lukien peniksen erektio ja kopulaatiokäyttäytyminen (katso Buijs, 1978; Sofroniew, 1983; Argiolas ja Gessa, 1991; Pedersen et al. , 1992, Carter, 1992, Wagner ja Clemens, 1993, Ivell ja Russel, 1995, Carter et ai., 1997, Tang et ai., 1998, Veronneau-Longueville et ai., 1999). Oksitosiini helpottaa erektiohäiriötä ja urospuolista seksuaalista käyttäytymistä hiirillä, rotilla, kaneilla ja apinoilla (katso Argiolas ja Gessa, 1991; Carter, 1992; Pedersen et ai., 1992; Argiolas ja Melis, 1995, 2004; Argiolas, 1999, 1987; Argiolas, 1987). Tämä voi tapahtua myös ihmisillä, koska seksuaaliset ärsykkeet lisäävät plasman oksitosiinia, erityisesti siemensyöksyn aikana (Carmichael et ai., 1974; Murphy et ai., XNUMX) ja rintojen ja sukuelinten manipuloinnilla, jotka yleensä ilmenevät seksuaalisen yhdynnässä (Tindall, XNUMX).
Oksitosiinin helpottava vaikutus miesten seksuaaliseen käyttäytymiseen osoitettiin ensinnäkin suonensisäisen oksitosiinin kyvyllä alentaa latenssia ensimmäiselle siemensyöksylle ja hidastaa sukupuolielinten poistumista urospuolisista kaninoista, jotka oli yhdistetty vastaanottaviin naaraisiin (Melin ja Kihlstrom, 1963). Oksitosiinin seksuaaliset vaikutukset tunnistettiin kuitenkin lopullisesti vasta 1980-luvulla. Keskitetysti nanogrammoina annettu oksitosiini pystyi sitten indusoimaan peniksen erektiota (Argiolas et ai., 1985, 1986) ja parantamaan kopulaatiokäyttäytymistä (Arletti et ai., 1985) urosrotilla ja lisäämään lordoosia naaraspuolisilla rotilla (Arletti ja Bertolini, 1985, Caldwell et ai., 1986), ilmeisesti vaikuttamalla kohdun tyyppisiin oksitosiinergisiin reseptoreihin (katso Argiolas ja Melis, 1995, 2004; Argiolas, 1999; Melis ja Argiolas, 2003; Oksitosiini parantaa seksuaalista käyttäytymistä ei vain seksuaalisesti voimakkailla urosrotilla (Arletti et ai., 1985), vaan myös ikääntyneillä urosrotilla (Arletti et ai., 1990), ja hallitsevissa, mutta ei alaisissa urospuolisissa orava apinoissa (Winslow ja Insel , 1991).
Oksitosiinin proektektinen vaikutus on testosteroniriippuvainen, koska se poistetaan hypofysektomian ja kastraation avulla ja palautetaan täydentämällä testosteronia tai sen metaboliitteja, estradiolia ja 5_-dihydro-testosteronia yhdessä (Melis et ai., 1994a). Herkin aivojen alue oksitosiinin aiheuttaman peniksen erektion indusoimiseksi on hypotalamuksen (Melis et ai., 1986) paraventrikulaarinen ydin, josta kaikki ylimääräiset hypotalamuksen oksitosinergiset ulokkeet ovat peräisin (katso edellä). Tällöin oksitosiinin havaittiin kykenevän indusoimaan peniksen erektiota (ja haukottelua), kun sitä injektoidaan niin pieninä annoksina kuin 3 pmol (ks. Kohta 2.1 alla). Oksitosiinin aiheuttama peniksen erektio myös injisoitaessa kahdenvälisesti hippokampuksen CA1-kenttään, mutta ei selkäosa-alikalvoon (ks. Kohta 2.3 alla), lateraalinen väliseinä, caudate-ydin, mediaalinen preoptinen alue, hypotalamuksen ventromediaalinen ydin ja supraoptinen ydin (Melis et ai., 1986). Mitä tulee mekanismiin, jolla oksitosiini vaikuttaa paraventrikulaariseen ytimeen tämän seksuaalisen vasteen indusoimiseksi, lukuisat tutkimukset viittaavat siihen, että oksitosiini aktivoi omat neuronit. Tämän hypoteesin mukaisesti seksuaalinen vuorovaikutus lisää FOS: ta, joka on välitön varhaisen geenin c-fos geenituote paraventricularisissa oksitosinergisissä neuroneissa, jotka ulottuvat selkäytimeen ja jotka osallistuvat peniksen erektioon (ks. Witt ja Insel, 1994 ja viitteet siinä) ja seksuaalinen impotenssi (esim. aikuisen urosrotin kyvyttömyys kopuloida munasarjojen poistaman estrogeeni-progesteroniprime- soidun reseptorisen naisen kanssa) on liitetty urosrotiin, jossa on alhainen oksitosiinimRNA-taso hypotalamuksen paraventrikulaarisessa ytimessä (Arletti et. al., 1997).
Onko oksitosiini vaikuttanut seksuaalisen käyttäytymisen ennakointivaiheeseen tai kulutusvaiheeseen tällä hetkellä epäselvä. Koska oksitosiini indusoi peniksen erektiota ja oksitosiinin pääasiallinen vaikutus kopulaatiokäyttäytymiseen, on ejaculatory-jakson väheneminen urosrotilla (Arletti et ai., 1985), on järkevää olettaa, että peptidi parantaa seksuaalista suorituskykyä. Koska oksitosiini lisää myös sosio-seksuaalista vuorovaikutusta (katso Pedersen et ai., 1992; Carter et ai., 1997; Ivell ja Russel, 1995), ja oksitosiinireseptoriantagonistit estävät ei-kontakti erektioita (Melis et ai., 1999a), joka katsotaan seksuaalisen kiihottumisen indeksiin (ks. Sachs, 1997, 2000, 2007; Melis et ai., 1998, 1999b ja siinä olevat viitteet), oksitosiinin mahdollista roolia seksuaalisen kiihottumisen ja seksuaalisen motivaation suhteen ei voida sulkea pois.
Tässä katsauksessa esitetään yhteenveto julkaistuista ja julkaisemattomista viimeaikaisten tutkimusten tuloksista oksitosiini indusoi peniksen erektiota paitsi kun se injektoidaan hypotalamuksen paraventrikulaariseen ytimeen, mutta myös muihin hypotalamuksen ulkopuolisiin aivojen alueisiin, kuten ventral tegmental -alueeseen (Melis et ai., 2007, 2009a; Succu et ai., 2008), thippokampuksen ventral subiculum ja amygdalan takaosa (Melis et ai., 2009b, 2010), jotka ovat tärkeä osa limbistä järjestelmää ja joiden uskotaan olevan avainasemassa motivaatio- ja palkitsemisprosesseissa. Nämä tutkimukset osoittavat, että oksitosiini osallistuu hermopiireihin, joihin kuuluvat muut neurotransmitterit, kuten dopamiini ja glutamiinihappo, ja muut aivojen alueet, muut kuin paraventrikulaarinen ydin, esim. Ventral tegmental -alue, ydin accumbens, hippokampus ja alueet, joita ei vielä ole tunnistettu. Nämä piirit välittävät todennäköisesti vuorovaikutusta mesolimbisen ja incerto-hypotalamuksen dopaminergisen järjestelmän välillä, ja niillä ei ole merkitystä miesten seksuaalisen käyttäytymisen kulutusvaiheessa (esim. Peniksen erektio ja kopulaatio), vaan myös seksuaalisen motivaation ja seksuaalisen kiihottuminen, mikä tarjoaa hermosubstraatin seksuaalisen toiminnan motivoivien ja palkitsevien ominaisuuksien selittämiseksi.
2. Oksitosiini vaikuttaa peniksen erektioon vaikuttamalla eri aivojen alueilla
2.1. Hypotalamuksen paraventrikulaarinen ydin
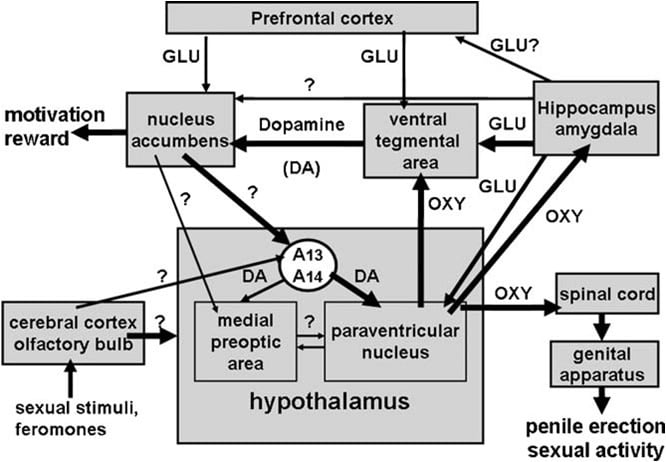
Kuten edellä mainittiin, hypotalamuksen paraventrikulaarinen ydin tunnistettiin pian aivojen alueeksi, joka oli herkin oksitosiinin pro-erektiohoidolle. Kun tätä ydintä injisoitiin yksipuolisesti, oksitosiini todettiin aktiiviseksi annoksilla, jotka olivat niin pieniä kuin 3 ng (3 pmol) (Melis et ai., 1986). Rakenne-aktiivisuussuhteiden tutkimukset osoittivat, että oksitosiinin indusoimaa peniksen erektiota välittivät uterinetyppi-oksitosiinireseptorit, jotka oli kytketty Ca2 + -virtaukseen oksitosinergisten hermosolujen solukappaleisiin, jotka ulottuvat hypotalamuksen ulkopuolisiin aivojen alueisiin ja typpioksidisyntaasin aktivoitumiseen. Typpioksidi vuorostaan toimimalla solunsisäisenä sanomanvälittäjänä, jolla on vielä tuntematon mekanismi (johon ei liity guanylaattisyklaasia) johtaa oksitosinergisten neuronien aktivoitumiseen selkäytimeen ja hypotalamuksen ulkopuolisiin aivojen alueisiin indusoimalla peniksen erektiota (kuva 1) alla ja Argiolas ja Melis, 1995, 2004, 2005 ja siinä olevat viitteet). Oksitosiinin kyky aktivoida omia neuronejaan
Kuva 1. (MISSING) Kaavamainen esitys oksitosinergisista neuroneista, jotka ovat peräisin hypotalamuksen paraventrikulaarisesta ytimestä ja projektista hypotalamuksen ulkopuolisille aivojen alueille, kuten selkäytimelle, VTA: lle, hippokampukselle, amygdalalle jne. dopamiini, eksitatoivat aminohapot, itse oksitosiini, heksareliinianalogiset peptidit ja VGF-johdetut peptidit johtavat peniksen erektioon, jota voidaan vähentää ja / tai poistaa stimuloimalla GABAergisia, opioidi- ja kannabinoidi- CB1-reseptoreita. Oksitosinergisten neuronien aktivoituminen on toissijainen näissä neuroneissa esiintyvän typpioksidisyntaasin aktivoinnin suhteen. Itse endogeeninen typpioksidi, joka muodostuu dopamiinin, eksitatoivien aminohappo- tai oksitosiinireseptorien tai eksogeenisen typpioksidin stimuloinnista, kuten sellainen, joka on peräisin typen oksidien luovuttajilta, annetaan suoraan paraventrikulaariseen ytimeen, aktivoi oksitosinergiset neuronit vielä tuntemattomalla mekanismilla, joka ei ilmeisesti ole yhteydessä guanylaattisyklaasin stimulointi. Tämä aiheuttaa vuorostaan oksitosiinin vapautumisen selkäytimessä ja hypotalamuksen ulkopuolisissa aivoissa. Jotkin yksityiskohdat mekanismeista, joilla oksitosiini indusoi peniksen erektiota, kun se vapautuu näillä alueilla, esim. VTA, ventral subiculum ja amygdala kuvataan vastaavissa aivojen alueen osissa. Tässä oksitosiini vaikuttaa omiin reseptoreihinsa ja lisää NO: n tuotantoa, mikä johtaa peniksen erektioon, kuten PVN: sta löytyy. Kuitenkin vaihteluvälin ollessa arvon mukaan verisuonissa VTA NO aktivoi guanylaattisyklaasia. Tämä aiheuttaa cGMP-pitoisuuden lisääntymisen, joka johtaa mesolimbisten dopaminergisten neuronien aktivoitumiseen ja peniksen erektioon. VS: ssä NO aktivoi glutamatergiset neuronit, jotka ulottuvat hippokampusalueille, mukaan lukien VTA. Glutamiinihappo VTA: ssa aktivoi vuorostaan mesolimbisia dopaminergisia neuroneja oksitosiinin kanssa. Edellä kuvatut kaltaiset mekanismit toimivat todennäköisesti myös silloin, kun peniksen erektio tapahtuu fysiologisissa yhteyksissä, nimittäin silloin, kun urosrotit sijoitetaan mahdottoman vastaanottavan naisen (esim. Koskematon erektio) läsnä ollessa tai kopulaation aikana.
paraventricularisessa ytimessä tuettiin tutkimuksia, jotka osoittivat, että: (1) oksitosiinireseptorit ovat läsnä tässä hypotalamuksessa (Freund-Mercier et ai., 1987; Freund-Mercier ja Stoeckel, 1995); (2) oksitosiini helpottaa sen omaa vapautumista in vitro ja in vivo (Freund-Mercier ja Richard, 1981, 1984; Moos et ai., 1984); ja (3) oksitosiini virittää omia neuronejaan vaikuttamalla paraventrikulaariseen ytimeen (Yamashita et ai., 1987). Lisäksi hypotalamuksen paraventrikulaarisessa ja supraoptisessa ytimessä on tunnistettu myös oksosyergisiä synapseja, jotka vaikuttavat magnosellulaaristen oksitosinergisten neuronien soluelimiin. (Theodosis, 1985). Lopuksi keskeisten oksitosiinergisten neuronien tuhoaminen paraventrikulaarisen ytimen elektrolyyttisillä tai kemiallisilla eksitotoksisilla vaurioilla, jotka poistavat kokonaan oksitosiinipitoisuuden koko keskushermostoon ja selkäytimeen, ei pelkästään oksitosiinin pro-erektio-vaikutusta, vaan myös heikentää lääkeaineen aiheuttamaa vaikutusta peniksen erektio ja koskematon erektio (katso alla ja Argiolas et ai., 1987a, b; Liu et ai., 1997 ja siinä olevat viitteet). Tulokset, jotka ovat samankaltaisia kuin paraventrikulaarisen ytimen leesiot, löytyvät voimakkaista ja selektiivisistä oksitosiinireseptoriantagonisteista. Itse asiassa nämä yhdisteet, jotka injektoitiin paraventrikulaariseen ytimeen nanogrammoina, estivät täysin oksitosiinin aiheuttaman peniksen erektion, kun taas sivuttaisiin kammioihin annettuna estettiin pelkästään oksitosiinin itsensä aiheuttama peniksen erektio, vaan myös huumeiden aiheuttama peniksen erektio (ks. Kohta 3 alla) ja Argiolas ja Melis, 1995, 2004, 2005 ja siinä olevat viitteet) ja ei-kontakti erektiot (Melis et ai., 1999a), ja ne olivat lisäksi erittäin tehokkaita heikentämään seksuaalisesti voimakkaiden urosrottien kopulaatiokäyttäytymistä (Argiolas et ai., 1988). Lisäksi seksuaalinen vuorovaikutus lisää FOS: a, joka on välitön varhaisen geenin c-fos geenituote paraventricularisissa oksitosinergisissä neuroneissa, jotka ulottuvat peniksen erektioon vaikuttavaan selkäytimeen (katso Witt ja Insel, 1994 ja siinä olevat viitteet). Lopuksi seksuaalinen impotenssi (esim. aikuisen urospuolisen rotan kyvyttömyys sekoittua estrogeeni-progesteroniprime- soidun reseptorisen naisen kanssa) hkuten myös urosrotissa, jossa on alhainen oksitosiini-mRNA-pitoisuus ja typpioksidisyntaasi hypotalamuksen paraventricularisessa ytimessä. (Benelli et ai., 1995; Arletti et ai., 1997) (näiden tutkimusten kattava katsaus on esitetty julkaisussa Argiolas, 1999; Argiolas ja Melis, 2004, 2005).
2.2. Ventral tegmental -alue
Ventral tegmentaalinen alue löydettiin vasta äskettäin aivoissa, jossa oksitosiini indusoi peniksen erektiota. Tämä alue sisältää oksityyppisiä hermopäätteitä, jotka ovat peräisin paraventrikulaarisesta ytimestä ja oksitosiinireseptoreista (Freund-Mercier et ai., 1987; Vaccari et ai., 1998). Tarkemmin sanottuna oksitosiini havaittiin kykeneväksi inisucing peniksen erektio, kun sitä injektoidaan yksipuolisesti kaudaliin, mutta ei rostraaliseen ventral tegmental -alueeseen annoksesta riippuvaisella tavalla (Melis et ai., 2007). Aktiiviset annokset olivat korkeampia kuin ne, joita tarvittiin ruiskuttamalla paraventrikulaariseen ytimeen ja samankaltaisia kuin peniksen erektio, kun niitä injektoitiin hippokampuksen ventral-subikuluun tai amygdalan posteromediaaliseen kortikaaliseen ytimeen (katso alla). Ilmeisesti pro-erektiohäiriötä välittää ydin accumbensin kuoreen ulottuvat mesolimbiset dopaminergiset neuronit, jotka puolestaan aktivoivat vielä tuntemattomia hermosoluja, jotka ulottuvat incerto-hypotalamisiin dopaminergisiin neuroneihin, jotka vaikuttavat paraventricular oxytocinergisiin neuroneihin, jotka välittävät peniksen erektiota (Melis et ai., 2007, 2009a).
Mitä tulee mekanismiin, jolla oksitosiini aktivoi dopaminergista neurotransmissiota ventral tegmental -alueella, käytettävissä olevat tiedot viittaavat siihen, että oksitosiini stimuloi oksitosinergisiä reseptoreita, jotka sijaitsevat mesolimbisten dopaminergisten neuronien soluelimissä. Tämä lisää Ca2 + -virtausta dopaminergisten neuronien solukappaleiden sisään, jolloin aktivoidaan typpioksidisyntaasi (Succu et ai., 2008). Kun poikkeama paraventrikulaarisesta ytimestä (ks. Kohta 3 alla), typpioksidi aktivoi vuorostaan guanylaattisyklaasia, mikä lisää syklisen GMP: n pitoisuutta. Tämän mekanismin mukaisesti joko d (CH2) 5Tyr (Me) 2-Orn8-vasotosiini, voimakas oksitosiiniantagonisti tai S-metyyli-tio-l-sitrulliini, joka on voimakas neuronaalisen typpioksidisyntaasin inhibiittori, injektoituna caudal ventral tegmental -alue ennen oksitosiinia, poistettiin peniksen erektio ja lisääntyminen solun ulkopuolisessa dopamiinikonsentraatiossa oksitosiinin indusoiman ydinkerhon kuoressa. Lisäksi 8-bromisyklinen GMP, aktiivinen fosfodiesteraasiresistentti syklinen GMP-analogi, indusoi peniksen erektiota, kun sitä injektoidaan kamalaiseen ventral tegmentaaliseen alueeseen, ja kasvattaa solun ulkopuolista dopamiinipitoisuutta ytimen accumbensin kuoressa, kuten oksitosiinilla injektoidaan Caudal ventral tegmental -alue (Succu et ai., 2008; Melis et ai., 2009a) (katso myös kuvio 2).
Haloperidoli, tehokas dopamiini D2-reseptoriantagonisti, joka on injektoitu ydin-akumeenien kuoreen, on aina tämän mekanismin mukaisesti vähentänyt oksitosiinin aiheuttamaa peniksen erektiota, joka on injektoitu ventral tegmental -alueelle (Melis et ai., 2007). Edellä mainittua mekanismia tuetaan myös kaksoisimmuno- fluoresenssitutkimuksilla, jotka osoittavat, että oksitosiinikuidut vaikuttavat dopaminergisten neuronien solukappaleisiin caudal-ventral tegmental -alueella, jotka oli aiemmin leimattu retrograde-merkkiaineella Fluorogold, joka oli injektoitu ydin accumbensin kuoreen ( Melis et ai., 2007, Succu et ai., 2008). Näiden dopaminergisten hermosolujen ja dopamiinireseptorien aktivoituminen ytimen accumbensissa johtavat puolestaan vielä tunnistamattomien hermosolujen aktivoitumiseen, jotka stimuloivat hermosolujen dopaminergisia neuroneja vapauttamaan dopamiinia paraventrikulaarisessa ytimessä, jolloin aktivoidaan oksitokinergiset neuronit, jotka ulottuvat selkäytimen ja peniksen erektio (katso edellä ja Melis et ai., 2007; Succu et ai., 2007, 2008). Itse asiassa oksitosiini, joka on injektoitu verisuonten vatsakalvon alueelle annoksella, joka aiheutti peniksen erektiota, lisääntynyt solun ulkopuolinen dopamiinikonsentraatio dialysaatissa, joka saatiin paitsi ytimestä accumbens, myös paraventrikulaarisesta ytimestä (Succu et ai., 2007).
2.3. Hippokampus
Hippokampuksen CA1-kenttä oli toinen aivojen alue, jossa oli runsaasti oksitosinergisiä kuituja ja reseptorit, jotka on tunnistettu aikaisemmissa tutkimuksissa, joissa oksitosiinin aiheuttama peniksen erektio (ks. Bujis, 1978; Sofroniew, 1983). Paraventrikulaarisen ytimen poikkeamiseksi tässä kuitenkin havaittiin, että oksitosiini kykenee indusoimaan peniksen erektiota vain, kun se injektoitiin kahdenvälisesti ja suuremmilla annoksilla kuin ne, jotka olivat aktiivisia paraventrikulaarisessa ytimessä (Melis et ai., 1986; Chen et ai., 1992). Oksitosiinin injektiona subiculumiin todettiin näissä aikaisemmissa tutkimuksissa inaktiivisiksi. Viimeaikaiset ja huolellisemmat mikroinjektiotutkimukset johtivat kuitenkin a ventral subiculumin alue jossa oksitosiinin injektio kykeni indusoimaan peniksen erektiota annosriippuvaisella tavalla (Melis et ai., 2009b). Tähän aivojen alueeseen injektoidun oksitosiinin pro-erektiovaikutusta havaittiin samankaltaisilla annoksilla kuin ne, jotka olivat aktiivisia ventral tegmental -alueella yksipuolisen injektion jälkeen (Melis et ai., 2007), kuten on havaittu paraventrikulaarisessa ytimessä. Ilmeisesti oksitosiini, joka on injektoitu vatsaaliseen subiculumiin, indusoi peniksen erektiota aktivoimalla typpioksidisyntaasia sisältävissä neuroneissa oksitosinergisiä reseptoreita, mikä aiheuttaa typpioksidituotannon kasvua. Typpidioksidi vuorostaan toimimalla solujenvälisenä sananvälittäjänä aktivoi glutamiinihapon neurotransmissiota, joka johtaa peniksen erektioon, mahdollisesti hermosolujen (glutamatergisten) efferenttien ulokkeiden kautta hippokampus-aivojen alueille, jotka moduloivat mesolimbisten dopaminergisten neuronien aktiivisuutta (esim. ventral tegmentaalinen alue, prefrontaalinen aivokuori, paraventrikulaarinen ydin) (katso alla ja Melis, 2007, 2009b; Succu et ai., 2008).
Tätä vaikutusmekanismia tukevat aivojen sisäiset mikrodialyysikokeet, jotka osoittavat, että oksitosiini, joka on injektoitu vatsaaliseen subiculumiin annoksilla, jotka indusoivat peniksen erektiota, lisäävät typpioksidin tuotantoa ja ekstrasellulaarista glutamiinihappokonsentraatiota dialysaatissa ventral-subiculumista (Melis et ai. , 2010) ja solunulkoinen dopamiini ytimessä accumbens (Melis et ai., 2007). Näitä vasteita vastustivat paitsi oksitosiinireseptoriantagonisti d (CH2) 5Tyr (Me) 2-Orn8-vasotosiini, mutta myös neuronaalinen typpioksidisyntaasi-inhibiittori S-metyyli-tio-litritliini ja annettua typpioksidiautomaattoria hemoglobiinia muutama minuutti ennen oksitosiinia (Melis et ai., 2010).
Lisäksi tämän toimintamekanismin mukaisesti glutamatergisen neurotransmissioaktivoituminen NMDA: n kautta, joka injektoidaan vatsaaliseen subiculumiin, indusoi peniksen erektiota (Melis et ai., 2010). Tällä hetkellä ei tunneta ventralisen subiculumin efferenttisten ulokkeiden fenotyyppiä, jotka aiheuttavat mesolimbisten dopaminergisten neuronien aktivoitumisen ja solun ulkopuolisen dopamiinin lisääntymisen ytimen accumbensissa. Kuitenkin, koska vatsakalvoon injektoidun oksitosiinin aiheuttama peniksen erektio esiintyy samanaikaisesti solun ulkopuolisen glutamiinihapon lisääntymisen kanssa dialysaatissa ventral tegmental -alueelta, mutta ei ytimen accumbensista ja sitä vastustaa (+) MK-801, voimakas, ei-kilpaileva antagonisti, joka on NMDA-alatyypin eksitatoristen aminohappo-reseptorien (Woodruff et ai., 1987), joka on injektoitu ventral tegmental -alueelle, mutta ei ytimessä accumbens, (katso kuvio 2 ja Melis et ai., 2009b) , on todennäköistä, että nämä ulokkeet johtavat glutamatergisen neurotransmis- sion aktivoitumiseen ventral tegmental -alueella, joka puolestaan aktivoi mesolimbiset dopaminergiset neuronit, jotka ulottuvat ydinasemaan. Tällä hetkellä ei tiedetä tällä hetkellä, onko hermosolukalvon alueella havaittu glutamiinihapon lisääntynyt pitoisuus oksitosiinin injektion jälkeen vatsaalisessa subikulaarissa vapautunut hermosoluista, jotka ovat peräisin subiculumista tai muista aivojen alueista (esim. Prefrontaalinen kuori). Kuitenkin, tämä aiheuttaa mesolimbisten dopaminergisten hermosolujen aktivoitumisen ja dopamiinin lisääntyneen vapautumisen ytimessä.. Tässä dopamiinireseptorien aktivoituminen johtaa incerto-hypotalamisten dopaminergisten neuronien aktivoitumiseen, vapauttamalla dopamiinia paraventrikulaariseen ytimeen, jolloin aktivoidaan selkäytimeen ulottuvat oksitosinergiset neuronit ja välittävät peniksen erektiota (katso edellä ja Melis et ai., 2007, 2009a; Succu et ai., 2008).
2.4. Amygdala
Amygdala on toinen aivojen alue, jossa on runsaasti oksitosiinikuituja ja -reseptoreita (katso Freund-Mercier et ai., 1987; Vaccari et ai., 1998; Uhl-Bronner et ai., 2005). Oksitosiinin uskotaan osallistuvan erilaisiin toimintoihin, anksiolyysiin, sosiaaliseen muistiin ja kognitioon, sosiaalisesti vahvistettuun oppimiseen, emotionaaliseen empatiaan, emotionaaliseen kasvojen käsittelyyn ja pelkoihin erektiohäiriöön ja seksuaaliseen käyttäytymiseen (ks. Kondo et ai., 1998; Dominguez et. al., 2001, Ebner et ai., 2005, Huber et ai., 2005, Domes et ai., 2007, Petrovic et ai., 2008, Lee et ai., 2009, Donaldson ja Young, 2009, Hurlemann et ai. , 2010). Oksitosiinin kyky indusoida peniksen erektiota urosrotilla, kun se indusoitiin amygdalan posteromediaaliseen kortikaaliseen ytimeen, havaittiin kuitenkin vasta äskettäin (Melis et ai., 2009b). Tämä vaste tapahtui samanaikaisesti solun ulkopuolisen dopamiinikonsentraation lisääntymisen kanssa ytimen accumbensin kuoresta saadussa dialysaatissa, kuten havaittiin oksitosiinin injektion jälkeen vatsaaliseen alikalvoon (Melis et ai., 2009b). Mekanismi, jolla oksytosiini injektoidaan amygdalan posteromediaaliseen kortikaaliseen ytimeen, indusoi peniksen erektiota tällä hetkellä ei tunneta. Käytettävissä olevat tiedot osoittavat, että sekä peniksen erektio että solun ulkopuolisen dopamiinikonsentraation lisääntyminen nukleaatista saaduista dialysaateista välittyvät oksitosinergisten reseptorien aktivoinnilla, koska molemmat vasteet poistettiin oksitosiinireseptorin antagonistilla d (CH2) 5Tyr ( Me) 2-Orn8-vasotosiini, joka on injektoitu amygdala-ytimessä muutaman minuutin ennen oksitosiinia (Melis et ai., 2009b).
Riippumatta siitä, mikä mekanismi oksitosiini aktivoituu amygdalan posteromediaalisessa kortikaalisessa ytimessä, peptidin aiheuttama seksuaalinen vaste poistetaan estämällä kaikki dopaminergiset reseptorit, joilla on cis-flupentiksoli, joka injektoidaan ydin accumbensin kuoreen ja NMDA-reseptorien salpauksella ( +) MK-801 injektoidaan ventral tegmentaaliseen alueeseen, mutta ei ydintekijöihin, kuten havaittiin vatsakalvoon injektoidun oksitosiinin indusoiman peniksen erektioon (Melis et ai., 2009b). Tämä viittaa siihen, että amygdalan posteromediaaliseen ytimeen injektoitu oksitosiini aktivoi glutamiinihapon neurotransmissiota ventral tegmental -alueella. Tämä aiheuttaa vuorostaan mesolimbisten dopaminergisten neuronien aktivoitumisen, mikä johtaa peniksen erektioon. Näiden havaintojen perusteella, jotka osoittavat hermosoluja, jotka yhdistävät tämän amygdalan ytimen ventralisen subiculumin kanssa (Canteras et ai., 1995; French ja Totterdell, 2003), nämä havainnot herättävät mahdollisuuden, että näiden kahden aivokentän välillä voi olla vuorovaikutus, vaikka se olisi suora on kuvattu polkuja amygdalasta joko ydintekijöihin tai ventral tegmentaalialueelle (Kelley ja Domesick, 1982; Witter, 2006).
2.5. Selkäydin
Selkäydin on toinen keskushermostoalueen alue, joka sisältää oksitosinergisiä kuituja ja reseptoreita (Freund-Mercier et ai., 1987; Uhl-Bronner et ai., 2005), joissa oksitosiini indusoi peniksen erektiota (Tang et ai., 1998 Veronneau-Longueville et ai., 1999, Giuliano ja Rampin, 2000, Giuliano et ai., 2001). Kuten edellä on muistutettu, nämä oksitosinergiset kuidut ovat peräisin hypotalamuksen paraventrikulaarisesta ytimestä ja myötävaikuttavat laskeviin reitteihin, jotka kontrolloivat selkärangan autonomisia neuroneja, jotka välittävät peniksen erektiota. Itse asiassa nämä kuidut tekevät synaptisia kontakteja torakko-lannerangan ja lumbo-sakraalisen dorsaalisen sarven preganglionisissa sympaattisissa ja parasympaattisissa solupylväissä selkärangan neuroneja innervating peniksen cavernous korpua (Marson ja McKenna, 1996; Giuliano ja Rampin, 2000; Giuliano et ai. , 2001). Nämä synaptiset kosketukset osoitettiin leimaamalla peniksestä peräisin olevia selkärangan neuroneja ja saavuttamalla selkäydintä spesifisillä retrograde-merkkiaineilla, jotka injektoitiin luolaisiin korpuihin yhdistettynä kaksoisimmuno- fluoresenssi- ja konfokaaliseen lasermikroskopiaan (Tang et ai., 1998; Veronneau-Longueville et ai., 1999). Näiden tutkimusten mukaisesti anestesoiduissa urosrotissa intratekaalinen oksitosiinin annosten injektointi lumbokristallien, mutta ei torakko-lannerangan tasolla, herätti intrakavernisen paineen annoksesta riippuvaisella tavalla. Nämä vaikutukset poistettiin estämällä oksitosinergisen reseptorin d (CH2) 5Tyr (Me) 2-Orn8-vasotosiini ja lantion hermojen (Giuliano ja Rampin, 2000; Giuliano et ai., 2001). Nämä tulokset osoittavat, että oksidosiini, joka vaikuttaa lumbokristalli- seen selkäytimeen, lisää intrakavernoalista painetta ja viittaa siihen, että oksitosiini, joka on vapautunut paraventrikulaarisen ytimen fysiologisen aktivoinnin aikana, on voimakas aktivaattori selkäydinprofektoreille hermosoluille, jotka ulottuvat syvälle korpuun. Mielenkiintoista on, että nämä pro-erektioiset selkärangan neuronit, joilla oksitosiini vaikuttavat vaikuttavan pro-erektioonsa, saavat myös synaptisia kontakteja serotoninergisista neuroneista, jotka ovat peräisin munuaisen oblongatan (Marson ja McKenna, 1992; Tang et al. ., 1998). Näiden serotoninergisten neuronien tuhoaminen helpottaa siemensyöksyä ja peniksen refleksejä urosrotissa (Marson ja McKenna, 1992; Yells et ai., 1992). Koska lääkkeet, jotka stimuloivat 5HT2C-reseptoreita, helpottavat peniksen erektiota, kun niitä annetaan intrakerebroventrikulaarisesti, mutta ei paraventriculaariseen ytimeen, ja lääkkeitä, jotka estävät 5HT2C-reseptoreita, vähentävät myös dopamiinin agonistia ja oksitosiinin aiheuttamaa peniksen erektiota, kun taas dopamiiniantagonistit eivät vähennä 5HT2C-agonistien aiheuttamaa peniksen erektiota ( katso myös Stancampiano et ai., 1994 ja siinä olevat viitteet), on myös ehdotettu, että oksitosiini helpottaa pro-erektiohapon 5HT2C-reseptorien vaikutusta lumbo- sakraalisen selkäytimen tasolla (Stancampiano et ai., 1994). Vaihtoehtoisesti oksitosiini voi vaikuttaa selkärankaisten laskevien serotoniinergisten neuronien aktiivisuuteen vaikuttamalla suoraan ydinalueeseen paragigantocellularis, jossa nämä neuronit ovat peräisin (katso Stancampiano et ai., 1994).
3. Oksitosiinin, dopamiinin ja glutamiinihapon vuorovaikutus keskushermostoon ja peniksen erektio
Kuten osassa 1 muistutettiin, kaikki keskushermostossa olevat oksitosergiset neuronit ovat peräisin paraventrikulaarisesta ytimestä ja ympäröivistä rakenteista. Näiden hermosolujen aktiivisuus on eri neurotransmitterien ja / tai neuropeptidien hallinnassa. Paraventrikulaarisella tasolla tutkituimpia ovat dopamiini, glutamiinihappo, gamma-aminovoihappo (GABA), typpioksidi, endokannabinoidit, opioidipeptidit, kasvuhormonia vapauttavat peptidit, VGF: ään liittyvät peptidit ja oksitosiini itse. Dopamiini, glutamiinihappo, kasvuhormonia vapauttavat peptidit, VGF: stä peräisin olevat peptidit ja oksitosiini ovat stimuloivia, esim. Nämä yhdisteet ja niiden agonistit helpottavat peniksen erektiota, kun niitä injektoidaan paraventrikulaariseen ytimeen, kun taas GABA, opioidipeptidit ja endokannabinoidit ovat inhiboivia, esim. Nämä yhdisteet tai niiden agonistit estävät peniksen erektiota (katso Meisel ja Sachs, 1994; Witt ja Insel, 1994; Argiolas ja Melis, 1995, 2004, 2005; Giuliano ja Rampin, 2000, 2004; McKenna, 2000; Andersson, 2001; Hull et ai., 2002;
Useat kokeellisten todisteiden rivit viittaavat siihen, että nämä oksitosinergiset neuronit ja edellä mainitut neurotransmitterit ja neuropeptidit osallistuvat erektiohäiriön ja seksuaalisen käyttäytymisen kontrollointiin eri fysiologisissa yhteyksissä. Lisäksi oksitosiini, joka vapautuu hypotalamuksen ulkopuolisissa aivoissa, kuten ventral tegmental -alueella, hippokampuksessa ja sen alueilla, amygdalassa ja selkäytimessä, voi vaikuttaa niiden neuronien aktiivisuuteen, joihin oksitosergiset synapsit vaikuttavat. Tällä hetkellä ainoat peniksen erektion kannalta tärkeät neuronit, joilla oksitosiiniset synapsiot vaikuttavat varmuudella, ovat solun elimet, jotka ovat nivelten ventral tegmentaalisen alueen mesolimbisten dopaminergisten neuronien soluja, jotka ulkonevat ydin accumbensin kuoreen (Melis et ai., 2007 Succu et ai., 2008) ja pro-erektiohäiriön neuronit, jotka ulottuvat lumbokristalli- sesta traktaatista luolaiseen korpuun (katso Giuliano ja Rampin, 2000; Giuliano et ai., 2001) (katso myös jaksot 2.2 ja 2.5) . Itse asiassa, vaikka oksitosinergisiä synapseja ja reseptoreita on tunnistettu myös ventral subiculumissa, amygdalassa ja selkäytimessä, alueilla, jotka ovat kaikki tärkeitä peniksen erektiolle (ks. Edellä), näillä alueilla neurotransmitterin tyyppi neuroneissa on jotka oksitosiinien hermopäätteet vaikuttavat, ovat vielä tuntemattomia.
Tässä katsauksen osassa on lyhyesti yhteenveto viimeaikaisesta kirjallisuudesta oksitosiinin pro-erektiohoidon vaikutuksesta, joka on injektoitu kaudaliseen ventral tegmentaaliseen alueeseen, hippokampuksen ventral subiculumiin ja selkäytimeen. Erityistä huomiota kiinnitetään peptidin vuorovaikutukseen dopamiinin ja glutamiinihapon kanssa näillä alueilla ja rooliin, joita tämä vuorovaikutus voi vaikuttaa erektiohäiriön keskusohjaukseen. Ensinnäkin annetaan lyhyt yhteenveto dopamiinin ja glutamiinihapon vaikutuksista paraventrikulaarisen ytimen oksitokinergisiin neuroneihin, joilla on myös keskeinen rooli erektiohäiriössä, jotta lukija olisi tietoinen tämän alan tutkimuksen alkuvaiheesta, kuten nämä tutkimukset on jo tarkistettu laajasti (ks. Argiolas ja Melis, 1995, 2004, 2005; Melis ja Argiolas, 2003). Myös tässä tapauksessa kiinnitetään erityistä huomiota uusimpiin tuloksiin, jotka viittaavat sekä dopamiini-oksitosiinisidoksen että glutamiinihappo-oksitosiinisidoksen tärkeään rooliin paitsi seksuaalisen suorituskyvyn (peniksen erektio ja kopulaatio) lisäksi myös seksuaalisessa herätys ja seksuaalinen motivaatio.
3.1. Dopamiini-oksitosiinin vuorovaikutus paraventrikulaarisessa ytimessä
- dopamiiniagonistien kyky indusoida peniksen erektio aktivoimalla keski-oksitosinergisiä neuroneja havaittiin välittömästi sen jälkeen, kun havaittiin, että apomorfiini indusoi peniksen erektiota, kun sitä injektoitiin paraventrikulaariseen ytimeen (Melis et ai., 1987), kun oksitosiinireseptorin antagonisti d (CH2) 5Tyr (Me) 2-Orn8-vasotosiini injektoitiin intraserebroventrikulaarisesti (icv), kykenee vähentämään lähes kokonaan peniksen erektiota, jota indusoi ei vain oksytosiini, jolle annetaan icv, vaan myös apomorfiini, joka annetaan ihon alle (Argiolas et ai., 1987b). Näitä tuloksia seurasi muiden tutkimusten tulokset, jotka osoittivat samankaltaisia tuloksia, kun d (CH2) 5Tyr (Me) 2-Orn8-vasotosiinille annettiin icv ja apomorfiini annettiin suoraan paraventrikulaariseen ytimeen (Melis et ai., 1989b), lEpäilemättä, että dopamiiniagonistit aiheuttavat peniksen erektiota aktivoimalla paraventrikulaarisia oksitosinergisiä neuroneja, jotka ulottuvat hypotalamuksen ulkopuolisiin aivojen alueisiin ja erityisesti selkäytimeen (ks. Argiolas ja Melis, 1995, 2004, 2005). Tämän hypoteesin mukaisesti anestesoiduilla rotilla on todettu äskettäin, että ei-peptidi- oksitosiinireseptoriantagonistin lumbokristalisten oksitosinergisten reseptorien salpaus kykenee poistamaan apomorfiinin indusoimat dopamiiniagonistin apomorfiinin aiheuttaman intrakavernisen paineen nousut, mikä antaa näyttöä paraventriculo-spinal oxytocinergic reitti, joka liittyy peniksen erektioon (Baskerville et ai., 2009).
Tutkimukset peniksen erektiosta aiheutuvan dopamiinireseptorin tunnistaminen osoitti, että myös paraventrikulaarisessa ytimessä dopamiinireseptorin agonistit aiheuttavat peniksen erektiota vaikuttamalla D2-perheen dopamiinireseptoreihin, kuten dopamiinireseptoriagonisteilla on annettu systeemisesti (katso Melis et ai., 1987; Eaton et ai., 1991; Melis ja Argiolas, 1995a). Näin ollen apomorfiini, voimakas sekoitettu D1 / D2-reseptoriagonisti ja kinpiroli, voimakas selektiivinen D2-reseptorin agonisti, mutta ei SKF 38393, selektiivinen D1-reseptoriagonisti, injektoitiin tähän hypotalamukseen, todettiin kykenevän indusoimaan peniksen erektiota annosriippuvaisella tavalla ja D2-reseptorin agonistien aiheuttama seksuaalinen vaste poistettiin D2-reseptoriantagonisteilla, kuten haloperidolilla ja l-sulpiridillä, mutta ei selektiivisen D23390-reseptoriantagonistin SCH 1: lla (Melis et ai., 1987). Apomorfiinin kyky indusoida peniksen erektiota, kun sitä injektoitiin paraventrikulaariseen ytimeen, vahvistettiin myös telemetristen tutkimusten avulla, jotka osoittivat, että paraventricular ytimessä annettu dopamiiniagonisti kykenee lisäämään intrakavernista painetta hereillä urosrotilla muuttamatta systeemistä verenpainetta (Chen et ai. 1999; Giuliano ja Allard, 2001), kuten havaittiin systeemisen injektion jälkeen (Bernabè et ai., 1999). Nämä tutkimukset ovat myös vahvisti D2-reseptorien pääasiallisen roolin, koska D1-reseptoriagonistien havaittiin tavallisesti kykenevän lisäämään intrakavernistä painetta, kun niitä injektoitiin paraventrikulaariseen tumaan (Chen et ai., 1999).
Tällöin oli saatavilla useita linjoja kokeellisia todisteita, jotka viittaavat siihen, että paraventrikulaariset D2-reseptorit, joiden stimulaatio aiheuttaa peniksen erektiota, sijaitsevat oksitosinergisten neuronien soluelimissä. Ensinnäkin paraventrikulaarinen ydin sisältää dopaminergisia hermopäätteitä, jotka kuuluvat ns. Incertohypothalamic dopaminergisiin neuroneihin. Näiden hermosolujen soluelimet sijaitsevat A13- ja A14-ryhmässä Dahlstrom ja Fuxe (1964), arborisoi laajasti ja innervoi useita hypotalamuksia, mukaan lukien paraventrikulaariset oksitosinergiset neuronit, jotka ulottuvat neurohypofyysiin ja / tai hypotalamuksen ulkopuolisiin aivojen alueisiin (Buijs et ai., 1984; Lindvall et ai., 1984).
Näiden dopaminergisten neuronien osallistuminen paraventrikulaariseen tasoon peniksen erektion ja kopulaation torjumiseen tuetaan mikrodialyysitutkimuksilla, jotka osoittavat, että solunulkoisen dopamiinin ja sen päämetaboliitin 3,4-dihydroksifenyylietikkahapon (DOPAC) pitoisuudet lisääntyvät dialysaatissa, joka on saatu seksuaalisesti voimakkaiden urosrottien paraventrikulaarinen ydin, jossa esiintyy epäkontakteja erektioita, kun ne asetetaan saavutettavissa olevan munasarjojen poistaman estrogeenin ja progesteronin pohjustaman vastaanottavan naaraan (Melis et ai., 2003).
Dopamiini- ja DOPAC-konsentraatioiden kasvu oli vieläkin suurempi, kun kopulointi reseptivaan naaraan kanssa oli sallittua (Melis et ai., 2003), kuten on havaittu mediaalisessa preoptic-alueella (Hull et ai., 1995) ja ydin accumbensissa (Pfaus ja Everitt, 1995). Toiseksi useat tutkimukset osoittavat, että paraventricular D2 -reseptorien stimulaation aiheuttama peniksen erektio välittyy näillä alueilla vapautuvalla oksitosiinilla. Näin ollen todettiin, että apomorfiini, joka annettiin peniksen erektiota indusoivina annoksina, pystyi lisäämään oksitosiinipitoisuutta, ei pelkästään rottien ja apinoiden plasmassa (Melis et ai., 1989a; Cameron et ai., 1992), vaan myös hypotalamuksen aivoissa alueet, kuten hippokampus (Melis et ai., 1990). Näiden tulosten mukaisesti paraventrikulaariseen ytimeen injektoitu apomorfiini annoksella, joka indusoi peniksen erektiota, osoitettiin äskettäin kykenevän kasvattamaan myös solun ulkopuolista dopamiinipitoisuutta ytimessä, mikä on oksitosiinireseptoriantagonistin d (CH2) vähentämä vaikutus. 5Tyr (Me) 2-Orn8-vasotosiini injektoidaan ventral tegmentaalialueelle (Succu et ai., 2007; Melis et ai., 2009a) (katso myös osa 4). Kolmanneksi paraventrikulaarisen ytimen kahdenväliset elektrolyyttiset vauriot, jotka eliminoivat lähes täydellisesti oksitosiinia hypotalamuksen ulkopuolisista aivojen alueista (Hawthorn et al., 1985), poistavat apomorfiinin aiheuttaman peniksen erektion (Argiolas et ai., 1987a) ja selektiiviset oksitosiinireseptoriantagonistit annetaan sivusuunnassa, mutta ei paraventrikulaariseen ytimeen, pienentää annoksesta riippuvaa apomorfiini-indusoitua peniksen erektiota, jonka voimakkuus on samansuuntainen kuin näiden yhdisteiden oksitosiinireseptorien estämisessä (Melis et ai., 1989b). Oksitosiinireseptoriantagonistit ovat myös erittäin tehokkaita vähentämään miesten seksuaalisen käyttäytymisen helpottamista, jota ei vain oksitosiini, vaan myös apomorfiini (Argiolas et ai., 1988, 1989).
Mitä tulee mekanismiin, jolla D2-reseptorit aktivoituvat dopamiinin tai dopamiinireseptorin agonistien avulla, lisää oksitosinergisten neuronien aktiivisuutta, mikä vapauttaa oksitosiinia extrahypothalamic-aivojen alueilla ja selkäytimessä, lukuisia kokeellisia tietojatuetaan hypoteesia siitä, että D2-reseptorien stimulointi lisää solunsisäisten Ca2 + -ionien pitoisuutta oksitosinergisten neuronien soluelimissä, mikä johtaa typpioksidisyntaasin aktivoitumiseen, Ca2 + -kalmoduliiniriippuvainen entsyymi, joka on läsnä näissä soluelimissä (Vincent ja Kimura, 1992; Torres et ai., 1993; Sanchez et ai., 1994; Sato-Suzuki et ai., 1998). Lisääntynyt typpioksidituotanto aiheuttaa vuorostaan oksitosergisten neuronien aktivoitumisen. Niinpä (1) apomorfiinin indusoimaa peniksen erektiota estivät orgaaniset kalsiumkanavasalpaajat ja by-conotoxin GVIA, voimakas ja selektiivinen N-tyypin (McCleskey et ai., 2) jännitteestä riippuvaisten Ca1987 + -kanavien estäjä, jotka annettiin paraventrikulaariseen ydin (katso Argiolas et ai., 1990 ja siinä olevat viitteet); (2) apomorfiinin aiheuttama peniksen erektio estettiin typen oksidisyntaasin inhibiittoreilla, jotka annettiin paraventrikulaariseen ytimeen (Melis et ai., 1994c); ja (3) apomorfiini ja muut D2-reseptoriagonistit annoksina, jotka indusoivat peniksen erektiota, nosti typen oksidien tuotantoa paraventrikulaarisessa dialysaatissa, joka saatiin aivojen mikrodialyysillä, mikä paraventrikulaarisen typpioksidisyntaasin inhibiittoreilla vähennettiin annoksilla, jotka pienensivät D2-reseptorin agonistisesti indusoitu peniksen erektio (Melis et ai., 1996). Mekanismi, jonka avulla typpioksidi aktivoi paraventrikulaarisia oksitosinergisiä neuroneja, ei ole vielä tiedossa, vaikka saatavilla olevat tiedot viittaavat siihen, että typpioksidi toimii solunsisäisenä sananvälittäjänä ja että guanylaattisyklaasi ei ole mukana. Itse asiassa, syklisen GMP: n, 8-bromisyklisen GMP: n, aktiivisen fosfodiesteraasinestistisen analogin todettiin kykenevän indusoimaan peniksen erektiota, kun se annettiin paraventrikulaariseen ytimeen (kuvio 2) (katso Melis ja Argiolas, 1995b ja siinä olevat viitteet).
Edellä mainittua tulkintaa ei ole usein pidetty vakuuttavana, lähinnä siksi, että dopamiini-D2-reseptorien stimulaatio on yleensä kytketty inhibitioon pikemminkin näiden reseptoreita sisältävien hermosolujen soluelinten virittämiseksi eri G-proteiinikytkettyjen mekanismien kautta (ks. Sokoloff ja Schwartz, 1995). Kuitenkin mahdollinen selitys tälle ristiriitaisuudelle, joka on linjassa paraventrikulaaristen oksitosinergisten neuronien suoran stimulaation kanssa dopamiinilla, on äskettäin ehdotettu löytämällä G-proteiiniin kytketty dopamiini D4 reseptori, D2-reseptoriperheen jäsen (D2, D3 ja D4), jonka stimulointi lisää Ca2 + -virtausta solu- valmisteissa, jotka sisältävät tämän reseptorin alatyypin kloonattua versiota (Moreland et ai., 2004). Vielä tärkeämpää on, että selektiivinen D4-reseptoriagonisti (esim. ABT 724) (N-metyyli-4- (2-syanofenyyli) piperatsynil-3-metyylibentsamidi-maleaatti) todettiin kykenevän indusoimaan peniksen erektiota urosrotilla, kun niitä annettiin systeemisesti (Brioni et ai., 2004). Tätä vaikutusta ei löytynyt selektiivisen D2-reseptorin alatyypin agonistin PNU-95666E: n (R-5,6-dihydro-N, N-dimetyyli-4-imidatso [4,5,1-i] kinolin-5-amiini) kanssa (Hsieh et ai., 2004), joka oli myös kykenemätön lisäämään Ca2 + -virtausta solu- valmisteisiin, jotka sisälsivät D4-reseptorin alatyypin kloonattua versiota (Brioni et ai., 2004; Moreland et ai., 2004). Edellä esitetyn hypoteesin ja havaintojen mukaisesti PD 168,077 (N-metyyli-4- (2-syanofenyyli) piperatsynil-3metyylibentsamidi-maleaatti), PIP-3EA (2- [4- (2-metoksifenyyli) piperatsin-1-yylimetyyli] imidatso [1,2-a] pyridiini) ja muut selektiiviset D4-reseptoriagonistit (Heier et ai., 1997; Melis et ai., 2006b; Löber et ai., 2009) todettiin kykenevän indusoimaan peniksen erektiota, kun sitä injektoitiin systeemisesti, ICv: hen ja sisään paraventrikulaarinen ydin, vaikkakin vähemmän tehokkaasti kuin apomorfiini. Näiden D4-reseptoriagonistien pro-erektiohäiriö estettiin L-745,870: lla (3- (4- [kloorifenyyli] piperatsiini-1-yyli) metyyli-1H-pyrrolo [2,3-B] pyridiinitrihydrokloridi), selektiivinen D4-reseptori antagonisti (Patel et ai., 1997; Melis et ai., 2005, 2006b; Löber et ai., 2009).
Lopuksi edellä mainittujen D4-reseptoriagonistien pro-erektiohappo vähensi myös typpioksidisyntaasin inhibiittoreilla, jotka annettiin paraventrikulaariseen ytimeen, ja d (CH2) 5Tyr (Me) 2-Orn8-vasotosiini, selektiivinen oksitosiinireseptoriantagonisti annostellaan, mutta ei paraventricularisessa ytimessä. Nämä tulokset ovat linjassa hypoteesin kanssa, että D4-reseptoriagonistit stimuloivat myös oksitosinergisiä neuroneja aktivoimalla typpioksidisyntaasia ja vapauttamalla oksitosiinia extrahypothalamic-aivojen alueilla, mikä puolestaan helpottaa peniksen erektiota, kuten apomorfiini ja klassiset D2-agonistit osoittavat (Melis et ai. ., 2005, 2006b; Löber et ai., 2009).
Yllä olevat havainnot tukevat myös hypoteesia, että dopamiini aiheuttaa peniksen erektiota vaikuttamalla D4-reseptoreihin, jotka sijaitsevat paraventricular oxytocinergisten neuronien soluelimissä ja jotka aiheuttavat lisääntynyttä Ca2 + -virtausta oksitosinergisten neuronien solunkappaleisiin, mikä johtaa lisääntyneeseen typpioksidituotantoon. Typpioksidi aktivoi vuorostaan oksitosinergisiä neuroneja vapauttamaan oksitosiinia hypotalamuksen ulkopuolisissa aivojen alueilla ja selkäytimessä, kuten jo keskusteltiin. Tässä suhteessa, on huomionarvoista, että dopamiinireseptorit on tunnistettu oksitosinergisten neuronien soluelimissä paraventrikulaarisessa ytimessä vasta äskettäin kaksoisimmuno-fluoresenssitutkimuksissa korkean valikoivuuden D2-, D3- ja D4-reseptorivasta-aineilla ja oksitosiinivasta-aineilla. Nämä tutkimukset ovat osoittaneet kaikkien kolmen D2receptor-alatyypin (D2, D3 ja D4) ilmentymisen, jotka paikallistuvat erikseen paraventricularisessa ytimessä olevien oksitosinergisten neuronien solukappaleisiin (ja myös supraoptiseen ytimeen ja mediaaliseen preoptiseen alueeseen) (Baskerville) ja Douglas, 2008, Baskerville et ai., 2009).
Tämä antaa voimakkaan neuroanatomisen tuen mahdollisuudelle, että D2-tyypin dopamiini- ja dopamiinireseptoriagonistit indusoivat peniksen erektiota aktivoimalla suoraan oksitosergisiä neuroneja, jotka ulottuvat edellä mainittuihin aivojen alueisiin.esim. selkäydin, ventral tegmental -alue, hippokampus ja amygdala. Nämä havainnot eivät kuitenkaan anna mitään apua D2-reseptorin alatyypin / niiden tunnistamiseen, joiden stimulaatio aiheuttaa erektiohäiriötä. Valitettavasti apua ei voida saada edes sellaisista tutkimuksista, joiden tarkoituksena on tunnistaa dopamiinireseptorin agonistien aktivoimat oksitosinergiset neuronit paraventricularisessa ytimessä. Itse asiassa, huolimatta erilaisesta dopamiinireseptorin alatyyppien aktiivisuudesta, joko sekoitetut dopamiinireseptorin agonistit (esim. Apomorfiini) tai selektiiviset D2-reseptoriagonistit (esim. Kinpiroli, joka vaikuttaa kaikkiin D2-reseptorin alatyyppeihin) tai selektiiviset D4-reseptoriagonistit aiheuttavat oksitosinergisten hermosolujen aktivoituminen mitattuna FOS-proteiinin lisääntyessä paraventrikulaarisen ytimen parvosellulaarisissa oksitosinergisissä neuroneissa (Bitner et ai., 2006). Tämä havainto on kuitenkin viime aikoina kyseenalaistettu, koska FOS-proteiinin lisääntyminen paraventricularisissa oksitosinergisissä neuroneissa todettiin vain silloin, kun quinerolane indusoi peniksen erektiota, joka toimii pääasiassa D2- ja D3-reseptorin alatyypeillä, mutta ei PD 168077, D4-reseptoriagonisti, huolimatta molempien yhdisteiden kyvystä indusoida seksuaalinen vaste (Baskerville et ai., 2009).
Muita kokeita muiden D2-reseptorialatyyppien (pääasiassa D2 ja D3) selektiivisten agonistien kanssa tarvitaan sitten kunkin dopamiinireseptorin alatyypin täsmällisen roolin tunnistamiseksi erektiohäiriön kontrolloinnissa paraventrikulaarisella tasolla. Tässä suhteessa, kuten jo aiemmin muistutettiin, apomorfiini, joka vaikuttaa voimakkaasti kaikkiin dopamiinireseptorin alatyyppeihin (katso Brioni et ai., 2004, ja siinä olevat viitteet), on paljon tehokkaampi kuin D4-reseptorien agonistit indusoimaan peniksen erektiota, kun se injektoidaan paraventrikulaariseen ydin. Tämä voi selittyä apomorfiinin suuremmalla affiniteetilla D4-reseptoreihin verrattuna testattujen D4-reseptoriagonistien aktiivisuuteen tai vaihtoehtoisesti D4-reseptoriagonistit voivat toimia D4-reseptorin osittaisena agonisteina tai eri dopamiinireseptorialatyyppien samanaikainen aktivointi apomorfiinin avulla voi olla tuottavat korkeamman oksitokinergisten neuronien aktivoitumisen, joka välittää peniksen erektiota, kuin D2-reseptorin agonistien aktivointi vain D4-reseptorin alatyypille.
Dopamiini D1: n ja D2-reseptorien välisiä vuorovaikutuksia on jo kuvattu seksuaalisen käyttäytymisen kontrolloinnissa mediaalisen preoptisen alueen tasolla (katso Hull et ai., 1989). Siinä tapauksessa, että selektiivisten D2-reseptoriagonistien kyvyttömyys indusoida peniksen erektiota (Hsieh et ai., 2004) vahvistetaan (mutta katso Depoortère et ai., 2009), esimerkiksi myös näiden yhdisteiden injektion jälkeen paraventrikulaariseen ytimeen D3-reseptorien keskeinen rooli yksin tai yhdessä D4-reseptorien kanssa oksitokinergisten neuronien aktivoinnissa, joka välittää peniksen erektiota, olisi analysoitava yksityiskohtaisesti (katso Baskerville et ai., 2009). Valitettavasti tällä hetkellä ei ole saatavilla selektiivisiä D2- ja D3-reseptoriagonisteja (esim. Jotka eroavat affiniteetistaan näiden kahden reseptorin alatyypin suhteen vähintään neljässä / viidessä suuruusluokassa in vitro). Tästä syystä äskettäinen ehdotus siitä, että D3-reseptorit välittävät klassisten D2-reseptoriagonistien indusoimaa peniksen erektiota, joka perustuu pääasiassa oletettujen D3-reseptoriantagonistien kykyyn vähentää klassisen D2-agonistien, kuten apomorfiini, kinpiroli ja pramipeksoli, jotka aktivoivat tehokkaasti kaikki dopamiini D2-reseptorin alatyypit (Collins et ai., 2009), on varmasti validoitava muilla kokeilla. Tämä validointi on välttämätöntä myös siksi, että tässä tutkimuksessa ei havaittu D4-reseptoriagonistien vaikutusta peniksen erektioon, toisin kuin edellä mainittujen tutkimusten tulokset, jotka osoittavat D4-reseptoriagonistien proektektisen vaikutuksen. Itse asiassa jopa apomorfiinin kyky indusoida peniksen erektiota (ja haukkumista) D4-reseptorin knockout-hiirissä, joilla on sama teho kuin villityypin D4-reseptorin knockout-hiirillä ja D3-reseptoriantagonistien kyky poistaa apomorfiinivaste näissä eläimissä ( Collins et ai., 2009) ei voida pitää lopullisena todisteena D3-reseptorin alatyypin valikoivasta roolista D2-reseptorin agonistien aiheuttamassa peniksen erektiossa. Erilaiset lajin erot, neurotransmitteri- / neuropeptidi- ja / tai neurotransmitteri- / neuropeptidireseptorigeenin ablaatiotutkimukset (neurotransmitteri / neuropeptidi ja / tai neurotransmitteri- / neuropeptidireseptorin knockout-eläimet) ovat yleensä lisänneet hämmennystä ja komplikaatioita neurotransmitterien ja seksuaalisen välittäjäaineiden oletetun seksuaalisen roolin vahvistamisessa. / tai neuropeptidit ja niiden reseptorit. Nimittäin oksitosiinigeenin ablaatio tuottaa oksitosiinipeliä hiirillä, jotka tavoittelevat ja kopioivat normaalisti, ikään kuin oksitosiini olisi tarpeeton pariutumisen ja kopulaation kannalta. Myös homotsygoottisilla naaraspuolisilla oksitosiinipitoisilla hiirillä esiintyy normaalia pariutumista ja synnytystä, vaikkakin pienellä maidon laskeutumisella (Nishimori et ai., 1996; Young et ai., 1996). Neuronaalista typpioksidisyntaasia koodaavan geenin ablaatio tuottaa myös typpioksidisyntaasia, joka katkaisee hiiret, jotka tavoittelevat ja kopioivat normaalisti (Huang et ai., 1993). Nämä havainnot viittaavat kuitenkin luultavasti lisääntymisfysiologian tärkeään piirteeseen, ts. Niiden järjestelmien redundanssiin, jotka liittyvät sen hallintaan keski- ja reuna-tasolla.
Tällaisella redundanssilla on varmasti evoluution alkuperää, koska se takaa geenien kulun seuraavalle sukupolvelle lajin selviytymisen kannalta. Siksi se tosiasia, että D4-reseptorigeenin ablaatio ei muuta apomorfiinin proektektista vaikutusta, viittaa siihen, että D4-reseptorit, kuten oksitosiini ja typpioksidi, ovat vain muutamia välittäjistä, jotka työskentelevät erektiohäiriöitä kontrolloivissa järjestelmissä, eikä viittaa siihen, että näiden reseptorien rooli peniksen erektio ja seksuaalinen käyttäytyminen eivät ole tärkeitä. D4-agonistien epäonnistuminen indusoi peniksen erektiota, kun sitä annettiin systeemisesti eri kantojen urosrotille, on äskettäin raportoitu toisessa tutkimuksessa (Depoortère et ai., 2009). Toisin kuin Collins et al. (2009), ja kuvaamaan eri D2-reseptorin alatyyppien roolia peniksen erektio-ohjauksessa vieläkin hämmentävämpää, tämä tutkimus osoittaa myös, että oletetut selektiiviset D3-reseptoriantagonistit, jotka oli annettu systeemisesti, eivät pystyneet vähentämään apomorfiinin aiheuttamaa peniksen erektiota kannan urosrotit, jotka ovat herkempiä apomorfiinin pro-erektiohoidolle, kun taas seksuaalinen vaste (ja haukottelu) antagonisoitiin selektiivisellä D2-antagonistilla L-741,626 (3 - [[4- (4-kloorifenyyli) -4-hydroksipiperidiini -1-yyli] metyyli-1H-indoli), mikä johtaa siihen, että tekijät viittaavat siihen, että D2-reseptorit ovat D3- ja D4-reseptoreiden sijasta tärkeitä rooli D2-agonistien indusoimassa peniksen erektiossa (Depoortère et ai., 2009). Lopuksi mahdollisuus, että dopamiinireseptoriagonistien eksitatoiva vaikutus oksitosinergisiin neuroneihin välittää peniksen erektiota, ainakin osittain, on epäsuora eikä suora, esimerkiksi välittäen tai vaikuttaa muiden neurotransmitterien neuropeptidien aktiivisuuden muutoksilla, jotka pystyvät moduloimaan aktiivisuutta. oksitosinergisiä neuroneja paraventrikulaarisessa ytimessä ei voida täysin sulkea pois.
3.2. Glutamiinihappo-oksitosiinin vuorovaikutus paraventrikulaarisessa ytimessä
Hypotalamuksen paraventrikulaarinen ydin on hyvin runsaasti synapseja, jotka sisältävät hermoston välittäjäaineena hermostuneita aminohappoja (esim. Glutamiinihappo ja asparagiinihappo).) (Van Den Pol, 1991). Tämän ytimen kiihottavat aminohapot osallistuvat lukuisiin toimintoihin, kuten peniksen erektioon ja seksuaaliseen käyttäytymiseen (Roeling et ai., 1991; Melis et ai., 1994b, 2000, 2004b). N-metyyli-d-asparagiinihappo (NMDA), joka on NMDA-reseptorin alatyypin selektiivinen agonisti, mutta ei (±) -_-amino-3-hydroksi-5-metyyli-isoksatsoli-4-propionihappo (AMPA) todettiin, että AMPA-reseptorin alatyypin tai (±) -trans (1) -amino-1,3-syklopentaanidikarboksilihapon (ACPD) selektiivinen agonisti, joka on metabotrooppisen reseptorin alatyypin selektiivinen agonisti, todettiin kykenevän indusoimaan peniksen erektiota injektoidessaan vapaasti liikkuvien rottien paraventrikulaarinen ydin (Melis et ai., 1994b). 948 MR Melis, A. Argiolas / Neuroscience ja Biobehavioral Reviews 35 (2011) 939-955 NMDA: n pro-erektiohäiriö estettiin (+) MK-801, ei-kilpaileva NMDA-reseptoriantagonisti (Woodruff et ai., 1987 ), injektoitu paraventrikulaariseen ytimeen (Melis et ai., 1994b). Näiden tulosten mukaisesti NMAa havaittiin paljon aktiivisemmaksi kuin muiden eksitatoivien aminohappojen reseptorin alatyyppien agonistit, kun ne injektoitiin paraventrikulaariseen ytimeen intrakavernisen paineen seurantaan tähtäävissä telemetriatutkimuksissa, kun lisääntyi intrakavernosaalista painetta hereillä tai anestesoiduilla urosrotilla (Zahran et. al., 2000, Chen ja Chang, 2003).
Kuten edellä on ehdotettu oksitosiinille ja dopamiinille, on todennäköistä, että NMDA-reseptorit, jotka välittävät peniksen erektiota, sijaitsevat oksitosinergisten neuronien soluelimissä, koska eksitatoriset aminohapon hermopäätteet vaikuttavat oksityyppisiin soluelimiin paraventrikulaarisessa ytimessä (Van Den Pol, 1991). Analogisesti dopamiinireseptoriagonistien kanssa havaitun NMDA: n pro-erektiohoidon vaikutuksesta välittyy ilmeisesti oksitosinergisen neurotransmissioaktivoitumisen aktivoiminen, jonka oksitosiiniantagonisti d (CH2) 5Tyr (Me) 2-Orn8-vasotosiini, joka on annettu icv: llä, on poistettu. ei paraventrikulaariseen ytimeen (katso Argiolas ja Melis, 1995, 2004, 2005 ja siinä olevat viitteet). Samoin NMDA: n indusoitu oksitosergisen neurotransmissioaktivoituminen on myös sekundaarinen typpioksidisyntaasin aktivoinnille, koska typpioksidisyntaasin estäjät (N-nitro-N-metyyli-arginiinimetyyliesteri ja N- metyyli-tio-l-sitrulliini), joka annettiin paraventrikulaariseen ytimeen, ja NMDA, joka on injektoitu paraventricular ytimeen annoksilla, jotka indusoivat peniksen erektiota, lisää typpioksidin tuotantoa hypotalamuksessa (ks. Argiolas ja Melis, 1995, 2004, 2005 ja viitteet siinä ). Dopamiinireseptoriagonistien osalta NMDA: n indusoitu typpioksidinaasin aktivointi voi olla myös sekundaarinen lisääntyneelle Ca2 + -virtaukselle oksitosinergisten solujen elimissä Ca2 + -kanavalla kytkettyjen NMDA-reseptorien kautta, kuten useissa hermovalmisteissa on esitetty (tarkastelua varten katso Snyder, 1992; Southam ja Garthwaite, 1993, Schuman ja Madison, 1994 ja siinä olevat viitteet). Typpioksidi aktivoi vuorostaan oksitosinergistä neurotransmissiota (katso edellä). Glutamatergisten projektioiden alkuperää, jotka aktivoivat paraventrikulaarisia oksitosinergisiä neuroneja, jotka välittävät peniksen erektiota, ei tunneta, vaikka jotkut neuroanatomiset ja elektrofysiologiset todisteet viittaavat siihen, että ne voivat olla peräisin ainakin osittain hippokampuksesta (Saphier ja Feldman, 1987; Chen et ai., 1992) . Vaikka on tarpeen tehdä lisää työtä glutamatergisten ulokkeiden alkuperän karakterisoimiseksi paraventrikulaariseen ytimeen, glutamiinihapon osallistuminen paraventrikulaariseen ytimeen peniksen erektion ja seksuaalisen käyttäytymisen kontrolloinnissa tukee selvästi mikrodialyysitutkimuksia. Niinpä glutamiinihapon ja asparagiinihapon solun ulkopuoliset pitoisuudet lisääntyivät dialysaatissa, joka saatiin urosrottien paraventriculaarisesta ytimestä, jossa esiintyi epäkontakteja erektioita, kun ne asetettiin estymättömien estrogeeni + progesteronilla pohjustettujen reseptivien naarasrottien läsnä ollessa (Melis et ai., 2004b), peniksen erektio, jota välittävät myös keskusoksitosergisen siirron aktivointi (Melis et ai., 1999a, b). Tällaiset korotukset havaittiin vieläkin suuremmiksi, kun kopulointi vastaanottavan naaraan kanssa sallittiin (Melis et ai., 2004a). Hypoteesin mukaisesti, että paraventricularisessa ytimessä esiintyy herätteisten aminohappojen lisääntynyttä aktiivisuutta peniksen pystytyksen ja kopulaation aikana, sekä noncontact-erektiot että kopulaatiokäyttäytyminen (jonka aikana esiintyy kopula-peniksen erektiota) vähenevät NMDA-reseptorien esto paraventrikulaariseen ytimeen. ja tämä pelkistys seuraa sen typen oksidituotannon kasvun vähenemistä, joka tapahtuu tässä hypotalamuksessa, näissä fysiologisissa yhteyksissä (Melis et ai., 2000). Ekstrasellulaarisen glutamiinihapon pitoisuuden lisääntyminen toissijaisena GABA-vapautumisen vähenemisenä GABAergisen hermopäätteistä, jotka vaikuttavat oksitosiinergisten solujen elinten vieressä esiintyviin aminohappoergisiin synapseihin, havaittiin myös paraventrikulaarisessa ytimessä CB1-antagonistin SR 1A: n kannabinoidireseptorien salpauksen jälkeen. annetaan lateraaliseen kammioon tai suoraan paraventrikulaariseen ytimeen annoksilla, jotka indusoivat peniksen erektiota (katso Succu et ai., 141761; Castelli et ai., 2006). Tällainen lisäys johti typpioksidisyntaasin aktivoitumiseen oksitosinergisten neuronien soluelimissä, mikä lisää typpioksidin tuotantoa. Typpioksidi aktivoi vuorostaan oksitokinergisiä neuroneja, jotka välittävät peniksen erektiota edellä kuvatulla tavalla. Tällaisen mekanismin mukaisesti SR 141761A: n indusoimaa peniksen erektiota pienensi NMDA-reseptorien salpaus ja typpioksidisyntaasin estäjät, mutta ei dopamiini- tai oksitosiinireseptorien esto paraventricularisessa ytimessä, kun se estettiin Oksytosiinireseptoriantagonistien keskitetyt oksitosiinireseptorit, joille on annettu icv
3.3. Oksitosiini-dopamiinin vuorovaikutus ventral tegmental -alueella
Oksitosiini indusoi peniksen erektiota, kun se injektoidaan ventral tegmental -alueen caudal-osaan annosriippuvaisella tavalla (Melis et ai., 2007). Ainoastaan yksipuolisesti injektoitu pienin aktiivinen annos oli 20 ng, kun taas suurin testattu annos oli 100 ng. Oksitosiinivaikutusta välittää oksitosinergisten reseptorien aktivointi, koska seksuaalinen vaste poistetaan ennen injektiota oksitosiiniantagonistia d (CH2) 5Tyr (Me) 2-Orn8-vasotosiinia caudal-ventral tegmental -alueelle. Nämä reseptorit ovat lokalisoituneet dopaminergisten neuronien solukappaleisiin, jotka ulottuvat pääasiassa ydinkerhon kuoren päälle. Niinpä (1) kaksoisimmunfluoresenssitutkimukset osoittavat, että caudal-ventral tegmental -alueella oksitosinergiset kuidut ovat läheisessä yhteydessä dopaminergisten neuronien soluelimiin, joista suurin osa on leimattu positiivisesti tyrosiinihydroksylaasille ja jotka sisälsivät aikaisemmin retrograde-merkkiainetta Fluorogold injektoidaan ydinkerhon kuoreen (Melis et ai., 2007) ja (2) ventral tegmentaalisen alueen oksitosiinin aiheuttama peniksen erektio samanaikaisesti ylimääräisen solupitoisen dopamiinin konsentraation lisääntymisen kanssa dialysaatissa, joka on saatu kuoresta. ytimen accumbens (Melis et ai., 2007). Oksitosiinin aiheuttama peniksen erektio esiintyy samanaikaisesti myös typpioksidituotannon lisääntyessä ventral tegmentaalialueella, koska molemmat vasteet ovat antagonisoituja paitsi d (CH2) 5Tyr (Me) 2-Orn8-vasotosiini ja typpioksidisyntaasi-inhibiittori S- metyyli-tio-1-sitrulliini, mutta myös _-conotoxin, jännitteestä riippuva Ca2 + -kanavien salpaus ja ODQ (1H- [1,2,4] oksadiatsoli [4,3-a] kinoksaliini-1-on), voimakas guanylaatin estäjä syklaasi, kaikki annetaan caudal-ventral tegmental -alueella ennen oksitosiinia (Succu et ai., 2008). Koska monet Fluorogold-leimatut dopaminergiset soluelimet, joihin oksitosinergiset kuidut, joihin todettiin olevan positiivista tyrosiinihydroksylaasia, kosketuksissa verenpainekerroksen alueella, leimattiin myös positiivisesti typpioksidisyntaasin ja guanylaattisyklaasin (Succu et ai., 2008), oksitosiinin \ t seuraavan mekanismin välityksellä voidaan välittää indusoitua peniksen erektiota. Oksitosergisten reseptorien aktivointi dopaminergisissä solukappaleissa peptidin avulla lisää Ca2 + -virtausta dopaminergisten neuronien solukappaleiden sisään. Tämä aktivoi typpioksidisyntaasia, Ca2 + -kalmoduliinista riippuvaa entsyymiä, mikä lisää typpioksidin tuotantoa. Typpioksidi aktivoi vuorostaan guanylaattisyklaasia, mikä johtaa syklisen GMP: n lisääntyneeseen konsentraatioon. Syklinen GMP aktivoi dopaminergiset neuronit, jotka ulottuvat ydinasemaan. Syklisen GMP: n rooli peniksen erektiossa, jota indusoi oksitosiini, joka on injektoitu verisuonikalvon alueelle, tukee myös 8-bromisyklisen GMP: n, joka on aktiivisen fosfodiesteraasiresistentin analogisen syklisen GMP: n analogia, kyky aiheuttaa peniksen erektiota, kun se injektoidaan caudal-ventral tegmental -alue ja kasvattaa solun ulkopuolista dopamiinia dialysaatissa ydinsoluista (Succu et ai., 2008; Melis et ai., 2009a). Tämä on ristiriidassa mekanismin kanssa, jonka avulla typpioksidi aktivoi oksityyppisiä neuroneja paraventrikulaarisessa ytimessä, koska se on 8-bromisyklinen GMP, joka ei kykene indusoimaan peniksen erektiota, kun sitä injektoidaan tässä ytimessä (Melis ja Argiolas, 1995b). 2). Mitä tulee dopamiinin aktivoimiin hermosoluihin, jotka johtavat peniksen erektioon, nämä ovat vielä tuntemattomia. Käytettävissä olevat tiedot viittaavat kuitenkin siihen, että nämä reitit aktivoivat dopamiinin neurotransmissiota hypotalamuksen paraventrikulaarisessa ytimessä. Näin ollen oksitosiinin aiheuttama peniksen erektio tapahtuu samanaikaisesti solun ulkopuolisen dopamiinin lisääntymisen kanssa paitsi \ t ydinkerroin, mutta myös paraventricularisessa ytimessä, ja sitä vastustaa dopamiinireseptorin antagonisti haloperidoli, joka on injektoitu paraventrikulaariseen ytimeen (Melis et ai., 2007). Yhdessä nämä tulokset tukevat ajatusta siitä, että paraventrikulaarisesta ytimestä peräisin olevat oksitosinergiset neuronit ja ne, jotka ulottuvat kaudaliseen ventral tegmentaaliseen alueeseen, kun aktivoidaan vapautumisoksitosiini tällä alueella, aktivoimalla siten NO-syklinen GMP-signalointijärjestelmä, joka puolestaan aktivoi mesolimbiset dopaminergiset neuronit (Melis et ai., 2007, 2009a; Succu et ai., 2008). Ydinosassa vapautunut dopamiini aktivoi vuorostaan hermosoluja, jotka johtavat incerto-hypotalamisten dopaminergisten neuronien aktivoitumiseen, jotka stimuloivat selkäydin välittävään peniksen erektioon ulottuvia paraventricular oxytocinergisiä neuroneja. Samanaikaisesti paraventrikulaariseen ytimeen vapautunut dopamiini voi myös aktivoida oksitosinergisiä neuroneja, jotka ulottuvat hypotalamuksen ulkopuolisiin aivojen alueisiin, kuten ventral tegmental -alueeseen, hippokampukseen, amygdalaan ja ehkä muihin aivojen alueisiin.
Kuten edellä on muistutettu, tämän hypoteesin mukaisesti paraventrikulaariseen ytimeen injektoitu apomorfiini annoksella, joka indusoi peniksen erektiota, lisää myös solun ulkopuolista dopamiinipitoisuutta ytimen accumbensissa, joka on oksitosiinireseptorin antagonistin d (CH2) 5Tyr (Me ) 2-Orn8-vasotosiini, joka on injektoitu ventral tegmentaalialueelle (Succu et ai., 2007; Melis et ai., 2009a). Yllä mainitut hermoradat voivat yhdessä muodostaa hypoteettisen hermopiirin, johon liittyy dopamiini, oksitosiini ja muut neurotransmitterit (esim. Glutamiinihappo, katso jäljempänä), jotka vaikuttavat paitsi seksuaaliseen suorituskykyyn myös seksuaaliseen motivaatioon ja seksuaaliseen palkitsemiseen (katso osa 4).
3.4. Oksitosiini-glutamiinihappo-vuorovaikutus hippokampuksen ventral subiculumissa
Oksitosiini indusoi peniksen erektiota, kun sitä injektoidaan vatsakalvoon, mutta ei dorsaaliseen subiculumiin, annoksesta riippuvaisella tavalla (Melis et ai., 2009b). Seksuaalinen vaste välittyy oksitosiinireseptorien stimuloinnilla, ja se poistetaan aikaisemmalla d (CH2) 5Tyr (Me) 2-Orn8-vasotosiinin injektiolla samaan oksitosiinin kohtaan, kuten muissa aivojen alueilla (katso edellä) . Näiden reseptorien paikallistamisen osalta käytettävissä olevat tiedot viittaavat siihen, että ne ovat paikallisia typpioksidisyntaasissa rikkaiden hermosolujen soluelimissä.
Niinpä mikrodialyysitutkimukset osoittavat, että oksitosiinin aiheuttama peniksen erektio tapahtuu samanaikaisesti typpioksidituotannon lisääntymisen kanssa ventralisessa subiculumissa, ja tämä nousu poistetaan paitsi ennen typpioksidisyntaasi-inhibiittorin S-metyyli-tio-l-sitrulliinin injektiota ja typpioksidipoistinhemoglobiini, mutta myös d (CH2) 5Tyr (Me) 2-Orn8-vasotosiini, kaikki annetaan samaan oksitosiinin kohtaan annoksilla, jotka vastustavat peniksen erektiota (Melis et ai., 2010). Tärkeämpää on, että oksitosiinin aiheuttama peniksen erektio tapahtuu samanaikaisesti myös solun ulkopuolisen glutamiinihapon konsentraation lisääntyessä vatsaalisessa subiculumissa, jota ei-kilpaileva NMDA-reseptoriantagonisti (+) MK-801 antagonisoi vain osittain. ventral subiculum (Melis et ai., 2010). Yhdessä nämä tulokset viittaavat siihen, että äskettäin muodostunut typpioksidi aktivoituu solujen välisenä sananvälittäjänä aktivoimalla glutamiinihapon neurotransmissiota, joka johtaa peniksen erektioon, mahdollisesti hermosolujen kautta. subiculum hippokampaalisten aivojen alueille. Tämän oletuksen mukaisesti NMDA, joka on injektoitu vatsaaliseen subiculumiin, indusoi peniksen erektiota annoksesta riippuvaisella tavalla, ja tämä vaikutus on täysin antagonisoitu edeltävällä injektiolla samaan (+) MK-801-kohtaan, mutta ei S-metyyli-tio-l-sitrulliiniin , hemoglobiini tai d (CH2) 5Tyr (Me) 2-Orn8-vasotosiini (Melis et ai., 2010). Neurofferenttireitit, jotka ulottuvat hippokampus-aivojen alueille, jotka ovat aktivoituneiden aminohappojen (eli glutamiinihapon) aktivoimia vatsaalisessa subiculumissa, on todennäköistä, että nämä ovat glutamatergisiä, kuten myös suurin osa hippokampuksen efferentteistä ulokkeista. Tällä hetkellä voi vain ehdottaa, että nämä ennusteet moduloivat mesolimbisten dopaminergisten neuronien aktiivisuutta, jotka puolestaan moduloivat incerto-hypotalamisten dopaminergisten neuronien aktiivisuutta paraventrikulaarisessa ytimessä, mikä johtaa oksitosergisten neuronien aktivoitumiseen välittää peniksen erektiota, kuten jo keskusteltiin (Katso edellä).
Niinpä ventral subiculum oxytocinin indusoiman peniksen erektio tapahtuu samanaikaisesti, kun lisääntyy solun ulkopuolisen dopamiinin pitoisuus ytimen accumbensin kuoressa, ja tämä nousu, kuten peniksen erektio, poistuu d (CH2) 5Tyr (Me) 2- Orn8-vasotosiini, joka on annettu ventral subiculumiin ennen oksitosiinia (Melis et ai., 2009b). Lisäksi, koska ventral subiculum oxytocinin aiheuttama peniksen erektio vähenee myös (+) MK-801: lla, joka injektoidaan ventral tegmental -alueelle, mutta ei ydintekijöihin (Melis et ai., 2009b) ja esiintyy samanaikaisesti solun ulkopuolisen glutamiinihappo ventral tegmental -alueella, mutta ei ytimen accumbensissa, koska d (CH2) 5Tyr (Me) -Orn8-vasotosiini kumosi molemmat vasteet, jotka on injektoitu vatsan alaosaan ennen oksitosiinia (ks. kuva 3), on todennäköistä, että mesolimbisten dopaminergisten neuronien aktivointi on toissijainen lisääntyneelle glutamatergiselle neurotransmissiolle ventral tegmentaalialueella. Tämä viittaa siihen, että ventral tegmentaalialueella on glutamiinihappo-dopamiinin vuorovaikutus, joka kontrolloi peniksen erektiota. Lisätutkimukset ovat välttämättömiä sen selvittämiseksi, ovatko erektiohoidot efferenttiset glutametergiset reitit subiculumista ventral tegmentaaliseen alueeseen suorat tai epäsuorat, eli prefrontaalisen kuoren tai muiden aivojen alueiden kautta (katso Melis et ai., 2009b ja siinä olevat viitteet). Koska paraventrikulaarinen ydin vastaanottaa myös glutamatergisia projekteja hippokampuksesta (katso edellä ja Saphier ja Feldman, 1987), ja glutamiinihappo aktivoi paraventricular oxytocinergic neuronit mukaan lukien ne, jotka ulottuvat ventral tegmental -alueelle (katso Argiolas ja Melis, 2005 ja siinä olevat viitteet), ja oksitosiini ventral tegmental -alueella aiheuttaa peniksen erektiota ja lisää mesolimbisen dopaminergisen neuronin aktiivisuuttas (katso edellä) on houkuttelevaa spekuloida, että paraventrikulaariset oksitosinergiset neuronit voivat myös osallistua ainakin osittain mesolimbisten dopaminergisten neuronien aktivoitumiseen oksitosiinilla, joka on injektoitu vatsaaliseen alikalvoon (katso osa 4).
4. Päätelmät
Yllä tarkastellut tutkimukset vahvistavat ja laajentavat varhaisia havaintoja, jotka osoittavat, että urosrotilla oksitosiinilla on keskeinen rooli peniksen erektion keskushallinnossa hypotalamuksen ja selkäydin paraventrikulaarisen ytimen tasolla. Erityisesti enitensentin tutkimukset osoittavat, että oksitosiini vaikuttaa peniksen erektioon myös toimimalla muilla aivojen alueilla, eli ventral tegmental -alueella, ventral subiculumissa ja amygdalan posteromediaalisessa kortikaalisessa ytimessä..
Paraventrikulaarisella tasolla tärkein uusi havainto on ehkä D2-perheen (D2, D3 ja D4) kaikkien dopamiinireseptorien ilmentyminen paraventriculaarisen ytimen (ja supraoptisen ytimen ja oksatokinergisten neuronien) soluelimissä. mediaalinen preoptinen alue) (Baskerville ja Douglas, 2008; Baskerville et ai., 2009). Tämä antaa voimakkaan neuroanatomisen tuki hypoteesille, että dopamiini- ja dopamiinireseptoriagonistit voivat aktivoida suoraan oksitosergisiä neuroneja, jotka osallistuvat erektiohäiriöön ja jotka eivät ulotu pelkästään selkäytimeen, vaan myös hypotalamuksen ulkopuolisiin aivojen alueisiin. Tältä osin on myös tärkeää havaita, että dopamiinireseptorin agonistin aiheuttama intrakavernisen paineen nousu vähenee oksotosinergisten reseptorien tukkeutumalla lumbo- sakraalisessa selkäytimessä (Baskerville et ai., 2009). Itse asiassa, vaikka tällaisia todisteita on saatu nukutetuista urosrotista, havainto vahvistaa dopamiinireseptorin agonistin aiheuttaman peniksen erektioon osallistuvan paraventriculo-spinaalisen oksitosinergisen laskupolun aktivoitumisen. Hsilti on vielä selvitettävä, onko oksitosinergisissä solukappaleissa esiintyvien dopamiinireseptorien stimuloinnin aiheuttama peniksen erektio toissijainen D2-perheen (D2, D3 tai D4) spesifisen dopamiinireseptorin alatyypin aktivoinnin suhteen tai jos nämä reseptorialatyypit toimivat yhdessä erektiohäiriön moduloimisessa, mahdollisesti eri tavoin riippuen kontekstista, jossa peniksen erektio tapahtuu (katso Moreland et ai., 2004; Enguehard-Gueiffier et ai., 2006; Melis et ai., 2006a, b; Löber et ai., 2009, Collins et ai., 2009, Depoortère et ai., 2009, Baskerville et ai., 2009).
Toinen tärkeä uusi havainto on, että oksitosiini indusoi peniksen erektiota, kun sitä injektoidaan paitsi paraventrikulaariseen ytimeen tai hippokampuksen CA1-kenttään, mutta myös ventral tegmentaaliseen alueeseen, ventral subiculumiin ja amygdalan posteromediaaliseen kortikaaliseen ytimeen. Näitä aivojen alueita ei testattu aikaisemmissa tutkimuksissa, jotka osoittivat, että oksitosiini lisäsi spontaaneja peniksen erektio-jaksoja urosrotissa, vaikka he saivat samankaltaisia kuin lumbokristalli- set selkäydin oksitosinergiset projektiot paraventrikulaarisesta ytimestä. Oksitosiinia todettiin kykenevän kasvattamaan spontaaneja peniksen erektio-jaksoja, joita esiintyy aikuisilla urosrotilla ilman seksuaalisia ärsykkeitä, kuten sellaisia, jotka ovat peräisin saatavilla olevasta tai esteettömästä (estrogeeni-progesteronin pohjustetusta) munasarjojen naaraspuolisesta rotasta tai manipulaatio sukuelimiin, kun se on viety hippokampuksen paraventrikulaariseen ytimeen ja CA1-kenttään, mutta ei selkäosaelementtiin, lateraaliseen väliseinään, caudate-tumaan, mediaaliseen preoptiseen alueeseen, ventromediaaliseen ytimeen ja supraoptiseen ytimeen (Melis et ai. , 1986). Kaikissa näissä tutkimuksissa peniksen erektio laskettiin yleensä, kun penis nousi peniksen vaipasta sellaisella tarkkailijalla, joka ei ollut tietoinen annetuista hoidoista suoraan kokeilun aikana tai myöhemmin tarkkailemalla videonauhalla tallennettua koetta videokameralaitteella. Kukin peniksen erektiojakso kestää 0.5-1 min ja siihen liittyy yleensä peniksen hoito ja / tai lonkka-taipumukset. Näissä rotissa ei yleensä suoriteta kokeita seksuaalisen kokemuksen, iän vaikutuksen tai jos nämä rotat voidaan jakaa mataliin tai suuriin vasteisiin oksitosiinin eri aivojen alueille injektoidun pro-erektiohoidon vaikutukseen. Tämä pätee myös useimpiin tutkimuksiin, jotka koskevat muiden neuropeptidien ja lääkkeiden, jotka lisäävät spontaania peniksen erektio-jaksoja, mukaan lukien dopamiiniagonistit, eksitatoivat aminohapot, ACTH-MSH, heksareliini ja VGF-peptidit, pro-erektiohäiriöitä. Näiden yhdisteiden pro-erektiovaikutusta on kuitenkin toistuvasti vahvistettu telemetristen menetelmien avulla, jotka määrittävät peniksen erektio esiintymällä lisääntyvällä intrakavernisella paineella, joka tapahtuu spontaanisti tai näiden yhdisteiden antamisen jälkeen erilaisilla reiteillä, ts. Systeemisesti, intraserebroventrikulaarisesti tai suoraan spesifisiin aivotaseisiin painemikrotransduktorin implantin jälkeen suoraan luolaan (ks. Bernabè et ai., 1999). Ventral tegmental -alueella myös amygdalan ventral subiculum ja posteromediaalinen ydin aiheuttavat peniksen erektiota vaikuttamalla oksitosinergisiin reseptoreihin. Tämä johtaa ventral tegmental -alueelta peräisin olevien mesolimbisten dopaminergisten hermosolujen aktivoitumiseen ja ulkonemiseen ytimen accumbensin kuorelle, mitattuna solun ulkopuolisen dopamiinikonsentraation lisääntymisellä nukleiiniakumbenien kuoresta saadussa dialysaatissa ja näihin epähypotalamuksen alueisiin injektoidun peptidin aiheuttaman erektiohäiriön vähenemiseen, joka havaittiin dopaminergisten reseptorien estämisen jälkeen. (ks. alla). Mitä tulee mekanismeihin, jotka ovat aktivoituneet oksytosinergisten reseptorien stimuloinnissa näissä aivojen alueilla, jotka johtavat mesolimbisten dopaminergisten neuronien aktivoitumiseen ja peniksen erektioon, parhaiten selvitettäviä ovat ne, jotka esiintyvät caudal-ventral tegmental -alueella. Itse asiassa tässä farmakologisissa ja immunofluoresenssituloksissa todetaan, että oksitosiinin hermopäätteet vaikuttavat dopaminergisten hermosolujen solukappaleisiin, jotka ulottuvat ytimen accumbensin kuoreen (Melis et ai., 2007, 2009a; Succu et ai., 2008). Monet näistä neuroneista ovat runsaasti typpioksidisyntaasissa ja guanylaattisyklaasissa. Oksitosinergisten reseptorien stimulointi näiden dopaminergisten neuronien soluelimissä saa aikaan typpioksidisyntaasin aktivoitumisen, mikä johtaa lisääntyneeseen typpioksidituotantoon. Typpioksidi aktivoi vuorostaan guanylaattisyklaasia, mikä lisää syklisen GMP: n pitoisuutta, joka johtaa mesolimbisten dopaminergisten hermosolujen aktivoitumiseen ja dopamiinin vapautumiseen ytimen accumbensissa mitattuna solunsisäisen mikrodialyysin avulla saadun ydinsolujen dopamiinin lisääntyessä dialysaatissa (Succu et ai., 2008 ). Ydinaineeseen vapautunut dopamiini puolestaan aktivoi hermoratoja, jotka johtavat peniksen erektioon. Tätä tukee dopamiinireseptoriantagonistien haloperidolin ja / tai cis-flupentiksolin, joka on injektoitu ytimen accumbensiin, kyky vähentää ventral tegmentaalisen alueen oksitosiinin aiheuttamaa peniksen erektiota (Succu et ai., 2008). Eräs pro-erektiokäyristä näyttää aktivoivan incerto-hypotalamisia dopaminergisia neuroneja, erityisesti niitä, jotka kehittyvät paraventrikulaaristen oksitosinergisten neuronien soluelimiin. Itse oksitosiini, joka on injektoitu verisuonten vatsakalvon alueelle, lisää ekstrasellulaarista dopamiinia paitsi ytimessä, myös paraventrikulaarisessa ytimessä, ja dopamiinireseptorien esto paraventricularisessa ytimessä vähentää merkittävästi ventral tegmentaalisen alueen oksitosiinin aiheuttamaa peniksen erektiota (Succu et ai. 2007, 2008, Melis et ai., 2007, 2009a). Näiden ytimien olemassaolo on dopamiini-paraventrikulaarinen dopamiini-paraventrikulaarinen oksitosiini-ventral tegmentaalinen alue oksitosiini-dopamiini-linkit myös ehdottaa, että apomorfiinin ja D4-reseptoriagonistin PD 168077: n pro-erektiohäiriön, joka on injektoitu paraventrikulaariseen ytimeen, kyky lisätä solun ulkopuolista dopamiinia ydinkerhon kuoressa (Succu et ai., 2007), vaste joka poistetaan d (CH2) 5Tyr (Me) -Orn8-vasotosiinilla, joka on annettu ventral tegmental -alueelle (Melis et ai., 2009a, katso myös alla). Lisätyötä on kuitenkin tarpeen tunnistaa neuraalireitit, jotka yhdistävät ytimen accumbensin incerto-hypotalamuksen dopaminergiseen järjestelmään.
Mekanismi, jolla oksitosiini indusoi peniksen erektiota ja aktivoi mesolimbiset dopaminergiset neuronit, kun ne injektoidaan ventral subiculumiin tai amygdalan posteromediaaliseen ytimeen, ymmärretään vain osittain. Näillä alueilla myös oksitosiini aktivoi omat reseptorit, jotka johtavat typpioksidisyntaasin aktivoitumiseen, mikä lisää typpioksidin tuotantoa. Typpioksidi aktivoi vuorostaan tuntemattomia efferentteja ulokkeita, jotka ilmeisesti lisäävät glutamatergistä neurotransmissiota ventral tegmental -alueella. Glutamiinihappo stimuloi sitten mesolimbisia dopaminergisia neuroneja, jotka johtavat peniksen erektioon. Tätä hypoteesia tukevat pääasiassa oksitosiinin, joka on injektoitu ventral subiculumiin, kyky lisätä solun ulkopuolista glutamiinihappoa ventral tegmental -alueella (kuv. 3) ja ei-kilpailukykyinen NMDA-reseptoriantagonisti (+) MK-801 injektoidaan ventral tegmentaaliseen alueeseen, mutta ei ydintekijöihin, oksitosiinin aiheuttaman peniksen erektion vähentämiseksi joko vatsaaliseen subiculumiin tai posteromediaaliseen ytimeen (Melis et ai., 2009b). Tällä hetkellä on saatavilla tarkempia tietoja vatsakalvon oksitosiinin aiheuttamasta peniksen erektiosta. Tässä oksitosiinin aiheuttama peniksen erektio tuntuu toissijaisena typpioksidisyntaasin sisältävien neuronien soluelimiin sijoitettujen oksitosinergisten reseptorien aktivoitumiseen. Tämä aiheuttaa typpioksidin tuotannon lisääntymisen, joka aktivoi glutamatergistä neurotransmissiota toimimalla solujen välisenä viestintävälineenä mekanismilla, joka on samanlainen kuin pitkäkestoisen potentiaalin (katso Snyder, 1992; Southam ja Garthwaite, 1993; Schuman ja Madison, 2004; . Tämän hypoteesin mukaisesti oksitosiinin aiheuttama peniksen erektio tapahtuu samanaikaisesti ekstrasellulaarisen glutamiinihapon lisääntymisen kanssa vatsaalisen subikulaatin dialysaatissa, ja stimuloivan aminohappo-reseptorien stimulointi ventral subiculumissa NMDA: lla indusoi peniksen erektiota. Glutamiinihappo puolestaan aktivoi neuraalisia efferentteja ulokkeita, jotka johtavat mesolimbisten dopaminergisten neuronien aktivoitumiseen ventral tegmentaalialueella, kuten edellä on raportoitu. Jos nämä mekanismit toimivat myös amygdalan posteromediaalisessa ytimessä, se on tällä hetkellä tuntematon. Lisäksi on tarpeen tehdä lisätutkimuksia sen osoittamiseksi, että (1) oksitosinergiset hermopäätteet ja reseptorit ventralisessa subiculumissa ja amygdalan posteromediaalisessa ytimessä ovat paikallisia typpioksidisyntaasia sisältävien neuronien solukappaleissa (2), jos nämä neuronit ovat lopulta eksitatoivien aminohappojen (glutamatergisten) synapsien ja (3) valvonnassa typpioksidin aktivoiman signalointijärjestelmän tunnistamiseksi. Tältä osin on huomionarvoista, että oksitosiinin kyky lisätä typpioksidisyntaasin aktiivisuutta dopaminergisten neuronien solukappaleissa caudal-ventral tegmental -alueella ja vielä tuntemattomista neuroneista ventral subiculumissa ja amygdalan posteromediaalinen ydin palauttaa mieleen oksitosiinin kyky aktivoida typpioksidisyntaasia oksitosinergisten neuronien soluelimissä paraventrikulaarisessa ytimessä (Melis et ai., 1997). Kuitenkin, vaikka ventral tegmental -alueella lisääntynyt typpioksidin tuotanto dopaminergisten hermosolujen solukappaleissa johtaa näiden neuronien aktivoitumiseen aktivoimalla guanylaattisyklaasia ja lisäämällä syklistä GMP: tä, tämä ei tapahdu paraventrikulaarisessa ytimessä. Niinpä 8-bromisyklinen GMP, joka on injektoitu paraventrikulaariseen ytimeen, ei indusoi peniksen erektiota, kun se tekee sen ruiskutettuna ventral tegmental -alueelle. Toinen signalointi, joka eroaa typpioksidisyklisestä GMP-järjestelmästä, osallistuu sitten paraventrikulaariseen tasoon, kun endogeenisen ja / tai eksogeenisen typpioksidin avulla peniksen erektio välittävät oksitosinergiset neuronit aktivoituvat (Melis ja Argiolas, 1995b; Melis et ai., 1997) (kuvio . 1). Toisaalta syklinen GMP ventral tegmental -alueella näyttää myös olevan avainasemassa mesolimbisten dopaminergisten hermosolujen aktivoinnissa ja solun ulkopuolisen dopamiinin lisääntymisessä, joka esiintyy dialysaatissa, joka on saatu urosrottien ytimestä. on valittu osoittamaan tai olemaan osoittamatta ei-kontaktien peniksen erektioita, kun ne asetetaan käsiksi pääsyyn ulottumattomissa munasarjojen poistuneessa (estrogeeni + progesteronilla käsitelty) rotan rotassa. Näissä koeolosuhteissa urospuolisilla rotilla, joilla oli ei-kontakti peniksen erektio, havaitaan solun ulkopuolisen dopamiinipitoisuuden lisääntyminen odotetulla tavalla, ja fosfodiesteraasi-inhibiittoreilla, jotka annetaan caudal-ventral tegmental -alueelle, tämä lisäys lisääntyy, vaikkakin vain vaatimattomasti (Sanna et. al., 2009).
Oksitosiinin, joka on injektoitu ventral tegmentaaliseen alueeseen, ventral subiculumiin ja posteromediaaliseen kortikaaliseen ytimeen, kykyä yhdessä paraventricular-ytimessä injektoitujen dopamiiniagonistien kanssa peniksen erektion indusoimiseksi ja mesolimbisten dopaminergisten neuronien aktivoimiseksi ansaitsevat joitakin kommentteja . Ensinnäkin edellä mainitut muistuttavat mekanismit voivat toimia silloin, kun peniksen erektio tapahtuu fysiologisissa yhteyksissä, kuten kopulaation aikana (kun esiintyy kopulaarisen peniksen erektiossa) tai ei-kontaktien peniksen erektiossa. Nämä erektiot ovat feromonivälitteisiä peniksen erektioita, joita ei voida erottaa lääkkeiden tai oksitosiinin indusoimista erektioista, joita esiintyy, kun seksuaalisesti voimakkaita urosrottia laitetaan estämättömän vastaanottavan (munasarjojen poistama estrogeeni + progesteroni pohjustettu) rotta ja katsotaan seksuaalisen indeksiin. arousal (Sachs, 1997, 2007). Vaikka nämä tulokset eivät kuitenkaan osoita, että oksitosiini näillä alueilla on tärkeä fysiologisissa yhteyksissä tai lääkkeen antamisen jälkeen esiintyvässä peniksen erektiossa, ne lisäävät vahvuutta varhaisiin havaintoihin, mikä viittaa siihen, että nämä aivojen alueet kuuluvat niihin, joissa keskitetysti annettava oksitosiini lisääntyy paitsi spontaanin peniksen erektio-jaksot, jotka ovat nähty pro-erektiohoitojen jälkeen, mutta myös parantamaan miesten (ja naisten) seksuaalista käyttäytymistä (ks. Argiolas ja Melis, 2004 ja siinä olevat viitteet). Niinpä oksitosiinipitoisuus kasvaa urosrottien hippokampuksessa, joka on käsitelty apomorfiinin pro-erektioannoksella, klassisella dopamiiniagonistilla (Melis et ai., 1990) ja d (CH2) 5Tyr (Me) -Orn8-vasotosiinilla, joka estää oksitosiinia reseptorit, on erittäin tehokas paitsi heikentämään kopulaatiokäyttäytymistä (Argiolas et ai., 1987a), myös apomorfiinin helpottava vaikutus miesten kopulaatiokäyttäytymiseen (Argiolas et ai., 1987b) seksuaalisesti voimakkaissa urosrotissa, joiden aikana kopulan peniksen erektiossa esiintyä. d (CH2) 5Tyr (Me) -rn8-vasotosiini on myös erittäin tehokas vähentämään ei-kontaktien erektioita seksuaalisesti voimakkaissa urosrotissa, kun ne annetaan nano-määrinä lateraaliseen kammioon, mutta ei PVN: aan (Melis et ai., 1999a).
Toiseksi, mesolimbisilla dopaminergisilla neuroneilla on keskeinen rooli luonnon vahvistavien ärsykkeiden, kuten ruoan, veden ja seksuaalisen aktiivisuuden, motivoivissa ja palkitsevissa ominaisuuksissa (Fibiger ja Phillips, 1988; Wise ja Rompre, 1989; Everitt, 1990). Erityisesti näiltä neuroneilta vapautuneen dopamiinin uskotaan välittävän luonnollisten ärsykkeiden motivoivien näkökohtien siirtymistä tavoitteeseen suunnattuun käyttäytymiseen, esimerkiksi seksuaalisen toiminnan, seksuaalisen kumppanin ja seksuaalisen yhdistyksen etsimisessä saavuttaakseen palkinnon ja tyytyväisyyden (Goto ja Grace, 2005). Niinpä ekstrasellulaarinen dopamiinipitoisuus kasvaa dialysaatissa sukupuolisesti voimakkaiden urosrottien ytimen accumbensin altistumisesta pääsyyn ulottumattomille munasarjojen poistamille estrogeeni + progesteronilla pohjustetuille naarasrotille, ja tällainen nousu oli vieläkin suurempi, kun uros rotan annettiin kopuloida vastaanottavan naisen kanssa (Pfaus ja Everitt, 1995).
Kolmanneksi esillä olevat tulokset tukevat hypoteesia siitä, että hermopiiri yhdistää paraventrikulaarisen ytimen ventral tegmentaaliseen alueeseen suoraan tai epäsuorasti (amygdalan ventral subiculumin ja / tai posteromediaalisen kortikaalisen ytimen kautta) ja ytimen accumbensin ja täältä tuntemattoman reitit takaisin paraventrikulaariseen ytimeen kontrolloidakseen selkäydin välittävän peniksen erektioon ulottuvien oksitosinergisten neuronien ja ventral tegmentaaliseen alueeseen, ventral subiculumiin ja amygdalan posteromediaaliseen kortikaaliseen ytimeen ulottuvien oksitosergisten neuronien aktiivisuutta. desolamiinisten neuronien aktiivisuus (kuvio 4). Tämä monimutkainen hermopiiri voi olla osallisena fysiologisissa yhteyksissä miesten seksuaalisen käyttäytymisen kulutus- (erektiohäiriö-) ja ennakoivien (motivoivien ja palkitsevien) näkökohtien hallintaan liittyvien hermotoimintojen integrointiin. Itse asiassa, solun ulkopuolinen dopamiini lisääntyy ydintekijöissä (Pfaus ja Everitt, 1995) ja seksuaalisesti voimakkaiden urosrottien paraventricularisessa ytimessä altistumattomana vastaanottaville naarasrotille, kun ei-kontakti erektioita esiintyy, ja vielä enemmän, kun kopulaatio on sallittua, esim. kun kopulassa esiintyy peniksen erektiota (Melis et ai., 2003). Siten, vaikka lisätutkimukset ovat välttämättömiä endogeenisen oksitosiinin roolin selvittämiseksi ventral tegmental -alueella, ventralisessa subiculumissa ja amygdalassa ei-kosketuksissa olevien erektioiden ja seksuaalisen käyttäytymisen aikana, voi olla järkevää olettaa, että tämä hypoteettinen hermopiiri, samalla kun se myötävaikuttaa seksuaalisen käyttäytymisen kuluttavat näkökohdat voivat samalla aktivoida mesolimbisen dopaminergisen järjestelmän, joka tarjoaa hermosubstraatin seksuaalisen aktiivisuuden palkitsevien ominaisuuksien selittämiseksi (Everitt, 1990; Pfaus ja Everitt, 1995). Tässä suhteessa on huomionarvoista, että ventral tegmentaaliseen alueeseen injektoidun oksitosiinin aktivoiman mesolimbisen dopaminergisen järjestelmän aktivoivat väärinkäytösten kaltaiset lääkkeet, kuten opiaatit, kannabinoidit, amfetamiini, kokaiini ja alkoholi (Tanda et ai., 1997) ja että oksitosiini pystyi vähentämään toleranssia ja riippuvuutta kokaiinista, morfiinista, alkoholista ja kannabinoideista (Kovacs et ai., 1998; Cui et ai., 2001). Johtopäätöksenä näyttää siltä, että oksitosiini, joka vapautuu paitsi ventral tegmental -alueella, myös amprdalan ventral subiculumissa ja posteromediaalisessa kortikaalisessa ytimessä, voi aktivoida mesolimbisia dopaminergisia neuroneja, jotka voivat olla mukana seksuaalisen aktiivisuuden ruokahaluttavissa ja palkitsevissa vaikutuksissa . Mesolimbisten dopaminergisten hermosolujen aktivointi voi olla suora oksotsosergisten reseptorien kautta mesolimbisten dopaminergisten hermosolujen soluelimissä tai epäsuora kautta glutamiinihapon neurotransmissioon aktivoimalla ventral tegmentaalialueella.
Ytimen accumbens-kuoressa vapautunut dopamiini moduloi vuorostaan paraventricularisessa ytimessä olevien incerto-hypotalamisten dopaminergisten neuronien aktiivisuutta, joka aiheuttaa joko peniksen erektio (selkäytimeen ulottuvien oksitosinergisten neuronien aktivoinnin kautta) tai seksuaalinen motivaatio ja palkkio (oksitosiiniergisen aktivoinnin kautta) neuronit, jotka ulottuvat ventral tegmentaaliseen alueeseen, ventral subiculumiin tai amygdalan posteromediaaliseen kortikaaliseen ytimeen). Koska dopamiini vapautuu myös ytimen accumbens-kuoressa ja paraventrikulaarisessa ytimessä, kun peniksen erektio tapahtuu fysiologisissa yhteyksissä (esim. Koskematon erektio ja kopulaatio) (Succu et ai., 2007; Melis et ai., 2003, 2007), se on todennäköistä, että keski-oksitosergiset neuronit osallistuvat neuroverkkoon, joka välittää vuorovaikutuksen mesolimbisen ja incerto-hypotalamuksen dopaminergisen järjestelmän välillä. Näillä hermopiireillä voi olla merkitystä paitsi seksuaalisen käyttäytymisen kulutusvaiheessa (esim. Peniksen erektio ja kopulaatio), myös seksuaalisen motivaation, seksuaalisen kiihottumisen ja seksuaalisen palkinnon yhteydessä.
Kaavamainen esitys hypoteettisesta hermopiiristä, johon liittyy oksitosiinia, joka vaikuttaa seksuaaliseen motivaatioon, palkitsevaan ja seksuaaliseen suorituskykyyn, kuten tämän luvun ja aiempien raporttien tulokset osoittavat. Paraventricular-ytimestä peräisin olevat ja selkäytimeen ulottuvat oksitosergiset neuronit, jotka aktivoituvat esimerkiksi dopamiinin ja glutamiinihapon (mutta myös muiden neurotransmitterien ja / tai neuropeptidien) avulla, helpottavat peniksen erektiota ja seksuaalista suorituskykyä aktivoimalla selkäytimeen ulottuvia oksitosinergisiä neuroneja. Paraventrikulaarisen ytimen dopamiini ja glutamiinihappo (mutta myös neurotransmitterit ja neuropeptidit) aktivoivat myös oksitokinergiset neuronit, jotka ulottuvat ventral tegmental -alueelle, aktivoimalla siten mesolimbiset dopaminergiset neuronit, jotka ulottuvat ydinasemaan, moduloimalla seksuaalista motivaatiota ja palkitsevuutta. Ydinvoimalla (NAs) vapautunut dopamiini aktivoi vuorostaan vielä tuntemattomia hermosoluja, jotka lisäävät incerto-hypotalamisten dopaminergisten hermosolujen (jotka ovat peräisin Dahlstromin ja Fuxen A13-A14-ryhmistä peräisin olevia) aktiivisuutta, jotka häiritsevät munuaisia oksitosinergisillä neuroneilla, mukaan lukien ne, jotka hankkivat selkäydin, joka johtaa peniksen erektioon. Tämä piiri voidaan aktivoida myös oksitosiinilla, joka on injektoitu paitsi verisuonten vatsakalvon alueelle, myös myös ventral-subiculumiin ja amygdalaan, joka myös saa oksitosinergisen inervaation paraventrikulaarisesta ytimestä, mahdollisesti suoran tai epäsuoran glutamatergisen efferentin kautta ventraliin. sekä seksuaalisen motivaation että peniksen erektio. Lopuksi edellä mainitut piirit voidaan aktivoida myös seksuaalisten ärsykkeiden ja feromonien avulla, koska solun ulkopuolinen dopamiini ja glutamiinihappo lisääntyvät paraventrikulaarisessa ytimessä (ja mediaalisessa preoptisessa alueella) feromonivälitteisten epäkontaktisten erektioiden ja kopulaation aikana (sopivien viitteiden kohdalla katso Viitteiden luettelo).
Kiitokset Tämä työ on osittain tuettu Italian yliopiston ministeriön ja tutkimuslaitoksen avustuksella AA: lle ja MRM: lle
Viitteet
Andersson, KE, 2001. Peniksen erektion farmakologia. Pharmacol. Rev 53, 417-450. Argiolas, A., 1994. Typpioksidi on peniksen erektion keskeinen välittäjä. Neurofarmakologia 33, 1339-1344. Argiolas, A., 1999. Neuropeptidit ja seksuaalinen käyttäytyminen. Neurosci. Biobehav. Rev 23, 1127-1142. Argiolas, A., Gessa, GL, 1991. Oksitosiinin keskeiset toiminnot. Neurosci. Biobehav. Rev 15, 217-231. Argiolas, A., Melis, MR, 1995. Peniksen erektion neuromodulointi: yleiskuva neurotransmitterien ja neuropeptidien roolista. Prog. Neurobiol. 47, 235-255. Argiolas, A., Melis, MR, 2004. Oksitosiinin ja paraventrikulaarisen ytimen rooli urospuolisten nisäkkäiden seksuaalisessa käyttäytymisessä. Physiol. Behav. 83, 309-317. Argiolas, A., Melis, MR, 2005. Peniksen erektion keskushallinta: hypotalamuksen paraventrikulaarisen ytimen rooli. Prog. Neurobiol. 76, 1-21. Argiolas, A., Collu, M., Gessa, GL, Melis, MR, Serra, G., 1988. Oksitosiiniantagonisti d (CH2) 5Tyr (Me) -Orn8-vasotosiini antagonisoi miesten kopulaatiokäyttäytymistä rotissa. E. J. Pharmacol. 149, 389-392. Argiolas, A., Collu, M., D'Aquila, P., Gessa, GL, Melis, MR, Serra, G., 1989. Myrkyllisen kopulatorisen käyttäytymisen apomorfiinin stimulaatio estyy oksitosiiniantagonistilla d (CH2) 5Tyr (Me) -Orn8-vasotosiinilla rotilla. Pharmacol. Biochem. Behav. 33, 81-83. Argiolas, A., Melis, MR, Gessa, GL, 1985. Intraventrikulaarinen oksitosiini indusoi haukottelua ja peniksen erektiota rotilla. E. J. Pharmacol. 117, 395-396. Argiolas, A., Melis, MR, Gessa, GL, 1986. Oksitosiini: erittäin voimakas peniksen erektio ja haukottelu miespuolisilla rotilla. E. J. Pharmacol. 130, 265-272. Argiolas, A., Melis, MR, Mauri, A., Gessa, GL, 1987a. Paraventrikulaarinen ytimen vaurio estää apomorfiinin ja oksitosiinin aiheuttamaa haukottelua ja peniksen erektiota, mutta ei ACTH: lla rotilla. Brain Res. 421, 349-352. Argiolas, A., Melis, MR, Vargiu, L., Mauri, A., Gessa, GL, 1987b. d (CH2) 5Tyr (Me) -Orn8-vasotosiini, voimakas oksitosiiniantagonisti, antagonisoi oksitosiinin ja apomorfiinin aiheuttamaa peniksen erektiota ja haukkumista, mutta ei ACTH 1-24. E. J. Pharmacol. 134, 221-224. Argiolas, A., Melis, MR, Stancampiano, R., Gessa, GL, 1990. _-Conotoxin estää apomorfiinin ja oksitosiinin aiheuttaman peniksen erektio ja haukkumisen urosrotilla. Pharmacol. Biochem. Behav. 37, 253-257. Arletti, R., Bertolini, A., 1985. Oksitosiini stimuloi lordoosien käyttäytymistä naaraspuolisilla rotilla. Neuropeptidit 6, 247-255. Arletti, R., Bazzani, C., Castelli, M., Bertolini, A., 1985. Oksitosiini parantaa miesten kopulaatiokykyä rotilla. Horm. Behav. 19, 14-20. Arletti, R., Benelli, A., Bertolini, A., 1990. Ikääntyvien urosrottien seksuaalista käyttäytymistä stimuloi oksitosiini. E. J. Pharmacol. 179, 377-382. Arletti, R., Calzà, L., Giardino, L., Benelli, A., Cavazzutti, E., Bertolini, A., 1997. Seksuaalinen impotenssi liittyy oksitosiinin vähenemiseen ja opioidipeptidien lisääntyneeseen tuotantoon hypotalamuksen paraventricularisessa ytimessä. Neurosci. Lett. 233, 65-68. Bancila, M., Giuliano, F., Rampin, O., Mailly, P., Brisorgueil, MJ, Clas, A., Verge, D., 2002. Todisteet siitä, että hypotalamuksen paraventrikulaarisesta ytimestä on suora projektio nukleotidin oletettavien serotoninergisten neuronien suhteen, jotka osallistuvat erektio-ohjaukseen rotilla. E. J. Neurosci. 16, 1240-1249. Burnett, AL, Lowenstein, CJ, Bredt, DS, Chang, TSK, Snyder, SH, 1992. Typpioksidi: fysiologinen välittäjä peniksen erektioon. Tiede 257, 401-403. Baskerville, TA, Douglas, AJ, 2008. Dopamiinin ja oksitosiinin vuorovaikutus seksuaalisen käyttäytymisen hallintaan. Prog. Brain Res. 170, 277-289. Baskerville, TA, Allard, J., Wayman, C., Douglas, AJ, 2009. Dopamiini-oksitosiinin vuorovaikutus peniksen erektiossa. E. J. Neurosci. 30, 2151-2164. Benelli, A., Bertolini, A., Poggioli, R., Cavazzutti, E., Calzà, L., Giardino, L., Arletti, R., 1995. Typpioksidi on mukana rottien urospuolisessa käyttäytymisessä. E. J. Pharmacol. 294, 505-510. Bernabè, J., Rampin, O., Sachs, BD, Giuliano, F., 1999. Intracavernous paine erektiossa rotilla: integroiva lähestymistapa, joka perustuu telemetriseen tallennukseen. Olen. J. Physiol. 276, R441-R449. Bitner, RS, Nikkel, AL, Otte, S., Martino, B., Barlow, EH, Bhatia, P., Stewart, AO, Brioni, JD, Decker, MW, Moreland, RB, 2006. Dopamiini D4-reseptorin signalointi rotan paraventrikulaarisessa hypotalamuksessa: todiste luonnollisesta kytkeytymisestä, johon liittyy välitön varhainen geenin induktio ja mitogeeniaktivoitunut proteiinikinaasifosforylaatio. Neurofarmakologia 50, 521-531. Brioni, JD, Moreland, RB, Cowart, M., Hsieh, GC, Stewart, AO, Hedlund, P., Donnelly-Roberts, DL, Nakane, M., Lynch 3rd., J., Kolasa, T., Polakowski , JS, Osinski, MA, Marsh, K., Andersson, KE, Sullivan, JP, 2004. DT-4-dopamiini-D724-reseptorien aktivointi indusoi peniksen erektiota rotilla. Proc. Natl. Acad. Sei. Yhdysvallat 101, 6758-6763. Buijs, RM, 1978. Rotan sisäiset ja ylimääräiset hypopotaaliset vasopressiini- ja oksitosiinireitit. Cell Tissue Res. 192, 423-435. Buijs, RM, Geffard, M., Pool, CW, Hoorneman, EMD, 1984. Supraoptic- ja paraventrikulaarisen ytimen dopaminerginen inervaatio. Valo- ja elektronimikroskooppinen tutkimus. Brain Res. 323, 65-72. Caldwell, JD, Prange, AJ, Pedersen, CA, 1986. Oksitosiini helpottaa estrogeenilla käsiteltyjen naaraspuolisten rottien seksuaalisuutta. Neuropeptidit 7, 175-189. Cameron, JL, Pomerantz, SM, Layden, LM, Amico, JA, 1992. Oksitosiinin pitoisuuksien dopaminerginen stimulointi urospuolisten ja naaraspuolisten apinoiden plasmassa apomorfiinin ja D2-reseptoriagonistin avulla. J. Clin. Endocrinol. Metab. 75, 855-860. Canteras, NS, Simerly, RB, Swanson, LW, 1995. Amygdalan mediaalisen ytimen ennusteiden järjestäminen: PHAL-tutkimus rotalla. J. Comp. Neurol. 360, 213-245. Carmichael, MS, Humbert, R., Dixen, J., Palmisano, G., Greeleaf, W., Davidson, JM, 1987. Plasman oksitosiini lisää ihmisen seksuaalista vastetta. J. Clin. Endocrinol. Metab. 64, 27-31. Carter, CS, 1992. Oksitosiini ja seksuaalinen käyttäytyminen. Neurosci. Biobehav. Rev 16, 131-144. Carter, CS, Lederhendler, II, Kirkpatrick, B., 1997. Interaktiivinen neurobiologia, New Yorkin tiedeakatemian Annals, vol. 807. New Yorkin tiedeakatemia, New York. Castelli, MP, Piras, AP, Melis, T., Succu, S., Sanna, F., Melis, MR, Collu, S., Ennas, MG, Diaz, G., Mackie, K., Argiolas, A. , 2007. Kannabinoidit CB1-reseptorit paraventrikulaariseen ytimeen ja peniksen erektion keskushallinta: immunosytokemia, autoradiografia ja käyttäytymistutkimukset. Neurotiede 147, 197-206. Chen, KK, Chang, LS, 2003. Erittävien aminohappojen reseptoriagonistien vaikutus peniksen erektioon hypotalamuksen paraventrikulaariseen ytimeen antamisen jälkeen rotilla. J. Urol. 62, 575-580. Chen, KK, Chan, JYH, Chang, LS, Chen, MT, Chang, SHH, 1992. Peniksen erektio ilmaistaan rotan hippokampuksen muodostumisen aktivoinnin jälkeen. Neurosci. Lett. 141, 218-222. Chen, KK, Chan, JYH, Chang, LS, 1999. Dopaminerginen neurotransmissio hypotalamuksen paraventrikulaarisen ytimen kohdalla peniksen erektio keskeisellä säätelyllä rotalla. J. Urol. 162, 237-242. Collins, GT, Truccone, A., Haji-Abdi, F., Newman, AH, Grundt, P., Rice, KC, Husbands, SM, Greedy, BM, Enguehard-Gueiffer, C., Gueiffer, A., Chen , J., Wang, S., Katz, JL, Grandy, DK, Sunahara, RK, Woods, JH, 2009. D2-reseptori välittää dopamiiniD3-kaltaisten agonistien pro-erektiohäiriöitä rotilla ja hiirillä. J. Pharmacol. Exp. Ther. 329, 210-217. Coolen, LM, Allard, J., Truitt, WA, McKenna, KE, 2004. Siemensyöksyn keskeinen säätely. Physiol. Behav. 83, 203-215. Cui, SS, Bowen, RC, Gu, GB, Hannesson, BK, Yu, PH, Zhang, X., 2001. Kannabinoidien vieroitusoireyhtymän ennaltaehkäisy litiumilla: oksitosinergisen neuronaalisen aktivaation osallistuminen. J. Neurosci. 21, 9867-9876. Dahlstrom, A., Fuxe, K., 1964. Todisteet monoamiinia sisältävien neuronien olemassaolosta keskushermostossa. I. Monoamiinien demonstrointi aivoriihi-neuronien solukappaleissa. Acta Physiol. Scand. 62 (Suppl. 232), 1-54. Depoortère, R., Bardin, L., Rodrigues, M., Abrial, E., Aliaga, M., Newman-Tancredi, A., 2009. Dopamiini D2-kaltaisten reseptoriagonistien aiheuttama peniksen erektio ja haukkuminen rotilla: dopamiinin D2in, mutta ei D3- ja D4-reseptorien, kannan vaikutus ja vaikutus. Behav. Pharmacol. 20, 303-311. Domes, G., Heinrichs, M., Buchel, C., Braus, DF, Herpertz, SC, 2007. Oksitosiini heikentää amygdala-vastauksia emotionaalisiin kasvoihin valenssista riippumatta. Biol. Psykiatria 62, 11871190. Dominguez, J., Riolo, JV, Xu, Z., Hull, ME, 2001. Säätäminen kopulaation ja mediaalisen preoptisen dopamiinin vapautumisen mediaalisen amygdalan avulla. J. Neurosci. 21, 349-355. Donaldson, ZR, Young, LJ, 2009. Oksitosiini, vasopressiini ja sosiaalisuuden neurogenetiikka. Tiede 322, 900-904. Eaton, RG, Markowski, VF, Lumley, LA, Thompson, JT, Moses, J., Hull, EM, 1991. Paraventrikulaarisen ytimen D2-reseptorit säätelevät sukupuolielinten vasteita ja kopulaatiota urosrotilla. Pharmacol. Biochem. Behav. 39, 177-181. Ebner, K., Bosch, EYVL, Krömer, SA, Singewald, N., Neumann, ID, 2005. Oksitosiinin vapautuminen rotan keski-amygdalassa moduloi stressin selviytymiskäyttäytymistä ja eksitatoristen aminohappojen vapautumista. Neuropsykofarmakologia 30, 223-230. Enguehard-Gueiffier, C., Hübner, H., El Hakmaoui, A., Allouchi, H., Gmeiner, P., Argiolas, A., Melis, MR, Gueiffier, A., 2006. 2 - [(4-fenyylipiperatsin-1-yyli) metyyli] imidatso (di) atsiinit valikoivina D4-ligandeina. Peniksen erektion indusointi 2- [4- (2-metoksifenyyli) piperatsin-1-yylimetyyli] imidatso [1,2-a] pyridiini (PIP3EA), voimakas ja selektiivinen D4-agonisti. J. Med. Chem. 49, 3938-3947. Everitt, BJ, 1990. Seksuaalinen motivaatio: herkän ja kopulaatioreaktion vastaisten mekanismien hermo- ja käyttäytymisanalyysi. Neurosci. Biobehav. Rev 14, 217-232. Fibiger, HC, Phillips, AG, 1988. Mesokortikolimbinen dopamiinijärjestelmä ja palkkio. Ann. N. Y. Acad. Sei. 5, 206-215. Ranskalainen, SJ, Totterdell, S., 2003. Yksittäiset ytimen accumbens-projektio-neuronit saavat sekä basolateraalisia amygdala- että ventral-subicular-afferenteja rotilla. Neurotiede 119, 19-31. 954 MR Melis, A. Argiolas / Neurotiede ja Bio-käyttäytymisen arvostelut 35 (2011) 939-955 Freund-Mercier, MJ, Richard, P., 1981. Oksitosiinin intraventrikulaaristen injektioiden kiihottavat vaikutukset maidon ejektion refleksiin rotalla. Neurosci. Lett. 23, 193-198. Freund-Mercier, MJ, Richard, P., 1984. Elektrofysiologiset todisteet oksitosiinin neuronien helpottamiseksi oksitosiinin avulla imetyksen aikana rotissa. J. Physiol. (Lond.) 352, 447-466. Freund-Mercier, MJ, Stoeckel, ME, 1995. Somatodendriittiset autoreceptorit oksitosiinin neuroneilla. Julkaisussa: Ivell, R., Russel, JA (Ed.), Oxytocin, Cellular ja Molecular Approaches in Medicine and Research. Adv. Exp. Med. Biol., 365. Plenum Press, New York ja London, pp. 185-194. Freund-Mercier, MJ, Stoeckel, ME, Palacios, JM, Pazos, JM, Richard, PH, Porte, A., 1987. 3H-oksitosiinia sitovien kohtien farmakologiset ominaisuudet ja anatominen jakauma Wistar-rotan aivoissa tutkittiin autoradiografialla. Neurotiede 20, 599-614. Giuliano, F., Rampin, O., 2000. Peniksen erektio on keskitetty. Neurosci. Biobehav. Rev 24, 517-533. Giuliano, F., Allard, J., 2001. Dopamiini ja seksuaalinen toiminta. Int. J. Impotence Res. 13 (Suppl. 3), 18-28. Giuliano, F., Rampin, O., 2004. Erektion neuroninen valvonta. Physiol. Behav. 83, 189-201. Giuliano, F., Bernabè, J., McKenna, KE, Longueville, F., Rampin, O., 2001. Oksitosiinin spinaalinen proerektiilivaikutus nukutetuissa rotissa. Am J. Physiol. Regul. Laipi. Comp. Physiol. 280, R1870-R1877. Goto, Y., Grace, AA, 2005. Nukleaalisen ja kortikaalisen aivojen dopaminerginen modulaatio kohden suunnattuun käyttäytymiseen. Nat. Neurosci. 8, 805-812. Hawthorn, J., Ang, VT, Jenkins, JS, 1985. Vaurioiden vaikutukset hypopotaamisten paraventriculaaristen, supraoptisten ja suprachiasmatisten ytimien vaikutuksesta vasopressiiniin ja oksitosiiniin rotan aivoissa ja selkäytimessä. Brain Res. 346, 51-57. Heier, RF, Dolak, LA, Duncan, JN, Hyslop, DK, Lipton, MF, Martin, LJ, Mauragis, MA, Piercey, MF, Nichols, NF, Schreur, PJ, Smith, MW, Moon, MW, 1997. (R) -5,6-dihydro-N, N-dimetyyli-4H-imidatso [4,5,1-ij] kinolin-5-amiinin synteesi ja biologiset vaikutukset. J. Med. Chem. 40, 639-646. Hsieh, GC, Hollingsworth, PR, Martino, B., Chang, R., Terranova, MA, O'Neill, AB, Lynch, JJ, Moreland, RB, Donnelly-Roberts, DL, Kolasa, T., Mikusa, JP , McVey, JM, Marsh, KC, Sullivan, JP, Brioni, JD, 2004. Keskeiset mekanismit, jotka säätelevät peniksen erektiota tietoisissa rotissa: dopaminergiset järjestelmät, jotka liittyvät apomorfiinin proerektiiliseen vaikutukseen. J. Pharmacol. Exp. Ther. 308, 330-338. Huang, PL, Dawson, TM, Bredt, DS, Snyder, SH, Fishman, MC, 1993. Neuronaalisen typpioksidisyntaasin geenin kohdennettu häiriö. Solu 75, 1273-1286. Huber, D., Veinante, P., Stoop, R., 2005. Vasopressiini ja oksitosiini virittävät erillisiä neuronipopulaatioita keski-amygdalassa. Tiede 308, 245-248. Hull, EM, Warner, RK, Bazzett, TJ, Eaton, RC, Thompson, JT, 1989. D2 / D1-suhde mediaalisessa preoptic-alueella vaikuttaa urosrottien kopulaatioon. J. Pharmacol. Exp. Ther. 251, 422-427. Hull, EM, Du, J., Lorrain, DS, Matuszewich, L., 1995. Ylimääräinen dopamiini mediaalisessa preoptic-alueella: vaikutukset seksuaaliseen motivaatioon ja kopulaation hormonaaliseen hallintaan. J. Neurosci. 15, 7465-7471. Hull, EM, Meisel, RL, Sachs, BD, 2002. Miesten seksuaalinen käyttäytyminen. Julkaisussa: Pfaff, DW, Arnold, AP, Etgen, AM, Fahrbach, SE, Rubin, RT (Ed.), Hormonit, Aivot ja Käyttäytyminen. Academic Press, New York, pp. 3-137. Hurlemann, R., Patin, A., Onur, OA, Cohen, MX, Baumgartner, T., Metzler, S., Dziobek, I., Gallinat, J., Wagner, M., Maier, W., Kendrick, KM, 2010. Oksitosiini lisää ihmisen amygdala-riippuvaisia, sosiaalisesti vahvistettuja oppimisia ja emotionaalista empatiaa. J. Neurosci. 30, 4999-5007. Ivell, R., Russel, JA, 1995. Oksitosiini: solujen ja molekyylien lähestymistavat lääketieteessä ja tutkimuksessa. Kokeellinen lääketiede ja biologia, vol. 395. Plenum Press, New York. Kelley, AE, Domesick, VB, 1982. Projektio jakautui hippokampuksen muodostumisesta rotan ytimelle: anterograde- ja retrograde-piparjuuriperoksidaasitutkimus. Neurotiede 7, 2321-2335. Kimura, Y., Naitou, Y., Wanibuchi, F., Yamaguchi, T., 2008. 5-HT (2C) -reseptorin aktivaatio on yleinen mekanismi apomorfiinin, oksitosiinin ja melanotaanin II proerektiilisille vaikutuksille rotilla. E. J. Pharmacol. 589, 157-162. Kondo, Y., Sachs, BD, Sakuma, Y., 1998. Etnisten narttujen syrjäisillä ärsykkeillä herättämän rotan peniksen erektiossa olevan mediaalisen amygdalan merkitys. Behav. Brain Res. 91, 215-222. Kovacs, GL, Sarnyai, Z., Szabo, G., 1998. Oksitosiini ja riippuvuus: tarkistus. Psychoneuroendocrinology 23, 945-962. Lee, HJ, Macbeth, AH, Pagani, JH, Scott Young 3rd, W., 2009. Oksitosiini: elämän suuri edistäjä. Prog. Neurobiol. 88, 127-151. Lindvall, O., Bjorklund, A., Skagerberg, G., 1984. Dopamiiniterminaalijärjestelmien selektiivinen istokemiallinen demonstrointi rotan di- ja telencephalonissa: uudet todisteet hypotalamuksen hermosolujen ytimien dopaminergisesta inervaatiosta. Brain Res. 306, 19-30. Liu, YC, Salamone, JD, Sachs, BD, 1997. Vähentynyt seksuaalinen vaste hypotalamuksen paraventrikulaarisen ytimen vaurioiden jälkeen urosrotilla. Behav. Neurosci. 111, 1361-1367. Löber, S., Tschammer, N., Hübner, H., Melis, MR, Argiolas, A., Gmeiner, P., 2009. Azuleenikehys uutena bioisosteerina: voimakkaan dopamiinin D4-reseptoriligandien suunnittelu, joka indusoi peniksen erektiota. Chem. Med. Chem. 4, 325-328. McCleskey, EW, Fox, AP, Feldman, DH, Cruz, LJ, Olivera, BM, Tsien, RW, Yoshikami, D., 1987. _-Conotoxin: suora ja jatkuva tiettyjen kalsiumkanavien esto neuroneissa, mutta ei lihas. Prot. Nat. Acad. Sei. Yhdysvallat 84, 4327-4331. McKenna, KE, 2000. Jotkut ehdotukset keskushermostoon kohdistuvan peniksen erektio-ohjauksen järjestämisestä. Neurosci. Biobehav. Rev 24, 535-540. Marson, L., McKenna, KE, 1992. 5-hydroksitryptamiinin rooli selkärangan seksuaalisen refleksin laskussa. Exp. Brain Res. 88, 313-318. Marson, L., McKenna, KE, 1996. CNS-soluryhmät, jotka osallistuvat ischiocavernosus- ja bulbospongiosus-lihasten hallintaan: transneuronaalinen jäljitystutkimus, jossa käytetään pseudorabies-virusta. J. Comp. Neurol. 374, 161-179. Meisel, RL, Sachs, BD, 1994. Miesten seksuaalisen käyttäytymisen fysiologia. Julkaisussa: Knobil, E., Neil, J. (Ed.), Reproduktion fysiologia, voi. 2, toinen painos. Raven Press, New York, pp. 3-96. Melin, P., Kihlstrom, JE, 1963. Oksitosiinin vaikutus seksuaaliseen käyttäytymiseen urospuolisilla kanilla. Endokrinologia 73, 433-435. Melis, MR, Argiolas, A., 1995a. Dopamiini ja seksuaalinen käyttäytyminen. Neurosci. Biobehav. Rev 19, 19-38. Melis, MR, Argiolas, A., 1995b. Typpioksidin luovuttajat aiheuttavat peniksen erektiota ja haukkumista, kun niitä pistetään urosrottien keskushermostoon. E. J. Pharmacol. 294, 1-9. Melis, MR, Argiolas, A., 2003. Keski-oksitoserginen neurotransmissio: lääke-kohde psykogeenisen erektiohäiriön hoitoon. As. Huumeiden tavoitteet 4, 55-66. Melis, MR, Argiolas, A., Gessa, GL, 1986. Oksitosiinin aiheuttama haukottelu ja peniksen erektio: vaikutuspaikka aivoissa. Brain Res. 398, 259-265. Melis, MR, Argiolas, A., Gessa, GL, 1987. Apomorfiinin aiheuttama haukottelu ja peniksen erektio: vaikutuspaikka aivoissa. Brain Res. 415, 98-104. Melis, MR, Argiolas, A., Gessa, GL, 1989a. Apomorfiini lisää plasman oksitosiinipitoisuuksia rotilla. Neurosci. Lett. 98, 351-355. Melis, MR, Argiolas, A., Gessa, GL, 1989b. Todisteet siitä, että apomorfiini aiheuttaa peniksen erektiota ja haukkumista vapauttamalla oksitosiinia keskushermostoon. E. J. Phamacol. 164, 565-570. Melis, MR, Argiolas, A., Stancampiano, R., Gessa, GL, 1990. Apomorfiinin vaikutus oksitosiinipitoisuuksiin urosrottien eri aivoissa ja plasmassa. E. J. Pharmacol. 182, 101-107. Melis, MR, Mauri, A., Argiolas, A., 1994a. Apomorfiinin ja oksitosiinin aiheuttama peniksen erektio ja haukkuminen ehjissä ja kastroiduissa urosrotissa: seksuaalisten steroidien vaikutus. Neuroendokrinologia 59, 349-354. Melis, MR, Stancampiano, R., Argiolas, A., 1994b. Paraventricular NMDA-injektion aiheuttama peniksen erektio ja haukkuminen välittyvät oksitosiinilla. Pharmacol. Biochem. Behav. 48, 203-207. Melis, MR, Stancampiano, R., Argiolas, A., 1994c. Apomorfiinin ja oksitosiinin aiheuttaman peniksen erektio ja haukottelu ehkäisevät NG-nitro-l-arginiinimetyyliesterillä: aivojen vaikutuspaikka. Pharmacol. Biochem. Behav. 48, 799-804. Melis, MR, Succu, S., Argiolas, A., 1996. Dopamiiniagonistit lisäävät typpioksidin tuotantoa hypotalamuksen paraventrikulaarisessa ytimessä: korrelaatio peniksen erektioon ja haukotteluun. E. J. Neurosci. 8, 2056-2063. Melis, MR, Succu, S., Iannucci, U., Argiolas, A., 1997. Oksitosiini lisää typpioksidin tuotantoa hypotalamuksen paraventricularisessa ytimessä: korrelaatio peniksen erektioon ja haukotteluun. Reg. Peptidit 69, 105-112. Melis, MR, Succu, S., Mauri, A., Argiolas, A., 1998. Typen oksidien tuotanto lisääntyy urospuolisten rottien hypotalamuksen paraventricularisessa ytimessä kosketukseen joutumattomien peniksen erektioiden ja kopulaation aikana. E. J. Neurosci. 10, 1968-1974. Melis, MR, Spano, MS, Succu, S., Argiolas, A., 1999a. Oksitosiiniantagonisti d (CH2) 5Tyr (Me) 2-Orn8-vasotosiini pienentää kosketuksettomia peniksen erektioita urosrotilla. Neurosci. Lett. 265, 171-174. Melis, MR, Succu, S., Spano, MS, Argiolas, A., 1999b. Morfiini, joka injektoidaan hypotalamuksen paraventrikulaariseen ytimeen, estää koskettamattomia erektioita ja heikentää kopulaatiota: typpioksidin osallistumista. E. J. Neurosci. 11, 1857-1864. Melis, MR, Spano, MS, Succu, S., Argiolas, A., 2000. Erittävien aminohappojen, dopamiinin ja oksitosiinireseptoriantagonistien vaikutus ei-kosketukseen liittyvään peniksen erektioon ja paraventrikulaariseen typpioksidin tuotantoon urosrotilla. Behav. Neurosci. 114, 849-857. Melis, MR, Succu, S., Mascia, MS, Cortis, L., Argiolas, A., 2003. Ylimääräinen dopamiini lisääntyy urospuolisten rottien paraventrikulaarisessa ytimessä seksuaalisen toiminnan aikana. E. J. Neurosci. 17, 1266-1272. Melis, MR, Succu, S., Mascia, MS, Argiolas, A., 2004a. Kannabinoidin CB1-reseptorien antagonismi urosrottien paraventrikulaarisessa ytimessä aiheuttaa peniksen erektiota. Neurosci. Lett. 359, 17-20. Melis, MR, Succu, S., Mascia, MS, Cortis, L., Argiolas, A., 2004b. Ylimääräiset herätteiset aminohapot lisääntyvät urospuolisten rottien paraventrikulaarisessa ytimessä seksuaalisen aktiivisuuden aikana: NMDA-reseptorien tärkein rooli erektiohäiriössä. E. J. Neurosci. 19, 2569-2575. Melis, MR, Succu, S., Mascia, MS, Argiolas, A., 2005. PD-168,077, selektiivinen dopamiini D4-reseptoriagonisti, indusoi peniksen erektiota, kun sitä injektoidaan urosrottien paraventrikulaariseen ytimeen. Neurosci. Lett. 379, 59-62. Melis, MR, Succu, S., Mascia, MS, Sanna, F., Melis, T., Succu, S., Castelli, MP, Argiolas, A., 2006a. SR 141716A-indusoitu peniksen erektio urosrotilla: paraventrikulaarisen glutamiinihapon ja typpioksidin osallistuminen. Neurofarmakologia 50, 219-228. Melis, MR, Succu, S., Sanna, F., Mascia, MS, Melis, T., Enguehard-Gueiffier, C., Hubner, H., Gmenier, P., Gueiffier, A., Argiolas, A., 2006b. PIP3EA ja PD168077, kaksi selektiivistä dopamiini D4-reseptoriagonistia, indusoivat peniksen erektiota urosrotilla: vaikutuspaikka ja -mekanismi aivoissa. E. J. Neurosci. 24, 2021-2030. Melis, MR, Melis, T., Cocco, C., Succu, S., Sanna, F., Pillolla, G., Boi, A., Ferri, GL, Argiolas, A., 2007. Ventral tegmental -alueelle injektoitu oksitosiini indusoi peniksen erektiota ja lisää solun ulkopuolista dopamiinia ydinasemassa MR Melis, A. Argiolas / Neurotiede ja Bio-käyttäytymisarvioinnit 35 (2011) 939-955 955 ja urospuolisten rottien hypotalamuksen paraventrikulaarinen ydin. E. J. Neurosci. 26, 1026-1035. Melis, MR, Sanna, F., Succu, S., Zarone, P., Boi, A., Argiolas, A., 2009a. Oksitosiinin rooli uros rotan seksuaalisen käyttäytymisen ennakoivissa ja kuluttavissa vaiheissa. Julkaisussa: Jastrow, H., Feuerbach, D. (Ed.), Oxytocin-tutkimuksen käsikirja: synteesi, varastointi ja julkaisu, toimet ja huumeiden muodot. Nova Publishers Inc, New York, USA, s. 11. 109-125. Melis, MR, Succu, S., Sanna, F., Boi, A., Argiolas, A., 2009b. Amygdalan ventral subiculumiin tai posteromediaaliseen kortikaaliseen ytimeen injektoitu oksitosiini indusoi peniksen erektiota ja lisää ekstrasellulaarista dopamiinia urosrottien ytimessä. E. J. Neurosci. 30, 1349-1357. Melis, MR, Succu, S., Cocco, C., Caboni, E., Sanna, F., Boi, A., Ferri, GL, Argiolas, A., 2010. Oksitosiini indusoi peniksen erektiota, kun se injektoidaan vatsaaliseen subikulusiin: typpioksidin ja glutamiinihapon rooli. Neurofarmakologia 58, 1153-1160. Moreland, RB, Nakane, M., Donnelly-Roberts, DL, Miller, LN, Chang, R., Uchic, ME, Terranova, MA, Gubbins, EJ, Helfrich, RJ, Namovic, MT, El-Kouhen, OF, Masters, JN, Brioni, JD, 2004. Ihmisen dopamiini-D: n (2) kaltaiseen reseptoria stabiiliin solulinjaan, joka on kytketty kalsiumvirtaan Galphan (qo5) kautta, vertaileva farmakologia. Biochem. Pharmacol. 68, 761-772. Moos, F., Freund-Mercier, MJ, Guerne, Y., Guerne, JM, Stoeckel, ME, Richard, P., 1984. Oksitosiinin ja vasopressiinin vapautuminen magnosellulaarisilla ytimillä in vitro: oksitosiinin spesifinen helpottava vaikutus sen omaan vapautumiseen. J. Endocrinol. 102, 63-72. Murphy, MR, Seckl, JR, Burton, S., Checkley, SA, Lightman, SL, 1987. Oksitosiinin ja vasopressiinin erittymisen muutokset seksuaalisen aktiivisuuden aikana miehillä. J. Clin. Endocrinol. Metab. 65, 738-741. Nishimori, K., Young, LJ, Guo, Q., Wang, Z., Insel, TR, Matzuk, MM, 1996. Hoitoon tarvitaan oksitosiinia, mutta ei välttämätöntä synnytyksen tai lisääntymiskäyttäytymisen kannalta. Proc. Natl. Acad. Sei. Yhdysvallat 93, 11699-11704. Patel, S., Freedman, S., Chapman, KL, Emms, F., Fletcher, AE, Knowles, M., Marwood, R., Mccallister, G., Myers, J., Curtis, J., Kulagowski, JJ, Leeson, PD, Ridgill, M., Graham, M., Matheson, S., Rathbone, D., Watt, AP, Bristow, LJ, Rupniak, NM, Baskin, E., Lynch, JJ, Ragan, CI , 1997. L 745,870: n, joka on selektiivinen antagonisti, jolla on suuri affiniteetti dopamiini D4-reseptoriin, biologinen profiili. J. Pharmacol. Exp. Ther. 283, 636-647. Pedersen, CA, Caldwell, JD, Jirikowski, GF, Insel, TR, 1992. Oxytocin äidin, seksuaalisen ja sosiaalisen käyttäytymisen, New Yorkin tiedeakatemian Annals, vol. 652. New Yorkin tiedeakatemia, New York. Petrovic, P., Kalisch, R., Singer, T., Dolan, RJ, 2008. Oksitosiini heikentää ehdollisia kasvoja ja amygdala-aktiivisuutta. J. Neurosci. 28, 6607-6615. Pfaus, JG, Everitt, BJ, 1995. Seksuaalisen käyttäytymisen psykofarmakologia. Julkaisussa: Knobil, FE, Kupfer, DJ (Ed.), Psykofarmakologia: neljäs sukupolven edistyminen. Raven Press, New York, pp. 742-758. Rajfer, J., Aronson, WJ, Bush, PA, Dorey, FJ, Ignarro, LJ, 1992. Typpioksidi, joka on corpus cavernosumin rentoutumisen välittäjä vasteena nonadrenergiselle, ei-kolinergiselle neurotransmissiolle. N. Engl. J. Med. 326, 90-94. Roeling, TAP, Van Erp, AMM, Meelis, W., Kruk, MR, Veening, JG, 1991. NMDA: n käyttäytymisvaikutukset, jotka injektoitiin rotan hypotalamiseen paraventrikulaariseen ytimeen. Brain Res. 550, 220-224. Sachs, BD, 1997. Erektio, joka syntyy urospuolisilla rotilla ilmassa olevien tuoksujen kautta. Physiol. Behav. 62, 921-924. Sachs, BD, 2000. Kontekstuaaliset lähestymistavat erektiohäiriön fysiologiaan ja luokitteluun, erektiohäiriöön ja seksuaaliseen kiihottumiseen. Neurosci. Biobehav. Rev 24, 541-560. Sachs, BD, 2007. Miesten seksuaalisen kiihottumisen kontekstuaalinen määritelmä. Horm. Behav. 51, 569-578. Sanchez, F., Alonso, JR, Arevalo, R., Blanco, E., Aijon, J., Vazquez, R., 1994. NADPH-diaforaasin ja vasopressiinin ja oksitosiinin samanaikainen esiintyminen rotan hypotalamuksessa olevissa magnosellulaarisissa neurosecretory-ytimissä. Cell Tissue Res. 276, 31-34. Sanna, F., Succu, S., Boi, A., Melis, MR, Argiolas, A., 2009. Fosfodiesteraasityypin 5-estäjät helpottavat kosketusta erektiota urosrotilla: vaikutuspaikka aivoissa ja vaikutusmekanismi. J. Sex. Med. 6, 2680-2689. Saphier, D., Feldman, S., 1987. Seinä- ja hippokampaalisten ärsykkeiden vaikutukset paraventrikulaarisiin ydinaseihin. Neurotiede 20, 749-755. Sato-Suzuki, I., Kita, I., Oguri, M., Arita, H., 1998. Rottin paraventrikulaarisen ytimen sähköinen ja kemiallinen stimulaatio indusoi stereotyyppisiä haukotteluvasteita. J. Neurophysiol. 80, 2765-2775. Schuman, EM, Madison, DV, 1994. Typpioksidin ja synaptisen funktion. Ann. Rev Neurosci. 17, 153-183. Snyder, SH, 1992. Typpioksidi: ensin uudessa neurotransmitteriluokassa? Tiede 254, 494-496. Sofroniew, MV, 1983. Vasopressiini ja oksitosiini nisäkkäiden aivoissa ja selkäytimessä. Trendit Neurosci. 6, 467-472. Sokoloff, P., Schwartz, JC, 1995. Uudet dopamiinireseptorit puolen vuosikymmenen kuluttua. Trends Pharmacol. Sei. 16, 270-275. Southam, E., Garthwaite, J., 1993. Typpioksidisyklinen GMP-signalointireitti rotan aivoissa. Neurofarmakologia 32, 1267-1277. Stancampiano, R., Melis, MR, Argiolas, A., 1994. 5-HT1c-agonistien aiheuttama peniksen erektio ja haukkuminen urosrotilla: suhde dopaminergiseen ja oksitosinergiseen siirtoon. E. J. Pharmacol. 261, 149-155. Succu, S., Mascia, MS, Sanna, F., Melis, T., Argiolas, A., Melis, MR, 2006. Kannabinoidin CB1-reseptoriantagonisti SR 141716A indusoi peniksen erektiota lisäämällä solun ulkopuolista glutamiinihappoa urosrottien paraventrikulaariseen ytimeen. Behav. Brain Res. 169, 274-281. Succu, S., Sanna, F., Melis, T., Boi, A., Argiolas, A., Melis, MR, 2007. Dopamiinireseptorien stimulointi urosrottien hypotalamuksen paraventrikulaarisessa ytimessä indusoi peniksen erektiota ja kasvattaa solun ulkopuolista dopamiinia ytimessä: keski-oksitosiinin osallistuminen. Neurofarmakologia 52, 1034-1043. Succu, S., Sanna, F., Cocco, C., Melis, T., Boi, A., Ferri, GL, Argiolas, A., Melis, MR, 2008. Oksitosiini indusoi peniksen erektiota, kun se injektoidaan urosrottien ventral tegmentaalialueelle: typpioksidin ja syklisen GMP: n rooli. E. J. Neurosci. 28, 813-821. Tanda, G., Pontieri, FE, Di Chiara, G., 1997. Kannabinoidit ja mesolimbisen dopamiinin siirron heroiinin aktivoituminen tavallisella mu1-opioidireseptorimekanismilla. Tiede 276, 2048-2050. Tang, Y., Rampin, O., Calas, A., Facchinetti, P., Giuliano, F., 1998. Tunnistettujen lumbosakraalisten ytimien oksitokinerginen ja serotoniinerginen inervointi kontrolloi peniksen erektiota urosrotissa. Neurotiede 82, 241-254. Theodosis, DT, 1985. Oksitosiini-immunoreaktiiviset terminaalit synapse- vat oksitosiinin neuroneissa supraoptisten ytimien sisällä. Luonto (Lontoo) 313, 682-684. Tindall, JS, 1974. Stimuli, joka aiheuttaa oksitosiinin vapautumista. Julkaisussa: Geiger, SR, Knobil, E., Sawyer, WH, Greef, R., Astwood, EB (Ed.), Fysiologian käsikirja. Lahko. 7, Endocrinology, voi. IV. American Physiology Society, Washington DC, s. 11. 257-267. Torres, G., Lee, S., Rivier, C., 1993. Rotan hypotalamuksen typpioksidisyntaasin ontogeenia ja kolokalisaatio neuropeptidien kanssa. Mol. Solu. Neurosci. 4, 155-163. Uhl-Bronner, S., Waltisperger, E., Martinez-Lorenzana, G., Condes, LM, Freund-Mercier, MJ, 2005. Oksitosiinia sitovien kohtien seksuaalinen dimorfinen ekspressio rotan eturintamassa ja selkäytimessä. Neurotiede 135, 147-154. Vaccari, C., Lolait, SJ, Ostrowski, NL, 1998. Vasopressiini V1b: n ja oksitosiinireseptorien ribonukleiinihappojen vertaileva jakauma aivoissa. Endokrinologia 139, 5015-5033. Van Den Pol, A., 1991. Glutamaatti ja aspartaatin immunoreaktiivisuus hypotalamuksen presynaptisissa aksoneissa. J. Neurosci. 11, 2087-2101. Veronneau-Longueville, F., Rampin, O., Freund-Mercier, MJ, Tang, Y., Calas, A., Marson, L., McKenna, KE, Stoeckel, ME, Benoit, G., Giuliano, F. , 1999. Autogeenisten ytimien oksitoserginen innervointi, joka kontrolloi peniksen erektiota rotalla. Neurotiede 93, 1437-1447. Vincent, SR, Kimura, H., 1992. Typpioksidisyntaasin histokemiallinen kartoitus rotan aivoissa. Neurotiede 46, 755-784. Wagner, CK, Clemens, LG, 1993. Neurofysiiniä sisältävä polku hypotalamuksen paraventrikulaarisesta ytimestä seksuaalisesti dimorfiseen motoriseen ytimeen lannerangan selkäytimessä. J. Comp. Neurol. 336, 106-116. Winslow, JT, Insel, TR, 1991. Sairaan oravan apinoiden yhteiskunnallinen asema määrittää käyttäytymisvasteen keski-oksitosiinin antamiselle. J. Neurosci. 11, 2032-2038. Wise, RA, Rompre, P.-P., 1989. Aivojen dopamiini ja palkkio. Ann. Rev Psychol. 40, 191-225. Witt, DM, Insel, TR, 1994. Miesten seksuaalinen käyttäytyminen aktivoi c-fos-kaltaista proteiinia oksytosiinin neuroneissa hypotalamuksen paraventrikulaarisessa ytimessä. J. Neuroendocrinol. 6, 13-18. Witter, MP, 2006. Rotta-subiculumin yhteydet: topografia suhteessa pylväs- ja laminaariseen organisaatioon. Behav Brain Res. 174, 251-264. Woodruff, GN, Foster, AC, Gill, R., Kemp, JA, Wong, EH, Iversen, LL, 1987. MK-801in ja N-metyyli-d-aspartaatin reseptorien välinen vuorovaikutus: toiminnalliset seuraukset. Neurofarmakologia 26, 903-909. Yamashita, H., Shigeru, O., Inenaga, K., Kasai, M., Uesugi, S., Kannan, H., Kaneko, T., 1987. Oksitosiini herättää pääasiassa oletettuja oksitosiinien neuroneja rotan supraoptisessa ytimessä in vitro. Brain Res. 416, 364-368. Yells, DP, Hendricks, SE, Prendergast, MA, 1992. Rintarauhasen häiriöt: vaikutukset pariutumiskäyttäytymiseen urosrotilla. Brain Res. 596, 73-79. Young, WS, Shepard, E., Amico, J., Hennighausen, L., LaMarca, ME, McKinney, C., Ginns, EI, 1996. Hiiren oksitosiinin puute estää maidon poistumisen, mutta ei hedelmällisyyttä tai synnytystä. J. Neuroendocrinol. 8, 847-854. Zahran, AR, Vachon, P., Courtois, F., Carrier, S., 2000. Lisääntyneen peniksen paineen lisääntyminen anestesoitujen rottien hypotalamiseen paraventrikulaariseen ytimeen suuntautuvien eksitatoristen aminohappojen reseptoriagonistien injektion jälkeen. J. Urol.