Dialogues Clin Neurosci. 2013 Dec;15(4):431-43.
Sažetak
Unatoč važnosti brojnih psihosocijalnih čimbenika, u svojoj osnovi, ovisnost o drogama uključuje biološki proces: sposobnost ponovnog izlaganja drogi koja uzrokuje promjene u ranjivom mozgu koji pokreće kompulzivno traženje i uzimanje lijekova i gubitak kontrole o uporabi droga, koji definiraju stanje ovisnosti. Ovdje ćemo pregledati tipove molekularnih i staničnih adaptacija koje se javljaju u određenim područjima mozga kako bi posredovale abnormalnosti u ponašanju povezane s ovisnošću. To uključuje promjene u ekspresiji gena koje se djelomično postižu putem epigenetskih mehanizama, plastičnosti u neurofiziološkom funkcioniranju neurona i sinapsa, te pripadajućoj plastičnosti u neuronskoj i sinaptičkoj morfologiji posredovanoj djelomično promijenjenom signalizacijom neurotrofnog faktora. Svaka od ovih vrsta modificiranih lijekova može se promatrati kao oblik "stanične ili molekularne memorije". Štoviše, zapanjujuće je da je većina plastičnosti povezanih s ovisnošću vrlo slična tipovima plastičnosti koji su povezani s klasičnijim oblicima "memorije ponašanja", možda odražavajući konačni repertoar adaptivnih mehanizama dostupnih neuronima kada se suoče s okolinom. izazovi. Konačno, molekularne i stanične prilagodbe povezane s ovisnošću uključuju većinu istih regija mozga koje posreduju više klasičnim oblicima pamćenja, u skladu s mišljenjem da su abnormalne uspomene važni pokretači sindroma ovisnosti. Cilj ovih studija koje imaju za cilj objasniti molekularnu i staničnu osnovu ovisnosti o drogama je da se na kraju razviju dijagnostički testovi na biološkoj osnovi, kao i učinkovitiji tretmani za poremećaje ovisnosti.
Uvod
Ovisnost o drogama, koja se može definirati kao kompulzivno traženje i uzimanje droga unatoč groznim posljedicama ili gubitku kontrole nad uporabom droga, uzrokovana je dugotrajnim promjenama uzrokovanim drogama koje se događaju u određenim područjima mozga.1 Međutim, samo neki pojedinci podliježu ovisnosti u slučaju ponovljenog izlaganja lijekovima, dok su drugi sposobni koristiti lijek usputno i bježeći od sindroma ovisnosti. Genetski čimbenici čine otprilike 50% ove individualne varijabilnosti u ranjivosti ovisnosti, a taj stupanj heritabilnosti vrijedi za sve glavne skupine lijekova koji izazivaju ovisnost, uključujući stimulanse, opijate, alkohol, nikotin i kanabinoide.2 Još nije bilo moguće identificirati većinu gena koji obuhvaćaju ovaj genetski rizik, vjerojatno zbog uključenosti možda stotina genetskih varijacija koje zbrajaju u jednu osobu kako bi se postigla ranjivost ovisnosti (ili, kod drugih pojedinaca, otpornost).
Ostalih 50% rizika za ovisnost nastaje zbog mnoštva čimbenika okoliša koji se javljaju tijekom cijelog života i koji djeluju u interakciji s genetskim sastavom pojedinca da bi ga učinili ranjivim na ovisnost u većoj ili manjoj mjeri. Nekoliko vrsta čimbenika okoliša uključeno je u ovisnost, uključujući psihosocijalne stresove, ali daleko najmoćniji čimbenik je izloženost samoj zlouporabi droga. Pokazalo se da određeni "prijelazni" lijekovi, posebno nikotin, povećavaju nečiju ranjivost na ovisnost o drugom lijeku.3 Štoviše, postoji sve više dokaza da, unatoč nizu genetskih rizika za ovisnost u populaciji, izloženost dovoljno visokim dozama lijeka za dulje vremensko razdoblje može transformirati nekoga tko ima relativno niže genetsko opterećenje u ovisnika..4
Veliki napredak postignut je u posljednja dva desetljeća u identificiranju i diskretnih područja mozga koja su važna u posredovanju sindroma ovisnosti, kao i vrste promjena na molekularnoj i staničnoj razini koje lijekovi potiču u tim regijama da podupru ključne aspekte. ovisnosti.1,5 Krug koji je dobio najveću pažnju naziva se mezolimbički dopaminski sustav, koji uključuje neurone dopamina u ventralnom tegmentalnom području (VTA) srednjeg mozga koji inervira srednja živčana tkiva u nukleusu accumbens (NAc, dio ventralnog striatuma). Ovi VTA neuroni također inerviraju mnoge druge predjele, uključujući hipokampus, amigdalu i prefrontalni korteks (PFC).
Ima smisla razmotriti ove mehanizme ovisnosti o drogama u ovome volumenu o pamćenju za tri preklapajuća razloga.6
- Prvo, sve prilagodbe uzrokovane lijekovima mogu se promatrati kao tipovi "molekularne ili stanične memorije": živčana stanica koja prolazi kroz takve promjene je različita kao posljedica izloženosti lijeku i stoga različito reagira na isti lijek, drugim lijekovima ili nizu drugih podražaja.
- Drugo, zanimljivo je da su mnoge, možda najviše, vrste promjena koje su bile povezane sa stanjem ovisnosti (npr. izmijenjena transkripcija gena, epigenetika, sinaptička i plastičnost cijelih stanica, neuronska morfologija i neurotrofni mehanizmi) su također uključeni u tradicionalne oblike "memorije ponašanja", kao što su prostorna memorija, kondicioniranje straha i operantno kondicioniranje, među ostalima.
- Treće, među regijama mozga na koje utječu droge zlostavljanja su oni koji su ključni neuralni supstrati za pamćenje ponašanja, uključujući hipokampus, amigdalu i PFC. To se podudara s sve većom spoznajom da neke od najvažnijih kliničkih značajki ovisnosti (npr. Žudnja za drogom i relapsa) odražavaju abnormalnosti u tradicionalnim memorijskim krugovima, a dugoročna sjećanja na iskustvo droge služe kao snažni pokretači patologije ovisnosti.4,7,8 Suprotno tome, područja nagrađivanja mozga (npr. VTA i NAc) snažno utječu na bihevioralnu memoriju.
Ovaj članak daje pregled glavnih tipova molekularnih i staničnih promjena koje se događaju u nekoliko područja mozga u životinjskim modelima ovisnosti, koncentrirajući se na nucleus accumbens za koje je većina informacija trenutno dostupna. Važno je napomenuti da je bilo moguće sve više potvrditi neke od tih promjena u ovisnicima o ljudima na temelju studija mozga nakon smrti. Unatoč činjenici da droge imaju različite kemijske strukture i djeluju na različite proteinske ciljeve, zapanjujuće je da su mnoge značajne prilagodbe povezane s ovisnošću zajedničke mnogim, au nekim slučajevima i svim zlouporabama droga i vjerojatno doprinose zajedničkim značajkama sindrom ovisnosti.4,9 Nasuprot tome, mnoge druge prilagodbe uzrokovane lijekovima specifične su za određeni lijek i mogu posredovati više jedinstvenih aspekata određene ovisnosti. Ovdje se usredotočujemo na stimulanse i opijatne droge zlouporabe, koje proizvode dramatičnije učinke na životinjskim modelima u usporedbi s drugim lijekovima. Također ističemo važna područja za buduća istraživanja koja će dodatno povećati naše znanje o sindromima ovisnosti i prevesti taj napredak u poboljšane dijagnostičke testove i tretmane.
Transkripcijski i epigenetski mehanizmi
Znanje da ovisnici mogu ostati pod povećanim rizikom od relapsa unatoč godinama apstinencije znači da ovisnost uključuje promjene u mozgu koje uzrokuju droge i koje mogu biti vrlo stabilne. To je dovelo do toga da nekoliko skupina promatra promjene u ekspresiji gena kao važnu komponentu procesa ovisnosti (Slika 1). U skladu s tim, studije gena kandidata ili istraživanja na razini genoma koja uključuju DNK mikroarve i nedavno RNA-seq (sekvenciranje eksprimiranih RNA) je identificirao brojne gene čija se ekspresija mijenja u određenoj regiji mozga u modelima ovisnosti i ovisnosti kod glodavaca i primata (npr. ref. 10-17). Primjeri takvih gena opisani su u sljedećim dijelovima ovog pregleda.
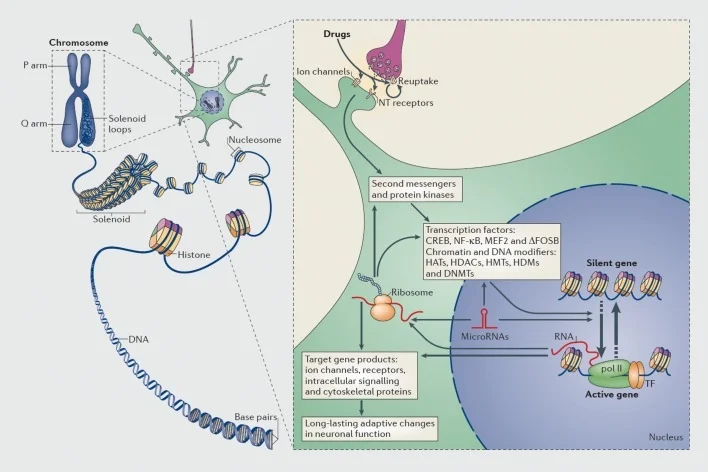
Mehanizmi transkripcijske i epigenetske regulacije lijekovima zlostavljanja. U eukariotskim stanicama, DNA se organizira omatanjem oko histonskih oktomera u obliku nukleosoma, koji se zatim dalje organiziraju i kondenziraju u kromosome (lijevi dio). Samo privremenim rasplitanjem zbijenog kromatina DNK specifičnog gena može se učiniti dostupnim stroju za transkripciju. Lijekovi zlostavljanja djeluju preko sinaptičkih ciljeva kao što su mehanizmi ponovnog preuzimanja, ionski kanali i receptori neurotransmitera (NT) da bi izmijenili unutarstanične signalne kaskade (desni dio). To dovodi do aktivacije ili inhibicije transkripcijskih faktora (TFs) i mnogih drugih nuklearnih ciljeva, uključujući proteine koji reguliraju kromatin (prikazani debelim strelicama); detaljni mehanizmi uključeni u sinaptičku regulaciju proteina koji reguliraju kromatin i dalje su slabo shvaćeni. Ti procesi u konačnici rezultiraju indukcijom ili potiskivanjem određenih gena, uključujući one za nekodirajuće RNA, kao što su mikroRNA; izmijenjena ekspresija nekih od ovih gena može dalje regulirati transkripciju gena. Predloženo je da su neke od tih promjena izazvanih lijekovima na razini kromatina izuzetno stabilne i da time podupiru dugotrajna ponašanja koja definiraju ovisnost. CREB, ciklički AMP-odgovarajući vezni protein; DNMT, DNA metiltransferaze; HAT, histon acetiltransferaze; HDAC, histon deacetilaze; HDM, histonske demetilaze; HMT, histon metiltransferaze; MEF2, faktor 2 specifičnog pojačivača miocita; NF-kB, nuklearni faktor-KB; pol II, RNA polimeraza II. Reproducirano iz ref 44: Robison AJ, Nestler EJ. Transkripcijski i epigenetski mehanizmi ovisnosti. Nat Rev Neurosci. 2011: 12: 623-637.
Isto tako, mnogi tipovi transkripcijskih faktora - proteini koji se vežu za regulatorne regije gena i time povećavaju ili smanjuju transkripciju tih gena - uključeni su u posredovanje dugoročnih učinaka droge zloupotrebe na ekspresiju gena u mozgu, Istaknuti primjeri uključuju CREB (cAMP element odgovora koji veže protein), ΔFosB (transkripcijski faktor Fos obitelji), NFkB (nuklearni faktor kB), MEF2 (faktor pojačanja miocita-2), i glukokortikoidni receptori, među nekoliko drugih.5,10,18-22 Sve je više moguće razumjeti stanične signalne putove kojima zlouporaba droga aktivira dani transkripcijski faktor u mozgu i uzročno povezati takvu aktivaciju s ciljnim genima tog transkripcijskog faktora i sa specifičnim aspektima ovisnosti u ponašanju (vidi Slika 1). Ovaj napredak je ilustriran razmatranjem CREB i ΔFosB, koji su najbolje proučavani transkripcijski faktori u modelima ovisnosti.
cAMP Odgovor elementa vezanja proteina
Aktiviraju se stimulativni i opijatni lijekovi zlouporabe CREB u nekoliko područja mozga važnih za ovisnost, uključujući istaknuto u NAc.23,24 Poznato je da se CREB aktivira u drugim sustavima pomoću cAMP, Ca2+i putevi faktora rasta,25 i još nije poznato koje od njih posreduje njegovu aktivaciju u NAc lijekovima zlouporabe. Pokazalo se da aktivacija lijeka CREB u NAc-u predstavlja klasični negativni povratni mehanizam, pri čemu CREB služi za smanjenje osjetljivosti životinje na korisne učinke ovih lijekova (tolerancija) i za posredovanje u negativnom emocionalnom stanju tijekom povlačenja lijeka (ovisnost).18,26,27 Nedavno je pokazano da ti učinci dovode do povećane samoprimjene lijekova i relapsa, vjerojatno kroz proces negativnog pojačanja.28 Čini se da te aktivnosti CREB-a uključuju i glavne podtipove NAc srednjih neurona, onih koji izražavaju pretežno D1 nasuprot D2 dopaminske receptore.24 Ineobično, velika količina literature pokazala je da je CREB, djelujući u hipokampusu i amigdali, ključna molekula u pamćenju ponašanja.29-31 Ova široka uloga u ovisnosti i pamćenju ponašanja vjerojatno odražava činjenicu da su neuroni prožeti konačnim brojem molekularnih mehanizama kojima se prilagođavaju okruženju koje se stalno mijenja.
Ciljni geni za CREB koji posreduju u ovom fenotipu ponašanja identificirani su kroz testove na razini genoma kao i više odabranih napora.10,18,32 Jedan primjer je opioidni peptid dynorphin: stimulacija ekspresije dynorphina u NAc neuronima, posredovanim putem CREB, povećava aktivaciju dynorphina k opioidnih receptora na VTA dopaminskim neuronima i na taj način suprimira dopaminergički prijenos na NAc i narušava nagradu.18 Pokazalo se da je nekoliko drugih CREB ciljeva važno za sinaptičnu plastičnost izazvanu lijekom, kao što je diskutirano u nastavku. Dok se CREB također aktivira u nekoliko drugih područja mozga pomoću stimulansa i opijata,23,24 manje se zna o bihevioralnim posljedicama ovog učinka i ciljnim genima kroz koje se javljaju. Isto tako, manje se zna o ulozi CREB-a u posredovanju u djelovanju drugih droga.19
ΔFosB
Akutna izloženost gotovo svakom lijeku uzrokuje transkripcijske faktore Fos obitelji u NAc i nekoliko drugih područja mozga. Ta je indukcija brza, ali i vrlo prolazna, s razinama Fos proteina koji se vraćaju na normalu unutar 8 do 12 sati. Jedinstveno među ovim proteinima obitelji Fos je ΔFosB, skraćeni proizvod FosB gena, koji se zbog svoje neuobičajene stabilnosti postupno nakuplja tijekom ponovljenog izlaganja lijeku i postaje dominantni Fos protein izražen pod tim uvjetima.22,33 Štoviše, zbog te stabilnosti, razine ΔFosB traju tjednima nakon povlačenja lijeka. Takva kronična indukcija ΔFosB pokazana je za gotovo sve lijekove zlouporabe34 i, za većinu lijekova, je selektivan za Dl-tip NAc neurona.34,35 To je također bilo pokazana u ovisnika o ljudima.35 Velika količina literature pokazala je da takva indukcija ΔFosB u D1-tip NAc neuroni povećavaju osjetljivost životinje na lijek kao i prirodne nagrade i promiču samo-primjenu lijeka, vjerojatno kroz proces pozitivnog pojačanja (vidi refs 34 do 38). Zanimljivo je da je indukcija ΔFosB u NAc lijeku dramatičnija u adolescentskih životinja, vrijeme veće ranjivosti ovisnosti,39 i pokazalo se da njegova indukcija nikotinom posreduje u povećanju nagrade kokaina nalik nikotinu.40
Što se tiče CREB-a, brojni ciljni geni za ΔFosB identificirani su u NAc korištenjem kandidatnih gena i pristupa širokog genoma.10,32 Dok CREB inducira dinorfin, ΔFosB ga suzbija, što pridonosi učincima ΔFosB-a na nagrađivanje.38 Drugi ΔFosB cilj je cFos: kako se ΔFosB akumulira s ponovljenom izloženošću lijeku, on potiskuje c-Fos i doprinosi molekularnom prekidaču pri čemu je ΔFosB selektivno induciran u stanju kroničnog lijeka.41 Pokazalo se da mnoge druge ΔFosB mete posreduju u sposobnosti određenih lijekova zlostavljanja da induciraju sinaptičku plastičnost u NAc i povezane promjene u dendritičkoj arborizaciji NAc srednjih neurona, kao što će biti razmotreno u nastavku.
Funkcionalne posljedice indukcije ΔFosB u drugim područjima mozga su manje dobro razumljive, iako je njegova indukcija u orbitofrontalnom korteksu (OFC) detaljno proučena. Ovdje ΔFosB posreduje u toleranciji koja se javlja u kognitivno-ometajućim učincima kokaina tijekom trajanja kronične izloženosti, a ta prilagodba povezana je s povećanom kokainskom samoupravom.42,43
Ispitivanja na razini gena ukazuju na nekoliko potencijalnih ciljnih gena koji posreduju u tim učincima.42 Unatoč jedinstvenim vremenskim svojstvima ΔFosB i znanju da je on induciran u tradicionalnim memorijskim krugovima (npr. Hipokampus), još nije istraženo uloge ΔFosB u bihevioralnoj memoriji, što je zanimljivo za buduća istraživanja.
Epigenetski mehanizmi
U posljednjih nekoliko godina, istraživanja transkripcije su gurnuta korak dalje prema epigenetici44 (Vidi Slika 1)koji se može široko definirati kao promjena ekspresije gena koja se javlja u odsutnosti promjene u DNA sekvenci. Epigenetski mehanizmi kontroliraju pakiranje DNA unutar stanične jezgre putem svojih interakcija s histonima i mnogim drugim vrstama nuklearnih proteina, koji zajedno sadrže kromatin. Ekspresija gena se kontrolira stanjem ovog pakiranja kroz kovalentnu modifikaciju histona, drugih proteina i same DNA. Kao samo neki primjeri, acetilacija histona teži promicanju aktivacije gena, metilacija histona može ili potaknuti aktivaciju ili potiskivanje gena ovisno o Lys ostatku koji je podvrgnut ovoj modifikaciji, a metilacija DNA općenito je povezana s represijom gena, iako određene varijante oblika metilacije ( npr. 5-hidroksimetilacija) može biti povezana s aktivacijom gena.
Epigenetika je privlačan mehanizam, jer u drugim sustavima, primjerice u biologiji razvoja i raka, određene epigenetske modifikacije mogu biti trajne. Zbog ovog razloga, epigenetika se provodi iu modelima učenja i pamćenja (npr. ref. 45-48), kao iu ovisnosti;44,49 u oba sustava zabilježene su duboke promjene u acetilaciji i metilaciji histona te u metilaciji DNA. Kao jedan primjer, histon metiltransferaza, G9a, uključena je u obje memorije50 i ovisnosti.51,52 U modelima ovisnosti, Izraz G9a je smanjen u NAc kao odgovor na stimulirajuće ili opijatne droge zlostavljanja i tPokazalo se da njegovo djelovanje poboljšava učinak ovih lijekova.51,52 Zanimljivo je da supresija kokaina G9a posreduje ΔFosB. G9a katalizira dimetilaciju Lys9a histona H3 (H3K9me2), glavnog medijatora represije gena. ChIP-čip ili ChIP-seq (kromatin imunoprecipitacija slijedi, odnosno, promotorskim čipovima ili sekvenciranjem s visokom propusnošću) korišten je za dobivanje genomskih mapa gena u NAc koji pokazuju promijenjenu H3K9me2 nakon izloženosti stimulansu ili opijatima.32,52,53 Preklapanjem tih popisa gena s popisima genskih ekspresija na čitavom genomu, te s mapama na genomima mnogih drugih oblika epigenetskih modifikacija (npr. Vezanje ΔFosB, vezivanje CREB-a, druge modifikacije histona, itd.),32,53 trebalo bi biti moguće identificirati sve više kompletnih gena koji su regulirani zlouporabom droga i razumjeti uključene epigenetske mehanizme.
Drugi oblik epigenetske regulacije koji su uključeni u pamćenje i ovisnost je stvaranje mikroRNA. Ove male, nekodirajuće RNA vežu se na komplementarne regije mRNA i na taj način potiskuju njihovo prevođenje ili induciraju njihovu degradaciju. Brisanje Argonauta, proteina ključnog za obradu miRNAs, mijenja reakcije ponašanja na kokain, s izraženim učincima opaženim za D1- nasuprot D2-tipu srednjih štapnih neurona.54 Pokazalo se da se nekoliko specifičnih miRNA regulira izlaganjem lijeku i, pak, da utječu na reakcije ponašanja na lijekove (npr. Refs 55,56). Bit će uzbudljivo u budućim istraživanjima identificirati ciljeve mRNA ovih miRNA i karakterizirati njihov utjecaj na proces ovisnosti.
Sinaptička plastičnost
Isti opći tipovi sinaptičkih modifikacija na glutamatergičkim sinapsi, koji su uključeni u hipokampus i amigdalu u pamćenju ponašanja (vidi druge članke u ovom broju), na sličan način su se pokazali u regijama za nagrađivanje mozga u modelima ovisnosti i bitni su u posredovanju procesu ovisnosti.57,58 Takva sinaptička plastičnost uzrokovana lijekovima opisana je u nekoliko područja mozga, međutim, ovdje se koncentriramo na NAc gdje je većina istraživanja usredotočena na (Slika 2).
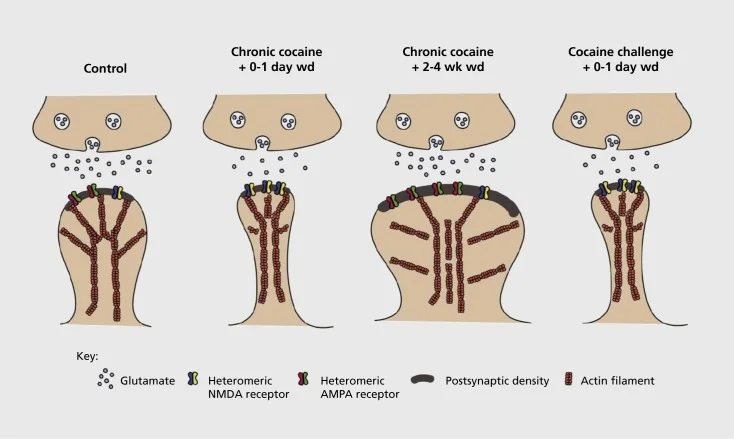
Model sinaptičke i strukturne plastičnosti ovisnosti u nucleus accumbens (NAc). Kronična izloženost kokainu rezultira vremenski ovisnom i prolaznom reorganizacijom receptora glutamata α-amino-3-hidroksi-5-metil-4-izoksazolepropionske kiseline (AMPA) i N-metil-D-asparaginske kiseline (NMDA) na sredstvu NAc neuronske kičme (MSN) sinapsi, kao i strukturne promjene u glavi kralježnice NAc MSN-a koje koreliraju s različitim oblicima sinaptičke plastičnosti. Na primjer, kronični kokain inducira površinsku ekspresiju NMDA receptora, stvaranje tihih sinapsi i dugotrajnu depresiju (LTD) u ranim točkama vremena povlačenja. Tijekom dužeg povlačenja (wd), ove sinaptičke promjene se vraćaju, a rezultat je povećana ekspresija površinskih AMPA receptora, konsolidacija sinapse u kralježnicu u obliku gljiva i dugotrajno pojačavanje (LTP). Ovi učinci se brzo vraćaju nakon izlaganja izazovnoj dozi kokaina koja dovodi do restrukturiranja kralježnice u tanke bodlje i depresiju sinaptičke snage.
Početni eksperimenti pokazali su da ponavljano izlaganje stimulirajućim lijekovima izaziva LTD (dugotrajnu depresiju) sličnu stanju u glutamatergičkim sinapama u NAc.59 Međutim, noviji radovi pokazali su da je takva plastičnost vrlo vremenski ovisna, s time da se LTD pojavljuje rano nakon posljednjeg izlaganja kokainu, razvijajući se u više stanja LTP (dugoročno pojačavanje) sličnog stanja nakon dužeg vremena izvlačenja.60,61 Ovaj rad, koji je do sada proveden primarno pomoću istraživača koji je primijenjen - za razliku od lijekova koji se daju samostalno - definirao je potrebu za sustavnijim istraživanjima u modelima samouprave koji prate oblike sinaptičke plastičnosti koji se javljaju kod glutamatergičnih sinapsi u NAc preko detaljnog vremenskog tijeka od stjecanja samouprave do njegovog održavanja, kroz različita vremena povlačenja i izumiranja, te kao odgovor na podražaj koji izaziva relaps. Dosadašnji rad je također definirao neke od molekularnih mehanizama koji doprinose ovoj sinaptičnoj plastičnosti uzrokovanoj lijekom, uključujući i promet AMPA receptora u sinapsu koja je možda posredovana djelomično putem CaMKII (Ca)2+fosforilacija određenih podjedinica AMPA receptora kao i izmijenjena ekspresija podjedinica AMPA receptora (npr. 60,62-65, Slike 2 i 3). Uloga CREB-a i ΔFosB-a bila je uključena u ove pojave, kao i povezane promjene morfologije glutamatergičnih sinapsi (vidi dolje). Na primjer, GluAl je meta za CREB u NAc, gdje su GluA2 i CaMKII obje ciljne skupine ΔFosB, u ovoj regiji mozga .35,36,66,67 Pomicanjem naprijed bit će važno povezati specifične prilagodbe s vremenski ovisnim promjenama u sinaptičkoj funkciji i osobinama ponašanja ovisnosti.

Molekularni mehanizmi u osnovi kokainske indukcije dendritičnih bodlji na srednjim bodljikavim neuronima jezgre accumbens (NAc). A) pokazuje povećanje broja dendritičnog broja kralježnice izazvano kokainom koje se može blokirati prekomjernom ekspresijom virusa G9a ili JunD (antagonist transkripcije posredovane AP1) ili oponašati virusnom prekomjernom ekspresijom FosB. B) Pokazalo se da regulacija trgovine AMPA receptorima (AMPAR) i aktinskog citoskeleta (lijevo), kao i regulacija transkripcije glutamatnih receptora i regulatornih bjelančevina aktina (npr. Posredovani putem ΔFosB, desno) igraju važnu ulogu u posredovanju regulacije kokaina u NAc gustoći dendritične kralježnice. UMK, kinaza domene LIM; RAC, supstrat C3 botulinskog toksina vezan za Ras.
Novi eksperimentalni alati omogućuju po prvi put da se s većom preciznošću definiraju koji pojedini krugovi pokazuju ove oblike sinaptičke plastičnosti i koje abnormalnosti u ponašanju posreduju. Na primjer, tŠkoljke i jezgrene subregije NAc pokazuju razlike u sinaptičkoj plastičnosti uzrokovanoj lijekovima, kao i D1- prema D2-srednjim srednjim kičmim neuronima unutar svake podregije.60,63,64,67 Isto tako, optogenetski eksperimenti pružili su novi uvid u doprinos određenog oblika sinaptičke plastičnosti (npr. LTD) specifičnim populacijama glutamatergičnih sinapsi u NAc, na primjer, one koje proizlaze iz medijalnog PFC nasuprot bazolateralnoj amigdali nasuprot ventralnom subikulumu (glavni izlaz hipokampusa).68-70 U konačnici, bit će potrebno prekrivati molekularne prilagodbe izazvane lijekovima u svakom od ovih aferentnih neurona prilagodbama specifičnim za sinapsu koje se javljaju u njihovim postsinaptičkim dendritima kako bi se stvorilo cjelovito razumijevanje načina na koji zlouporaba droga modificira moždani krug kako bi pokrenula određene aspekte bolesti. ovisna država. Ovaj će pothvat zahtijevati veću procjenu plastičnosti izazvane lijekovima u inhibitornim sinapsama unutar istih regija mozga, području koje je do danas dobivalo vrlo malo pažnje.65
Plastičnost cijelih stanica
Dok je većina istraživanja koja uključuju neurofiziološke promjene u neuronima u pojavama zlouporabe droga, kao u učenju i pojavama pamćenja, usredotočena na sinaptičku plastičnost, sve je više dokaza o važnosti plastičnosti cijelih stanica. Plastičnost cijelih stanica, koja se također naziva homeostatska plastičnost,71 uključuje promjene u intrinzičnoj podražljivosti cijele živčane stanice na način da ona nije specifična za sinapsu. S obzirom da određene značajke ovisnosti o drogama uključuju pojačanu ili smanjenu osjetljivost na lijek, ima smisla da povećana ili smanjena električna pobuđenost određenih živčanih stanica pridonosi tim prilagodbama ponašanja.5
Korištenje električnih romobila ističe najbolje utvrđeni primjer plastičnosti cijele stanice na lijek zlouporabe je sposobnost kroničnih opijata da povećaju unutarnju podražljivost noradrenergičkih neurona locus coeruleus (LC)).72 Povećana ekscitabilnost je posredovana preko CREB-a i njegove indukcije određenih izoformi adenilil ciklaze, što dovodi do povećanog ispaljivanja LC neurona, možda kroz indukciju Na + kanala.72-75 Ta hiperekscitivnost LC neurona predstavlja klasični mehanizam tolerancije i ovisnosti i pokreće neke od znakova i simptoma povlačenja opijata. Zanimljivo je da CREB posreduje u sličnoj formi plastičnosti cijelih stanica u NAc srednjim neuronima, koji također postaju hipereksibilni zbog kronične izloženosti lijekovima zlouporabe putem CREB-a.76 Stoga će biti kritično u budućim istraživanjima razumjeti kako CREB-posredovana sinaptička plastičnost glutamatergičnih sinapsi na NAc srednjim neuronima65,66 sumama s CREB-posredovanom intrinzičnom hipereekscitabilnošću tih neurona76 kontrolirati bihevioralne značajke ovisnosti.
Još jedan primjer plastičnosti cijelih stanica u modelima ovisnosti je hiperekscitabilnost VTA dopaminskih neurona koji se javlja nakon kronične izloženosti opijatnim lijekovimai (Slika 4).77,78 Ova adaptacija, koja je povezana s morfološkim promjenama u tim živčanim stanicama (vidi sljedeći odjeljak), nije posredovana CREB-om, već je postignuta regulacijom neurotrofnih signalnih kaskada, kao što je opisano u nastavku.
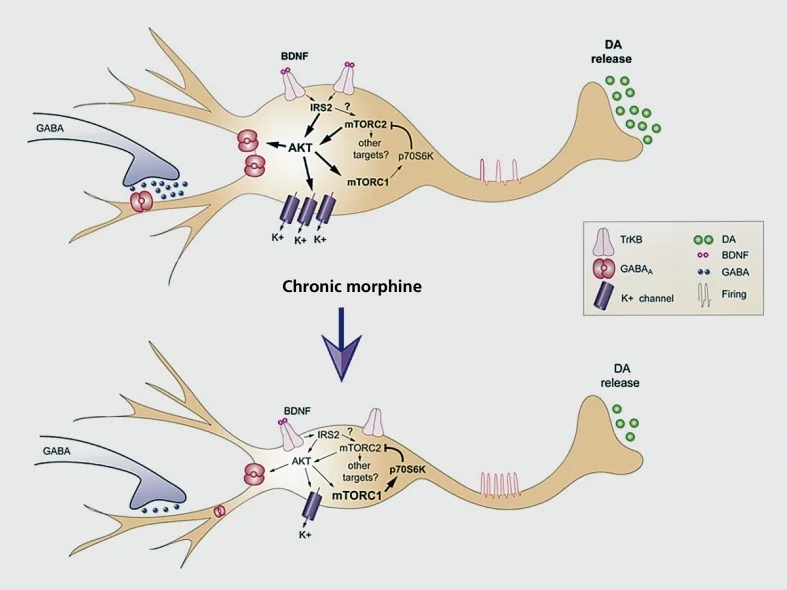
Radni model kroničnih morfin-induciranih adaptacija u neuronama dopamina u ventralnom tegmentalnom području (VTA). Kronični morfij smanjuje veličinu VTA dopamina (DA), ali povećava neuronsku podražljivost, dok se prijenos dopamina u nucleus accumbens smanjuje. Neto učinak morfija je manje odgovoran put nagrađivanja, tj. Tolerantnost na nagradu. Reguliranje signalizacije IRS2-AKT u VTA posreduje u učincima kroničnog morfija na veličinu soma i električnu podražljivost; učinak na ekscitabilnost posreduje se smanjenim strujama γ-aminomaslačne kiseline (GABA) A i suzbijanjem ekspresije K 'kanala, Reguliranje aktivnosti mTORC2-a izazvane morfinom u VTA ključno je za morfološke i fiziološke prilagodbe morfija, kao i za toleranciju na dobit. Za razliku od mT0RC2, kronični morfin povećava aktivnost mTORCI, što ne utječe na ove adaptacije izazvane morfijem. BDNF, neurotrofni faktor izveden iz mozga; IRS, supstanca za receptor inzulina; mTORC, mTOR kompleks; AKT, protein kinaza B Replicirano iz ref 77
Morfološka plastičnost i neurotrofni mehanizmi
Sve veći broj dokaza, mnogo toga iz studija hipokampalnog i cerebralnog kortikalnog neurona, pokazao je da su promjene u sinaptičkoj plastičnosti povezane s morfološkim promjenama kod sinapsi. Primjerice, LTD i generiranje tihih sinapsi povezani su s formiranjem tankih ili tvrdih dendritskih bodlji, dok je LTP povezan s većim bodljama u obliku gljiva.79,80 Stoga je zanimljivo da se područje zlouporabe droga usredotočilo na promjene izazvane drogom u dendritičnim bodljama već više od 15 godina. Kronična izloženost stimulirajuće droge povećavaju gustoću dendritske kralježnice srednjih neurona kralježnice NAc, što je promjena koja preovladava za neurone tipa Dl.67,81,82 Indukcija bodljastih dijelova uglavnom je povezana s osjetljivim odgovorima na ove lijekove, iako neki dokazi u sukobu s tim gledištem.
Međutim, kao i kod istraživanja sinaptičke plastičnosti, potrebno je mnogo više rada kako bi se sustavno definirale promjene u dendritskim bodljama koje se javljaju tijekom tijeka samouprave, povlačenja i relapsa. Sdo danas, uključujući lijek istraživača i samoga sebe, sugeriraju vrlo različite promjene kralježnice koje se događaju u različitim točkama vremena povlačenja i u NAc ljusci nasuprot jezgrenim podregijama.83-86 Također će biti važno definirati precizne molekularne mehanizme pomoću kojih kokain ili drugi stimulans proizvodi ove vremenski ovisne i specifične učinke na stanični tip. Pokazalo se da je ΔFosB i neophodan i dovoljan za indukciju nezrelih kralješnica na Nl neuronima Dl tipa..35,51,67 Takva regulacija događa se zajedno s kokainom i ΔFosB regulacijom nekoliko proteina za koje se zna da kontroliraju reorganizaciju aktinog citoskeleta. Kao samo jedan primjer, transkripcijska regulacija nekoliko faktora izmjene gvaninskih nukleotida i GTPase aktivirajućih proteina smanjuje Rac1, malu GTPazu, za prolazno smanjenje aktivnosti u odgovoru na svaku izloženost kokainu, i prikazana su takva pulsirajuća smanjenja aktivnosti Rac1, koristeći optogenetsku kontrolu Rac1, da posreduje u indukciji nezrelih kralježnica.87 Ovi učinci Racl vjerojatno se javljaju kroz njegovu kontrolu nad kofilinom i drugim aktin regulatornim proteinima, za koje je također pokazano da posreduju u regulaciji kokaina rasta kralježnice.87,88 Međutim, važno je naglasiti da je ovo samo jedan put koji je uključen u regulaciju kokaina nezrelim bodljama, jer se pokazalo da i nekoliko drugih proteina igra važnu ulogu, uključujući CDK5 (ciklin-ovisna kinaza-5), CaMKII, NFkB , MEF2, CREB, G9a i DNMT3 (DNA metiltransf brisanje 3a), da nabrojimo samo neke.20,21,35,51,67,89,90 Zanimljivo, kokainska regulacija nekoliko ovih gena, uključujući indukciju CDK5, CaMKII i NFkB, te potiskivanje G9a, također je posredovana preko ΔFosB.20,35,51,91
Iznenađujuće, opijatni lijekovi zlostavljanja vrše suprotan učinak i smanjuju dendritičnu gustoću kralježnice NAc srednjih štapnih neurona.81 Malo se zna o posljedicama ove prilagodbe i uključenim molekularnim mehanizmima. Ovaj fenomen je, međutim, iznenađujuće, s obzirom na to da su CREB i ΔFosB inducirani od strane oba stimulansa i opijata i oboje su uključeni u stimulaciju posredovanu indukciju NAc dendritičke gustoće kralježnice. To postavlja pitanje kako opijati suzbijaju gustoću NAc kralježnice usprkos njihovoj indukciji tih faktora.
Drugi glavni oblik morfološke plastičnosti koji se vidi u modelima zlouporabe droga je fizička redukcija veličine ćelijskih soma VTA dopaminskih neurona induciranih kroničnom primjenom opijata.77,92,93 Slična prilagodba javlja se kao odgovor na kanabinoide.94 Ovo skupljanje VTA dopaminskih neurona, koje se javlja kod opijatne samouprave93 i dokumentirana je u ovisnicima o heroinu koji su pregledani nakon smrti77 čini se da posreduje u toleranciji nagrađivanja i povezan je s smanjenim otpuštanjem dopamina u NAc. Značajni dokazi sada pokazuju da je to smanjenje u veličini stanične some posredovano supresijom opijata ekspresije neurotrofnog faktora (BDNF) iz mozga unutar tih neurona. Izravno smo povezali ovo povlačenje BDNF podrške i smanjenje VTA neurona uzrokovano opijatima, na smanjenu aktivnost nizvodnih BDNF signalnih kaskada u VTA dopaminskim neuronima, specifično reduciranu aktivnost IRS2 (insulin receptor substrate-2), AKT (serin-treonin) kinaza), i TORC2 (meta rapamicina-2, koja je neosjetljiva na rapamicin).77,93 Također smo povezali ovu downregulaciju BDNF signalizacije izravno s povećanom podraživošću koju morfin inducira u tim neuronima, kao što je ranije spomenuto.77,78 Doista, smanjena veličina somskih stanica i povećana podražljivost su čvrsto povezani, jer indukcija jednog dovodi do drugog i obrnuto. Ta kontrola nad pobuđenošću stanica uključuje supresiju K+ kanale i GABAA struje u tim neuronima.
Ova uloga BDNF-a u kontroli odgovora morfija na razini VTA-a u suprotnosti je s vrlo različitom uključenošću u djelovanje kokaina i drugih stimulansa. Stimulansi induciraju BDNF signaliziranje NAc, učinak zbog povećane lokalne sinteze BDNF, kao i povećanog oslobađanja iz nekoliko aferentnih područja.95 Štoviše, povećano BDNF signaliziranje u NAc, ali ne u VTA, pokazalo se da promiče učinke ovih lijekova na ponašanje, uključujući i njihovu samoupravu.95,96 Suprotno reguliranje BDNF signalizacije na VTA-NAc putu od opijata prema stimulansima povećava mogućnost da takve razlike posreduju u suprotnoj regulaciji lijekova NAc dendritičnim bodljama, što je mogućnost koja se sada istražuje.
Budući naputci
Gornja priča naglašava ogroman napredak koji je postignut u razumijevanju molekularnih i staničnih prilagodbi koje se javljaju u regijama za nagrađivanje mozga kao odgovor na ponovljeno izlaganje drogi zlostavljanja, te u povezivanju individualnih prilagodbi na određene značajke ponašanja sindroma ovisnosti u životinjskim modelima. , Unatoč tom napretku, glavna pitanja ostaju. Većina naših postojećih znanja usredotočena je na VTA i NAc, s mnogo manje dostupnih informacija o drugim ključnim limbičkim regijama mozga koje su također ključne za ovisnost o drogama. Osim toga, sve eksperimentalne demonstracije uzročne uloge molekularno-stanične adaptacije u ponašanju povezanom s drogom manipulirale su pojedinačnim prilagodbama. Manipulirati brojnim prilagodbama u isto vrijeme je očito mnogo teže, ali je također bitno, jer znamo da lijekovi proizvode velik broj različitih vrsta promjena čak i unutar pojedinih neurona, što vjerojatno dovodi do kompliciranih načina utjecaja na ponašanje. Takav sustavni biološki pristup bit će presudan za krajnje razbijanje bioloških podloga ovisnosti. Naposljetku, napori za razumijevanje molekularno-staničnih mehanizama sjećanja vezanih uz ovisnost nalaze se na točki na kojoj se sada bore svi drugi napori da se shvati biološka osnova sećanja u ponašanju: naša sposobnost povezivanja bioloških fenomena sa složenim pamćenjem ponašanja ostaje iznimno teško. Prevladavanje ove podjele predstavlja možda najveći izazov u neuroznanosti.
Odabrane kratice i akronimi
- NAC
- nucleus accumbens
- CREB
- vezni protein cAMP odgovora
- ΔFosB
- Fos transkripcijski faktor obitelji Fos
- VTA
- ventralno tegmentalno područje
- AMPA
- a-amino-3-hidroksi-5-metil-4-izoksazolepropionska kiselina
- LTD
- dugotrajna depresija
- LTP
- dugoročno protentiranje
- BDNF
- neurotrofni faktor izveden iz mozga
- NKkB
- nuklearni faktor kB
REFERENCE