MEGJEGYZÉSEK: Nora Volkow, a Nemzeti Kábítószer-visszaélési Intézet vezetője és csapata ismerteti. Ez az áttekintés felsorolja a 3 fő neurobiológiai diszfunkciót, amelyek az összes függőségben szerepet játszanak. Egyszerűen kijelentve, hogy: a) Desenzitizáció: a dopamin jelátvitel csökkenése miatt számtalan öröm választ; b) Szenzibilizáció: fokozott dopamin válasz a függőségi jelekre, kiváltókra vagy stresszre; és c) Hypofrontalitás: az önkontroll áramkörök gyengülése a frontális kéreg térfogatának és működésének csökkenése miatt. Ugyanezeket az agyi változásokat az American Society for Addiction Medicine (ASAM) is leírta a függőség új meghatározása megjelent augusztusban, 2011.
Volkow ND, Wang GJ, Fowler JS, Tomasi D, Telang F, Baler R. Bioessays. 2010 Sep; 32 (9): 748-55.
Országos Kábítószer-visszaélési Intézet, NIH, Bethesda, MD 20892, USA.
Absztrakt
Az agyi képalkotási eredmények alapján egy olyan modellt mutatunk be, amely szerint a függőség az agyi áramkörök és funkciók közötti információfeldolgozásban és integrációban kiegyensúlyozatlanná válik.
A működési zavarok:
a) a jutalomkörök csökkent érzékenysége, \ t
(b) a memóriaáramkörök fokozott érzékenysége a drogok és a kábítószer-jelzések, a stresszreaktivitás és a negatív hangulat elvárásainak függvényében;
(c) és gyengült vezérlő áramkör.
Bár a visszaélés kábítószerével végzett kezdeti kísérlet nagyrészt önkéntes viselkedés, a folyamatos kábítószer-használat végül is károsíthatja az agyi neuronális áramköröket, amelyek részt vesznek a szabad akaratban, és a kábítószer-használat automatikus kényszeres viselkedéssé válik. Az addiktív gyógyszerek neuronok közötti neurotranszmitter-jelek (beleértve a dopaminot, a glutamátot és a GABA-t) együttes optimalizálásának képessége megváltoztatja a különböző neuronális áramkörök működését, amelyek a függőségi pálya különböző szakaszaiban elkezdenek elzáródni. A kábítószer-expozíció, a gyógyszeres jelek vagy a stressz hatására ez a motiváció / hajtás áramkör korlátlan hiperaktiválódását eredményezi, ami a kábítószer-bevitelhez vezet, ami a függőséget jellemzi.
Bevezetés
Az idegtudományi kutatás utolsó 25 éve bizonyítékot szolgáltatott arra, hogy a függőség az agyi betegség, amely erős érvként szolgál az ugyanolyan orvosi ellátási normák fenntartásához, mint az olyan betegek esetében, akik közösek a többi nagy betegséggel járó betegséggel, mint például cukorbetegség. Valóban, a függőséggel kapcsolatos kutatás elkezdte feltárni az események sorrendjét és a tartós következményeket, amelyek az addiktív anyag tartós visszaéléséből eredhetnek. Ezek a vizsgálatok azt mutatták, hogy az ismételt kábítószer-használat a kulcsmolekulákra és az agyi áramkörökre irányulhat, és végül megzavarhatja az érzelmeket, megismerést és viselkedést alátámasztó magasabb rendű folyamatokat. Megtanultuk, hogy a függőséget az agy diszfunkciójának bővülő ciklusa jellemzi. A károsodás jellemzően az agy evolúciósan primitívebb területein kezdődik, amelyek a jutalmat feldolgozzák, majd a többi összetettebb kognitív funkciókért felelős területekre lépnek. Így a jutalom mellett a függő személyek súlyos tanulási zavarokat is tapasztalhatnak (memória, kondicionálás, szokás), végrehajtó funkció (impulzus-gátlás, döntéshozatal, késleltetett kielégítés), kognitív tudatosság (interoception) és még érzelmi (hangulat- és stresszreaktivitás) funkciókat.
A pozitron emissziós tomográfiát (PET) használó agyi képalkotó vizsgálatok eredményeinek nagyrészt az agyi áramköröket mutatjuk be, amelyeket a kábítószer krónikus visszaélése befolyásol, majd egy koherens modellt mutat be, amely szerint a függőség a nettó eredményként jelenik meg. kiegyensúlyozatlan információfeldolgozás ezen áramkörökben és azok között. A fokozatos adaptív (neuroplasztikus) agyi folyamatok, valamint a valószínűségüket befolyásoló biológiai és környezeti sebezhetőségi tényezők alapos megértése döntő fontosságú a függőség elleni küzdelem hatékonyabb megelőzési és kezelési módszereinek kidolgozása szempontjából.
A függőséghez magas, de rövid, dopamin-törés szükséges
A függőség mindenekelőtt az agy jutalmazási rendszerének betegsége. Ez a rendszer a neurotranszmitter dopamint (DA) használja fő pénznemként az információk továbbítására. Az agy DA kulcsszerepet játszik az ásékonysággal kapcsolatos információk feldolgozásában [1, 2], amely a jutalom szabályozására vagy befolyásolására irányuló képességének középpontjában áll [3, 4], jutalom elvárás [5], a motiváció, az érzelmek és az öröm érzései. A DA átmeneti felszabadulása az agy ventralis striatumában szükséges, bár nem elégséges esemény a bonyolult folyamatokban, amelyek a jutalom érzetét keltik: úgy tűnik, hogy a DA növekedése pozitív kapcsolatban áll az alanyok által tapasztalt „magas” intenzitásával. Kondicionált válaszok csak akkor válnak ki, ha a DA ismételten felszabadul, mint ilyen éles, átmeneti, hullám, a gyógyszerekre vagy a gyógyszerekkel kapcsolatos jelekre adott válaszként.
Érdekes, hogy közvetlenül vagy közvetve minden addiktív kábítószer-munka túlzott, de átmeneti növekedést vált ki az extracelluláris DA-ban a jutalom (limbikus) rendszer kulcsfontosságú régiójában [6, 7], különösen a ventrális striatumban elhelyezkedő accumbens (Nac) magban. Az ilyen DA túlfeszültségek hasonlítanak, és bizonyos esetekben nagymértékben meghaladják a természetesen élvezetes ingerek által kiváltott fiziológiai növekedéseket (amelyeket általában természetes erősítőknek vagy jutalmaknak neveznek). Ahogy azt vártuk, a pozitron emissziós tomográfiával (PET) végzett emberi agyi képalkotó vizsgálatok egyértelműen kimutatták, hogy a különböző gyógyszercsoportok által indukált DA növekedés (például. stimulánsok (1A), [8, 9], nikotin [10] és az alkohol [11]) a ventrális striatumon belül, a mérgezés során az eufória (vagy magas) szubjektív tapasztalatához kapcsolódnak [12, 13, 14]. Mivel a PET-tanulmányokat ébrenlétben végezhetjük, a hatóanyag-hatások szubjektív jelentései és a DA-szintek relatív változásai közötti összefüggést is meg lehet mutatni. A legtöbb tanulmány arról számolt be, hogy azok, akik a legnagyobb dózisnövekedést mutatták a kábítószer-expozíció után [amfetamin, nikotin, alkohol, metilfenidát (MPH)], szintén jelentik a legintenzívebb magas vagy eufóriát (1B).
Az állati és emberi tanulmányok kimutatták, hogy az agy sebessége, amellyel egy gyógyszer belép, elindul és elhagyja az agyat (azaz farmakokinetikai profilja) alapvető szerepet játszik a megerősítő hatások meghatározásában. Valóban, minden olyan kábítószer-visszaélés, amelynek agyi farmakokinetikáját PET-vel (kokain, MPH, metamfetamin és nikotin) mértük, ugyanolyan profilt mutat, amikor intravénásan alkalmazzák, azaza csúcsszintek az emberi agyban 10 min.2A), és ez a gyors felvétel a „magas” (2B). Ebből az összefüggésből következik, hogy az addiktív hatóanyagnak az agyba történő bejutásának lehető leggyorsabban történő biztosításának hatékony módja kell, hogy legyen az erősítő potenciál minimalizálására, így a visszaélés felelősségére. Egy olyan kísérletet terveztünk, amely pontosan teszteli ezt a hipotézist az MPH stimuláns gyógyszerrel, amely a kokainhoz hasonlóan növeli a DA-t, lassítva a transzportot a preszinaptikus neuronba (azaz a DA transzporterek blokkolásával), ezáltal növelve a DA jelet. Valójában azt találtuk, hogy míg az MPH intravénás beadása gyakran euphorigénes, orálisan beadott MPH, ami szintén növeli a DA-t a striatumban [15], de 6-12-szeres lassabb farmakokinetikával nem jellemző, hogy erősödik [16, 17]. Így az orális MPH - vagy az amfetamin [18] ehhez a kérdéshez - a magas szint előidézéséhez valószínűleg az agyba történő lassú felvételük tükrözi [19]. Ezért indokolt javasolni egy szoros összefüggés meglétét az agyba való visszaélés sebessége között, amely meghatározza a DA növekedésének sebességét a ventrális striatumban, és annak erősítő hatásait [20, 21, 22]. Más szóval, ha egy gyógyszer megerősítő hatást fejt ki, akkor hirtelen meg kell emelnie a DA-t. Miért kellene így lennie?
A neuronális tüzelés nagysága és időtartama alapján a DA jelzés két alapforma lehet: fázisos vagy tonikus. A fázisjelzést nagy amplitúdó és rövid burst tüzelés jellemzi, míg a tonikus jelzés jellemzően alacsony amplitúdóval és hosszabb ideig tartó vagy tartós időintervallummal rendelkezik. A megkülönböztetés azért fontos, mert kiderül, hogy a visszaélésekhez szükséges gyógyszerekhez fázikus DA jelzés szükséges, hogy „kondicionált válaszokat” idézzenek elő, ami az egyik kezdeti neuroadaptáció, amely az erősítő ingereknek (beleértve a gyógyszert is) való expozíciót követi. Az egyik megkülönböztető szempont, amely összekapcsolja a fázisjelzést a kondicionálással, a D2R és a glutamát bevonása. n-metil-d-aspartinsav (NMDA) receptorok [23]. Másrészt, a tonikus DA jelzés szerepet játszik a munkamemória és más végrehajtási folyamatok modulálásában. Néhány olyan jellemző, amely megkülönbözteti ezt a jelzésmódot a fázis típusától, az, hogy főleg alacsonyabb affinitású DA receptorokon (DA D1 receptorokon) működik. Azonban a különböző mechanizmusok ellenére az elhúzódó hatóanyag-expozíció (és a tónusos DA jelátvitel ezen receptorokon keresztül történő változása) is szerepet játszott a neuroplasztikus változásokban, amelyek végül kondicionálást eredményeznek [25] az NMDA és az alfa-amino-3-hidroxil-5-metil-4-izoxazon-propionát (AMPA) glutamát receptorok módosításával [24].
A bizonyítékok azt mutatják, hogy a DA mimikus phasic DA sejtek tüzelésének hirtelen fokozott drognövekedése. Ez segít megmagyarázni, hogy az addiktív anyag krónikus alkalmazása olyan erőteljes, kondicionált válaszokat eredményezhet a gyógyszerhez, annak elvárásaihoz és számtalan jeléhez (emberek, dolgok és helyek), amelyek a használathoz kapcsolódnak. Bár az ilyen gyors DA-emelésektől függő visszaélésszerű gyógyszerek akut erősítő hatásai valószínűleg „szükségesek” a függőség kialakulásához, nyilvánvalóan nem „elegendőek”. más neurotranszmitter rendszerek másodlagos neuroadaptációiból erednek (például glutamát [26] és talán γ-aminobutirinsavat (GABA) is, amely végül a DA által modulált további agy áramköröket érinti. Ezek az áramkörök a következő szakaszok középpontjában állnak.
A krónikus kábítószerrel való visszaélés csökkenti a dopamin receptorokat és a dopamin termelést: A „magas” blunted
Az a tény, hogy a kábítószer-használat krónikusnak kell lennie a függőség előtti gyökérzetben, egyértelműen jelzi, hogy a betegség a sérülékeny egyénekben a jutalmazási rendszer ismételt zavaraitól függ. Ezek a zavarok végül sok más áramkörben (motiváció / hajtás, gátló kontroll / végrehajtó funkció és memória / kondicionálás) neuroadaptációkhoz vezethetnek, amelyeket szintén DA modulál.27]. A függő betegeknél következetesen jelentett neuro-adaptációk közül a D2R (nagy affinitású) receptorok szintjének jelentős csökkenése és a DA sejtek által kibocsátott DA mennyisége [28] (Ábra 3). Fontos, hogy ezek a hiányok alacsonyabb regionális metabolikus aktivitással járnak a prefrontális kéreg (PFC) olyan területein, amelyek kritikusak a megfelelő végrehajtási teljesítmény szempontjából (azaz anterior cingulate gyrus (CG) és orbitofrontális kéreg (OFC)) (4A). Ez a megfigyelés arra enged következtetni, hogy ez lehet az egyik olyan mechanizmus, amely összekapcsolja a kábítószer-indukálta DA-jelzés zavarát a kényszeres kábítószer-adagolással és a kábítószer-fogyasztás ellenőrzésének hiányával [29]. Ezenkívül a kialakuló hipodopaminerg állapot megmagyarázná egy függő egyén csökkent érzékenységét a természetes haszon iránt (pl. Étel, szex stb.), Valamint a drogfogyasztás fenntartását, amely ideiglenesen kompenzálja ezt a hiányt [30]. E tudás lényeges következménye, hogy ezeknek a hiányoknak a kezelése (a striatum D2R szintek növelésével és a striatum és prefrontális régiókban a DA felszabadulásával) klinikai stratégiát kínálhat a függőség hatásának javítására [31]. Van-e bizonyíték arra, hogy a hipodopaminerg állapot visszahelyezése pozitív hatással lehet az anyag-visszaéléshez kapcsolódó viselkedésre? A válasz igen. Vizsgálataink azt mutatják, hogy a D2R túltermelésének kényszerítése révén a kokain- vagy alkohol-tapasztalt patkányok jutalmazási rendszerében jelentősen csökkenthetjük a kokain önadagolását [31] vagy alkohol [32]. Továbbá rágcsálókban, valamint az emberi metamfetamin-bántalmazókban [33] a D2R csökkent striatális szintje szintén impulzivitással függ össze, és rágcsálókban a gyógyszer önadagolásának kompulzív mintázatát feltételezi (lásd alább).
A képalkotó vizsgálatok azt is kimutatták, hogy az emberekben a függőség a DA-felszabadulás csökkenésével jár együtt a ventrális striatumban és a striatum más régióiban, és az aktív és a méregtelenített kábítószer-használóknál a kábítószerrel szembeni kedvező válaszokban (Ábra 5) [34]. Ez egy váratlan eredmény volt, mivel feltételezték, hogy a függőség a gyógyszerekre adott jutalmazó (és így a dopaminerg) válaszok fokozott érzékenységét tükrözi. A kábítószer-bántalmazók esetében a DA-felszabadulás csökkenése tükrözi a megszakadt neurofiziológiát a jutalmi áramkörben (azaz a DA-ban a striatumban felszabaduló DA-idegsejtekben), vagy alternatív módon a jutalmi áramkör megszakított visszacsatolási szabályozása a prefrontális (végrehajtó kontroll) vagy az amigdaláris (érzelmi) útvonalakon (prefrontális-striatus, amygdalarstriatális glutamáterg utak). Mivel a striatum tiszta dopaminerg diszfunkciója, amint azt a krónikus kábítószer-bántalmazó szemlélteti, nem veszi figyelembe azokat a tulajdonságokat, amelyek az addiktív viselkedést, például az impulzivitást, a vágyat és a kábítószer-jelek által kiváltott visszaesést jellemzik, nagyon valószínű, hogy a prefrontális régiók (mint és az amygdala) is részt vesznek itt, mert azok megzavarása lehetővé tenné vagy legalábbis befolyásolná ezeket a viselkedési jellemzőket.
A csökkent dopamin receptor (DR2) szint csökkenti az impulzivitás szabályozását a prefrontális kéreg által
Feltételezhető, hogy a függőséget jellemző kompulzív drogfogyasztási magatartás csökkent ellenőrzése részben az agy frontális régióiban fellépő specifikus zavarokból eredhet [35]. Jelentős mennyiségű bizonyíték van, amely támogatja ezt a fogalmat, kezdve az állatkísérletekből, amelyek feltárják a D2R és a viselkedésellenőrzés közötti kapcsolatot. A patkányokkal végzett kísérletek egyértelműen korrelációt mutatnak az alacsony D2R és az impulzivitás között [36], valamint az impulzivitás és a kábítószer-önigazgatás között [37]. De mi a kapcsolat? Mint korábban említettük, a kábítószer-bántalmazókban az alacsonyabb striatális D2R szignifikánsan korrelál az alacsonyabb agyi glükóz-metabolizmussal a PFC kulcsfontosságú régióiban, mint például az OFC (melynek része a sűrűség-hozzárendelés és amelynek zavara kompulzív viselkedést eredményez) és a CG-ben (gátló kontroll) és hibaellenőrzés, és amelyek megzavarása impulzivitást eredményez) (\ t4B) [38, 39]. Ezenkívül egy egyénben (átlagos SD ± életkor, 24 ± 3 év) végzett kísérletben az alkoholizmus családtörténetét tapasztaltuk, de akik nem maguk is alkoholisták voltak, jelentős összefüggést találtunk a striatális D2R és a frontális régiók metabolizmusa között (CG , OFC és dorsolaterális PFC), valamint az elülső szigetelésben (részt vesz az interoceptionben, az önismeretben és a kábítószer vágyban) [40] (Ábra 6). Érdekes, hogy ezeknek az egyéneknek magasabb striatális D2R-je volt, mint az összehasonlított kontrolloknak, akiknek nem volt családi története az alkoholizmusnak, bár a frontális metabolizmusban nem különböztek. A kontrollokban a striatális D2R nem korrelált a frontális anyagcserével. Ez arra vezetett bennünket, hogy spekuláljuk, hogy az alkoholizmus magas szintű genetikai kockázatát mutató alanyokban a normálnál magasabb striatális D2R megvédi őket az alkoholizmus ellen részben a prefrontális régiók aktivitásának erősítésével. Kombináció esetén ezek az adatok arra utalnak, hogy a striatumban a D2R magas szintje megvédheti a kábítószerrel való visszaélést és a függőséget azáltal, hogy az impulzivitási tulajdonságokat ellenőrzik, azaz, a viselkedési válaszok gátlásában és az érzelmek szabályozásában részt vevő áramkörök szabályozásával.
Hasonlóképpen azt feltételeztük, hogy a prefrontális régiók is szerepet játszanak az addiktív alanyokban megfigyelt striatális DA felszabadulás (és megerősítés) csökkentésében, mivel szabályozzák a DA sejtek tüzelését a striatumban a midrain és a DA felszabadulás során. A hipotézis teszteléséhez meghatároztuk a PFC-ben a kiindulási anyagcsere-metabolizmus és az MPH intravénás beadása által a kontrollokban és a méregtelenített alkoholistákban indukált striatális dózis növekedését. A hipotézisnek megfelelően az alkoholistákban nem sikerült kimutatni a normális összefüggést a striatumban a prefrontális metabolizmus és a DA felszabadulás között, ami arra enged következtetni, hogy az alkoholistákban észlelt DA felszabadulás szignifikáns csökkenése részben a prefrontális agyi régiókban az agyi aktivitás helytelen szabályozását tükrözi [34].
Ezzel összefüggésben találtunk összefüggést a PFC csökkentett kiindulási aktivitása és a reduktív striatális D2R között a drogfüggő betegeknél, valamint az alapvonalú PFC aktivitás és a DA felszabadulás között a kontrollokban, amelyek nincsenek a függő egyedekben. Ezek a szövetségek a PFC-útvonalak neuroadaptációi és a DA-díj és a motivációs rendszer lefelé irányuló diszfunkciói közötti erős kapcsolatokat támasztják alá, valószínűleg a PFC impulzivitásra és kompulzivitásra gyakorolt hatása miatt. Ezek azonban nem adják meg a további viselkedési jelenségeket, mint például a kábítószerrel összefüggő jelek hatását a vágy kiváltásában, ami feltehetően a memória és a tanulási áramköröket vonja maga után.
A kondicionált emlékek és a sztereotípiák viselkedése helyettesíti a „magas” vezetőt
A ventrális striatumban a DA-sejtek túlzott stimulációja végül új funkcionális kapcsolatokat hoz létre az agyban a késztetés kielégítése és az azt körülvevő szituációs események között (pl. A környezet, a gyógyszerkészítés rutinja stb.), Újdonságok meghatározásával. , erőteljes tanult egyesületek, amelyek viselkedést indíthatnak. Végső soron a gyógyszer puszta memóriája vagy előrejelzése kiválthatja az addiktív személyeket jellemző impulzív viselkedést. Ismétlődő droghasználat esetén a DA sejtek striatumban történő tüzelése elkezdi megváltoztatni a mögöttes asszociatív tanulás neurokémiáját. Ez megkönnyíti a kábítószerhez kapcsolódó maladaptív memória nyomok konszolidációját, amely segít megmagyarázni a kábítószerrel összefüggő stimulusok mindenfajta képességét (az ilyen ingereknek kitett kábítószer-jutalom fogadásának várakozásában) [41] a DA-sejtek égetésének gyors indítására. A DA motivációjának szerepe miatt ezek a DA-emelések kiváltják a jutalom biztosításához szükséges motivációs hajtást [42]. Valójában, ha a patkányokat ismételten egy olyan neutrális ingerre teszik ki, amely párosul a gyógyszerrel (kondicionált), DA-t okozhat, és visszaállíthatja a gyógyszer önadagolását [43]. Az ilyen kondicionált válaszok klinikailag relevánsak az anyaghasználat rendellenességeiben, mert felelősek a függő személy nagy valószínűséggel a visszaesésnek még hosszabb méregtelenítési időszakok után is. Most, az agyi képalkotó technikák lehetővé teszik számunkra, hogy teszteljük, hogy az embereknek a kábítószerrel összefüggő jelzésekkel való expozíciója a laboratóriumi állatoknál mutatott kábítószer-vágyat kiváltja-e.
Ismétlődő droghasználat esetén a DA sejtek striatumban történő tüzelése elkezdi megváltoztatni a mögöttes asszociatív tanulás neurokémiáját. Ez megkönnyíti a kábítószerhez kapcsolódó maladaptív memória nyomok konszolidációját, amely segít megmagyarázni a kábítószerrel összefüggő stimulusok mindenfajta képességét (az ilyen ingereknek kitett kábítószer-jutalom fogadásának várakozásában) [41] a DA-sejtek égetésének gyors indítására. A DA motivációjának szerepe miatt ezek a DA-emelések kiváltják a jutalom biztosításához szükséges motivációs hajtást [42]. Valójában, ha a patkányokat ismételten egy olyan neutrális ingerre teszik ki, amely párosul a gyógyszerrel (kondicionált), DA-t okozhat, és visszaállíthatja a gyógyszer önadagolását [43]. Az ilyen kondicionált válaszok klinikailag relevánsak az anyaghasználat rendellenességeiben, mert felelősek a függő személy nagy valószínűséggel a visszaesésnek még hosszabb méregtelenítési időszakok után is. Most, az agyi képalkotó technikák lehetővé teszik számunkra, hogy teszteljük, hogy az embereknek a kábítószerrel összefüggő jelzésekkel való expozíciója a laboratóriumi állatoknál mutatott kábítószer-vágyat kiváltja-e.
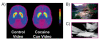
Ezt a kérdést az aktív kokainhasználókban vizsgálták. A PET és a [11C] raclopride, két független vizsgálat kimutatta, hogy egy kokain-cues videó (a kokain dohányzó alanyok), de nem egy semleges videó (a természet jelenetei) a megnövekedett striatális DA-t a kokaintól függő humán betegekben (Ábra 7) és hogy a DA növekedése a kábítószer vágyának szubjektív jelentésekkel függ össze [44, 45]. Minél nagyobb a DA növekedés, amelyet a kokain-csajok expozíciója vált ki, annál intenzívebb a drog. Ezenkívül a DA-emelkedések nagyságrendje korrelált a függőség súlyossági pontszámával is, kiemelve a kondicionált válaszok relevanciáját a függőség klinikai szindrómájában.
Fontos azonban hangsúlyozni, hogy ezeknek a rosszindulatú szövetségeknek a feltételezett ereje ellenére nemrégiben új bizonyítékokat gyűjtöttünk, amelyek arra utalnak, hogy a kokainbántalmazók megtartják bizonyos képességüket arra, hogy célzottan gátolják a vágyat. Ezért a fronto-striatális szabályozás megerősítésére irányuló stratégiák potenciális terápiás előnyöket jelenthetnek [46].
Összeszereljük
A kábítószerfüggőség leginkább ártalmas jellemzői közül az a túlnyomó vágy, hogy olyan gyógyszereket szedjenek, amelyek évekig tartó absztinencia után is felléphetnek, és a raboktól szenvedő betegek súlyosan veszélyeztetett képessége, hogy a jól ismert negatív következmények ellenére a vágy eltűnik.
Javasoltunk egy függőségi modellt [47], amely elmagyarázza e betegség többdimenziós jellegét, azzal a céllal, hogy négy egymással összefüggő áramkör hálózatát javasolja, amelyek kombinált diszfunkcionális kimenete megmagyarázhatja a függőség számos sztereotípiás viselkedési jellemzőjét: (a) jutalom, beleértve a bazális ganglionok több magját, különösen a ventrális striatum, amelynek Nac-ját a ventrális tegmentális területről kapja, és az információt továbbítja a ventrális pallidumhoz (VP); (b) motiváció / hajtás, amely az OFC-n belül található, a szubkultális kéregben, a hátsó striatumban és a motoros kéregben; (c) az amygdala és a hippocampusban található memória és tanulás; és d) a dorsolaterális prefrontális kéregben, az elülső CG és az alsó frontális kéregben elhelyezett tervezés és ellenőrzés. Ezek a négy áramkör közvetlen idegennyelést kap a DA neuronoktól, de közvetlen vagy közvetett vetülettel (többnyire glutamatergikus) kapcsolódnak egymáshoz.
A modell négy áramköre együtt működik, és működésük tapasztalattal változik. Mindegyik fontos fogalomhoz kapcsolódik, vagyis: sűrűség (jutalom), belső állapot (motiváció / hajtás), tanult egyesületek (memória, kondicionálás) és konfliktusmegoldás (kontroll). Ezen túlmenően ezek az áramkörök kölcsönhatásba lépnek a hangulattal (beleértve a stresszreaktivitást is) érintő áramkörökkel [48] és interocepcióval (ami a kábítószer vágyának és hangulatának tudatosságát eredményezi) [49]. Javasoltuk, hogy az itt vázolt négykörös hálózat tevékenységének mintája befolyásolja, hogy a normális egyén hogyan dönt a versengő alternatívák között. Ezeket a választásokat a jutalom, a memória / kondicionálás, a motiváció és a vezérlő áramkörök szisztematikusan befolyásolják, és ezeket a hangulat és a tudatos tudatosság alapjául szolgáló áramkörök modulálják (8A).
Az ingerre adott választ a pillanatnyi sűrűsége, azaz a várható jutalom befolyásolja. A jutalom-várakozásokat részben a ventrális striatumba vető DA-neuronok feldolgozzák, és az OFC glutamatergikus vetületei befolyásolják (ami a kontextus függvényében a sűrűségértéket hozzárendeli) és az amygdala / hippocampus (amely közvetíti a kondicionált válaszokat és a memória emlékeit). Az inger értékét a többi alternatív ingerrel szemben súlyozzuk (összehasonlítjuk), de az egyén belső igényeinek függvényében is változik, amelyet a hangulat (beleértve a stresszreaktivitást) és az interoceptív tudatosság modulál. Különösen a stressz-expozíció növeli a gyógyszerek sűrűségét, ugyanakkor csökkenti az amygdala prefrontális szabályozását [50]. Ezen túlmenően, mivel a krónikus kábítószer-expozíció a fokozott szenzitizációhoz kapcsolódik a stresszválaszokhoz, ez magyarázza, hogy a stressz a klinikai helyzetekben olyan gyakran kiváltja a kábítószer-visszaesést. Minél erősebb az inger érzékenysége, részben a korábban emlékezetes tapasztalatok által alakítottak, annál nagyobb a motivációs áramkör aktiválása, és annál erősebb a hajtás a beszerzésre. Az inger beszerzésére (vagy nem) történő kognitív döntést részben a PFC és a CG dolgozza fel, amelyek mérik az egyensúlyt azonnali pozitív és a késleltetett negatív eredmények között, valamint az alacsonyabb frontális kéreg (Broadmann Area 44) között. amely megakadályozza a cselekvés előtti válaszreakciót [51].
E modell szerint a rabszolgamódosított témában (8B), a visszaélés kábítószerének kiszámíthatóságát és az ahhoz kapcsolódó jeleket más (természetes) jutalmak rovására növelik, amelyek sűrűsége jelentősen csökken. Ez megmagyarázza a kábítószer-keresési motiváció növekedését. Ugyanakkor az akut hatóanyag-expozíció visszaállítja a jutalmi küszöbértékeket is, ami a jutalmi áramkör érzékenységének csökkenéséhez vezet [52], amely szintén segít megmagyarázni a nem kábítószer-erősítők értékének csökkenését a függő személyben. A gyógyszerek fokozott sűrűségének másik oka a DA-nak a visszaélések (tolerancia) elleni gyógyszerekhez való hozzászokásának hiánya a normál szokásos szokásokhoz képest, amelyek a természetes jutalmakhoz vezetnek, és amely telítettséget eredményez [53].
Továbbá a kondicionált ingereknek való kitettség elegendő a jutalom küszöbértékek növeléséhez [54]; így megjósolhatnánk, hogy egy függő személyben a kondicionált jelekkel rendelkező környezetnek való kitettség tovább súlyosbítaná a természetes jutalmak iránti érzékenységüket. Más versenyzők versenyének hiányában a feltételes tanulás megnöveli a gyógyszer megszerzését a fő motivációs hajtás szintjére az egyén számára. Feltételezzük, hogy a kábítószeres jelek (vagy stressz) gyors DA-emelkedést eredményeznek a vákuumban és a dorzális striatumban, ami a kábítószer-bevitel motivációját hajtja végre, és nem lehet megfelelően ellentmondani egy diszfunkcionális PFC-nek. Így a kábítószer-fogyasztás és a mérgezés hatására a DA-jelek javulása a motivációs / meghajtó és memória áramkörök megfelelő túlaktiválásához vezetne, amely deaktiválja a PFC-t (az előrontó gátlás intenzív amygdala aktiválással történik) [50], blokkolja a PFC teljesítményét a motivációs / meghajtó áramkör vezérlésére. E gátló kontroll nélkül pozitív visszacsatolású hurok jön létre, ami kompulzív drogbevitelhez vezet. Mivel az áramkörök közötti kölcsönhatások kétirányúak, a hálózat aktiválása a mérgezés során tovább erősíti a hatóanyag fizikai értékét és a gyógyszeres jelek kondicionálását.
Következtetések
Röviden, egy olyan modellt javasolunk, amely a függőséget mutatja be: A függőség során a memória áramkörben lévő drogjelek megnövekedett értéke ösztönzi az elvárásokat, és fokozza a gyógyszer fogyasztásának motivációját, leküzdve a már működőképtelen PFC által kifejtett gátló kontrollt. Bár a kábítószerfüggő alanyoknál a gyógyszer által kiváltott DA-növekedés jelentősen gyengül, a gyógyszer farmakológiai hatásai önmagukban kondicionált válaszként jelentkeznek, ami tovább növeli a gyógyszer szedésének motivációját és a pozitív visszacsatolású hurok előnyben részesítését a szétkapcsolás miatt a prefrontális vezérlőáramkör. Ugyanakkor a függőség valószínűleg újra kalibrálja a hangulatot és a tudatos tudatosságot (a szürke sötétebb árnyalatai által képviselt) áramköröket.8B) olyan módon, hogy ha kísérletileg megerõsítették volna, akkor az egyensúlyt a gátló kontrolltól és a vágyatól és a kényszeres kábítószer-beviteltől távolabb eldönti.
Könnyen elismerjük, hogy ez egy egyszerűsített modell: rájöttünk, hogy ezekben az áramkörökben más agyi régiókat is be kell vonni, hogy az egyik régió hozzájárulhat több áramkörhöz, és hogy más áramkörök is valószínűleg részt vesznek a függőségben. Ezen túlmenően, bár ez a modell a DA-ra összpontosít, a preklinikai vizsgálatokból kitűnik, hogy a glutamatergikus előrejelzések módosítása számos, a függőségben megfigyelt adaptációt közvetít, és amit itt tárgyaltunk. A preklinikai vizsgálatokból is kiderül, hogy más neurotranszmitterek is szerepet játszanak a gyógyszerek megerősítő hatásában, beleértve a kannabinoidokat és az opioidokat. Sajnos, a közelmúltig, a PET-képalkotáshoz való korlátozott hozzáférés a rádió-nyomjelzőkhöz korlátozta a más neurotranszmitterek kábítószer-jutalomban és függőségben való részvételét.
Rövidítések
- AMPA
- α-amino-3-hidroxil-5-metil-4-izoxazol-propionát
- CG
- cingulate gyrus
- CTX
- kéreg
- D2R
- dopamin típusú 2 / 3 receptor
- DA
- dopamin
- FDG
- fiuor
- GABA
- y-aminobutirinsav
- HPA
- hypothalamikus hipofízis tengely
- MPH
- metilfenidát
- nac
- nucleus accumbens
- NMDA
- n-metil-d-aszparaginsav
- OFC
- orbitofrontális kéreg
- PET
- pozitron emissziós tomográfia
- ŐRVEZETŐ
- prefrontális kéreg
- VP
- ventrális pallidum
Referenciák
55. Fowler JS, Volkow ND, Logan J, et al. A metamfetamin gyors felvétele és tartós kötődése az emberi agyban: összehasonlítás a kokainnal. Neuroimage. 2008;43: 756-63. [PMC ingyenes cikk] [PubMed