НОВИНИ ТА ПОГЛЯДИ
19 грудня 2018
Виявлені мозкові кола компульсивної наркоманії
Дослідження у мишей визначає адаптацію головного мозку, що лежить в основі компульсивного поведінки, пов'язаного з наркоманією, і яка може пояснити, чому деякі споживачі наркотиків ведуть себе примусово, тоді як інші не.
Препарати зловживання мають складні фармакологічні ефекти, які викликають багато змін у функціях мозку. Один з цих ефектів, пряма або непряма активація нейронів, які вивільняють нейромедіатор дофамін, є загальною для всіх наркотиків і давно передбачається, що вони сприяють розвитку наркоманії. Введення в природа, Пасколі та інші1 повідомляють про нейробіологічні механізми, викликані повторною активацією дофамінових нейронів, які можуть пояснити, чому деякі споживачі наркотиків шукають винагороду, незважаючи на негативні наслідки - тип компульсивного поведінки, що є визначальною рисою людської залежності2.
Автори взяли оптогенетичний підхід, щоб імітувати активацію допамінових систем головного мозку наркотичними засобами: вони використовували лазерне світло, доставлене через оптичне волокно, для активації дофамінових нейронів у вентральній області (VTA) мозку генетично модифікованих мишей. Миші могли безпосередньо стимулювати ці самі нейрони, натискаючи на важіль, і виконували цю дію жадібно протягом тестового періоду 40 хвилин на день протягом майже 2 тижнів.
У наступні дні миші отримували короткий електричний удар до своїх ніг на одну третину випадків натискання важеля, навмання. Їхня поведінка в цьому стані виявила інтригуючу мінливість: 40% мишей (називаються відмовники) значно зменшили частоту натискання на важелі при данні ударів стопи (Рис. 1a), тоді як решта 60% (переслідувачі) були готові отримати болючі покарання за можливість самостимулювати свої дофамінові нейрони (рис. 1b). Як показали деякі з цих авторів3, що наполегливі миші забезпечують модель стійкого вживання наркотиків, незважаючи на негативні наслідки, і паралельно підмножини споживачів наркотиків, чиє вживання наркотиків стає компульсивним.
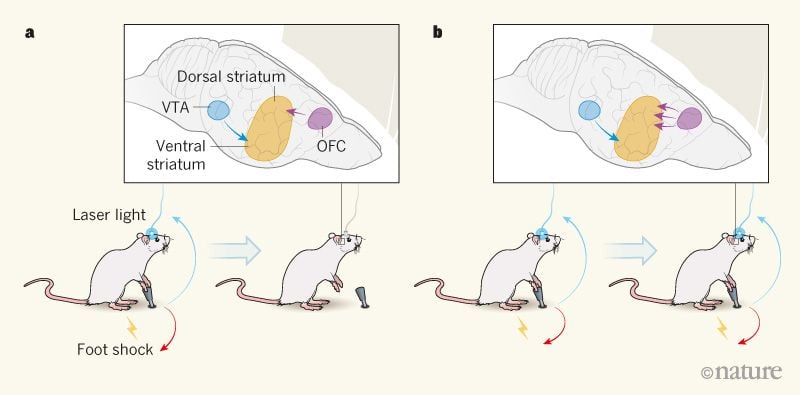
Малюнок 1 | Компульсивна активація нейронів дофаміну в мозку. У дослідженні Пасколі та ін.1Миші натискали на важіль, щоб активувати допамін-вивільняючі нейрони через доставку лазерного світла, проведеного оптичним волокном. Ці нейрони, які проектуються з вентральної тегментальної області (VTA) до вентрального стриатуму в мозку, пов'язані з винагородою. aДеякі миші, які називалися відмовники, зменшили поведінку натискання важеля, коли це було пов'язано з болісним ураженням електричним струмом на ногах. Сила зв'язків між нейронами орбітофронтальної кори (OFC), що проекують до спинного стриатума, була низькою у цих мишей. bІнші миші, що називалися наглядачами, продовжували натискати на важіль, незважаючи на покарання - відмітною ознакою нав'язливого поведінки. Нейронні зв'язки між OFC і дорсальним стриатумом були сильнішими у цих мишей, ніж у відракаторах. Коли автори послаблювали ці сполуки у пасивних мишей, знижувалося (не показано) компульсивное поведінка тварин.
Наступні автори спробували визначити, що відрізняється між мозком переслідувачів і відмовників. Вони вимірювали активність нейронів, що з'єднують різні області мозку в реальному часі, щоб визначити, які мережі були активними, коли миші натискали на важіль. Зв'язок між орбітофронтальною корою (OFC), областю, що бере участь у процесі прийняття рішень, і спинний стриатум, який займається добровільною діяльністю, збільшувався перед натисканням на мишах, які хотіли отримати удари разом з самостимуляцією дофаміном. Оптогенетичне інгібування цього нервового шляху перетворювало нашедших мишей на відмову від мишей. Цей висновок показує, що підвищена активність нейронів, що проектуються з OFC в спинний стриатум, була необхідна для цієї форми компульсивної активації дофамінових нейронів.
Проте цей поведінковий перемикач був лише тимчасовим: коли оптогенетичне інгібування було відключене, компульсивное поведінка відновилося у наполегливих мишей. Автори аргументували, що тривалі зміни на синапсах - переходах між нейронами - які з'єднують нейрони OFC і дорсального стриатума, можуть виникати в результаті багатоденної самостимуляції нейронів дофаміну. Якби ці зміни відбувалися тільки у мишей, що тривають, це могло б пояснити їх стійку компульсивну поведінку.
Якщо ця гіпотеза вірна, то сила синаптичних зв'язків між OFC і нейронами спинного стриатума повинна бути більшою у тих, хто переслідує, ніж у відракачів, що дозволяє краще активувати нейрони дорсального стриатума нейронами OFC. Дійсно, Пасколі та інші Далі було показано, що сила синапсів між нейронами OFC і нейронами дорсального стриатума зросла у мишей, що тривають (рис. 1). Відновники, а також миші, які ніколи не були піддані експериментальній установці та мишам, які отримували удари, але не дозволяли використовувати важіль, показали низьку синаптичну міцність між OFC і нейронами спинного стриатума.
Примітно, що автори виявили, що компульсивна поведінка може бути придушена або індукована відповідно зниженням або збільшенням сили цієї нейронної зв'язку. Послаблення синаптичних зв'язків між OFC і дорзальним стриатумом у мишей, що тривають, знижувало їх готовність до самостимуляції перед можливим шоком ноги. І навпаки, відмовники можуть бути перетворені на переслідувачів, збільшуючи силу цих синаптичних зв'язків. На відміну від тимчасового розвороту, що спостерігається після оптогенетичного інгібування OFC-нейронів, що проектуються до спинного стриатуму, ці зміни синаптичної сили викликали поведінковий перемикач, який зберігався протягом шести днів.
Пасколі та інші виявили нейроадаптацію, яка дозволяє мишам перекривати хворобливий стимул, щоб продовжувати активувати свої дофамінові нейрони. Хронічне вживання наркотичних засобів у людей призводить до повторної активації тієї ж схеми підсилення допаміну, тому подібна нейроадаптація може призвести до продовження прийому наркотиків, незважаючи на негативні наслідки. Щоб перевірити це твердження, ми повинні визначити, чи зміни у силі зв'язків між OFC і нейронами спинного стриатума опосередковують компульсивну поведінку у мишей, натискаючи на важіль для отримання кокаїну, амфетамінів або опіоїдів перед можливим шоком.
Чи оптимізована стимуляція дофамінових нейронів точно імітує активацію дофамінових нейронів наркотичними засобами? Існують очевидні відмінності між швидким включенням і вимиканням лазера під час оптогенетичної стимуляції і більш повільним початком і тривалістю дії препарату. Проте автори раніше показали4 що споживання кокаїну та оптогенетична активація індукують майже ідентичні адаптації в нейронах дофаміну та їх безпосередніх низхідних цілях, забезпечуючи сильне обґрунтування експериментального підходу, використаного в поточному дослідженні.
Чому самостимуляція дофамінових нейронів призводить до компульсивного поведінки лише в підмножині індивідів? Наполегливість і відмова від самостійного стимулювання мишей приблизно в той же час і з подібним числом подій перед початком ударних ударів, але, здається, мозок двох груп змінювався у різних напрямках. Нейрони дофаміну VTA, стимульовані мишами, не з'єднують безпосередньо з OFC або дорзальним стриатумом, тому зв'язок між цими областями повинна включати численні синаптичні з'єднання. Раніше був описаний мультисинаптичний шлях, через який активація VTA дофамінових нейронів може призвести до змін в спинному стриатумі.5і було запропоновано лежати в основі переходу від не-компульсивного до компульсивного прийому наркотиків6,7. Існуючі раніше відмінності в цій мультисинаптичній схемі могли б пояснити, чому компульсивна поведінка і пов'язані з нею зміни синаптичних зв'язків зустрічаються лише у деяких мишей.
Синаптичні зміни можуть тривати кілька днів, років або навіть життя. Можливі зміни, виявлені Пасколі та ін. формують основу тривалого зміни поведінки, що є ознакою наркоманії? Вирішення цього питання вимагатиме експериментальних доказів того, що самостійне введення препарату, незважаючи на негативні наслідки, відбувається через посилення зв'язків між OFC і дорзальним стриатумом, і що дійсно активація дофамінових систем приводить до руху ланцюг нейронних подій, які завершуються в примусовому прийомі наркотиків.
природа 564, 349-350 (2018)
doi: 10.1038 / d41586-018-07716-z