КОМЕНТАРИ: Одне з небагатьох досліджень, яке висвітлює, як стриманість впливає на рівень дофамінових рецепторів у приматів.
- D2-рецептори відновляються досить швидко - менше місяця
- D1-рецептори є занадто високими за місяць, але відскакують протягом 90 днів.
- Високі або низькі D1 рецептори можуть бути ключем до гострої абстиненції та тяги
Томас Дж. Р. Беверідж1, Хіларі Р Сміт1, Майкл А Надер1 та Лінда Дж. Порріно1
1Кафедра фізіології та фармакології, Центр нейробіологічного розслідування зловживання наркотиками, Медична школа Університету Уейк Форест, Вінстон-Салем, штат Північна Кароліна, США
Листування: д-р Л.Я. Порріно, кафедра фізіології та фармакології, Центр нейробіологічних розслідувань зловживання наркотиками, медична школа Університету Уейк-Форест, Медичний центр, бульвар, Вінстон-Салем, NC 27157-1083, США. Тел: + 1 336 716 8575; Факс: + 1 336 716 8501; Електронна пошта: [захищено електронною поштою]
Отримано 29 квітня 2008 р .; Переглянуто 25 липня 2008 року; Прийнято 30 липня 2008 року; Опубліковано в Інтернеті 3 вересня 2008 року.
абстрактний
Хоча дисрегуляція в системі дофаміну (ДА) є характерною ознакою хронічного впливу кокаїну, питання про те, чи зберігаються ці зміни до абстиненції, залишається в основному без відповіді. Нелюдські примати є ідеальною моделлю, в якій можна оцінити вплив абстиненції на систему ДА після хронічного впливу кокаїну. У цьому дослідженні чоловіки-мавпи-резуси самостійно вводили кокаїн (0.3) mg/кг на впорскування, підсилювачі 30 на сеанс) за фіксований інтервал 3-хвграфік протягом 100 днів з подальшим утриманням або 30, або 90 днів. Ця тривалість самостійного введення кокаїну раніше показала зменшення щільності рецепторів DA-D2 та підвищення рівня D1-подібних рецепторів та транспортерів DA (DAT). Відповідь контрольних мавп підтримували подачею їжі за однаковим протоколом та однаковими періодами утримання. [3H]Приєднання SCH 23390 до Рецептори DA D1 після днів відмови від 30 були значно вищими у всіх частинах стриатуму, порівняно з контрольними тваринами, тоді як [3H]Зв'язування раклоприду з рецепторами DA D2 не відрізнялося між групами. [3H]Зв'язок WN 35 428 з DAT також був значно вищим практично на всіх ділянках спинного та вентрального стриатуму після днів відмови від 30. Однак після днів абстиненції 90 рівень рівнів DA D1-рецепторів та DAT не відрізнявся від контрольних значень. Хоча ці результати свідчать про можливе відновлення окремих елементів системи ДА, вони також підкреслюють динамічний характер цих компонентів під час початкових фаз утримання від хронічного самоконтролю кокаїну.
Ключові слова:
кокаїн, дофамін, авторадиография, утримання, стриатум
ВСТУП
Хронічне вживання кокаїну серед наркоманів людини пов'язане з нейроадаптаціями в системі дофаміну (DA) (Мелісон та ін, 1998; Волков та ін, 1993, 1997). Сюди входять збільшення щільності транспортерів DA (DAT) та зниження концентрацій DA-D2-подібних рецепторів (мало та ін, 1999; Пюре та ін, 2002; Волков та ін, 1993). Крім того, спостерігалися зміни в випуску DA. Наприклад, дослідники, які використовують позитронно-емісійну томографію (ПЕТ) з дослідженнями [11C]раклоприд та метилфенідат продемонстрували зниження викиду DA в смузі хронічних споживачів кокаїну (Волков та ін, 1997; Wong та ін, 2006). Однак однією з проблем є те, що часто важко виключити вплив інших факторів, таких як вживання інших незаконних та легальних наркотиків, відмінності в попередньому режимі споживання та вживання наркотиків та відмінності в способі життя. Ці відмінності, а також наявність умов, які можуть передувати вживання наркотиків, можуть обмежувати тлумачення досліджень у пацієнтів людини.
Нелюдські моделі приматів, в яких змінами можна систематично маніпулювати, є альтернативним підходом до вивчення наслідків хронічного самовведення кокаїну та подальшого утримання. Попередні дослідження показали, що хронічне опромінення кокаїну супроводжується значним зниженням концентрації рецепторів DA D2, а також підвищенням рівня D1-рецепторів та щільності DAT (Лечворт та ін, 2001; Мур та ін, 1998a, 1998b; Надер та ін, 2002, 2006). Ці ефекти відображають ті, що спостерігаються у людей, тим самим обґрунтовуючи корисність цих моделей впливу наркотиків.
Хоча є вагомі докази дисрегуляції систем ДА, але виявилося складніше оцінити, чи є докази відновлення після припинення вживання наркотиків (Мелісон та ін, 1998; Якобсен та ін, 2000; Волков та ін, 1993) чи тривають ці зміни поза часовими рамками тривалої дії кокаїну. Знову ж таки, нелюдські моделі приматів можуть дати розуміння цієї фази залежності. Фарфель та ін (1992) повідомляло про зниження концентрації DAT та D1-подібних рецепторів у смузі мавп після утримання від хронічного невмілого впливу кокаїну. Однак конкретну роль абстиненції було важко визначити через відсутність вимірювань у групі без періоду абстиненції. Аналогічно Мелега та ін (2008) повідомили про істотне зниження рівня ДАТ в смузі вервету мавп після тижня 3 утримання від ескалаційного режиму метамфетаміну. Введення стимуляторів в обох дослідженнях, однак, не припинялось. Шлях введення (контингент) vs було показано, що впливає на мозок по-різному щодо вивільнення ДА (Хембі та ін, 1997) і метаболізм глюкози (Грехем і Порріно, 1995; Порріно та ін, 2002). Таким чином, використання цього методу в даному дослідженні обходить це питання. Крім того, ефекти тривалого самоуправління кокаїном на системи ДА головного мозку були широко вивчені, використовуючи цю модель самовведення у мавп-резусів, тим самим забезпечуючи базову лінію для оцінки нейроадаптацій, що виникають під час абстиненції.
Метою цих досліджень було визначити, чи змінюються концентрації DAT та DA D1 та D2 рецепторів, які раніше були продемонстровані у тварин, що зазнали самоконтролю кокаїну (Лечворт та ін, 2001; Мур та ін, 1998a, 1998b; Надер та ін, 2002) буде змінено після тривалих періодів утримання. На основі досліджень у споживачів наркотиків людини (пор Волков та ін, 1993), ми припустили, що ці зміни в системі DA продовжуватимуться навіть після місяців утримання від 3. З цією метою мавпи кокаїну самостійно вводять сеанси 100 із загальним прийомом 900 mg/кг, після чого слід або 30, або 90 дні утримання від препарату. DA D1 і D2 рецептори, а також DAT вимірювали кількісно пробірці рецепторна авторадіографія.
МЕТОДИ
Тематика
Всього 17 експериментально-наївних дорослих мавп-резусів (Макака мулатка) вагою між 7.7 і 13 кг (середнє ± SD, 10.2 ± 1.32) на початку дослідження служили суб'єктами. Усі процедури проводилися відповідно до встановленої практики, як описано у Керівництво Національного інституту охорони здоров’я по догляду та використанню лабораторних тварин. Крім того, всі процедури були переглянуті та затверджені Комітетом з догляду та використання тварин Університету Уейк Форест. Мавпи були індивідуально розміщені в клітках з нержавіючої сталі з водою ad libitum; тварини мали фізичний і зоровий контакт один з одним. Масу тіла підтримували приблизно на рівні 90 – 95% ваги для годування на вільному вигодовуванні гранулами з ароматом у банані, отриманими під час експериментальних сесій та додатковою годівлею Lab Diet Monkey Chow, за умови, що не раніше 30 хв після сеансу Крім того, їм давали свіжі фрукти або арахіс не рідше трьох разів на тиждень. Кожну мавпу зважували один раз на тиждень, і при необхідності їх раціон коригували для підтримки стабільної ваги.
Поведінковий апарат
Експериментальні сесії проводилися у вентильованих та звужених ослаблених операційних камерах (1.5 × 0.74 × 0.76 м; Med Associates Inc., East Fairfield, VT), призначений для розміщення крісла приматів (Модель R001; Primate Products, Редвуд-Сіті, Каліфорнія). Камера містила розвідувальну панель (48 × 69) см), який складався з двох висувних важелів (5 см шириною) і три подразника вогню. Важелі розташовувалися в межах легкої досяжності від мавпи, яка сиділа в кріслі примаса. Гранули з харчовим бананом (1) г; Bio-Serv, Frenchtown, NJ) доставляли з годівниці, розташованої зверху камери. Перистальтичний інфузійний насос (7531-10; Cole-Parmer Co., Чикаго, штат Іллінойс) був використаний для доставки ін'єкцій ліків зі швидкістю приблизно 1 мл на 10 s тим тваринам, що самостійно вводять кокаїн. Функціонування камер та збирання даних здійснювалося за допомогою комп'ютерної системи Power Macintosh з інтерфейсом (Med Associates Inc.).
Хірургічні процедури
Всі мавпи, включаючи контрольних, готували хірургічним шляхом у стерильних умовах, що містять внутрішньовенні катетери та порти судинного доступу (Model GPV; Access Technologies, Skokie, IL). Мавпам знеболювали комбінацію кетаміну (15) mg/кг, im) та буторфанол (0.03 mg/kg, im) і зробили надріз біля стегнової вени. Після тупої дисекції та ізоляції вени проксимальний кінець катетера був введений у вену на відстань, розраховану на закінчення в нижній порожнистій вені. Дистальний кінець катетера був нанизаний підшкірно до розрізу, зробленого трохи від середньої лінії спини. Порт для судинного доступу розміщувався в кишені, утвореному тупою розсіченням біля цього розрізу. Мавпам дали 24 – 48 h час відновлення перед поверненням до реагуючих на харчові продукти. Приблизно за 5 днів до термінальної процедури кожній мавпі імплантували хронічний катетер, що перебуває у сусідню стегнову артерію для збору проб артеріальної крові. Хірургічні процедури були ідентичними описаним для венозних катетерів. У день остаточного сеансу було проведено термінальне дослідження мозкового обміну глюкози, в якому мавпам вводили 2-[14C]дезоксиглюкоза (2-DG) приблизно 2 хв після закінчення сеансу і через артеріальний катетер через 45 були отримані зразки крові хв період (див Beveridge та ін, 2006 для деталей). Дані метаболізму цих досліджень тут не представлені.
Процедури самоуправління
Мавпи спочатку були навчені реагувати на одному з двох важелів, підсилюючи кожну відповідь на правильному важелі харчовою гранулою. Протягом приблизно 3-тижневого періоду інтервал між наявністю харчових гранул поступово збільшувався, поки не досягнуто інтервалу 3-хв (тобто графік фіксованого інтервалу 3-хв. Підсилення; FI 3-хв.). За умовами остаточного розкладу, перша відповідь на важіль після 3 хв призвів до доставки харчової гранули; сесії закінчилися після презентацій їжі 30. Наприкінці кожного сеансу важелі реагування були втягнуті, домашні світильники та стимулюючі вогні гасили, а тварини залишалися в затемненій камері приблизно 30 хв до того, як їх повернули до рідних кліток. Усі мавпи відповідали за графіком FI 3-хв подачі їжі протягом принаймні сеансів 20 і до отримання стабільних показників (± 20% середнього рівня протягом трьох сеансів поспіль, без тенденцій щодо рівня відповідей). Коли реакція на підтримання їжі була стабільною, годівницю відключали від мережі, а ефекти вимирання на реакцію перевіряли протягом п’яти сеансів поспіль, після чого реакцію відновлювали та підтримували подачею їжі.
Після встановлення базової продуктивності всіх мавп готували хірургічним шляхом за допомогою венозних катетерів, як описано вище, та випадковим чином віднесли до однієї з трьох груп. Одна група мавп слугувала контролем і продовжувала відповідати за графіком FI 3-хв подачі їжі на загальну кількість сеансів 100 (N=6). Решта мавп 11 були віднесені до груп самовведення кокаїну (0.3 mg/кг на ін’єкцію). Тому що 0.3 mg/кг кокаїну на ін'єкцію вважали високою дозою для мавп, що раніше були наївними кокаїном, для більшості тварин ця доза була досягнута протягом двох сеансів, спочатку дозволивши мавпі самостійно вводити 0.1 mg/кг кокаїну. Ефективність зберігання їжі дозволяла стабілізуватися після операції (приблизно 4 – 6 днів) до початку сеансів самоконтролю кокаїну. Перед кожним експериментальним сеансом спинку тварини очищали за допомогою 95% Еталовий і бетадиновий скраб і калібрована ігла Huber Point Hugle (модель PG22-20) вставляли в порт, що веде до венозного катетера, підключаючи інфузійний насос, що містить розчин кокаїну, до катетера. Перед початком сеансу насос працював приблизно 125 s, заповнивши порт порцією кокаїну, яка була доступна під час експериментального сеансу. Сесії закінчилися після ін'єкцій 30; як за умов контролю, мавпи залишалися в затемненій камері приблизно 30 хв. Наприкінці кожного сеансу порт заповнювали гепаринізованим фізіологічним розчином (100) U/мл) для запобігання згортання крові.
Експериментальні сесії проводилися приблизно в один і той же час щодня і тривали протягом загальної кількості сеансів 100. Після завершення сеансів 100 було введено період абстиненції 30 або 90 днів, протягом якого катетери щодня промивали гепаринізованим фізіологічним розчином, але не проводилися сеанси самоприйняття кокаїну та їжі. Для контрольної групи у чотирьох тварин були встановлені періоди абстиненції 30 днів, а у двох інших - 90. Для групи кокаїну були встановлені періоди абстиненції 30 днів для восьми тварин та 90 днів для трьох тварин. Наприкінці періоду абстиненції було проведено один остаточний сеанс самоуправління (контроль за їжею або кокаїном), і відразу після сесії було розпочато процедуру 2-DG. У двох контрольних групах та чотирьох тваринах із самоконтролем кокаїну в групі стримувань, що тривалий день, не було отримано жодного кокаїну на останньому сеансі. Тварин гуманно вбивали при передозуванні пентобарбіталу (30 mg/кг, iv) наприкінці 45 хв.
Обробка тканин
Після вбивства мозок негайно видаляли, блокували та заморожували в ізопентані при −35 до −55 ° C, а потім зберігали при −80 ° C. Потім тканинні блоки, що містять смугу, розрізали в кріостаті при −20 ° C в корональній площині на 20 μм секцій, зібраних на електростатично заряджених слайдах, висушують під вакуумом протягом ночі при температурі 4 ° C, потім зберігають при температурі –80 ° C до обробки до авторадиографії. Мозкові зрізи збирали з частин хвостатого ядра, путамена та ядерних ядер, що лежать рострально до передньої коміссури. Цей регіон називають докомісійним стриатумом. Далі, ростральний та каудальний рівні домоміскулярного стриатуму були позначені з посиланням на ядра ядер. Ростральний докоммісуральний стриатум - це область, де ядро ядра не диференціюється на окремі оболонки та серцевини. Каудальний передкомісуральний стриатум - область, що збігається з появою оболонки та серцевини ядра яруса, яка є передньою до появи нюхового горбка. Для кожного з досліджень на зв'язування були взяті два сусідні зрізи на кожному з п’яти рівнів (два ростральних і три каудальних) через доміскулярний стриатум для загальної кількості зрізів 10 на тварину.
Прив'язка рецепторів D1
Щільність сайту зв'язування рецепторів DA D1 визначали з [3H]SCH 23390 (специфічна діяльність - 85 Ci/ммоль; PerkinElmer, Boston, MA) за кількісними показниками пробірці рецепторна авторадиография згідно з процедурами, адаптованими з Lidow та ін (1991) та Надер та ін (2002). Розділи попередньо інкубували для 20 хв в буфері (50 мМ Трис, 120 мМ NaCl, 5 mM KCl, 2 мМ CaCl2, 1 мМ MgCl2, pH 7.4, 25 ° C) для видалення ендогенного DA, кокаїну та [14C] від процедури 2-DG. Потім секції інкубували для 30 хв в тому ж буфері, рН 7.4, 25 ° C, що містить 1 mM аскорбінова кислота, 40 нМ кетансерин і 1 nM [3H]SCH 23390. Після інкубації ділянки двічі промивали 20 s в буфері, що містить 1 mM аскорбінової кислоти при рН 7.4, 4 ° C, потім опускають у дистильовану воду при 4 ° C і сушать під потоком прохолодного повітря. Неспецифічне зв'язування визначали шляхом інкубації сусідніх ділянок в інкубаційному розчині в присутності 5 μM (+) -бутакламол. Секції разом з каліброваними [3H] Авторадиографічні стандарти (Amersham, Piscataway, NJ) були призначені для фільму Kodak Biomax MR (Fisher Scientific, Pittsburgh, PA) протягом 6 тижнів.
Прив'язка рецепторів D2
Густину та розподіл сайтів зв'язування рецепторів DA D2 визначали за допомогою [3H]раклоприд (специфічна активність, 87 Ci/ммоль; PerkinElmer) відповідно до процедур, адаптованих від Lidow та ін (1991) та Надер та ін (2002). Розділи попередньо інкубували для 20 хв в буфері (50 мМ Трис, 120 мМ NaCl, 5 mM KCl, pH 7.4, 25 ° C) для видалення ендогенного DA, кокаїну та [14C] від процедури 2-DG. Слайди потім інкубували для 30 хв у тому ж буфері, що містить 5 mM аскорбінової кислоти та 2 nM [3H]раклоприд. Розрізи промивали 3 × 2 хв в буфері при рН 7.4, 4 ° C, потім опускають у дистильовану воду при 4 ° C і сушать під струменем прохолодного повітря. Неспецифічне зв'язування визначали шляхом інкубації сусідніх ділянок в інкубаційному розчині в присутності 1 μM (+) –Бутакламол. Секції разом з каліброваними [3H] Авторадиографічні стандарти були призначені для плівки Kodak Biomax MR протягом тижнів 8.
Зв'язування транспортера дофаміну
Щільність сайтів зв'язування DAT визначали за допомогою [3H]WIN 35,428 (специфічна активність, 87 Ci/ммоль; PerkinElmer) авторадиографія відповідно до процедур, адаптованих від Канфілд та ін (1990) та Лечворт та ін (2001). Зрізи тканин попередньо інкубували в буфері (50 мМ Трис, 100 mM NaCl, pH 7.4, 4 ° C) для 20 хв для видалення залишків DA, кокаїну та [14C] від процедури 2-DG. Потім секції інкубували для 2 год при 4 ° C у тому самому буфері, що містить 5 nM [3H]WIN 35 428. Розрізи промивали загалом 2 хв в буфері при температурі 4 ° C, потім опускають у дистильовану воду при 4 ° C і сушать під струменем холодного повітря. Неспецифічне зв'язування визначали шляхом інкубації сусідніх ділянок в інкубаційному розчині в присутності 30 μМ кокаїн. Секції разом з каліброваними [3H] Авторадиографічні стандарти були призначені для плівки Kodak Biomax MR протягом тижнів 6.
Денситометрія та аналіз даних
Фільми розробляли за допомогою розробника Kodak GBX, зупинки та швидкого фіксатора (VWR, West Chester, PA), а потім промивали. Аналіз авторадиограм проводили за допомогою кількісної денситометрії за допомогою комп'ютеризованої системи обробки зображень (MCID, Imaging Research; InterFocus Imaging Ltd, Кембридж, Великобританія). Значення оптичної щільності перетворювали на фмоль/мг (від мокрої маси тканини) за посиланням на відкалібровану [3H] стандарти. Специфічне зв'язування визначалося цифровим відніманням зображень неспецифічного зв'язування із накладених суміжних зображень загального зв’язування. Структури були ідентифіковані за допомогою фарбування Нісслом ділянок, прилеглих до тих, що аналізувались на зв'язування рецепторів. Дані кожного аналізу аналізували незалежно за допомогою однобічного аналізу дисперсії з подальшими відмінностями найменших квадратів Постфактум тести для численних порівнянь. Кожен регіон складався з окремого аналізу. Оскільки дані про зв'язування, отримані від контрольних тварин, які утримувались протягом 30 та 90 днів, не суттєво відрізнялися одна від одної, як у попередніх дослідженнях (Надер та ін, 2002), дані контрольних груп були об'єднані. Крім того, не було суттєвих відмінностей між даними тих тварин, які отримували кокаїн, та тими, які не були на їх остаточному сеансі, тому дані цих груп також були об'єднані.
РЕЗУЛЬТАТИ
Вплив утримання від хронічного самоконтролю кокаїну протягом днів 30
Концентрації [3H]Зв'язування SCH 23390 з рецепторами DA D1 в передкоммусуральній смузі показано в Таблиця 1. Специфічне зв'язування [3H]SCH 23390 припадає більше, ніж 90% загального зв’язування. Відповідно до попередніх звітів (Мур та ін, 1998a; Надер та ін, 2002), зв’язування [3H]Рецептори SCH 23390 до D1 у контрольних тварин, що не піддаються впливу лікарських препаратів, були неоднорідними із помітними відмінностями ступеня зв'язування серед субрегіонів стриатуму. Маркування було щільніше в більш ростральних і медіальних частинах по всій смузі.
Після 30-днів відмови від впливу кокаїну, зв'язування з D1-рецепторами характеризувалося широким підйомом по всьому рострально-каудальному ступеню докомісурального стриатуму, порівняно з щільністю зв'язування у контрольних тварин, що не зазнавали наркотиків (Таблиця 1; малюнок 1). У більш ростральному стриатумі концентрація була значно вищою в хвостовому ядрі, включаючи дорсолатеральне (+27%), центральний (+27%), дорсомедіальні (+27%) і вентромедіальні (+23%) порцій, а також у спинних (+17%), центральний (+22%) і вентральні (+23%) порції пупмен в порівнянні з щільністю у тварин, що не піддаються впливу лікарських засобів. Значні підвищення були помітні і в ядрах ярусів (+23%) на цьому рівні. На рівні смугастої тканини, де ядро і оболонка ядер ядер найбільш диференційовані, щільність D1-подібних рецепторів також була значно вищою в дорсолатералі (+31%), центральний (+29%), дорсомедіальні (+30%) і вентромедіальні (+18%) хвостатого ядра, а також спинного (+23%), центральний (+29%) і вентральні (+28%) раз, порівняно з щільністю контролів, що не піддаються впливу лікарських засобів. У межах вентральної смуги на цьому рівні концентрація D1 сайти зв'язування рецепторів були вищими в ядрі ядерного ядра (+45%) і оболонки (+20%), а також у нюховому горбку (+26%) порівняно з щільністю в контролі.
Малюнок 1.
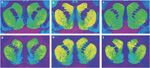 Представницькі авторадиограми [3H] Зв'язування SCH 23390 з D1-рецепторами (верхня панель) та [3H]WIN 35428 зв'язується з транспортерами дофаміну (нижня панель) у корональних зрізах стритума мавпи резус. (a, d) Контроль тварин, які реагують на посилення їжі. (b, e) тварина для самостійного введення кокаїну з дотриманням 30 днів. (c, f) тварина для самостійного введення кокаїну з дотриманням 90 днів.
Представницькі авторадиограми [3H] Зв'язування SCH 23390 з D1-рецепторами (верхня панель) та [3H]WIN 35428 зв'язується з транспортерами дофаміну (нижня панель) у корональних зрізах стритума мавпи резус. (a, d) Контроль тварин, які реагують на посилення їжі. (b, e) тварина для самостійного введення кокаїну з дотриманням 30 днів. (c, f) тварина для самостійного введення кокаїну з дотриманням 90 днів.
Концентрації [3H]зв'язування раклоприду з рецепторами DA D2 в домоміскулярному стриатумі показано в Таблиця 2. Специфічне зв'язування з [3H]Раклоприд становив більше, ніж 90% загального зв’язування. Розподіл [3H]Зв'язування раклоприду з D2 рецепторами також було неоднорідним у субрегіонах спинного та вентрального стриатуму, як у попередніх звітах (Мур та ін, 1998b; Надер та ін, 2002). У контрольних групах, що не піддаються впливу лікарських засобів, у дорсальному відділі були присутні більш високі концентрації сайтів зв'язування D2 порівняно з вентральною смугою. Крім того, були дані про середній та бічний градієнт із більш високою концентрацією сайтів зв'язування, присутніх у більш бічних ділянках смуги.
Після днів відмови від 30, рівні більшості зв'язування D2-рецепторів у тварин, підданих впливу кокаїну, та укріплених харчовими продуктами, не суттєво відрізнялися один від одного в більшості регіонів стриатуму. Більш високі концентрації місць зв’язування спостерігалися у вентральних путімен (+10%) і переднє ядро acumbens (+12%) в тканини від макак, що зазнали кокаїну, порівняно з контрольними. Інших суттєвих відмінностей не відмічено.
Концентрації [3H]WIN 35428, що зв'язується з DAT, у домоміскулярному стриатумі показані в Таблиця 3. Відповідно до попередніх звітів (Лечворт та ін, 2001) зв'язування з DAT-сайтами у тварин, що не піддаються впливу наркотиків, було вищим у дорсальному відношенні порівняно з вентральним стриатумом. У ядрах ядер спостерігали більш високі ущільнення в ядрі порівняно з відділами оболонки. Нарешті, неспецифічне зв'язування становило менше 10% від загальної кількості.
Після 30 днів утримання від впливу кокаїну зв'язування з ДАТ було значно вищим у більшості областей ростралу стриматуму до передньої комісації порівняно зі зв'язуванням у контрольних тварин, що не зазнавали наркотиків (малюнок 1). Зокрема, концентрації DAT-зв'язуючих ділянок на ростральних рівнях були значно вищими в центральних (+22%), дорсомедіальні (+25%) і вентромедіальні (+28%) хвостатого ядра, а в спинному (+16%) і центральний (+23%) путімен, порівняно з підсиленими харчовими продуктами контролю. Крім того, було також значно більш високе зв'язування з ДАТ в передньому ядрі ясельних (+37%) у кокаїні порівняно з мавпами, підсиленими харчовими продуктами. У більш каудальних ділянках домоміскулярного стриатуму щільність сайтів зв'язування ДАТ була значно вищою в центральному хвостовому ядрі (+21%), і putamen, центральний (+20%) і вентральний (+19%; малюнок 1). У межах вентрального стриатуму на цьому рівні зв'язування з ДАТ було значно вище в ядрі ядерного ядра (+20%) і нюховий горбок (+24%) в тканини кокаїну- vs харчові мавпи.
Вплив утримання від хронічного самоконтролю кокаїну протягом днів 90
На відміну від поширених відмінностей у щільності місць зв'язування рецепторів D1, виявлених у тварин, які зазнавали впливу кокаїну, після днів відмови від 30, після днів відмови від 90, не було суттєвих відмінностей порівняно з контрольованими харчовими продуктами контролями в будь-якій частині докомісару смугастий (Таблиця 1; малюнок 1). Аналогічно концентрації [3H]Зв'язування раклоприду з рецепторами DA D2 в домоміскулярному стриатумі після днів абстиненції 90 також не суттєво відрізнялося від таких у тварин, які не зазнали впливу лікарських засобів (Таблиця 2).
Концентрації [3H]Зв'язування WIN 35428 з DAT демонструвало аналогічну схему, яку спостерігали рецептори D1 та D2. Не було суттєвих відмінностей у щільності DAT між мавпами, що зазнали впливу кокаїну, після днів відмови від 90 порівняно з рівнями контролю, що не зазнавали впливу наркотиків (Таблиця 3; малюнок 1), хоча слід зазначити, що спостерігалася тенденція до більш високих рівнів зв'язування в передній ядрі ярубів.
ОБГОВОРЕННЯ
Попередні дослідження нашої групи показали, що хронічне опромінення кокаїном призначається суттєвою дисрегуляцією системи ДА нелюдських приматів (Лечворт та ін, 2001; Мур та ін, 1998a, 1998b; Надер та ін, 2002, 2006). Результати цього дослідження демонструють, що ця дисрегуляція залишається очевидною після припинення впливу кокаїну. Після днів відмови від 30 концентрації рецепторів DA D1 та DAT були значно підвищені протягом усього смуга мавп з історіями хронічного самовведення кокаїну порівняно з контрольованими харчовими продуктами. Однак, це дослідження також дає чіткі докази відновлення в системі DA після більш тривалих періодів абстиненції (90 днів), про що свідчить відсутність значних відмінностей між кокаїном та контрольованими тваринами на даний момент. Ці дані говорять про те, що вплив кокаїну може не спричинити постійних змін у системі ДА, але відновлення може відбутися при тривалому утриманні від вживання наркотиків.
Дерегуляція концентрацій ДАТ, показана тут після утримання, узгоджується з попередніми повідомленнями у приматів нелюдських (Лечворт та ін, 2001), що показало значне підвищення щільності сайтів зв'язування ДАТ як у вентральній, так і в дорсальній смузі. Незважаючи на те, що це не було чітко випробувано, виявляється, що після припинення впливу лікарських препаратів підвищення щільності ділянки зв'язування ДАТ є щонайменше настільки ж великим і більш розповсюдженим у регіонах смуги, ніж ті, про які повідомлялося без періоду відміни (Лечворт та ін, 2001). Аналогічно, підвищені концентрації сайтів зв'язування рецепторів D1, що спостерігаються тут після днів відмови від 30, також узгоджуються з попередніми дослідженнями, які показали підвищену щільність зв'язування D1-рецепторів у стриатумі нелюдських приматів, що піддаються ідентичному режиму самоконтролю кокаїну (Надер та ін, 2002). На відміну від цього, не спостерігалося суттєвих відмінностей між рівнями щільності зв'язування D2-рецепторів у смузі, що зазнавав впливу кокаїну та контрольних тварин. Цей недолік дисрегуляції був присутній, незважаючи на значне зниження концентрації D2-рецепторів, про які повідомлялося в обох наркоманів людини (Волков та ін, 1993) та тваринні моделі самоуправління кокаїном (Мур та ін, 1998a, 1998b; Надер та ін, 2002, 2006). Отже, теперішні дані пропонують більш швидку нормалізацію для контролю рівнів у цій системі порівняно з D1-подібними рецепторами та DAT. В сукупності зміни рецепторів DA та DAT чітко показують, що період, що негайно закінчується самоприйняттям кокаїну, є дуже нестабільним, що має значні зміни в регуляції системи DA, але що за цим супроводжується повторною регуляцією система, що наближається до більш нормального розподілу рецепторів DA та DAT після більш тривалого утримання.
Зміни рецептора D1
Поширені підвищення щільності D1 рецепторів, що спостерігаються тут після припинення вживання кокаїну, узгоджуються з повідомленнями, що демонструють підвищену чутливість D1 рецепторів під час відміни. Вимірювання чутливості до D1 було проведено у дослідженні Генрі і Уайт (1991), в яких було виявлено, що одиничні записи нейронів у ядрах ядер є більш чутливими до агоніста рецептора D1 SKF 38393 після хронічних щоденних ін'єкцій кокаїну порівняно з контролем, що лікується фізіологічним розчином. Цей ефект був стійким, оскільки підвищена чутливість залишалася очевидною до одного місяця після відміни. Автори припустили, що сенсибілізація рецепторів D1 обумовлена підвищеною чутливістю авторецепторів D2 у зоні соматодендриту A10, тим самим зменшуючи гальмівний потік імпульсу по всій системі DA-мезоакумуляторів (Генрі і Білий, 1991). Дані цього дослідження говорять про збільшення сайтів зв'язування рецепторів D1 в абстиненції, що може пояснити цю підвищену чутливість дофамінергічних нейронів до агоніста D1 рецептора прямого дії. Крім того, посилений вплив SKF 38393 на нейрони нейронів ядер не було очевидним через два місяці після відміни, що дозволяє припустити відновлення чутливості рецепторів D1 (Генрі і Білий, 1991); результат, відповідний відновленню щільності рецепторів D1, відміченому в цьому дослідженні після днів відмови від 90. Інші звіти також підтримують важливу роль D1-рецепторів у рецидиві. Пряма стимуляція D1-рецепторів в оболонці ядра ядер може відновити пошук кокаїну у стримуючих гризунів (Шмідт та ін, 2006). Однак література дещо суперечить тому, що як агоністи, так і антагоністи D1 можуть послаблювати пошук наркотиків, спричинених праймерами кокаїну або кокаїновими подразниками (Alleweireldt та ін, 2002; Де Фріз та ін, 1999; Хроян та ін, 2000; Self та ін, 1996; Білий та ін, 2001). Нещодавно Хроян та ін (2003) повідомили, що агоністи та антагоністи D1 зменшують рецидив у нелюдській моделі пошуку кокаїну. Ці автори припустили, що може існувати критичний діапазон активності рецепторів D1, необхідний для пошуку кокаїну, і що антагоністи та агоністи можуть перенести активність з цього вікна. Підвищені концентрації D1-рецепторів, які супроводжують утримання, можуть змінити цей діапазон, що призведе до зміни чутливості цієї системи. Інша думка полягає в тому, що активність D1 може діяти на модуляцію активності D2-рецепторів (Нолан та ін, 2007; Раскін та ін, 1999; Уолтерс та ін, 1987). Наведені дані говорять про те, що відношення D1 до D2-рецепторів зміщується в ході абстиненції і, таким чином, може змінювати ефективність цієї модуляції.
Хоча, на відміну від наявних даних, повідомлялося про зниження рівня D1-рецепторів після хронічного самоконтролю кокаїну (Мур та ін, 1998a) існують значні відмінності між цими дослідженнями, такими як доза та тривалість впливу кокаїну, загальне споживання та порівняльні контрольні групи. Таким чином, у сукупності зведені дані підтверджують, що система D1 знаходиться в значному потоці після виходу з хронічного введення кокаїну.
Зміни транспортера дофаміну
Виявлення підвищених концентрацій ДАТ у смугастих кокаїном тварин після припинення вживання наркотиків розширюють результати наших попередніх досліджень, показуючи підвищений рівень зв'язування ДАТ, які супроводжують самовведення кокаїну у нелюдських приматів. Наведені дані демонструють, що ця дисрегуляція зберігається протягом початкових фаз абстиненції. Крім того, вони припускають, що відновлення до контрольних рівнів проходить порівняно тривалий час (до цього дня, до 90 днів). У наших попередніх дослідженнях ми показали, що, хоча спочатку обмежувались значною мірою вентральними смугастими ділянками, зміни щільності сайтів зв'язування ДАТ розширювались і охоплювали більше спинних та ростральних ділянок стриатуму з більш тривалими періодами впливу кокаїну (Лечворт та ін, 2001; Порріно та ін, 2004). У цьому дослідженні повернення до контрольних рівнів концентрацій ДАТ під час абстиненції виявилося більшим та швидшим у дорзальному стриатумі, ніж у вентральному стриатумі, і, таким чином, здавалося, що йде зворотна анатомічна траєкторія до структури ефектів, спричинених хронічним впливом кокаїну .
Ці дані також узгоджуються з повідомленнями користувачів кокаїну (мало та ін, 1999; Мелісон та ін, 1998; Пюре та ін, 2002; Сталі та ін, 1994), які виявили підвищений рівень зв'язування з DAT-сайтами в смугаті порівняно з контролем, з найбільш вираженими збільшеннями, розташованими у вентральній смузі. Останнім часом показано, що ці піднесення супроводжуються значним зниженням зв'язування везикулярного транспорту транспорту 2 (VMAT2) везикулярного (мало та ін, 2003), що говорить про фактичну втрату нейронів DA. Автори дійшли висновку, що підвищення DAT, ймовірно, безпосередньо пов’язане з компенсаційною реакцією на фармакологічну блокаду кокаїном, тоді як зниження VMAT2 скоріше відображало загальні зміни метаболізму DA, що призводило до гіподопамінергічної функції.
Повідомлялося, що у наркоманів від кокаїну людини знижені концентрації DA у вентральному стриатумі, виміряні ПЕТ, у відповідь на виклик метилфенідата порівняно зі здоровими контролями (Волков та ін, 1997). Нещодавно Мартінес та ін (2007) повідомляли, що споживачі кокаїну були придушеними у відповідь на виклик амфетаміну у вентральному стриатумі та путімен. Крім того, це зменшення вивільнення DA, спричиненого амфетаміном, було пов'язане з вибором кокаїну на окремих сесіях самостійного введення, таким чином, що ті користувачі з найнижчим ступенем вивільнення DA у відповідь на амфетамін, швидше за все, обрали кокаїн над альтернативним підсилювачем (Мартінес та ін, 2007). Останні дослідження моделей використання кокаїну на гризунах також підтримують цю ідею. Mateo та ін (2005)Наприклад, повідомлялося, що вплив на хронічне самовведення кокаїну пов'язане із зміною функції ДАТ. Ці дослідники показали, що рівень поглинання ДА збільшується, що призводить до більш швидкого кліренсу синаптичного ДА, і, отже, зниження базового рівня позаклітинної ДА або гіподопамінергічного стану. Таким чином, цілком ймовірно, що підвищені концентрації ДАТ після відміни від хронічного самовведення кокаїну, що спостерігаються в цьому дослідженні, являють собою компенсаторну відповідь, що призводить до зниження базового рівня позаклітинного ДА.
Зміни рецептора D2
Одним з результатів цього дослідження було те, що концентрація D2-рецепторів повернулася до контрольних значень після днів відмови від 30 порівняно зі значним зниженням, яке спостерігалось у тварин без періоду відміни (Надер та ін, 2002). На відміну від цього дослідження, дослідження зображень на людях, як правило, встановили, що рівні рецепторів D2 нижчі, ніж у контрольних після тривалого утримання від хронічного впливу кокаїну (Мартінес та ін, 2004; Волков та ін, 1993). Потенційні пояснення відмінностей між цими дослідженнями на людях та теперішнім нелюдським дослідженням приматів включають відмінності в структурі та тривалості споживання кокаїну, а також можливість попереднього існування нижчих рівнів D2-рецепторів у наркоманів.
Відповідно до останньої ідеї, існують докази, що свідчать про те, що нижчий базальний рівень D2-рецепторів у здорових людей передбачає підвищення посилюючої ефективності стимуляторів, таких як метилфенідатіВолков та ін, 1999) і аналогічно у мавп базовий рівень D2-рецепторів передбачав схильність до самостійного введення кокаїну (Morgan та ін, 2002; Надер та ін, 2006). Відповідно до паралельного характеру цих знахідок у різних видів, як у людини (Волков та ін, 1993) і нелюдський примат (Надер та ін, 2006) візуальні дослідження продемонстрували нижчий рівень доступності D2-рецепторів після утримання від кокаїну. Зокрема, графік самовведення кокаїну в останньому експерименті (Надер та ін, 2006) був подібний до графіка підкріплення, використаного в цьому дослідженні. Таким чином, різні результати цих двох досліджень навряд чи були обумовлені методологічними відмінностями, такими як графік посилення або кумулятивного споживання під час самостійного введення кокаїну.
Більш вірогідне пояснення передбачає функціональну динаміку системи DA. Міри наявності рецепторів D2 з ПЕТ були описані як "функціональні", оскільки сигнал пов'язаний з кількістю білка (в даному випадку щільністю D2-рецепторів) та рівнем циркулюючого нейротрансміттера (Див. Laruelle, 2000; Nader і Czoty, 2008 для подальшого обговорення). Яn навпаки, рецепторна авторадиография незабруднена циркулюючими рівнями DA. Таким чином, дане дослідження, поряд з нашою попередньою роботою, дозволяє припустити, що щільність рецепторів D2 зменшується при самостійному застосуванні кокаїну, але, здається, рівень рецепторів відновлюється під час утримання. У аналогічно проведеному ПЕТ-дослідженні (Надер та ін, 2006) одужання відмічено у трьох з п’яти мавп. Наведені результати свідчать про те, що ці мавпи, ймовірно, не відрізнялися за щільністю рецепторів D2, але, можливо, чутливість системи DA (тобто рівні циркулюючої DA під час абстиненції) диференціювалась між «видуженими» та «невідкритими» суб'єктами.
Недоліки
Одним з важливих обмежень сучасних досліджень є те, що наші дослідження не можуть вирішити функціональність D1 і D2 рецепторів або DAT. Швидше ми вивчали лише зміни щільності рецепторних білків. Хоча результати мають наслідки для потенційної ролі цих систем, необхідно буде подати подальші дослідження, щоб пролити світло на поведінкові наслідки змін, показаних тут. Ще одне обмеження цього дослідження полягає в тому, що авторадиографические ліганди часто не в змозі дисоціювати між внутрішньоклітинними та цитоплазматичними місцями їх мішеней, оскільки радіоактивно мічені антагоністи часто проникні мембраною. мало та ін (2002) продемонстрували, що хронічне опромінення кокаїном призводить до значної регуляції ДАТ на поверхні мембрани, одночасно зі зниженням внутрішньоклітинної концентрації ДАТ у трансфікованих клітинах. Останнім часом Самувел та ін (2008) повідомили про подібну знахідку у синаптосомальних препаратів смугастої смуги. Ці результати говорять про те, що зміни в розподілі ДАТ, що спостерігаються в цьому дослідженні, можуть представляти зміни на поверхні мембрани, а не внутрішньоклітинних ділянок.
Нарешті, слід дотримуватися певної обережності інтерпретації досліджень тривалого (90 днів) абстиненції, оскільки ці результати базувалися на порівняно невеликій групі тварин (N=3). Незважаючи на малу кількість випробуваних, дані, отримані з цієї групи, були досить послідовними, як це можна побачити на графіку розкидання, показаному в малюнок 2. Концентрація сайтів зв'язування D1-рецепторів по всій смузі показувала невелику мінливість у межах груп, що дозволяє припустити достовірність цих результатів. Аналогічна консистенція була також очевидна в даних аналізу D2-рецепторів та зв'язування DAT. Хоча слід дотримуватися обережності, ці дані наполегливо говорять про те, що відновлення концентрацій DAT і DA-рецепторів в межах стриатуму може відбуватися при тривалому утриманні.
Малюнок 2.
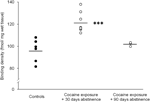 Щільність зв'язування D1-рецепторів для окремих тварин в середньому по всьому стриатуму проводилася після посилення харчових продуктів (контролю), або відмови від 30 або 90-днів від хронічного самовведення кокаїну. Засоби для груп зображуються чорними смугами, ***p<0.001 порівняно з контрольованими харчовими продуктами.
Щільність зв'язування D1-рецепторів для окремих тварин в середньому по всьому стриатуму проводилася після посилення харчових продуктів (контролю), або відмови від 30 або 90-днів від хронічного самовведення кокаїну. Засоби для груп зображуються чорними смугами, ***p<0.001 порівняно з контрольованими харчовими продуктами.
ВИСНОВКИ
На закінчення, вплив самоконтролю кокаїну призвело до значних змін у регуляції систем ДА, які зберігалися на ранніх фазах (перші 30 дні) абстиненції. Це було найбільш очевидним у регуляції концентрації D1-рецепторів та DAT, як за величиною змін, так і за їх топографічним ступенем. На відміну від цього, існували докази нормалізації з тривалістю тривалості утримання від впливу кокаїну, оскільки концентрації DAT, D1 та D2 рецепторів після днів відмови від 90 не відрізнялися від концентрацій, які не піддавалися впливу наркотиків. TОднак системи геза не обов'язково дотримуються того ж часового курсу відновлення, що дозволяє припустити, що існує певна нестабільність у регуляції рівнів DA, особливо на початку абстиненції. Ця дофамінергічна дисрегуляція може вплинути на ефективність будь-якої потенційної фармакотерапії, яка застосовується утримуючим наркоманів від кокаїну, особливо якщо за механізмом дії медикаменту покладається на систему ДА.
примітки
Розкриття інформації/КОНФЛІКТ ІНТЕРЕСІВ
Автори не можуть розкривати конфлікт інтересів.
посилання
- Alleweireldt AT, Weber SM, Kirschner KF, Bullock BL, Neisewander JL (2002). Блокада або стимуляція рецепторів дофаміну D1 послаблює відновлення згаслої поведінки, що шукає кокаїн, у щурів. Психофармакологія (Берл) 159: 284–293. | Стаття | PubMed | ChemPort |
- Beveridge TJ, Smith HR, Daunais JB, Nader MA, Porrino LJ (2006). Хронічне самовведення кокаїну пов'язане зі зміненою функціональною активністю у скроневих долях приматів, що не належать людині. Eur J Neurosci 23: 3109–3118. | Стаття | PubMed |
- Canfield DR, Spealman RD, Kaufman MJ, Madras BK (1990). Авторадиографічна локалізація сайтів зв’язування кокаїну за допомогою [3H] CFT ([3H] WIN 35428) у мозку мавпи. Синапс 6: 189–195. | Стаття | PubMed | ChemPort |
- De Vries TJ, Schoffelmeer AN, Binnekade R, Vanderschuren LJ (1999). Дофамінергічні механізми, що опосередковують стимул до пошуку кокаїну та героїну після тривалого відміни IV самостійного введення наркотиків. Психофармакологія (Берл) 143: 254–260. | Стаття | PubMed | ChemPort |
- Farfel GM, Kleven MS, Woolverton WL, Seiden LS, Perry BD (1992). Вплив повторних ін'єкцій кокаїну на сайти зв'язування катехоламінових рецепторів, сайти зв'язування транспортера дофаміну та поведінка у мавпи резус. Brain Res 578: 235–243. | Стаття | PubMed | ChemPort |
- Грехем J, Порріно LJ (1995). Нейроанатомічні субстрати самоконтролю кокаїну. CRC: Boca Raton, FL.
- Hemby SE, Co C, Koves TR, Smith JE, Dworkin SI (1997). Відмінність концентрацій позаклітинного дофаміну в ядрі збільшується під час введення щура, залежного від відповіді та незалежного від відповіді. Психофармакологія (Берл) 133: 7–16. | Стаття | PubMed | ChemPort |
- Генрі DJ, White FJ (1991). Повторне введення кокаїну викликає стійке посилення чутливості рецепторів дофаміну D1 в ядрах щурів. J Pharmacol Exp Ther 258: 882–890. | PubMed | ChemPort |
- Jacobsen LK, Staley JK, Malison RT, Zoghbi SS, Seibyl JP, Kosten TR та ін (2000). Підвищена доступність зв'язування центрального транспортера серотоніну у гостро абстиненційних кокаїнових пацієнтів. Am J Psychiatry 157: 1134–1140. | Стаття | PubMed | ISI | ChemPort |
- Khroyan TV, Barrett-Larimore RL, Rowlett JK, Spealman RD (2000). Дофамінові D1- та D2-подібні рецепторні механізми в рецидиві поведінки, що шукає кокаїн: ефекти селективних антагоністів та агоністів. J Pharmacol Exp Ther 294: 680–687. | PubMed | ISI | ChemPort |
- Khroyan TV, Platt DM, Rowlett JK, Spealman RD (2003). Зменшення рецидиву до пошуку кокаїну агоністами та антагоністами рецепторів дофаміну D1 у приматів, що не належать людині. Психофармакологія (Берл) 168: 124–131. | Стаття | PubMed | ChemPort |
- Ларуель М (2000). Зображення синаптичної нейротрансмісії с в природних умовах прив'язні методи змагань: критичний огляд. J Метабр крові Cereb 20: 423–451. | Стаття | PubMed | ISI | ChemPort |
- Letchworth SR, Nader MA, Smith HR, Friedman DP, Porrino LJ (2001). Прогресування змін щільності ділянки зв'язування транспортера дофаміну внаслідок самовведення кокаїну у мавп резус. J Neurosci 21: 2799–2807. | PubMed | ISI | ChemPort |
- Lidow MS, Goldman-Rakic PS, Gallager DW, Rakic P (1991). Розподіл дофамінергічних рецепторів у корі головного мозку приматів: кількісний авторадіографічний аналіз з використанням [3H] раклоприду, [3H] спіперону та [3H] SCH 23390. Неврологія 40: 657–671. | Стаття | PubMed | ChemPort |
- Little KY, Elmer LW, Zhong H, Scheys JO, Zhang L (2002). Кокаїнова індукція транспорту транспортера дофаміну до плазматичної мембрани. Mol Pharmacol 61: 436–445. | Стаття | PubMed | ISI | ChemPort |
- Little KY, Krolewski DM, Zhang L, Cassin BJ (2003). Втрата смугастого везикулярного білка-транспортера моноаміну (VMAT2) у споживачів кокаїну людини. Am J Psychiatry 160: 47–55. | Стаття | PubMed |
- Little KY, Zhang L, Desmond T, Frey KA, Dalack GW, Cassin BJ (1999). Стрияльні дофамінергічні порушення у споживачів кокаїну людини. Am J Psychiatry 156: 238–245. | PubMed | ChemPort |
- Malison RT, Best SE, van Dyck CH, McCance EF, Wallace EA, Laruelle M та ін (1998). Підвищені смугасті транспортери дофаміну під час гострого абстиненції кокаїну, виміряні [123I] beta-CIT SPECT. Am J Psychiatry 155: 832–834. | PubMed | ChemPort |
- Martinez D, Broft A, Foltin RW, Slifstein M, Hwang DR, Huang Y та ін (2004). Кокаїнова залежність та наявність рецепторів d2 у функціональних підрозділах стриатуму: взаємозв'язок із поведінкою, що шукає кокаїн. Нейропсіхофармакологіі 29: 1190–1202. | Стаття | PubMed | ISI | ChemPort |
- Martinez D, Narendran R, Foltin RW, Slifstein M, Hwang DR, Broft A та ін (2007). Вивільнення дофаміну, спричинене амфетаміном: помітно притуплене в залежності від кокаїну та прогнозує вибір самостійного введення кокаїну. Am J Psychiatry 164: 622–629. | Стаття | PubMed | ISI |
- Mash DC, Pablo J, Ouyang Q, Hearn WL, Izenwasser S (2002). У споживачів кокаїну транспортна функція підвищена. J Neurochem 81: 292–300. | Стаття | PubMed | ChemPort |
- Mateo Y, відсутність CM, Morgan D, Roberts DC, Jones SR (2005). Зниження термінальної функції дофаміну та нечутливість до кокаїну після самостійного введення та позбавлення від кокаїну. Нейропсіхофармакологіі 30: 1455–1463. | Стаття | PubMed | ISI | ChemPort |
- Melega WP, Jorgensen MJ, Lacan G, Way BM, Pham J, Morton G та ін (2008). Довготривале введення метамфетаміну в мавпу Vervet моделює аспекти впливу людини: нейротоксичність мозку та поведінковий профіль. Нейропсіхофармакологіі 33: 1441–1452. | Стаття | PubMed | ChemPort |
- Moore RJ, Vinsant SL, Nader MA, Porrino LJ, Friedman DP (1998a). Вплив кокаїнового введення на стрифатні дофамінові рецептори D1 у мавп-резусів. Синапс 28: 1–9. | Стаття | PubMed | ChemPort |
- Moore RJ, Vinsant SL, Nader MA, Porrino LJ, Friedman DP (1998b). Вплив самовведення кокаїну на дофамінові D2 рецептори у резус-мавп. Синапс 30: 88–96. | Стаття | PubMed | ChemPort |
- Morgan D, Grant KA, Gage HD, Mach RH, Kaplan JR, Prioleau O та ін (2002). Соціальне домінування у мавп: дофамінові D2 рецептори та кокаїнове самовведення. Nat Neurosci 5: 169–174. | Стаття | PubMed | ISI | ChemPort |
- Nader MA, Czoty PW (2008). Зображення мозку у нелюдських приматів: розуміння наркоманії. ІЛАР J 49: 89–102. | PubMed | ChemPort |
- Nader MA, Daunais JB, Moore T, Nader SH, Moore RJ, Smith HR та ін (2002). Вплив кокаїнового введення на стриатальні дофамінові системи у мавп-резусів: початкове та хронічне опромінення. Нейропсіхофармакологіі 27: 35–46. | Стаття | PubMed | ISI | ChemPort |
- Nader MA, Morgan D, Gage HD, Nader SH, Calhoun TL, Buchheimer N та ін (2006). ПЕТ-візуалізація рецепторів дофаміну D2 під час хронічного самостійного введення кокаїну у мавп. Nat Neurosci 9: 1050–1056. | Стаття | PubMed | ChemPort |
- Нолан Е.Б., Гаррісон Л.М., Лахосте Дж. Дж., Раскін Д.Н. (2007). Поведінковий синергізм між D (1) та D (2) дофаміновими рецепторами у мишей не залежить від розривів. Синапс 61: 279–287. | Стаття | PubMed | ChemPort |
- Porrino LJ, Lyons D, Miller MD, Smith HR, Friedman DP, Daunais JB та ін (2002). Метаболічне відображення ефектів кокаїну під час початкових фаз самостійного введення у примату нелюди. J Neurosci 22: 7687–7694. | PubMed | ChemPort |
- Porrino LJ, Lyons D, Smith HR, Daunais JB, Nader MA (2004). Самоконтроль кокаїну виробляє прогресивне залучення лімбічних, асоціаційних та сенсомоторних смугастих доменів. J Neurosci 24: 3554–3562. | Стаття | PubMed | ISI | ChemPort |
- Раскін Д.Н., Бергстром Д.А., Уолтерс Дж. Р. (1999). Багатосекундні коливання швидкості стрільби в блідості глобуса: синергетична модуляція рецепторами дофаміну D1 та D2. J Pharmacol Exp Ther 290: 1493–1501. | PubMed | ISI | ChemPort |
- Samuvel DJ, Jayanthi LD, Manohar S, Kaliyaperumal K, див. RE, Ramamoorthy S (2008). Дисрегуляція торгівлі та функціонування транспортерів дофаміну після утримання від самоконтролю кокаїну у щурів: свідчення диференціальної регуляції в хвостатих хворобах та ядрах. J Pharmacol Exp Ther 325: 293–301. | Стаття | PubMed | ChemPort |
- Schmidt HD, Anderson SM, Pierce RC (2006). Стимуляція D1-подібних або D2-рецепторів допаміну в оболонці, а не в основі, ядра ядра відновлює поведінку, яка шукає кокаїн у щура. Eur J Neurosci 23: 219–228. | Стаття | PubMed |
- Self DW, Barnhart WJ, Lehman DA, Nestler EJ (1996). Протилежна модуляція поведінки, що шукає кокаїн, агоністами дофамінових рецепторів D1 та D2. наука 271: 1586–1589. | Стаття | PubMed | ISI | ChemPort |
- Staley JK, Hearn WL, Ruttenber AJ, Wetli CV, Mash DC (1994). Місця розпізнавання кокаїну з високим спорідненням у транспортері дофаміну підвищені у фатальних жертв передозування кокаїну. J Pharmacol Exp Ther 271: 1678–1685. | PubMed | ChemPort |
- Волков Н.Д., Фаулер Ю.С., Ван Г.Я., Хитземанн Р., Логан Дж. та ін (1993). Зниження доступності рецепторів дофаміну D2 пов'язане зі зниженим фронтальним метаболізмом у зловживаючих кокаїном. Синапс 14: 169–177. | Стаття | PubMed | ISI | ChemPort |
- Volkow ND, Wang GJ, Fowler JS, Logan J, Gatley SJ, Gifford A та ін (1999). Прогнозування посилення реакцій на психостимулятори у людини за рівнем рецепторів дофаміну D2 в мозку. Am J Psychiatry 156: 1440–1443. | PubMed | ISI | ChemPort |
- Волков Н.Д., Ван Г.Я., Фаулер Ю.С., Логан Дж. та ін (1997). Зниження стриатальної дофамінергічної чутливості у детоксифікованих кокаїнозалежних суб'єктів. природа 386: 830–833. | Стаття | PubMed | ISI | ChemPort |
- Walters JR, Bergstrom DA, Carlson JH, Chase TN, Braun AR (1987). Активація рецепторів дофаміну D1 необхідна для постсинаптичної експресії ефектів агоніста D2. наука 236: 719–722. | Стаття | PubMed | ChemPort |
- Weiss F, Martin-Fardon R, Ciccocioppo R, Kerr TM, Smith DL, Ben-Shahar O (2001). Незмінна стійкість до вимирання кокаїну, спричинене поведінкою, пов'язаною з наркотиками. Нейропсіхофармакологіі 25: 361–372. | Стаття | PubMed | ISI | ChemPort |
- Wong DF, Kuwabara H, Schretlen DJ, Bonson KR, Zhou Y, Nandi A та ін (2006). Підвищена зайнятість дофамінових рецепторів у стриатумі людини під час випробовування кокаїну. Нейропсіхофармакологіі 31: 2716–2727. | Стаття | PubMed | ChemPort |
![Таблиця 1 - Ефект днів 30 або 90 днів утримання після хронічного самоконтролю кокаїну на щільності [lsqb] 3H [rsqb] SCH 23390 Прив’язка до D1 рецепторів у докомісійному стриату мавп резуса - на жаль, ми не в змозі надати доступний альтернативний текст це. Якщо вам потрібна допомога, щоб отримати доступ до цього зображення, зв'яжіться з help@nature.com або автором](https://yourbrainonporn.com/wp-content/uploads/2020/01/table_thumb.gif)