КОМЕНТАРИ: Відмінний огляд майже всіх відповідних досліджень щодо андрогенних рецепторів, дофаміну та статевої функції. Фантастичне малювання взаємозв'язків між гіпоталамусом і винагородою.
Хорм Бехав. 2008 травень; 53(5): 647-658.
Опубліковано в мережі 2008 лютого 13. doi: 10.1016 / j.yhbeh.2008.01.010
абстрактний
Підлітковий вік пов'язаний із збільшенням поведінки, яка шукає задоволення, яка, у свою чергу, формується пубертальною активацією осі гіпоталамо-гіпофіза-гонади. У тваринних моделях поведінки, природно корисної, такі як секс, андрогени яєчок сприяють розвитку та вираженню поведінки у чоловіків. Для здійснення поведінкового дозрівання мозок зазнає значного ремоделювання в підлітковому віці, і багато змін також чутливі до андрогенів, імовірно, діючи через андрогенні рецептори (АР). Враховуючи делікатну взаємодію гормональних залоз та розвиток мозку, не дивно, що порушення рівня гормонів у цей чутливий період суттєво змінює поведінку підлітків та дорослих. У хом'яків-чоловіків вплив тестостерону в підлітковому віці потрібно для нормального вираження сексуальної поведінки дорослих. У чоловіків, позбавлених андрогенів під час статевого дозрівання, спостерігається стійкий дефіцит спаровування. І навпаки, самих андрогенів недостатньо для того, щоб викликати спаровування у препубертатних самців, навіть незважаючи на те, що АР мозку є перед пубертатом. У цьому контексті широке використання анаболо-андрогенних стероїдів (ААС) у підлітковому віці викликає серйозне занепокоєння. Зловживання ААС може змінити як терміни, так і рівні андрогенів у підлітків. У хом’яків підлітковий вплив на ААС збільшує агресію і викликає тривалі зміни в нейротрансмітерних системах. Крім того, AAS самі по собі підсилюють, що демонструє самоприйом тестостерону та інших AAS. Однак останні дані свідчать про те, що для посилення дії андрогенів може не знадобитися класичний АР. Тому для кращого розуміння зловживання ААС необхідне подальше вивчення взаємодії між андрогенами та корисна поведінка в мозку підлітка.
огляд
Підлітковий вік пробуджує мозок як до задоволення, так і до ризику. У людських підлітків це часто має форму експериментів з наркотиками та сексом. У США середній вік для першого статевого акту у чоловіків становить 16.4 років, а 65% мали статевий акт за 12-м класом (Фонд сім'ї Кайзера, 2005). Так само це населення має найвищі показники вживання незаконних наркотиків у США. Згідно з даними Національного опитування 2004 щодо вживання наркотиків та здоров'я, у минулому році 38% чоловіків у віці 18 – 25 вживали незаконний наркотик (SAMHSA / OAS, 2005). Більше того, 31% хлопчиків-підлітків вживали наркотики чи алкоголь під час останньої сексуальної зустрічі (Фонд сім'ї Кайзера, 2005). Крім того, підлітковий вік є ключовим моментом в етіології деяких психопатологій, таких як депресія, тривожність, невпорядковане харчування та розлад поведінки. Ми вважаємо, що пубертальна секреція гормонів гонад, їх активація стероїдних рецепторів у мозку та взаємодія між гормоном та досвідом щодо розвитку мозку підлітків сприяють змінам поведінки, які спостерігаються в підлітковому віці.
Наша мета тут - переглянути докази того, що андрогени гонади опосередковують дозрівання підлітків та ефективність мотивованої поведінки дорослих, а також корисні властивості цих форм поведінки. Ми також представляємо докази того, що сам тестостерон приносить користь, що, ймовірно, сприяє зрілим змінам мотивованої поведінки в підлітковому віці, коли рівень тестостерону парить. Основна увага в цій роботі приділяється нашим дослідженням нейронних схем, що лежать в основі сексуальної поведінки чоловіків, особливо у сирійських хом'яків, з особливим акцентом на взаємодію між тестостероном та дофаміном (DA). Ми пропонуємо, що пубертальні андрогени мають як перехідний, так і тривалий вплив на схеми нагород та мотивовану поведінку. Далі ми гіпотезуємо, що доповнення екзогенними андрогенами у формі анаболо-андрогенних стероїдів (AAS) посилює нормальний вплив пубертальних андрогенів, тим самим негативно впливаючи на розвиток мозку та поведінки підлітків.
Підлітковий вік як чутливий період для розвитку мозку
Зрештою, мозок є і пусковим механізмом, і мішенню дії андрогенів у підлітковому віці. У молодих хлопчиків (<12 років) та молодих хом'яків (віком <28 днів) циркулюючі андрогени та гонадотропіни знаходяться на базальному рівні. Оскільки секреція лютеїнізуючого гормону з передньої частини гіпофіза підвищується у відповідь на гіпоталамічний гонадотропін-рилізинг гормон, концентрація тестостерону в циркуляції значно зростає. Це відбувається до II / III стадії Таннера (14 років) у хлопчиків та до 28-денного віку у хом'яків. До того часу, коли хлопчики досягають IV / V стадії Таннера (приблизно 16 років) або коли хом'яки досягли 50–60-денного віку, ендогенний тестостерон знаходиться в межах дорослих чоловіків. Секреція пубертатного гормону збігається з періодом підліткового віку, який протікає приблизно у людей від 12 до 20 років. Пубертатні гормони діють не тільки на периферичні тканини, викликаючи появу вторинних статевих ознак, що є явними ознаками статевого дозрівання, але вони також діють централізовано, впливаючи як на перебудову мозку підлітка, так і на дозрівання поведінки. Крім того, фізіологічні та неврологічні зміни, викликані пубертатними гормонами, призводять до значних змін у досвіді людини, які самі по собі можуть глибоко змінити хід розвитку мозку. Таким чином, пубертатне збільшення статевих стероїдних гормонів, зумовлене термінами дозрівання репродуктивної нейроендокринної осі, у свою чергу формує поведінковий розвиток підлітка за допомогою як прямого, так і непрямого впливу на нервову систему.
Підлітковий вік людини зараз визнаний головним і динамічним періодом нейронного розвитку, протягом якого поведінкові схеми переробляються та вдосконалюються. Хоча мозок 5-річної дитини вже становить 90% від свого дорослого розміру (Декабан, 1978), значне реконструкція ще попереду. Ця концепція була розгорнута дослідженнями як людей, так і тварин, що засвідчили, що багато основних процесів розвитку, що відбуваються під час перинатального розвитку мозку, рекапітулюються в підлітковому віці. Ці процеси включають нейрогенез (Екенхофф і Ракич, 1988; Він і екіпажі, 2007; Пінос, Колладо, Родрігес-Зафра, Родрігес, Сеговія та Гійом, 2001; Ранкін, Партлоу, МакКерді, Джайлз і Фішер, 2003), запрограмована загибель клітин (Нуньєс, Лошке та Юраска, 2001; Нуньєс, Соді та Юраска, 2002), розробка та обрізка дендритних арборізацій та синапсів (Андерсен, Рутштейн, Бензо, Хостетер та Тейчер, 1997; Huttenlocher і Dabholkar, 1997; Lenroot і Giedd, 2006; Соуелл, Томпсон, Леонард, Ласкаво просимо, Кан та Тога, 2004) мієлінізація (Бенес, Черепаха, Хан і Фарол, 1994; Паус, Коллінз, Еванс, Леонард, Пайк і Зідденбос, 2001; Соуелл, Томпсон, Тесснер та Тога, 2001) та статевої диференціації (Chung, De Vries і Swaab, 2002; Девіс, Шріне та Горський, 1996; Nunez et al., 2001). Таким чином, траєкторія розвитку постнатального мозку не є лінійною, а натомість характеризується підлітковим сплеском швидких змін і передбачає як прогресуючі, так і регресивні події. Як відомо будь-якому біологу розвитку, періоди швидких змін розвитку сигналізують про підвищену чутливість і вразливість як до змін, що залежать від досвіду, так і до несприятливих наслідків збурень і образи, і немає підстав думати, що розвиток мозку людини підлітка є будь-яким винятком (Андерсен, 2003; Спис, 2000). Таким чином, передбачається, що збурення в часі впливу пубертального гормону на мозок підлітка можуть мати тривалі наслідки для поведінки дорослих.
Андрогени та нейронні кола для мотивованої поведінки
Оскільки підлітковий вік є перехідною та динамічною фазою розвитку, важко буде оцінити мозок та поведінку підлітка ізольовано. Натомість, щоб оцінити унікальний характер підліткового віку, корисно порівняти його з мозком та поведінкою дорослих дорослих. Таким чином, з акцентом цієї статті на сексуальну поведінку чоловіка та винагороду тут важливо запровадити нейронні ланцюги для копуляції та сексуальної мотивації у дорослих чоловіків, включаючи роль гонадальних стероїдних гормонів у поведінковій активації та розподілі рецепторів для андрогенів (AR) та естрогени (ER).
АР присутні в групах клітин, які утворюють нейронні ланцюги, опосередковуючи нагородження соціальної поведінки, наприклад, сексу. Крім того, АР головного мозку виражається до статевого дозрівання у хом'яків і антророгенами регулюється як у неповнолітніх, так і у дорослих чоловіків (Kashon, Hayes, Shek і Sisk, 1995; Meek, Romeo, Novak і Sisk, 1997). У мозку гризунів спостерігається значне перекриття розподілу АР та ЕР (Вуд і Ньюмен, 1995) і ароматаза (Селотті, Негрі-Чесі та Полетті, 1997), включаючи як α, так і β форми рецептора естрогену (Shughrue, Lane та Merchenthaler, 1997). Після зв'язування з лігандом «класичні» AR та ER функціонують як фактори транскрипції для індукції транскрипції та синтезу нових білків. Не дивно, що ці ефекти слідують порівняно повільним часовим ходом із запізненням настання дії. Стероїдна стимуляція сексуальної поведінки хом'яків (Шляхта та Альсум, 1975) узгоджується з діями через класичні геномні дії. Наприклад, для відновлення спаровування у довготривалих кастратах потрібно 2 тиждень впливу стероїдів. Більш недавні дослідження на щурах також продемонстрували швидку клітинну дію андрогенів у ділянках мозку, у яких мало класичних рецепторів (Мермельштайн, Беккер та Сурмеєр, 1996). Вважається, що ці стероїдні дії опосередковуються негеномними рецепторами. Враховуючи, що поширення класичного АР та ЕР в мозку хом'яка порівняно обмежене (Вуд і Суонн, 1999), потенційні цілі мозку для негеномних андрогенних дій значно ширші.
Медіальна преоптична зона (MPOA) відіграє центральну роль у копуляції у самців від золотих рибок до людини (розглянуто в Халл, Вуд та Маккенна, 2006). Більше того, MPOA хом'яка перетворює стероїдні гормони гонад через рясні AR та ER, а тестостеронові імплантати в MPOA є достатніми для відновлення сексуальної активності у довгострокових кастратах (Вуд і Суонн, 1999). У самців щурів гонадні стероїди діють в МПОА для регулювання вивільнення базального DA (Путнам, Сато і Халл, 2003) і стимулюють спаровування (Халл, Дю, Лотарингія та Матушевич, 1995). Спочатку спостерігається незначне збільшення рівня DA, коли самка представлена за екраном. Під час копуляції MPOA DA збільшується ще більше (+ 50% від базової лінії), і для цього ефекту потрібні андрогени (Hull et al., 1995; Putnam та ін., 2003). Не дивно, що у кастрованих самців, які не спаровуються, MPOA DA не збільшується (Hull et al., 1995). Інтерпретувати цей результат дещо складно, оскільки відсутність вивільнення ДА бентежить відсутністю сексуальної активності. Однак вивільнення DA в MPOA корелює зі втратою спаровування на короткочасних кастратах (Hull et al., 1995) та відновленням тестостерону відновлення сексуальної активності у довгострокових кастратах (Ду, Лотарингія і Халл, 1998; Putnam, Du, Sato і Hull, 2001).
У межах МРОА гризунів андрогенні та естрогенні метаболіти тестостерону відіграють особливу роль у регуляції спаровування (Putnam та ін., 2003; Путнам, Сато, Ріоло та Халл, 2005). Затримка ініціювання копуляції (горіння чи інтроміт) є одним із показників сексуальної мотивації. Затримка статевої активності чутлива до естрогенів завдяки підтримці синтази оксиду азоту MPOA, яка, в свою чергу, підтримує базальний рівень DA. Кастрати, оброблені естрогеном, мають високий базальний рівень DA, що сильно корелює зі здатністю ініціювати копуляцію. Однак вони не демонструють збільшення вивільнення DA, спричиненого жінками та копуляцією, що сильно корелює із сексуальною працездатністю. Отже, їх сексуальна ефективність є нижчою за неушкоджений рівень. З іншого боку, кастрати, оброблені самим неароматизуючим андрогеном, не демонструють підвищеного рівня базального ДА, і вони не можуть ініціювати копуляцію. Тому для нормальної сексуальної працездатності необхідні і естрогени, і андрогени. Сексуальна працездатність, як правило, виражається як частота вимірювань горішок, інтромісій та еякуляцій. Тільки коли замінюються і естрогени, і андрогени, у кастрованих самців спостерігається підвищений рівень DA (і скорочення затримки) та підвищення DA (спричинене жіночою та копуляційною здатністю) (і збільшення частоти заходів). Таким чином, естрогени в MPOA сприяють сексуальній мотивації, а естрогени та андрогени - до сексуальної ефективності.
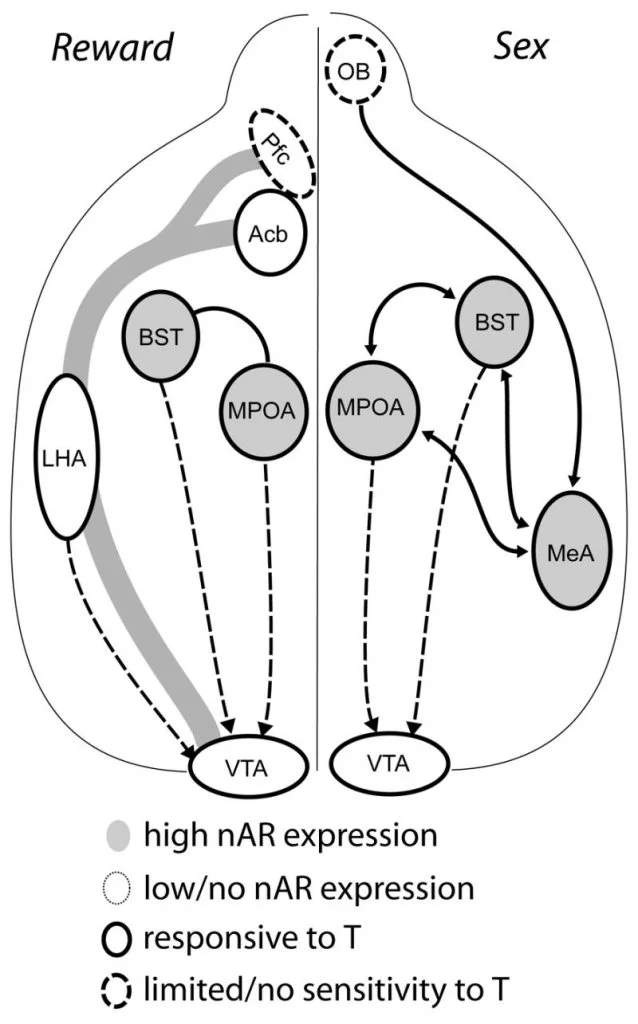
Хоча тестостерон необхідний для вивільнення MPOA DA під час поведінки чоловічої копуляції та для самої спаровування, ні тестостерон, ні одне спарювання не можуть викликати DA в MPOA. Натомість, для вивільнення ДА в МПО необхідні також хіміосенсорні сигнали від домовлених жінок. У гризунів хіміосенсорні подразники є основною сенсорною модальністю для ініціювання сексуальної поведінки чоловіків (Рис. 1). Хемосенсорні сигнали передаються від нюхових цибулин до МПОА через медіальне амігдалоїдне ядро та постільне ядро stria terminalis, структури з рясним AR та ER (Вуд і Суонн, 1999). Для визначення ролі хемосенсорних сигналів у ДА, спричинених спаровуванням, ми вимірювали МПАА DA під час спаровування в холоднокровних чоловічих хом'яків з односторонньою нюховою бульбектомією (UBx, Триемстра, Нагатані та Вуд, 2005). Хоча двостороннє видалення нюхових цибулин усуває статеву активність та звільнення MPOA DA, одностороння бульбектомія не заважає спаровуванню. У цьому дослідженні копуляція індукувала вивільнення MPOA DA при вимірюванні контралатерально пошкодженої нюхової цибулини, але не в іпсилатеральній півкулі (Рис. 2). Подібні результати спостерігалися у самців щурів з ураженням медіальної мигдалини (Домінгес, Ріоло, Сю та Халл, 2001). У відповідному дослідженні хімічна стимуляція медіальної мигдалини у щурів викликала вивільнення MPOA DA, еквівалентне тому, що під час копуляції (Домінгуес і Халл, 2001). У сукупності ці дані говорять про те, що тестостерон створює вседозволене середовище, яке дозволяє зовнішнім сенсорним стимулам досягати MPOA та індукувати вивільнення DA під час копуляції.

Рис. 2
Зрештою, сексуальна поведінка та інші природні винагороди активують нейронні шляхи нагородження. Мезокортиколімбічний ланцюг DA складається з вентральної тегментальної області (VTA), ядерного акумулятора (Acb) та префронтальної кори (Pfc). Тіла клітин дофаміну, що перебувають у проекті VTA, рострально відносяться до Acb та Pfc (Koob and Nestler, 1997). У щурів DA потрапляє в Acb під час сексу (Пфаус, Дамсма, Номікос, Венкстерн, Блаха, Філіпс і Фібігер, 1990). Багато наркотиків, що зловживають, також діють в системі мезолімбічної DA, щоб збільшити вивільнення DA (амфетаміни) або інгібувати повторне захоплення DA (кокаїн Ді Кьяра і Імперато, 1988), тим самим підсилюючи їх адиктивні властивості. Таким чином, тестостерон може впливати на вивільнення DA в Acb як шляхом посилення сексуальної поведінки, так і через дії наркотиків (див. Нижче).
Сучасні дані свідчать про те, що мезокортиколімбічна система DA дозріває в підлітковому віці. Щільність волокна Acb DA різко зростає в підлітковому періоді в піщах, що говорить про те, що значне дозрівання дофамінергічних проекцій ВТА до Acb відбувається в підлітковому періоді (Лестінг, Недденс і Техерт-Нудт, 2005). Крім того, дофамінергічний вхід до GABA (γ-аміномасляної кислоти) -ергічних клітин у медіальній префронтальній корі щурів збагачується та модулюється серотонінергічними системами під час пубертального розвитку (Бенес, Тейлор і Каннінгем, 2000), а маніпулювання андрогенами у дорослих щурів призводить до зміни щільності дофамінергічного аксона в межах префронтальної кори (Крицер, 2003). Pfc, Acb і VTA мають мало AR або ER, хоча ERβ присутній у VTA (Shughrue та ін., 1997). Тому, мабуть, ймовірно, що андрогени впливають на мезокортиколімбічну систему DA через андроген-чутливі аференти або через ERβ у ВТА, як у гіпоталамусі (Handa et al., Це питання). Наші дані показують, що андроген-чутливі клітини чоловічих хом'яків проектуються на ВТА від структур, пов'язаних із стероїдно-чутливою поведінкою. Наприклад, і MPOA, і ядро ліжка Stria terminalis (BST) містять велику кількість AR-позитивних клітин, що виступають на VTA (Сато і дерево, 2006). Вентральний палідій, головний ефекторний мішень Acb (Захм і Хаймер, 1990), також містить багато AR-позитивних клітин, що виступають на VTA. Ці прогнози дають можливість андрогенам змінювати активність мезокортиколімбічної системи DA.
Стероїдно-залежна організація поведінки в підлітковому віці
Традиційний погляд на дію гормону на поведінку підлітків ґрунтується на активаційному впливі стероїдних гормонів, в якому йдеться про здатність стероїдів полегшувати поведінку у конкретних соціальних ситуаціях, діючи всередині клітини-мішені в нейронних ланцюгах, що лежать в основі поведінки. Активаційні ефекти є тимчасовими в тому сенсі, що вони приходять і проходять із наявністю і відсутністю гормону, і вони, як правило, пов'язані з вираженням поведінки дорослих. Навпаки, організаційні ефекти стосуються здатності стероїдів ліпити структуру нервової системи під час розвитку. Структурна організація є постійною, зберігається поза періодом впливу гормону і визначає нервові та поведінкові реакції на стероїди у дорослому віці. Наше розуміння взаємозв'язку розвитку між організаційними та активаційними ефектами стероїдних гормонів розвивалося протягом останніх років 50. Фенікс та його колеги вперше запропонували, щоб поведінкові (активаційні) реакції дорослих на стероїдні гормони запрограмовані (організовані) стероїдними гормонами під час максимально чутливого періоду перинатального розвитку (Фенікс, Гой, Джералл та Янг, 1959). Пізніше Скотт та його колеги заклали теоретичну основу існування декількох чутливих періодів для прогресуючої організації нервової системи та відзначили, що чутливі періоди, найімовірніше, мають місце в періоди швидких змін розвитку (1974). Згодом Арнольд та Брідлоу вказували, що стероїдно-залежна організація мозку може відбуватися поза чутливих періодів розвитку (Arnold and Breedlove, 1985). Протягом останніх років 15, в яких використовувались різні моделі тварин та поведінкові системи, було зрозуміло, що мозок підлітка чутливий як до активаційних, так і до організаційних ефектів гонадальних стероїдів (розглянуто в Sisk і Zehr, 2005). І, як і інші періоди швидких змін розвитку, підлітковий вік являє собою визначене вікно можливостей для стероїдзалежної реконструкції мозку.
Наша робота з використанням хом'яка як моделі тварини свідчить про те, що соціальна поведінка чоловіків модифікується стероїдами в підлітковому віці (Шульц, Менард, Сміт, Альберс і Сіск, 2006; Шульц і Сіск, 2006). До статевого дозрівання лікування тестостероном не може активізувати сексуальну поведінку у хом'яків, що дозволяє припустити, що зрілі процеси, які роблять нейронні ланцюги сприйнятливими до активації або організації стероїдними гормонами, ще не відбулися (Meek et al., 1997; Ромео, Річардсон і Сіск, 2002a). І навпаки, хоча явне вираження чоловічої репродуктивної поведінки в зрілому віці не вимагає абсолютної присутності гонадних стероїдів у підлітковому віці, максимальне вираження поведінки вимагає. Порівнюючи маскулінну репродуктивну поведінку чоловіків, кастрованих або в препубертатному (NoT@P), або в постпубертатному (T@P) і потім лікуваних тестостероном у зрілому віці, у препубертатних кастратів NoT@P спостерігається щонайменше 50% дефіцит маскулінної поведінки порівняно з самцями, кастрованими після підліткового віку. (Рис. 3, Шульц, Річардсон, Зер, Осетек, Менард і Сіск, 2004). Крім того, дефіцит репродуктивної поведінки є довготривалим, і його не можна подолати ні тривалим лікуванням тестостероном, ні сексуальним досвідом у дорослому віці (Schulz et al., 2004). Подібним чином після лікування естрогеном і прогестероном самці NoT@P демонструють коротші затримки лордозу та більшу тривалість лордозу, ніж самці, кастровані у дорослому віці (Schulz et al., 2004), що дозволяє припустити, що препубертальні кастрати менш дефіміновані, ніж самці, що піддаються пубертальному тестостерону.

Рис. 3
Можливо, чоловіки NoT@P страждають від зниження сексуальної мотивації. Один із способів вирішення цього питання полягає в тому, щоб порівняти затримки для участі як в аногенітальному дослідженні (AGI), так і в установці між самцями, гонадектомованими до (NoT@P) і після статевого дозрівання (T@P). Якщо сексуальна мотивація залежить від впливу гонадних гормонів у підлітковому віці, ми передбачимо більш тривалу затримку для участі в сексуальній поведінці у чоловіків NoT@P. Дійсно, при повторному контакті з естральними самками самцям NoT@P потрібно більше часу, щоб почати AGI та підвищити рівень, ніж самцям T@P (Рис. 4). Таким чином, на додаток до організації аспектів сексуальної активності, здається, що гормони статевого дозрівання також організовують корисні аспекти сексуальної поведінки. На підтримку цієї можливості центральне введення агоніста DA апоморфіну в дорослому віці відновлює поведінку NoT@P самців до типових для дорослих рівнів, що свідчить про те, що тестостерон у підлітковому віці зазвичай організовує дофамінергічні нейронні ланцюги (Salas-Ramirez, Montalto, and Sisk, 2006). ). Тим не менш, залишається багато цікавих питань. Чи буде NoT@P барпрес самця для естральної самки чи виробить умовну перевагу місця для спаровування? Майбутні дослідження вивчатимуть роль гормонів статевого дозрівання в організації сексуальної мотивації та сексуальної активності.

Рис. 4
Затримки та тривалість аногенітального дослідження (AGI), які демонструють самці хом’яків, гонадектомовані до статевого дозрівання (NoT@P) або після статевого дозрівання (T@P). Усі чоловіки отримували тестостерон у дорослому віці через 7 тижнів після гонадектомії та за тиждень до першого поведінкового тесту. A. Самці T@P показали подібні затримки AGI у трьох тестах з естральною самкою, тоді як самці NoT@P збільшили латентність AGI під час третього тесту з естральною самкою. B. Самці T@P зменшили затримку під час трьох тестів поведінки з естральною самкою, тоді як самці noT@P не показали жодних змін у затримці під час трьох тестів поведінки. Ці дані свідчать про те, що пубертатні статеві гормони мають тривалий, сприятливий вплив на мотивацію дорослого чоловіка до сексуальної поведінки з жінкою. (Неопубліковані дані тварин у Schulz, KM, Richardson, HN, Zehr, JL, Osetek, AJ, Menard, TA, і Sisk, CL, 2004).
Препубертатні поведінкові реакції на стероїди
Однією з тривалих загадок розвитку поведінки підлітків є те, чому активізація репродуктивної поведінки у відповідь на опромінення стероїдів посилюється у препубертатних чоловічих хом'яків. Якщо низький рівень андрогенів до статевого дозрівання обмежує вираження сексуальної поведінки чоловіків у препубертатних самців, то доповнення ендогенних андрогенів у препубертальних самців повинно викликати спаровування. Це виявляється не так (Meek et al., 1997; Ромео, Кук-Віньс, Річардсон і Сіск, 2001; Ромео, Вагнер, Янсен, Діедрих і Сіск, 2002b), незважаючи на те, що кількість та розподіл АР та ЕР по всьому ланцюгу спаровування є подібними у допубертальних та дорослих кастратах, які лікуються гормонами (Meek et al., 1997; Ромео, Дідріх і Сіск, 1999; Romeo et al., 2002a). Тому виявляється, що андрогени та АР необхідні, але недостатньо для вираження сексуальної поведінки чоловіків.
Намагання визначити фактори, що обмежують сексуальну активність до статевого дозрівання, поки що неоднозначні. Відповіді Фос на хемосенсорні сигнали з боку чутливих жінок подібні у передлежачих та дорослих чоловіків хом'яків (Ромео, Парфітт, Річардсон і Сіск, 1998). Ці дані демонструють, що сенсорні механізми трансдукції дозріли до статевої зрілості. Таким чином, неповнолітні самці здатні виявляти хемосенсорні сигнали у жінок; де вони відрізняються від дорослих, - це те, як вони реагують на ці підказки. Одне з можливих пояснень полягає в тому, що чоловіки допубертатного віку не мотивовані до сексуальної поведінки. Ми виявили, що передпубертетні хом'яки чоловічої статі не виявляють підвищеної дофамінергічної реакції в MPOA у відповідь на жіночі феромони, тоді як статеві люди, що не піддаються сексуальному розвитку, виявляють надійні допамінергічні реакції MPOA на ті ж подразники (Рис. 5, Шульц, Річардсон, Ромео, Морріс, Грінгленд і Сіск, 2003). Аналогічно, у препубертатних самців не виявляється типового для дорослого збільшення циркулюючого тестостерону після впливу жіночих феромонів (Парфітт, Томпсон, Річардсон, Ромео і Сіск, 1999). Таким чином, феромони жіночої статі є безумовним стимулом для нейрохімічних та нейроендокринних реакцій у дорослих, але не допубертатних чоловіків, що свідчить про те, що виразність цих соціально значущих сенсорних стимулів змінюється у зв'язку з пубертальним розвитком, можливо, пов'язаним із придбанням корисних властивостей та сексуальної мотивації. Крім того, хоча тестостерон і справді полегшує ГРВІ самки у препубертатних самців, цей ефект залежить від того, чи був у чоловіка попередній вплив згубної самки чи ні. Можливо, дивно, що лікування тестостероном зменшує затримку та збільшує тривалість АГІ лише у чоловіків, що перебувають у статевому плані передпубертатного віку (Рис. 6). Крім того, допубертальні самці, які мали один попередній досвід роботи із самкою, значно довші затримки AGI та коротші терміни AGI, ніж чоловіки, що взаємодіють із сприйнятливими жінками вперше (Рис. 6). Ці дані говорять про те, що взаємодія з чудовою жінкою є відхильною, а не корисною до статевої зрілості, тим самим усуваючи будь-який полегшує вплив тестостерону на АГІ під час наступних взаємодій з самицею. Цікаво було б дізнатися, чи зберігаються негативні поведінкові наслідки раннього впливу згубної самки в підлітковому та дорослому віці, особливо враховуючи, що повторне опромінення жахливих самок під час підлітковий вік, як правило, полегшує вираження репродуктивної поведінки чоловіка (Molenda-Figueira, Salas-Ramirez, Schulz, Zehr, Montalto і Sisk, 2007).

Рис. 5
Допубертальні та дорослі чоловічі медіальні преоптичні області (MPOA) дофамінергічні реакції на жіночі феромони, що містяться у вагінальних секретах. У дорослих чоловіків спостерігається підвищення дофамінергічної активності MPOA при впливі на жіночі піхвові секрети, тоді як у препубертатних чоловіків не спостерігається підвищена допамінергічна відповідь MPOA на жіночі феромони. (Перемальована з Schulz, KM, Richardson, HN, Romeo, RD, Morris, JA, Lookingland, KJ, і Sisk, CL, 2003).

Незважаючи на те, що допубертальне лікування андрогенами не може викликати копуляцію, нещодавня робота нашої лабораторії дозволяє стверджувати, що нервова система хом'яків чутлива до організуючих дій тестостерону на репродуктивну поведінку до підліткового віку (Шульц, Зер, Салас-Рамірес і Сіск, 2007). Кастрація плюс 19 днів впливу тестостерону до або під час підліткового віку, але не після підліткового віку сприяла монтажному поведінці, коли в дорослому віці замінювали тестостерон. У чоловіків, які піддаються тестостерону допубертально, також спостерігається більше інтромісіонів у дорослому віці, ніж чоловіки, які піддаються тестостерону під час або після статевого дозрівання (Schulz et al., 2007). Ці дані говорять про те, що здатність тестостерону організовувати поведінкові нервові ланцюги зменшується з віком, і що підлітковий вік позначає кінець затяжного постнатального чутливого періоду до впливу тестостерону.
Фармакологічні андрогени
Попередні дані говорять про те, що ендогенні стероїди гонад посилюють мотивовану поведінку в підлітковому віці. Тепер, що станеться, якщо андрогени самостійно вводять на рівні до нормальних фізіологічних концентрацій 100x? Це проблема зловживання анаболо-андрогенними стероїдами (ААС) (розглянуто в Броуер, 2002; Кларк та Хендерсон, 2003). Тут доречний короткий відступ: всі AAS є похідними тестостерону, всі AAS мають карбоновий каркас із злитими кільцями 4, більшість мають вуглецю 19. ААС застосовують головним чином для їх анаболічного (нарощування м’язів) ефекту. Однак, як випливає з назви, AAS також має андрогенні властивості. Тестостерон - логічний вибір у дослідженнях на тваринах для вивчення основних механізмів винагороди андрогенів. Він залишається популярним вибором і для користувачів, найчастіше у формі складних ефірів тестостерону тривалої дії, таких як пропіонат тестостерону. У 2006 тестостерон був єдиним найпоширенішим забороненим речовиною, виявленим в аналізах сечі в лабораторіях, акредитованих WADA (WADA, 2006). Найбільшу частку (34%) тестів на тестостерон припадало на ААС-позитивні аналізи сечі на Олімпійських іграх 2000 у Сіднеї (Van Eenoo та Delbeke, 2003). Аналогічно, в сечових тестах користувачів AAS 41% тестували позитивно на тестостерон (Brower, Catlin, Blow, Eliopulos, Beresford, 1991). При високих дозах ААС виробляє значні зміни поведінки. Зокрема, через їх тісний зв’язок з тестостероном, використання ААС у підлітковому віці може порушити нормальну стероїдну середу нервової системи підлітка, що розвивається, включаючи кількість, терміни та тип впливу стероїдів.
Як і інші заборонені наркотики, зловживання ААС людьми є проблемою підліткового віку. Відповідно до Національного опитування домогосподарств 1994 щодо вживання наркотиків (SAMHSA / OAS, 1996), піки вживання стероїдів у пізньому підлітковому віці у віці 18. Крім того, в опитуванні "Моніторинг майбутнього" (Джонстон, О'Мейлі та Бахман, 2003), частота вживання стероїдів серед літніх людей середньої школи (2.7%) була порівнянна з частотою кокаїну (3.5%) або героїну (1.4%). Вживання стероїдів також все частіше зустрічається у молодшому віці: 2.5% учнів 8-го класу (13 – 14 років) вживали стероїди, схожі на частоту тріщин (2.5%) та вживання героїну (1.6%). Ця тенденція до використання ААС у ранньому підлітковому віці є особливо тривожною з огляду на занепокоєння 1), що підлітки можуть бути особливо вразливими до зловживання ААС та 2), що підлітковий вплив на ААС на фармакологічних рівнях може значно змінити нормальне дозрівання мозку та поведінка, щоб викликати перебільшені морфологічні та поведінкові реакції, гостро та хронічно.
Невідповідна агресія - це поведінкова реакція, яка найчастіше пов'язана зі зловживанням ААС людини. У опублікованих повідомленнях про випадки вживання стероїдів було причетно до кількох жорстоких вбивств (Conacher and Workman, 1989; Папа і Кац, 1990; Папа, Курі, Пауелл, Кемпбелл і Кац, 1996; Шульте, Холл і Бойєр, 1993). У опитуваннях нинішніх користувачів ААС підвищена агресія та дратівливість були найпоширенішими поведінковими побічними ефектами від використання ААС (Бонд, Чой та Папа, 1995; Галлігані, Ренк і Хансен, 1996; Мідглі, Хізер і Девіс, 2001; Парротт, Чой та Дейвіс, 1994; Перрі, Кутчер, Лунд, Йейтс, Холман і Демерс, 2003). Однак, враховуючи діапазон впливу андрогенів, різноманітність психіатричних симптомів та потенціал наявної психіатричної дисфункції, важко визначити точну роль ААС у цих випадках агресії людини. Результати перспективних досліджень добровольців, які отримували ін'єкції ААС, неоднозначні: Tricker та ін. (1996) та О'Коннор та ін. (2004) не повідомлялося про збільшення гнівної поведінки, в той час як в інших дослідженнях спостерігалося посилення агресії (Далі, Су, Шмідт, Пікар, Мерфі та Рубінов, 2001; Hannan, Friedl, Zold, Kettler, and Plymate, 1991; Курі, Лукас, Папа і Олива, 1995; Папа і Кац, 1994; Су, Пальяро, Шмідт, Пікар, Волковіц і Рубінов, 1993). Тим не менш, важливо пам’ятати, що дози, які вводяться людям-добровольцям, значно нижчі, ніж дози, пропоновані на веб-сайтах з культуризму, а тривалість лікування, як правило, коротка. Таким чином, в цілому, мабуть, справедливо зробити висновок, що AAS має потенціал посилення агоністичної поведінки, принаймні, у сприйнятливих людей. Папа та ін. (1994) встановлено, що AAS викликає психіатричні симптоми у вразливих людей.
Дослідження на тваринах також дали вагомі докази агресії, викликаної ААС. Підлітки-хом'яки, які хронічно отримували стероїди з високою дозою, мають більш короткі затримки нападу та більшу кількість нападів та укусів у бік зловмисника у порівнянні з нелікованими самцями (Гаррісон, Коннор, Новак, Наш і Меллоні, 2000; Меллоні, Коннор, Ханг, Гаррісон і Ферріс, 1997). Аналогічно, легка провокація (затискання хвоста) призводить до постійного посилення агресії у підлітків-самців щурів, включаючи агресію до самок (Каннінгем і МакГінніс, 2006). Ще більша стурбованість, що підлітковий вплив ААС у хом'яків викликає тривале збільшення агоністичної поведінки, що зберігається після припинення вживання стероїдів (Грімс і Меллоні, 2006). Ці зміни в поведінці супроводжуються тривалим ремоделірованием нервової схеми в передньому гіпоталамусі. Зокрема, підлітковий вплив на ААС у хом'яків підсилює аргінін вазопресин (AVP, Грімс і Меллоні, 2006) та знижує регулятори серотоніну та серотонінергічних рецепторів 5HT1A та 5HT1B (Річчі, Расакем, Грімс і Меллоні, 2006). Не дивно, що ААС також змінює рівень мозку АР. Хронічне опромінення або тестостероном, або нандролоном збільшує ядерний АР клітин у самців щурів (Менард і Харлан, 1993; Вессон і МакГінніс, 2006). Таким чином, існує потенціал для ААС посилити андрогензалежну поведінку як за рахунок доповнення ендогенних андрогенів, так і за рахунок збільшення андрогенної чуйності за рахунок посилення експресії AR.
У порівнянні з агоністичною поведінкою, ААС мають менш виражений вплив на поведінку спаровування у гризунів-самців, і реакція залежить від конкретного використовуваного стероїду (розглянуто в Кларк та Хендерсон, 2003). У хом'яків-чоловіків, які споживають тестостерон в пероральних розчинах, еякуляція збільшується залежно від дози (Wood, 2002). Однак ні тестостерон, ні нандролон не посилювали спаровування у підлітків-самців щурів. Станозолол, відносно менш потужний ААС з мінімальною андрогенною активністю, фактично гальмує як спаровування, так і агресію (Farrell та McGinnis, 2003), імовірно, знижуючи рівень ендогенного андрогену.
Особливо важливо зазначити, що хом'яки підлітків та дорослих можуть виявляти різні поведінкові реакції на вплив ААС. Незважаючи на те, що ААС помітно посилив агоністичну поведінку у чоловіків-підлітків, те саме лікування у дорослому віці призвело лише до незначного збільшення агресивної поведінки та значно зниженої сексуальної поведінки (Salas-Ramirez, Montaldo і Sisk, 2008). Це відповідає концепції підліткового віку як чутливого періоду до дії андрогенів. Крім того, так само, як дорослі чоловічі хом'яки набувають толерантність до екзогенного тестостерону (Пітерс і Вуд, 2005) ми вважаємо, що чоловіки, що розвиваються, здобувають толерантність до тестостерону в міру дозрівання. Таким чином, наслідки ААС змінюються протягом розвитку підлітків, а підлітковий вплив на ААС може спричинити надмірну агресивну та сексуальну поведінку, яка може зберігатися в дорослому віці.
Підсилюючий ефект андрогенів
Парування та боротьба - це одна винагорода (принаймні, якщо ви виграєте бій). Самці щурів кілька разів будуть натискати на важіль, щоб поєднатися з самкою (Everitt і Stacey, 1987). Аналогічно, миші-самки та хом'яки-самки формуватимуть умовне уподобання місця (CPP) для місць, де вони раніше вигравали бійки (Мартінес, Гіллен-Салазар, Сальвадор та Саймон, 1995; Мейзель і Джоппа, 1994). Якщо ААС може підвищити корисну соціальну поведінку вище рівнів, які зазвичай спостерігаються у непошкоджених статевих залоз чоловіків, логічно очікувати, що сам тестостерон може бути корисним. Це було випробувано з використанням двох добре встановлених моделей тварин для винагороди та підкріплення: CPP та самоуправління. Результати цих досліджень демонструють, що тестостерон посилюється в експериментальному контексті, коли анаболічні ефекти та спортивні показники не мають значення. З CPP досліджувана речовина неодноразово поєднується з унікальним середовищем (наприклад, певна камера в апараті для тестування). Після того як тварина асоціює зміцнюючу досліджувану речовину з цим середовищем, воно буде шукати навколишнє середовище навіть за відсутності винагороди. Перші повідомлення про нагородження андрогенів у лабораторних тварин використовували системні ін'єкції тестостерону для індукції CPP у мишей-самців (Арнедо, Сальвадор, Мартінес-Санчіс і Гонсалес-Боно, 2000; Арнедо, Сальвадор, Мартінес-Санчіс і Пелліцер, 2002) і щурів (Олександр, Пакард і Хайнс, 1994; де Беун, Янсен, Сленген і Ван де Полл, 1992). Згодом наша лабораторія використовувала самоприйом тестостерону для демонстрації посилення андрогенів (Джонсон і Вуд, 2001). Ми виявили, що хом'яки чоловіки добровільно споживають пероральні розчини тестостерону, використовуючи як тести вибору пляшок 2, так і пиття, спричинене їжею. У пізніших дослідженнях ми продемонстрували внутрішньовенне самовведення у щурів та хом'яків (Вуд, Джонсон, Чу, Шад і Селфі, 2004). Внутрішньовенне введення усуває потенційні збиваючі наслідки смаку або заливки кишечника на прийом андрогенів.
В умовах зловживання ААС важливо розмежовувати центральний та периферичний вплив андрогенів. Оскільки тестостерон має широкий вплив на організм, можна стверджувати, що винагорода та підсилення системними ін'єкціями тестостерону є вторинними для системних анаболічних та андрогенних дій тестостерону. Іншими словами, можливо тестостерон знижує втомлюваність м’язів і покращує функцію суглобів, так що тварини просто почувати краще. Дійсно, це пояснення було використано в клінічній літературі (хоча і без експериментальних доказів), щоб аргументувати потенціал залежності та залежності від ААС (DiPasquale, 1998). Однак Packard et al (Пакард, Корнелл та Олександр, 1997) показали, що ін'єкції тестостерону безпосередньо в мозок щурів можуть викликати СРР. Так само наша лабораторія продемонструвала внутрішньомозкове внутрішньовентрикулярне (ікв) тестостеронове самоуведення у хом'яків-чоловіків (Wood et al., 2004). Внутрішньомозковий CPP та icv самоуправління з тестостероном стверджують, що центральні мішені опосередковують андрогенне посилення.
Примітно, що посилення тестостерону не обов'язково слідує тим самим механізмам, які були встановлені раніше для стероїдних ефектів на сексуальну поведінку. Як обговорювалося раніше, MPOA є ключовим сайтом для організації сексуальної поведінки чоловічих гризунів (Халл, Мейзел і Сакс, 2002). У хом'яків MPOA має багато стероїдних рецепторів, а тестостеронові імплантати в MPOA відновлюють сексуальну активність у довготривалих кастратах (Вуд і Суонн, 1999). Час перебігу цих стероїдних ефектів повільний: монтажна поведінка зберігається протягом тижнів після орхідектомії, а тривале опромінення стероїдів необхідне для відновлення спаровування у довгострокових кастратах (Шляхта та Альсум, 1975). Однак ін'єкції тестостерону в MPOA щурів-самців не можуть викликати CPP (Король, Пакард і Олександр, 1999). Це говорить про те, що інші області мозку мають важливе значення для посилення андрогенів.
На противагу цьому, самці щурів формують СРР для ін'єкцій тестостерону в Acb (Packard та ін., 1997). Як і у випадку з іншими наркотиками, що зловживають, DA, ймовірно, є ключовим нейромедіатором для посилення тестостерону: CPP, індукований системною ін'єкцією тестостерону, блокується антагоністами D1 та D2 дофамінових рецепторів (Schroeder і Packard, 2000). Однак, на відміну від інших наркотиків, що зловживають, наші дослідження на хом'яках свідчать, що тестостерон не індукує вивільнення Acb DA (Тріемстра, Сато і Вуд, в пресі). Так само дослідження щурів-самців показують, що андрогени не впливають на базальний рівень DA або вивільнення DA, стимульованого амфетаміном (Birgner, Kindlundh-Hogberg, Nyberg і Bergstrom, 2006; але також див Кларк, Лінденфельд і Гіббонс, 1996). Крім того, тестостерон чинить відносно незначний вплив на рівень тканин Acb DA (Тіблін, Фінн, Росс і Стенфорс, 1999). Ці дані в сукупності дозволяють припустити, що хоча посилення тестостерону в кінцевому рахунку може змінити активність DA в Acb, механізми можуть відрізнятися від механізмів кокаїну чи інших стимуляторів. У зв'язку з цим останні дані свідчать про те, що хронічне опромінення ААС може змінити чутливість до DA шляхом зміни метаболізму DA (Курлінг, Канкаанпаа, Еллермаа, Каріла та Сеппала, 2005), рівні рецепторів DA (Kindlundh, Lindblom, Bergstrom, Wikberg і Nyberg, 2001; Kindlundh, Lindblom і Nyberg, 2003) або транспортер DA (Kindlundh, Bergstrom, Monazzam, Hallberg, Blomqvist, Langstrom і Nyberg, 2002).
В даний час специфічні стероїдні сигнали, рецептори та ділянки мозку для посилення тестостерону невідомі. На основі недавнього дослідження хом'яків з нашої лабораторії, схоже, посилюючий ефект тестостерону опосередковується андрогенами та естрогенами (DiMeo та Wood, 2006). Поширені ААС включають як ароматизуючі, так і неароматизуючі андрогени (Голлавей, 1997; WADA, 2006). Це означає, що і AR, і ER можуть перетворювати стероїдні подразники на винагороду. Існує додаткова можливість того, що посилення тестостерону може бути опосередковане комбінацією класичних та негеномних рецепторів.
Кілька рядків доказів вказують на дії негеномних рецепторів у посилюючій дії ААС. На додаток до розрідженого розподілу AR в Acb та VTA, часовий хід підсилення андрогену є швидким (<30 хв), і обробка сигналів за допомогою класичного AR може бути недостатньо швидкою для підсилення. Відповідно, для перевірки ролі негеномної АР в підкріпленні ААС ми застосували два додаткові методи (Рис. 7). В одному експерименті (Сато, Йохансен, Йорданія та Вуд, 2006), ми дозволили щурам із мутацією фемінізації яєчок (Tfm, див. це питання) самостійно вводити дигідротестостерон (DHT), неароматизуючий андроген. Мутація Tfm значно зменшує зв'язування ліганду при АР. Тим не менш, щури Tfm та їхні брати-сестри дикого типу самостійно вводять приблизно однакову кількість ДГТ. Це стверджує, що негеномні ефекти ДГТ. У наступному дослідженні ми встановили, чи хом’яки-чоловіки будуть самостійно вводити ДГТ, кон'юговані з бичачим сироватковим альбуміном (BSA, Рис. 8, Сато і дерево, 2007). Кон'югати DHT-BSA непроникні для мембран; таким чином їх вплив обмежується клітиною поверхні. Хом'яки, що вводять DHT, як показано раніше (DiMeo та Wood, 2006). Вони виявили схожу перевагу для кон'югатів DHT-BSA, але не змогли самостійно ввести BSA.

Рис. 7

Рис. 8
Ці дані вказують на центральну роль для АР клітинних клітин у посиленні андрогенів. В даний час точна природа таких рецепторів не відома. Було запропоновано, що андрогени можуть діяти на клітинній поверхні через зв'язування з виділеною мембраною AR (Томас, Дресинг, Панг, Берг, Даббс, Беннінгхофф і Дуті, 2006, також дивіться це питання). Це може бути у формі позаядерної класичної АР, про яку повідомляється у гіпокампі (у цьому випуску Саркі та ін.). Альтернативно, попередні дослідження також описували стероїд-зв'язуючі сайти в інших системах нейротрансмітерів. Зокрема, різноманітність стероїдних гормонів, включаючи AAS, може аллостерично модулювати рецептор GABA-A (Хендерсон, 2007; Ламберт, Белеллі, Педен, Варді та Пітерс, 2003). Так само сульфатовані нейростероїди можуть змінювати активність N-метил-Dпідтип рецепторів аспартату (Малаєв, Гіббс і Фарб, 2002) рецептори. Це важлива область для майбутніх досліджень.
Чому повинна бути мембранна AR? Як обговорювалося раніше, існує тісна зв'язок між секрецією андрогенів та винагородженням соціальної поведінки. Ми можемо припустити, що посилення секреції тестостерону, яке слідує за спаровуванням або боротьбою, служить зміцненню поведінки. Якщо це так, необхідно швидко пов'язати стимул (поведінку) і винагороду (тестостерон). Це найкраще досягти шляхом зв'язування з мембраною AR. У зв'язку з цим було б цікаво визначити, чи затискання секреції андрогенів під час спаровування зменшує корисні наслідки сексуальної поведінки.
Підсумки
Тут ми переглядаємо докази того, що андрогени є потужними посередниками мотивації поведінки дорослих, а також, що терміни впливу андрогенів під час програм розвитку андроген-залежної мотивованої поведінки у дорослому віці Анаболічні стероїди швидко стають сприятливим препаратом зловживань з боку підлітків у США. Незважаючи на те, що ААС може не мати звикання кокаїну чи героїну, ми лише починаємо розуміти потенціал андрогенного посилення та звикання. Зокрема, коли молодіжні види спорту стають більш конкурентоспроможними, зростає тиск на спортсменів, що розвиваються, використовувати стероїди, починаючи з молодшого віку. Ця тенденція викликає занепокоєння з огляду на нові докази стероїдчутливого нейронного дозрівання у підлітків.
Незважаючи на підвищену обізнаність як громадськістю, так і науковою спільнотою про глибокі нервові зміни, що супроводжують підліткове життя, експериментальне вивчення нейробіології розвитку статевого дозрівання було обмеженим. Тваринні моделі підліткового розвитку необхідні для дослідження того, як терміни впливу гормонів під час розвитку збільшують ризик для психопатології та вживання наркотиків та які типи досвіду пом'якшують чи посилюють поведінкові наслідки відхилень у пубертальному періоді. Наприклад, соціальні фактори, такі як вплив на однолітків, посилюють ефекти пубертатного часу для вживання речовин та алкоголю (Biehl, Natsuaki та Ge, 2007; Паттон, Нові, Лі та Хікок, 2004; Сімонс-Мортон і Хейні, 2003; Віхстром і Педерсен, 2001). Тваринні моделі пубертатного часу також інформують людські наукові зусилля та, можливо, призведуть до більш ефективних терапевтичних втручань у підлітковому віці.
Подяки
Ми дякуємо Елені Анцулатос, Кортні Баллард, Люсі Чу, Келлі Пітерс, Дженніфер Тріемстра, Джейн Веньє, Ліза Роджерс і Памела Монталто за допомогу в цих дослідженнях. Ця робота підтримується грантами від NIH (DA12843 до RIW, MH68764 до CLS та MH070125 до KMS).
Виноски
Заява видавця: Це PDF-файл неозброєного рукопису, який був прийнятий до публікації. Як послугу нашим клієнтам ми надаємо цю ранню версію рукопису. Рукопис буде підданий копіюванню, набору тексту та перегляду отриманого доказу до його опублікування в остаточній формі. Зверніть увагу, що під час виробничого процесу можуть бути виявлені помилки, які можуть вплинути на вміст, і всі правові застереження, які стосуються журналу, стосуються.
посилання
- Alexander GM, Packard MG, Hines M. Тестостерон має корисні афективні властивості у щурів-самців: наслідки для біологічної основи сексуальної мотивації. Поведінкова неврологія. 1994;108: 424-8. [PubMed]
- Andersen SL. Траєкторії розвитку мозку: точка вразливості або вікно можливостей? Огляди неврології та біо поведінки. 2003;27: 3-18. [PubMed]
- Андерсен С.Л., Рутштейн М., Бензо JM, Хостетер JC, Teicher MH. Статеві відмінності у перевиробленні та елімінації рецепторів дофаміну. Neuroreport. 1997;8: 1495-8. [PubMed]
- Arnedo MT, Salvador A, Martinez-Sanchis S, Gonzalez-Bono E. Нагороджувальні властивості тестостерону у неушкоджених мишей-самців: пілотне дослідження. Фармакологія, біохімія та поведінка. 2000;65: 327-32.
- Арнедо М.Т., Сальвадор А, Мартинес-Санчіс С., Пелліцер О. Подібні корисні ефекти тестостерону у мишей, які оцінені як особи, які коротко і довго затримуються. Біологія наркоманії. 2002;7: 373-9. [PubMed]
- Арнольд А.П., Брейдлоу СМ. Організаційний та активаційний вплив статевих стероїдів на мозок та поведінку: реаналіз. Гормони та поведінка. 1985;19: 469-98. [PubMed]
- Benes FM, Тейлор JB, Cunningham MC. Конвергенція і пластичність моноамінергічних систем в медіальній префронтальній корі в постнатальний період: наслідки для розвитку психопатології. Кора головного мозку. 2000;10: 1014-27. [PubMed]
- Benes FM, Turtle M, Khan Y, Farol P. Мієлінізація ключової релейної зони у формуванні гіпокампу відбувається в людському мозку в дитинстві, юності та дорослому віці. Архіви загальної психіатрії. 1994;51: 477-84. [PubMed]
- Biehl MC, Natsuaki MN, Ge XJ. Вплив пубертальних термінів на вживання алкоголю та траєкторій пиття. Журнал молоді та юності. 2007;36: 153-167.
- Birgner C, Kindlundh-Hogberg AM, Nyberg F, Bergstrom L. Неврологічні літери. 2006. Змінені позаклітинні рівні DOPAC та HVA в ядрі щурів обширюються оболонкою у відповідь на субхронічне введення нандролону та подальше виклик амфетаміну.
- Bond AJ, Choi PY, Pope HG., Jr Оцінка уважної упередженості та настрою у користувачів та користувачів, які не користуються анаболо-андрогенними стероїдами. Залежність від наркотиків та алкоголю. 1995;37: 241-5. [PubMed]
- Броуер KJ. Зловживання анаболічними стероїдами та залежність. Поточні психіатричні звіти. 2002;4: 377-87. [PubMed]
- Brower KJ, Catlin DH, Blow FC, Eliopulos GA, Beresford TP. Клінічна оцінка та аналіз сечі на анаболіко-андрогенні зловживання стероїдами та залежність. Американський журнал зловживання наркотиками та алкоголем. 1991;17: 161-171. [PubMed]
- Celotti F, Negri-Cesi P, Poletti A. Стероїдний метаболізм у мозку ссавців: 5-альфа-зменшення та ароматизація. Бюлетень дослідження мозку. 1997;44: 365-75. [PubMed]
- Chung WC, De Vries GJ, Swaab DF. Статева диференціація постільного ядра stria terminalis у людини може поширюватися і на доросле життя. Журнал Neuroscience. 2002;22: 1027-33. [PubMed]
- Кларк А.С., Хендерсон Л.П. Поведінкові та фізіологічні відповіді на анаболіко-андрогенні стероїди. Огляди неврології та біо поведінки. 2003;27: 413-36. [PubMed]
- Кларк А.С., Лінденфельд РК, Гіббонс СН. Анаболо-андрогенні стероїди та винагорода мозку. Фармакологія, біохімія та поведінка. 1996;53: 741-5.
- Коначер Г.Н., робочий Д.Г. Насильницький злочин, можливо, пов'язаний з використанням анаболічних стероїдів. Американський журнал психіатрії. 1989;146: 679. [PubMed]
- Cunningham RL, McGinnis MY. Фізична провокація пубертального анаболічного андрогенного стероїду, що піддається впливу самців щурів, викликає агресію до жінок. Гормони та поведінка. 2006;50: 410-6. [PubMed]
- Daly RC, Su TP, Schmidt PJ, Pickar D, Murphy DL, Rubinow DR. Цереброспінальна рідина та зміни поведінки після введення метилтестостерону: попередні результати. Архіви загальної психіатрії. 2001;58: 172-7. [PubMed]
- Девіс EC, Shryne JE, Gorski RA. Структурні статеві диморфізми в антеровентральному перивентрикулярному ядрі гіпоталамуса щура чутливі до гонадальних стероїдів перинатально, але розвиваються перипубертально. Нейроендокринологія. 1996;63: 142-8. [PubMed]
- де Беун Р, Янсен Е, Сленген Ж.Л., Ван де Поллл NE. Тестостерон як апетитний та дискримінаційний стимул у щурів: залежність від сексу та дози. Фізіологія та поведінка. 1992;52: 629-34. [PubMed]
- Декабан А.С. Зміни ваги мозку протягом періоду життя людини: відношення ваг мозку до висоти тіла та ваги тіла. Літописи неврології. 1978;4: 345-56. [PubMed]
- Di Chiara G, Imperato A. Препарати, які зловживають люди, переважно підвищують концентрацію синаптичних дофамінів у мезолімбічної системі вільно рухаються щурів. Праці Національної академії наук Сполучених Штатів Америки. 1988;85: 5274-8. [PMC безкоштовна стаття] [PubMed]
- ДіМео А.Н., Вуд РІ. Самостійне введення естрогену та дигідротестостерону у хом'яків-чоловіків. Гормони та поведінка. 2006;49: 519-26. [PubMed]
- DiPasquale M. Анаболічні стероїди. В: Тартер Р.Е., Аммерман РТ, Отт PJ, редактори. Довідник зловживання речовинами. Пленум Прес; NY: 1998. стор. 547 – 565.
- Домінгуес J, Ріоло JV, Сю Z, Халл Е.М. Регулювання медіальної мигдалини копуляції та медіального преоптичного вивільнення дофаміну. Журнал Neuroscience. 2001;21: 349-355. [PubMed]
- Домінгуес Дж. М., Халл Е.М. Стимуляція медіальної мигдалини посилює медіальний преоптичний вивільнення дофаміну: наслідки для сексуальної поведінки самця щурів. Дослідження мозку. 2001;917: 225-229. [PubMed]
- Du J, Lorrain DS, Hull EM. Кастрація зменшує позаклітинне, але збільшує внутрішньоклітинний дофамін в медіальній преоптичній зоні щурів-самців. Дослідження мозку. 1998;782: 11-17. [PubMed]
- Eckenhoff MF, Rakic P. Природа та доля проліферативних клітин у зубчастій звивині гіпокампа протягом тривалості життя мавпи резус. Журнал Neuroscience. 1988;8: 2729-47. [PubMed]
- Еверіт Б.Ж., Стейсі П. Дослідження інструментальної поведінки із сексуальним підкріпленням у самців щурів (Rattus norvegicus): II. Наслідки преоптичного ураження області, кастрації та тестостерону. Журнал порівняльної психології. 1987;101: 407-19. [PubMed]
- Gallaway S. Стероїдна Біблія. Belle International Press; Сакраменто, Каліфорнія: 1997.
- Galligani N, Renck A, Hansen S. Особистий профіль чоловіків, які використовують анаболічні андрогенні стероїди. Гормони та поведінка. 1996;30: 170-5. [PubMed]
- Grimes JM, Melloni RH., Jr. Тривалі зміни в нервовій системі серотоніну після припинення впливу підлітків на анаболі-андрогенні стероїди у хом'яків (Mesocricetus auratus) Поведінкова неврологія. 2006;120: 1242-51. [PubMed]
- Hannan CJ, Jr, Friedl KE, Zold A, Kettler TM, Plymate SR. Психологічні та синдроми гомованіальної кислоти в сироватці крові у чоловіків, які отримували андрогенні стероїди. Психоневроендокринологія. 1991;16: 335-43. [PubMed]
- Harrison RJ, Connor DF, Nowak C, Nash K, Melloni RH., Jr. Хронічне анаболіко-андрогенне стероїдне лікування в підлітковому віці збільшує передній гіпоталамічний вазопресин та агресію інтактних хом'яків. Психоневроендокринологія. 2000;25: 317-38. [PubMed]
- Він J, екіпажі FT. Нейрогенез знижується під час дозрівання мозку з підліткового та дорослого віку. Фармакологія, біохімія та поведінка. 2007;86: 327-33.
- Henderson LP. Стероїдна модуляція передачі рецепторів GABAA в гіпоталамусі: вплив на репродуктивну функцію. Нейрофармакологія. 2007;52: 1439-53. [PMC безкоштовна стаття] [PubMed]
- Халл Е.М, Ду Дж, Лотарингія Д.С., Матушевич Л. Позаклітинний дофамін в медіальній преоптичній зоні: наслідки для сексуальної мотивації та гормонального контролю копуляції. Журнал Neuroscience. 1995;15: 7465-7471. [PubMed]
- Hull EM, Meisel RL, Sachs BD. Статева поведінка чоловіків. В: Pfaff DW, Арнольд А.П., Etgen AM, Fahrbach SE, Rubin RT, редактори. Гормони, мозок та поведінка. Академічна преса; Нью-Йорк: 2002. стор. 3 – 137.
- Халл Е. М., Вуд РІ, Маккенна КЕ. Нейробіологія сексуальної поведінки чоловіків. В: Ніл Дж. Д., редактор. Фізіологія розмноження. Вип. 1. Elsevier Press; Нью-Йорк: 2006. стор. 1729 – 1824.
- Huttenlocher PR, Dabholkar AS. Регіональні відмінності в синаптогенезі кори головного мозку людини. Журнал порівняльної неврології. 1997;387: 167-78. [PubMed]
- Джонсон Л.Р., Wood RI. Пероральний прийом тестостерону у хом'яків-чоловіків. Нейроендокринологія. 2001;73: 285-92. [PubMed]
- Johnston LD, O'Malley PM, Bachman JG. Учні середньої школи (видання NIH № 03 – 5375) І. Бетесда, доктор медицини: Національний інститут зловживання наркотиками; 2003. Моніторинг майбутніх результатів національного опитування щодо вживання наркотиків, 1975 – 2002.
- Фонд сім'ї Кайзера. Сексуальна активність у США підлітків. 2005. стор. № 3040 – 02.
- Kashon ML, Hayes MJ, Shek PP, Sisk CL. Регулювання імунореактивності андрогенних рецепторів мозку андрогеном у передпубертальних чоловічих тхорів. Біологія розмноження. 1995;52: 1198-205. [PubMed]
- Kindlundh AM, Bergstrom M, Monazzam A, Hallberg M, Blomqvist G, Langstrom B, Nyberg F. Dopaminergic ефекти після хронічного лікування нандролоном, візуалізованим у мозку щурів методом позитронно-емісійної томографії. Прогрес у нейропсихофармакології та біологічній психіатрії. 2002;26: 1303-8.
- Kindlundh AM, Lindblom J, Bergstrom L, Wikberg JE, Nyberg F. Анаболо-андрогенний стероїдний нандролон-деканоат впливає на щільність дофамінових рецепторів у головному мозку щурів. European Journal of Neuroscience. 2001;13: 291-6. [PubMed]
- Kindlundh AM, Lindblom J, Nyberg F. Хронічне введення з нандролоновим деканоатом викликає зміни вмісту гено-транскрипту дофаміну D (1) - та D (2) -рецепторів у мозку щурів. Дослідження мозку. 2003;979: 37-42. [PubMed]
- King BE, Packard MG, Alexander GM. Афективні властивості внутрішньомедіального преоптичного введення тестостерону у самців щурів. Неврологічні літери. 1999;269: 149-52. [PubMed]
- Koob GF, Nestler EJ. Нейробіологія наркоманії. Журнал нейропсихіатрії та клінічних нейронаук. 1997;9: 482-97. [PubMed]
- Kouri EM, Lukas SE, Pope HG, Jr, Oliva PS. Підвищена агресивна реакція у добровольців-чоловіків після введення поступово збільшуючих доз ципіонату тестостерону. Залежність від наркотиків та алкоголю. 1995;40: 73-9. [PubMed]
- Кріцер МФ. Довготривала гонадектомія впливає на щільність тирозин гідроксилази, але не дофамін-бета-гідроксилази, холіну ацетилтрансферази або серотоніну-імунореактивні аксони в медіальних префронтальних кортиках дорослих щурів-самців. Кора головного мозку. 2003;13: 282-296. [PubMed]
- Kurling S, Kankaanpaa A, Ellermaa S, Karila T, Seppala T. Вплив субхронічного лікування нандролоновим деканоатом на дофамінергічну та серотонінергічну нейронні системи в мозку щурів. Дослідження мозку. 2005;1044: 67-75. [PubMed]
- Lambert JJ, Belelli D, Peden DR, Vardy AW, Peters JA. Нейростероїдна модуляція рецепторів GABAA. Прогрес у нейробіології. 2003;71: 67-80. [PubMed]
- Ленроут Р.К., Гедд Ю.Н. Розвиток мозку у дітей та підлітків: уявлення про анатомічну магнітно-резонансну томографію. Огляд неврології та біо поведінки. 2006;30: 718-29.
- Lesting J, Neddens J, Teuchert-Noodt G. Онтогенез іннервації дофаміну в ядрі acumbens з пустощів. Дослідження мозку. 2005;1066: 16-23. [PubMed]
- Малаєв А, Гіббс ТТ, Фарб DH. Інгібування відповіді NMDA прегненолоном сульфатом виявляє підтипову селективну модуляцію рецепторів NMDA сульфатованими стероїдами. Британський журнал фармакології. 2002;135: 901-9. [PMC безкоштовна стаття] [PubMed]
- Мартінес М, Гілен-Салазар Ф, Сальвадор А, Саймон В.М. Успішна внутрішня агресія та обумовлена перевага місця у мишей. Фізіологія та поведінка. 1995;58: 323-8. [PubMed]
- Meek LR, Romeo RD, Novak CM, Sisk CL. Дія тестостерону у препубертальних та постпубертальних чоловічих хом'яків: дисоціація впливу на репродуктивну поведінку та імунореактивність андрогенних рецепторів мозку. Гормони та поведінка. 1997;31: 75-88.
- Meisel RL, Joppa MA. Умовні переваги місця у хом'яків після агресивних або сексуальних контактів. Фізіологія та поведінка. 1994;56: 1115-8. [PubMed]
- Melloni RH, Jr, Connor DF, Hang PT, Harrison RJ, Ferris CF. Анаболо-андрогенне опромінення стероїдів у підлітковому віці та агресивна поведінка у золотих хом'яків. Фізіологія і поведінка. 1997;61: 359-64. [PubMed]
- Менард С, Харлан Р. Підвищення регуляції імунореактивності андрогенних рецепторів у мозку щурів андрогенно-анаболічними стероїдами. Дослідження мозку. 1993;622: 226-236. [PubMed]
- Mermelstein PG, Becker JB, Surmeier DJ. Естрадіол зменшує струми кальцію в неостриатальних нейронах щурів через мембранний рецептор. Журнал Neuroscience. 1996;16: 595-604. [PubMed]
- Midgley SJ, Хізер Н, Девіс JB. Рівні агресії серед групи анаболо-андрогенних стероїдів. Медицина, наука та право. 2001;41: 309-14.
- Molenda-Figueira HN, Salas-Ramirez KY, Schulz KM, Zehr JL, Montalto PR, Sisk CL. Соціальний досвід підлітків відновлює еякуляторну поведінку дорослих у сирійських хом'яків, яким не вистачає пубертального тестостерону. Товариство з поведінкової нейроендокринології; Pacific Grove, Каліфорнія: 2007.
- Благородний Р.Г., Alsum PB. Гормонозалежні статеві диморфізми у золотого хом'яка (Mesocricetus auratus) Фізіологія та поведінка. 1975;14: 567-74. [PubMed]
- Nunez JL, Lauschke DM, Juraska JM. Клітинна загибель у розвитку задньої кори у щурів-самців і жінок. Журнал порівняльної неврології. 2001;436: 32-41. [PubMed]
- Нуньєс Дж. Л., Соджі Дж., Юраска Дж. М. Гормони яєчників після післяпологового дня 20 зменшують кількість нейронів у первинній зоровій корі щура. Журнал Neurobiology. 2002;52: 312-21. [PubMed]
- О'Коннор БД, Арчер Дж, Ву ФК. Вплив тестостерону на настрій, агресію та сексуальну поведінку у молодих чоловіків: подвійне сліпе, плацебо-контрольоване, перехресне дослідження. Журнал клінічної ендокринології та метаболізму. 2004;89: 2837-45. [PubMed]
- Packard MG, Cornell AH, Alexander GM. Нагородження афективних властивостей внутрішньоядерних ущільнює ін'єкції тестостерону. Поведінкова неврологія. 1997;111: 219-24. [PubMed]
- Parfitt DB, Thompson RC, Richardson HN, Romeo RD, Sisk CL. МРНК GnRH збільшується з пубертатом в головному мозку сирійського хом'яка. Журнал нейроендокринології. 1999;11: 621-7. [PubMed]
- Parrott AC, Choi PY, Davies M. Використання анаболічних стероїдів спортсменами-любителями: вплив на стан психологічного настрою. Журнал спортивної медицини та фізичної підготовки. 1994;34: 292-8. [PubMed]
- Patton PE, Novy MJ, Lee DM, Hickok LR. Діагноз та репродуктивний результат після хірургічного лікування повної септатової матки, дубльованої шийки матки та перегородки піхви. Американський журнал акушерства та гінекології. 2004;190: 1669 – 75. 1675 – 8. [PubMed]
- Паус Т, Коллінз Д.Л., Еванс А.С., Леонард Г., Пайк Б, Зейденбос А. Дозрівання білої речовини в мозку людини: огляд досліджень магнітного резонансу. Бюлетень дослідження мозку. 2001;54: 255-66. [PubMed]
- Perry PJ, Kutscher EC, Lund BC, Yates WR, Holman TL, Demers L. Заходи агресії та зміни настрою у важкоатлетів-чоловіків із застосуванням андрогенних анаболічних стероїдів та без них. Журнал судових наук. 2003;48: 646-51. [PubMed]
- Петерс К.Д., Вуд Р.І. Андрогенна залежність у хом'яків: передозування, толерантність та потенційні опіоїдргічні механізми. Неврологія. 2005;130: 971-81. [PubMed]
- Pfaus JG, Damsma G, Nomikos GG, Wenkstern DG, Blaha CD, Phillips AG, Fibiger HC. Сексуальна поведінка підсилює центральну передачу дофаміну у самця щура. Дослідження мозку. 1990;530: 345-348. [PubMed]
- Phoenix CH, Goy RW, Gerall AA, Young WC. Організуюча дія пренатально введеного тестостерону пропіонату на тканини, що опосередковують парування поведінки у самки морської свинки. Ендокринологія. 1959;65: 369-82. [PubMed]
- Пінос Н, Колладо Р, Родрігес-Зафра М, Родрігес С, Сеговія S, Гійомон А. Розвиток статевих відмінностей у локусі корулеуса щура. Бюлетень дослідження мозку. 2001;56: 73-8. [PubMed]
- Папа Х.Г., молодший, Katz DL. Вбивства та близькі до вбивства анаболічні стероїди. [Див. Коментар] Журнал клінічної психіатрії. 1990;51: 28-31. [PubMed]
- Папа Х.Г., молодший, Katz DL. Психіатричні та медичні наслідки вживання анаболо-андрогенних стероїдів. Контрольоване дослідження спортсменів 160. Архіви загальної психіатрії. 1994;51: 375-82. [PubMed]
- Pope HG, Jr, Kouri EM, Powell KF, Campbell C, Katz DL. Анаболічно-андрогенні стероїди використовують серед ув'язнених 133. Комплексна психіатрія. 1996;37: 322-7. [PubMed]
- Putnam SK, Du J, Sato S, Hull EM. Відновлення тестостерону поведінки копуляції корелює з медіальним преоптичним вивільненням дофаміну у кастрованих щурів-самців. Гормони та поведінка. 2001;39: 216-224. [PubMed]
- Putnam SK, Sato S, Hull EM. Вплив метаболітів тестостерону на копуляцію та медіальний преоптичний вивільнення дофаміну у кастрованих щурів-самців. Гормони та поведінка. 2003;44: 419-26. [PubMed]
- Putnam SK, Sato S, Riolo JV, Hull EM. Вплив метаболітів тестостерону на копуляцію, медіальний преоптичний дофамін та NOS-імунореактивність у кастрованих щурів-самців. Гормони та поведінка. 2005;47: 513-522. [PubMed]
- Rankin SL, Partlow GD, McCurdy RD, Giles ED, Fisher KR. Постнатальний нейрогенез у вазопресині та окситоцин-містять ядро гіпоталамуса свині. Дослідження мозку. 2003;971: 189-96. [PubMed]
- Річі Л.А., Расакхам К, Грімс Дж. М., Меллоні Р.Х., активність рецепторів серотоніну-1A та експресія модулюють підліткову анаболічну / андрогенну стероїд-агресивну агресію у хом'яків. Фармакологія, біохімія та поведінка. 2006;85: 1-11.
- Romeo RD, Cook-Wiens E, Richardson HN, Sisk CL. Дигідротестостерон активізує сексуальну поведінку у дорослих чоловіків хом'яків, але не у неповнолітніх. Фізіологія та поведінка. 2001;73: 579-84. [PubMed]
- Ромео РД, Діеріч С.Л., Sisk CL. Імунореактивність рецепторів естрогенів у препубертальних та дорослих сирійських хом'яків. Неврологічні літери. 1999;265: 167-70. [PubMed]
- Romeo RD, Parfitt DB, Richardson HN, Sisk CL. Феромони виявляють еквівалентні рівні Fos-імунореактивності у препубертатних та дорослих сирійських хом'яків. Гормони та поведінка. 1998;34: 48-55. [PubMed]
- Romeo RD, Richardson HN, Sisk CL. Статеве дозрівання і дозрівання чоловічого мозку і сексуальної поведінки: перетворення поведінкового потенціалу. Огляди неврології та біо поведінки. 2002a;26: 381-91. [PubMed]
- Romeo RD, Wagner CK, Jansen HT, Diedrich SL, Sisk CL. Естрадіол індукує гіпоталамічні рецептори прогестерону, але не активізує поведінку спаровування у чоловічих хом'яків (Mesocricetus auratus) до статевого дозрівання. Поведінкова неврологія. 2002b;116: 198-205. [PubMed]
- Salas-Ramirez KY, Montalto PR, Sisk CL. Анаболічні андрогенні стероїди (ААС) по-різному впливають на соціальну поведінку у сирійських хом'яків підлітків та дорослих чоловіків. Гормони та поведінка. 2008 в пресі.
- SAMHSA / OAS. Публікація DHHS (SMA) 1996. Національне опитування домогосподарств 1994 щодо зловживання наркотиками, основні результати 1994; стор. 96 – 3085.
- SAMHSA / OAS. Результати Національного опитування 2004 щодо вживання та здоров’я наркотиків: національні висновки. 2005. NSDUH серія H-28, публікація DHHS № SMA 05 – 4062.
- Сато С.М., Йохансен Дж., Джордан CL, Wood RI. Андрогенне самоуправління щурами Tfm. 10-та щорічна нарада Товариства поведінкової нейроендокринології.2006.
- Сато С.М., Вуд РІ. Самостійне введення мембранонепроникних анаболо-андрогенних стероїдів (ААС) у сирійських хом'яків. 11-та щорічна зустріч суспільства з поведінкової нейроендокринології.2007.
- Schroeder JP, Packard MG. Роль підтипів рецепторів дофаміну в придбанні тестостерону переваги місця у щурів. Неврологічні літери. 2000;282: 17-20. [PubMed]
- Schulte HM, Hall MJ, Boyer M. Домашнє насильство, пов'язане із зловживанням анаболічними стероїдами. Американський журнал психіатрії. 1993;150: 348. [PubMed]
- Schulz KM, Menard TA, Smith DA, Albers HE, Sisk CL. Опромінення гормонів яєчок у підлітковому віці організовує бічне маркування поведінки та зв’язування рецепторів вазопресину в бічній перегородці. Гормони та поведінка. 2006;50: 477-83. [PubMed]
- Schulz KM, Richardson HN, Romeo RD, Morris JA, Lookingland KJ, Sisk CL. Медіальні преоптичні області дофамінергічні реакції на жіночі феромони розвиваються в період статевого дозрівання у сирійського хом’яка-самця. Дослідження мозку. 2003;988: 139-45. [PubMed]
- Schulz KM, Richardson HN, Zehr JL, Osetek AJ, Menard TA, Sisk CL. Гонадальні гормони маскулінізують та визначають репродуктивну поведінку під час статевого дозрівання у сирійського хом'яка-сирійця. Гормони та поведінка. 2004;45: 242-9. [PubMed]
- Шульц К.М., Sisk CL. Пубертальні гормони, мозок підлітка та дозрівання соціальної поведінки: уроки сирійського хом'яка. Молекулярна та клітинна ендокринологія. 2006:254–255. 120–6.
- Шульц К.М., Зер Й.Л., Салас-Рамірес К.Й., Сіск CL. Планувальник зустрічей з неврологічних наук. Сандієго, Каліфорнія: Товариство з нейронауки; 2007. Чи є підлітковий вік другим чутливим періодом для організації впливу тестостерону на репродуктивну поведінку чоловіків? 2007 Інтернет.
- Скотт JP, Stewart JM, De Ghett VJ. Критичні періоди в організації систем. Психобіологія розвитку. 1974;7: 489-513. [PubMed]
- Shughrue PJ, Lane MV, Merchenthaler I. Порівняльний розподіл рецепторів естрогенів-альфа та -бета мРНК у центральній нервовій системі щурів. Журнал порівняльної неврології. 1997;388: 507-25. [PubMed]
- Simons-Morton BG, Haynie DL. Психосоціальні провідники підвищеної стадії куріння серед шестикласників. Американський журнал про поведінку здоров'я. 2003;27: 592-602. [PubMed]
- Sisk CL, Zehr JL. Пубертатні гормони організують підлітковий мозок і поведінку. Межі в нейроендокринології. 2005;26: 163-74. [PubMed]
- Sowell ER, Thompson PM, Leonard CM, Welcome SE, Kan E, Toga AW. Поздовжнє картографування коркової товщини та зростання мозку у нормальних дітей. Журнал Neuroscience. 2004;24: 8223-31. [PubMed]
- Соуелл Е.Р., Томпсон П.М., Тесснер К.Д., Тога А.В. Картографування продовження росту мозку і зниження щільності сірої речовини в дорсальній лобовій корі: зворотні зв'язки під час дозрівання мозку в пост-підлітковому віці. Журнал Neuroscience. 2001;21: 8819-29. [PubMed]
- Спис LP. Підлітковий мозок і вікові поведінкові прояви. Огляд неврології та біо поведінки. 2000;24: 417-63.
- Su TP, Pagliaro M, Schmidt PJ, Pickar D, Wolkowitz O, Rubinow DR. Нейропсихіатричні ефекти анаболічних стероїдів у нормальних чоловіків-добровольців. JAMA. 1993;269: 2760-4. [PubMed]
- Thiblin I, Finn A, Ross SB, Stenfors C. Збільшення активності дофамінергічних та 5-гідрокситриптамінергічних в мозку самця щурів після тривалого лікування анаболічними андрогенними стероїдами. Британський журнал фармакології. 1999;126: 1301-6. [PMC безкоштовна стаття] [PubMed]
- Thomas P, Dressing G, Pang Y, Berg H, Tubbs C, Benninghoff A, Doughty K. Progestin, рецептори, пов’язані з естрогеном та андрогеном G-білками в рибних статевих залозах. Стероїди. 2006;71: 310-6. [PubMed]
- Tricker R, Casaburi R, Storer TW, Clevenger B, Berman N, Shirazi A, Bhasin S. Ефекти супрафізіологічних доз тестостерону на гнівну поведінку у здорових чоловіків-евгонад - дослідження клінічного дослідницького центру. Журнал клінічної ендокринології та метаболізму. 1996;81: 3754-8. [PubMed]
- Triemstra JL, Nagatani S, Wood RI. Хемосенсорні сигнали важливі для спричиненого спаровуванням вивільнення дофаміну в МПОА сирійських хом'яків. Neuropsychopharmacology. 2005;30: 1436-42. [PubMed]
- Triemstra JL, Sato SM, Wood RI. Тестостерон і ядро приєднує дофамін у самця сирійського хом'яка. Психоневроендокринологія (в пресі)
- Van Eenoo P, Delbeke FT. Поширеність допінгу у Фландрії порівняно з поширеністю допінгу в міжнародних видах спорту. Міжнародний журнал спортивної медицини. 2003;24: 565-570. [PubMed]
- ВАДА. Побічні аналітичні результати, про які повідомляють акредитовані лабораторії. 2006. http://www.wada-ama.org.
- Wesson DW, McGinnis MY. Укладання анаболічних андрогенних стероїдів (ААС) під час статевого дозрівання у щурів: нейроендокринна та поведінкова оцінка. Фармакологія, біохімія та поведінка. 2006;83: 410-9.
- Wichstrom L, Pedersen W. Використання анаболо-андрогенних стероїдів у підлітковому віці: виграти, виглядати добре чи погано? Журнал досліджень з алкоголю. 2001;62: 5-13. [PubMed]
- Wood RI, Johnson LR, Chu L, Schad C, Self DW. Підсилення тестостерону: внутрішньовенне та внутрішньомозкове внутрішньовентрикулярне самовведення у щурів та хом'яків-самців. Психофармакологія. 2004;171: 298-305. [PubMed]
- Wood RI, Newman SW. Андрогенні та естрогенові рецептори співіснують з окремими нейронами в мозку сирійського хом'яка. Нейроендокринологія. 1995;62: 487-97. [PubMed]
- Wood RI, Swann JM. Нейронна інтеграція хемосенсорних та гормональних сигналів, що контролюють сексуальну поведінку чоловіків. В: Wallen K, Schneider JS, редактори. Репродукція в контексті. MIT Press; Кембридж: 1999. стор. 423 – 444.
- Zahm DS, Heimer L. Два транспаллідальні шляхи, що походять в ядро щурів. Журнал порівняльної неврології. 1990;302: 437-46. [PubMed]