Neurosci Biobehav Rev. 2011 35 (3): 939-55. doi: 10.1016 / j.neubiorev.2010.10.014. Epub 2010 Nov 2.
- 1Бернард Б. Броді Кафедра неврології, Університет Кальярі, Cittadella Universitaria, 09042 Monserrato, CA, Італія. [захищено електронною поштою]
РЕФЕРАТ
Окситоцин є потужним індуктором ерекції статевого члена при введенні в центральну нервову систему. У щурів-самців найбільш чутливою ділянкою головного мозку для про-еректильної дії окситоцину є паравентрикулярне ядро гіпоталамуса. Це ядро і навколишні області містять клітинні тіла всіх окситоцинергічних нейронів, що проеціюються в позагипоталамические ділянки мозку і спинний мозок. Цей огляд показує, що окситоцин індукує ерекцію статевого члена також при ін'єкції в деякі з цих областей (наприклад, вентральна тегментальна ділянка, вентральний сублікум гіпокампу, постромедіальне кортикальне ядро мигдалини і торако-поперековий спинний мозок). Дослідження мікроін'єкції в поєднанні з внутрішньо-мозковим мікродіалізом і дослідженнями подвійної імунофлюоресценції показують, що окситоцин в цих областях активує безпосередньо або опосередковано (головним чином через глутамінову кислоту) мезолімбічні допамінергічні нейрони. Допамін, що виділяється в nucleus accumbens, в свою чергу, активує нервові шляхи, що призводять до активації допамінергічних нейронів внутрішньо-гіпоталамічних в паравентрикулярном ядрі. Це активізує не тільки окситоцинергічні нейрони, що виступають на спинний мозок і опосередковують ерекцію статевого члена, але й ті, які проеціюють вищезазначені області гіпоталамуса, модулюючи безпосередньо або опосередковано (через глутамінову кислоту) активність мезолімбічних допамінергічних нейронів, що контролюють мотивацію і винагороду. Разом ці нервові шляхи можуть представляти собою складну гіпотетичну схему, яка відіграє роль не тільки в фазі консервації статевої активності (еректильна функція і копуляція), але і в мотиваційних і корисних аспектах попередньої фази сексуальної поведінки.
1.Введення
Ерекція статевого члена є чоловічою статевою реакцією, яка відіграє ключову роль у відтворенні ссавців, включаючи людину, і яка може також спостерігатися в контекстах, відмінних від тих, які суворо пов'язані з відтворенням. Залежно від контексту, в якому відбувається ерекція статевого члена, в його регулюванні беруть участь різні центральні і периферичні нервові та / або гуморальні механізми (див. Meisel і Sachs, 1994; Argiolas і Melis, 1995, 2004, 2005; Sachs, 2000, 2007; Андуссон, 2000, Melis і Argiolas, 2000a, 2004, Hull et al., 2001). Серед центральних нейромедіаторів і нейропептидів, які контролюють ерекцію статевого члена, найбільш відомі є дофамін, серотонін, збудливі амінокислоти, оксид азоту, адренокортикотропін, окситоцин і опіоїдні пептиди. Вони можуть полегшувати або пригнічувати ерекцію статевого члена, діючи в декількох областях мозку, медіальну преоптичну ділянку, паравентрикулярне ядро гіпоталамуса, вентральну тегментальну область, гіпокамп, мигдалину, ядро ложа stria terminalis, nucleus accumbens, довгастий мозок і спинний мозок (Таблиця 1) (див. Meisel і Sachs, 1994; Witt and Insel, 1994; Stancampiano et al., 1994; Argiolas і Melis, 1995, 2005; Argiolas, 1999; Bancila et al., 2002; Giuliano and Rampin, 2000, Andersson, 2000, Hull et al., 2001, Coolen et al., 2002).
Окситоцин, нейрогіпофізарний пептид, добре відомий своєю гормональною роллю в лактації і родах, присутній у жінок і чоловіків, не тільки в нейронах з клітинними тілами, розташованими в паравентрикулярних і надоптичних ядрах гіпоталамуса, що проектуються на нейрогіпофіз, а також у проекції нейронів від паравентрикулярного ядра і навколишніх структур до екстра-протопластичних ділянок головного мозку (тобто перегородки, вентральної тегментальної області, гіпокампу, мигдалини, довгастого мозку і спинного мозку). Вважається, що ці нейрони залучені до численних центральних функцій, таких як пам'ять, навчання, приналежність та соціально-сексуальна поведінка, включаючи ерекцію статевого члена і копуляторну поведінку (див. Buijs, 1978; Sofroniew, 1983; Argiolas and Gessa, 1991; Wagner і Clemens, 1992, Ivell і Russel, 1992, Carter et al., 1993, Tang et al., 1995, Veronneau-Longueville et al., 1997). Дійсно, окситоцин полегшує еректильну функцію і сексуальну поведінку чоловіків у мишей, щурів, кроликів і мавп (див. Argiolas and Gessa, 1998; Carter, 1999; Pedersen et al., 1991; Argiolas і Melis, 1992, 1992; Argiolas, 1995). Це може статися і у людей, оскільки окситоцин у плазмі збільшується шляхом сексуальних подразників, особливо при еякуляції (Carmichael et al., 2004; Murphy et al., 1999), а також маніпуляціями грудей і геніталій, які зазвичай відбуваються під час статевого життя спілкування (Tindall, 1987).
Допоміжна дія окситоцину на сексуальну поведінку чоловіків вперше була продемонстрована здатністю внутрішньовенного введення окситоцину зменшувати латентність до першої еякуляції і затримувати сексуальне виснаження кроликів у парі з сприйнятливими жінками (Melin і Kihlstrom, 1963). Однак сексуальні ефекти окситоцину остаточно визнавалися лише у вісімдесяті роки. Окситоцин, наданий централізовано в кількості нанограм, виявив здатність індукувати ерекцію статевого члена (Argiolas et al., 1985, 1986) і поліпшити копуляторну поведінку (Arletti et al., 1985) у самців щурів і збільшити лордоз у щурів-самців (Arletti). і Bertolini, 1985, Caldwell et al., 1986), мабуть, діючи на окситоцинергічні рецептори маткового типу (див. Argiolas і Melis, 1995, 2004; Argiolas, 1999; Melis і Argiolas, 2003; Окситоцин покращує сексуальну поведінку не тільки у статево сильних щурів-самців (Arletti et al., 1985), але також у старих самців щурів (Arletti et al., 1990), а також у домінантних, але не в підпорядкованих, чоловічих мавп білок (Winslow and Insel). , 1991).
Проеректильний ефект окситоцину залежить від тестостерону, оскільки його скасовують гіпофізектомією і кастрацією, а також відновлюють за допомогою тестостерону або його метаболітів, естрадіолу і 5-дигідро-тестостерону. (Melis et al., 1994a). Найбільш чутливою областю головного мозку для індукції ерекції статевого члена окситоцином є паравентрикулярне ядро гіпоталамуса (Melis et al., 1986), з якого виникають всі окситоцинергічні проекції поза гіпоталамуса (див. Вище). Тут було виявлено, що окситоцин здатний індукувати ерекцію статевого члена (і позіхання) при введенні в дозах так само, як 3 pmol (див. Нижче розділ 2.1). Окситоцин індукував ерекцію статевого члена також при двосторонньому введенні в поле CA1 гіпокампу, але не в дорзальному сублікулі (див. Нижче розділ 2.3), латеральну перегородку, хворобливе ядро, медіальну преоптичну область, вентромедіальне ядро гіпоталамуса і надоптическое ядро (Melis et al., 1986). Що стосується механізму, за допомогою якого окситоцин діє в паравентрикулярном ядрі, щоб викликати цю сексуальну реакцію, численні дослідження показують, що окситоцин активує свої власні нейрони. У відповідності з цією гіпотезою статева взаємодія підвищує ФОС, продукт гена безпосереднього раннього гена c-fos в паравентрикулярних окситоцинергічних нейронах, що проектуються на спинний мозок, які беруть участь у контролі ерекції статевого члена (див. Witt and Insel, 1994 та посилання в них), і статева імпотенція (наприклад, нездатність дорослої самки щура до копуляції з овариэктомированной естроген-прогестеронеполімеризированной сприйнятливою жінкою) була пов'язана з самцем щура з низьким рівнем мРНК окситоцину в паравентрикулярном ядрі гіпоталамуса (Arletti et al., 1997).
Чи впливає окситоцин на попередню фазу або на фазу консервації сексуальної поведінки, поки що не зрозуміло. Оскільки окситоцин індукує ерекцію статевого члена і основним ефектом окситоцину на копуляторну поведінку є зменшення пост-еякуляторного інтервалу у самців щурів (Arletti et al., 1985), доцільно припустити, що пептид покращує сексуальну продуктивність. Однак, оскільки окситоцин також збільшує соціально-статеву взаємодію (див. Pedersen et al., 1992; Carter et al., 1997; Ivell and Russel, 1995), і антагоністи окситоцинового рецептора запобігають неконтактні ерекції (Melis et al., 1999a), розглядаються як індекс сексуального збудження (див. Sachs, 1997, 2000, 2007; Melis et al., 1998, 1999b і посилання в ньому), можливу роль окситоцину в сексуальному збудженні і сексуальній мотивації не можна виключити.
Цей огляд узагальнює опубліковані та неопубліковані результати останніх досліджень, які показують це окситоцин індукує ерекцію статевого члена не тільки при ін'єкції в паравентрикулярне ядро гіпоталамуса, але й в інших позагипоталамических ділянках головного мозку, таких як вентральна область (Melis et al., 2007, 2009a; Succu et al., 2008), т. \ Tвінтральний сублікум гіпокампу і заднього ядра мигдалини (Melis et al., 2009b, 2010), які є важливими складовими лімбічної системи і які, як вважають, відіграють ключову роль у процесах мотивації та винагороди. Ці дослідження показують, що окситоцин бере участь у нейронних ланцюгах, які включають інші нейротрансмітери, такі як допамін і глутамінова кислота, та інші ділянки мозку, крім паравентрикулярного ядра, наприклад, вентральна область тегментації, nucleus accumbens, гіпокамп і області виявлено. Ці схеми, ймовірно, опосередковують взаємодію між мезолімбічною і внутрішньо-гіпоталамічною допамінергічною системою і грають роль не тільки в фазі консервації чоловічої сексуальної поведінки (наприклад, ерекції статевого члена і копуляції), але також і в сексуальній мотивації та сексуальній поведінці. збудження, отже, забезпечення нейронного субстрату для пояснення мотиваційних і корисних властивостей сексуальної активності.
2. Окситоцин впливає на ерекцію статевого члена, діючи в різних областях мозку
2.1. Паравентрикулярне ядро гіпоталамуса
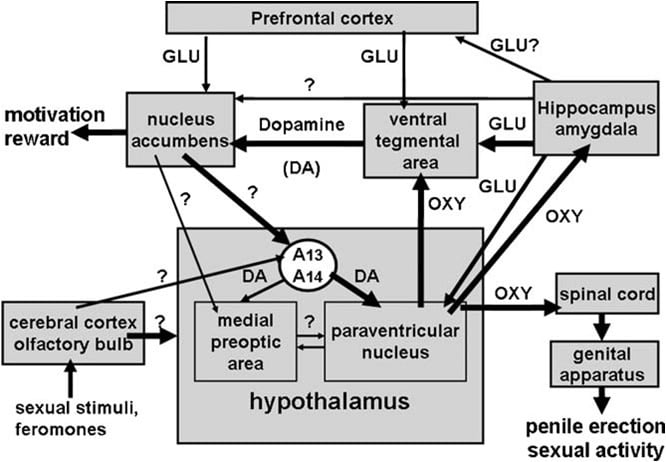
Як згадувалося вище, паравентрикулярне ядро гіпоталамуса незабаром було ідентифіковано як область головного мозку, найбільш чутлива до проеректильного ефекту окситоцину. При одноразовому введенні в це ядро окситоцин виявився активним у дозах, таких як 3 ng (3 pmol) (Melis et al., 1986). Дослідження взаємозв'язків між структурою та активністю показали, що ерекція пеніса, викликана окситоцином, була опосередкована рецепторами окситоцину матки, приєднаними до припливу Ca2 + до клітинних тіл окситоцинергічних нейронів, що спрямовуються до позагипоталамических ділянок мозку та активації синтази оксиду азоту. Оксид азоту, у свою чергу, діючи як внутрішньоклітинний месенджер з ще невідомим механізмом (не залучаючи гуанілатциклазу), призводить до активації окситоцинергічних нейронів, що проектуються в спинний мозок і поза гіпоталамічні ділянки мозку, індукуючи ерекцію статевого члена (рис. 1) (див. нижче і Argiolas і Melis, 1995, 2004, 2005 і посилання в ньому). Здатність окситоцину активувати свої власні нейрони
1. (MISSING) Схематичне зображення окситоцинергічних нейронів, які походять з паравентрикулярного ядра гіпоталамуса і спрямовані на позагіпоталамічні ділянки головного мозку, такі як спинний мозок, VTA, гіпокамп, мигдалина і т.д. дофамін, збуджуючі амінокислоти, сам окситоцин, пептиди аналога гексареліну і пептиди, отримані з VGF, призводять до ерекції статевого члена, яка може бути зменшена та / або ліквідована шляхом стимуляції рецепторів GABAergic, опиоидов і каннабиноидов CB1. Активація окситоцинергічних нейронів є вторинною по відношенню до активації синтази оксиду азоту, присутньої в цих нейронах. Насправді ендогенний оксид азоту, утворений стимуляцією дофаміну, збудливих амінокислот або окситоцинових рецепторів або екзогенного оксиду азоту, як той, що отримується з донорів оксиду азоту, подається безпосередньо в паравентрикулярне ядро, активує окситоцинергічні нейрони за допомогою невизначеного механізму, очевидно, не пов'язаного з стимуляція гуанілатциклази. Це, у свою чергу, призводить до вивільнення окситоцину в спинний мозок і в позагіпоталамічних ділянках мозку. Деякі деталі про механізми, за допомогою яких окситоцин індукує ерекцію статевого члена при вивільненні в цих областях, наприклад, VTA, вентральний сублікум і мигдалину, описані у відповідних ділянках області мозку. Тут окситоцин діє на власні рецептори і збільшує продукцію NO, що призводить до ерекції статевого члена, як це виявлено в PVN. Однак при відмінності від PVN, в каудальному VTA NO активується гуанилатциклаза. Це викликає збільшення концентрації цГМФ, що призводить до активації мезолімбічних допамінергічних нейронів і ерекції статевого члена. У VS NO активуються глутаматергічні нейрони, що проектуються на поза-гіпокампальні ділянки, включаючи ВТА. Глутамінова кислота в VTA активує, в свою чергу, мезолімбічні допамінергічні нейрони, які виявляються при окситоцині. Механізми, подібні до описаних вище, можуть діяти також, коли ерекція статевого члена відбувається у фізіологічних контекстах, а саме, коли самці щурів поміщають у присутності недоступної сприйнятливої жінки (наприклад, безконтактні ерекції) або під час копуляції.
в паравентрикулярном ядрі було підтверджено дослідженнями, які показують, що: (1) окситоцинові рецептори присутні в цьому ядрі гіпоталамуса (Freund-Mercier et al., 1987; Freund-Mercier і Stoeckel, 1995); (2) окситоцин полегшує власне вивільнення in vitro та in vivo (Freund-Mercier і Richard, 1981, 1984; Moos et al., 1984); і (3) Окситоцин збуджує власні нейрони, діючи в паравентрикулярном ядрі (Yamashita et al., 1987). Більш того, окситоцинергічні синапси, що впливають на клітинні тіла магніто-клітинних окситоцинергічних нейронів, також були виявлені в паравентрикулярному і надоптичному ядрі гіпоталамуса. (Теодоз, 1985). Нарешті, знищення центральних окситоцинергічних нейронів шляхом електролітичних або хімічних екситотоксичних уражень паравентрикулярного ядра, що повністю виснажує вміст окситоцину в центральній нервовій системі і спинному мозку, скасовує не тільки проеректильну дію окситоцину, але й погіршує індуковані препаратом. ерекцію статевого члена і безконтактні ерекції (див. нижче Argiolas et al., 1987a, b; Liu et al., 1997 і посилання в ньому). Результати, подібні тим, які були виявлені при ураженні паравентрикулярного ядра, виявлені з сильними і селективними антагоністами окситоцинових рецепторів. Дійсно, ці сполуки, що вводяться в паравентрикулярне ядро в кількостях нанограмів, запобігають ерекції пенілу, індукованої окситоцином, а при введенні в бічні шлуночки запобігають не тільки ерекцію статевого члена, викликану самою окситоцином, але й індуковану лікарським засобом ерекцію статевого члена (див. Нижче розділ 3 і Argiolas і Melis, 1995, 2004, 2005 і посилання в ньому) і безконтактні ерекції (Melis et al., 1999a) і, крім того, надзвичайно ефективні в порушенні копуляторного поведінки статево сильних щурів-самців (Argiolas et al., 1988). Крім того, статева взаємодія підвищує ФОС, продукт гена безпосереднього раннього гена c-fos в паравентрикулярних окситоцинергічних нейронах, що проектуються на спинний мозок, залучений до контролю ерекції статевого члена (див. Witt and Insel, 1994 і посилання в ньому). Нарешті, сексуальна імпотенція (наприклад, нездатність дорослих самців щурів копулювати з рецепторами естроген-прогестероноподібної жінки)також асоціювалися у самців щурів з низьким рівнем мРНК окситоцину та синтази азотно-оксиду в паравентрикулярном ядрі гіпоталамуса (Benelli et al., 1995; Arletti et al., 1997) (для великого огляду цих досліджень див. Argiolas, 1999; Argiolas і Melis, 2004, 2005).
2.2. Вентральна тегментальная область
Вентральна тегментальная область була виявлена лише нещодавно як ділянку мозку, в якому окситоцин індукує ерекцію статевого члена. Ця область містить окситоцинергічні нервові закінчення, що походять з паравентрикулярного ядра і окситоцинових рецепторів (Freund-Mercier et al., 1987; Vaccari et al., 1998). Точніше, виявлено, що окситоцин здатний iерекція пеніса при односторонньому введенні в каудальний, але не в ростральний вентральний сегмент залежним від дози способом (Melis et al., 2007). Активні дози були вищими, ніж ті, які були потрібні при ін'єкції в паравентрикулярне ядро і подібні до тих, що викликали ерекцію статевого члена, коли їх вводили в вентральний сублікум гіпокампу або в постромедіальне кортикальне ядро мигдалини (див. Нижче). Очевидно, проеректильний ефект опосередковується активацією мезолімбічних допамінергічних нейронів, що проектуються до оболонки nucleus accumbens, що, в свою чергу, активує ще невідомі нейронні шляхи, що проектуються до нейронів, що опосередковують ерекцію статевого члена. (Melis et al., 2007, 2009a).
Що стосується механізму, за допомогою якого окситоцин активує дофамінергічну нейротрансмісію у вентральній тегментальній області, наявні дані свідчать про те, що Окситоцин стимулює окситоцинергічні рецептори, розташовані в клітинах органів мезолімбічних допамінергічних нейронів. Це збільшує приплив Ca2 + всередину клітинних тіл дофамінергічних нейронів, тим самим активуючи синтазу оксиду азоту (Succu et al., 2008). При відхиленні від паравентрикулярного ядра (див. Нижче розділ 3), оксид азоту, у свою чергу, активує гуанілатциклазу, отже, збільшуючи концентрацію циклічного GMP. Відповідно до цього механізму, або d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин, потужний антагоніст окситоцину, або S-метилтіо-l-цитрулін, потужний інгібітор синтази оксиду азоту нейронів, вводиться в каудальна вентральна тегментальная область перед окситоцином, скасована ерекція статевого члена і збільшення концентрації позаклітинного дофаміну в оболонці nucleus accumbens, індукованої окситоцином. Більш того, 8-бромциклічний GMP, активний резистентний до фосфодіестерази циклічний GMP аналог, індукує ерекцію статевого члена при введенні в каудальний вентральний тегментальний ділянку і підвищує концентрацію позаклітинного дофаміну в оболонці nucleus accumbens, як виявлено при введенні окситоцину каудальна вентральна тегментальна область (Succu et al., 2008; Melis et al., 2009a) (див. також Фіг. 2).
Завжди відповідно до цього механізму галоперидол, потужний антагоніст рецептора D2 допаміну, який вводиться в оболонку nucleus accumbens, зменшує ерекцію пеніса, індуковану окситоцином, що вводиться в область вентрального тегментала (Melis et al., 2007). Вищезгаданий механізм також підтверджується дослідженнями подвійної імунофлуоресценції, які показують, що волокна окситоцину потрапляють на клітинні тіла дофамінергічних нейронів каудального вентрального тегментального ділянки, які раніше мітили ретроградним індикатором Fluorogold, введеним в оболонку nucleus accumbens ( Melis et al., 2007, Succu et al., 2008). Активації цих дофамінергічних нейронів і дофамінових рецепторів в nucleus accumbens призводять, в свою чергу, до активації нервових шляхів, які ще не ідентифіковані, які стимулюють допамінергічні нейрони нейтронів до вивільнення дофаміну в паравентрикулярних ядрах, тим самим активуючи окситоцинергічні нейрони, що провокують спинний мозок і опосередковує ерекцію статевого члена (див. вище і Melis et al., 2007; Succu et al., 2007, 2008). Дійсно, окситоцин вводять в каудальну вентральну тегментальну ділянку при дозі, що індукує ерекцію статевого члена, підвищену екстраклітичну концентрацію допаміну в диализате, отриману не тільки з nucleus accumbens, але і з паравентрикулярного ядра (Succu et al., 2007).
2.3. Гіпокамп
Область CA1 гіпокампу була іншою областю головного мозку, багатою окситоцинергічними волокнами і рецептори, ідентифіковані раніше дослідженнями, в яких ін'єкція окситоцину індукувала ерекцію статевого члена (див. Bujis, 1978; Sofroniew, 1983). Проте, у відмінності від паравентрикулярного ядра, тут виявлено, що окситоцин здатний індукувати ерекцію статевого члена тільки при двосторонньому введенні і при більш високих дозах, ніж ті, що виявилися активними в паравентрикулярном ядрі (Melis et al., 1986; Chen et al., 1992). Ін'єкції окситоцину в сублікум були виявлені неактивними в цих попередніх дослідженнях. Однак останні і більш ретельні дослідження мікроін'єкцій призводять до ідентифікації a область вентрального сублікула в якій ін'єкція окситоцину була здатна індукувати ерекцію статевого члена залежним від дози способом (Melis et al., 2009b). Проеректильний ефект окситоцину, що вводиться в цю область мозку, спостерігався при дозах, аналогічних тим, що виявилися активними в вентральній ділянці після односторонньої ін'єкції (Melis et al., 2007), як було виявлено в паравентрикулярном ядрі. Мабуть, окситоцин, що вводиться в вентральний сублікул, індукує ерекцію статевого члена шляхом активації окситоцинергічних рецепторів у нейронах, що містять оксид-синтазу азоту, викликаючи збільшення виробництва оксиду азоту. Оксид азоту, у свою чергу, діючи як міжклітинний посланник, активує нейротрансмісію глутамінової кислоти, що призводить до ерекції статевого члена, можливо через нейронні (глутаматергічні) еферентні проекції з вентрального субликуля до зон гіппокампа, що модулюють активність мезолімбічних допамінергічних нейронів (наприклад, вентральна тегментальна область, префронтальна кора, паравентрикулярное ядро) (див. нижче і Melis, 2007, 2009b; Succu et al., 2008).
Цей механізм дії підтримується експериментами внутрішнього церебрального мікродіалізу, які показують, що окситоцин, який вводиться в вентральний сублікум в дозах, які індукують ерекцію статевого члена, підвищує продукування оксиду азоту і концентрацію позаклітинної глутамінової кислоти в диализате з вентрального субликула (Melis et al. , 2010) і позаклітинного допаміну в nucleus accumbens (Melis et al., 2007). Ці відповіді антагонізувалися не тільки антагоністом окситоцинового рецептора d (CH2) 5Tyr (Me) 2-Orn8-вазотоцину, але і інгібітором S-метилтіо-lcitrulline з синтазою оксиду азоту нейронів та даним гемоглобіном-поглиначем оксиду азоту у вентральний сублікум за кілька хвилин до окситоцину (Melis et al., 2010).
Більш того, відповідно до цього механізму дії, активація глутаматергічної нейротрансмісії NMDA, що вводиться в вентральний сублікум, індукує ерекцію статевого члена (Melis et al., 2010). Фенотип еферентних проекцій з вентрального сублікула, які викликають активацію мезолімбічних допамінергічних нейронів і збільшення надклітинного дофаміну в nucleus accumbens, в даний час невідомий. Однак, оскільки ерекція пеніса, індукована окситоцином, що вводиться в вентральний сублікум, відбувається одночасно із збільшенням надклітинної глутамінової кислоти в диализате з вентральної тегментальної області, але не з nucleus accumbens і антагонізується (+) МК-801, потужний неконкурентний антагоніст збуджуючих амінокислотних рецепторів підтипу NMDA (Woodruff et al., 1987), вводять в область вентрального тегментала, але не в nucleus accumbens (див. фіг. 2 і Melis et al., 2009b) , ймовірно, що ці прогнози призводять до активації глутаматергічної нейротрансмісії в вентральній тегментальній ділянці, яка в свою чергу активує мезолімбічні допамінергічні нейрони, що проектуються до nucleus accumbens. Чи не відомо, чи підвищена концентрація глутамінової кислоти, виявлена в вентральній тегментальній області після ін'єкції окситоцину в вентральний сублікум, виходить з нейронів, що походять з сублікулу або в інших областях мозку (наприклад, префронтальна кора). Тим не менш, це викликає активацію мезолімбічних допамінергічних нейронів і підвищений вивільнення допаміну в nucleus accumbens. При цьому активація дофамінових рецепторів призводить до активації интеро-гіпоталамічних допамінергічних нейронів, вивільнення дофаміну в паравентрикулярном ядрі, тим самим активуючи окситоцинергічні нейрони, що виступають на спинний мозок і опосередковуючи ерекцію пеніса. (див. вище і Melis et al., 2007, 2009a; Succu et al., 2008).
2.4. Мигдалини
Мигдалини - це інша область мозку, багата волокнами і рецепторами окситоцину (див. Freund-Mercier et al., 1987; Vaccari et al., 1998; Uhl-Bronner et al., 2005). Окситоцин тут, як вважають, бере участь у різних функціях, від анксиолиза, соціальної пам'яті та пізнання, соціально підсиленого навчання, емоційної емпатії, емоційної обробки обличчя та страху у людей до еректильної функції та сексуальної поведінки (див. Kondo et al., 1998; Dominguez et al., 2001; Ebner et al., 2005, Huber et al., 2005, Domes et al., 2007, Petrovic et al., 2008, Lee et al., 2009, Donaldson and Young, 2009, Hurlemann et al. , 2010). Однак здатність окситоцину індукувати ерекцію статевого члена у щурів-самців, коли індукована в постромедіальном кірковому ядрі мигдалини була виявлена лише нещодавно (Melis et al., 2009b). Ця реакція відбувалася одночасно зі збільшенням концентрації позаклітинного дофаміну в диализате, отриманому з оболонки nucleus accumbens, як було виявлено після ін'єкції окситоцину в вентральний сублікум (Melis et al., 2009b). На даний момент невідомий механізм, за допомогою якого окситоцин вводять в постромедіальне кортикальне ядро мигдалини. Наявні дані показують, що як ерекція статевого члена, так і збільшення позаклітинної концентрації дофаміну в диализате, отриманому з nucleus accumbens, опосередковуються активацією окситоцинергічних рецепторів, оскільки обидва відповіді скасовані антагоністом окситоцинового рецептора d (CH2) 5Tyr ( Me) 2-Orn8-вазотоцин вводять в ядро мигдалини за кілька хвилин до окситоцину (Melis et al., 2009b).
Незалежно від того, який механізм окситоцину активується в постромедіальном кірковому ядрі мигдалини, сексуальна реакція, викликана пептидом, скасовується блокадою всіх допамінергічних рецепторів з цис-флупентиксолом, введеним в оболонку nucleus accumbens і блокадою NMDA-рецепторів ( +) MK-801 вводять в область вентрального тегментала, але не в nucleus accumbens, як виявлено для ерекції статевого члена, індукованої окситоцином, що вводиться в вентральний сублікум (Melis et al., 2009b). Це свідчить про те, що окситоцин, що вводиться в постромедіальное ядро мигдалини, активує нейротрансмісію глутамінової кислоти у вентральній області. Це викликає в свою чергу активацію мезолімбічних допамінергічних нейронів, що призводить до ерекції статевого члена. З урахуванням досліджень, що показують нейронні шляхи, що з'єднують це ядро мигдалини з вентральним субликулом (Canteras et al., 1995; французький і Totterdell, 2003), ці висновки підвищують можливість існування взаємодії між цими двома ділянками мозку, хоча і безпосередньо описані шляхи від мигдалини до ядра accumbens або до вентральної тегментальної області (Kelley and Domesick, 1982; Witter, 2006).
2.5. Спинний мозок
Спинний мозок - ще одна область центральної нервової системи, яка містить окситоцинергічні волокна і рецептори (Freund-Mercier et al., 1987; Uhl-Bronner et al., 2005), в якій окситоцин індукує ерекцію статевого члена (Tang et al., 1998). Veronneau-Longueville et al., 1999, Giuliano і Rampin, 2000, Giuliano et al., 2001). Як згадувалося вище, ці окситоцинергічні волокна походять з паравентрикулярного ядра гіпоталамуса і сприяють низхідним шляхам, що контролюють спинальні вегетативні нейрони, що опосередковують ерекцію статевого члена. Дійсно, ці волокна роблять синаптичні контакти в доганальних рогових прегангліонарних симпатичних і парасимпатичних клітинних стовпцях в торако-поперековому і lumbo-sacral тракті з спинномозковими нейронами, іннервуючими кавернозні корпуси статевого члена (Marson і McKenna, 1996; Giuliano і Rampin, 2000; Giuliano et al. , 2001). Ці синаптичні контакти були продемонстровані шляхом маркування спинальних нейронів, що походять з статевого члена, і досягання спинного мозку за допомогою специфічних ретроградних маркерів, введених в кавернозні корпуси, в поєднанні з подвійними імунофлуоресцентними і конфокальними лазерними мікроскопічними дослідженнями (Tang et al., 1998; Veronneau-Longueville). et al., 1999). У відповідності з цими дослідженнями, у анестезованих самців щурів інтратекальна ін'єкція кумулятивних доз окситоцину на люмбо-крижовому, але не на торако-поперековому рівні, викликала інтракавернозний підвищення тиску залежно від дози. Ці ефекти були скасовані блокадою окситоцинергічного рецептора з d (CH2) 5Tyr (Me) 2-Orn8-вазотоцином і розділом тазових нервів (Giuliano і Rampin, 2000; Giuliano et al., 2001). Ці результати демонструють, що окситоцин, що діє на lumbo-sacral спинному мозку, підвищує внутрішньокавернозний тиск, і припускає, що окситоцин, що вивільняється під час фізіологічної активації паравентрикулярного ядра, є потужним активатором спинно-еректильних нейронів. Цікаво, що ці проеректильні спинномозкові нейрони, на яких окситоцин діє на проеректильну дію, також отримують синаптичні контакти від серотонінергічних нейронів, що походять з ядра paragigantocellularis ретикулярної формації довгастого мозку (Marson і McKenna, 1992; Tang et al. ., 1998). Руйнування цих серотонінергічних нейронів полегшує еякуляцію і рефлекси пеніса у самців щурів (Marson і McKenna, 1992; Yells et al., 1992). Оскільки препарати, що стимулюють рецептори 5HT2C, полегшують ерекцію статевого члена при внутрішньомозково-шлуночці, а не в паравентрикулярне ядро, і препарати, які блокують рецептори 5HT2C, зменшують також ерекцію пеніла, викликану антагоністами 5HT2C ( див. Stancampiano et al., 1994 і посилання в ньому), також було запропоновано, що окситоцин полегшує дію про-еректильних рецепторів 5HT2C на рівні lumbo-sacral спинного мозку (Stancampiano et al., 1994). Альтернативно, окситоцин може впливати на активність спинальних низхідних серотонінергічних нейронів, діючи безпосередньо в ядрі paragigantocellularis, де відбуваються ці нейрони (див. Stancampiano et al., 1994).
3. Взаємодії між окситоцином, дофаміном і глутаміновою кислотою в центральній нервовій системі і ерекції статевого члена
Як згадується в розділі 1, всі окситоцинергічні нейрони, присутні в центральній нервовій системі, походять з паравентрикулярного ядра і навколишніх структур. Активність цих нейронів знаходиться під контролем різних нейротрансмітерів та / або нейропептидів. Серед найбільш вивчених на паравентрикулярном рівні дофамін, глутамінова кислота, гамма-аміномасляна кислота (ГАМК), оксид азоту, ендоканабіноїди, опіоїдні пептиди, вивільняючі гормони пептиди, VGF-пов'язані пептиди і сам окситоцин. Допамін, глутамінова кислота, пептиди, що вивільняють гормон росту, пептиди, отримані з VGF, і окситоцин, є стимулюючими, наприклад, ці сполуки та їх агоністи полегшують ерекцію статевого члена при ін'єкції в паравентрикулярне ядро, тоді як GABA, опіоїдні пептиди і ендоканнабіноїди є інгібіторами, наприклад, ці сполуки або їх агоністи пригнічують ерекцію статевого члена (див. Meisel і Sachs, 1994; Witt and Insel, 1994; Argiolas і Melis, 1995, 2004, 2005; Giuliano і Rampin, 2000, 2004; McKenna, 2000; Andersson, 2001; Hull et al., 2002).
Кілька рядків експериментальних даних свідчать, що ці окситоцинергічні нейрони і вищевказані нейротрансмітери і нейропептиди беруть участь у контролі еректильної функції і сексуальної поведінки в різних фізіологічних контекстах. Більш того, окситоцин, що виділяється в позагипоталамических ділянках головного мозку, таких як вентральна тегментальна область, гіпокамп і його області, мигдалина і спинний мозок, можуть впливати на активність тих нейронів, на які потрапляють окситоцинергічні синапси. На даний момент єдиними нейронами, важливими для ерекції статевого члена, на які позначаються окситоцинергічні синапси, визначені з певністю, є тіла клітин мезолімбічних допамінергічних нейронів каудального вентрального тегментального ділянки, що проектуються до оболонки nucleus accumbens (Melis et al., 2007). Succu et al., 2008), а також проеректильні спинномозкові нейрони, що проектуються з люмбо-сакрального тракту до кавернозних корпусів (див. Giuliano and Rampin, 2000; Giuliano et al., 2001) (див. Також розділи 2.2 і 2.5) . Дійсно, хоча окситоцинергічні синапси і рецептори також були ідентифіковані в вентральному сублікулі, мигдалині та спинному мозку, області, які є важливими для ерекції статевого члена (див. Вище), у цих областях тип нейротрансмітера / ів, присутній у нейронах які окситоцинергічні нервові закінчення вдаються, ще невідомі.
У цьому розділі коротко викладено недавню літературу про механізми, що лежать в основі проеректильного ефекту окситоцину, що вводиться в каудальний вентральний сегмент, вентральний сублікум гіпокампу і в спинний мозок. Особлива увага приділяється взаємодії пептиду з дофаміном і глутаміновою кислотою в цих областях і від ролі, яку ця взаємодія може грати в центральному контролі еректильної функції. Насамперед наводиться короткий огляд впливу дофаміну і глутамінової кислоти на окситоцинергічні нейрони в паравентрикулярном ядрі, які також відіграють ключову роль у еректильній функції, з тим, щоб зробити читачем свідомість раннього стану досліджень у цій галузі, ці дослідження вже були широко розглянуті (див. Argiolas і Melis, 1995, 2004, 2005; Melis і Argiolas, 2003). Також у цьому випадку особлива увага приділяється останнім результатам, які свідчать про важливу роль як для допамін-окситоцинового ланки, так і для глутамінової кислоти-окситоцинової ланки не тільки в сексуальній діяльності (ерекція статевого члена і копуляція), але й у статевій діяльності збудження і сексуальна мотивація.
3.1. Взаємодія допамін-окситоцину в паравентрикулярном ядрі
Команда здатність допамінових агоністів індукувати ерекцію статевого члена шляхом активації центральних окситоцинергічних нейронів було запропоновано відразу ж після виявлення, що апоморфін індукує ерекцію статевого члена при ін'єкції в паравентрикулярне ядро (Melis et al., 1987), коли був знайдений антагоніст окситоцинового рецептора d (CH2) 5Tyr (Me) 2-Orn8-вазотоцину, ін'єктований (icv). здатні знизити майже повністю ерекцію статевого члена, індуковане не тільки окситоцином, що надається icv, але і апоморфіном, що надається підшкірно (Argiolas et al., 1987b). Ці результати супроводжувалися результатами інших досліджень, які показували подібні результати, коли d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин був наданий icv і апоморфін подавали безпосередньо в паравентрикулярне ядро (Melis et al., 1989b), lприпускаючи, що агоністи дофаміну індукують ерекцію статевого члена шляхом активації паравентрикулярних окситоцинергічних нейронів, що проеціюються в позагипоталамические ділянки головного мозку і, зокрема, в спинний мозок (див. Argiolas і Melis, 1995, 2004, 2005). Відповідно до цієї гіпотези, у анестезованих щурів нещодавно було виявлено блокаду lumbo-sacral окситоцинергічних рецепторів антагоністом непептидного окситоцинового рецептора, здатним знищити індукований апоморфіном підвищення внутрішньокавернозного тиску, індукованого агоністом допаміну апоморфіном, надаючи докази paraventriculo-спинальний окситоцинергічний шлях, що бере участь в ерекції статевого члена (Baskerville et al., 2009).
Дослідження спрямовані на виявлення дофамінового рецептора, відповідального за індукцію ерекції статевого члена, виявило, що і в паравентрикулярном ядрі агоністи дофамінових рецепторів індукують ерекцію статевого члена, діючи на дофамінові рецептори родини D2як встановлено з агоністами дофамінових рецепторів, наведених системно (див. Melis et al., 1987; Eaton et al., 1991; Melis and Argiolas, 1995a). Відповідно, виявлено, що апоморфін, потужний змішаний агоніст D1 / D2 рецептора і хіпінрол, потужний агоніст селективного D2рецептора, але не SKF 38393, агоніст селективного рецептора D1, який вводиться в це ядро гіпоталамусу. і сексуальна реакція, індукована цими агоністами рецептора D2, була скасована антагоністами рецепторів D2, такими як галоперидол і l-сульпірид, але не за допомогою SCH 23390, селективного антагоніста рецептора D1 (Melis et al., 1987). Здатність апоморфіну індукувати ерекцію статевого члена при ін'єкції в паравентрикулярне ядро також підтверджується телеметричними дослідженнями, які показують, що агоніст допаміну, що вводиться в паравентрикулярне ядро, здатний підвищувати внутрішньокавернозний тиск у щурів, що не спали, без зміни системного артеріального тиску (Chen et al. , 1999, Giuliano і Allard, 2001), як виявлено після системної ін'єкції (Bernabè et al., 1999). Ці дослідження також підтвердили головну роль рецепторів D2, оскільки агоністи рецепторів D1 зазвичай виявилися нездатними збільшити внутрішньокавернозний тиск при введенні в паравентрикулярне ядро (Chen et al., 1999).
Було отримано кілька рядків експериментальних даних, які свідчать про те, що паравентрикулярні рецептори D2, стимулювання яких викликає ерекцію статевого члена, розташовані на клітинах тіл окситоцинергічних нейронів. По-перше, паравентрикулярне ядро містить дофамінергічні нервові термінали, які належать до так званих "інерто-гіпаталамічних" допамінергічних нейронів. Клітинні тіла цих нейронів розташовані в групі A13 і A14 Dahlstrom і Fuxe (1964) широко розгортають і іннервують кілька гіпоталамусних структур, включаючи паравентрикулярні окситоцинергічні нейрони, що проектуються на нейрогіпофіз та / або в позагипоталамические ділянки мозку (Buijs et al., 1984; Lindvall et al., 1984).
Участь цих допамінергічних нейронів на паравентрикулярному рівні в контролі ерекції статевого члена і копуляції підтверджується дослідженнями мікродіалізу, які показують, що концентрації позаклітинного дофаміну і 3,4-дигідроксифенилуксусной кислоти (DOPAC), його основного метаболіту, збільшуються в діалізаті, отриманому з паравентрикулярное ядро щурів-сексуально потужних самців, які показують безконтактні ерекції, коли їх вводять у присутності недоступної овариэктомированной рецепторної жінки з естроген + прогестерон (Melis et al., 2003).
Збільшення концентрацій дофаміну та DOPAC було навіть вище, коли дозволялося копуляція з рецептивною жінкою (Melis et al., 2003), як виявлено в медіальній преоптичній області (Hull et al., 1995) і в nucleus accumbens (Pfaus). і Everitt, 1995). По-друге, кілька досліджень показують, що ерекція пеніса, викликана стимуляцією паравентрикулярних рецепторів D2, опосередковується окситоцином, що виділяється в цих областях. Відповідно, виявлено, що апоморфін, що вводиться в дозах, які індукують ерекцію статевого члена, може підвищити концентрацію окситоцину не тільки в плазмі щурів і мавп (Melis et al., 1989a; Cameron et al., 1992), але також і в позагипоталамическом мозку ділянки, такі як гіпокамп (Melis et al., 1990). Відповідно до цих результатів, недавно було показано, що апоморфін, введений в паравентрикулярне ядро в дозі, що індукує ерекцію статевого члена, здатний збільшити також позаклітинні концентрації дофаміну в nucleus accumbens, ефект, зменшений антагоністом окситоцинового рецептора d (CH2). 5Tyr (Me) 2-Orn8-вазотоцин вводять в область вентрального тегментала (Succu et al., 2007; Melis et al., 2009a) (див. Також розділ 4). По-третє, двосторонні електролітичні ураження паравентрикулярного ядра, які майже повністю виключають окситоцин з позагіпоталамічних ділянок головного мозку (Hawthorn et al., 1985), скасовують індуковану апоморфіном ерекцію статевого члена (Argiolas et al., 1987a) і селективні антагоністи окситоцинових рецепторів. вводять в латеральні шлуночки, але не в паравентрикулярне ядро, зменшують дозозалежну апоморфінову індуковану пенильную ерекцію з потенцією, паралельною до такої сполуки при блокуванні окситоцинових рецепторів (Melis et al., 1989b). Антагоністи рецепторів окситоцину також є надзвичайно сильними для зменшення полегшення сексуальної поведінки чоловіків, індукованого не тільки окситоцином, але і апоморфіном (Argiolas et al., 1988, 1989).
Що стосується механізму, за допомогою якого рецептори D2 активуються допаміном або агоністами дофамінових рецепторів, то підвищується активність окситоцинергічних нейронів, тим самим вивільняючи окситоцин у екстраготаламічних ділянках мозку і в спинному мозку, численні експериментальні дані.Підтверджують гіпотезу про те, що стимуляція рецепторів D2 збільшує концентрацію внутрішньоклітинних іонів Ca2 + всередині клітин тіла окситоцинергічних нейронів, що призводить до активації синтази оксиду азоту, Ca2 + -калмодулин-залежний фермент, який присутній в цих клітинних тілах (Vincent і Kimura, 1992; Torres et al., 1993; Sanchez et al., 1994; Sato-Suzuki et al., 1998). Підвищена продукція оксиду азоту викликає в свою чергу активацію окситоцинергічних нейронів. Відповідно, (1) ерекція, викликана апоморфіном, була запобігана органічними блокаторами кальцієвих каналів і by_-конотоксином GVIA, потужним і селективним блокатором залежних від напруги каналів Ca2 + N-типу (McCleskey et al., 1987), поданих у паравентрикулярний ядра (див. Argiolas et al., 1990 і посилання в ньому); (2) індуковані апоморфіном ерекцію пеніса запобігали інгібітори синтази оксиду азоту, введені в паравентрикулярне ядро (Melis et al., 1994c); і (3) апоморфін та інші агоністи рецепторів D2, що вводяться в дозах, які індукують ерекцію статевого члена, підвищили виробництво оксиду азоту в паравентрикулярному диализате, отриманому при внутрішньо-мозковому мікродіалізі, що було зменшено за рахунок інгібіторів паравентрикулярної синтази оксиду азоту. Рецептор агоніста D2 індукований ерекцією пеніса (Melis et al., 1996). Механізм, за допомогою якого оксид азоту активує паравентрикулярні окситоцинергічні нейрони, поки що невідомий, хоча наявні дані свідчать про те, що оксид азоту діє як внутрішньоклітинний месенджер, і ця гуанілатциклаза не бере участь. Дійсно, активний аналог фосфодіестерази, стійкий до циклічного GMP, 8-бромциклічний GMP, виявився нездатним індукувати ерекцію статевого члена, коли його вводили в паравентрикулярне ядро (мал. 2) (див. Melis і Argiolas, 1995b і посилання в ньому).
Вищенаведене тлумачення часто вважалося непереконливим, головним чином тому, що стимуляція рецепторів D2 дофаміну зазвичай пов'язана з інгібуванням, а не збудженням клітинних тіл нейронів, що містять ці рецептори, через різні механізми, пов'язані з G-білком (див. Sokoloff і Schwartz, 1995). Проте, можливе пояснення цього розбіжності, яке відповідає прямому стимулюванню паравентрикулярних окситоцинергічних нейронів дофаміном, було запропоновано нещодавно відкриттям G білок-зв'язаний дофамін D4 рецептор, член сімейства рецепторів D2 (D2, D3 і D4), стимуляція якого збільшує приплив Ca2 + в клітинні препарати, що містять клоновані версії цього підтипу рецепторів (Moreland et al., 2004). Більш важливим є те, що селективний агоніст рецептора D4 (наприклад, ABT 724) (N-метил-4- (2-ціанофеніл) піперазиніл-3methylbenzamide малеат) виявився здатним індукувати ерекцію статевого члена у самців щурів при системному введенні (Brioni et al., 2004). Цей ефект не був виявлений при селективному агоністі рецептора D2 підтипу PNU-95666E (R-5,6-дигідро-N, N-диметил-4Himidazo [4,5,1-i] хінолін-5-амін) (Hsieh et al., 2004), також не вдалося збільшити приплив Ca2 + в клітинні препарати, що містять клоновану версію підтипу рецептора D4 (Brioni et al., 2004; Moreland et al., 2004). Відповідно до наведеної вище гіпотези та висновків, PD 168,077 (N-метил-4- (2-цианофенил) піперазиніл-3methylbenzamide малеат), PIP-3EA (2- [4- (2-метоксифенил) піперазин-1-ілметил] imidazo [1,2-a] піридин) та інші селективні агоністи D4-рецепторів (Heier et al., 1997; Melis et al., 2006b; Löber et al., 2009) виявили здатні індукувати ерекцію статевого члена при введенні системно, icv і паравентрикулярне ядро, хоча менш ефективно, ніж апоморфін. Проеректильний ефект цих агоністів рецепторів D4 запобігали L-745,870 (3- (4- [хлорфеніл] піперазин-1-іл) -метил-1H-пирроло [2,3-B] піридин тригідрохлорид), селективний D4 рецептор антагоніст (Patel et al., 1997; Melis et al., 2005, 2006b; Löber et al., 2009).
Нарешті, проеректильний ефект вищевказаних агоністів рецепторів D4 також був знижений інгібіторами синтази оксиду азоту, що вводяться в паравентрикулярне ядро, і d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин, селективний антагоніст окситоцинових рецепторів. дано icv, але не в паравентрикулярном ядрі. Ці результати узгоджуються з гіпотезою, що агоністи рецепторів D4 також стимулюють окситоцинергічні нейрони за допомогою активації синтази оксиду азоту і вивільнення окситоцину в ділянках головного мозку, що в свою чергу полегшує ерекцію пеніса, як показано для апоморфіну і класичних агоністів D2 (Melis et al. ., 2005, 2006b, Löber et al., 2009).
Вищенаведені висновки також підтверджують гіпотезу про те, що допамін індукує ерекцію статевого члена, діючи на рецептори D4, розташовані на клітинних телах паравентрикулярних окситоцинергічних нейронів, які викликають збільшення припливу Ca2 + до клітинних тіл окситоцинергічних нейронів, що призводить до збільшення виробництва оксиду азоту. Оксид азоту, у свою чергу, активує окситоцинергічні нейрони для вивільнення окситоцину в позагипоталамических областях головного мозку і в спинному мозку, як вже обговорювалося. Щодо цього, Примітно, що дофамінові рецептори були виявлені в клітинних тілах окситоцинергічних нейронів в паравентрикулярном ядрі лише недавно за допомогою досліджень з подвійною імунофлуоресценцією з високим селективним антитілом до рецепторів D2, D3 і D4 і з антитілами до окситоцину. Ці дослідження показали експресію всіх трьох підтипів D2рецептора (D2, D3 і D4), які локалізуються окремо в клітинних тілах окситоцинергічних нейронів в паравентрикулярном ядрі (а також в надоптичних ядрах і медіальній зоні преоптики) (Baskerville). і Douglas, 2008, Baskerville et al., 2009).
Це забезпечує сильну нейроанатомічну підтримку можливості, що агоністи дофамінових і дофамінових рецепторів типу D2 індукують ерекцію статевого члена шляхом активації безпосередньо окситоцинергічних нейронів, що проеціюються в екстраготаламічні області мозку, згадані вище, наприклад, спинний мозок, вентральна тегментальна область, гіпокамп і мигдалина. Однак ці дані не надають ніякої допомоги для ідентифікації підтипу рецепторів D2, стимулювання яких викликає еректильну реакцію. На жаль, не можна отримати допомоги навіть від досліджень, спрямованих на виявлення окситоцинергічних нейронів, активованих агоністами дофамінових рецепторів в паравентрикулярном ядрі. Дійсно, незважаючи на різну активність на різних підтипах рецепторів допаміну, або змішані агоністи дофамінових рецепторів (наприклад, апоморфін), або селективні агоністи D2 рецепторів (наприклад, хіппірол, який діє на всі підтипи рецепторів D2) або селективні агоністи рецепторів D4 активація окситоцинергічних нейронів, виміряна збільшенням FOS-білка в паркоцелюлярних окситоцинергічних нейронах паравентрикулярного ядра (Bitner et al., 2006). Однак, цей висновок був недавно поставлений під сумнів, оскільки збільшення FOS білка в паравентрикулярних окситоцинергічних нейронах було знайдено тільки тоді, коли ерикція пеніса була викликана хінероланом, який діє головним чином на підтипи рецепторів D2 і D3, але не на PD 168077, агоніст D4 рецептора, незважаючи на здатність обох сполук індукувати сексуальну реакцію (Baskerville et al., 2009).
Подальші експерименти з селективними агоністами інших підтипів рецепторів D2 (головним чином D2 і D3) є необхідними для визначення точної ролі кожного підтипу допамінових рецепторів у контролі еректильної функції на паравентрикулярном рівні. У цьому відношенні, як вже згадувалося раніше, апоморфін, який діє потужно на всіх підтипах дофамінових рецепторів (див. Brioni et al., 2004 і посилання в ньому), є набагато більш ефективним, ніж агоністи рецепторів D4 при індукції ерекції статевого члена при введенні в паравентрикулярний ядра. Це можна пояснити більш високою спорідненістю апоморфіну до рецепторів D4 у порівнянні з агоністами тестованих рецепторів D4 або, альтернативно, агоністами рецепторів D4 можуть діяти як часткові агоністи рецептора D4, або супутня активація різних підтипів дофамінових рецепторів виробляють більш високу активацію окситоцинергічних нейронів, що опосередковують ерекцію пеніса, ніж тільки активацію агоністами рецепторів D2 підтипу рецептора D4.
Взаємодії між дофаміновими рецепторами D1 і D2 вже описані в контролі за статевою поведінкою на рівні медіальної преоптической області (див. Hull et al., 1989). У випадку, якщо нездатність селективних агоністів рецепторів D2 індукувати ерекцію статевого члена (Hsieh et al., 2004) буде підтверджено (але див. Depoortère et al., 2009), наприклад, навіть після введення цих сполук у паравентрикулярне ядро головну роль для D3 рецепторів самостійно або разом з рецепторами D4 в активації окситоцинергічних нейронів, що опосередковують ерекцію статевого члена, слід детально проаналізувати (див. Baskerville et al., 2009). На жаль, селективні агоністи рецепторів D2 і D3 (наприклад, які відрізняються за спорідненістю до цих двох підтипів рецепторів щонайменше чотири / п'ять порядків in vitro) недоступні на даний момент. З цієї причини нещодавнє припущення, що рецептори D3 опосередковують ерекцію пеніса, індуковане класичними агоністами рецепторів D2, що базується головним чином на здатності передбачуваних антагоністів рецепторів D3, що характеризуються в експериментах in vitro, для зменшення ерекції пеніса, індукованого класичними агоністами D2, такими як апоморфін, хінпірол і праміпексол, які сильно активують всі підтипи дофамінових рецепторів D2 (Collins et al., 2009), повинні бути підтверджені іншими експериментами. Ця перевірка необхідна також тому, що в даному дослідженні не було виявлено ніякого впливу агоністів рецепторів D4 на ерекцію статевого члена, що є яскравим контрастом з результатами вищенаведених досліджень, які демонструють проеректильний ефект агоністів рецепторів D4. Дійсно, навіть здатність апоморфіну індукувати ерекцію пеніса (і позіхання) у мишей з нокаутом рецептора D4 з потенцією, ідентичною тій, що спостерігається у мишей, що нокаутують рецептори D4 дикого типу, і здатність антагоністів рецепторів D3 скасувати відповідь на апоморфін у цих тварин ( Collins et al., 2009) не може розглядатися як остаточне доказ селективної ролі підтипу рецепторів D3 в індукованій ерекцією пеніса рецептора D2. Відмінності між різними видами, дослідження з абляцією генів нейротрансмітер / нейропептид та / або нейромедіатор / нейропептид (нейротрансмітер / нейропептид та / або тварини нокаутного рецептора нейромедіатора / нейропептиду), як правило, додавали додаткову плутанину та ускладнення для підтвердження передбачуваної сексуальної ролі нейромедіаторів та / або нейропептиди та їх рецептори. Зокрема, абляція гена окситоцину продукує окситоцину, що вибиває мишей, які спаровуються і копулюють нормально, як якщо б окситоцин не був необхідним для спаровування і копуляції. Також гомозиготні жіночі миші з нокаутом окситоцину показують нормальне спаровування і родовий процес, хоча і з вираженим порушенням зупинки молока (Nishimori et al., 1996; Young et al., 1996). Абляція гена, що кодує нейрональну синтазу оксиду азоту, також продукує синтазу оксиду азоту, вибиваючи мишей, які спаровуються і копулюють нормально (Huang et al., 1993). Однак ці дані, ймовірно, вказують на важливу особливість репродуктивної фізіології, тобто надмірність систем, залучених до її контролю на центральному і периферійному рівні.
Така надлишковість, безумовно, має еволюційне походження, оскільки гарантує проходження генів до наступного покоління для виживання виду. Тому той факт, що абляція гена рецептора D4 не змінює проеректильного ефекту апоморфіну, дозволяє припустити, що рецептори D4, такі як окситоцин і оксид азоту, є лише кількома медіаторами, що працюють у системах контролю еректильної функції, а не припускаючи, що для цих рецепторів немає ніякої ролі у контролі ерекції статевого члена і сексуальної поведінки. Нездатність агоністів D4 індукувати ерекцію статевого члена при системному введенні щурам-самцям різних штамів нещодавно повідомлялася в іншому дослідженні (Depoortère et al., 2009). Однак, на відміну від роботи Collins et al. (2009), і щоб зробити картину про роль різних підтипів рецепторів D2 у контролі ерекції статевого члена ще більш загадковою, це дослідження також показує, що передбачувані селективні антагоністи рецепторів D3, що даються системно, не змогли зменшити індуковану апоморфіном ерекцію статевого члена в самці щурів штаму більш чутливі до проеректильного ефекту апоморфіну, в той час як статева реакція (і позіхання) антагонізувалася селективним антагоністом D2 L-741,626 (3 - [[4- (4-хлорфеніл) -4-гидроксипиперидин -1-іл] метил-1H-індол), що приводить авторів до припущення, що рецептори D2, а не D3 і D4 рецептори, є тими, що відіграють основну роль в ерекції індукованої пенісом агоніста D2 (Depoortère et al., 2009). Нарешті, можливість того, що збуджуючий ефект агоністів дофамінових рецепторів на окситоцинергічні нейрони, що опосередковують ерекцію статевого члена, щонайменше частково, є непрямим, а не прямим, наприклад, опосередкованим або під впливом змін активності інших нейромедиаторів нейропептидів, здатних модулювати активність Окситоцинергічні нейрони в паравентрикулярном ядрі не можуть бути повністю виключені.
3.2. Взаємодія глутамінової кислоти з окситоцином в паравентрикулярном ядрі
Паравентрикулярне ядро гіпоталамуса дуже багате синапсами, що містять збудливу амінокислоту як нейромедіатора (наприклад, глутамінову кислоту і аспарагінову кислоту).) (Van Den Pol, 1991). Збудливі амінокислоти в цьому ядрі беруть участь у численних функціях, включаючи ерекцію статевого члена і сексуальну поведінку (Roeling et al., 1991; Melis et al., 1994b, 2000, 2004b). Відповідно, N-метил-d-аспарагінова кислота (NMDA), селективний агоніст підтипу рецептора NMDA, але не (±) -_-аміно-3-гідрокси-5-метил-изоксазол-4-пропіонова кислота (АМРА) Виявлено, що селективний агоніст підтипу рецептора АМРА або (±) -транс (1) -аміно-ХНУМХ-циклопентандикарбоновая кислота (АКПД), селективний агоніст підтипу метаботропних рецепторів, здатний індукувати ерекцію статевого члена при введенні в паравентрикулярное ядро вільно рухаються щурів (Melis et al., 1,3b). Про-еректильний ефект 1994 MR Melis, A. Argiolas / Neuroscience і Biobehavioral Reviews 948 (35) 2011-939 NMDA запобігали (+) МК-ХНУМКС, неконкурентним антагоністом NMDA рецептора (Woodruff et al., 955). ), вводяться в паравентрикулярне ядро (Melis et al., 801b). Відповідно до цих результатів, в дослідженнях телеметрії, спрямованих на моніторинг внутрішньокавернозного тиску, NMDA виявився набагато більш активним, ніж агоністи інших підтипів рецепторів збудливих амінокислот при ін'єкції в паравентрикулярне ядро при збільшенні внутрішньокавернозного тиску у щурів, що спали, або анестезії (Zahran et і ін., 1987, Chen і Chang, 1994).
Як було запропоновано вище для окситоцину і допаміну, ймовірно, що NMDA-рецептори, що опосередковують ерекцію пеніса, розташовані в клітинних тілах окситоцинергічних нейронів, оскільки нервові закінчення збудливих амінокислот потрапляють на тіла окситоцинергічних клітин в паравентрикулярном ядрі (Van Den Pol, 1991). Аналогічно тому, що було виявлено з агоністами дофамінових рецепторів, проеректильний ефект NMDA, очевидно, опосередкований активацією окситоцинергічної нейротрансмісії, яка відміняється антагоністом окситоцину d (CH2) 5Tyr (Me) 2-Orn8-вазотоцином, не в паравентрикулярне ядро (див. Argiolas і Melis, 1995, 2004, 2005 і посилання в ньому). Аналогічно, індукована NMDA активація окситоцинергічної нейротрансмісії також є вторинною по відношенню до активації синтази оксиду азоту, оскільки NMDA-індукована ерекція пеніса запобігається інгібіторами синтази оксиду азоту (N-Nitro-N-метил-аргініновий метиловий ефір і N- метил-тіо-l-цитрулін), що подається в паравентрикулярне ядро, і NMDA, що вводиться в паравентрикулярне ядро при дозах, які індукують ерекцію статевого члена, збільшує виробництво оксиду азоту в ядрі гіпоталамусу (див. Argiolas і Melis, 1995, 2004, 2005 і посилання в ньому ). Що стосується агоністів дофамінових рецепторів, то індукована NMDA активація оксидисинтази азоту може бути також вторинною по відношенню до підвищеного припливу Ca2 + в окситоцинергічні клітинні тіла через Ca2 + каналові NMDA-рецептори, як показано в декількох нейронних препаратах (для огляду див. Snyder, 1992; Southam і Garthwaite, 1993, Schuman і Madison, 1994 і посилання в ньому). Оксид азоту в свою чергу активує окситоцинергічну нейротрансмісію (див. Вище). Походження глутаматергічних прогнозів, які активують паравентрикулярні окситоцинергічні нейрони, що опосередковують ерекцію статевого члена, невідомі, хоча деякі нейроанатомічні та електрофізіологічні дані свідчать про те, що вони можуть виникнути, принаймні частково, в гіпокампі (Saphier і Feldman, 1987; Chen et al., 1992). . Хоча необхідна подальша робота, щоб краще охарактеризувати походження глутаматергічних проекцій до паравентрикулярного ядра, участь глутамінової кислоти в паравентрикулярном ядрі в контролі ерекції статевого члена і сексуальної поведінки чітко підтверджується дослідженнями мікродіалізу. Відповідно, позаклітинні концентрації глутамінової кислоти та аспарагінової кислоти збільшувалися в диализате, отриманому з паравентрикулярного ядра щурів-самців, що показали безконтактні ерекції при наявності недоступних естроген + прогестеронів рецептивних жіночих щурів (Melis et al., 2004b), ерекції статевого члена, які також опосередковуються активацією центральної окситоцинергічної передачі (Melis et al., 1999a, b). Таке збільшення було виявлено навіть вище, коли дозволялося копуляція з сприйнятливою самкою (Melis et al., 2004a). Відповідно до гіпотези про те, що підвищена активність збудливих амінокислот відбувається в паравентрикулярном ядрі під час ерекції статевого члена і копуляції, як безконтактні ерекції, так і копуляторна поведінка (під час яких відбувається ерекція пениса) зменшуються блокадою NMDA-рецепторів в паравентрикулярном ядрі. і це зниження супроводжується зменшенням збільшення продукції оксиду азоту, що відбувається в цьому ядрі гіпоталамуса в цих фізіологічних контекстах (Melis et al., 2000). Збільшення концентрації позаклітинної глутамінової кислоти вторинної по відношенню до зниженого вивільнення ГАМК з ГАМКергічних нервових закінчень, що впливає на збуджуючі амінокислотні синапси, розташовані одночасно з окситоцинергічними клітинами, також було виявлено після блокади рецепторів каннабіноїдних CB1 антагоністом CB1 SR 141761A, вводять в бічні шлуночки або безпосередньо в паравентрикулярне ядро при дозах, які індукують ерекцію статевого члена (див. Succu et al., 2006; Castelli et al., 2007). Таке збільшення призвело до активації оксиду азоту-синтази в клітинні тіла окситоцинергічних нейронів, збільшивши виробництво оксиду азоту. Оксид азоту, у свою чергу, активує окситоцинергічні нейрони, опосередковуючи ерекцію статевого члена, як описано вище. Відповідно до такого механізму, ерекція пеніса, індукована СР 141761A, була зменшена блокадою NMDA-рецепторів і інгібіторами оксиду-оксиду азоту, але не блокадою рецепторів дофаміну або окситоцину в паравентрикулярном ядрі, а блокування центральні окситоцинові рецептори антагоністами окситоцинового рецептора, отримані з icv
3.3. Окситоцин-дофамінова взаємодія в вентральній тегментальной області
Окситоцин індукує ерекцію статевого члена при введенні в каудальну частину вентрального тегментального ділянки дозозалежним чином (Melis et al., 2007). Найменшою активною дозою, введеною в односторонньому порядку, був 20 нг, у той час як найвища досліджувана доза була 100 нг. Ефект окситоцину опосередковується активацією окситоцинергічних рецепторів, оскільки сексуальна відповідь скасовується попередньою ін'єкцією антагоніста окситоцину d (CH2) 5Tyr (Me) 2-Orn8-вазотоцину в каудальній вентральній області. Ці рецептори локалізовані в клітинах органів дофамінергічних нейронів, які проектуються переважно до оболонки nucleus accumbens. Відповідно, дослідження (1) з подвійною імунофлуоресценцією показують, що в каудальній вентральній тегментальной області окситоцинергічні волокна знаходяться в тісному контакті з клітинами тіл дофамінергічних нейронів, більшість з яких були позитивно мічені тирозин-гидроксилазой і містять ретроградний індикатор Fluorogold. ін'єктується в оболонку nucleus accumbens (Melis et al., 2007), і (2) вентральна тегментальная зона, індукована окситоцином ерекція пеніса, відбувається одночасно зі збільшенням концентрації позаклітинного дофаміну в диализате, отриманому з оболонки nucleus accumbens (Melis et al., 2007). Індукована окситоцином ерекція пеніса також відбувається одночасно із збільшенням продукції оксиду азоту в вентральній тегментальной області, оскільки обидві відповіді антагонізуються не тільки d (CH2) 5Tyr (Me) 2-Orn8-вазотоцином, але і інгібітором S-синтази азоту метил-тіо-1-цитрулін, а також _-конотоксин, залежний від напруги Ca2 + блокатор каналів, а також ODQ (1H- [1,2,4] оксадиазол [4,3-a] хиноксалин-1-один), потужний інгібітор гуанілату циклази, всі дані в каудальній вентральній тегментальной області перед окситоцином (Succu et al., 2008). Оскільки багато з меченних Fluorogold допамінергічних клітинних тіл, з якими контактували окситоцинергічні волокна, виявилися позитивними для тирозингидроксилази в каудальній вентральній тегментальній ділянці, також позитивно позначені для синтази азотної синтази та гуанілатциклази (Succu et al., 2008), окситоцин. ерекція пеніса може бути опосередкована наступним механізмом. Активація окситоцинергічних рецепторів в дофамінергічних клітинних тілах пептидом збільшує приплив Ca2 + в клітинні тіла дофамінергічних нейронів. Це активує синтазу оксиду азоту, Ca2 + -калмодулін-залежний фермент, що збільшує виробництво оксиду азоту. Оксид азоту в свою чергу активує гуанилатциклазу, що призводить до підвищеної концентрації циклічного GMP. Циклічний GMP активує дофамінергічні нейрони, що проектуються до nucleus accumbens. Роль циклічного GMP в ерекції статевого члена, індукованої окситоцином, введеним в каудальний вентральний сегмент, також підтверджується здатністю 8-бромоциклічного GMP, активного резистентного до фосфодіестеразу аналога циклічного GMP, індукувати ерекцію статевого члена при введенні каудальної вентральної тегментальной області, а також для збільшення надклітинного дофаміну в диализате з nucleus accumbens (Succu et al., 2008; Melis et al., 2009a). Це розходиться з механізмом, за допомогою якого оксид азоту активує окситоцинергічні нейрони в паравентрикулярному ядрі, будучи бромциклічним ГМП 8, який не може індукувати ерекцію статевого члена при введенні в це ядро (Melis і Argiolas, 1995b) (рис. 2). Що стосується нервових шляхів, що активуються дофаміном у ядрі accumbens, що призводить до ерекції статевого члена, то вони поки невідомі. Проте наявні дані свідчать про те, що ці шляхи активують нейротрансмісію дофаміну в паравентрикулярном ядрі гіпоталамуса. Відповідно, індукована окситоцином ерекція пеніса відбувається одночасно із збільшенням позаклітинного дофаміну не тільки в nucleus accumbens, але також і в паравентрикулярном ядрі, і антагонізується антагоністом галоперидолу рецептора дофаміну, введеного в паравентрикулярне ядро (Melis et al., 2007). AЦі результати підтверджують ідею, що окситоцинергічні нейрони, що походять з паравентрикулярного ядра і проеціюються в каудальний вентральний сегмент, активуючи окситоцин в цій області, тим самим активуючи NO-циклічну систему сигналізації GMP, що в свою чергу активує мезолімбічні допамінергічні нейрони (Melis et al., 2007, 2009a; Succu et al., 2008). Допамін, що виділяється в nucleus accumbens, в свою чергу, активує нервові шляхи, що призводять до активації допамінергічних нейронів, що стимулюють паравентрикулярні окситоцинергічні нейрони, що виступають на спинний мозок, що сприяє ерекції статевого члена. У той же час, дофамін, що виділяється в паравентрикулярном ядрі, також може активувати окситоцинергічні нейрони, що проеціюються в позагипоталамические ділянки головного мозку, такі як вентральна тегментальна область, гіпокамп, мигдалина і, можливо, інші області мозку.
Як нагадувалося вище, відповідно до цієї гіпотези, апоморфін, введений в паравентрикулярне ядро в дозі, що індукує ерекцію статевого члена, також підвищує концентрацію позаклітинного дофаміну в nucleus accumbens, ефект, зменшений антагоністом окситоцинового рецептора d (CH2) 5Tyr (Me ) 2-Orn8-вазотоцин вводять в область вентрального тегментала (Succu et al., 2007; Melis et al., 2009a). Разом вищевказані нейронні шляхи можуть являти собою гіпотетичні нейронні схеми, що включають допамін, окситоцин та інші нейротрансмітери (наприклад, глутамінову кислоту, див. Нижче), що впливають не тільки на сексуальну діяльність, але й на сексуальну мотивацію та сексуальне задоволення (див. розділ 4).
3.4. Взаємодія окситоцин-глутамінової кислоти в вентральному субликуле гіпокампу
Окситоцин індукує ерекцію статевого члена при введенні в вентраль, але не в дорзальний сублікум, залежним від дози (Melis et al., 2009b). Статевий відповідь опосередковується стимуляцією окситоцинових рецепторів, які скасовуються попередньою ін'єкцією d (CH2) 5Tyr (Me) 2-Orn8-вазотоцину, що вводиться в ту ж ділянку окситоцину, як і в інших областях мозку (див. Вище). . Що стосується локалізації цих рецепторів, то наявні дані свідчать про те, що вони локалізовані в клітинах тіл нейронів, багатих синтазами оксиду азоту.
Відповідно, дослідження мікродіалізу показують, що індукована окситоцином ерекція пеніса відбувається одночасно зі збільшенням продукції оксиду азоту в вентральному сублікулі, і це збільшення скасовується не тільки попередньою ін'єкцією оксидисинтази азоту S-метилтіо-l-цитруліном. і гемоглобіном-поглиначем оксиду азоту, а також d (CH2) 5Tyr (Me) 2-Orn8-вазотоцином, все введено в ту ж ділянку окситоцину в дозах, які антагонізують ерекцію статевого члена (Melis et al., 2010). Більш важливо, що індукована окситоцином ерекція пеніса відбувається також одночасно зі збільшенням концентрації позаклітинної глутамінової кислоти в вентральному сублікулі, який лише частково антагонізується неконкурентним антагоністом NMDA рецептора (+) МК-801, наданим вентральний сублікум (Melis et al., 2010). Разом ці результати свідчать про те, що новоутворений оксид азоту, діючи як міжклітинний месенджер, активує нейротрансмісію глутамінової кислоти, що призводить до ерекції статевого члена, можливо, через нейронні еферентні проекції вентральних Субкулум до екстра-гіпокампальних ділянок мозку. Відповідно до цієї гіпотези, NMDA, що вводиться в вентральний сублікул, індукує ерекцію статевого члена залежним від дози чином, і цей ефект повністю антагонізується попередньою ін'єкцією в ту ж саму ділянку (+) МК-801, але не S-метил-тіо-l-цитруліном гемоглобін або d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин (Melis et al., 2010). Що стосується нейронних еферентних шляхів, що проектуються на зони головного мозку, що активуються збудливими амінокислотами (тобто, глутамінова кислота) у вентральному сублікулі, цілком ймовірно, що вони є глутаматергічними, як і більшість еферентних проекцій гіпокампа. На даний момент можна лише припустити, що ці прогнози модулюють активність мезолімбічних допамінергічних нейронів, які, в свою чергу, модулюють активність допамінергічних нейронів в паравентрикулярному ядрі, що призводить до активації окситоцинергічних нейронів. опосередкування ерекції статевого члена, як вже обговорювалося (Дивись вище).
Відповідно ерекція статевого члена, індукована вентральним субликулом окситоцину, відбувається одночасно зі збільшенням концентрації позаклітинного дофаміну в оболонці nucleus accumbens, і це збільшення, як ерекція статевого члена, скасовується d (CH2) 5Tyr (Me) 2- Orn8-вазотоцин вводять у вентральний сублікум перед окситоцином (Melis et al., 2009b). Більше того, оскільки вентральна сублікулярна ерекція пеніса окситоцином також зменшується за рахунок (+) МК-ХНУМКС, введеного в вентральну тегментальну область, але не в ядрі accumbens (Melis et al., 801b) і відбувається одночасно із збільшенням позаклітинного глутамінової кислоти в вентральній тегментальной області, але не в nucleus accumbens, що є обома відповідями, скасованими d (CH2009) 2Tyr (Me) -Orn5-вазотоцином, введеним у вентральний сублікум перед окситоцином (див. фіг. 8), ймовірно, активація мезолімбічних допамінергічних нейронів є вторинною по відношенню до посиленої глутаматергічної нейротрансмісії в вентральній тегментальной області. Це свідчить про те, що взаємодія глутамінової кислоти з дофаміном, що контролює ерекцію статевого члена, існує в області вентрального тегментала. Необхідні подальші дослідження, щоб з'ясувати, чи проеректильні ефферентні глутаметергічні шляхи від сублікулу до вентральної тегментальної ділянки є прямими або непрямими, тобто через префронтальну кору або інші ділянки головного мозку (див. Melis et al., 2009b і посилання в ньому). Так як паравентрикулярне ядро також отримує глутаматергічні проекції з гіпокампу (див. Вище, а також Saphier і Feldman, 1987), та глутамінова кислота активує паравентрикулярні окситоцинергічні нейрони, в тому числі ті, що виступають у вентральну область (див. Argiolas і Melis, 2005 і посилання в ньому), і окситоцин у вентральній сегментарній області індукує ерекцію статевого члена і підвищує активність мезолімбічного допамінергічного нейронаs (див. вище), спокусливо спекулювати, що pаравентрикулярні окситоцинергічні нейрони можуть також бути залучені, принаймні частково, до активації мезолімбічних допамінергічних нейронів окситоцином, введеним у вентральний субикуляр (див. розділ 4).
4 Заключні зауваження
Вищенаведені дослідження підтверджують і розширюють ранні результати, що показують, що у щурів-самців окситоцин відіграє ключову роль в центральному контролі ерекції статевого члена на рівні паравентрикулярного ядра гіпоталамуса і спинного мозку. Зокрема, найбільш реДослідження Центру показують, що окситоцин впливає на ерекцію статевого члена також діючи в інших областях мозку, тобто вентральній тегментальній ділянці, вентральному субликуле і постромедіальному корковому ядру мигдалини.
На паравентрикулярном рівні найважливішим новим знахідкою є, можливо, відкриття експресії всіх дофамінових рецепторів сімейства D2 (D2, D3 і D4) в клітинних тілах окситоцинергічних нейронів паравентрикулярного ядра (і в надоптичному ядрі і медіальної преоптической області) (Baskerville і Douglas, 2008; Baskerville et al., 2009). Це забезпечує сильний нейроанатомічний характер підтримують гіпотезу, що агоністи дофамінових і дофамінових рецепторів можуть безпосередньо активувати окситоцинергічні нейрони, що беруть участь у еректильній функції, і проектувати не тільки до спинного мозку, але і до поза гіпоталамічних областей головного мозку.. У зв'язку з цим також важливо відкриття, що агоніст дофамінового рецептора, індуковане підвищенням интракавернозного тиску, знижується блокадою окситоцинергічних рецепторів у люмбо-крижовому спинному мозку (Baskerville et al., 2009). Дійсно, хоча такі докази були отримані у анестезованих щурів-самців, знахідка підтверджує активацію паравентрикуло-спинального окситоцинергічного низхідного шляху, залученого до ерекції пеніна, індукованої агоністом дофамінових рецепторів. HНезважаючи на це, ще потрібно з'ясувати, чи ерекція статевого члена, викликана стимуляцією дофамінових рецепторів, що є в органах окситоцинергічних клітин, є вторинною по відношенню до активації специфічного підтипу рецептора дофаміну сімейства D2 (D2, D3 або D4) або якщо ці підтипи рецепторів взаємодіють у модулюванні еректильної реакції, можливо різними способами в залежності від контексту, в якому відбувається ерекція статевого члена (див. Moreland et al., 2004; Enguehard-Gueiffier et al., 2006; Melis et al., 2006a, b, Löber et al., 2009, Collins et al., 2009, Depoortère et al., 2009, Baskerville et al., 2009).
Іншим важливим новим знахідкою є те, що окситоцин індукує ерекцію статевого члена при введенні не тільки в паравентрикулярне ядро або поле CA1 гіпокампу, але і в вентральну область тегмента, вентральний сублікум і постромедіальне кортикальне ядро мигдалини. Ці області мозку не були протестовані в попередніх дослідженнях, які показують, що окситоцин збільшував спонтанні епізоди ерекції статевого члена у самців щурів, хоча вони отримують, подібно до крижово-крижових окситоцинергічних проекцій спинного мозку з паравентрикулярного ядер. Окситоцин дійсно виявив здатність збільшувати спонтанні ерекції ерекції статевого члена, які виникають у дорослих щурів-самців при відсутності будь-яких сексуальних подразників, таких як ті, які походять від наявності доступної або недоступної рецептивної (естроген-прогестерону) овариэктомированной щури або маніпуляції геніталій, коли вводяться в паравентрикулярне ядро і CA1 поле гіпокампу, але не в дорзальний сублікум, латеральну перегородку, хвостові ядра, медіальну преоптическую область, вентромедіальное ядро і надоптическое ядро (Melis et al. , 1986). У всіх цих дослідженнях ерекцію статевого члена зазвичай підраховували, коли пеніс виходив з оболонки пеніса спостерігачем, який не знав про дане лікування безпосередньо під час експерименту або пізніше, спостерігаючи експеримент, записаний на відеоплівці з апаратом відеокамери. Кожен епізод ерекції статевого члена триває протягом 0.5-1 хв і зазвичай супроводжується пенісним доглядом і / або згинаннями стегна. У цих щурів звичайно не робиться експеримент, щоб з'ясувати вплив сексуального досвіду, віку або, якщо цих щурів можна розділити на низьких або високих респондерів на проеректильний ефект окситоцину, введеного в різні ділянки головного мозку. Це стосується також більшості досліджень проеректильного ефекту інших нейропептидів і препаратів, які збільшують спонтанні епізоди ерекції статевого члена, включаючи агоністи дофаміну, збуджуючі амінокислоти, АКТГ-MSH, пептиди гексареліну і VGF. Проте проеректильний ефект цих сполук неодноразово підтверджувався методами телеметрії, які визначають виникнення ерекції статевого члена за рахунок збільшення внутрішньокавернозного тиску, що відбувається спонтанно або після введення цих сполук різними шляхами, тобто системно, интрацеребровентрикулярно або безпосередньо в ядра специфічного мозку, після імплантації мікроперетворювача тиску безпосередньо в кавернозні корпуси (див. Bernabè et al., 1999). У вентральній тегментальній області вентральний сублікум і постромедіальное ядро мигдалини також окситоцин індукують ерекцію статевого члена, діючи на окситоцинергічні рецептори. Це призводить до активації мезолімбічних допамінергічних нейронів, що виникають у вентральній тегментальній ділянці і виступають до оболонки nucleus accumbens, вимірюється збільшенням концентрації позаклітинного дофаміну в диализате, отриманому з оболонки nucleus accumbens, і зменшенням еректильної реакції, індукованої пептидом, введеним в ці позагипоталамические ділянки, виявленого після блокади дофамінергічних рецепторів nucleus accumbens (див. нижче). Що стосується механізмів, що активуються стимуляцією окситоцинергічних рецепторів у цих ділянках мозку, які призводять до активації мезолімбічних допамінергічних нейронів і ерекції статевого члена, краще прояснюються ті, що відбуваються в каудальній вентральній області. Дійсно, тут результати фармакологічної та імунофлуоресценції показують, що нервові закінчення окситоцину посягають на клітинні тіла дофамінергічних нейронів, що проектуються на оболонку nucleus accumbens (Melis et al., 2007, 2009a; Succu et al., 2008). Багато з цих нейронів багаті синтазою оксиду азоту та гуанілатциклазою. Стимуляція окситоцинергічних рецепторів у клітинних органах цих дофамінергічних нейронів викликає активацію синтази оксиду азоту, що призводить до збільшення виробництва оксиду азоту. Оксид азоту в свою чергу активує гуанилатциклазу, тим самим підвищуючи концентрацію циклічного GMP, що призводить до активації мезолімбічних допамінергічних нейронів і до вивільнення допаміну в nucleus accumbens, що вимірюється збільшенням позаклітинного дофаміну в диализате з nucleus accumbens, отриманого шляхом внутрішньо-мозкового мікродіалізу (Succu et al., 2008). ). Допамін, що виділяється в ядрі accumbens, у свою чергу, активує нервові шляхи, що призводять до ерекції статевого члена. Це підтверджується здатністю антагоністів дофамінових рецепторів галоперидолу та / або цис-флупентиксола вводитися в nucleus accumbens для зменшення вентральної тегментальной області індукованої окситоцином ерекції пеніса (Succu et al., 2008). Один з проеректильних шляхів, як видається, активує интеро-гіпоталамічні допамінергічні нейрони, зокрема ті, які проекують до клітинних тіл паравентрикулярних окситоцинергічних нейронів. Дійсно, окситоцин, який вводиться в каудальну вентральну тегментальну область, збільшує позаклітинний дофамін не тільки в ядрі accumbens, але і в паравентрикулярном ядрі, а блокада дофамінових рецепторів в паравентрикулярном ядрі значно знижує вентральну ерекцію пеніла (Succu et al. Melis et al., 2007, 2008a), 2007, 2009a). Існування цих ядрах дофамін-паравентрикулярних дофамін-паравентрикулярних окситоцин-вентральних сегментів окситоцин-дофамінових зв'язків \ t передбачається також здатність проеректильної дози апоморфіну та агоніста рецептора D4 PD 168077 вводити в паравентрикулярне ядро для збільшення надклітинного дофаміну в оболонці nucleus accumbens (Succu et al., 2007), відповідь що скасовується d (CH2) 5Tyr (Me) -Orn8-вазотоцином, що вводиться в область вентрального тегментала (Melis et al., 2009a, див. також нижче). Проте, необхідна подальша робота для виявлення нейронних шляхів, які з'єднують nucleus accumbens з внутрішньо-гіпоталамічною допамінергічною системою.
Механізм, за допомогою якого окситоцин індукує ерекцію статевого члена і активує мезолімбічні дофамінергічні нейрони при ін'єкції в вентральний сублікум або в постромедіальне ядро мигдалини, лише частково розуміється. У цих областях також окситоцин активує власні рецептори, які призводять до активації синтази оксиду азоту, тим самим збільшуючи виробництво оксиду азоту. Оксид азоту в свою чергу активує невідомі еферентні проекції, які, мабуть, збільшують глутаматергічну нейротрансмісію в вентральній тегментальной області. Потім глутамінова кислота стимулює мезолімбічні дофамінергічні нейрони, що призводить до ерекції статевого члена. Ця гіпотеза підтримується, головним чином, здатністю окситоцину, що вводиться в вентральний сублікум, для збільшення надклітинної глутамінової кислоти в вентральній сегментарній області (фіг. 3), і неконкурентного антагоніста NMDA рецептора (+) МК-801, введеного в область вентрального тегментала, але не в nucleus accumbens, щоб зменшити ерекцію пеніса, індуковану окситоцином, введеним або в вентральний субцикулу, або в посттрансляционное ядро мигдалини (Melis et al., 2009b). На даний момент, більш докладна інформація доступна для вентральної субікулярной ерекції пеніса, викликаної окситоцином. Тут індукована окситоцином ерекція статевого члена стає вторинною по відношенню до активації окситоцинергічних рецепторів, розташованих в тілах клітин азотно-оксидно-синтазних нейронів. Це призводить до збільшення виробництва оксиду азоту, який активує нейтральні передачі глутаматергічної дії, діючи як міжклітинний месенджер з механізмом, подібним до описаного для довгострокового потенціювання (див. Snyder, 1992; Southam і Garthwaite, 1993; Schuman і Madison, 2004; . У відповідності з цією гіпотезою індукована окситоцином ерекція пеніса відбувається одночасно з збільшенням позаклітинної глутамінової кислоти в диализате з вентрального сублікулу, а стимуляція збудливих амінокислотних рецепторів в вентральному сублікулі за допомогою NMDA індукує ерекцію статевого члена. Глутамінова кислота, в свою чергу, активує нейронні еферентні проекції, які призводять до активації мезолімбічних допамінергічних нейронів в вентральній тегментальной області, як описано вище. Якщо ці механізми функціонують і в заднемодиальном ядрі мигдалини, то в даний час невідомо. Більш того, необхідні подальші дослідження для того, щоб довести, що (1) окситоцинергічні нервові закінчення і рецептори в вентральному сублікулі і в постромедіальном ядрі мигдалини локалізовані в тілах клітин нейронів, що містять синтазу оксиду азоту (2), якщо ці нейрони в кінцевому рахунку під контролем збудливих амінокислотних (глутаматергічних) синапсів і (3) для ідентифікації сигнальної системи, активованої оксидом азоту. У зв'язку з цим слід зазначити, що здатність окситоцину збільшувати активність оксид-оксид-синтази в клітинних органах дофамінергічних нейронів каудального вентрального тегментального ділянки і досі невідомих нейронів вентрального субліката і постромедіального ядра мигдалини, здатність окситоцину активувати азотно-оксидно-синтазу в клітинних тілах окситоцинергічних нейронів в паравентрикулярном ядрі (Melis et al., 1997). Однак у той час як у вентральній тегментальной області підвищена продукція оксиду азоту в клітинних органах дофамінергічних нейронів призводить до активації цих нейронів шляхом активації гуанілатциклази і збільшення циклічного GMP, це не відбувається в паравентрикулярном ядрі. Відповідно, 8-бромциклічний GMP, що вводиться в паравентрикулярне ядро, не індукує ерекцію статевого члена, в той час як він вводиться в вентральну тегментальную область. Інший сигнальний шлях, відмінний від системи азотно-оксидециклічної GMP, потім бере участь на паравентрикулярном рівні в активації окситоцинергічних нейронів, що опосередковують ерекцію статевого члена ендогенним та / або екзогенним оксидом азоту (Melis і Argiolas, 1995b; Melis et al., 1997) (фіг.8). . 1). З іншого боку, циклічний GMP в вентральній тегментальной області, здається, грає також ключову роль в активації мезолімбічних допамінергічних нейронів і в збільшенні позаклітинного дофаміну, що відбувається в диализате, отриманому з оболонки ядра щурів самців щурів. відібрані для показу або не показують безконтактні ерекції статевого члена, коли їх поміщають у присутності недоступної овариэктомированной рецептивної (естроген + прогестерон) жіночої щури. У цих експериментальних умовах у самців щурів, які показують безконтактну ерекцію статевого члена, збільшення концентрації позаклітинного дофаміну виявляється, як і очікувалося, і це збільшення додатково збільшується, хоча і лише скромно, інгібіторами фосфодіестерази, що вводяться в каудальну вентральну область (Sanna et al. al., 2009).
Здатність окситоцину вводити в вентральну тегментальну область, в вентральний сублікум і в постромедіальне кортикальне ядро мигдалини, разом з інгібіторами допамінових агоністів в паравентрикулярне ядро, щоб викликати ерекцію статевого члена і активувати мезолімбічні допамінергічні нейрони, заслуговує деяких коментарів. . По-перше, механізми, подібні до згаданих вище, можуть бути ефективними, коли ерекція статевого члена відбувається у фізіологічних контекстах, наприклад, під час копуляції (коли відбувається ерекція пениса) або під час безконтактної ерекції статевого члена. Ці ерекції являють собою феромон-опосередковані ерекції статевого члена, не відрізняються від тих, які індукуються лікарськими засобами або окситоцином, які виникають, коли статево потужні чоловічі щури вводяться в присутність недоступної рецептивної (овариэктомизированной естроген + прогестерон) жіночої щури і розглядаються як індекс сексуальної \ t збудження (Sachs, 1997, 2007). Дійсно, хоча ці результати не демонструють, що окситоцин у цих областях відіграє певну роль у ерекції пеніса, що відбувається у фізіологічних контекстах або після введення препарату, вони додають додаткової сили до ранніх висновків, які свідчать про те, що ці області мозку належать до тих, де окситоцин наданий центральним чином збільшується не тільки спонтанні епізоди ерекції статевого члена, що спостерігаються після проректильних препаратів, а й поліпшення сексуальної поведінки чоловіків (і жінок) (див. Argiolas і Melis, 2004 і посилання в ньому). Відповідно, підвищується концентрація окситоцину у гіпокампу щурів-самців, які отримували про-еректильну дозу апоморфіну, класичний агоніст допаміну (Melis et al., 1990) і d (CH2) 5Tyr (Me) -Orn8-вазотоцин, який блокує окситоцин Рецептори, надзвичайно ефективні не тільки в порушенні копуляторної поведінки (Argiolas et al., 1987a), але також сприяють впливу апоморфіну на чоловіче копулятивное поведінка (Argiolas et al., 1987b) у сексуально потужних самців щурів, під час яких в згущуванні ерекції пениса відбуваються. d (CH2) 5Tyr (Me) -Orn8-вазотоцин є також надзвичайно сильним у зниженні безконтактних ерекцій у сексуально потужних щурів-самців, коли їх вводять у нанограммові кількості в бічні шлуночки, але не в PVN (Melis et al., 1999a).
По-друге, мезолімбічні допамінергічні нейрони відіграють ключову роль у мотиваційних та корисних властивостях природних підсилюючих стимулів, таких як їжа, вода та сексуальна активність (Fibiger та Phillips, 1988; Wise and Rompre, 1989; Everitt, 1990). Зокрема, вважається, що дофамін, що виділяється з цих нейронів, опосередковує перенесення мотиваційних аспектів природних стимулів до цільової поведінки, наприклад, у випадку сексуальної активності, пошуку сексуального партнера та статевого акту для досягнення нагороди та задоволення. (Гото і Грейс, 2005). Відповідно, концентрація позаклітинного дофаміну збільшується в диализате від ядра акумулюючих статево-сильних щурів-самців під час впливу недоступною овариэктомированной естроген + прогестерон рецептивної жіночої щури, і таке збільшення було навіть вище, коли самцю щурам дозволяли копулюватися з сприйнятливою самкою (Pfaus і Everitt, 1995).
По-третє, ці результати підтверджують гіпотезу про те, що нейронна ланцюг з'єднує паравентрикулярне ядро з вентральною тегментальною областю безпосередньо або опосередковано (через вентральний сублікум та / або постромедіальне кортикальне ядро мигдалини) і nucleus accumbens, а звідси через невідомі. шляхи повернення назад до паравентрикулярного ядра для контролю активності окситоцинергічних нейронів, що проектуються на спинний мозок, що опосередковує ерекцію статевого члена, і окситоцинергічних нейронів, що проеціюються до вентральної тегментальной області, вентрального сублікулу і постромедіального коркового ядра мигдалини, модулюючи таким чином активність мезолімбічних допамінергічних нейронів (рис. 4). Цей складний нейронний ланцюг може грати роль в інтеграції нейронних активностей, що беруть участь у контролі контутерного (еректильно-еякуляторного) та попереджувального (мотиваційного та корисного) аспектів чоловічої сексуальної поведінки у фізіологічних умовах. Дійсно, позаклітинні дофаміни збільшуються в nucleus accumbens (Pfaus і Everitt, 1995) і в паравентрикулярном ядрі щурів-сексуально потужних самців під час впливу недоступної сприйнятливої жіночої щури, коли відбувається безконтактна ерекція, і навіть більше, коли допускається копуляція, наприклад, коли в копу відбуваються ерекції статевого члена (Melis et al., 2003). Таким чином, хоча необхідні подальші дослідження для з'ясування ролі ендогенного окситоцину в вентральній тегментальной області, вентральній сублікулі і мигдалині під час безконтактних ерекцій і сексуальної поведінки, може бути розумно припустити, що ця гіпотетична нейронна ланцюг, одночасно сприяючи Консультативні аспекти сексуальної поведінки, в той же час можуть також активувати мезолімбічну допамінергічну систему, що забезпечує нейронний субстрат для пояснення корисних властивостей сексуальної активності (Everitt, 1990; Pfaus і Everitt, 1995). У зв'язку з цим слід зазначити, що мезолімбічна допамінергічна система, активована окситоцином, що вводиться в область вентрального тегментала, є такою ж, що активується наркотичними засобами, такими як опіати, каннабіноїди, амфетамін, кокаїн і алкоголь (Tanda et al., 1997), і виявлено, що окситоцин здатний знижувати толерантність і залежність від кокаїну, морфіну, спирту та каннабіноїдів (Kovacs et al., 1998; Cui et al., 2001). На закінчення, здається, що окситоцин, що виділяється не тільки в вентральній тегментальной області, але і в вентральному субликуле і постромедіальном корковому ядрі мигдалини, може активувати мезолімбічні допамінергічні нейрони, які можуть бути залучені в апетитні і корисні ефекти сексуальної активності. . Активація мезолімбічних допамінергічних нейронів може бути прямою, через окситоцинергічні рецептори в клітинних органах мезолімбічних допамінергічних нейронів, або опосередковано через активацію нейротрансмісії глутамінової кислоти в вентральній тегментальной області.
Допамін, що виділяється в оболонці nucleus accumbens, модулює в свою чергу активність допамінергічних нейронів внутрішньо-гіпоталамічних в паравентрикулярном ядрі, що викликає або ерекцію статевого члена (через активацію окситоцинергічних нейронів, що виступають на спинний мозок), або сексуальну мотивацію і винагороду (через активацію окситоцинергічних) нейрони, що виступають на вентральну тегментальну область, вентральний сублікум або постромедіальне кортикальне ядро мигдалини). Оскільки дофамін також вивільняється в оболонці nucleus accumbens і в паравентрикулярном ядрі, коли ерекція статевого члена відбувається у фізіологічних контекстах (наприклад, безконтактні ерекції і копуляції) (Succu et al., 2007; Melis et al., 2003, 2007), ймовірно, що центральні окситоцинергічні нейрони беруть участь у нейронних ланцюгах, що опосередковують взаємодію між мезолімбічною і вторто-гіпоталамічною допамінергічною системою. Ці нейронні ланцюги можуть грати роль не тільки у фазі консервації сексуальної поведінки (наприклад, ерекції статевого члена і копуляції), але й у статевій мотивації, сексуальному збудженні та сексуальному нагороді.
Схематичне зображення гіпотетичної нейронної схеми за участю окситоцину, що впливає на сексуальну мотивацію, користь і сексуальну діяльність, як це передбачено результатами цієї глави та попередніх звітів. Окситоцинергічні нейрони, що походять з паравентрикулярного ядра і виступають на спинний мозок, коли активуються, наприклад, дофаміном і глутаміновою кислотою (але також іншими нейротрансмітерами та / або нейропептидами), полегшують ерекцію статевого члена і статеву активність шляхом активації окситоцинергічних нейронів, що виступають на спинний мозок. Допамін і глутамінова кислота (а також нейротрансмітери і нейропептиди) в паравентрикулярном ядрі також активують окситоцинергічні нейрони, що проеціюються в вентральну тегментальну область, тим самим активуючи мезолімбічні допамінергічні нейрони, що проеціюють в ядро accumbens, модулюючи сексуальну мотивацію і винагороду. Допамін, що виділяється в ядрі accumbens (NA), активує в свою чергу ще невідомі нервові шляхи, які збільшують активність допамінергічних нейронів (що походять з груп A13-A14 Dahlstrom і Fuxe), що впливають на інші окситоцинергічні нейрони, включаючи ті, що проектують спинного мозку, що призводить до ерекції статевого члена. Ця схема також може бути активована окситоцином, введеним не тільки в каудальний вентральний сегмент, але і в вентральний субикулум і в мигдалину, яка також отримує окситоцинергічну іннервацію з паравентрикулярного ядра, можливо через прямий або непрямий глутаматергічний еферентний вентральний. Тегментальна область, що призводить до модуляції як статевої мотивації, так і ерекції статевого члена. Нарешті, вищезазначені схеми можуть бути активовані також сексуальними подразниками і феромонами, оскільки позаклітинні дофамінові і глутамінові кислоти збільшуються в паравентрикулярном ядрі (і в медіальній преоптичній області) під час феромон-опосередкованої безконтактної ерекції і копуляції (див. Список посилань).
Подяки Ця робота була частково підтримана грантом від італійського міністерства університету та досліджень до AA та MRM
посилання
Andersson, KE, 2001. Фармакологія ерекції статевого члена. Pharmacol. Преподобний 53, 417-450. Argiolas, A., 1994. Оксид азоту є центральним посередником ерекції статевого члена. Нейрофармакологія 33, 1339-1344. Argiolas, A., 1999. Нейропептиди і сексуальна поведінка. Neurosci. Biobehav. Преподобний 23, 1127-1142. Argiolas, A., Gessa, GL, 1991. Центральні функції окситоцину. Neurosci. Biobehav. Преподобний 15, 217-231. Argiolas, A., Melis, MR, 1995. Нейромодуляція ерекції статевого члена: огляд ролі нейротрансмітерів і нейропептидів. Prog. Neurobiol. 47, 235-255. Argiolas, A., Melis, MR, 2004. Роль окситоцину і паравентрикулярного ядра в статевій поведінці ссавців-самців. Physiol. Behav. 83, 309-317. Argiolas, A., Melis, MR, 2005. Центральний контроль ерекції статевого члена: роль паравентрикулярного ядра гіпоталамуса. Prog. Neurobiol. 76, 1-21. Argiolas, A., Collu, M., Gessa, GL, Melis, MR, Serra, G., 1988. Антагоніст окситоцину d (CH2) 5Tyr (Me) -Orn8-вазотоцин антагонізує чоловічу копуляторну поведінку у щурів. E. J. Pharmacol. 149, 389-392. Арджолас А., Коллу М., Д'Аквіла П., Гесса Г.Л., Меліс М.Р., Серра Г., 1989. Стимуляція апоморфіну чоловічої копуляторної поведінки запобігається антагоністом окситоцину d (CH2) 5Tyr (Me) -Orn8-вазотоцину у щурів. Pharmacol. Biochem. Behav. 33, 81-83. Argiolas, A., Melis, MR, Gessa, GL, 1985. Внутрішньошлуночковий окситоцин індукує зяючу і ерекцію статевого члена у щурів. E. J. Pharmacol. 117, 395-396. Argiolas, A., Melis, MR, Gessa, GL, 1986. Окситоцин: надзвичайно сильний індуктор ерекції статевого члена і позіхання у самців щурів. E. J. Pharmacol. 130, 265-272. Argiolas, A., Melis, MR, Mauri, A., Gessa, GL, 1987a. Паравентрикулярне ураження ядра перешкоджає позіханню і ерекції статевого члена, викликаної апоморфіном і окситоцином, але не АКТГ у щурів. Мозок Рес. 421, 349-352. Argiolas, A., Melis, MR, Vargiu, L., Mauri, A., Gessa, GL, 1987b. d (CH2) 5Tyr (Me) -Orn8-вазотоцин, потужний антагоніст окситоцину, антагонізує ерекцію статевого члена і позіхання, індуковане окситоцином і апоморфіном, але не ACTH 1-24. E. J. Pharmacol. 134, 221-224. Argiolas, A., Melis, MR, Stancampiano, R., Gessa, GL, 1990. _ -Конотоксин запобігає апоморфіну і індуковану окситоцином ерекцію статевого члена і позіхання у самців щурів. Pharmacol. Biochem. Behav. 37, 253-257. Arletti, R., Bertolini, A., 1985. Окситоцин стимулює поведінку лордозу у самок щурів. Нейропептиди 6, 247-255. Arletti, R., Bazzani, C., Castelli, M., Bertolini, A., 1985. Окситоцин покращує чоловічі копуляторні показники у щурів. Хорм. Behav. 19, 14-20. Arletti, R., Benelli, A., Bertolini, A., 1990. Статеве поведінка старіючих самців щурів стимулюється окситоцином. E. J. Pharmacol. 179, 377-382. Arletti, R., Calzà, L., Giardino, L., Benelli, A., Cavazzutti, Е., Bertolini, A., 1997. Статева імпотенція пов'язана зі зниженням продукції окситоцину і підвищеною продукцією опіоїдних пептидів в паравентрикулярном ядрі гіпоталамуса. Neurosci. Lett. 233, 65-68. Bancila, M., Giuliano, F., Rampin, O., Mailly, P., Brisorgueil, MJ, Clas, A., Verge, D., 2002. Докази прямої проекції від паравентрикулярного ядра гіпоталамуса до передбачуваних серотонінергічних нейронів ядра paragigantocellularis, що беруть участь у контролі ерекції у щурів. E. J. Neurosci. 16, 1240-1249. Burnett, AL, Lowenstein, CJ, Bredt, DS, Chang, TSK, Snyder, SH, 1992. Оксид азоту: фізіологічний посередник ерекції статевого члена. Наука 257, 401-403. Baskerville, TA, Douglas, AJ, 2008. Взаємодія дофаміну і окситоцину в контролі за сексуальною поведінкою. Prog. Мозок Рес. 170, 277-289. Baskerville, ТА, Allard, J., Wayman, C., Douglas, AJ, 2009. Взаємодія дофамін-окситоцину в ерекції статевого члена. E. J. Neurosci. 30, 2151-2164. Benelli, A., Bertolini, A., Poggioli, R., Cavazzutti, Е., Calzà, L., Giardino, L., Arletti, R., 1995. Оксид азоту бере участь у чоловічій сексуальній поведінці щурів. E. J. Pharmacol. 294, 505-510. Bernabè, J., Rampin, O., Sachs, BD, Giuliano, F., 1999. Внутрішньокавернозний тиск під час ерекції у щурів: інтегративний підхід, заснований на телеметричному записі. Am. J. Physiol. 276, R441-R449. Bitner, RS, Nikkel, AL, Otte, S., Martino, B., Barlow, EH, Bhatia, P., Stewart, AO, Brioni, JD, Decker, MW, Moreland, RB, 2006. Сигналізація дофамінового рецептора D4 у ядрах паравентрикулярного гіпоталамусу у щурів: свідчення природного зчеплення, що включає безпосередню ранню індукцію генів і фосфорилювання протеїнкінази з активованим митогеном. Нейрофармакологія 50, 521-531. Brioni, JD, Moreland, RB, Cowart, M., Hsieh, GC, Stewart, AO, Hedlund, P., Donnelly-Roberts, DL, Nakane, M., Lynch 3., J., Kolasa, T., Polakowski , JS, Osinski, MA, Marsh, K., Andersson, KE, Sullivan, JP, 2004. Активація дофамінових рецепторів D4 за допомогою ABT-724 індукує ерекцію статевого члена у щурів. Proc. Natl. Акад. Sci. USA 101, 6758-6763. Buijs, RM, 1978. Внутрішньо- і екстра-гіпоталамічний вазопресин і шляхи окситоцину у щурів. Клітинна тканина Res. 192, 423-435. Buijs, RM, Geffard, М., Пул, CW, Hoorneman, EMD, 1984. Допамінергічна іннервація надоптичного і паравентрикулярного ядра. Світло-електронне мікроскопічне дослідження. Мозок Рес. 323, 65-72. Колдуелл, JD, Prange, AJ, Педерсен, CA, 1986. Окситоцин полегшує сексуальну сприйнятливість жіночих щурів, оброблених естрогенами. Нейропептиди 7, 175-189. Cameron, JL, Pomerantz, SM, Layden, LM, Amico, JA, 1992. Допамінергічна стимуляція концентрації окситоцину в плазмі чоловічих і жіночих мавп апоморфіном і агоністом рецептора D2. J. Clin. Ендокринол. Metab. 75, 855-860. Canteras, NS, Simerly, RB, Swanson, LW, 1995. Організація проекцій з медіального ядра мигдалини: дослідження PHAL на щурах. J. Comp. Neurol. 360, 213-245. Carmichael, MS, Humbert, R., Dixen, J., Palmisano, G., Greeleaf, W., Davidson, JM, 1987. Плазма окситоцину збільшується в статевій реакції людини. J. Clin. Ендокринол. Metab. 64, 27-31. Carter, CS, 1992. Окситоцин і сексуальна поведінка. Neurosci. Biobehav. Преподобний 16, 131-144. Carter, CS, Lederhendler, II, Kirkpatrick, B., 1997. Інтерактивна нейробіологія приналежності, Аннали Нью-Йоркської академії наук, вип. 807. Нью-Йоркська академія наук, Нью-Йорк. Castelli, MP, Piras, AP, Melis, Т., Succu, S., Sanna, F., Melis, MR, Collu, S., Ennas, MG, Diaz, G., Mackie, K., Argiolas, A. , 2007. Рецептори каннабіноїдів CB1 в паравентрикулярном ядрі та центральний контроль ерекції статевого члена: імуноцитохімія, авторадіографія та поведінкові дослідження. Неврологія 147, 197-206. Chen, KK, Chang, LS, 2003. Вплив агоністів рецепторів збудливих амінокислот на ерекцію статевого члена після введення в паравентрикулярне ядро гіпоталамуса у щурів. J. Urol. 62, 575-580. Чень, КК, Чан, JYH, Чанг, ЛС, Чень, МТ, Чанг, SHH, 1992. Виявлення ерекції статевого члена після активації утворення гиппокампа у щурів. Neurosci. Lett. 141, 218-222. Чень, КК, Чан, JYH, Чанг, LS, 1999. Допамінергічна нейротрансмісія в паравентрикулярном ядрі гіпоталамуса в центральній регуляції ерекції статевого члена у щурів. J. Urol. 162, 237-242. Collins, GT, Truccone, A., Haji-Abdi, F., Newman, AH, Grundt, P., Рис, KC, Husbands, SM, Greedy, BM, Enguehard-Gueiffer, C., Gueiffer, A., Chen , J., Wang, S., Katz, JL, Grandy, DK, Sunahara, RK, Woods, JH, 2009. Про-еректильні ефекти дофаміну D2-подібних агоністів опосередковуються рецептором D3 у щурів і мишей. J. Pharmacol. Exp. Ther. 329, 210-217. Coolen, LM, Allard, J., Truitt, WA, McKenna, KE, 2004. Центральна регуляція еякуляції. Physiol. Behav. 83, 203-215. Cui, SS, Bowen, RC, Gu, GB, Hannesson, BK, Yu, PH, Zhang, X., 2001. Профілактика синдрому відміни канабіноїдів літієм: залучення окситоцинергічної активації нейронів. J. Neurosci. 21, 9867-9876. Дальстром А., Fuxe, K., 1964. Докази існування моноамінсодержащих нейронів в центральній нервовій системі. I. Демонстрація моноамінів у клітинах тіла нейронів стовбура мозку. Acta Physiol. Scand. 62 (Доп. 232), 1-54. Depoortère, R., Bardin, L., Rodrigues, M., Abrial, E., Aliaga, M., Newman-Tancredi, A., 2009. Ерекція статевого члена і позіхання, викликані агоністами дофамінових D2 рецепторів у щурів: вплив штаму і внеску дофамінових D2, але не рецепторів D3 і D4. Behav. Pharmacol. 20, 303-311. Domes, G., Heinrichs, M., Buchel, C., Braus, DF, Herpertz, SC, 2007. Окситоцин послаблює амігдальні реакції на емоційні особи, незалежно від валентності. Biol. Психіатрія 62, 11871190. Dominguez, J., Riolo, JV, Xu, Z., Hull, ME, 2001. Регулювання за допомогою медіальної мигдалини копуляції і медіального преоптичного вивільнення дофаміну. J. Neurosci. 21, 349-355. Donaldson, ZR, Young, LJ, 2009. Окситоцин, вазопресин і нейрогенетика соціальності. Наука 322, 900-904. Eaton, RG, Markowski, VF, Lumley, LA, Thompson, JT, Moses, J., Hull, EM, 1991. Рецептори D2 в паравентрикулярном ядрі регулюють генітальні реакції і копуляцію у самців щурів. Pharmacol. Biochem. Behav. 39, 177-181. Ebner, K., Bosch, OJ, Krömer, SA, Singewald, N., Neumann, ID, 2005. Вивільнення окситоцину в центральній мигдалині щурів модулює поведінку при стискуванні та вивільнення збудливих амінокислот. Нейропсихофармакологія 30, 223-230. Enguehard-Gueiffier, C., Hübner, H., El Hakmaoui, A., Allouchi, H., Gmeiner, P., Argiolas, A., Melis, MR, Gueiffier, A., 2006. 2 - [(4-Phenylpiperazin-1-іл) метил] імідазо (ді) азіни як селективні D4-ліганди. Індукція ерекції статевого члена 2- [4- (2-метоксифенил) піперазин-1-ілметил] імідазо [1,2-a] піридин (PIP3EA), сильний і селективний агоніст D4. J. Med. Chem. 49, 3938-3947. Everitt, BJ, 1990. Статева мотивація: нейронний і поведінковий аналіз механізмів, що лежать в основі апетитних і копуляторних відповідей самців щурів. Neurosci. Biobehav. Преподобний 14, 217-232. Fibiger, HC, Phillips, AG, 1988. Мезокортиколимбическая дофамінова система і винагорода. Ann. N. Y. Акад. Sci. 5, 206-215. Французька, SJ, Totterdell, S., 2003. Індивідуальні ядра-акумулятори-проекційні нейрони одержують як базалотеральную амигдалу, так і вентральні сублікулярні аферентні у щурів. Неврологія 119, 19-31. 954 MR Melis, A. Argiolas / Neuroscience і Biobehavioral Рецензії 35 (2011) 939-955 Freund-Mercier, MJ, Richard, P., 1981. Збуджуючі ефекти внутрішньошлуночкових ін'єкцій окситоцину на рефлекс викиду молока у щура. Neurosci. Lett. 23, 193-198. Freund-Mercier, MJ, Richard, P., 1984. Електрофізіологічні дані для полегшення контролю нейронів окситоцину окситоцином під час вигодовування у щурів. J. Physiol. (Лонд.) 352, 447-466. Freund-Mercier, MJ, Stoeckel, ME, 1995. Соматодендритні авторецептори на окситоцинових нейронах. У: Ivell, R., Russel, JA (Ред.), Окситоцин, клітинні та молекулярні підходи в медицині та дослідженнях. Adv. Exp. Med. Biol., 365. Plenum Press, Нью-Йорк і Лондон, с. 185-194. Freund-Mercier, MJ, Stoeckel, ME, Palacios, JM, Pazos, JM, Richard, PH, Porte, A., 1987. Фармакологічні характеристики та анатомічний розподіл сайтів зв'язування окситоцину 3H у мозку щурів Wistar вивчали за допомогою авторадіографії. Неврологія 20, 599-614. Giuliano, F., Rampin, O., 2000. Центральний контроль ерекції статевого члена. Neurosci. Biobehav. Преподобний 24, 517-533. Giuliano, F., Allard, J., 2001. Допамін і статева функція. Int. J. Impotence Res. 13 (Доп. 3), 18-28. Giuliano, F., Rampin, O., 2004. Нейронний контроль ерекції. Physiol. Behav. 83, 189-201. Giuliano, F., Bernabè, J., McKenna, KE, Longueville, F., Rampin, O., 2001. Спинний проректильний ефект окситоцину в анестезованих щурах. Am J. Physiol. Regul. Integ. Comp. Physiol. 280, R1870-R1877. Goto, Y., Грейс, АА, 2005. Допамінергічна модуляція лімбічного та кортикального приводу nucleus accumbens в цілеспрямованій поведінці. Nat. Neurosci. 8, 805-812. Hawthorn, J., Ang, VT, Jenkins, JS, 1985. Вплив уражень в гіпоталамічних паравентрикулярних, супрапоптичних і супрахіазматичних ядрах на вазопресин і окситоцин у головному і спинному мозку щура. Мозок Рес. 346, 51-57. Heier, RF, Dolak, LA, Duncan, JN, Hyslop, DK, Lipton, MF, Martin, LJ, Mauragis, MA, Piercey, MF, Nichols, NF, Schreur, PJ, Smith, MW, Moon, MW, 1997. Синтез і біологічна активність (R) -5,6-дигідро-N, N-диметил-4H-імідазо [4,5,1-ij] хінолін-5-аміну) та його метаболітів. J. Med. Chem. 40, 639-646. Сі, Джорджія, Холлінгсворт, PR, Мартіно, Б., Чанг, Р., Теранова, Массачусетс, О'Ніл, AB, Лінч, Джей Джей, Мореленд, РБ, Доннеллі-Робертс, DL, Коласа, Т., Мікуса, JP , McVey, JM, Marsh, KC, Sullivan, JP, Brioni, JD, 2004. Центральні механізми, що регулюють ерекцію пеніса у свідомих щурів: дофамінергічні системи, пов'язані з проеректильним ефектом апоморфіну. J. Pharmacol. Exp. Ther. 308, 330-338. Huang, PL, Dawson, TM, Bredt, DS, Snyder, SH, Fishman, MC, 1993. Цілеспрямоване порушення гена синтази оксиду азоту нейронів. Стільник 75, 1273-1286. Huber, D., Veinante, P., Stoop, R., 2005. Вазопресин і окситоцин збуджують чіткі популяції нейронів в центральній мигдалині. Наука 308, 245-248. Халл, Е. М., Уорнер, Р. К., Базетт, Т. Я., Ітон, Р. К., Томпсон, Дж. Т., 1989. Співвідношення D2 / D1 у медіальній зоні преоптичного впливу впливає на копуляцію щурів-самців. J. Pharmacol. Exp. Ther. 251, 422-427. Халл, Е. М., Du, J., Lorrain, DS, Matuszewich, L., 1995. Надклітинний дофамін в медіальній преоптичній області: наслідки для сексуальної мотивації і гормонального контролю копуляції. J. Neurosci. 15, 7465-7471. Корпус, EM, Meisel, RL, Sachs, BD, 2002. Сексуальна поведінка чоловіків. У: Pfaff, DW, Arnold, AP, Etgen, AM, Fahrbach, SE, Rubin, RT (Ред.), Гормони, мозок і поведінка. Academic Press, Нью-Йорк, с. 3-137. Hurlemann, R., Patin, A., Onur, OA, Cohen, MX, Baumgartner, T., Metzler, S., Dziobek, I., Gallinat, J., Wagner, M., Maier, W., Kendrick, КМ, 2010. Окситоцин посилює амігдал-залежне, соціально посилене навчання і емоційну емпатію у людей. J. Neurosci. 30, 4999-5007. Ivell, R., Russel, JA, 1995. Окситоцин: Клітинні та молекулярні підходи в медицині та наукових дослідженнях. Досягнення в експериментальній медицині та біології, вип. 395. Plenum Press, Нью-Йорк. Kelley, AE, Domesick, VB, 1982. Розподіл проекції від утворення гіпокампу до nucleus accumbens у щура: дослідження антероградної та ретроградно-пероксидази хрону. Неврологія 7, 2321-2335. Kimura, Y., Naitou, Y., Wanibuchi, F., Yamaguchi, T., 2008. Активація рецептора 5-HT (2C) є загальним механізмом проректильного впливу апоморфіну, окситоцину і меланотану-II на щурів. E. J. Pharmacol. 589, 157-162. Кондо, Y., Sachs, BD, Sakuma, Y., 1998. Важливість медіальної амигдали в ерекції статевого члена у щурів викликана віддаленими стимулами від еструдних самок. Behav. Мозок Рес. 91, 215-222. Kovacs, GL, Sarnyai, Z., Szabo, G., 1998. Окситоцин і наркоманія: огляд. Психоневроендокринологія 23, 945-962. Lee, HJ, Macbeth, AH, Pagani, JH, Scott Young 3rd, W., 2009. Окситоцин: великий посередник життя. Prog. Neurobiol. 88, 127-151. Lindvall, O., Bjorklund, A., Skagerberg, G., 1984. Селективна істохімічна демонстрація дофамінових термінальних систем у ді-і тенцефалоні щурів: нові свідчення дофамінергічної іннервації гіпоталамічних ядер нейросекрета. Мозок Рес. 306, 19-30. Лю, YC, Salamone, JD, Sachs, BD, 1997. Порушення сексуальної реакції після ураження паравентрикулярного ядра гіпоталамуса у самців щурів. Behav. Neurosci. 111, 1361-1367. Löber, S., Tschammer, N., Hübner, H., Melis, MR, Argiolas, A., Gmeiner, P., 2009. Азуленовий каркас в якості нового біоізостера: конструювання потужних лігандів дофамінових рецепторів D4, що індукують ерекцію статевого члена. Chem. Med. Chem. 4, 325-328. McCleskey, EW, Fox, AP, Фельдман, DH, Круз, LJ, Олівера, Б. М., Ціен, RW, Yoshikami, D., 1987. _-Конотоксин: пряма і стійка блокада специфічних типів кальцієвих каналів у нейронах, а не м'язи. Prot. Nat. Акад. Sci. USA 84, 4327-4331. McKenna, KE, 2000. Деякі пропозиції щодо організації центральної нервової системи контролю ерекції статевого члена. Neurosci. Biobehav. Преподобний 24, 535-540. Marson, L., McKenna, KE, 1992. Роль 5-гидрокситриптамина в низхідному інгібуванні спинальних статевих рефлексів. Exp. Мозок Рес. 88, 313-318. Marson, L., McKenna, KE, 1996. ЦНС-клітинні групи беруть участь у контролі ісхіковернозних і бульбоспонгиозних м'язів: трансневроновое трасування з використанням вірусу псевдобери. J. Comp. Neurol. 374, 161-179. Meisel, RL, Sachs, BD, 1994. Фізіологія чоловічої сексуальної поведінки. У: Knobil, E., Neil, J. (Ред.), Фізіологія репродукції, вип. 2, друге видання. Raven Press, Нью-Йорк, с. 3-96. Мелін П., Кіхлстром, JE, 1963. Вплив окситоцину на сексуальну поведінку у кроликів-самців. Ендокринологія 73, 433-435. Melis, MR, Argiolas, A., 1995a. Допамін і сексуальна поведінка. Neurosci. Biobehav. Преподобний 19, 19-38. Melis, MR, Argiolas, A., 1995b. Донори оксиду азоту індукують ерекцію статевого члена і позіхання при введенні в центральну нервову систему самців щурів. E. J. Pharmacol. 294, 1-9. Melis, MR, Argiolas, A., 2003. Центральна окситоцинергічна нейротрансмісія: мішень для лікування психотропної еректильної дисфункції. Curr. Препарати мішені 4, 55-66. Melis, MR, Argiolas, A., Gessa, GL, 1986. Індукована окситоцином позіхання і ерекція статевого члена: ділянка дії в головному мозку. Мозок Рес. 398, 259-265. Melis, MR, Argiolas, A., Gessa, GL, 1987. Індукована апоморфіном позіхання і ерекція статевого члена: ділянка дії в головному мозку. Мозок Рес. 415, 98-104. Melis, MR, Argiolas, A., Gessa, GL, 1989a. Апоморфін підвищує рівень плазми окситоцину у щурів. Neurosci. Lett. 98, 351-355. Melis, MR, Argiolas, A., Gessa, GL, 1989b. Докази того, що апоморфін індукує ерекцію статевого члена і позіхаючи, вивільняючи окситоцин в центральну нервову систему. E. J. Фамакол. 164, 565-570. Melis, MR, Argiolas, A., Stancampiano, R., Gessa, GL, 1990. Вплив апоморфіну на концентрацію окситоцину в різних областях мозку і плазмі щурів-самців. E. J. Pharmacol. 182, 101-107. Melis, MR, Mauri, A., Argiolas, A., 1994a. Індукована апоморфіном та окситоцином ерекція статевого члена і позіхання у інтактних і кастрованих самців щурів: ефект сексуальних стероїдів. Нейроендокринологія 59, 349-354. Melis, MR, Stancampiano, R., Argiolas, A., 1994b. Ерекція статевого члена і позіхання, викликані паравентрикулярними ін'єкціями NMDA, опосередковуються окситоцином. Pharmacol. Biochem. Behav. 48, 203-207. Melis, MR, Stancampiano, R., Argiolas, A., 1994c. Профілактика за допомогою NG-нітро-l-аргініну метилового ефіру апоморфіну та окситоцину індукованої ерекції статевого члена та позіхання: ділянка дії в мозку. Pharmacol. Biochem. Behav. 48, 799-804. Melis, MR, Succu, S., Argiolas, A., 1996. Агоністи дофаміну збільшують виробництво оксиду азоту в паравентрикулярном ядрі гіпоталамуса: кореляція з ерекцією статевого члена і позіханням. E. J. Neurosci. 8, 2056-2063. Melis, MR, Succu, S., Iannucci, U., Argiolas, A., 1997. Окситоцин підвищує продукування оксиду азоту в паравентрикулярном ядрі гіпоталамуса: кореляція з ерекцією статевого члена і позіханням. Рег. Пептиди 69, 105-112. Melis, MR, Succu, S., Mauri, A., Argiolas, A., 1998. Виробництво оксиду азоту збільшується в паравентрикулярном ядрі гіпоталамуса самців щурів під час безконтактної ерекції пеніна і копуляції. E. J. Neurosci. 10, 1968-1974. Melis, MR, Spano, MS, Succu, S., Argiolas, A., 1999a. Антагоніст окситоцину d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин знижує безконтактну ерекцію пеніса у самців щурів. Neurosci. Lett. 265, 171-174. Melis, MR, Succu, S., Spano, MS, Argiolas, A., 1999b. Морфін, що вводиться в паравентрикулярне ядро гіпоталамуса, запобігає безконтактну ерекцію і погіршує копуляцію: залучення оксиду азоту. E. J. Neurosci. 11, 1857-1864. Melis, MR, Spano, MS, Succu, S., Argiolas, A., 2000. Вплив антагоністів збудливих амінокислот, дофаміну та окситоцину на безконтактні ерекції статевого члена і паравентрикулярное виробництво оксиду азоту у самців щурів. Behav. Neurosci. 114, 849-857. Melis, MR, Succu, S., Mascia, MS, Cortis, L., Argiolas, A., 2003. Надклітинний дофамін збільшується в паравентрикулярном ядрі щурів-самців під час сексуальної активності. E. J. Neurosci. 17, 1266-1272. Melis, MR, Succu, S., Mascia, MS, Argiolas, A., 2004a. Антагонізм рецепторів каннабіноїдів CB1 у паравентрикулярному ядрі щурів-самців викликає ерекцію статевого члена. Neurosci. Lett. 359, 17-20. Melis, MR, Succu, S., Mascia, MS, Cortis, L., Argiolas, A., 2004b. Збільшення позаклітинних збудливих амінокислот в паравентрикулярном ядрі щурів-самців під час сексуальної активності: головна рольрецепторів NMDA в еректильній функції. E. J. Neurosci. 19, 2569-2575. Melis, MR, Succu, S., Mascia, MS, Argiolas, A., 2005. PD-168,077, агоніст селективного дофамінового рецептора D4, індукує ерекцію статевого члена при введенні в паравентрикулярне ядро щурів-самців. Neurosci. Lett. 379, 59-62. Melis, MR, Succu, S., Mascia, MS, Sanna, F., Melis, T., Succu, S., Castelli, MP, Argiolas, A., 2006a. SR 141716A-індукована ерекція пеніса у самців щурів: участь паравентрикулярної глутамінової кислоти та оксиду азоту. Нейрофармакологія 50, 219-228. Melis, MR, Succu, S., Sanna, F., Mascia, MS, Melis, Т., Enguehard-Gueiffier, C., Hubner, H., Gmenier, P., Gueiffier, A., Argiolas, A., 2006b. PIP3EA і PD168077, два агоністи рецептора D4 дофаміну, індукують ерекцію статевого члена у самців щурів: ділянку і механізм дії в головному мозку. E. J. Neurosci. 24, 2021-2030. Melis, MR, Melis, Т., Cocco, C., Succu, S., Sanna, F., Pillolla, G., Boi, A., Ferri, GL, Argiolas, A., 2007. Окситоцин, ін'єктований у вентральну область тегментальної області, індукує ерекцію статевого члена і підвищує надклітинний допамін у ядрі accumbens MR Melis, A. Argiolas / Neuroscience і Biobehavioral Reviews 35 (2011) 939-955 955 і паравентрикулярне ядро гіпоталамуса самців щурів. E. J. Neurosci. 26, 1026-1035. Melis, MR, Sanna, F., Succu, S., Zarone, P., Boi, A., Argiolas, A., 2009a. Роль окситоцину в передчасних і консервативних фазах сексуальної поведінки самців щурів. У: Jastrow, H., Feuerbach, D. (Ред.), Довідник з досліджень окситоцину: синтез, зберігання і вивільнення, дії та лікарські форми. Nova Publishers Inc, Нью-Йорк, США, с. 109-125. Melis, MR, Succu, S., Sanna, F., Boi, A., Argiolas, A., 2009b. Окситоцин, що вводиться в вентральний субикулум або постромедіальне кортикальне ядро мигдалини, індукує ерекцію статевого члена і збільшує позаклітинний допамін в ядрі accumbens самців щурів. E. J. Neurosci. 30, 1349-1357. Melis, MR, Succu, S., Cocco, C., Caboni, E., Sanna, F., Boi, A., Ferri, GL, Argiolas, A., 2010. Окситоцин індукує ерекцію статевого члена при введенні в вентральний сублікум: роль оксиду азоту та глутамінової кислоти. Нейрофармакологія 58, 1153-1160. Морленд, Р.Б., Накане, М., Доннеллі-Робертс, Д.Л., Міллер, Л.Н., Чанг, Р., Учік, М.Є., Терранова М.А., Губбінс Е.Ю., Хелфріч Р.Я., Намович М.Т. Майстри, JN, Brioni, JD, 2004. Порівняльна фармакологія людських допамінових D (2) -рецепторів стабільних клітинних ліній, пов'язаних з потоком кальцію через Galpha (qo5). Biochem. Pharmacol. 68, 761-772. Moos, F., Freund-Mercier, MJ, Guerne, Y., Guerne, JM, Stoeckel, ME, Richard, P., 1984. Вивільнення окситоцину і вазопресину за допомогою магніто-клітинних ядер in vitro: специфічний полегшуючий ефект окситоцину на власний випуск. J. Ендокринол. 102, 63-72. Murphy, MR, Seckl, JR, Бертон, С., Чеклі, SA, Лайтман, SL, 1987. Зміни секреції окситоцину і вазопресину під час сексуальної активності у чоловіків. J. Clin. Ендокринол. Metab. 65, 738-741. Nishimori, K., Young, LJ, Gu, Q., Wang, Z., Insel, TR, Matzuk, MM, 1996. Окситоцин необхідний для догляду, але не є суттєвим для родової діяльності або репродуктивної поведінки. Proc. Natl. Акад. Sci. USA 93, 11699-11704. Patel, S., Freedman, S., Chapman, KL, Emms, F., Fletcher, AE, Knowles, M., Marwood, R., Mccallister, G., Myers, J., Curtis, J., Kulagowski, JJ, Leeson, PD, Ridgill, M., Graham, M., Matheson, S., Rathbone, D., Watt, AP, Bristow, LJ, Rupniak, NM, Baskin, E., Lynch, JJ, Ragan, CI , 1997. Біологічний профіль L 745,870, селективний антагоніст з високою аффинностью до рецептора D4 дофаміну. J. Pharmacol. Exp. Ther. 283, 636-647. Pedersen, CA, Caldwell, JD, Jirikowski, GF, Insel, TR, 1992. Окситоцин у поведінці матерів, статевих та соціальних процесів, аннали Нью-Йоркської академії наук, вип. 652. Нью-Йоркська академія наук, Нью-Йорк. Петрович П., Каліш Р., Сінгер Т., Долан Р. Я., 2008. Окситоцин послаблює афективні оцінки умовних особин і амигдальной активності. J. Neurosci. 28, 6607-6615. Pfaus, JG, Everitt, BJ, 1995. Психофармакологія сексуальної поведінки. У: Knobil, FE, Купфер, DJ (Ред.), Психофармакологія: Четверте покоління прогресу. Raven Press, Нью-Йорк, с. 742-758. Rajfer, J., Aronson, WJ, Bush, PA, Dorey, FJ, Ignarro, LJ, 1992. Оксид азоту як медіатор релаксації кавернозного тіла у відповідь на неадренергічну, нехолінергічну нейротрансмісію. N. Engl. J. Med. 326, 90-94. Roeling, TAP, Van Erp, AMM, Meelis, W., Kruk, MR, Veening, JG, 1991. Поведінкові ефекти NMDA вводяться в гипоталамусное паравентрикулярне ядро щура. Мозок Рес. 550, 220-224. Sachs, BD, 1997. Ерекція викликана у щурів-самців повітряно-аерозольним ароматом від еструдних самок. Physiol. Behav. 62, 921-924. Sachs, BD, 2000. Контекстуальні підходи до фізіології та класифікації еректильної функції, еректильної дисфункції та сексуального збудження. Neurosci. Biobehav. Преподобний 24, 541-560. Sachs, BD, 2007. Контекстне визначення чоловічого сексуального збудження. Хорм. Behav. 51, 569-578. Sanchez, F., Alonso, JR, Arevalo, R., Blanco, Е., Aijon, J., Vazquez, R., 1994. Співіснування NADPH-діафорази з вазопресином і окситоцином в гіпоталамічних магніто-клітинних нейросекреторних ядрах щура. Клітинна тканина Res. 276, 31-34. Sanna, F., Succu, S., Boi, A., Melis, MR, Argiolas, A., 2009. Інгібітори фосфодіестерази типу 5 полегшують безконтактні ерекції у самців щурів: ділянку дії в мозку і механізм дії. J. Секс. Med. 6, 2680-2689. Saphier, D., Feldman, S., 1987. Вплив перегородкових і гіпокампальних стимулів на нейрони паравентрикулярного ядра. Неврологія 20, 749-755. Sato-Suzuki, I., Kita, I., Oguri, M., Arita, H., 1998. Стереотипні позіхаючі відповіді, індуковані електричною та хімічною стимуляцією паравентрикулярного ядра щура. J. Нейрофізіол. 80, 2765-2775. Шуман, Е.М., Медісон, Д.В., 1994. Оксид азоту і синаптична функція. Ann. Преподобний Neurosci. 17, 153-183. Снайдер, SH, 1992. Оксид азоту: спочатку в новому класі нейромедіаторів? Наука 254, 494-496. Софронів, М.В., ХНУМХ. Вазопресин і окситоцин в головному і спинному мозку ссавців. Тенденції неврозу. 6, 467-472. Sokoloff, P., Schwartz, JC, 1995. Нові рецептори допаміну через півтора десятиліття. Trends Pharmacol. Sci. 16, 270-275. Southam, E., Garthwaite, J., 1993. Сигнальний шлях азотно-оксидно-циклічного GMP у мозку щурів. Нейрофармакологія 32, 1267-1277. Stancampiano, R., Melis, MR, Argiolas, A., 1994. Ерекція статевого члена і позіхання, викликані агоністами 5-HT1c у самців щурів: зв'язок з допамінергічною та окситоцинергічною передачею. E. J. Pharmacol. 261, 149-155. Succu, S., Mascia, MS, Sanna, F., Melis, T., Argiolas, A., Melis, MR, 2006. Антагоніст рецептора каннабіноїду CB1 SR 141716A індукує ерекцію статевого члена шляхом збільшення надклітинної глутамінової кислоти в паравентрикулярном ядрі самців щурів. Behav. Мозок Рес. 169, 274-281. Succu, S., Sanna, F., Melis, T., Boi, A., Argiolas, A., Melis, MR, 2007. Стимуляція дофамінових рецепторів в паравентрикулярном ядрі гіпоталамуса самців щурів викликає ерекцію статевого члена і підвищує надклітинний дофамін в nucleus accumbens: залучення центрального окситоцину. Нейрофармакологія 52, 1034-1043. Succu, S., Sanna, F., Cocco, C., Melis, T., Boi, A., Ferri, GL, Argiolas, A., Melis, MR, 2008. Окситоцин індукує ерекцію статевого члена при введенні в область вентрального тегментального щура: роль оксиду азоту та циклічного GMP. E. J. Neurosci. 28, 813-821. Tanda, G., Pontieri, FE, Di Chiara, G., 1997. Каннабіноїди та активація героїну мезолімбічної передачі допаміну загальним механізмом опіоїдних рецепторів mu1. Наука 276, 2048-2050. Tang, Y., Rampin, O., Calas, A., Facchinetti, P., Giuliano, F., 1998. Окситоцинергічну і серотонінергічну іннервацію виявлених попереково-крижових ядер контролюють ерекцію статевого члена у самців щура. Неврологія 82, 241-254. Теодоз, DT, 1985. Синапси окситоцин-імунореактивного терміналу на нейронах окситоцину в надоптичних ядрах. Природа (Лондон) 313, 682-684. Tindall, JS, 1974. Стимули, які викликають вивільнення окситоцину. У: Geiger, SR, Knobil, Е., Сойєр, WH, Greef, R., Astwood, EB (Ред.), Довідник з фізіології. Секта. 7, Endocrinology, vol. IV. Американське товариство фізіології, Вашингтон, округ Колумбія, с. 257-267. Torres, G., Lee, S., Rivier, C., 1993. Онтогенез синтази оксиду азоту гіпоталамуса щурів і колокалізація з нейропептидами. Mol. Стільниковий Neurosci. 4, 155-163. Uhl-Bronner, S., Waltisperger, E., Martinez-Lorenzana, G., Condes, LM, Freund-Mercier, MJ, 2005. Статева диморфна експресія сайтів зв'язування окситоцину в передньому мозку і спинному мозку щура. Неврологія 135, 147-154. Vaccari, C., Lolait, SJ, Ostrowski, NL, 1998. Порівняльний розподіл вазопресину V1b і окситоцинового рецептора поштовхом рибонуклеїнових кислот у мозку. Ендокринологія 139, 5015-5033. Ван Ден Пол, А., 1991. Імунореактивність глутамату та аспартату в гіпоталамічних пресинаптичних аксонах. J. Neurosci. 11, 2087-2101. Veronneau-Longueville, F., Rampin, O., Freund-Mercier, MJ, Tang, Y., Calas, A., Marson, L., McKenna, KE, Stoeckel, ME, Benoit, G., Giuliano, F. , 1999. Окситоцинергічна іннервація вегетативних ядер, що контролює ерекцію статевого члена у щурів. Неврологія 93, 1437-1447. Vincent, SR, Kimura, H., 1992. Гістохімічне картування синтази оксиду азоту в мозку щурів. Неврологія 46, 755-784. Wagner, CK, Clemens, LG, 1993. Нейрофізинсодержащий шлях від паравентрикулярного ядра гіпоталамуса до сексуально-диморфного моторного ядра в поперековому спинному мозку. J. Comp. Neurol. 336, 106-116. Winslow, JT, Insel, TR, 1991. Соціальний статус у парах мавп білків чоловічої статі визначає поведінковий відповідь на центральне введення окситоцину. J. Neurosci. 11, 2032-2038. Wise, RA, Rompre, P.-P., 1989. Мозковий допамін і винагорода. Ann. Преподобний Психол. 40, 191-225. Witt, DM, Insel, TR, 1994. Статева поведінка чоловіків активує c-fos-подібний білок у нейронах окситоцину в паравентрикулярном ядрі гіпоталамуса. J. Нейроендокринол. 6, 13-18. Witter, MP, 2006. З'єднання субликула щура: топографія по відношенню до колоночной і ламінарної організації. Behav Brain Res. 174, 251-264. Вудрафф, Г.Н., Фостер, А.С., Гілл, Р., Кемп, Я.А., Вонг, Е.Х., Іверсен, Л.Л., 1987. Взаємодія між МК-ХНУМХ і рецепторами N-метил-d-аспартату: функціональні наслідки. Нейрофармакологія 26, 903-909. Yamashita, H., Shigeru, O., Inenaga, K., Kasai, M., Uesugi, S., Kannan, H., Kaneko, T., 1987. Окситоцин переважно збуджує передбачувані нейрони окситоцину в надоптичному ядрі щура in vitro. Мозок Рес. 416, 364-368. Вигукує, DP, Хендрікс, SE, Prendergast, MA, 1992. Ураження ядра paragigantocellularis: вплив на поведінку спарювання у самців щурів. Мозок Рес. 596, 73-79. Young, WS, Shepard, E., Amico, J., Hennighausen, L., LaMarca, ME, McKinney, C., Ginns, EI, 1996. Дефіцит окситоцину миші запобігає викид молока, але не родючості або родів. J. Нейроендокринол. 8, 847-854. Zahran, AR, Vachon, P., Courtois, F., Carrier, S., 2000. Збільшення внутрішньокавернозного тиску статевого члена після ін'єкцій агоністів рецептора збудливих амінокислот в гіпоталамусному паравентрикулярном ядрі анестезованих щурів. J. Urol.