КОМЕНТАРИ: огляд провідного дослідника з питань ожиріння та харчової залежності.
Том 69, випуск 4, 24 лютий 2011, сторінки 664 – 679
http://dx.doi.org/10.1016/j.neuron.2011.02.016,
Розгляд
Пол Дж. Кенні1, ,
1 Лабораторія поведінкової та молекулярної нейрології, кафедра молекулярної терапії, Науково-дослідний інститут Скриппса, Юпітер, штат Флорида, 33458, США
________________________________________
Харчування споживається для того, щоб підтримувати енергетичний баланс на гомеостатичних рівнях. Крім того, смачна їжа споживається також за свої гедонічні властивості, незалежні від енергетичного статусу. Таке споживання, пов'язане з винагородою, може призвести до перевищення калорійності, що перевищує вимоги, і вважається основним винуватцем у швидко зростаючих показниках ожиріння в розвинених країнах. У порівнянні з гомеостатичними механізмами годування, набагато менше відомо про те, як гедонічні системи в мозку впливають на споживання їжі. Цікаво, що надмірне споживання смачної їжі може викликати нейроадаптивні реакції в схемах винагороди мозку, подібних до наркотичних засобів. Крім того, подібні генетичні уразливості в системах винагороди мозку можуть підвищити схильність до наркоманії та ожиріння. Тут будуть розглянуті останні досягнення нашого розуміння мозкових ланцюгів, які регулюють гедонічні аспекти поведінки харчування. Також будуть розглянуті нові факти, які свідчать про те, що ожиріння і наркоманія можуть поділяти загальні гедонічні механізми.
________________________________________
Основний текст
"Немає щирішої любові, ніж любов до їжі".
—Джордж Бернар Шоу
Вступ
Ожиріння, що визначається як індекс маси тіла (ІМТ)> 30, - це стан, при якому ожиріння є аномально високим і може бути наслідком гіперфагії або зниження швидкості метаболізму (O'Rahilly, 2009). Надмірне ожиріння є основним фактором ризику серцево-судинних захворювань, раку, діабету 2 типу та порушень настрою, оскільки люди з ожирінням часто страждають від соціальної стигматизації ([Bean et al., 2008], [Центри контролю та профілактики захворювань, 2009] та [Luppino et al., 2010]). За даними Центру контролю за захворюваннями (CDC), витрати на охорону здоров’я, пов’язані з ожирінням, у США між 1998 і 2000 рр. Становили приблизно 213 млрд. Доларів. Крім того, 300,000 1999 смертей у Сполучених Штатах щороку можна віднести до захворювань, пов’язаних із надмірною вагою та ожирінням (Allison et al., 30), при цьому ожиріння є другою провідною причиною смерті, яку можна запобігти вживанню тютюну. Тим не менше, поширеність ожиріння в західних суспільствах продовжує різко зростати, і, за сучасними підрахунками, понад 2010% дорослих в США страждають ожирінням (Flegal et al., XNUMX).
Більшість концептуалізацій регулювання годування пропонують взаємодія двох паралельних систем для впливу на споживання їжі ([Hommel et al., 2006], [Lutter and Nestler, 2009] та [Morton et al., 2006]). Гомеостатична система включає гормональні регулятори рівня голоду, ситості та ожиріння, такі як лептин, грелін та інсулін, які діють на гіпоталамічні та мозкові стовбурові ланцюги, щоб стимулювати або гальмувати годування з метою підтримки відповідного рівня енергетичного балансу. Дисфункція компонентів гомеостатичної системи, наприклад, вроджена недостатність лептину, може призвести до стійкого стану позитивного енергетичного балансу та розвитку ожиріння ([Campfield et al., 1995], [Halaas et al., 1995] та [Pelleymounter та ін., 1995]). Механізми, за допомогою яких гормональні регулятори голоду та ситості діють на гіпоталамічні та стовбурові ланцюги мозку для підтримки енергетичного гомеостазу, були детально описані в інших місцях, і читачі, зацікавлені в цій темі, посилаються на безліч чудових відгуків на цю тему (наприклад, [Abizaid та ін., 2006a] та [Gao and Horvath, 2007]).
На додаток до метаболічних систем, системи винагороди мозку також відіграють важливу роль у поведінці харчування ([Lutter and Nestler, 2009] та [Saper et al., 2002]). Загалом, м’яку їжу не їдять надмірно, тоді як смачну їжу часто вживають навіть після того, як задовольняються енергетичні потреби. Легкість доступу до смачної енергоємної їжі вважається основним фактором екологічного ризику ожиріння (Volkow and Wise, 2005), а надмірне споживання смачної їжі вважається основним фактором, що сприяє недавньому сплеску ожиріння ([Finkelstein et al., 2005], [Hill et al., 2003] та [Swinburn et al., 2009]). Дійсно, отримання приємних ефектів смачної їжі є потужною спонукальною силою, яка у деяких людей може перекрити гомеостатичні сигнали ([Shomaker et al., 2010], [Sunday et al., 1983] та [Zheng et al., 2009]) . Коли їм пропонують вибір, щури в переважній більшості віддають перевагу споживанню безкалорійного розчину сахарину, а не самостійному введенню внутрішньовенних інфузій кокаїну (Lenoir et al., 2007). Більш того, ситі щури добровільно піддаються сильному холоду (-15 ° C), шкідливому жаркому болю або неприємному поштовху, щоб отримати смачні харчові продукти, такі як пісочний пиріг, м'ясний паштет, арахісове масло, кока-кола, цукерки M&M, шоколад чіпси або йогуртові краплі, навіть коли менш смачна стандартна чау є у вільному доступі ([Cabanac and Johnson, 1983], [Foo and Mason, 2005] та [Oswald et al., 2010]). Ці висновки підкреслюють, наскільки інтенсивно макроелементи в смачній їжі можуть стимулювати системи винагороди мозку, незалежно від їх калорійності ([Wang et al., 2004a] та [Wang et al., 2004b]), і наскільки високою може бути мотивація споживати смачну їжу навіть за відсутності гомеостатичних потреб у енергії. Наркотики, такі як кокаїн або нікотин, також можуть спричинити високий рівень споживчої поведінки, хоча вони позбавлені калорійності та поживності. Насправді, через численні подібності між переїданням ожиріння та надмірним вживанням наркотиків при наркоманії (Volkow and Wise, 2005), стверджується, що ожиріння слід розглядати як розлад головного мозку і включати як діагностичну категорію в майбутнє п’яте видання Посібника з діагностики та статистики психічних розладів (DSM-V) ([Devlin, 2007] та [Volkow and O'Brien, 2007]). Порівняно з гомеостатичними механізмами харчової поведінки значно менше відомо про те, як гедоністичні системи впливають на споживання їжі. Подібним чином, вплив внутрішніх змін, спричинених дієтою, на реакцію систем винагороди мозку та те, як ці ефекти сприяють переїданню та ожирінню, залишається незрозумілим. Нижче наведено останні дані, що висвітлюють досягнення нашого розуміння гедонічних механізмів прийому їжі та індукованих дієтою змін у нагороджувальній діяльності мозку, які можуть сприяти розвитку ожиріння
Активізація систем відшкодування мозку у відповідь на харчову їжу: взаємодія з гормональними регуляторами енергетичного балансу
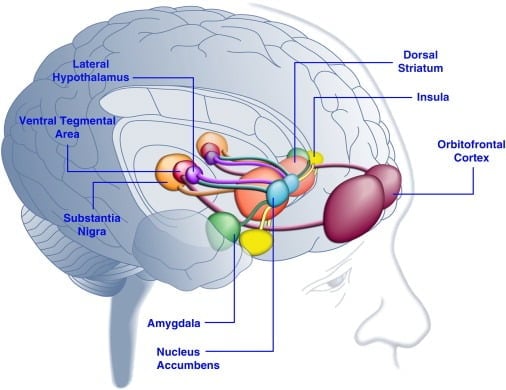
Споживання смачної їжі може покращити настрій у людей ([Dallman et al., 2003] та [Macht та Mueller, 2007]) та підтримати встановлення переваги умовного місця у лабораторних тварин ([Imaizumi et al., 2001] та [ Sclafani та ін., 1998]). Ці ефекти, ймовірно, пов’язані зі стимулюванням систем винагороди мозку смачною їжею (мал. 1). Дійсно, дослідження візуалізації мозку людини показали, що зорові та нюхові сигнали, пов'язані з їжею та їжею, можуть активувати кортиколімбічні та мезоакументові ланцюги мозку, пов'язані з винагородою, зокрема, орбітофронтальну кору (OFC), інсулу, мигдалину, гіпоталамус, стриатум та середній мозок включаючи вентральну тегментальну область (VTA) і substantia nigra (SN) ([Bragulat et al., 2010], [Pelchat et al., 2004], [Schur et al., 2009] та [Simmons et al., 2005]) ). Струйатум, інсула, кора передньої черепиці та середній мозок кодують суб'єктивну цінність винагороди незалежно від їх типу (наприклад, їжа, стать, грошові винагороди), що відповідає ролі цієї мережі нейронів у загальному гедонічному представленні (Sescosese et al. , 2010). На відміну від цього, OFC відіграє особливо помітну роль у уявленнях, пов'язаних зі значенням певних видів винагород, включаючи смачну їжу ([Man et al., 2009], [Rolls, 2008] та [Sescosese et al., 2010]) ). Голод може посилити сприятливу харчову активацію кортиколімбічної та середньої мозкових областей у людей (LaBar et al., 2001). Наприклад, інтенсивність активації вентрального стриатуму, мигдалини, інсули та OFC у відповідь на висококалорійну смачну їжу була набагато більшою, коли люди піддавали голоду, а не ситі (Goldstone et al., 2009). Це узгоджується з тим, що періоди голоду та дієти збільшують рейтинги «сили» смачної їжі та тяги до «спокусливої» їжі ([Hofmann et al., 2010] та [Rolls et al., 1983]) ). І навпаки, перегодовування може знизити реакції нейронів на смачну їжу, особливо в остьовій корі та гіпоталамусі (Cornier et al., 2009). Отже, на гедонічну цінність їжі впливає метаболічний стан, що дозволяє припустити, що регулятори метаболізму, такі як лептин та грелін, можуть впливати на активність гедонічних систем у мозку. Відповідно до цієї точки зору, люди, які отримували лептин або пептид післяпрандіального фактора YY3-36 (PYY) ([Batterham et al., 2007] та [Farooqi et al., 2007]), або ті, хто переніс шлункову дистацію. імітуючи прийом їжі (Wang et al., 2008), знижували активність у пов'язаних з винагородою ділянках мозку. І навпаки, пацієнти з гіперфагічною хворобою людини з вродженою недостатністю лептину демонструють підвищену активність в остьовій корі та стриатумі у відповідь на зображення їжі ([Baicy et al., 2007] та [Farooqi et al., 2007]). У цих людей замісна терапія лептином послаблювала посилену острівну та смугасту активність та зменшувала самолюбство сподобання їжі ([Baicy et al., 2007] та [Farooqi et al., 2007]). Лікування лептином також блокує корисні властивості сахарози у щурів з обмеженою їжею, аналогічні антагоністу рецептора дофаміну α-флупентіксол (Figlewicz et al., 2001). Крім того, рецептори лептину експресуються на нейронах дофаміну середнього мозку у VTA та SN (Figlewicz et al., 2003), що дозволяє припустити, що лептин може впливати на гедонічні аспекти поведінки годування за допомогою модуляції мезотріатальної передачі дофаміну. Підтверджуючи цю можливість, вливання лептину у ВТА пригнічувало активність дофамінових нейронів та зменшувало споживання їжі щурів (Hommel et al., 2006; див. Також Krügel et al., 2003). І навпаки, збиття рецепторів лептину у ВТА збільшувало споживання їжі, посилювало опорно-рухову активність та збільшувало перевагу смачної їжі у щурів (Hommel et al., 2006). Тому лептин чинить пригнічуючий вплив на передачу дофаміну мезоакумуляторів, нейромедіаторну систему, яка сильно впливає на винагороду та мотивацію, але менше - на енергетичний гомеостаз ([de Araujo et al., 2010] та [Vucetic and Reyes, 2010]). Нещодавно було показано, що пов'язаний з голодом гормон грелін ([Kojima et al., 1999] та [Nakazato et al., 2001]) потенціював активацію гедонічних систем у мозку у відповідь на харчові сигнали (Malik et al. , 2008). Зокрема, грелін посилив активацію OFC, мигдалини, інсули, стриатуму, VTA та SN у відповідь на знімки високопокушеної їжі у людей з ожирінням (Malik et al., 2008). У щурів грелін чинить стимулюючу дію на дофамінові системи середнього мозку ([Abizaid et al., 2006b], [Jerlhag et al., 2006] та [Jerlhag et al., 2007]) і збільшує корисну цінність приємної їжі (Perello та ін., 2010).
Малюнок 1. Ділянки мозку людини, що активізуються у відповідь на смачну їжу або пов'язані з їжею ознаки. Вважається, що орбітофронтальна кора і мигдалина кодують інформацію, пов’язану з винагородною цінністю їжі ([Baxter and Murray, 2002], [Holland and Gallagher, 2004], [Kringelbach et al., 2003], [O’Doherty et al. , 2002] та [Rolls, 2010]). Інсула обробляє інформацію, що стосується смаку їжі та її гедонічної оцінки ([Balleine and Dickinson, 2000] та [Small, 2010]). Nucleus accumbens і дорсальний смугастий вузол, які отримують дофамінергічний вхід з вентральної ділянки ділянки та чорної субстанції, регулюють мотиваційні та стимулюючі властивості їжі ([Baicy et al., 2007], [Berridge, 1996], [Berridge, 2009], [Farooqi et al., 2007], [Malik et al., 2008] та [Söderpalm and Berridge, 2000]). Бічний гіпоталамус може регулювати корисні реакції на смачну їжу та стимулювати поведінку, яка шукає їжу (Kelley et al., 1996). Ці мозкові структури діють узгоджено, щоб регулювати вивчення гедоністичних властивостей їжі, спрямовуючи увагу та зусилля на отримання продовольчих винагород та регулюючи стимулюючу цінність екологічних стимулів, які передбачають наявність харчових винагород (Dagher, 2009). Для наочності показано не всі взаємозв'язки між цими структурами.
Подібні ділянки мозку активізуються приємною їжею в мозку щурів, як ті, що активуються у людини, що вимірюється експресією негайних ранніх генів (IEG), таких як c-fos, дуга або zif268. Дійсно, смачна їжа активує дорсальний та вентральний стриатум, ВТА, бічний гіпоталамус (ЛГ) та центральні та базолатеральні ядра міндалини та пов’язані з нагодою коркові структури у щурів ([Анджелес-Кастелланос та ін., 2007], [Парк та ін.) Carr, 1998] та [Schiltz et al., 2007]). Цікаво, що імунореактивність Fos фактично знижувалася в латеральній та медіальній габенулі у щурів після смачного споживання їжі (LHb) (Park and Carr, 1998). У приматів, нелюдських, ЛГб активується за допомогою відвертих подразників або опущення очікуваної винагороди і гальмується доставкою винагородного соку (Matsumoto and Hikosaka, 2007). Крім того, активність LHb пригнічує пов'язані з нагородами нейрони, що містять мезоаккументи дофаміну, шляхом непрямого шляху, що включає ростромедіальне тегментальне ядро (RMTg) (Jhou et al., 2009). Отже, габенулярная активність обернено пов'язана з гедонікою їжі, що дозволяє припустити, що габенулярний комплекс може впливати на не гомеостатичне харчування. Дійсно, активація LHb нещодавно показала зменшення споживання сахарози у щурів, тоді як ураження LHb збільшують поведінку, яка шукає сахарозу (Friedman et al., 2011). Зважаючи на те, що габенулярний комплекс невеликий і складний для виявлення та функціонального зображення у людини (Salas et al., 2010), це може пояснити, чому про зміни в габенулярной активності не було повідомлено в дослідженнях зображень людини у відповідь на смачну їжу.
Мозкові ланцюги, які регулюють гедонічне харчування: Дофамінові системи середнього мозку
Дофаміновий шлях мезоакуменсів активується у людей та лабораторних тварин у відповідь на смачну їжу або апетитні ознаки, пов’язані з їжею, а також лептин, грелін та інші регулятори апетиту впливають на активність у цій системі. Це говорить про те, що дофамінові системи середнього мозку відіграють важливу роль у смачному споживанні їжі. Мабуть, найяскравішим свідченням того, що передача дофаміну середнього мозку впливає на приємне споживання їжі у людей, є той факт, що пацієнти з хворобою Паркінсона (ПД), у яких відбувається дегенерація дофаміновмісних нейронів у середньому мозку, споживають менше їжі, ніж не уражені особи (Ніренберг та Води, 2006). Більше того, лікування хворих на ПД агоністами допамінових рецепторів може спричинити компульсивно споживання смачної їжі ([Dagher and Robbins, 2009] та [Nirenberg and Waters, 2006]). Насправді, агоністи рецепторів дофаміну можуть викликати гедонічне переїдання навіть у осіб, що не мають БП (Cornelius et al., 2010). У тварин смачні розчини сахарози стимулюють передачу дофаміну в NAc (Hernandez and Hoebel, 1988), ефект, який узгоджується з дослідженнями зображень людського мозку (Small et al., 2003). За допомогою циклічної вольтамперометрії швидкого сканування було показано, що сигнали, що передбачають доставку винагороди за сахарозу або несподівану доставку сахарози, викликали передачу дофаміну в NAc ([Roitman et al., 2004] та [Roitman et al., 2008]). Крім того, несподівана доставка шкідливих розчинів хініну мала протилежний ефект, зменшуючи передачу аккумального дофаміну (Roitman et al., 2008). Нарешті, миші, у яких фермент тирозингідроксилаза (TH) був інактивований, внаслідок чого у них дефіцит дофаміну, все ще демонструють помітну перевагу до розчинів сахарози (або сахарину) порівняно з водою, але споживають менше загальної кількості сахарози, ніж контрольні миші ( Гармата і Пальмітер, 2003). Це свідчить про те, що миші з дефіцитом дофаміну все ще можуть виявити смакові якості сахарози і віддають перевагу цим розчинам воді, але не здатні підтримувати споживання смачних розчинів. Тому було запропоновано, щоб передача дофаміну в мезоакуменс регулювала мотиваційні аспекти поведінки годування, які залучені до заготівлі їжі, а інші системи нейромедіаторів, ймовірно, регулювали гедонічні аспекти смачного споживання їжі.
Мозкові ланцюги, які регулюють гедонічне харчування: Стріатогіпоталамічні системи
Введення агоністів мк-опіоїдних рецепторів, таких як [D-Ala2-N-Me-Phe4-глі-ol5] -енкефалін (DAMGO), в NAc стимулює поведінку годування щурів з доступом до лібіту до їжі (тобто, гомеостатичне годування) ( [Peciña and Berridge, 2005] та [Zhang et al., 1998]). І навпаки, антагоністи опіоїдних рецепторів, влиті в NAc, знижують споживання бажаної їжі, не впливаючи на прийом менш приємних альтернатив (Kelley et al., 1996). Ці дані узгоджуються з думкою, що смугасті опіоїдні системи регулюють гедонічні властивості смачної їжі. Особливо важливу роль в гомеостатичному вигодовуванні відіграє область оболонки NAc і, зокрема, гедонічні «гарячі точки» у ростродоральної області медіальної оболонки ([Peciña and Berridge, 2005] та [Peciña et al., 2006b]). Оскільки активація мк-опіоїдних рецепторів призводить до пригнічення активності нейронів середнього колючого нерва в NAc, було запропоновано, щоб оболонка NAc здійснювала інгібіторну дію на споживання їжі, сприятливої (Kelley et al., 2005). Відповідно до цього погляду, стимуляція інгібіторних GABAA або GABAB рецепторів ([Basso і Kelley, 1999] та [Stratford and Kelley, 1997]) або блокада збуджуючих іонотропних рецепторів глутамату (Maldonado-Irizarry et al., 1995) в оболонці NAc. збільшує споживання їжі. Аналогічно, ексцитотоксичне ураження оболонки NAc також збільшує споживання їжі та підвищує чутливість до нагородження їжею ([Johnson et al., 1996] та [Maldonado-Irizarry and Kelley, 1995]). Зокрема, споживання енергетично щільної смачної їжі переважно спричинене цими маніпуляціями ([Basso та Kelley, 1999], [Kelley et al., 2005] та [Zhang et al., 1998]).
Враховуючи основний вплив акумбальної сигналізації на гедонічне годування, Томпсон і Свонсон (2010) використовували процедуру відстеження ланцюга, щоб точно визначити точні анатомічні мережі, за допомогою яких NAc може впливати на споживання їжі, що споживається. У цих вишуканих дослідженнях щури отримали дві неонові ін'єкції антероградного / ретроградного відстежувачів (звані COIN) в місця оболонки NAc, які сильно впливають на смачне споживання їжі, і були виявлені аферентні / еферентні зв'язки. Було показано, що пов'язані з годуванням ділянки в NAc поширюють інгібіторні проекції переважно до переднього ЛГ та вентрального паліда (ВП) (Thompson and Swanson, 2010). На відміну від решти NAc, яка щільно виступає на VTA, гедонічні гарячі точки в оболонці NAc проектують на міжфасцикулярне ядро (ІФН), структуру, розташовану поруч з ВТА, що зворотно розширює дофамінергічні проекції. Оболонка NAc (Томпсон і Суонсон, 2010). Крім того, передній ЛГ проеціюється до ЛГб (Томпсон і Суонсон, 2010), що знову дозволяє припустити, що габентулярний комплекс може грати роль у харчовій гедоніці (Friedman et al., 2011).
Наведені вище дані показують, що ЛГ отримує помітний інгібіторний вхід з місць в NAc, які чинять тонізуючий вплив на смачне споживання їжі. ЛГ також має функціональну зв'язок з іншими корковими та лімбічними ділянками мозку, пов'язаними з організацією та спрямуванням поведінки на отримання приємної їжі (мал. 1), наприклад, OFC, інсула та мигдалина. Важливо, що інактивація ЛГ скасовує стимулюючу дію маніпуляцій NAc на прийом їжі ([Maldonado-Irizarry et al., 1995] та [Will et al., 2003]). Крім того, інактивація оболонки NAc посилює активність ЛГ, зокрема нейронів ЛГ, які синтезують нейропептидний гіпокретин (також відомий як орексин), як вимірюють імунореактивністю Фоса ([Baldo et al., 2004] та [Stratford and Kelley, 1999 ]). Дійсно, вливання агоніста мк-опіоїдного рецептора DAMGO в оболонку NAc активує гіпокретин, що містить нейрони в гіпоталамусі (Zheng et al., 2007), а порушення передачі гіпокретину в VTA скасовує приємне вживання їжі, викликане внутрішньо-NAc DAMGO вливанням. (Zheng та ін., 2007). Таким чином, гарячі точки гедонів у оболонці NAc надають тонізуючий вплив на нейрони ЛГ, зокрема на нейрони, що містять гіпокретин (Louis et al., 2010), тим самим обмежуючи споживання смачної їжі. Порушення цього акумулятивного "сигналу зупинки", наприклад, завдяки посиленій сигналізації опіоїдних рецепторів, призводить до посилення активності ЛГ, що призводить до споживання не гомеостатичного смаку їжі (рис. 2).
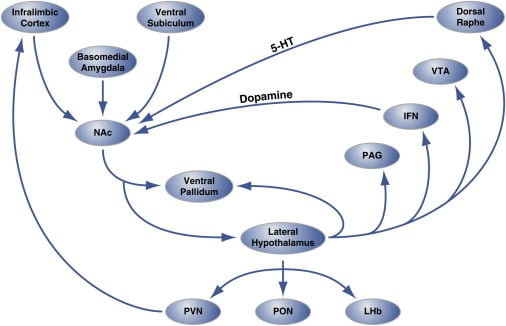
Рисунок 2. Організація на рівні ланцюга гедонічних "гарячих плям" в оболонці ядерних накопичень, яка регулює гедонічне харчування
Область оболонки ядра accumbens (NAc) отримує іннервацію від коркових та лімбічних ділянок головного мозку та проекцій до бічного гіпоталамуса та вентрального блідості. У свою чергу, латеральний гіпоталамус також виступає на вентральний палідій, а також на ядро PAG, IFN, VTA та дорсальне рафе. ІФН та дорсальний рафа поширюють дофамінергічні та серотонінергічні прогнози відповідно до NAc. Бічний гіпоталамус також іннервує таламічні (PVN і PON) та епіталамічні (LHb) структури. Не показані незначні проекції від бічного гіпоталамуса до септальних областей мозку. 5-HT, серотонін; ІФН, міжфасцикулярне ядро; LHb, бічна габенула; PON, преоптичне ядро; PVN, паравентрикулярне ядро таламуса; VTA, вентральна тегментальна область. Фігура адаптована з дозволу Томпсона та Суонсона (2010).
Мозкові ланцюги, які регулюють гедонічне харчування: Стріатопалідальні системи
Крім ЛГ, нейронні оболонки NAc також проектуються на ВП (мал. 2). В цікавій серії експериментів було показано, що акумулятивні проекції на ВП та ЛГ можуть регулювати дисоційовані аспекти не гомеостатичного прийому їжі (Сміт та Берридж, 2007). Вливання DAMGO або в оболонку NAc, або на ВП посилювало орофасциальну реакцію на розчини сахарози, гіпотезуючи, що відображає реакції "симпатії" у щурів (тобто реакцію на смакові якості), а також збільшує споживання їжі (Smith and Berridge, 2007). Вливання налоксону або в NAc, або в VP знижувало реакції подобання обличчя на сахарозу, що дозволяє припустити, що синхронізована передача опіоїдів у NAc та VP необхідна для обробки смакової їжі. Однак налоксон, влитий у NAc, але не ВП, зменшив гомеостатичне харчування (Сміт та Берридж, 2007), що дозволяє припустити, що гомеостатичне харчування відбувається незалежно від цього NAc → VP-зв’язку і натомість, ймовірно, покладається на шлях NAc → LH ([Smith and Берридж, 2007] та [Taha et al., 2009]). Відповідно до думки про те, що аспекти не гомеостатичного вживання їжі можуть бути дисоційованими, записи в одній одиниці показали, що популяція нейронів NAc виявляється вибірково кодуючи інформацію, що стосується відносних зміцнюючих властивостей їжі (тобто смакових властивостей) (Taha and Fields, 2005) . У тих самих щурів зміни активності другої популяції нейронів NAc збігалися з початком поведінки годування (Taha and Fields, 2005).
Мозкові ланцюги, що регулюють гедонічне харчування: амігдалярні системи
Далі підтримуючи уявлення про те, що аспекти їжі без гомеостатики є дисоційованими, вливання налоксону в оболонку NAc або ВП, але не базолатеральна мигдалина (BLA), зменшила смакові якості розчинів сахарози (Wassum et al., 2009). Однак, коли антагоністи мк-опіоїдних рецепторів налоксон або CTOP вливались у BLA, а не NAc-оболонку чи VP, спостерігалося помітне ослаблення підвищеної мотивації відповідати на розчини сахарози, як правило, голодні ([Wassum et al ., 2011] та [Wassum et al., 2009]). Це говорить про те, що стимулюючі властивості сахарози регулюються навколоносовими ланцюгами. В цілому, наведені вище дані показують, що різні аспекти гедонічного вживання їжі, такі як обробка інформації, пов'язаної з приємністю їжі, поведінкою підходу та збільшенням стимулюючої цінності смачної їжі у голодних тварин, диференційовано регулюються дискретними мікроциркуляціями в контексті більша кортиколімбічна-стриатопалідальна-гіпоталамо-таламокортикальна схема (мал. 2).
Чи пристосовують мозкові гедонічні ланцюги примусові їжі?
Kelley et al. Розглядали функціональне значення гедонових точок в оболонці NAc та їх вплив на більш широкі схеми, пов'язані з годуванням у мозку. (2005). Вони гіпотезують, що шлях оболонки NAc → LH, поряд із регуляторними областями головного та нижнього течії (мал. 2), служить «дозорному» призначенню (Kelley et al., 2005). Зокрема, вони пропонують, що навіть у голодних тварин, коли потяг до їжі є сильним, здатність припинити поведінку з годуванням повинна зберігатися у випадку загрози з боку навколишнього середовища (Kelley et al., 2005). Таким чином, активація нейронів оболонки NAc і супутнє інгібування нейронів ЛГ можуть порушити постійне годування і полегшити перехід поведінки на більш відповідні адаптивні реакції, такі як заморожування або втеча (Kelley et al., 2005). Якщо це дійсно так, то важливо буде дослідити, чи порушена ця оболонка NAc → ШВЛ через надмірне споживання смачної їжі або генетичні фактори, що впливають на вразливість до ожиріння. Зважаючи на це, наша лабораторія та інші нещодавно повідомили, що надмірне споживання приємної їжі, калорійної калорій, пов'язане з появою компульсивно-поведінкової їжі у щурів ([Джонсон та Кенні, 2010], [Latagliata et al., 2010] та [Освальд та ін., 2010]). Зокрема, ми виявили, що смачне споживання їжі у ожирілих щурів було стійким до зриву від агресивного умовного подразника, який передбачив негативний результат (електричний стоп) (Johnson and Kenny, 2010). Таким чином, буде важливо перевірити, чи дефіцит в оболонці NAc → ЛГ, керований переїданням, принаймні частково сприяє помітній недостатності надмірної ваги та ожиріння людей використовувати інформацію щодо згубних наслідків їх споживчої поведінки для зменшення споживання їжі. .
Змінена активність відшкодування мозку при ожирінні: дослідження зображень мозку людини
Отримання стимулюючого впливу приємної їжі на системи відшкодування мозку вважається важливим мотиваційним фактором, що сприяє переїданню. Таким чином, важливе питання полягає в тому, чи можуть зміни в функції відшкодування мозку сприяти розвитку ожиріння. Інтуїтивно зрозумілий прогноз полягає в тому, що посилена конститутивна реакція системи відшкодування мозку на смачну їжу призведе до переїдання та збільшення ваги. Відповідно до цієї гіпотези, люди з високим рівнем чутливості до нагородження ознакою виявляють посилену активність у регіонах мозку, пов'язаних із нагородою за їжу, включаючи NAc, мигдалину, OFC та VP, піддаючись смачній їжі, такі як шоколадний торт та піца (Beaver et al. , 2006). Ожирілі люди аналогічно демонструють посилену активацію схем нагородження мозку у відповідь на смачну їжу або асоційовані з їжею сигнали порівняно з худим контролем ([Gautier et al., 2000], [Karhunen et al., 1997] та [Rothemund et al., 2007 ]). Високий рівень чутливості до нагородження рисою також співвідносився із збільшенням маси тіла у людей ([Davis et al., 2004] та [Franken and Muris, 2005]). Однак важливо, що жінка з ожирінням (ІМТ> 30) мала вищий рівень ангедонії (тобто знижена вихідна чутливість до винагороди), ніж жінка із зайвою вагою (ІМТ> 25 <30) (Davis et al., 2004). Аналогічно, Стейс і колеги (2008b) показали, що у дівчаток-підлітків з ожирінням спостерігається підвищена активація інсули та інших коркових областей мозку у відповідь на приємну їжу або асоційовані з їжею сигнали порівняно з суб'єктами, що контролюють худість, але що активізує хвостату область стриатум у відповідь на приємну їжу обернено корелювався з ІМТ у страждаючих ожирінням. Більше того, у жінок, які набрали вагу протягом періоду місяця 6, спостерігалося помітне зниження стриптичної активності у відповідь на смачну їжу протягом цього періоду часу порівняно з жінками, які не набирали вагу (Stice et al., 2010a). Якщо взяти все це разом, виявляється, що гіперчутливість схем нагород може схилити людину до переїдання та збільшення ваги (Stice et al., 2010b). Однак у міру збільшення набору ваги тоді може почати формуватися дефіцит активності конкретних компонентів системи відшкодування мозку, зокрема стріатуму. Було запропоновано, що поява цього стану гіпосенситивності винагородження може утримати надмірне споживання приємної їжі з метою подолання такого дефіциту винагороди ([Stice et al., 2008a] та [Wang et al., 2002]). Отже, здається, що занадто мала або занадто велика винагорода за їжу збільшує вразливість до переїдання та ожиріння (Stoeckel, 2010). Привабливою концептуальною основою для узгодження цих, очевидно протилежних точок зору, є те, що кортиколімбічні області, які беруть участь у організації поведінки щодо отримання нагород за їжу та прогнозуванні очікуваної майбутньої винагороди за їжу, можуть стати гіперактивними для людей з надмірною вагою та осіб, схильних до ожиріння. І навпаки, смугасті ділянки мозку, які обробляють фактичний досвід задоволення від гедонічного їжі, можуть поступово ставати менш функціональними у цих самих людей. Відносна мотиваційна цінність смачної їжі, отже, очікується, що під час розвитку ожиріння збільшуватиметься в той же час, коли гедонічна цінність, отримана від споживання смачної їжі, зменшуватиметься.
Змінена активність відшкодування мозку при ожирінні: дослідження гризунів
Вплив споживання їжі на смак на системи відшкодування головного мозку безпосередньо оцінювали у лабораторних тварин, використовуючи процедуру винагороди за стимуляцію мозку (BSR). Добре відомо, що електрична стимуляція ЛГ, яка отримує тонізуючий вхід з акумуляторних гедонових гарячих точок (мал. 2), є дуже корисною, і щури будуть наполегливо працювати, щоб самостимулювати цю область мозку, наприклад (Markou та Frank, 1987 ). На додаток до підтримки поведінки самостимуляції, електричне стимулювання ЛГ також може викликати інтенсивні нападки поведінки годування (Margules and Olds, 1962), і було запропоновано, щоб нагороджувальні властивості стимуляції ЛГ могли бути пов'язані з внутрішньою роллю цього. сайт головного мозку в апетитних та стимулюючих властивостях їжі (Margules and Olds, 1962). Відповідно до такої точки зору, голод і втрата ваги підвищують чутливість щурів до самооцінки LH, що приносить користь ([Blundell and Herberg, 1968], [Carr and Simon, 1984] та [Margules and Olds, 1962]), ефект який може бути заблокований внутрішньомозкової інфузією лептину (Fulton et al., 2000). І навпаки, електричне самостимуляція ЛГ гальмується у насичених тварин (Wilkinson and Peele, 1962). Дійсно, перегодовування щурів через внутрішньошлункову трубку для годування (Hoebel і Teitelbaum, 1962), шлункове відходження або внутрішньовенне вливання глюкагону, що імітує постпрандіальну ситості ([Hoebel, 1969], [Hoebel and Balagura, 1967] і [Mount and Hoebel, 1967]) ), всі ослаблені реагують на стимуляцію ЛГ. Насправді, щури, які раніше енергійно реагували на користь стимуляції ЛГ, будуть відповідати так, як ніби ця стимуляція була відвертою після прийому їжі або розвитку ожиріння (Hoebel і Thompson, 1969). Отже, хронічне обмеження їжі та втрата ваги посилюється, тоді як перегодовування зменшується, чутливість сайтів, що стосуються нагород, у ЛГ. Тому чутливість нейронів ЛГ до винагороди за електричну самостимуляцію може, таким чином, дати важливе розуміння функціонування мозкової схеми, яка регулює гедонічну реакцію на їжу.
Оскільки простота доступу до енергетично щільної смачної їжі та пов'язана з цим надмірне споживання вважається головним фактором навколишнього середовища, що сприяє ожирінню (Volkow and Wise, 2005), наша лабораторія нещодавно використовувала процедуру BSR для оцінки активності винагородження мозку у щурів із розширеним доступом до приємної їжі. . Зокрема, ми зафіксували реагування на електричну стимуляцію ЛГ у щурів, які мали дозвіл на доступ до харчової чау-поодинці або чау в поєднанні з щоденним доступом 18 – 23 год до приємної дієти. Ця дієта складалася з чізкейку, бекону, ковбаси та інших апетитних харчових продуктів (Johnson and Kenny, 2010). Ми виявили, що щури з розширеним доступом до смачної їжі швидко набирали значну вагу і демонстрували прогресивно погіршується дефіцит винагороди головного мозку (відображається як зменшення чутливості до стимулювання стимуляції ЛГ) (Джонсон та Кенні, 2010; Фігура 3). Це говорить про те, що розвиток ожиріння, спричиненого дієтою, пов'язане з поступовим зниженням чутливості сайтів нагород в ЛГ (Johnson and Kenny, 2010). Повідомлялося також про дефіцит нагородних сигналів у дорослих щурів, які раніше мали необмежений доступ до сахарози або їжі з високим вмістом жиру в підлітковому віці ([Teegarden et al., 2009], [Vendruscolo et al., 2010a] та [Vendruscolo et al., 2010b]). Ці ефекти у щурів нагадують знижену активацію смугастої тканини у відповідь на нагородження їжею, описане вище у людей, коли вони набирали вагу протягом місячного періоду 6 (Stice et al., 2010a; див. Малюнок 4). Такий дефіцит винагороди, спричинений дієтою, у щурів із зайвою вагою, а можливо, у людей, які набирають вагу, ймовірно відображає протидіючу реакцію в схемах нагородження їжею, щоб виступити проти їх надмірного стимулювання приємною їжею (Johnson and Kenny, 2010). Важливим аспектом цього висновку є те, що подібний дефіцит функцій винагороди виявляється також у щурів, які переживають кокаїн або героїн ([Ahmed et al., 2002], [Kenny et al., 2006] та [Markou та Koob, 1991]; Малюнок 3). Насправді, було висунуто гіпотезу, що викликана наркотиками дисфункція винагород може сприяти переходу від контрольованого до неконтрольованого вживання наркотиків, надаючи нове джерело мотивації до споживання наркотику, щоб полегшити стійкий стан зменшеної винагороди ([Ахмед та Кооб , 2005] і [Koob і Le Moal, 2008]). Тому можливо, що дефіцит чутливості місць нагородження ЛГ, викликаний переїданням, може збільшити довготривалу наполегливість споживання їжі, що смакується, у щурів із зайвою вагою, пересунувши дієтичні переваги до їжі з більш високим гедонічним впливом, щоб полегшити стійкий стан негативу нагорода.
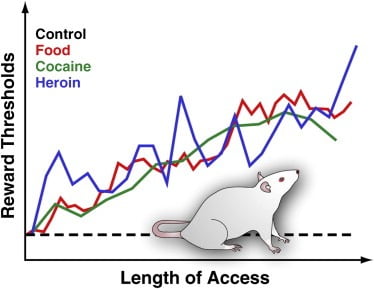
Рисунок 3. Нагороджуйте пороги у щурів із розширеним щоденним доступом до харчової їжі, кокаїну чи героїну
Для вимірювання порогів винагороди стимулюючий електрод хірургічно імплантується в бічний гіпоталамус щурів, область, в якій електрична стимуляція є сильною винагородою і може викликати інтенсивні нападки поведінки годування. Після одужання тваринам дозволяється самостимулювати цю область поворотом колеса. Після встановлення стійкої поведінки самостимуляції визначається мінімальна інтенсивність стимуляції, яка підтримувала поведінку самостимуляції (тобто поріг винагороди). Цей поріг винагороди забезпечує оперативний захід діяльності системи винагород. Порогові значення винагороди залишаються стабільними та незмінними у контрольних щурів, які мають доступ до стандартних лабораторних чау і які залишаються наївними. Однак пороги поступово підвищуються у щурів із розширеним щоденним доступом до енергетично щільної їжі, що складається з смачних харчових продуктів (наприклад, чізкейку, бекону, шоколаду тощо). Аналогічно, поріг винагороди прогресивно підвищується у щурів, які розширюють щоденний доступ до внутрішньовенних вливань кокаїну чи героїну. Підвищений поріг винагороди трактується таким чином, щоб відображати зменшену чутливість системи винагород мозку. Ці ефекти говорять про те, що надмірне споживання приємної їжі та пов'язане з цим збільшення ваги може спричинити глибокий дефіцит винагороди мозку, аналогічний тому, що викликається надмірним споживанням наркотичних речовин.
Рисунок 4. Стриїтальна пластичність при ожирінні Підвищення ваги пов'язане зі зниженням активації смугастої тканини у відповідь на смачну їжу, виміряну за допомогою fMRI, та нижчим рівнем доступності стриманого дофамінового D2-рецептора (D2R) у людини (детальніше див. Текст).
Дефіцитний дофаміновий D2 рецептор сигналізує при ожирінні
Кілька останніх доповідей виявили потенційні механізми, завдяки яким дефіцит винагороди може виникнути у відповідь на надмірне споживання смачної їжі під час розвитку ожиріння. Як зазначалося вище, жінки, які набирали вагу протягом періоду місяця 6, помітно знизили смугасту активність у відповідь на смачну їжу протягом цього періоду порівняно з жінками, які не набирали вагу (Stice et al., 2010a; Фігура 4). Швидкі люди, яким дозволено їсти свою улюблену страву до насичення, мали нижчі рівні зв'язування допамінового рецептора D2 (D2R) раклоприду в стриатумі (Small et al., 2003), що дозволяє припустити, що сигналізація D2R зменшується у відповідь на споживання їжі, приємної для їжі. Дійсно, у людей з ожирінням спостерігаються більш низькі рівні смугастої D2R доступності порівняно з худим контролем ([Barnard et al., 2009], [Stice et al., 2008a] та [Wang et al., 2001]; рис. 4), тоді як втрата ваги у пацієнтів з ожирінням асоціюється зі збільшенням смугастої щільності D2R (Wang et al., 2008). Враховуючи, що смугаста передача дофаміну відіграє ключову роль у регулюванні гедонічного прийому їжі, адаптивне зниження сигналізації D2R може сприяти зниженню реакції стриатуму на смачну їжу у людей, що страждають ожирінням. Щоб перевірити цю можливість, малі та співробітники вивчали активність в схемах нагородження мозку у відповідь на приємний молочний коктейль у контрольних осіб та осіб, які переносять алель TaqIA A1 (Felsted et al., 2010). Поліморфізм довжини рестрикційного фрагмента TaqIA розташований нижче від гена D2R (Neville et al., 2004), а у людей, які переносять алель A1 поліморфізму, між 30% –40% меншою кількістю смугастих D2R, порівняно з тими, що не носять алель ([Jönsson та ін., 1999], [Рітчі і благородний, 2003] та [Stice et al., 2010b]). Крім того, носії алелей A1 також мають зменшений метаболізм глюкози в стритальних і кортикальних ділянках мозку, які беруть участь у гедонічних реакціях на їжу (Jönsson et al., 1999). Особи, що містять алель TaqIA A1, є надмірно представленими в популяції ожиріння ([Barnard et al., 2009], [Stice et al., 2008a] та [Wang et al., 2001]). Крім того, алель A1 також збільшує вразливість до алкогольної, опіоїдної та психомоторної стимуляторів ([Lawford et al., 2000], [Noble et al., 1993] та [Noble et al., 2000]). Було встановлено, що ділянки середнього мозку, ймовірно, включають VTA та SN, які забезпечують дофамінергічний вхід у стриатум, активувались у відповідь на приємний молочний коктейль у контрольних осіб (Felsted et al., 2010). І навпаки, активність у цих сайтах мозку насправді знижувалася у відповідь на нагороду їжею в носіях алелей A1 (Felsted et al., 2010). Подібні зворотні реакції при активації мозку між алельними носіями A1 та неносіями також були виявлені в таламічних та кортикальних сайтах мозку (Felsted et al., 2010). Ці дані повністю узгоджуються з ключовою роллю D2Rs у регулюванні мезотріальної чутливості до смачної їжі. Стейс та колеги (2008a) виявили зворотну кореляцію між ІМТ та активацією стриатуму (хвостатого і путамена) у відповідь на смачний шоколадний молочний коктейль у пацієнтів людини. Більше того, ця зворотна залежність була найбільш очевидною у осіб, які носять алель TaqIA A1 (Stice et al., 2008a). Майбутнє збільшення ваги у цих осіб, виміряне 1 роком після первинної томографії головного мозку, показало, що величина активації смугастої тканини у відповідь на смачну їжу негативно корелювалась із збільшенням ваги у суб'єктів із алелем A1 та позитивно корелювала у суб'єктів, що не належать до A1 ( Stice та ін., 2008a). У подальшому дослідженні було повідомлено, що величина активації смугастої тканини у відповідь на уявне поїдання смачної їжі, на відміну від її фактичного споживання, обернено корелює із збільшенням ваги протягом наступного року у суб'єктів із алелем A1, але позитивно співвіднесені у суб'єктів алелей, що не належать до A1 (Stice et al., 2010b). Ці висновки дозволяють стверджувати, що D2R регулюють смугасту чутливість до смачної їжі, і зменшення D2R сигналізації, викликане збільшенням ваги або генетичними факторами, може підвищити вразливість до ожиріння.
Дефіцитна сигналізація D2R сприяє зниженню дефіциту у ожирінні
Подібно до пониженого рівня смугастих D2R у людей, які страждають ожирінням, рівень D2R також знижується у мишей і щурів, які годували дієти, що харчуються (наприклад, [Colantuoni et al., 2001], [Geiger et al., 2009] та [Johnson and Kenny] , 2010]) і у щурів, генетично схильних до ожиріння (щури Цукера) (Thanos et al., 2008). Наша лабораторія безпосередньо дослідила роль для порушеної смугастої передачі дофаміну в цілому і зменшення сигналу D2R, зокрема, у дефіциті нагородження, подібного до залежності, який виникає у щурів під час розвитку ожиріння (див. Малюнок 5). Зокрема, ми протестували ефекти зменшення експресії смугастих D2R у щурів із використанням вірусно опосередкованої РНК-інтерференції, а потім оцінювали пороги BSR, коли щури мали доступ лише до чау або чау в поєднанні з щоденним доступом 18 – 23 год до приємного високоенергетичного дієта (тобто дієтичне харчування) (Джонсон та Кенні, 2010). Ми виявили, що реагування на нагородження стимуляцією ЛГ стало майже негайно зменшуватися після впливу дієти кафетерії у щурів збивання D2R (Джонсон та Кенні, 2010; Фігура 5). Таким чином, зниження рівня смугастого D2R швидко прискорює появу гіпофункціональності винагороди у щурів із розширеним доступом до дуже приємної їжі - процесу, який зазвичай займає багато тижнів у контрольних щурів із розширеним доступом до смачного раціону. Тим не менш, збивання смугастих D2R у щурів, які мають доступ до чау, не змінило реагування на нагородження стимуляцією ЛГ, що дозволяє припустити, що зменшена смугаста сигналізація D2R взаємодіє з іншими спричиненими дієтою адаптаційними реакціями в схемах нагородження мозку, щоб викликати гіпосенситивність винагороди. На додаток до зниження рівня D2R, інші моменти стриатальної дофамінергічної передачі також змінюються в мозку ожирілих щурів. Наприклад, щури Sprague-Dawley розводять селективність для швидкого набору ваги на дієті з високим рівнем енергії (щури, схильні до ожиріння) мають нижчий базальний і викликаний рівень дофаміну в NAc, ніж щури, стійкі до збільшення ваги (ожиріння, стійкі до ожиріння) (Geiger et співавт., 2008; див. також Rada et al., 2010). У щурів, схильних до ожиріння, також спостерігається зниження рівня біосинтезуючих та зберігаючих дофаміну механізмів, що дозволяє припустити, що збій у виробництві та вивільненні дофаміну сприяє дефіциту передачі допаміну в стриатумі у ожирілих щурів (Geiger et al., 2008). Щури, у яких розвинулося ожиріння через надмірне споживання приємної дієти з високим рівнем енергії, також мали нижчий базальний і викликаний рівень дофаміну в NAc порівняно з щурами, які мали доступ лише до стандартної чау ([Davis et al., 2008] та [Geiger et al., 2009]). Важливо, що їжа стандартної чау була достатньою для підвищення рівня дофаміну в NAc контрольних щурів, тоді як лише високопродуктивні харчові предмети були достатніми для запускання накопичувального дофаміну у ожирілих щурів, які мали в історії розширений доступ до смачної їжі. (Гейгер та ін., 2009). Ці висновки демонструють, що розвиток ожиріння у щурів пов'язаний з дисфункцією в мезостріальній передачі дофаміну, найбільш помітно при смугастих D2R, і що дефіцитна сигналізація D2R сприяє виникненню дефіциту винагороди під час розвитку ожиріння у щурів. Це узгоджується з тим, що пониження регуляції смугастих D2R є помітною нейроадаптивною реакцією на збільшення ваги у людей ([Barnard et al., 2009], [Stice et al., 2008a] та [Wang et al., 2001]), і що дефіцитна смугаста сигналізація D2R може притупляти смугасті реакції на гедонічну їжу у людей, тим самим схиляючи індивіда до майбутнього збільшення ваги ([Stice et al., 2008a] та [Wang et al., 2001]).
Рисунок 5. Рецептори дофаміну D2, дисфункція винагороди та компульсивність ожиріння - Нокдаун рецепторів дофаміну D2 (D2R) у стриатумі щурів прискорює появу дисфункції винагороди та компульсивного харчування у щурів з розширеним доступом до смачної їжі.
Дефіцит D2R Сигналізація Може спричинити компульсивне харчування при ожирінні
Ожиріння характеризується переїданням, яке зберігається, незважаючи на виражене прагнення обмежити споживання та знання глибоких негативних здоров’я та соціальних наслідків тривалого надмірного споживання ([Booth et al., 2008], [Delin et al., 1997] та [Puhl et співавт., 2008]). Це пояснюється тим, що багато пацієнтів з ожирінням піддаються потенційно небезпечній баріатричній (шлункової шунтування) операції для контролю своєї ваги (Yurcisin та ін., 2009), але часто рецидивують до переїдання, хоча операція знижує суб'єктивні оцінки голоду та знижує здатність споживати велику кількість їжі ([Kalarchian et al., 2002] та [Saunders, 2001]). Наркоманія аналогічно визначається як втрата гальмівного контролю над споживанням наркотиків та збереження звички, незважаючи на усвідомлення потенційно руйнівних наслідків для здоров'я, соціальних та фінансових ситуацій (DSM-IV; Американська психіатрична асоціація, 1994). Таким чином, ожиріння та наркоманія поділяють ознаки компульсивних розладів у тому, що є очевидне невдало використовувати інформацію щодо майбутніх шкідливих наслідків до помірного споживання та наполегливості споживання, незважаючи на наявність менш шкідливих альтернативних способів поведінки.
Примусовий прийом наркотиків був оперативно визначений у гризунів як споживання, стійке до придушення покаранням, або стимули навколишнього середовища, що передбачають покарання ([Pelloux et al., 2007] та [Vanderschuren and Everitt, 2004]). Періоди розширеного доступу до кокаїну та інших наркотиків можуть спричиняти появу компульсивної поведінки наркоманів у щурів ([Ahmed і Koob, 1998], [Deroche-Gamonet et al., 2004] та [Vanderschuren and Everitt, 2004]) ). Дійсно, щури з історією великого споживання кокаїну виявляють стійкість до зриву від неприємного умовного подразника (КС), що прогнозує негативний результат (тобто, кия, що прогнозує доставку відвертого стоп) ([Belin et al., 2008] і [Vanderschuren і Everitt, 2004]). І навпаки, той самий неприязний КС може значно зменшити реакцію, яка шукає наркотики, у щурів із відносно обмеженим доступом до препарату. Розглядаючи схожість між компульсивним вживанням наркотиків у наркоманії та переїданням при ожирінні, ми нещодавно дослідили, чи ожиріння щурів споживатиме приємну їжу на компульсивно подобається, і якщо смугасті D2R відіграють роль у цьому процесі (Джонсон та Кенні, 2010). Ми виявили, що ожирілі щури з історією розширеного доступу до смачної їжі продовжували їсти смачну їжу навіть у присутності шкідливого КС (легкий кий), який передбачив доставку відвертого стоп (Johnson and Kenny, 2010). На противагу цьому той же неприязний КС порушив спокійне споживання їжі у худорлявих щурів при дуже обмеженому впливі на енергетично щільну смачну їжу. Таким чином, споживання їжі на смак може стати нав'язливою для ожирілих щурів приблизно так само, як споживання кокаїну може стати нав'язливим. Відповідно до такої інтерпретації даних, миші, які раніше мали доступ до смачної дієти з високим вмістом жиру, проводили більше часу в неприязному середовищі (яскраво освітленому), щоб отримати приємну їжу, ніж миші, які не мали попереднього досвіду дієти (Teegarden і Bale , 2007). Через страх перед хижаком яскраво освітлені відкриті арени сильно протистоять мишам (Suarez і Gallup, 1981). Таким чином, миші стають стійкими до потенційно негативних наслідків поведінки, що їх готують, і ризикують хижаками отримувати смачну їжу навіть тоді, коли менше приємної їжі є в набагато нижчій небезпеці.
Інтригуюче, алель A1 поліморфізму TaqIA, що призводить до зниження щільної щільності D2R (Noble, 2000) та притупленої стритальної активації у відповідь на смачну їжу (Stice et al., 2008a), також пов'язаний з дефіцитом у навчанні уникати дій, які мають негативні наслідки (Klein et al., 2007). Саме такий вид невикористання інформації, пов'язаної з майбутніми негативними наслідками переїдання, може сприяти розвитку компульсивного вживання їжі у людей з ожирінням. Ми виявили, що поява компульсивного їжі у щурів, які мають доступ до смачної їжі, було різко прискорено після стрибального стрибкування D2R (Johnson and Kenny, 2010). Насправді, щури із стриптизним D2R нокаутом, які раніше мали лише 14 дні розширеного доступу до енергетично щільної смачної їжі, демонстрували приємне споживання їжі, яке було стійким до руйнування протилежною ЦС (Джонсон та Кенні, 2010; Фігура 5). Однак цього періоду обмеженого впливу на смачну їжу 14 дня не було достатньо, щоб викликати нав'язливе харчування у контрольних щурів (Johnson and Kenny, 2010). Ці висновки дозволяють припустити, що у ожирілих щурів може виникнути компульсивний прийом приємної їжі. Крім того, дефіцитна смугаста сигналізація D2R, яка прискорює появу гіпосенситивності винагороди у відповідь на приємне надмірне споживання їжі, також прискорює появу компульсивно їсти (мал. 5).
Взаємодія між D2R і гормональними регуляторами енергетичного балансу при ожирінні
Екзогенний лептин, який вводиться у ВТА, інгібує передачу дофаміну мезоаккуменів та поведінку харчування ([Hommel et al., 2006] та [Krügel et al., 2003]). На додаток до його гострої інгібіторної дії на дофамінові системи середнього мозку, існує накопичення доказів того, що тонічна сигналізація лептину також може бути необхідною для підтримки відповідних рівнів мезотріатальної дофамінової сигналізації. Флієр та його колеги виявили, що об / об у мишей був нижчий рівень тирозин-гідроксилази в дофамінових нейронах середнього мозку, ключового ферменту в біосинтезі дофаміну (Fulton et al., 2006). Крім того, ob / ob миші знижували вивільнений дофамін у NAc (Fulton et al., 2006) та зменшували соматодендритні везикулярні запаси дофаміну у VTA та SN (Roseberry et al., 2007). Ці недоліки у виробництві дофаміну та механізмах переведення сигналу в мишах з об / об були виправлені лікуванням лептином ([Fulton et al., 2006] та [Pfaffly et al., 2010]). Насправді лептин, влитий тільки в ЛГ, був достатнім для корекції дисфункціональної передачі дофаміну мишам об / об (Leinninger et al., 2009), що пропонує клітини, що експресують рецептори лептину в ЛГ, для підтримки відповідного рівня сигналу дофаміну. На додаток до зменшення виробництва та вивільнення дофаміну, об / об миші також мали тенденцію до нижчих рівнів експресії D2R у стриатумі (Pfaffly et al., 2010). Крім того, екзогенне лікування лептином у режимі, що призводить до розвитку нечутливості до сигналу лептину (тобто стійкості до лептину), помітно знижує рівні смугасті D2R у мишей дикого типу (Pfaffly et al., 2010). Ожирілі щури розвивають стійкість до лептину у VTA ([Matheny et al., 2011] та [Scarpace et al., 2010]), а також мають нижчий рівень ТГ у VTA, зменшення вивільнення дофаміну в стриатумі та знижений рівень смугастого D2R (Гейгер та ін., 2008). У сукупності ці дані демонструють, що лептин чинить складні дії на дофамінові системи середнього мозку. З одного боку, гостра активація рецепторів лептину у ВТА надає інгібуючу дію на передачу дофаміну мезоаккуменів і може гальмувати поведінку годування ([Hommel et al., 2006] та [Krügel et al., 2003]). З іншого боку, сигналізація лептину в середньому мозку необхідна для підтримання відповідної продукції допаміну та передачі сигналу, а генетичний дефіцит сигналізації лептину або розвиток стійкості до лептину при ожирінні сильно порушує системи мезоаккумулювання дофамінових систем. Таким чином, є цікава можливість того, що розвиток стійкості до лептину в дофамінергічних нейронах середнього мозку під час розвитку ожиріння може відігравати центральну роль у порушенні смугастої сигналізації D2R, що, як видається, спричиняє появу дисфункції нагороди, що нагадує залежність, та компульсивного переїдання. (Малюнок 5) у ожирілих щурів.
На додаток до складних ефектів лептинової сигналізації на мезотріатальну дофамінергічну передачу, існує накопичувальний доказ того, що D2R можуть, в свою чергу, регулювати передачу лептину. Бромокриптин-агоніст D2R знижує рівень циркулюючого лептину ([Doknic et al., 2002], [Kok et al., 2006] та [Mastronardi et al., 2001]), що дозволяє припустити, що D2R надають інгібіторний вплив на рівень лептину. Крім того, миші з нульовою мутацією в гені D2R мають посилену сигналізацію лептину в гіпоталамусі і більш чутливі до аноректичних ефектів лептину (Kim et al., 2010). Добре відомо, що рівень лептину збільшується під час розвитку ожиріння (гіперлептинемія), проте спостерігається супутнє зниження чутливості до сигналу лептину (тобто стійкості до лептину) (Hamilton et al., 1995). Таким чином, є цікавою можливістю, що зменшення смугастої D2R сигналізації під час розвитку ожиріння може представляти компенсаційну реакцію на надмірне споживання приємної їжі та збільшення ваги, що збільшує рівень циркулюючого лептину та підвищує його ефективність сигналізації для подолання розвитку лептинової резистентності. Така дія може посилити інгібуючу дію лептину на смугасті системи, які регулюють чутливість до смакової їжі ([Farooqi et al., 2007], [Fulton et al., 2006] та [Hommel et al., 2006]), тим самим діючи. послабити гедонічні реакції на смачну їжу. Поєднуючи цей висновок разом з регулюючою роллю лептину на D2R, описаних вище, видається, що лептин та D2R сигналізація можуть бути пов'язані зворотно для регулювання гомеостатичного та гедонічного аспектів поведінки годування.
Нерегульовані системи напруги мозку при ожирінні
Сигналізація лептину в середньому мозку діє на регулювання передачі дофаміну мезоаккуменів та реагування на гедонічну їжу. Однак нейрони в VTA, які експресують рецептори лептину, рідко випромінюються до NAc, і натомість демонструють більш помітні проекції до центрального ядра мигдалини (CeA) (Leshan et al., 2010). В контексті поведінки при годівлі, як відомо, CeA регулює гальмівні дії шкідливих стимулів навколишнього середовища на споживання їжі (Петрович та ін., 2009). Зокрема, ураження CeA, але не базолатеральна мигдалина (BLA), скасовує інгібіторну дію умовного подразника, що поєднується в підніжках, на годування, що дозволяє припустити, що CeA є критичним для інгібіторного контролю за поведінкою годування у відповідь на екологічні підказки, що прогнозують негативний результат ( Петрович та ін., 2009). Ожирі щури або щури, що не страждають жировим покриттям, зі стримучим D2R стрибанням та доступом до смачної їжі, продовжують вживати їжу на смак компульсивно, за наявності відрази CS. Ці ефекти разюче схожі на порушення реактивності до протилежної ЦС у постраждалих від CeA щурів (Petrovich et al., 2009). Таким чином, важливо буде визначити, чи зміни в активності CeA, можливо, як наслідок зменшення регуляторної дії D2R або розвитку стійкості до лептину в середньому мозку, сприяє появі компульсивно їсти у ожирілих щурів.
Окрім регулювання впливу шкідливих стимулів навколишнього середовища на поведінку годування, CeA може також відігравати ключову роль у гедонічному харчуванні, пов’язаному зі стресом. У людей стрес сильно мотивує вибір та споживання енергійної смачної їжі, незалежно від потреби в калоріях ([Gluck et al., 2004], [Kandiah et al., 2006] та [O'Connor et al., 2008]) , а ожиріння пов’язане з підвищеною секрецією глюкокортикоїдів, пов’язаною зі стресом ([Björntorp and Rosmond, 2000] та [la Fleur, 2006]). Екологічні та соціальні стресові фактори також спричиняють гіперфагію енергетично смачної їжі у гризунів та мавп, при цьому смачна їжа може послабити несприятливі наслідки стресу ([Dallman et al., 2003], [Dallman et al., 2006], [Pecoraro et та ін., 2004] та [Wilson et al., 2008]). Крім того, препарат йохімбін, що викликає стрес, може відновити раніше загашену смачну їжу, що вимагає відповіді (натискання на важіль) у щурів, що послаблюється антагоністом рецептора кортикотропіну-релізингу-1 (CRF-1) анталармін (Ghitza et al., 2006 ). Важливо зазначити, що точний вплив стресу на споживання їжі у людей та лабораторних тварин залежить від природи та величини стресора, типу їжі, доступної для споживання (смачна проти м'якої), маси тіла та статі (Даллман , 2010).
Миші з розширеним доступом до смачної дієти з високим вмістом жиру мали знижену експресію гормону стресу CRF в CeA (Teegarden and Bale, 2007). І навпаки, у мишей, які піддаються «відходу» від смачної дієти, спостерігається посилення експресії CRF в CeA (Teegarden and Bale, 2007). Цей останній ефект дуже схожий на посилення експресії CRF у CeA, виявлених у щурів, які перебувають у відмові від усіх основних наркотичних засобів зловживання (Koob, 2010). Оскільки подальше вживання наркотиків може нормалізувати цю відверту нейробіологічну відповідь на відміну наркотиків, було висунуто гіпотезу, що гіперактивна передача CRF в CeA та інших лімбічних структурах може сприяти розвитку компульсивного вживання наркотиків (Koob і Zorrilla, 2010). Відповідно до цієї точки зору, миші, які перебувають у відході від смачної їжі, щільної енергією, у якої підвищений рівень CRF в CeA, витрачали значно більше часу в неприязному (яскраво освітленому) середовищі для отримання приємної їжі, ніж миші, які не мали досвіду їжі, навіть хоча менш приємний був у неагресивному (темно освітленому) середовищі (Teegarden and Bale, 2007). Таким чином, миші стають стійкими до потенційно негативних наслідків їх поведінкової годівлі та ризикують хижати отримувати приємну їжу, навіть якщо менш придатна їжа є в набагато нижчій небезпеці, що частково послаблює передачу CRF в CeA (Teegarden and Bale, 2007). Кілька поданих доказів підтверджують роль передачі ХРН у нав'язливому харчуванні. Зокрема, недавнє дослідження оцінило вплив антагоніста рецептора CRF-1 R121919 на споживання їжі у щурів, які зазнавали циклічних змін у своєму раціоні, в яких вони мали доступ до стандартних чау-чау 5 днів на тиждень та доступу до смачної дієти цукрового харчування 2 днів на тиждень тиждень (Cottone та ін., 2009). Після 7 тижнів цього циклічного відхилення в харчуванні, R121919 зменшив надмірне споживання дуже смачної дієти і збільшив споживання м'якої чау (Cottone et al., 2009). Крім того, рівень експресії CRF у CeA був підвищений у циклізованих щурів під час виведення з смачного раціону харчування, але повернувся до вихідних рівнів після повторного впливу приємної дієти (Cottone et al., 2009). Нарешті, регуляція CRF передачі GABAergic у CeA була посилена у циклізованих щурів, які перебувають у відході від смачної дієти, порівняно з контрольними щурами, які раніше мали доступ лише до м'якої чаури, що відображалося в тому, що R121919 порушив викликаний GABAergic інгібіторний постсинаптичний потенціал у Зрізи CeA від цикличних щурів в концентрації, яка не змінювала пропускання, в скибочках від контрольних щурів (Cottone et al., 2009). Цікаво, що подібний вплив CRF на передачу GABAergic у CeA спостерігається також у щурів, які перенесли виведення з хронічного впливу етанолу (Roberto et al., 2010). Нарешті, CeA, ядро ліжка Stria terminalis (BNST) та оболонка NAc складають більшу суміжну структуру, яку називають "розширеною мигдалиною". Вливання CRF в оболонку NAc на ділянках, що стимулює гедонічне поїдання, посилює мотиваційну сприятливість навколишнього середовища кий, який раніше був пов'язаний з наявністю смачної їжі (Peciña et al., 2006a). Отже, стрес може посилити виразність довкілля, пов'язаного з їжею, модулюючи активність нейронів оболонки NAc. У сукупності ці висновки дозволяють стверджувати, що надмірне споживання їжі, сприйнятої приємною їжею або наркотиків, може викликати подібні нейроадаптивні реакції в шляхах екстрагіпоталамічного стресу в мозку, що може сприяти компульсивному поведінці.
Висновки
Останнім часом було досягнуто значного прогресу у виявленні систем мозку, що беруть участь у гедонічних ефектах смачної їжі, та адаптаціях, які відбуваються в цих схемах у відповідь на надмірне споживання смачної їжі та збільшення ваги. Вражає те, що подібні системи мозку та загальні адаптивні реакції виникають у відповідь на споживання як смачної їжі, так і наркотиків, що викликають звикання. Зокрема, надмірне споживання смачної їжі або наркотиків, що спричиняють зловживання, спричиняє подібний дефіцит у реакції систем винагороди мозку. Їжа, що викликає смак, та наркотики, що викликають звикання, спричиняють дефіцит передачі дофаміну через смужку та експресію смугастих D2R. Приємна їжа та наркотики, що викликають звикання, також викликають появу компульсивно-подібної поведінки споживачів у гризунів та викликають екстрагіпоталамічну реакцію стресу. Нарешті, загальні генетичні вразливості в системах винагороди мозку можуть схиляти людей до переїдання та ожиріння, а також до вживання наркотиків та звикання. Насправді, виходячи з цих та інших подібностей між ожирінням та наркоманією, доводилося, що ожиріння слід включати як діагностичну категорію до майбутнього DSM-V ([Devlin, 2007] та [Volkow and O'Brien, 2007] ). З огляду на це, критичні напрямки майбутніх досліджень включатимуть подальше вивчення потенційних нейробіологічних збігів між компульсивним переїданням та вживанням наркотиків. Наприклад, буде важливо перевірити, чи пов’язане ожиріння з розвитком поведінки, подібної до звички, що виникає внаслідок пластичності у спинному смугастому тілі, так само, як наркоманія може бути пов’язана із реконструкцією смуг та появою звичок, схожих на наркотики. поведінки ([Everitt and Robbins, 2005], [Hollander et al., 2010] та [Kasanetz et al., 2010]). Крім того, ділянки головного мозку кори, що беруть участь у виконавчому контролі та прийнятті рішень (тобто префронтальна кора) та в процесах інтероцептивної обробки (кора острова), сильно вплинули на наркоманію ([Everitt et al., 2008], [Fineberg et al., 2010 ], [Koob and Volkow, 2010] та [Naqvi and Bechara, 2009]), проте мало відомо про їх точну роль у компульсивному харчуванні та ожирінні, наприклад ([Nair et al., 2011] та [Volkow et al. , 2009]). У сукупності дані, розглянуті вище, підтверджують уявлення про те, що ожиріння та наркоманія можуть виникати внаслідок подібних нейроадаптивних реакцій в схемах винагороди мозку, і припускають, що відомі механізми наркоманії можуть створити евристичну основу для розуміння ожиріння.
Подяки
Автор підтримується грантами Національного інституту зловживання наркотиками (NIDA). Автор вдячний Полу Джонсону та Крісті Фаулер за цінні уявлення та коментарі до рукопису. Це номер рукопису 21042 від Науково-дослідного інституту Скриппса.
посилання
1.
o Abizaid та ін., 2006a
o A. Abizaid, Q. Gao, TL Horvath
o Думки про їжу: Мозкові механізми та периферійний енергетичний баланс
o Нейрон, 51 (2006), стор. 691 – 702
o
2.
o Abizaid та ін., 2006b
o A. Abizaid, ZW Liu, ZB Andrews, M. Shanabrough, E. Borok, JD Elsworth, RH Roth, MW Sleeman, MR Піччотто, MH Tschöp та ін.
o Грелін модулює активність та синаптичну організацію введення дофамінових нейронів середнього мозку, одночасно сприяючи підвищенню апетиту
o J. Clin. Інвест., 116 (2006), стор. 3229 – 3239
o
3.
o Ахмед і Кооб, 1998
o SH Ahmed, GF Koob
o Перехід від помірного до надмірного прийому ліків: зміна встановленої гедонічної точки
o Science, 282 (1998), стор. 298 – 300
o
4.
o Ахмед і Кооб, 2005
o SH Ahmed, GF Koob
o Перехід до наркоманії: негативна модель підкріплення, заснована на алостатичному зниженні функції винагороди
o Психофармакологія (Берл.), 180 (2005), стор. 473 – 490
o
5.
o Ахмед та ін., 2002
o SH Ahmed, PJ Kenny, GF Koob, A. Markou
o Нейробіологічні докази гедонічного аллостазу, пов'язаного з ескалацією вживання кокаїну
o Nat. Neurosci., 5 (2002), стор. 625 – 626
o
6.
o Allison та ін., 1999
o DB Allison, KR Fontaine, JE Manson, J. Stevens, TB VanItallie
o Щорічна смерть, пов’язана з ожирінням у США
o JAMA, 282 (1999), стор. 1530 – 1538
o
7.
o Американська психіатрична асоціація, 1994
o Американська психіатрична асоціація
o Діагностичний та статистичний посібник психічних розладів
o (Четверте видання) Американська психіатрична асоціація, Вашингтон, округ Колумбія (1994)
o
8.
o Анджелес-Кастелланос та ін., 2007
o М. Анджелес-Кастельянос, Дж. Мендоса, К. Ескобар
o обмежені схеми годування, щоденні ритми зсуву фаз c-Fos та імунореактивності білка Per1 в кортиколімбічних регіонах у щурів
o Нейрологія, 144 (2007), стор. 344 – 355
o
9.
o Baicy et al., 2007
o К. Байці, Е. Д. Лондон, Дж. Монтеросо, М. Л. Вонг, Т. Делібасі, А. Шарма, Дж. Лікініо
o Заміна лептину змінює реакцію мозку на харчові сигнали у дорослих з генетично недостатнім лептином
o Зб. Natl. Акад. Наук. США, 104 (2007), стор. 18276 – 18279
o
10.
o Балдо та ін., 2004
o BA Baldo, L. Gual-Bonilla, K. Sijapati, RA, Daniel, CF Landry, AE Kelley
o Активізація субпопуляції орексинових / гіпокретинових гіпоталамічних нейронів за допомогою інгібування GABAA-рецептора, опосередкованого рецептором GABAA, але не шляхом впливу нового середовища
o Eur. J. Neurosci., 19 (2004), стор. 376 – 386
o
11.
o Balleine and Dickinson, 2000
o BW Balleine, A. Dickinson
o Вплив ураження суглобової кори на інструментальне кондиціонування: свідчення про роль у спонукальній пам'яті
o J. Neurosci., 20 (2000), стор. 8954 – 8964
o
12.
o Barnard та ін., 2009
o Н. Д. Барнард, Е. П. Ноубл, Т. Річі, Дж. Коен, DJ Дженкінс, Г. Тернер-Мак-Гріві, Л. Глоде, А. А. Грін, Х. Фердосян
o D2 рецептор дофаміну Taq1A поліморфізм, маса тіла та раціон харчування при цукровому діабеті типу 2
o Харчування, 25 (2009), стор. 58 – 65
o
13.
o Бассо і Келлі, 1999
o А. М. Бассо, А. Е. Келлі
o Харчування, спричинене стимуляцією рецепторів GABA (A) в оболонці ядра ядра: регіональне відображення та характеристика макроелементів та переваг смаку
o Бехав. Neurosci., 113 (1999), стор. 324 – 336
o
14.
o Batterham та ін., 2007
o RL Batterham, DH ffytche, JM Rosenthal, FO Zelaya, GJ Barker, DJ Withers, SC Williams
o PYY-модуляція коркових та гіпоталамічних областей мозку передбачає поведінку харчування у людини
o Природа, 450 (2007), стор. 106 – 109
o
15.
o Бакстер і Мюррей, 2002
o М. Г. Бакстер, Е. А. Мюррей
o Мигдалина і винагорода
o Nat. Преподобний Неврос., 3 (2002), стор. 563 – 573
o
16.
o Бін та ін., 2008
o М. К. Бін, К. Стюарт, М. Е. Олбріш
o ожиріння в Америці: наслідки для клінічних та медичних психологів
o J. Clin. Психол. Мед. Налаштування, 15 (2008), стор. 214 – 224
o
17.
o Бівер та ін., 2006
o Дж. Д. Бівер, А. Д. Лоуренс, Дж. ван Діцхуйцен, М. Х. Девіс, А. Вудс, А. Дж. Калдер
o Індивідуальні відмінності у нагороді стимулюють нейронну реакцію на зображення їжі
o J. Neurosci., 26 (2006), стор. 5160 – 5166
o
18.
o Белін та ін., 2008
o D. Belin, AC Mar, JW Dalley, TW Robbins, BJ Everitt
o Висока імпульсивність прогнозує перехід на компульсивний прийом кокаїну
o Science, 320 (2008), стор. 1352 – 1355
o
19.
o Беррідж, 1996
o KC Berridge
o нагорода за їжу: мозкові субстрати бажань і симпатій
o Neurosci. Біобехав. Вип., 20 (1996), стор. 1 – 25
o
20.
o Беррідж, 2009
o KC Berridge
o «Сподобатися» та «бажати» харчових нагород: субстрати мозку та роль у розладах їжі
o Фізіол. Behav., 97 (2009), стор. 537 – 550
o
21.
o Бьорнторп та Росмонд, 2000
o P. Björntorp, R. Rosmond
o Ожиріння та кортизол
o Харчування, 16 (2000), стор. 924 – 936
o
22.
o Blundell and Herberg, 1968
o JE Blundell, LJ Herberg
o відносний вплив дефіциту харчування та дефіциту харчування на швидкість електричного самостимуляції бічного гіпоталамуса
o Природа, 219 (1968), стор. 627 – 628
o
23.
o Бут та ін., 2008
o ML Booth, RL Wilkenfeld, DL Pagnini, SL Booth, LA King
o Сприйняття підлітків щодо надмірної ваги та ожиріння: вивчення думки
o J. Paediatr. Здоров'я дитини, 44 (2008), стор. 248 – 252
o
24.
o Bragulat та ін., 2010
o В. Брагулат, М. Джемідзіч, К. Бруно, Каліфорнія Кокс, Т. Талаваж, Р. В. Консідін, Д. А. Карекен
o Зонди, пов'язані з харчовим запахом ланцюгів відшкодування мозку під час голоду: пілотне дослідження фМР
o Ожиріння, Срібна весна, доктор медицини (2010)
o
25.
o Кабанак і Джонсон, 1983
o М. Кабанак, К. Г. Джонсон
o Аналіз конфлікту між смаковими якостями та експозицією холодів у щурів
o Фізіол. Behav., 31 (1983), стор. 249 – 253
o
26.
o Кемпфілд та ін., 1995
o LA Campfield, FJ Smith, Y. Guisez, R. Devos, P. Burn
o рекомбінантний ОВ білок миші: свідчення для периферійного сигналу, що пов'язує ожиріння та центральну нейронну мережу
o Science, 269 (1995), стор. 546 – 549
o
27.
o Кеннон і Пальмітер, 2003
o CM Cannon, RD Palmiter
o винагорода без дофаміну
o J. Neurosci., 23 (2003), стор. 10827 – 10831
o
28.
o Карр та Саймон, 1984
o KD Carr, EJ Simon
o Потенціювання винагороди голодом опосередковано опіоїдами
o мозковий ресурс, 297 (1984), стор. 369 – 373
o
29.
o Центри контролю та профілактики захворювань, 2009
o Центри контролю та профілактики захворювань (2009). Тенденції ожиріння в США (Атланта: Центри контролю та профілактики захворювань).
o
30.
o Colantuoni та ін., 2001
o C. Colantuoni, J. Schwenker, J. McCarthy, P. Rada, B. Ladenheim, JL Cadet, GJ Schwartz, TH Moran, BG Hoebel
o Надмірне споживання цукру змінює зв'язування з дофаміновими та му-опіоїдними рецепторами в мозку
o Neuroreport, 12 (2001), стор. 3549 – 3552
o
31.
o Корнелій та ін., 2010
o JR Cornelius, M. Tippmann-Peikert, NL Slocumb, CF Фріріхс, MH Silber
o Порушення контролю імпульсу при застосуванні дофамінергічних засобів при синдромі неспокійних ніг: Дослідження контрольного випадку
o Сон, 33 (2010), стор. 81 – 87
o
32.
o Корньє та ін., 2009
o М. А. Корньє, А. К. Зальцберг, DC Endly, DH Bessesen, DC Rojas, JR Tregellas
o Вплив перегодовування на реакцію нейронів на візуальні сигнали їжі у худих та знижених ожирінь
o PLOS ONE, 4 (2009), стор. e6310 http://dx.doi.org/10.1371/journal.pone.0006310
o
33.
o Cottone та ін., 2009
o P. Cottone, V. Sabino, M. Roberto, M. Bajo, L. Pockros, JB Frihauf, EM Fekete, L. Steardo, KC Rice, DE Grigoriadis та ін.
o Набір системи CRF опосередковує темну сторону нав'язливого прийому їжі
o Зб. Natl. Акад. Наук. США, 106 (2009), стор. 20016 – 20020
o
34.
o Дагер, 2009
o А. Дагер
o Невробіологія апетиту: Голод як залежність
o Int. Дж. Обес. (Лонд.), 33 (Suppl 2) (2009), стор. S30 – S33
o
35.
o Дагер та Роббінс, 2009
o А. Дагер, Т. В. Роббінс
o Особистість, залежність, дофамін: Дані про хворобу Паркінсона
o Нейрон, 61 (2009), стор. 502 – 510
o
36.
o Далман, 2010
o М. Ф. Далман
o Стрес-викликане ожиріння та емоційна нервова система
o Тенденції ендокринолу. Metab., 21 (2010), стор. 159 – 165
o
37.
o Даллман та ін., 2003
o М. Ф. Даллман, Н. Пекораро, С. Ф. Акана, С.Є. Флер, Ф. Гомес, Х. Гос'яр, М.Є. Белл, С.Баттнагар, К.Д. Логеро, С. Манало
o Хронічний стрес та ожиріння: новий погляд на "комфортну їжу"
o Зб. Natl. Акад. Наук. США, 100 (2003), стор. 11696 – 11701
o
38.
o Даллман та ін., 2006
o М. Ф. Далман, NC Пекораро, С.Є. Ла Флер, Дж.П. Ворн, А.Б. Гінзберг, С.Ф. Акана, К.К. Логеро, Х. Хос'яр, А.М. Стрек, С.Баттнагар, М.Е.
o глюкокортикоїди, хронічний стрес та ожиріння
o Прог. Мозковий ресурс, 153 (2006), стор. 75 – 105
o
39.
o Девіс та ін., 2004
o C. Девіс, С. Страчан, М. Берксон
o Чутливість до винагороди: наслідки переїдання та зайвої ваги
o Апетит, 42 (2004), стор. 131 – 138
o
40.
o Девіс та ін., 2008
o JF Davis, AL Tracy, JD Schurdak, MH Tschöp, JW Lipton, DJ Clegg, SC Benoit
o Підвищений рівень дієтичного жиру зменшує винагороду за психостимулятори та оборот мезолімбічного дофаміну у щура
o Бехав. Neurosci., 122 (2008), стор. 1257 – 1263
o
41.
o de Araujo та ін., 2010
o IE de Araujo, X. Ren, JG Ferreira
o Метаболічні зондування в дофамінових системах мозку
o Результати Пробл. Cell Differ., 52 (2010), стор. 69 – 86
o
42.
o Delin та ін., 1997
o CR Delin, JM Watts, JL Saebel, PG Anderson
o харчова поведінка та відчуття голоду після хірургічного шунтування шлунка для хворобливого ожиріння
o Обес. Surg., 7 (1997), стор. 405 – 413
o
43.
o Deroche-Gamonet та ін., 2004
o V. Deroche-Gamonet, D. Belin, PV Piazza
o докази поведінки у щура, що нагадує залежність
o Science, 305 (2004), стор. 1014 – 1017
o
44.
o Devlin, 2007
o MJ Devlin
o Чи є в DSM-V місце ожиріння?
o Int. Дж. Їст. Disord., 40 (Suppl) (2007), стор. S83 – S88
o
45.
o Doknic та ін., 2002
o М. Докніч, С. Пекіч, М. Заркович, М. Медик-Стояноська, К. Дієгес, Ф. Касануева, В. Попович
o Дофамінергічний тон і ожиріння: уявлення про пролактиноми, які лікували бромокриптином
o Eur. J. Endocrinol., 147 (2002), стор. 77 – 84
o
46.
o Еверіт та Роббінс, 2005
o BJ Everitt, TW Роббінс
o Нейрові системи підкріплення наркоманії: від дії до звичок до примусу
o Nat. Neurosci., 8 (2005), стор. 1481 – 1489
o
47.
o Everitt та ін., 2008
o BJ Everitt, D. Belin, D. Economidou, Y. Pelloux, JW Dalley, TW Robbins
o Огляд. Нейронні механізми, що лежать в основі вразливості до розвитку нав'язливих звичок до наркоманії та звикання
o Філос. Транс. Р. Соц. Лонд. Б Біол. Наук., 363 (2008), стор. 3125 – 3135
o
48.
o Farooqi та ін., 2007
o І.С. Фарукі, Е. Буллмор, Дж. Кео, Дж. Гіллард, С. О'Рахіллі, ПК Флетчер
o Лептин регулює смугасті ділянки та харчову поведінку людини
o наука, 317 (2007), с. 1355
o
49.
o Felsted та ін., 2010
o JA Felsted, X. Ren, F. Chouinard-Decorte, DM Small
o Генетично обумовлені відмінності у реакції мозку на первинну винагороду за їжу
o J. Neurosci., 30 (2010), стор. 2428 – 2432
o
50.
o Figlewicz та ін., 2001
o Д. П. Фіглевич, М. С. Гіггінс, С. Б. Нг-Еванс, П. Дж. Гавел
o Лептин змінює перевагу місця, обумовленого сахарозою, у щурів з обмеженою їжею
o Фізіол. Behav., 73 (2001), стор. 229 – 234
o
51.
o Figlewicz та ін., 2003
o Д. П. Фіглевич, С. Б. Еванс, Дж. Мерфі, М. Хоен, Д. Г. Баскін
o Експресія рецепторів для інсуліну та лептину в вентральній тегментальній області / substantia nigra (VTA / SN) щура
o мозковий ресурс, 964 (2003), стор. 107 – 115
o
52.
o Fineberg та ін., 2010
o Н. А. Фінеберг, М. Н. Потенца, С. Р. Чемберлен, Х. А. Берлін, Л. Мензіс, А. Бечара, Б. Дж. Сахакян, Т. В. Роббінс, Е. Т. Булмор, Е. Холландер
o Зондування компульсивного та імпульсивного поведінки, від моделей тварин до ендофенотипів: оглядовий огляд
o нейропсихофармакологія, 35 (2010), стор. 591 – 604
o
53.
o Finkelstein та ін., 2005
o EA Finkelstein, CJ Ruhm, KM Kosa
o Економічні причини та наслідки ожиріння
o Ану. Rev. Public Health, 26 (2005), стор. 239 – 257
o
54.
o Flegal та ін., 2010
o KM Flegal, MD Carroll, CL Ogden, LR Curtin
o Поширеність і тенденції ожиріння серед дорослих США, 1999-2008
o JAMA, 303 (2010), стор. 235 – 241
o
55.
o Foo і Мейсон, 2005
o Х. Фоо, П. Мейсон
o сенсорне пригнічення під час годування
o Зб. Natl. Акад. Наук. США, 102 (2005), стор. 16865 – 16869
o
56.
o Франкен і Муріс, 2005
o IH Franken, P. Muris
o Індивідуальні відмінності у чутливості до винагороди пов'язані з тягою до їжі та відносною масою тіла у здорових жінок
o Апетит, 45 (2005), стор. 198 – 201
o
57.
o Friedman та ін., 2011
o А. Фрідман, Е. Лакс, Ю. Дікштейн, Л. Абрахам, Ю. Фламенхафт, Е. Судай, М. Бен-Цион, Г. Ядид
o Електрична стимуляція бічного габенула справляє гальмівний вплив на самовведення сахарози
o Нейрофармакологія, 60 (2011), стор. 381 – 387
o
58.
o Фултон та ін., 2000
o С. Фултон, Б. Вудсайд, П. Шизгал
o Модуляція схеми винагороди мозку лептином
o Science, 287 (2000), стор. 125 – 128
o
59.
o Фултон та ін., 2006
o С. Фултон, П. Піссіос, Р. П. Маншон, Л. Стайлз, Л. Франк, Е. Н. Потос, Е. Маратос-Флієр, Дж. Ф. Флієр
o лептинову регуляцію дофамінових шляхів мезоаккуменів
o Нейрон, 51 (2006), стор. 811 – 822
o
60.
o Гао і Хорват, 2007
o Q. Гао, Т. Л. Горват
o нейробіологія харчування та енерговитрат
o Ану. Преподобний Неврос., 30 (2007), стор. 367 – 398
o
61.
o Гатьє та ін., 2000
o JF Gautier, K. Chen, AD Salbe, D. Bandy, RE Pratley, M. Heiman, E. Ravussin, EM Reiman, PA Tataranni
o Диференціальні реакції мозку на насичення у ожирілих та худорлявих чоловіків
o Діабет, 49 (2000), стор. 838 – 846
o
62.
o Geiger та ін., 2008
o BM Geiger, GG Behr, LE Frank, AD Caldera-Siu, MC Beinfeld, E.G. Kokkotou, EN Pothos
o Докази дефектного мезолімбічного екзоцитозу дофаміну у схильних до ожиріння щурів
o FASEB J., 22 (2008), стор. 2740 – 2746
o
63.
o Geiger та ін., 2009
o BM Geiger, M. Haburcak, NM Avena, MC Moyer, BG BG Hoebel, EN Pothos
o Дефіцит мезолімбічної нейромедіації дофаміну при харчовому ожирінні щурів
o Нейрологія, 159 (2009), стор. 1193 – 1199
o
64.
o Ghitza та ін., 2006
o UE Ghitza, SM Grey, DH Epstein, KC Rice, Y. Shaham
o нейропсихофармакологія
o Анксіогенний препарат йохімбін відновлює приємну їжу в моделі рецидиву щурів: роль рецепторів CRF (1), 33 (2006), стор. 2188 – 2196
o
65.
o Gluck та ін., 2004
o М. Е. Глюк, А. Гелібтер, Дж. Хунг, Е. Яхав
o кортизол, голод та бажання запоїти їжу після холодного стресового тесту у жінок з ожирінням із розладом їжі
o Психосом. Мед., 66 (2004), стор. 876 – 881
o
66.
o Goldstone та ін., 2009
o А. П. Голдстоун, К. Г. Прехтль де Ернандес, Дж. Д. Бівер, К. Мухаммед, К. Кріз, Г. Белл, Г. Дюригель, Е. Хьюз, А. Д. Уолдман, Г. Мороз, Дж. Д. Белл
o Пост упереджує системи відшкодування мозку до висококалорійної їжі
o Eur. J. Neurosci., 30 (2009), стор. 1625 – 1635
o
67.
o Halaas та ін., 1995
o JL Halaas, KS Gajiwala, M. Maffei, SL Cohen, BT Chait, D. Rabinowitz, RL Lallone, SK Burley, JM Friedman
o Ефекти на зниження ваги білка плазми, кодованого геном ожиріння
o Science, 269 (1995), стор. 543 – 546
o
68.
o Гамільтон та ін., 1995
o BS Hamilton, D. Paglia, AY Kwan, M. Deitel
o Підвищена експресія ожиріння мРНК у жирових клітинах сальника у людей, що страждають масовим ожирінням
o Nat. Мед., 1 (1995), стор. 953 – 956
o
69.
o Ернандес і Хобель, 1988
o Л. Ернандес, Б. Г. Гебель
o винагорода за їжу та кокаїн збільшують позаклітинний дофамін в ядрах, що вимірюється мікродіалізом
o Life Sci., 42 (1988), стор. 1705 – 1712
o
70.
o Hill та ін., 2003
o JO Hill, HR Wyatt, GW Reed, JC Peters
o Ожиріння та навколишнє середовище: звідки ми підемо звідси?
o Science, 299 (2003), стор. 853 – 855
o
71.
o Hoebel, 1969
o BG Hoebel
o Годування та самостимуляція
o Енн. NY Акад. Наук., 157 (1969), стор. 758 – 778
o
72.
o Hoebel і Balagura, 1967
o BG Hoebel, S. Balagura
o Самостимуляція бічного гіпоталамусу, модифікованого інсуліном та глюкагоном
o Фізіол. Behav., 2 (1967), стор. 337 – 340
o
73.
o Hoebel і Teitelbaum, 1962
o BG Hoebel, P. Teitelbaum
o Гіпоталамічний контроль годування та самостимуляція
o Science, 135 (1962), стор. 375 – 377
o
74.
o Хобель та Томпсон, 1969
o BG Hoebel, RD Thompson
o Відраза до бічної гіпоталамічної стимуляції, викликаної внутрішньошлунковою годівлею або ожирінням
o J. Comp. Фізіол. Psychol., 68 (1969), стор. 536 – 543
o
75.
o Hofmann et al., 2010
o W. Hofmann, GM van Koningsbruggen, W. Stroebe, S. Ramanathan, H. Aarts
o Як розгортається задоволення: Гедонічні реакції на спокусливу їжу
o Психол. Наук., 21 (2010), стор. 1863 – 1870
o
76.
o Голландія та Галлахер, 2004
o ПК Голланд, М. Галлахер
o Емігдала-лобова взаємодія та тривалість винагороди
o Curr. Думка. Neurobiol., 14 (2004), стор. 148 – 155
o
77.
o Hollander та ін., 2010
o JA Hollander, HI Im, AL Amelio, J. Kocerha, P. Bali, Q. Lu, D. Willoughby, C. Wahlestedt, MD Conkright, PJ Kenny
o Стрияльна мікроРНК контролює споживання кокаїну за допомогою сигналу CREB
o Природа, 466 (2010), стор. 197 – 202
o
78.
o Hommel та ін., 2006
o JD Hommel, R. Trinko, RM Sears, D. Georgescu, ZW Liu, XB Gao, JJ Thurmon, M. Marinelli, RJ DiLeone
o сигналізація рецепторів лептину в нейронах середнього мозку дофаміну регулює годування
o Нейрон, 51 (2006), стор. 801 – 810
o
79.
o Imaizumi та ін., 2001
o M. Imaizumi, M. Takeda, A. Suzuki, S. Sawano, T. Fushiki
o перевагу їжі з високим вмістом жиру у мишей: смажена картопля порівняно з вареною картоплею
o Апетит, 36 (2001), стор. 237 – 238
o
80.
o Jerlhag та ін., 2006
o Е. Джерлхаг, Е. Егесіоглу, С. Л. Діксон, М. Андерссон, Л. Свенссон, Дж. Енгель
o Грелін стимулює опорно-рухову активність та акумуляторний перелив дофаміну через центральні холінергічні системи у мишей: наслідки для його участі у винагороді мозку
o наркоман. Біол., 11 (2006), стор. 45 – 54
o
81.
o Jerlhag та ін., 2007
o Е. Джерлхаг, Е. Егесіоглу, С. Л. Діксон, А. Духан, Л. Свенссон, Дж. Енгель
o введення греліну в зону тегментації стимулює опорно-рухову активність і підвищує позаклітинну концентрацію дофаміну в ядрах ядер
o наркоман. Біол., 12 (2007), стор. 6 – 16
o
82.
o Джоу та ін., 2009
o TC Jhou, HL Fields, MG Baxter, CB Saper, PC Holland
o Ростромедіальне тегментальне ядро (RMTg), GABAergic, що впливає на дофамінові нейрони середнього мозку, кодує аверсивні подразники та інгібує рухові реакції
o Нейрон, 61 (2009), стор. 786 – 800
o
83.
o Джонсон і Кенні, 2010
o Прем'єр Джонсон, PJ Кенні
o Дофамінові D2-рецептори при дисфункції винагородження, що нагадує залежність, і компульсивному харчуванні у ожирілих щурів
o Nat. Neurosci., 13 (2010), стор. 635 – 641
o
84.
o Джонсон та ін., 1996
o PI Johnson, MA Parente, JR Stellar
o Індуковані NMDA ураження ядер ядра або вентрального блідості збільшують корисну ефективність їжі для позбавлених щурів
o мозковий ресурс, 722 (1996), стор. 109 – 117
o
85.
o Jönsson та ін., 1999
o Е.Г. Йенссон, М. М. Нотен, Ф. Грюнхаге, Л. Фарде, Ю. Накасіма, П. Проппінг, Г. К. Седвалл
o Поліморфізми в гені рецептора дофаміну D2 та їх зв'язок із щільністю рецепторів дофаміну здорових добровольців
o Мол. Психіатрія, 4 (1999), стор. 290 – 296
o
86.
o Kalarchian та ін., 2002
o М.А. Каларчіян, доктор медицини Маркус, Г.Т. Вілсон, Е.В. Лабув'є, Р.Е. Бролін, Л.Б. ЛаМарка
o Поїдання серед хворих на шлунковий байпас при тривалому спостереженні
o Обес. Surg., 12 (2002), стор. 270 – 275
o
87.
o Kandiah та ін., 2006
o J. Kandiah, M. Yake, J. Jones, M. Meyer
o Стрес впливає на апетит та комфортність харчових уподобань у жінок коледжу
o Nutr. Відповідно, 26 (2006), стор. 118 – 123
o
88.
o Karhunen та ін., 1997
o LJ Karhunen, RI Lappalainen, EJ Vanninen, JT Kuikka, MI Uusitupa
o Регіональний мозковий кровотік під час впливу їжі у жінок з ожирінням та нормальною вагою
o Мозок, 120 (1997), стор. 1675 – 1684
o
89.
o Kasanetz та ін., 2010
o Ф. Касанець, В. Дерош-Гамонет, Н. Берсон, Е. Баладо, М. Лафуркад, О. Манцоні, П. В. Піаца
o Перехід до звикання пов'язаний зі стійким порушенням синаптичної пластичності
o Science, 328 (2010), стор. 1709 – 1712
o
90.
o Kelley та ін., 1996
o AE Kelley, EP Bless, CJ Swanson
o Дослідження впливу антагоністів опіатів, влитих у ядра акулітів, на годування та пиття сахарози у щурів
o J. Pharmacol. Досвід Ther., 278 (1996), стор. 1499 – 1507
o
91.
o Kelley та ін., 2005
o AE Kelley, BA Baldo, WE Pratt, MJ Will
o Кортикостриативно-гіпоталамічна схема та мотивація їжі: інтеграція енергії, дії та винагороди
o Фізіол. Behav., 86 (2005), стор. 773 – 795
o
92.
o Кенні та ін., 2006
o PJ Kenny, SA Chen, O. Kitamura, A. Markou, GF Koob
o Умовна відмова призводить до споживання героїну та зменшує чутливість до винагороди
o J. Neurosci., 26 (2006), стор. 5894 – 5900
o
93.
o Кім та ін., 2010
o KS Kim, YR Yoon, HJ Lee, S. Yoon, SY Kim, SW Shin, JJ An, MS Kim, SY Choi, W. Sun, JH Baik
o посилена гіпоталамічна лептинова сигналізація у мишей, у яких відсутні дофамінові D2 рецептори
o J. Biol. Chem., 285 (2010), стор. 8905 – 8917
o
94.
o Klein та ін., 2007
o TA Klein, J. Neumann, M. Reuter, J. Hennig, DY von Cramon, M. Ullsperger
o генетично обумовлені відмінності в навчанні на помилках
o Science, 318 (2007), стор. 1642 – 1645
o
95.
o Kojima та ін., 1999
o M. Kojima, H. Hosoda, Y. Date, M. Nakazato, H. Matsuo, K. Kangawa
o Грелін - гормон росту, який вивільняє ацильований пептид із шлунку
o Природа, 402 (1999), стор. 656 – 660
o
96.
o Кок та ін., 2006
o П. Кок, Ф. Роелфсема, М. Фреліх, Дж. ван Пелт, А. Е. Мендерс, Х. Пійл
o Активація рецепторів дофаміну D2 знижує концентрацію циркадного лептину у жінок з ожирінням
o J. Clin. Ендокринол. Metab., 91 (2006), стор. 3236 – 3240
o
97.
o Koob, 2010
o Г. Ф. Кооб
o Роль CRF та пов'язаних з CRF пептидів у темній стороні залежності
o мозковий ресурс, 1314 (2010), стор. 3 – 14
o
98.
o Koob і Le Moal, 2008
o GF Koob, M. Le Moal
o Наркоманія та антиреверсивна система мозку
o Ану. Преподобний Психол., 59 (2008), стор. 29 – 53
o
99.
o Koob і Volkow, 2010
o GF Koob, ND Volkow
o Нейроциркуляція залежності
o нейропсихофармакологія, 35 (2010), стор. 217 – 238
o
100.
o Koob і Zorrilla, 2010
o GF Koob, EP Zorrilla
o нейробіологічні механізми звикання: фокус на факторі, що вивільняє кортикотропін
o Curr. Думка. Досліджуйте. Наркотики, 11 (2010), стор. 63 – 71
o
101.
o Kringelbach та ін., 2003
o М. Л. Крінгельбах, Дж. О'Доерті, Е. Т. Роллс, К. Ендрюс
o Активація орбітофронтальної кори людини до рідкого харчового подразника корелює з її суб'єктивною приємністю
o Цереб. Cortex, 13 (2003), стор. 1064 – 1071
o
102.
o Krügel та ін., 2003
o У. Крюгель, Т. Шрафт, Х. Кіттнер, У. Кісс, П. Іллес
o Вивільнення дозаміну в основі ядра та годування в ядрах щурів пригнічується лептином
o Eur. J. Pharmacol., 482 (2003), стор. 185 – 187
o
103.
o la Fleur, 2006
o SE la Fleur
o Вплив глюкокортикоїдів на поведінку годування щурів
o Фізіол. Behav., 89 (2006), стор. 110 – 114
o
104.
o LaBar та ін., 2001
o KS LaBar, DR Gitelman, TB Parrish, YH Kim, AC Nobre, MM Mesulam
o Голод вибірково модулює активацію кортиколімбіки до харчових подразників у людини
o Бехав. Neurosci., 115 (2001), стор. 493 – 500
o
105.
o Latagliata та ін., 2010
o EC Latagliata, E. Patrono, S. Puglisi-Allegra, R. Ventura
o Пошук їжі, незважаючи на шкідливі наслідки, знаходиться під префронтальним норадренергічним контролем кортикальної тканини
o BMC Neurosci., 11 (2010), стор. 15
o
106.
o Lawford та ін., 2000
o БР Лоуфорд, Р. М. Янг, Е. П. Ноубл, Дж. Сарджент, Дж. Роуелл, С. Шадфорт, X. Чжан, Т. Річі
o Алел-залежність D (2) рецептора А (1) і опіоїдна залежність: асоціація з використанням героїну та реакція на лікування метадоном
o Am. Дж. Мед. Genet., 96 (2000), стор. 592 – 598
o
107.
o Leinninger та ін., 2009
o GM Leinninger, YH Jo, RL Leshan, GW Louis, H. Yang, JG Barrera, H. Wilson, DM Opland, MA Faouzi, Y. Gong та ін.
o Лептин діє через бічні гіпоталамічні нейрони, що експресують рецептор лептину, для модуляції мезолімбічної дофамінової системи та пригнічення годування
o Cell Metab., 10 (2009), стор. 89 – 98
o
108.
o Lenoir та ін., 2007
o M. Lenoir, F. Serre, L. Cantin, SH Ahmed
o Інтенсивна солодкість перевершує кокаїнову винагороду
o PLOS ONE, 2 (2007), стор. e698 http://dx.doi.org/10.1371/journal.pone.0000698
o
109.
o Лешан та ін., 2010
o RL Leshan, DM Opland, GW Louis, GM Leinninger, CM Patterson, CJ Rhodes, H. Münzberg, MG Myers Mr.
o Нейрони рецептора лептинової тегементальної області спеціально проектують та регулюють транскрипційні нейрони нейроскриптів кокаїном та амфетаміном розширеної центральної мигдалини
o J. Neurosci., 30 (2010), стор. 5713 – 5723
o
110.
o Луї та ін., 2010
o GW Louis, GM Leinninger, CJ Rhodes, MG Myers Jr.
o Пряма іннервація та модуляція орексинових нейронів бічними гіпоталамічними нейронами LepRb
o J. Neurosci., 30 (2010), стор. 11278 – 11287
o
111.
o Luppino та ін., 2010
o FS Луппіно, LM de Wit, PF Bouvy, T. Stijnen, P. Cuijpers, BW Penninx, FG Zitman
o Зайва вага, ожиріння та депресія: систематичний огляд та мета-аналіз поздовжніх досліджень
o Арка. Психіатрія поколінь, 67 (2010), стор. 220 – 229
o
112.
o Люттер і Нестлер, 2009
o М. Люттер, EJ Nestler
o Гомеостатичні та гедонічні сигнали взаємодіють у регуляції прийому їжі
o J. Nutr., 139 (2009), стор. 629 – 632
o
113.
o Махт і Мюллер, 2007
o М. Махт, Дж. Мюллер
o негайний вплив шоколаду на експериментально викликані стани настрою
o Апетит, 49 (2007), стор. 667 – 674
o
114.
o Мальдонадо-Ірізарі та Келлі, 1995
o CS Мальдонадо-Ірізарі, А.Є. Келлі
o Екситототоксичні ураження ядра та оболонки субрегіонів ядра різко порушують регуляцію маси тіла та рухову активність у щурів
o Мозговий Рез. Bull., 38 (1995), стор. 551 – 559
o
115.
o Maldonado-Irizarry et al., 1995
o CS Maldonado-Irizarry, CJ Swanson, AE Kelley
o Рецептори глутамату в ядрі містять оболонку, контролюючи поведінку живлення через бічний гіпоталамус
o J. Neurosci., 15 (1995), стор. 6779 – 6788
o
116.
o Malik та ін., 2008
o С. Малик, Ф. МакГлоун, Д. Бедроссян, А. Дагер
o Грелін модулює мозкову діяльність в областях, що контролюють апетитну поведінку
o Cell Metab., 7 (2008), стор. 400 – 409
o
117.
o Man та ін., 2009
o MS Man, HF Clarke, AC Roberts
o роль орбітофронтальної кори та медіального стриатуму в регулюванні переважних реакцій на харчові винагороди
o Цереб. Cortex, 19 (2009), стор. 899 – 906
o
118.
o Маргели та Старі, 1962
o DL Margules, J. Olds
o Ідентичні системи «годування» та «нагородження» у бічному гіпоталамусі щурів
o Science, 135 (1962), стор. 374 – 375
o
119.
o Марку і Франк, 1987
o А. Марку, Р. А. Франк
o Вплив розміщення операнта та електрода на функції тривалої реакції поїзда на самостимуляцію
o Фізіол. Behav., 41 (1987), стор. 303 – 308
o
120.
o Марку і Кооб, 1991
o А. Марку, Г. Ф. Кооб
o Посткокаїнова ангедонія. Тваринна модель виведення кокаїну
o нейропсихофармакологія, 4 (1991), стор. 17 – 26
o
121.
o Mastronardi та ін., 2001
o CA Mastronardi, WH Yu, VK Srivastava, WL Dees, SM McCann
o Вивільнення лептопіну, спричинене ліпополісахаридом, нейронно контролюється
o Зб. Natl. Акад. Наук. США, 98 (2001), стор. 14720 – 14725
o
122.
o Matheny та ін., 2011
o M. Matheny, A. Shapiro, N. Tumer, PJ Scarpace
o Клітинна стійкість до лептину, спричинена дієтою та індукована лептином, включає в себе вентральну тегментальну область щурів
o Нейрофармакологія (2011) http://dx.doi.org/10.1016/j.neuropharm.2010.11.002 у пресі. Опубліковано в Інтернеті 5, 2010
o
123.
o Мацумото і Хікосака, 2007
o М. Мацумото, О. Хікосака
o Бічна габенула як джерело негативних нагородних сигналів у нейронах дофаміну
o Природа, 447 (2007), стор. 1111 – 1115
o
124.
o Мортон та ін., 2006
o Дж. Дж. Мортон, Д.Є. Каммінгс, Д.Г. Баскін, Г.С. Барш, М. В. Шварц
o контроль центральної нервової системи над прийомом їжі та вагою тіла
o Природа, 443 (2006), стор. 289 – 295
o
125.
o Гора і Хобель, 1967
o Г. Маунт, Б.Г. Хобель
o Бічна гіпоталамічна самостимуляція: Самовизначений поріг збільшується при прийомі їжі
o Психон. Наук., 9 (1967), стор. 265 – 266
o
126.
o Nair та ін., 2011
o SG Nair, BM Navarre, C. Cifani, CL Pickens, JM Bossert, Y. Shaham
o Роль дорсальної медіальної префронтальної кори дофамінових рецепторів сімейства D1 у рецидиві їжі, яка шукає жир, що індукується анксіогенним препаратом йохімбіном
o нейропсихофармакологія, 36 (2011), стор. 497 – 510
o
127.
o Nakazato та ін., 2001
o М. Наказато, Н. Муракамі, Ю. Дате, М. Кодзіма, Х. Мацуо, К. Кангава, С. Мацукура
o роль греліну в центральній регуляції годування
o Природа, 409 (2001), стор. 194 – 198
o
128.
o Naqvi і Bechara, 2009
o NH Naqvi, A. Bechara
o Прихований острів залежності: Інсула
o Тенденції Neurosci., 32 (2009), стор. 56 – 67
o
129.
o Neville та ін., 2004
o MJ Neville, EC Johnstone, RT Walton
o Ідентифікація та характеристика ANKK1: Новий ген кінази, тісно пов'язаний з DRD2 на хромосомній смузі 11q23.1
o Гум. Mutat., 23 (2004), стор. 540 – 545
o
130.
o Ніренберг і Води, 2006
o MJ Nirenberg, C. Waters
o Обов'язкове вживання їжі та збільшення ваги, пов’язане із застосуванням агоніста дофаміну
o Mov. Розбрат., 21 (2006), стор. 524 – 529
o
131.
o благородний, 2000
o EP Noble
o Наркоманія та процес її винагороди за допомогою поліморфізмів гена рецепторів дофаміну D2: огляд
o Eur. Психіатрія, 15 (2000), стор. 79 – 89
o
132.
o Noble та ін., 1993
o EP Noble, K. Blum, ME Khalsa, T. Ritchie, A. Montgomery, RC Wood, RJ Fitch, T. Ozkaragoz, PJ Sheridan, MD Anglin et al.
o Алелійна асоціація гена рецептора дофаміну D2 з кокаїновою залежністю
o Залежність від наркотиків, 33 (1993), стор. 271 – 285
o
133.
o Noble та ін., 2000
o EP Noble, X. Zhang, TL Ritchie, RS Sparkes
o Гаплотипи в локусі DRD2 та сильний алкоголізм
o Am. Дж. Мед. Genet., 96 (2000), стор. 622 – 631
o
134.
o О'Коннор та ін., 2008
o Д. Б. О'Коннор, Ф. Джонс, М. Коннер, Б. Макміллан, Е. Фергюсон
o Вплив щоденних клопотів та стилю харчування на харчову поведінку
o Health Psychol., 27 (1, Suppl) (2008), стор. S20 – S31
o
135.
o O'Doherty та ін., 2002
o JP O'Doherty, R. Deichmann, HD Critchley, RJ Dolan
o Нейрові реакції під час очікування первинної винагороди за смак
o Нейрон, 33 (2002), стор. 815 – 826
o
136.
o О'Рахіллі, 2009
o С. О'Рахіллі
o Генетика людини висвітлює шляхи до метаболічних захворювань
o Природа, 462 (2009), стор. 307 – 314
o
137.
o Освальд та ін., 2010
o К. Д. Освальд, Д. Л. Мердо, В. Л. Кінг, М. М. Боггіано
o Мотивація їжі на смак, незважаючи на наслідки в тваринній моделі їжі
o Int. Дж. Їст. Розбрат. (2010) http://dx.doi.org/10.1002/eat.20808 у пресі. Опубліковано в Інтернеті 22, 2010
o
138.
o Парк і Карр, 1998
o TH Park, KD Carr
o Нейроанатомічні структури фос-імунної імунореактивності, спричинені сприятливим прийомом їжі та їжею у щурів, які отримували фізіологічний та налтрексоновий режим
o мозковий ресурс, 805 (1998), стор. 169 – 180
o
139.
o Peciña and Berridge, 2005
o S. Peciña, KC Berridge
o гаряча точка гедонів у оболонці ядерних ядер: де му-опіоїди викликають посилений гедонічний вплив солодкості?
o J. Neurosci., 25 (2005), стор. 11777 – 11786
o
140.
o Peciña та ін., 2006a
o S. Peciña, J. Schulkin, KC Berridge
o Коефіцієнт, що вивільняє кортикотропін, збільшує нуклеус, збільшує мотивацію, що спрацьовує за допомогою київ, на винагороду сахарози: Парадоксальні позитивні стимулюючі ефекти при стресі?
o BMC Biol., 4 (2006), стор. 8
o
141.
o Peciña та ін., 2006b
o S. Peciña, KS Smith, KC Berridge
o Гедонічні гарячі точки в мозку
o нейрознавець, 12 (2006), стор. 500 – 511
o
142.
o Pecoraro та ін., 2004
o Н. Пекораро, Ф. Рейес, Ф. Гомес, А. Бхаргава, М. Ф. Далман
o Хронічний стрес сприяє приємному годуванню, що зменшує ознаки стресу: зворотний ефект та зворотний ефект від хронічного стресу
o Ендокринологія, 145 (2004), стор. 3754 – 3762
o
143.
o Pelchat та ін., 2004
o М. Л. Пельчат, А. Джонсон, Р. Чан, Дж. Вальдес, Дж. Д. Рагланд
o Образи бажання: активація їжі під час фМР
o Neuroimage, 23 (2004), стор. 1486 – 1493
o
144.
o Pelleymounter та ін., 1995
o М. А. Пеллемонтер, М. Дж. Каллен, М. Б. Бейкер, Р. Гехт, Д. Вінтерс, Т. Бун, Ф. Коллінз
o Вплив продукту гена ожиріння на регулювання маси тіла у мишей
o Science, 269 (1995), стор. 540 – 543
o
145.
o Pelloux та ін., 2007
o Y. Pelloux, BJ Everitt, A. Dickinson
o Нав'язливий пошук наркотиків щурами під покаранням: наслідки вживання наркотиків в анамнезі
o Психофармакологія (Берл.), 194 (2007), стор. 127 – 137
o
146.
o Perello та ін., 2010
o M. Perello, I. Sakata, S. Birnbaum, JC Chuang, S. Osborne-Lawrence, SA Rovinsky, J. Woloszyn, M. Yanagisawa, M. Lutter, JM Zigman
o Грелін збільшує корисну цінність дієти з високим вмістом жиру в залежності від орексину
o Біол. Психіатрія, 67 (2010), стор. 880 – 886
o
147.
o Петрович та ін., 2009
o Г. Д. Петрович, Каліфорнія Росс, П. Моді, ПК Голланд, М. Галлахер
o Центральна, але не базолатеральна, мигдалина має вирішальне значення для контролю годівлі за допомогою відвертих вивчених знаків
o J. Neurosci., 29 (2009), стор. 15205 – 15212
o
148.
o Pfaffly та ін., 2010
o J. Pfaffly, M. Michaelides, GJ Wang, JE Pessin, ND Volkow, PK Thanos
o Лептин збільшує зв'язування рецепторів D2 зі стриатозними допаміновими мишами з дефіцитом лептину (ожиріння)
o Synapse, 64 (2010), стор. 503 – 510
o
149.
o Puhl та ін., 2008
o Р. М. Пул, Каліфорнія Мосс-Ракусін, М. Б. Шварц, К. Д. Браунелл
o Стигматизація ваги та зменшення упередженості: перспективи надмірної ваги та ожиріння дорослих
o Health Educ. Відповідно, 23 (2008), стор. 347 – 358
o
150.
o Рада та ін., 2010
o P. Rada, ME ME Bocarsly, JR Barson, BG Hoebel, SF Leibowitz
o Зменшене кількість дофаміну у пацюків Sprague-Dawley, схильних до переїдання дієти, багатої жирами
o Фізіол. Behav., 101 (2010), стор. 394 – 400
o
151.
o Річі та благородний, 2003
o Т. Річі, Е. П. Благородний
o асоціація семи поліморфізмів гена дофамінових рецепторів D2 з характеристиками зв'язування рецепторів мозку
o Нейрохем. Відповідно, 28 (2003), стор. 73 – 82
o
152.
o Роберто та ін., 2010
o M. Roberto, MT Cruz, NW Gilpin, V. Sabino, P. Schweitzer, M. Bajo, P. Cottone, SG Madamba, DG Stouffer, EP Zorrilla et al.
o Вивільнення факторами амігдали гамма-аміномасляної кислоти, що вивільняє кортикотропін, відіграє ключову роль у алкогольній залежності
o Біол. Психіатрія, 67 (2010), стор. 831 – 839
o
153.
o Roitman та ін., 2004
o MF Roitman, GD Stuber, PE Phillips, RM Wightman, RM Carelli
o Дофамін діє як субсекундний модулятор пошуку їжі
o J. Neurosci., 24 (2004), стор. 1265 – 1271
o
154.
o Roitman та ін., 2008
o М. Ф. Ройтман, Р. А. Вілер, Р. М. Вайтман, Р. М. Кареллі
o Хімічні реакції в реальному часі в ядрі розрізняють нагороджувальні та неприязні стимули
o Nat. Neurosci., 11 (2008), стор. 1376 – 1377
o
155.
o рулони, 2008
o ET Rolls
o Функції кори орбітофронтальної та прегеніальної цингулятів у смаку, нюху, апетиті та емоціях
o Acta Physiol. Hung., 95 (2008), стор. 131 – 164
o
156.
o рулони, 2010
o ET Rolls
o Смакові, нюхові та харчові текстури винагороджують обробку мозку та ожиріння
o Int. Дж. Обес. (Лонд.) (2010) http://dx.doi.org/10.1038/ijo.2010.155 у пресі. Опубліковано в Інтернеті 3, 2010
o
157.
o Rolls та ін., 1983
o ET Rolls, BJ Rolls, EA Rowe
o Сенсорне та мотиваційне насичення зору та смаку їжі та води у людини
o Фізіол. Behav., 30 (1983), стор. 185 – 192
o
158.
o Roseberry та ін., 2007
o А.Г. Роузберрі, Т. Художник, Г.П. Марк, Дж. Т. Вільямс
o Зниження везикулярного соматодендритного дофаміну зберігається у мишей з дефіцитом лептину
o J. Neurosci., 27 (2007), стор. 7021 – 7027
o
159.
o Rothemund та ін., 2007
o Y. Rothemund, C. Preuschhof, G. Bohner, HC Bauknecht, R. Klingebiel, H. Flor, BF Klapp
o Диференціальна активація дорсального стриатуму висококалорійними зоровими харчовими стимулами у ожиріння
o Neuroimage, 37 (2007), стор. 410 – 421
o
160.
o Salas та ін., 2010
o R. Salas, P. Baldwin, M. de Biasi, PR Montague
o Сміливі відповіді на негативні помилки прогнозування винагороди у габенулі людини
o передня частина. Гул. Neurosci., 4 (2010), стор. 36
o
161.
o Saper та ін., 2002
o CB Saper, TC Chou, JK Elmquist
o Необхідність годування: гомеостатичний та гедонічний контроль їжі
o Нейрон, 36 (2002), стор. 199 – 211
o
162.
o Saunders, 2001
o Р. Сондерс
o Обов'язкове втручання в їжу та шлункове лікування: що стосується голоду?
o Обес. Surg., 11 (2001), стор. 757 – 761
o
163.
o Scarpace та ін., 2010
o PJ Scarpace, M. Matheny, Y. Zhang
o Біг на колесі виключає перевагу з високим вмістом жиру та посилює передачу лептину в вентральній тегментальній області
o Фізіол. Behav., 100 (2010), стор. 173 – 179
o
164.
o Schiltz та ін., 2007
o CA Schiltz, QZ Bremer, CF Landry, AE Kelley
o Сигнали, пов'язані з їжею, змінюють функціональну зв'язок переднього мозку, як це оцінюють за допомогою негайної експресії гена та проенкефаліну
o BMC Biol., 5 (2007), стор. 16
o
165.
o Schur та ін., 2009
o EA Schur, NM Kleinhans, J. Goldberg, D. Buchwald, MW Schwartz, K. Maravilla
o Активізація системи регулювання енергії мозку та центрів винагород за допомогою харчових підказок залежить від вибору зорового стимулу
o Int. Дж. Обес. (Лонд.), 33 (2009), стор. 653 – 661
o
166.
o Sclafani та ін., 1998
o А. Sclafani, RJ Bodnar, AR Delamater
o Фармакологія харчових умовних переваг
o Апетит, 31 (1998), стор. 406
o
167.
o Sescosese та ін., 2010
o G. Sescosese, J. Redouté, JC Dreher
o архітектура кодування значень винагороди в корі орбітофронтальної кори людини
o J. Neurosci., 30 (2010), стор. 13095 – 13104
o
168.
o Shomaker та ін., 2010
o LB Shomaker, M. Tanofsky-Kraff, JM Zocca, A. Courville, M. Kozlosky, KM Columbo, LE Wolkoff, SM Brady, М.К. Крокер, AH Ali та ін.
o Їжа за відсутності голоду у підлітків: Прийом після їжі з великим масивом порівняно з їжею після стандартизованої їжі
o Am. J. Clin. Nutr., 92 (2010), стор. 697 – 703
o
169.
o Simmons та ін., 2005
o В. К. Сіммонс, А. Мартін, Л. В. Барсалу
o Картинки апетитних продуктів активізують смакові корти для смаку та винагороди
o Цереб. Cortex, 15 (2005), стор. 1602 – 1608
o
170.
o Малий, 2010
o DM Малий
o Смачне представлення в людській зорі
o мозкова структура. Функц., 214 (2010), стор. 551 – 561
o
171.
o Малий та ін., 2003
o Д. М. Малий, М. Джонс-Готман, А. Дагер
o Вивільнення дофаміну, спричинене годуванням, дорзальним стриатумом, корелює з оцінкою приємності до їжі у здорових добровольців
o Neuroimage, 19 (2003), стор. 1709 – 1715
o
172.
o Сміт і Беррідж, 2007
o К.С. Сміт, К. К. Берридж
o Опіоїдний лімбічний ланцюг для винагороди: взаємодія між гедоновими гарячими точками ядерних ядер та вентральним палідієм
o J. Neurosci., 27 (2007), стор. 1594 – 1605
o
173.
o Седерпальм і Берридж, 2000
o AH Söderpalm, KC Berridge
o Споживання їжі після діазепаму, морфіну або мускамолу: Мікроін'єкції У оболонці ядра приєднується
o Фармакол. Biochem. Behav., 66 (2000), стор. 429 – 434
o
174.
o Stice та ін., 2008a
o E. Stice, S. Spoor, C. Bohon, DM Small
o Співвідношення між ожирінням і притупленою смугастою реакцією на їжу модерується аллелем TaqIA A1
o Science, 322 (2008), стор. 449 – 452
o
175.
o Stice та ін., 2008b
o E. Stice, S. Spoor, C. Bohon, MG Veldhuizen, DM Small
o Співвідношення винагороди від прийому їжі та очікуваного прийому їжі до ожиріння: Функціональне дослідження магнітного резонансу
o Дж. Абнорм. Psychol., 117 (2008), стор. 924 – 935
o
176.
o Stice та ін., 2010a
o E. Stice, S. Yokum, K. Blum, C. Bohon
o Збільшення ваги пов'язане зі зниженою смугастою реакцією на смачну їжу
o J. Neurosci., 30 (2010), стор. 13105 – 13109
o
177.
o Stice та ін., 2010b
o E. Stice, S. Yokum, C. Bohon, N. Marti, A. Smolen
o Сприйнятність нагодової схеми до їжі пророкує майбутнє збільшення маси тіла: помірні ефекти DRD2 та DRD4
o Neuroimage, 50 (2010), стор. 1618 – 1625
o
178.
o Stoeckel, 2010
o Stoeckel, LE (2010). Принцип ожиріння Золотинок. Науковий американський. Червень 8, 2010. http://www.scientistamerican.com/article.cfm?id=the-goldilocks-principle-obesity.
o
179.
o Стратфорд і Келлі, 1997
o TR Stratford, AE Kelley
o GABA в оболонці ядра ядра бере участь у центральній регуляції поведінки при годівлі
o J. Neurosci., 17 (1997), стор. 4434 – 4440
o
180.
o Стратфорд і Келлі, 1999
o TR Stratford, AE Kelley
o Докази функціонального зв'язку між оболонкою ядра ядра та бічним гіпоталамусом, що підтверджує контроль поведінки живлення
o J. Neurosci., 19 (1999), стор. 11040 – 11048
o
181.
o Suarez і Gallup, 1981
o SD Suarez, GGJ Gallup
o Етологічний аналіз поведінки у щурах та мишах під відкритим небом
o Дізнайтеся. Motiv., 12 (1981), стор. 342 – 363
o
182.
o неділя та ін., 1983
o SR Sunday, SA Sanders, G. Collier
o Форми смаку та їжі
o Фізіол. Behav., 30 (1983), стор. 915 – 918
o
183.
o Swinburn та ін., 2009
o Б. Свінберн, Г. Сакс, Е. Равуссін
o Збільшення постачання продовольчої енергії більш ніж достатньо для пояснення епідемії ожиріння в США
o Am. J. Clin. Nutr., 90 (2009), стор. 1453 – 1456
o
184.
o Таха і поля, 2005
o SA Taha, HL Fields
o Кодування смакової та апетитної поведінки різними популяціями нейронів у ядрах ядра
o J. Neurosci., 25 (2005), стор. 1193 – 1202
o
185.
o Taha та ін., 2009
o SA Taha, Y. Katsuura, D. Noorvash, A. Seroussi, HL Fields
o конвергентні, а не серійні, смугасті та палідальні схеми регулюють споживання їжі, спричиненої опіоїдами
o Нейрологія, 161 (2009), стор. 718 – 733
o
186.
o Teegarden and Bele, 2007
o SL Teegarden, TL Bale
o Зменшення дієтичних переваг призводить до підвищення емоційності та ризику рецидиву харчування
o Біол. Психіатрія, 61 (2007), стор. 1021 – 1029
o
187.
o Teegarden та ін., 2009
o SL Teegarden, А.Н. Скотт, Т.Л. Бейл
o Раннє вплив дієти з високим вмістом жирів сприяє довготривалим змінам дієтичних переваг та центральній сигналізації про винагороду
o Нейрологія, 162 (2009), стор. 924 – 932
o
188.
o Thanos та ін., 2008
o PK Thanos, M. Michaelides, YK Piyis, GJ Wang, ND Volkow
o Обмеження в їжі помітно збільшує рецептор дофаміну D2 (D2R) в моделі ожиріння щурів, що оцінюється за допомогою in-vivo візуалізації muPET ([11C] раклоприд) та in-vitro ([3H] спіперону) авторадиографії
o Synapse, 62 (2008), стор. 50 – 61
o
189.
o Томпсон і Суонсон, 2010
o Р. Р. Томпсон, Л. В. Свонсон
o Аналіз структурних зв'язків, керований гіпотезами, підтримує мережу над ієрархічною моделлю архітектури мозку
o Зб. Natl. Акад. Наук. США, 107 (2010), стор. 15235 – 15239
o
190.
o Vanderschuren та Everitt, 2004
o LJ Vanderschuren, BJ Everitt
o Пошук наркотиків стає нав'язливим після тривалого прийому кокаїну
o Science, 305 (2004), стор. 1017 – 1019
o
191.
o Vendruscolo та ін., 2010a
o LF Vendruscolo, AB Geye, M. Darnaudéry, SH Ahmed, M. Cador
o Надмірне споживання цукру в підлітковому віці вибірково змінює мотивацію та функцію винагороди у дорослих щурів
o PLOS ONE, 5 (2010), стор. e9296 http://dx.doi.org/10.1371/journal.pone.0009296
o
192.
o Vendruscolo та ін., 2010b
o LF Vendruscolo, AB Gueye, JC Vendruscolo, KJ Clemens, P. Mormède, M. Darnaudéry, M. Cador
o Зменшене вживання алкоголю у дорослих щурів, підданих дії сахарози в підлітковому віці
o Нейрофармакологія, 59 (2010), стор. 388 – 394
o
193.
o Волков та О'Брайен, 2007
o Н. Д. Волков, К. П. О'Брайен
o Проблеми для DSM-V: Чи слід включати ожиріння як розлад мозку?
o Am. J. Психіатрія, 164 (2007), стор. 708 – 710
o
194.
o Волков і Мудрий, 2005
o Н. Д. Волков, Р. А. Мудрий
o Як наркоманія може допомогти нам зрозуміти ожиріння?
o Nat. Neurosci., 8 (2005), стор. 555 – 560
o
195.
o Volkow et al., 2009
o Н. Д. Волков, Дж. Дж. Ван, Ф. Теланг, Дж. С. Фаулер, Р. З. Гольдштейн, Н. Алія-Кляйн, Дж. Логан, К. Вонг, П. К. Танос, Ю. Ма, К. Прадхан
o зворотна асоціація між ІМТ та префронтальною метаболічною активністю у здорових дорослих
o Ожиріння (Срібна весна), 17 (2009), стор. 60 – 65
o
196.
o Вучетік і Рейєс, 2010
o Z. Vucetic, TM Reyes
o Центральна дофамінергічна схема, яка контролює прийом їжі та винагороду: наслідки для регулювання ожиріння
o Wiley Interdiscip. Преподобний Сист. Біол. Мед., 2 (2010), стор. 577 – 593
o
197.
o Ван та ін., 2001
o GJ Wang, ND Volkow, J. Logan, NR Pappas, CT Wong, W. Zhu, N. Netusil, JS Fowler
o Дофамін мозку та ожиріння
o Lancet, 357 (2001), стор. 354 – 357
o
198.
o Ван та ін., 2002
o GJ Wang, ND Volkow, JS Fowler
o Роль дофаміну в мотивації їжі у людей: наслідки ожиріння
o думка експертів. Тер. Цілі, 6 (2002), стор. 601 – 609
o
199.
o Ван та ін., 2004a
o GJ Wang, ND Volkow, F. Telang, M. Jayne, J. Ma, M. Rao, W. Zhu, CT Wong, NR Pappas, A. Geliebter, JS Fowler
o Опромінення апетитних харчових стимулів помітно активізує мозок людини
o Neuroimage, 21 (2004), стор. 1790 – 1797
o
200.
o Ван та ін., 2004b
o GJ Wang, ND Volkow, PK Thanos, JS Fowler
o подібність між ожирінням та наркоманією, оціненою нейрофункціональною томографією: огляд концепції
o J. Addict. Дис., 23 (2004), стор. 39 – 53
o
201.
o Ван та ін., 2008
o GJ Wang, D. Tomasi, W. Backus, R. Wang, F. Telang, A. Geliebter, J. Korner, A. Bauman, JS Fowler, PK Thanos, ND Volkow
o Шлункова дистанія активізує схему ситості в мозку людини
o Neuroimage, 39 (2008), стор. 1824 – 1831
o
202.
o Wassum та ін., 2009
o KM Wassum, SB Ostlund, NT Maidment, BW Balleine
o Чіткі опіоїдні схеми визначають смакові якості та бажаність нагороджувати події
o Зб. Natl. Акад. Наук. США, 106 (2009), стор. 12512 – 12517
o
203.
o Wassum та ін., 2011
o KM Wassum, IC Cely, BW Balleine, NT Maidment
o активація мк-опіоїдних рецепторів у базолатеральній мигдалині опосередковує знання збільшення, але не зменшує стимулюючу цінність харчової винагороди
o J. Neurosci., 31 (2011), стор. 1591 – 1599
o
204.
o Вілкінсон і Піл, 1962
o HA HA Wilkinson, TL Peele
o Модифікація внутрішньочерепного самостимуляції голодом
o Am. J. Physiol., 203 (1962), стор. 537 – 540
o
205.
o Вілл та ін., 2003
o MJ Will, EB Franzblau, AE Kelley
o мукуопіоїди нуклеуса, що регулюють прийом дієти з високим вмістом жиру шляхом активації розподіленої мозкової мережі
o J. Neurosci., 23 (2003), стор. 2882 – 2888
o
206.
o Wilson та ін., 2008
o ME ME Wilson, J. Fisher, A. Fischer, V. Lee, RB Harris, TJ Bartness
o кількісна оцінка споживання їжі мавпами, що живуть у соціальних мережах: вплив соціального статусу на споживання калорій
o Фізіол. Behav., 94 (2008), стор. 586 – 594
o Стаття | PDF (553 K) |
Переглянути запис у Scopus
| Цитується в Scopus (22)
207.
o Yurcisin та ін., 2009
o Б. М. Юрчісін, М. М. Гаддор, Е. Дж. Демарія
o Ожиріння та баріатрична хірургія
o Clin. Мед. Грудей, 30 (2009), стор. 539 – 553, ix
o
208.
o Чжан та ін., 1998
o М. Чжан, Б. А. Госнелл, А. Е. Келлі
o Прийом їжі з високим вмістом жиру вибірково посилюється за рахунок стимуляції му опіоїдних рецепторів всередині ядра
o J. Pharmacol. Досвід Ther., 285 (1998), стор. 908 – 914
o Переглянути запис у Scopus
| Цитується в Scopus (148)
209.
o Zheng та ін., 2007
o Х. Чжен, Л.М. Паттерсон, HR Berthoud
o Сигналізація орексину в вентральній тегментальній області необхідна для апетиту з високим вмістом жиру, викликаного опіоїдною стимуляцією ядра ядра
o J. Neurosci., 27 (2007), стор. 11075 – 11082
o Переглянути запис у Scopus
| Цитується в Scopus (64)
210.
o Zheng та ін., 2009
o Х. Чжен, Н. Р. Ленард, А.С. Шін, Б.Р. Бертуд
o Контроль апетиту та регулювання енергетичного балансу в сучасному світі: мозок, керований нагородами, перекриває сигнали поповнення
o Int. Дж. Обес. (Лонд.), 33 (Suppl 2) (2009), стор. S8 – S13
o Переглянути запис у Scopus
| Цитується в Scopus (34)