Наукові доповіді обсяг 9, Номер статті: 16918 (2019)
абстрактний
Надмірне споживання сахарози викликає тягу до звикання, що може стати основою епідемії ожиріння. Опіоїди та дофамін опосередковують корисну дію від зловживання наркотиками та природні винагороди від стимулів, таких як смачна їжа. Ми досліджували ефекти сахарози з використанням ПЕТ-зображень за допомогою [11C] карфентаніл (агоніст опіоїдних рецепторів мкг) та [11C] раклоприд (антагоніст рецептора дофаміну D2 / 3) у семи міні-свинок Геттінген, знеболених. Потім ми давали міні-свинкам доступ до розчину сахарози протягом однієї години 12 днів поспіль і знову проводили візуалізацію через 24 години після остаточного доступу до сахарози. На меншій вибірці з п'яти міні-свинок ми виконали додатковий [11C] сеанс ПЕТ карфентанілу після першого впливу сахарози. Ми обчислили потенціали зв'язування з урахуванням вокселів (BP)ND) використовуючи мозочок як область незміщуваного зв'язування, проаналізував відмінності за допомогою статистичного непараметричного картографування та провів регіональний аналіз. Через 12 днів доступу сахарози, БПND обидва відслідковувача значно знизилися в стриатумі, ядерних корінцях, таламусі, мигдалині, корінчастої корі та префронтальній корі, що відповідає регуляції щільності рецепторів. Після одноразового впливу сахарози ми виявили зниження зв'язування [11C] карфентанілу в ядрах ярусів і корінгової кори, що відповідає викиду опіоїдів. Низька доступність опіоїдних та дофамінових рецепторів може пояснити адиктивний потенціал, пов'язаний з прийомом сахарози.
Вступ
П'ять відсотків світового населення клінічно страждають ожирінням1. Як відмітна ознака метаболічного синдрому, ожиріння асоціюється з діабетом 2 типу, серцево-судинними захворюваннями, респіраторними проблемами та ризиком депресії та, можливо, деменції2. Збільшення споживання енергетично щільної їжі перебільшує фізіологічну відмінність між гомеостатичним голодом, який слідує за позбавленням від їжі, і гедонічним голодом, або "тягою", що виникає за відсутності позбавлення3,4. Оскільки гомеостатична регуляція сама по собі не може пояснити поточне зростання ожиріння, обов'язково перевірити вплив на мозкові механізми винагороди та задоволення аддиктивними властивостями дуже смачної їжі.
Споживання цукрози пов’язане з ожирінням, а сахароза все частіше вважається залежним речовиною5. Деякі висновки суперечать цій заяві через труднощі у відділенні споживання їжі, що не підходить для смаку, від реакцій на їжу гедонів, а також у визначенні звикання інгредієнта в обробленій їжі, а також різних механізмів, за допомогою яких їжа змінює схему мозку природними шляхами6. Тим не менш, у конкретних умовах споживання сахарози викликає винагороду та тягу, порівнянні за величиною з тими, викликаними наркотичними засобами, що призводять до надмірного споживання та можливого ожиріння.6,7.
Голод асоціюється з "бажанням", що тісно пов'язане з ефектами дофамінергічної нейротрансмісії за ряду нагородних обставин8, але залишається незрозумілим, як дія дофаміну (DA) модулюється у відповідь на компульсивний прийом їжі. Споживання смачної їжі пов'язане з "симпатією", опосередкованою головним чином ендогенною опіоїдною системою, особливо мк-опіоїдним рецептором (μOR)9,10, що може сприяти надмірному споживанню при дерегуляції. У цьому звіті ми перевіряємо твердження, що сахароза призводить до вивільнення опіоїдів та дофаміну, що знижує доступність рецепторів μOR та DA D2 / 3. Доступність - це показник кількості незайнятих рецепторів, доступних для зв'язування з трассером, і в принципі не розрізняє зайнятість ліганду та щільність рецепторів.11.
Початок нав'язливого прийому їжі залежить від численних факторів, а причинно-наслідкові дослідження у людини викликають етичні проблеми. Тому більшість досліджень зосереджуються на поведінці кормів у щурів12. Хоча щури мають "солодкий зуб", їхні гомеостатичні механізми, важливі для збільшення ваги, метаболізму та типу накопичення жиру, значно відрізняються від таких у людей. Геттінгенська мініпіга - велика всеїдна тварина з добре розвиненим гіренцефалічним мозком, яку можна зобразити з достатньою роздільною здатністю. Його чітко визначені підкіркові та префронтальні коркові ділянки13 дозволяють більш прямий переклад на функцію мозку людини. Тут для тестування ми використовуємо позитронно-емісійну томографію (ПЕТ) в природних умовах µOR та DA D2 / 3 в міні-свинарній моделі субхронічного опромінення сахарози. У меншій вибірці ми дослідили безпосередній вплив на заповнення мкОР після першого впливу сахарози. Нарешті, ми перевірили взаємозв'язок між зміною доступності рецепторів двох тракторів.
результати
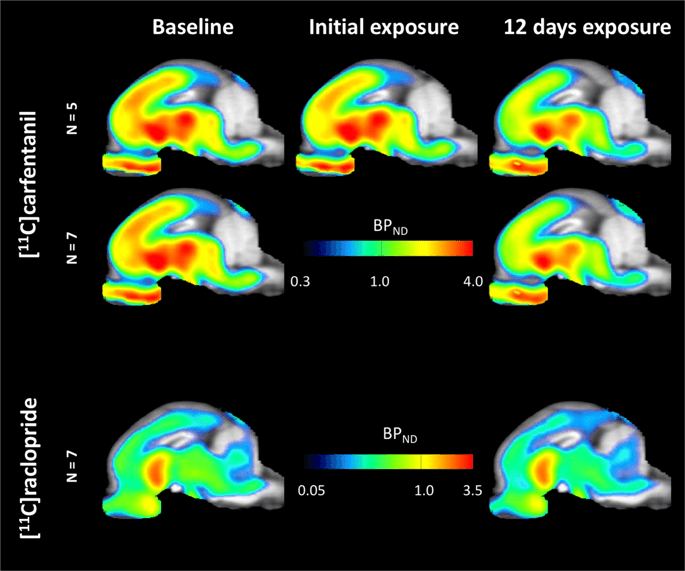
Середні параметричні карти [11C] карфентаніл і [11C] потенціал зв'язування раклоприду (БП)ND) показані на рис. 1. Проаналізувати зміни, що відбулися після першої експозиції сахарози у п’яти міні-свиней порівняно з базовою лінією та через день після 12th доступ сахарози в семи міні-свинях порівняно з базовою лінією, ми використовували теорію перестановки та нерегіональний аналіз цілого мозку, кращий метод для зразків такого розміру14.
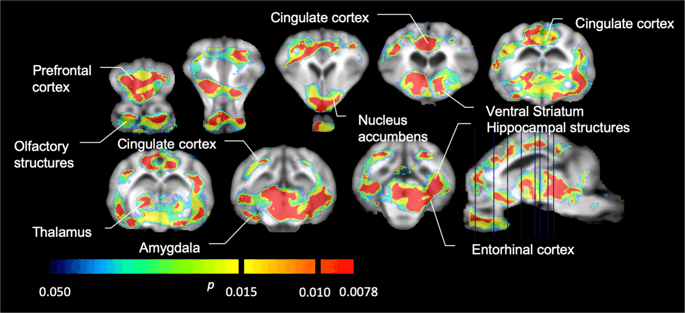
Середній воксельський не зміщуваний потенціал зв’язування (ВР)ND) карти, накладені на зображення МРТ у сагітальному вигляді. Дані представлені для [11C] карфентанил BPND з 5 міні-свиней, зображених за базовою лінією, після початкового впливу сахарози та через 12 днів впливу сахарози (верхній ряд). [11C] карфентанил BPND з усіх 7 міні-свинок, що були зроблені на початковому рівні та через 12 днів доступ сахарози представлений у середньому ряду. [11C] раклоприд BPND з усіх 7 міні-свинок, які були зроблені на початковому рівні та через 12 днів доступу сахарози, показані в нижньому рядку. Зауважте, що кольорова шкала є експоненціальною для виділення [11C] раклоприд BPND у позашлункових регіонах.
Початкове опромінення сахарози
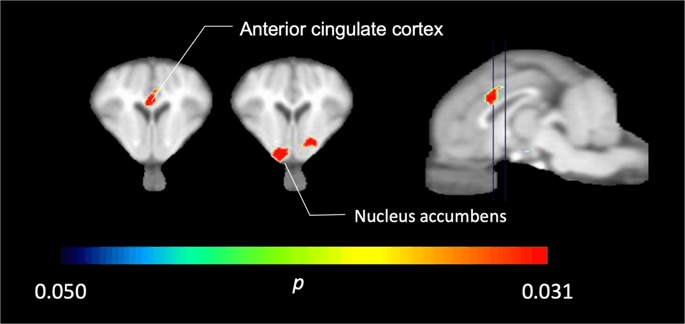
У п'яти міні-свинях, зображених [11C] карфентанілу на початковому рівні та одразу після першого опромінення сахарози ми виявили значно зменшене зв'язування мікроелементів у корі переднього цингулату та ядрі, що реагує на сахарозу, показане кольором на рис. 2, із зазначенням р <0.05. Ми виявили на 14% зменшення зв'язування індикаторів в обох областях порівняно з вихідним рівнем.
Значні зменшення в [11C] карфентанил BPND після першого впливу води на сахарозу порівняно з базовим рівнем (n = 5). Лише вокселі зі значущими (p Зменшення <0.05) показані як кольорові ділянки, спроектовані на порізи МРТ, зважені на Т1, на рівні передньої порожнистої кори (ліворуч) та ядерного накопичення (посередині) зі стереотаксичного атласу мозку міні-свиней. Зверніть увагу, що максимальний рівень значущості, досягнутий для 5 тварин, становить 2-5 ≈ 0.031 (див. Кольорову смугу). Дані представлені на корональних ділянках головного мозку свиней на рівнях, зазначених на сагітальному зображенні (праворуч).
12 днів доступу сахарози
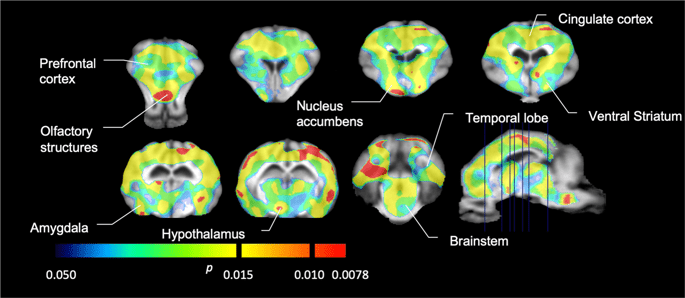
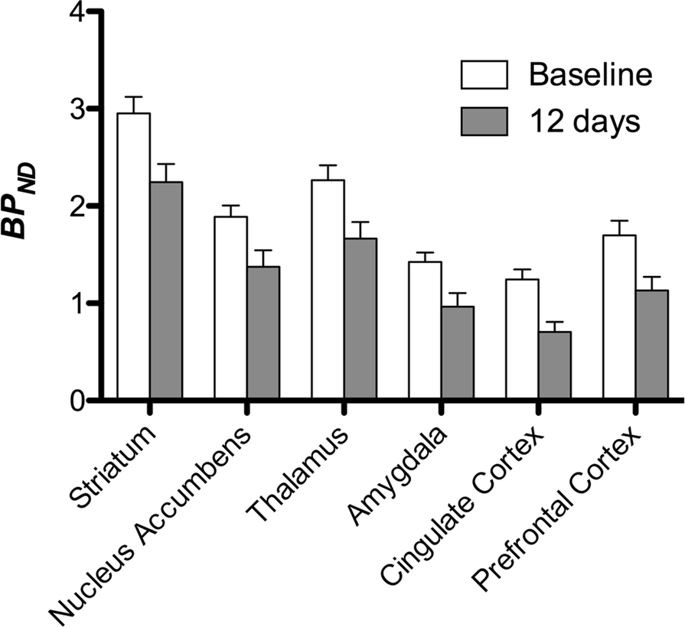
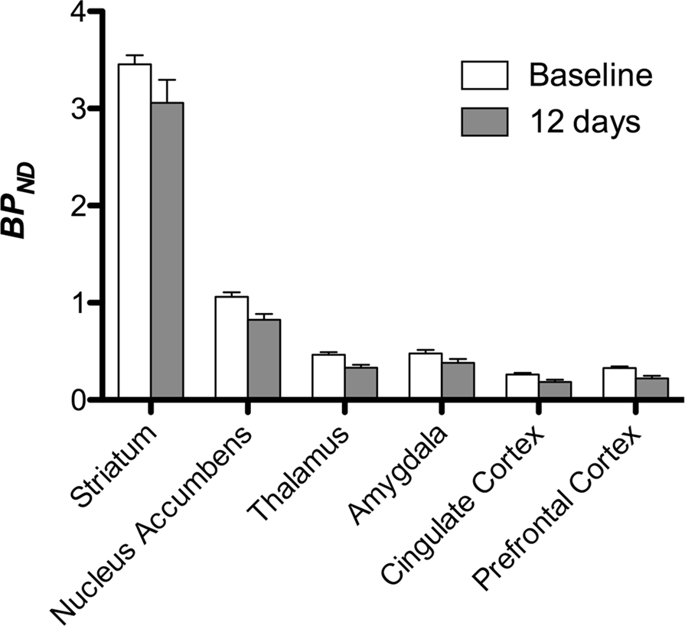
Потім ми провели аналіз семи міні-свиней, зображених за допомогою [11C] карфентаніл на початковому рівні та після 12 днів доступу сахарози та виявив значно знижене зв'язування мікроелементів у тварин, що зазнали дії сахарози, порівняно з вихідними. Найбільш сильно уражені регіони зображені червоним кольором на рис. 3 (p <0.01) і включають частини нюхових структур, nucleus accumbens / вентральний смугастий кісток і скроневу кору / частку, а потім ділянки, показані жовтим кольором (p <0.015), які включали частини префронтальної кори, мозочкової кори, мигдалини та стовбура мозку . Для того, щоб отримати BPND значення та оцінюючи відсоткові зміни, ми провели регіональний аналіз та отримали середні значення в кожному регіоні за базовою лінією та після споживання сахарози (рис. 4).
Значні зменшення в [11C] потенціал зв'язування карфентанілу (БП)ND) між базовою лінією та після 12 днів впливу сахарози на воду (n = 7). Вокселі зі значущими (p Зменшення <0.05) показано як кольорові ділянки, спроектовані на зважені М1 МРТ зрізи зі стереотаксичного атласу мозку міні-свиней. Дані представлені на корональних відділах мозку на рівнях, вказаних на сагітальному зображенні (праворуч унизу). Зверніть увагу, що максимальний рівень значущості, досягнутий для 7 тварин, становить 2-7 ≈ 0.0078 (див. Кольорову смугу).
Ми використовували [11C] раклоприд як відслідковуючи рецептори DA D2 / 3 у стритальних та екстрастратальних областях мозку у міні-свиней на початковому рівні та через 12 днів доступу сахарози (рис. 1). Ми виявили знижене зв'язування слідів у тварин, що зазнали дії сахарози, порівняно з вихідним рівнем із найбільшими ефектами (р <0.01) у зонах префронтальної кори, ядерного накопичення / вентрального смугастого мозку, мозочкової кори, мигдалини, таламуса, довгастого мозку, областей гіпокампа та нюхових ділянок (Рис. 5). Дані регіонального аналізу представлені на рис. 6.
Значні зменшення в [11C] потенціал зв'язування раклоприду (БП)ND) між базовою лінією та після 12 днів впливу сахарози на воду (n = 7). Вокселі зі значущими (p Зменшення <0.05) показано як кольорові ділянки, спроектовані на зважені М1 МРТ зрізи зі стереотаксичного атласу мозку міні-свиней. Дані представлені на корональних зрізах мозку свині на рівнях, вказаних на сагітальному зображенні (праворуч унизу). Зверніть увагу, що максимальний рівень значущості, досягнутий для 7 тварин, становить 2-7 ≈ 0.0078 (див. Кольорову смугу).
Кореляції між [11C] раклоприд і [11C] дані карфентанілу
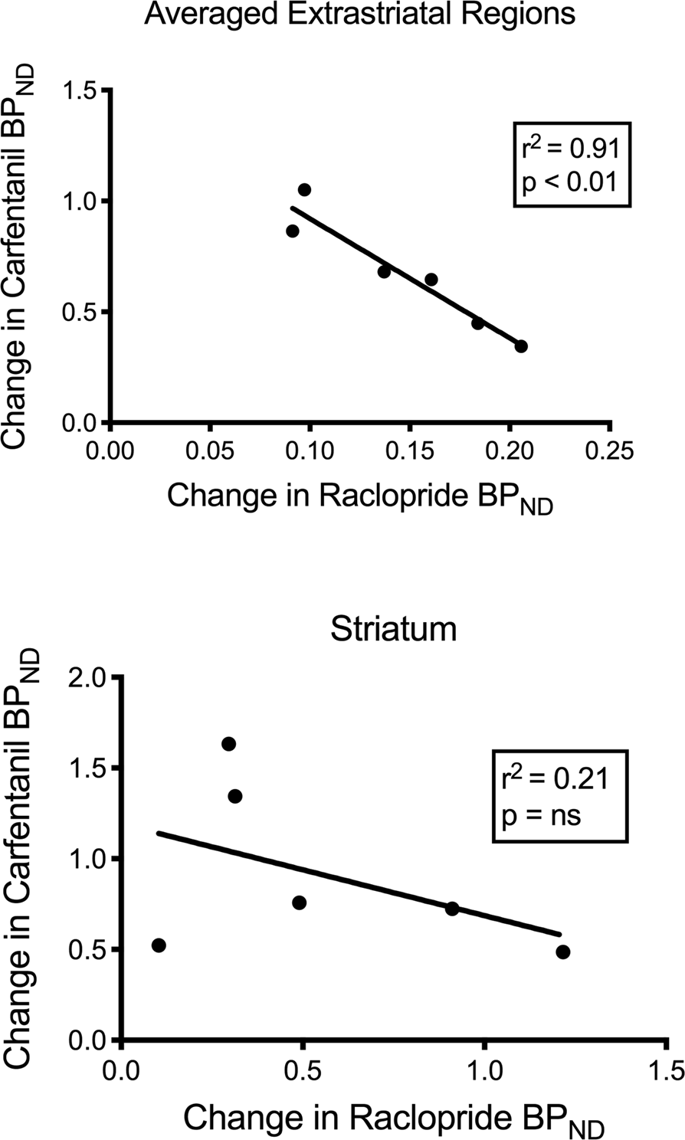
Ми перевірили потенційну кореляцію між [11C] раклоприд і [11C] значення карфентанілу ВРND у стриатальних та нестрийних областях у міні-свиней на початковому рівні та після 12 днів прийому сахарози, без жодних асоціацій. Потім ми перевірили, чи корелюють зниження зв'язування з трассером, і порівняли зміни ВРND для [11C] раклоприд зі змінами АДND для [11C] карфентанілу лише в міні-свинях, які мали нижчий рівень АДND обох відслідковувачів після споживання сахарози (n = 6). Ми виявили значні негативні кореляції в усередненому екстрастріальному (r2 = 0.91, p <0.01), але не в смугастих областях (рис. 7).
Кореляції між попередніми мінусовими відхиленнями [11C] раклоприд і [11С] потенціали зв'язування карфентанілу (БП)ND) у міні-свиней зі зниженим зв'язуванням трасерів після споживання сахарози (n = 6). Наводяться дані із усереднених позастрахових областей (вгорі) та смугастого (знизу). Коефіцієнт визначення (r2) і значення p відображаються для кожного графіка.
Обговорення
Ми визначили вплив повторного періодичного доступу до сахарози на опіоїдну та нейромедіацію DA в мозку ссавців. Поздовжні в природних умовах ПЕТ-візуалізація рецепторів μOR та DA D2 / 3 виявила зменшення доступності рецепторів у всій схемі нагородження, включаючи нуклеуси ядра, префронтальну кору та кору передньої черепиці. Результати наочно показують, що сахароза впливає на механізми винагороди таким чином, як у зловживань наркотиками.
Відомо, що вживання сахарози як приємної речовини звільняє DA та викликає залежність у гризунів15, із цукрозою, яка виявляється навіть приємнішою, ніж кокаїн у гризунів у певних контекстах. Таким чином, гризуни працюють інтенсивніше, щоб отримувати сахарозу, ніж кокаїн, навіть за відсутності їжі5. Однак ефекти сахарози регулюються як гомеостатичною системою, так і гедонічними схемами винагороди16,17 які можуть опосередковувати різницю між харчовими та гедонічними аспектами дії сахарози18. Ми вибрали графік на одну годину в день, щоб сприяти "перегукуванню", оскільки попередні дослідження на щурах виявили більшу кількість споживання протягом першої години щоденного доступу за перервним графіком15,19. Поведінкові дослідження прийому їжі часто спрямовані на обмеження їжі тварин, але конструкція може не обов'язково відображати ті самі нейронні механізми, що діють при ожирінні. Свиней у цьому дослідженні не обмежувались їжею, а крім доступу до сахарози годували звичайними кількостями їх звичайного раціону.
Опіоїдні рецептори (АБО) широко експресуються в мозку, зокрема в структурах, відомих для модуляції процесів їжі та винагородження20. АБО показали важливе значення для корисних ефектів кокаїну21,22,23,24. Зміни в зв'язуванні також були пов'язані з гомеостатичними реакціями на їжу та задоволенням, пов'язаним з приємною їжею25. Зокрема, «уподобання» їжі пов'язане з ендогенною опіоїдною системою, особливо з µOR9,10 в оболонці ядра acumbens і вентрального блідості26. Інфузії агоніста мкОР на окремі ділянки ядер ядра та вентрального блідості сильно посилюють поведінку, що сподобається, включаючи випинання язика та облизування лапи, після збільшення приємного прийому їжі.27,28,29. Подальші докази опіоїдної сигналізації при обробці гедонової регуляції надходять від антагоністів мкОР, які зменшують споживання смачної чау в обох ad libitum- тварини з обмеженою годівлею та їжею, але мають більш обмежений вплив на споживання нестабільних стандартних гранул30,31. У людини антагоністи мкОР знижують короткочасний прийом їжі та зменшують приємність смачної їжі32,33,34. Опіоїдна сигналізація в базолатеральній мигдалині також сприяє бажанню їжі через модуляцію пошуку винагород та заохочувальної цінності їжі.35.
З [11C] карфентанілом, ми отримали зображення зв'язування трассера, чутливого як до рівнів мкОР, так і до вивільнення мозку ендогенних опіоїдів36,37. Ми виявили негайну втрату наявності мкОР в областях ядер ядра та передній корінгової корі, специфічних областях мозку шляху нагородження, після початкового споживання сахарози п’ятьма міні-свинями, що відповідає ендогенному вивільненню опіоїдів. Попередні дослідження показали, що смачна їжа може призвести до почуття задоволення38 стимулюючи вивільнення опіоїдів. Через 12 днів доступу сахарози ми спостерігали зменшення [11C] зв'язування карфентанілу, яке має кілька можливих пояснень39 включаючи вивільнення ендогенного опіоїду та зв'язування з мкОР, інтерналізацію мкОР внаслідок посилення зв'язування опіоїдів та посилення активації рецепторів DA D2 / 3, що призводить до гетерологічної десенсибілізації мкОР40.
На підтвердження цих висновків [11C] дослідження карфентанілу пацієнтів із булімією41, ожиріння42,43,44і розлад їжі45, показують зниження доступності рецепторів. Однак це хронічні стани, тоді як міні-свинки отримували сахарозу лише 12 днів. У дослідженні гострої поведінки при годівлі у здорових чоловіків годування призвело до надійного та широко розповсюдженого ендогенного мозкового опіоїдного вивільнення, як за наявності, так і за відсутності гедонії, припускаючи, що вивільнення опіоїдів відображає метаболічні та гомеостатичні, а також гедонічні реакції25. Це дослідження разом з іншим, яке зобразило пацієнтів після рідкої їжі з ароматом шоколаду44, має безпосереднє відношення до гострого дослідження п’яти міні-свиней після першого опромінення сахарози, але відрізняється від дослідження субхронічної експозиції сахарози протягом 12 днів, коли знижена доступність рецепторів швидше відображає повторну надсимуляцію та супутню пониження регуляції мкОР.
Префронтальна кора має важливе значення при прийнятті рішень і присвоюванні значень предметам, і тому μOR у префронтальній корі може бути відповідальним за змінену оцінку харчової здатності, яка може підвищити залежність потенціалу їжі. Ми виявили зниження зв'язування в префронтальній корі, що відповідає попереднім дослідженням, що показують, що дієта з високим вмістом жиру знижує рівень мРНК мКОР у префронтальній корі46 і ця інфузія агоніста мкОР у префронтальній корі збільшує споживання солодкої їжі47. Однак знову виникає питання, чи дієта з високим вмістом жиру є більш хронічним станом, який, швидше за все, опосередковує зниження рівня рецепторів, порівняно з короткостроковою схемою годування сахарозою, припускаючи стійке вивільнення ендогенних опіоїдів, що витісняє карцеентаніл, пов'язаний з мкОР , навіть через 12 днів сахарози.
Адвокатський склад був причетний до винагород як від наркотиків, так і від поведінки. Було виявлено, що хронічне вживання кокаїну гальмує сигналізацію DA48. Рівень рецепторів DA D1 та D2 / 3 змінюється нікотином у головному мозку свиней49, а також у приматів, що не мають людини, з історією зловживання кокаїном50, що відповідає зменшенню регуляції D2 / 3 рецепторів у мозку людей, кокаїнових кокаїну51,52. Що стосується зловживань наркотиками, показано, що сахароза збільшує рецептори DA D119 і збільшити випуск DA53, посилюючи роль DA в "бажанні" стосовно смачної їжі. Попередні дослідження ПЕТ продемонстрували зменшення наявності смугастих рецепторів DA D2 / 3 при хворобливому ожирінні та середній вазі54,55, аналогічний за величиною зменшення у хворих на наркоманію56, а також у тварин з моделями ожиріння57. У дослідженнях на гризунах збиття рецепторів D2 / 3 у стриатумі сприяє розвитку компульсивного пошуку їжі у щурів, які мають доступ до смачної їжі57.
Наші спостереження щодо зниженої доступності рецепторів D2 / 3 для свиней можуть вказувати на підвищення рівня DA у відповідь на стимулюючу значущість, пов’язану з прийомом сахарози, оскільки DA відпускається як частина бажань зловживання наркотиками та інших приємних заходів52,58,59,60. Оскільки свиней під час візуалізації знеболювали та не отримували сахарозу протягом 24 годин, зниження D2 / 3 п.н.ND скоріше відображає зменшення кількості рецепторів у відповідь на тривале збільшення вивільнення DA на кожен з 12 днів доступу сахарози. Зниження може підвищити порогові показники винагороди мозку, пов'язані з низкою регуляцією смугастих D2-рецепторів. Це може пояснити підвищену сприйнятливість до наркотиків зловживань, виявлену в попередніх дослідженнях щурів, що переїдали сахарозу, що призвело до перехресної сенсибілізації до кокаїну, гіперактивності після амфетаміну з низькою дозою, збільшення споживання алкоголю при утриманні від сахарози та толерантності до знеболюючого впливу опіатів6.
Попереднє дослідження ожиріння в міні-поросі в Геттінгені виявило зменшення мозкового кровотоку в ядрах ядер, вентральній тегментальній зоні (ВТА) і префронтальній корі, з однокомпонентною комп’ютерною томографією емісії (SPECT) мозку61. Відповідно до цих висновків, ми спостерігали зменшене зв'язування DA D2 / 3 у вентрофоребральній ділянці, що містить ядро ядра та в префронтальній корі. Позаклітинні рівні DA збільшуються в 3 рази в ядрах ядер після прийому сахарози у вільно рухаються щурів, які проходять мікродіаліз62. У тварин, залежних від сахарози, повторне споживання сахарози може призвести до вивільнення DA з оболонки ядер ядер63. Тварини, які годували дієтою з обмеженим доступом до сахарози, мали нижчу зв'язування рецепторів DA D2 в оболонці ядра ядра та дорзальному стриатумі64. Обмежені дієти з високим вмістом жиру та сахарози можуть призвести до тривалої регуляції мРНК рецепторів D1 та D2 в ядрах ядер.65. Проведене дослідження мікродіалізу ефектів смачної їжі виявило збільшення вивільнення DA в ядрах ядра та передній корі, коли їжа ще вважалася новою; як тільки щури звикли до нової їжі, збільшене вивільнення притуплялося в ядрах ядер, але не в передній корі.66. Різниця сприйнятливості до звикання та зумовлення активності у двох регіонах може пояснити більший приріст, що спостерігається у префронтальній корі, ніж у ядерних комах міні-свиней, що піддаються одній і тій же смачній речовині, яка втратила новизну через дванадцять днів. Однак, як ми не зображували міні-свиней із [11C] раклоприд після першого введення сахарози, це пояснення є умоглядним.
Префронтальна кора модулює модуль виконавчої функції, прийняття рішень та самоконтроль67. Нефункціональна нейротрансмісія ДА в префронтальній корі погіршує модуляцію обробки винагород, що говорить про порушення функцій виконавчої влади та навичок прийняття рішень у людей з ожирінням.68,69. Крім того, дослідження ПЕТ людини у людини співвідносило зменшення метаболізму лобової кори зі зменшенням зв'язування смугастого D2 при ожирінні70. Тут ми виявляємо зменшену доступність D2 / 3 рецепторів у префронтальній корі, включаючи орбітофронтальну кору свиней, що піддаються режиму сахарози.
Дофамінергічні нейрони VTA надсилають проекції до гіпокампу та мигдалини, де вони підтримують звичну поведінку71 і опосередковують кодування та отримання кондиціонування до наркотиків72,73 і харчові підказки74,75. Зображення мозку людини показало активацію гіпокампа у відповідь на тягу до їжі та дегустацію76. Відповідно до наших висновків щодо зменшення доступності рецепторів D2 / 3 для гіпокампа та амігдалярного типу у відповідь на сахарозу, картографування мозку людини за допомогою [18F] fallypride показав викид DA, спричинений кокаїном, в мигдалинах та гіпокампі77. У мозку гризунів вплив кокаїну на киї викликало вивільнення DA в мигдалині78, а зміни рівня амігдали DA вплинули на поведінку, яка шукала кокаїн79.
У ході дослідження ожирінь, асоціація між доступністю D2 / 3 та μOR, як відомо, існує у смугастих ділянках худорлявих осіб, була порушена у вентральній смузі80. Ми порівняли значення ВРND з двох трасерів, щоб перевірити, чи дані відтворили цей ефект. На відміну від худорлявих людей, теперішній мозок свиней не мав кореляції між значеннями ВРND двох прослідників, на початку або після впливу сахарози. Потім ми перевірили, чи не матимуть тварини з найбільшим зниженням зв'язування рацеклоприду трассерів також найбільші зменшення зв'язування карцертанілу з трассером, але натомість ми виявили негативну кореляцію в усереднених позастрахових районах, що дозволяє припустити, що тварини з найбільшою зміною потенціалу зв'язування трекер-раклоприд мав найменшу зміну потенціалу зв'язування карцертанілу. Зворотне співвідношення між змінами говорить про те, що вплив прийому сахарози на доступність відповідних рецепторів регулюється в протилежних напрямках. Відомо, що надмірне споживання смачної їжі або наркотиків може бути спричинене бажанням чи сподобанням, або обом60,81. Можливо, що величина бажань, керованих дофаміном, заперечує величину сподобань, спричинену опіоїдами, або навпаки. Останні дані свідчать про роль GABAA рецептори ВТА та холінергічні термінали в стриатумі та, можливо, корі, які діють як перемикачі між дофамінозалежними та дофамінозалежними механізмами опіоїдної дії82,83 Це може пояснити взаємність ефектів дофаміну та опіоїдів у визначених тут екстрастратичних районах свиней.
Недоліком ПЕТ, також у порівняно великих тварин, є обмежена просторова роздільна здатність томографії, яка впливає на результати малих областей мозку, що беруть участь у поведінці, пов'язаному з їжею. Однак, незважаючи на ці побоювання, [11З] зв'язування раклоприду раніше реєструвалося як у смугастих, так і в позашлункових областях84,85,86,87. Використання [11C] раклоприд для маркування одного і того ж типу рецепторів не викликає занепокоєння щодо потенційних різниць спорідненості, які можуть вплинути на використання окремих трекерів для одних і тих же рецепторів у різних регіонах. Останні дослідження включали записи позашлюбного зв’язування [11С] раклоприд. Алакурті та ін. виявив хорошу відтворюваність заходів зв'язування смугастого раклоприду в стриатумі, з лише хорошою до помірної відтворюваності в корі85. У більш пізньому дослідженні Свенсон та ін. обговорили кілька питань, що стосуються використання [11C] раклоприд як маркер екстрастратальних D2 / 3 -рецепторів при дослідженні здорових людей, включаючи погану відтворюваність кори і обмежене зниження екстрастрітального зв’язування лобової кори у відповідь на блокуючий агент D2 / 388. Порівняння тесту-повторного тестування виявило варіабельність 4–7% у стриатумі та 13–59% у кортикальних областях, але час між обстеженнями становив у середньому 20 днів, на відміну від більш інформативних 1–2 днів більшості досліджень. Ряд факторів у житті цих суб'єктів, можливо, встиг вплинути на результати. Дійсно, ми показуємо тут, що просто додавання вживання споживання сахарози до ранкової програми протягом 12 днів може впливати на обов'язкові заходи, отримані через два тижні. Інші фактори, настільки поширені, як грати у відеоігри, шопінг, вступати в нові романтичні стосунки та сексуальну активність, вживати наркотики або змінювати дієту та фізичні навантаження, можуть впливати на екстрастрітальний рівень дофаміну, що може відрізнятись великими наборами даних. Поточне дослідження міні-свиней запровадило чітко контрольовану систему, єдиною змінною якої було відсутність або присутність в раціоні сахарози. У цьому контексті дані семи тварин мали достатньо низьку варіабельність у відповідних позашлункових областях для виявлення статистично значущого зниження зв'язування у відповідь на сахарозу.
Обмеженням цього дослідження є використання анестетиків, необхідних для забезпечення нерухомості протягом в природних умовах зображення тварин. Вплив специфічних анестетиків та їх взаємодія з лікарськими препаратами чи іншими втручаннями можуть зірвати зв'язування радіолігандів89,90. Кетамін - антиглутатергічний препарат з швидким антидепресивним ефектом у субанестетичних дозах91,92,93, які не зменшують смугасті [11З] зв'язування раклоприду у людини94. Однак було виявлено, що S-кетамін знижує доступність зв'язування рецепторів дофаміну D2 / 3 у стриматі свідомих приматів, які не є людиною95. Ізофлюран - поширений анестетик у ПЕТ тварин. У попередніх дослідженнях ми виявили смугасте скупчення [11C] SCH23390, радіоліганд рецепторів дофаміну D1 значно більший у міні-свиней, знеболених ізофлураном, а не пропофолом, що говорить про сприйнятливість дофамінергічної нейротрансмісії до ефектів анестезії96. У поточному дослідженні всіх міні-свиней зображували в обох часових точках під попереднім лікуванням кетаміном та анестезією ізофлурана, що робить ці порівняння дійсними.
Висновок
Надмірне споживання смачної їжі може як викликати, так і стати наслідком звикання, що має прямі наслідки для здоров’я через ожиріння. Ми перевірили твердження, що опіоїди та допамін опосередковують винагороду, важливу для виживання, а також зловживання наркотиками. Міні-свинки з переривчастим доступом до розчину сахарози протягом 12 днів поспіль демонстрували зменшення доступності дофаміну D2 / 3 та мк-опіоїдних рецепторів у стритальних та позашлункових областях мозку, маючи на увазі, що продукти з високим вмістом сахарози впливають на схему винагороди головного мозку аналогічно тій, що спостерігалася при наркоманії споживаються. Початкове одиничне опромінення сахарози відповідало викиду опіоїдів у ділянках мозку, що діють на користь. Зміни наявності опіоїдів та дофаміну пояснюють залежність потенціалу цукрози, що споживається в надлишку.
Матеріали та методи
Етика тварин
Це дослідження було затверджено та регламентовано Датською інспекцією з експериментів над тваринами, і всі експерименти були проведені відповідно до Директиви Європарламенту та Ради 2010/63 / ЄС про захист тварин, що використовуються для наукових цілей, та вказівок ARRIVE. Ми використовували сім чотирнадцятимісячних самок Геттінген (Ellegaard, Dalmose, Данія). Міні-свиней годували гранульованою дієтою (6 дл, 2 рази на день, Спеціальні дієтичні послуги, Орхус, Данія) доступною водопровідною водою ad libitum. Температура навколишнього середовища становила 20–22 ° C, відносна вологість повітря 50–55%, повітря змінювали вісім разів щогодини.
Постійне споживання сахарози
Ми зобразили сім міні-свинок за допомогою [11C] раклоприд і [11C] карфентанілу на початковому рівні, і знову через день після 12 днів дії сахарози. Експозиція цукрози складалася з однієї години доступу сахарози (сахароза, Дансукер, Копенгаген, Данія) (500 грамів сахарози на 2 літри води) щодня протягом 12 днів. Кількість споживання сахарози було зафіксовано, і всі міні-свинки щодня споживали 2 літри. Ми також зобразили п'ять таких самих міні-свинок із [11C] карфентаніл через 30 хвилин після першого доступу до сахарози для дослідження гострого вивільнення опіоїдів.
Міні-свині набирали в середньому 13.6% маси тіла від 25.4 кг (± 0.73 СЕМ) на початковому рівні до 28.9 кг (± 0.69 СЕМ) після 12-денного впливу сахарози, що було значно вищим (однобічний t-тест, p < 0.001), ніж збільшення, яке спостерігається у зразку контрольних свиней, отриманих у попередніх дослідженнях, де ваги зростали в середньому лише на 4.9% за той самий період розвитку.
Мозок PET зображення
Ми голодували свиней протягом ночі з вільним доступом до води перед зображенням. Ми попередньо лікували і знеболювали міні-свинки, як описано раніше97 і помістили їх на спині в пристрої ПЕТ / КТ (Siemens Biograph 64 Truepoint PET). Ми провели низькодозовий КТ перед кожним придбанням ПЕТ для анатомічного визначення та корекції ослаблення даних викидів ПЕТ. Нам внутрішньовенно вводили [11C] раклоприд на початковому рівні (360 ± 18 МБкк, питома активність 77 ± 76 ГБк / мкмоль, введена маса 0.12 ± 0.08 мкг / кг) та через 12 днів сахарози (374 ± 54 МБкк, питома активність 127 ± 85 ГБк / мкмоль, введена маса 0.06 ± 0.05 мкг / кг), і [11C] карфентанілу на початковому рівні (377 ± 43 МБкк, питома активність 311 ± 195 ГБк / мкмоль, введена маса 0.03 ± 0.02 мкг / кг) та через 12 днів сахарози (337 ± 71 МБкк, питома активність 177 ± 157 ГБк / мкмоль, вводили масу 0.06 ± 0.08 мкг / кг через вушну вену в 10 мл фізіологічного розчину протягом першої хвилини 90-хвилинного сканування. Ми реконструювали дані PET, використовуючи TrueX 3D OSEM (3 ітерації, 21 підмножина), матрицю 256 × 256 × 109 та 2-мм фільтр Гаусса, використовуючи структуру часових кадрів 5 × 60, 3 × 300, 4 × 600 , 2 × 900 секунд (всього 14 кадрів, 90 хвилин). На початковому етапі та після 12 днів сахарози було зображено міні-свиней за допомогою обох відслідковувачів, які були введені не менше 100 хвилин один від одного, через період напіввиведення [11C] ПЕТ-трекери. Після завершення останнього сеансу ПЕТ ми евтаназували міні-свиней під глибокою анестезією шляхом внутрішньовенної передозування пентобарбіталу (100 мг / кг).
Кількісний аналіз та статистика
Ми виконали етапи попередньої обробки за допомогою PMOD 3.7 (PMOD Technologies Ltd, Цюріх, Швейцарія). Для визначення параметрів стереотактичної трансформації від усереднених за часом зображень ПЕТ ми використовували шаблони, характерні для ліганду. Ми застосували згенеровані матриці перетворення та поля викривлення на відповідний динамічний часовий ряд ПЕТ. Ми створили параметричні зображення [11C] потенціал зв'язування раклоприду (БП)ND) методом багатолінійної референтної тканини Ichise та колег98. Ми створили на замовлення маску мозочка, яка виключала верміс для отримання радіоактивності тканин мозочка з часом в області незначної щільності рецепторів DA D2 / 3. Ми створили параметричні зображення [11C] карфентанілу, використовуючи реалізацію моделі Логанської тканини99,100 з t * = 30 хв. Дослідження [11З] зв'язування карфентанілу в мозку людини використовували потиличну кору в якості референтної області36; однак у свиней, згідно з кривими часу активності, незмінне зв'язування було нижчим у мозочку, ніж у потиличній корі, що відповідає результатам дослідження авторадіографії щурів101. Тому ми вибрали мозочок як опорний регіон у поточному дослідженні.
Статистичний аналіз
Ми піддавали карти воксельному аналізу зі статистичним непараметричним картографуванням (SnPM v13.01, http://warwick.ac.uk/snpm) Пакет інструментів SPM, який використовує непараметричну теорію перестановки, щоб забезпечити основу для статистичного висновку; підхід показано, що він працює добре для малих вибірок завдяки суворому контролю помилкових позитивних результатів14 і застосовується, як описано раніше102. Експерт з невроанатомії свиней (DO) порівняв отримані зображення з порогом до 5% рівня значущості з високою роздільною здатністю Геттінген мініатюрний атлас103,104 визначити та позначити області знижених DA D2 / 3 та μOR BPND від базової лінії до стану постсахарози. Потім ми провели аналіз регіонального інтересу (ROI), щоб витягти ВРND Значення конкретних регіонів, які виявляють інтерес, ґрунтуються на аналізі SnPM, включаючи стриатум, ядро ярусів, таламус, мигдалину, кору черепа і префронтальну кору. Жодних додаткових статистичних даних щодо аналізу рентабельності інвестицій не проводилося, оскільки в цих регіонах вже було виявлено значне використання SnPM.
посилання
- 1.
Сміт, С. та Герон, А. Діабет та ожиріння: епідемії близнюків. Нат Мед 12, 75 – 80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL & Curtin, LR Поширеність та тенденції ожиріння серед дорослих американців, 1999–2008. JAMA 303, 235 – 241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Девіс, Каліфорнія та ін. Дофамін для «бажаючих» та опіоїди для «вподобання»: порівняння ожирілих дорослих людей із їжею та без запою. Ожиріння (Silver Spring) 17, 1220 – 1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Дреновський, А. Ожиріння та харчове середовище: харчова щільність енергії та дієта. Американський журнал профілактичної медицини 27, 154 – 162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Ленуар, М., Серр, Ф., Кантін, Л. та Ахмед, Ш. Інтенсивна солодкість перевершує винагороду кокаїну. PLoS One 2, e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ахмед, С., Авена, Н.М., Беррідж, К.К., Гірхардт, А. і Гіллем, К.І. Нейрологія у ХХІ столітті (ред. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Подальші розробки в нейробіології їжі та наркоманії: оновлення про стан науки. харчування 28, 341 – 343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Лейтон, М. в Задоволення мозку (під ред. Kringelbach, ML & Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ & Bullmore, ET Від гедоніки смаку до мотиваційного спонукання: центральні му-опіоїдні рецептори та поведінка, що харчується запоями. Int J Neuropsychopharmacol 12, 995 – 1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Беррідж, KC Харчова нагорода: мозкові субстрати бажань і сподобань. Нейрознавство та біобіхевіоричні огляди 20, 1 – 25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Картування нейрорецепторів на роботі: щодо визначення та інтерпретації зв'язуючих потенціалів після 20 років прогресу. Int Rev Neurobiol 63, 1 – 20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG Тваринні моделі цукрового та жирного запою: взаємозв'язок із харчовою залежністю та збільшенням маси тіла. Методи Мол Біол 829, 351 – 365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Джелсінг, Дж. та ін. Префронтальна кора в головному мозку міні Ґоттінген визначається критеріями нейронної проекції та цитоархітектурою. Brain Res Bull 70, 322 – 336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Ніколс, ТЕ та Холмс, А. П. Непараметричні тести перестановки функціонального нейровізуалізації: буквар з прикладами Hum Brain Mapp 15, 1 – 25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG Докази залежності від цукру: поведінкові та нейрохімічні ефекти періодичного, надмірного споживання цукру. Нейрознавство та біобіхевіоричні огляди 32, 20 – 39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Алонсо-Алонсо, М. та ін. Система винагородження за харчування: сучасні перспективи та майбутні потреби в дослідженні. Nutr Rev 73, 296 – 307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Самостійне введення сахарози та активація ЦНС у щурів. Am J Physiol Regul Integr Comp Physiol 300, Р876–884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Теллес, Лос-Анджелес та ін. Окремі схеми кодують гедонічні та харчові значення цукру. Природа неврології 19, 465 – 470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Колантуоні, С. та ін. Надмірне споживання цукру змінює зв'язування з дофаміновими та му-опіоїдними рецепторами в мозку. Neuroreport 12, 3549 – 3552 (2001).
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Опіатний рецептор: авторадіографічна локалізація в мозку щурів. Proc Natl Acad Sci США 73, 3729 – 3733 (1976).
- 21.
Содерман, AR та Унтервальд, Е. М. Кокаїнова винагорода та гіперактивність у щурів: місця модуляції му опіоїдних рецепторів. Неврологія 154, 1506 – 1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ & Roberts, DC Бета-фунальтрексамін впливає на самоконтроль кокаїну у щурів, реагуючи на графік прогресивного співвідношення підкріплення. Фармакологія, біохімія та поведінка 75, 301 – 307 (2003).
- 23.
Шредер, штат Дж та ін. Роль му-опіоїдних рецепторів в індукованій кокаїном активності, сенсибілізації та винагороді у щура. Психофармакология 195, 265 – 272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW Відновлення, спричинене кокаїном, вимагає ендогенної стимуляції му-опіоїдних рецепторів у вентральному палідумі. Журнал нейронауки: офіційний журнал Товариства нейронаук 25, 4512 – 4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ та ін. Годування вивільняє ендогенні опіоїди у людини. J Neurosci 37, 8284 – 8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS & Berridge, KC Опіоїдний лімбічний контур для винагороди: взаємодія між гедонічними гарячими точками ядерного акумули і вентральним палідумом. J Neurosci 27, 1594 – 1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, KC Опіоїдна ділянка в оболонці nucleus accumbens опосередковує їжу та гедонічну "симпатію" до їжі: карта на основі мікроін'єкційних шлейфів Fos Brain Res 863, 71 – 86 (2000).
- 28.
Zhang, M. & Kelley, AE Прийом розчинів сахарину, солі та етанолу збільшується за рахунок вливання агоніста мю-опіоїдів у ядро акумбену. Психофармакология 159, 415 – 423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA & Kelley, AE Прийом їжі з високим вмістом жиру вибірково посилюється за рахунок стимуляції опіоїдних мю в межах ядра. Журнал фармакології та експериментальної терапії 285, 908 – 914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP & Billington, CJ. Am J Physiol 268, Р. 248–252 (1995).
- 31.
Glass, MJ, Billington, CJ & Levine, AS Опіоїди та споживання їжі: розподілені функціональні нервові шляхи? Нейропептиди 33, 360 – 368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. & Apfelbaum, M. Антагоніст опіоїдів, налтрексон, зменшує перевагу сахарози у людей. Am J Physiol 251, Р91–96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS Вплив налтрексону на виявлення смаку та поріг розпізнавання. Апетит 32, 241 – 249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, BA Naloxone, блокатор опіатів, зменшує споживання солодкої їжі з високим вмістом жиру у людей, що харчуються ожирінням та нежирними запоями. Am J Clin Nutr 61, 1206 – 1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW Визначні опіоїдні схеми визначають смакові якості та бажаність нагороджувальних подій. Proc Natl Acad Sci США 106, 12512 – 12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Коласанті, А. та ін. Ендогенне вивільнення опіоїдів у системі винагородження мозку людини, викликане гострим введенням амфетаміну. Біол Психіатрія 72, 371 – 377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Мік, я. та ін. Амфетамін, індукований ендогенним опіоїдним вивільненням в мозку людини, виявлений за допомогою [11С] карфентанілу ПЕТ: реплікація в незалежній когорті. Int J Neuropsychopharmacol, 1 – 6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Gray, RW Опіоїдні пептиди та контроль людської поведінки під час прийому. Нейрознавство та біобіхевіоричні огляди 26, 713 – 728 (2002).
- 39.
Шпренгер, Т., Бертель, А., Платцер, С., Бокер, Х. і Толле, Т. Р. Чого повчитися в природних умовах опіодергічна томографія мозку? Eur J Біль 9, 117 – 121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM & Cuntapay, M. Дофамін-опіоїдні взаємодії в стриатумі щурів: модулююча роль для рецепторів D1 дофаміну в передачі сигналів, опосередкованих дельта-опіоїдними рецепторами. Нейрофармакологія 39, 372 – 381 (2000).
- 41.
Бенчеріф, Б. та ін. Регіональне зв'язування мупіопіоїдних рецепторів у корі острівця зменшується при нервовій булімії та навпаки корелює з поведінкою натще. Журнал ядерної медицини: офіційне видання, Товариство ядерної медицини 46, 1349 – 1351 (2005).
- 42.
Карлссон, ХК та ін. Ожиріння пов'язане зі зниженням муоопіоїдних, але незмінних доступності рецепторів дофаміну D2 в мозку. J Neurosci 35, 3959 – 3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Карлссон, ХК та ін. Втрата ваги після баріатричної операції нормалізує мозкові опіоїдні рецептори при хворобливому ожирінні. Психіатрія Мол 21, 1057 – 1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Бургардт, PR, Ротберг, AE, Dykhuis, KE, Burant, CF & Zubieta, JK Ендогенні опіоїдні механізми впливають на ожиріння та втрату ваги у людей. J Clin Endocrinol Metab 100, 3193 – 3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Маджурі, Дж. та ін. Нейромедіація дофаміну та опіоїдів у поведінкових залежностях: порівняльне дослідження ПЕТ у патологічних азартних іграх та вживанні напоїв. Нейропсіхофармакологіі 42, 1169 – 1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM Хронічна дієта з високим вмістом жиру керує постнатальною епігенетичною регуляцією му-опіоїдного рецептора в мозку. Нейропсіхофармакологія: офіційне видання Американського коледжу нейропсихофармакології 36, 1199 – 1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA Індукція гіперфагії та споживання вуглеводів шляхом стимуляції му-опіоїдних рецепторів у обмежених областях лобової кори. Журнал нейронауки: офіційний журнал Товариства нейронаук 31, 3249 – 3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Парк, К., Волков, Н.Д., Пан, Ю. & Ду, С. Хронічний кокаїн гасить дофамінову сигналізацію під час кокаїнової інтоксикації та дисбалансує D1 над сигналами рецепторів D2. Журнал нейронауки: офіційний журнал Товариства нейронаук 33, 15827 – 15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Куммінг, П. та ін. Вплив гострого нікотину на гемодинаміку та зв'язування [11С] раклоприду з рецепторами дофаміну D2,3 у мозку свиней. NeuroImage 19, 1127 – 1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP Вплив самоконтролю кокаїну на рецептори дофаміну D2 у резус-мавп. Синапс 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND та ін. Сигнали кокаїну та дофаміну в дорсальному стриатумі: механізм тяги до кокаїнової залежності. Журнал нейронауки: офіційний журнал Товариства нейронаук 26, 6583 – 6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Вонг, ДФ та ін. Підвищена наповнюваність дофамінових рецепторів у стриатумі людини під час випробовування кокаїну. Нейропсіхофармакологіі 31, 2716 – 2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP & Norgren, R. Пероральна стимуляція сахарози збільшує накопичення дофаміну у щурів. Am J Physiol Regul Integr Comp Physiol 286, Р31–37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. & Telang, F. Роль дофаміну в зображенні у зловживанні наркотиками та наркоманії. Нейрофармакологія 56(Доп. 1), 3–8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Ван, GJ та ін. Мозок дофаміну та ожиріння. Ланцет 357, 354 – 357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS Подібність між ожирінням та наркоманією за оцінкою нейрофункціональної візуалізації: огляд концепції. Журнал залежних захворювань 23, 39 – 53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM & Kenny, PJ Допамінові D2-рецептори при дисфункції винагороди, подібній до залежності, та примусовому харчуванні у ожирілих щурів. Природа неврології 13, 635 – 641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC & Kringelbach, ML Ефективна неврологія задоволення: винагорода у людей та тварин. Психофармакология 199, 457 – 480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC & Kringelbach, ML Системи задоволення в мозку. Нейрон 86, 646 – 664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Шульц, В. Прогнозний нагородний сигнал дофамінових нейронів. J нейрофізіол 80, 1 – 27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH Зміни в діяльності мозку після ожиріння, спричиненого дієтою. Ожиріння 19, 749 – 756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. & Norgren, R. Накопичує механізми дофаміну в прийомі сахарози. Brain Res 904, 76 – 84 (2001).
- 63.
Rada, P., Avena, NM & Hoebel, BG Щоденний випивка на цукор багаторазово вивільняє дофамін в оболонці. Неврологія 134, 737 – 744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR & Hajnal, A. Повторний доступ сахарози впливає на щільність рецепторів дофаміну D2 в смугастому тілі. Neuroreport 13, 1575 – 1578 (2002).
- 65.
Алсіо, Дж. та ін. Експресія гена рецепторів дофаміну D1 зменшується в ядрах при тривалому впливі смачної їжі і відрізняється залежно від фенотипу ожиріння, спричиненого дієтою у щурів. Неврологія 171, 779 – 787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Бассарео, В. та Ді Кіара, Г. Диференціальний вплив механізмів асоціативного та неасоціативного навчання на реакцію передачі префронтального та акумбального дофаміну на харчові подразники у щурів, яких годували ad libitum. J Neurosci 17, 851 – 861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Незбалансовані нейронні ланцюги в залежності. Curr Opin Neurobiol 23, 639 – 648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Броган, А., Хейві, Д. та Піньятті, Р. Анорексія, булімія та ожиріння: спільний дефіцит у прийнятті рішень щодо азартних завдань в Айові (IGT). J Int Neuropsychol Soc 16, 711 – 715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL Дефіцит прийняття рішень та переїдання: модель ризику ожиріння. Obes Res 12, 929 – 935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND та ін. Низькі дофамінові рецептори смугастого D2 асоціюються з префронтальним метаболізмом у ожирінь: можливі фактори, що сприяють. NeuroImage 42, 1537 – 1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, BW Центральне ядро амігдали взаємодіє з дорсолатеральним смугастим для регулювання набуття звичок. J Neurosci 32, 1073 – 1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Грант, С. та ін. Активізація ланцюгів пам'яті під час випробовування кокаїну. Proc Natl Acad Sci США 93, 12040 – 12045 (1996).
- 73.
Childress, AR та ін. Лімбічна активація під час індукованого кокаїном тяги. Am J Psychiatry 156, 11 – 18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Малер, С. В. і Беррідж, К. К. Що і коли «бажати»? Зосередження мотивації на основі мигдалини на цукрі та статі. Психофармакология 221, 407 – 426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF & Volkow, ND Нейробіологія наркоманії: нейроциркуляційний аналіз. Ланцет Психіатрія 3, 760 – 773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. Кортова активація у відповідь на чисті смакові подразники під час фізіологічних станів голоду та ситості. NeuroImage 44, 1008 – 1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Фотрос, А. та ін. Вивільнення дофаміну, викликаного кокаїном, в амігдалі та гіпокампі: дослідження з високою роздільною здатністю PET [(1) (8) F] у фалліпрідах у учасників, що залежать від кокаїну. Нейропсіхофармакологіі 38, 1780 – 1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Вайс, Ф. та ін. Контроль поведінки, що шукає кокаїн, за допомогою наркотичних стимулів у щурів: вплив на відновлення згашених оперативно-реагуючих та позаклітинних рівнів дофаміну в мигдалинах та ядрах. Proc Natl Acad Sci США 97, 4321 – 4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Антагонізм рецепторів дофаміну D1 або D2 в межах базолатеральної мигдалини диференційовано змінює придбання асоціацій кокаїну-кий, необхідних для індукованого києм відновлення пошуку кокаїну. Неврологія 137, 699 – 706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Туомінен, Л. та ін. Аберрантна мезолімбічна допаміно-опіатна взаємодія при ожирінні. NeuroImage 122, 80 – 86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Шульц, В. Поведінкові сигнали дофаміну. Тенденції Neurosci 30, 203 – 210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR & van der Kooy, D. Нейробіологія мотивації опіатів. Холодний весняний Харб Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Регулювання нікотинових та опіоїдних рецепторів опосередкованої передачі D2-рецептора дофаміновим стриатом. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Номура, Ю. та ін. Вікове зниження рівня доступності рецепторів дофаміну D2 / 3, вимірюваного [C-11] раклопридом, у нестаціонарних регіонах мозку людини: Порівняння чотирьох методів. NeuroImage 41, T133 – T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Алакурті, К. та ін. Довгострокова перевірка надійності повторного тестування зв'язування рецепторів дофаміну D2 / 3 смугастої та екстрастріальної: дослідження з раклопридом [(11) C] та ПЕТ високої роздільної здатності. J Метабр крові Cereb 35, 1199 – 1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ Ендогенне вивільнення дофаміну після фармакологічних проблем при хворобі Паркінсона. Ann Neurol 53, 647 – 653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Савамото, Н. та ін. Когнітивний дефіцит та вивільнення стриато-лобового дофаміну при хворобі Паркінсона. Brain 131, 1294 – 1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE та ін. Дійсність та надійність кількісного визначення зв’язку екстрастріальної [(11) C] раклоприду в мозку живого людини. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Цукада, Х. та ін. Анестезія ізофлурана посилює інгібуючу дію кокаїну та GBR12909 на транспортер дофаміну: ПЕТ-дослідження в поєднанні з мікродіалізом в мозку мавпи. Brain Res 849, 85 – 96 (1999).
- 90.
Хассун, Вт. та ін. ПЕТ-дослідження зв'язування [11С] раклоприду в стриатумі неспаної кішки: вплив анестетиків та роль мозкового кровотоку. Європейський журнал ядерної медицини та молекулярних зображень 30, 141 – 148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. Роль кетаміну в стійкій до лікування депресії: систематичний огляд. Curr Neuropharmacol 12, 444 – 461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Берман, РМ та ін. Антидепресивна дія кетаміну у хворих на депресію. Біол Психіатрія 47, 351 – 354 (2000).
- 93.
Браун, Каліфорнія та Луцькі, І. Антидепресантні ефекти кетаміну: механізми, що лежать в основі швидкодіючих нових антидепресантів. Фармакологічний фронт 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Аалто, С. та ін. Кетамін не знижує зв'язування рецепторів дофаміну D2 у стриату у людини. Психофармакология 164, 401 – 406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Хашимото, К., Какіучі, Т., Оба, Х., Нісіяма, С. та Цукада, Х. Зменшення зв'язування дофамінових рецепторів D2 / 3 у смугастому тілі після одноразового введення ескетаміну, але не R-кетаміну: ПЕТ навчання у свідомих мавп. Eur Arch Psychiatry Clin Neurosci 267, 173 – 176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Альструп, АК та ін. Вплив наркозу та видів на поглинання або зв'язування радіолігандів в природних умовах в міні-свині в Геттінгені. БіоМед дослідження міжнародних 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP та ін. Поздовжнє моноамінергічне ПЕТ-зображення хронічного гальмування протеасоми у міні-свиней. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE Стратегії вдосконалення оцінки параметрів нейрорецепторів методом лінійного регресійного аналізу. J Метабр крові Cereb 22, 1271 – 1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Логан, Дж. та ін. Коефіцієнти розподілу об'єму без забору крові за допомогою графічного аналізу даних ПЕТ. J Метабр крові Cereb 16, 834 – 840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ. Кількісне визначення му-опіоїдних рецепторів мозку за допомогою [11C] карфентанілу: методи довідкових тканин. Nucl Med Biol 30, 177 – 186 (2003).
- 101.
Panksepp, J. & Bishop, P. Авторадиографічна карта зв’язування (3H) дипренорфіну в мозку щурів: ефекти соціальної взаємодії. Brain Res Bull 7, 405 – 410 (1981).
- 102.
Ландау, AM та ін. Електроконвульсивна стимуляція різним чином впливає на зв'язування [(11) C] MDL100,907 до коркових та підкіркових рецепторів 5HT2A у мозку свинячого мозку. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. Телецефалон міні-свині Геттінгена, цитоархітектура та анатомія поверхні кори. Структура мозку Функція 222, 2093 – 2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Орловський, Д., Глуд, А.Н., Паломеро-Галахер, Н., Соренсен, JCH і Бяркам, CR Інтернет-гістологічний атлас мозку міні-свиней Геттінгена. Heliyon 5, e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Подяки
Університет Орхуса «Грант на розвиток проектів на ідеї АС» АМЛ фінансував дослідження. Ми вдячні за технічну підтримку з боку персоналу ПЕТ-центру Орхуської університетської лікарні та Орхуського університетського господарства за допомогу в лікуванні тварин. Ми дякуємо професору Мортену Крингельбаху, професору Йорген Шель-Крюгеру та доценту Арне Меллеру за допомогу в започаткуванні цих досліджень.
Декларації з етики
Конфлікт інтересів
Автори не оголошують жодних конкуруючих інтересів.
Додаткова інформація
Примітка видавця Природа Springer залишається нейтральною щодо претензій юрисдикції на опублікованих картах та інституційних підставах.
Права та дозволи
Відкритий доступ Ця стаття ліцензується за міжнародною ліцензією Creative Commons Attribution 4.0, яка дозволяє використовувати, обмін, адаптацію, розповсюдження та відтворення у будь-якому носії чи форматі, якщо ви надаєте належний кредит первинному автору (авторам) та джерелу, надайте посилання на ліцензію Creative Commons та зазначте, чи були внесені зміни. Зображення або інший сторонній матеріал у цій статті включені до ліцензії Creative Commons статті, якщо інше не вказано кредитною лінією до матеріалу. Якщо матеріали не включені до ліцензії Creative Commons статті, і ваше призначення не заборонено законом або перевищує дозволене використання, вам потрібно буде отримати дозвіл безпосередньо від власника авторських прав. Щоб переглянути копію цієї ліцензії, відвідайте сторінку http://creativecommons.org/licenses/by/4.0/.