Proc Natl Acad Sci США A. Jan 19, 2010; 107 (3): 1217 – 1222.
Опубліковано онлайн Dec 29, 2009. doi: 10.1073 / pnas.0911998107
PMCID: PMC2824263
Неврологія
Ян Лю,a,b Брендон Дж. Арагона,c Кімберлі А. Янг,a,b Девід М. Діц,b,d,e Мохамед Каббай,b,d Мішель Мазей-Робісон,e Ерік Дж. Нестлер,e та Зуоксин Ванa,b,1
Ця стаття була цитується інші статті в PMC.
абстрактний
Прерійна полевка (Microtus ochrogaster) - соціальний моногамний вид гризуна, який утворює парні зв’язки після спаровування, поведінка, в якій був залучений центральний дофамін (DA). Тут ми використовували чоловічі прерійні лялечки, щоб вивчити вплив впливу наркотиків на парне склеювання та пов'язану з цим нейронну схему. У нашому першому експерименті поведінку, мотивовану амфетаміном (AMPH), досліджували за допомогою парадигми умовного уподобання місця (CPP) і було показано, що вона опосередковується активацією D1-подібних DA-рецепторів. Далі ми вивчили ефекти повторного впливу AMPH на парне склеювання. Попередньо оброблені інтактними та сольовими контрольними самцями виявляли переваги партнера, спричиненого спаровуванням, тоді як самці, попередньо оброблені AMPH у дозах, ефективних для індукції CPP, не виявляли переваг партнера, спричиненого спаровуванням. Таке лікування AMPH також посилює експресію D1, але не експресію D2, DA в ядрах ядер (NAcc). Крім того, фармакологічна блокада D1-подібних DA-рецепторів у NAcc врятувала переваги партнерів, викликаних спаровуванням, у чоловіків, які лікували АМФГ. Наші дані разом вказують на те, що повторне опромінення АМФН може звузити поведінковий репертуар чоловічих прерійних польот через механізм, специфічний для рецептора DA, в NAcc, що призведе до порушення утворення парних зв’язків.
Загальновизнано, що мотивована та емоційна поведінка, що сприяє фітнесу, регулюється схемою винагород мозку, включаючи мезолімбічну дофамін (DA) (1, 2). Хоча ця система часто пов'язана з прийомом їжі та сексуальною поведінкою (3, 4), це також було причетно до інших природних мотивованих поведінок, таких як соціальна гра між неповнолітніми та соціальна зв'язок між батьком та потомством (5-9). Часто недооціненими в дослідженнях є соціальні зв'язки, утворені між дорослими товаришами, тобто парні зв’язки. Нещодавно проведене дослідження з використанням соціально моногамного виду гризунів, прерійної польової (Microtus ochrogaster) (10-12), вказують на те, що велика частина нейронної регуляції, що лежить в основі утворення парних зв'язків, і підтримання відбувається в межах ядерних ядер (NAcc) (13-15) - мезолімбічна область мозку, критична для опосередкування мотивованої поведінки (1, 2, 16).
Хоча мотиваційна схема розвивалася для просування поведінки, що сприяє фітнесу, таких як годування, спаровування та соціальні зв'язки (1, 17), він уразливий до штучної узурпації зловживання наркотиками (8). Наприклад, прийом зловживань психостимуляторами, такими як кокаїн та амфетамін (AMPH), призводить до постійних змін активності мезолімбічного ДА (18, 19). Інтенсивний вплив на цю схему цими та іншими наркотичними препаратами пропонується знизити сприйняте значення природних стимулів (20), у тому числі соціального характеру (8). Хоча відомо, що наркомани виявляють порушення соціальної поведінки (21), нейронна регуляція взаємодії між медичним досвідом та соціальною прихильністю недостатньо вивчена. Це частково тому, що такі взаємодії складно моделювати у традиційних лабораторних гризунів, які не виявляють соціальних зв'язків між дорослими людьми.
Нейробіологія такої соціальної прихильності, зокрема парні зв’язки між дорослими, широко вивчалася в прерійній польовій (10-12), а останнім часом цей вид був створений як життєздатна модель для вивчення мотиваційної цінності AMPH (22). Крім того, утворення обох парних зв'язків та посилення AMPH опосередковано, принаймні частково, передачею DA в межах NAcc (14, 15, 23). Тому в цьому дослідженні було використано модель прерійної польової речовини для встановлення поведінкового аналізу для вивчення впливу впливу наркотиків на соціальні зв’язки та зосереджено увагу на сигнальній системі NAcc DA, щоб виявити нейронний механізм, що лежить в основі цих поведінкових ефектів.
результати
AMPH-обумовлена налаштування місця (CPP) опосередковується DA за специфічним для рецептора способом.
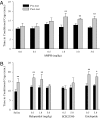
Формування CPP визначалося значним збільшенням часу, проведеного в клітці, парній AMPH, протягом посттесту, після 3 днів кондиціонування АМФН, порівняно з претестом. Ні сольові ін'єкції, ні фізіологічний розчин, що містять дві найнижчі дози тестованих AMPH (0.1 та 0.5 мг / кг), не змінювали переваги клітки (Рис. 1A). Однак чоловіки обумовлені більш високими дозами AMPH, включаючи 1.0 (t = 2.87, P <0.01), 3.0 (t = 3.63, P <0.01), або 5.0 мг / кг (t = 3.03, P <0.01), відображається CPP (Рис. 1A).
Оскільки AMPH суттєво збільшує нейротрансмісію DA в клітинах прерії (24), і DA опосередковує посилення AMPH в інших видах (23), ми далі дослідили регуляцію рецепторів DA (DAR) рецептора, спричиненого AMPH у чоловічих прерій. Суб'єктів тестували в парадигмі CPP, обробляли сольовим розчином або сольовим розчином, що містять різні дози неселективного антагоніста DAR (галоперидол) перед ін'єкціями AMPH (1.0 мг / кг) під час кондиціонування 3, а потім тестували на CPP у післятестовому періоді. Суб'єкти, оброблені фізіологічним розчином (t = 2.69, P <0.01) або фізіологічний розчин, що містить дві найнижчі дози галоперидолу (0.1 мг / кг; t = 3.62, P <0.01; 1.0 мг / кг; t = 3.89, P <0.01) перед кондиціонуванням AMPH демонстрував AMPH-індукований CPP, тоді як галоперидол у дозі 5.0 мг / кг блокував AMPH-індукований CPP, показуючи участь DAR у поведінкових ефектах AMPH (Рис. 1B). Щоб визначити, який підтип DAR опосередковує індуковану AMPH CPP, перед введенням AMPH під час кондиціонування вводили або специфічний антагоніст, подібний до D1, або специфічний антагоніст (подібний D23390) до ін'єкцій AMPH. D2-подібний антагонізм не блокував AMPH-індукований CPP (t = 3.15, P <0.01 для 0.5 мг / кг та t = 2.60, P <0.05 для 5.0 мг / кг етиклоприду), але блокада D1-подібних рецепторів усуває AMPH-індукований CPP (Рис. 1B), демонструючи, що індукований AMPH CPP опосередковується активацією D1-подібних, але не D2-подібних рецепторів у чоловічих прерійних полех.
Досвід AMPH Змінює формування переваг партнера, спричиненого спаровуванням.
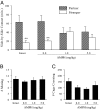
Хоча індукована AMPH CPP вимагає активації D1-подібних рецепторів (Рис. 1B), ми раніше показали, що активація D1-подібних рецепторів перешкоджає утворенню спарених парних зв'язків (14). Тому ми висунули гіпотезу, що попередня обробка AMPH буде перешкоджати зв`язку, викликаному спаровуванням, в чоловічих прерій. Чоловіків розділили на чотири групи, які не отримували ін'єкцій (неушкоджених), фізіологічним розчином або ін'єкцій 1.0 або 5.0 мг / кг AMPH протягом днів 3 (парадигма ін'єкції, достатня для індукції CPP). На четвертий день всіх чоловіків спарували з сексуально сприйнятливою самкою протягом 24 h, а потім перевіряли на переваги партнера. Відповідно до попередніх досліджень (14, 25-27), неушкоджені самці та самці, які отримували ін'єкції фізіологічного розчину за 3 днів до спаровування, виявляли переваги партнера, спричиненого спаровуванням (неушкоджені самці; t = 3.05, P <0.01, чоловіки, яким вводили фізіологічний розчин; t = 3.21, P <0.01; Рис. 2A). Однак самці, яким попередньо обробляли дозу AMPH протягом 3 днів до спаровування, не виявили переваг партнера (Рис. 2A). Важливо, що попередня обробка AMPH не впливала на частоту спаровування протягом періоду співжиття (F(3, 26) = 0.26, P = 0.85; Рис. 2B) або рухової активності під час тестування переваг партнера (F(3, 26)= 2.34, P = 0.10; Рис. 2C), що вказує на те, що AMPH безпосередньо втручався у вподобання партнера, що спричиняє шлюб.
Досвід AMPH підвищує D1 рецептори в NAcc.
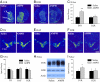
Зважаючи на те, що переваги партнерів з попередньою експозицією AMPH і як спричинені AMPH CPP (див. Вище), так і парне зв’язування (14) регулюються NAcc DA, ми припустили, що AMPH суттєво змінить мезолімбічну схему DA в польових чоловічих преріях. Мізки суб'єктів з вищезгаданого поведінкового експерименту були оброблені для мічення in situ маркерних мРНК DA. У чоловіків, які отримували AMPH (1.0 мг / кг), було виявлено значне збільшення D1-рецептора (D1R; t = 3.06, P <0.01), але не рецептор D2 (D2R), маркування мРНК у межах NAcc, порівняно з чоловіками, які отримували попередню обробку сольовим розчином (Рис. 3 A-C). Однак не виявлено групових відмінностей у щільності маркування мРНК для тирозину гідроксилази (TH), транспортера DA (DAT) або D2R в межах вентральної тегментальної області (VTA) - області мозку, яка забезпечує основний дофамінергічний вхід до NAcc (Рис. 3 D-G). Підвищена експресія D1Rs в NAcc додатково підтверджується вестерн-блоттінгом (t = 1.90, P <0.05; Рис. 3 H та I). Ці дані разом указують на те, що вплив AMPH має специфічний для рецепторів та сайтів вплив на мезолімбічну систему ДА чоловічих прерійних лялечок - збільшуючи рівень D1R в NAcc.
D1 Рецептори в NAcc Mediate AMPH Погіршення налаштувань партнера.
Раніше ми демонстрували, що в чоловічих прерійних польотах активація D1R в межах NAcc перешкоджала формуванню переваг партнера (14), і поточне дослідження демонструє, що вплив AMPH регулює D1R в NAcc (Рис. 3). Тому ми перевірили гіпотезу про те, що спричинене AMPH порушення переваг партнерів опосередковується D1R в межах NAcc. Самці отримували стереотаксичну канюляцію, спрямовану двосторонньо на оболонку NAcc (Рис. 4A). Штучна цереброспінальна рідина (CSF) сама по собі або CSF, що містить різні дози антагоніста D1-подібного рецептора SCH23390, вводили в NAcc перед ін'єкціями AMPH (1.0 мг / кг) під час кондиціонування 3 днів. Після цього випробовуваних спарювали з самкою протягом 24 год, а потім перевіряли на переваги партнера. Як і в експерименті вище (Рис. 2), Експозиція AMPH запобігла перевагу партнерів, спричинених спаровуванням, у чоловіків, які отримували внутрішньо NAcc ін'єкції CSF або малу дозу SCH23390 (Рис. 4B). Однак у самців, яким вводили високу дозу SCH23390 (100 нг / кг), виявлялися переваги партнерів (t = 2.55, P <0.05), що вказує на те, що блокада D1R у NAcc усувала AMPH-індуковані порушення формування переваг партнера (Рис. 4B). Не було виявлено групових відмінностей у частоті спарювання під час співжиття чи опорно-рухової активності під час тестування переваг партнера.
Обговорення
У цьому дослідженні ми повторюємо наше попереднє висновок про те, що вплив AMPH викликає CPP у чоловічих прерій (22) і продемонструвати, що для такої поведінки необхідна активація D1R в NAcc, результат, що відповідає дослідженням інших видів гризунів (28). Цей висновок разом з попередніми дослідженнями дозволяє припустити, що чіткі механізми DAergic в NAcc регулюють поведінку, мотивовану AMPH та партнером: поведінку, мотивовану AMPH (CPP), опосередковується D1R, тоді як поведінка, мотивована партнером (уподобання партнера), сприяє D2R активація та інгібується активацією D1R в межах NAcc (13-15). [Важливо зазначити, що в NAcc активація D2R опосередковує індукований наркотиком CPP за певних умов (29) і активація D1R бере участь у інших соціально мотивованих поведінках, таких як спрямованих на потомство (7, 30)].
Диференціальна регуляція DAergic CPP та формування переваг партнера, швидше за все, досягається різницею ступеня концентрації викликаної стимулом DA, що активує різні підтипи DAR. Через відмінності у спорідненості зв'язування необхідні міцні підвищення концентрації DA для активації D1R низької спорідненості, тоді як скромні підвищення концентрації DA переважно активують D2R високої спорідненості (31). У прерійних польотах AMPH викликає значно більшу концентрацію концентрації DA (24) порівняно з тим, викликаним спаровуванням (15, 25). Ці дані дозволяють припустити, що порівняно скромне збільшення концентрації ДА під час соціальних взаємодій (15, 25) дозволяють специфічну активацію D2R з високою спорідненістю і таким чином полегшують утворення парних зв'язків. І навпаки, стійке підвищення концентрації DA після введення AMPH, ймовірно, достатньо для активації D1R з низькою афінністю, тим самим полегшуючи CPP, викликаний AMPH.
Рецепторно-специфічна регуляція поведінки за допомогою ДА узгоджується із позаклітинними електрофізіологічними дослідженнями на вільно переміщуваних щурах, що показують, що лікарські та природні подразники обробляються різними популяціями нейронів у межах NAcc (32). Хоча такі електрофізіологічні дослідження не в змозі ідентифікувати підтип рецепторів DA, експресованих на окремих нейронах, анатомічні дослідження демонструють, що NAcc складається з проекційних нейронів, які експресують або D1Rs, або D2Rs з дуже малою спільною експресією (33). Психостимулятори переважно активують внутрішньоклітинні сигнальні шляхи нижче за течією від D1R (як це визначається збільшенням фосфорилювання сигнальних молекул) (34) і раніше ми показали, що посилена активація цих сигнальних шляхів перешкоджає формуванню переваг партнера (35). Таким чином, хоча передача DA в межах NAcc відіграє важливу роль у відповіді на AMPH та формуванні переваг партнерів, ці поведінки, ймовірно, опосередковуються через різні мікросхеми, які складають системи смугової проекції (33, 36). Це представляє особливий інтерес, оскільки утворення парних зв'язків опосередковується активацією нейронів, що експресують D2R, які переважно виступають у вентральний палідій (33), ще одна область мозку, важлива для парного зв’язку (26).
У цьому дослідженні ми надаємо докази того, що досвід AMPH перешкоджає спаренню, викликаному спаровуванням. Оскільки тести переваги партнерів у цих експериментах були проведені 48 год після останнього впливу АМФГ (тобто після того, як препарат повністю метаболізувався), ці дані говорять про стійкий вплив AMPH на соціальну зв’язок. Один потенційний механізм, що відповідає ефектам AMPH для інших видів (37, 38), за допомогою якого AMPH може погіршити парне з'єднання, завдяки збільшенню експресії D1R в межах NAcc. Це поняття підтримується антагоністичною роллю NAcc D1R у формуванні переваг партнера (14, 24) та поточними даними, що демонструють порятунок переваг партнера, викликаного спаровуванням, внутрішньо-NAcc блокадою D1R у тварин, оброблених АМФН (Рис. 4). Цікаво, що раніше ми показали, що в чоловічих прерійних польотах підвищення регуляції NAcc D1R після 2 тижневих парних зв'язків полегшує селективну агресію до конкретних незнайомих людей, включаючи сексуально сприйнятливих жінок, що дозволяє припустити, що ця нейронна пластичність є розвинутим механізмом, за допомогою якого чоловічі голоси підтримувати вже встановлені парні облігації (14). Поточне дослідження свідчить про те, що AMPH штучно запускає цю нейропластичність, що призводить до порушення АМФН парних зв'язків. Можливо також, що самці, оброблені АМФН, можуть асоціювати самку з відхиленням стану відміни АМФГ, і, таким чином, ця негативна асоціація може лежати в основі погіршення AMPH парного зв’язку. Попереднє дослідження продемонструвало, що виведення зі схеми ескалації дози сексуальної поведінки у чоловіків, що погіршували ді-амфетамін (39). Однак у нашому дослідженні, вулкани з різних груп лікування виявили подібні спаровування (Рис. 2B), що свідчить про те, що вони, ймовірно, не знаходились у стані виведення з амфетаміну. Тим не менш, ця можливість вимагає подальшого розслідування.
Добре встановлено, що нейронна пластичність, викликана наркотиками, є основою для наркоманії (40). Психостимулятори різко змінюють структурну пластичність в мезолімбічній системі DA (41) і є дані, які дозволяють стверджувати, що такі зміни є більш стійкими в нейронах, що експресують D1 (37). Більше того, електрофізіологічні дослідження показали, що досвід кокаїну може зменшити подальшу нейропластичність в межах NAcc (42). Дійсно, індукована лікарськими засобами нейронна перебудова NAcc послаблює природну нейронну перебудову після нового впливу складних середовищ (43). Тому, хоча наркоманія широко визнана розладом навчання та пам’яті (1, 40, 44), часто недооцінюється, що спричинена наркотиками втрата потенціалу до додаткової зміни в мезолімбічних схемах також може мати істотне значення для залежності. Таке зниження пластичності може обмежувати поведінковий репертуар до пошуку наркотиків. Тому не дивно, що оброблені AMPH вулкани демонстрували зменшену поведінку парних зв'язків. Поточний вплив впливу AMPH на парні зв’язки узгоджується з попередніми дослідженнями, що ілюструють згубний вплив психостимуляторів на інші соціальні форми поведінки, включаючи поведінку матері (45-47) та соціальна гра (48-50). Разом така робота дає обіцянку, що вивчення взаємодії наркотиків та соціальних стимулів у мозку може значно розширити наше розуміння сильної взаємодії між соціальною поведінкою та вживанням наркотиків у людей (21).
Матеріали та методи
Тема.
Суб'єкти були сексуально наївними чоловічими прерійними польотами з лабораторії племінної колонії. Суб'єктів відлучили у віці 21 днів і розмістили в одностатевих парах побратимів у пластикових клітках (12 × 28 × 16 см), де вода та їжа були надані ad libitum. Всі клітини підтримували за циклом 14: 10 світло-темний, і температура була приблизно 20 ° C. Під час тестування всі випробувані були приблизно віком 90 днів. Стереотаксична канюляція та специфічне місце вливання препаратів ДА детально описані в інших місцях (14).
Тестування на поведінку.
Тестування CPP проводилося, як описано раніше (22) за такими винятками. Початкові переваги клітки для кожного суб'єкта визначали за попереднім тестом 30-хв на день 1. Потім піддослідних кондиціонували протягом хв сеансів 40, AMPH до неполіпшеної клітини та фізіологічним розчином до бажаної клітини (і AMPH, і ін'єкції фізіологічного розчину були зроблені в один і той же день, 6 год один від одного) протягом 3 днів поспіль (дні 2 – 4). Після цього випробовуваних тестували (післятест) на наявність CPP в день 5.
Тестування переваг партнерів проводилось, як описано раніше (14). Якщо коротко, апарат для випробування складався з центральної клітки (12 × 28 × 16 см), з'єднаної порожнистими трубами (7.5 × 16 см) до двох паралельних однакових кліток, у кожній з яких розміщена тварина-стимулювач. Тварин-стимул був знайомим «партнером» (самкою суб'єкта) та незнайомою «незнайомою людиною» (самкою, яка раніше не стикалася з предметом), які були вільно прив’язані до своїх окремих кліток без прямого контакту один з одним. На початку тесту 3-h випробовуваних поміщали в центральну клітку і дозволяли вільно рухатись по всій апараті. Поведінка реєструвались за допомогою системи запису відеозаписів. Експериментатори, сліпі до маніпуляцій, переглянули стрічку та записали поведінку суб'єкта. Уподобання партнера було визначено як суб'єкт, що проводить значно більше часу в стороні в сторону контакту з партнером, ніж з незнайомцем, на що вказують парні зразки t тест (27).
Гібридизація в ситу і західний імуноблоттінг.
Специфічні антисмислові рибопроби (Таблиця 1) використовувались для маркування D1R, D2R, TH та DAT in situ мРНК in situ. Маркування проводилось с 35S-мічені зонди та сенсорні мРНК-контролі для кожного маркера DA, як описано раніше (51). Для вестерн-блоттінгового аналізу білок DAR екстрагували з супернатанту тканинних перфораторів NAcc та аналізували, як описано раніше (52).
Кількісне визначення та аналіз даних.
Параметри CPP та партнерів визначалися парними зразками t тести. Групові відмінності спарювань під час першого 6 год спарювання з самкою та кліткою під час тесту переваг партнера аналізували ANOVA. Оптична щільність маркування D1R та D2R мРНК в NAcc, а також маркування МРНК мРНК в МТР ТХ, ДАТ і D2R в VTA були кількісно визначені за допомогою авторадиограм за допомогою комп'ютеризованої програми зображення (NIH IMAGE 1.64). Дані були представлені у вигляді відсоткової зміни середнього рівня фізіологічної контрольної групи та групові відмінності були проаналізовані t тести. Нарешті, оптичні щільності маркування D1R та D2R на рентгенівській плівці експериментів із вестерн-блоттінгом були проаналізовані t тести
Експериментальний дизайн.
Експеримент 1a встановив криву доза-відповідь для індукованої AMPH CPP. Суб'єктів тестували в апараті CPP в день 1, випадковим чином розподіляли в одну з шести експериментальних груп, які отримували ip (ip) ін'єкції сольового розчину, що містять різні концентрації AMPHn = 12), 0.1 (n = 8), 0.5 (n = 9), 1.0 (n = 12), 3.0 (n = 12) або 5.0 мг / кг (n = 13)] протягом 3 днів (день 2 – 4) кондиціонування, а потім тестували на CPP у післятестовому періоді 5 дня.
Експеримент 1b виявив роль рецепторів DA в індукованій AMPH CPP. Суб'єкти були протестовані в апараті CPP і були випадковим чином розподілені в одну з восьми експериментальних груп, які отримали sc (sc) ін'єкцію фізіологічного розчину (n = 10) або сольовий розчин, що містить різні концентрації неселективного антагоніста рецепторів DA [галоперидол; 0.1 (n = 8), 1.0 (n = 8) або 5.0mg / кг (n = 8)], або специфічний для D1 (SCH23390; 0.5 (n = 7) або 5.0 мг / кг (n = 7)] або D2-подібний специфічний антагоніст рецепторів DA [етиклоприд; 0.5 (n = 8) або 5.0 мг / кг (n = 8)]. Через тридцять хвилин для кондиціонування AMPH була використана порогова доза AMPH (1.0mg / kg), яка індукувала CPP в експерименті 1a. Після 3 днів кондиціонування AMPH всі суб'єкти отримали тест на CPP.
Експеримент 2 вивчав, чи перешкоджав досвід AMPH парним зв’язкам. Суб'єкти були випадковим чином віднесені до однієї з трьох експериментальних груп, які отримували ip ін'єкції фізіологічного розчину (n = 8) або сольовий розчин, що містить 1.0 мг / кг (n = 8) або 5.0 мг / кг (n = 7) AMPH один раз на день протягом 3 днів поспіль - парадигма, яка викликала CPP у чоловічих прерій. На четвертий день випробовуваних спарювали з емітрогенною жінкою, що прогрунтувала естроген, протягом 24 год (14), а потім були протестовані в тесті переваг партнера 3-h. Для контролю за можливим впливом ін'єкцій на парне скріплення, четверта експериментальна група неушкоджених самців, які не отримували жодних ін'єкцій (n = 6) поєднувались з самками, які були естрогеном, протягом 24 год, а потім перевіряли на переваги партнера. Усі тести на поведінку були зняті на відеозапис для перевірки спаровування. Тривалість випробовуваних сторонніх контактів з партнером та незнайомцем була кількісно визначена. Крім того, під час тестування переваг партнера 6-h кількісно визначали частоти спайок під час першого 3 год спарювання та опорно-рухової активності (вказували на схрещування клітки). Після тесту на перевагу партнера випробовувані були негайно вбиті. Всі мізки збирали, заморожували на сухому льоду та зберігали при температурі −80 ° C для мічення гібридизації in situ маркерних мРНК маркера DA.
Експеримент 3 вивчав, чи асоційоване парушення AMPH пов'язане зі змінами активності мезолімбічного ДА. Мозок у суб'єктів, які отримали фізіологічний розчин (n = 8) або 1.0 мг / кг AMPH (n = 8) в експерименті 2 розрізали на кріостаті на корональні ділянки (товщина 14 мкм), які були відтані, встановлені на гірки Superfrost / plus (Fisher Scientific). Мозкові зрізи з інтервалами 98-мкм обробляли для мічення гібридизації in situ мРНК D1R, D2R, TH та DAT. Оскільки ворсинки, отримані з 1.0 мг / кг AMPH, показали збільшення D1R, але не D2R, мічення мРНК в NAcc, порівняно з контролем, що вводиться фізіологічним розчином, було створено дві додаткові групи суб'єктів, які отримували ін'єкції фізіологічного розчину (n = 6) або 1.0 мг / кг AMPH (n = 6), 24 год спаровування, а потім тестування переваг партнера, як описано вище. Суб'єктів обезголовили, а мізки нарізали криостатом при товщині 300 мкм. Тканинні удари двосторонньо взяті з NAcc обробляли для D1R та D2R вестерн-блот.
Експеримент 4 досліджував, чи активація рецепторів типу D1 в NAcc є причиною порушення AMPH парного зв’язку. Суб'єктам імплантували направляючі канюлі, двосторонні, спрямовані на оболонку NAcc. Після днів відновлення 3 їх випадковим чином було розподілено до однієї з трьох експериментальних груп, в яких вони отримували внутрішньо NAcc ін'єкції CSF (200 nL / сторона, n = 11) або CSF, що містить 0.4 (n = 6) або 100 нг / сторона (n = 7) SCH23390. Через тридцять хвилин вони отримували введення ін’єкцій 1.0 мг / кг AMPH. Цю процедуру повторювали протягом днів 3. На четвертий день випробовуваних спарювали з жіночою естрогеном протягом 24 год, а потім перевіряли на переваги партнера.
Подяки
Автори дякують Кайлу Гоброгге, Клаудії Лібервірт, Келлі Лей та Меліссі Мартін за те, що вони критично прочитали цей рукопис. Цю роботу підтримали Національні інститути грантів з охорони здоров'я MHR01-58616, DAR01-19627 та DAK02-23048 до ZW
посилання