Comentarios: Esta revisión foi producida polo xefe de NIDA, Nora Volkow, eo seu equipo. Non hai dúbidas de que as adiccións químicas e os vicios de comportamento comparten os mesmos mecanismos e circuítos neuronais. Isto ten moito sentido, xa que as adicciones químicas secuestran o circuíto neural para o enlace, o sexo e a alimentación. Como o sexo libera dúas veces a dopamina como comer a súa comida favorita, e un usuario porno pode manter a dopamina elevada durante horas, é tolo propoñer que a adicción ao porno non pode existir.
Curr Top Behav Neurosci. 2011 Oct 21.
Volkow ND, Wang GJ, Fowler JS, Tomasi D, Baler R.
fonte
Instituto Nacional de Abuso de Drogas, 6001 Executive Boulevard 6001, Sala 5274, Bethesda, MD, 20892, EUA [protexido por correo electrónico].
Abstracto
Tanto a adicción á droga como a obesidade pódense definir como trastornos nos que o valor de saliency dun tipo de recompensa (medicamentos e alimentos, respectivamente) vólvese anormalmente mellorado en relación cos outros e a costa doutros. Este modelo é consistente co feito de que tanto as drogas como os alimentos teñen poderosos efectos de reforzo, en parte mediados por aumentos de dopamina no sistema límbico, que, en determinadas circunstancias ou en individuos vulnerables, poderían desbordar os mecanismos de control homeostático do cerebro. Tales paralelos xeraron un interese significativo para comprender as vulnerabilidades e traxectorias compartidas entre a adicción e a obesidade. Agora, os descubrimentos de imaxes cerebrais comezaron a descubrir características comúns entre estas dúas condicións e delinear algúns dos circuítos cerebrais superpuestos cuxas disfuncións poden explicar déficits de comportamento estereotipados e relacionados en seres humanos. Testes resultados suxiren que tanto os individuos obesos como os que dependen de drogas padecen alteracións nas rutas dopaminérxicas que regulan os sistemas neuronais asociados non só coa sensibilidade e a motivación da recompensa, senón tamén co condicionamento (memoria / aprendizaxe), control de impulsos (inhibición do comportamento) e reactividade ao estrés. , e conciencia interoceptiva. Aquí integramos os resultados derivados predominantemente da tomografía por emisión de positróns que aclaran o papel da dopamina na adicción ás drogas e na obesidade e propoñemos un modelo de traballo actualizado para axudar a identificar estratexias de tratamento que poidan beneficiar ambas as condicións.
1 Fondo
2 O papel da dopamina na recompensa aguda ás drogas e aos alimentos
3 Imaxe DA en resposta ás drogas e ás condicións condicionadas en dependencia
4 O impacto da disfunción no control inhibitorio
5 Implicación dos circuítos de motivación
6 Implicación do circuíto interoceptivo
7 O circuíto da aversión
8 Recompensa de medicamentos e alimentos patolóxicos: un modelo de traballo actualizado
1 Fondo
A dopamina (DA) considérase unha clave para os efectos gratificantes das recompensas naturais e de drogas. Non obstante, o seu papel na perda de control e comportamentos compulsivos que están asociados coa adicción e a obesidade son moito menos claros. Os estudos de PET xogaron un papel crucial na caracterización do papel dos sistemas cerebrovasculares cerebrais en adicción (ademais do seu papel na recompensa de drogas) e na obesidade. De feito, as drogas de abuso (incluído o alcohol) son consumidas por humanos ou autoadministradas por animais de laboratorio porque son intrínsecamente gratificantes, un efecto que está mediado a través das súas propiedades que aumentan a DA no sistema mesolímbico (Wise) 2009). Hnon obstante, no caso de adicción, os estudos de imaxe revelaron que o trastorno afecta non só ao circuíto de recompensa DA, senón tamén a outras vías de DA implicadas na modulación de condicionamentos / hábitos, motivación e funcións executivas (control inhibitorio, atribución de relevancia e decisión e que os déficits DA tamén poden participar no aumento da reactividade e trastorno da conciencia interoceptiva asociada á adicción. Os estudos preclínicos e clínicos tamén revelaron outros neurotransmisores (e neuropéptidos) que desempeñan un papel importante na recompensa e adicción á droga. (ie, cannabinoides, opioides) e están íntimamente implicados nos cambios neuroplásticos que seguen o uso repetido de drogas (é dicir, glutamato, opioides, GABA, factor de liberación de corticotropina). O sistema glutamatérxico é particularmente destacado neste sentido porque media as interrupcións tanto na potenciación a longo prazo como na depresión a longo prazo que se observaron en modelos animais de administración de drogas crónicas (Thomas et al. 2008). As revisións relativas a estes sistemas adicionais poden atoparse noutro lugar (Kalivas) 2009; Koob 1992).
Xa que as drogas activan os mesmos sistemas de recompensa que subxacen á recompensa de alimentos, non é totalmente inesperado que, en xeral, os estudos de imaxe cerebral apoien a noción de que tamén as implicacións nos circuítos modulados DA están implicados en comportamentos comerciais patolóxicos e compulsivos.. As píldoras dos alimentos, como as drogas, aumentan a DA extracelular estriada e motivan o comportamento necesario para adquirir e comer a comida, proporcionando evidencias da implicación do DA non só na recompensa de alimentos, senón tamén na motivación non hedónica propiedades dos alimentos (é dicir, necesidades calóricas) e diminución do control inhibitorio visto no exceso compulsivo (Avena et al. 2008; Volkow et al. 2008a).
Aquí revisamos os resultados de estudos de imaxe que se centran específicamente nos solapes nos circuítos cerebrais que se ven perturbados na obesidade e na adicción ás drogas. Convén recordar, porén, que a regulación dos comportamentos de inxestión de alimentos é moito máis complexa que a regulación do consumo de drogas. Este último está mediado predominantemente polos efectos gratificantes das drogas, mentres que o primeiro está modulado non só polos seus efectos gratificantes (factores hedónicos) senón tamén por múltiples factores periféricos e centrais que detectan as necesidades de nutrientes no corpo necesarias para a supervivencia (factores homeostáticos). Curiosamente, hai evidencias crecentes de que os factores homeostáticos (por exemplo, insulina, leptina, grelina) modulan a inxestión de alimentos en parte aumentando ou diminuíndo a sensibilidade dos circuítos de recompensa do cerebro aos estímulos alimentarios (Volkow et al. 2011a).
2 O papel da dopamina na recompensa aguda ás drogas e aos alimentos
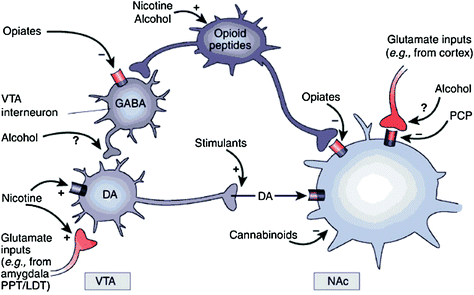
Xa sexa directa ou indirectamente, todas as drogas adictivas mostran unha capacidade para aumentar a DA no núcleo accumbens (NAc) a través de interaccións específicas con diferentes obxectivos moleculares (Nestler 2004) (Fig. 1). A vía DA mesolímbica [as células DA na área tegmental ventral (VTA) que se proxectan no NAc] parece ser crucial para a recompensa de drogas (Wise) 2009). Non obstante, como se describe a continuación, outras vías DA [mesostriatal (células DA na substancia negra que se proxectan no estriado dorsal) e mesocortical (células DA en VTA que se proxectan no córtex frontal)] tamén contribúen á recompensa e á adicción á droga. 2009). En xeral, parece que os efectos gratificantes e condicionantes das drogas son impulsados predominantemente por disparos de células DA fásicos, o que leva a aumentos DA grandes e transitorios. En contraste, os cambios na función executiva que ocorren en augas abaixo están ligados a cambios no disparo de células DA tónicas e producen niveis de DA máis baixos pero máis estables (Grace) 2000; Wanat et al. 2009). Este, á súa vez, apunta aos receptores D1 (D1R), que son receptores DA de baixa afinidade que estimulan a sinalización do AMP cíclico, xa que están implicados tanto na recompensa aguda de drogas como no condicionamento, xa que estes están asociados coas altas concentracións de DA necesarias para estimular a D1R. En contraste, os D2R, que inhiben a sinalización cíclica de AMP, son estimulados por DA fásico e tónico. Nótese que, debido á falta de radiotrazadores específicos para a imaxe PET dos receptores DA dos tipos D1, D3, D4 e D5, a maioría dos estudos sobre os efectos dos medicamentos de abuso e dependencia no cerebro humano centráronse en D2Rs.
Fig 1 Os fármacos de abuso actúan sobre a recompensa e os circuítos auxiliares a través de diferentes mecanismos, con todo, conducen a efectos dopaminérgicos similares no VTA e na NAc. Así, os estimulantes impulsan a DA acumbal directamente, mentres que os opiáceos fan isto reducindo o ton inhibitorio das interneuronas GABAérxicas na sinalización DA tanto na VTA coma na NAc entón. Aínda que os mecanismos doutras drogas de abuso son menos claros, hai evidencias que suxiren que a nicotina pode activar VTA DA directamente a través do receptor nicotínico da acetilcolina (nAChR) nesas neuronas e indirectamente a través da estimulación dos seus receptores en terminais nerviosas glutamatéricas que inervan as células DA. O alcohol parece inhibir os terminais GABAérxicos na VTA, o que leva á desinhibición das neuronas DA na VTA. Os cannabinoides actúan, entre outros, a través da activación dos receptores CB1 nas terminales nerviosas glutamatérxicas e GABAérxicas do NAc e nas propias neuronas NAc. A fenciclidina (PCP) pode actuar inhibindo os receptores de glutamato NMDA postsináptico no NAc. Ademais, hai algunhas evidencias que suxiren que a nicotina eo alcohol tamén poden interactuar coas vías de opioide e canabinoides endóxenas (non se amosan). PPT / LDT, peduncular pontin tegmentum / lateral dorsal tegmentum. Reproducido con permiso de Nestler2005)
Nos humanos, os estudos de PET mostraron que varias drogas [estimulantes] (Drevets et al. 2001; Volkow et al. 1999b), nicotina (Brody et al., 2009), alcohol (Boileau et al. 2003), e marihuana (Bossong et al. 2009)] aumenta a DA no estriado dorsal e ventral (onde se localiza o NAc). Estes estudos aproveitan varios radiotrazadores, como [11C] racloprida, que se unen a D2R pero só cando estes non son unión endóxena de AD (desocupada), que en condicións de liña de base corresponde a 85-90% do D2R estriado (Abi-Dargham et al. 1998). Así, unha comparación de [11C] a unión de racloprida despois do placebo e despois da administración do fármaco pode axudarnos a estimar a diminución da dispoñibilidade de D2R inducida polo fármaco (ou outros estímulos que poden aumentar a DA). Estas diminúen en [11A unión de C] raclopride é proporcional ao aumento de DA (Breier et al. 1997). Estes estudos demostraron que os aumentos de DA inducidos por fármacos no estriado son proporcionales á intensidade da experiencia subxectiva de euforia ou "alta" [ver revisión (Volkow et al. 2009a)] (Fig. 2).
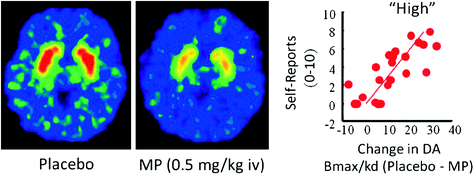
Fig 2 Efectos do metilfenidato intravenoso (MP) na unión de racloprida e relación entre os incrementos de DA estriados inducidos por MP no estriado e as autoinformes de "alto". Modificado de Volkow et al. (1999b)
Os estudos de PET tamén revelaron unha relación clara e directa entre o perfil farmacocinético dunha droga (é dicir, a velocidade coa que entra e sae do cerebro) e os seus efectos de reforzo. Especificamente, canto máis rápido un fármaco alcanza niveis máximos no cerebro, máis intenso é o "alto" (Volkow et al.). 2009a). Por exemplo, para un nivel equivalente de cocaína que chega ao cerebro (avaliado a través de PET), cando a cocaína entrou no cerebro rápidamente (administración afumada ou iv), provocou un "alto" máis intenso que cando entrou a un ritmo máis lento (bufado) (Volkow et al. 2000). Isto é consistente cos estudos preclínicos que mostran unha correlación similar entre o perfil farmacocinético dun fármaco e as súas propiedades reforzantes (Balster e Schuster) 1973). EuÉ razoable hipótese que tales aumentos de DA abruptos e grandes como provocados polas drogas de abuso poden imitar o aumento rápido e grande da DA que resulta do disparo de fásicas DA que se asociaron no cerebro co procesamento de información sobre a recompensa e a calidade. (Schultz 2010). Tales aumentos de DA inducidos por fármacos no NAc poden ser necesarios para a adicción, pero o feito de que se produzan tamén en individuos non adictos indica que son insuficientes para explicar o uso impulsivo e compulsivo de drogas característicos da adicción.
Hai agora evidencias de que as respostas dopaminérxicas comparables están vinculadas coa recompensa de alimentos e que estes mecanismos tamén poden xogar un papel no consumo excesivo de alimentos e na obesidade. É ben sabido que certos alimentos, especialmente os ricos en azucres e graxas, son moi gratificantes (Lenoir et al. 2007). Os alimentos ricos en calorías poden promover a alimentación excesiva (comer que está desvinculado das necesidades enerxéticas) e desencadear asociacións aprendidas entre o estímulo ea recompensa (condicionamento). En termos evolutivos, esta propiedade dos alimentos apetecibles era vantaxosa en ambientes onde as fontes de alimentos eran escasas e / ou pouco fiables, porque aseguraba que se comían alimentos cando estivesen dispoñibles, permitindo que a enerxía se almacenase no corpo (como graxa) para o seu uso futuro. . Por desgraza, en sociedades como a nosa, onde a comida é abundante e está sempre dispoñible, esta adaptación converteuse nunha responsabilidade.
Varios neurotransmisores, incluíndo DA, cannabinoides, opioides e serotonina, así como hormonas e neuropéptidos implicados na regulación homeostática da inxestión de alimentos, como a insulina, orexina, leptina e grelina, foron implicados nos efectos gratificantes dos alimentos (Atkinson). 2008; Cason et al. 2010; Cota et al. 2006). Destes, a DA foi a máis investigada e é a máis caracterizada. Os experimentos en roedores demostraron que, despois da primeira exposición a unha recompensa de alimentos, o disparo de neuronas DA no VTA aumenta cun aumento resultante da liberación de DA en NAc (Norgren et al. 2006). Do mesmo xeito, en individuos humanos con peso normal e saudable, a inxestión de alimentos apetecibles demostrou que libera o DA no estriado dorsal en proporción ás puntuacións da agrada da comida (Small et al. 2003) (Fig. 3). Non obstante, e como se viu nos estudos con consumadores de drogas, os aumentos inducidos polos alimentos na DA estriatal só non poden explicar a diferenza entre a inxestión normal de alimentos e o consumo excesivo de alimentos compulsivos xa que estes tamén ocorren en individuos sans que non comen demasiado. Así, como é o caso da adicción, é probable que as adaptacións de baixada estean implicadas na perda de control sobre a inxestión de alimentos.
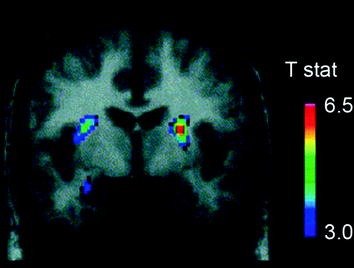
Fig 3 A liberación de dopamina inducida pola alimentación. Sección coronal do mapa T de reducións significativas estatisticamente en11C] potencial de unión de raclopride (PA) despois da alimentación. A barra de cor representa os valores t estatísticos. (Reproducido con permiso Small et al. 2003)
3 Imaxe DA en resposta ás drogas e ás condicións condicionadas en dependencia
O papel da DA no reforzo é máis complexo que o código para a recompensa per se (pracer hedónico); por exemplo, os estímulos que inducen aumentos rápidos e grandes de DA tamén provocan respostas condicionadas e provocan motivación de incentivo para a súa adquisición (Owesson-White et al. 2009). Isto é importante porque, a través do proceso de condicionamento, os estímulos neutros que están ligados ao reforzador (sexa un reforzador natural ou de drogas) adquiren a capacidade por si mesmos de aumentar a DA en estriado (incluída a NAc) en anticipación da recompensa, xerando así. unha forte motivación para buscar a droga (Owesson-White et al. 2009). Non obstante, o desacoplamento dos mecanismos de recompensa e acondicionamento no proceso de adicción ás drogas é máis difícil que para o consumo de alimentos porque as drogas de abuso, a través dos seus efectos farmacolóxicos, activan directamente as neuronas DA (é dicir, a nicotina) ou aumentan a liberación de DA (é dicir, a anfetamina).
Os estudos de imaxe cerebral que compararon os incrementos de DA inducidos polo fármaco estimulante metilfenidato (MP) ou anfetamina (AMPH) entre os suxeitos adictos á cocaína fronte aos controis mostraron unha marcada atenuación dos aumentos de DA inducidos por MP ou AMPH no estriado (50% máis baixo en maltratadores desintoxicados e 80% en maltratadores activos) e menores autoinformes dos efectos gratificantes da droga en relación aos controis que non abusan de drogas (Martinez et al. 2007; Volkow et al. 1997) (Fig. 4). Isto foi sorprendente xa que MP e AMPH son farmacológicamente similares á cocaína e á metanfetamina, respectivamente, e os consumidores de drogas non poden distinguir entre eles cando son administrados por vía intravenosa. Dado que se observaron as marcadas reducións dos incrementos de DA inducidos por fármacos se os abusadores de cocaína foran desintoxicados ou non, isto indica que o estado de retirada non é un factor de confusión (Volkow et al. 2011b). Estes e resultados relacionados (Volkow et al. 2009a) son consistentes coa hipótese de que a resposta hedónica se fai deficiente en individuos adictos ás drogas e reforza aínda máis a noción de que os efectos farmacolóxicos agudos que aumentan a DA na droga non poden explicar por si só o aumento da motivación para consumilos.
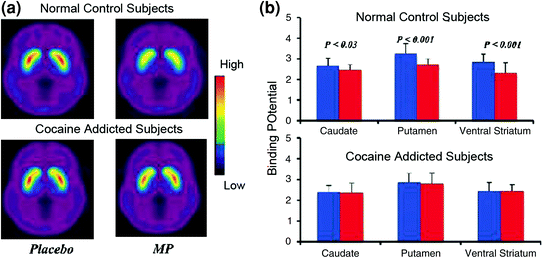
Fig 4 Os cambios de DA inducidos pola MP iv nos controis e nos suxeitos adictos á cocaína activa. Imaxes de potencial biding (BPND) promedio non separables [de BPND]11C] racloprida nos suxeitos adictos á cocaína activa (n = 19) e nos controis (n = 24) probados despois do placebo e despois da MP iv. b Dispoñibilidade de D2R (BPND) no caudado, putamen e estrato ventral despois do placebo (azul) e despois do MP (vermello) nos controles e nos suxeitos adictos á cocaína. MP reduciu D2R nos controis pero non nos suxeitos adictos á cocaína. Nótese que os consumidores de cocaína mostran ambas diminucións na dispoñibilidade estratal D2R basal (medida placebo) e diminúe na liberación de DA cando se administra un MP iv (medido como diminución da dispoñibilidade de D2R desde o inicio). Aínda que se podería cuestionar en que medida a dispoñibilidade de D2R en estratosos baixos no suxeito adicto á cocaína limita a capacidade de detectar novas diminucións por parte do MP, o feito de que os suxeitos adictos á cocaína mostran unha redución da dispoñibilidade de D2R cando está exposta a pistas de cocaína indica que os efectos atenuados de MP en [11C] a ligazón racloprida reflicte unha diminución da liberación DA. Reproducido con permiso (Volkow et al. 1997; Wang et al. 2010)
A resposta das neuronas VTA DA a estímulos gratificantes cambia coa exposición repetida.
Aínda que as células DA disparan sobre a primeira exposición a unha nova recompensa, a exposición repetida ao DA fai que as neuronas deixen de disparar ao recompensar o consumo e ao lume cando están expostos a estímulos que son predictivos da recompensa. (Schultz et al. 1997). Isto probablemente subxace ao papel de DA na aprendizaxe e no acondicionamento. De feito, a sinalización DA fásica inducida por fármacos pode eventualmente desencadear neuroadaptacións en circuítos auxiliares relacionados coa formación do hábito e o condicionamento do comportamento. Testes cambios son predominantemente inducidos por sinalización D1R e cambios sinápticos nos receptores NMDA e AMPA modulados polo glutamato (Luscher e Malenka 2011; Zweifel et al. 2009). O recrutamento destes circuítos é significativo na progresión da enfermidade porque as seguintes respostas condicionadas axudan a explicar o intenso desexo da droga (o desexo) e o uso compulsivo que ocorre cando os suxeitos adictos están expostos a pistas asociadas a drogas. Esta hipótese é consistente coas observacións independentes (Volkow et al. 2006b; Wong et al. 2006) que mostran o poder da exposición de sinais asociada á cocaína para aumentar os niveis de DA no estriado dorsal e provocar un aumento concomitante da experiencia subxectiva do desexo nos abusadores de cocaína desintoxicados. 5). Dado que o estriado dorsal ten un papel na aprendizaxe de hábitats (Belin et al. 2009; Yin et al. 2004), a asociación pode reflectir o fortalecemento de hábitos como progresa a cronicidade da adicción. Isto suxire que unha interrupción básica na adicción pode relacionarse coas respostas condicionadas provocadas pola DA que resultan en hábitos que provocan un desexo intenso e un consumo compulsivo de drogas. Curiosamente, empregando activamente os suxeitos adictos á cocaína, os incrementos de DA provocados por sinais condicionados parecen ser aínda maiores que os producidos polo propio fármaco estimulante, avaliados en dous grupos separados de suxeitos (Volkow et al. 2011b, 2006b), o que suxire que as respostas condicionadas poden impulsar a sinalización DA que mantén a motivación para tomar o medicamento mesmo cando os seus efectos farmacolóxicos parecen reducirse. Así, aínda que as drogas poden orixinar sentimentos de recompensa inmediata a través da liberación DA no estriado ventral, con uso repetido e como se desenvolve o hábito, parece haber un cambio do estímulo condicionado á droga. Segundo estudos realizados en animais de laboratorio, as proxeccións glutamatérxicas do córtex prefrontal e da amígdala en VTA / SN e NAc medían estas respostas condicionadas (Kalivas) 2009). Deste xeito, a mera previsión dunha recompensa pode converterse na recompensa que motiva o comportamento necesario para o consumo de drogas (ou alimentos).
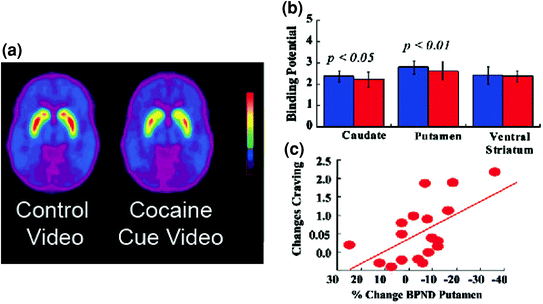
Fig 5 Os cambios de DA inducidos por sinais condicionados en suxeitos adictos á cocaína activa. Imaxes potenciais de unión non separables (BPND) de racloprida [11C] en suxeitos adictos á cocaína (n = 17) probados ao ver un vídeo neutro (escenas da natureza) e ao ver un vídeo de cocaína (suxeitos que administran cocaína). b Dispoñibilidade de D2R (BPND) no estrato caudado, putamen e ventral para o vídeo neutro (azul) e o vídeo de cocaína (vermello). As indicacións de cocaína diminuíron D2R no caudado e putamen. c Correlacións entre os cambios de D2R (que reflicten incrementos de DA) e os autoinformes do desexo de cocaína inducidos polo vídeo de cocaína. Modificado de ref. (Volkow et al. 2006b)
ICiertamente, este tipo de "interruptor" funcional tamén se informou de reforzos naturais, que probablemente inducirán un cambio equivalente e gradual en aumentos de DA, desde as rexións ventral ata as dorsais do estriado durante a transición dun estímulo novo que é inherentemente gratificante para as páxinas asociadas que o predicen. Esta transición transmítese a través da sinalización DA, que parece codificar por un "erro de predicción de recompensa" (Schultz 2010). As extensas glutamatérxicas afirman ás neuronas DA de rexións implicadas no procesamento da cortiza sensorial (insula ou cortiza primaria gustativa), homeostática (hipotálamo), recompensa (NAc), emocional (amígdala e hipocampo) e multimodal (córtex orbitofrontal para a atribución de salience). , modula a súa actividade en resposta ás recompensas e ás pistas condicionadas (Geisler e Wise) 2008). Máis concretamente, as proxeccións da amígdala e da cortiza orbitofrontal (OFC) ás neuronas DA e á NAc están implicadas nas respostas condicionadas aos alimentos (Petrovich) 2010). En realidade, os estudos de imaxe mostraron que cando aos suxeitos varóns non obesos se lles pediu que inhibisen o seu desexo de alimentos, mentres estaban expostos a indicacións alimentarias, mostraron unha diminución da actividade metabólica na amígdala e no OFC (así como no hipocampo), na insula e no estriado. e que as diminucións na OFC asociáronse con reducións no desexo de alimentos (Wang et al.). 2009). Unha inhibición similar da actividade metabólica no OFC (e tamén no NAc) foi observada en consumidores de cocaína cando se lles pediu que inhibisen o seu desexo de drogas ao expoñerse a consignas de cocaína (Volkow et al. 2009b).
Aínda así, a aparición de tales ansias condicionadas, que para alimentos tamén se producen en individuos sans que non se alimentan en exceso, non serían tan devastadores se non se uniron a un déficit crecente na capacidade do cerebro para inhibir comportamentos inadaptados.
4 O impacto da disfunción no control inhibitorio
A capacidade de inhibir as respostas prepotentes está obrigada a contribuír á capacidade dun individuo de evitar comportamentos inadecuados, como tomar drogas ou comer ao longo do punto de saciedade, e así aumentar a súa vulnerabilidade á adicción (ou obesidade) (Volkow e Fowler 2000; Volkow et al. 2008a).
Os estudos de PET descubriron reducións significativas na dispoñibilidade de D2R no estriado dos suxeitos adictos que persisten durante meses despois da desintoxicación prolongada [revisada (Volkow et al. 2009a)]. Do mesmo xeito, os estudos preclínicos en primates de roedores e non humanos mostraron que as exposicións repetidas de medicamentos están asociadas con reducións nos niveis de estrías D2R (Nader et al. 2006; Thanos et al. 2007; Volkow et al. 2001). No estriado, D2R media a sinalización na vía indirecta estriatal que modula as rexións prefrontais; e demostrouse que a súa baixa regulación aumenta a sensibilización aos efectos dos fármacos en modelos animais (Ferguson et al. 2011). Nos humanos adictos ás drogas, a redución do estriatal D2R está asociada a unha diminución da actividade das rexións prefrontais, como evidenciado pola diminución do metabolismo basal de glicosa (un marcador da función cerebral) en OFC, xiro cingulado anterior (ACC) e córtex prefrontal dorsolateral (DLPFC) ) (Volkow et al. 2001, 1993, 2007) (Fig. 6). Tendo en conta que OFC, ACC e DLPFC están implicados na atribución de potencia, control inhibitorio / regulación das emocións e toma de decisións, respectivamente, postulouse que a súa regulación inadecuada pola sinalización de DA mediada por D2R nos suxeitos adictos podería subestimar o maior valor motivacional das drogas no seu comportamento e a perda de control sobre a inxestión de drogas (Volkow e Fowler 2000). Ademais, debido a que as deficiencias en OFC e ACC están asociadas a comportamentos compulsivos e impulsividade (Fineberg et al. 2009), A modulación alterada de DA destas rexións é susceptible de contribuír ao consumo de drogas compulsivo e impulsivo visto na dependencia (Goldstein e Volkow) 2002). De feito, nos agresores de metanfetamina, D2R de baixo estriatismo asociouse con impulsividade (Lee et al. 2009), e tamén previu a administración compulsiva de cocaína en roedores (Everitt et al. 2008). Tamén é posible un escenario inverso, no que unha vulnerabilidade inicial para o uso de drogas preexístase en rexións prefrontais, e en que o uso repetido de drogas desencadea descensos no D2R estriado. De feito, un estudo feito en individuos que, a pesar de ter un alto risco de alcoholismo (antecedentes familiares positivos de alcoholismo), non foron alcohólicos, revelou unha dispoñibilidade estratal D2R superior á normal que estaba asociada co metabolismo normal en OFC, ACC e DLPFC (Volkow). et al. 2006a). Isto suxire que, nestes suxeitos con risco de alcoholismo, a función prefrontal normal estivo ligada a unha maior sinalización estratal D2R, que á súa vez os protexía do abuso de alcohol.
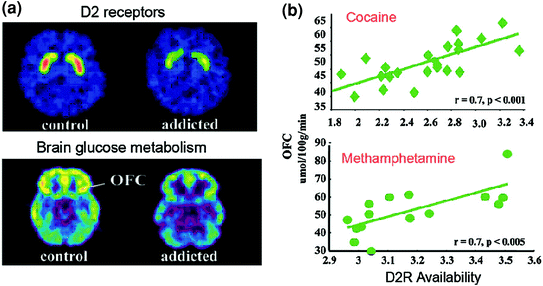
Fig 6 Correlacións entre a dispoñibilidade de D2R estriatal e o metabolismo nas rexións cerebrais prefrontais. imaxes do cerebro axial para un control e para un suxeito adicto á cocaína para as imaxes de base da dispoñibilidade de D2R en estriado (obtido con11C] racloprida) e do metabolismo da glicosa no cerebro en OFC (obtido con []18FDG). b Correlacións entre o D2R estriatal eo metabolismo en OFC nos suxeitos adictos á cocaína e os que dependen da metanfetamina. Reproducido de Volkow et al. (2009a) Copyright (2009), con permiso de Elsevier
Previsiblemente, tamén se atoparon evidencias de disregulación nos circuítos de control entre os individuos obesos. Ambos estudos preclínicos e clínicos demostraron unha diminución da sinalización estratal D2R, que, como se mencionou anteriormente, está ligada á recompensa (NAc) pero tamén co establecemento de hábitos e rutinas (striatum dorsal) en obesit.y (Geiger et al. 2009; Wang et al. 2001). É importante destacar que a diminución da dispoñibilidade de D2R estriatal foi ligada á inxestión compulsiva de alimentos en roedores obesos (Johnson e Kenny) 2010) e con diminución da actividade metabólica en OFC e ACC en humanos obesos (Volkow et al.). 2008b) (Fig. 7a – c). Tendo en conta que a disfunción en OFC e ACC resulta en compulsividade [ver revisión (Fineberg et al. 2009)], isto pode ser parte do mecanismo polo cal a sinalización D2R estriatal baixa facilita a hiperfagia (Davis et al. 2009). Ademais, dado que a diminución da sinalización relacionada con D2R tamén pode reducir a sensibilidade a outras recompensas naturais, este déficit nas persoas obesas tamén pode contribuír ao exceso de compensación (Geiger et al. 2008).
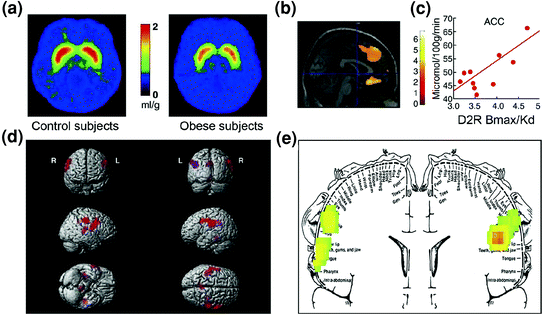
Fig 7 A hiperfagia pode resultar dunha unidade para compensar un circuíto de recompensa debilitado (procesado a través de circuítos corticostriatais regulados por dopamina) combinado cunha sensibilidade máis elevada á palatabilidad (propiedades hedónicas dos alimentos procesados en parte a través do córtex somatosensorial). a Imaxes medias para a dispoñibilidade do receptor DA D2 (D2R) en controis (n = 10) e en suxeitos con obesidade mórbida (n = 10). b Resultados de SPM (Mapeado paramétrico estatístico) que identificaron as áreas do cerebro onde D2R se asociou ao metabolismo da glicosa, incluíron o OFC medial, o ACC e o PFC dorsolateral (rexión non mostrada). c Pendente de regresión entre a D2R estriada e a actividade metabólica en ACC en suxeitos obesos. d Imaxes de SPM renderizadas tridimensionalmente que mostran as áreas con maior metabolismo en obesos que en suxeitos delgados (P <0.003, sen corrixir). e Resultados de SPM codificados por cores mostrados nun plano coronal cun diagrama superposto do homúnculo somatosensorial. Os resultados (valor z) preséntanse usando a escala do arco da vella onde vermello> amarelo> verde. En comparación con suxeitos delgados, os suxeitos obesos tiñan un metabolismo basal máis alto nas áreas somatosensoriais onde están representadas a boca, os beizos e a lingua e que están implicados no procesado da palatabilidade dos alimentos. Modificado, con permiso, de Volkow et al. (2008a) (a – c) e Wang et al. (2002) (d, e)
Esta hipótese é consistente coas evidencias preclínicas que amosan que a diminución da actividade DA en VTA resulta nun aumento dramático no consumo de alimentos ricos en graxa (Stoeckel et al. 2008). Do mesmo xeito, en comparación con individuos con peso normal, os individuos obesos que se presentaron con imaxes de alimentos altamente calóricos (estímulos aos que están condicionados) mostraron un aumento da activación neuronal en rexións que forman parte dos circuítos de recompensa e motivación (NAc, striatum dorsal, OFC). , ACC, amígdala, hipocampo e insula) (Killgore e Yurgelun-Todd 2005). Pola contra, nos controis de peso normal, a activación do ACC e OFC (rexións implicadas na atribución de saience que se proxectan no NAc) durante a presentación de alimentos ricos en calorías resultou ser correlacionada negativamente co seu índice de masa corporal (IMC) ( Stice et al. 2008b). Isto suxire unha interacción dinámica entre a cantidade de alimentos consumidos (reflectida en parte no IMC) ea reactividade das rexións recompensas con alimentos altamente calóricos (reflectidos na activación de OFC e ACC) en individuos con peso normal, que se perde en obesidade.
Sorprendentemente, os individuos obesos mostraron menos activación dos circuítos de recompensa do consumo real de alimentos (chamado recompensa alimentaria consumadora) que os individuos delgados, mentres que mostraron unha maior activación das rexións corticais somatosensoriais que procesan a palatabilidad cando se anticipaba ao consumo (Stice et al. 2008b). Esta última observación correspondía a rexións onde un estudo anterior revelara unha actividade mellorada no suxeito obeso probado no inicio (non estimulación) (Wang et al. 2002) (Fig. 7d, e). Unha actividade mellorada das rexións que a palatabilidad dos procesos podería facer que os suxeitos obesos favorecen a comida sobre outros reforzadores naturais, mentres que a diminución da activación dos obxectivos dopaminérgicos polo consumo de alimentos pode levar ao exceso de consumo como medio para compensar a feble sinalización D2R (Stice et al. 2008a). Esta resposta reducida do circuíto de recompensa ao consumo de alimentos en suxeitos obesos é unha reminiscencia dos aumentos de DA reducidos provocados polo consumo de drogas en persoas adictas cando se comparan con suxeitos non adictos.
A cortiza prefrontal (PFC) desempeña un papel crucial na función executiva, incluído o control inhibitorio (Miller e Cohen) 2001). Estes procesos son modulados por D1R e D2R (presuntamente tamén D4R) e, polo tanto, a diminución da actividade no PFC, tanto na adicción como na obesidade, é susceptible de contribuír a un control pobre e unha alta compulsividade. A dispoñibilidade menor de normal de D2R no estriado das persoas obesas, que foi asociada a unha reducida actividade en PFC e ACC (Volkow et al. 2008b), polo tanto, é probable que contribúa ao seu deficiente control sobre a inxestión de alimentos. De feito, a correlación negativa entre o IMC e o estriatal D2R informaron en obesos (Wang et al.). 2001) e con sobrepeso (Haltia et al. 2007a) os individuos o apoian. Unha mellor comprensión dos mecanismos que provocan un deterioro da función de PFC na obesidade (ou adicción) podería facilitar o desenvolvemento de estratexias para mellorar, ou quizais incluso revertir, as deficiencias específicas en dominios cognitivos cruciais. Por exemplo, o desconto por demora, que é a tendencia a desvalorizar unha recompensa en función do atraso temporal da súa entrega, é unha das operacións cognitivas máis investigadas en relación con trastornos asociados á impulsividade e compulsividade. O desconto de atraso foi investigado de forma exhaustiva nos consumidores de drogas que presentan unha preferencia esaxerada por recompensas pequenas pero inmediatas sobre grandes pero atrasadas (Bickel et al. 2007). Non obstante, os poucos estudos realizados con individuos obesos tamén descubriron evidencias de preferencia por recompensas altas e inmediatas, a pesar dun aumento das posibilidades de sufrir perdas futuras máis altas (Brogan et al. 2010; Weller et al. 2008). E máis recentemente, outro estudo atopou unha correlación positiva entre o IMC eo desconto hiperbólico, onde os beneficios futuros negativos descontan menos que os beneficios futuros positivos (Ikeda et al. 2010). Curiosamente, o desconto por atraso parece depender da función do estriado ventral (Gregorios-Pippas et al. 2009) e do PFC, incluíndo o OFC lateral (Bjork et al.). 2009), e é sensible ás manipulacións DA (Pine et al. 2010). Especificamente, a mellora da sinalización DA (con tratamento con DOPA L) aumentou a impulsividade e o desconto temporal.
5 Implicación dos circuítos de motivación
A sinalización dopaminérxica tamén modula a motivación. As características do comportamento, como o vigor, a persistencia e o investimento dun esforzo continuado para conseguir un obxectivo, están todos suxeitos a unha modulación por parte da DA que actúa a través de varias rexións obxecto de aprendizaxe incluíndo NAc, ACC, OFC, DLPFC, amígdala, estriado dorsal e pallidum ventral (Salamone et al. 2007). A sinalización DA disregulada está asociada a unha maior motivación para a adquisición de drogas, sinal de adicción, polo que as persoas adictas a drogas a miúdo participan en comportamentos extremos para obter drogas, aínda que conteñen consecuencias severas e adversas coñecidas (Volkow e Li 2005). Porque a toma de drogas convértese no principal impulso motivacional na adicción ás drogas (Volkow et al. 2003), os suxeitos adictos son despertados e motivados polo proceso de obtención da droga, pero tenden a ser retirados e apáticos cando están expostos a actividades non relacionadas coa droga. Este cambio estudouse comparando os patróns de activación cerebral que se producen coa exposición a pistas condicionadas con aqueles que se producen en ausencia de tales sinais. En contraste coas diminucións na actividade prefrontal denunciadas en maltratadores de cocaína desintoxicados cando non se estimulaban con píldoras de drogas ou drogas [ver revisión (Volkow et al. 2009a)], estas rexións prefrontais se activan cando os consumidores de cocaína están expostos a estímulos inductivos (ou drogas ou sinais) (Grant et al. 1996; Volkow et al. 1999a; Wang et al. 1999). Este resultado é unha reminiscencia da observación de que os consumidores de cocaína, estudados pouco despois dun episodio de cocaína, mostraron un aumento da actividade metabólica en OFC e ACC (tamén estriado dorsal) asociado ao desexo (Volkow et al. 1991).
Ademais, cando se comparan as respostas ao MP iv entre os adictos á cocaína e os individuos non adictos, os primeiros responderon cun aumento do metabolismo no ACC ventral e no OFC medial (un efecto asociado ao desexo), mentres que o segundo mostrou a resposta oposta, ou sexa, diminución. metabolismo nestas rexións (Volkow et al. 2005). Isto suxire que a activación destas rexións prefrontais con exposición ao fármaco pode ser específica da dependencia e está asociada co desexo aumentado da droga. Ademais, un estudo que levou aos suxeitos adictos á cocaína a inhibir desexando o desexo cando está exposto a unhas drogas mostrou que aqueles individuos que tiveron éxito no inhibición do desexo mostraron un metabolismo diminuído na OFC media (que procesa o valor motivacional dun reforzador) e NAc (que prevé recompensa) (Volkow et al. 2009b). Estes descubrimentos corroboran aínda máis a implicación de OFC, ACC e striatum na mellora da motivación para adquirir a droga viciada.
Como era de esperar, a OFC tamén estivo implicada na atribución de valor para os alimentos (Grabenhorst et al. 2008; Rolls e McCabe 2007), axudando a avaliar a súa agresividade e palatabilidad esperadas en función do seu contexto. Os estudos de PET con FDG para medir o metabolismo da glicosa no cerebro en individuos con peso normal informaron que a exposición a indicios de alimentos aumentou a actividade metabólica en OFC, o que foi un efecto asociado á percepción da fame e ao desexo de alimentos (Wang et al. 2004). A activación da OFC mellorada pola estimulación dos alimentos é susceptible de reflectir efectos dopaminérgicos descendentes e participar na implicación de DA no impulso para o consumo de alimentos. A OFC xoga un papel na aprendizaxe das asociacións de reforzo de estímulos e do condicionamento (Cox et al. 2005; Gallagher et al. 1999), soporta a alimentación provocada por indicios condicionados (Weingarten.) 1983), e probablemente contribúe a comer de máis, independentemente dos sinais de fame (Ogden e Wardle) 1990). De feito, a disfunción da OFC estivo relacionada coa alimentación excesiva (Machado e Bachevalier) 2007).
A pesar dalgunhas inconsistencias entre os estudos, os datos de imaxe cerebral tamén apoian a noción de que os cambios estruturais e funcionais nas rexións cerebrais implicadas na función executiva (incluído o control inhibitorio) poden estar asociados a un alto IMC en individuos saudables. Por exemplo, un estudo de resonancia magnética feita en mulleres de idade avanzada, utilizando morfometría baseada en voxel, atopou unha correlación negativa entre o IMC e os volumes de materia gris (incluídas as rexións frontais), que na OFC asociouse a unha función executiva deteriorada (Walther et al. 2010). Usando o PET para medir o metabolismo cerebral da glicosa en controis sans, reportamos unha correlación negativa entre o IMC ea actividade metabólica en DLPFC, OFC e ACC. Neste estudo, a actividade metabólica nas rexións prefrontais previu o rendemento dos suxeitos nas probas da función executiva (Volkow et al. 2009c). Do mesmo xeito, un estudo espectroscópico de resonancia magnética nuclear (RMN) en controis de idade media e anciáns saudables mostrou que o IMC estaba asociado negativamente aos niveis de N-acetil-aspartato (un marcador de integridade neuronal) na cortiza frontal e na ACC (Gazdzinski et al. 2008; Volkow et al. 2009c).
Os estudos de imaxe cerebral que comparan os individuos obesos e fraco tamén reportaron menor densidade de materia gris nas rexións frontais (opérculo frontal e xiro central frontal) e en xiro post-central e putamen (Pannacciulli et al. 2006). Outro estudo non atopou diferenzas nos volumes de materia gris entre asuntos obesos e delgados. rexistrou unha correlación positiva entre o volume de materia branca nas estruturas cerebrais basais e as proporcións cintura / cadeira, unha tendencia parcialmente revertida pola dieta (Haltia et al. 2007b). Curiosamente, as áreas corticais, como o DPFC e OFC que están implicadas no control inhibitorio, tamén se atoparon que se activaron en dieters exitosos en resposta ao consumo de comidas (DelParigi et al. 2007), que suxire un obxectivo potencial para a reciclaxe do comportamento no tratamento da obesidade (e tamén na dependencia).
6 Implicación do circuíto interoceptivo
Os estudos de neuroimagen revelaron que a insula central xoga un papel crítico nos desexos de comida, cocaína e cigarros (Bonson et al. 2002; Pelchat et al. 2004; Wang et al. 2007). A importancia do insula foi resaltada por un estudo que informou de que os fumadores con dano nesta rexión (pero que non controlan aos fumadores que sufriron lesións extrainsulares) puideron deixar de fumar con facilidade e sen experimentar nin ansias nin recaídas (Naqvi et al . 2007). A insula, particularmente as súas rexións máis anteriores, está conectada recíprocamente a varias rexións límbicas (por exemplo, o córtex prefrontal ventromedial, a amígdala eo estriado ventral) e parece ter unha función interoceptiva, integrando a información autonómica e visceral con emoción e motivación. consciente destes impulsos (Naqvi e Bechara 2009). De feito, os estudos de lesións cerebrais suxiren que o PFC e insula ventromedial son compoñentes necesarios dos circuítos distribuídos que apoian a toma de decisións emocionais (Clark et al. 2008). De acordo con esta hipótese, os estudos de imaxe mostran unha activación diferencial da insula durante o desexo (Brody et al.). 2009; Goudriaan et al. 2010; Naqvi e Bechara 2009; Wang et al. 1999). Por conseguinte, suxeriuse que a reactividade desta rexión cerebral serve de biomarcador para axudar a predicir a recaída (Janes et al. 2010).
A insula é tamén unha área gustativa primaria, que participa en moitos aspectos dos comportamentos alimenticios, como o gusto. Ademais, a insula rostral (conectada á cortiza de sabor primario) proporciona información ao OFC que inflúe na súa representación multimodal do valor de agradecemento ou recompensa dos alimentos entrantes (Rolls) 2008). Debido á implicación da insula no sentido interoceptivo do corpo, na conciencia emocional (Craig 2003) e en motivación e emoción (Rolls.) 2008), podería esperarse unha contribución de insuficiencia insular na obesidade. De feito, a distensión gástrica resulta na activación da insula posterior, que é susceptible de reflectir o seu papel na conciencia dos estados corporais (neste caso de plenitude) (Wang et al. 2008). Ademais, en suxeitos delgados, pero non obesos, a distensión gástrica resultou na activación da amígdala e na desactivación da insula anterior (Tomasi et al. 2009). A falta de resposta de amígdala nos suxeitos obesos podería reflectir unha conciencia interoceptiva de estados corporais ligada á saciedade (estómago cheo). Aínda que a modulación da actividade insular por DA foi mal investigada, recoñécese que a DA está implicada nas respostas á degustación de alimentos apetecibles que están mediados a través da insula (Hajnal e Norgren 2005). Os estudos de imaxe humana demostraron que probar os alimentos saborosos activaron as zonas insula e media cerebral (DelParigi et al. 2005; Frank et al. 2008). Non obstante, a sinalización DA tamén pode ser necesaria para detectar o contido calórico dos alimentos. Por exemplo, cando as mulleres con peso normal probaron un edulcorante con calorías (sacarosa), tanto a zona insulina como a do cerebro midaminérgico activáronse, mentres que degustar un edulcorante sen calorías (sucralose) só activou o insula (Frank et al. 2008). Os suxeitos obesos mostran unha maior activación insular que os controis normais ao probar unha comida líquida que consiste en azucre e graxa (DelParigi et al. 2005). En contraste, os individuos que se recuperaron da anorexia nerviosa mostran menos activación no insula cando proban sacarosa e ningunha asociación de sentimentos de agrado con activación insular como se observa nos controis normais (Wagner et al. 2008). Cando se combinan, estes resultados fan probable que a desregulación da ínsula en resposta aos estímulos do gusto poida estar implicada no deterioro do control de varios comportamentos apetitivos.
7 O circuíto da aversión
Como se mencionou anteriormente, o adestramento (acondicionado) nunha tónica que prevé a recompensa leva a disparar células dopaminérxicas en resposta á previsión de recompensa, e non á recompensa en si. Por outra banda, e de acordo con esta lóxica, observouse que as células dopaminérxicas dispararanse menos do normal se non se materializa a recompensa esperada (Schultz et al. 1997). Evidencia acumulada (Christoph et al. 1986; Lisoprawski et al. 1980; Matsumoto e Hikosaka 2007; Nishikawa et al. 1986) apunta ao habenula como unha das rexións que controla a diminución do disparo das células dopaminérxicas na VTA que poden seguir a falta de recibir unha recompensa esperada (Kimura et al. 2007). Deste xeito, unha maior sensibilidade da habenula, como resultado das exposicións crónicas ás drogas, podería ser a base dunha maior reactividade ás indicacións da droga. De feito, a activación do habenula, nos suxeitos adictos á cocaína, asociouse cunha recaída no comportamento ao tomar drogas cando se expón a cue (Brown et al. 2011; Zhang et al. 2005). No caso da nicotina, os receptores nicotínicos α5 do habenula parecen modular as respostas aversivas a grandes doses de nicotina (Fowler et al. 2011); e os receptores α5 e α2 no habénula están implicados na retirada da nicotina (Salas et al. 2009). Debido á resposta oposta do habenula á das neuronas DA para recompensar (desactivación) e a súa activación tras a exposición a estímulos aversivos, referímosnos / referímonos aquí á sinalización do habénula como unha que transmite unha entrada "antirretorno".
O habenula parece desempeñar un papel similar en relación coa recompensa de alimentos. Unha dieta alimentaria altamente apetecible pode inducir a obesidade nas ratas, aumentando o peso correlacionándose cos aumentos da unión do péptido µ-opiáceo na amígdala basolateral e basomedial. Curiosamente, o habénula medial mostrou unha unión significativa máis elevada da unión de péptidos µ-opiáceos (aproximadamente 40%) tras a exposición ao alimento agradable nas ratas que gañaron peso (as que consumiron máis alimentos) pero non nas que non o fixeron (Smith et al. 2002). Isto suxire que o habenula pode estar implicado no exceso de comida en condicións de dispoñibilidade de alimentos apetecibles. Ademais, as neuronas do núcleo tegmental rostromedial, que reciben un importante aporte da habénula lateral, proxéctanse ás neuronas VTA DA e son activadas logo da privación de alimentos (Jhou et al. 2009). Estes resultados son consistentes co papel do habenula na mediación das respostas a estímulos aversivos ou estados como os que ocorren durante a dieta ou a retirada de drogas.
A implicación do habenula como un centro antirretorno dentro das redes emocionais é consistente cos modelos teóricos anteriores de adicción que postularon respostas anti-recompensa sensibilizadas (mediadas a través dunha maior sensibilidade da amígdala e un aumento da sinalización aínda que o factor de liberación de corticotropina) como drogas. (Koob e Le Moal 2008). Respostas antirresas similares tamén poden contribuír ao consumo excesivo de alimentos na obesidade.
8 Recompensa de medicamentos e alimentos patolóxicos: un modelo de traballo actualizado
Ta capacidade de resistir o desexo de usar unha droga ou comer ao longo do punto de saciedade require o bo funcionamento dos circuítos neuronais implicados no control de arriba para abaixo para opoñerse ás respostas condicionadas que predicen a recompensa de inxerir o alimento e o desexo de inxerir o alimento comida / droga. Aquí destacamos seis destes circuítos: recompensa / salitación, condicionamentos / hábitos, control inhibitorio / función executiva, motivación / impulsión, interocepción e reacción por evitar a aversión / tensión (fig. 8). Con base nos datos de imaxe presentados aquí, postulamos que é a discrepancia entre a expectativa dos efectos de drogas / alimentos (respostas condicionadas) e os efectos neurofisiolóxicos que mantén a toma de drogas ou o consumo excesivo de alimentos nun intento de alcanzar os recompensa esperada. Ademais, xa sexa probado durante períodos tempranos ou prolongados de abstinencia / dieta, os suxeitos adictos / obesos mostran menor D2R en estriado (incluído o NAc), que están asociados con diminución da actividade basal nas rexións do cerebro frontal implicadas na atribución de salience (córtex orbitofrontal) e inhibitorio control (ACC e DLPFC), cuxa interrupción resulta en compulsividade e impulsividade. FEn realidade, tamén se están producindo probas sobre o papel dos circuítos interoceptivos e aversivos nos desequilibrios sistémicos que resultan no consumo compulsivo de drogas ou alimentos.
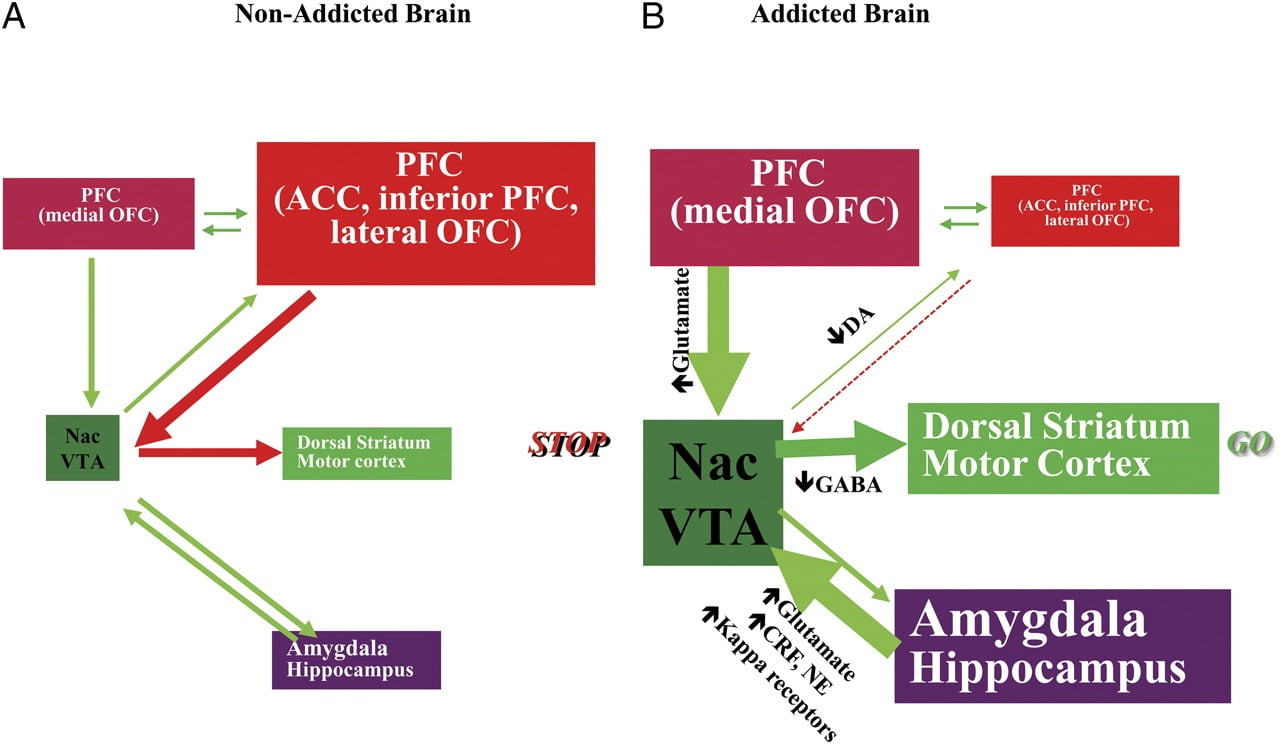
Fig 8 Modelo que propón unha rede de circuítos interactivos, interrupcións que contribúen ao complexo conxunto de comportamentos estereotipados subxacentes á toxicomanía e ao exceso de alimentos crónico: recompensa (núcleo accumbens, VTA e pallidum ventral), condicionamento / memoria (amígdala, OFC medial para a atribución de saliency, hipocampo e estriado dorsal para hábitos), control executivo (DLPFC, ACC, córtex frontal inferior e OFC lateral) motivación / impulsión (OFC medial para a atribución de saliency, ACC ventral, VTA, SN, estriado dorsal e cortiza motora). Nac, núcleo accumbens, interocepción (Insula e ACC), e aversión / evasión (Habenula). a Cando estes circuítos estean equilibrados, isto dá lugar a un control inhibitorio adecuado e á toma de decisións. b Durante a adicción, cando o valor aumentado da expectativa do fármaco nos circuítos de recompensa, motivación e memoria supera o circuíto de control, favorecendo un circuíto de feedback positivo iniciado polo consumo da droga e perpetuado pola activación mellorada da motivación / unidade. e circuítos de memoria. Estes circuítos tamén interactúan con circuítos implicados na regulación do humor, incluíndo a reactividade por tensión (que implica a amígdala, o hipotálamo, o habenula) e a interocepción (que implica o insula e o ACC e contribúe ao coñecemento do desexo). Varios neurotransmisores están implicados nestas neuroadaptacións, incluíndo glutamato, GABA, norepinefrina, factor de liberación de corticotropina e receptores de opioides. CRF, factor de liberación de corticotropina; NE, noradrenalina. Modificado con permiso de Volkow et al. (2011b)
Como consecuencia da interrupción secuencial destes circuítos, os individuos poden experimentar 1) un valor motivacional mellorado da droga / alimento (secundario a asociacións aprendidas a través de condicionamentos e hábitos) a costa doutros reforzadores (secundario á diminución da sensibilidade do circuíto de recompensa ), 2) unha capacidade deficiente para inhibir as accións intencionais (dirixidas por obxectivos) provocadas polo forte desexo de tomar a droga / alimento (secundaria á deterioración da función executiva) que resulta nunha reactividade de estrés compulsiva e 3). e evitación aversiva que resulta nunha toma de drogas impulsiva para escapar do estado aversivo.
Este modelo suxire un enfoque terapéutico multipropósito para a dependencia destinado a diminuír as propiedades reforzantes do medicamento / alimento, restablecer / mellorar as propiedades gratificantes dos reforzadores naturais, inhibir as asociacións aprendidas condicionadas, aumentar a motivación para actividades non relacionadas coa droga e diminuír a reactividade mellorar o humor e reforzar o control inhibitorio de propósito xeral.
Grazas
Os autores queren agradecer o apoio ao programa intramuros NIAAA dos Institutos Nacionais de Saúde.
References