Os informes científicos volume 9, Número do artigo: 16918 (2019)
Abstracto
O consumo excesivo de sacarosa orixina ansias como as dependencias que poden apuntalar a epidemia de obesidade. Os opioides e a dopamina median os efectos gratificantes das drogas de abuso e das recompensas naturais de estímulos como a comida saborosa. Investigamos os efectos da sacarosa usando imaxes PET con [11C] carfentanil (agonista do receptor μ-opioide) e [11Raclopruro (antagonista do receptor da dopamina D2 / 3) en sete minipigos de Göttingen anestesiados femininos. A continuación, démoslles aos minipigs acceso a solución de sacarosa durante unha hora en 12 días consecutivos e fixemos de novo imaxes 24 horas despois do acceso final a sacarosa. Nunha mostra máis pequena de cinco minipigs, realizamos un adicional [11C] sesión de PET carfentanil despois da primeira exposición a sacarosa. Calculamos os potenciais de unión entre voxel (BP)ND) empregando o cerebel como rexión de unión non desplazable, analizou as diferenzas con cartografía non paramétrica estatística e realizou unha análise rexional. Despois de 12 días de acceso a sacarosa, BPND de ambos os rastreadores diminuíron significativamente no estriato, o núcleo accumbens, o tálamo, a amígdala, a corteza cingulada e a corteza prefrontal, consistente na regulación descendente das densidades de receptores. Despois dunha única exposición á sacarosa, atopamos a unión reducida de [11C] carfentanil no núcleo accumbens e cortiza cingular, consistente na liberación de opioides. A menor dispoñibilidade de receptores de opioides e dopamina pode explicar o potencial adictivo asociado á inxestión de sacarosa.
introdución
O cinco por cento da poboación mundial é clínicamente obesa1. Como distintivo da síndrome metabólica, a obesidade está asociada a diabetes tipo 2, enfermidades cardiovasculares, problemas respiratorios e risco de depresión e posiblemente demencia.2. O aumento do consumo de alimentos densos en enerxía esaxeraba a distinción fisiolóxica entre fame homeostática que segue á privación de alimentos, e fame hedonica ou "ansia", que se produce na ausencia de privación3,4. Dado que a regulación homeostática só non pode dar conta do aumento actual da obesidade, é obrigatorio probar o efecto sobre os mecanismos cerebrais de recompensa e pracer das propiedades adictivas dos alimentos altamente agradables.
O consumo de sacarosa está asociado á obesidade, e a sacarosa considérase cada vez máis unha sustancia viciante5. Algúns descubrimentos varían con esta afirmación debido ás dificultades para separar o consumo de alimentos non agradables das respostas hedonicas e para determinar o ingrediente adictivo nos alimentos procesados, así como polos diferentes mecanismos polos que o alimento altera os circuítos cerebrais por vías naturais.6. Non obstante, en contextos específicos, a inxestión de sacarosa induce recompensas e ansias, comparables en magnitude ás inducidas por drogas adictivas, que conducen a un exceso de consumo e obesidade eventual.6,7.
A fame está asociada ao "querer" que está intimamente relacionado cos efectos da neurotransmisión dopaminérxica en varias circunstancias de recompensa.8, pero aínda non está claro como a acción da dopamina (DA) se modula en resposta a unha alimentación compulsiva. O consumo de alimentos saborosos está ligado ao "gusto", mediado principalmente polo sistema opioide endóxeno, especialmente o receptor μ-opioide (μOR)9,10, que pode promover o exceso de consumo cando se desregule. No presente informe, probamos a afirmación de que a sacarosa conduce a liberación de opioides e dopamina que reduce a dispoñibilidade de receptores de μOR e DA D2 / 3. A dispoñibilidade é un índice do número de receptores desocupados dispoñibles para a unión do trazador e, en principio, non distingue entre a ocupación de ligando e a densidade de receptores11.
A aparición dunha alimentación compulsiva depende de múltiples factores e os estudos causais en humanos plantexan cuestións éticas. A maioría dos estudos céntranse polo tanto no comportamento da alimentación nas ratas12. Aínda que as ratas teñen un "dente doce", os seus mecanismos homeostáticos importantes para o aumento de peso, o metabolismo e o tipo de acumulación de graxa, difiren significativamente dos humanos. O minipig de Göttingen é un animal omnívoro de gran tamaño cun cerebro xinecefálico ben desenvolvido, que se pode imaxinar a resolución suficiente. As súas rexións corticais subcorticales e prefrontales ben definidas13 habilitar unha tradución máis directa á función cerebral humana. Aquí, empregamos imaxes tomográficas de emisión de positrones (PET) para probar in vivo Dispoñibilidade de μOR e DA D2 / 3 nun modelo minipig de exposición subcrónica a sacarosa. Nunha mostra máis pequena, investigamos os efectos inmediatos sobre a ocupación de μOR despois da primeira exposición a sacarosa. Finalmente, probamos a relación entre os cambios na dispoñibilidade de receptores dos dous trazadores.
Resultados
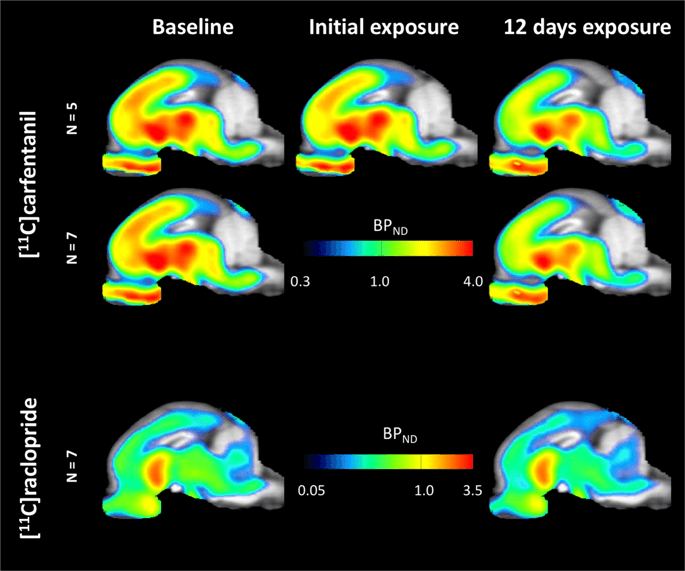
Mapas paramétricos medios de [11C] carfentanil e [11Potencial de unión ao raclopride (B)ND) móstranse na fig. 1. Analizar os cambios producidos despois da primeira exposición a sacarosa en cinco minipigs en comparación coa liña base e un día despois das 12th Acceso a sacarosa en sete minipigs en comparación coa liña base, utilizamos a teoría da permutación e a análise de cerebro enteiro non restrinxido rexionalmente, o método preferido para mostras deste tamaño.14.
Potencial medio de vinculación non-desprazable (BP)ND) mapas superpostos ás imaxes de resonancia magnética en visión sagital. Os datos preséntanse para [11C] carfentanilo BPND dos 5 minipigs que se representaron na base, despois da exposición inicial a sacarosa e despois de 12 días de exposición a sacarosa (fila superior). [11C] carfentanilo BPND de todos os 7 minipigs que se representan na base e despois de 12 días de acceso a sacarosa preséntanse na fila media. [11C] raclopride BPND de todos os 7 minipigs que se amosan na base e despois de 12 días de acceso a sacarosa móstranse na fila inferior. Teña en conta que a escala de cores é exponencial para destacar [11C] raclopride BPND en rexións extraestriais.
Exposición inicial a sacarosa
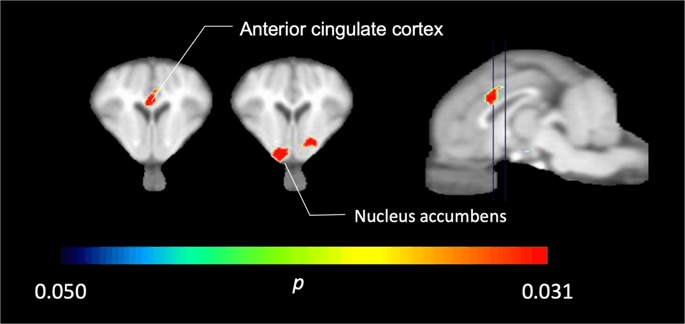
Nos cinco minipigs con [11C] carfentanil na base e inmediatamente despois da primeira exposición a sacarosa, atopamos unha unión de rastreadores significativamente reducida na córtex cingulada anterior e no núcleo accumbens en resposta á sacarosa, mostrada en cor na Fig. 2, indicando p <0.05. Detectamos ata un 14% de diminución da unión do trazador en ambas áreas en comparación coa liña base.
Descensos significativos en [11C] carfentanilo BPND despois da primeira exposición a auga a sacarosa en comparación coa liña base (n = 5). Só vocales con significativo (p <0.05) as diminucións móstranse como áreas coloreadas proxectadas en cortes de resonancia magnética T1 ponderados ao nivel da córtex cingulada anterior (esquerda) e do núcleo accumbens (medio) dun atlas cerebral minipig estereotaxico. Teña en conta que o nivel máximo de significación alcanzable con 5 animais é 2-5 ≈ 0.031 (ver barra de cores). Preséntanse datos sobre seccións coronais do cerebro de porco nos niveis indicados na imaxe sagital (dereita).
12 días de acceso a sacarosa
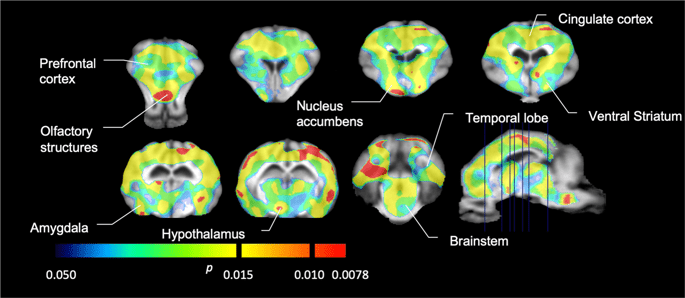
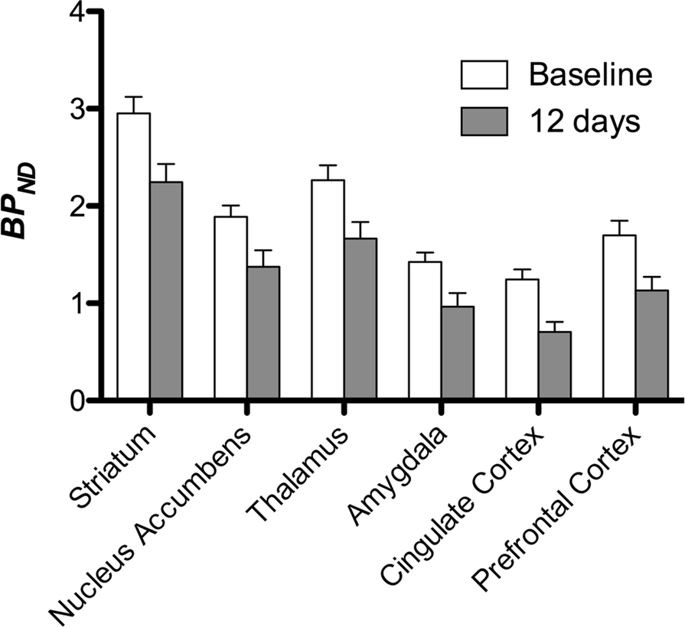
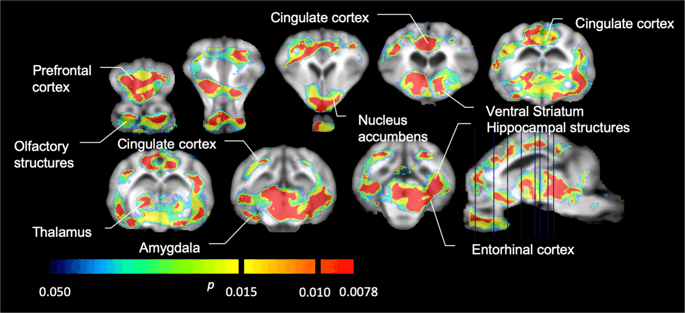
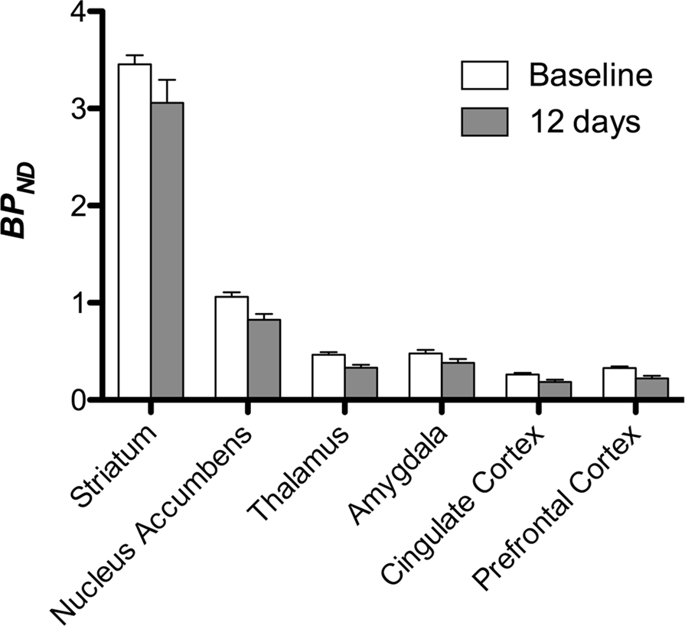
Despois realizamos a análise de sete minipigs con [11C] carfentanil na liña base e despois de 12 días de acceso a sacarosa e atopou a unión de rastreadores significativamente reducida en animais expostos a sacarosa en comparación coa liña base. As rexións máis afectadas significativamente móstranse en vermello na Fig. 3 (p <0.01) e inclúen partes das estruturas olfactivas, núcleo accumbens / estriado ventral e córtex temporal / lóbulo, seguidas de áreas mostradas en amarelo (p <0.015) que incluían partes da córtex prefrontal, córtex cingulada, amígdala e tronco cerebral . Para obter TAND valores e valoración do cambio por cento, realizamos análises rexionais e obtemos valores medios en cada rexión na base e despois do consumo de sacarosa (Fig. 4).
Descensos significativos en [11C] potencial de unión ao carfentanil (BP)ND) entre a liña base e despois de 12 días de exposición a auga a sacarosa (n = 7). As voces con significativo (p <0.05) as diminucións móstranse como áreas coloreadas proxectadas en cortes de resonancia magnética T1 ponderados dun atlas cerebral minipig estereotáxico. Os datos preséntanse sobre as seccións cerebrais coronais nos niveis indicados na imaxe sagital (abaixo á dereita). Teña en conta que o nivel máximo de significación alcanzable con 7 animais é 2-7 ≈ 0.0078 (ver barra de cores).
Usabamos [11O raclopride como o rastreador de receptores DA D2 / 3 en rexións cerebrais estriais e extrastriatais en minipigs na base e despois de 12 días de acceso a sacarosa (Fig. 1). Atopamos unha diminución da unión do trazador en animais expostos á sacarosa, en comparación coa liña de base con maiores efectos (p <0.01) en áreas da cortiza prefrontal, núcleo accumbens / estriado ventral, cortiza cingulada, amígdala, tálamo, mesencéfalo, rexións hipocampais e áreas olfactivas. (Fig. 5). Os datos da análise rexional preséntanse na Fig. 6.
Descensos significativos en [11Potencial de unión ao raclopride (B)ND) entre a liña base e despois de 12 días de exposición a auga a sacarosa (n = 7). As voces con significativo (p <0.05) as diminucións móstranse como áreas coloreadas proxectadas en cortes de resonancia magnética T1 ponderados dun atlas cerebral minipig estereotáxico. Os datos preséntanse en seccións coronais do cerebro do porco nos niveis indicados na imaxe sagital (abaixo á dereita). Teña en conta que o nivel máximo de significación alcanzable con 7 animais é 2-7 ≈ 0.0078 (ver barra de cores).
Correlacións entre [11C] raclopride e11C] datos do carfentanil
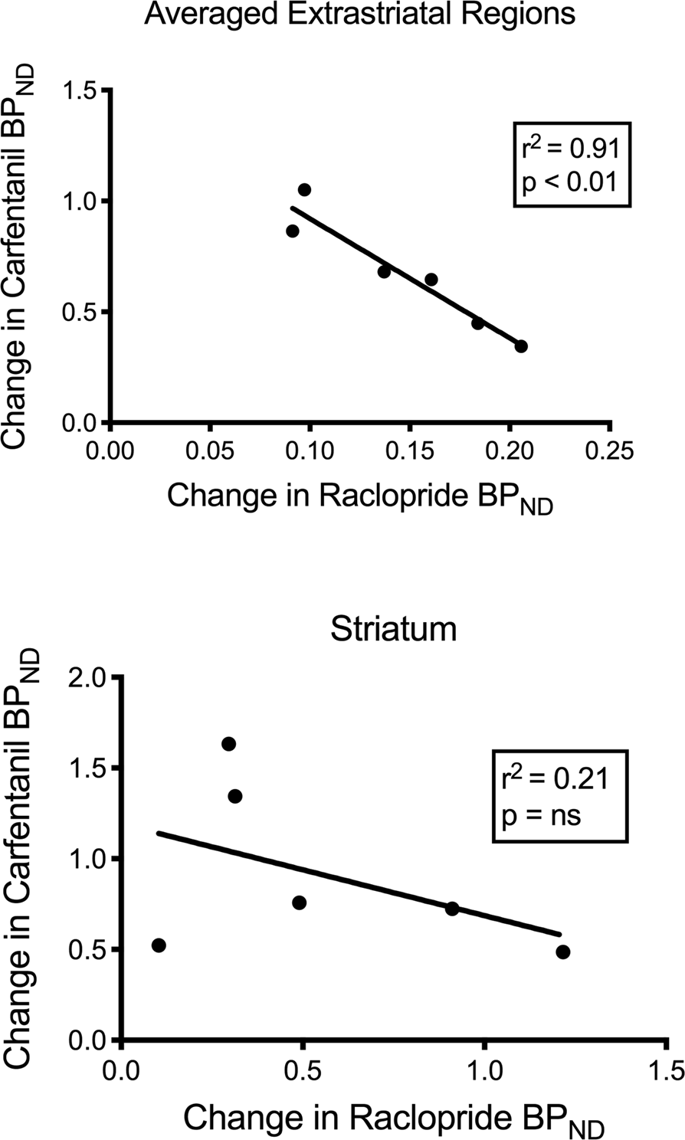
Probamos a correlación potencial entre [11C] raclopride e11C] valores do carfentanil de BPND en rexións estriais e non estriais en minipigs na base e despois de 12 días de inxestión de sacarosa, sen observacións asociadas. Despois probamos se se correlacionaron os descensos de unión de trazadores e comparamos os cambios de BPND para [11C] raclopride cos cambios de BPND para [11C] carfentanil só nos minipigs que tiñan menor BPND de ambos os rastreadores despois da inxestión de sacarosa (n = 6). Atopamos correlacións negativas significativas no extrastriatal medio (r)2 = 0.91, p <0.01), pero non nas rexións estriais (Fig. 7).
Correlacións entre descensos anteriores e post-de [11C] raclopride e11C) potenciais de unión ao carfentanil (BPND) en minipigs con diminución da unión do trazador despois da inxestión de sacarosa (n = 6). Preséntanse datos das medias rexións extratriais (superior) e estriado (inferior). O coeficiente de determinación (r2) e móstranse os valores de p para cada gráfica.
Conversa
Determinamos os efectos do acceso intermitente repetido á sacarosa sobre neurotransmisión de opioides e DA no cerebro de mamíferos. Lonxitudinal in vivo A imaxe de PET dos receptores μOR e DA D2 / 3 revelou unha dispoñibilidade reducida de receptores en todo o circuíto de recompensa, incluído o núcleo accumbens, a corteza prefrontal e a córtex cingulada anterior. Os resultados demostran claramente que a sacarosa afecta a mecanismos de recompensa dun xeito similar ao das drogas de abuso.
A inxestión de sacarosa como sustancia saborosa é coñecida para liberar DA e inducir a dependencia dos roedores15, con sacarosa que se demostra ser aínda máis agradable que a cocaína en roedores en determinados contextos. Así, os roedores traballan con máis intensidade para obter sacarosa que a cocaína, incluso a falta de privación de alimentos5. Non obstante, os efectos da sacarosa están regulados tanto polo sistema homeostático coma por circuítos de recompensa hedonica16,17 que pode mediar a distinción entre aspectos nutricionais e hedónicos da acción sacarosa18. Optamos por un horario dunha hora ao día para promover o "binging", xa que estudos anteriores en ratas demostraron unha maior achega durante a primeira hora de acceso diario nun horario intermitente.15,19. Os estudos de comportamento sobre a inxestión de alimentos adoitan dirixir a animais con restrición de alimentos, pero o deseño pode non necesariamente reflectir os mesmos mecanismos neuronais activos na obesidade. Os porcos do presente estudo non se restrinxiron aos alimentos e alimentáronse das cantidades habituais da súa dieta normal ademais do acceso á sacarosa.
Os receptores de opioides son moi expresados no cerebro, especialmente en estruturas coñecidas por modular os procesos de alimentación e recompensa20. Os ORs demostraron ser importantes nos efectos gratificantes e recaíntes da cocaína21,22,23,24. As alteracións na unión tamén estiveron relacionadas coas respostas homeostáticas ao comer e o pracer asociado cos alimentos saborosos25. En particular, o "gusto" dos alimentos está ligado ao sistema opioide endóxeno, especialmente o μOR9,10 na cuncha do núcleo accumbens e no pallidum ventral26. As infusións dun agonista μOR en distintas partes do núcleo accumbens e ventral pallidum potencian fortemente os comportamentos de "gusto", incluídas as protuberancias da lingua e o lamer pata, despois do aumento de inxestión agradable de alimentos.27,28,29. Outras evidencias para a sinalización de opioides no procesamento da regulación hedonica provén de antagonistas μOR que atenúan o consumo de chow palatable nos dous ad libitum-de animais e animais restrinxidos con alimentación, pero con un efecto máis limitado na inxestión de pellets estándar non palatables30,31. En humanos, os antagonistas μOR diminúen a inxestión de alimentos a curto prazo e reducen a grata alimentación agradable32,33,34. A sinalización de opioides na amígdala basolateral tamén contribúe a "querer" dos alimentos mediante a modulación da busca de recompensas e o valor incentivo dos alimentos35.
Con [11C] carfentanil, obtivemos imaxes de unión de rastreadores sensible tanto aos niveis de μOR como á liberación do cerebro de opioides endóxenos36,37. Detectamos a perda inmediata de dispoñibilidade de μOR en áreas do núcleo accumbens e córtex cingulado anterior, rexións cerebrais específicas da vía de recompensa, despois do consumo inicial de sacarosa por cinco minipigs, consistente na liberación de opioides endóxena. Estudos anteriores demostraron que a comida agradable pode provocar sentimentos de pracer38 ao estimular a liberación de opioides. Despois de 12 días de acceso a sacarosa, observamos que diminuíu [11C] enlace carfentanil, que pode ter varias explicacións posibles39 incluída a liberación de opioides endóxena e a unión a μOR, a internalización de μOR como resultado do aumento da unión de opioides e un aumento da activación do receptor DA D2 / 3 dando lugar á desensibilización heteróloga de μOR40.
En apoio aos resultados actuais, [11C] estudos de carfentanil a pacientes con bulimia41, obesidade42,43,44, e trastorno por alimentación coxestiva45, mostra unha diminución da dispoñibilidade de receptores. Non obstante, trátase de condicións crónicas, mentres que os minipigs só recibiron sacarosa durante 12 días. Nun estudo do comportamento de alimentación aguda en homes sans, a alimentación levou a unha liberación robusta e xeneralizada de opioides endóxenos, tanto na presenza como na ausencia de hedonia, o que suxire que a liberación de opioides reflicte respostas metabólicas e homeostáticas, así como hedonicas.25. Este estudo, xunto con outro que imaxinou aos pacientes despois dunha comida líquida con sabor a chocolate44, é directamente relevante para o estudo agudo de cinco minipigs despois da primeira exposición a sacarosa, pero é diferente do estudo de exposición a sacarosa subcrónica durante 12 días, onde a dispoñibilidade reducida de receptores reflicte máis probablemente a sobreestimulación repetida e a regulación concomitante de μOR.
A cortiza prefrontal é importante na toma de decisións e no atributo de valor aos elementos e polo tanto o μOR na córtex prefrontal pode ser responsable da avaliación alterada da carencia alimentaria, o que pode elevar o potencial adictivo dos alimentos. Atopamos unha diminución da unión na córtex prefrontal, de acordo con estudos previos que demostraron que a dieta rica en graxas reduce os niveis de ARNm μOR na cortiza prefrontal46 e esa infusión dun agonista μOR na cortiza prefrontal aumenta a inxestión de alimentos doces47. De novo, sen embargo, xorde a cuestión de que a dieta rica en graxa é unha condición máis crónica que media máis probable a regulación descendente do receptor, en comparación co deseño de alimentación con sacarosa a curto prazo, suxerindo a liberación sostida de opioides endóxenos que despraza o rastreador de carfentanil a μOR. , incluso despois de 12 días de sacarosa.
A DA implicouse en recompensas tanto por drogas como por comportamento. Atopouse o uso de cocaína crónica que inhibe a sinalización de DA48. Os niveis de receptor DA D1 e D2 / 3 son alterados pola nicotina no cerebro de porco49e en primates non humanos cunha historia de abuso de cocaína50, consistente na descenso dos receptores D2 / 3 nos cerebros dos adictos á cocaína humana51,52. En canto a drogas de abuso, demostrouse que a sacarosa regula os receptores de DA D119 e aumentar a liberación de DA53reforzando o papel da DA no "querer" en relación coa comida saborosa. Estudos anteriores de PET demostraron unha diminución na dispoñibilidade do receptor estriatal D2 / 3 na obesidade mórbida fronte ao peso medio54,55, de magnitude similar á redución de pacientes drogodependentes56, e en animais con modelos de obesidade57. Nos estudos de roedores, o derrubamento do receptor D2 / 3 no estriat promove o desenvolvemento de alimentos compulsivos que buscan en ratas con acceso a alimentos saborosos57.
As nosas observacións sobre a diminución da dispoñibilidade de receptores de D2 / 3 do porco poden indicar un aumento dos niveis de DA en resposta ao incentivo de salientabilidade asociado á inxestión de sacarosa, xa que a DA é liberada como parte do desexo de drogas de abuso e outras actividades agradables.52,58,59,60. Como os porcos foron anestesiados durante a imaxe e non recibiron sacarosa en 24 horas, a diminución de D2 / 3 BPND máis probablemente reflicte unha redución do número de receptores en resposta a un aumento prolongado da liberación de DA en cada un dos 12 días de acceso a sacarosa. A redución pode elevar os limiares de recompensa do cerebro, asociados coa regulación descendente dos receptores DA D2 estriais. Isto pode explicar a maior susceptibilidade aos fármacos de abuso vistos en estudos anteriores sobre ratas que alimentan sacarosa que provocou sensibilización cruzada á cocaína, hiperactividade despois de anfetamina de baixa dose, aumento da inxestión de alcol ao absterse de sacarosa e tolerancia aos efectos analxésicos de opiáceos.6.
Un estudo previo da obesidade no minipig de Göttingen identificou unha diminución do fluxo sanguíneo cerebral no núcleo accumbens, área tegmental ventral (VTA) e córtex prefrontal, con tomografía computarizada (SPECT) de emisión de fotóns do cerebro.61. De acordo con estes descubrimentos, observamos a unión de DA D2 / 3 reducida na rexión do ventroforebrain que contén o núcleo accumbens e na córtex prefrontal. Os niveis extracelulares de DA aumentan de 3 veces no núcleo accumbens despois da inxestión de sacarosa en ratos en movemento libre sometidos a microdiálise62. En animais dependentes de sacarosa, a inxestión repetida de sacarosa pode levar á liberación de DA da cáscara do núcleo accumbens63. Os animais alimentados cunha dieta restrinxida con acceso limitado á sacarosa tiñan un menor receptor DA D2 na unión do núcleo accumbens e no estriato dorsal.64. As dietas restrinxidas con alto contido de graxa e sacarosa poden levar á baixa regulación do ARNm do receptor D1 e D2 no núcleo accumbens65. Un estudo de microdialise sobre os efectos dos alimentos saborosos revelou un aumento da liberación de DA no núcleo accumbens e na cortiza prefrontal cando o alimento aínda era considerado novedoso; unha vez que as ratas estaban acostumadas ao novo alimento, o aumento da liberación foi contundido no núcleo accumbens, pero non na cortiza prefrontal66. A susceptibilidade diferencial á habituación e acondicionamento da actividade en dúas rexións pode explicar o aumento maior observado na cortiza prefrontal que no núcleo accumbens de minipigs expostos á mesma substancia palatable que perdeu novidade ao cabo de doce días. Non obstante, como non aparecemos minipig con [11O raclopruro despois da primeira administración de sacarosa, esta explicación é especulativa.
A corteza prefrontal modula a función executiva, a toma de decisións e o autocontrol67. A neurotransmisión DA disfuncional na cortiza prefrontal prexudica a modulación do procesamento de recompensas, o que suxire unha función executiva deficiente e habilidades para a toma de decisións en persoas obesas68,69. Ademais, un estudo PET humano correlacionou a diminución do metabolismo da corteza frontal coa diminución da unión estriatal D2 na obesidade70. Aquí atopamos unha dispoñibilidade reducida de receptores D2 / 3 na córtex prefrontal incluída a córtex orbitofrontal de porcos expostos ao réxime de sacarosa.
As neuronas dopaminérxicas do VTA envían proxeccións ao hipocampo e á amígdala, onde soportan comportamentos parecidos ao hábito71 e mediar a codificación e recuperación do condicionamento á droga72,73 e cuñas de comida74,75. A imaxe cerebral humana demostrou a activación do hipocampo en resposta á ansia e degustación de alimentos76. Coherente cos nosos resultados dunha dispoñibilidade reducida de receptores de hipocampo e amígdalar D2 / 3 en resposta a sacarosa, mapeamento de cerebro humano con [18F] Fallypride mostrou a liberación de DA inducida polo cue en amígdala e hipocampo77. Nos cerebros de roedores, a exposición a cocaína provocou a liberación de DA na amígdala78e alteracións dos niveis de DA amígdala influíron no comportamento que busca a cocaína inducida polo cu79.
Nun estudo de individuos obesos, a asociación entre as dispoñibilidades D2 / 3 e μOR, que se coñece que existe en rexións estriais de individuos magros, foi alterada no estriat ventral.80. Comparamos os valores de BPND dos dous trazadores para probar se os datos reproducían este efecto. A diferenza dos humanos magros, os cerebros actuais dos porcos non tiñan correlación entre os valores da BPND dos dous rastreadores, na base ou despois da exposición a sacarosa. A continuación, probamos se os animais con maiores descensos de unión de raclopride de rastreadores terían tamén a maior diminución da unión de carfentanil de rastreadores, pero atopamos unha correlación negativa nas rexións extra-extriatales medias, suxerindo que os animais con maior cambio do potencial de unión de O raclopride de rastrexo tivo o menor cambio do potencial de unión do carfentanil de rastrexo. A relación inversa entre os cambios suxire que os efectos da inxestión de sacarosa sobre as dispoñibilidades dos respectivos receptores están regulados en direccións opostas. Sábese que o consumo excesivo de alimentos saborosos, ou drogas, pode ser impulsado por ganas ou gustos, ou por ambos60,81. É posible que a magnitude de querer impulsado pola dopamina negue a magnitude da afección impulsada polos opioides ou viceversa. A evidencia recente apunta aos papeis do GABAA receptores no VTA e terminais colinérxicos no estriato e posiblemente a cortiza que actúan como conmutadores entre mecanismos de acción opioide dependentes da dopamina e dos dopaminos82,83 que pode explicar a reciprocidade dos efectos da dopamina e opioides en rexións extraestriais porcinas determinadas aquí.
A falta de PET, tamén en animais relativamente grandes, é a resolución espacial limitada da tomografía que afecta aos resultados das pequenas rexións cerebrais implicadas en comportamentos asociados aos alimentos. Non obstante, a pesar destas preocupacións, [11A unión do raclopruro C anteriormente rexistrouse tanto nas rexións estriatais como extrastriatales84,85,86,87. O uso de [11O raclopride C para etiquetar o mesmo tipo de receptores non preocupa as diferenzas de afinidade potenciais que poidan afectar ao uso de rastreadores separados para os mesmos receptores en diferentes rexións. Estudos recentes incluíron rexistros de unión extrastriatal de [11C] raclopride. Alakurtti et al. atopou unha boa reproducibilidade das medidas de unión de raclopride estriatal no estriato, só coa reproducibilidade boa ou moderada na córtex85. Nun estudo posterior, Svensson et al. discutiron varios temas que afectan ao uso de [11O raclopride como marcador de receptores extraestriais D2 / 3 nun estudo sobre humanos sans, incluída a mala reproducibilidade na córtex e a diminución limitada da unión extrastriatal na córtex frontal en resposta a un axente de bloqueo D2 / 3.88. As comparacións do test-test revelaron variabilidades do 4-7% no estriato e do 13-59% nas rexións corticais, pero o tempo entre os exames medía 20 días, a diferenza dos informativos 1-2 días da maioría dos estudos. Algúns factores na vida destes suxeitos poden ter tempo para influír nos achados. De feito, mostramos aquí que o simple engadido do consumo de sacarosa a unha rutina matinal durante 12 días pode ter influído en medidas vinculantes obtidas dúas semanas despois. Outros factores tan comúns como xogar a videoxogos, facer compras, entrar en novas relacións románticas e actividades sexuais, usar drogas ou cambiar a dieta e o exercicio poden influír nos niveis de dopamina extraestriatal con posibilidades de variacións de datos. O estudo actual en minipigs introduciu unha configuración ben controlada, sendo a única variable a ausencia ou a presenza de sacarosa na dieta. Neste contexto, os datos de sete animais tiñan unha variabilidade suficientemente baixa nas rexións extraestriais relevantes para identificar unha redución estatística significativamente importante da resposta á sacarosa.
Unha limitación do estudo actual é o uso de anestésicos necesarios para asegurar a inmobilidade durante in vivo imaxes de animais. Os efectos de anestésicos específicos e as súas interaccións con fármacos ou outras intervencións poden confundir a unión de radiolixios89,90. A ketamina é un fármaco antiaglutatermático con efectos antidepresivos rápidos en doses sub-anestésicas91,92,93, que non reducen o estriatal [11A unión de raclopride en humanos94. Non obstante, atopouse a S-ketamina que reduciu a dispoñibilidade de unión de receptores D2 / 3 da dopamina no estriado de primates non humanos conscientes95. O isoflurano é un anestésico común nos animais PET. En estudos anteriores, atopamos unha acumulación estriatal de [11C] SCH23390, unha radioliganda dos receptores D1 da dopamina que é significativamente maior nos minipigs anestesiados con isoflurano máis que con propofol, o que suxire a susceptibilidade da neurotransmisión dopaminérxica aos efectos da anestesia.96. No estudo actual, todos os minipigs foron representados en ambos momentos baixo premedicación con ketamina e anestesia isoflurano, facendo válidas as comparacións actuais.
Conclusión
O consumo excesivo de alimentos saborosos pode provocar e converterse na adicción con consecuencias directas para a saúde pola obesidade. Probamos a afirmación de que os opioides e a dopamina mediaban recompensas, importantes para a supervivencia e para o abuso de drogas. Os minipigs con acceso intermitente a unha solución de sacarosa durante 12 días consecutivos demostraron unha diminución da dispoñibilidade de dopamina D2 / 3 e do receptor opioide μ-opioide en rexións cerebrais estriatas e extraestriais, o que implica que os alimentos ricos en sacarosa inflúen nos circuítos de recompensa do cerebro de formas similares ás observadas cando as drogas adictivas. consúmense. A exposición inicial inicial a sacarosa foi consistente coa liberación de opioides en rexións cerebrais activas como recompensa. Os cambios de dispoñibilidade de opioides e dopamina explican o potencial adictivo da sacarosa consumida en exceso.
Materiais e Métodos
Ética animal
Este estudo foi aprobado e regulado pola Inspección Danesa de Experimentos con Animais e todos os experimentos realizáronse de acordo coa directiva 2010/63 / UE do Parlamento Europeo e do Consello sobre a protección de animais usados con fins científicos e as directrices ARRIVE. Empregamos sete minipigs de Göttingen para femia de catorce meses (Ellegaard, Dalmose, Dinamarca). Os minipigs alimentáronse cunha dieta de pellets (6 dL, 2 veces ao día, Special Diets Services, Aarhus, Dinamarca) con auga de billa dispoñible ad libitum. A temperatura ambiental foi de 20-22 ° C, a humidade relativa do 50-55% e o aire cambiaba oito veces cada hora.
Consumo intermitente de sacarosa
Imaxinamos sete minipigs con [11C] raclopride e11C] carfentanil na base, e de novo un día despois de 12 días consecutivos de exposición a auga a sacarosa. A exposición á sacarosa consistiu nunha hora de auga con sacarosa (sacarosa, Dansukker, Copenhague, Dinamarca) (500 gramos de sacarosa en 2 litros de auga), diariamente durante un período de 12 días. Gravouse a cantidade de inxestión de sacarosa e todos os minipigs consumiron 2 litros cada día. Tamén imaxinamos cinco dos mesmos minipigs con [11C] carfentanil, 30 minutos despois do primeiro acceso a sacarosa, para estudar a liberación aguda de opioides.
Os mini-porcos gañaron unha media do 13.6% de peso corporal desde 25.4 kg (± 0.73 SEM) na liña base ata 28.9 kg (± 0.69 SEM) despois da exposición a sacarosa de 12 días, que foi significativamente maior (proba t de cola única, p < 0.001) que os aumentos observados nunha mostra de mini-porcos control obtidos en estudos anteriores, onde os pesos aumentaron de media só un 4.9%, durante o mesmo período de desenvolvemento.
Imaxe PET da cerebro
Xantamos porcos durante a noite con acceso gratuíto á auga antes da imaxe. Premedicamos e anestesiamos minipigs como se describiu anteriormente97 e colocounos supinamente nun dispositivo PET / CT (Siemens Biograph 64 Truepoint PET). Realizamos unha tomografía de baixa dose antes de cada adquisición de PET para a definición anatómica e corrección de atenuación dos datos de emisión de PET. Administramos por vía intravenosa [11Raclopride C na base (360 ± 18 MBq, actividade específica 77 ± 76 GBq / μmol, masa inxectada 0.12 ± 0.08 μg / kg) e despois de 12 días de sacarosa (374 ± 54 MBq, actividade específica 127 ± 85 GBq / μmol, masa inxectada 0.06 ± 0.05 μg / kg) e [11C] carfentanil na base (377 ± 43 MBq, actividade específica 311 ± 195 GBq / μmol, masa inxectada 0.03 ± 0.02 μg / kg) e despois de 12 días de sacarosa (337 ± 71 MBq, actividade específica 177 ± 157 GBq / μmol, masa inxectada 0.06 ± 0.08 μg / kg) a través da vea do oído, en 10 ml de solución salina, durante o primeiro minuto dunha exploración de 90 minutos. Reconstruimos os datos PET utilizando TrueX 3D OSEM (3 iteracións, 21 subconxuntos), unha matriz de 256 × 256 × 109 e un filtro Gauss de 2 mm, empregando unha estrutura temporal de 5 × 60, 3 × 300, 4 × 600 , 2 × 900 segundos (en total 14 fotogramas, 90 minutos). Na liña base e despois de 12 días de sacarosa, fixéronse imaxes de minipigs con dous rastreadores inxectados polo menos a 100 minutos de distancia debido á vida media de [11C] Rastrexadores de PET. Ao finalizar a sesión PET PET, eutanasiamos minipigs baixo anestesia profunda por unha sobredose por vía intravenosa de pentobarbital (100 mg / kg).
Análises e estatísticas cuantitativas
Realizamos pasos de preprocesamento utilizando PMOD 3.7 (PMOD Technologies Ltd, Zúric, Suiza). Para definir os parámetros de transformación estereotácticos a partir de imaxes PET de media de tempo, empregáronse modelos específicos de ligando. Aplicamos as matrices de transformación xeradas e os campos de deformación nas series de tempo dinámicas correspondentes a PET. Xeramos imaxes paramétricas de [11Potencial de unión ao raclopride (B)ND) mediante o método de tecido de referencia multilineal de Ichise e compañeiros de traballo98. Creamos unha máscara personalizada do cerebelio que excluíu ao vermis para obter a radioactividade do tecido cerebelo co paso do tempo nunha rexión de densidade do receptor DA D2 / 3 insignificante. Xeramos imaxes paramétricas de [11C] carfentanil usando unha implementación do modelo de tecido de referencia de Logan99,100 con t * = 30 min. Estudos de [11A unión de carfentanil no cerebro humano usou a cortiza occipital como rexión de referencia36; con todo, no porco, segundo as curvas de actividade do tempo, a unión non desprazable foi menor no cerebelio que na córtex occipital, consistente nos resultados dun estudo de autoradiografía de ratas101. Polo tanto, seleccionamos o cerebel como rexión de referencia no estudo actual.
Análise estatística
Sometemos os mapas a unha análise de voxel-con Mapping non paramétrico estatístico (SnPM v13.01, http://warwick.ac.uk/snpm) Caixa de ferramentas SPM que usa a teoría de permutacións non paramétricas para proporcionar un marco para a inferencia estatística, un enfoque mostrado que funciona ben para pequenas mostras debido ao control estrito de falsos positivos14 e aplicouse como se describiu anteriormente102. Un experto en neuroanatomía porcina (DO) comparou as imaxes resultantes limiadas a un 5% de significación cun atlas de minipig de alta resolución de Gotinga103,104 definir e etiquetar rexións de diminución DA D2 / 3 e μOR BPND desde a liña base ata a afección post-sacarosa. Despois realizamos unha análise de rexión de interese (ROI) para extraer BPND Os valores de determinadas rexións resultaron de interese baseándose na análise SnPM, incluíndo o estriato, o núcleo accumbens, o tálamo, a amígdala, a córtex cingulada e a córtex prefrontal. Non se realizaron estatísticas adicionais na análise do ROI, xa que se comprobou que estas rexións eran significativas mediante SnPM.
References
- 1.
Smyth, S. & Heron, A. Diabetes e obesidade: as epidemias xemelgas. Nat Med 12, 75 – 80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL e Curtin, LR Prevalencia e tendencias na obesidade entre adultos dos Estados Unidos, 1999-2008. Jama 303, 235 – 241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, CA et al. Dopamina por "querer" e opioides por "gusto": unha comparación de adultos obesos con e sen comer. Obesidade (Silver Spring) 17, 1220 – 1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. A obesidade e o ambiente alimentario: densidade de enerxía e custos da dieta. Revista americana de medicina preventiva 27, 154 – 162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. e Ahmed, SH A intensa dozura supera a recompensa da cocaína. un PLoS 2, e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. e Guillem, K. In Neurociencia no século XXI (ed. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Outros desenvolvementos na neurobioloxía da alimentación e da adicción: actualización sobre o estado da ciencia. Nutrición 28, 341 – 343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M. In Praceres do Cerebro (ed. Kringelbach, ML e Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ e Bullmore, ET Da hedónica do gusto ao impulso motivacional: receptores centrais de mu-opioides e comportamento de consumo excesivo. Int J Neuropsychopharmacol 12, 995 – 1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, KC Recompensa alimentaria: substratos cerebrais de ganas e gustos. Revisións de neurociencia e bio-comportamento 20, 1 – 25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Cartografía de neurorreceptores no traballo: sobre a definición e interpretación de potenciais de unión despois de 20 anos de progreso. Int Rev Neurobiol 63, 1 – 20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME e Hoebel, BG Modelos animais de azucre e graxa: relación coa adicción á alimentación e aumento do peso corporal. Métodos Mol Biol 829, 351 – 365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Jelsing, J. et al. A córtex prefrontal no cerebro de Gottingen minipig definida por criterios de proxección neural e citoarquitectura. Brain Res Bull 70, 322 – 336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE e Holmes, AP Probas de permutación non paramétricas para a neuroimaxe funcional: un cebador con exemplos. Mapa de Hum Brain 15, 1 – 25 (2002).
- 15.
Avena, NM, Rada, P. e Hoebel, BG Evidencia da adicción ao azucre: efectos condutuais e neuroquímicos da inxestión excesiva de azucre intermitente. Revisións de neurociencia e bio-comportamento 32, 20 – 39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Alonso-Alonso, M. et al. Sistema de recompensa de alimentos: perspectivas actuais e necesidades futuras de investigación. Nutr Rev 73, 296 – 307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ e Zavosh, A. Autoadministración de sacarosa e activación do SNC na rata. Am J Physiol Regul Integr Comp Physiol 300, R876-884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA et al. Circuítos separados codifican os valores hedónicos e nutricionais do azucre. Neurociencia da natureza 19, 465 – 470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Colantuoni, C. et al. A inxestión excesiva de azucre altera a unión aos receptores de dopamina e mu-opioides no cerebro. Neuroreport 12, 3549 – 3552 (2001).
- 20.
Pert, CB, Kuhar, MJ e Snyder, receptor de opiáceos SH: localización autoradiográfica no cerebro da rata. Proc Natl Acad Sci Estados Unidos 73, 3729 – 3733 (1976).
- 21.
Soderman, AR e Unterwald, EM Recompensa de cocaína e hiperactividade na rata: sitios de modulación do receptor opioide mu. Neurociencia 154, 1506 – 1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ e Roberts, DC A beta-funaltrexamina afecta a autoadministración de cocaína en ratas que responden nun programa progresivo de reforzo. Farmacoloxía, bioquímica e comportamento 75, 301 – 307 (2003).
- 23.
Schroeder, JA et al. Un papel para os receptores de opioides na actividade inducida pola cocaína, sensibilización e recompensa na rata. Psychopharmacology 195, 265 – 272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. e Kalivas, PW O restablecemento inducido pola cocaína require unha estimulación endóxena dos receptores mu-opioides no pálido ventral. The Journal of Neuroscience: o diario oficial da Society for Neuroscience 25, 4512 – 4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ et al. A alimentación libera os opioides endóxenos nos humanos. J Neurosci 37, 8284 – 8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS e Berridge, KC Circuíto límbico opioide para recompensa: interacción entre os puntos quentes hedónicos do núcleo accumbens e o pallidum ventral. J Neurosci 27, 1594 – 1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. e Berridge, KC O sitio de opioides no núcleo accumbens media a comida e o "gusto" hedónico pola comida: mapa baseado en plumas Fos de microinxección. Brain Res 863, 71 – 86 (2000).
- 28.
Zhang, M. e Kelley, AE A inxestión de solucións de sacarina, sal e etanol increméntase mediante a infusión dun agonista opioide mu no núcleo accumbens. Psychopharmacology 159, 415 – 423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA e Kelley, AE A inxestión de alimentos ricos en graxas aumenta selectivamente mediante a estimulación do receptor de opioides mu dentro do núcleo accumbens. Revista de farmacoloxía e terapéutica experimental 285, 908 – 914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP e Billington, CJ A naloxona bloquea esa porción de alimentación impulsada polo sabor doce en ratas con restrición alimentaria. Am J Physiol 268, R248-252 (1995).
- 31.
Glass, MJ, Billington, CJ e Levine, AS Opioides e inxestión de alimentos: vías neuronais funcionais distribuídas? Neuropéptidos 33, 360 – 368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. e Apfelbaum, M. Un antagonista dos opioides, a naltrexona, reduce a preferencia pola sacarosa nos humanos. Am J Physiol 251, R91-96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ e Levine, AS O efecto da naltrexona no limiar de detección e recoñecemento do gusto. Apetito 32, 241 – 249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. e Gosnell, BA A naloxona, un bloqueador de opiáceos, reduce o consumo de alimentos doces ricos en graxas en mulleres obesas e magras. Am J Clin Nutr 61, 1206 – 1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW Os distintos circuítos opioides determinan a sabor e a conveniencia de eventos gratificantes. Proc Natl Acad Sci Estados Unidos 106, 12512 – 12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Colasanti, A. et al. Liberación de opioides endóxeno no sistema de recompensa do cerebro humano inducido pola administración de anfetamina aguda. Bioloxía de psiquiatría 72, 371 – 377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Mick, eu et al. A liberación de opioides endóxeno endoxeno inducido pola amfetamina no cerebro humano detectado con PET 11 carfentanil: replicación nunha cohorte independente. Int J Neuropsychopharmacol, 1 – 6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Gray, péptidos opioides RW e control do comportamento inxestivo humano. Revisións de neurociencia e bio-comportamento 26, 713 – 728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. & Tolle, TR Que aprender de in vivo imaxe cerebral opioidérxica? Eur J Pain 9, 117 – 121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM e Cuntapay, M. Interaccións dopamina-opioides no estriado da rata: un papel modulador dos receptores D1 de dopamina na transducción de sinais mediada por receptores de opioides delta. Neurofarmacoloxía 39, 372 – 381 (2000).
- 41.
Bencherif, B. et al. A unión do receptor mu-opioide rexional na cortiza insular diminúe na bulimia nervosa e correlaciona inversamente co comportamento do xaxún. Revista de medicina nuclear: publicación oficial, Society of Nuclear Medicine 46, 1349 – 1351 (2005).
- 42.
Karlsson, HK et al. A obesidade está asociada coa diminución da dispoñibilidade do receptor dopamínico D2 mu-opioide pero non alterado no cerebro. J Neurosci 35, 3959 – 3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Karlsson, HK et al. A perda de peso despois da cirurxía bariátrica normaliza os receptores de opioides cerebrais na obesidade mórbida. Mol Psiquiatría 21, 1057 – 1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF e Zubieta, JK Os mecanismos opioides endóxenos están implicados na obesidade e na perda de peso en humanos. J Clin Endocrinol Metab 100, 3193 – 3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Majuri, J. et al. Neurotransmisión de dopamina e opioides en adiccións ao comportamento: un estudo PET comparativo en xogos patolóxicos e comidas por excitación. Neuropsicopharmacoloxía 42, 1169 – 1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM A dieta crónica con moito contido de graxa impulsa a regulación epixenética postnatal do receptor mu-opioide no cerebro. Neuropsicofarmacoloxía: publicación oficial do Colexio Americano de Neuropsicofarmacoloxía 36, 1199 – 1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. e Baldo, BA Indución de hiperfagia e inxestión de hidratos de carbono por estimulación do receptor mu-opioide en rexións circunscritas da cortiza frontal. The Journal of Neuroscience: o diario oficial da Society for Neuroscience 31, 3249 – 3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. A cocaína crónica amortece a sinalización de dopamina durante a intoxicación por cocaína e desequilibra a sinalización do receptor D1 sobre a receptor D2. The Journal of Neuroscience: o diario oficial da Society for Neuroscience 33, 15827 – 15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Cumming, P. et al. Efectos da nicotina aguda na hemodinámica e unión do raclopride [11C] aos receptores da dopamina D2,3 no cerebro de porco. Neuroimage 19, 1127 – 1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ e Friedman, DP Efecto da autoadministración de cocaína sobre os receptores D2 de dopamina en monos rhesus. Sinapse 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND et al. Cocaína e dopamina no estriat dorsal: mecanismo de ansia na adicción á cocaína. The Journal of Neuroscience: o diario oficial da Society for Neuroscience 26, 6583 – 6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Wong, DF et al. Aumento da ocupación de receptores de dopamina no estriato humano durante a ansia de cocaína provocada por cue. Neuropsicopharmacoloxía 31, 2716 – 2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP e Norgren, R. A estimulación oral da sacarosa aumenta a dopamina accumbens na rata. Am J Physiol Regul Integr Comp Physiol 286, R31-37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. e Telang, F. Imaxinando o papel da dopamina no abuso e adicción ás drogas. Neurofarmacoloxía 56(Suplemento 1), 3-8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Wang, GJ et al. Dopamina cerebral e obesidade. Lanceta 357, 354 – 357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK e Fowler, JS Semellanza entre a obesidade e a adicción ás drogas segundo a avaliación da imaxe neurofuncional: unha revisión do concepto. Revista de enfermidades adictivas 23, 39 – 53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM e Kenny, receptores P2 de dopamina DXNUMX en disfunción de recompensa similar á adicción e alimentación compulsiva en ratas obesas. Neurociencia da natureza 13, 635 – 641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC e Kringelbach, ML Neurociencia afectiva do pracer: recompensa en humanos e animais. Psychopharmacology 199, 457 – 480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC e Kringelbach, ML Sistemas de pracer no cerebro. Neurona 86, 646 – 664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. Sinal de recompensa preditiva das neuronas dopaminas. J Neurofisíol 80, 1 – 27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. e Malbert, CH Cambios na actividade cerebral despois dunha obesidade inducida pola dieta. Obesidade 19, 749 – 756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. e Norgren, R. Mecanismos de dopamina Accumbens na inxestión de sacarosa. Brain Res 904, 76 – 84 (2001).
- 63.
Rada, P., Avena, NM e Hoebel, BG O consumo diario de azucre libera repetidamente dopamina no caparazón accumbens. Neurociencia 134, 737 – 744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR e Hajnal, A. O acceso repetido á sacarosa inflúe na densidade do receptor de dopamina D2 no estriado. Neuroreport 13, 1575 – 1578 (2002).
- 65.
Alsio, J. et al. A expresión xénica do receptor da dopamina D1 diminúe no núcleo acumbens á exposición a longo prazo a alimentos saborosos e difire en función do fenotipo de obesidade inducida pola dieta nas ratas. Neurociencia 171, 779 – 787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. e Di Chiara, G. Influencia diferencial dos mecanismos de aprendizaxe asociativa e non asociativa na capacidade de resposta da transmisión de dopamina prefrontal e acumbal aos estímulos alimentarios en ratas alimentadas ad libitum. J Neurosci 17, 851 – 861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Circuítos neuronais desequilibrados na adicción. Curr Opin Neurobiol 23, 639 – 648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. e Pignatti, R. Anorexia, bulimia e obesidade: déficits de toma de decisións compartidos na Iowa Gambling Task (IGT). J Int Neuropsychol Soc 16, 711 – 715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. e Kennedy, JL Déficits de toma de decisións e alimentación excesiva: un modelo de risco para a obesidade. Obes Res 12, 929 – 935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND et al. Os receptores D2 estriatal de dopamina baixa están asociados ao metabolismo prefrontal en suxestos obesos: posibles factores que contribúen. Neuroimage 42, 1537 – 1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW e Balleine, BW O núcleo central da amígdala interactúa co estriado dorsolateral para regular a adquisición de hábitos. J Neurosci 32, 1073 – 1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Subvención, S. et al. Activación de circuítos de memoria durante a ansia de cocaína. Proc Natl Acad Sci Estados Unidos 93, 12040 – 12045 (1996).
- 73.
Childress, AR et al. Activación límbica durante a ansia de cocaína inducida por un cu. Am J Psiquiatría 156, 11 – 18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV e Berridge, KC Que e cando "querer"? Enfoque baseado en amígdala, que inclúe incentivos sobre o azucre e o sexo. Psychopharmacology 221, 407 – 426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF & Volkow, ND Neurobioloxía da adicción: unha análise de neurocircuitismo. Psiquiatría de Lancet 3, 760 – 773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. Activación cortical en resposta a estímulos gustativos puros durante os estados fisiolóxicos de fame e saciedade. Neuroimage 44, 1008 – 1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Fotos, A. et al. Liberación de dopamina inducida pola cocaína en amígdala e hipocampo: un estudo de PET de alta resolución ([1) (8) F] fallypride en participantes dependentes de cocaína. Neuropsicopharmacoloxía 38, 1780 – 1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. et al. Control do comportamento que busca a cocaína por estímulos asociados a fármacos en ratas: efectos sobre a recuperación de niveis de dopamina extrapelados e de dopamina extraxelular en amígdala e nucleo accumbens. Proc Natl Acad Sci Estados Unidos 97, 4321 – 4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Dopamina D1 ou antagonismo dos receptores D2 dentro da amígdala basolateral altera diferencialmente a adquisición de asociacións de cocaína necesarias para o restablecemento inducido por cue para a busca de cocaína. Neurociencia 137, 699 – 706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Tuominen, L. et al. Interacción dopamina-opiáceos mesolimbic aberrante na obesidade. Neuroimage 122, 80 – 86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Schultz, W. Sinais de dopamina comportamental. Tendencias Neurosci 30, 203 – 210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR e van der Kooy, D. A neurobioloxía da motivación dos opiáceos. Cold Spring Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. e Ford, CP Regulación do receptor nicotínico e opioide da transmisión mediada polo receptor D2 da dopamina estriada. Rep. Sci 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Nomura, Y. et al. Descenso relacionado coa idade da dispoñibilidade do receptor da dopamina D2 / 3 medido con raclopride [C-11] en rexións do cerebro humano non estriatais: Comparación de catro métodos. Neuroimage 41, T133 – T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Alakurtti, K. et al. Fiabilidade a proba a longo prazo da unión do receptor D2 / 3 de dopamina estriatal e extraestriatal: estuda con [(11) C] clorclruro e PET de alta resolución. J Cereb Blood Flow Metab 35, 1199 – 1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ Liberación endóxena de dopamina despois de desafíos farmacolóxicos na enfermidade de Parkinson. Ann Neurol 53, 647 – 653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Sawamoto, N. et al. Déficits cognitivos e liberación de dopamina estriato-frontal na enfermidade de Parkinson. Cerebro 131, 1294 – 1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE et al. Validez e fiabilidade da cuantificación de raclopride extrastriatal [(11) C] no cerebro humano vivo. Neuroimage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Tsukada, H. et al. A anestesia por isoflurano aumenta os efectos inhibidores da cocaína e GBR12909 no transportador de dopamina: estudos de PET en combinación con microdiálise no cerebro mono. Brain Res 849, 85 – 96 (1999).
- 90.
Hassoun, W. et al. Estudo PET da unión do raclopride [11C] no estriato do gato esperto: efectos dos anestésicos e papel do fluxo sanguíneo cerebral. Revista europea de medicina nuclear e imaxe molecular 30, 141 – 148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. e Amore, M. O papel da ketamina na depresión resistente ao tratamento: unha revisión sistemática. Curr Neuropharmacol 12, 444 – 461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Berman, RM et al. Efectos antidepresivos da cetamina en pacientes con depresión. Bioloxía de psiquiatría 47, 351 – 354 (2000).
- 93.
Browne, CA e Lucki, I. Efectos antidepresivos da ketamina: mecanismos subxacentes aos novos antidepresivos de acción rápida. Front Pharmacol 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Aalto, S. et al. A cetamina non diminúe a unión do receptor D2 da dopamina estriatal no home. Psychopharmacology 164, 401 – 406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. e Tsukada, H. Redución da unión do receptor D2 / 3 de dopamina no estriado despois dunha única administración de esketamina, pero non R-ketamina: un PET estudo en monos conscientes. Eur Arch Psychiatry Clin Neurosci 267, 173 – 176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Alstrup, AK et al. Efectos da anestesia e das especies na captación ou unión de radiolixios in vivo no minipig de Göttingen. BioMed investigación internacional 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP et al. Imaxe PET monoaminérxica lonxitudinal da inhibición do proteasoma crónico en minipigs. Rep. Sci 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB e Carson, RE Estratexias para mellorar a estimación dos parámetros dos neurorreceptores mediante análise de regresión lineal. J Cereb Blood Flow Metab 22, 1271 – 1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Logan, J. et al. Relacións de volume de distribución sen toma de sangue a partir da análise gráfica de datos PET. J Cereb Blood Flow Metab 16, 834 – 840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Cuantificación de receptores mu-opioides cerebrais con [11C] carfentanil: métodos de referencia nos tecidos. Nucl Med Biol 30, 177 – 186 (2003).
- 101.
Panksepp, J. & Bishop, P. Un mapa autoradiográfico de (3H) unión á diprenorfina no cerebro da rata: efectos da interacción social. Brain Res Bull 7, 405 – 410 (1981).
- 102.
Landau, AM et al. A estimulación electroconvulsiva afecta de xeito diferente [(11) C] MDL 100,907 que se une a receptores corticos e subcorticais 5HT2A do cerebro porcino J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH e Palomero-Gallagher, N. O telencéfalo do minipig de Gottingen, citoarquitectura e anatomía da superficie cortical. Función de estrutura cerebral 222, 2093 – 2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH e Bjarkam, CR Atlas histolóxico en liña do cerebro de minipig de Gottingen. Heliyon 5, e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Grazas
Unha universidade de Aarhus "Subvención de Proxecto de Ideas da UA" para AML financiado o estudo. Agradecemos o apoio técnico do persoal do Centro de PET do Hospital Universitario de Aarhus e da Facenda da Universidade de Aarhus para axudar co tratamento dos animais. Agradecemos ao profesor Morten Kringelbach, ao profesor Jørgen Scheel-Kruger e ao profesor asociado Arne Møller a axuda para a iniciación destes estudos.
Declaracións de ética
Conflito de intereses
Os autores non declaran intereses en competencia.
Información adicional
Nota do editor Natureza Springer permanece neutral respecto das reclamacións xurisdicionais en mapas publicados e afiliacións institucionais.
Dereitos e permisos
Abre o Access Este artigo está licenciado baixo unha licenza Internacional de Creative Commons recoñecemento 4.0, que permite o uso, o uso compartido, a adaptación, a distribución e a reprodución en calquera soporte ou formato, sempre que concedas o crédito apropiado aos autores e fontes orixinais. ligazón á licenza Creative Commons e indique se se realizaron cambios. As imaxes ou outro material de terceiros deste artigo inclúense na licenza Creative Commons do artigo, a non ser que se indique o contrario nunha liña de crédito do material. Se o material non está incluído na licenza Creative Commons do artigo e o seu uso previsto non está permitido pola regulación legal ou supera o uso permitido, necesitará obter o permiso directamente do titular do copyright. Para ver unha copia desta licenza, visite http://creativecommons.org/licenses/by/4.0/.