Dialogi Clin Neurosci. 2013 Dec;15(4):431-43.
Anotācija
Neskatoties uz daudzu psihosociālu faktoru nozīmi, narkomānijas pamatā ir bioloģisks process: iespēja atkārtoti pakļauties ļaunprātīgas izmantošanas narkotikām, lai izraisītu izmaiņas neaizsargātās smadzenēs, kas vada kompulsīvo meklēšanu un narkotiku lietošanu un kontroles zaudēšanu. narkotiku lietošanu, kas nosaka atkarības stāvokli. Šeit mēs aplūkojam molekulāro un šūnu adaptāciju veidus, kas notiek konkrētos smadzeņu reģionos, lai starpniekotu ar atkarību saistītās uzvedības novirzes. Tie ietver gēnu ekspresijas izmaiņas, kas daļēji panāktas ar epigenetiskiem mehānismiem, neironu un sinapšu neirofizioloģiskās funkcionēšanas plastiskumu un ar to saistīto plastiskumu neironu un sinaptiskā morfoloģijā, ko daļēji veicina neirotrofiskā faktora signalizācija. Katru no šiem narkotiku izraisīto modifikāciju veidiem var uzskatīt par “šūnu vai molekulāro atmiņu”. Turklāt ir pārsteidzoši, ka lielākā daļa ar atkarību saistīto plastiskuma formu ir ļoti līdzīgas plastiskuma veidiem, kas ir saistīti ar klasiskākām "uzvedības atmiņas" formām, kas, iespējams, atspoguļo neironiem pieejamo adaptīvo mehānismu ierobežoto repertuāru, saskaroties ar apkārtējo vidi. problēmas. Visbeidzot, ar atkarību saistītās molekulārās un šūnu pielāgošanās ietver lielāko daļu to pašu smadzeņu reģionu, kas veicina klasiskākas atmiņas formas, saskaņā ar viedokli, ka patoloģiskas atmiņas ir svarīgi atkarības sindroma virzītājspēki. Šo pētījumu mērķis, kuru mērķis ir izskaidrot narkomānijas molekulāro un šūnu bāzi, ir izstrādāt bioloģiski pamatotus diagnostikas testus, kā arī efektīvāku atkarības traucējumu ārstēšanu.
Ievads
Narkotiku atkarība, ko var definēt kā kompulsīvu meklēšanu un narkotiku lietošanu, neskatoties uz briesmīgām sekām vai narkotiku lietošanas kontroles zaudēšanu, izraisa ilgstošas narkotiku izraisītas izmaiņas, kas rodas dažos smadzeņu reģionos.1 Tomēr tikai daži cilvēki atkārtojas atkarībai no atkārtotas iedarbības uz narkotikām, bet citi spēj lietot narkotiku nejauši un izvairīties no atkarības sindroma. Ģenētiskie faktori veido aptuveni 50% no šīs individuālās atkarības atkarības ievainojamības pakāpes, un šis pārmantojamības pakāpe attiecas uz visām galvenajām atkarību izraisošo zāļu klasēm, ieskaitot stimulantus, opiātus, alkoholu, nikotīnu un kannabinoīdus..2 Vēl nav bijis iespējams identificēt lielāko daļu gēnu, kas ietver šo ģenētisko risku, iespējams, tāpēc, ka varbūt ir iesaistīti simtiem ģenētisko variāciju, kas summējas vienā indivīdā, lai piešķirtu atkarības ievainojamību (vai citās personām - rezistenci).
Pārējie 50% atkarības riska ir saistīti ar daudziem vides faktoriem, kas rodas visā dzīves laikā, kas mijiedarbojas ar indivīda ģenētisko sastāvu, lai viņu lielākā vai mazākā mērā padarītu neaizsargātu pret atkarību. Atkarībā ir iesaistīti vairāki vides faktoru veidi, tostarp psihosociālie stresi, taču visspēcīgākais faktors ir pati narkotisko vielu iedarbība. Ir pierādīts, ka dažas “vārtejas” narkotikas, it īpaši nikotīns, palielina neaizsargātību pret atkarību no citām narkotikām.3 Turklāt ir arvien vairāk pierādījumu tam, ka, neraugoties uz dažādiem ģenētiskajiem riskiem, kas saistīti ar atkarību visā populācijā, pietiekami lielas zāļu devas ilgstošas iedarbības laikā var pārvērst kādu, kam ir relatīvi zemāka ģenētiskā slodze, atkarīgajam..4
Pēdējo divu desmitgažu laikā ir panākts liels progress, nosakot gan atsevišķus smadzeņu reģionus, kas ir svarīgi atkarības sindroma starpniecībā, gan pārmaiņu veidus molekulārajos un šūnu līmeņos, kas narkotikām šajos reģionos izraisa pamataspektus. atkarību.1,5 Vislielāko uzmanību saņēmušo ķēdi sauc par mezolimbisko dopamīna sistēmu, kas ietver dopamīna neironus vidus smadzeņu vidējā smadzeņu kodējošā vidē (VTA) kodola accumbens vidē (NAc, ventrālā striatuma daļa). Šie VTA neironi arī iedzīst daudzus citus priekšdziedzera reģionus, tostarp hipokampus, amygdalu un prefrontālo garozu (PFC).
Ir lietderīgi apsvērt šos narkotiku izraisītos atkarības mehānismus šajā apjomā atmiņā trīs iemeslu dēļ.6
- Pirmkārt, visas narkotiku izraisītās adaptācijas var uzskatīt par “molekulārās vai šūnu atmiņas tipiem”: nervu šūnas, kas tiek pakļautas šādām izmaiņām, ir atšķirīgas zāļu iedarbības dēļ un tādējādi atšķirīgi reaģē uz to pašu narkotiku, citām narkotikām vai daudziem citiem stimuliem.
- Otrkārt, ir interesanti, ka daudzi, varbūt lielākā daļa, no izmaiņu veidiem, kas ir saistīti ar atkarības stāvokli (piemēram, mainīts gēnu transkripcija, epigenetika, sinaptiskā un pilnšūnu plastiskums, neironu morfoloģija un neirotrofiskie mehānismi) ir iesaistītas arī tradicionālās „uzvedības atmiņas” formās, piemēram, telpiskā atmiņa, bailes kondicionēšana un operanta kondicionēšana.
- Treškārt, starp smadzeņu reģioniem, kurus skārusi narkotiku lietošana, ir tie, kas ir galvenie neirālie substrāti uzvedības atmiņai, tostarp hipokamps, amygdala un PFC. Tas sakrīt ar pieaugošo izpratni par to, ka dažas no klīniski nozīmīgām atkarības pazīmēm (piemēram, narkotiku tieksme un recidīvs) atspoguļo novirzes tradicionālajās atmiņas ķēdēs, ar ilgtermiņa atmiņām par zāļu pieredzi, kas kalpo par spēcīgiem atkarības patoloģijas virzītājspēkiem.4,7,8 Un otrādi, smadzeņu atalgojuma reģioni (piemēram, VTA un NAc) spēcīgi ietekmē uzvedības atmiņu.
Šajā rakstā sniegts pārskats par galvenajiem molekulāro un šūnu izmaiņu veidiem, kas rodas vairākos smadzeņu reģionos atkarības dzīvnieku modeļos, koncentrējoties uz kodoliem, kuriem pašlaik ir pieejama lielākā daļa informācijas. Svarīgi, ka, balstoties uz pēcdzemdību smadzeņu pētījumiem, arvien vairāk ir bijis iespējams apstiprināt dažas no šīm cilvēku atkarību ietekmējošām personām. Neskatoties uz to, ka ļaunprātīgas izmantošanas narkotikām ir atšķirīgas ķīmiskās struktūras un tie darbojas ar atšķirīgiem olbaltumvielu mērķiem, ir pārsteidzoši, ka daudzi nozīmīgi atkarību izraisoši pielāgojumi ir kopīgi daudziem un dažos gadījumos visiem ļaunprātīgas lietošanas narkotikām un, iespējams, veicina kopīgas iezīmes. atkarības sindroms.4,9 Turpretim daudzas citas narkotiku izraisītas adaptācijas ir specifiskas konkrētai zālēm un var būt par pamatu vairākām unikālām atkarības īpašībām. Šeit mēs pievēršam uzmanību ļaunprātīgas izmantošanas stimulējošām un opiātu zālēm, kas rada dramatiskāku ietekmi uz dzīvnieku modeļiem salīdzinājumā ar citām zālēm. Mēs arī izceļam svarīgas jomas nākotnes pētījumiem, kas vēl vairāk palielinās mūsu zināšanas par atkarības sindromiem un pārvērš šos sasniegumus uzlabotos diagnostikas testos un ārstēs.
Transkripcijas un epigenetiskie mehānismi
Zināšanas, ka narkomāni var saglabāties paaugstināts recidīvu risks, neraugoties uz abstinences gadiem, nozīmē, ka atkarība ir saistīta ar narkotiku izraisītajām izmaiņām smadzenēs, kas var būt ļoti stabilas. Tā rezultātā vairākas grupas ir apsvērušas izmaiņas gēnu ekspresijā kā nozīmīgu atkarības procesa sastāvdaļu (Skaitlis 1). Attiecīgi, pētījumi par kandidātu gēniem vai genoma mēroga pētījumiem, kuros iesaistītas DNS mikroskopijas un vēl nesen - RNS-seq (izteiktu RNS augstas caurlaidības secība) ir identificējis daudzus gēnus, kuru ekspresija ir mainīta noteiktā smadzeņu apgabalā ar grauzēju un primātu atkarības modeļiem un cilvēkiem, kuri ir atkarīgi no cilvēkiem (piem., 10-17). Šādu gēnu piemēri ir aplūkoti turpmākajās šīs pārskatīšanas sadaļās.
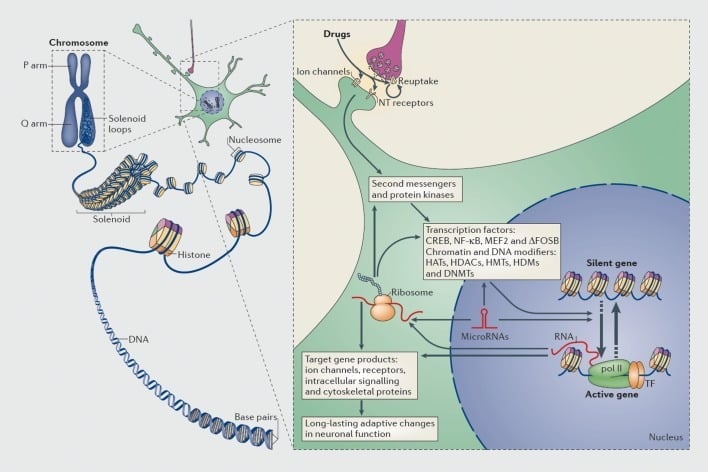
Transkripcijas un epigenetiskās regulēšanas mehānismi ļaunprātīgas izmantošanas dēļ. Eukariotiskajās šūnās DNS tiek organizēta, iesaiņojot ap histonu oktomērus, veidojot nukleozomas, kas pēc tam tiek organizētas un kondensētas, veidojot hromosomas (kreisā daļa). Tikai, īslaicīgi atdalot saspiestu hromatīnu, specifiskā gēna DNS var padarīt pieejamu transkripcijas iekārtai. Ļaunprātīgas iedarbības līdzekļi darbojas, izmantojot sinaptiskus mērķus, piemēram, atpakaļsaistes mehānismus, jonu kanālus un neirotransmitera (NT) receptorus, lai mainītu intracelulāros signālu kaskādes (labā daļa). Tas noved pie transkripcijas faktoru (TF) un daudzu citu kodoliekārtu, tostarp hromatīnu regulējošo olbaltumvielu (ar biezām bultiņām), aktivācijas vai inhibīcijas; detalizēti mehānismi, kas iesaistīti hromatīnu regulējošo proteīnu sinaptiskajā regulēšanā, joprojām ir vāji saprotami. Šie procesi galu galā noved pie konkrētu gēnu indukcijas vai represijas, tostarp tiem, kas nav kodēti RNS, piemēram, mikroRNS; dažu šo gēnu izmainītā ekspresija savukārt var regulēt gēnu transkripciju. Tiek ierosināts, ka dažas no šīm narkotiku izraisītajām izmaiņām hromatīna līmenī ir ārkārtīgi stabilas un tādējādi ir pamatā ilgstošai uzvedībai, kas nosaka atkarību. CREB, cikliska AMP reaģējoša elementa saistīšanās proteīns; DNMT, DNS metiltransferāzes; HAT, histona acetiltransferāzes; HDAC, histona dezacetilāzes; HDM, histona demetilāzes; HMT, histona metiltransferāzes; MEF2, specifisks pastiprinātāja faktors 2; NF-kB, kodolfaktoru-KB; pol II, RNS polimerāze II. Atkārtots no ref 44: Robison AJ, Nestler EJ. Atkarības transkripcijas un epigenetiskie mehānismi. Nat Rev Neurosci. 2011: 12: 623-637.
Tāpat daudzu veidu transkripcijas faktori - olbaltumvielas, kas saistās ar gēnu regulējošajiem reģioniem un tādējādi palielina vai samazina šo gēnu transkripciju - ir bijuši iesaistīti medikamenta ļaunprātīgas lietošanas ilgtermiņa seku izplatīšanā uz gēnu ekspresiju smadzenēs. Daži citi piemēri ir CREB (cAMP atbildes elementa saistošais proteīns), ΔFosB (Fos ģimenes transkripcijas faktors), NFkB (kodolfaktoru kB), MEF2 (miocītu pastiprinošā faktora-2) un glikokortikoīdu receptori.5,10,18-22 Aizvien vairāk ir bijis iespējams saprast šūnu signālu ceļus, pa kuriem ļaunprātīgas narkotikas aktivizē noteiktu transkripcijas faktoru smadzenēs, un cēloņsakarībā saistīt šādu aktivāciju ar šī transkripcijas faktora mērķa gēniem un īpašiem atkarības uzvedības aspektiem (sk. Attēls 1). Šo progresu ilustrē CREB un ΔFosB, kas ir vislabāk pētīti transkripcijas faktori atkarības modeļos.
cAMP atbildes elementa saistošais proteīns
Aktivizē stimulējošas un opiātu narkotikas CREB vairākos smadzeņu reģionos, kas ir svarīgi atkarībai, tostarp pamanāms NAc.23,24 CREB ir zināms, ka tā tiek aktivizēta citās sistēmās, izmantojot cAMP, Ca2+un augšanas faktora ceļi,25 un vēl nav zināms, kurš no šiem mediatoriem izraisa ļaunprātīgas lietošanas narkotiku lietošanu NAc. Ir pierādīts, ka CREB narkotiku aktivizēšana NAc ir klasisks negatīvas atgriezeniskās saites mehānisms, ar to CREB kalpo, lai samazinātu dzīvnieka jutīgumu pret šo zāļu atalgojošo iedarbību (tolerance) un izraisītu negatīvu emocionālo stāvokli zāļu lietošanas laikā (atkarība)..18,26,27 Šīs blakusparādības nesen tika pierādītas, lai palielinātu narkotiku pašregulāciju un recidīvu, iespējams, izmantojot negatīvu pastiprinājumu.28 Šīs CREB darbības, šķiet, ir saistītas ar abiem galvenajiem NAc vidējo smadzeņu neironu apakštipiem, tiem, kas ekspresē galvenokārt D1 pret D2 dopamīna receptoriem.24 Ineapšaubāmi, liels skaits literatūras ir parādījuši, ka CREB, kas darbojas hipokampā un amigdalā, ir galvenā molekula uzvedības atmiņā..29-31 Šī plašā loma atkarības un uzvedības atmiņā, iespējams, atspoguļo faktu, ka neironiem piemīt ierobežots molekulāro mehānismu skaits, ar kuru palīdzību var pielāgoties pastāvīgi mainīgajai videi.
CREB mērķa gēni, kas starpniecību veic šo uzvedības fenotipu, ir identificēti ar genoma mēroga testiem, kā arī vairāk izvēlētiem centieniem.10,18,32 Viens piemērs ir opioīdu peptīda dinorfīns: stimulējoša dinamorfīna ekspresijas indukcija NAc neironos, ko veicina CREB, \ t palielina k opioīdu receptoru dinamora aktivāciju uz VTA dopamīna neironiem un tādējādi nomāc dopamīnerģisko pārraidi NAc un mazina atalgojumu.18 Ir pierādīts, ka vairāki citi CREB mērķi ir svarīgi narkotiku izraisītajai sinaptiskajai plastiskībai, kā tas ir aprakstīts turpmāk. CREB ir aktivizēts arī vairākos citos smadzeņu reģionos ar stimulantu un opiātu palīdzību,23,24 mazāk ir zināms par šī efekta uzvedības sekām un mērķa gēniem, caur kuriem tās rodas. Tāpat mazāk zināms par CREB lomu citu ļaunprātīgu narkotiku darbību starpniecībā.19
ΔFosB
Akūtā iedarbība uz praktiski jebkuru narkotiku lietošanu izraisa visus Fos ģimenes transkripcijas faktorus NAc un vairākos citos smadzeņu reģionos. Šī indukcija ir ātra, bet arī ļoti pārejoša, un Fos proteīna līmenis 8 laikā atgriežas normālā stāvoklī līdz 12 stundām. Unikāli starp šiem Fos ģimenes proteīniem ir ΔFosB, FosB gēna atdalītais produkts, kas neparastās stabilitātes dēļ pakāpeniski uzkrājas atkārtotas zāļu iedarbības gaitā un kļūst par dominējošo Fos proteīnu, kas izteikts šajos apstākļos.22,33 Turklāt šīs stabilitātes dēļ ΔFosB līmenis saglabājas nedēļas pēc zāļu lietošanas pārtraukšanas. Šāda hroniska ΔFosB indukcija ir pierādīta gandrīz visām ļaunprātīgas izmantošanas zālēm34 un vairumam zāļu ir selektīva attiecībā uz Dl tipa NAc neironiem.34,35 Tas arī ir bijis pierādīts cilvēka narkomāniem.35 Liela literatūras kopa ir parādījusi, ka šāda ΔFosB indukcija D1-NAc tipa neironi palielina dzīvnieka jutīgumu pret narkotikām, kā arī dabiskas priekšrocības un veicina zāļu pašpārvaldi, iespējams, ar pozitīvas pastiprināšanas procesu (skatiet norādes 34 uz 38). Interesanti, ka ΔFosB narkotiku indukcija NAc ir pusaudžu dzīvniekiem dramatiskāka, jo ir lielāka atkarības ievainojamība,39 un ir pierādīts, ka tā izraisīta nikotīna starpniecība ir nikotīna vārtejai līdzīga kokaīna atalgojuma palielināšana.40
CREB gadījumā NAc ir identificēti daudzi mērķa gēni ΔFosB, izmantojot kandidāta gēnu un genoma mēroga pieejas.10,32 Kamēr CREB inducē dinorfīnu, ΔFosB nomāc to, kas veicina ΔFosB labvēlīgo efektu.38 Vēl viens ΔFosB mērķis ir cFos: tā kā ΔFosB uzkrājas ar atkārtotu zāļu iedarbību, tas apspiež c-Fos un veicina molekulāro slēdzi, ar kuru ΔFosB selektīvi inducē hroniskā narkotiku apstrādātā stāvoklī.41 Ir pierādīts, ka daudzi citi ΔFosB mērķi ietekmē dažu zāļu ļaunprātīgas izmantošanas spēju izraisīt sinaptisku plastiskumu NAc un ar to saistītās izmaiņas NAc vidējo smadzeņu neironu dendritiskajā arborizācijā, kā tas tiks aplūkots turpmāk.
ΔFosB indukcijas funkcionālās sekas citos smadzeņu reģionos ir mazāk labi saprotamas, lai gan tās indukcija orbitofrontālajā garozā (OFC) ir pētīta detalizēti. Šajā gadījumā ΔFosB mediē toleranci, kas notiek ar kokaīna kognitīvi traucējošām sekām hroniskas iedarbības laikā, un šī adaptācija ir saistīta ar paaugstinātu kokaīna pašpārvaldi..42,43
Genoma mēroga testi liecina par vairākiem iespējamiem mērķa gēniem, kas veicina šo ietekmi.42 Neskatoties uz ΔFosB unikālajām laika īpašībām un zināšanām, ka tas tiek izraisīts tradicionālajās atmiņas ķēdēs (piemēram, hipokampā), vēl nav pētīta ΔFosB loma uzvedības atmiņā, kas ir interesants priekšmets turpmākajiem pētījumiem.
Epigenētiskie mehānismi
Pēdējos gados transkripcijas pētījumi ir virzīti vienu soli tālāk uz epigenetiku44 (Sk. Attēls 1), ko var plaši definēt kā gēnu ekspresijas izmaiņas, kas rodas, ja DNS sekvences nav. Epigenetiskie mehānismi kontrolē DNS iepakošanu šūnu kodolā, izmantojot mijiedarbību ar histoniem un daudziem citiem kodolproteīnu veidiem, kas kopā satur hromatīnu. Gēnu ekspresiju kontrolē šī iepakojuma stāvoklis, ko izraisa histonu, citu proteīnu un pašu DNS kovalentā modifikācija. Kā tikai daži piemēri, histonu acetilēšana parasti veicina gēnu aktivāciju, histonu metilēšana var veicināt vai nu gēnu aktivāciju vai represijas atkarībā no Lys atlikuma, kas atrodas šajā modifikācijā, un DNS metilēšana parasti ir saistīta ar gēnu represijām, lai gan dažu metilēšanas variantu ( piemēram, 5-hidroksimetilēšana) var būt saistīta ar gēnu aktivāciju.
Epigenetika ir pievilcīgs mehānisms, jo citās sistēmās, piemēram, attīstības un vēža bioloģijā, dažas epigenetiskās modifikācijas var būt pastāvīgas. Šī iemesla dēļ, epigenetika tiek īstenota gan mācīšanās, gan atmiņas modeļos (piemēram, refs 45-48), kā arī atkarībā;44,49 abās sistēmās ir ziņots par būtiskām izmaiņām histona acetilēšanas un metilēšanas un DNS metilēšanas laikā. Kā tikai viens piemērs, histona metiltransferāze, G9a, ir iesaistīta abās atmiņās50 un atkarību.51,52 Atkarības modeļos G9a izteiksme ir samazināta NAc, reaģējot uz ļaunprātīgas izmantošanas stimulējošām vai opiātu zālēm, un tir pierādīts, ka viņa uzlabo šo narkotiku ietekmi.51,52 Interesanti, ka G9a kokaīna nomākšanu mediē ΔFosB. G9a katalizē histonu H9 (H3K3me9), kas ir galvenais gēnu represiju mediatoru, Lys2 dimetilēšanu. ChIP mikroshēma vai ChIP-seq (hromatīna imunoprecipitācija, kam seko attiecīgi promotora mikroshēmas vai augstas caurlaidības sekvencēšana) tika izmantota, lai iegūtu genoma mēroga kartes gēniem NAc, kas uzrāda mainītu H3K9me2 pēc stimulantu vai opiātu iedarbības.32,52,53 Pārklājot šos gēnu sarakstus ar gēnu ekspresijas izmaiņu genoma sarakstiem, kā arī ar daudzu citu epigenetisko modifikāciju veidu genoma kartēm (piemēram, ΔFosB saistīšana, CREB saistība, citi histona modifikācijas utt.),32,53 vajadzētu būt iespējai identificēt aizvien pilnīgāku gēnu kopumu, ko regulē ļaunprātīgas narkotikas, un saprast attiecīgos iesaistītos epigenetiskos mehānismus.
Vēl viena epigenetiskā regulējuma forma, kas saistīta ar atmiņu un atkarību, ir mikroRNS radīšana. Šīs mazās, nekodējošās RNS saistās ar komplementāriem mRNS reģioniem un tādējādi nomāc to translāciju vai izraisa to degradāciju. Argonautu, proteīnu, kas ir būtisks miRNS apstrādei, dzēšana maina uzvedības reakcijas uz kokaīnu, novērojot D1-D2 tipa vidējas smailes neironus.54 Ir pierādīts, ka vairāki specifiski miRNS ir regulēti ar zāļu iedarbību un, savukārt, ietekmē uzvedības reakcijas uz narkotikām (piemēram, 55,56). Turpmākajos pētījumos būs aizraujoši identificēt šo miRNS mRNS mērķus un raksturot, kā tie ietekmē atkarības procesu.
Synaptic plastiskums
Tādi paši vispārējie sinaptisko modifikāciju veidi, kas ir saistīti ar hipokampu un amygdalu uzvedības atmiņā (skat. Citus rakstus šajā jautājumā), līdzīgi ir pierādīti arī smadzeņu atlīdzības reģionos atkarības modeļos un ir svarīgi mediācijas procesā. atkarības process.57,58 Šāda narkotiku izraisīta sinaptiskā plastiskums ir aprakstīts vairākos smadzeņu reģionos, tomēr mēs šeit koncentrējamies uz NAc, kur lielākā daļa pētījumu ir vērsti uz līdz šim (Skaitlis 2).
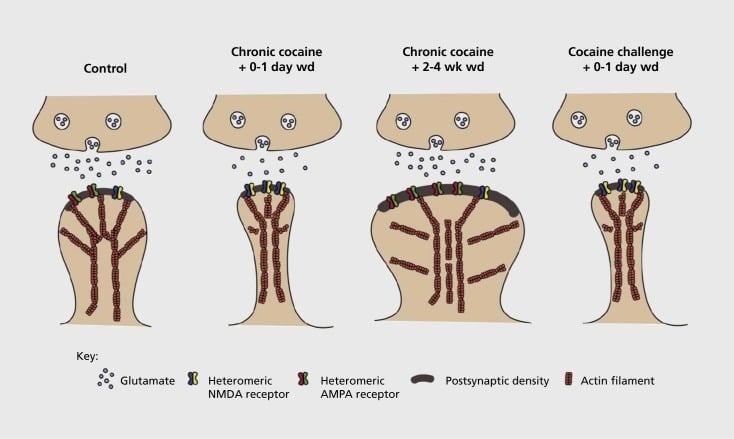
Ar narkomāniju saistītā sinaptiskā un strukturālā plastiskuma modeli kodolkrāsās (NAc). Hroniska kokaīna iedarbība izraisa laika atkarīgu un pārejošu α-amino-3-hidroksi-5-metil-4-izoksazolepropionskābes (AMPA) un N-metil-D-asparagīnskābes (NMDA) glutamāta receptoru reorganizāciju NAc vidē. smadzeņu neironu (MSN) sinapses, kā arī strukturālās izmaiņas NAc MSN mugurkaula galā, kas korelē ar atšķirīgām sinaptiskās plastiskuma formām. Piemēram, hronisks kokaīns izraisa NMDA receptoru virsmas izpausmi, kluso sinapses veidošanos un ilgtermiņa depresiju (LTD) agrīnās izstāšanās laikā. Ilgstošākas atsaukšanas laikā (wd) šīs sinaptiskās izmaiņas mainās, kā rezultātā palielinās virsmas AMPA receptoru ekspresija, sinapses konsolidācija sēņu formas mugurā un ilgstoša potencēšana (LTP). Šie efekti atkal atgriežas pēc tam, kad ir pakļauta kokaīna iedarbības devai, kas noved pie mugurkaula pārkārtošanās plānās muguriņās un sinaptiskā spēka depresiju.
Sākotnējie eksperimenti parādīja, ka atkārtota iedarbība uz stimulējošu narkotiku lietošanu izraisa LTD (ilgstoša depresija) līdzīgu stāvokli glutamatergiskās sinapsēs NAc.59 Tomēr jaunāks darbs ir parādījis, ka plastiskums ir ļoti atkarīgs no laika, jo LTD sākas pēc pēdējā kokaīna iedarbības, kas pēc ilgākiem atteikuma laika punktiem kļūst par vairāk kā LTP (ilgtermiņa potenciāls) līdzīgu stāvokli.60,61 Šis darbs, kas līdz šim tika veikts, galvenokārt izmantojot pētnieku, nevis pašpārvaldes zāles, ir noteicis nepieciešamību pēc sistemātiskākām izmeklēšanām pašpārvaldes modeļos, kas seko sinaptiskā plastiskuma formām, kas rodas glutamatergiskās sinapses laikā. NAc detalizētā laika posmā no pašpārvaldes iegūšanas līdz tās uzturēšanai, dažādos atcelšanas un izmiršanas laikos, kā arī reakcijā uz recidīvu izraisošiem stimuliem. Līdz šim veiktais darbs ir definējis arī dažus molekulāros mehānismus, kas veicina šo narkotiku izraisīto sinaptisko plastiskumu, ieskaitot AMPA receptoru tirdzniecību sinapsesā, iespējams, daļēji izmantojot CaMKII (Ca2+/ kalmodulīna atkarīgo proteīnu kināzes II) dažu AMPA receptoru apakšvienību fosforilācija, kā arī AMPA receptoru apakšvienību izmainīta ekspresija (piemēram, 60,62-65, Skaitļi 2 un 3). CREB un ΔFosB loma ir saistīta ar šīm parādībām, kā arī saistītajām izmaiņām glutamatergiskās sinapses morfoloģijā (skatīt tālāk). Piemēram, GluAl ir CREB mērķis NAc, kur GluA2 un CaMKII ir abi FosB mērķi, šajā smadzeņu reģionā .35,36,66,67 Virzoties uz priekšu, būs svarīgi saistīt konkrētus pielāgojumus laika atkarīgajām sinaptiskās funkcijas izmaiņām un atkarības uzvedības iezīmēm.
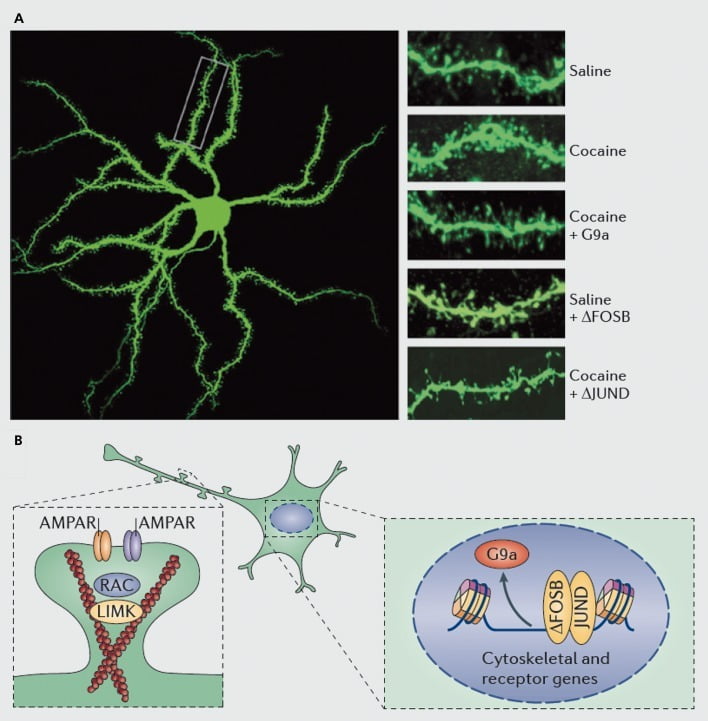
Molekulārie mehānismi, kas ir dendrīta mugurkaula kokaīna indukcijas pamatā uz kodola accumbens (NAc) vidēja muguras neironiem. A) parāda kokaīna izraisītu mugurkaula dendrīta skaita pieaugumu, ko var bloķēt ar vīrusu pārmērīgu G9a vai JunD ekspresiju (AP1 mediētas transkripcijas antagonists) vai atdarina FosB vīrusu pārmērīga ekspresija. B) Ir pierādīts, ka svarīga loma ir AMPA receptoru (AMPAR) un aktīna citoskeleta (pa kreisi) regulēšanai, kā arī glutamāta receptoru un aktīnu regulējošo olbaltumvielu transkripcijas regulēšanai (piemēram, kā starpniecību ar ΔFosB, pa labi). mediējot kokaīna NAc dendrīta mugurkaula blīvuma regulēšanu. UMK, LIM domēna kināze; RAC, ar Ras saistītā C3 botulīna toksīna substrāts.
Jauni eksperimentālie rīki ļauj pirmo reizi noteikt ar arvien lielāku precizitāti, kādas konkrētas ķēdes attēlo šīs sinaptiskās plastiskuma formas un kādas uzvedības novirzes tās ietekmē. Piemēram, tNAc displejs un galvenie apakšreģioni parāda atšķirības narkotiku izraisītā sinaptiskā plastitātē, tāpat kā D1-versus D2 tipa vidēji smailie neironi katrā apakšreģionā.60,63,64,67 Tāpat optogenētiskie eksperimenti ir snieguši jaunu ieskatu konkrēta sinaptiskās plastiskuma (piemēram, LTD) ieguldījuma īpašās glutamatergiskās sinapses populācijās NAc, piemēram, tādiem, kas rodas no mediālā PFC pret bazolaterālo amygdala pret ventrālo subikulu (galvenais produkts). hippocampus).68-70 Galu galā būs nepieciešams pārklāt zāļu izraisītas molekulārās adaptācijas katrā no šiem aferentajiem neironiem ar sinapses specifiskām adaptācijām, kas notiek viņu postsinaptiskajos dendritos, lai apkopotu pilnīgu izpratni par to, kā ļaunprātīgas narkotikas pārveido smadzeņu shēmu, lai virzītu konkrētus atkarīgs stāvoklis. Šim nolūkam būs nepieciešams vairāk novērtēt zāļu izraisīto plastiskumu inhibējošās sinapsēs šajos pašos smadzeņu reģionos, apgabalā, kuram līdz šim ir pievērsta ļoti maz uzmanības.65
Pilnu šūnu plastiskums
Lai gan lielākā daļa pētījumu, kas saistīti ar neirofizioloģiskām pārmaiņām neironiem narkotiku lietošanas parādībās, kā mācīšanās un atmiņas fenomens, ir koncentrējies uz sinaptisku plastiskumu, arvien vairāk pierādījumu liecina arī par visu šūnu plastiskuma nozīmi. Visa šūnu plastiskums, ko dēvē arī par homeostatisku plastiskumu, \ t71 ir saistītas ar visu nervu šūnu iekšējās uzbudināmības izmaiņām tādā veidā, ka tas nav specifisks. Ņemot vērā, ka atsevišķas narkotiku atkarības pazīmes ir saistītas ar pastiprinātu vai pazeminātu jutību pret zālēm, ir jēga, ka dažu nervu šūnu pastiprināta vai samazināta elektriskā uzbudināmība veicina šos uzvedības pielāgojumus..5
Jūsu darbs IR Klientu apkalpošana visizplatītākā pilnas šūnu plastiskuma piemērs pret ļaunprātīgu narkotiku lietošanu ir hronisku opiātu spēja palielināt lokus coeruleus noradrenerģisko neironu iekšējo uzbudināmību (LC).72 Šo palielināto uzbudināmību izraisa CREB un tā indukcija dažām adenililciklāzes izoforām, kas palielina LC neironu aizdegšanos, iespējams, izmantojot Na + kanālu indukciju.72-75 Šis LC neironu hiperexcililitāte ir klasisks tolerances un atkarības mehānisms, un tas izraisa dažas opiātu izdalīšanās pazīmes un simptomus. Interesanti, ka CREB starpniecību veido līdzīgu formu šūnu plastiskumu NAc vidēja smailes neironiem, kurus arī padara hiperexcitable ar hronisku iedarbību uz narkotikām, izmantojot CREB.76 Līdz ar to turpmākajos pētījumos būs izšķiroša nozīme, lai saprastu, kā glutamatergiskās sinapses sinerģiskā plastiskums CREB-mediēta ar NAc vidējiem smadzeņu neironiem65,66 summējas ar šo neironu CREB-mediēto iekšējo hiperexcitability76 kontrolēt atkarības uzvedības iezīmes.
Vēl viens pilnas šūnu plastiskuma piemērs atkarības modeļos ir VTA dopamīna neironu pārmērīga jutība, kas rodas pēc hroniskas opiātu zāļu iedarbības.unSkaitlis 4).77,78 Šī adaptācija, kas ir saistīta ar morfoloģiskām izmaiņām šajās nervu šūnās (skatīt nākamo sadaļu), nav mediēta ar CREB, bet tiek panākta, regulējot neirotrofas signalizācijas kaskādes, kā aprakstīts tālāk.

Hronisku morfīna izraisītu adaptāciju darbaspēka modelis ventrālās tegmentālās zonas (VTA) dopamīna neironos. Hronisks morfīns samazina VTA dopamīna (DA) soma lielumu, bet palielina neironu uzbudināmību, bet dopamīna pārnešana uz kodola accumbens samazinās. Morfīna neto ietekme ir mazāk atsaucīgs atlīdzības ceļš, ti, atalgojuma pielaide. IRS2-AKT signalizācijas regulēšana VTA starpniecību ietekmē hroniskā morfīna ietekmi uz soma lielumu un elektrisko uzbudināmību; Ietekme uz uzbudināmību ir saistīta ar samazinātu γ-aminosviestskābes (GABA) A strāvu un K 'kanāla ekspresijas nomākšanu. Morfīna inducēta mTORC2 aktivitātes pazemināšanās VTA ir būtiska šīm morfīna izraisītajām morfoloģiskajām un fizioloģiskajām adaptācijām, kā arī atalgojuma pielaidei. Atšķirībā no mT0RC2 hroniskā morfīna palielina mTORCI aktivitāti, kas neietekmē šīs morfīna izraisītās adaptācijas. BDNF, smadzeņu radītais neirotrofiskais faktors; IRS, insulīna receptoru viela; mTORC, mTOR komplekss; AKT, proteīnkināze B Atkārtojama no ref 77
Morfoloģiskais plastiskums un neirotrofiskie mehānismi
Pieaugošie pierādījumi, kas lielā mērā ir iegūti no hipokampusa un smadzeņu garozas neironu pētījumiem, ir parādījuši, ka sinaptiskā plastiskuma izmaiņas ir saistītas ar morfoloģiskām izmaiņām sinapses. Piemēram, LTD un kluso sinapšu ģenerēšana ir saistīta ar plānu vai stublāju dendritu muguriņu veidošanos, bet LTP ir saistīta ar lielākiem, sēņu formas muguriņiem.79,80 Tāpēc ir interesanti, ka narkomānijas jomā vairāk nekā 15 gadus galvenā uzmanība ir pievērsta narkotiku izraisītām izmaiņām dendrīta muguriņās. Hroniska iedarbība stimulējošas narkotikas ļaunprātīgas izmantošanas palielina dendrītisko mugurkaula blīvumu vidēji smalkiem NAc neironiem, kas pārsvarā ir Dl tipa neironiem.67,81,82 Spīniju indukcija lielākoties ir saistīta ar jutīgām uzvedības reakcijām uz šīm zālēm, lai gan daži pierādījumi ir pretrunā ar šo viedokli.
Tomēr, tāpat kā pētījumi par sinaptisko plastiskumu, ir nepieciešams daudz vairāk darba, lai sistemātiski noteiktu izmaiņas dendrītu mugurās, kas rodas zāļu pašpārvaldes, atsaukšanas un recidīva laikā. Slīdz šim, iesaistot pētnieku un pašnodarbinātu narkotiku, liecina par ļoti atšķirīgām mugurkaula izmaiņām, kas notiek dažādos atteikuma laika punktos un NAc apvalkā, salīdzinot ar galvenajiem apakšreģioniem.83-86 Būs svarīgi arī noteikt precīzus molekulāros mehānismus, ar kuriem kokaīns vai cits stimulators rada šos laika atkarīgos un šūnu tipa specifiskos efektus. Ir pierādīts, ka ΔFosB ir nepieciešams un pietiekams, lai Dl tipa NAc neironiem inducētu nenobriedušus spines.35,51,67 Šāds regulējums notiek kopā ar kokaīna un ΔFosB regulējumu vairākiem proteīniem, kas zināmi, lai kontrolētu aktīna citoskeleta reorganizāciju. Kā tikai viens piemērs, vairāku guanīna nukleotīdu apmaiņas faktoru un GTPāzes aktivējošo proteīnu transkripcijas regulēšana mazo GTPāzi mazina Rac1, lai īslaicīgi samazinātu aktivitāti, reaģējot uz katru kokaīna iedarbību, un tādi pulsējoši Rac1 aktivitātes samazinājumi ir pierādīti, izmantojot optogenētisko kontroli. Rac1, lai mediētu nenobriedušu muguriņu indukciju.87 Šie Racl efekti, iespējams, rodas, kontrolējot cofilīna un citus aktīna regulējošos proteīnus, kas arī pierāda, ka tie ietekmē medikamentu regulēšanu mugurkaula augšanā.87,88 Tomēr ir svarīgi uzsvērt, ka tas ir tikai viens ceļš, kas saistīts ar kokaīna nenobriedušu muguriņu regulēšanu, jo ir pierādīts, ka būtiska loma ir arī vairākiem citiem proteīniem, tostarp CDK5 (no ciklīna atkarīgā kināze-5), CaMKII, NFkB , MEF2, CREB, G9a un DNMT3 (DNS metiltransfs izdzēš 3a), lai nosauktu tikai dažus.20,21,35,51,67,89,90 Interesanti, ka kokaīna regulēšana vairākiem no šiem gēniem, ieskaitot CDK5, CaMKII un NFkB indukciju, un G9a represijas, ir arī ar ΔFosB starpniecību.20,35,51,91
Pārsteidzoši, ka opiātu narkotikas ļaunprātīgi izmanto pretēju efektu un samazina dendritisko mugurkaula blīvumu NAc vidēji smaila neironiem.81 Ir maz zināms par šīs adaptācijas sekām un attiecīgajiem molekulārajiem mehānismiem. Šī parādība ir tomēr, pārsteidzoši, ņemot vērā, ka CREB un ΔFosB inducē gan stimulanti, gan opiāti, un abi ir iesaistīti stimulējošā medikamenta NAc dendritiskā mugurkaula blīvuma indukcijā.. Tas rada jautājumu par to, kā opiāti nomāc NAc mugurkaula blīvumu, neskatoties uz šo faktoru indukciju.
Otrs nozīmīgais morfoloģiskās plastiskuma veids, kas novērots narkotiku lietošanas modeļos, ir fiziski samazināts hronisko opiātu ievadīšanas izraisīto VTA dopamīna neironu šūnu daudzums..77,92,93 Līdzīga adaptācija notiek, reaģējot uz kanabinoīdiem.94 Šis VTA dopamīna neironu sarukums, kas notiek ar opiātu pašpārvaldi93 un ir dokumentēts cilvēka heroīna atkarīgajos pētījumos, \ t77 šķiet, ka ir starpība pret atalgojumu, un tā ir saistīta ar samazinātu dopamīna izdalīšanos NAc. Nozīmīgi pierādījumi tagad liecina, ka šo šūnu soma lieluma samazināšanos mediē opiātu izraisīta neirotrofiskā faktora (BDNF) ekspresija šajos neironos. Mēs esam tieši saistījuši šo opiātu izraisīto BDNF atbalsta atcelšanu un VTA neironu saraušanos, samazinātu pakārtoto BDNF signalizācijas kaskāžu aktivitāti VTA dopamīna neironos, īpaši samazinot IRS2 (insulīna receptoru substrāts-2) aktivitāti, AKT (serīna treonīns) kināze), un TORC2 (rapamicīna-2 mērķis, kas nav jutīgs pret rapamicīnu).77,93 Mēs esam arī saistījuši šo BDNF pazemināšanos tieši ar palielināto uzbudināmību, ko morfīns inducē šajos neironos, kā minēts iepriekš.77,78 Patiešām, samazināta šūnu soma lielums un palielināta uzbudināmība ir cieši saistīti, jo viena indukcija izraisa otru un otrādi. Šī šūnu uzbudināmības kontrole ietver K nomākšanu+ kanāliem un GABAA šajos neironos.
Šī BDNF loma morfīna reakciju kontrolē VTA līmenī kontrastē ar tās ļoti atšķirīgo iesaistīšanos kokaīna un citu stimulantu darbībā. Stimulanti inducē BDNF signālu NAc, kas ir palielināta lokālā BDNF sintēze, kā arī pastiprināta atbrīvošanās no vairākiem afferentiem reģioniem.95 Turklāt ir pierādīts, ka palielināta BDNF signalizācija NAc, bet ne VTA, veicina šo zāļu uzvedību, tostarp to pašpārvaldi.95,96 Pretēja BDNF signālu regulēšana VTA-NAc ceļā ar opiātiem pret stimulatoriem rada iespēju, ka šādas atšķirības ir pretrunā ar narkotiku pretēju NAc dendrītu muguriņu regulēšanu, kas tagad tiek pētīta.
Turpmākie virzieni
Iepriekš minētais stāstījums uzsver milzīgo progresu, kas panākts, izprotot molekulāros un šūnu pielāgojumus, kas notiek smadzeņu atlīdzības reģionos, reaģējot uz atkārtotu iedarbību uz ļaunprātīgu narkotiku lietošanu, un saistot individuālus pielāgojumus atkarības sindromu konkrētām uzvedības pazīmēm dzīvnieku modeļos. . Neskatoties uz šiem sasniegumiem, joprojām ir svarīgi jautājumi. Lielākā daļa no mūsu esošajām zināšanām ir vērstas uz VTA un NAc, un ir daudz mazāk informācijas par citiem svarīgākajiem limbiskajiem smadzeņu reģioniem, kas ir arī svarīgi narkomānijai. Turklāt visas eksperimentālās demonstrācijas par molekulāro šūnu adaptācijas cēloņsakarību ar narkotikām saistītā uzvedībā ir ietekmējušas individuālas adaptācijas vienu reizi. Lai manipulētu ar daudziem pielāgojumiem vienlaicīgi, ir daudz grūtāk, bet tas ir arī svarīgi, jo mēs zinām, ka narkotikas rada lielu skaitu atšķirīgu izmaiņu pat atsevišķos neironos, kas, visticamāk, ir sarežģīti, lai ietekmētu uzvedību. Šāda sistēmas bioloģijas pieeja būs izšķiroša, lai galu galā krekinga atkarības bioloģiskos pamatus. Visbeidzot, centieni izprast ar atkarību saistītu atmiņu molekulāro šūnu mehānismus nonāk tajā brīdī, kad visi citi centieni izprast uzvedības atmiņas bioloģisko pamatu tagad cīnās: mūsu spēja saistīt bioloģiskās parādības ir sarežģīta uzvedības atmiņa joprojām ir ļoti sarežģīta. Pārvarot šo plaisu, iespējams, lielākais izaicinājums neiroloģijā.
Atlasītie saīsinājumi un akronīmi
- Nac
- kodols accumbens
- CREB
- cAMP atbildes elementa saistošais proteīns
- ΔFosB
- Fos ģimenes transkripcijas faktors
- VTA
- ventrālā ķermeņa daļa
- AMPA
- α-amino-3-hidroksi-5-metil-4-izoksazolepropionskābe
- LTD
- ilgstoša depresija
- LTP
- ilgtermiņa aizstāvība
- BDNF
- no smadzenēm iegūts neirotrofisks faktors
- NKkB
- kodolfaktoru kB
ATSAUCES