Dialogues Clin Neurosci. 2013 Dec;15(4):431-43.
Abstrak
Walaupun terdapat banyak faktor psikososial, terasnya, penagihan dadah melibatkan proses biologi: keupayaan pendedahan berulang kepada ubat penyalahgunaan untuk mendorong perubahan dalam otak yang lemah yang mendorong pencarian dan pengambilan dadah yang kompulsif dan kehilangan kawalan atas penggunaan dadah, yang menentukan keadaan ketagihan. Di sini, kita mengkaji jenis-jenis penyesuaian molekul dan selular yang berlaku di kawasan otak tertentu untuk menengah keabnormalan kelakuan berkaitan ketagihan. Ini termasuk perubahan dalam ekspresi gen yang dicapai sebahagiannya melalui mekanisme epigenetik, kepekaan dalam fungsi neuronsiologi neuron dan sinaps, dan kepekaan yang berkaitan dengan morfologi neuron dan sinaptik yang diantara sebahagiannya oleh isyarat faktor neurotrofik yang diubah. Setiap jenis pengubahsuaian yang disebabkan oleh ubat ini boleh dilihat sebagai "memori selular atau molekul." Lebih-lebih lagi, ia menampakkan bahawa bentuk plastisiti yang berkaitan dengan ketagihan sangat serupa dengan jenis plastisitas yang telah dikaitkan dengan bentuk-bentuk "ingatan tingkah laku yang lebih klasik", mungkin mencerminkan repertoir mekanisma adaptif yang tersedia untuk neuron apabila berhadapan dengan alam sekitar cabaran. Akhirnya, penyesuaian molekul dan selular yang berkaitan dengan ketagihan melibatkan kebanyakan kawasan otak yang sama yang memeterai bentuk memori yang lebih klasik, selaras dengan pandangan bahawa ingatan abnormal adalah pemacu penting bagi sindrom kecanduan. Matlamat kajian ini yang bertujuan untuk menjelaskan asas molekul dan selular penagihan dadah adalah untuk membangunkan ujian diagnostik berasaskan biologi, serta rawatan yang lebih berkesan untuk gangguan ketagihan.
Pengenalan
Ketagihan dadah, yang boleh ditakrifkan sebagai pencarian dan pengambilan dadah yang kompulsif walaupun akibat yang mengerikan atau kehilangan kawalan ke atas penggunaan dadah, disebabkan oleh perubahan yang disebabkan oleh dadah yang berpanjangan yang berlaku di kawasan otak tertentu.1 Namun sesetengah individu, bagaimanapun, tunduk kepada ketagihan dalam menghadapi pendedahan dadah berulang, sementara yang lain mampu menggunakan ubat secara harfiah dan melarikan diri dari sindrom ketagihan. Faktor genetik menyumbang kira-kira 50% kebolehubahan individu dalam ketagihan kecanduan, dan tahap heritability ini adalah benar untuk semua kelas utama ubat-ubatan ketagihan, termasuk perangsang, opiates, alkohol, nikotin, dan cannabinoids.2 Tidak mungkin untuk mengenal pasti kebanyakan gen yang merangkumi risiko genetik ini, mungkin disebabkan oleh penglibatan mungkin beratus-ratus variasi genetik yang disimpulkan dalam satu individu untuk memberikan kerentanan ketagihan (atau, pada individu lain, rintangan).
50% risiko kecanduan lain disebabkan oleh banyak faktor persekitaran, yang berlaku sepanjang hayat, yang berinteraksi dengan komposisi genetik seseorang untuk menjadikannya rentan terhadap kecanduan pada tahap yang lebih besar atau lebih rendah. Beberapa jenis faktor persekitaran telah terlibat dalam ketagihan, termasuk tekanan psikososial, tetapi sejauh ini faktor yang paling kuat adalah pendedahan kepada penyalahgunaan dadah itu sendiri. Dadah "gateway" tertentu, khususnya nikotin, terbukti meningkatkan kerentanan seseorang terhadap kecanduan terhadap ubat lain.3 Selain itu, terdapat bukti yang semakin meningkat bahawa, walaupun terdapat pelbagai risiko genetik untuk kecanduan di seluruh penduduk, pendedahan kepada dos yang cukup tinggi dalam ubat untuk jangka masa yang panjang boleh mengubah seseorang yang mempunyai beban genetik yang agak rendah ke dalam penagih.4
Kemajuan besar telah dibuat sejak dua dekade yang lalu dalam mengenal pasti kedua-dua daerah diskrit otak yang penting dalam pengantaraan sindrom ketagihan, serta jenis perubahan pada tingkat molekul dan sel yang narkoba yang diinduksi di wilayah ini untuk mengatasi aspek utama daripada ketagihan.1,5 Litar yang telah mendapat perhatian paling banyak disebut sebagai sistem dopamine mesolimbi, yang melibatkan neuron dopamine di kawasan tegar ventral (VTA) daripada midbrain yang menyegarkan neuron berduri sederhana dalam accumbens nukleus (NAc, sebahagian daripada striatum ventral). Neuron VTA ini juga menyerap banyak kawasan forebrain lain, termasuk hippocampus, amygdala, dan korteks prefrontal (PFC).
Adalah wajar untuk mempertimbangkan mekanisme ketagihan yang disebabkan oleh dadah dalam jumlah ini untuk ingatan untuk tiga sebab yang bertindih.6
- Pertama, semua penyesuaian yang disebabkan oleh ubat-ubatan boleh dilihat sebagai jenis "memori molekul atau selular:" sel saraf yang menjalani perubahan sedemikian adalah berbeza kerana pendedahan dadah dan dengan itu bertindak berbeza dengan ubat yang sama, kepada ubat-ubatan lain, atau kepada pelbagai rangsangan lain sebagai hasilnya.
- Kedua, adalah menarik bahawa banyak, mungkin yang paling, jenis perubahan yang telah dikaitkan dengan keadaan ketagihan (contohnya, transkripsi gen diubah, epigenetik, plastisitas sinaptik dan keseluruhan sel, dan morfologi neuron dan mekanisme neurotropik) juga terlibat dalam bentuk "ingatan tingkah laku" tradisional seperti memori ruang, ketakutan, dan penyelenggaraan pengendali, antara lain.
- Ketiga, di kalangan kawasan otak yang terjejas oleh dadah penyalahgunaan adalah mereka yang merupakan substrat saraf utama untuk ingatan tingkah laku, termasuk hippocampus, amygdala, dan PFC. Ini bertepatan dengan kesedaran yang semakin meningkat bahawa beberapa ciri utama ketagihan yang dilihat secara klinikal (contohnya keinginan ubat dan kambuh semula) mencerminkan keabnormalan dalam litar ingatan tradisional, dengan ingatan jangka panjang pengalaman dadah berfungsi sebagai pemacu yang kuat terhadap patologi ketagihan.4,7,8 Sebaliknya, kawasan ganjaran otak (misalnya, VTA dan NAc) berpengaruh mempengaruhi ingatan tingkah laku.
Artikel ini memberikan gambaran tentang jenis-jenis utama perubahan molekul dan selular yang terjadi di beberapa kawasan otak dalam model ketagihan haiwan, menumpukan perhatian kepada nukleus accumbens yang mana kebanyakan maklumat kini tersedia. Yang penting, semakin mungkin untuk mengesahkan beberapa perubahan dalam penagih manusia berdasarkan kajian otak postmortem. Walaupun ubat-ubatan penyalahgunaan mempunyai struktur kimia yang berbeza dan bertindak pada sasaran protein yang berbeza, ia menyedari bahawa banyak penyesuaian yang berkaitan dengan kecanduan yang umum adalah biasa bagi kebanyakan orang, dan dalam sesetengah kes, ubat penyalahgunaan dan mungkin menyumbang kepada ciri-ciri yang dikongsi bersama sindrom penagihan.4,9 Sebaliknya, banyak penyesuaian yang disebabkan oleh dadah lain adalah khusus kepada ubat yang diberikan dan boleh memeterai lebih banyak aspek unik ketagihan yang diberikan. Kami memberi tumpuan di sini pada ubat-ubatan perangsang dan obat pengacau, yang menghasilkan kesan yang lebih dramatik dalam model haiwan berbanding dengan ubat lain. Kami juga menyerlahkan bidang-bidang penting untuk penyelidikan masa depan yang akan meningkatkan lagi pengetahuan tentang sindrom ketagihan dan menterjemahkan kemajuan-kemajuan ini ke dalam ujian diagnostik dan rawatan yang lebih baik.
Transkrip dan mekanisme epigenetik
Pengetahuan bahawa penagih dapat tetap berisiko tinggi untuk berulang walaupun bertahun-tahun pantang berarti bahawa ketagihan melibatkan perubahan yang disebabkan oleh dadah di otak yang dapat sangat stabil. Ini telah membawa beberapa kumpulan untuk mempertimbangkan perubahan dalam ungkapan gen sebagai komponen penting dalam proses penagihan (Rajah 1). Oleh itu, penyelidikan gen calon atau penyiasatan seluruh genom yang melibatkan mikroorganisma DNA dan lebih baru-baru ini RNA-seq (urutan urutan tinggi RNA yang dinyatakan) telah mengenal pasti banyak gen yang ekspresi diubah dalam rantau otak yang diberikan dalam model tikus dan primata ketagihan dan dalam penagih manusia (contohnya, nyatakan 10-17). Contoh-contoh gen tersebut dibincangkan dalam bahagian-bahagian seterusnya kajian ini.
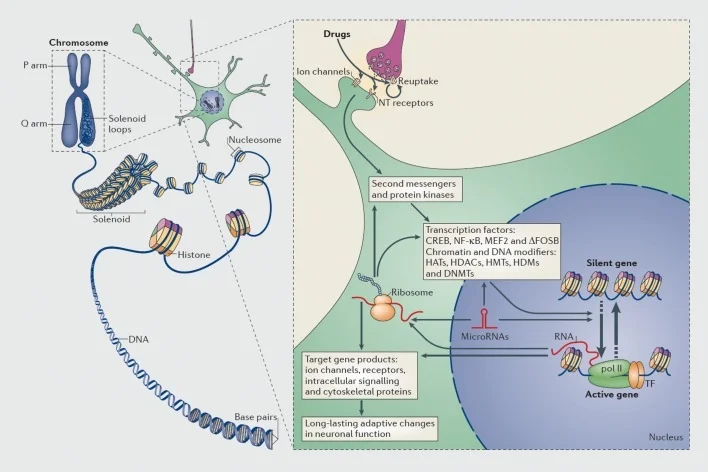
Mekanisme pengawalan transkrip dan epigenetik dengan dadah penyalahgunaan. Dalam sel-sel eukariotik, DNA diorganisasikan dengan membungkus sekitar oktomer histone untuk membentuk nukleosom, yang kemudiannya dianjurkan dan dipelbagaikan untuk membentuk kromosom (bahagian kiri). Hanya dengan mengecilkan kromatin yang dipadatkan buat sementara waktu, DNA gen tertentu boleh dijadikan akses kepada jentera transkrip. Dadah penyalahgunaan bertindak melalui sasaran sinaptik seperti mekanisme reuptake, saluran ion, dan penerima reseptor neurotransmitter (NT) untuk mengubah cascade isyarat intraselular (bahagian kanan). Ini membawa kepada pengaktifan atau perencatan faktor transkripsi (TF) dan banyak sasaran nuklear lain, termasuk protein kromatin-peraturan (ditunjukkan oleh anak panah tebal); mekanisme terperinci yang terlibat dalam pengawalan synaptic protein-regulatory chromatin masih kurang difahami. Proses-proses ini akhirnya mengakibatkan induksi atau penindasan gen tertentu, termasuk mereka untuk RNA bukan pengkodan seperti mikroRNA; Ekspresi yang diubah dari beberapa gen ini dapat seterusnya mengatur transkripsi gen. Adalah dicadangkan bahawa beberapa perubahan yang disebabkan oleh dadah di peringkat kromatin sangat stabil dan dengan itu mendasari tingkah laku yang tahan lama yang menentukan ketagihan. CREB, protein siklik AMP-responsif mengikat protein; DNMTs, metiltransferases DNA; HATs, asetiltransferase histon; HDACs, deacetylases histon; HDMs, histone demethylases; HMTs, methyltransferases histone; MEF2, faktor penentu khusus myocyte 2; NF-kB, faktor nuklear-KB; poli II, polimerase RNA II. Diterbitkan semula dari ref 44: Robison AJ, Nestler EJ. Mekanisme transkriptional dan epigenetik ketagihan. Nat Rev Neurosci. 2011; 12: 623-637.
Begitu juga, banyak jenis faktor transkripsi-protein yang mengikat kawasan-kawasan pengawalseliaan gen dan dengan itu meningkatkan atau mengurangkan transkripsi gen tersebut-telah terlibat dalam pengantaraan kesan jangka panjang ubat penyalahgunaan terhadap ekspresi gen di otak. Contoh utama termasuk CREB (faktor tindak balas unsur tindak balas CAMP), ΔFosB (faktor transkripsi keluarga Fos), NFkB (faktor nuklear kB), MEF2 (faktor peningkatan myositik-2), dan reseptor glucocorticoid, antara lain.5,10,18-22 Semakin mungkin untuk memahami jalur isyarat selular di mana ubat-ubatan penyalahgunaan mengaktifkan faktor transkripsi tertentu di otak dan untuk menghubungkan pengaktifan sedemikian dengan gen sasaran faktor transkripsi dan dengan aspek tingkah laku ketagihan tertentu (lihat Rajah 1). Kemajuan ini digambarkan dengan pertimbangan CREB dan ΔFosB, yang merupakan faktor transkripsi terbaik dalam model ketagihan.
cAMP Response element mengikat protein
Ubat-ubatan penyalahgunaan dan penipuan mengaktifkan penyalahgunaan CREB di beberapa kawasan otak yang penting untuk ketagihan, termasuk yang jelas di NAc.23,24 CREB dikenali untuk diaktifkan dalam sistem lain oleh cAMP, Ca2+, dan laluan faktor pertumbuhan,25 dan belum diketahui mana yang mengantara pengaktifannya di NAc oleh ubat penyalahgunaan. Pengaktifan dadah CREB di NAc telah ditunjukkan untuk mewakili mekanisme maklum balas negatif klasik, di mana CREB berfungsi untuk mengurangkan kepekaan haiwan terhadap kesan yang baik dari ubat-ubatan ini (toleransi) dan untuk memediasi keadaan emosi negatif semasa penarikan dadah (ketergantungan).18,26,27 Kesan-kesan ini telah ditunjukkan baru-baru ini untuk memacu peningkatan ubat-ubatan diri sendiri dan kambuh semula, mungkin melalui proses pengukuhan negatif.28 Tindakan-tindakan CREB ini seolah-olah melibatkan kedua-dua subtipe utama neuron berjalur medium NAc, yang menyatakan terutamanya D1 berbanding D2 reseptor dopamin.24 Interestingly, sebuah badan besar sastera telah menunjukkan bahawa CREB, yang bertindak dalam hippocampus dan amygdala, adalah molekul utama dalam ingatan tingkah laku.29-31 Peranan luas dalam ketagihan dan ingatan tingkah laku mungkin mencerminkan fakta bahawa neuron dipenuhi dengan jumlah mekanisme molekul yang terhingga yang dapat menyesuaikan diri dengan persekitaran yang sentiasa berubah.
Gen sasaran untuk CREB yang menengahkan fenotip tingkah laku ini telah dikenalpasti melalui ujian genom yang luas serta usaha yang lebih terpilih.10,18,32 Satu contoh ialah dynorphin peptida opioid: induksi perangsang ekspresi dynorphin dalam neuron NAc, ditengah melalui CREB, meningkatkan pengaktifan dynorphin penagih k opioid pada neuron dopamin VTA dan dengan itu menindas penghantaran dopaminergik ke NAc dan merosakkan ganjaran.18 Beberapa sasaran CREB yang lain telah terbukti menjadi penting untuk kepekaan sinaptik yang disebabkan oleh dadah, seperti yang dibincangkan di bawah. Walaupun CREB juga diaktifkan di beberapa kawasan otak yang lain oleh stimulan dan opiat,23,24 kurang diketahui mengenai kesan tingkah laku kesan ini dan gen sasaran di mana ia berlaku. Begitu juga, kurang diketahui mengenai peranan CREB dalam memediasi tindakan penyalahgunaan ubat lain.19
ΔFosB
Pendedahan akut kepada hampir mana-mana ubat penyalahgunaan mendorong semua faktor transkripsi keluarga Fos di NAc dan beberapa kawasan otak yang lain. Induksi ini pesat tetapi juga sangat sementara, dengan tahap protein Fos kembali normal dalam 8 hingga jam 12. Uniknya di kalangan protein keluarga Fos adalah ΔFosB, produk terpenggal gen FosB, yang berdasarkan kestabilannya yang luar biasa, secara beransur-ansur terkumpul melalui proses pendedahan dadah berulang dan menjadi protein Fos yang utama yang dinyatakan di bawah syarat-syarat ini.22,33 Selain itu, kerana kestabilan ini, tahap ΔFosB berterusan selama beberapa minggu selepas penarikan dadah. Induksi kronik seperti ΔFosB telah ditunjukkan untuk hampir semua ubat penyalahgunaan34 dan, untuk ubat-ubatan yang paling, adalah selektif untuk neuron Dl-jenis NA.34,35 Ia juga telah ditunjukkan dalam penagih manusia.35 Sebuah kesusasteraan besar telah menunjukkan bahawa induksi ΔFosB tersebut dalam D1-Neuron jenis NAc meningkatkan kepekaan haiwan terhadap dadah serta ganjaran semula jadi dan mempromosikan pentadbiran diri ubat, mungkin melalui proses peneguhan positif (sila lihat 34 ke 38). Menariknya, induksi dadah ΔFosB dalam NAc lebih dramatik pada haiwan remaja, masa kerentanan ketagihan kecanduan,39 dan induksi oleh nikotin telah ditunjukkan untuk menjadi penambahbaikan ganjaran kokain seperti gerbang nikotin.40
Bagi CREB, banyak gen sasaran untuk ΔFosB telah dikenalpasti dalam NAc dengan menggunakan pendekatan gen calon dan genom.10,32 Walaupun CREB menginduksi dinorphin, ΔFosB menekannya, yang menyumbang kepada kesan pro-ganjaran ΔFosB.38 Satu lagi sasaran ΔFosB adalah cFos: kerana ΔFosB berkumpul dengan pendedahan ubat yang berulang ia menekan c-Fos dan menyumbang kepada suis molekul di mana ΔFosB dipilih secara terpilih dalam keadaan yang dirawat ubat kronik.41 Banyak lagi sasaran ΔFosB telah ditunjukkan untuk memantapkan keupayaan ubat-ubatan penyalahgunaan tertentu untuk mendorong plastisitas sinaptik dalam NAc dan perubahan yang berkaitan dalam aromaisasi dendritik neuron berduri medium NAc, seperti yang akan dibincangkan di bawah.
Akibat fungsional induksi ΔFosB di kawasan otak lain kurang dipahami, walaupun induksinya dalam korteks orbitofrontal (OFC) telah dipelajari secara terperinci. Di sini, ΔFosB mengantara toleransi yang berlaku kepada kesan-kesan kognitif yang mengganggu kokain semasa pendedahan kronik, dan penyesuaian ini dikaitkan dengan meningkatnya kokain diri pentadbiran.42,43
Ujian Genome yang luas telah mencadangkan beberapa gen sasaran yang berpotensi yang menengahi kesan ini.42 Walaupun sifat temporal unik ΔFosB, dan pengetahuan bahawa ia disebabkan oleh litar memori tradisional (misalnya, hippocampus), belum ada penerokaan mengenai peranan ΔFosB dalam memori tingkah laku, subjek yang menarik untuk penyelidikan masa depan.
Mekanisme epigenetik
Dalam tahun-tahun kebelakangan ini, kajian transkripsi telah diteruskan satu langkah ke epigenetik44 (Lihat Rajah 1), yang boleh didefinisikan secara meluas sebagai perubahan dalam ekspresi gen yang terjadi tanpa adanya perubahan urutan DNA. Mekanisme epigenetik mengendalikan pembungkusan DNA dalam inti sel melalui interaksi dengan histones dan banyak jenis protein nukleus lainnya, yang bersama-sama terdiri dari chromatin. Ekspresi gen dikawal oleh keadaan pembungkusan ini melalui pengubahsuaian kovalen histones, protein lain, dan DNA itu sendiri. Sebagai beberapa contoh, asetilasi histon cenderung untuk menggalakkan pengaktifan gen, metilasi histon sama ada boleh mempromosikan pengaktifan gen atau penindasan bergantung kepada residu Lys yang menjalani pengubahsuaian ini, dan metilasi DNA umumnya dikaitkan dengan penindasan gen walaupun bentuk varian tertentu metilasi ( contohnya, 5-hydroxymethylation) mungkin dikaitkan dengan pengaktifan gen.
Epigenetics adalah mekanisme yang menarik kerana, dalam sistem lain, sebagai contoh, biologi perkembangan dan kanser, pengubahsuaian epigenetik tertentu boleh kekal. Atas sebab ini, epigenetik telah diusahakan dalam model pembelajaran dan ingatan (contohnya, refleks 45-48) serta ketagihan;44,49 dalam kedua-dua sistem perubahan mendalam telah dilaporkan dalam asetilasi histon dan metilasi dan dalam metilasi DNA. Sebagai contoh, methyltransferase histone, G9a, terlibat dalam kedua-dua memori50 dan ketagihan.51,52 Dalam model kecanduan, Ungkapan G9a dikurangkan di NAc sebagai tindak balas terhadap perangsang atau obat pengacau dan tbeliau telah ditunjukkan untuk meningkatkan kesan ganjaran ubat ini.51,52 Menariknya, penindasan kokain G9a diasingkan oleh ΔFosB. G9a mempercepat dimethylation daripada Lys9 histone H3 (H3K9me2), penengah utama penindasan gen. Chip-chip atau ChIP-seq (chromatin immunoprecipitation diikuti, masing-masing, oleh cip promoter atau penjujukan tinggi) telah digunakan untuk mendapatkan peta gen gen gen di NAc yang memaparkan perubahan H3K9me2 selepas pendedahan perangsang atau pendedahan.32,52,53 Dengan melampaui senarai gen ini dengan perubahan gen ekspresi gen genom, dan dengan peta genom pelbagai jenis pengubahsuaian epigenetik (contohnya, ØFosB mengikat, CREB mengikat, pengubahsuaian histon lain, dll),32,53 ia perlu untuk mengenal pasti gen yang semakin lengkap yang dikawal oleh ubat penyalahgunaan dan untuk memahami mekanisme epigenetik yang terlibat.
Satu lagi bentuk peraturan epigenetik yang terlibat dalam ingatan dan ketagihan ialah penjanaan mikroRNA. Ini kecil, RNA bukan pengekodan mengikat ke kawasan-kawasan komplementer mRNA dan dengan itu menekan terjemahan mereka atau mendorong degradasi mereka. Pemotongan Argonaut, protein yang penting untuk pemprosesan miRNA, mengubah tindak balas tindak balas terhadap kokain, dengan kesan yang berbeza yang diperhatikan untuk D1 - berbanding jenis neuron berduri D2 sederhana.54 Beberapa miRNA tertentu juga telah ditunjukkan untuk dikawal oleh pendedahan dadah dan, sebaliknya, mempengaruhi tindak balas tingkah laku terhadap ubat-ubatan (mis., Nyatakan 55,56). Ia akan menarik dalam kajian masa depan untuk mengenal pasti sasaran mRNA daripada miRNAs ini dan mencirikan bagaimana ia mempengaruhi proses ketagihan.
Plastik synaptic
Jenis umum perubahan sinaptik yang sama pada sinaps glutamatergik, yang telah dikaitkan dengan hippocampus dan amygdala dalam ingatan tingkah laku (lihat artikel lain dalam isu ini), juga telah terbukti berlaku di kawasan ganjaran otak dalam model ketagihan dan menjadi penting dalam pengantaraan proses penagihan.57,58 Plastik sinaptik yang disebabkan oleh ubat-ubatan ini telah diterangkan di beberapa kawasan otak, namun, kami menumpukan perhatian di sini di NAc di mana kebanyakan penyelidikan telah menumpukan kepada tarikh (Rajah 2).
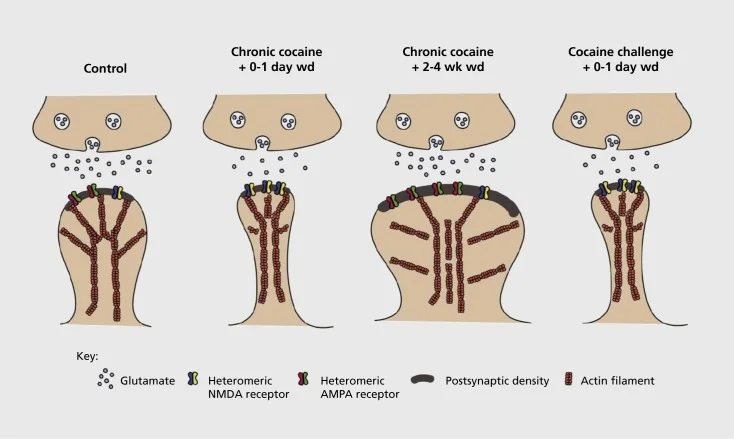
Model kelopak sinaptik yang berkaitan dengan ketagihan dan struktur dalam nukleus accumbens (NAc). Pendedahan kronik terhadap kokain menghasilkan penyusunan semula masa dan rejim penghidratan reseptor glukamat asid α-amino-3-hydroxy-5-methyl-4-isokazolepropionic (AMPA) dan N-methyl-D-aspartic acid (NMDA) spin neuron spin (MSN), serta perubahan struktur di kepala tulang belakang NAc MSNs yang berkaitan dengan bentuk plasticine synaptic yang berbeza. Sebagai contoh, kokain kronik mendorong ekspresi permukaan reseptor NMDA, pembentukan sinaps senyap dan kemurungan jangka panjang (LTD) pada titik masa pengeluaran awal. Semasa pengeluaran yang lebih lama (wd), perubahan sinaptik ini terbalik dengan hasilnya peningkatan ekspresi reseptor AMPA permukaan, penyatuan sinaps ke tulang belakang berbentuk cendawan dan potentiasi jangka panjang (LTP). Kesan-kesan ini dengan cepat kembali semula apabila terdedah kepada dos cabaran kokain yang membawa kepada penyusunan semula tulang belakang ke duri nipis dan kemurungan kekuatan sinaptik.
Eksperimen awal menunjukkan bahawa pendedahan berulang kepada ubat-ubatan perangsang penyalahgunaan menginduksi keadaan seperti LTD (kemerosotan jangka panjang) pada sinaps glutamatergik di NAc.59 Walau bagaimanapun, kerja yang lebih baru telah menunjukkan keplastikan yang sangat bergantung pada masa, dengan LTD yang berlaku lebih awal selepas pendedahan kokain yang terakhir berkembang menjadi lebih banyak keadaan seperti LTP (jangka masa potentiation) seperti keadaan masa yang lebih lama.60,61 Kerja-kerja ini, yang setakat ini telah dijalankan terutamanya menggunakan penyiasat yang ditadbir-yang bertentangan dengan ubat-ubatan yang dikendalikan oleh diri sendiri, telah menentukan keperluan untuk penyiasatan yang lebih sistematik dalam model pentadbiran diri yang mengesan bentuk plastisisme sinaptik yang berlaku pada sinaps glutamatergik Memperolehi kursus masa yang terperinci daripada perolehan pentadbiran diri kepada penyelenggaraannya, melalui masa penarikan dan kepupusan yang berlainan, dan sebagai tindak balas kepada rangsangan yang membangkitkan semula. Bekerja hingga kini juga telah menerangkan beberapa mekanisme molekul yang menyumbang kepada kepekaan sinaptik yang disebabkan oleh dadah ini, termasuk pemerdagangan reseptor AMPA kepada sinaps yang mungkin dimantapkan sebahagiannya melalui CaMKII (Ca2+/ protein kinase II yang bergantung kepada calmodulin) phosphorylation subun reseptor AMPA tertentu dan juga ekspresi diubah subun reseptor AMPA (contohnya, 60,62-65, Angka 2 dan 3). Peranan untuk CREB dan ΔFosB telah terlibat dalam fenomena ini, serta perubahan berkaitan dalam morfologi sinaps glutamatergik (lihat di bawah). Sebagai contoh, GluAl adalah sasaran untuk CREB di NAc, di mana GluA2 dan CaMKII adalah kedua-dua sasaran ΔFosB, di rantau otak .35,36,66,67 Melangkah ke hadapan, penting untuk menghubungkan penyesuaian khusus kepada perubahan yang bergantung pada masa dalam fungsi sinaptik dan ciri-ciri perilaku penagihan.

Mekanisme molekul yang mendasari kokain induksi dendritic spines pada nucleus accumbens (NAc) neuron berduri sederhana. A) menunjukkan peningkatan yang disebabkan oleh kokain dalam jumlah tulang belakang dendritik yang dapat disekat oleh ekspresi berlebihan G9a atau JunD (antagonis transkripsi perantara AP1), atau ditiru oleh ekspresi berlebihan FosB virus. B) Peraturan perdagangan reseptor AMPA (AMPAR) dan sitoskeleton aktin (kiri), serta peraturan transkripsi reseptor glutamat dan protein pengawas aktin (misalnya, seperti yang dimediasi melalui ΔFosB, kanan) telah terbukti memainkan peranan penting dalam memantapkan peraturan kokain mengenai ketumpatan tulang belakang dendritik NAc. UMK, kinase domain LIM; RAC, substrat toksin botulinum C3 yang berkaitan dengan Ras.
Alat percubaan baru memungkinkan untuk pertama kalinya untuk menentukan dengan ketepatan yang semakin meningkat yang litar tertentu memperlihatkan bentuk plasticine synaptic dan apa kelainan perilaku yang mereka mengah. Sebagai contoh, tdia perisai dan subkeluar inti dari perbezaan paparan NAc dalam kepekaan sinaptik yang disebabkan oleh ubat-ubatan, seperti D1-berbanding dengan jenis-jenis neuron berduri D2 dalam setiap subregion.60,63,64,67 Begitu juga, eksperimen optogenetik telah memberikan pandangan baru tentang sumbangan bentuk plasticine synaptic tertentu (contohnya, LTD) pada populasi spesifik synapses glutamatergik di NAc, contohnya, yang timbul daripada medial PFC versus amygdala medial berbanding subiculum ventral (output utama daripada hippocampus).68-70 Pada akhirnya, adalah perlu untuk meletakkan penyesuaian molekul yang disebabkan oleh ubat di setiap neuron aferen ini dengan penyesuaian khusus sinaps yang berlaku pada dendrit pasca-sinaptik mereka untuk menyusun pemahaman lengkap tentang bagaimana penyalahgunaan ubat-ubatan mengubah litar otak untuk mendorong aspek-aspek tertentu dari keadaan ketagih. Usaha ini akan memerlukan penghayatan yang lebih tinggi terhadap keplastikan yang disebabkan oleh ubat-ubatan di sinapsis penghambat di kawasan otak yang sama ini, kawasan yang telah mendapat perhatian yang sangat sedikit hingga kini.65
Keplastikan sel utuh
Walaupun majoriti penyelidikan yang melibatkan perubahan neurofsiologi dalam neuron dalam fenomena penyalahgunaan dadah, seperti dalam fenomena pembelajaran dan ingatan, telah memberi tumpuan kepada kepekaan sinaptik, terdapat bukti yang semakin meningkat untuk kepentingan plastisitas sel keseluruhan juga. Keplastikan sel utuh, juga disebut sebagai plastisitas homostatik,71 melibatkan perubahan keceriaan intrinsik sel saraf keseluruhan dengan cara yang tidak sinaps khusus. Memandangkan ciri-ciri tertentu penagihan dadah melibatkan sensitiviti yang dipertingkatkan atau dikurangkan kepada ubat, masuk akal bahawa keceriaan elektrik yang dipertingkatkan atau dikurangkan sel-sel saraf tertentu menyumbang kepada penyesuaian tingkah laku.5
. Contoh yang paling baik tentang plastisitas sel keseluruhan kepada ubat penyalahgunaan adalah keupayaan opiat kronik untuk meningkatkan keceriaan intrinsik neuron noradrenergik locus coeruleus (LC).72 Keupayaan yang meningkat ini dikawal melalui CREB dan induksi beberapa isoforms of adenylyl cyclase, yang mendorong peningkatan penembakan neuron LC mungkin melalui induksi saluran Na +.72-75 Hiperexcitabilty neuron LC mewakili mekanisme klasik toleransi dan ketergantungan dan memacu beberapa tanda dan gejala pengeluaran penipuan. Menariknya, CREB menirukan bentuk yang sama dengan kepekaan keseluruhan sel dalam neuron berduri medium NAc, yang juga diberikan hiperaksir dengan pendedahan kronik terhadap penyalahgunaan dadah melalui CREB.76 Oleh itu, ia akan menjadi kritikal dalam siasatan masa depan untuk memahami bagaimana plasticity synaptic-mediated synthesis glutamatergik pada neuron berdecit medium NAc65,66 merangkum dengan hiperseksitivitas intrinsik-mediasi CREB neuron-neuron ini76 untuk mengawal ciri tingkah laku ketagihan.
Satu lagi contoh kelenturan sel keseluruhan dalam model ketagihan adalah hiperkitabiliti neuron dopamine VTA yang berlaku selepas pendedahan kronik terhadap ubat abusdanRajah 4).77,78 Penyesuaian ini, yang dikaitkan dengan perubahan morfologi dalam sel-sel saraf ini (lihat bahagian seterusnya), tidak dimediasi oleh CREB tetapi dicapai melalui pengawalan lekukan isyarat neurotropik, seperti yang dijelaskan di bawah.
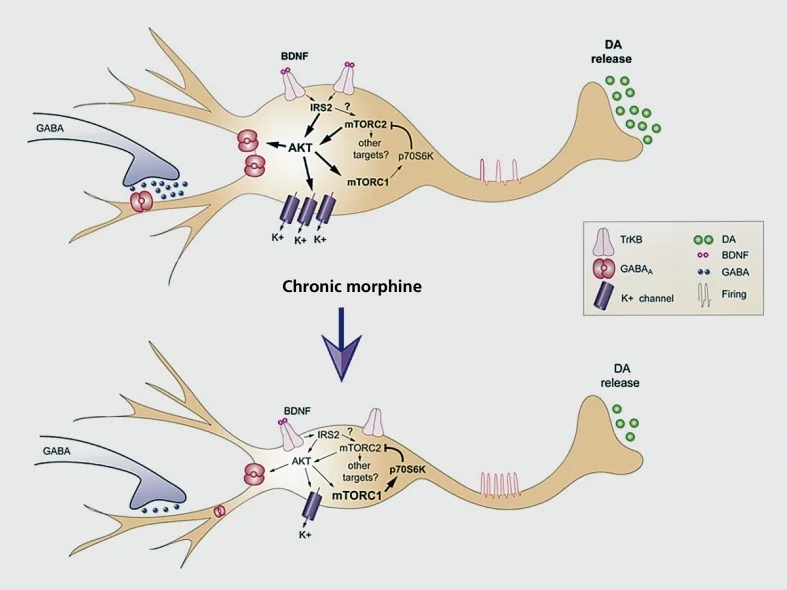
Model kerja penyesuaian morfin yang disebabkan oleh kronik di kawasan tegar ventral (VTA) neopsi dopamin. Morfin kronik menurunkan VTA dopamine (DA) soma saiz namun meningkatkan keceriaan neuron, sementara penghantaran dopamin ke accumbens nukleus berkurangan. Kesan bersih morfin adalah jalur ganjaran yang kurang responsif, iaitu toleransi ganjaran. Downregulation of IRS2-AKT signaling in VTA mediates effects morfine chronic on soma size and excitability electrical; kesan pada kegembiraan dimediasi melalui penurunan asid γ-aminobutyric (GABA) A dan penindasan ekspresi saluran K '. Kegiatan mTORC2 yang dikurangkan oleh morfin dalam VTA adalah penting untuk penyesuaian morfologi dan fisiologi yang disebabkan morfin dan untuk toleransi ganjaran. Berbeza dengan mT0RC2, morfin kronik meningkatkan aktivitas mTORCI, yang tidak mempengaruhi adaptasi yang disebabkan oleh morfin. BDNF, faktor neurotropik yang berasal dari otak; IRS, bahan reseptor insulin; mTORC, kompleks mTOR; AKT, protein kinase B Diterbitkan semula daripada ref 77
Keplastikan morfologi dan mekanisme neurotropik
Peningkatan bukti, sebahagian besar dari kajian neuron hippocampal dan cerebral, telah menunjukkan bahawa perubahan plastisitas sinaptik dikaitkan dengan perubahan morfologi pada sinapsis. Sebagai contoh, LTD dan penjanaan sinapsis senyap dikaitkan dengan pembentukan dendritik dendritik yang nipis atau rapi, manakala LTP dikaitkan dengan duri yang lebih besar, cendawan.79,80 Oleh itu, menarik bahawa bidang penyalahgunaan dadah telah memfokus pada perubahan akibat dendritik yang disebabkan oleh ubat selama> 15 tahun. Pendedahan kronik ke ubat penyalahgunaan perangsang meningkatkan ketumpatan tulang belakang dendritik neuron berduri sederhana NAc, perubahan yang mendominasi untuk jenis neuron Dl.67,81,82 Induksi duri telah dikaitkan dengan sebahagian besarnya dengan respons tingkah laku yang sensitif terhadap ubat-ubatan ini, walaupun beberapa bukti bertentangan dengan pandangan ini.
Seperti kajian keplastikan sinaptik, bagaimanapun, lebih banyak kerja diperlukan untuk menentukan sistem perubahan dendritik dini yang berlaku semasa kursus pengambilan diri, pengeluaran, dan kambuh semula jadi. Studies setakat ini, yang melibatkan penyiasat dan dadah yang ditadbir sendiri, mencadangkan perubahan tulang belakang yang sangat berbeza yang berlaku pada masa penarikan balik yang berbeza dan dalam cengkerang NAc berbanding subregional teras.83-86 Ia juga akan penting untuk menentukan mekanisme molekul yang tepat yang mana kokain atau perangsang lain menghasilkan kesan-kesan tertentu yang bergantung pada masa dan jenis sel. ΔFosB telah terbukti perlu dan mencukupi untuk induksi duri yang tidak matang pada neuron Dl jenis NA.35,51,67 Peraturan sedemikian berlaku bersama-sama dengan kokain dan regulasi ΔFosB beberapa protein yang diketahui mengawal penyusunan semula cytoskeleton aktin. Sebagai satu contoh, peraturan transkrip beberapa faktor pertukaran nukleotida guanine dan GTPase mengaktifkan protein merangsang Rac1, GTPase kecil, untuk aktiviti berkurang secara sementara sebagai tindak balas terhadap pendedahan kokain masing-masing, dan penurunan berkurangnya dalam aktiviti Rac1 telah ditunjukkan, menggunakan kawalan optogenetik Rac1, untuk memeterai induksi duri yang tidak matang.87 Kesan Racl ini mungkin berlaku melalui kawalan cofilin dan protein pengawalseliaan actin lain, yang juga telah ditunjukkan untuk menengahi peraturan kokain pertumbuhan tulang belakang.87,88 Walau bagaimanapun, adalah penting untuk menekankan bahawa ini adalah satu-satunya jalan yang terlibat dalam peraturan kokain mengenai duri yang belum matang, kerana beberapa protein lain telah terbukti memainkan peranan penting juga, termasuk CDK5 (kinase-5 yang bergantung pada siklin), CaMKII, NFkB , MEF2, CREB, G9a, dan DNMT3 (DNA methyltransf erase 3a), untuk beberapa nama.20,21,35,51,67,89,90 Menariknya, peraturan kokain beberapa gen ini, termasuk induksi CDK5, CaMKII, dan NFkB, dan penindasan G9a, juga dimediasi melalui ΔFosB.20,35,51,91
Yang menghairankan, ubat pengacau penipuan menimbulkan kesan sebaliknya dan mengurangkan ketumpatan tulang belakang dendritik neurons berduri NAc sederhana.81 Sedikit diketahui tentang akibat tingkah laku penyesuaian ini dan mekanisme molekul yang mendasari yang terlibat. Fenomena ini ialah, Walau bagaimanapun, mengejutkan, memandangkan CREB dan ΔFosB diinduksi oleh kedua-dua perangsang dan opiat dan kedua-duanya terlibat dalam induksi perangsang stimulasi NAc dendritic spine density. Ini menimbulkan persoalan bagaimana opiates menahan ketumpatan tulang belakang NAc walaupun induksi mereka faktor-faktor ini.
Bentuk morfologi utama yang lain yang dilihat dalam model penyalahgunaan dadah adalah pengurangan fizikal dalam saiz sel soma neuron dopamin VTA yang disebabkan oleh pentadbiran opiate kronik.77,92,93 Penyesuaian yang sama berlaku sebagai tindak balas kepada cannabinoids.94 Penguncupan neuron VTA dopamine, yang berlaku dengan pentadbiran diri yang tidak baik93 dan telah didokumentasikan dalam penagih heroin manusia yang diperiksa postmortem,77 seolah-olah memeterai toleransi ganjaran dan dikaitkan dengan pembebasan dopamin dikurangkan di NAc. Bukti yang banyak sekarang menunjukkan bahawa pengurangan dalam saiz soma sel ini dimediasi oleh penindasan opiate faktor neurotrofik yang berasal dari otak (BDNF) dalam neuron ini. Kami mempunyai hubungan secara langsung dengan pengeluaran sokongan BDNF ini, dan pengecutan neuron VTA, untuk mengurangkan aktiviti cascade batalion BDNF dalam neuron dopamin VTA, mengurangkan aktiviti IRS2 (substrat reseptor insulin-2), AKT (serine-threineine kinase), dan TORC2 (sasaran rapamycin-2, yang tidak sensitif terhadap rapamycin).77,93 Kami juga telah menghubungkan downregulation ini dengan memberi isyarat BDNF secara langsung kepada peningkatan keseronokan yang mendorong morfin dalam neuron-neuron ini, seperti yang dinyatakan sebelum ini.77,78 Sesungguhnya, saiz sel yang berkurangan dan peningkatan keseronokan dipadankan dengan ketat, kerana induksi satu mengarah kepada yang lain dan sebaliknya. Kawalan ke atas kegembiraan sel ini melibatkan penindasan K+ saluran dan GABAA semasa dalam neuron ini.
Peranan BDNF dalam mengawal respons morfin pada tahap VTA berbeza dengan penglibatannya yang sangat berbeza dalam tindakan kokain dan perangsang lain. Rangsangan mendorong BDNF memberi isyarat kepada NAc, kesan akibat peningkatan sintesis tempatan BDNF serta peningkatan pembebasan dari beberapa kawasan afferent.95 Selain itu, peningkatan isyarat BDNF di NAc, tetapi tidak dalam VTA, telah ditunjukkan untuk mempromosikan kesan tingkah laku ubat-ubatan ini termasuk pentadbiran diri mereka.95,96 Peraturan yang berlawanan dari pemberian isyarat BDNF di jalur VTA-NAc oleh opiat berbanding perangsang menimbulkan kemungkinan bahawa perbezaan tersebut menjadi perantara peraturan ubat lawan dendritik NAc, kemungkinan sekarang sedang disiasat.
Arah masa depan
Naratif di atas menggariskan kemajuan besar yang telah dibuat dalam memahami penyesuaian molekul dan selular yang berlaku di kawasan ganjaran otak sebagai tindak balas kepada pendedahan berulang kepada ubat penyalahgunaan, dan dalam menyesuaikan penyesuaian individu kepada ciri-ciri perilaku tertentu sindrom ketagihan dalam model haiwan . Walaupun kemajuan ini, soalan utama kekal. Kebanyakan pengetahuan sedia ada kami memberi tumpuan kepada VTA dan NAc, dengan kurang banyak maklumat yang tersedia mengenai kawasan otak limbik utama yang juga penting untuk ketagihan dadah. Di samping itu, semua demonstrasi percubaan peranan penyebab molekul-selular penyesuaian dalam tingkah laku yang berkaitan dengan dadah telah memanipulasi penyesuaian individu satu demi satu. Untuk memanipulasi banyak penyesuaian pada masa yang sama adalah jelas jauh lebih sukar, tetapi juga penting, kerana kita tahu bahawa ubat menghasilkan banyak jenis perubahan yang berbeza walaupun dalam neuron individu, yang mungkin menyimpulkan dengan cara yang rumit untuk mempengaruhi tingkah laku. Pendekatan biologi sistem sedemikian akan menjadi penting untuk akhirnya memecah asas biologi ketagihan. Akhir sekali, usaha untuk memahami mekanisme molekul-selular kenangan yang berkaitan dengan ketagihan mendapati diri mereka pada titik di mana semua usaha lain untuk memahami asas biologi memori tingkah laku kini perjuangan: keupayaan kita untuk mengaitkan fenomena biologi ke ingatan tingkah laku kompleks masih sangat sukar. Mengatasi pembahagian ini mungkin merupakan cabaran terbesar dalam neurosains.
Penghargaan
Kerja-kerja ini disokong oleh geran dari Institut Kebangsaan mengenai Penyalahgunaan Dadah.
Singkatan terpilih dan akronim
- Nac
- nukleus accumbens
- CREB
- unsur tindak balas CAMP mengikat protein
- ΔFosB
- faktor transkripsi keluarga Fos
- VTA
- kawasan tegegal ventral
- AMPA
- asid α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic
- LTD
- kemurungan jangka panjang
- LTP
- penipuan jangka panjang
- BDNF
- faktor neurotropik yang berasal dari otak
- NKkB
- faktor nuklear kB
RUJUKAN