Laporan Saintifik jumlah 9, Nombor artikel: 16918 (2019)
Abstrak
Penggunaan sukrosa yang berlebihan menimbulkan keinginan seperti kecanduan yang boleh menyokong wabak obesiti. Opioid dan dopamin mengetengahkan kesan ganjaran ubat penyalahgunaan, dan ganjaran semula jadi daripada rangsangan seperti makanan enak. Kami menyiasat kesan sukrosa menggunakan pengimejan PET dengan [11C] carfentanil (agonis reseptor μ-opioid) dan [11C] raclopride (dopamine D2 / 3 antagonist reseptor) dalam tujuh anestetik kanak-kanak Göttingen minipigs. Kami kemudian memberikan minipigs akses kepada penyelesaian sukrosa selama satu jam pada 12 hari berturut-turut dan melakukan pengimejan lagi 24 jam selepas akses sukrosa terakhir. Dalam sampel yang lebih kecil daripada lima minipig, kami melakukan tambahan [11C] sesi PET karfentanil selepas pendedahan sukrosa pertama. Kami mengira potensi mengikat voxel (BPND) dengan menggunakan cerebellum sebagai wilayah yang tidak dapat digantikan, mengasingkan perbezaan dengan pemetaan statistik yang tidak parametrik, dan melakukan analisis serantau. Selepas 12 hari akses sukrosa, BPND kedua-dua tracer telah menurun dengan ketara di striatum, accumbens nukleus, thalamus, amygdala, cortex cortex dan korteks prefrontal, selaras dengan pengawalseliaan kepadatan reseptor. Selepas satu pendedahan kepada sukrosa, kami mendapati penurunan pengikatan [11C] carfentanil dalam nukleus accumbens dan cingulate cortex, selaras dengan pembebasan opioid. Ketersediaan reseptor opioid dan dopamine yang lebih rendah mungkin menjelaskan potensi ketagihan yang berkaitan dengan pengambilan sukrosa.
Pengenalan
Lima peratus populasi dunia adalah secara klinikal gemuk1. Sebagai lambang sindrom metabolik, obesiti dikaitkan dengan diabetes jenis 2, penyakit kardiovaskular, masalah pernapasan, dan risiko kemurungan dan mungkin demensia2. Peningkatan penggunaan makanan padat tenaga telah membesar-besarkan perbezaan fisiologi antara kelaparan homeostatik yang berikut kekurangan makanan, dan kelaparan hedonik, atau "keinginan", yang berlaku tanpa ketiadaan kekurangan3,4. Oleh kerana peraturan homeostatik sahaja tidak dapat menjelaskan kenaikan semasa obesiti, adalah wajib untuk menguji kesan pada mekanisme otak ganjaran dan keseronokan sifat ketagihan makanan yang sangat enak.
Penggunaan alkohol dikaitkan dengan obesiti, dan sukrosa semakin dianggap sebagai zat adiktif5. Sesetengah penemuan adalah berbeza dengan tuntutan ini disebabkan oleh kesukaran untuk memisahkan penggunaan makanan yang tidak enak dari tindak balas makanan hedonik, dan dalam menentukan bahan ketagihan dalam makanan yang diproses, serta mekanisme yang berbeza dengan makanan yang mengubah litar otak melalui laluan semula jadi6. Walau bagaimanapun, dalam konteks tertentu, pengambilan sukrosa akan mendorong ganjaran dan keinginan, sebanding dengan magnitud yang disebabkan oleh ubat-ubatan ketagihan, yang mengakibatkan kegemukan dan akhirnya obesiti6,7.
Kelaparan dikaitkan dengan "ingin" yang berkait rapat dengan kesan neurotransmiter dopaminergik dalam beberapa keadaan ganjaran8, tetapi masih tidak jelas bagaimana tindakan dopamin (DA) dimodulasi sebagai tindak balas kepada makanan kompulsif. Penggunaan makanan enak dikaitkan dengan "suka", diselia terutamanya oleh sistem opioid endogen, terutama reseptor μ-opioid (μOR)9,10, yang boleh menggalakkan penggunaan lebihan apabila diturunkan deregulasi. Dalam laporan ini, kami menguji tuntutan bahawa sukrosa membawa kepada pembebasan opioid dan dopamin yang merendahkan ketersediaan reseptor μOR dan DA D2 / 3. Ketersediaan adalah indeks bilangan reseptor kosong yang tersedia untuk mengikat penjejak dan secara prinsipnya tidak membedakan penghunian ligand dan kepadatan reseptor11.
Permulaan makan kompulsif bergantung kepada pelbagai faktor, dan kajian kausal pada manusia meningkatkan isu etika. Oleh itu, majoriti kajian menumpukan pada tingkah laku makan pada tikus12. Walaupun tikus mempunyai "gigi manis", mekanisme homeostatic mereka penting untuk menaikkan berat badan, metabolisme, dan jenis pengumpulan lemak, berbeza dengan ketara daripada manusia. Minipig Göttingen adalah haiwan omnivora yang besar dengan otak gyrencephalic yang maju, yang dapat diindikasikan pada resolusi yang mencukupi. Kawasan kortikal subcortical dan prefrontalnya yang jelas13 membolehkan terjemahan yang lebih langsung kepada fungsi otak manusia. Di sini, kita menggunakan pengimejan tomografi pelepasan positron (PET) untuk menguji dalam vivo μOR dan DA D2 / 3 dalam model minipig pendedahan sukrosa subkronik. Dalam sampel yang lebih kecil, kami menyiasat kesan segera terhadap penghunian μOR selepas pendedahan pertama kepada sukrosa. Akhirnya, kami menguji hubungan antara perubahan reseptor dengan adanya kedua-dua pendaki.
Hasil
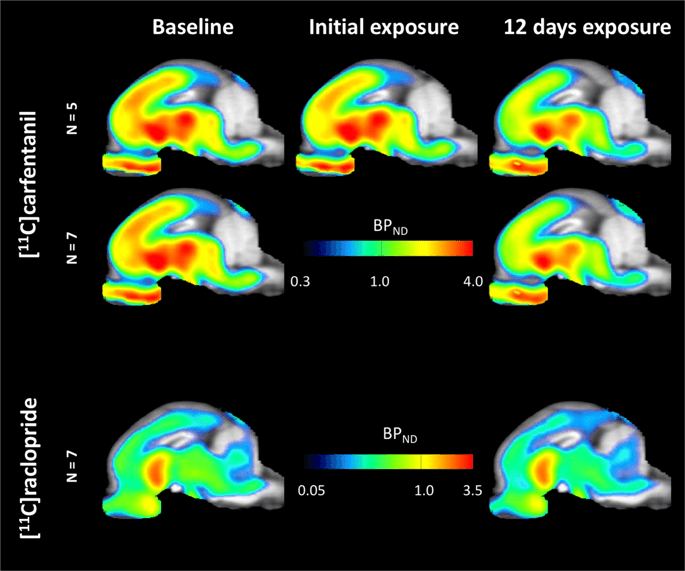
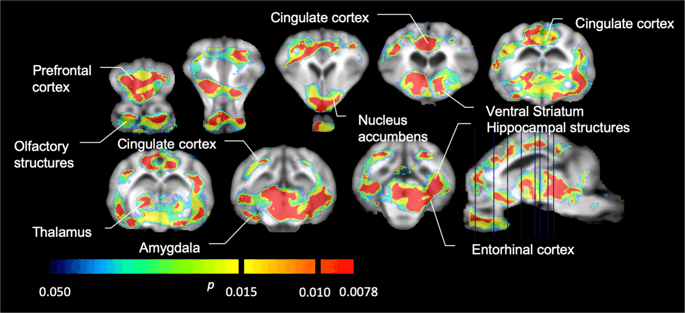
Purata peta parametrik [11C] carfentanil dan [11C] potensi mengikat raclopride (BPND) ditunjukkan dalam Rajah. 1. Untuk menganalisis perubahan yang berlaku selepas pendedahan sukrosa pertama dalam lima minipig berbanding dengan garis dasar, dan satu hari selepas 12th akses sukrosa dalam tujuh minipig berbanding dengan garis dasar, kami menggunakan teori permutasi dan analisa seluruh otak yang terhad secara serantau, kaedah pilihan untuk sampel saiz ini14.
Potensi mengikat voxel yang tidak dapat digantikan secara purata (BPND) peta ditapis pada imej MRI dalam pandangan sagittal. Data dibentangkan untuk [11C] carfentanil BPND daripada 5 minipigs yang dicatatkan pada garis dasar, selepas terdedah awal kepada sukrosa dan selepas 12 hari pendedahan sukrosa (baris atas). [11C] carfentanil BPND daripada semua 7 minipigs yang dicatatkan pada garis dasar dan selepas 12 hari akses sucrose dibentangkan di baris tengah. [11C] raclopride BPND daripada semua 7 minipigs yang dicatatkan pada garis dasar dan selepas 12 hari akses sucrose ditunjukkan pada baris bawah. Ambil perhatian bahawa skala warna adalah eksponen untuk menyerlahkan [11C] raclopride BPND di kawasan extrastriatal.
Pendedahan sukrosa awal
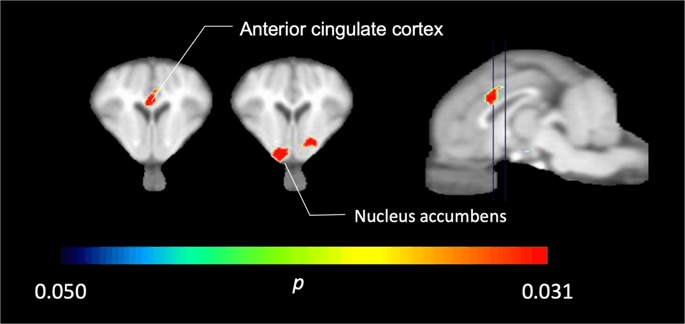
Dalam lima minipigs yang dicatatkan dengan [11C] carfentanil pada garis dasar dan sejurus selepas pendedahan sukrosa pertama, kami mendapati pengesanan pengesanan yang berkurangan dalam korteks cingulate anterior dan nukleus akrab sebagai tindak balas kepada sukrosa, ditunjukkan dalam warna dalam Rajah. 2, menunjukkan p <0.05. Kami mengesan sebanyak 14% penurunan pengikatan pelacak di kedua-dua kawasan berbanding dengan garis dasar.
Penurunan ketara dalam [11C] carfentanil BPND selepas pendedahan air sukrosa pertama berbanding dengan garis dasar (n = 5). Hanya voxel dengan ketara (p <0.05) penurunan ditunjukkan sebagai kawasan berwarna yang diproyeksikan pada pemotongan MRI berwajaran T1 pada tahap korteks cingulate anterior (kiri) dan accumbens inti (tengah) dari atlas otak minipig stereotaxic Perhatikan bahawa tahap kepentingan maksimum yang dapat dicapai dengan 5 haiwan adalah 2-5 ≈ 0.031 (lihat bar warna). Data dibentangkan pada bahagian coronal otak babi pada tahap yang ditunjukkan pada imej sagittal (kanan).
12 hari akses sukrosa
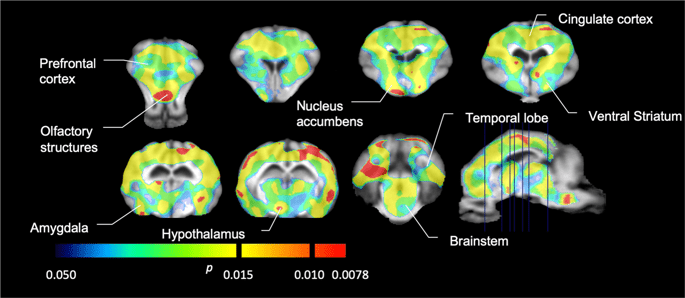
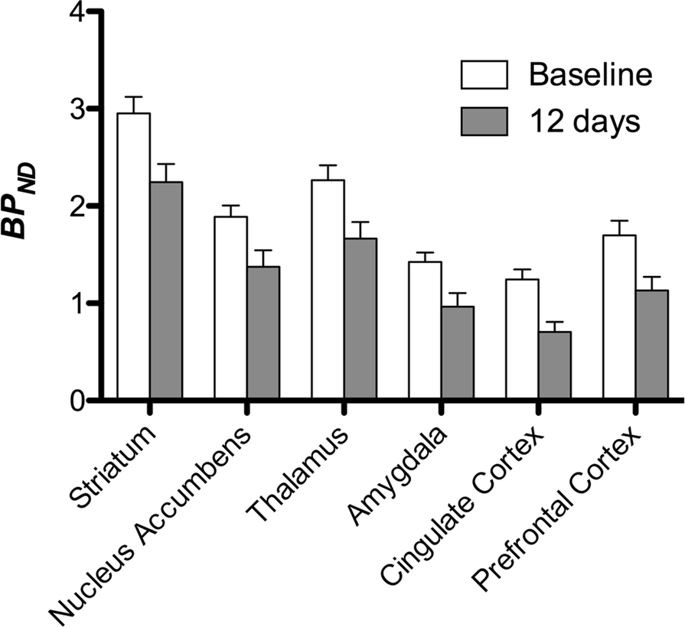
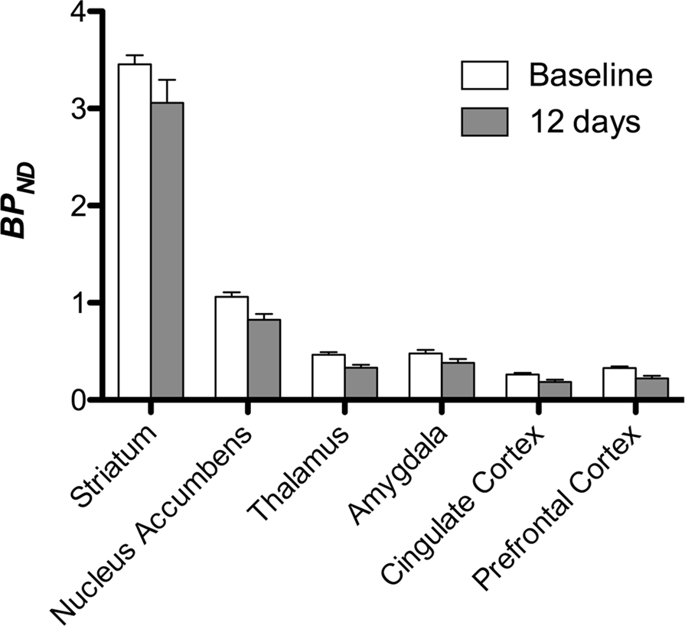
Kami kemudian melakukan analisis tujuh minipigs yang dicatatkan dengan [11C] carfentanil pada asas dan selepas 12 hari akses sukrosa dan dijumpai pengurangan penjejakan yang ketara dalam haiwan yang terdedah sukrosa berbanding dengan garis dasar. Kawasan yang paling ketara terjejas ditunjukkan dalam warna merah dalam Rajah. 3 (p <0.01) dan termasuk bahagian struktur penciuman, inti nukleus / striatum ventral dan korteks temporal / lobus, diikuti oleh area yang ditunjukkan dalam warna kuning (p <0.015) yang merangkumi bahagian korteks prefrontal, korteks cingulate, amigdala dan batang otak . Untuk mendapatkan BPND nilai dan menilai perubahan peratus, kami melakukan analisis serantau dan memperoleh nilai min di setiap rantau pada asas dan selepas penggunaan sukrosa (Gamb. 4).
Penurunan ketara dalam [11C] potensi karfentanil mengikat (BPND) antara baseline dan selepas 12 hari pendedahan air sukrosa (n = 7). Voxel dengan ketara (p <0.05) penurunan ditunjukkan sebagai kawasan berwarna yang diproyeksikan ke potongan MRI berwajaran T1 dari atlas otak minipig stereotaxic. Data disajikan pada bahagian otak koronal pada tahap yang ditunjukkan pada gambar sagital (kanan bawah). Perhatikan bahawa tahap kepentingan maksimum yang dapat dicapai dengan 7 haiwan adalah 2-7 ≈ 0.0078 (lihat bar warna).
Kami menggunakan [11C] raclopride sebagai pengesan reseptor DA D2 / 3 di kawasan otak yang striatal dan extrastriatal dalam minipigs pada garis dasar dan selepas 12 hari akses sukrosa (Gamb. 1). Kami mendapati penurunan pengikatan pelacak pada haiwan yang terdedah kepada sukrosa, dibandingkan dengan garis dasar dengan kesan terbesar (p <0.01) di kawasan korteks prefrontal, nukleus accumbens / ventral striatum, cingulate cortex, amygdala, thalamus, mesencephalon, rantau hippocampal, dan daerah penciuman (Gamb. 5). Data dari analisis serantau dibentangkan dalam Rajah. 6.
Penurunan ketara dalam [11C] potensi mengikat raclopride (BPND) antara baseline dan selepas 12 hari pendedahan air sukrosa (n = 7). Voxel dengan ketara (p <0.05) penurunan ditunjukkan sebagai kawasan berwarna yang diproyeksikan ke potongan MRI berwajaran T1 dari atlas otak minipig stereotaxic. Data disajikan pada bahagian koronal otak babi pada tahap yang ditunjukkan pada gambar sagital (kanan bawah). Perhatikan bahawa tahap kepentingan maksimum yang dapat dicapai dengan 7 haiwan adalah 2-7 ≈ 0.0078 (lihat bar warna).
Hubungan antara [11C] raclopride dan [11C] data carfentanil
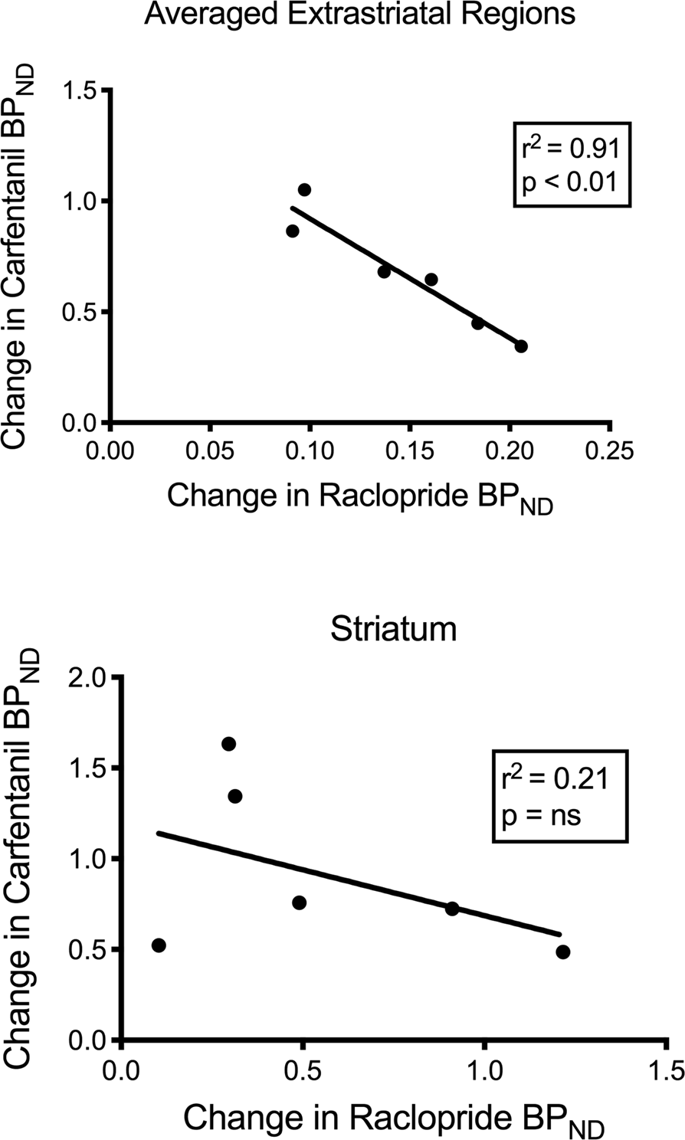
Kami menguji korelasi yang berpotensi antara [11C] raclopride dan [11C] nilai karfentanil BPND di kawasan striatal dan non-striatal di minipigs pada garis dasar dan selepas pengambilan sukrosa selama 12 hari, tanpa persatuan yang diamati. Kami kemudiannya menguji sama ada penurunan pengikisan pengikatan dikaitkan, dan kami membandingkan perubahan BPND untuk [11C] raclopride dengan perubahan BPND untuk [11C] carfentanil hanya dalam minipigs yang mempunyai BP yang lebih rendahND dari kedua-dua tracers selepas pengambilan sukrosa (n = 6). Kami mendapati korelasi negatif yang signifikan dalam extrastriatal (r2 = 0.91, p <0.01), tetapi tidak di daerah striatal (Gbr. 7).
Korelasi antara pra-tolak selepas pasca penurunan [11C] raclopride dan [11C] potensi karfentanil mengikat (BPND) dalam minipig dengan pengurangan jejak yang dikurangkan selepas pengambilan sukrosa (n = 6). Data dari wilayah ekstrastrial yang rata (atas) dan striatum (bawah) dibentangkan. Koefisien penentuan (r2) dan nilai p ditunjukkan untuk setiap graf.
Perbincangan
Kami menentukan kesan akses sekejap berulang kepada sukrosa terhadap opioid dan DA neurotransmit dalam otak mamalia. Longitudinal dalam vivo Pencitraan PET penerima reseptor μOR dan DA D2 / 3 mendedahkan ketersediaan penerima reseptor sepanjang litar ganjaran, termasuk nukleus accumbens, korteks prefrontal, dan korteks cingulate anterior. Hasilnya dengan jelas menunjukkan bahawa sukrosa mempengaruhi mekanisme penghargaan dengan cara yang serupa dengan ubat penyalahgunaan.
Pengambilan sukrosa sebagai bahan semulajadi dikenali untuk melepaskan DA dan mendorong pergantungan kepada tikus15, dengan sukrosa kelihatan lebih menyenangkan daripada kokain dalam tikus dalam konteks tertentu. Oleh itu, tikus bekerja dengan lebih gigih untuk mendapatkan sukrosa daripada kokain, walaupun tanpa ketiadaan makanan5. Walau bagaimanapun, kesan sukrosa dikawal selia oleh sistem homeostatik dan oleh litar ganjaran hedonik16,17 yang boleh menengahi perbezaan antara aspek pemakanan dan hedonik tindakan sukrosa18. Kami memilih untuk jadual satu jam sehari untuk mempromosikan "binging", kerana kajian terdahulu dalam tikus telah menunjukkan pengambilan yang lebih tinggi semasa jam pertama akses harian dalam jadual sekejap15,19. Kajian tingkah laku pengambilan makanan sering menyasarkan haiwan yang terhad kepada makanan, tetapi reka bentuknya tidak semestinya mencerminkan mekanisme saraf yang sama aktif dalam obesiti. Babi dalam kajian ini bukanlah makanan yang terhad dan diberi makan jumlah biasa dari diet biasa mereka selain akses kepada sukrosa.
Reseptor opioid (OR) secara meluas dinyatakan dalam otak, khususnya dalam struktur yang dikenali untuk memodulasi proses makan dan ganjaran20. OR telah terbukti penting dalam memberi manfaat dan reaksi reaksi kokain21,22,23,24. Perubahan dalam mengikat juga dikaitkan dengan respons homeostatik untuk makan dan keseronokan yang berkaitan dengan makanan yang enak25. Khususnya, "suka" makanan dikaitkan dengan sistem opioid endogen, terutamanya μOR9,10 dalam cengkerang nukleus accumbens dan pallidum ventral26. Infusi agonis μOR ke dalam bahagian-bahagian yang berbeza dari accumbens nukleus dan pallidum ventral dengan kuat meningkatkan tingkah laku "suka", termasuk tudung lidah dan menjilat kaki, berikutan pengambilan makanan yang lebih enak27,28,29. Bukti lanjut untuk isyarat opioid dalam pemprosesan peraturan hedonik berasal dari antagonis μOR yang melemahkan pengambilan chow yang baik dalam kedua-duanya iklan libitummakanan haiwan dan makanan terhad, tetapi dengan kesan yang lebih terhad pada pengambilan pelet standard yang tidak enak30,31. Pada manusia, antagonis μOR mengurangkan pengambilan makanan jangka pendek dan mengurangkan keseronokan makanan enak32,33,34. Isyarat opioid dalam amygdala basolateral juga menyumbang kepada "ingin" makanan melalui modulasi mencari ganjaran dan nilai insentif makanan35.
Dengan [11C] carfentanil, kami memperoleh imej pengikat pengesan yang sensitif kepada tahap μOR dan pembebasan otak opioid endogen36,37. Kami mengesan hilangnya ketersediaan μOR dengan segera di kawasan-kawasan nukleus accumbens dan korteks cingulate anterior, kawasan otak khusus jalur ganjaran, selepas penggunaan awal sukrosa sebanyak lima minipig, konsisten dengan pembebasan opioid endogen. Kajian terdahulu telah menunjukkan bahawa makanan enak boleh membawa kepada perasaan keseronokan38 dengan merangsang pembebasan opioid. Selepas 12 hari akses sukrosa, kami melihat penurunan [11C] mengikat karfentanil, yang mempunyai beberapa penjelasan yang mungkin39 termasuk pelepasan opioid endogen dan mengikat kepada μOR, penyambungan μOR akibat peningkatan opioid yang mengikat, dan meningkatkan pengaktifan reseptor DA D2 / 3 yang membawa kepada desensitisasi heterologus μOR40.
Untuk menyokong penemuan sekarang, [11C] kajian carfentanil pesakit dengan bulimia41, obesiti42,43,44, dan gangguan makan pesta45, menunjukkan penurunan ketersediaan reseptor. Walau bagaimanapun, ini adalah keadaan kronik manakala minipig hanya menerima sukrosa selama 12 hari. Dalam kajian tentang tingkah laku makan akut dalam lelaki yang sihat, makanan menyebabkan pembebasan serioid serioid yang meluas dan meluas, baik dalam kehadiran dan ketiadaan hedonia, menunjukkan bahawa pembebasan opioid mencerminkan metabolik dan homeostatik, serta hedonik, respons25. Kajian ini, bersama dengan yang lain yang menggambarkan pesakit selepas hidangan cair yang berperisa coklat44, secara langsung berkaitan dengan kajian akut lima minipig selepas pendedahan sukrosa pertama, tetapi berbeza daripada kajian pendedahan sukrosa subkronik selama 12 hari di mana ketersediaan reseptor yang dikurangkan lebih cenderung mencerminkan overstimulation yang berulang dan penyesuaian yang lebih tinggi dari μOR.
Korteks prefrontal adalah penting dalam membuat keputusan dan memberi nilai kepada item dan oleh itu, μOR dalam korteks prefrontal mungkin bertanggungjawab untuk penilaian yang diubah suai makanan, yang boleh meningkatkan potensi ketagihan makanan. Kami telah menemui pengikatan yang berkurangan dalam korteks prefrontal, selaras dengan kajian terdahulu yang menunjukkan bahawa diet lemak yang tinggi mengurangkan tahap mRNA μOR dalam korteks prefrontal46 dan penyerapan agonis μOR dalam korteks prefrontal meningkatkan pengambilan makanan manis47. Sekali lagi, masalah ini timbul sama ada diet tinggi lemak adalah keadaan yang lebih kronik yang lebih mungkin mengarahkan pengurangan regulator reseptor, berbanding dengan reka bentuk suapan sucrose jangka pendek, mencadangkan pembebasan opioid endogen yang berterusan yang menggantikan karfentanil pengangkut yang terikat kepada μOR , walaupun selepas 12 hari sukrosa.
DA telah terbabit dalam ganjaran baik dari dadah dan tingkah laku. Penggunaan kokain kronik telah didapati menghalang isyarat DA48. Tahap reseptor DA D1 dan D2 / 3 diubah oleh nikotin dalam otak babi49, dan dalam primata bukan manusia dengan sejarah penderaan kokain50, selaras dengan pengurangan reseptor D2 / 3 di otak penagih kokain manusia51,52. Bagi ubat penyalahgunaan, sukrosa telah terbukti menyerap reseptor DA D119 dan meningkatkan pengeluaran DA53, menguatkan peranan DA dalam "ingin" berhubung dengan makanan yang enak. Kajian PET terdahulu telah menunjukkan penurunan reseptor DA D2 / 3 yang ketat dalam obesiti morbid vs berat purata54,55, sama besarnya dengan pengurangan pesakit ubat-ubatan56, dan dalam haiwan dengan model obesiti57. Dalam kajian tikus, penghapusan reseptor D2 / 3 di striatum menggalakkan pembangunan makanan mencari makanan tikus yang kompulsif dengan akses kepada makanan yang enak57.
Pengamatan kami terhadap ketersediaan penerima reseptor D2 / 3 yang menurunkan babi mungkin menunjukkan peningkatan paras DA sebagai tindak balas terhadap kesungguhan insentif yang dikaitkan dengan pengambilan sukrosa sejak DA dibebaskan sebagai sebahagian daripada pengambilan dadah penyalahgunaan dan aktiviti menyenangkan lain52,58,59,60. Memandangkan babi telah dibiakkan semasa pengimejan, dan tidak menerima sukrosa dalam masa 24 jam, penurunan D2 / 3 BPND lebih cenderung mencerminkan pengurangan bilangan reseptor sebagai tindak balas kepada peningkatan pembebasan DA yang berpanjangan pada setiap 12 hari akses sukrosa. Pengurangan ini dapat membangkitkan nilai ganjaran otak, yang dikaitkan dengan pengawalseliaan reseptor DA D2 yang ketat. Ini mungkin menjelaskan peningkatan kerentanan terhadap ubat penyalahgunaan yang dilihat dalam kajian sebelumnya terhadap tikus yang mengatasi sukrosa yang menyebabkan sensitiviti silang terhadap kokain, hiperaktif selepas amphetamine dos yang rendah, pengambilan alkohol meningkat apabila menjauhi sukrosa, dan toleransi terhadap kesan analgesik opiat6.
Satu kajian sebelumnya tentang obesiti di minipig Göttingen mengenalpasti aliran darah serebral menurun di inti accumbens, kawasan ventral tegmental (VTA) dan korteks prefrontal, dengan tomografi terkomputer foton tunggal (SPECT) otak61. Selaras dengan penemuan ini, kami mengamati pengurangan DA D2 / 3 yang terikat di kawasan ventroforebrain yang mengandungi nukleus accumbens dan dalam korteks prefrontal. Tahap ekstraselular DA meningkat 3 kali ganda dalam nukleus accumbens setelah pengambilan sukrosa dalam tikus bebas bergerak yang menjalani mikrodialisis62. Dalam haiwan yang bergantung kepada sukrosa, pengambilan sukrosa berulang dapat menyebabkan pembebasan DA dari shell nukleus accumbens63. Haiwan yang memakan diet terhad dengan akses terhad kepada sukrosa mempunyai reseptor DA D2 yang lebih rendah yang mengikat dalam kulit kepala nukleus dan striatum dorsal64. Diet lemak tinggi dan diet sukrosa boleh menyebabkan pengurangan regulasi D1 dan D2 reseptor mRNA dalam nukleus accumbens65. Kajian microdialysis mengenai kesan makanan enak mendedahkan kenaikan DA meningkat dalam akusatik nukleus dan korteks prefrontal apabila makanan itu masih dianggap novel; sebaik sahaja tikus terbiasa dengan makanan baru, pelepasan yang lebih tinggi telah ditumbuk dalam akusatif nukleus, tetapi tidak dalam korteks prefrontal66. Kerentanan pembezaan terhadap habituation dan pengkondisian aktiviti di dua kawasan boleh menjelaskan peningkatan yang lebih besar yang diperhatikan dalam korteks prefrontal berbanding dengan nukleus accumbens minipigs yang terdedah kepada bahan semulajadi yang sama yang hilang kebaharuan selepas dua belas hari. Walau bagaimanapun, seperti yang kita tidak gambar minipigs dengan [11C] raclopride selepas pentadbiran sukrosa pertama, penjelasan ini adalah spekulatif.
Korteks prefrontal memodulasi fungsi eksekutif, membuat keputusan, dan mengawal diri67. Dysfunctional DA neurotransmission dalam korteks prefrontal merosakkan modulasi pemprosesan ganjaran, mencadangkan fungsi eksekutif yang merosakkan dan kemahiran membuat keputusan dalam individu gemuk68,69. Selain itu, kajian PET manusia berkorelasi menurunkan metabolisme korteks hadapan dengan pengurangan stamina D2 mengikat dalam obesiti70. Di sini, kita dapati mengurangkan reseptor D2 / 3 dalam korteks prefrontal termasuk korteks orbitofrontal babi yang terdedah kepada rejimen sukrosa.
Neuron dopaminergik VTA menghantar unjuran ke hippocampus dan amygdala, di mana mereka menyokong tingkah laku seperti tabiat71 dan menengah pengekodan dan pengambilan pengkondisian kepada ubat72,73 dan isyarat makanan74,75. Pencitraan otak manusia telah menunjukkan pengaktifan hippocampal sebagai tindak balas kepada keinginan dan rasa makanan76. Selaras dengan penemuan kami tentang ketersediaan reseptor hippocampal dan amygdalar D2 / 3 sebagai tindak balas terhadap sukrosa, pemetaan otak manusia dengan [18F] fallypride menunjukkan kokain DA yang disebabkan oleh pelepasan amygdala dan hippocampus77. Dalam otak tikus, pendedahan kokain memicu pembebasan DA di amygdala78, dan perubahan tahap amygdala DA mempengaruhi pengaruh tingkah laku kokain yang ditimbulkan oleh cue79.
Dalam kajian individu gemuk, persamaan antara D2 / 3 dan kelebihan μOR, yang diketahui wujud di kawasan-kawasan penderaan yang ramping, terganggu di striatum ventral80. Kami membandingkan nilai-nilai BPND daripada kedua-dua pengesan untuk menguji jika data menghasilkan semula kesan ini. Tidak seperti manusia yang kurus, otak sekarang babi tidak mempunyai korelasi antara nilai-nilai BPND dari dua pengesan, pada garis dasar atau selepas pendedahan kepada sukrosa. Kami kemudiannya menguji sama ada haiwan yang mempunyai pengurangan raclopride pengejar yang paling besar juga akan mengurangkan pengurangan karfentanil pengesanan yang lebih besar, tetapi sebaliknya kita dapati korelasi negatif di kawasan ekstrastrial yang rata-rata, menunjukkan bahawa haiwan dengan perubahan besar potensi mengikat raclopride pengesan mempunyai perubahan terendah potensi mengikat karfentanil pengesan. Hubungan songsang antara perubahan menunjukkan bahawa kesan pengambilan sukrosa terhadap kebolehlindaan reseptor masing-masing diatur dalam arah yang bertentangan. Adalah diketahui bahawa penggunaan berlebihan makanan yang enak, atau ubat-ubatan, boleh didorong oleh keinginan atau keinginan, atau keduanya60,81. Adalah mungkin bahawa magnitud yang dikehendaki oleh dopamine menafikan magnitud yang disukai oleh opioid, atau sebaliknya. Bukti terkini menunjukkan peranan GABAA reseptor di VTA dan terminal cholinergic di striatum dan mungkin korteks yang bertindak sebagai switch antara mekanisme dopamine bergantung dan dopamine tindakan opioid82,83 yang mungkin menjelaskan kesan dopamin dan kesan opioid dalam kawasan ekstrastrial babi yang ditentukan di sini.
Kekurangan PET, juga dalam haiwan yang agak besar, adalah resolusi spatial tomografi yang terhad yang menjejaskan hasil daripada kawasan otak kecil yang terlibat dalam tingkah laku yang berkaitan dengan makanan. Bagaimanapun, walaupun terdapat kebimbangan ini, [11C] raclopride mengikat sebelum ini telah direkodkan kedua-duanya di kawasan striatal dan extrastriatal84,85,86,87. Penggunaan [11C] raclopride untuk menamakan jenis reseptor yang sama tidak menimbulkan kekhawatiran tentang perbezaan afiniti berpotensi yang boleh menjejaskan penggunaan tracers yang berasingan untuk reseptor yang sama di kawasan yang berbeza. Kajian terbaru merangkumi rekod pengikatan ekstrastrial [11C] raclopride. Alakurtti et al. mendapati penambahbaikan yang baik dari ukuran raclopride striatal yang mengikat di striatum, dengan hanya baik untuk reproducibility sederhana dalam korteks85. Dalam kajian seterusnya, Svensson et al. membincangkan beberapa isu yang mempengaruhi penggunaan [11C] raclopride sebagai penanda reseptor D2 / 3 extrastriatal dalam kajian manusia yang sihat, termasuk reproduktibiliti yang tidak baik dalam korteks dan penurunan terhad pengekstrakan ekstrastrial dalam korteks frontal sebagai tindak balas kepada agen penyekat D2 / 388. Perbandingan ujian semula menunjukkan variabilitas 4-7% di striatum dan 13-59% di kawasan kortikal, tetapi masa antara peperiksaan purata 20 hari, tidak seperti yang lebih bermaklumat 1-2 hari kebanyakan kajian. Beberapa faktor dalam kehidupan subjek tersebut mungkin mempunyai masa untuk mempengaruhi penemuan. Sesungguhnya, kami menunjukkan di sini bahawa hanya menambah penggunaan sukrosa untuk rutin pagi selama 12 hari mungkin telah mempengaruhi langkah mengikat yang diperoleh dua minggu kemudian. Faktor lain yang biasa seperti bermain permainan video, membeli-belah, memasuki hubungan romantis baru dan aktiviti seksual, menggunakan ubat-ubatan atau mengubah diet dan senaman boleh mempengaruhi paras dopamin ekstrastriat dengan potensi untuk variasi dataset yang besar. Kajian semasa dalam minipigs memperkenalkan satu set kawalan yang baik dengan satu-satunya pembolehubah ialah ketiadaan atau kehadiran sukrosa dalam diet. Dalam konteks ini, data dari tujuh haiwan mempunyai kepelbagaian yang cukup rendah di kawasan ekstrastrial yang berkaitan untuk mengenal pasti pengurangan pengikatan secara signifikan dalam tindak balas terhadap sukrosa.
Batasan kajian semasa adalah penggunaan anestetik yang diperlukan untuk memastikan tidak bergerak semasa dalam vivo pencitraan haiwan. Kesan anestetik spesifik, dan interaksi mereka dengan ubat-ubatan atau intervensi lain, boleh mengelirukan pengikatan radioligans89,90. Ketamine adalah ubat anti-glutamatergik dengan kesan antidepresan yang cepat dalam dos sub-anestetik91,92,93, yang tidak mengurangkan striatal [11C] raclopride mengikat pada manusia94. Walau bagaimanapun, S-ketamin didapati mengurangkan pengikatan reseptor dopamin D2 / 3 di striatum primata bukan manusia yang sedar95. Isoflurane adalah anestetik biasa dalam PET haiwan. Dalam kajian sebelumnya, kami mendapati pengumpulan striatal [11C] SCH23390, radioligand penerima reseptor dopamine yang lebih tinggi dalam minipigs yang dibius dengan isoflurane dan bukan propofol, mencadangkan kerentanan dopaminergic neurotransmission kepada kesan anestesia96. Dalam kajian semasa, semua minipigs dicatatkan pada kedua-dua timepoints di bawah ketamine pre-medication dan isoflurane anesthesia, menjadikan perbandingan sekarang adalah sah.
Kesimpulan
Penggunaan makanan enak yang berlebihan mungkin menyebabkan, dan menjadi hasil dari, ketagihan dengan akibat langsung kepada kesihatan oleh obesiti. Kami menguji tuntutan bahawa opioid dan dopamin menuntun ganjaran, penting untuk terus hidup serta penyalahgunaan dadah. Minipigs dengan capaian sekejap kepada penyelesaian sukrosa pada 12 hari berturut-turut menunjukkan penurunan reseptor dopamin D2 / 3 dan reseptor μ-opioid di kawasan otak yang striatal dan extrastriatal, menyiratkan bahawa makanan yang tinggi dalam sukrosa mempengaruhi litar ganjaran otak dalam cara yang serupa dengan yang diperhatikan apabila ubat ketagihan dimakan. Pendedahan awal kepada sukrosa adalah konsisten dengan pembebasan opioid di kawasan otak yang aktif dalam ganjaran. Perubahan ketersediaan opioid dan dopamin menjelaskan potensi ketagihan sukrosa yang digunakan lebih banyak.
Bahan dan Kaedah
Etika haiwan
Kajian ini telah diluluskan dan dikawal oleh Inspektorat Haiwan Eksperimen Denmark dan semua eksperimen telah dijalankan mengikut arahan 2010/63 / EU Parlimen Eropah dan Majlis mengenai Perlindungan Haiwan yang Digunakan untuk Tujuan Saintifik dan garis panduan ARRIVE. Kami menggunakan tujuh wanita berusia empat belas bulan yang berusia Gottingen minipigs (Ellegaard, Dalmose, Denmark). Minipigs diberi makanan pelet (6 dL, 2 kali sehari, Perkhidmatan Diet Khas, Aarhus, Denmark) dengan air paip yang disediakan iklan libitum. Suhu alam sekitar adalah 20-22 ° C, kelembapan relatif 50-55%, dan udara diubah lapan kali setiap jam.
Penggunaan sukrosa berselang-seli
Kami mengutip tujuh minipigs dengan [11C] raclopride dan [11C] carfentanil pada garis dasar, dan sekali lagi sehari selepas 12 hari berturut-turut pendedahan air sukrosa. Pendedahan tepung terdiri daripada satu jam sukrosa (sukrosa, Dansukker, Copenhagen, Denmark) akses air (500 gram sukrosa dalam 2 liter air), setiap hari dalam tempoh 12 hari. Jumlah pengambilan sukrosa telah direkodkan dan semua minipig menggunakan 2 liter setiap hari. Kami juga menggambarkan lima minipigs yang sama dengan [11C] carfentanil, 30 minit selepas akses sukrosa pertama, untuk mengkaji pelepasan opioid akut.
Minipigs memperoleh purata 13.6% berat badan dari 25.4 kg (± 0.73 SEM) pada awal hingga 28.9 kg (± 0.69 SEM) selepas pendedahan sukrosa 12 hari, yang jauh lebih tinggi (ujian-satu-t-t, p < 0.001) daripada kenaikan yang diperhatikan dalam sampel minipigs kawalan yang diperoleh dalam kajian sebelumnya, di mana berat badan meningkat rata-rata hanya 4.9%, dalam tempoh perkembangan yang sama.
Imaging PET Imaging
Kami berpuasa babi semalaman dengan akses percuma ke air sebelum pengimejan. Kami menghidapi minipig sebelum berubat dan disedut seperti yang diterangkan sebelum ini97 dan meletakkannya di dalam alat PET / CT (Siemens Biograph 64 Truepoint PET). Kami melakukan imbasan CT dos rendah sebelum setiap pemerolehan PET untuk definisi anatomi dan pembetulan pengecilan data pelepasan PET. Kami secara intravena diberikan [11C] raclopride pada baseline (360 ± 18 MBq, aktiviti tertentu 77 ± 76 GBq / μmol, massa disuntik 0.12 ± 0.08 μg / kg) dan selepas 12 hari sukrosa (374 ± 54 MBq, aktiviti tertentu 127 ± 85 GBq / jisim disuntik 0.06 ± 0.05 μg / kg), dan [11C] carfentanil pada baseline (377 ± 43 MBq, aktiviti spesifik 311 ± 195 GBq / μmol, jisim disuntik 0.03 ± 0.02 μg / kg) dan selepas 12 hari sucrose (337 ± 71 MBq, aktiviti spesifik 177 ± 157 GBq / jisim yang disuntik 0.06 ± 0.08 μg / kg) melalui vena telinga, dalam 10 mL saline, semasa minit pertama imbasan 90 minit. Kami membina semula data PET menggunakan OSEM TrueX 3D (3 lelaran, 21 subset), matriks 256 × 256 × 109, dan penapis Gauss 2-mm, menggunakan struktur rangka masa 5 × 60, 3 × 300, 4 × 600 , 2 × 900 saat (jumlah 14 bingkai, 90 minit). Pada garis dasar dan selepas 12 hari sukrosa, minipig dicatatkan dengan kedua-dua penjejak yang disuntik sekurang-kurangnya 100 minit, kerana separuh hayat [11C] PET pengesan. Selepas selesai sesi PET akhir, kami mengosongkan minipig di bawah anestesia yang mendalam oleh overdosis overdosis pentobarbital (100 mg / kg).
Analisis kuantitatif dan statistik
Kami melakukan langkah-langkah pra-proses menggunakan PMOD 3.7 (PMOD Technologies Ltd, Zurich, Switzerland). Untuk menentukan parameter transformasi stereotaktik dari imej PET purata masa, kami menggunakan templat khusus ligan. Kami menggunakan matriks transformasi yang dijanakan dan medan warping ke siri masa PET yang dinamik. Kami menjana imej parametrik [11C] potensi mengikat raclopride (BPND) melalui kaedah tisu rujukan multilinear Ichise dan rakan sekerja98. Kami mencipta topeng buatan khas cerebellum yang mengecualikan vermis untuk mendapatkan radioaktif tisu cerebellar dari masa ke masa di kawasan yang boleh diabaikan ketumpatan reseptor DA D2 / 3. Kami menjana imej parametrik [11C] carfentanil menggunakan satu pelaksanaan model tisu rujukan Logan99,100 dengan t * = 30 min. Kajian [11C] karfentanil yang mengikat otak manusia telah menggunakan korteks ikal ulangan sebagai kawasan rujukan36; Walau bagaimanapun, dalam babi, mengikut keluk aktiviti masa, pengikatan yang tidak digantikan adalah lebih rendah pada cerebellum daripada pada korteks ikal, selaras dengan penemuan dari kajian autoradiography tikus101. Oleh itu, kami memilih cerebellum sebagai kawasan rujukan dalam kajian semasa.
Analisis statistik
Kami menundukkan peta untuk analisis voxel-bijak dengan Pemetaan Bukan Parameter Statistik (SnPM v13.01, http://warwick.ac.uk/snpm) Kotak SPM yang menggunakan teori permutasi bukan parametrik untuk menyediakan rangka kerja untuk kesimpulan statistik, pendekatan yang ditunjukkan untuk berfungsi dengan baik untuk sampel kecil kerana kawalan ketat positif palsu14 dan digunakan seperti yang dinyatakan sebelum ini102. Pakar dalam neuroanatomi babi (DO) berbanding imej yang terhasil diturunkan kepada tahap penting 5% kepada atlas minimig Göttingen minipig resolusi tinggi103,104 untuk mentakrifkan dan menanda kawasan DA D2 / 3 dan BP BPND dari garis dasar ke keadaan pasca sukrosa. Kami kemudian melakukan analisa rantau (minat) (ROI) untuk mengekstrak BPND nilai-nilai kawasan spesifik yang dijumpai menarik berdasarkan analisis SnPM, termasuk striatum, akusatif nukleus, thalamus, amygdala, korteks cingulate dan korteks prefrontal. Tiada statistik tambahan dilakukan pada analisis ROI, kerana kawasan-kawasan ini telah didapati signifikan menggunakan SnPM.
Rujukan
- 1.
Smyth, S. & Heron, A. Diabetes dan obesiti: wabak kembar. Nat Med 12, 75-80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL & Curtin, LR Prevalensi dan trend obesiti di kalangan orang dewasa AS, 1999–2008. JAMA 303, 235-241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, CA et al. Dopamin untuk "menginginkan" dan opioid untuk "suka": perbandingan orang dewasa gemuk dengan dan tanpa makan pesta. Obesiti (Silver Spring) 17, 1220-1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. Obesiti dan persekitaran makanan: ketumpatan tenaga diet dan kos diet. Jurnal perubatan pencegahan Amerika 27, 154-162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. & Ahmed, SH Rasa manis yang tinggi melebihi ganjaran kokain. PLoS SATU 2, e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. & Guillem, K. In Neurosains pada abad ke-21 (ed Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Perkembangan lebih lanjut dalam neurobiologi makanan dan ketagihan: kemas kini mengenai keadaan sains. Pemakanan 28, 341-343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M. Dalam Keseronokan otak (eds Kringelbach, ML & Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ & Bullmore, ET Dari hedonik rasa hingga dorongan motivasi: reseptor mu-opioid pusat dan tingkah laku makan berlebihan. Int J Neuropsychopharmacol 12, 995-1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, ganjaran Makanan KC: substrat otak yang ingin dan suka. Ulasan neurosains dan biobehavioral 20, 1-25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Pemetaan neuroreceptor di tempat kerja: mengenai definisi dan tafsiran potensi mengikat setelah 20 tahun kemajuan. Int Rev Neurobiol 63, 1-20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG Model haiwan mengenai gula dan lemak: hubungan dengan ketagihan makanan dan peningkatan berat badan. Kaedah Mol Biol 829, 351-365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Jelsing, J. et al. Korteks prefrontal di Gottingen minipig otak yang ditakrifkan oleh kriteria unjuran neural dan cytoarchitecture. Bruce Res Bull 70, 322-336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE & Holmes, AP Uji permutasi nonparametrik untuk neuroimaging berfungsi: primer dengan contoh. Hum Mama Brain 15, 1-25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG Bukti ketagihan gula: kesan tingkah laku dan neurokimia dari pengambilan gula yang berlebihan dan berlebihan. Ulasan neurosains dan biobehavioral 32, 20-39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Alonso-Alonso, M. et al. Sistem ganjaran makanan: perspektif semasa dan keperluan penyelidikan masa depan. Nutr Rev 73, 296-307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Sucrose pentadbiran diri dan pengaktifan CNS pada tikus. Am J Physiol Regul Integr Comp Physiol 300, R876-884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA et al. Litar berasingan yang menyandikan nilai-nilai hedonik dan pemakanan gula. Saraf neurosains 19, 465-470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Colantuoni, C. et al. Pengambilan gula yang berlebihan dapat mengikat pengikat dopamin dan mu-opioid di otak. Neuroreport 12, 3549-3552 (2001).
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Opiate reseptor: penyetempatan autoradiografi pada otak tikus. Proc Natl Acad Sci USA 73, 3729-3733 (1976).
- 21.
Soderman, AR & Unterwald, EM kokain ganjaran dan hiperaktif pada tikus: laman web modulasi reseptor opioid. Neurosains 154, 1506-1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ & Roberts, DC Beta-funaltrexamine mempengaruhi pentadbiran kokain pada tikus yang bertindak balas pada jadual nisbah progresif peneguhan. Farmakologi, biokimia, dan tingkah laku 75, 301-307 (2003).
- 23.
Schroeder, JA et al. Satu peranan untuk reseptor mu opioid dalam aktiviti yang disebabkan oleh cocaine, pemekaan, dan ganjaran dalam tikus. Psychopharmacology 195, 265-272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW Pemulihan yang disebabkan kokain memerlukan rangsangan endogen reseptor mu-opioid di pallidum ventral. Jurnal neurosains: jurnal rasmi Persatuan Neurosains 25, 4512-4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ et al. Siaran Memakan Opioid Endogen dalam Manusia. J Neurosci 37, 8284-8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS & Berridge, KC litar limbik Opioid untuk ganjaran: interaksi antara titik panas hedonik nukleus accumbens dan ventral pallidum. J Neurosci 27, 1594-1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, laman Opioid KC dalam shell inti nukleus memediasi makan dan 'suka' hedonik terhadap makanan: peta berdasarkan mikroinjeksi Fos. Otak Res 863, 71-86 (2000).
- 28.
Zhang, M. & Kelley, AE Pengambilan larutan sakarin, garam, dan etanol ditingkatkan dengan kemasukan agonis mu opioid ke dalam nukleus. Psychopharmacology 159, 415-423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA & Kelley, AE Pengambilan makanan tinggi lemak secara selektif ditingkatkan oleh rangsangan reseptor opioid mu dalam nukleus. Jurnal farmakologi dan terapeutik eksperimen 285, 908-914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP & Billington, CJ Naloxone menyekat bahagian pemberian makanan yang didorong oleh rasa manis pada tikus yang terhad makanan. Am J Physiol 268, R248-252 (1995).
- 31.
Kaca, MJ, Billington, CJ & Levine, AS Opioid dan pengambilan makanan: saluran saraf berfungsi yang diedarkan? Neuropeptida 33, 360-368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. & Apfelbaum, M. Seorang antagonis opioid, naltrexone, mengurangkan pilihan untuk sukrosa pada manusia. Am J Physiol 251, R91-96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS Pengaruh naltrexone pada pengecaman rasa dan ambang pengecaman. Selera 32, 241-249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, BA Naloxone, penyekat candu, mengurangkan penggunaan makanan tinggi lemak manis pada pemakan pesta wanita gemuk dan kurus. Am J Clin Nutr 61, 1206-1212 (1995).
- 35.
Litar opioid berbeza Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW menentukan kelembapan dan keinginan acara yang bermanfaat. Proc Natl Acad Sci USA 106, 12512-12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Colasanti, A. et al. Pembebasan opioid endogen dalam sistem ganjaran otak manusia yang disebabkan oleh pentadbiran amphetamine akut. Biol Psikiatri 72, 371-377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Mick, saya. et al. Amphetamine disebabkan pembebasan opioid endogen di otak manusia yang dikesan dengan [11C] carfentanil PET: replikasi dalam kohort bebas. Int J Neuropsychopharmacol, 1-6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Grey, peptida RW Opioid dan kawalan tingkah laku penelan manusia. Ulasan neurosains dan biobehavioral 26, 713-728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. & Tolle, TR Apa yang harus dipelajari dari dalam vivo pengimejan otak opioidergik? Eur J Sakit 9, 117-121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Interaksi Unterwald, EM & Cuntapay, M. Dopamine-opioid dalam tikus striatum: peranan modulasi untuk reseptor dopamin D1 dalam transduksi isyarat yang dimediasi reseptor opioid delta Neuropharmacology 39, 372-381 (2000).
- 41.
Bencherif, B. et al. Reseptor mu-opioid serantau yang mengikat korteks insula menurun dalam bulimia nervosa dan berkorelasi dengan tingkah laku puasa. Jurnal perubatan nuklear: penerbitan rasmi, Persatuan Perubatan Nuklear 46, 1349-1351 (2005).
- 42.
Karlsson, HK et al. Obesiti dikaitkan dengan penurunan mu-opioid tetapi ketersediaan penerima reseptor dopamine D2 di otak. J Neurosci 35, 3959-3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Karlsson, HK et al. Berat badan selepas pembedahan bariatric menormalkan reseptor opioid otak dalam obesiti yang mengerikan. Mental Psikiatri 21, 1057-1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, JK Mekanisme Opioid Endogen Terkait dalam Obesiti dan Penurunan Berat Badan pada Manusia. J Clin Endocrinol Metab 100, 3193-3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Majuri, J. et al. Dopamine dan Opioid Neurotransmission dalam Ketagihan Tingkah Laku: Kajian Haiwan Perbandingan dalam Perjudian Patologi dan Makan Binge. Neuropsychopharmacology 42, 1169-1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM Makanan tinggi lemak kronik mendorong peraturan epigenetik pasca kelahiran reseptor mu-opioid di otak. Neuropsychopharmacology: penerbitan rasmi Kolej Amerika Neuropsychopharmacology 36, 1199-1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA Induksi pengambilan hiperfagia dan karbohidrat oleh rangsangan reseptor mu-opioid di kawasan yang terbatas pada korteks frontal. Jurnal neurosains: jurnal rasmi Persatuan Neurosains 31, 3249-3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. Kokain kronik merendahkan isyarat dopamin semasa mabuk kokain dan ketidakseimbangan D1 berbanding isyarat reseptor D2. Jurnal neurosains: jurnal rasmi Persatuan Neurosains 33, 15827-15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Cumming, P. et al. Kesan nikotin akut pada hemodinamik dan pengikat raclopride [11C] kepada penerima D2,3 dopamin dalam otak babi. NeuroImage 19, 1127-1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP Kesan pentadbiran diri kokain pada reseptor dopamin D2 pada monyet rhesus. Sinaps 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND et al. Tanda-tanda kokain dan dopamin di striatum punggung: mekanisme keinginan dalam ketagihan kokain. Jurnal neurosains: jurnal rasmi Persatuan Neurosains 26, 6583-6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Wong, DF et al. Meningkatkan penghunian reseptor dopamin dalam striatum manusia semasa keinginan kokain yang ditimbulkan. Neuropsychopharmacology 31, 2716-2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP & Norgren, R. Rangsangan sukrosa oral meningkatkan pengambilan dopamin pada tikus. Am J Physiol Regul Integr Comp Physiol 286, R31-37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. & Telang, F. Menggambarkan peranan dopamin dalam penyalahgunaan dan ketagihan dadah. Neuropharmacology 56(Suppl 1), 3-8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Wang, GJ et al. Dopamine otak dan obesiti. Lancet 357, 354-357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS Kesamaan antara kegemukan dan ketagihan dadah seperti yang dinilai oleh pencitraan neurofungsi: tinjauan konsep. Jurnal penyakit ketagihan 23, 39-53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Reseptor Johnson, PM & Kenny, PJ Dopamine D2 dalam disfungsi ganjaran seperti ketagihan dan makan kompulsif pada tikus gemuk. Saraf neurosains 13, 635-641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC & Kringelbach, ML Neurosains afektif keseronokan: penghargaan pada manusia dan haiwan. Psychopharmacology 199, 457-480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC & Kringelbach, ML Sistem kesenangan di otak. Sel-sel otak 86, 646-664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. Isyarat ganjaran ramalan neuron dopamin. J Neurophysiol 80, 1-27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH Perubahan aktiviti otak selepas kegemukan yang disebabkan oleh diet. Obesiti 19, 749-756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. & Norgren, R. Mengumpulkan mekanisme dopamin dalam pengambilan sukrosa. Otak Res 904, 76-84 (2001).
- 63.
Rada, P., Avena, NM & Hoebel, BG Setiap hari, gula bergantung berulang kali melepaskan dopamin di cangkerang. Neurosains 134, 737-744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR & Hajnal, A. Akses sukrosa berulang mempengaruhi kepadatan reseptor dopamin D2 dalam striatum. Neuroreport 13, 1575-1578 (2002).
- 65.
Alsio, J. et al. Ekspresi gen reseptor Dopamine D1 berkurangan dalam nukleus berikutan pendedahan jangka panjang kepada makanan yang enak dan berbeza bergantung kepada fenotip obesiti yang disebabkan oleh diet dalam tikus. Neurosains 171, 779-787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. & Di Chiara, G. Pengaruh perbezaan mekanisme pembelajaran asosiatif dan bukan asosiatif terhadap tindak balas penghantaran dopamin prefrontal dan accumbal kepada rangsangan makanan pada tikus yang diberi makan secara libitum. J Neurosci 17, 851-861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Litar neuron yang tidak seimbang dalam ketagihan. Curr Opin Neurobiol 23, 639-648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. & Pignatti, R. Anorexia, bulimia, dan obesiti: berkongsi kekurangan membuat keputusan pada Tugasan Perjudian Iowa (IGT). J Int Neuropsychol Soc 16, 711-715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL Kekurangan membuat keputusan dan makan berlebihan: model risiko untuk kegemukan. Obes Res 12, 929-935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND et al. Reseptor D2 dopamine yang rendah dikaitkan dengan metabolisme prefrontal dalam subjek obes: faktor penyumbang yang mungkin. NeuroImage 42, 1537-1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, inti pusat BW Amygdala berinteraksi dengan striatum dorsolateral untuk mengatur pemerolehan tabiat. J Neurosci 32, 1073-1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Pemberian, S. et al. Pengaktifan litar memori semasa keinginan kokain yang ditimbulkan. Proc Natl Acad Sci USA 93, 12040-12045 (1996).
- 73.
Childress, AR et al. Pengaktifan Limbic semasa keinginan kokain yang disebabkan oleh kokain. Am J Psikiatri 156, 11-18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV & Berridge, KC Apa dan kapan "mahu"? Amygdala yang berfokus pada penekanan insentif terhadap gula dan seks. Psychopharmacology 221, 407-426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF & Volkow, ND Neurobiologi ketagihan: analisis neurocircuitry. Lancet Psychiatry 3, 760-773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. Pengaktifan kortikal sebagai tindak balas terhadap rangsangan rasa murni semasa keadaan fisiologi kelaparan dan kenyang. NeuroImage 44, 1008-1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Fotros, A. et al. Pelepasan dopamine kokain di amygdala dan hippocampus: kajian PET [(1) (8) F] fallypride bertaraf tinggi dalam kokain yang bergantung kepada peserta. Neuropsychopharmacology 38, 1780-1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. et al. Mengawal tingkah laku mencari kokain oleh rangsangan yang berkaitan dengan dadah dalam tikus: kesan terhadap pemulihan tahap penghidrogenan yang bertindak balas dan ekstraselular dalam amigdala dan nukleus accumbens. Proc Natl Acad Sci USA 97, 4321-4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Dopamine D1 atau D2 antagonisme reseptor dalam amigdala basolateral secara berbeza mengubah pemerolehan kokain-kaitan yang diperlukan untuk pemulihan semula pencarian kokain. Neurosains 137, 699-706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Tuominen, L. et al. Interaksi dopamine-opiate mesolimbic yang tidak menentu dalam obesiti. NeuroImage 122, 80-86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Isyarat dopamine perilaku Schultz, W.. Trend Neurosci 30, 203-210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR & van der Kooy, D. Neurobiologi motivasi candu. Cold Spring Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Reseptor nikotinik dan opioid terhadap transmisi mediator reseptor dopamin D2. Rep Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Nomura, Y. et al. Ketersediaan umur reseptor dopamin D2 / 3 yang diukur dengan raclopride [C-11] di kawasan otak manusia yang tidak striatal: Perbandingan empat kaedah. NeuroImage 41, T133-T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Alakurtti, K. et al. Kebolehpercayaan ujian jangka panjang untuk menguji reseptor D2 / 3 dopamine striatal dan ekstrastrial: kajian dengan pet raclopride [[11] C] dan PET resolusi tinggi. J Cereb Aliran Metab Darah 35, 1199-1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ Endogenous dopamine melepaskan setelah cabaran farmakologi dalam penyakit Parkinson. Ann Neurol 53, 647-653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Sawamoto, N. et al. Defisit kognitif dan pembebasan dopamin striato-frontal dalam penyakit Parkinson. Otak 131, 1294-1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE et al. Kesahan dan kebolehpercayaan extrastriatal [(11) C] raclopride mengikat kuantifikasi dalam otak manusia yang hidup. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Tsukada, H. et al. Isoflurane anesthesia meningkatkan kesan menghalang kokain dan GBR12909 pada pengangkut dopamin: kajian PET dalam kombinasi dengan mikrodialisis di otak monyet. Otak Res 849, 85-96 (1999).
- 90.
Hassoun, W. et al. Kajian PET mengenai raclopride [11C] mengikat di striatum kucing awake: kesan anestetik dan peranan aliran darah serebrum. Jurnal Eropah perubatan nuklear dan pengimejan molekul 30, 141-148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. Peranan ketamin dalam kemurungan tahan rawatan: tinjauan sistematik. Curr Neuropharmacol 12, 444-461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Berman, RM et al. Kesan antidepresan ketamin pada pesakit yang tertekan. Biol Psikiatri 47, 351-354 (2000).
- 93.
Browne, CA & Lucki, I. Kesan antidepresan ketamin: mekanisme yang mendasari antidepresan novel yang bertindak pantas. Pharmacol Front 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Aalto, S. et al. Ketamine tidak mengurangkan reseptor dopamin D2 yang mengikat pada manusia. Psychopharmacology 164, 401-406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. & Tsukada, H. Pengurangan pengikatan reseptor dopamin D2 / 3 dalam striatum selepas satu kali penggunaan esketamin, tetapi bukan R-ketamin: PET belajar di monyet yang sedar. Eur Arch Psychiatry Clin Neurosci 267, 173-176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Alstrup, AK et al. Kesan anestesia dan spesies pada pengambilan atau mengikat radioligans dalam vivo dalam minipig Gottingen. Penyelidikan BioMed antarabangsa 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP et al. Pencahayaan PET monoaminergik membujur perencatan proteaseom kronik dalam minipigs. Rep Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Strategi Ichise, M., Toyama, H., Innis, RB & Carson, RE untuk meningkatkan anggaran parameter neuroreceptor dengan analisis regresi linear. J Cereb Aliran Metab Darah 22, 1271-1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Logan, J. et al. Nisbah isipadu pengedaran tanpa sampel darah dari analisis grafik data PET. J Cereb Aliran Metab Darah 16, 834-840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Kuantifikasi reseptor mu-opioid otak dengan [11C] carfentanil: kaedah tisu rujukan. Nucl Med Biol 30, 177-186 (2003).
- 101.
Panksepp, J. & Bishop, P. Peta autoradiografi pengikatan (3H) diprenorphine di otak tikus: kesan interaksi sosial. Bruce Res Bull 7, 405-410 (1981).
- 102.
Landau, AM et al. Rangsangan elektroconvulsif berbeza mempengaruhi [(11) C] MDL100,907, 5 mengikat kepada reseptor 2HTXNUMXA kortikal dan subkortik dalam otak porcine. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. The telencephalon of the Gottingen minipig, cytoarchitecture dan anatomi permukaan kortikal. Fungsi Struktur Otak 222, 2093-2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR Atlas histologi dalam talian otak Gottingen minipig. Heliyon 5, e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Penghargaan
Aarhus University "AU Idea Pembangunan Projek Idea" kepada AML membiayai kajian ini. Kami berterima kasih atas sokongan teknikal dari kakitangan di Pusat PET Rumah Sakit Aarhus University dan Ladang Universiti Aarhus untuk membantu rawatan haiwan. Kami berterima kasih kepada Profesor Morten Kringelbach, Profesor Jørgen Scheel-Kruger dan Profesor Madya Arne Møller untuk membantu dengan permulaan kajian-kajian ini.
Pengisytiharan etika
Bersaing kepentingan
Para pengarang menyatakan tiada kepentingan bersaing.
Maklumat Tambahan
Nota penerbit Alam Semula Jadi Springer tetap netral dengan mengambil kira tuntutan yurisdiksi dalam peta yang diterbitkan dan gabungan institusi.
Hak dan kebenaran
Membuka akses Artikel ini dilesenkan di bawah Lesen Antarabangsa Atribusi 4.0 Creative Commons, yang membenarkan penggunaan, perkongsian, penyesuaian, pengedaran dan pengeluaran semula dalam mana-mana medium atau format, selagi anda memberikan kredit yang sesuai kepada pengarang asal dan sumbernya, berikan pautan ke lesen Creative Commons, dan tunjukkan sama ada perubahan dibuat. Imej atau bahan pihak ketiga yang lain dalam artikel ini dimasukkan dalam lesen Creative Commons artikel, kecuali dinyatakan sebaliknya dalam garis kredit kepada bahan tersebut. Sekiranya bahan tidak termasuk di dalam lesen Creative Commons dan penggunaan yang dimaksudkan tidak dibenarkan oleh peraturan berkanun atau melebihi penggunaan yang dibenarkan, anda perlu mendapatkan kebenaran secara langsung dari pemegang hak cipta. Untuk melihat salinan lesen ini, lawati http://creativecommons.org/licenses/by/4.0/.