Davanti. Behav. Neurosci., 02 April 2014 |
Carla Kalkhoven1, Cor Sennef1, Ard Peeters1 ed Ruud van den Bos2*
- 1Chardon Pharma, Herpen, Paesi Bassi
- 2Dipartimento di Fisiologia animale organistica, Facoltà di scienze, Radboud University Nijmegen, Nijmegen, Paesi Bassi
La malattia di Huntington (HD) è una malattia genetica e neurodegenerativa, che colpisce specificamente i neuroni striatali della via indiretta, determinando un progressivo declino della coordinazione muscolare e la perdita di controllo emotivo e cognitivo. È interessante notare che la predisposizione al gioco d'azzardo patologico e ad altre dipendenze coinvolge disturbi negli stessi circuiti cortico-striatali che sono affetti dalla MH e mostrano sintomi correlati alla disinibizione, inclusa una sensibilità modificata a punizioni e ricompense, impulsività e incapacità di considerare i vantaggi a lungo termine oltre i premi a breve termine. Sia i pazienti con MH che i giocatori d'azzardo patologici mostrano anche deficit di rendimento simili su compiti decisionali rischiosi, come l'Iowa Gambling Task (IGT). Queste somiglianze suggeriscono che i pazienti con MH sono un probabile gruppo di rischio per problemi di gioco. Tuttavia, tali problemi sono stati osservati solo incidentalmente nei pazienti con MH. In questa recensione, miriamo a caratterizzare il rischio di gioco patologico in HD, così come i meccanismi neurobiologici sottostanti. Soprattutto con l'attuale aumento delle opportunità di gioco d'azzardo su Internet facilmente accessibili, è importante comprendere questi rischi e fornire un adeguato supporto al paziente di conseguenza. Sulla base dei risultati neuropatologici e comportamentali, proponiamo che i pazienti con MH potrebbero non avere una maggiore tendenza a cercare rischi e iniziare a giocare d'azzardo, ma che hanno una maggiore possibilità di sviluppare una dipendenza una volta impegnati in attività di gioco. Pertanto, gli sviluppi attuali e futuri delle possibilità di gioco d'azzardo su Internet e le relative dipendenze dovrebbero essere considerati con attenzione, specialmente per i gruppi vulnerabili come i pazienti con MH.
Introduzione
La malattia di Huntington (HD) è una malattia genetica neurodegenerativa, ereditata in modo autosomico dominante. La malattia è caratterizzata da sintomi motori, cognitivi e comportamentali progressivi, che di solito si manifestano tra 30 e 50 anni di età, e portano a morte prematura in 10-20 anni dopo l'insorgenza della malattia. L'HD è causata da una mutazione nel gene dell'Huntingtin (HTT), che porta all'aggregazione delle proteine, alla deregolazione di diversi processi cellulari e infine alla morte cellulare. La degenerazione neuronale inizialmente si verifica selettivamente nello striato (nucleo caudato e putamen), dove colpisce le vie cortico-striatali che servono a controllare le funzioni motorie e cognitive (Reiner et al., 2011; Vonsattel et al., 2011). A livello motorio, questo processo degenerativo è espresso come movimenti disorganizzati (corea), mentre a livello cognitivo / comportamentale i pazienti mostrano una "sindrome da disfunzione esecutiva", che comprende tra l'altro impulsività, scarsa valutazione del rischio e incapacità di fermare un corso di azione (Hamilton et al., 2003; Duff et al., 2010b). Sintomi comportamentali e cognitivi simili sono osservati in comportamenti di dipendenza correlati a sostanze o attività (Newman, 1987; Rosenblatt, 2007; Iacono et al., 2008). Pertanto, ci si può aspettare che i pazienti con MH siano a rischio di sviluppare dipendenze. I paradigmi decisionali in contesti di laboratorio hanno infatti suggerito deficit nei processi decisionali a rischio in pazienti con MH avanzata (ad es. Stout et al., 2001) e il gioco d'azzardo patologico è stato osservato in questo gruppo di pazienti (De Marchi et al., 1998). Tuttavia, questi risultati sono rari e sorprendentemente pochi studi hanno esaminato direttamente i sintomi e le conseguenze, ad esempio, della disinibizione comportamentale nella MH.
In questa recensione discuteremo che i pazienti con MH potrebbero essere un gruppo a rischio per lo sviluppo di giochi d'azzardo problematici. In primo luogo, il gioco problematico è caratterizzato dall'incapacità dei soggetti di smettere di giocare nonostante i problemi finanziari, personali o professionali. Basato su disturbi neurobiologici e sintomi comportamentali, la capacità di fermare il comportamento di gioco sembra essere diminuita o assente nei pazienti con MH. In secondo luogo, a causa dell'atteggiamento più liberale nei confronti del gioco d'azzardo e delle crescenti possibilità di gioco d'azzardo online legale e illegale (vedi ad esempio, Griffiths, 2003), potremmo aspettarci che il verificarsi di problemi di gioco aumenti nei prossimi anni. Una maggiore accessibilità può rappresentare un rischio specifico per i gruppi vulnerabili, come i pazienti con MH, che non sono stati precedentemente esposti a tali rischi.
In generale, il cambiamento delle condizioni esterne e dei metodi di trattamento può avere effetti inattesi e indesiderati sul comportamento del paziente, specialmente nelle malattie neurologiche complesse. Tali effetti vengono facilmente persi quando i sintomi comportamentali non vengono regolarmente rivalutati. Ciò può essere meglio illustrato dal caso del morbo di Parkinson, in cui l'introduzione del trattamento farmacologico con agonisti della dopamina ha portato a disturbi del controllo degli impulsi come il gioco d'azzardo compulsivo, lo shopping, il mangiare e l'ipersessualità, causati dalla sovrastimolazione del sistema dopaminergico mesolimbico (Dodd et al., 2005; Witjas et al., 2012; Weintraub et al., 2013). Tuttavia, questi effetti indesiderati non sono stati riconosciuti fino a diversi anni dopo l'introduzione delle terapie con agonisti della dopamina in combinazione con i cambiamenti della società correlati alla (shopping), al consumo di cibo, alla sessualità, a Internet e al gioco d'azzardo. Questo esempio dimostra che la rivalutazione dei fattori di rischio è importante per poter fornire un trattamento e una guida efficaci ai pazienti di fronte a un ambiente che cambia.
Qui, esploreremo il profilo della malattia della MH in relazione alla dipendenza, ai problemi del gioco d'azzardo e ai deficit decisionali. Nella sezione HD: Neuropatologia, sintomi e progressione, la progressione dei sintomi della MH sarà discussa in relazione ai disturbi nei circuiti cortico-striatali coinvolti nell'apprendimento delle attività, nella sensibilità alla punizione e nel controllo cognitivo / impulsivo. Nella sezione Comportamento rischioso e gioco d'azzardo patologico in HD, il profilo neurobiologico dei pazienti con MH sarà discusso nel contesto del gioco d'azzardo e di test per l'assunzione di rischi e di decisioni consolidati, come l'Iowa Gambling Task (IGT) e il Cambridge Gambling Task (CGT). Nella sezione Discussione, discuteremo di come una caratterizzazione dei rischi del gioco d'azzardo possa portare a raccomandazioni per i pazienti con MH e i loro assistenti su come affrontare questo problema e quali situazioni sono meglio evitate. Miriamo anche a identificare domande ancora senza risposta, che possono fungere da punto di partenza per future ricerche sull'incidenza e sui rischi dei problemi di gioco nei pazienti con MH.
HD: Neuropatologia, sintomi e progressione
Meccanismi della neurobiologia
L'HD è causata da una ripetizione instabile di CAG (trinucleotide, citosina-adenina-guanina) nella regione codificante del gene HTT, che porta alla produzione di proteina huntingtina mutante (Htt) con stiramento di poliglutamina espansa (poliQ) (MacDonald et al., 1993). Il numero di ripetizioni di trinucleotidi è inversamente correlato all'età di esordio della malattia (Snell et al., 1993; Stine et al., 1993). La maggior parte dei pazienti con MH presenta ripetizioni 40-55 che causano un tipico disturbo ad esordio nell'adulto, mentre espansioni di più di ripetizioni di 70 portano ad un disturbo di insorgenza giovanile. Gli individui con meno di ripetizioni 35 CAG nel gene HTT non svilupperanno HD. Sebbene i meccanismi esatti della patogenesi dell'HD restino sconosciuti e non possano essere discussi qui in dettaglio, essi implicano la formazione di aggregati proteici mediante l'Htt espanso polyQ, così come l'interazione del mutante Htt con numerose proteine coinvolte nel metabolismo energetico, proteine e vescicole trasporto e regolazione della trascrizione genica (Li e Li, 2004; Jones e Hughes, 2011). La conseguente deregolamentazione di questi processi cellulari alla fine porta alla degenerazione neuronale attraverso meccanismi che coinvolgono eccitotossicità e apoptosi.
La degenerazione neuronale è inizialmente limitata ai gangli della base, dove i neuroni spinosi medi nello striato (nucleo caudato e putamen) sono colpiti in modo specifico (Vonsattel e DiFiglia, 1998; Kassubek et al., 2004). Lo striato riceve il suo input eccitatorio (glutamatergico) principale dalle aree corticali, mentre riceve il suo input dopaminergico dalla substantia nigra. Lo striato ha due principali output inibitori (GABA-ergica): una via diretta e una indiretta (Figura 1A). I neuroni striatali della via diretta proiettano verso il globo pallido interno (GPi), che a sua volta ha proiezioni inibitorie al talamo. Il talamo dà origine alla principale componente eccitatoria della corteccia. Quindi, in effetti, l'attivazione della via striatale diretta inibisce l'attività della GPi, che a sua volta disinibisce l'attività talamocorticale, facilitando così il movimento e le funzioni cognitive. La via striatale indiretta, d'altra parte, proietta il GP esterno (GPe), che a sua volta invia proiezioni inibitori al nucleo subtalamico (STN). L'STN invia proiezioni eccitatorie al GPi. Di conseguenza, l'attivazione della via striatale indiretta in tal modo disinibisce l'STN, permettendo di attivare il GPi, che a sua volta inibisce l'attività talamocorticale, sopprimendo i movimenti e le funzioni cognitive. Il comportamento adattivo deriva da un (delicato) equilibrio di attività nel percorso diretto e indiretto. La patologia nella via indiretta è la chiave per la MH e interrompe l'equilibrio nel controllo striatale con conseguente perdita di controllo inibitorio sul funzionamento e sul comportamento motori (Figura 1B; Albin et al., 1989; Alexander e Crutcher, 1990).
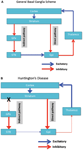
Figura 1. (UN) Schema semplificato dell'organizzazione delle reti di gangli cortico-basali (aree corticali, striatali, pallide e talamiche) che mostrano i percorsi diretti e indiretti nel cervello normale. (B) La degenerazione specifica della via indiretta (X) in HD porta ad una diminuzione del controllo inibitorio sulle funzioni corticali. GPe: esterno globus pallidus; GPi: globus pallidus interno; STN: nucleo subtalamico. Rosso: percorsi inibitori (GABA), Blu: percorsi eccitatori (glutammato).
I circuiti dei gangli cortico-basali, che comprendono le connessioni tra aree corticali, aree striatali, aree pallide e aree talamiche, sono organizzati in modo parallelo, sottraendo diverse funzioni nell'organizzazione del comportamento. Poiché esistono molte recensioni eccellenti sull'anatomia e sulla funzione di questi circuiti (ad es. Alexander et al., 1986, 1990; Alexander e Crutcher, 1990; Yin e Knowlton, 2006; Verny et al., 2007; Yin et al., 2008; Haber e Knutson, 2010; Sesack and Grace, 2010), evidenziamo solo alcuni problemi che sono alla base della nostra recensione. In primo luogo, approssimativamente esiste un'organizzazione topografica dorsale o ventrale in entrambe le aree corticale e striatale. Pertanto, le aree prefrontali dorsali sono associate a aree striatali dorsali mentre le aree prefrontali più ventrale sono associate a più aree striatali ventrale (incluso il nucleo accumbens). In secondo luogo, possono essere descritti in generale tre circuiti funzionalmente diversi. Il circuito sensorimotorio comprende il corpo striato sensomotorio (putamen) e le cortecce sensomotorie associate all'esecuzione del comportamento motorio. Il circuito di controllo associativo / cognitivo coinvolge la corteccia prefrontale dorsolaterale, la corteccia cingolata anteriore e lo striato associativo (nucleo caudato). Questo circuito è particolarmente rilevante per il funzionamento esecutivo, cioè è coinvolto nel controllo cognitivo, nella pianificazione e nella memoria di lavoro. Inoltre, è coinvolto nella promozione del comportamento adattivo a lungo termine rafforzando o fermando (punendo) il comportamento strumentale, cioè le sequenze di atti comportamentali, apprese in interazione con l'ambiente (Kravitz et al., 2012; Paton e Louie, 2012). Il circuito limbico comprende la corteccia orbitofrontale, la corteccia prefrontale ventromediale, l'amigdala e lo striato limbico (nucleo accumbens). Questo circuito è particolarmente rilevante per valutare il valore affettivo degli stimoli, segnalando la ricompensa o la punizione prevista di uno stimolo, una scelta o un evento imminente, un controllo emotivo e un apprendimento adattivo (emozionale) (O'Doherty et al., 2001; Rushworth et al., 2007; van den Bos et al., 2013b, 2014).
La patologia in HD è osservata sia nel nucleo di putamen che di caudato (Vonsattel e DiFiglia, 1998; Kassubek et al., 2004; Vonsattel, 2008; Vonsattel et al., 2011; Hadzi et al., 2012). Inoltre, in entrambe le strutture l'atrofia segue uno schema caratteristico, che inizia nelle regioni dorsale e caudale e si sposta verso le regioni ventrale e rostrale man mano che la malattia progredisce (Vonsattel e DiFiglia, 1998; Kassubek et al., 2004; Vonsattel, 2008). Tuttavia, in alcuni studi è stata osservata anche atrofia precoce nel nucleo accumbens e globus pallidus (van den Bogaard et al., 2011; Sánchez-Castañeda et al., 2013). Mentre i disturbi nel circuito sensomotorio (putamen) possono essere correlati ai sintomi motori, i disturbi nel circuito di controllo cognitivo / associativo (nucleo caudato) possono essere correlati alla disfunzione esecutiva e causare deficit ad esempio nella memoria di lavoro nei primi pazienti con MH (Lawrence et al., 1996; Bonelli e Cummings, 2007; Wolf et al., 2007). Disturbi nel circuito limbico, come ad esempio a causa dell'atrofia precoce nel nucleo accumbens, possono essere correlati all'apatia e alla depressione (Bonelli e Cummings, 2007; Unschuld et al., 2012). L'atrofia progressiva nello striato può portare ad una successiva disfunzione dei circuiti cortico-striatali. Per esempio, il nucleo del caudato ventrale fa anche parte del circuito orbitofrontale, che viene influenzato dal progredire della malattia. La disfunzione di questo circuito è legata alla disinibizione comportamentale (Bonelli e Cummings, 2007). Alla fine, la degenerazione può diffondersi ad altre aree del cervello, comprese altre parti dei gangli della base (aree pallide e talamo), ippocampo, amigdala e aree corticali nelle fasi avanzate della malattia.
In sintesi, l'HD è caratterizzata da una degenerazione specifica dei neuroni striatali appartenenti alla via indiretta. Con il progredire della malattia, l'atrofia dello striato si diffonde lungo un gradiente caudale-rostrale e dorsale-ventrale causando un disturbo sequenziale dei circuiti cortico-striatali. La conseguente perdita del controllo inibitorio in questi circuiti è direttamente correlata alla progressione dei sintomi motori, cognitivi e comportamentali in HD, come discusso di seguito.
Sintomi di HD
L'HD è caratterizzato da una varietà di sintomi motori, cognitivi e comportamentali progressivi. I primi sintomi di solito si verificano a mezza età, con un'età media di 40, sebbene una piccola percentuale di pazienti soffra di HD giovanile, che inizia prima dell'età di 20. Poiché i sintomi e la progressione della MH ad insorgenza giovanile sono in qualche modo distinti dalla malattia ad esordio nell'adulto, ci concentreremo su quest'ultimo gruppo di pazienti in questa revisione. Uno dei primi sintomi a manifestarsi in HD è la corea (disturbo del movimento involontario), e una diagnosi clinica viene solitamente fatta dopo l'inizio delle anormalità del movimento (Shannon, 2011). Alcuni studi, tuttavia, riportano sottili cambiamenti cognitivi ed emotivi prima dell'insorgenza dei sintomi motori, e l'ordine esatto di comparsa e progressione dei sintomi della MH rimane oggetto di dibattito. Tuttavia, sono disponibili diverse revisioni complete delle manifestazioni cliniche della MH (Roos, 2010; Anderson, 2011; Shannon, 2011).
Sintomi motori
I sintomi motori iniziano a manifestarsi nei primi stadi della MH e sono di solito i primi sintomi a essere notati in contesti di laboratorio e da parenti di primo grado di pazienti con MH (de Boo et al., 1997; Kirkwood et al., 1999, 2001). I disturbi motori sembrano iniziare come una disfunzione nel controllo della retroazione degli errori (Smith et al., 2000), in linea con il ruolo del circuito motorio cortico-striatale nell'apprendimento e controllo sensorimotorio (Graybiel et al., 1994). I primi segni di anomalie motorie sono spesso movimenti involontari sottili (corea) di muscoli facciali, dita delle mani e dei piedi ("spasmi"), iperreflessia e movimenti volontari esagerati (Young et al., 1986; Shannon, 2011), che portano a un'apparizione generale di irrequietezza e goffaggine nei primi pazienti con MH. Questi movimenti anormali sono sottili e spesso passano inosservati all'inizio, ma gradualmente peggiorano e si diffondono a tutti gli altri muscoli nel tempo. Altri primi sintomi motori includono movimenti oculari saccadici lenti o ritardati (Peltsch et al., 2008) e disartria (Ramig, 1986; Young et al., 1986). La disartria, un disturbo del linguaggio motorio, porta a difficoltà con l'articolazione e lo slurramento delle parole, il che rende il linguaggio progressivamente più difficile da comprendere. La disfagia (difficoltà di deglutizione) è osservata nella maggior parte dei pazienti con esordio a metà della malattia e peggiora gradualmente fino a quando i pazienti non riescono più a mangiare senza assistenza e spesso richiedono un sondino nella fase tardiva della MH (Heemskerk e Roos, 2011). Altri sintomi motori non coreici che di solito si manifestano nella fase intermedia della malattia includono disturbi dell'andamento, instabilità posturale e distonia (contrazioni muscolari involontarie che causano movimenti lenti e ripetitivi e posture anormali), spesso accompagnate da frequenti cadute (Koller e Trimble, 1985; Tian et al., 1992; Louis et al., 1999; Grimbergen et al., 2008). Rigidità e bradicinesia (lentezza dei movimenti e dei riflessi) a volte sono osservate, ma sono per lo più limitate a casi di HD giovanile (Bittenbender e Quadfasel, 1962; Hansotia et al., 1968). Questi sintomi motori sono coerenti con la disfunzione dei circuiti cortico-striatali sensomotorio (e controllo associativo / cognitivo) che sono comunemente colpiti in HD.
Sintomi comportamentali e psichiatrici
I disturbi comportamentali nella MH possono essere complessi e difficili da classificare, e la loro insorgenza e insorgenza è altamente variabile tra gli individui. Inoltre, a volte può essere difficile distinguere i disturbi comportamentali dal normale coping con una malattia angosciante (Caine e Shoulson, 1983). Il numero di studi che hanno caratterizzato i sintomi comportamentali nella MH è limitato e, di conseguenza, la loro prevalenza nella malattia è relativamente poco approfondita (van Duijn et al., 2007). I sintomi comportamentali ed emotivi più frequentemente e coerentemente riportati in HD sono irritabilità, apatia e depressione, che si verificano con una prevalenza di circa 50% (Caine e Shoulson, 1983; Folstein e Folstein, 1983; Craufurd et al., 2001; Kirkwood et al., 2001; van Duijn et al., 2007, 2014; Tabrizi et al., 2009). Sia l'irritabilità che l'apatia sono talvolta osservate nei pazienti pre-manifest HD (Tabrizi et al., 2009; van Duijn et al., 2014) e anche la depressione è stata riportata nelle prime fasi cliniche (Shiwach, 1994; Julien et al., 2007; Epping et al., 2013). Questi sintomi affettivi sono tra i primi sintomi non motori a essere notati dai parenti di primo grado (Kirkwood et al., 2001). Tipici sintomi correlati all'apatia, che gradualmente peggiorano nel corso della malattia, includono mancanza di energia, motivazione e iniziativa, diminuzione della perseveranza e qualità del lavoro, compromissione del giudizio, scarsa cura di se stessi e smarrimento emotivo (Craufurd et al., 2001; Kirkwood et al., 2001). I sintomi depressivi sono stati correlati ad una maggiore attività nella corteccia prefrontale ventromediale (Unschuld et al., 2012). L'irritabilità è associata alla disfunzione del circuito orbitofrontale, che porta ad un minor controllo sulle risposte emotive nell'amigdala (Klöppel et al., 2010).
Altri sintomi e disturbi psichiatrici meno comunemente osservati nella MH sono ansia, disturbo ossessivo-compulsivo, mania, sintomi psicotici simili alla schizofrenia, come paranoia, allucinazioni e delusioni (Caine e Shoulson, 1983; Folstein e Folstein, 1983; Craufurd et al., 2001; Kirkwood et al., 2001; van Duijn et al., 2007). Questi sintomi di solito non si verificano fino alle fasi intermedie o tardive della malattia, sebbene siano stati segnalati incidentalmente anche in pazienti con MH preclinici (Duff et al., 2007). Disturbo ossessivo-compulsivo è stato associato a danni alla corteccia orbitofrontale e alla corteccia cingolata anteriore, mentre la schizofrenia, una malattia che comporta deficit nell'organizzazione, pianificazione e attenzione, è correlata alla disfunzione corteccia prefrontale dorsolaterale (Tekin e Cummings, 2002).
È suggerito che la maggior parte dei sintomi psichiatrici nella MH siano in realtà parte di una "sindrome del lobo frontale" ampia e mal definita o "sindrome da disfunzione esecutiva", che include sintomi quali apatia, irritabilità, disinibizione, impulsività, ossessività e perseverazione (Lyketsos et al., 2004; Rosenblatt, 2007), che sono tutti comunemente osservati nei pazienti con MH (Hamilton et al., 2003; Duff et al., 2010b). Nel loro insieme, la letteratura indica che l'insorgenza e la progressione dei sintomi comportamentali nella MH sono eterogenee, con disturbi affettivi che si verificano più spesso e con esordio precoce, mentre ansia, disturbo ossessivo-compulsivo e sintomi psicotici sono meno comuni e di solito si verificano più tardi nella malattia . Questi sintomi psichiatrici sono associati alla disfunzione dei circuiti di controllo cortico-striatale limbico e di controllo cognitivo-associativo che sono comunemente colpiti nella MH.
Sintomi cognitivi
Il declino cognitivo è un altro aspetto importante della patologia HD. Molti studi si sono concentrati specificamente sull'insorgenza di sintomi cognitivi nelle fasi precliniche e precoci della MH, nella speranza di scoprire i primi biomarcatori clinici della malattia (rivisti in Papp et al., 2011; Dumas et al., 2013). Nel complesso, i risultati suggeriscono che sottili cambiamenti cognitivi possono essere osservati fino a 5-10 anni prima dell'inizio dei sintomi motori con metodi sufficientemente sensibili. Uno studio ha anche scoperto che, negli stadi preclinici e precoci della MH, il 40% dei pazienti già soddisfa i criteri per un danno cognitivo lieve (un disturbo associato a una limitata perdita di memoria, che non soddisfa i criteri per la diagnosi di demenza; Duff et al., 2010a). Tuttavia, non tutti gli studi supportano questi risultati (Blackmore et al., 1995; Giordani et al., 1995; de Boo et al., 1997; Kirkwood et al., 2001). In generale, la letteratura concorda sul fatto che l'elaborazione delle informazioni e la velocità psicomotoria sono particolarmente colpite in questa fase iniziale (Rothlind et al., 1993; Kirkwood et al., 1999; Verny et al., 2007; Paulsen et al., 2008). Altre alterazioni cognitive precoci comunemente osservate comprendono problemi con attenzione, memoria (funzionante) e prestazioni visuospaziali (Jason et al., 1988; Rothlind et al., 1993; Foroud et al., 1995; Lawrence et al., 1996; Hahn-Barma et al., 1998; Verny et al., 2007; Paulsen et al., 2008; Tabrizi et al., 2009; Papp et al., 2011; Stout et al., 2011). L'inflessibilità cognitiva è stata osservata nei pazienti con malattia precoce (Jason et al., 1988), in quale fase i cambiamenti extra-dimensionali sono specificamente compromessi, mentre l'apprendimento inverso è ancora intatto (Lawrence et al., 1996). Pertanto, i pazienti sono ancora in grado di rivalutare il valore dello stimolo e apprendere nuove contingenze di ricompensa-stimolo all'interno della stessa dimensione (ad esempio, forma o colore), ma hanno problemi spostando la loro attenzione su una dimensione diversa (ad esempio, da colore a forma) come richiesto da la nuova regola del compito per ottenere una ricompensa. Negli stadi successivi della malattia, l'inflessibilità cognitiva e la perseveranza causano anche un alterato apprendimento inverso nei pazienti con MH (Josiassen et al., 1983; Lange et al., 1995). Questa progressione dei sintomi è coerente con la disfunzione specifica del circuito prefrontale dorsolaterale precoce della malattia, dal momento che lo spostamento extra-dimensionale è mediato dalla corteccia prefrontale dorsolaterale, mentre l'apprendimento inverso è mediato dalla corteccia orbitofrontale (Dias et al., 1996; McAlonan e Brown, 2003). Altre menomazioni precoci comprendono comportamento disorganizzato, pianificazione compromessa, scarso giudizio e riduzione del controllo comportamentale ed emotivo (Watkins et al., 2000; Paradiso et al., 2008; Duff et al., 2010b). La disinibizione è stata osservata nei pazienti con MH precoce, le cui prestazioni sono compromesse in attività che richiedono l'inibizione di risposte pre-potenti ma inappropriate (Holl et al., 2013). Infine, diversi studi hanno scoperto che i pazienti con HD preclinici sono compromessi nel riconoscimento di emozioni negative come rabbia, disgusto, paura e tristezza. Il riconoscimento emotivo diminuisce progressivamente e può diffondersi a problemi con emozioni neutre nelle prime fasi cliniche della malattia (Johnson et al., 2007; Tabrizi et al., 2009; Labuschagne et al., 2013). Questo fenotipo è correlato alla disfunzione della corteccia orbitofrontale, che è coinvolta nell'elaborazione delle informazioni emotive e di ricompensa (Henley et al., 2008; Ille et al., 2011).
Gli studi con modelli animali di MH mostrano deficit cognitivi simili a quelli osservati nei pazienti umani. Sebbene non tutti gli studi trovino solidi deficit cognitivi (Fielding et al., 2012), i risultati di modelli di topi e topi in HD comprendono ansia, aumentata reattività agli stimoli emotivi negativi e menomazioni nell'inversione dell'apprendimento e spostamento della strategia (Faure et al., 2011; Abada et al., 2013). Uno studio ha rilevato specifici deficit precoci nell'apprendimento inverso prima dell'insorgenza dei sintomi motori in un modello di ratto di HD (Fink et al., 2012). È interessante notare che gli animali in HD sembrano avere una maggiore reattività agli stimoli emotivi negativi, mentre i pazienti umani mostrano una diminuzione del riconoscimento delle emozioni negative. Al momento non è chiaro se questo riflette le differenze nel compito amministrato (riconoscendo le emozioni risposte comportamentali a stimoli minacciosi), differenze legate alle specie nell'esito della patologia o una differenza fondamentale tra il modello di ratto e la condizione umana. In generale, gli studi condotti su pazienti umani e su modelli animali di MH dimostrano che una vasta gamma di funzioni cognitive può già essere compromessa nella prima fase della MH. Le prime anomalie includono principalmente deficit dell'attenzione, memoria, flessibilità cognitiva e riconoscimento emotivo. In questa fase iniziale, i pazienti spesso hanno una ridotta consapevolezza delle proprie (declinabili) capacità cognitive (Hoth et al., 2007). Nel corso del tempo, i sintomi cognitivi peggiorano progressivamente, portando infine a grave demenza sottocorticale nelle fasi avanzate della malattia. Sebbene l'insorgenza di sintomi sia generalmente coerente con il successivo deficit del controllo associativo / cognitivo e dei circuiti limico-cortico-striatali, le funzioni specifiche correlate al circuito limbico possono anche essere già influenzate nella fase iniziale della HD.
Conclusione
I sintomi motori, comportamentali e cognitivi nella MH sono stati studiati ampiamente in passato e continuano ad essere un argomento di interesse a causa dell'ampia varietà e variabilità nell'insorgenza e nell'insorgenza di questi sintomi tra i pazienti. In generale, i sintomi comportamentali e cognitivi sono legati a tre categorie comportamentali frontali: apatia, disfunzione esecutiva e disinibizione. La combinazione di questi sintomi viene talvolta definita "sindrome da disfunzione esecutiva". Tutti questi sintomi sono correlati a deficit nei circuiti cortico-striatali che coinvolgono la corteccia orbitofrontale, la corteccia prefrontale dorsolaterale e la corteccia cingolata anteriore. Come discusso sopra, gli studi neuropatologici hanno osservato una degenerazione progressiva dello striato in direzione dorsale-ventrale nei pazienti con MH. Sebbene le osservazioni comportamentali e cognitive concordino in parte con una progressiva compromissione dei circuiti cortico-striatali, i risultati sintomatici sembrano essere più diffusi del previsto sulla base di osservazioni patologiche. L'esordio e la progressione dei sintomi comportamentali e cognitivi nella MH sono altamente eterogenei, indicando che il danno alle regioni striatali può essere più variabile e diffuso nelle prime fasi della MH di quanto si pensasse in precedenza. Questa visione è supportata da prove di diversi studi di imaging strutturale (Thieben et al., 2002; Rosas et al., 2005; van den Bogaard et al., 2011).
Comportamento rischioso e gioco d'azzardo patologico in HD
Gioco d'azzardo patologico
Mentre molte persone sono in grado di giocare a scopo ricreativo, può essere un problema palese per alcuni, poiché sviluppano forme patologiche di questo comportamento. Il gioco d'azzardo patologico è caratterizzato da un eccessivo bisogno di giocare nonostante le chiare conseguenze finanziarie, personali e professionali negative. Recentemente è stato classificato come una dipendenza in DSM-V, in quanto ricorda da vicino i disturbi da abuso di sostanze sia nei criteri diagnostici che in quelli di neuropatologia (van Holst et al., 2010; Clark e Goudriaan, 2012). Il gioco d'azzardo patologico sarà la prima e unica "dipendenza comportamentale" riconosciuta nella categoria "Dipendenza e disturbi correlati ". Tuttavia, va notato che esistono differenze tra la dipendenza da sostanze psicoattive e la dipendenza dal gioco d'azzardo. In primo luogo, soddisfare la brama di sostanze psicoattive consiste nel consumare la sostanza di cui è noto l'effetto, mentre soddisfare la brama di gioco può avere un esito incerto in quanto il denaro può essere vinto o meno, a meno che non sia l'atto del gioco stesso, ad esempio come un'attività eccitante. Quindi, il gioco d'azzardo patologico può essere più eterogeneo a questo riguardo con un risultato più incerto dell'abuso di sostanze. Va notato che la variabilità dei risultati, comprese le vittorie e le perdite, può essere cruciale per lo sviluppo della dipendenza dal gioco d'azzardo, poiché presenta un modello intermittente variabile di rinforzo, che è la forma più potente di condizionamento strumentale / classico (Sharpe, 2002; Fiorillo et al., 2003). In secondo luogo, le sostanze psicoattive possono modificare più fortemente l'attività nel cervello e nel sistema nervoso periferico rispetto al gioco d'azzardo, a causa della loro diretta attività farmacologica su diversi sistemi di neurotrasmettitori, accelerando in tal modo i processi di dipendenza, rendendo l'abuso di sostanze una forma più potente di dipendenza.
I meccanismi neurobiologici di base del gioco d'azzardo sono complessi e coinvolgono molte diverse regioni del cervello e sistemi di neurotrasmettitori (esaminati in Raylu e Oei, 2002; Goudriaan et al., 2004; Potenza, 2013). La predisposizione alla dipendenza è stata correlata a un livello ridotto di recettori D2 della dopamina nello striato, che funzionano in un circuito di feedback per inibire l'ulteriore rilascio di dopamina. La risultante iperattività dei percorsi dopaminergici aumenta la sensibilità alla ricompensa, la motivazione e il rinforzo positivo del comportamento di dipendenza (Volkow et al., 2002; Di Chiara e Bassareo, 2007). I cambiamenti motivazionali specifici che si verificano quando si sviluppa il gioco patologico includono una maggiore motivazione a giocare (van Holst et al., 2012) e maggiore attenzione agli stimoli legati al gioco d'azzardo (Brevers et al., 2011a,b). Inoltre, i giocatori patologici hanno ridotto il controllo cognitivo sul comportamento in generale, come esemplificato da una riduzione delle prestazioni nei compiti di inibizione della risposta, aumento dell'impulsività e una preferenza per i guadagni immediati oltre i ritardi nei compiti neurocognitivi (Goudriaan et al., 2004; Brevers et al., 2012a; van den Bos et al., 2013a).
I giocatori d'azzardo patologici hanno prestazioni scarse rispetto ai controlli sui compiti decisionali rischiosi legati alla ricompensa formale (ad es. Cavedini et al., 2002; Brand et al., 2005; Brevers et al., 2012b; revisione: Brevers et al., 2013). Questa cattiva prestazione è indipendente dal fatto che le attività contengano regole esplicite e stabili per vincere e perdere come il gioco del gioco dei dadi (Brand et al., 2005) o se i soggetti devono imparare per tentativi ed errori quali scelte sono vantaggiose a lungo termine, come l'IGT (Cavedini et al., 2002; Brevers et al., 2012b; vedere la sezione Decisioni rischiose da parte dei pazienti HD in attività di laboratorio per i dettagli di questa attività). Tuttavia, la gravità del gioco d'azzardo era piuttosto correlata con le prestazioni nei compiti decisionali in cui la probabilità di esito è sconosciuta (IGT) rispetto alle attività con regole esplicite (Brevers et al., 2012b). Questa osservazione è interessante in considerazione del fatto che nei soggetti normali la seconda metà dell'IGT quando i soggetti hanno acquisito contingenze di compiti è simile a compiti con regole esplicite. Collettivamente, questi dati suggeriscono quindi che nelle disfunzioni patologiche nel processo decisionale possono derivare sia il controllo esecutivo diminuito, che è legato a regole più esplicite, sia l'elaborazione disturbata di punizione-premio (emotiva), che è più correlata al trial-and- errore di apprendimento per valutare il valore a lungo termine delle opzioni (van den Bos et al., 2013a, 2014). Inoltre, suggerisce che i disturbi di quest'ultimo potrebbero essere un fattore predisponente all'escalation del comportamento di gioco.
Da questi studi è chiaro che la predisposizione neurobiologica per lo sviluppo del comportamento patologico del gioco comporta disturbi sia nel circuito di controllo cognitivo / associativo sia nel circuito limbico (van den Bos et al., 2013a). Di conseguenza, i giocatori patologici mostrano un controllo cognitivo ridotto, una maggiore impulsività e una maggiore sensibilità alla ricompensa, tutti aspetti della disinibizione comportamentale (Iacono et al., 2008). La possibilità che un individuo sviluppi una dipendenza nella sua vita, tuttavia, dipende anche da molti altri aspetti, come le esperienze della prima infanzia e i rischi ambientali.
Gioco d'azzardo patologico in HD: prove epidemiologiche
Con la crescente quantità di possibilità offerte da Internet, negli ultimi anni c'è stato anche un aumento delle opportunità di gioco online sia legale che illegale. Queste attività di gioco facilmente accessibili e spesso incontrollate possono rappresentare un rischio per chiunque abbia una maggiore suscettibilità alla dipendenza dal gioco, ma potrebbero altrimenti non essere coinvolte in tali attività (Griffiths, 2003). I pazienti con MH sono uno dei gruppi per i quali il gioco d'azzardo su Internet può rappresentare un tale rischio, perché la disinibizione comportamentale, una caratteristica comune della malattia, è un fattore importante nello sviluppo di dipendenze (Iacono et al., 2008). Infatti, come accennato in precedenza, i pazienti con MH mostrano diversi segni di disinibizione, come irritabilità, inibizione della risposta compromessa e ridotto riconoscimento emotivo, in una fase precoce della malattia. Altri sintomi che sono stati osservati nella MH e possono influenzare la capacità dei pazienti di prendere decisioni razionali, sono l'inflessibilità cognitiva, la perseveranza, lo scarso giudizio e la riduzione della consapevolezza di sé. Oltre a queste somiglianze sintomatiche tra pazienti con MH e giocatori patologici, entrambi i gruppi mostrano anomalie strutturali e funzionali in circuiti cortico-striatali simili.
In vista di queste somiglianze tra giocatori patologici e pazienti con MH, ci si può aspettare che l'incidenza dei problemi di gioco aumenti tra i pazienti con MH rispetto alla popolazione normale. Tuttavia, solo uno studio finora ha riportato casi di gioco d'azzardo patologico in una famiglia italiana con HD (De Marchi et al., 1998). In questa famiglia, a due individui è stato diagnosticato un gioco d'azzardo patologico intorno all'età di 18, molto prima dell'inizio dei segni clinici della MH. Altri studi epidemiologici non hanno riportato questo problema, sebbene un compromesso processo decisionale, assunzione di rischi e scarsa capacità di giudizio abbiano dimostrato di rappresentare un rischio per i pazienti affetti da MH che gestiscono importanti decisioni di vita e affari finanziari (Klitzman et al., 2007; Shannon, 2011). Allo stesso modo, nella letteratura attuale sulla patologia HD mancano rapporti su argomenti correlati come l'abuso di sostanze e la dipendenza dall'uso di Internet. Al momento non è chiaro se l'assenza di segnalazioni di problemi di gioco nella letteratura in HD sia causata da una mancanza di attenzione per questo fenomeno, o se non vi sia in realtà una maggiore prevalenza del gioco d'azzardo patologico tra i pazienti con MH. Diversi motivi possono spiegare perché tali problemi non sono stati segnalati più frequentemente. In primo luogo, anche se l'incidenza del gioco d'azzardo patologico è aumentata in HD, questo probabilmente interesserà ancora solo una piccola percentuale di pazienti. In combinazione con il fatto che la popolazione affetta da HD è limitata nel numero, ciò potrebbe causare problemi di gioco inosservati come problema specifico in questo gruppo di pazienti. In secondo luogo, la mancanza di problemi di gioco in HD può essere correlata all'incapacità o alla mancanza di volontà dei pazienti di lasciare la casa a causa di disturbi motori e segni di apatia e depressione frequentemente osservati. Prima dell'avvento del gioco d'azzardo su Internet, questo potrebbe aver impedito ai malati di HD di visitare luoghi di gioco pubblici come il casinò. Infine, l'adolescenza sembra essere un periodo delicato per lo sviluppo di problemi di gioco (van den Bos et al., 2013a), mentre la maggior parte dei pazienti con MH non inizia a mostrare i sintomi correlati alla disinibizione fino a tarda età. Tuttavia, con l'aumento delle attività legate agli Internet degli adolescenti, possono acquisire forme di comportamento ricreativo come il gioco d'azzardo online, che si trasformano in un problema quando i sintomi dell'HD si manifestano più tardi nella vita. Pertanto, mentre l'ambiente in cui i pazienti affetti da gambling-HD si trovano potrebbero non aver promosso tale comportamento in passato, è chiaro che una maggiore accessibilità e disponibilità di opportunità di gioco da casa possono cambiare la prevalenza dei problemi correlati nella popolazione HD .
Decisioni rischiose da parte dei pazienti HD in attività di laboratorio
I compiti di laboratorio sono comunemente usati per valutare le anomalie cognitive e comportamentali nei disturbi neurologici. Per ottenere informazioni sui processi e le menomazioni coinvolte nel processo decisionale e nell'assunzione di rischi, sono stati sviluppati diversi compiti, tra cui l'IGT (Bechara et al., 1994) e la CGT (Rogers et al., 1999). Sulla IGT, i partecipanti sono presentati con quattro mazzi di carte. Sono incaricati di scegliere le carte da questi mazzi, con le quali possono vincere o perdere denaro; l'obiettivo del compito è vincere quanto più denaro possibile. I mazzi differiscono tra loro nella frequenza e nella quantità di vittorie e sconfitte. Due di questi sono mazzi "cattivi", che portano a una perdita complessiva nel lungo periodo, e due sono mazzi "buoni", che portano ad un guadagno complessivo. I partecipanti non ricevono queste informazioni, tuttavia, e hanno bisogno di scoprire quali mazzi sono più vantaggiosi durante gli esperimenti. Normale, sano, i partecipanti apprendono con successo le regole del compito dopo una certa quantità di campionamento, e alla fine iniziano a preferire i due mazzi "buoni". Tuttavia, ci sono significative differenze individuali nelle prestazioni anche tra partecipanti sani, tra cui ad esempio chiare differenze di sesso (van den Bos et al., 2013b). Sulla CGT, i partecipanti sono presentati con una fila di scatole 10 di due colori diversi e devono prendere una decisione probabilistica in cui la casella di colore di un token è nascosta. Devono quindi scommettere punti di credito sulla loro fiducia in questa decisione. In questo compito, tutte le informazioni rilevanti vengono presentate al partecipante durante l'esperimento e le prove sono indipendenti, riducendo così al minimo la memoria di lavoro e le esigenze di apprendimento. Entrambi i compiti di gioco d'azzardo sono ben stabiliti e l'IGT è accettato come una simulazione valida del processo decisionale nella vita reale (Buelow e Suhr, 2009), mentre la CGT è particolarmente utile per lo studio del processo decisionale al di fuori di un contesto di apprendimento.
I pazienti con MH sono stati testati sia nell'Iowa che a Cambridge Gambling Task. In uno studio con pazienti in fase intermedia, Stout et al. (2001) trovato che la prestazione sull'IGT era ridotta rispetto ai soggetti normali. La differenza di prestazioni divenne evidente nella seconda parte del compito; dove i soggetti normalmente iniziano a mostrare una preferenza per i buoni mazzi, i pazienti con MH continuano a fare selezioni frequenti dai cattivi mazzi. Questo suggerisce che i pazienti con MH non hanno ancora appreso quali mazzi erano vantaggiosi, o hanno continuato a scegliere carte dai mazzi cattivi nonostante questa conoscenza. Gli autori hanno notato che molti partecipanti all'HD hanno indicato di sapere che alcuni mazzi erano svantaggiosi, ma continuavano a selezionare carte da quei mazzi, suggerendo che i pazienti con MH possono imparare le regole del compito, ma non sono in grado di imporre un modello di selezione vantaggioso e resistere rispondere a punizioni e premi individuali. Ciononostante, si è scoperto che una riduzione delle prestazioni era associata a problemi di memoria e concettualizzazione, portando gli autori a ipotizzare che i pazienti con MH potessero avere difficoltà nell'apprendimento o nel ricordare le conseguenze a lungo termine della scelta delle carte da un determinato mazzo. I pazienti con MH hanno anche ottenuto punteggi più alti sulla disinibizione rispetto ai controlli sani, ma questa misura non era correlata con le prestazioni del compito. In un follow-up degli stessi dati, Stout e colleghi, hanno confrontato tre modelli decisionali cognitivi per spiegare il deficit di prestazioni dei pazienti con MH e hanno trovato che questo era meglio spiegato dai deficit nella memoria di lavoro e da aumenti di imprudenza e impulsività (Busemeyer e Stout, 2002). Le prestazioni compromesse dei pazienti con MH sull'IGT possono anche essere correlate a un ridotto impatto delle perdite su questi pazienti, che è stato rilevato misurando le risposte di conduttanza della pelle durante l'IGT (Campbell et al., 2004). Questo risultato è coerente con il riconoscimento non corretto delle emozioni negative nei pazienti con MH (Johnson et al., 2007; Ille et al., 2011e suggerisce che potrebbero essere meno sensibili alle punizioni di grandi dimensioni, e quindi meno propensi a voltare le spalle ai mazzi di carte sbagliate. Soprattutto la seconda parte dell'IGT richiede la capacità di sopprimere i corsi d'azione svantaggiosi in risposta alle punizioni, rafforzando nel contempo le azioni redditizie (de Visser et al., 2011; van den Bos et al., 2013b, 2014).
Un numero limitato di altri studi ha testato un processo decisionale rischioso nelle prime fasi della MH, ma non ha riscontrato difficoltà di performance in questi pazienti sia sull'IGT che sulla CGT (Watkins et al., 2000; Holl et al., 2013). Pertanto, sembra che le menomazioni nel processo decisionale e il rischio di problemi di gioco non si sviluppino fino agli stadi intermedi della malattia. Tuttavia, questi studi hanno riscontrato svantaggi nelle attività che richiedevano la pianificazione e l'inibizione delle risposte pre-potenti nei pazienti con MH precoce. Sembra quindi che i pazienti con MH sviluppino inizialmente sottili problemi con l'inibizione, la pianificazione, il riconoscimento emotivo e la memoria di lavoro. In alcuni pazienti questo può già portare a problemi di giudizio e di decisione nelle prime fasi della malattia, ma la maggior parte dei pazienti con MH non ha problemi con compiti decisionali rischiosi finché non raggiungono uno stadio intermedio della malattia.
Meccanismi neurobiologici del processo decisionale in HD
Percorsi neurobiologici alla base dei normali processi decisionali nell'IGT
I meccanismi neurobiologici alla base dei processi decisionali nella IGT sono stati ben studiati e descritti (vedi ad es. Bechara et al., 2000; Doya, 2008; de Visser et al., 2011; van den Bos et al., 2013b, 2014). L'esecuzione normale di questo compito richiede un'interazione tra i circuiti cortico-striatali di controllo limbico e associativo / cognitivo. Si ritiene che l'attività nel circuito limbico sia dominante durante la prima fase dell'IGT, durante la quale è coinvolta nel comportamento esplorativo, risponde alle ricompense e alle punizioni e apprende i valori affettivi dei risultati a breve e lungo termine delle decisioni nel compito (Manes et al., 2002; Clark e Manes, 2004; Fellows e Farah, 2005; Gleichgerrcht et al., 2010; de Visser et al., 2011; van den Bos et al., 2014). Il circuito di controllo associativo / cognitivo, d'altra parte, è più importante durante la seconda parte dell'IGT, quando è necessario sopprimere le risposte impulsive ai premi e alle punizioni per il beneficio a lungo termine, rinforzare i modelli comportamentali vantaggiosi e sopprimere schemi svantaggiosi (Manes et al., 2002; Clark e Manes, 2004; Fellows e Farah, 2005; Gleichgerrcht et al., 2010; de Visser et al., 2011; van den Bos et al., 2014).
Anomalie neurobiologiche nei processi decisionali dell'IGT in HD
Poiché i processi decisionali nell'IGT implicano un'interazione tra circuiti cortico-striatali di controllo limbico e associativo / cognitivo, non sorprende che i pazienti con MH siano compromessi nell'esecuzione di questo compito. Una delle osservazioni di Stout e colleghi è che l'impatto della perdita sul processo decisionale è ridotto nei pazienti con MH (Campbell et al., 2004). Ciò è coerente con i risultati secondo cui questi pazienti sono compromessi nel riconoscimento delle emozioni negative e possono essere spiegati da disturbi nella corteccia orbitofrontale (Ille et al., 2011). La corteccia orbitofrontale è importante per l'elaborazione emotiva e viene attivata in soggetti normali in risposta a punizioni e ricompense in un compito decisionale (O'Doherty et al., 2001). Un'altra scoperta di Stout et al. (2001) è che le prestazioni dei pazienti con MH sull'IGT sono correlate con la concettualizzazione ridotta e le misure di memoria a lungo termine sulla scala di valutazione della demenza di Mattis. L'incapacità di apprendere o ricordare quali piattaforme sono vantaggiose a lungo termine può essere associata ad una diminuzione dell'attività del circuito di controllo cognitivo / associativo, necessaria per la pianificazione a lungo termine e il controllo degli impulsi (Manes et al., 2002; Clark e Manes, 2004; Fellows e Farah, 2005; Gleichgerrcht et al., 2010). Ciò è anche coerente con i deficit specifici della via indiretta in HD, dal momento che uno studio recente mostra che la via indiretta è importante per la sensibilità alla punizione in un compito di apprendimento di rinforzo (Kravitz et al., 2012; Paton e Louie, 2012). L'insensibilità alle conseguenze future di una decisione può anche essere causata dalla disfunzione della corteccia prefrontale ventromediale, dal momento che insensibilità simile è stata osservata in pazienti con danni a questa area prefrontale (Bechara et al., 1994). Pertanto, la riduzione della prestazione dei pazienti con MH sull'IGT può essere causata da una combinazione di disfunzioni nei circuiti cortico-striatali che coinvolgono la corteccia orbitofrontale, la corteccia prefrontale ventromediale e la corteccia prefrontale dorsolaterale. Ciò porta a una riduzione della capacità di risposta alla punizione nella prima fase dell'attività e alla mancata conoscenza di quali piattaforme sono vantaggiose a lungo termine, pianificano di conseguenza e sopprimono le risposte impulsive nella seconda fase dell'IGT.
Discussione
HD e gioco d'azzardo patologico: quali sono i rischi?
La tipica serie di sintomi motori, emotivi e cognitivi della MH è causata dall'atrofia progressiva dello striato che colpisce i diversi circuiti cortico-striatali. Sebbene l'insorgenza e la progressione dei sintomi comportamentali e cognitivi sembri essere altamente eterogenea, i circuiti motori e cognitivi sono tipicamente colpiti nelle prime fasi della malattia, mentre il circuito limbico è interessato in una fase successiva. È interessante notare che la predisposizione neurobiologica al gioco d'azzardo patologico e ad altre dipendenze comporta disturbi negli stessi circuiti cortico-striatali che sono affetti dalla MH. Nonostante queste sorprendenti somiglianze, tuttavia, nella letteratura medica l'HD non è stato associato al gioco d'azzardo patologico o ad altri comportamenti di dipendenza. Solo uno studio finora ha descritto una famiglia in cui i problemi di gioco si sono verificati in diversi membri della famiglia affetti da HD (De Marchi et al., 1998). Noi ipotizziamo che i sintomi motori dei pazienti, così come la loro età e ambiente sociale, possano finora aver impedito loro di sviluppare il gioco d'azzardo patologico, nonostante la loro maggiore suscettibilità a tali problemi. D'altra parte, ci si può aspettare che la depressione frequentemente diagnosticata aumenti l'impulsività e il rischio di problemi di gioco, sulla base di studi di correlazione (Clarke, 2006). Un'altra spiegazione per la mancanza di osservazioni sui problemi del gioco d'azzardo in HD può essere correlata a differenze nella neuropatologia di base. Mentre i disturbi cognitivi sembrano essere molto simili tra giocatori d'azzardo patologici e pazienti con MH, i cambiamenti emotivi sono di natura diversa. I giocatori d'azzardo patologici mostrano principalmente una maggiore sensibilità alle ricompense, esortandoli a iniziare e continuare il gioco d'azzardo. L'HD, d'altra parte, è stata associata ad una diminuita sensibilità alle punizioni e alle emozioni negative. Questa differenza può essere una ragione importante per cui i pazienti con MH non sembrano avere una maggiore tendenza a iniziare a giocare oa impegnarsi in altri comportamenti gratificanti e che creano dipendenza.
Tuttavia, i disturbi del circuito cortico-striatico limbico dei pazienti con MH possono ancora promuovere un processo decisionale rischioso in situazioni con esito incerto, come dimostrato nell'IGT (Doya, 2008). Inoltre, la combinazione di diminuita sensibilità alla punizione, incapacità di inibire le risposte impulsive a ricompense immediate e incapacità di considerare ricompense ritardate a lungo termine e applicare di conseguenza modelli comportamentali vantaggiosi, rende probabile che i pazienti con MH sviluppino problemi di gioco, quando incontrano un situazione che promuove tale comportamento. I problemi caratteristici dei pazienti con MH con cambiamento di strategia e sintomi di inflessibilità cognitiva e perseveranza possono contribuire alla progressione del comportamento patologico in queste situazioni. Quindi, proponiamo che i pazienti con MH non abbiano una maggiore tendenza a iniziare il gioco d'azzardo o altri comportamenti di dipendenza inerenti alla loro neuropatologia, ma che abbiano un aumentato rischio di sviluppare una dipendenza una volta che si impegnano nel gioco d'azzardo. In accordo con questa idea, è stato osservato che i pazienti con lesioni frontali diventano impulsivi e spesso prendono decisioni sbagliate, ma che non mostrano un comportamento di assunzione di rischi maggiore (Miller, 1992; Bechara et al., 2000). Ciò suggerisce che un comportamento compromesso in termini di presa di decisioni e assunzione di rischi o di attenzione non si verifica necessariamente insieme e che diverse combinazioni di disturbi del circuito limbic e associativo / cognitivo possono avere effetti diversi sul comportamento decisionale e sul gioco d'azzardo. La nostra ipotesi spiegherebbe anche perché non è stato osservato che i pazienti con MH hanno prestazioni peggiori con la CGT. Poiché tutte le informazioni su opportunità e valori di vittorie e perdite sono disponibili in anticipo in questo compito, i pazienti con MH potrebbero non sviluppare strategie svantaggiose, perché non sono attivamente alla ricerca di rischi. Tuttavia, questo dovrebbe essere testato in pazienti con malattia più avanzata.
Se i pazienti con MH presentano effettivamente un rischio maggiore di sviluppare comportamenti patologici di gioco d'azzardo se presentati con la situazione appropriata, l'aumento delle opportunità di gioco d'azzardo su Internet facilmente accessibili può rappresentare un rischio specifico per questo gruppo di pazienti. Anche se non cercano attivamente queste situazioni, i pazienti con MH hanno maggiori probabilità di trovare opportunità di gioco rispetto a prima. Ciò è particolarmente vero per i pazienti che trascorrono la maggior parte del loro tempo a casa a causa dei loro sintomi, in cui Internet può essere un mezzo importante per occuparli. Una maggiore probabilità di coinvolgimento nel gioco d'azzardo può quindi causare un aumento sproporzionato dei problemi correlati nella popolazione HD. Suggeriamo che i tutori dovrebbero essere consapevoli di questi possibili rischi e preferibilmente cercare di impedire ai pazienti con MH di impegnarsi in attività di gioco (online). Inoltre, sosteniamo che i medici dovrebbero valutare regolarmente il rischio e la prevalenza dei problemi legati al gioco d'azzardo nella popolazione HD, per essere in grado di fornire cure e orientamenti appropriati a pazienti e assistenti.
Direzioni future
Oltre agli studi epidemiologici per valutare la prevalenza del gioco d'azzardo patologico e altre dipendenze nella MH, possono essere suggerite diverse linee di ricerca per aumentare la nostra comprensione dei problemi discussi in questo documento. Prima di tutto, sarebbe interessante collegare i deficit di prestazione all'IGT direttamente ai disturbi dell'attività cortico-striatale nei pazienti con MH. A tal fine, i modelli di attivazione cerebrale dei pazienti HD possono essere studiati con la risonanza magnetica funzionale durante l'esecuzione dell'IGT e confrontati con l'attività nei soggetti normali. Si prevede che l'attività nello striato, nella corteccia prefrontale dorsolaterale e nella corteccia orbitofrontale diminuirà nei pazienti con MH durante il processo decisionale sull'IGT.
Per studiare gli aspetti comportamentali e neurobiologici del comportamento di gioco in HD in modo più dettagliato, è possibile utilizzare i modelli di malattia dei roditori attualmente disponibili. A livello comportamentale, ci si può aspettare che questi animali mostrino una prestazione ridotta sull'IGT, simile ai pazienti umani. Sono disponibili versioni roditori di IGT (recensione: de Visser et al., 2011) e il coinvolgimento di diverse strutture neuronali in questi modelli è ben caratterizzato (de Visser et al., 2011; van den Bos et al., 2013a, 2014). Pertanto, tali esperimenti sono fattibili e possono essere combinati con un'analisi approfondita dei cambiamenti neuronali sottostanti nei modelli di roditori di HD utilizzando una varietà di tecniche. Inoltre, con l'avvento di metodi e strumenti di ricerca più ecologici validi per valutare lo sviluppo di comportamenti patologici, il rischio di sviluppare il gioco d'azzardo patologico può essere studiato in condizioni (semi) naturali sia nell'uomo che negli animali (van den Bos et al., 2013a). Insieme, questi studi sui sintomi legati al gioco d'azzardo e sulla neuropatologia di base nei pazienti umani e nei modelli animali della MH ci forniranno una migliore comprensione dei rischi legati al gioco d'azzardo, e possibilmente altri comportamenti di dipendenza, in HD, e miglioreranno la nostra capacità di fornire trattamento e guida adeguati.
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riferimenti
Abada, YK, Schreiber, R. ed Ellenbroek, B. (2013). Deficit motori, emotivi e cognitivi nei topi BACHD adulti: un modello per la malattia di Huntington. Behav. Cervello. 238, 243-251. doi: 10.1016 / j.bbr.2012.10.039
Albin, RL, Young, AB e Penney, JB (1989). L'anatomia funzionale dei disturbi dei gangli della base. Tendenze neurosci. 12, 366–375. doi: 10.1016/0166-2236(89)90074-x
Alexander, GE e Crutcher, MD (1990). Architettura funzionale dei circuiti dei gangli della base: substrati neurali di elaborazione parallela. Tendenze neurosci. 13, 266–271. doi: 10.1016/0166-2236(90)90107-l
Alexander, GE, Crutcher, MD e DeLong, MR (1990). Circuiti ganglia-talamo-corticali basali: substrati paralleli per funzioni motorie, oculomotorie, "prefrontali" e "limbiche". Prog. Cervello. 85, 119–146. doi: 10.1016/s0079-6123(08)62678-3
Alexander, GE, DeLong, MR e Strick, PL (1986). Organizzazione parallela di circuiti funzionalmente segregati che collegano i gangli della base e la corteccia. Annu. Rev. Neurosci. 9, 357-381. doi: 10.1146 / annurev.neuro.9.1.357
Anderson, KE (2011). "Capitolo 2 - Malattia di Huntington", a Manuale di Neurologia clinica, edes WJ Weiner ed E. Tolosa, Hyperkinetic Movement Disorders (London: Elsevier), 15-24.
Bechara, A., Damasio, AR, Damasio, H. e Anderson, SW (1994). Insensibilità alle conseguenze future a seguito del danneggiamento della corteccia prefrontale umana. Cognizione 50, 7–15. doi: 10.1016/0010-0277(94)90018-3
Bechara, A., Damasio, H. e Damasio, AR (2000). Emozione, processo decisionale e corteccia orbitofrontale. Cereb. Corteccia 10, 295-307. doi: 10.1093 / cercor / 10.3.295
Bittenbender, JB e Quadfasel, FA (1962). Forme rigide ed acide della corea di Huntington. Arco. Neurol. 7, 275-288. doi: 10.1001 / archneur.1962.04210040027003
Blackmore, L., Simpson, SA e Crawford, JR (1995). Prestazioni cognitive nel campione britannico di persone presintomatiche portatrici del gene per la malattia di Huntington. J. Med. Genet. 32, 358-362. doi: 10.1136 / jmg.32.5.358
Bonelli, RM e Cummings, JL (2007). Circuito e comportamento sottocorticali frontali. Dialoghi Clin. Neurosci. 9, 141-151.
Marchio, M., Kalbe, E., Labudda, K., Fujiwara, E., Kessler, J. e Markowitsch, HJ (2005). Menomazioni decisionali in pazienti con gioco d'azzardo patologico. Resistenza psichiatrica 133, 91-99. doi: 10.1016 / j.psychres.2004.10.003
Brevers, D., Bechara, A., Cleeremans, A. e Noël, X. (2013). Iowa Gambling Task (IGT): vent'anni dopo - disturbo del gioco d'azzardo e IGT. Davanti. Psychol. 4: 665. doi: 10.3389 / fpsyg.2013.00665
Brevers, D., Cleeremans, A., Bechara, A., Laloyaux, C., Kornreich, C., Verbanck, P., et al. (2011a). Tempo di bias attenzionale per le informazioni sul gioco d'azzardo nel gioco d'azzardo problematico. Psychol. Dipendente. Behav. 25, 675-682. doi: 10.1037 / a0024201
Brevers, D., Cleeremans, A., Goudriaan, AE, Bechara, A., Kornreich, C., Verbanck, P., et al. (2012b). Il processo decisionale sotto ambiguità ma non a rischio è legato alla gravità del problema del gioco d'azzardo. Resistenza psichiatrica 200, 568-574. doi: 10.1016 / j.psychres.2012.03.053
Brevers, D., Cleeremans, A., Verbruggen, F., Bechara, A., Kornreich, C., Verbanck, P., et al. (2012a). L'azione impulsiva ma la scelta impulsiva determina la gravità del gioco d'azzardo problematico. PLoS One 7: e50647. doi: 10.1371 / journal.pone.0050647
Brevers, D., Cleeremans, A., Tibboel, H., Bechara, A., Kornreich, C., Verbanck, P., et al. (2011b). Ridotto battito d'occhio attenuante per gli stimoli legati al gioco d'azzardo nei giocatori problematici. J. Behav. Ther. Exp. Psichiatria 42, 265-269. doi: 10.1016 / j.jbtep.2011.01.005
Buelow, MT e Suhr, JA (2009). Costruisci la validità del compito del gioco d'azzardo iowa. Neuropsychol. Rev. 19, 102–114. doi: 10.1007/s11065-009-9083-4
Busemeyer, JR e Stout, JC (2002). Un contributo dei modelli di decisione cognitiva alla valutazione clinica: prestazioni in decomposizione sul compito di gioco di Bechara. Psychol. Valutare. 14, 253-262. doi: 10.1037 / 1040-3590.14.3.253
Caine, ED e Shoulson, I. (1983). Sindromi psichiatriche nella malattia di Huntington. Am. J. Psychiatry 140, 728-733.
Campbell, MC, Stout, JC e Finn, PR (2004). Ridotta autonomia di risposta alle perdite di gioco d'azzardo nella malattia di Huntington. J. Int. Neuropsychol. Soc. 10, 239-245. doi: 10.1017 / s1355617704102105
Cavedini, P., Riboldi, G., Keller, R., D'Annucci, A., e Bellodi, L. (2002). Disfunzione del lobo frontale in pazienti con gioco d'azzardo patologico. Biol. Psichiatria 51, 334–341. doi: 10.1016/s0006-3223(01)01227-6
Clark, L. e Goudriaan, AE (2012). "Neuroimaging nel problema del gioco d'azzardo", in Enciclopedia dei comportamenti di dipendenza, PM PM Miller (Londra: Elsevier).
Clark, L. e Manes, F. (2004). Decisione sociale ed emotiva dopo lesione del lobo frontale. Neurocase 10, 398-403. doi: 10.1080 / 13554790490882799
Clarke, D. (2006). Impulsività come mediatore nella relazione tra depressione e gioco d'azzardo problematico. Pers. Individ. Differire. 40, 5-15. doi: 10.1016 / j.paid.2005.05.008
Craufurd, D., Thompson, JC e Snowden, JS (2001). Cambiamenti comportamentali nella malattia di Huntington. Neuropsichiatria Neuropsychol. Behav. Neurol. 14, 219-226.
de Boo, GM, Tibben, A., Lanser, JB, Jennekens-Schinkel, A., Hermans, J., Maat-Kievit, A., et al. (1997). Sintomi precoci cognitivi e motori in portatori identificati del gene per la malattia di Huntington. Arco. Neurol. 54, 1353-1357. doi: 10.1001 / archneur.1997.00550230030012
De Marchi, N., Morris, M., Mennella, R., La Pia, S. e Nestadt, G. (1998). Associazione del disturbo ossessivo-compulsivo e del gioco d'azzardo patologico con la malattia di Huntington in un pedigree italiano: possibile associazione con la mutazione della malattia di Huntington. Acta Psychiatr. Scand. 97, 62–65. doi: 10.1111/j.1600-0447.1998.tb09964.x
de Visser, L., Homberg, JR, Mitsogiannis, M., Zeeb, FD, Rivalan, M., Fitoussi, A., et al. (2011). Versioni roditori del compito del gioco d'azzardo iowa: opportunità e sfide per la comprensione del processo decisionale. Davanti. Neurosci. 5: 109. doi: 10.3389 / fnins.2011.00109
Di Chiara, G. e Bassareo, V. (2007). Sistema di ricompensa e dipendenza: cosa fa e cosa non fa la dopamina. Curr. Opin. Pharmacol. 7, 69-76. doi: 10.1016 / j.coph.2007.02.001
Dias, R., Robbins, TW e Roberts, AC (1996). Dissociazione nella corteccia prefrontale di cambiamenti affettivi e attenzionali. Natura 380, 69-72. doi: 10.1038 / 380069a0
Dodd, M., Klos, K., Bower, J., Geda, Y., Josephs, K. e Ahlskog, J. (2005). Gioco d'azzardo patologico causato da farmaci usati per il trattamento del morbo di Parkinson. Arco. Neurol. 62, 1377-1381. doi: 10.1001 / archneur.62.9.noc50009
Doya, K. (2008). Modulatori del processo decisionale. Nat. Neurosci. 11, 410-416. doi: 10.1038 / nn2077
Duff, K., Paulsen, JS, Beglinger, LJ, Langbehn, DR e Stout, JC (2007). Sintomi psichiatrici nella malattia di Huntington prima della diagnosi: studio predittivo-HD. Biol. Psichiatria 62, 1341-1346. doi: 10.1016 / j.biopsych.2006.11.034
Duff, K., Paulsen, JS, Beglinger, LJ, Langbehn, DR, Wang, C., Stout, JC, et al. (2010b). Comportamenti "frontali" prima della diagnosi della malattia di Huntington e della sua relazione con i marcatori della progressione della malattia: evidenza di una precoce mancanza di consapevolezza. J. Clinica Neuropsichiatrica. Neurosci. 22, 196-207. doi: 10.1176 / appi.neuropsych.22.2.196
Duff, K., Paulsen, J., Mills, J., Beglinger, LJ, Moser, DJ, Smith, MM, et al. (2010a). Compromissione cognitiva lieve nella malattia di Huntington prediagnosticata. Neurologia 75, 500–507. doi: 10.1212/wnl.0b013e3181eccfa2
Dumas, EM, van den Bogaard, SJ, Middelkoop, HA e Roos, RA (2013). Una revisione della cognizione nella malattia di Huntington. Davanti. Biosci. (Schol. Ed.) 5, 1-18. doi: 10.2741 / s355
Epping, EA, Mills, JA, Beglinger, LJ, Fiedorowicz, JG, Craufurd, D., Smith, MM, et al. (2013). Caratterizzazione della depressione nella malattia di Huntington prodromica nei predittori neurobiologici dello studio HD (PREDICT-HD). J. Psychiatr. Res. 47, 1423-1431. doi: 10.1016 / j.jpsychires.2013.05.026
Faure, A., Höhn, S., von Hörsten, S., Delatour, B., Raber, K., Le Blanc, P., et al. (2011). Alterazione emotiva e motivazionale modificata nel modello di ratto transgenico per la malattia di Huntington. Neurobiol. Imparare. Mem. 95, 92-101. doi: 10.1016 / j.nlm.2010.11.010
Fellows, LK e Farah, MJ (2005). Diverse menomazioni di fondo nel processo decisionale a seguito di danno del lobo frontale ventromediale e dorsolaterale nell'uomo. Cereb. Corteccia 15, 58-63. doi: 10.1093 / cercor / bhh108
Fielding, SA, Brooks, SP, Klein, A., Bayram-Weston, Z., Jones, L. e Dunnett, SB (2012). Profili di decadimento motorio e cognitivo nel modello di topo transgenico della malattia di Huntington. Cervello. Toro. 88, 223-236. doi: 10.1016 / j.brainresbull.2011.09.011
Fink, KD, Rossignol, J., Crane, AT, Davis, KK, Bavar, AM, Dekorver, NW, et al. (2012). Disfunzione cognitiva precoce nel modello di ratto transgenico HD 51 CAG della malattia di Huntington. Behav. Neurosci. 126, 479-487. doi: 10.1037 / a0028028
Fiorillo, CD, Tobler, PN e Schultz, W. (2003). Codifica discreta della probabilità di ricompensa e incertezza dei neuroni della dopamina. Scienze 299, 1898-1902. doi: 10.1126 / science.1077349
Folstein, SE e Folstein, MF (1983). Caratteristiche psichiatriche della malattia di Huntington: recenti approcci e risultati. Psychiatr. Dev. 1, 193-205.
Foroud, T., Siemers, E., Kleindorfer, D., Bill, DJ, Hodes, ME, Norton, JA, et al. (1995). Punteggi cognitivi nei portatori del gene della malattia di Huntington rispetto ai non portatori. Ann. Neurol. 37, 657-664. doi: 10.1002 / ana.410370516
Giordani, B., Berent, S., Boivin, MJ, Penney, JB, Lehtinen, S., Markel, DS, et al. (1995). Analisi longitudinale del legame neuropsicologico e genetico delle persone a rischio di malattia di Huntington. Arco. Neurol. 52, 59-64. doi: 10.1001 / archneur.1995.00540250063014
Gleichgerrcht, E., Ibanez, A., Roca, M., Torralva, T. e Manes, F. (2010). Cognizione decisionale nelle malattie neurodegenerative. Nat. Rev. Neurol. 6, 611-623. doi: 10.1038 / nrneurol.2010.148
Goudriaan, AE, Oosterlaan, J., de Beurs, E. e Van den Brink, W. (2004). Gioco d'azzardo patologico: una rassegna completa dei risultati bio-comportamentali. Neurosci. Biobehav. Rev. 28, 123-141. doi: 10.1016 / j.neubiorev.2004.03.001
Graybiel, AM, Aosaki, T., Flaherty, AW e Kimura, M. (1994). I gangli basali e il controllo motorio adattivo. Scienze 265, 1826-1831. doi: 10.1126 / science.8091209
Griffiths, M. (2003). Gioco d'azzardo su Internet: problemi, preoccupazioni e raccomandazioni. Cyberpsychol. Behav. 6, 557-568. doi: 10.1089 / 109493103322725333
Grimbergen, YAM, Knol, MJ, Bloem, BR, Kremer, BPH, Roos, RAC e Munneke, M. (2008). Cadute e disturbi della deambulazione nella malattia di Huntington. Mov. Disord. 23, 970-976. doi: 10.1002 / mds.22003
Haber, SN e Knutson, B. (2010). Il circuito della ricompensa: collegamento tra anatomia dei primati e imaging umano. Neuropsicofarmacologia 35, 4-26. doi: 10.1038 / npp.2009.129
Hadzi, TC, Hendricks, AE, Latourelle, JC, Lunetta, KL, Cupples, LA, Gillis, T., et al. (2012). Valutazione del coinvolgimento corticale e striatale nei cervelli della malattia di 523 Huntington. Neurologia 79, 1708–1715. doi: 10.1212/wnl.0b013e31826e9a5d
Hahn-Barma, V., Deweer, B., Dürr, A., Dodé, C., Feingold, J., Pillon, B., et al. (1998). I cambiamenti cognitivi sono i primi sintomi della malattia di Huntington? Uno studio su portatori di geni. J. Neurol. Neurosurg. Psichiatria 64, 172-177. doi: 10.1136 / jnnp.64.2.172
Hamilton, JM, Salmon, DP, Corey-Bloom, J., Gamst, A., Paulsen, JS, Jerkins, S., et al. (2003). Anomalie comportamentali contribuiscono al declino funzionale nella malattia di Huntington. J. Neurol. Neurosurg. Psichiatria 74, 120-122. doi: 10.1136 / jnnp.74.1.120
Hansotia, P., Cleeland, CS e Chun, RW (1968). Corea giovanile Huntington. Neurologia 18, 217-224.
Heemskerk, A.-W. e Roos, RAC (2011). Disfagia nella malattia di Huntington: una revisione. Disfagia 26, 62–66. doi: 10.1007/s00455-010-9302-4
Henley, SMD, Wild, EJ, Hobbs, NZ, Warren, JD, Frost, C., Scahill, RI, et al. (2008). Il riconoscimento delle emozioni difettose all'inizio della MH è neuropsicologicamente e anatomicamente generico. Neuropsychologia 46, 2152-2160. doi: 10.1016 / j.neuropsychologia.2008.02.025
Holl, AK, Wilkinson, L., Tabrizi, SJ, Painold, A. e Jahanshahi, M. (2013). Disfunzione esecutiva selettiva ma processo decisionale intatto e rischioso nella malattia di Huntington in fase iniziale. Mov. Disord. 28, 1104-1109. doi: 10.1002 / mds.25388
Hoth, KF, Paulsen, JS, Moser, DJ, Tranel, D., Clark, LA e Bechara, A. (2007). I pazienti con malattia di Huntington hanno una ridotta consapevolezza delle abilità cognitive, emotive e funzionali. J. Clin. Exp. Neuropsychol. 29, 365-376. doi: 10.1080 / 13803390600718958
Iacono, WG, Malone, SM e McGue, M. (2008). Disinibizione comportamentale e sviluppo della dipendenza precoce: influenze comuni e specifiche. Annu. Rev. Clin. Psychol. 4, 325-348. doi: 10.1146 / annurev.clinpsy.4.022007.141157
Ille, R., Schäfer, A., Scharmüller, W., Enzinger, C., Schöggl, H., Kapfhammer, HP, et al. (2011). Riconoscimento ed esperienza delle emozioni nella malattia di Huntington: studio di morfometria basato su voxel. J. Psychiatry Neurosci. 36, 383-390. doi: 10.1503 / jpn.100143
Jason, GW, Pajurkova, EM, Suchowersky, O., Hewitt, J., Hilbert, C., Reed, J., et al. (1988). Compromissione neuropsicologica presintomatica nella malattia di Huntington. Arco. Neurol. 45, 769-773. doi: 10.1001 / archneur.1988.00520310079021
Johnson, SA, Stout, JC, Solomon, AC, Langbehn, DR, Aylward, EH, Cruce, CB, et al. E Predict-HD Investigators del gruppo di studio Huntington (2007). Oltre il disgusto: riconoscimento alterato delle emozioni negative prima della diagnosi nella malattia di Huntington. Cervello 130, 1732-1744. doi: 10.1093 / cervello / awm107
Jones, L. e Hughes, A. (2011). "Meccanismi patogenetici nella malattia di Huntington", in Rassegna internazionale di neurobiologia, a cura di J. Brotchie, E. Bezard e P. Jenner, Pathophysiology, Farmacology and Biochemistry of Dyskinesia (London: Academic Press), 373-418.
Josiassen, RC, Curry, LM e Mancall, EL (1983). Sviluppo di deficit neuropsicologici nella malattia di Huntington. Arco. Neurol. 40, 791-796. doi: 10.1001 / archneur.1983.04050120041005
Julien, CL, Thompson, JC, Wild, S., Yardumian, P., Snowden, JS, Turner, G., et al. (2007). Disturbi psichiatrici nella malattia di Huntington preclinica. J. Neurol. Neurosurg. Psichiatria 78, 939-943. doi: 10.1136 / jnnp.2006.103309
Kassubek, J., Juengling, FD, Kioschies, T., Henkel, K., Karitzky, J., Kramer, B., et al. (2004). Topografia dell'atrofia cerebrale nella malattia di Huntington in fase iniziale: studio MRI morfometrico basato su voxel. J. Neurol. Neurosurg. Psichiatria 75, 213-220. doi: 10.1136 / jnnp.2002.009019
Kirkwood, SC, Siemers, E., Stout, JC, Hodes, ME, Conneally, PM, Christian, JC, et al. (1999). Cambiamenti cognitivi e motori longitudinali tra portatori del gene della malattia di Huntington presintomatici. Arco. Neurol. 56, 563-568. doi: 10.1001 / archneur.56.5.563
Kirkwood, SC, Su, JL, Conneally, P. e Foroud, T. (2001). Progressione dei sintomi nelle fasi iniziali e intermedie della malattia di Huntington. Arco. Neurol. 58, 273-278. doi: 10.1001 / archneur.58.2.273
Klitzman, R., Thorne, D., Williamson, J., Chung, W. e Marder, K. (2007). Il processo decisionale sulle scelte riproduttive tra gli individui a rischio per la malattia di Huntington. J. Genet. Cons. 16, 347–362. doi: 10.1007/s10897-006-9080-1
Klöppel, S., Stonnington, CM, Petrovic, P., Mobbs, D., Tüscher, O., Craufurd, D., et al. (2010). Irritabilità nella malattia di Huntington pre-clinica. Neuropsychologia 48, 549-557. doi: 10.1016 / j.neuropsychologia.2009.10.016
Koller, WC e Trimble, J. (1985). L'anormalità dell'andatura della malattia di Huntington. Neurologia 35, 1450-1454. doi: 10.1212 / wnl.35.10.1450
Kravitz, AV, Tye, LD e Kreitzer, AC (2012). Ruoli distinti per i neuroni striatali del percorso diretto e indiretto nel rinforzo. Nat. Neurosci. 15, 816-818. doi: 10.1038 / nn.3100
Labuschagne, I., Jones, R., Callaghan, J., Whitehead, D., Dumas, EM, Say, MJ, et al. (2013). Disturbi del riconoscimento facciale emotivo e effetti farmacologici in pre-manifestazione attraverso la malattia di Huntington dello stadio II. Resistenza psichiatrica 207, 118-126. doi: 10.1016 / j.psychres.2012.09.022
Lange, KW, Sahakian, BJ, Quinn, NP, Marsden, CD e Robbins, TW (1995). Il confronto tra la funzione di memoria esecutiva e visuospaziale nella malattia di Huntington e la demenza di tipo Alzheimer corrisponde al grado di demenza. J. Neurol. Neurosurg. Psichiatria 58, 598-606. doi: 10.1136 / jnnp.58.5.598
Lawrence, AD, Sahakian, BJ, Hodges, JR, Rosser, AE, Lange, KW e Robbins, TW (1996). Funzioni esecutive e mnemoniche nella precoce malattia di Huntington. Cervello 119, 1633-1645. doi: 10.1093 / cervello / 119.5.1633
Li, SH e Li, XJ (2004). Interazioni huntingtina-proteina e patogenesi della malattia di Huntington. Tendenze Genet. 20, 146-154. doi: 10.1016 / j.tig.2004.01.008
Louis, ED, Lee, P., Quinn, L. e Marder, K. (1999). Distonia nella malattia di Huntington: prevalenza e caratteristiche cliniche. Mov. Disord. 14, 95–101. doi: 10.1002/1531-8257(199901)14:1<95::aid-mds1016>3.0.co;2-8
Lyketsos, CG, Rosenblatt, A. e Rabins, P. (2004). Sindrome del lobo frontale dimenticata o "Sindrome da disfunzione esecutiva". Psicosomatica 45, 247-255. doi: 10.1176 / appi.psy.45.3.247
MacDonald, ME, et al. E Huntington's Disease Collaborative Research Group (1993). Un nuovo gene contenente una ripetizione trinucleotidica espansa e instabile sui cromosomi della malattia di Huntington. Cella 72, 971–983. doi: 10.1016/0092-8674(93)90585-e
Manes, F., Sahakian, B., Clark, L., Rogers, R., Antoun, N., Aitken, M., et al. (2002). Processi decisionali in seguito a danni alla corteccia prefrontale. Cervello 125, 624-639. doi: 10.1093 / cervello / awf049
McAlonan, K. e Brown, VJ (2003). La corteccia prefrontale orbitale media l'apprendimento inverso e non il cambiamento dell'attivo nel ratto. Behav. Cervello. 146, 97-103. doi: 10.1016 / j.bbr.2003.09.019
Miller, LA (1992). Impulsività, assunzione di rischi e capacità di sintetizzare informazioni frammentate dopo lobectomia frontale. Neuropsychologia 30, 69–79. doi: 10.1016/0028-3932(92)90015-e
Newman, JP (1987). Reazione alla punizione in estranei e psicopatici: implicazioni per il comportamento impulsivo degli individui disinibiti. J. Res. Pers. 21, 464–480. doi: 10.1016/0092-6566(87)90033-x
O'Doherty, J., Kringelbach, ML, Rolls, ET, Hornak, J. e Andrews, C. (2001). Rappresentazioni astratte di ricompensa e punizione nella corteccia orbitofrontale umana. Nat. Neurosci. 4, 95-102. doi: 10.1038 / 82959
Papp, KV, Kaplan, RF e Snyder, PJ (2011). Marcatori biologici di cognizione nella malattia di Huntington prodromica: una revisione. Cervello Cogn. 77, 280-291. doi: 10.1016 / j.bandc.2011.07.009
Paradiso, S., Turner, BM, Paulsen, JS, Jorge, R., Ponto, LLB e Robinson, RG (2008). Basi neurali di disforia nella precoce malattia di Huntington. Resistenza psichiatrica 162, 73-87. doi: 10.1016 / j.pscychresns.2007.04.001
Paton, JJ e Louie, K. (2012). Ricompensa e punizione illuminate. Nat. Neurosci. 15, 807-809. doi: 10.1038 / nn.3122
Paulsen, JS, Langbehn, DR, Stout, JC, Aylward, E., Ross, CA, Nance, M., et al. (2008). Rilevazione della malattia di Huntington decenni prima della diagnosi: lo studio predittivo-HD. J. Neurol. Neurosurg. Psichiatria 79, 874-880. doi: 10.1136 / jnnp.2007.128728
Peltsch, A., Hoffman, A., Armstrong, I., Pari, G. e Muñoz, DP (2008). Menomazioni saccadiche nella malattia di Huntington. Exp. Cervello. 186, 457–469. doi: 10.1007/s00221-007-1248-x
Potenza, MN (2013). Neurobiologia dei comportamenti di gioco d'azzardo. Curr. Opin. Neurobiol. 23, 660-667. doi: 10.1016 / j.conb.2013.03.004
Ramig, LA (1986). Analisi acustiche della fonazione in pazienti con malattia di Huntington. Rapporto preliminare. Ann. Otol. Rhinol. Laryngol. 95, 288-293.
Raylu, N. e Oei, TPS (2002). Gioco d'azzardo patologico. Una recensione completa. Clin. Psychol. Rev. 22, 1009–1061. doi: 10.1016/S0272-7358(02)00101-0
Reiner, A., Dragatsis, I. e Dietrich, P. (2011). "Genetica e neuropatologia della malattia di Huntington", in Rassegna internazionale di neurobiologia, a cura di J. Brotchie, E. Bezard e P. Jenner, Pathophysiology, Farmacology and Biochemistry of Dyskinesia (London: Academic Press), 325-372.
Rogers, RD, Everitt, BJ, Baldacchino, A., Blackshaw, AJ, Swainson, R., Wynne, K., et al. (1999). Deficit dissociabili nella cognizione decisionale dei tossicodipendenti cronici di anfetamine, dei consumatori di oppiacei, dei pazienti con danno focale alla corteccia prefrontale e dei volontari normali impoveriti di triptofano: evidenza di meccanismi monoaminergici. Neuropsicofarmacologia 20, 322–339. doi: 10.1016/s0893-133x(98)00091-8
Roos, RA (2010). Malattia di Huntington: una revisione clinica. Orphanet J. Rare Dis. 5:40. doi: 10.1186/1750-1172-5-40
Rosas, HD, Hevelone, ND, Zaleta, AK, Greve, DN, Salat, DH e Fischl, B. (2005). Assottigliamento corticale regionale nella malattia preclinica di Huntington e sua relazione con la cognizione. Neurologia 65, 745-747. doi: 10.1212 / 01.wnl.0000174432.87383.87
Rosenblatt, A. (2007). Neuropsichiatria della malattia di Huntington. Dialoghi Clin. Neurosci. 9, 191-197.
Rothlind, JC, Bylsma, FW, Peyser, C., Folstein, SE e Brandt, J. (1993). Correlati cognitivi e motori del funzionamento quotidiano nella precoce malattia di Huntington. J. Nerv. Ment. Dis. 181, 194–199. doi: 10.1097/00005053-199303000-00008
Rushworth, MFS, Behrens, TEJ, Rudebeck, PH e Walton, ME (2007). Ruoli contrastanti per il cingolo e la corteccia orbitofrontale nelle decisioni e nel comportamento sociale. Tendenze Cogn. Sci. 11, 168-176. doi: 10.1016 / j.tics.2007.01.004
Sánchez-Castañeda, C., Cherubini, A., Elifani, F., Péran, P., Orobello, S., Capelli, G., et al. (2013). Ricerca di biomarcatori della malattia di Huntington mediante imaging multimodale dei gangli basali trasversali. Ronzio. Mappatura del cervello. 34, 1625-1635. doi: 10.1002 / hbm.22019
Sesack, SR e Grace, AA (2010). Rete di ricompensa dei gangli cortico-basali: microcircuito. Neuropsicofarmacologia 35, 27-47. doi: 10.1038 / npp.2009.93
Shannon, KM (2011). "Capitolo 1 - Malattia di Huntington - segni clinici, sintomi, diagnosi e diagnosi presintomatiche", in Manuale di Neurologia clinica, edes WJ Weiner ed E. Tolosa, Hyperkinetic Movement Disorders (London: Elsevier), 3-13.
Sharpe, L. (2002). Un modello cognitivo-comportamentale riformulato del gioco d'azzardo problematico. Una prospettiva biopsicosociale. Clin. Psychol. Rev. 22, 1–25. doi: 10.1016/s0272-7358(00)00087-8
Shiwach, R. (1994). Psicopatologia nei pazienti con malattia di Huntington. Acta Psychiatr. Scand. 90, 241–246. doi: 10.1111/j.1600-0447.1994.tb01587.x
Smith, MA, Brandt, J. e Shadmehr, R. (2000). Il disturbo motorio nella malattia di Huntington inizia come disfunzione nel controllo della retroazione degli errori. Natura 403, 544-549. doi: 10.1038 / 35000576
Snell, RG, MacMillan, JC, Cheadle, JP, Fenton, I., Lazarou, LP, Davies, P., et al. (1993). Relazione tra espansione ripetuta del trinucleotide e variazione fenotipica nella malattia di Huntington. Nat. Genet. 4, 393-397. doi: 10.1038 / ng0893-393
Stine, OC, Piacevole, N., Franz, ML, Abbott, MH, Folstein, SE e Ross, CA (1993). Correlazione tra l'età di insorgenza della malattia di Huntington e la durata della ripetizione del trinucleotide in IT-15. Ronzio. Mol. Genet. 2, 1547-1549. doi: 10.1093 / hmg / 2.10.1547
Stout, JC, Paulsen, JS, Queller, S., Solomon, AC, Whitlock, KB, Campbell, JC, et al. (2011). Segni neurocognitivi nella malattia di Huntington prodromica. Neuropsicologia 25, 1-14. doi: 10.1037 / a0020937
Stout, JC, Rodawalt, WC e Siemers, ER (2001). Prendere decisioni rischiose nella malattia di Huntington. J. Int. Neuropsychol. Soc. 7, 92-101. doi: 10.1017 / S1355617701711095
Tabrizi, SJ, Langbehn, DR, Leavitt, BR, Roos, RA, Durr, A., Craufurd, D., et al. (2009). Manifestazioni biologiche e cliniche della malattia di Huntington nello studio longitudinale TRACK-HD: analisi cross-sectional dei dati di base. Lancet Neurol. 8, 791–801. doi: 10.1016/S1474-4422(09)70170-X
Tekin, S. e Cummings, JL (2002). Circuiti neuronali sottocorticali frontali e neuropsichiatria clinica: un aggiornamento. J. Psychosom. Res. 53, 647–654. doi: 10.1016/s0022-3999(02)00428-2
Thieben, MJ, Duggins, AJ, Good, CD, Gomes, L., Mahant, N., Richards, F., et al. (2002). La distribuzione della neuropatologia strutturale nella malattia di Huntington pre-clinica. Cervello 125, 1815-1828. doi: 10.1093 / cervello / awf179
Tian, J., Herdman, SJ, Zee, DS e Folstein, SE (1992). Stabilità posturale nei pazienti con malattia di Huntington. Neurologia 42, 1232-1238. doi: 10.1212 / wnl.42.6.1232
Unschuld, PG, Joel, SE, Pekar, JJ, Reading, SA, Oishi, K., McEntee, J., et al. (2012). I sintomi depressivi nella malattia di Huntington prodromica sono correlati alla connettività funzionale correlata allo stroop nella corteccia prefrontale ventromediale. Resistenza psichiatrica 203, 166-174. doi: 10.1016 / j.pscychresns.2012.01.002
van den Bogaard, SJ, Dumas, EM, Acharya, TP, Johnson, H., Langbehn, DR, Scahill, RI, et al. (2011). Atrofia precoce del nucleo di pallidum e accumbens nella malattia di Huntington. J. Neurol. 258, 412–420. doi: 10.1007/s00415-010-5768-0
van den Bos, R., Davies, W., Dellu-Hagedorn, F., Goudriaan, AE, Granon, S., Homberg, J., et al. (2013a). Approcci cross-specie al gioco d'azzardo patologico: una revisione che si occupa delle differenze tra i sessi, della vulnerabilità adolescenziale e della validità ecologica degli strumenti di ricerca. Neurosci. Biobehav. Rev. 37, 2454-2471. doi: 10.1016 / j.neubiorev.2013.07.005
van den Bos, R., Homberg, J. e de Visser, L. (2013b). Una revisione critica delle differenze sessuali nei compiti decisionali: concentrarsi sul compito del gioco d'azzardo. Behav. Cervello. 238, 95-108. doi: 10.1016 / j.bbr.2012.10.002
van den Bos, R., Koot, S. e de Visser, L. (2014). Una versione da roditore del compito del gioco d'azzardo iowa: 7 anni di progressi. Davanti. Psychol. 5: 203.doi: 10.3389 / fpsyg.2014.00203
van Duijn, E., Kingma, EM e van der Mast, RC (2007). Psicopatologia nei portatori del gene della malattia di Huntington verificati. J. Clinica Neuropsichiatrica. Neurosci. 19, 441-448. doi: 10.1176 / appi.neuropsych.19.4.441
van Duijn, E., Reedeker, N., Giltay, EJ, Eindhoven, D., Roos, RAC e van der Mast, RC (2014). Corso di irritabilità, depressione e apatia nella malattia di Huntington in relazione ai sintomi motori durante un periodo di follow-up di due anni. NEURODEGENER. Dis. 13, 9-16. doi: 10.1159 / 000343210
van Holst, RJ, van den Brink, W., Veltman, DJ e Goudriaan, AE (2010). Perché i giocatori d'azzardo non riescono a vincere: una revisione dei risultati cognitivi e neuroimaging nel gioco d'azzardo patologico. Neurosci. Biobehav. Rev. 34, 87-107. doi: 10.1016 / j.neubiorev.2009.07.007
van Holst, RJ, Veltman, DJ, Büchel, C., Van den Brink, W. e Goudriaan, AE (2012). Aspettativa distorta nel gioco d'azzardo problematico: è la dipendenza nell'anticipazione? Biol. Psichiatria 71, 741-748. doi: 10.1016 / j.biopsych.2011.12.030
Verny, C., Allain, P., Prudean, A., Malinge, MC, Gohier, B., Scherer, C., et al. (2007). Cambiamenti cognitivi nei portatori asintomatici del gene della mutazione della malattia di Huntington. Euro. J. Neurol. 14, 1344-1350. doi: 10.1111 / j.1468-1331.2007.01975.x
Volkow, ND, Fowler, JS e Wang, GJ (2002). Ruolo della dopamina nel rinforzo della droga e nella dipendenza nell'uomo: risultati degli studi di imaging. Behav. Pharmacol. 13, 355–366. doi: 10.1097/00008877-200209000-00008
Vonsattel, JP e DiFiglia, M. (1998). Malattia di Huntington. J. Neuropathol. Exp. Neurol. 57, 369–384. doi: 10.1097/00005072-199805000-00001
Vonsattel, JPG, Keller, C. e Cortes Ramirez, EP (2011). Capitolo 4 - Malattia di Huntington - neuropatologia "in Manuale di Neurologia clinica, edes W. Weiner ed E. Tolosa, Hyperkinetic Movement Disorders (London: Elsevier), 83-100.
Vonsattel, JPG (2008). Modelli di malattia di Huntington e neuropatologia umana: somiglianze e differenze. Acta Neuropathol. 115, 55–69. doi: 10.1007/s00401-007-0306-6
Watkins, LHA, Rogers, RD, Lawrence, AD, Sahakian, BJ, Rosser, AE e Robbins, TW (2000). Pianificazione compromessa ma decisioni intere nella malattia di Huntington in fase iniziale: implicazioni per la patologia fronto-striatale specifica. Neuropsychologia 38, 1112–1125. doi: 10.1016/s0028-3932(00)00028-2
Weintraub, D., Papay, K., Siderowf, A., e Parkinson's Progression Markers Initiative. (2013). Screening per i sintomi del controllo degli impulsi in pazienti con malattia di Parkinson de novo: uno studio caso-controllo. Neurologia 80, 176–180. doi: 10.1212/wnl.0b013e31827b915c
Witjas, T., Eusebio, A., Fluchère, F. e Azulay, JP (2012). Comportamenti di dipendenza e morbo di Parkinson. Rev. Neurol. (Parigi) 168, 624-633. doi: 10.1016 / j.neurol.2012.06.014
Wolf, RC, Vasic, N., Schönfeldt-Lecuona, C., Landwehrmeyer, GB e Ecker, D. (2007). Disfunzione della corteccia prefrontale dorsolaterale nella malattia di Huntington presintomatica: evidenza di fMRI correlata all'evento. Cervello 130, 2845-2857. doi: 10.1093 / cervello / awm210
Yin, HH e Knowlton, BJ (2006). Il ruolo dei gangli della base nella formazione dell'abitudine. Nat. Rev. Neurosci. 7, 464-476. doi: 10.1038 / nrn1919
Yin, HH, Ostlund, SB e Balleine, BW (2008). Apprendimento basato sulla gratificazione oltre la dopamina nel nucleo accumbens: le funzioni integrative delle reti di gangli cortico-basali. Euro. J. Neurosci. 28, 1437-1448. doi: 10.1111 / j.1460-9568.2008.06422.x
Young, AB, Shoulson, I., Penney, JB, Starosta-Rubinstein, S., Gomez, F., Travers, H., et al. (1986). La malattia di Huntington in Venezuela Caratteristiche neurologiche e declino funzionale. Neurologia 36, 244-249. doi: 10.1212 / WNL.36.2.244
Parole chiave: malattia di Huntington, assunzione di rischi, gioco d'azzardo, corteccia prefrontale, gangli della base, disinibizione
Citation: Kalkhoven C, Sennef C, Peeters A e van den Bos R (2014) comportamenti rischiosi e gioco d'azzardo patologico nella malattia di Huntington. Davanti. Behav. Neurosci. 8: 103. doi: 10.3389 / fnbeh.2014.00103
Ricevuto: 30 November 2013; In attesa di pubblicazione della carta: 18 gennaio 2014;
Accettato: 12 March 2014; Pubblicato online: 02 April 2014.
A cura di:
Patrick Anselme, Università di Liegi, Belgio
Recensito da:
Damien Brevers, Université Libre de Bruxelles, Belgio
Bryan F. Singer, Università del Michigan, USA