- 1Cognitive Psychopharmacology Laboratory, Neuroscience Department, Centre for Addiction and Mental Health, Toronto, ON, Kanada
- 2Translational Neuroscience Program, Department of Psychiatry, School of Medicine, University of Pennsylvania, Philadelphia, PA, USA
- 3Sekcja Biopsychologii, Wydział Neuronauki, Centrum ds. Uzależnień i Zdrowia Psychicznego, Toronto, ON, Kanada
Uzależnienie jest uważane za chorobę mózgu spowodowaną przewlekłą ekspozycją na leki. Uczulenie mózgowych układów dopaminowych (DA) częściowo pośredniczy w tym działaniu. Patologiczny hazard (PG) jest uważany za uzależnienie behawioralne. Dlatego PG może być spowodowane przewlekłym narażeniem na hazard. Identyfikacja uwrażliwienia hazardu systemów DA spowodowałaby tę możliwość. Nagrody hazardowe wywołują wydanie DA. Jeden epizod gry na automatach zmienia reakcję DA z dostarczania nagród na początek wskazówek (kołowrotki) o nagrodę, zgodnie z zasadami uczenia się różnic czasowych. Tak więc warunkowane bodźce (CS) odgrywają kluczową rolę w reakcjach DA na hazard. U naczelnych odpowiedź DA na CS jest najsilniejsza, gdy prawdopodobieństwo nagrody wynosi 50%. Zgodnie z tym harmonogramem CS wywołuje oczekiwanie na nagrodę, ale nie podaje informacji o tym, czy nastąpi w danym okresie próbnym. Podczas hazardu harmonogram 50% powinien wywoływać maksymalne uwolnienie DA. Jest to ściśle zgodne z częstotliwością nagród (46%) na komercyjnym automacie do gry. Uwalnianie DA może przyczyniać się do uczulenia, szczególnie w przypadku amfetaminy. Przewlekła ekspozycja na CS, która przewiduje 50 nagrodę w danym czasie, może naśladować ten efekt. Testowaliśmy tę hipotezę w trzech badaniach na szczurach. Zwierzęta otrzymały 15 x 45-min ekspozycji na CS, które przewidywały nagrodę z prawdopodobieństwem 0, 25, 50, 75 lub 100%. CS było światłem; nagrodą był 10% roztwór sacharozy. Po treningu szczury otrzymały uczulający schemat pięciu oddzielnych dawek (1 mg / kg) d-amfetaminy. Wreszcie otrzymali prowokację amfetaminą 0.5 lub 1 mg / kg przed testem aktywności ruchowej 90-min. We wszystkich trzech badaniach grupa 50% wykazywała większą aktywność niż inne grupy w odpowiedzi na obie dawki prowokacyjne. Rozmiary efektów były skromne, ale spójne, co odzwierciedla znaczący związek między grupą a rangą (ϕ = 0.986, p = 0.025). Przewlekłe narażenie na podobny do hazardu harmonogram bodźców predykcyjnych nagrody może promować uczulenie na amfetaminę, podobnie jak narażenie na samą amfetaminę.
Wprowadzenie
Uzależnienie scharakteryzowano jako chorobę mózgu spowodowaną przewlekłą ekspozycją na narkotyki (Leshner, 1997). Uważa się, że neuroplastyczność pośredniczy w skutkach takiego narażenia (Nestler, 2001). Uczulanie mózgowych układów dopaminowych (DA) jest formą neuroplastyczności związanej z nadreaktywnością na bodźce warunkowane (CS) leków oraz kompulsywne poszukiwanie narkotyków (Robinson i Berridge, 2001). Działanie uczulające zostało zdefiniowane operacyjnie poprzez zwiększone uwalnianie DA w odpowiedzi na CS w celu uzyskania nagrody i przez zwiększoną odpowiedź ruchową na farmakologiczne prowokacje DA (Robinson i Berridge, 1993; Pierce i Kalivas, 1997; Vanderschuren i Kalivas, 2000). Chociaż uczulenie jest tylko jedną z wielu zmian w mózgu związanych z uzależnieniem (por. Robbins i Everitt, 1999; Koob i Le Moal, 2008), sugeruje się, że zmiany w presynaptycznym uwalnianiu dopaminy reprezentują typowe neuroadaptacje zaangażowane w poszukiwanie uzależnienia od narkotyków (np. nawrót), w tym leki wywołujące uczulenie ruchowe na opiaty (np. morfinę) lub stymulację stymulującą (np. amfetaminę) , powodują również przywrócenie wygaszonych odpowiedzi operantów na samodzielne podawanie heroiny lub kokainy - zwierzęcy model nawrotu (Vanderschuren i in., 1999). Dowody na to, że uczulenie motywacyjne (zwiększona wartość nagrody za lek) jest najbardziej widoczne po początkowej ekspozycji na leki uzależniające, dalej sugeruje, że uczulenie może być również zaangażowane we wczesnych stadiach uzależnienia (Vanderschuren i Pierce, 2010).
Patologiczny hazard (PG) został opisany jako uzależnienie behawioralne i niedawno przeklasyfikowany do tej samej kategorii co zaburzenia uzależnienia od substancji w 5th edycji Diagnostycznego i statystycznego podręcznika zaburzeń psychicznych (Frascella i in., 2010; APA, 2013). Oznacza to, że PG może być spowodowane przewlekłym narażeniem na działanie podobne do hazardu, a wspólne mechanizmy mogą pośredniczyć w skutkach hazardu i narażenia na narkotyki (Zack i Poulos, 2009; Leeman i Potenza, 2012); i że uczulanie mózgowych szlaków DA może być jednym z ważnych elementów tego procesu.
Dowody kliniczne pośrednio potwierdzają tę możliwość: za pomocą pozytronowej tomografii emisyjnej (PET) Boileau i współpracownicy stwierdzili, że mężczyźni z PG wykazują znacznie większe uwalnianie prążkowia DA w odpowiedzi na amfetaminę (0.4 mg / kg) niż zdrowi mężczyźni z grupy kontrolnej (Boileau i in., 2013). Ogólne różnice między grupami były znaczące w prążkowiu asocjacyjnym i somatosensorycznym. W prążkowiu limbicznym, które obejmuje jądro półleżące, grupy nie różniły się. Jednak u pacjentów z PG uwalnianie DA w prążkowiu limbicznym korelowało bezpośrednio z nasileniem objawów PG. Odkrycia te są zgodne z uczuleniem szlaków DA mózgu w PG, ale sugerują także pewne ważne różnice z osobnikami zależnymi od substancji ludzkich oraz z klasycznym zwierzęcym modelem uczulenia na amfetaminę. W przeciwieństwie do osobników PG i zwierząt narażonych na niskie dawki amfetaminy (por. Robinson i wsp., 1982), ludzie uzależnieni od substancji konsekwentnie wykazują zmniejszone uwalnianie DA w celu stymulowania (Volkow i wsp., 1997; Martinez i wsp., 2007), a dowody od zwierząt sugerują, że może to odzwierciedlać deficyty funkcji DA podczas początkowych stadiów abstynencji w wyniku ciągłych schematów nadużywania substancji (Mateo i in., 2005). W badaniach, w których wykazano uczulenie stymulujące u zwierząt, zwiększone uwalnianie DA zwykle obserwuje się w prążkowiu kończynowym zamiast w prążkowiu grzbietowym (asocjacyjnym, somatosensorycznym) (Vezina, 2004). Jednak poszukiwania narkotyków wywołane przez wskazówkę (tj. Uwarunkowane) u zwierząt wielokrotnie narażonych na kokainę powiązano ze zwiększonym uwalnianiem DA w prążkowiu grzbietowym, co wydaje się wskazywać na bardziej nawykową formę zachowań motywowanych (Ito i wsp., 2002). Zatem ogólne zwiększenie uwalniania DA w obszarach grzbietowych u pacjentów z PG może być związane z opartym na nawykach (nieelastycznym, rutynowym) poszukiwaniem nagrody obejmującym „przejście z brzusznej do bardziej grzbietowej domeny prążkowia” (Everitt i Robbins, 2005, str. 1481), podczas gdy zależne od nasilenia uwalnianie DA w prążkowiu limbicznym u tych pacjentów może bardziej odpowiadać uczuleniu motywacyjnemu, jak typowo modelowane u zwierząt. Wyniki badania PET nie mogą ujawnić, czy nadreaktywność DA była wcześniej istniejącą cechą tych podmiotów PG, konsekwencją narażenia na hazard lub wynikiem całkowicie innego procesu. Aby odpowiedzieć na to pytanie, konieczne jest wykazanie indukcji uczulenia przez przewlekłą ekspozycję hazardu u osób, które są normalne przed ekspozycją. Rodzi to pytania, jakie cechy hazardu najprawdopodobniej wywołają uczulenie.
Skinner zauważył, że zmienny harmonogram wzmocnień miał fundamentalne znaczenie dla uroku hazardu (lub przynajmniej jego trwałości) (Skinner, 1953). Obstawianie w grze na automatach jest zgodne z podstawowymi zasadami warunkowania instrumentalnego, co znajduje odzwierciedlenie w potencjalnej korelacji między wypłatą pieniężną a wielkością zakładu w kolejnych spinach (Tremblay i in., 2011). Zatem odpowiedź operanta o zmiennym stosunku wydaje się zapewniać zewnętrznie ważny model hazardu na automatach.
Ostatnie badania na zwierzętach zapewniają silne wstępne poparcie dla przyczynowego wpływu narażenia hazardowego na uczulenie. Piosenkarz i koledzy badali wpływ codziennych sesji 55 1-h utrwalonego (FR20) lub zmiennego (VR20) wzmocnienia sacharyny w paradygmacie operant-dźwignia na późniejszą reakcję lokomotoryczną na małą dawkę (0.5 mg / kg) amfetaminy u zdrowego mężczyzny ( Sprague Dawley) szczury (Singer i in., 2012). Postawili hipotezę, że jeśli hazard prowadzi do uwrażliwienia, szczury narażone na zmienny harmonogram, który naśladuje hazard, powinny wykazywać większą reakcję na amfetaminę niż szczury narażone na ustalony harmonogram. Jak przewidywano, grupa VR20 wykazywała 50% większą odpowiedź lokomotoryczną na amfetaminę niż grupa FR20. Natomiast grupy wykazywały równoważną lokomocję po wstrzyknięciu soli fizjologicznej. Wyniki te potwierdzają, że przewlekła ekspozycja na zmienne wzmocnienie jest wystarczająca do wywołania hiperreaktywności na prowokację DA u zdrowych zwierząt randomizowanych do odpowiednich schematów.
Z tego wyniku wynika szereg pytań: Po pierwsze, w jakim stopniu postrzegana przypadkowość - lub jej brak - między odpowiedzią operanta a jej wynikiem pośredniczy w tych skutkach? Jeśli chodzi o uczenie się, czy ten efekt wiąże się z „oczekiwaniem odpowiedzi na wynik”, czy może podobny efekt można zaobserwować przy braku reakcji operanta, tj. „Oczekiwanej odpowiedzi na bodziec” w paradygmacie pawłowskim (por. Bolles, 1972)? Po drugie, czy stopień przygodności między zdarzeniem poprzedzającym (odpowiedź lub bodziec) a jego wynikiem wpływa na stopień uczulenia?
Drugie pytanie dotyczy roli niepewności w uczuleniu. Na przykład, czy gry, których wynik jest naprawdę losowy - całkowicie nieprzewidywalny - mają większy potencjał do wywoływania uczuć niż gry, w których szanse na wygraną są jasno określone, ale nie losowe, nawet jeśli bezwzględna stopa nagrody jest niska? Niniejsze badanie dotyczyło tych pytań.
Projekt eksperymentalny został poinformowany przez przełomowe badanie dotyczące oczekiwanej nagrody i odpowiedzi neuronu DA u małp (Fiorillo i in., 2003). Zwierzęta w tym badaniu otrzymały nagrodę w postaci soku (USA) w programach zmiennych proporcji 0, 25, 50, 75 lub 100%. Harmonogramy zostały oznaczone przez 1 z 4 różnymi CS (ikony). Harmonogram 0% dostarczał nagrodę tak często, jak harmonogram 100%, ale pominął CS. Szybkość wypalania neuronów DA w okresie między początkiem CS a dostarczeniem lub pominięciem w USA była kluczową miarą zależną. Badanie wykazało, że odpowiedź DA wzrosła w funkcji niepewności dostarczania nagrody. Zatem, zgodnie z harmonogramem 100%, niewielka aktywność wywołana CS, w harmonogramach 25 i 75%, CS wywoływała umiarkowany i podobny poziom aktywności, a pod harmonogramem 50% CS wywołała maksymalną aktywność. W każdym przypadku tempo strzelania rosło w trakcie okresu CS-US, tj. W miarę jak oczekiwanie zbliżało się do realizacji.
Odkrycia te wskazują, że aktywność DA nie tylko zmienia się w zależności od tego, czy nagroda jest pewna (Stały stosunek) czy niepewna (Zmienny stosunek), ale także zmienia się odwrotnie proporcjonalnie do ilości informacji o dostawie nagrody przekazanej przez CS. W warunku 100% CS wywołuje oczekiwanie na nagrodę, a także doskonale przewiduje jego dostarczenie. W warunkach 25 i 75% CS wywołuje oczekiwanie i przewiduje dostawę nagrody trzy razy na cztery. W warunku 50% CS wywołuje oczekiwanie, ale nie dostarcza żadnych informacji o dostarczeniu nagrody poza przypadkiem. Na podstawie ich ustaleń Fiorillo i in. podsumował: „Ten wywołany niepewnością wzrost dopaminy może przyczynić się do nagradzających właściwości hazardu” (str. 1901).
Skutki 50% zmiennej nagrody w jednej sesji nie powinny zmieniać się w trakcie wielu sesji, ponieważ prawdopodobieństwo nagrody pozostaje całkowicie nieprzewidywalne w każdej próbie. Tak więc, biorąc pod uwagę warunki, które maksymalizują chroniczną aktywację neuronów DA podczas powtarzających się epizodów hazardu, schemat 50% powinien wywołać najtrwalszy i najsilniejszy efekt. Jest to godne uwagi, biorąc pod uwagę, że długoterminowa stopa nagrody (wypłata> 0) zaobserwowana podczas tysięcy obrotów na komercyjnym automacie wynosiła 45.8% (Tremblay i in., 2011). Tak więc zmienna nagroda 50% wydaje się dokładnie odzwierciedlać harmonogram wypłat zarządzany przez rzeczywiste urządzenia hazardowe.
W niniejszym badaniu wykorzystano te same schematy kondycjonowania, co Fiorillo i wsp. w przypadku narażenia przewlekłego, projekt międzygrupowy ze szczurami. Zwierzęta przeszły ~ 3 tygodnie codziennych sesji kondycjonujących, w których CS (światło) połączono z US (mała ilość sacharozy). Po fazie szkolenia zwierzęta odpoczywały przed oceną uczulenia indeksowanego reakcją lokomotoryczną na amfetaminę. Na podstawie literatury przewidywano, że szczury narażone na różne schematy nagradzania nie różniłyby się zachowaniem lokomotorycznym wolnym od leków, ale wykazywałyby znacząco różne poziomy lokomocji po amfetaminie, przy czym 50% grupa wykazywałaby większą odpowiedź lokomotoryczną na lek w porównaniu do inne grupy w trakcie dawek, wzorca, którego można by się spodziewać, gdyby 50% zwierząt zostało wcześniej poddanych działaniu dodatkowych dawek samej amfetaminy (tj. uczulenia krzyżowego).
Experiment 1
Materiały i Metody
Tematy
Cztery grupy (n = 8 / grupa) dorosłych (300 – 350 g) samców szczurów Sprague-Dawley (Charles River, St. Constant, Quebec, Kanada) umieszczono pojedynczo w przezroczystych poliwęglanowych pudełkach (20 × 43 × 22 cm) pod odwrotnym 12: Cykl światła-ciemności 12. Otrzymali ad libitum dostęp do żywności i wody oraz codzienne obchodzenie się z eksperymentatorem przez 2 tygodni przed badaniem. Każda grupa była uwarunkowana jednym z czterech harmonogramów zmiennych wynagrodzeń: 0, 25, 50 lub 100%. Grupa 75% została pominięta w tym wstępnym badaniu, ponieważ Fiorillo i in. (2003) znaleziono równoważne wydanie DA po CS w ramach 25 i 75% nagród, tak że oba warunki doprowadziły do większego uwolnienia DA niż warunek 100% CS-US, ale mniej niż warunek 50%.
Aparatura
Dostęp do prezentacji sacharozy i do CS dostarczono indywidualnie w pudełkach kondycjonujących operant (33 × 31 × 29 cm). Każde pudełko było wyposażone w magazynek wzmacniający, umieszczony na ścianie przedniej. Światło w górnej części magazynu służyło jako CS. Zmotoryzowany, sterowany solenoidem płynny wóz może zostać podniesiony na podłogę magazynu. Wydarzenia w pudełku były kontrolowane przez sprzęt i oprogramowanie Med Associates, przy użyciu wewnętrznego programu napisanego w MED-PC. Testy lokomotoryczne przeprowadzono indywidualnie w klatkach z pleksiglasu (27 × 48 × 20 cm). Każda klatka była wyposażona w system monitorowania składający się z sześciu komórek foto-wiązki do wykrywania ruchu poziomego.
Procedura
Trening. Badanie przeprowadzono zgodnie z wytycznymi etycznymi określonymi przez Canadian Council on Animal Care. Szczury były ograniczone do pożywienia do 90% masy ciała na czas trwania badania i trzymane osobno. Każdy szczur otrzymał 15 dni nagradzania sacharozą (10% roztwór wodny w 0.06 ml na nagrodę): 5 kolejne dni x 3 tygodnie, z weekendami wyłączonymi. Zwierzęta były utrzymywane na standardowej karmie przed i po fazie treningowej; ekspozycja na sacharozę była ograniczona do piętnastu ~ 40-min sesji treningowych. Każda codzienna sesja składała się z prezentacji bodźców 15 (światło; CS), każda oddzielona interwałem próbnym 120. Światło znajdowało się w górnym panelu magazynu i pozostało włączone dla 25 s, z sacharozą udostępnioną podczas ostatnich 5. W przypadku grupy 0 sacharozę podnoszono co 140 s (dla 5 s), ale światło bodźca nie było oświetlone. Zrównało to interwał między prezentacjami wozu w grupie 0 a innymi grupami (120 + 25 s). Każda sesja leczenia trwała ~ 40 min. Średnio grupa 25 otrzymywała sacharozę raz na każde cztery prezentacje CS; grupa 50 otrzymała sacharozę raz na dwie prezentacje CS, a grupa 100 otrzymała sacharozę po każdej prezentacji CS.
Testowanie. Dwa tygodnie po ostatniej sesji dostępu do sacharozy (lub „kondycjonowania”) oceniono odpowiedź lokomotoryczną na d-amfetaminę (AMPH; ip). Szczury otrzymały trzy sesje 2-h, aby przyzwyczaić się do pudełek lokomotorycznych, a następnie sześć sesji testowych AMPH. Dni testu AMPH wystąpiły w odstępach 1-wk. W dniach testowych szczurom podawano 30 min, aby przyzwyczaić się do pudełek, a następnie otrzymywano pojedynczą dawkę XPHUMX mg / kg AMPH, a następnie, w oddzielnych cotygodniowych sesjach, pięć dawek 0.5 mg / kg (jedna dawka dziennie) w dniach testowych 1.0 przez 1 . Postomocję post-AMPH oceniano dla 5 min na każdej sesji.
Podejście analityczne do danych
Analizy statystyczne przeprowadzono za pomocą SPSS (v. 16 i v. 21; SPSS Inc., Chicago IL). Natychmiastową reakcję behawioralną na CS oceniano pod względem wgłębień w nos w otwór, w którym dozowano sacharozę. Średnia liczba szturchnięć nosa podczas tego okresu (5 na próbę) została następnie porównana ze średnią liczbą szturchnięć nosa przez ten sam czas (5 s) uśrednioną w czasie, gdy CS był nieobecny. Grupowanie × ANOVA sesji wyszukiwań nosa z obecnym CS i nieobecne śledziły nabywanie dyskryminacyjnych odpowiedzi na sygnał i masowe odpowiedzi nosa w różnych harmonogramach w trakcie sesji treningowych sacharozy 15.
Wpływ leczenia na odpowiedzi lokomotoryczne oceniano za pomocą ANOVA Group × Session dla fazy przyzwyczajenia bez leku (trzy sesje), prowokacji przed uczuleniem 0.5 mg / kg AMPH (jedna sesja) i podczas pięciosekundowego 1 mg / kg AMPH schemat działania uczulającego, gdy oczekiwano, że grupy będą się różnić w odpowiedzi na powtarzane dawki AMPH. Grupa × Sesja ANOVA oceniała również reakcje ruchowe wolne od leku podczas fazy przyzwyczajania 30-min przed iniekcją z każdej sesji testu AMPH. Planowane porównania oceniały różnicę średnich wyników dla grupy 50 vs. grupa 0 (brak kontroli oczekiwanej) i grupy 100 (brak kontroli niepewności), za pomocą t-Testy (Howell, 1992), przy użyciu warunków błędu MS i błędu df dla odpowiedniego efektu (tj. interakcji grupy lub grupy × sesji) z analizy ANOVA (Winer, 1971). Analizy trendów wielomianowych testowały profil zmian w trakcie sesji.
Aby określić, czy reakcje podejścia w obecności i nieobecności CS podczas sesji treningowych sacharozy 15 przyczyniły się do zmienności odpowiedzi lokomotorycznej na AMPH lub różnic w grupie w odpowiedzi AMPH, przeprowadzono dalsze analizy kowariancji (ANCOVA) na AMPH dane lokomotoryczne, w tym całkowite szturchnięcia nosa (suma dla sesji 15), gdy CS był nieobecny jako współzmienna. Znaczący wpływ współzmiennej wskazywałby, że reakcje bez użycia leków były moderowane (wpływały na siłę) efektów grupy lub sesji. Zmniejszenie znaczenia efektów grupy lub sesji w obecności znaczącej współzmiennej wskazywałoby na reakcje podejścia mediowane (rozliczane) skutkami grupy lub sesji. Spadek znaczenia efektów grupowych lub sesyjnych przy braku istotnego efektu współzmiennego po prostu odzwierciedlałby utratę mocy statystycznej z powodu realokacji df z okresu błędu do współzmiennej i nie miałby wpływu na interpretację efekty grupy lub sesji.
Efekt
Nos szturcha podczas sesji kondycjonowania sacharozy
CS obecny. Postać 1A pokazuje średnie szturchnięcia nosa dla grup 25, 50 i 100, podczas gdy CS był obecny na sesjach kondycjonowania sacharozy 15 (nosa nie były kodowane dla grupy 0, która nie otrzymała CS). Grupa 3 × sesja 15 ANOVA dała znaczące główne efekty Grupy, F(2, 21) = 5.63, p = 0.011 i sesja, F(14, 294) = 14.00, p <0.001, wraz ze znaczącą interakcją Grupa × Sesja, F(28, 294) = 2.93, p <0.001. Postać 1A wskazuje, że główny efekt Session odzwierciedla wzrost nosa w sesjach we wszystkich trzech grupach, a główny efekt grupy odzwierciedla ogólnie wyższe wyniki ogólne w grupie 100 vs. grupa 25 z wynikami pośrednimi w grupie 50. Znacząca interakcja Grupa × Sesja dla trendu sześciennego, F(2, 21) = 4.42, p = 0.030, wskazał na szybki wzrost, spadek i wyrównywanie w pokesach w nosie podczas sesji w grupie 100, w porównaniu z liniowym wzrostem w sesjach w grupie 50 i płytszym wzrostem liniowym w porównaniu z sesjami w grupie 25.
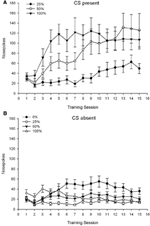
Rycina 1. Średnie (SE) odpowiedzi podejścia (szturchanie nosa) podczas sesji treningowych sacharozy 15 w grupach szczurów Sprague Dawley (n = 8 / group) narażony na nagrodę sacharozy (roztwór 10%) dostarczany w ramach zmiennych harmonogramów 0, 25, 50 lub 100%. Uwarunkowanym bodźcem było światło (120). Grupa 0 otrzymała taką samą liczbę nagród jak grupa 100 pod nieobecność uwarunkowanych bodźców. () Wyniki, gdy CS był obecny (próby 5 x 15). (B) Wyniki, gdy CS był nieobecny (średnia dla 5 × 15 s, gdy światło było wyłączone).
CS nieobecny. Postać 1B pokazuje średnie szturchnięcia nosa dla wszystkich czterech grup przez równoważny czas trwania (testy 5 × 15) uśrednione w czasie, gdy CS był nieobecny. Grupa 4 × sesja 15 ANOVA dała znaczące główne efekty Grupy, F(3, 28) = 7.06, p = 0.001 i sesja F(14, 392) = 2.84, p <0.001, wraz ze znaczącą interakcją Grupa × Sesja, F(42, 392) = 3.93, p <0.001. Istotna interakcja Grupa × Sesja dla trendu kwadratowego, F(3, 28) = 3.91, p = 0.019, wraz z brakiem interakcji dla trendu sześciennego, F(3, 28) <0.93, p > 0.44, odzwierciedla profil „odwróconej litery U”, polegający na szturchaniu nosem podczas sesji w grupie 0, w porównaniu z ogólnie stabilnym profilem podczas sesji w innych grupach.
Habituacja do komór lokomotorycznych
Grupa 4 × sesja 3 ANOVA dała główny efekt sesji, F(2, 56) = 5.67, p = 0.006 i żadnych innych znaczących efektów, F(3, 28) <1.60, p > 0.21. Średnie (SE) zerwania wiązki na 2 godziny w klatkach lokomotorycznych wynosiły 1681 (123) na sesji 1, 1525 (140) na sesji 2 i 1269 (96) na sesji 3. Planowane porównania nie wykazały znaczących różnic między grupą 50 a grupą. 0 lub grupa 100 na pierwszej lub ostatniej sesji habituacji, t(84) <1.69, p > 0.05. Tak więc, przy braku AMPH, powtarzana ekspozycja na skrzynki testowe wiązała się ze stałym spadkiem spontanicznej aktywności lokomotorycznej w czterech grupach (tj. Efekt sesji) i brakiem zróżnicowanej odpowiedzi w funkcji harmonogramu treningu sacharozy (brak interakcji) .
Sesje testowe
Wpływ pre-uczulenia 0.5 mg / kg prowokacja AMPH.
Lokomocja przed wstrzyknięciem. Jednokierunkowa ANOVA grupy 4 odpowiedzi lokomotorycznej podczas fazy habituacji 30-min przed iniekcją nie przyniosła znaczących efektów, F(3, 28) <1.05, p > 0.38. Planowane porównania nie wykazały znaczącej różnicy między grupą 50 a grupą 0 lub grupą 100, t(32) <0.87, p > 0.40. Dlatego wyjściowe różnice w lokomocji przed wstrzyknięciem nie wyjaśniały różnic między grupami w odpowiedzi lokomotorycznej na AMPH. Średnie (SE) pęknięcia wiązki dla próbki wyniosły 559 (77).
Lokomocja po wstrzyknięciu a końcowa sesja przyzwyczajenia bez leku. ANOVA dla 4 grup × 2 sesji porównała odpowiedzi lokomotoryczne grup podczas ostatniej sesji habituacji i bezpośrednio po wstępnym uczuleniu 0.5 mg / kg AMPH. Wyniki sesji habituacji (120 min) zostały przeskalowane tak, aby odpowiadały czasowi trwania sesji testowej AMPH (90 min) (surowy wynik habituacji × 90/120). Analiza przyniosła istotny efekt główny Session, F(1, 28) = 34.16, p <0.001 i bez innych znaczących efektów, F(3, 28) <2.26, p > 0.10. Efekt Session odzwierciedlał wzrost średnich (SE) zerwania wiązki w odpowiedzi na dawkę z 952 (72) do 1859 (151). Planowane porównania nie wykazały istotnych różnic między grupą 50 a grupą 0 lub grupą 100 w odpowiedzi na dawkę, t(56) <1.72, p > 0.10. Jednak kolejność rang wyników złamania belki (M; SE) była zgodna z hipotezą: grupa 50 (2205; 264)> grupa 0 (2025; 203)> grupa 100 (1909; 407)> grupa 25 (1296; 299) .
Wpływ 1 mg / kg AMPH.
Lokomocja przed wstrzyknięciem. ANOVA grupy 4 × sesja 5 odpowiedzi lokomotorycznej podczas fazy przyzwyczajania 30-min przed wstrzyknięciem na sesje testowe 1 mg / kg AMPH dały główny efekt sesji, F(4, 112) = 43.64, p <0.0001 i bez innych znaczących efektów, F(3, 28) <0.97, p > 0.42. Planowane porównania nie wykazały znaczącej różnicy między grupą 50 a grupą 0 lub grupą 100 na pierwszej lub ostatniej sesji testowej, t(140) <0.84, p > 0.30. Dlatego wyjściowe różnice w lokomocji nie uwzględniały różnic między grupami w odpowiedzi lokomotorycznej na AMPH. Średnie (SE) wyniki zerwania wiązki dla fazy przyzwyczajenia przed podaniem dawki na sesjach 1–5 wyniosły: 454 (30), 809 (53), 760 (36), 505 (35), 756 (39).
Lokomocja po wstrzyknięciu. Postać 2 pokazuje wpływ pięciu wstrzyknięć 1 mg / kg AMPH (jeden na tydzień) na wyniki aktywności ruchowej w czterech grupach. Grupa 4 × sesja 5 ANOVA dała główny efekt sesji, F(4, 112) = 8.21, p <0.001, marginalny efekt główny Grupy, F(2, 45) = 3.28, p = 0.085 i brak istotnych interakcji, F(12, 122) <0.77, p > 0.68.
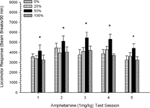
Rycina 2. Średnia (SE) reakcja lokomotoryczna (liczba przerw w wiązce w układzie elektronicznym na 90 min) na 1 mg / kg d-amfetaminy (ip) podczas tygodniowych sesji 5 w grupach szczurów Sprague Dawley (n = 8 / grupa) wcześniej narażony na codzienne sesje warunkowania 15 z nagrodą sacharozy (roztwór 10%) dostarczany zgodnie ze zmiennymi harmonogramami 0, 25, 50 lub 100%. Uwarunkowanym bodźcem było światło (120). Grupa 0 otrzymała taką samą liczbę nagród jak grupa 100 pod nieobecność uwarunkowanych bodźców. *p <0.05 dla średniej różnicy między grupą 50 a grupą 0 oraz grupą 100, na podstawie zaplanowanych porównań.
Planowane porównania wykazały, że wyniki grupy 50 znacznie różniły się od grupy 0, t(14) = 2.19, p = 0.037 i grupa 100, t(14) = 2.36, p = 0.025 [i różnił się nieznacznie od grupy 25, t(14) = 2.03, p = 0.051]. Zatem w grupie 50 odpowiedź lokomotoryczna na 1 mg / kg AMPH niezawodnie przekraczała odpowiedź pozostałych trzech grup we wszystkich pięciu sesjach testowych. Analiza trendu wielomianowego wykryła znaczny trend kwadratowy w sesjach, F(1, 28) = 32.47, p <0.0001 i żadnych innych znaczących trendów, F(1, 28) <1.78, p > 0.19. Postać 2 pokazuje, że wynik ten odzwierciedla wzorzec „odwróconego U” na sesjach.
Kontrola zmienności w szturchaniu nosa podczas treningu sacharozy
Kontynuacja ANCOVA odpowiedzi lokomotorycznych na 1 mg / kg AMPH, z ukąszeniami nosa (obecna CS) jako współzmienna, w trzech grupach, które otrzymały CS, przyniosła marginalny główny efekt grupy, F(2, 20) = 3.07, p = 0.069 i brak znaczących efektów związanych z współzmiennymi, F(4, 80) <0.05, p > 0.85. Tak więc, odpowiedź na podstawie wskazówek podczas treningu nie wyjaśniała znaczącej zmienności w odpowiedzi lokomotorycznej na 1 mg / kg AMPH w grupach 25, 50 lub 100.
Kontynuacja ANCOVA odpowiedzi lokomotorycznych na 1 mg / kg AMPH, z ukąszeniami nosa (CS nieobecna) jako współzmienną, dała znaczący efekt współzmiennej, F(1, 27) = 6.17, p = 0.020, znaczący główny efekt grupy, F(3, 27) = 4.13, p = 0.016, marginalna sesja × Współzmienna współzmienna, p = 0.080 i żadnych innych znaczących efektów, F(4, 108) <1.48, p > 0.21. A zatem, podejście bez wskazówek (bez rozróżnienia) odpowiadające podczas treningu wyjaśniało znaczące zróżnicowanie odpowiedzi lokomotorycznej na 1 mg / kg AMPH. Jednak ta zmienność nie pokrywała się z wariancją związaną z grupą, ponieważ uwzględnienie zmiennej towarzyszącej w analizie raczej zwiększyło niż zmniejszyło znaczenie efektu grupowego.
Dyskusja
Dane dotyczące grzebania w nosie podczas obecności CS pokazują, że grupy nabyły związek między CS a dostarczaniem sacharozy, co odzwierciedla wzrost odpowiedzi nakierowanych na sesje szkoleniowe. Profil odpowiedzi podczas sesji CS był sugerowany, że schematy CS-US 100 i 50% były równie skuteczne w wywoływaniu podejścia, podczas gdy harmonogram 25% wywołał skromniejszy wzrost w podejściu indukowanym cue. Dane dotyczące szturchania nosa podczas nieobecności CS sugerują, że grupy, które otrzymały jeden z trzech harmonogramów treningowych CS-sacharozy (grupa 25, 50, 100) szybko nauczyły się redukować nosy w przypadku braku CS, podczas gdy zwierzęta w grupie 0 , który nie otrzymał CS, nauczył się jedynie zmniejszać swoje podejście do podejścia w ograniczonym stopniu po intensywnym szkoleniu.
Dane dotyczące przyzwyczajeń pokazują, że grupy nie różniły się przed AMPH i że powtarzająca się ekspozycja na pola testowe była związana ze zmniejszoną bezruchową odpowiedzią lokomocyjną. Dlatego różnic międzygrupowych i zwiększonej odpowiedzi na powtarzane dawki AMPH nie można przypisać wcześniej istniejącym różnicom w zachowaniu lokomotorycznym.
Wyniki prowokacji przed uczuleniem 0.5 mg / kg AMPH potwierdziły, że lek zwiększył aktywność lokomotoryczną w stosunku do ostatniego dnia przyzwyczajania bez leku. Zgodnie z tą hipotezą grupa 50 zajęła wyższą pozycję niż grupy 0 lub 100 (a także grupa 25) pod względem średniej odpowiedzi na dawkę, chociaż średnie różnice między grupami nie były znaczące.
W przypadku sesji uczulających zaplanowane porównania między grupami wykazały, że wcześniejsza ekspozycja na 50% kondycjonowaną sacharozę jako nagrodę doprowadziła do znacznego wzrostu odpowiedzi lokomotorycznej na dawkę amfetaminy 1.0 mg / kg w porównaniu z pozostałymi trzema schematami. Efekt ten był oczywisty już od pierwszej dawki i nie zmieniał się znacząco przy powtarzanych dawkach. Analiza trendów wykazała dwufazową odpowiedź (dla pełnej próbki) na powtarzane dawki AMPH, zwiększającą się do trzeciej dawki, a następnie malejącą. Wyniki kontynuacji ANCOVA z szturchnięciami w nos (brak CS) jako współzmiennej potwierdziły, że różnice w odpowiedziach lokomotorycznych czterech grup na 1 mg / kg AMPH nie były zapośredniczone przez nie-podpowiedzi reagujące podczas sesji treningowych z sacharozą.
Efekt grupowy podczas sesji uwrażliwiania jest zgodny z naszą hipotezą. Efekt sesji dwufazowej nie jest zgodny z oczekiwaną dalszą eskalacją odpowiedzi lokomotorycznych przy powtarzanych dawkach AMPH. Może to być związane z przerwami między dawkami. Aby rozwiązać ten problem, należy zastosować procedurę (alternatywne dawki dzienne), która wywołuje konsekwentną eskalację odpowiedzi ruchowej na dawkę AMPH 1.0 mg / kg (tj. Uczulenie behawioralne). Wpływ reżimu uczulającego AMPH na następną odpowiedź na drugie wyzwanie 0.5 mg / kg dodatkowo wspiera ogólność tego efektu. Włączenie prowokacji solą fizjologiczną przed AMPH określiłoby rolę oczekiwanej lub zależnej od wstrzyknięcia (np. Stresu) wpływu na odpowiedź lokomotoryczną na AMPH. Włączenie grupy 75% kondycjonowanej sacharozy pomogłoby wyjaśnić rolę niepewności nagrody w porównaniu do rzadkości nagród na wzór odpowiedzi dla grup 50 i grupy 25. Ponadto, aby umożliwić ocenę (przez ANCOVA) wkładu reakcji bez użycia narkotyków w ruch lokalny pod AMPH (za pomocą szturchańców nosowych z CS obecnych jako współzmienna), szturchnięcia nosa były również kodowane dla grupy 0 podczas interwału, gdy CS była obecna w pozostałych czterech grupach (tj. tak, że nosa we wszystkich pięciu grupach - w tym grupa 0, która nie otrzymała CS - mogła być uwzględniona w analizie kowariancji z CS obecną jako współzmienna). Te udoskonalenia zostały włączone do eksperymentu 2.
Experiment 2
Materiały i Metody
Metodologia eksperymentu 2 była podobna do metodologii eksperymentu 1, ale zmieniona w celu lepszego przybliżenia reżimu, który niezawodnie indukuje uczulenie na AMPH (Fletcher i in., 2005). Zmiany były następujące: (a) Grupa 75% CS-sacharoza (n = 8) został włączony; (b) Podczas treningu sacharozy szczury (z wyjątkiem grupy 0) otrzymały prezentacje 20 CS (światło) (w przeciwieństwie do 15 w eksperymencie 1); (c) Każda prezentacja CS była oddzielona średnim odstępem między próbami 90; zakres: 30 – 180 s (vs. 120 w eksperymencie 1), który zrównoważył wzrost prób treningowych w celu zrównania czasu trwania każdej sesji treningowej z eksperymentem 1; (d) czas trwania każdej z trzech sesji przyzwyczajania został zmniejszony z 120 do 90 min, aby odpowiadał czasowi trwania sesji testowych; (e) Dodano próbkę soli fizjologicznej (ip, 1 ml / kg) (90 min) (dzień treningowy po sacharozie 8), aby ocenić efekty lokomotoryczne wstrzyknięcia per se (np. oczekiwanie, stres); (f) Sesje uczulające 1 mg / kg odbywały się raczej w dni powszednie (dni po treningu 12 – 21) niż w odstępach tygodniowych, jak w eksperymencie 1; (g) Wraz z pre-sensytyzacją 0.5 mg / kg prowokacji AMPH (dzień po treningu 9) dodano drugie wyzwanie po uczuleniu 0.5 mg / kg AMPH (dzień treningowy po sacharozie 28), aby przetestować ogólność działanie uczulające w dawkach; (h) szturchanie nosa podczas obecności CS było zakodowane dla wszystkich grup (w tym grupy 0); (i) szturchanie nosem podczas nieobecności CS rejestrowano konkretnie z interwału 5 bezpośrednio przed początkiem CS, aby zareagować na przedwczesne podejście.
Efekt
Nos szturcha podczas sesji kondycjonowania sacharozy
Grupa 5 × sesja 15 × faza 2 (obecność CS, nieobecność CS) ANOVA pokesów nosa przyniosła znaczące główne efekty grupy, F(4, 19) = 2.89, p = 0.050, Sesja F(14, 266) = 2.28, p = 0.006 i Phase, F(1, 19) = 14.72, p = 0.001, a także znacząca trójstronna interakcja, F(56, 266) = 1.38, p = 0.050. Panele (A, B) figurowy 3 wykreśl średnie wyniki grup dla naskórka nosowego odpowiednio dla fazy CS obecna i fazy braku CS. Porównanie dwóch paneli ujawnia, że główny efekt Fazy odzwierciedlał bardziej ogólne odpowiedzi na szturchanie nosa, gdy CS był obecny vs. nieobecny. Dlatego odpowiedzi podpowiadane pojawiały się istotnie częściej niż przedwczesne odpowiedzi bez wskazań. Główne efekty grup i sesji nie były łatwo interpretowane ze względu na interakcję wyższego rzędu. Ten ostatni wynik odzwierciedlał zbieżność wyników dla pięciu grup na stosunkowo stabilnym, niskim poziomie we wszystkich sesjach, w których brakowało CS (ryc. 3B), wraz z rozbieżnością wyników na wysokie (grupa 75, grupa 100), pośrednie (grupa 50) i niskie (grupa 0, grupa 25) poziomy szturchnięcia nosa odpowiadające na sesje, gdy CS było obecne (rysunek 3A). Spośród trendów wielomianowych niższego rzędu (liniowy, kwadratowy, sześcienny) tylko interakcja trójstronna dla trendu liniowego zbliżyła się do znaczenia, F(4, 19) = 2.32, p = 0.094, odzwierciedlający ogólnie monotoniczny wzrost nosa w trakcie sesji w grupie 75 i stosunkowo szybszą stabilizację na wysokim, średnim i niskim poziomie odpowiedzi w innych grupach, gdy CS był obecny.
Rycina 3. Średnie (SE) odpowiedzi podejścia (szturchanie nosa) podczas sesji treningowych sacharozy 15 w grupach szczurów Sprague Dawley (n = 8 / group) narażony na nagrodę sacharozy (roztwór 10%) dostarczany w ramach zmiennych harmonogramów 0, 25, 50, 75 lub 100%. Uwarunkowanym bodźcem było światło (120). Grupa 0 otrzymała taką samą liczbę nagród jak grupa 100 pod nieobecność uwarunkowanych bodźców. () Wyniki, gdy CS był obecny (próby 5 x 20). (B) Wyniki, gdy CS był nieobecny (średnia dla 5 × 20 s, gdy światło było wyłączone).
Przyzwyczajenie do skrzynek lokomotorycznych
Grupa 5 × ANOVA sesji 3 bezkomórkowych odpowiedzi ruchowych dała znaczący główny efekt sesji, F(2, 70) = 60.01, p <0.0001 i bez innych znaczących efektów, F(4, 35) <0.70, p > 0.60. Planowane porównania grupy 50 z grupą 0 iz grupą 100 na pierwszej i ostatniej sesji habituacji nie przyniosły znaczących efektów, t<0.84, p > 0.40. Dlatego też średnia odpowiedź lokomotoryczna bez leku w kluczowych grupach nie różniła się przed badaniem. Średnia (SE) liczba pęknięć wiązki na 90 min wynosiła 2162 (118) na sesji 1, 1470 (116) na sesji 2 i 1250 (98) na sesji 3.
Sesje testowe
Solankowy. Grupa 5 × sesja 2 ANOVA porównała odpowiedź lokomotoryczną w końcowej sesji przyzwyczajenia i sesję prowokacji solą fizjologiczną. ANOVA przyniosła główny efekt sesji, F(1, 35) = 62.46, p <0.0001 i bez innych znaczących efektów, F(4, 35) <0.65, p > 0.64. Postać 4 wykresy oznaczają, że grupa oznacza i że efekt Sesji odzwierciedla ogólny spadek odpowiedzi lokomotorycznej od ostatniej sesji przyzwyczajenia bez leku do sesji z solą, która nie różniła się w zależności od grupy. Tak więc spadek odpowiedzi ruchowej obserwowany podczas trzech sesji przyzwyczajeń kontynuowano przy czwartej ekspozycji bez użycia leku na pudełka testowe.
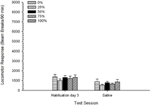
Rycina 4. Średnia (SE) reakcja lokomotoryczna (liczba przerw w wiązce w układzie elektronicznym na 90 min) podczas ostatniej sesji przyzwyczajania bez leku 3 i podczas kolejnej sesji po wstrzyknięciu soli fizjologicznej (ip, 1 ml / kg) w grupach Sprague Dawley szczury (n = 8 / grupa) wcześniej narażony na codzienne sesje warunkowania 15 z nagrodą sacharozy (roztwór 10%) dostarczany zgodnie ze zmiennymi harmonogramami 0, 25, 50, 75 lub 100%. Uwarunkowanym bodźcem było światło (120). Grupa 0 otrzymała taką samą liczbę nagród jak grupa 100 pod nieobecność uwarunkowanych bodźców.
Wpływ 0.5 mg / kg AMPH.
Lokomocja przed wstrzyknięciem. Grupa 5 × sesja 2 ANOVA lokomocji przed wstrzyknięciem (30-min) w czasie przed i po uczuleniu 0.5 mg / kg dni testu AMPH dały znaczący główny efekt sesji, F(1, 35) = 13.39, p = 0.001 i żadnych innych znaczących efektów, F(4, 35) <1.79, p > 0.15. Planowane porównania nie wykazały znaczących różnic między grupą 50 a grupą 0 lub grupą 100 na pierwszej sesji, t(70) <1.00, p > 0.30. Jednak na drugiej sesji (po uczuleniu) grupa 50 (1203; 121) wykazała znacznie więcej pęknięć wiązki przed wstrzyknięciem (M; SE) niż grupa 100 (756; 103), t(70) = 5.11, p <0.001, ale nie różniło się od grupy 0 (1126; 211), t(7) <0.88, p > 0.40. Dlatego wyjściowe różnice w lokomocji nie uwzględniały różnic między grupami w odpowiedzi lokomotorycznej na pierwszą dawkę 0.5 mg / kg AMPH, ale mogły przyczynić się do różnic między grupą 50 i 100 w odpowiedzi lokomotorycznej na drugą dawkę 0.5 mg / kg AMPH. . Średnie (SE) pęknięcia wiązki w fazie przed wstrzyknięciem w pierwszej i drugiej sesji testu AMPH 0.5 mg / kg wyniosły 757 (41) i 974 (59).
Lokomocja po wstrzyknięciu. ANOVA grupy 5 × 2 odpowiedzi lokomotorycznej na 0.5 mg / kg AMPH przed i po schemacie uwrażliwienia na dawkę 5 dało główny efekt sesji, F(1, 35) = 76.05, p <0.0001 i bez innych znaczących efektów, F(4, 35) <1.10, p > 0.37. Postać 5 pokazuje średnie wyniki dla każdej grupy i sesji.
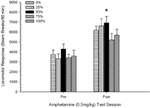
Rycina 5. Średnia (SE) reakcja lokomotoryczna (liczba przerw w wiązce w układzie elektronicznym na 90 min) na 0.5 mg / kg d-amfetaminy podczas oddzielnych sesji przed i po sesji uczulającej na sesję 5 d-amfetaminy (1.0 mg / kg; ip na sesję) w grupach szczurów Sprague Dawley (n = 8 / grupa) wcześniej narażony na codzienne sesje warunkowania 15 z nagrodą sacharozy (roztwór 10%) dostarczany zgodnie ze zmiennymi harmonogramami 0, 25, 50, 75 lub 100%. Uwarunkowanym bodźcem było światło (120). Grupa 0 otrzymała taką samą liczbę nagród jak grupa 100 pod nieobecność uwarunkowanych bodźców. *p <0.05 dla średniej różnicy między grupą 50 a grupą 0 oraz grupą 100, na podstawie zaplanowanych porównań.
Figura pokazuje, że efekt sesji obejmował znaczny wzrost całkowitych średnich (SE) pęknięć wiązki na 90 min z 0.5 mg / kg dawki 1, 3674 (216) do 0.5 mg / kg dawki 2, 6123 (275). Brak interakcji lub efektu grupy sugerował, że uczulenie na AMPH nie zmieniało się niezawodnie w różnych grupach. Pomimo braku znaczących efektów związanych z grupą w ANOVA, kontrola figury ujawnia, że grupa 50 wykazywała największą odpowiedź zarówno na pierwszą, jak i drugą dawkę 0.5 mg / kg. Planowane porównania odpowiedzi na pierwszą dawkę 0.5 mg / kg nie wykazały istotnej różnicy między grupą 50 a grupą 0 lub grupą 100, t„s(35) <0.48, p > 0.50. Jednak w odpowiedzi na drugą (po uczuleniu) dawkę 0.5 mg / kg, grupa 50 wykazywała znacznie większą lokomocję niż grupa 0, t(35) = 2.00, p <0.05, a także grupa 100, t(35) = 3.29, p <0.01.
W świetle znaczącej różnicy grup w lokomocji przed wstrzyknięciem w drugiej sesji 0.5 mg / kg AMPH opisanej powyżej, przeprowadzono kontrolną grupę 5 × sesję 2 ANCOVA odpowiedzi lokomotorycznej na 0.5 mg / kg AMPH, kontrolując przed ruch wtrysku na drugiej sesji. Ta analiza dała znaczący efekt współzmiennej, F(1, 34) = 8.65, p = 0.006, główny efekt sesji F(1, 34) = 10.83, p = 0.002 i żadnych innych znaczących efektów, F(4, 34) <0.85, p > 0.50. Co ważne, zaplanowane porównania oparte na błędzie MS i błędzie df z ANCOVA potwierdziły, że średnia odpowiedź lokomotoryczna na drugą dawkę 0.5 mg / kg AMPH pozostała istotnie większa w grupie 50 niż w grupie 100, t(34) = 3.09, p <0.01 i grupa 0, t(34) = 1.88, p <0.05 (jednostronne), gdy kontrolowano odchylenie przed wstrzyknięciem od sesji 2. Zatem grupa 50 wykazywała znacząco większą odpowiedź lokomotoryczną po uczuleniu na 0.5 mg / kg AMPH niż grupa 100 lub grupa 0, a te różnice między grupami nie były spowodowane lokomocją przed wstrzyknięciem w dniach badania.
Wpływ 1.0 mg / kg AMPH.
Lokomocja przed wstrzyknięciem. Grupa 5 × sesja 5 ANOVA wyników 30-min przed wstrzyknięciem dla sesji uczuleń 1 mg / kg AMPH dała główny efekt sesji, F(4, 140) = 16.70, p <0.0001 i bez innych znaczących efektów, F(4, 35) <0.94, p > 0.45. Planowane porównania nie wykazały znaczącej różnicy w lokomocji przed wstrzyknięciem między grupą 50 a grupą 0 lub grupą 100 na pierwszej sesji, t(175) <1.66, p > 0.10. Jednak podczas ostatniej sesji grupa 50 (1167; 140) wykazała znacznie więcej pęknięć wiązki (M; SE) niż grupa 100 (1000; 99), t(175) = 2.35, p <0.05, ale nie różniło się od grupy 0 (1085, 120), t(175) <1.16, p > 0.20. Dlatego różnice w lokomocji przed wstrzyknięciem przyczyniły się do różnic między grupami 50 i 100 w odpowiedzi lokomotorycznej na końcową dawkę 1 mg / kg AMPH. Średnie (SE) całkowite pęknięcia wiązki dla próbki podczas fazy przed wstrzyknięciem dla sesji od 1 do 5 wyniosły: 810 (46), 784 (52), 760 (53), 726 (46), 1009 (51).
Lokomocja po wstrzyknięciu. Grupa 5 × sesja 5 ANOVA odpowiedzi na 1 mg / kg AMPH przyniosła znaczący główny efekt sesji, F(4, 140) = 6.72, p <0.001, marginalna interakcja Grupa × Sesja, F(16, 140) = 1.57, p = 0.085 i brak głównego efektu grupy, F(4, 35) <0.44, p > 0.77. Analiza trendów wielomianowych ujawniła istotny trend liniowy, F(1, 35) = 9.19, p = 0.005 i trend sześcienny, F(1, 35) = 21.63, p <0.001, w czasie sesji od 1 do 5. Rysunek 6 pokazuje średnie wyniki lokomotoryczne dla każdej grupy i sesji.

Rycina 6. Średnia (SE) reakcja lokomotoryczna (liczba przerw w wiązce w układzie elektronicznym na 90 min) na 1 mg / kg d-amfetaminy (ip) podczas tygodniowych sesji 5 w grupach szczurów Sprague Dawley (n = 8 / grupa) wcześniej narażony na codzienne sesje warunkowania 15 z nagrodą sacharozy (roztwór 10%) dostarczany zgodnie ze zmiennymi harmonogramami 0, 25, 50, 75 lub 100%. Uwarunkowanym bodźcem było światło (120). Grupa 0 otrzymała taką samą liczbę nagród jak grupa 100 pod nieobecność uwarunkowanych bodźców.
Rysunek pokazuje, że efekt Session odzwierciedlał znaczny wzrost całkowitych średnich (SE) przerw w wiązce dla pełnej próbki od sesji 1, 4624 (213) do sesji 5, 5736 (272), potwierdzając pojawienie się uczulenia na AMPH. Sześcienny trend oznaczał względne maksima w sesjach 1, 3 i 5, z zanurzeniami w sesjach 2 i 4, szczególnie dla grup 0 i 50. Rysunek pokazuje również, że pomimo braku znaczącej interakcji, grupa 25 wykazywała stopniowo większą odpowiedź lokomotoryczną podczas sesji i różniła się znacznie od innych grup w sesjach 4 i 5 (odpowiednio 9 i 22%, niż następna najwyższa grupa). Planowane porównania wykazały, że grupa 50 nie różni się znacząco od grup 0 lub 100, t(175) <0.89, p > 0.40 w pierwszej lub ostatniej sesji testowej 1 mg / kg AMPH.
Kontrola zmienności w szturchaniu nosa podczas treningu sacharozy
Dwie grupy 5 × sesja 2 ANCOVA odpowiedzi lokomotorycznej na 0.5 mg / kg AMPH przed i po reżimie uczulania, w tym całkowite szturchanie nosa podczas treningu sacharozy z obecnością CS i brakiem CS jako oddzielnych współzmiennych, nie stwierdzono istotnych efektów dla żadnej z zmiennych towarzyszących, F(1, 18) <1.03, p > 0.31. Dlatego podejście odpowiadające podczas treningu nie pośredniczyło w różnicach między grupami w odpowiedzi na 0.5 mg / kg AMPH.
Dwie grupy 5 x Sesja 5 ANCOVA odpowiedzi lokomotorycznej na 1 mg / kg podczas sesji uwrażliwiania z całkowitymi szturchnięciami nosa (obecne CS, nieobecne CS) jako oddzielne współzmienne nie przyniosły znaczących efektów współzmiennej podczas obecności CS, F(4, 104) <1.04, p > 0.38 i marginalny efekt główny zmiennej towarzyszącej przy braku CS, F(1, 18) = 3.32, p = 0.085.
Dyskusja
Wyniki tego badania nie popierają konsekwentnie hipotezy, że grupa 50 wykazywałaby wyższą odpowiedź lokomotoryczną w ciągu sesji w porównaniu z innymi grupami. Dane dotyczące AMPH 1 mg / kg potwierdziły pojawienie się uczulenia w schemacie dawkowania alternatywnego dnia. Wzorzec między grupami wskazywał na tendencję do większego uczulenia podczas ostatnich sesji w grupie 25, bez takich dowodów dla grupy 50. W przeciwieństwie do tego, wyniki dawek 0.5 mg / kg wskazywały na tendencję do większego uczulenia w grupie 50, jednocześnie potwierdzając znaczny ogólny wzrost odpowiedzi lokomotorycznej w grupach do drugiej względem pierwszej dawki 0.5 mg / kg AMPH. Efekt zerowy zastrzyku soli fizjologicznej potwierdził, że oczekiwanie lub stres związany z iniekcją nie przyczyniły się do efektów AMPH.
Dane szturchania nosa ponownie ujawniły ogólny wzrost reakcji w podejściu podczas sesji treningowych, gdy CS był obecny, bez odpowiedniego wzrostu, gdy CS był nieobecny. Dlatego wydawało się, że zwierzęta nabyły związek między CS a perspektywą nagrody sacharozy. Różnice grupowe w częstości szturchnięć w nos, gdy CS był obecny, były w przybliżeniu zgodne z częstotliwością dostarczania nagród zgodnie z odpowiednimi harmonogramami, przy czym grupy 75 i 100 pokazały najwięcej szturchnięć w nos, grupa 50 wykazała średnią liczbę szturchnięć w nos, a grupy 0 i 25 wyświetla najmniejszą liczbę uderzeń w nos. Wyniki te sugerują, że CS zaczął kontrolować podejście odpowiadające w sposób zgodny z ogólnym prawdopodobieństwem nagrody. Chociaż spekulacyjne, jednym z możliwych wyjaśnień niższych częstości szturchania nosa z CS obecnymi w grupie 50 w eksperymencie 2 vs. eksperyment 1 może być skrócenie interwału między próbami, ponieważ dłuższe interwały między próbami (eksperyment 1) wydają się zachęcać do impulsywności tendencje i jest to związane ze zwiększonym obrotem DA w przednich obręczy, kory przedkręgowej i infralimbicznej (Dalley i wsp., 2002). Dlatego zmniejszenie 30 o interwał między próbami w eksperymencie 2 (i 3) może mieć zmienione poziomy korowej DA i promować bardziej selektywne (tj. Kierując się względną częstotliwością nagrody) w porównaniu z podejściem impulsywnym (nie kierowanym częstotliwością nagrody) odpowiadanie w grupie 50 podczas prób treningowych w eksperymencie 2 w porównaniu z eksperymentem 1.
Brak istotnych efektów zależnych od współzmiennych w przypadku szturchańców nosa w obecnym stanie CS w ANCOVA wskazuje, że podejście odpowiadające podczas treningu z sacharozą nie pośredniczyło w oddziaływaniu różnych harmonogramów sacharozy CS na odpowiedzi na AMPH. Nieznacznie istotny wpływ zmiennej współzmiennej dla warunku nieobecności CS w ANCOVA odpowiedzi lokomotorycznych na 1 mg / kg AMPH sugeruje, że tendencja do odpowiedzi przedwczesnych bez leków wyjaśnia niektóre zmienności efektów lokomotorycznych AMPH podczas sesji uwrażliwiania.
Razem dowody sugerują, że skutki historii kondycjonowania mogą być bardziej widoczne w przypadku 0.5 AMPH niż w przypadku 1 mg / kg AMPH, a protokół generujący uczulenie w przypadku braku innych manipulacji może przesłaniać lub powodować zbędne skutki domniemanego manipulacja behawioralna promująca uczulenie (tj. przewlekła zmienna nagroda).
Uczulenie behawioralne na AMPH to silny efekt w laboratorium. Jednak poza laboratorium tylko niewielka część osób, które hazardowo chronicznie eskalują do poziomów patologicznych. Chociaż ryzyko uczulenia jest związane z ryzykiem uzależnienia (lub poszukiwania narkotyków), szczególnie w przypadku środków psychostymulujących (Vezina, 2004; Flagel i wsp., 2008), wiele czynników oprócz ryzyka uczulenia może predysponować do uzależnienia (np. Verdejo-Garcia i wsp., 2008; Conversano i in., 2012; Volkow i wsp., 2012). Niemniej jednak, czynniki cechy, które nadają wrażliwość na uczulenie, mogą oddziaływać z historią kondycjonowania, aby zaakcentować skutki nieprzewidywalnej nagrody (tj. Harmonogramu 50% CS-US) na reaktywność układu DA. Aby zbadać tę możliwość, eksperyment 3 zastosował tę samą procedurę co eksperyment 2, ale użył szczepu Lewisa zamiast szczurów szczepu Sprague Dawley.
Szczury Sprague Dawley wykazują pośrednie poziomy transporterów DA, z niższymi poziomami niż szczury szczepu Wistar (Zamudio i in., 2005), ale wyższy poziom niż szczury Wistar-Kyoto (szczep „depresyjny”) w jądrze półleżącym, ciele migdałowatym, brzusznej okolicy kulszowej i istocie czarnej (Jiao i in., 2003). Ten profil może uczynić szczury Sprague Dawley jedynie umiarkowanie wrażliwymi na środowiskowe lub farmakologiczne manipulacje funkcji DA. Przeciwnie, szczury Lewis wykazują niski poziom transporterów DA, a także receptorów DA D2 i D3 DA w jądrze półleżącym i grzbietowym prążkowiu w porównaniu z innymi szczepami (np. F344) (Flores i in., 1998). Te różnice morfologiczne mogą przyczyniać się do zróżnicowanej odpowiedzi szczurów Lewis na manipulacje DA. Szczury Lewis również wykazują szereg zaakcentowanych odpowiedzi na eksperymentalne manipulacje lekami w porównaniu z innymi szczepami (np. F344). Co najważniejsze, szczury Lewis wykazują większą wrażliwość na metamfetaminę, charakteryzującą się niską reakcją na dawki początkowe, ale wyższą odpowiedzią na dawki późniejsze (Camp i wsp., 1994). Szczury Lewisa wykazują również większe uczulenie ruchowe na szereg dawek kokainy (Kosten i in., 1994; Haile i wsp., 2001). Opierając się na tym schemacie efektów, przypuszczaliśmy, że szczury Lewisa pozwolą nam zbadać, czy podatność na uczulenie wzmacnia wpływ harmonogramu kondycjonowania na późniejszą odpowiedź na AMPH.
Experiment 3
Materiały i Metody
Metodologia była taka sama jak w eksperymencie 2, poza zastosowaniem szczurów Lewis (200 – 225 g po przybyciu, Charles River, Quebec, Kanada).
Efekt
Nos szturcha podczas sesji kondycjonowania sacharozy
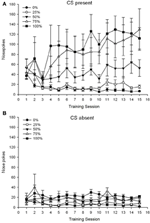
Grupa 5 × sesja 15 × faza 2 (obecność CS, nieobecność CS) ANOVA pokesów nosa przyniosła znaczące główne efekty grupy, F(4, 34) = 6.12, p = 0.001, sesja, F(14, 476) = 3.42, p <0.001 i Faza, F(1, 34) = 20.83, p <0.001, a także znacząca trójstronna interakcja, F(56, 476) = 1.56, p = 0.008. Panele (A, B) figurowy 7 wykreśl średnie wyniki grup dla naskórka nosowego odpowiednio dla fazy CS obecna i fazy braku CS. Porównanie dwóch paneli ujawnia, że główny efekt Fazy odzwierciedlał bardziej ogólne reakcje na szturchanie nosa, gdy CS był obecny vs. nieobecny. Dlatego odpowiedzi podpowiadane występowały istotnie częściej niż odpowiedzi przedwczesne. Główne efekty grup i sesji nie były łatwo interpretowane ze względu na interakcję wyższego rzędu. Interakcja trójstronna odzwierciedlała zbieżność wyników dla pięciu grup na stosunkowo stabilnym niskim poziomie we wszystkich sesjach, gdy nie było CS [Panel (B)], wraz z rozbieżnością wyników, gdy CS był obecny w stosunkowo dyskretnych profilach dla każdej grupy, która była równoległa do ich rangi kolejności częstotliwości nagród: od najwyższej (grupa 100) do najniższej (grupa 25) [Panel ()]. Tylko liniowy trend interakcji był znaczący, F(4, 34) = 4.03, p = 0.009, odzwierciedlający ogólnie stały wzrost pokesów w nosie podczas sesji w grupie 100, gdy CS był obecny w porównaniu ze stosunkowo niespójnym profilem wzrostu nosa w trakcie sesji w innych grupach podczas tej fazy.

Rycina 7. Średnie (SE) reakcje podejścia (szturchanie nosa) podczas sesji treningowych sacharozy 15 w grupach szczurów Lewis (n = 8 / group) narażony na nagrodę sacharozy (roztwór 10%) dostarczany w ramach zmiennych harmonogramów 0, 25, 50, 75 lub 100%. Uwarunkowanym bodźcem było światło (120). Grupa 0 otrzymała taką samą liczbę nagród jak grupa 100 pod nieobecność uwarunkowanych bodźców. () Wyniki, gdy CS był obecny (próby 5 x 20). (B) Wyniki, gdy CS był nieobecny (średnia dla 5 × 20 s, gdy światło było wyłączone).
Przyzwyczajenie do skrzynek lokomotorycznych
Grupa 5 × sesja 3 ANOVA dała główny efekt sesji, F(2, 70) = 23.07, p <0.0001 i bez innych znaczących efektów, F(8, 70) <1.47, p > 0.18. Krzywoliniowy wzór średnich (SE) wyników lokomotorycznych wyłonił się z sesji 1, 1076 (74), poprzez sesję 2, 644 (48), do sesji 3, 762 (59). Planowane porównania grupy 50 z grupą 0 iz grupą 100 na pierwszej i ostatniej sesji habituacji ujawniły znacznie mniej przerw w wiązce w grupie 50 (M = 911; SE = 109) vs. grupa 0 (M = 1103; SE = 176) na sesji habituacji 1, t(105) = 2.02, p <0.05, ale nie ma różnicy między grupą 50 a grupą 100 (M = 1066; SE = 150), t(105) <1.20, p > 0.20, w tej sesji. Grupa 50 nie różniła się istotnie ani od grupy 0, ani od grupy 100 na ostatniej sesji habituacji, t(105) <0.93, p > 0.30. Dlatego średnia odpowiedź lokomotoryczna bez leku w kluczowych grupach nie różniła się konsekwentnie przed badaniem.
Sesje testowe
Solankowy. Grupa 5 × sesja 2 ANOVA odpowiedzi lokomotorycznych na końcowej sesji przyzwyczajenia i sesja testu z solą fizjologiczną przyniosły znaczący główny efekt sesji, F(1, 35) = 50.12, p <0.0001 i bez innych znaczących efektów, F(4, 35) <0.57, p > 0.68. Postać 8 pokazuje średnie wyniki grupy dla dwóch sesji i wskazuje, że efekt Sesji odzwierciedlał znaczny spadek od przyzwyczajenia do testu z solą. Tak więc odbiór zastrzyku per se (np. oczekiwanie, stres) nie zwiększyło odpowiedzi lokomotorycznej.

Rycina 8. Średnia (SE) reakcja lokomotoryczna (liczba przerw w wiązce w układzie elektronicznym na 90 min) podczas ostatniej sesji przyzwyczajania bez leku 3 i podczas następnej sesji po wstrzyknięciu soli fizjologicznej (ip, 1 ml / kg) w grupach szczurów Lewis (n = 8 / grupa) wcześniej narażony na codzienne sesje warunkowania 15 z nagrodą sacharozy (roztwór 10%) dostarczany zgodnie ze zmiennymi harmonogramami 0, 25, 50, 75 lub 100%. Uwarunkowanym bodźcem było światło (120). Grupa 0 otrzymała taką samą liczbę nagród jak grupa 100 pod nieobecność uwarunkowanych bodźców.
Wpływ 0.5 mg / kg AMPH.
Lokomocja przed wstrzyknięciem. Grupa 5 × sesja 2 ANOVA lokomocji przed wstrzyknięciem dała znaczący efekt główny sesji, F(1, 35) = 15.04, p <0.001 i bez innych znaczących efektów, F(4, 35) <1.19, p > 0.33. Planowane porównania nie wykazały znaczącej różnicy między grupą 50 a grupą 0 lub grupą 100 w żadnej sesji testowej, t(70) <0.99, p > 0.30. Dlatego wyjściowe różnice w lokomocji przed wstrzyknięciem nie wyjaśniały różnic między grupami w odpowiedzi lokomotorycznej na 0.5 mg / kg AMPH. Średnie (SE) pęknięcia wiązki w fazie przed wstrzyknięciem dla pierwszej i drugiej sesji (po uczuleniu) 0.5 mg / kg wyniosły 325 (25) i 473 (36).
Lokomocja po wstrzyknięciu. ANOVA grupy 5 × sesja 2 odpowiedzi lokomotorycznej na dawki 0.5 mg / kg dostarczone przed i po przewlekłym 1 mg / kg AMPH dały główny efekt sesji, F(1, 34) = 87.44, p <0.0001 i bez innych znaczących efektów, F(4, 34) <0.94, p > 0.45. Postać 9 wykreśla średnie wyniki ruchowe dla każdej grupy i sesji i pokazuje, że efekt Sesji odzwierciedla zwiększoną ogólną odpowiedź na drugą dawkę 0.5 mg / kg, co jest zgodne z uczuleniem. Rysunek pokazuje również, że grupy działały bardzo podobnie w sesji 1, ale ta grupa 50 wykazywała większą aktywność lokomotoryczną niż inne grupy w sesji 2. Planowane porównania w odpowiedzi na pierwszą dawkę 0.5 mg / kg nie wykazały istotnych różnic między grupą 50 a grupą 0 lub grupą 100, t(35) <1.28, p > 0.20. Jednak grupa 50 wykazywała znacznie większą odpowiedź lokomotoryczną na drugą dawkę 0.5 mg / kg niż grupa 0, t(35) = 4.32, p <0.001 lub grupa 100, t(35) = 2.24, p <0.05.

Rycina 9. Średnia (SE) reakcja lokomotoryczna (liczba przerw w wiązce w układzie elektronicznym na 90 min) na 0.5 mg / kg d-amfetaminy podczas oddzielnych sesji przed i po sesji uczulającej na sesję 5 d-amfetaminy (1.0 mg / kg; ip na sesję) w grupach szczurów Lewis (n = 8 / grupa) wcześniej narażony na codzienne sesje warunkowania 15 z nagrodą sacharozy (roztwór 10%) dostarczany zgodnie ze zmiennymi harmonogramami 0, 25, 50, 75 lub 100%. Uwarunkowanym bodźcem było światło (120). Grupa 0 otrzymała taką samą liczbę nagród jak grupa 100 pod nieobecność uwarunkowanych bodźców. *p <0.05 dla średniej różnicy między grupą 50 a grupą 0 oraz grupą 100, na podstawie zaplanowanych porównań.
Wpływ 1 mg / kg AMPH.
Lokomocja przed wstrzyknięciem. Grupa 5 × sesja 5 ANOVA wyników 30-min przed wstrzyknięciem dla sesji sensytyzacji przyniosła główny efekt sesji, F(4, 140) = 4.10, p = 0.004 i żadnych innych znaczących efektów, F(4, 35) = 1.25, p > 0.31. Planowane porównania wykazały, że pęknięcia wiązki podczas fazy przedwtryskowej (M; SE) były istotnie niższe w grupie 50 (395; 62) niż w grupie 100 (508; 62), t(175) = 2.58, p <0.01, ale nie grupa 0, t(175) <1.83, p > 0.10, na 1 mg / kg sesji AMPH 1. Na ostatniej sesji 1 mg / kg AMPH, zaplanowane porównania wykazały również, że lokomocja przed wstrzyknięciem w grupie 50 (378; 60) była znacznie niższa niż w grupie 100 (650; 75 ), t(175) = 6.17, p <0.001, ale nie w grupie 0, t(175) <1.84, p > 0.10. Ponieważ kierunek tych różnic między grupami (grupa kontrolna = grupa 50) był przeciwny do hipotetycznego wzorca, różnice między grupami w lokomocji po wstrzyknięciu, które są zgodne z hipotezą, nie mogą być przypisane różnicom linii bazowej przed wstrzyknięciem. Średnie (SE) całkowite pęknięcia wiązki podczas fazy przedwtryskowej dla sesji od 1 do 5 wyniosły: 442 (34), 452 (32), 542 (40), 411 (26), 504 (37).
Lokomocja po wstrzyknięciu. ANOVA grupy 5 × sesje 5 odpowiedzi na dawki 1 mg / kg dały znaczący główny efekt sesji, F(4, 140) = 6.15, p <0.001 i bez innych znaczących efektów, F(4, 35) <0.57, p > 0.68. Analiza trendów wielomianowych ujawniła istotny trend liniowy, F(1, 35) = 9.34, p = 0.004 i trend sześcienny, F(1, 35) = 5.08, p = 0.031, drugi wynik oznaczający względne maksima w sesjach 3 i 5. Postać 10 wykreśla te wyniki i pokazuje, że pomimo braku znaczącej interakcji w ANOVA, grupa 50 wykazywała znacznie większą lokomocję niż pozostałe cztery grupy w odpowiedzi na ostateczną dawkę 1 mg / kg. W związku z tym planowane porównania ujawniły znacznie większe średnie wyniki w sesji 5 w grupie 50 niż we wszystkich innych grupach, t(35) > 3.68, p <0.001.
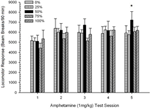
Rycina 10. Średnia (SE) reakcja lokomotoryczna (liczba przerw w wiązce w układzie elektronicznym na 90 min) na 1 mg / kg d-amfetaminy (ip) podczas tygodniowych sesji 5 w grupach szczurów Lewisa (n = 8 / grupa) wcześniej narażony na codzienne sesje warunkowania 15 z nagrodą sacharozy (roztwór 10%) dostarczany zgodnie ze zmiennymi harmonogramami 0, 25, 50, 75 lub 100%. Uwarunkowanym bodźcem było światło (120). Grupa 0 otrzymała taką samą liczbę nagród jak grupa 100 pod nieobecność uwarunkowanych bodźców. *p <0.05 dla średniej różnicy między grupą 50 a grupą 0 oraz grupą 100, na podstawie zaplanowanych porównań.
Kontrola zmienności w szturchaniu nosa podczas treningu sacharozy
Dwie grupy 5 × sesja 2 ANCOVA odpowiedzi lokomotorycznej na 0.5 mg / kg AMPH przed i po reżimie uczulania, w tym całkowite szturchanie nosa podczas treningu sacharozy z obecnością CS i brakiem CS jako oddzielnych współzmiennych, nie stwierdzono istotnych efektów dla żadnej z zmiennych towarzyszących, F(1, 32) <0.44 p > 0.51. Dwie wartości ANCOVA 5 grup × 5 sesji odpowiedzi lokomotorycznej na 1 mg / kg AMPH podczas sesji uczulających z całkowitymi szturchnięciami w nos (CS obecny, brak CS) jako oddzielne zmienne towarzyszące nie dały żadnych istotnych efektów współzmiennej, gdy CS był obecny lub nieobecny, F(1, 33) <0.14, p > 0.71. Dlatego odpowiedź w podejściu wolnym od leków nie uwzględnia różnic grup w odpowiedziach lokomotorycznych na żadną z dawek AMPH.
Dyskusja
Uczulenie rozwinęło się w wyniku powtarzanego 1.0 mg / kg amfetaminy. Dane dotyczące habituacji i soli fizjologicznej potwierdzają, że efekt ten nie był spowodowany istniejącymi wcześniej różnicami, oczekiwaniem lub reakcjami związanymi ze stresem na wstrzyknięcie. ANCOVA z szturchnięciami w nos potwierdzają, że te efekty nie były spowodowane zachowaniem bez narkotyków. Same dane z nosa wskazywały, że grupy uzyskały związek między CS a perspektywą nagrody za sacharozę. Poziom rangi, w jaki grupa szturchanie nosem odpowiadał na koniec treningu, odpowiadał ogólnej częstotliwości nagród w różnych harmonogramach, od najwyższego (grupa 100) do najniższego (grupa 0), tak jak w eksperymencie 2. Stosunkowo niższa ogólna średnia Poziomy kłucia w nosie w tym eksperymencie w porównaniu z eksperymentami 1 i 2 mogą odzwierciedlać bardziej selektywne podejście odpowiadające na sygnały nagrody u szczurów Lewis (Kosten i in., 2007).
Dane dotyczące dawki 0.5 mg / kg wykazały, że początkowa odpowiedź lokomotoryczna na AMPH u szczurów Lewisa (Figura 9) był nieco stłumiony w porównaniu ze szczurami Sprague Dawley (eksperyment 2; Figura 5), ale wzrost wewnątrz grupy w odpowiedzi na drugą dawkę u szczurów Lewisa był znaczny (prawie dwukrotność odpowiedzi na pierwszą dawkę 0.5 mg / kg) po schemacie AMPH sesji 5. Szczególnie grupa 50 wykazywała większą odpowiedź lokomotoryczną niż wszystkie grupy z wyjątkiem grupy 25 do drugiej (tj. po uczuleniu) dawki 0.5 mg / kg AMPH i większej odpowiedzi lokomotorycznej niż wszystkie inne grupy, w tym grupa 25, do końcowej dawki 1 mg / kg AMPH (końcowa sesja uczulania) .
Podsumowanie analizy rankingów grup w eksperymentach
Aby określić wiarygodność różnic grupowych w uczuleniu, w analizie nieparametrycznej oceniano zależność między grupą a rangą średniej odpowiedzi ruchowej na drugą (przewlekłą AMPH) 0.5 mg / kg i końcową dawkę 1.0 mg / kg AMPH z eksperymentów 3. Analiza dała znaczący efekt, φ = 0.986, p = 0.025, odzwierciedlając fakt, że grupa 50 zajęła pierwsze miejsce we wszystkich oprócz jednego porównania. Wyższą rangę grupy 50 w porównaniu do wszystkich innych grup w odpowiedzi na drugą (post przewlekłą AMPH) dawkę 0.5 mg / kg przedstawiono na rysunku 5 (eksperyment 2) i rysunek 9 (eksperyment 3). Wyższą rangę grupy 50 względem innych grup w odpowiedzi na ostateczną dawkę 1.0 mg / kg przedstawiono na Figurze 2 (eksperyment 1) i rysunek 10 (eksperyment 3). Jedynym wyjątkiem od tego wzorca była odpowiedź na ostateczną dawkę 1.0 mg / kg u szczurów Sprague-Dawley w eksperymencie 2.
ogólna dyskusja
Obecna seria eksperymentów przetestowała hipotezę, że chroniczne narażenie na hazardowy harmonogram nagród może uwrażliwić ścieżki DA mózgu podobnie jak chroniczne narażenie na narkotyki. Dowody na taki efekt sugerowałyby, że neuroplastyczność, tego samego rodzaju, o której uważa się, że przyczynia się do uzależnienia od narkotyków, może być indukowana przez chroniczne narażenie na nieprzewidywalne harmonogramy nagród. Zgodnie z literaturą na temat uzależnienia od narkotyków, odpowiedź ruchowa na dawki 0.5 i 1.0 mg / kg reaktywności układu DA indeksowanego przez AMPH, z większą ruchliwością w odpowiedzi na późniejsze dawki określające działanie uczulające (por. Robinson i Berridge, 1993; Pierce i Kalivas, 1997; Vanderschuren i Kalivas, 2000).
Ogólnie wyniki są zgodne z naszą hipotezą. Jednak wskazują również na znaczną zmienność efektów eksperymentalnych z powodu czynników proceduralnych. Skutki schematu kondycjonowania były umiarkowane, ale spójne, z grupą 50 wykazującą większą odpowiedź niż pozostałe cztery grupy na obie dawki po pięciu reżimach dawkowania. Chociaż ogólnie F-wartości dla efektów związanych z grupą w analizach wariancji były często nieistotne, kluczowe różnice grupowe potwierdzono za pomocą porównań planowanych parami. W tym względzie należy zauważyć, że „obecne myślenie jest jednak tym ogólnym znaczeniem [dla F w ANOVA] nie jest konieczne. Po pierwsze, hipotezy testowane przez ogólny test i test wielokrotnego porównania są zupełnie inne, z całkiem różnymi poziomami mocy. Na przykład ogólny F faktycznie rozdziela różnice między grupami na liczbę stopni swobody dla grup. Ma to wpływ na rozcieńczenie całości F w sytuacji, gdy kilka średnich grupowych jest sobie równych, ale różni się od innych średnich ”(Howell, 1992, str. 338). Dokładnie taka sytuacja miała miejsce w obecnych eksperymentach, gdzie grupa 50 miała się różnić od grupy 0 i grupy 100, ale nie przewidywano żadnej różnicy między tymi grupami kontrolnymi dla grupy 25 lub grupy 75.
Dane dotyczące poke nosa potwierdziły, że w każdym eksperymencie zwierzęta nabyły związek między CS a perspektywą nagrody sacharozy. Zależność między częstotliwością szturchania nosa dla różnych grup i ogólną częstotliwością nagrody w ramach ich odpowiednich harmonogramów treningowych sugeruje, że średnia stopa nagrody za sacharozę kierowała podejściem wolnym od narkotyków. Jednak brak pośredniczącego wpływu szturchańców nosa na reakcje lokomotoryczne na AMPH w grupie w ANCOVA wskazał, że oddzielne procesy leżą u podstaw dwóch zachowań.
W niektórych przypadkach wpływ harmonogramu kondycjonowania był widoczny w odpowiedzi na pierwszą dawkę AMPH; w innych przypadkach pojawił się dopiero po wielokrotnych dawkach. Różnice grupowe w odpowiedzi lokomotorycznej na pierwszą dawkę AMPH sugerują, że sama ekspozycja na schematy nagród podobne do hazardu wystarcza do wywołania uczulenia. Różnice grupowe w poruszaniu się po wielokrotnych dawkach AMPH wskazują na bardziej subtelny efekt, który można scharakteryzować jako „podatność”, który manifestuje się tylko w połączeniu z ciągłą ekspozycją na główny czynnik uczulający (tj. Amfetaminę).
Różnice w strukturze odpowiedzi między eksperymentami sugerują, że dłuższy odstęp między treningiem a początkową prowokacją AMPH może zmaksymalizować możliwość wykrycia nieodłącznego efektu uczulającego leczenia kondycjonującego. To z kolei sugeruje, że efekty ekspozycji warunkowej nagrody mogą inkubować się w czasie, zjawisko obserwowane również w przypadku uczulenia stymulującego (Grimm i wsp., 2006). Wzorzec odpowiedzi na dwie dawki amfetaminy sugeruje, że dawka 0.5 mg / kg może być bardziej skuteczna w ujawnianiu skutków historii kondycjonowania. To z kolei sugeruje, że efekty warunkujące w ramach obecnego protokołu treningowego są nieco subtelne i mogą być zakamuflowane przez efekty sufitowe w dawkach AMPH i warunki, które generują de novo uczulenie.
W eksperymencie 3 dwufazowy wzór odpowiedzi na dawki 0.5 mg / kg i postępujące pojawienie się wyższości w grupie 50 jest zgodny z oczekiwanym profilem dla szczurów Lewisa w odpowiedzi na metamfetaminę (Camp i wsp., 1994). Potwierdza to słuszność obecnych ustaleń i sugeruje nakładanie się czynników łagodzących podatność na uczulenie psychostymulujące i schematy nagród podobne do hazardu.
We wszystkich eksperymentach reakcja ruchowa po uczuleniu grupy 50 ogólnie przewyższała reakcję innych grup przy różnych dawkach amfetaminy i różnych szczepach zwierząt. Jednak duża zmienność wewnątrz grupy i niewielkie rozmiary efektów międzygrupowych wskazują na rolę innych czynników w reaktywności układu DA na amfetaminę po ekspozycji na różne harmonogramy warunkowej nagrody sacharozy. Chociaż odpowiedzi neuronów DA na sygnały nagradzające mogą stanowić gruboziarnisty model hazardu (Fiorillo i in., 2003), podobnie jak wszystkie modele, następuje utrata informacji na rzecz oszczędności, tj. zademonstrowanie kluczowego procesu. W rezultacie wzorzec efektów w warunkach CS-US w oryginalnym Fiorillo i in. badanie nie jest w pełni uogólnione na odpowiedź ruchową na amfetaminę. Potrzebne są dalsze udoskonalenia modelu, aby w pełni uchwycić aspekty hazardu, które wpływają na działanie systemu DA.
Podsumowując, wyniki tej serii eksperymentów dostarczają tymczasowego wsparcia dla hipotezy, że chroniczne narażenie na podobne do hazardu harmonogramy nagród zwiększa reaktywność układu DA mózgu na prowokację psychostymulującą. Jako takie rozszerzają wyniki Singer i in. (2012) który wykazał, że w stosunku do ustalonego harmonogramu wcześniejsze narażenie na zmienny harmonogram wzmacniania w paradygmacie operacyjnym poprawia późniejszą odpowiedź ruchową na amfetaminę. Mówiąc dokładniej, obecne ustalenia wskazują na niepewność dostarczenia nagrody jako kluczowego czynnika leżącego u podstaw efektów zmiennej nagrody. Wielkość efektów w paradygmacie operantu była znacznie większa niż efekty stwierdzone w obecnych eksperymentach. Może to odzwierciedlać większą chroniczną ekspozycję na aktywność podobną do hazardu (55 vs. dni 15); może odzwierciedlać skutki wymagania od operatora reakcji w celu uzyskania nagrody (tj. roli agencyjnej) zamiast biernego narażenia, jak w niniejszym badaniu. Wydłużenie czasu szkolenia w obecnym paradygmacie pomogłoby rozwiązać te pytania.
Ważność zmiennych harmonogramów wynagrodzeń i posiłków jako modeli hazardu nie może być zebrana z tych eksperymentów. Przyszłe badania, które badają wpływ historii warunkowania na podejmowanie ryzyka w grach hazardowych gryzoni, mogłyby rozwiązać ten problem. Podobnie, zgodność między obecnym uczuleniem behawioralnym a podwyższoną odpowiedzią prążkowia DA na amfetaminę stwierdzoną ostatnio u patologicznych hazardzistów musi czekać na dalsze badania (Boileau i in., 2013). Mikro-dializa mogłaby rozwiązać to pytanie, a przewidywanie oparte na danych ludzkich byłoby takie, że większe uwalnianie DA w „fenotypie hazardu” grupy 50 byłoby najbardziej widoczne w grzbietowym (sensomotorycznym) prążkowiu niż w brzusznym (limbicznym) prążkowiu . Walidacja ekspozycji na zmienną CS + 50% w tych innych paradygmatach potwierdziłaby jej użyteczność jako bona fide eksperymentalny model PG.
Podczas gdy niektóre formy hazardu wyraźnie pociągają za sobą reakcję instrumentalną (np. Automaty do gier), w innych formach hazardu (np. Loteria) związek między akcją (zakupem kuponu, tj. , numery loterii), a sama nagroda (wygrywająca liczba i wypłata pieniężna) jest znacznie bardziej rozproszona. Niemniej jednak aktywacja DA w okresie CS-US może również wystąpić. Może to wyjaśniać, dlaczego po ogłoszeniu „wygrywającej liczby” przykuwa uwagę, ponieważ każda pojedyncza kulka loterii spada, tworząc określoną sekwencję cyfr w wygrywającej liczbie. Chociaż prawdopodobieństwo wystąpienia określonej cyfry jest zdefiniowane matematycznie, wynik dla każdej pojedynczej kuli loterii jest binarny - trafienie (pasuje do numeru gracza) lub pudło (nie pasuje do numeru gracza) - a wynik w jakimkolwiek procesie jest nieznany. Taki scenariusz może lepiej scharakteryzować doświadczenie grupy 50 w obecnych eksperymentach, w których nagroda została zapewniona w sposób przypadkowy, ale także nieprzewidywalny, a CS jedynie wskazywał na potencjał nagrody, nie ujawniając, czy nastąpi to w danym badaniu. Automaty do gry są silniej powiązane z PG niż losy loterii (Cox i in., 2000; Bakken i in., 2009), wskazując na istotną rolę czynników instrumentalnych (i bezpośredniości) w satysfakcjonujących aspektach hazardu w tej populacji (Loba i wsp., 2001). Niemniej jednak proces Pawłowa wzorowany na obecnych eksperymentach (CS + niepewna nagroda) wydaje się być niezbędnym, jeśli nie wystarczającym, elementem gry hazardowej.
Wraz z brakiem wyraźnego wymogu instrumentalnego, wiele innych cech konstrukcyjnych mogło przyczynić się do stosunkowo skromnego i zmiennego wzorca efektów eksperymentalnych. Grupy różniły się całkowitą ekspozycją na sacharozę, a także przypadkowością między CS a nagrodą sacharozy. Chociaż mogło to przyczynić się do zmienności między grupami, nie może łatwo wyjaśnić, dlaczego zwierzęta z największą ekspozycją na sacharozę (grupa 100) wykazywały mniejszą wrażliwość niż grupa 50. Ponadto grupa 0 nie otrzymała żadnego bodźca przed ekspozycją na sacharozę w każdym badaniu. Chociaż wykluczało to oczekiwane nagrodzenie, ale nie kontrolowało obecności bodźca przed dostarczeniem nagrody, które istniało we wszystkich innych grupach. Aby rozwiązać ten problem, przyszłe badania powinny obejmować warunek, w którym zwierzęta otrzymują nagrodę za każdą próbę po losowym narażeniu na neutralny bodziec (tj. Którego obecność nie sygnalizuje potencjału nagrody).
Kolejnym ograniczeniem projektowym jest potencjalne pojawienie się zachowań pomocniczych, które mogą wpłynąć na efekty harmonogramu szkolenia. W obliczu niepewności zwierzęta mogą rozwinąć przesądne zachowania mające na celu poprawę postrzeganej kontroli i ograniczenie aktywacji DA wywołanej niepewnością (por. Harris i in., 2013). Jest zatem możliwe, że niekontrolowane aspekty projektu eksperymentalnego umożliwiły zwierzętom zniwelowanie skutków harmonogramu kondycjonowania. Taki efekt może przyczynić się do stosunkowo skromnej i zmiennej odpowiedzi na amfetaminę w grupie 50 po treningu CS + sacharoza. Przyszłe badania powinny rejestrować spontaniczne zachowania, oprócz szturchańców nosa, podczas sesji treningowych, aby przetestować tę możliwość i kontrolować ją statystycznie, jeśli się pojawi. Ponieważ oczekuje się, że takie zachowanie będzie przeciwdziałać lub tłumić skutki niepewności wywołanej harmonogramem, odpowiedź na lokomotorię w grupie 50 powinna być zwiększona, gdy jest kontrolowana (proceduralnie lub statystycznie). Dlatego też obecny (niekontrolowany) projekt zapewnia konserwatywny test efektów nagrody 50% CS + na uczulenie na amfetaminę.
Pod względem ważności zewnętrznej użycie samców szczurów ogranicza również możliwość uogólnienia wyników. Brak wyraźnego warunku „kary” różni się również od hazardu, w którym duże straty pieniężne są powszechne i wywierają istotne efekty motywacyjne (Nieuwenhuis i in., 2005; Singh and Khan, 2012). Zdolność do gromadzenia nagrody jest również nieobecna w obecnym paradygmacie, a skumulowane wygrane w automatach okazały się oddziaływać na manipulacje DA u ludzi (Tremblay i in., 2011; Smart i in., 2013). Podobnie szansa na wygraną jest ważną różnicą między obecnym modelem a rzeczywistym hazardem.
Pomimo tych ograniczeń, obecne wyniki sugerują, że zmienna nagroda CS + 50% może angażować ścieżki DA związane ze wzmacniającymi efektami hazardu (Fiorillo i in., 2003; Anselme, 2013). Uczulenie krzyżowe odpowiedzi na AMPH zgodnie z harmonogramem podobnym do hazardu jest zgodne z kluczową rolą DA w grach hazardowych i działaniach psychostymulujących (Zack i Poulos, 2009) i rozszerza wcześniejsze badania na temat krzyżowania motywacji do uprawiania hazardu przez AMPH u patologicznych graczy (Zack i Poulos, 2004). Obecne wyniki również pośrednio sugerują, że skromne dawki AMPH, które nie powodują ponadfizjologicznego uwalniania DA, mogą lepiej modelować aktywność mózgu w odpowiedzi na przerywane sygnały nagrody (tj. Podczas hazardu) niż ekspozycja na wysokie (tj. Objadające się) dawki leków pobudzających (por. Vanderschuren i Pierce, 2010). Bezpośrednie wsparcie dla tej korespondencji można uzyskać, oceniając uwalnianie DA w odpowiedzi na 50% zmienny harmonogram CS-US i różne dawki AMPH przy użyciu mikrodializy.
Z eksperymentalnego punktu widzenia zarówno obecny model Pavlovian, jak i poprzedni model zmiennego wzmocnienia operanta wydają się rodzić fenotyp podobny do ludzkiego patologicznego hazardzisty. Jako takie stanowią cenne uzupełnienie gier hazardowych dla gryzoni, które modelują zachowania hazardowe (jako miara zależna), ale do tej pory zatrudniały tylko zdrowe zwierzęta, odpowiedniki ludzkich graczy społecznych. W oparciu o literaturę zwierzęta przewlekle narażone na zmienną nagrodę mogą się znacznie różnić w tych zadaniach, szczególnie w odpowiedzi na leki DA-ergiczne. Połączenie fenotypu hazardu dla szczurów z zadaniami związanymi z hazardem może pozwolić na systematyczne opracowywanie leków do leczenia PG, które mogą nie zostać w pełni zrealizowane tylko u zdrowych zwierząt. Dalsze udoskonalenia eksperymentalnego schematu i schematu treningowego, jak opisano powyżej, powinny poprawić zgodność między zwierzętami wyszkolonymi w tym paradygmacie a rzeczywistymi patologicznymi hazardzistami.
Z kliniczno-socjologicznego punktu widzenia ustalenie, że ekspozycja na 50% zmiennej CS + nagroda, która ściśle odpowiada harmonogramowi nagród na komercyjnym automacie do gry (Tremblay i in., 2011), zmienia system DA mózgu w wiarygodny i trwały sposób, co sugeruje, że w niektórych przypadkach aktywność hazardowa, jak narkotyki, może być „patogenem” zdolnym do uzależnienia. Jednak skromna wielkość efektu i duża zmienność w odpowiedzi na nagrodę 50% CS + sugerują, że podobnie jak narkotyki, tendencja do harmonogramów nagród związanych z hazardem w celu promowania uzależnienia będzie w dużym stopniu zależeć od wcześniej istniejącego profilu ryzyka gracza. Niemniej jednak, aby zaoszczędzić osobom narażonym na wysokie ryzyko narażenia na potencjalne niekorzystne skutki związane z hazardem, wydaje się rozsądne, aby polityki stosowane w celu powstrzymania używania i minimalizowania szkód spowodowanych przez narkotyki mogły zostać rozszerzone również na gry hazardowe.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek powiązań handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowanie
Badania te zostały sfinansowane przez granty kanadyjskiej Rady Nauk Przyrodniczych i Inżynieryjnych dla Paula J. Fletchera. Serdecznie dziękujemy Pani Djurdji Djordjevic za przygotowanie liczb.
Referencje
Anselme, P. (2013). Dopamina, motywacja i ewolucyjne znaczenie zachowań podobnych do hazardu. Behav. Brain Res. 256, 1 – 4. doi: 10.1016 / j.bbr.2013.07.039
APA (2013). Podręcznik diagnostyczny i statystyczny zaburzeń psychicznych, 5th Edn. Arlington, VA: American Psychiatric Publishing.
Bakken, IJ, Gotestam, KG, Grawe, RW, Wenzel, HG i Oren, A. (2009). Zachowania hazardowe i problemy z hazardem w Norwegii 2007. Scand. J. Psychol. 50, 333-339. doi: 10.1111 / j.1467-9450.2009.00713.x
Boileau, I., Payer, D., Chugani, B., Lobo, DS, Houle, S., Wilson, AA, i in. (2013). In vivo dowody na większe uwalnianie dopaminy indukowane amfetaminą w patologicznym hazardie: badanie pozytronowej tomografii emisyjnej z [C] - (+) - PHNO. Mol. Psychiatria doi: 10.1038 / mp.2013.163. [Wydanie elektroniczne przed papierowym].
Bolles, RC (1972). Wzmocnienie, oczekiwanie i nauka. Psychol. Obrót silnika. 79, 394 – 409. doi: 10.1037 / h0033120
Camp, DM, Browman, KE i Robinson, TE (1994). Wpływ metamfetaminy i kokainy na zachowanie motoryczne i pozakomórkową dopaminę w brzusznym prążkowiu szczurów Lewis kontra Fischer 344. brain Res. 668, 180–193. doi: 10.1016/0006-8993(94)90523-1
Conversano, C., Marazziti, D., Carmassi, C., Baldini, S., Barnabei, G. i Dell'Osso, L. (2012). Hazard patologiczny: systematyczny przegląd wyników badań biochemicznych, neuroobrazowych i neuropsychologicznych. Harv. Wielebna Psychiatria 20, 130-148. doi: 10.3109 / 10673229.2012.694318
Cox, BJ, Kwong, J., Michaud, V., i Enns, MW (2000). Problem i prawdopodobny hazard patologiczny: rozważania z ankiety przeprowadzonej przez społeczność. Mogą. J. Psychiatria 45, 548-553.
Dalley, JW, Theobald, DE, Eagle, DM, Passetti, F., i Robbins, TW (2002). Niedobory w kontroli impulsów związane z tonicznie podwyższoną funkcją serotonergiczną w korze przedczołowej szczura. Neuropsychopharmacology 26, 716–728. doi: 10.1016/S0893-133X(01)00412-2
Everitt, BJ i Robbins, TW (2005). Neuronowe systemy wzmacniania uzależnienia od narkotyków: od działań po przyzwyczajenia. Nat. Neurosci. 8, 1481-1489. doi: 10.1038 / nn1579
Fiorillo, CD, Tobler, PN i Schultz, W. (2003). Dyskretne kodowanie prawdopodobieństwa nagrody i niepewności przez neurony dopaminowe. nauka 299, 1898 – 1902. doi: 10.1126 / science.1077349
Flagel, SB, Watson, SJ, Akil, H. i Robinson, TE (2008). Indywidualne różnice w przypisywaniu bodźca motywacyjnego wskazówce związanej z nagrodą: wpływ na uczulenie na kokainę. Behav. Brain Res. 186, 48 – 56. doi: 10.1016 / j.bbr.2007.07.022
Fletcher, PJ, Tenn, CC, Rizos, Z., Lovic, V., i Kapur, S. (2005). Uczulenie na amfetaminę, ale nie PCP, zaburza uważne przesunięcie zestawu: odwrócenie przez agonistę receptora D1 wstrzykniętego do środkowej kory przedczołowej. Psychopharmacology (Berl.) 183, 190–200. doi: 10.1007/s00213-005-0157-6
Flores, G., Wood, GK, Barbeau, D., Quirion, R., i Srivastava, LK (1998). Szczury Lewisa i Fischera: porównanie poziomów transportera dopaminy i receptorów. brain Res. 814, 34–40. doi: 10.1016/S0006-8993(98)01011-7
Frascella, J., Potenza, MN, Brown, LL, i Childress, AR (2010). Wspólne luki w mózgu otwierają drogę do uzależnień od substancji: uzależnienie od rzeźbienia w nowym stawie? Ann. NY Acad. Sci. 1187, 294-315. doi: 10.1111 / j.1749-6632.2009.05420.x
Grimm, JW, Buse, C., Manaois, M., Osincup, D., Fyall, A., i Wells, B. (2006). Zależne od czasu rozłożenie efektów zależnych od dawki kokainy na głód i ruchliwość sacharozy. Behav. Pharmacol. 17, 143 – 149. doi: 10.1097 / 01.fbp.0000190686.23103.f8
Haile, CN, Hiroi, N., Nestler, EJ i Kosten, TA (2001). Różnicowe reakcje behawioralne na kokainę są związane z dynamiką mezolimbicznych białek dopaminy u szczurów Lewis i Fischer 344. Synapse 41, 179 – 190. doi: 10.1002 / syn.1073
Harris, JA, Andrew, BJ i Kwok, DW (2013). Podejście do magazynu podczas sygnału o jedzeniu zależy od warunkowania Pawłowa, a nie instrumentalnego. J. Exp. Psychol. Anim. Behav. Proces. 39, 107 – 116. doi: 10.1037 / a0031315
Howell, DC (1992). Metody statystyczne dla psychologii. Boston, MA: Duxbury.
Ito, R., Dalley, JW, Robbins, TW i Everitt, BJ (2002). Uwalnianie dopaminy w grzbietowym prążkowiu podczas zachowań związanych z poszukiwaniem kokainy pod kontrolą wskazań związanych z narkotykami. J. Neurosci. 22, 6247 – 6253.
Jiao, X., Pare, WP i Tejani-Butt, S. (2003). Różnice naprężeń w rozmieszczeniu miejsc transportujących dopaminę w mózgu szczura. Wałówka. Neuropsychopharmacol. Biol. Psychiatria 27, 913–919. doi: 10.1016/S0278-5846(03)00150-7
Koob, GF i Le Moal, M. (2008). Przejrzeć. Mechanizmy neurobiologiczne procesów motywacyjnych przeciwnika w uzależnieniu. Philos. Trans. R. Soc. Lond. B Biol. Sci. 363, 3113 – 3123. doi: 10.1098 / rstb.2008.0094
Kosten, TA, Miserendino, MJ, Chi, S. oraz Nestler, EJ (1994). Szczepy szczurów Fischera i Lewisa wykazują zróżnicowane działanie kokainy w uwarunkowanych preferencjach miejsca i uczuleniu behawioralnym, ale nie w aktywności ruchowej lub warunkowej niechęci do smaku. J. Pharmacol. Exp. Ther. 269, 137 – 144.
Kosten, TA, Zhang, XY i Haile, CN (2007). Różnice szczepów w utrzymaniu samodzielnego podawania kokainy i ich związek z reakcjami na nowości. Behav. Neurosci. 121, 380 – 388. doi: 10.1037 / 0735-7044.121.2.380
Leeman, RF i Potenza, MN (2012). Podobieństwa i różnice między patologicznym hazardem a zaburzeniami związanymi z używaniem substancji: skupienie na impulsywności i przymusie. Psychopharmacology (Berl.) 219, 469–490. doi: 10.1007/s00213-011-2550-7
Leshner, AI (1997). Uzależnienie jest chorobą mózgu i ma znaczenie. nauka 278, 45 – 47. doi: 10.1126 / science.278.5335.45
Loba, P., Stewart, SH, Klein, RM i Blackburn, JR (2001). Manipulacje cechami standardowych gier terminalu loterii wideo (VLT): efekty u patologicznych i niepatologicznych graczy. J. Gambl. Stadnina. 17, 297 – 320. doi: 10.1023 / A: 1013639729908
Martinez, D., Narendran, R., Foltin, RW, Slifstein, M., Hwang, DR, Broft, A., i in. (2007). Wywoływane przez amfetaminę uwalnianie dopaminy: wyraźnie stępione w uzależnieniu od kokainy i przewidujące wybór samodzielnego podawania kokainy. Rano. J. Psychiatry 164, 622-629. doi: 10.1176 / appi.ajp.164.4.622
Mateo, Y., Lack, CM, Morgan, D., Roberts, DC, i Jones, SR (2005). Zmniejszona końcowa funkcja dopaminy i niewrażliwość na kokainę po samoobsługowym zażyciu kokainy i jej pozbawieniu. Neuropsychopharmacology 30, 1455-1463. doi: 10.1038 / sj.npp.1300687
Nestler, EJ (2001). Molekularne podstawy długotrwałej plastyczności leżącej u podstaw uzależnienia. Nat. Wielebny Neurosci. 2, 119 – 128. doi: 10.1038 / 35053570
Nieuwenhuis, S., Heslenfeld, DJ, von Geusau, NJ, Mars, RB, Holroyd, CB, i Yeung, N. (2005). Aktywność w obszarach mózgu wrażliwych na nagrody jest silnie zależna od kontekstu. Neuroimage 25, 1302-1309. doi: 10.1016 / j.neuroimage.2004.12.043
Pierce, RC i Kalivas, PW (1997). Model obwodów ekspresji uczulenia behawioralnego na psychostymulanty podobne do amfetaminy. Brain Res. Brain Res. Obrót silnika. 25, 192. doi: 10.1016 / S0165-0173 (97) 00021-0
Robbins, TW i Everitt, BJ (1999). Uzależnienie od narkotyków: złe nawyki się sumują. Natura 398, 567-570. doi: 10.1038 / 19208
Robinson, TE, Becker, JB i Presty, SK (1982). Długoterminowe ułatwienie zachowań rotacyjnych indukowanych amfetaminą i prążkowia uwalnianie dopaminy wytwarzane przez jednorazowe narażenie na amfetaminę: różnice płciowe. brain Res. 253, 231–241. doi: 10.1016/0006-8993(82)90690-4
Robinson, TE i Berridge, KC (1993). Neuralna podstawa głodu narkotykowego: teoria uzależnienia motywacyjno-uwrażliwiająca. Brain Res. Brain Res. Obrót silnika. 18, 247 – 291. doi: 10.1016 / 0165-0173 (93) 90013-P
Robinson, TE i Berridge, KC (2001). Uwrażliwienie motywacyjne i uzależnienie. Nałóg 96, 103-114. doi: 10.1046 / j.1360-0443.2001.9611038.x
Singer, BF, Scott-Railton, J., i Vezina, P. (2012). Nieprzewidywalne wzmocnienie sacharyny poprawia reakcję ruchową na amfetaminę. Behav. Brain Res. 226, 340 – 344. doi: 10.1016 / j.bbr.2011.09.003
Singh, V., i Khan, A. (2012). Podejmowanie decyzji w wariantach nagrody i kary za zadanie hazardowe w Iowa: dowód „przewidywania” czy „kadrowania”? Z przodu. Neurosci. 6: 107. doi: 10.3389 / fnins.2012.00107
Skinner, BF (1953). Nauka i ludzkie zachowanie. New York, NY: Free Press.
Smart, K., Desmond, RC, Poulos, CX i Zack, M. (2013). Modafinil zwiększa saldo nagród w grze na automatach u patologicznych graczy o niskiej i wysokiej impulsywności. Neuropharmacology 73, 66 – 74. doi: 10.1016 / j.neuropharm.2013.05.015
Tremblay, AM, Desmond, RC, Poulos, CX i Zack, M. (2011). Haloperidol modyfikuje instrumentalne aspekty hazardu na automatach u patologicznych graczy i zdrowych kontrolek. Nałogowiec. Biol. 16, 467-484. doi: 10.1111 / j.1369-1600.2010.00208.x
Vanderschuren, LJ i Kalivas, PW (2000). Zmiany w transmisji dopaminergicznej i glutaminergicznej w indukcji i ekspresji uczulenia behawioralnego: krytyczny przegląd badań przedklinicznych. Psychopharmacology (Berl.) 151, 99 – 120. doi: 10.1007 / s002130000493
Vanderschuren, LJ i Pierce, RC (2010). Procesy uczulania w uzależnieniu od narkotyków. Curr. Top. Behav Neurosci. 3, 179 – 195. doi: 10.1007 / 7854_2009_21
Vanderschuren, LJ, Schoffelmeer, AN, Mulder, AH i De Vries, TJ (1999). Mechanizmy dopaminergiczne pośredniczące w długotrwałej ekspresji uczulenia narządu ruchu po ekspozycji na morfinę lub amfetaminę. Psychopharmacology (Berl.) 143, 244 – 253. doi: 10.1007 / s002130050943
Verdejo-Garcia, A., Lawrence, AJ i Clark, L. (2008). Impulsywność jako marker podatności na zaburzenia związane z używaniem substancji: przegląd wyników badań wysokiego ryzyka, problematycznych hazardzistów i badań nad powiązaniami genetycznymi. Neurosci. Biobehav. Obrót silnika. 32, 777-810. doi: 10.1016 / j.neubiorev.2007.11.003
Vezina, P. (2004). Uczulenie reaktywności neuronów dopaminowych śródmózgowia i samodzielne podawanie leków stymulujących psychomotorycznie. Neurosci. Biobehav. Obrót silnika. 27, 827-839. doi: 10.1016 / j.neubiorev.2003.11.001
Volkow, ND, Wang, GJ, Fowler, JS, Logan, J., Gatley, SJ, Hitzemann, R., i in. (1997). Zmniejszona prążkowia reakcja dopaminergiczna u detoksykowanych osób uzależnionych od kokainy. Natura 386, 830 – 833. doi: 10.1038 / 386830a0
Volkow, ND, Wang, GJ, Fowler, JS i Tomasi, D. (2012). Układy uzależnień w ludzkim mózgu. Annu. Rev. Pharmacol. Toksykol. 52, 321 – 336. doi: 10.1146 / annurev-pharmtox-010611-134625
Winer, B. (red.). (1971). Zasady statystyczne w projektowaniu eksperymentalnym. Nowy Jork, NY: McGraw-Hill.
Zack, M., i Poulos, CX (2004). Amfetamina stymuluje motywację do hazardu i związanych z nim sieci semantycznych u problematycznych graczy. Neuropsychopharmacology 29, 195-207. doi: 10.1038 / sj.npp.1300333
Zack, M., i Poulos, CX (2009). Równoległe role dopaminy w patologicznym hazardzie i uzależnieniu psychostymulującym. Curr. Drug Abuse Rev. 2, 11 – 25. doi: 10.2174 / 1874473710902010011
Zamudio, S., Fregoso, T., Miranda, A., De La Cruz, F., i Flores, G. (2005). Różnice naprężeń poziomów receptorów dopaminy i zachowania związane z dopaminą u szczurów. Brain Res. Byk. 65, 339 – 347. doi: 10.1016 / j.brainresbull.2005.01.009
Słowa kluczowe: hazard patologiczny, uczulenie, amfetamina, dopamina, niepewność
Cytowanie: Zack M, Featherstone RE, Mathewson S i Fletcher PJ (2014) Chroniczne narażenie na podobny do hazardu harmonogram bodźców predykcyjnych nagrody może promować uczulenie na amfetaminę u szczurów. Z przodu. Behav. Neurosci. 8: 36. doi: 10.3389 / fnbeh.2014.00036
Otrzymano: 01 listopad 2013; Akceptowane: 23 January 2014;
Publikacja internetowa: 11 Luty 2014.
Edytowany przez:
Bryan F. Singer, University of Michigan, USA
Zrecenzowany przez:
Louk Vanderschuren, University of Utrecht, Holandia
Ruud Van Den Bos, Radboud University Nijmegen, Holandia
Patrick Anselme, Uniwersytet w Liège, Belgia
Prawa autorskie © 2014 Zack, Featherstone, Mathewson i Fletcher. To jest artykuł o otwartym dostępie dystrybuowany zgodnie z warunkami Licencja Creative Commons Uznanie autorstwa (CC BY). Używanie, rozpowszechnianie lub powielanie na innych forach jest dozwolone, pod warunkiem, że oryginalni autorzy lub licencjodawcy są uznani i że cytowana jest oryginalna publikacja w tym czasopiśmie, zgodnie z przyjętą praktyką akademicką. Zabronione jest użytkowanie, dystrybucja lub reprodukcja, która nie jest zgodna z niniejszymi warunkami.
* Korespondencja: Martin Zack, Cognitive Psychopharmacology Laboratory, Neuroscience Department, Centre for Addiction and Mental Health, 33 Russell Street, Toronto, ON M5S 2S1, Kanada e-mail: [email chroniony]
 Martin Zack
Martin Zack