Диалоги Clin Neurosci. 2013 Dec;15(4):431-43.
Абстрактные
Несмотря на важность многочисленных психосоциальных факторов, по своей сути, наркомания включает в себя биологический процесс: способность к повторному воздействию наркотического средства, чтобы вызвать изменения в уязвимом мозге, которые приводят к компульсивному поиску и взятию наркотиков, а также к потере контроля над употреблением наркотиков, которые определяют состояние зависимости. Здесь мы рассмотрим типы молекулярных и клеточных адаптаций, которые происходят в определенных областях мозга, чтобы опосредовать связанные с наркоманией поведенческие аномалии. К ним относятся изменения в экспрессии генов, достигаемые частично посредством эпигенетических механизмов, пластичность в нейрофизиологическом функционировании нейронов и синапсов и связанная с ними пластичность в нейронной и синаптической морфологиях, опосредованно, частично, изменением сигналов нейротрофического фактора. Каждый из этих типов индуцированных лекарственными средствами модификаций можно рассматривать как форму «клеточной или молекулярной памяти». Более того, поразительно, что большинство форм пластичности, связанных с зависимостью, очень похожи на типы пластичности, которые были связаны с более классическими формами «поведенческой памяти», возможно, отражая конечный репертуар адаптивных механизмов, доступных нейронам при столкновении с окружающей средой вызовы. Наконец, связанные с зависимостью молекулярные и клеточные адаптации включают в себя большинство тех же областей мозга, которые опосредуют более классические формы памяти, согласующиеся с мнением о том, что аномальные воспоминания являются важными факторами синдромов зависимости. Цель этих исследований, направленных на разъяснение молекулярной и клеточной основы наркомании, заключается в том, чтобы в конечном итоге разработать биологические диагностические тесты, а также более эффективное лечение расстройств зависимости.
Введение
Наркомания, которая может быть определена как принудительный поиск и прием лекарств, несмотря на ужасные последствия или потерю контроля над употреблением наркотиков, вызвана длительными изменениями, вызванными лекарственными средствами, которые происходят в определенных областях мозга.1 Однако некоторые люди склонны к наркомании в условиях многократного воздействия наркотиков, в то время как другие способны случайно употреблять наркотик и избегать синдрома наркомании. Генетические факторы составляют примерно 50% этой индивидуальной изменчивости уязвимости, связанной с зависимостью, и эта степень наследуемости сохраняется для всех основных классов наркотических веществ, включая стимуляторы, опиаты, алкоголь, никотин и каннабиноиды.2 До сих пор не удалось идентифицировать большинство генов, которые составляют этот генетический риск, вероятно, из-за участия, возможно, сотен генетических вариаций, суммирующих в одном отдельном человеку, чтобы укрепить уязвимость к наркомании (или, в случае других людей, устойчивость).
Остальные 50% риска зависимости связаны с множеством факторов окружающей среды, возникающих на протяжении всей жизни, которые взаимодействуют с генетическим составом человека, делая его или ее уязвимыми для зависимости в большей или меньшей степени. Несколько типов факторов окружающей среды были вовлечены в зависимость, включая психосоциальные стрессы, но, безусловно, самым сильным фактором является воздействие самого наркотического вещества. Было показано, что некоторые «входные» наркотики, в частности, никотин, увеличивают уязвимость человека перед зависимостью от другого наркотика.3 Более того, все больше доказательств того, что, несмотря на ряд генетических рисков для зависимости среди населения, воздействие достаточно высоких доз препарата в течение длительных периодов времени может превратить того, кто имеет относительно более низкую генетическую нагрузку на наркомана.4
За последние два десятилетия был достигнут большой прогресс в выявлении как дискретных областей мозга, которые важны для опосредования синдрома зависимости, так и типов изменений на молекулярном и клеточном уровнях, которые наркотики стимулируют в этих регионах, чтобы лежать в основе ключевых аспектов наркомании.1,5 Цепь, которая получила наибольшее внимание, упоминается как мезолимбическая система допамина, которая включает дофаминовые нейроны в брюшной тегментальной области (VTA) среднего мозга, иннервирующие средние колючие нейроны в ядре accumbens (NAc, часть вентрального полосатого тела). Эти нейроны VTA также иннервируют многие другие области переднего мозга, включая гиппокамп, миндалину и префронтальную кору (PFC).
Имеет смысл рассмотреть эти наркотические механизмы наркомании в этом объеме памяти по трем перекрывающимся причинам.6
- Во-первых, все индуцированные лекарством адаптации можно рассматривать как типы «молекулярной или клеточной памяти»: нервная клетка, подвергающаяся таким изменениям, различна в результате воздействия лекарственного средства и, следовательно, реагирует по-разному на тот же самый препарат, к другим лекарственным средствам или к множеству других стимулов в результате.
- Во-вторых, интересно, что многие, возможно, большинство, типы изменений, которые были связаны с состоянием зависимости (например, измененная транскрипция генов, эпигенетика, синаптическая и цельноклеточная пластичность и морфология нейронов и нейротрофические механизмы) также причастны к традиционным формам «поведенческой памяти», таким как пространственная память, обуздание страха и обусловливание оперантами, среди прочих.
- В-третьих, среди областей мозга, пораженных наркотиками, злоупотребляют те, которые являются ключевыми нейронными субстратами для поведенческой памяти, включая гиппокамп, миндалину и ПФУ. Это совпадает с возрастающей реализацией того, что некоторые из наиболее важных особенностей склонности, наблюдаемых клинически (например, тяга к лекарственным средствам и рецидив), отражают отклонения в традиционных схемах памяти, с многолетним воспоминанием о наркотическом опыте, служащем мощными драйверами патологии зависимости.4,7,8 И наоборот, области вознаграждения мозга (например, VTA и NAc) сильно влияют на поведенческую память.
В этой статье представлен обзор основных типов молекулярных и клеточных изменений, которые происходят в нескольких областях мозга на животных моделях зависимости, концентрируясь на ядре accumbens, для которого в настоящее время имеется большая часть информации. Важно отметить, что все чаще можно было подтвердить некоторые из этих изменений у людей, употребляющих наркотики, на основе исследований посмертных мозгов. Несмотря на то, что наркотики злоупотребления имеют различные химические структуры и действуют на различные белковые мишени, поразительно, что многие важные связанные с зависимостью адаптации являются общими для многих, а в некоторых случаях и всех, наркотиками злоупотребления и, вероятно, способствуют совместным функциям синдром наркомании.4,9 Напротив, многие другие адаптированные к лекарственным средствам адаптации являются специфическими для данного препарата и могут опосредовать более уникальные аспекты данной зависимости. Мы фокусируемся здесь на стимуляторах и опиатных наркотиках, которые оказывают более драматическое воздействие на модели животных по сравнению с другими лекарственными средствами. Мы также выделим важные области для будущих исследований, которые еще больше увеличат наши знания о синдромах зависимости и переведут эти достижения в улучшенные диагностические тесты и лечение.
Транскрипционные и эпигенетические механизмы
Знания, что наркоманы могут оставаться повышенным риском рецидива, несмотря на то, что годы воздержания означают, что зависимость связана с вызванными наркотиками изменениями в мозге, которые могут быть очень стабильными. Это привело несколько групп к рассмотрению изменений в экспрессии генов как важного компонента процесса зависимости (Рисунок 1). Соответственно, исследования генов-кандидатов или исследований генома с участием микрочипов ДНК и более позднего РНК-seq (высокопроизводительное секвенирование экспрессируемых РНК) выявил многочисленные гены, экспрессия которых изменяется в данной области мозга в моделях грызунов и приматов наркомании и у людей-наркоманов (например, ref 10-17). Примеры таких генов обсуждаются в последующих разделах этого обзора.
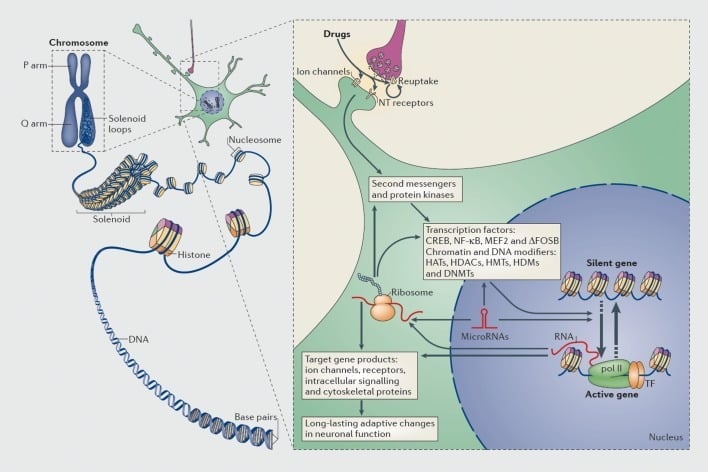
Механизмы транскрипционной и эпигенетической регуляции наркотиками. В эукариотических клетках ДНК организуют путем обертывания вокруг гистоновых октомеров с образованием нуклеосом, которые затем дополнительно организуются и конденсируются с образованием хромосом (левая часть). Только путем временного распутывания уплотненного хроматина ДНК ДНК определенного гена может быть доступна для транскрипционного механизма. Препараты злоупотребления действуют через синаптические мишени, такие как механизмы обратного захвата, ионные каналы и рецепторы нейротрансмиттеров (NT) для изменения внутриклеточных сигнальных каскадов (правая часть). Это приводит к активации или ингибированию транскрипционных факторов (TF) и многих других ядерных мишеней, включая хроматин-регуляторные белки (показаны толстыми стрелками); подробные механизмы, участвующие в синаптической регуляции хроматин-регуляторных белков, остаются недостаточно понятными. Эти процессы в конечном итоге приводят к индукции или репрессии конкретных генов, в том числе к не кодирующим РНК, таким как микроРНК; измененная экспрессия некоторых из этих генов может, в свою очередь, дополнительно регулировать транскрипцию гена. Предполагается, что некоторые из этих индуцированных лекарственными средствами изменений на уровне хроматина являются чрезвычайно стабильными и, следовательно, лежат в основе долговременного поведения, которое определяет зависимость. CREB, циклический AMP-чувствительный элемент, связывающий белок; DNMT, ДНК-метилтрансферазы; HAT, гистон-ацетилтрансферазы; HDACs, гистондеацетилазы; HDM, гистоновые деметилазы; ГМТ, гистон-метилтрансферазы; MEF2, специфичный для миоцитов фактор энхансера 2; NF-kB, ядерный фактор-KB; pol II, РНК-полимераза II. Воспроизводится из ссылки 44: Robison AJ, Nestler EJ. Транскрипционные и эпигенетические механизмы зависимости. Nat Rev Neurosci. 2011; 12: 623-637.
Аналогичным образом, многие типы факторов транскрипции - белки, которые связываются с регуляторными регионами генов и тем самым увеличивают или уменьшают транскрипцию этих генов, - были вовлечены в опосредование долгосрочных эффектов наркомании на экспрессию генов в мозге, Важными примерами являются CREB (связывающий белок cAMP-ответа), ΔFosB (фактор транскрипции семейства Fos), NFkB (ядерный фактор kB), MEF2 (фактор увеличения миоцитов-2) и глюкокортикоидные рецепторы, среди ряда других.5,10,18–22 Становилось все более возможным понять клеточные сигнальные пути, посредством которых наркотики, вызывающие злоупотребление, активируют данный фактор транскрипции в мозге, и причинно связать такую активацию с генами-мишенями этого фактора транскрипции и с конкретными поведенческими аспектами зависимости (см. Рисунок 1). Этот прогресс иллюстрируется рассмотрением CREB и ΔFosB, которые являются наиболее изученными факторами транскрипции в моделях зависимости.
cAMP-связывающий белок
Стимулятор и опиатные наркотики активируют CREB в нескольких областях мозга, важных для наркомании, в том числе в NAc.23,24 Известно, что CREB активируется в других системах cAMP, Ca2+, и пути роста факторов,25 и пока не известно, какая из них опосредует его активацию в NAc наркотиками злоупотребления. Показано, что активация лекарственного средства CREB в NAc представляет собой классический механизм отрицательной обратной связи, посредством чего CREB служит для снижения чувствительности животного к положительным эффектам этих препаратов (толерантность) и опосредует негативное эмоциональное состояние во время отмены наркотиков (зависимость).18,26,27 Эти эффекты были недавно продемонстрированы, чтобы стимулировать самолечение и рецидивы наркотиков, предположительно, через процесс отрицательного подкрепления.28 Эти действия CREB, по-видимому, включают в себя как основные подтипы средних колючих нейронов NAc, те, которые экспрессируют преимущественно D1 против D2 дофаминовые рецепторы.24 IНесмотря на то, что большое количество литературы показало, что CREB, действуя в гиппокампе и амигдале, является ключевой молекулой в поведенческой памяти.29–31 Эта широкая роль в зависимости и поведенческой памяти, вероятно, отражает тот факт, что нейроны проникнуты конечным числом молекулярных механизмов, с помощью которых можно адаптироваться к постоянно меняющейся среде.
Целевые гены для CREB, которые опосредуют этот поведенческий фенотип, были идентифицированы с помощью анализа генома, а также более конкретных усилий.10,18,32 Одним из примеров является опиоидный пептид динорфин: стимуляция индукции экспрессии динорфина в нейронах NAc, опосредованная через CREB, увеличивает активацию диморфина k опиоидных рецепторов на VTA допамин-нейронах и тем самым подавляет допаминергическую передачу в NAc и нарушает награду.18 Было показано, что несколько других целей CREB имеют важное значение для индуцированной лекарством синаптической пластичности, как обсуждается ниже. В то время как CREB также активируется в нескольких других областях мозга стимуляторами и опиатами,23,24 меньше известно о поведенческих последствиях этого эффекта и о генах-мишенях, через которые они возникают. Точно так же мало известно о роли CREB в посредничестве других наркотиков, вызывающих злоупотребление.19
ΔFosB
Острая подверженность практически любому препарату злоупотребления вызывает все факторы транскрипции семейства Fos в NAc и ряде других областей мозга. Эта индукция протекает быстро, но также очень кратковременно, при этом уровни белка Fos возвращаются в норму в течение 8 до 12 часов. Уникальным среди этих белков семейства Fos является ΔFosB, усеченный продукт гена FosB, который в силу своей необычной стабильности постепенно накапливается в ходе повторного воздействия препарата и становится преобладающим белком Fos, выраженным в этих условиях.22,33 Более того, из-за этой стабильности уровни ΔFosB сохраняются в течение недель после отмены препарата. Такая хроническая индукция ΔFosB была продемонстрирована практически для всех наркотиков злоупотребления34 и для большинства лекарств является селективным для нейронов NA-типа типа D1.34,35 Он также демонстрируется у людей, употребляющих наркотики.35 Большой объем литературы показал, что такая индукция ΔFosB в D1-нейроны NAc типа увеличивают чувствительность животного к лекарству, а также естественные награды и способствуют самостоятельному введению лекарства, предположительно, посредством процесса положительного подкрепления (см. ссылки 34 на 38). Интересно, что индуцирование лекарством ΔFosB в NAc является более драматичным у подростков-подростков, время большей уязвимости к наркомании,39 и его индукция никотином, как было показано, опосредует усиление кокаинового вознаграждения, похожее на шлюз никотина..40
Что касается CREB, многочисленные гены-мишени для ΔFosB были идентифицированы в NAc с использованием генов-кандидатов и геномных подходов.10,32 В то время как CREB индуцирует динорфин, ΔFosB подавляет его, что способствует положительному эффекту ΔFosB..38 Другой целью ΔFosB является cFos: поскольку ΔFosB накапливается с повторным воздействием лекарственного средства, он подавляет c-Fos и вносит свой вклад в молекулярный переключатель, посредством которого ΔFosB избирательно индуцируется в хроническом лекарственном отношении.41 Было показано, что многие другие мишени ΔFosB опосредуют способность некоторых лекарств злоупотребления индуцировать синаптическую пластичность в NAc и связанные с ними изменения дендритной арборизации средних колючих нейронов NAc, как будет обсуждаться ниже.
Функциональные последствия индукции ΔFosB в других областях мозга менее понятны, хотя его индукция в орбитофронтальной коре (ОФК) изучена более подробно. Здесь ΔFosB опосредует толерантность, которая возникает к когнитивно-разрушающим эффектам кокаина во время хронического воздействия, и эта адаптация связана с повышенным самообслуживанием кокаина.42,43
Анализ генома показал несколько потенциальных генов-мишеней, которые опосредуют эти эффекты.42 Несмотря на уникальные временные свойства ΔFosB и знание о том, что она индуцируется в традиционных схемах памяти (например, в гиппокампе), еще не проводилось исследование роли ΔFosB в поведенческой памяти, что является интересным предметом для будущих исследований.
Эпигенетические механизмы
В последние годы исследования транскрипции были продвинуты на один шаг дальше к эпигенетике44 (См. Рисунок 1), который может быть широко определен как изменение экспрессии генов, которое происходит в отсутствие изменения последовательности ДНК. Эпигенетические механизмы контролируют упаковку ДНК в ядре клетки через ее взаимодействия с гистонами и многими другими типами ядерных белков, которые вместе содержат хроматин. Экспрессия гена контролируется состоянием этой упаковки путем ковалентной модификации гистонов, других белков и самой ДНК. Как только некоторые примеры, ацетилирование гистонов имеет тенденцию стимулировать активацию генов, метилирование гистонов может либо способствовать активации гена или репрессии в зависимости от остатка Lys, подвергающегося этой модификации, и метилирование ДНК обычно связано с репрессией генов, хотя некоторые варианты форм метилирования ( например, 5-гидроксиметилирование) могут быть связаны с активацией гена.
Эпигенетика является привлекательным механизмом, потому что в других системах, например биологии развития и рака, некоторые эпигенетические модификации могут быть постоянными. По этой причине, эпигенетика преследовалась как в моделях обучения, так и в памяти (например, refs 45-48), а также в зависимости;44,49 в обеих системах сообщалось о глубоких изменениях в ацетилировании и метилировании гистонов и в метилировании ДНК. Как только один пример, гистон-метилтрансфераза, G9a, участвует в обеих памяти50 и зависимость.51,52 В моделях зависимости, Выражение G9a ограничено в NAc в ответ на стимулятор или опиатные наркотики злоупотребления и tего было показано, чтобы повысить полезность этих препаратов.51,52 Интересно, что подавление кокаина G9a опосредуется ΔFosB. G9a катализирует диметилирование Lys9 гистона H3 (H3K9me2), основного медиатора регенерации генов. ChIP-чип или ChIP-seq (иммунопреципитация хроматина, соответственно, с помощью промоторных чипов или высокопроизводительное секвенирование) были использованы для получения геномных карт генов в NAc, которые отображали измененный H3K9me2 после воздействия стимулятора или опиума.32,52,53 Путем перекрытия этих списков генов с геномическими списками изменений экспрессии генов и с картами генома многих других форм эпигенетических модификаций (например, связывание с FosB, связывание CREB, другие модификации гистонов и т. Д.),32,53 должно быть возможно идентифицировать все более полный набор генов, которые регулируются наркотиками злоупотребления и для понимания лежащих в его основе эпигенетических механизмов.
Другой формой эпигенетической регуляции, связанной с памятью и наркоманией, является генерация микроРНК. Эти небольшие некодирующие РНК связываются с комплементарными областями мРНК и тем самым подавляют их трансляцию или индуцируют их деградацию. Удаление Argonaut, белка, необходимого для обработки miRNAs, изменяет поведенческие реакции на кокаин, с различными эффектами, наблюдаемыми для средних колючих нейронов D1- или D2.54 Аналогично показано, что несколько специфических miRNAs регулируются воздействием лекарственного средства и, в свою очередь, влияют на поведенческие реакции на наркотики (например, ref 55,56). В будущих исследованиях будет интересно выявить мишеней мРНК этих миРНК и охарактеризовать, как они влияют на процесс зависимости.
Синаптическая пластичность
Аналогичные общие типы синаптических модификаций в глутаматергических синапсах, которые были замечены в гиппокампе и амигдале в поведенческой памяти (см. Другие статьи в этом выпуске), аналогичным образом проявляются в областях вознаграждения мозга в моделях зависимости и важны для опосредования процесс наркомании.57,58 Такая индуцированная лекарством синаптическая пластичность была описана в нескольких областях мозга, однако мы концентрируемся здесь на NAc, где большая часть исследований была сфокусирована на сегодняшний день (Рисунок 2).
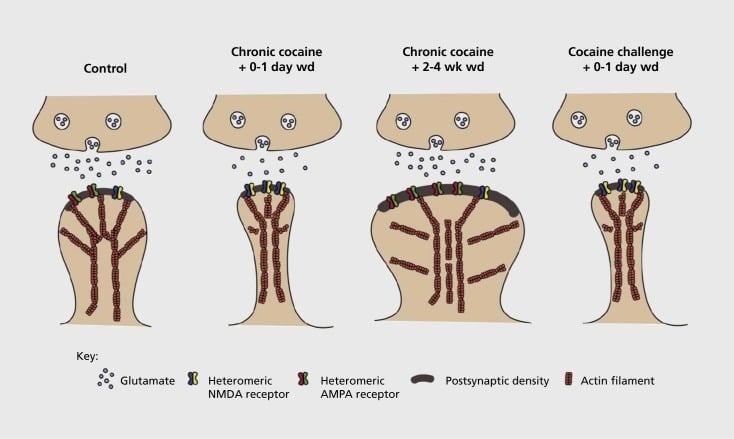
Модель связанной с зависимостью синаптической и структурной пластичности в ядре accumbens (NAc). Хроническое воздействие кокаина приводит к временной и переходной реорганизации рецепторов глутамата α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (AMPA) и N-метил-D-аспарагиновой кислоты (NMDA) на среде NAc колючий нейрон (MSN), а также структурные изменения в головке позвоночника NAc MSN, которые коррелируют с различными формами синаптической пластичности. Например, хронический кокаин индуцирует поверхностную экспрессию рецепторов NMDA, тихий синапс и долгосрочную депрессию (LTD) в моменты раннего времени отсрочки. При более длительном изъятии (wd) эти синаптические изменения обращаются, в результате увеличивается экспрессия поверхностных рецепторов AMPA, консолидация синапса в позвоночник грибовидной формы и долгосрочное потенцирование (LTP). Эти эффекты быстро возвращаются снова при воздействии непропорциональной дозы кокаина, что приводит к реструктуризации позвоночника в тонкие шипы и снижению синаптической силы.
Первоначальные эксперименты показали, что повторное воздействие раздражающих препаратов, вызывающих злоупотребление, индуцирует LTD (долгосрочное депрессивное) состояние в глутаматергических синапсах в NAc.59 Однако более поздняя работа продемонстрировала, что такая пластичность является очень зависящей от времени, причем LTD происходит рано после того, как последнее воздействие на кокаин развивается в большей степени, чем LTP (долгосрочное потенцирование), как более длительное время от времени.60,61 Эта работа, которая на сегодняшний день была проведена в основном с использованием исследователя, находящегося в ведении, в отличие от самообслуживаемых лекарств, определила необходимость более систематических исследований в моделях самообучения, которые отслеживают формы синаптической пластичности, которые происходят при глутаматергических синапсах в NAc на протяжении детального курса времени от приобретения самоуправления до его поддержания, в разное время ухода и вымирания, а также в ответ на стимулы, вызывающие рецидив. Работа на сегодняшний день также определила некоторые молекулярные механизмы, которые вносят вклад в эту синтетическую пластичность, индуцированную лекарством, включая торговлю рецепторами AMPA с синапсом, возможно, опосредованно частично через CaMKII (Ca2+/ кальмодулинзависимая протеинкиназа II) фосфорилирование некоторых субъединиц рецептора AMPA, а также измененная экспрессия субъединиц рецептора AMPA (например, 60,62-65, Цифры 2 и 3). Роль CREB и ΔFosB связана с этими явлениями, а также с соответствующими изменениями в морфологии глутаматергических синапсов (см. Ниже). Например, GluAl является мишенью для CREB в NAc, где GluA2 и CaMKII являются одновременно мишенями ΔFosB, в этой области мозга .35,36,66,67 Двигаясь вперед, важно связать конкретные адаптации с зависящими от времени изменениями синаптической функции и поведенческими особенностями зависимости.
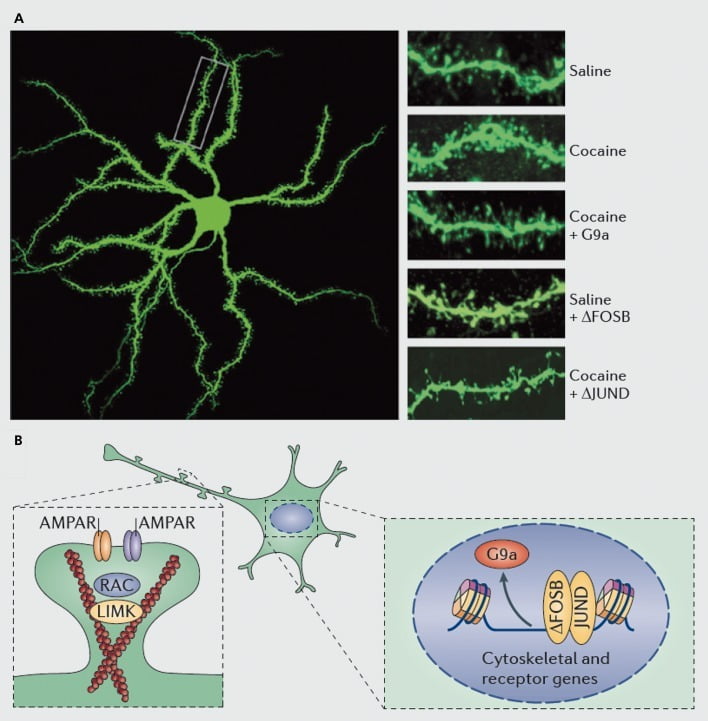
Молекулярные механизмы, лежащие в основе индукции кокаином дендритных шипов на средних шиповатых нейронах прилежащего ядра (NAc). A) демонстрирует индуцированное кокаином увеличение числа дендритных шипов, которое может быть заблокировано вирусной сверхэкспрессией G9a или JunD (антагонист AP1-опосредованной транскрипции) или имитировано вирусной сверхэкспрессией FosB. B) Было показано, что регуляция транспорта рецептора AMPA (AMPAR) и актинового цитоскелета (слева), а также регуляция транскрипции рецепторов глутамата и регуляторных белков актина (например, опосредованная через ΔFosB, справа) играет важную роль. в посредничестве кокаина в регуляции плотности дендритных шипов NAc. UMK, киназа домена LIM; RAC, Ras-связанный субстрат ботулотоксина C3.
Новые экспериментальные инструменты позволяют в первый раз с высокой точностью определить, какие конкретные схемы отображают эти формы синаптической пластичности и какие поведенческие аномалии они опосредуют. Например, tон и основные субрегионы NAc демонстрируют различия в индуцированной лекарством синаптической пластичности, а также средние колючие нейроны D1- или D2 в каждой подобласти.60,63,64,67 Аналогичным образом, оптико-экспериментальные эксперименты дали новое представление о вкладе конкретной формы синаптической пластичности (например, LTD) в конкретные популяции глутаматергических синапсов в NAc, например, из медиальной PFC по сравнению с базалокальной амигдалой по сравнению с вентральной суббукулой (основной выход гиппокампа).68–70 В конце концов, необходимо будет наложить вызванные лекарствами молекулярные адаптации в каждом из этих афферентных нейронов с адаптациями, специфичными для синапсов, которые происходят в их постсинаптических дендритах, чтобы составить полное представление о том, как наркотики, вызывающие злоупотребление, изменяют схему мозга, чтобы управлять определенными аспектами зависимое состояние. Это усилие потребует большей оценки индуцированной лекарствами пластичности тормозных синапсов в тех же самых областях мозга, области, которой до сих пор уделялось очень мало внимания.65
Цельная клеточная пластичность
В то время как большинство исследований, связанных с нейрофизиологическими изменениями нейронов в явлениях злоупотребления наркотиками, как в явлениях обучения и памяти, было сосредоточено на синаптической пластичности, все больше свидетельствуют о важности пластичности целых клеток. Пластическая пластичность всего тела, также называемая гомеостатической пластичностью,71 включает изменения внутренней возбудимости всей нервной клетки таким образом, что она не является синаптической. Учитывая, что некоторые особенности наркомании включают повышенную или уменьшенную чувствительность к лекарственному средству, имеет смысл, что усиленная или уменьшенная электрическая возбудимость некоторых нервных клеток способствует этим поведенческим приспособлениям.5
Ассоциация наиболее убедительным примером пластичности целых клеток к наркотику злоупотребления является способность хронических опиатов повышать внутреннюю возбудимость норадренергических нейронов локуса coeruleus (LC).72 Эта повышенная возбудимость опосредуется через CREB и его индукцию определенных изоформ аденилилциклазы, которые приводят к увеличению обжига LC нейронов, возможно, за счет индукции каналов Na +.72–75 Эта гипервозбудимость ЖК-нейронов представляет собой классический механизм толерантности и зависимости и приводит к некоторым признакам и симптомам снятия опиатов. Интересно, что CREB опосредует аналогичную форму цельной клеточной пластичности в средних колючих нейронах NAc, которые также оказываются сверхвозбужденными при хроническом воздействии на наркотики злоупотреблением через CREB.76 Поэтому в будущих исследованиях будет важно понять, как CREB-опосредованная синаптическая пластичность глутаматергических синапсов на средних колючих нейронах NAc65,66 суммирует с CREB-опосредованной внутренней гипервозбудимостью этих нейронов76 для контроля поведенческих особенностей зависимости.
Другим примером пластичности цельной клетки в моделях зависимости является гипервозбудимость нейронов дофамина VTA, которая возникает после хронического воздействия опиатных препаратов abusи (Рисунок 4).77,78 Эта адаптация, которая была связана с морфологическими изменениями в этих нервных клетках (см. Следующий раздел), не опосредована CREB, а достигается посредством регулирования нейротрофических сигнальных каскадов, как описано ниже.

Рабочая модель хронических модификаций, индуцированных морфином, в дофаминовых нейронах вентральной тегментальной области (VTA). Хронический морфин снижает размер домы VTA допамина (DA), но увеличивает возбудимость нейронов, в то время как передача дофамина в ядро accumbens снижается. Чистый эффект морфина - это менее отзывчивый путь вознаграждения, т. Е. Поощрение толерантности. Подавление сигнализации IRS2-AKT в VTA опосредует эффекты хронического морфина на размер сомы и электрическую возбудимость; влияние на возбудимость опосредуется снижением токов A γ-аминомасляной кислоты (ГАМК) и подавлением экспрессии K 'канала, Морфиновое индуцированное снижение активности mTORC2 в VTA имеет решающее значение для этих морфино-индуцированных морфологических и физиологических адаптаций, а также для поощрительной толерантности. В отличие от mT0RC2, хронический морфин увеличивает активность mTORCI, что не влияет на эти модифицированные морфием адаптации. BDNF, нейротрофический фактор мозга; IRS, вещество рецептора инсулина; mTORC, mTOR complex; AKT, протеинкиназа B Воспроизводится из ref 77
Морфологическая пластичность и нейротрофические механизмы
Увеличение доказательств, в основном из исследований гиппокампа и церебральных кортикальных нейронов, показало, что изменения синаптической пластичности связаны с морфологическими изменениями в синапсах. Например, LTD и генерация тихих синапсов связаны с образованием тонких или коротких дендритных шипов, тогда как LTP ассоциируется с более крупными грибными шипами.79,80 Таким образом, интересно, что область злоупотребления наркотиками была сосредоточена на вызванных лекарствами изменениях дендритных шипов более 15 лет. Хроническое воздействие стимуляторы злоупотребления повышают плотность дендритного позвоночника средних колючих нейронов NAc, что преобладает для нейронов Dl-типа.67,81,82 Индукция шипов ассоциируется в основном с сенсибилизированными поведенческими реакциями на эти препараты, хотя некоторые данные противоречат этой точке зрения.
Однако, как и при исследованиях синаптической пластичности, требуется гораздо больше работы для системного определения изменений дендритных шипов, которые происходят во время курса лечения, отмены и рецидива наркотиков. Sна сегодняшний день, с участием исследуемого и самостоятельно вводимого лекарственного средства, предлагают очень разные изменения позвоночника, происходящие в разные моменты времени отрыва, а также в оболочках NAc и основных субрегионах.83–86 Также важно определить точные молекулярные механизмы, с помощью которых кокаин или другой стимулятор вырабатывают эти зависящие от времени и специфические эффекты клеточного типа. Показано, что ΔFosB является необходимым и достаточным для индукции незрелых шипов на нейронах NAc типа Dl.35,51,67 Такое регулирование происходит в сочетании с регуляцией кокаина и ΔFosB нескольких белков, которые, как известно, контролируют реорганизацию актинового цитоскелета. Как только один пример, транскрипционная регуляция нескольких факторов обмена гуанинового нуклеотида и активирующих GTPase белков, Rac1, небольшая GTPase, для кратковременного снижения активности в ответ на каждое воздействие кокаина и такое пульсирующее снижение активности Rac1 было показано с использованием оптогенетического контроля Rac1, чтобы опосредовать индукцию незрелых шипов.87 Эти эффекты Racl предположительно происходят через его контроль над кофилином и другими регуляторными белками актина, которые также, как было показано, опосредуют регулирование кокаина роста позвоночника.87,88 Однако важно подчеркнуть, что это всего лишь один из путей, участвующих в регуляции кокаином незрелых шипов, поскольку было показано, что несколько других белков также играют важную роль, включая CDK5 (циклин-зависимая киназа-5), CaMKII, NFkB. , MEF2, CREB, G9a и DNMT3 (ДНК-метилтрансфераза 3a), и это лишь некоторые из них.20,21,35,51,67,89,90 Интересно, что регулирование кокаина нескольких из этих генов, включая индукцию CDK5, CaMKII и NFkB, и подавление G9a, также опосредуется через ΔFosB.20,35,51,91
Удивительно, что опиатные наркотики злоупотребляют противоположным эффектом и уменьшают плотность дендритного позвоночника средних колючих нейронов NAc.81 Мало что известно о поведенческих последствиях этой адаптации и лежащих в ее основе молекулярных механизмах. Это явление, однако, удивительно, учитывая, что CREB и ΔFosB индуцируются как стимуляторами, так и опиатами и оба участвуют в стимуляции, индуцированной стимуляцией NAc дендритной плотности позвоночника. Это ставит вопрос о том, как опиаты подавляют плотность позвоночника NAc, несмотря на их индукцию этих факторов.
Другой основной формой морфологической пластичности, наблюдаемой в моделях злоупотребления наркотиками, является физическое снижение размера сотовой ячейки нейронов VTA допамина, индуцированное хроническим опиатным введением.77,92,93 Подобная адаптация происходит в ответ на каннабиноиды.94 Эта усадка нейронов допамина VTA, которая возникает при самообмене опиатов93 и был зарегистрирован в людях, страдающих от героина, рассматриваемых postmortem,77 как представляется, опосредует точность вознаграждения и связан с сокращением допамина в NAc. Значительные доказательства теперь указывают на то, что это уменьшение размера сотовой клетки опосредуется подавлением опиатов экспрессии нейротрофического фактора мозга (BDNF) в этих нейронах. Мы непосредственно связали этот вывод опиатов с изъятием поддержки BDNF и усадкой нейрона VTA для снижения активности сигнальных каскадов нисходящего потока BDNF в нейронах допамина VTA, в частности, сниженной активности IRS2 (субстрат рецептора инсулина-2), AKT (серин-треонин киназа) и TORC2 (мишень рапамицина-2, которая нечувствительна к рапамицину).77,93 Мы также связали эту подавляющую сигнализацию BDNF непосредственно с повышенной возбудимостью, которую морфин индуцирует в этих нейронах, как отмечалось ранее.77,78 Действительно, уменьшенный размер сотовой соты и повышенная возбудимость тесно связаны, поскольку индукция одного приводит к другому и наоборот. Этот контроль над возбудимостью клеток связан с подавлением K+ каналов и ГАМКA тока в этих нейронах.
Эта роль для BDNF в контроле ответов морфина на уровне VTA контрастирует с его очень различным участием в действиях кокаина и других стимуляторов. Стимуляторы индуцируют BDNF-сигнализацию NAc, что объясняется увеличением местного синтеза BDNF, а также увеличением высвобождения из нескольких афферентных областей.95 Более того, повышенная сигнализация BDNF в NAc, но не в VTA, как было показано, способствует поведенческим эффектам этих препаратов, включая их самоуправление.95,96 Противоположная регуляция передачи сигналов BDNF в пути VTA-NAc опиатами по сравнению со стимуляторами повышает вероятность того, что такие различия опосредуют противоположную регуляцию лекарствами дендритных шипов NAc, возможность в настоящее время исследуется.
Будущие направления
В приведенном выше повествовании подчеркиваются огромные успехи, достигнутые в понимании молекулярных и клеточных адаптаций, происходящих в регионах вознаграждения мозга в ответ на повторное облучение наркотиками, и в связи с индивидуальными адаптациями к определенным поведенческим особенностям синдромов зависимости на животных моделях , Несмотря на эти успехи, остаются серьезные вопросы. Большинство наших существующих знаний сосредоточено на VTA и NAc, причем гораздо меньше информации о других ключевых лимбических областях мозга, которые также имеют решающее значение для наркомании. Кроме того, все экспериментальные демонстрации причинно-следственной роли молекулярно-клеточной адаптации в связанном с наркотиками поведении управляли индивидуальными адаптациями по одному за раз. Очевидно, что манипулировать множеством адаптаций в то же время намного сложнее, но это также важно, поскольку мы знаем, что препараты производят большое количество разнородных типов изменений даже внутри отдельных нейронов, которые, вероятно, суммируются сложными способами, чтобы влиять на поведение. Такой подход к системной биологии будет иметь решающее значение для окончательного разрушения биологических основ зависимости. Наконец, усилия по пониманию молекулярно-клеточных механизмов воспоминаний, связанных с наркоманией, оказываются в момент, когда все другие усилия по пониманию биологической основы поведенческой памяти теперь борются: наша способность связывать биологические явления с сложной поведенческой памятью чрезвычайно сложна. Преодоление этого разрыва представляет собой, пожалуй, самую большую проблему в нейронауках.
Благодарности
Эта работа была поддержана грантами Национального института по борьбе со злоупотреблением наркотиками.
Выбранные сокращения и аббревиатуры
- Нак
- прилежащего ядра
- CREB
- связующий белок cAMP-ответа
- ΔFosB
- фактор транскрипции семейства Fos
- VTA
- брюшная тегментальная область
- AMPA
- α-амино-3-гидрокси-5-метил-4-изоксазолпропионовая кислота
- LTD
- долгосрочная депрессия
- LTP
- долгосрочная защита
- BDNF
- мозговой нейротрофический фактор
- NKkB
- ядерный фактор kB
Ссылки