НОВОСТИ И МНЕНИЯ
19 декабря 2018
Выявлены мозговые цепи компульсивной наркомании
Исследование на мышах идентифицирует адаптацию мозга, которая лежит в основе компульсивного поведения, связанного с наркоманией, и которая может объяснить, почему некоторые потребители наркотиков ведут себя навязчиво, а другие - нет.
Наркотики злоупотребляют комплексными фармакологическими эффектами, которые вызывают множество изменений в работе мозга. Один из этих эффектов, прямая или непрямая активация нейронов, которые высвобождают нейротрансмиттер дофамин, является общим для всех лекарств, вызывающих злоупотребление, и долгое время считалось, что он способствует развитию зависимости. Запись в природа, Пасколи и другие1 сообщить о нейробиологических механизмах, вызванных повторной активацией дофаминовых нейронов, которые могут объяснить, почему некоторые потребители наркотиков стремятся к награде, несмотря на негативные последствия - тип компульсивного поведения, который является определяющей чертой человеческой зависимости2.
Авторы применили оптогенетический подход для имитации активации дофаминовых систем мозга наркотиками злоупотребления: они использовали лазерный свет, доставляемый через оптическое волокно, для активации дофаминовых нейронов в вентральной области (VTA) мозга мышей с генной инженерией. Мыши могли непосредственно стимулировать сами эти нейроны, нажимая рычаг, и выполняли это действие энергично в течение тестового периода 40 минут в день в течение почти 2 недель.
В последующие дни мышей подвергали коротким ударам электрическим током по ногам в трети случаев случайного нажатия на рычаг. Их поведение в этом состоянии показало интригующую изменчивость: 40% мышей (так называемых отреченных) значительно снижали частоту нажатия на рычаг, когда давали удары ногой (рис. 1a), тогда как оставшиеся 60% (продолжатели) были готовы к болезненному воздействию наказание за возможность самостимуляции своих дофаминовых нейронов (рис. 1b). Как некоторые из этих авторов ранее показали3настойчивые мыши обеспечивают модель постоянного употребления наркотиков, несмотря на негативные последствия, и параллельны подгруппе людей, употребляющих наркотики, чье употребление наркотиков становится навязчивым.
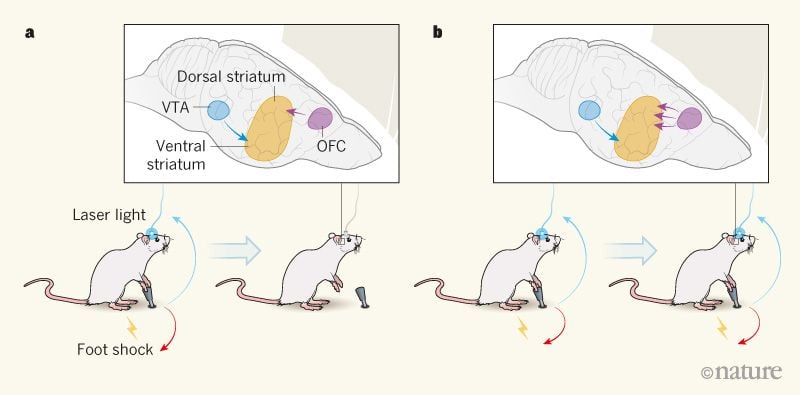
Рисунок 1 | Компульсивная активация дофаминовых нейронов в мозге. В исследовании Пасколи и др..1Мыши нажимали на рычаг, чтобы активировать нейроны, высвобождающие допамин, посредством доставки лазерного света, проводимого оптическим волокном. Эти нейроны, которые проецируются из вентральной области (VTA) в вентральный стриатум в головном мозге, связаны с вознаграждением. aНекоторые мыши, называемые отшельниками, снижали поведение при нажатии рычага, когда это было связано с болезненным поражением электрическим током их ног. У этих мышей сила связей между нейронами орбитофронтальной коры (OFC), проецирующимися на дорсальный стриатум, была низкой. bДругие мыши, которых называли настойчивыми, продолжали нажимать на рычаг, несмотря на наказание - признак навязчивого поведения. Нервные связи между OFC и дорсальным полосатым телом у этих мышей были сильнее, чем у отреченных. Когда авторы ослабили эти связи у настойчивых мышей, компульсивное поведение животных уменьшилось (не показано).
Затем авторы попытались определить, что отличалось между мозгами упорствующих и отреченных. Они измерили активность нейронов, соединяющих различные области мозга в режиме реального времени, чтобы определить, какие сети были активны, когда мыши нажимали на рычаг. Связь между орбитофронтальной корой (OFC), областью, участвующей в принятии решений, и дорсальным полосатым телом, который занимается произвольными действиями, усилилась до нажатия рычага у мышей, которые были готовы получить шоки вместе с самостимуляцией дофамином. Оптогенетическое ингибирование этого нервного пути превратило настойчивых мышей в отказывающихся мышей. Это открытие показывает, что повышенная активность нейронов, проецируемых из OFC в дорсальный стриатум, была необходима для этой формы компульсивной активации дофаминовых нейронов.
Однако это изменение поведения было только временным: когда оптогенетическое торможение было отключено, компульсивное поведение возобновилось у настойчивых мышей. Авторы полагают, что длительные изменения в синапсах - соединениях между нейронами - которые связывают OFC и нейроны дорсального стриатума, могут возникнуть в результате многодневной самостимуляции дофаминовых нейронов. Если бы эти изменения произошли только у настойчивых мышей, это объяснило бы их стойкое компульсивное поведение.
Если эта гипотеза верна, сила синаптических связей между OFC и нейронами дорсального стриатума должна быть выше у персевера, чем у отреченных, что позволяет лучше активировать нейроны дорсального стриатума нейронами OFC. Действительно, Пасколи и другие продолжил, чтобы показать, что сила синапсов между нейронами OFC и дорсальными полосатыми нейронами увеличилась у настойчивых мышей (рис. 1). Отравители, наряду с мышами, которые никогда не подвергались экспериментальной установке, и мышами, которые получали удары, но не имели права использовать рычаг, все показали низкую синаптическую силу между OFC и дорсальными полосатыми нейронами.
Примечательно, что авторы обнаружили, что компульсивное поведение можно подавлять или индуцировать, соответственно уменьшая или увеличивая силу этой нервной связи. Ослабление синаптических связей между OFC и дорсальным полосатым телом у настойчивых мышей снижало их готовность к самостимуляции перед лицом возможного шокового шока. И наоборот, отреченные могут быть превращены в настойчивых, увеличивая силу этих синаптических связей. В отличие от временного реверса, наблюдаемого после оптогенетического торможения нейронов OFC, выступающих в дорсальный стриатум, эти изменения в силе синапсов вызвали изменение поведения, которое сохранялось в течение шести дней.
Пастбища и другие обнаружили нейроадаптацию, которая позволяет мышам преодолевать болезненный стимул, чтобы продолжать активировать свои дофаминовые нейроны. Хроническое употребление наркотиков, злоупотребляющих людьми, приводит к повторной активации одной и той же схемы, усиливающей допамин, поэтому подобная нейроадаптация может привести к тому, что они продолжат принимать наркотики, несмотря на негативные последствия. Чтобы проверить это предположение, мы должны определить, влияют ли изменения в силе связей между OFC и нейронами дорсального полосатого тела на компульсивное поведение у мышей, нажимающих рычаг для приема кокаина, амфетаминов или опиоидов перед лицом возможного шокового шока.
Точно ли имитируется оптогенетическая стимуляция дофаминовых нейронов активацией дофаминовых нейронов лекарственными препаратами? Существуют очевидные различия между быстрым включением и выключением лазера во время оптогенетической стимуляции и более медленным началом и большей продолжительностью действия препарата. Тем не менее, авторы ранее показали4 что потребление кокаина и оптогенетическая активация вызывают почти идентичные адаптации в дофаминовых нейронах и их ближайших нижестоящих мишенях, что обеспечивает сильное обоснование для экспериментального подхода, использованного в настоящем исследовании.
Почему самостимуляция дофаминовых нейронов приводит к компульсивному поведению только у подгруппы людей? Настойчивые и отрекающиеся мыши самостимулировались в течение примерно того же времени и с таким же количеством событий до того, как началось наказание за удар ногой, однако мозг обеих групп, похоже, изменился по-разному. Стимулированные мышами дофаминовые нейроны VTA не соединяются непосредственно с OFC или дорсальным полосатым телом, поэтому связь между этими областями должна включать множество синаптических связей. Ранее был описан мультисинаптический путь, посредством которого активация дофаминовых нейронов VTA может вызывать изменения в дорсальном стриатуме.5и было предложено лежать в основе переходов от некомпульсивного к компульсивному употреблению наркотиков6,7, Существовавшие ранее различия в этой мультисинаптической схеме могут объяснить, почему компульсивное поведение и связанные с ним изменения в синаптических связях встречаются только у некоторых мышей.
Синаптические изменения могут длиться дни, годы или даже всю жизнь. Могли бы изменения, обнаруженные Пасколи и др., сформировать основу для устойчивых изменений в поведении, которые являются отличительной чертой наркомании? Решение этого вопроса потребует экспериментальных доказательств того, что самостоятельное введение лекарственного средства, несмотря на негативные последствия, происходит через усиление связей между ОФК и дорсальным полосатым телом, и что именно активация дофаминовых систем приводит в движение цепь нейронных событий, кульминацией которых является в компульсивном употреблении наркотиков.
природа 564, 349-350 (2018)
doi: 10.1038 / d41586-018-07716-z