КОММЕНТАРИИ: Отличный обзор почти всех соответствующих исследований рецепторов андрогенов, допамина и сексуальной функции. Фантастический рисунок взаимосвязей между циклами гипоталамуса и вознаграждения.
Хорм Бехав. 2008 май; 53(5): 647-658.
Опубликован онлайн 2008 Февраль 13. DOI: 10.1016 / j.yhbeh.2008.01.010
Абстрактные
Подростковый возраст связан с увеличением поведения в поисках удовольствия, которое, в свою очередь, формируется пубертатной активацией гипоталамо-гипофизарно-гонадной оси. В животных моделях естественно полезного поведения, таких как секс, тестикулярные андрогены способствуют развитию и выражению поведения у мужчин. Для осуществления поведенческого созревания мозг подвергается значительному ремоделированию в подростковом возрасте, и многие из этих изменений также чувствительны к андрогенам, предположительно действующим через андрогенные рецепторы (АР). Учитывая тонкое взаимодействие гормонов гонад и развития мозга, неудивительно, что нарушение уровня гормонов в этот чувствительный период значительно изменяет поведение подростков и взрослых. У мужчин-хомяков подверженность тестостерону в подростковом возрасте требуется для нормального выражения сексуального поведения взрослых. Мужчины, лишенные андрогенов во время полового созревания, демонстрируют устойчивый дефицит при спаривании. Напротив, только андрогенов недостаточно, чтобы индуцировать спаривание у препубертатных самцов, даже если мозг AR присутствует до полового созревания. В этом контексте большое значение имеет широкое распространение анаболических андрогенных стероидов (ААС) в подростковом возрасте. Нарушение AAS может изменить как сроки, так и уровни андрогенов у подростков-подростков. У хомяков подростковое воздействие ААС увеличивает агрессивность и вызывает длительные изменения в нейротрансмиттерных системах. Кроме того, AAS сами усиливают, что подтверждается самоуправлением тестостерона и других ААС. Однако недавние данные свидетельствуют о том, что усиливающие эффекты андрогенов могут не требовать классического АР. Поэтому для лучшего понимания злоупотребления ААС требуется дальнейшее изучение взаимодействия между андрогенами и поощрительным поведением в подростковом мозге.
Обзор
Подростковый возраст пробуждает мозг как для удовольствия, так и для риска. В человеческих подростках это часто принимает форму экспериментов с наркотиками и сексом. В Соединенных Штатах средний возраст для первого полового акта у мужчин - 16.4 лет, а 65% имели половой акт 12th класса (Семейный фонд Kaiser, 2005). Аналогичным образом, эта популяция имеет самые высокие показатели употребления запрещенных наркотиков в Соединенных Штатах. Согласно Национальному опросу по использованию и здоровью 2004, 38% мужчин в возрасте 18-25 использовали незаконный наркотик в прошлом году (SAMHSA / OAS, 2005). Кроме того, 31% подростков-мальчиков употребляли наркотики или алкоголь во время их последней сексуальной встречи (Семейный фонд Kaiser, 2005). Кроме того, подростковый возраст является ключевым моментом в этиологии некоторых психопатологий, таких как депрессия, тревога, нарушение питания и расстройство поведения. Мы полагаем, что половая секреция гонадальных гормонов, их активация стероидных рецепторов в головном мозге и взаимодействие между гормоном и опытом развития подросткового мозга способствуют поведенческим изменениям, наблюдаемым в подростковом возрасте.
Наша цель здесь - проанализировать доказательства того, что гонадальные андрогены опосредуют подростковое созревание и взрослое поведение мотивированного поведения, а также полезные свойства этого поведения. Мы также представляем доказательства того, что сам тестостерон является полезным, что, вероятно, способствует соматическим изменениям мотивированного поведения в подростковом возрасте, когда уровень тестостерона парит. Основное внимание в этой статье уделяется изучению нейронных схем, лежащих в основе мужского сексуального поведения, особенно у сирийского хомячка, с особым упором на взаимодействие между тестостероном и дофамином (ДА). Мы предлагаем, чтобы пубертатные андрогены имели как временные, так и долгосрочные последствия для схем вознаграждения и мотивированного поведения. Далее мы предполагаем, что добавление экзогенными андрогенами в виде анаболических андрогенных стероидов (AAS) увеличивает нормальное влияние половых андрогенов, тем самым отрицательно влияя на развитие подростка мозга и поведения.
Подростковый возраст как чувствительный период развития мозга
В конечном итоге мозг является одновременно пусковым механизмом и мишенью для действия андрогенов в подростковом возрасте. У мальчиков (<12 лет) и молодых хомяков (<28 дней) циркулирующие андрогены и гонадотропины находятся на базовом уровне. По мере того как секреция лютеинизирующего гормона передней долей гипофиза повышается в ответ на гипоталамический гонадотропин-рилизинг-гормон, концентрация циркулирующего тестостерона значительно увеличивается. Это происходит на стадии II / III по Таннеру (14 лет) у мальчиков и к 28-дневному возрасту у хомяков. К тому времени, когда мальчики достигают стадии IV / V по Таннеру (примерно 16 лет) или когда хомяки достигают возраста 50–60 дней, уровень эндогенного тестостерона находится в пределах диапазона взрослых мужчин. Пубертатная секреция гормонов совпадает с периодом подросткового возраста, который у людей приходится примерно с 12 до 20 лет. Пубертатные гормоны действуют не только на периферические ткани, вызывая появление вторичных половых признаков, которые являются явными признаками полового созревания, но они также действуют центрально, влияя как на ремоделирование мозга подростка, так и на поведенческое созревание. Кроме того, физиологические и неврологические изменения, вызванные пубертатными гормонами, приводят к значительным изменениям в опыте человека, что само по себе может существенно изменить ход развития мозга. Таким образом, пубертатное повышение уровня половых стероидных гормонов, вызванное созреванием репродуктивной нейроэндокринной оси во времени, в свою очередь, формирует поведенческое развитие подростков посредством как прямого, так и косвенного влияния на нервную систему.
Подростковый возраст в настоящее время признан в качестве основного и динамичного периода развития нервной системы, в ходе которого перестраиваются и уточняются поведенческие схемы. Хотя мозг 5-летнего ребенка уже 90% от его взрослого размера (Dekaban, 1978), значительное ремоделирование еще впереди. Эта концепция была зажжена исследованиями как у людей, так и у животных, которые подтверждают, что многие из основных процессов развития, возникающих во время развития перинатального мозга, повторяются в подростковом возрасте. Эти процессы включают нейрогенез (Eckenhoff и Rakic, 1988; Он и Экипажи, 2007; Пинос, Колладо, Родригес-Зафра, Родригес, Сеговия и Гильямон, 2001; Ранкин, Партоу, МакКерди, Джайлс и Фишер, 2003), запрограммированная гибель клеток (Нунез, Лаушке и Юраска, 2001; Нунез, Содхи и Юраска, 2002), разработка и обрезка дендритных арборизаций и синапсов (Андерсен, Рутштейн, Бензо, Хостеттер и Тейхер, 1997; Huttenlocher и Dabholkar, 1997; Lenroot и Giedd, 2006; Соуэлл, Томпсон, Леонард, Добро пожаловать, Кан и Тога, 2004), миелинизация (Бенеш, Черепаха, Хан и Фарол, 1994; Паус, Коллинз, Эванс, Леонард, Пайк и Зийденбос, 2001; Соуэлл, Томпсон, Тесснер и Тога, 2001) и сексуальной дифференциации (Chung, De Vries и Swaab, 2002; Дэвис, Шрин и Горски, 1996; Nunez и др., 2001). Таким образом, траектория развития постнатального мозга не является линейной, но вместо этого характеризуется подростковым всплеском быстрых изменений и включает как прогрессивные, так и регрессивные события. Как известно любому биологу развития, периоды быстрого изменения изменения сигнала повышают чувствительность и уязвимость как к зависимым от опыта изменению, так и к неблагоприятным последствиям возмущений и оскорблений, и нет оснований полагать, что развитие человеческого подросткового мозга является любым исключением (Андерсен, 2003; Копье, 2000). Таким образом, предсказания, связанные с временным периодом воздействия пубертатного гормона на мозг подростка, будут иметь долгосрочные последствия для поведения взрослых.
Андрогены и нейронные цепи для мотивированного поведения
Поскольку подростковый возраст является переходной и динамичной фазой развития, было бы трудно оценить изолированный мозг и поведение подростка. Вместо этого, чтобы оценить уникальный характер подросткового возраста, полезно противопоставить его мозгу и поведению взрослых взрослых. Таким образом, в центре внимания этой статьи о сексуальном поведении и вознаграждении мужчин здесь важно ввести нейронные схемы для совокупления и сексуальной мотивации у взрослых мужчин, в том числе роль гонадальных стероидных гормонов в поведенческой активации и распределение рецепторов андрогенов (AR) и эстрогенами (ER).
AR присутствуют в клеточных группах, которые образуют нейронные цепи, опосредующие полезные социальные формы, такие как пол. Кроме того, мозг AR выражается до полового созревания у хомячков и повышается у андрогенов у мальчиков и взрослых мужчин (Kashon, Hayes, Shek и Sisk, 1995; Meek, Romeo, Novak и Sisk, 1997). В мозге грызунов существует существенное перекрытие в распределении AR и ER (Дерево и Ньюман, 1995) и ароматазы (Celotti, Negri-Cesi и Poletti, 1997), включая как α, так и β-формы рецептора эстрогена (Shughrue, Lane и Merchenthaler, 1997). При связывании с лигандом «классические» AR и ER функционируют как факторы транскрипции для индукции транскрипции и синтеза новых белков. Неудивительно, что эти эффекты следуют относительно медленному курсу с задержкой начала действия. Стероидная стимуляция полового поведения мужчин-хомяков (Noble и Alsum, 1975) согласуется с действиями через классические геномные действия. Например, для восстановления спаривания в длительных кастратах требуется неделя стероидов 2. Более поздние исследования у крыс также продемонстрировали быстрые клеточные эффекты андрогенов в областях мозга, которые обладают несколькими классическими рецепторами (Mermelstein, Becker и Surmeier, 1996). Считается, что эти стероидные действия опосредуются негеномными рецепторами. В то время как распределение классических AR и ER в мозге хомяка относительно ограничено (Wood and Swann, 1999), потенциальные мозговые мишени для негеномного андрогенного действия намного шире.
Медиальная преоптическая область (MPOA) играет центральную роль в копуляции у мужчин от золотых рыбок до людей (см. Халл, Вуд и МакКенна, 2006). Кроме того, хомяк MPOA трансформирует гонадальные стероидные гормоны через обильные AR и ER, а имплантаты тестостерона в MPOA достаточны для восстановления сексуальной активности в долгосрочных кастритах (Wood and Swann, 1999). У самцов крыс гонадальные стероиды действуют в MPOA для регулирования базального выделения DA (Путнам, Сато и Халл, 2003) и стимулируют спаривание (Халл, Ду, Лоррен и Матушевич, 1995). Первоначально наблюдается умеренное увеличение DA, когда женщина представлена за экраном. Во время спаривания MPOA DA увеличивается (+ 50% от базовой линии), и для этого эффекта требуются андрогены (Халл и др., 1995; Putnam et al., 2003). Неудивительно, что у кастрированных самцов, которые не спариваются, MPOA DA не увеличивается (Халл и др., 1995). Трудно интерпретировать этот результат, поскольку отсутствие освобождения от ДА смешивается с отсутствием сексуальной активности. Однако высвобождение DA в MPOA коррелирует с потерей спаривания в кратковременных кастратах (Халл и др., 1995), а также вызванное тестостероном восстановление половой активности в долгосрочных кастратах (Du, Lorrain и Hull, 1998; Путнам, Дю, Сато и Халл, 2001).
Внутри грызуна MPOA андрогенные и эстрогенные метаболиты тестостерона играют определенную роль в регуляции спаривания (Putnam et al., 2003; Путнам, Сато, Риоло и Халл, 2005). Задержка для начала совокупления (монтирование или интромит) является одной из мер сексуальной мотивации. Латентность к сексуальной активности чувствительна к эстрогенам, благодаря поддержанию синтазы оксида азота MPOA, которая, в свою очередь, поддерживает базовые уровни DA. Обработанные эстрогеном касты показывают высокие базальные уровни DA, которые сильно коррелируют со способностью инициировать совокупление. Тем не менее, они не могут показать увеличение дозы DA, вызванное женской и копуляционной терапией, что сильно коррелирует с сексуальной эффективностью. Следовательно, их сексуальная активность ниже неповрежденных. С другой стороны, кастраты, обработанные неароматизируемыми андрогенами, не показывают повышенных базальных уровней DA, и они не могут инициировать совокупление. Поэтому для нормальной сексуальной активности необходимы как эстрогены, так и андрогены. Сексуальная характеристика обычно выражается в виде частотных показателей монтирования, интродукции и эякуляции. Только когда заменяются оба эстрогена и андрогена, у кастрированных самцов наблюдаются повышенные уровни DA (и более короткие показатели латентности), а DA-увеличение, связанное с женскими и копулятивными эффектами (и увеличение частоты). Таким образом, эстрогены в MPOA способствуют сексуальной мотивации, и как эстрогены, так и андрогены к сексуальной активности.
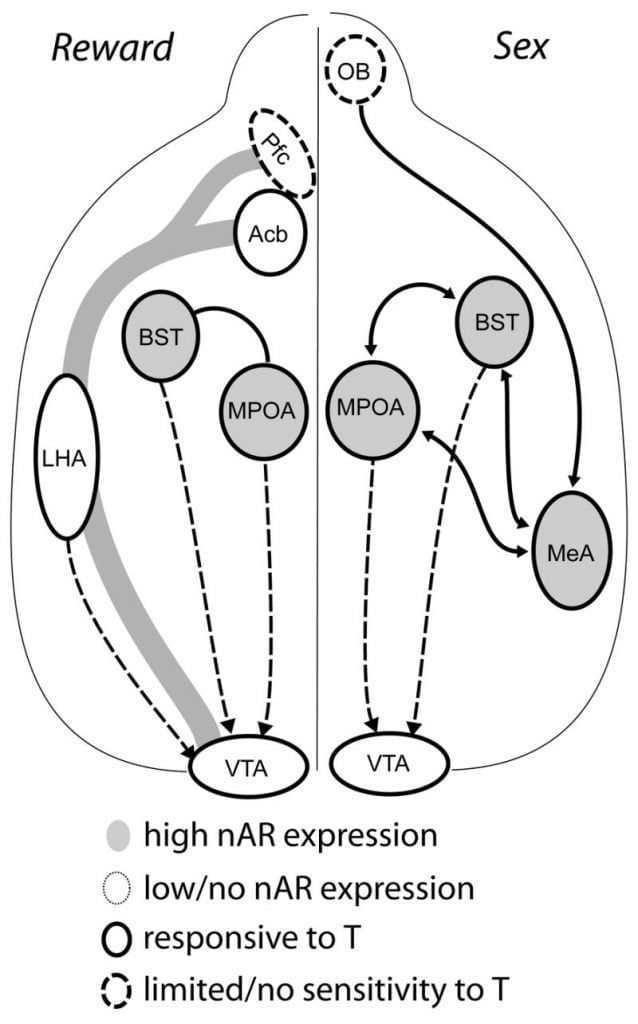
Хотя тестостерон необходим для высвобождения MPOA DA во время мужского копулятивного поведения и для спаривания, ни тестостерон, ни спаривание в одиночку не могут вызвать ДА в MPOA. Вместо этого хемосенсорные сигналы от конспецифических самок также необходимы для высвобождения DA в MPOA. У грызунов хемосенсорные стимулы являются основной сенсорной способностью инициировать мужское сексуальное поведение (Рис 1). Хемосенсорные сигналы передаются от обонятельных луковиц до МПОА через медиальное амигдалоидное ядро и ядро ложа стриевых островка, структуры с обильным AR и ER (Wood and Swann, 1999). Чтобы определить роль хемосенсорных сигналов в индуцированном сопряжением DA, мы измерили MPOA DA во время спаривания у гонад-интактных мужских хомячков с односторонней обонятельной бульбэктомией (UBx, Триемстра, Нагатани и Вуд, 2005). Хотя двустороннее удаление обонятельных луковиц устраняет сексуальную активность и освобождение MPOA DA, односторонняя bulbectomy не мешает спариванию. В этом исследовании копуляция индуцировала высвобождение MPOA DA при измерении контралатеральной к пораженной обонятельной луковице, но не в ипсилатеральном полушарии (Рис 2). Аналогичные результаты наблюдались у самцов крыс с поражениями медиальной миндалины (Домингес, Риоло, Сюй и Халл, 2001). В связанном исследовании химическая стимуляция медиальной амигдали у крыс индуцировала высвобождение MPOA DA, эквивалентное высвобождению во время копуляции (Домингес и Халл, 2001). В совокупности эти данные показывают, что тестостерон создает разрешающую среду, которая позволяет внешним сенсорным стимулам достигать MPOA и индуцировать высвобождение DA во время копуляции.

Рис 2
В конечном счете, сексуальное поведение и другие природные награды активируют пути нейронной награды. Мезокортиколимбическая цепь DA состоит из брюшной тегментальной области (VTA), ядра accumbens (Acb) и префронтальной коры (Pfc). Допаминовые клетки, находящиеся в проекте VTA, рострально к Acb и Pfc (Koob и Nestler, 1997). У крыс DA выпускается в Acb во время секса (Pfaus, Damsma, Nomikos, Wenkstern, Blaha, Phillips и Fibiger, 1990). Многие лекарственные средства злоупотребления также действуют в мезолимбической системе DA для увеличения выделения DA (амфетамины) или ингибируют обратный захват DA (кокаин, Ди Чиара и Императо, 1988), тем самым усиливая их захватывающие свойства. Таким образом, тестостерон может влиять на высвобождение DA в Acb как посредством улучшения сексуального поведения, так и посредством его действий в качестве наркотического средства (см. Ниже).
Имеющиеся данные свидетельствуют о том, что мезокортиколибденовая DA система созревает в подростковом возрасте. Плотность волокон Acb DA резко возрастает в подростковом возрасте у песчанок, указывая на то, что значительное созревание дофаминергических прогнозов VTA для Acb происходит в подростковый период (Lesting, Neddens и Teuchert-Noodt, 2005). Кроме того, дофаминергический вход в GABA (γ-аминомасляная кислота) -эргические клетки в префронтальной коре головного мозга обогащается и модулируется серотонинергическими системами во время пубертатного развития (Бенеш, Тейлор и Каннингем, 2000), а манипуляция андрогенами у взрослых крыс приводит к изменениям плотности дофаминергических аксонов в префронтальной коре (Kritzer, 2003). Pfc, Acb и VTA имеют несколько AR или ER, хотя ERβ присутствует в VTA (Shughrue et al., 1997). Поэтому представляется вероятным, что андрогены влияют на мезокортиколибденовую систему DA через андроген-чувствительные афференты или через ERβ в VTA, как в гипоталамусе (Handa et al., This issue). Наши данные показывают, что чувствительные к андрогену клетки у самцов хомяков проецируются на VTA из структур, связанных со стероид-чувствительным поведением. Например, как MPOA, так и ядро кровати stria terminalis (BST) содержат большое количество AR-позитивных клеток, выступающих в VTA (Сато и дерево, 2006). Вентральный паллидум, основная акцептивная мишень Acb (Zahm и Heimer, 1990), также содержит много AR-позитивных клеток, выступающих в VTA. Эти прогнозы дают возможность андрогенам модифицировать активность мезокортиколибденовой DA-системы.
Стероид-зависимая организация поведения в подростковом возрасте
Традиционный взгляд на гормональное действие на поведение подростков основан на активирующих эффектах стероидных гормонов, которые относятся к способности стероидов способствовать поведению в конкретных социальных контекстах посредством действия в клетках-мишенях в нейронных цепях, лежащих в основе поведения. Активационные эффекты преходящи в том смысле, что они приходят и уходят с наличием и отсутствием гормона, и они, как правило, связаны с выражением взрослого поведения. Напротив, организационные эффекты относятся к способности стероидов лепить структуру нервной системы во время развития. Структурная организация является постоянной, сохраняется за пределами периода воздействия гормона и определяет нейронные и поведенческие реакции на стероиды в зрелом возрасте. Наше понимание взаимосвязи между организационными и активирующими эффектами стероидных гормонов развилось за последние 50 лет. Феникс и его коллеги впервые предложили, чтобы взрослые поведенческие (активационные) ответы на стероидные гормоны программировались (организовывались) стероидными гормонами в течение максимально чувствительного периода перинатального развития (Phoenix, Goy, Gerall и Young, 1959). Позднее Скотт и его коллеги заложили теоретическую основу для существования множества чувствительных периодов для прогрессивной организации нервной системы и отметили, что чувствительные периоды, скорее всего, будут возникать в периоды быстрого изменения развития (1974). Впоследствии Арнольд и Бридлоу отмечали, что стероидзависимая организация мозга может возникать вне чувствительных периодов развития (Арнольд и Бридлоу, 1985). За прошедшие 15 годы исследования, в которых использовались различные модели животных и поведенческие системы, дают понять, что мозг подростка чувствителен к активационным и организационным эффектам гонадальных стероидов (см. Sisk и Zehr, 2005). И, как и другие периоды быстрого изменения развития, подростковый возраст представляет собой определенное окно возможностей для стероидозависимого ремоделирования мозга.
Наша работа с использованием хомяка как модели для животных свидетельствует о том, что мужское социальное поведение модифицируется стероидами в подростковом возрасте (Шульц, Менард, Смит, Альберс и Сиск, 2006; Шульц и Сиск, 2006). До полового созревания лечение тестостероном не может активировать сексуальное поведение у хомячков, указывая на то, что процессы созревания, которые оказывают нейронные цепи, восприимчивые к активации или организации стероидными гормонами, еще не произошли (Meek и др., 1997; Ромео, Ричардсон и Сиск, 2002a). И наоборот, в то время как открытое проявление мужского репродуктивного поведения во взрослом возрасте не требует абсолютного присутствия гонадных стероидов в подростковом возрасте, максимальное выражение поведения требует. При сравнении мужского репродуктивного поведения у самцов, кастрированных либо в препубертатном (NoT@P), либо в постпубертатном (T@P) и затем получавших тестостерон во взрослом возрасте, у кастратов препубертатного NoT@P наблюдается по крайней мере 50% дефицит мужского поведения по сравнению с самцами, кастрированными после подросткового возраста. (Рис 3, Шульц, Ричардсон, Зар, Осетек, Менар и Сиск, 2004). Более того, дефицит репродуктивного поведения длительный и не может быть преодолен длительным лечением тестостероном или сексуальным опытом во взрослую жизнь (Schulz et al., 2004). Точно так же после лечения эстрогеном и прогестероном у самцов NoT@P наблюдается более короткая латентность лордоза и более длительная продолжительность лордоза, чем у самцов, кастрированных во взрослом возрасте.Schulz et al., 2004), предполагая, что препубертатные кастриты менее дефеминизированы, чем самцы, подвергшиеся воздействию полового тестостерона.

Рис 3
Возможно, у мужчин NoT@P снижена сексуальная мотивация. Один из способов ответить на этот вопрос — сравнить латентные периоды для участия как в аногенитальном исследовании (AGI), так и в монтаже у мужчин, подвергшихся гонадэктомии до (NoT@P) и после полового созревания (T@P). Если сексуальная мотивация зависит от воздействия гонадных гормонов в подростковом возрасте, мы можем предсказать более длительные латентные периоды сексуального поведения у мужчин без Т@П. Действительно, при повторном воздействии эстральных самок самцам NoT@P требуется больше времени, чтобы начать AGI и подняться, по сравнению с самцами T@P (Рис 4). Таким образом, оказывается, что в дополнение к организации аспектов сексуального поведения пубертатные гормоны также организуют аспекты вознаграждения сексуального поведения. В поддержку этой возможности центральное введение агониста дофамина апоморфина во взрослом возрасте восстанавливает поведение мужчин NoT@P до типичного для взрослых уровня, предполагая, что тестостерон в подростковом возрасте обычно организует дофаминергические нейронные цепи (Salas-Ramirez, Montalto, and Sisk, 2006). ). Тем не менее, остается много интересных вопросов. Будет ли самец NoT@P давить на эстральную самку или развивать обусловленное предпочтение места для места спаривания? Будущие исследования будут изучать роль гормонов полового созревания в организации сексуальной мотивации и сексуальной активности.

Рис 4
Задержка и продолжительность аногенитального исследования (AGI) у самцов хомяков, подвергнутых гонадэктомии до полового созревания (NoT@P) или после полового созревания (T@P). Всем самцам вводили тестостерон во взрослом возрасте через 7 недель после гонадэктомии и за неделю до первого поведенческого теста. A. Самцы T@P показали одинаковые латентные периоды AGI в трех тестах с эстральной самкой, тогда как самцы NoT@P увеличили латентный период AGI во время третьего теста с эстральной самкой. B. У самцов T@P уменьшилась задержка подъема в трех поведенческих тестах с эстральной самкой, тогда как у самцов без T@P не было изменений в задержке подъема в трех поведенческих тестах. Эти данные свидетельствуют о том, что пубертатные гонадные гормоны оказывают длительное стимулирующее воздействие на мотивацию взрослых мужчин к сексуальному поведению с женщинами. (Неопубликованные данные о животных в Schulz, KM, Richardson, HN, Zehr, JL, Osetek, AJ, Menard, TA и Sisk, CL, 2004).
Препубертатные поведенческие реакции на стероиды
Одна из длительных головоломок поведенческого развития подростков заключается в том, что активация репродуктивного поведения в ответ на воздействие стероидов ослабляется у препубертатных мужских хомяков. Если низкие уровни андрогенов до полового созревания ограничивают экспрессию мужского сексуального поведения у препубертатных мужчин, то добавление эндогенных андрогенов у препубертатных мужчин должно вызывать спаривание. Это оказывается не так (Meek и др., 1997; Ромео, Кук-Винес, Ричардсон и Сиск, 2001; Ромео, Вагнер, Янсен, Дидрих и Сиск, 2002b), несмотря на то, что количество и распределение AR и ER во всем спаривающем контуре сходны у обработанных гормонами препубертатных и взрослых кастритов (Meek и др., 1997; Ромео, Дидрих и Сиск, 1999; Romeo и др., 2002a). Поэтому представляется, что андрогены и AR необходимы, но недостаточно для выражения мужского сексуального поведения.
Усилия по выявлению факторов, которые ограничивают сексуальную активность до полового созревания, до сих пор были неоднозначными. Ответы Fos на хемосенсорные сигналы у эстральных женщин сходны у препубертатных и взрослых мужских хомячков (Ромео, Парфитт, Ричардсон и Сиск, 1998). Эти данные показывают, что сенсорные механизмы трансдукции созревают до полового созревания. Таким образом, несовершеннолетние мужчины способны обнаруживать хемосенсорные сигналы у самок; где они отличаются от взрослых, заключается в том, как они реагируют на эти сигналы. Одним из возможных объяснений является то, что препубертатные самцы не мотивированы заниматься сексуальным поведением. Мы обнаружили, что препубертатные мужские хомяки не проявляют повышенных дофаминергических реакций в MPOA в ответ на женские феромоны, тогда как у сексуальных наивных взрослых мужчин демонстрируются устойчивые дофаминергические реакции MPOA на одни и те же стимулы (Рис 5, Шульц, Ричардсон, Ромео, Моррис, Глядя и Сиск, 2003). Аналогичным образом, препубертатные самцы не могут продемонстрировать взрослого типичного увеличения циркулирующего тестостерона после воздействия феромонов у женщин (Парфитт, Томпсон, Ричардсон, Ромео и Сиск, 1999). Таким образом, женские феромоны, по-видимому, являются безусловным стимулом для нейрохимических и нейроэндокринных реакций у взрослых, но не препубертатных мужчин, что указывает на то, что значимость этих социально значимых сенсорных стимулов изменяется в течение пубертатного развития, возможно, связанных с приобретением полезных свойств и сексуальной мотивации. Кроме того, несмотря на то, что тестостерон облегчает AGI у самки у препубертатных самцов, этот эффект зависит от того, имел ли сам мужчина предыдущий контакт с эстральной самкой. Возможно, удивительно, что терапия тестостероном снижает латентность и увеличивает продолжительность AGI только у сексуально наивных препубертатных мужчин (Рис 6). Кроме того, препубертатные самцы, у которых был один предыдущий опыт работы с женщиной, демонстрировали гораздо более длительные задержки AGI и более короткие продолжительности AGI, чем мужчины, впервые взаимодействующие с восприимчивыми самками (Рис 6). Эти данные свидетельствуют о том, что взаимодействия с эстральной женщиной являются отвратительными, а не полезными до полового созревания, тем самым устраняя любые облегчающие эффекты тестостерона на AGI во время последующих взаимодействий с женщиной. Было бы интересно узнать, сохраняются ли негативные поведенческие последствия раннего воздействия на эстрадную женщину в подростковом и взрослом возрасте, особенно учитывая, что многократное воздействие эстральных женщин в течение подростковый возраст в целом способствует выражению мужского репродуктивного поведения (Моленда-Фигейра, Салас-Рамирес, Шульц, Цер, Монтальто и Сиск, 2007).

Рис 5
Предпубертатная и взрослая медиальная преоптическая область (MPOA) допаминергические реакции на женские феромоны, содержащиеся во влагалищных выделениях. Взрослые самцы показывают увеличение дофаминергической активности MPOA с воздействием женских вагинальных секретов, тогда как препубертатные самцы не проявляют повышенных дофаминергических ответов MPOA на женские феромоны. (Переустановлено из Schulz, KM, Richardson, HN, Romeo, RD, Morris, JA, Lookland, KJ и Sisk, CL, 2003).

Хотя препубертатное лечение андрогенами не может вызвать копуляцию, недавняя работа из нашей лаборатории показывает, что нервная система хомяка чувствительна к организующим действиям тестостерона на репродуктивное поведение до подросткового возраста (Шульц, Зар, Салас-Рамирес и Сиск, 2007). Кастрация и 19 дней воздействия тестостерона до или во время, но не после подросткового возраста, способствовали установлению поведения при замене тестостерона во взрослой жизни. Самцы, подвергнутые тестостерону препубертатно, также проявляли больше интромиссий во взрослом возрасте, чем мужчины, подвергшиеся воздействию тестостерона во время или после полового созревания (Schulz et al., 2007). Эти данные свидетельствуют о том, что способность тестостерона к организации поведенческих нейронных цепей снижается с возрастом, и что подростковый возраст обозначает конец длительного послеродового чувствительного периода для воздействия тестостерона.
Фармакологические андрогены
Предыдущие данные свидетельствуют о том, что эндогенные гонадальные стероиды усиливают мотивированное поведение в подростковом возрасте. Теперь, что произойдет, если один самоконтролирует андрогены на уровнях до 100x нормальных физиологических концентраций? Это проблема злоупотребления анаболически-андрогенным стероидом (AAS) (см. Браузер, 2002; Кларк и Хендерсон, 2003). Здесь уместно краткое отступление: все AAS являются производными тестостерона, все AAS имеют углеродный скелет с конденсированными кольцами 4, большинство из которых имеют углеводы 19. AAS используются главным образом для их анаболических (мышечных) эффектов. Однако, как следует из их названия, AAS также обладает андрогенными свойствами. Тестостерон является логичным выбором в исследованиях на животных для изучения фундаментальных механизмов награды андрогенов. Он остается популярным выбором для пользователей-людей, а чаще всего в виде сложных эфиров тестостерона длительного действия, таких как пропионат тестостерона. В 2006 тестостерон был единственным наиболее распространенным запрещенным веществом, обнаруженным при анализе мочи в аккредитованных WADA лабораториях (WADA, 2006). Тестостерон составлял наибольшую долю (34%) AAS-положительных анализов мочи на Олимпийских играх 2000 в Сиднее (Van Eenoo и Delbeke, 2003). Аналогичным образом, при анализе мочи пользователей AAS, 41% показал положительный результат теста на тестостерон (Brower, Catlin, Blow, Eliopulos, Beresford, 1991). При высоких дозах ААС вызывает значительные поведенческие изменения. В частности, из-за их тесной связи с тестостероном использование ААС в подростковые годы, по-видимому, нарушает нормальную стероидную среду развивающейся человеческой подростковой нервной системы, включая количество, время и тип воздействия стероидов.
Как и в случае с другими незаконными наркотиками, злоупотребление ААС людьми является проблемой подросткового возраста. Согласно Национальному обследованию домашних хозяйств по потреблению наркотиков 1994 (SAMHSA / OAS, 1996), пики стероидного использования в позднем подростковом возрасте в возрасте 18. Кроме того, в обзоре «Мониторинг будущего» (Джонстон, О'Мэлли и Бахман, 2003), частотность использования стероидов среди старшеклассников (2.7%) была сопоставима с продолжительностью жизни для кокаина (3.5%) или героина (1.4%). Использование стероидов также возрастает в более раннем возрасте: 2.5% учащихся 8th классов (13-14 лет) использовали стероиды, аналогичные заболеваемости трещинами (2.5%) и потреблением героина (1.6%). Эта тенденция к использованию ААС в раннем подростковом возрасте вызывает особую обеспокоенность в связи с опасениями 1), что подростки могут быть особенно уязвимы для злоупотребления AAS и 2), что подверженность подростков воздействию ААС на фармакологических уровнях может существенно изменить нормальное созревание мозга и поведение, чтобы произвести преувеличенные морфологические и поведенческие реакции, остро и хронически.
Несоответствующая агрессия - это поведенческая реакция, чаще всего связанная с злоупотреблением AAS человека. В опубликованных сообщениях о случаях употребления стероидов были замешаны в нескольких насильственных убийствах (Конайер и рабочий, 1989; Папа и Кац, 1990; Папа, Коури, Пауэлл, Кэмпбелл и Кац, 1996; Шульте, Холл и Бойер, 1993). В опросах современных пользователей AAS повышенная агрессивность и раздражительность были наиболее распространенными поведенческими побочными эффектами использования AAS (Бонд, Чой и Папа, 1995; Галлигани, Ренк и Хансен, 1996; Мидгли, Хизер и Дэвис, 2001; Парротт, Чой и Дэвис, 1994; Перри, Кучер, Лунд, Йетс, Холмен и Демерс, 2003). Однако, учитывая диапазон андрогенных воздействий, разнообразие психических симптомов и потенциал ранее существовавшей психиатрической дисфункции, трудно определить точную роль AAS в этих случаях человеческой агрессии. Результаты проспективных исследований добровольцев-добровольцев, получающих инъекции ААС, были неоднозначными: Tricker et al (1996) и O'Connor и др. (2004) не сообщал об увеличении сердитого поведения, в то время как в других исследованиях наблюдалась повышенная агрессия (Дали, Су, Шмидт, Пикар, Мерфи и Рубиноу, 2001; Ханнан, Фридль, Золд, Кеттлер и Плимате, 1991; Кури, Лукас, Папа и Олива, 1995; Папа и Кац, 1994; Su, Pagliaro, Schmidt, Pickar, Wolkowitz и Rubinow, 1993). Тем не менее, важно иметь в виду, что дозы, вводимые добровольцам для человека, намного ниже, чем дозы, рекомендованные на веб-сайтах по созданию тела, и продолжительность лечения обычно коротка. Таким образом, в целом, справедливо заключить, что AAS может повысить агонистическое поведение, по крайней мере, у восприимчивых людей. Pope et al (1994) обнаружили, что AAS вызывают психические симптомы у уязвимых лиц.
Исследования на животных также предоставили убедительные доказательства агрессии, вызванной ААС. Подростковые хомячки-подростки, которые хронически обрабатываются высокодозными стероидами, имеют более короткие латентные атаки и большее количество атак и укусов к нарушителю-мужчине по сравнению с необработанными самцами (Харрисон, Коннор, Новак, Нэш и Меллони, 2000; Меллони, Коннор, Ханг, Харрисон и Феррис, 1997). Аналогичным образом, мягкая провокация (хвостовой пинч) вызывает постоянное увеличение агрессивности у самцов крыс-самцов, включая агрессию по отношению к самкам (Каннингем и Макгиннис, 2006). Еще большее беспокойство вызывает то, что подростковое воздействие ААС у хомяков вызывает длительное увеличение агонистического поведения, которое сохраняется после прекращения использования стероидов (Граймс и Меллони, 2006). Эти поведенческие изменения сопровождаются длительным ремоделированием нейронных схем в переднем гипоталамусе. В частности, подростковое воздействие ААС у хомячков усиливает аргониновый вазопрессин (AVP, Граймс и Меллони, 2006) и подавляет серотонин и серотонинергические рецепторы 5HT1A и 5HT1B (Риччи, Расахан, Граймс и Меллони, 2006). Неудивительно, что AAS также изменяет уровни мозга в AR. Хроническое воздействие либо тестостерона, либо нандролона усиливает клеточную ядерную АР у самцов крыс (Менар и Харлан, 1993; Вессон и Макгиннис, 2006). Таким образом, существует вероятность того, что ААС улучшит андрогензависимое поведение как путем дополнения эндогенных андрогенов, так и путем увеличения андрогенной реакции путем увеличения экспрессии АР.
По сравнению с агонистическим поведением AAS оказывают менее заметное влияние на поведение при поведении у мужских грызунов, и ответ зависит от конкретного используемого стероида (см. Кларк и Хендерсон, 2003). У мужских хомяков, потребляющих тестостерон в пероральных растворах, эякуляция увеличивалась дозозависимым образом (Wood, 2002). Однако ни тестостерон, ни нандролон не улучшали спаривание у самцов крыс-самцов. Станозолол, относительно менее мощный ААС с минимальной андрогенной активностью, фактически ингибировал как спаривание, так и агрессию (Фаррелл и Макгиннис, 2003), по-видимому, путем снижения уровня эндогенных андрогенов.
Особенно важно отметить, что подростковые и взрослые хомяки могут демонстрировать различные поведенческие реакции на воздействие ААС. В то время как AAS заметно улучшало агонистическое поведение у подростков-подростков, такое же лечение во взрослую жизнь приводило к лишь незначительному увеличению агрессивного поведения и значительному снижению сексуального поведения (Салас-Рамирес, Монтальдо и Сиск, 2008). Это согласуется с концепцией подросткового возраста как чувствительного периода действия андрогенов. Кроме того, так же, как взрослые мужчины-хомяки приобретают толерантность к экзогенному тестостерону (Peters and Wood, 2005), мы считаем, что развитие самцов приобретает толерантность к тестостерону по мере созревания. Таким образом, последствия изменения ААС в развитии подростков, а также подверженность подростков ААС могут вызывать чрезмерные агрессивные и сексуальные модели поведения, которые могут сохраняться во взрослую жизнь.
Усиливающие эффекты андрогенов
Спаривание и борьба - все это полезно (по крайней мере, если вы выиграете бой). Самцы крыс многократно нажимают на рычаг, чтобы совокупляться с самкой (Эверитт и Стейси, 1987). Аналогичным образом, самцы-мыши и самки-хомяки формируют предпочтение условного места (CPP) для мест, где они ранее выигрывали бои (Мартинес, Гильен-Салазар, Сальвадор и Саймон, 1995; Мейсел и Джоппа, 1994). Если ААС может повысить эффективность социального поведения выше уровней, обычно наблюдаемых у мужчин без половых органов, логично ожидать, что сам тестостерон может быть полезным. Это было проверено с использованием двух устоявшихся моделей животных для вознаграждения и подкрепления: CPP и самоуправление. Результаты этих исследований показывают, что тестостерон усиливается в экспериментальном контексте, когда анаболические эффекты и спортивные результаты не имеют значения. При использовании CPP испытуемое вещество повторно соединяется с уникальной средой (например, определенной камерой в испытательном аппарате). Как только животное связывает усиливающее тестовое вещество с этой средой, он будет искать окружающую среду даже в отсутствие вознаграждения. Первые сообщения о награде андрогена у лабораторных животных использовали системные инъекции тестостерона для индукции CPP у мышей-самцов (Арнедо, Сальвадор, Мартинес-Санчис и Гонсалес-Боно, 2000; Арнедо, Сальвадор, Мартинес-Санчис и Пеллицер, 2002) и крыс (Александр, Паккард и Хайнс, 1994; де Бун, Янсен, Сленгэн и Ван де Опрос, 1992). Впоследствии наша лаборатория использовала самолечение тестостерона для демонстрации андрогенной подкрепления (Джонсон и Вуд, 2001). Мы обнаружили, что мужские хомяки добровольно потребляют оральные растворы тестостерона, используя как тесты выбора 2-бутылок, так и пищу, вызванную пищевыми продуктами. В более поздних исследованиях мы продемонстрировали iv самоуправление у самцов крыс и хомячков (Вуд, Джонсон, Чу, Шад и Я, 2004). Внутривенная доставка устраняет потенциальные смешающие эффекты вкуса или наполнения кишечника при приеме андрогенов.
В контексте злоупотребления ААС важно различать центральные и периферические эффекты андрогенов. Поскольку тестостерон имеет широко распространенные эффекты во всем теле, можно утверждать, что вознаграждение и усиление системными инъекциями тестостерона являются вторичными по отношению к системным анаболическим и андрогенным действиям тестостерона. Другими словами, возможно, тестостерон уменьшает мышечную усталость и улучшает совместную функцию, так что животные просто чувствовать лучше. Действительно, это объяснение было использовано в клинической литературе (хотя и без экспериментальных доказательств), чтобы спорить с потенциалом зависимости и зависимости от AAS (DiPasquale, 1998). Однако Packard et al (Паккард, Корнелл и Александр, 1997) показали, что инъекции тестостерона непосредственно в мозг крысы могут индуцировать CPP. Аналогичным образом, наша лаборатория продемонстрировала внутрисосудисторикулярное (icv) самоконтроль тестостерона у мужских хомячков (Wood et al., 2004). Внутримозговое СРП и самолечение icv с тестостероном утверждают, что центральные мишени опосредуют андрогенную армирование.
Примечательно, что усиление тестостерона не обязательно должно следовать тем же механизмам, которые ранее были установлены для стероидных эффектов на сексуальное поведение. Как обсуждалось ранее, MPOA является ключевым сайтом для организации сексуального поведения мужчин-грызунов (Hull, Meisel и Sachs, 2002). В хомяках МПОА имеет обильные стероидные рецепторы, а имплантаты тестостерона в МПОА восстанавливают половую активность в длительных кастратах (Wood and Swann, 1999). Временной ход этих стероидных эффектов медленный: поведение при посадке сохраняется в течение недель после орхидэктомии, а расширенное стероидное воздействие необходимо для восстановления спаривания в длительных кастратах (Noble и Alsum, 1975). Однако инъекции тестостерона в MPOA самцов крыс не могут вызвать CPP (Король, Паккард и Александр, 1999). Это говорит о том, что другие области мозга важны для усиления андрогенов.
Напротив, самцы крыс образуют CPP для инъекций тестостерона в Acb (Packard et al., 1997). Как и в случае с другими препаратами злоупотребления, DA, вероятно, будет ключевым нейротрансмиттером для усиления тестостерона: CPP, вызванный системной инъекцией тестостерона, блокируется антагонистами D1 и D2 дофаминовых рецепторов (Шредер и Паккард, 2000). Однако, в отличие от других наркотических средств, наши исследования у хомячков показывают, что тестостерон не вызывает выброс Acb DA (Триемстра, Сато и Вуд, в прессе). Аналогично, исследования крыс-самцов показывают, что андрогены не влияют на базальные уровни DA или стимулированный амфетамином DA-релиз (Биргнер, Киндллунд-Хогберг, Ниберг и Бергстром, 2006; но также см. Кларк, Линденфельд и Гиббонс, 1996). Кроме того, тестостерон оказывает относительно незначительное влияние на уровни ткани Acb DA (Тиблин, Финн, Росс и Стенфорс, 1999). Вместе эти данные свидетельствуют о том, что хотя усиление тестостерона может в конечном счете изменить активность DA в Acb, механизмы могут отличаться от механизмов кокаина или других стимуляторов. В связи с этим недавние данные свидетельствуют о том, что хроническое воздействие ААС может изменить чувствительность к ДА, изменив метаболизм ДА (Курлинг, Канкаанпаа, Эллерма, Карила и Сеппала, 2005), уровни DA-рецепторов (Киндлунд, Линдблом, Бергстром, Викберг и Нюберг, 2001; Киндлунд, Линдблом и Ниберг, 2003) или транспортер DA (Киндлунд, Бергстром, Моназам, Халлберг, Бломквист, Лангстром и Ниберг, 2002).
В настоящее время неизвестные специфические стероидные сигналы, рецепторы и участки мозга для действия подкрепления тестостерона неизвестны. Основываясь на недавнем исследовании хомяков из нашей лаборатории, усиливающие эффекты тестостерона, по-видимому, опосредуются как андрогенами, так и эстрогенами (DiMeo и Wood, 2006). Общеупорядоченные AAS включают как ароматизируемые, так и неароматизируемые андрогены (Gallaway, 1997; WADA, 2006). Это означает, что как AR, так и ER могут трансформировать стероидные стимулы для вознаграждения. Существует дополнительная возможность того, что усиление тестостерона может быть опосредовано комбинацией классических и негеномных рецепторов.
Несколько линий доказательств указывают на действия негеномных рецепторов в усиливающих эффектах ААС. В дополнение к редкому распределению AR в Acb и VTA, время подкрепления андрогеном быстрое (<30 мин), и обработка сигнала через классический AR может быть недостаточно быстрой для подкрепления. Соответственно, чтобы проверить роль негеномной AR в усилении AAS, мы использовали два дополнительных метода (Рис 7). В одном эксперименте (Сато, Йохансен, Иордания и Вуд, 2006), мы разрешили крысам с мутацией феминизации яичка (Tfm, см. эту проблему), чтобы самостоятельно управлять дигидротестостероном (DHT), неароматизируемым андрогеном. Мутация Tfm значительно уменьшает связывание лиганда при AR. Тем не менее, крысы Tfm и их родные братья дикого типа самостоятельно вводили примерно такое же количество DHT. Это говорит о негеномных эффектах DHT. В последующем исследовании мы определили, будут ли мужские хомячки самостоятельно управлять DHT, конъюгированные с бычьим сывороточным альбумином (BSA, Рис 8, Сато и дерево, 2007). Конъюгаты DHT-BSA являются мембранонепроницаемыми; поэтому их эффекты ограничены поверхностью клетки. Хомяки самостоятельно управляют ДГТ, как было продемонстрировано ранее (DiMeo и Wood, 2006). Они показали аналогичное предпочтение конъюгатам DHT-BSA, но не смогли самостоятельно управлять BSA.

Рис 7

Рис 8
Эти данные указывают на центральную роль AR для клеточной поверхности в андрогенном усилении. В настоящее время точная природа таких рецепторов неизвестна. Было высказано предположение, что андрогены могут воздействовать на клеточную поверхность посредством связывания с выделенной мембраной AR (Томас, Одевание, Панг, Берг, Таббс, Беннингхофф и Даути, 2006, также см. этот вопрос). Это может быть в виде внеядерного классического AR, как сообщается в гиппокампе (Sarkey et al., В этом выпуске). Альтернативно, в предыдущих исследованиях также описаны сайты, связывающие стероиды, на других нейромедиаторных системах. В частности, различные стероидные гормоны, включая AAS, могут аллостерически модулировать рецептор ГАМК-А (Хендерсон, 2007; Ламберт, Белелли, Педен, Варди и Петерс, 2003). Аналогично, сульфатированные нейростероиды могут модифицировать активность N-Метил-D- подтипы рецептора-аспартата (Малаев, Гиббс и Фарб, 2002). Это важная область для будущих исследований.
Почему должна быть мембрана AR? Как обсуждалось ранее, существует тесная связь между секрецией андрогенов и полезным социальным поведением. Мы можем предположить, что увеличение секреции тестостерона, которое следует за спариванием или борьбой, служит для усиления поведения. Если это так, необходимо иметь быстрое сочетание стимула (поведения) и вознаграждения (тестостерона). Этого лучше всего достичь путем связывания с мембраной AR. В этой связи было бы интересно определить, снижает ли зажимную секрецию андрогенов во время спаривания отрицательные эффекты сексуального поведения.
Обзор
Здесь мы рассмотрим доказательства того, что андрогены являются мощными медиаторами мотивированного поведения взрослых и, кроме того, время воздействия андрогена во время программ развития андрогензависимое мотивированное поведение во взрослой жизни. Анаболические стероиды быстро становятся предпочтительным средством злоупотребления подростками в США. В то время как у AAS, возможно, нет привыкания к кокаину или героину, мы только начинаем понимать потенциал андрогенного усиления и зависимости. В частности, поскольку молодежные виды спорта становятся более конкурентоспособными, усиливается давление на развитие спортсменов на использование стероидов, начиная с более раннего возраста. Эта тенденция вызывает беспокойство в связи с новыми доказательствами стероид-чувствительного нервного созревания у подростков.
Несмотря на повышенную осведомленность как общественных, так и научных сообществ о глубоких нервных изменениях, сопровождающих подростковый возраст, экспериментальное исследование нейробиологии развития половой зрелости было ограничено. Модели животных развития подростков необходимы для изучения того, как время воздействия гормона во время развития увеличивает риск для человека в отношении психопатологии и употребления наркотиков, а также то, какие типы событий смягчают или усиливают поведенческие эффекты отклонений в пубертатном сроке. Например, социальные факторы, такие как влияние сверстников, усугубляют последствия пубертатного времени для употребления психоактивных веществ и алкоголя (Biehl, Natsuaki и Ge, 2007; Паттон, Новый, Ли и Хикок, 2004; Саймонс-Мортон и Хейни, 2003; Wichstrom и Pedersen, 2001). Модели животных с пубертатным сроком также будут информировать исследовательские усилия человека и потенциально привести к более эффективным терапевтическим вмешательствам в подростковом возрасте.
Благодарности
Мы благодарим Eleni Antzoulatos, Cortney Ballard, Lucy Chu, Kelly Peters, Jennifer Triemstra, Jane Venier, Lisa Rogers и Pamela Montalto за помощь в этих исследованиях. Эта работа поддерживается грантами от NIH (DA12843 до RIW, MH68764 до CLS и MH070125 до KMS).
Сноски
Отказ от ответственности издателя: Это файл PDF из неотредактированной рукописи, который был принят для публикации. В качестве сервиса для наших клиентов мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергаться копированию, набору и обзору полученного доказательства до его публикации в его окончательной форме. Обратите внимание, что во время производственного процесса могут быть обнаружены ошибки, которые могут повлиять на содержимое, и все юридические заявления об отказе от ответственности, которые применяются к журналу.
Рекомендации
- Alexander GM, Packard MG, Hines M. Тестостерон обладает хорошими аффективными свойствами у самцов крыс: последствия для биологической основы сексуальной мотивации. Поведенческая нейронаука. 1994;108: 424-8. [PubMed]
- Андерсен С.Л. Траектории развития мозга: точка уязвимости или окно возможностей? Неврология и биоповеденческие обзоры. 2003;27: 3-18. [PubMed]
- Andersen SL, Rutstein M, Benzo JM, Hostetter JC, Teicher MH. Сексуальные различия в перепроизводстве и элиминации рецепторов допамина. Neuroreport. 1997;8: 1495-8. [PubMed]
- Арнедо МТ, Сальвадор А, Мартинес-Санчис С., Гонсалес-Боно Е. Награждение свойств тестостерона у нетронутых самцов мышей: экспериментальное исследование. Фармакология, биохимия и поведение. 2000;65: 327-32.
- Arnedo MT, Salvador A, Martinez-Sanchis S, Pellicer O. Подобные полезные эффекты тестостерона у мышей, оцененных как пациенты с латентностью короткой и длительной атаки. Биология зависимости. 2002;7: 373-9. [PubMed]
- Арнольд А.П., Бридлове С.М. Организационные и активационные эффекты сексуальных стероидов на мозг и поведение: повторный анализ. Гормоны и поведение. 1985;19: 469-98. [PubMed]
- Бенеш Ф.М., Тейлор Дж. Б., Каннингем М.К. Конвергенция и пластичность моноаминергических систем в медиальной префронтальной коре в постнатальном периоде: последствия для развития психопатологии. Кора головного мозга. 2000;10: 1014-27. [PubMed]
- Benes FM, Turtle M, Khan Y, Farol P. Миелинизация ключевой релейной зоны в формировании гиппокампа происходит в мозге человека в детстве, юности и взрослой жизни. Архив общей психиатрии. 1994;51: 477-84. [PubMed]
- Biehl MC, Natsuaki MN, Ge XJ. Влияние пубертатного времени на употребление алкоголя и траектории тяжелого питья. Журнал молодежи и подросткового возраста. 2007;36: 153-167.
- Биргнер С, Киндллунд-Хогберг А.М., Ниберг Ф., Бергстром Л. Письма о нейробиологии. 2006. Изменены внеклеточные уровни ДОПАК и HVA в оболочке ядра крысы крысы в ответ на субхроническое введение нандролона и последующую проблему амфетамина.
- Bond AJ, Choi PY, Pope HG., Jr Оценка смещения внимания и настроения у пользователей и пользователей, не являющихся пользователями анаболических андрогенных стероидов. Наркотическая и алкогольная зависимость. 1995;37: 241-5. [PubMed]
- Brower KJ. Нарушение анаболических стероидов и зависимость. Текущие отчеты психиатрии. 2002;4: 377-87. [PubMed]
- Brower KJ, Catlin DH, Blow FC, Eliopulos GA, Бересфорд ТП. Клиническая оценка и анализ мочи на злоупотребление анаболически-андрогенным стероидом и зависимость. Американский журнал злоупотребления наркотиками и алкоголем. 1991;17: 161-171. [PubMed]
- Celotti F, Negri-Cesi P, Poletti A. Стероидный обмен в мозге млекопитающих: 5alpha-редукция и ароматизация. Бюллетень исследований мозга. 1997;44: 365-75. [PubMed]
- Chung WC, De Vries GJ, Swaab DF. Сексуальная дифференциация ядра костей стриевых терминалов у людей может распространиться во взрослую жизнь. Журнал неврологии. 2002;22: 1027-33. [PubMed]
- Кларк А.С., Хендерсон Л.П. Поведенческие и физиологические реакции на анаболически-андрогенные стероиды. Неврология и биоповеденческие обзоры. 2003;27: 413-36. [PubMed]
- Clark AS, Lindenfeld RC, Gibbons CH. Анаболико-андрогенные стероиды и мозговая награда. Фармакология, биохимия и поведение. 1996;53: 741-5.
- Conacher GN, Workman DG. Насильственные преступления, возможно, связаны с использованием анаболического стероида. Американский журнал психиатрии. 1989;146: 679. [PubMed]
- Каннингем Р.Л., Макгиннис М.Ю. Физическая провокация половых анаболических андрогенных стероидов, подвергнутых воздействию самцов крыс, вызывает агрессию по отношению к самкам. Гормоны и поведение. 2006;50: 410-6. [PubMed]
- Daly RC, Su TP, Schmidt PJ, Pickar D, Murphy DL, Rubinow DR. Цереброспинальная жидкость и поведенческие изменения после введения метилтестостерона: предварительные результаты. Архив общей психиатрии. 2001;58: 172-7. [PubMed]
- Davis EC, Shryne JE, Gorski RA. Структурные половые диморфизмы в переднецентрическом перивентрикулярном ядре гипоталамуса крысы чувствительны к гонадальным стероидам перинатально, но развиваются перипубертально. Нейроэндокринология. 1996;63: 142-8. [PubMed]
- de Beun R, Jansen E, Slangen JL, Van de Poll NE. Тестостерон как чувствительный и дискриминационный стимул у крыс: эффекты, связанные с сексом и дозой. Физиология и поведение. 1992;52: 629-34. [PubMed]
- Декабан А.С. Изменения веса мозга во время жизни человека: отношение веса мозга к высотам тела и весам тела. Анналы неврологии. 1978;4: 345-56. [PubMed]
- Di Chiara G, Imperato A. Препараты, злоупотребляемые людьми, преимущественно повышают концентрацию синаптических дофаминов в мезолимбической системе свободно движущихся крыс. Труды Национальной академии наук Соединенных Штатов Америки. 1988;85: 5274-8. [Бесплатная статья PMC] [PubMed]
- DiMeo AN, Wood RI. Самоуправление эстрогенами и дигидротестостероном у мужских хомячков. Гормоны и поведение. 2006;49: 519-26. [PubMed]
- DiPasquale M. Анаболические стероиды. В: Tarter RE, Ammerman RT, Ott PJ, редакторы. Справочник по злоупотреблению психоактивными веществами. Пленум Пресс; NY: 1998. pp. 547-565.
- Dominguez J, Riolo JV, Xu Z, Hull EM. Регулирование медиальной амигдалой копуляции и медиального преоптического допамина. Журнал неврологии. 2001;21: 349-355. [PubMed]
- Dominguez JM, Hull EM. Стимуляция медиальной амигдалы усиливает медиальное преоптическое допаминное выделение: последствия для сексуального поведения мужчин-крыс. Исследование мозга. 2001;917: 225-229. [PubMed]
- Du J, Lorrain DS, Hull EM. Кастрация снижается внеклеточно, но увеличивает внутриклеточный допамин в медиальной преоптической области самцов крыс. Исследование мозга. 1998;782: 11-17. [PubMed]
- Экенхофф М.Ф., Ракич П. Природа и судьба пролиферативных клеток в гиппокампальной зубчатой извилине в течение жизни резус-обезьяны. Журнал неврологии. 1988;8: 2729-47. [PubMed]
- Everitt BJ, Stacey P. Исследования инструментального поведения с сексуальным усилением у самцов крыс (Rattus norvegicus): II. Воздействие преоптических поражений области, кастрации и тестостерона. Журнал сравнительной психологии. 1987;101: 407-19. [PubMed]
- Галлауэй С. Библия стероидов. Belle International Press; Сакраменто, Калифорния: 1997.
- Galligani N, Renck A, Hansen S. Профиль личности мужчин, использующих анаболические андрогенные стероиды. Гормоны и поведение. 1996;30: 170-5. [PubMed]
- Grimes JM, Melloni RH., Jr Длительные изменения в нейронной системе серотонина после прекращения подросткового анаболико-андрогенного воздействия стероидов у хомячков (Mesocricetus auratus) Поведенческая нейронаука. 2006;120: 1242-51. [PubMed]
- Hannan CJ, Jr, Friedl KE, Zold A, Kettler TM, Plymate SR. Психологические и сывороточные изменения гомованилиновой кислоты у мужчин, которым вводили андрогенные стероиды. Психонейроэндокринология. 1991;16: 335-43. [PubMed]
- Harrison RJ, Connor DF, Nowak C, Nash K, Melloni RH., Jr Хроническое анаболически-андрогенное лечение стероидами во время подросткового возраста увеличивает передний гипоталамический вазопрессин и агрессию у нетронутых хомяков. Психонейроэндокринология. 2000;25: 317-38. [PubMed]
- Он J, Экипаж FT. Нейрогенез уменьшается во время созревания мозга от подросткового возраста до взрослой жизни. Фармакология, биохимия и поведение. 2007;86: 327-33.
- Хендерсон Л.П. Стероидная модуляция передачи GABAA-опосредованной передачи в гипоталамусе: воздействие на репродуктивную функцию. Нейрофармакология. 2007;52: 1439-53. [Бесплатная статья PMC] [PubMed]
- Hull EM, Du J, Lorrain DS, Matuszewich L. Внеклеточный допамин в медиальной преоптической области: последствия для сексуальной мотивации и гормонального контроля копуляции. Журнал неврологии. 1995;15: 7465-7471. [PubMed]
- Hull EM, Meisel RL, Sachs BD. Мужское сексуальное поведение. В: Pfaff DW, Arnold AP, Etgen AM, Fahrbach SE, Rubin RT, редакторы. Гормоны, мозг и поведение. Академическая пресса; Нью-Йорк: 2002. pp. 3-137.
- Hull EM, Wood RI, McKenna KE. Нейробиология мужского сексуального поведения. В: Neill JD, редактор. Физиология репродукции. Том 1. Elsevier Press; Нью-Йорк: 2006. pp. 1729-1824.
- Huttenlocher PR, Dabholkar AS. Региональные различия в синаптогенезе в коре головного мозга человека. Журнал сравнительной неврологии. 1997;387: 167-78. [PubMed]
- Johnson LR, Wood RI. Устное введение тестостерона у мужчин хомяков. Нейроэндокринология. 2001;73: 285-92. [PubMed]
- Johnston LD, O'Malley PM, Bachman JG. Учащиеся средней школы (публикация NIH № 03-5375) I. Bethesda, MD: Национальный институт по злоупотреблению наркотиками; 2003. Мониторинг результатов национального общенационального опроса по вопросам потребления наркотиков, 1975-2002.
- Фонд семьи Кайзер. Американская сексуальная активность. 2005. pp. # 3040-02.
- Kashon ML, Hayes MJ, Shek PP, Sisk CL. Регулирование иммунореактивности рецепторов андрогенных рецепторов андрогенами в препубертатных мужских хорьках. Биология репродукции. 1995;52: 1198-205. [PubMed]
- Kindlundh AM, Bergstrom M, Monazzam A, Hallberg M, Blomqvist G, Langstrom B, Nyberg F. Допаминергические эффекты после хронического лечения нандролоном, визуализированным в мозге крысы с помощью позитронно-эмиссионной томографии. Прогресс в нейропсихофармакологии и биологической психиатрии. 2002;26: 1303-8.
- Kindlundh AM, Lindblom J, Bergstrom L, Wikberg JE, Nyberg F. Анаболико-андрогенный стероид-нандролон-деканоат влияет на плотность допамин-рецепторов в мозге мужской крысы. Европейский журнал неврологии. 2001;13: 291-6. [PubMed]
- Kindlundh AM, Lindblom J, Nyberg F. Хроническое введение с нандролон-деканоатом вызывает изменения содержания ген-транскрипта допамина D (1) и D (2) -рецепторов в мозге крысы. Исследование мозга. 2003;979: 37-42. [PubMed]
- King BE, Packard MG, Александр ГМ. Аффективные свойства внутримедиальных преоптических областей инъекций тестостерона у самцов крыс. Письма о нейробиологии. 1999;269: 149-52. [PubMed]
- Koob GF, Nestler EJ. Нейробиология наркомании. Журнал нейропсихиатрии и клинической неврологии. 1997;9: 482-97. [PubMed]
- Кури Е.М., Лукас С.Е., Папа Х.Г., младший, Олива П.С. Повышенная агрессивная реакция у добровольцев-мужчин после введения постепенно возрастающих доз тестостерона ципионата. Наркотическая и алкогольная зависимость. 1995;40: 73-9. [PubMed]
- Kritzer MF. Долгосрочная гонадэктомия влияет на плотность тирозингидроксилазы, но не допамин-бета-гидроксилаза-, холин-ацетилтрансфераза- или серотонин-иммунореактивных аксонов в медиальной префронтальной коре взрослых крыс-самцов. Кора головного мозга. 2003;13: 282-296. [PubMed]
- Kurling S, Kankaanpaa A, Ellermaa S, Karila T, Seppala T. Влияние субхронического лечения нандролона деканоатом на дофаминергические и серотонинергические нейронные системы в мозге крыс. Исследование мозга. 2005;1044: 67-75. [PubMed]
- Ламберт Дж. Дж., Белелли Д, Педен Д.Р., Варди А.В., Петерс Дж. Нейростероидная модуляция GABAA-рецепторов. Прогресс в нейробиологии. 2003;71: 67-80. [PubMed]
- Ленроот РК, Джидд Дж. Развитие мозга у детей и подростков: понимание анатомической магнитно-резонансной томографии. Неврология и биоповеденческий обзор. 2006;30: 718-29.
- Lesting J, Neddens J, Teuchert-Noodt G. Онтогения интранации допамина в ядре прилежащих песчанок. Исследование мозга. 2005;1066: 16-23. [PubMed]
- Малаев А., Гиббс Т.Т., Фарб Д.Х. Ингибирование NMDA-ответа прегненолоновым сульфатом обнаруживает подтип селективной модуляции NMDA-рецепторов сульфатированными стероидами. Британский журнал фармакологии. 2002;135: 901-9. [Бесплатная статья PMC] [PubMed]
- Мартинес М, Гильен-Салазар Ф., Сальвадор А, Симон В.М. Успешная межмолекулярная агрессия и условное расположение предпочтений у мышей. Физиология и поведение. 1995;58: 323-8. [PubMed]
- Meek LR, Romeo RD, Novak CM, Sisk CL. Действия тестостерона у препубертатных и постпубертатных мужских хомячков: диссоциация эффектов на репродуктивное поведение и иммунореактивность рецепторов андрогенных рецепторов. Гормоны и поведение. 1997;31: 75-88.
- Meisel RL, Joppa MA. Условное расположение места у женщин-хомяков после агрессивных или сексуальных контактов. Физиология и поведение. 1994;56: 1115-8. [PubMed]
- Меллони Р.Х., младший, Коннор Д.Ф., Ханг ПТ, Харрисон Р.Ю., Феррис К.Ф. Анаболико-андрогенное воздействие стероидов в подростковом возрасте и агрессивное поведение у золотых хомяков. Физиология и поведение. 1997;61: 359-64. [PubMed]
- Menard C, Harlan R. Повышенная регуляция иммунореактивности андрогенового рецептора в мозге крысы андрогенно-анаболическими стероидами. Исследование мозга. 1993;622: 226-236. [PubMed]
- Mermelstein PG, Becker JB, Surmeier DJ. Эстрадиол уменьшает течения кальция в нейроатальных нейронах крысы через мембранный рецептор. Журнал неврологии. 1996;16: 595-604. [PubMed]
- Midgley SJ, Heather N, Davies JB. Уровни агрессии среди группы анаболико-андрогенных пользователей стероидов. Медицина, наука и право. 2001;41: 309-14.
- Molenda-Figueira HN, Salas-Ramirez KY, Schulz KM, Zehr JL, Montalto PR, Sisk CL. Социальный опыт подростков восстанавливает эякуляторное поведение взрослых у самцов сирийских хомячков, лишенных пубертатного тестостерона. Общество поведенческой нейроэндокринологии; Pacific Grove, CA: 2007.
- Noble RG, Alsum PB. Гормональные зависимые полые диморфизмы у золотого хомяка (Mesocricetus auratus) Физиология и поведение. 1975;14: 567-74. [PubMed]
- Nunez JL, Lauschke DM, Juraska JM. Смертность клеток при развитии задней коры у самцов и самцов крыс. Журнал сравнительной неврологии. 2001;436: 32-41. [PubMed]
- Nunez JL, Sodhi J, Juraska JM. Гормоны яичников после послеродового дня 20 уменьшают число нейронов в первичной зрительной коре головного мозга крысы. Журнал нейробиологии. 2002;52: 312-21. [PubMed]
- O'Connor DB, Archer J, Wu FC. Влияние тестостерона на настроение, агрессию и сексуальное поведение у молодых мужчин: двойное слепое, плацебо-контролируемое, перекрестное исследование. Журнал клинической эндокринологии и метаболизма. 2004;89: 2837-45. [PubMed]
- Packard MG, Корнелл А.Х., Александр ГМ. Награждение аффективных свойств инъекций интрануклеарных приемов тестостерона. Поведенческая нейронаука. 1997;111: 219-24. [PubMed]
- Parfitt DB, Thompson RC, Richardson HN, Romeo RD, Sisk CL. МРНК GnRH увеличивается с половым созреванием в мужском мозге сирийского хомяка. Журнал нейроэндокринологии. 1999;11: 621-7. [PubMed]
- Parrott AC, Choi PY, Davies M. Использование анаболических стероидов спортсменами-любителями: воздействие на состояние психологического настроения. Журнал спортивной медицины и физической подготовки. 1994;34: 292-8. [PubMed]
- Patton PE, New MJ, Lee DM, Hickok LR. Диагноз и репродуктивный результат после хирургического лечения полной септильной матки, дублированной шейки матки и вагинальной перегородки. Американский журнал акушерства и гинекологии. 2004;190: 1669-75. 1675-8. [PubMed]
- Paus T, Collins DL, Evans AC, Leonard G, Pike B, Zijdenbos A. Созревание белого вещества в мозге человека: обзор исследований магнитного резонанса. Бюллетень исследований мозга. 2001;54: 255-66. [PubMed]
- Perry PJ, Kutscher EC, Lund BC, Yates WR, Holman TL, Demers L. Меры агрессии и изменения настроения у мужских тяжелоатлетов с использованием андрогенного анаболического стероида и без него. Журнал судебных наук. 2003;48: 646-51. [PubMed]
- Peters KD, Wood RI. Андрогенная зависимость у хомячков: передозировка, толерантность и потенциальные опиоидерические механизмы. Neuroscience. 2005;130: 971-81. [PubMed]
- Pfaus JG, Damsma G, Nomikos GG, Wenkstern DG, Blaha CD, Phillips AG, Fibiger HC. Сексуальное поведение усиливает центральную передачу дофамина у самцов крысы. Исследование мозга. 1990;530: 345-348. [PubMed]
- Phoenix CH, Goy RW, Gerall AA, Young WC. Организация действия пренатально вводимого тестостерона пропионата на ткани, опосредующие спаривание у самки морской свинки. Эндокринологии. 1959;65: 369-82. [PubMed]
- Пинос Х, Колладо П, Родригес-Зафра М., Родригес С, Сеговия С., Гильямон А. Развитие половых различий в локусе корулеуза крысы. Бюллетень исследований мозга. 2001;56: 73-8. [PubMed]
- Папа Х.Г., младший, Кац Д.Л. Убийство и близкое к убийствам пользователей анаболических стероидов. [См. Комментарий] Журнал клинической психиатрии. 1990;51: 28-31. [PubMed]
- Папа Х.Г., младший, Кац Д.Л. Психиатрические и медицинские эффекты использования анаболических андрогенных стероидов. Контролируемое исследование спортсменов 160. Архив общей психиатрии. 1994;51: 375-82. [PubMed]
- Папа Х.Г., младший, Кури Э.М., Пауэлл К.Ф., Кэмпбелл С, Кац Д.Л. Использование анаболических андрогенных стероидов среди заключенных 133. Всесторонняя психиатрия. 1996;37: 322-7. [PubMed]
- Putnam SK, Du J, Sato S, Hull EM. Тестостерон, восстанавливающий копулятивное поведение, коррелирует с медиальным преоптическим высвобождением допамина у кастрированных самцов крыс. Гормоны и поведение. 2001;39: 216-224. [PubMed]
- Putnam SK, Sato S, Hull EM. Влияние метаболитов тестостерона на копуляцию и медиальное преоптическое допаминное выделение у кастрированных самцов крыс. Гормоны и поведение. 2003;44: 419-26. [PubMed]
- Putnam SK, Sato S, Riolo JV, Hull EM. Влияние метаболитов тестостерона на совокупление, медиальный преоптический допамин и NOS-иммунореактивность у кастрированных самцов крыс. Гормоны и поведение. 2005;47: 513-522. [PubMed]
- Rankin SL, Partlow GD, McCurdy RD, Giles ED, Fisher KR. Постнатальный нейрогенез в вазопрессине и окситоцинсодержащем ядре гипоталамуса свиньи. Исследование мозга. 2003;971: 189-96. [PubMed]
- Ricci LA, Rasakham K, Grimes JM, Melloni RH., Jr Серотонин-1A рецепторная активность и экспрессия модулируют подростческую анаболическую / андрогенную вызванную стероидами агрессию у хомяков. Фармакология, биохимия и поведение. 2006;85: 1-11.
- Romeo RD, Cook-Wiens E, Richardson HN, Sisk CL. Дигидротестостерон активирует сексуальное поведение у взрослых мужских хомячков, но не у несовершеннолетних. Физиология и поведение. 2001;73: 579-84. [PubMed]
- Romeo RD, Diedrich SL, Sisk CL. Иммунореактивность рецептора эстрогена у препубертатных и взрослых мужчин сирийских хомяков. Письма о нейробиологии. 1999;265: 167-70. [PubMed]
- Romeo RD, Parfitt DB, Richardson HN, Sisk CL. Феромоны вызывают эквивалентные уровни Fos-иммунореактивности у препубертатных и взрослых сирийских хомяков. Гормоны и поведение. 1998;34: 48-55. [PubMed]
- Romeo RD, Richardson HN, Sisk CL. Половое созревание и созревание мужского мозга и сексуального поведения: восстановление поведенческого потенциала. Неврология и биоповеденческие обзоры. 2002a;26: 381-91. [PubMed]
- Romeo RD, Wagner CK, Jansen HT, Diedrich SL, Sisk CL. Эстрадиол индуцирует гипоталамический рецептор прогестерона, но не активирует спаривание у мужских хомячков (Mesocricetus auratus) до полового созревания. Поведенческая нейронаука. 2002b;116: 198-205. [PubMed]
- Salas-Ramirez KY, Montalto PR, Sisk CL. Анаболические андрогенные стероиды (AAS) по-разному влияют на социальное поведение подростков и взрослых сирийских хомяков. Гормоны и поведение. 2008 в прессе.
- SAMHSA / ОАГ. Публикация DHHS Нет (SMA) 1996. Обследование домашних хозяйств 1994 по злоупотреблению наркотиками, основные выводы 1994; pp. 96-3085.
- SAMHSA / ОАГ. Результаты Национального опроса по использованию и здоровью наркоманов 2004: национальные результаты. 2005. Серия NSDUH H-28, DHHS Публикация № SMA 05-4062.
- Sato SM, Johansen J, Jordan CL, Wood RI. Самолечение андрогенов у крыс Tfm. 10th Ежегодное собрание общества по поведенческой нейроэндокринологии. 2006.
- Sato SM, Wood RI. Самоорганизация мембранно-непроницаемых анаболико-андрогенных стероидов (ааз) у сирийских хомяков. 11th Ежегодное собрание общества по поведенческой нейроэндокринологии. 2007.
- Schroeder JP, Packard MG. Роль подтипов рецептора допамина в приобретении предпочтения тестостерона для условных мест у крыс. Письма о нейробиологии. 2000;282: 17-20. [PubMed]
- Schulte HM, Hall MJ, Boyer M. Домашнее насилие, связанное с злоупотреблением анаболическим стероидом. Американский журнал психиатрии. 1993;150: 348. [PubMed]
- Шульц К.М., Менард Т.А., Смит Д.А., Альберс О.Э., Сиск К.Л. Выращивание яичного гормона в подростковом возрасте организует повязку с фланговым положением и связывание рецептора вазопрессина в боковой перегородке. Гормоны и поведение. 2006;50: 477-83. [PubMed]
- Шульц К.М., Ричардсон Х.Н., Ромео Р.Д., Моррис Дж. А., Глэндленд К. Дж., Сиск К.Л. Медиальные преоптические допаминергические реакции на женские феромоны развиваются во время полового созревания у самца сирийского хомяка. Исследование мозга. 2003;988: 139-45. [PubMed]
- Шульц К.М., Ричардсон Х.Н., Зехр Л.Л., Оссек А.Я., Менард Т.А., Сиск К.Л. Гонадальные гормоны маскируют и демиминируют репродуктивное поведение во время полового созревания у самца сирийского хомяка. Гормоны и поведение. 2004;45: 242-9. [PubMed]
- Schulz KM, Sisk CL. Пубертальные гормоны, мозг подростков и созревание социального поведения: уроки сирийского хомяка. Молекулярная и клеточная эндокринология. 2006:254–255. 120–6.
- Schulz KM, Zehr JL, Salas-Ramirez KY, Sisk CL. Планировщик встреч Neuroscience. Сандиго, Калифорния: Общество неврологии; 2007. Является ли подростковый период вторым чувствительным периодом для организации воздействия тестостерона на репродуктивное поведение взрослых мужчин? 2007 Online.
- Скотт Дж. П., Стюарт Дж. М., Де Гетт В. Дж. Критические периоды в организации систем. Психология развития. 1974;7: 489-513. [PubMed]
- Shughrue PJ, Lane MV, Merchenthaler I. Сравнительное распределение рецептор-альфа-рецепторов эстрогена и -бета в центральной нервной системе крысы. Журнал сравнительной неврологии. 1997;388: 507-25. [PubMed]
- Саймонс-Мортон Б.Г., Хейни Д.Л. Психосоциальные предикторы повышенной стадии курения среди шестого класса. Американский журнал поведения здоровья. 2003;27: 592-602. [PubMed]
- Sisk CL, Zehr JL. Пубертальные гормоны организуют мозг и поведение подростков. Границы в нейроэндокринологии. 2005;26: 163-74. [PubMed]
- Соуэл Э.Р., Томпсон П.М., Леонард С.М., Добро пожаловать С.Е., Кан Е, Тога AW. Продольное картирование толщины коры и рост мозга у нормальных детей. Журнал неврологии. 2004;24: 8223-31. [PubMed]
- Соуэлл Э.Р., Томпсон П.М., Тесснер К.Д., Тога А.В. Сопоставление продолжающегося роста головного мозга и снижение плотности серого вещества в дорсальной лобной коре: обратные отношения во время созревания головного мозга. Журнал неврологии. 2001;21: 8819-29. [PubMed]
- Копье LP. Подростковый мозг и возрастные поведенческие проявления. Неврология и биоповеденческий обзор. 2000;24: 417-63.
- Su TP, Pagliaro M, Schmidt PJ, Pickar D, Wolkowitz O, Rubinow DR. Нейропсихиатрические эффекты анаболических стероидов у мужчин нормальных добровольцев. JAMA. 1993;269: 2760-4. [PubMed]
- Thiblin I, Finn A, Ross SB, Stenfors C. Повышенная дофаминергическая и 5-гидрокситриптаминергическая активность в мужском мозге крыс после длительного лечения анаболическими андрогенными стероидами. Британский журнал фармакологии. 1999;126: 1301-6. [Бесплатная статья PMC] [PubMed]
- Томас П, одевание G, Pang Y, Berg H, Tubbs C, Benninghoff A, Doughty K. Прогестин, эстроген и андроген G-белковые рецепторы в рыбных гонадах. Стероиды. 2006;71: 310-6. [PubMed]
- Трикер Р., Касабури Р., Сторер Т.В., Клевенджер Б., Берман Н., Ширази А., Бхасин С. Эффекты супрафизиологических доз тестостерона на гневное поведение у здоровых эугонадальных мужчин - исследование центра клинических исследований. Журнал клинической эндокринологии и метаболизма. 1996;81: 3754-8. [PubMed]
- Triemstra JL, Nagatani S, Wood RI. Хемосенсорные сигналы необходимы для спаривания индуцированного высвобождения допамина в MPOA мужских сирийских хомяков. Neuropsychopharmacology. 2005;30: 1436-42. [PubMed]
- Triemstra JL, Sato SM, Wood RI. Тестостерон и ядро приспосабливают допамин у самца сирийского хомяка. психонейроэндокринологии (в прессе)
- Van Eenoo P, Delbeke FT. Распространенность допинга во Фландрии по сравнению с распространением допинга в международных видах спорта. Международный журнал спортивной медицины. 2003;24: 565-570. [PubMed]
- WADA. Неблагоприятные аналитические данные, представленные аккредитованными лабораториями. 2006. http://www.wada-ama.org.
- Wesson DW, McGinnis MY. Укладка анаболических андрогенных стероидов (AAS) во время полового созревания у крыс: нейроэндокринная и поведенческая оценка. Фармакология, биохимия и поведение. 2006;83: 410-9.
- Wichstrom L, Pedersen W. Использование анаболических андрогенных стероидов в подростковом возрасте: выигрыш, хороший взгляд или плохое? Журнал исследований алкоголя. 2001;62: 5-13. [PubMed]
- Wood RI, Johnson LR, Chu L, Schad C, Self DW. Усиление тестостерона: внутривенное и внутричерепно-мозговое самолечение у самцов крыс и хомяков. Психофармакологии. 2004;171: 298-305. [PubMed]
- Wood RI, Newman SW. Андроген и эстрогеновые рецепторы сосуществуют с отдельными нейронами в мозге сирийского хомяка. Нейроэндокринология. 1995;62: 487-97. [PubMed]
- Wood RI, Swann JM. Нейронная интеграция хемосенсорных и гормональных сигналов, которые контролируют сексуальное поведение мужчин. В: Wallen K, Schneider JS, редакторы. Воспроизведение в контексте. MIT Press; Кембридж: 1999. pp. 423-444.
- Zahm DS, Heimer L. Два транспаллидных пути, происходящих в ядре крысы. Журнал сравнительной неврологии. 1990;302: 437-46. [PubMed]