Neurosci Biobehav Rev. 2011 Ян; 35 (3): 939-55. doi: 10.1016 / j.neubiorev.2010.10.014. Epub 2010 Ноябрь 2.
- 1Бернард Б. Броди Кафедра неврологии Университета Кальяри, Cittadella Universitaria, 09042 Monserrato, CA, Италия. [электронная почта защищена]
АННОТАЦИЯ
Окситоцин является мощным индуктором эрекции полового члена при введении в центральную нервную систему. У самцов крыс наиболее чувствительной областью мозга для эректильного эффекта окситоцина является паравентрикулярное ядро гипоталамуса. Это ядро и окружающие области содержат клетки клеток всех окситоцинергических нейронов, выступающих в области экстра-гипоталамуса мозга и спинного мозга. Этот обзор показывает, что окситоцин индуцирует эрекцию полового члена также при инъекции в некоторых из этих областей (например, вентральную тегментальную область, вентральную суббулуму гиппокампа, заднечеловеческое кортикальное ядро миндалины и торако-поясничного спинного мозга). Микроинъекционные исследования в сочетании с исследованиями внутридицевого микродиализа и двойного иммунофлюоресценции показывают, что окситоцин в этих областях активирует прямо или косвенно (в основном через глютаминовую кислоту) мезолимбические допаминергические нейроны. Допамин, высвобождаемый в ядре, в свою очередь активирует нейронные пути, ведущие к активации интактно-гипоталамических допаминергических нейронов в паравентрикулярном ядре. Это активирует не только окситоцинергические нейроны, выступающие в спинной мозг и опосредующие эрекцию полового члена, но также и те, которые направлены в вышеуказанные дополнительные гипоталамические области, прямо или косвенно модулируя (через глутаминовую кислоту) активность мезолимбических дофаминергических нейронов, контролирующих мотивацию и вознаграждение. Вместе эти нейронные пути могут представлять собой сложную гипотетическую схему, которая играет роль не только в завершающей фазе сексуальной активности (эректильная функция и совокупление), но также в мотивационных и полезных аспектах опережающей фазы сексуального поведения.
1.Introduction
Эрекция полового члена является мужской сексуальной реакцией, которая играет ключевую роль в размножении млекопитающих, включая человека, и которая также может наблюдаться в контексте, отличном от тех, которые строго связаны с размножением. В зависимости от контекста, в котором происходит эрекция полового члена, в его регуляции участвуют различные центральные и периферические нейронные и / или гуморальные механизмы (см. Meisel и Sachs, 1994, Argiolas и Melis, 1995, 2004, 2005, Sachs, 2000, 2007, McKenna, 2000, Giuliano и Rampin, 2000, 2004, Andersson, 2001, Melis и Argiolas, 1995a, 2003, Hull и др., 2002). Среди центральных нейротрансмиттеров и нейропептидов, которые контролируют эрекцию полового члена, наиболее известны допамин, серотонин, возбуждающие аминокислоты, оксид азота, адренокортикотропин, окситоцин и опиоидные пептиды, Они могут способствовать или препятствовать эрекции полового члена, действуя в нескольких областях мозга, т.е. медиальная преоптическая область, паравентрикулярное ядро гипоталамуса, брюшная тегментальная область, гиппокамп, миндалевидная клетка, ядро постели стрии, ядро укупоривает, продолговатый мозг и спинной мозг (Таблица 1) (см. Meisel and Sachs, 1994, Witt and Insel, 1994, Stancampiano и др., 1994, Argiolas и Melis, 1995, 2005, Argiolas, 1999, Bancila и др., 2002, Giuliano и Rampin, 2000, McKenna, 2000, Andersson, 2001, Hull и др., 2002, Coolen и др., 2004).
Окситоцин, нейрогипофизарный пептид, хорошо известный своей гормональной ролью в лактации и родах, присутствует у самок и самцов не только в нейронах с клеточными телами, расположенных в паравентрикулярных и супраоптических ядрах гипоталамуса, выступающих в нейрогипофиз, но и в проекциях нейронов от паравентрикулярного ядра и окружающих его структур до внегипоталамических областей мозга (т. е. перегородки, брюшной тегментальной области, гиппокампа, миндалины, продолговатого мозга и спинного мозга). Предполагается, что эти нейроны задействованы в многочисленных центральных функциях, таких как память, обучение, аффилированное и социально-сексуальное поведение, включая эрекцию полового члена и копулятивное поведение (см. Buijs, 1978, Sofroniew, 1983, Argiolas and Gessa, 1991, Pedersen et al. , 1992, Carter, 1992, Wagner и Clemens, 1993, Ivell and Russel, 1995, Carter et al., 1997, Tang и др., 1998, Veronneau-Longueville и др., 1999). Действительно, окситоцин облегчает эректильную функцию и мужское половое поведение у мышей, крыс, кроликов и обезьян (см. Argiolas and Gessa, 1991, Carter, 1992, Pedersen и др., 1992, Argiolas и Melis, 1995, 2004, Argiolas, 1999). Это может произойти и у людей, так как окситоцин плазмы увеличивается сексуальными стимулами, особенно при эякуляции (Carmichael et al., 1987, Murphy et al., 1987) и манипуляцией с грудью и гениталиями, которые обычно возникают во время полового половое сношение (Tindall, 1974).
Способствующий эффект окситоцина на мужское сексуальное поведение впервые был продемонстрирован способностью внутривенного окситоцина уменьшать латентность до первой эякуляции и замедлять половое истощение мужских кроликов в паре с восприимчивыми самками (Melin and Kihlstrom, 1963). Однако сексуальные эффекты окситоцина были окончательно распознаны только в восьмидесятых годах. Затем было найдено, что окситоцин, полученный централизованно в количествах нанограмм, способен индуцировать эрекцию полового члена (Argiolas et al., 1985, 1986) и улучшить копулятивное поведение (Arletti et al., 1985) у самцов крыс и увеличить лордоз у самок крыс (Arletti и Bertolini, 1985, Caldwell и др., 1986), по-видимому, действуя на окситоцинергические рецепторы маточного типа (см. Argiolas and Melis, 1995, 2004, Argiolas, 1999, Melis и Argiolas, 2003 и ссылки в них). Окситоцин улучшает сексуальное поведение не только у половозрелых самцов крыс (Arletti et al., 1985), но также у взрослых самцов крыс (Arletti et al., 1990) и у доминирующих, но не у подчиненных, обезьян-белок-самцов (Уинслоу и Инсел , 1991).
Проэректильный эффект окситоцина является тестостеронозависимым, поскольку он отменяется гипофизэктомией и кастрацией и восстанавливается добавлением тестостерона или его метаболитов, эстрадиола и 5_-дигидро-тестостерона, вместе взятых (Melis et al., 1994a). Наиболее чувствительной областью мозга для индукции эрекции полового члена окситоцином является паравентрикулярное ядро гипоталамуса (Melis et al., 1986), из которого происходят все экстра-гипоталамические окситоцинергические проекции (см. Выше). Было обнаружено, что окситоцин способен индуцировать эрекцию полового члена (и зевоту) при инъекции в дозах до 3 пмоль (см. Раздел 2.1 ниже). Окситоцин индуцирует эрекцию полового члена также при инъекции в двухстороннем порядке в поле CA1 гиппокампа, но не в дорзальной субкулуме (см. Раздел 2.3 ниже), боковая перегородка, хвостатое ядро, медиальная преоптическая область, вентромедиальное ядро гипоталамуса и супраоптическое ядро (Melis et al., 1986). Что касается механизма, с помощью которого окситоцин действует в паравентрикулярном ядре, чтобы вызвать этот сексуальный ответ, многочисленные исследования показывают, что окситоцин активирует собственные нейроны. В соответствии с этой гипотезой, сексуальное взаимодействие увеличивает FOS, продукт гена непосредственного раннего гена c-fos в паравентрикулярных окситоцинергических нейронах, выступающих в спинной мозг, которые участвуют в контроле эрекции полового члена (см. Witt and Insel, 1994 и ссылки в нем) и сексуальная импотенция (например, неспособность взрослой самки крысы к совокуплению с овариэктомированной эстроген-прогестеронноподобной восприимчивой самкой) была связана с мужской крысой с низкими уровнями мРНК окситоцина в паравентрикулярном ядре гипоталамуса (Arletti et al., 1997).
В настоящее время неясно, влияет ли окситоцин на фазу опережения или на завершающую стадию сексуального поведения, Поскольку окситоцин индуцирует эрекцию полового члена, и основным эффектом окситоцина на копулятивное поведение является уменьшение интервала после эякуляции у самцов крыс (Arletti et al., 1985), разумно предположить, что пептид улучшает сексуальную активность. Однако, поскольку окситоцин также увеличивает социально-половое взаимодействие (см. Pedersen et al., 1992, Carter et al., 1997, Ivell and Russel, 1995) и антагонисты рецепторов окситоцина, предотвращают бесконтактные эрекции (Melis et al., 1999a), которые (см. Sachs, 1997, 2000, 2007, Melis et al., 1998, 1999b и ссылки в них), нельзя исключать возможную роль окситоцина в сексуальном возбуждении и сексуальной мотивации.
В этом обзоре обобщены опубликованные и неопубликованные результаты последних исследований, которые показывают, что окситоцин индуцирует эрекцию полового члена не только при введении в паравентрикулярное ядро гипоталамуса, но и в других экстра-гипоталамических областях мозга, таких как брюшная тегментальная область (Melis et al., 2007, 2009a, Succu и др., 2008), tон вентральный субикулум гиппокампа и заднее ядро миндалины (Melis et al., 2009b, 2010), которые являются важными составляющими лимбической системы и, как считается, играют ключевую роль в процессах мотивации и вознаграждения. Эти исследования показывают, что окситоцин участвует в нейронных цепях, которые включают в себя другие нейротрансмиттеры, такие как допамин и глутаминовую кислоту, и другие области мозга, отличные от паравентрикулярного ядра, например, вентральную тегментальную область, прилежащие ядра, гиппокамп и районы, определены. Эти схемы, вероятно, будут опосредованы взаимодействием мезолимбика и интра-гипоталамической дофаминергической системы и сыграть роль не только в завершающей фазе мужского сексуального поведения (например, эрекция полового члена и копуляции), но и в сексуальной мотивации и сексуальном следовательно, обеспечивая нейронный субстрат для объяснения мотивационных и полезных свойств сексуальной активности.
2. Окситоцин влияет на эрекцию полового члена, действуя в разных областях мозга
2.1. Паравентрикулярное ядро гипоталамуса
Как было напомнено выше, паравентрикулярное ядро гипоталамуса вскоре было идентифицировано как область мозга, наиболее чувствительная к эректируемому эффекту окситоцина. При инъецировании в одностороннем порядке в этом ядре окситоцин был активен при дозах, равных 3 ng (3 пмоль) (Melis et al., 1986). Исследования зависимости структуры и активности показали, что индуцированная окситоцином эрекция полового члена была опосредована рецепторами окситоцина типа uterinetype, связанными с притоком Ca2 + в клеточные тела окситоцинергических нейронов, выступающих в области экстра-гипоталамуса и активизацией оксида азота-синтазы. Оксид азота, в свою очередь, действуя как внутриклеточный мессенджер с еще неизвестным механизмом (не включающим гуанилатциклазу), приводит к активации окситоцинергических нейронов, выступающих в спинной мозг и внегипоталамические области мозга, что приводит к эрекции полового члена (рис. 1) (см. ниже и Argiolas и Melis, 1995, 2004, 2005 и ссылки в них). Способность окситоцина активировать собственные нейроны
Рис. 1. (MISSING) Схематическое представление окситоцинергических нейронов, которые происходят в паравентрикулярном ядре гипоталамуса, и проецируются на экстрагифоталамические области мозга, такие как спинной мозг, VTA, гиппокамп, миндалин и т. Д. Активация этих нейронов посредством допамин, возбуждающие аминокислоты, сам окситоцин, аналог-пептиды гексарелина и пептиды, полученные из VGF, приводят к эрекции полового члена, которая может быть уменьшена и / или отменена стимуляцией рецепторов CB1 GABAergic, опиоидов и каннабиноидов. Активация окситоцинергических нейронов является вторичной по отношению к активации присутствующей в этих нейронах синтазы оксида азота. Действительно, эндогенный оксид азота, образованный стимуляцией допамина, возбуждающей аминокислоты или окситоциновых рецепторов или экзогенной оксиды азота, так как полученный из доноров оксида азота, передаваемых непосредственно в паравентрикулярное ядро, активирует окситоцинергические нейроны еще неизвестным механизмом, по-видимому, не связан с стимуляция гуанилатциклазы. Это приводит, в свою очередь, к высвобождению окситоцина в спинном мозге и в экстра-гипоталамических областях мозга. Некоторые подробности о механизмах, с помощью которых окситоцин индуцирует эрекцию полового члена при их высвобождении в этих областях, например, VTA, вентральную суббукулу и миндалину, описаны в соответствующих разделах области мозга. Здесь окситоцин действует на собственные рецепторы и увеличивает продукцию NO, что приводит к эрекции полового члена, как установлено в PVN. Однако, в отличие от PVN, в каудальном VTA NO активируется гуанилатциклаза. Это вызывает увеличение концентрации цГМФ, приводящее к активации мезолимбических дофаминергических нейронов и эрекции полового члена. В VS NO активируется глутаматергические нейроны, выступающие в области экстрагиппокампа, включая VTA. Глутаминовая кислота в VTA активирует, в свою очередь, мезолимбические допаминергические нейроны, обнаруженные с окситоцином. Механизмы, подобные описанным выше, вероятно, будут действовать также, когда эрекция полового члена происходит в физиологических условиях, а именно, когда самцов крыс помещают в присутствии недоступной восприимчивой самки (например, бесконтактные эрекции) или во время совокупления.
в паравентрикулярном ядре подтверждалось исследованиями, показывающими, что: (1) окситоциновые рецепторы присутствуют в этом гипоталамическом ядре (Freund-Mercier et al., 1987, Freund-Mercier и Stoeckel, 1995); (2) окситоцин облегчает собственное выделение in vitro и in vivo (Freund-Mercier и Richard, 1981, 1984, Moos и др., 1984); а также (3) окситоцин возбуждает собственные нейроны, действуя в паравентрикулярном ядре (Yamashita et al., 1987). Кроме того, в паравентрикулярном и супраоптическом ядре гипоталамуса были идентифицированы окситоцинергические синапсы, падающие на клеточные тела магнетоцеллюлярных окситоцинергических нейронов (Theodosis, 1985). Наконец, разрушение центральных окситоцинергических нейронов электролитическими или химическими экситотоксическими поражениями паравентрикулярного ядра, которое полностью истощает содержание окситоцина через центральную нервную систему и спинной мозг, отменяет не только эректильный эффект окситоцина, но также ухудшает вызванное лекарством эрекция полового члена и неконтактные эрекции (см. ниже и Argiolas et al., 1987a, b; Liu et al., 1997 и ссылки в ней). Результаты, аналогичные тем, которые были обнаружены при поражениях паравентрикулярного ядра, обнаружены у сильных и селективных антагонистов рецепторов окситоцина. Действительно, эти соединения, инъецированные в паравентрикулярное ядро в количествах нанограмм, предотвращали полностью индуцированную окситоцином эрекцию полового члена, тогда как при вдавании в боковые желудочки предотвращали не только эрекции полового члена, вызванные самим окситоцином, но и индуцированную лекарством эрекцию полового члена (см. Раздел 3 ниже и Argiolas и Melis, 1995, 2004, 2005 и ссылки в них) и бесконтактные эрекции (Melis et al., 1999a) и, кроме того, чрезвычайно эффективны в снижении копулятивного поведения сексуально-сильных самцов крыс (Argiolas et al., 1988). Кроме того, сексуальное взаимодействие увеличивает FOS, генный продукт немедленного раннего гена c-fos в паравентрикулярных окситоцинергических нейронах, выступающих в спинной мозг, участвующих в контроле эрекции полового члена (см. Witt and Insel, 1994 и ссылки в нем). Наконец, сексуальная импотенция (например, неспособность взрослой самки крысы к совокуплению с эстроген-прогестеронприемной восприимчивой самкой) hкак также было связано с мужской крысой с низким уровнем мРНК окситоцина и синтазы азот-оксида в паравентрикулярном ядре гипоталамуса (Benelli et al., 1995, Arletti et al., 1997) (обширный обзор этих исследований см. Argiolas, 1999, Argiolas и Melis, 2004, 2005).
2.2. Вентральная тегментальная область
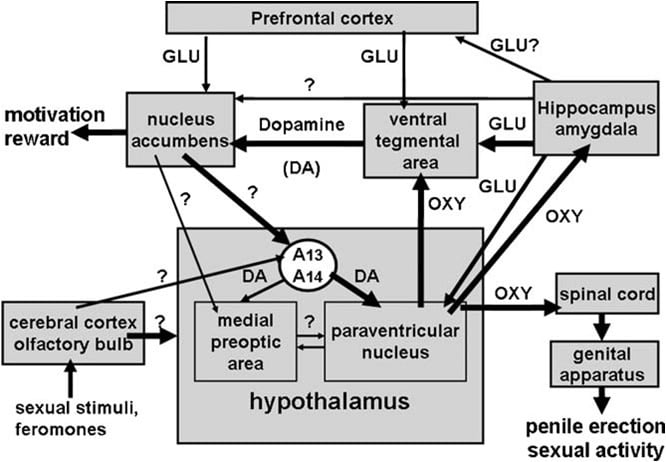
Вентральная тегментальная область была обнаружена только недавно как участок мозга, в котором окситоцин индуцирует эрекцию полового члена, Эта область содержит окситоцинергические нервные окончания, возникающие в паравентрикулярном ядре и окситоциновых рецепторах (Freund-Mercier et al., 1987, Vaccari et al., 1998). Точнее, был обнаружен окситоцин, способный к iпри введении в одностороннем порядке в хвостовую часть, но не в ростральной брюшной тегментальной области в зависимости от дозы (Melis et al., 2007). Активные дозы были выше, чем те, которые требуются при введении в паравентрикулярное ядро, и аналогичны тем, которые индуцируют эрекцию полового члена при введении в брюшную суббулюму гиппокампа или в заднечеловеческое кортикальное ядро миндалины (см. Ниже). По-видимому, проэректильный эффект опосредуется активацией мезолимбических допаминергических нейронов, выступающих в оболочку ядра accumbens, который, в свою очередь, активирует все еще неизвестные нейронные пути, направленные на интра-гипоталамические допаминергические нейроны, падающие на паравентрикулярные окситоцинергические нейроны, опосредующие эрекцию полового члена (Melis et al., 2007, 2009a).
Что касается механизма, посредством которого окситоцин активирует допаминергическую нейротрансмиссию в брюшной тегментальной области, имеющиеся данные показывают, что окситоцин стимулирует окситоцинергические рецепторы, расположенные в клеточных телах мезолимбических дофаминергических нейронов. Это увеличивает приток Ca2 + внутри тел клеток дофаминергических нейронов, тем самым активируя синтазу оксида азота (Succu et al., 2008). В отличие от паравентрикулярного ядра (см. Раздел 3 ниже) оксид азота, в свою очередь, активирует гуанилатциклазу, что увеличивает концентрацию циклического GMP. В соответствии с этим механизмом либо d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин, сильнодействующий антагонист окситоцина, либо S-метил-тио-1-цитруллин, мощный ингибитор нейрональной оксид-синтазы азота, вводимый в каудальной вентральной тегментальной области перед окситоцином, отмене эрекции полового члена и увеличению внеклеточной концентрации дофамина в оболочке прилежащего ядра, вызванного окситоцином. Кроме того, 8-бромциклический GMP, активный устойчивый к фосфодиэстеразе циклический GMP-аналог, индуцирует эрекцию полового члена при введении в каудальную вентральную тегментальную область и увеличивает внеклеточную концентрацию дофамина в оболочке ядра accumbens, как это обнаружено с использованием окситоцина, инъецированного в каудальная брюшная тегментальная область (Succu et al., 2008, Melis et al., 2009a) (см. также рисунок 2).
Всегда в соответствии с этим механизмом галоперидол, мощный антагонист рецептора DOPNUMX дофамина, вводимый в оболочку ядра accumbens, уменьшает эрекцию полового члена, вызванную окситоцином, введенным в брюшную тегментальную область (Melis et al., 2). Вышеупомянутый механизм также подтверждается исследованиями двойной иммунофлюоресценции, показывающими, что окситоциновые волокна поражаются клеточными телами дофаминергических нейронов в хвостовой вентральной тегментальной области, которые ранее были помечены ретроградным индикатором Fluorogold, введенным в оболочку ядра accumbens ( Melis et al., 2007, Succu и др., 2007). Активации этих допаминергических нейронов и допаминовых рецепторов в ядре accumbens приводят, в свою очередь, к активации нейронных путей, которые еще предстоит идентифицировать, которые стимулируют интактно-гипоталамические дофаминергические нейроны, чтобы высвободить допамин в паравентрикулярном ядре, тем самым активируя окситоцинергические нейроны, направленные на спинной мозг и опосредующая эрекция полового члена (см. выше и Melis et al., 2007; Succu et al., 2007, 2008). Действительно, окситоцин вводили в хвостовую вентральную тегментальную область в дозе, которая вызывала эрекцию полового члена, повышала внеклеточную концентрацию дофамина в диализате, полученную не только от ядрового прилегания, но также от паравентрикулярного ядра (Succu et al., 2007).
2.3. Гиппокамп
Поле CA1 гиппокампа было другой областью мозга, богатой окситоцинергическими волокнами и рецепторы, идентифицированные в более ранних исследованиях, в которых введение индуцированной окситоцином эрекции полового члена (см. Bujis, 1978, Sofroniew, 1983). Однако, в отличие от паравентрикулярного ядра, здесь был обнаружен окситоцин, способный индуцировать эрекцию полового члена только при инъецировании в билатеральном и в более высоких дозах, чем те, которые были обнаружены в паравентрикулярном ядре (Melis et al., 1986, Chen et al., 1992). Инъекции окситоцина в суббукулу были обнаружены неактивными в этих более ранних исследованиях. Однако недавние и более тщательные исследования микроинъекции приводят к область вентральной субкулумы в которой инъекция окситоцина способна индуцировать эрекцию полового члена дозозависимым образом (Melis et al., 2009b). Проэректильный эффект окситоцина, вводимого в эту область мозга, наблюдался при дозах, аналогичных тем, которые были обнаружены в брюшной тегментальной области после односторонней инъекции (Melis et al., 2007), как обнаружено в паравентрикулярном ядре. По-видимому, окситоцин, вводимый в брюшную субкулуму, индуцирует эрекцию полового члена путем активации окситоцинергических рецепторов в нейронах, содержащих оксид азота-синтазы, что приводит к увеличению производства оксида азота. Оксид азота, в свою очередь, действуя как межклеточный мессенджер, активирует нейротрансмиссию глутаминовой кислоты, приводя к эрекции полового члена, возможно через нервные (глутаматергические) эфферентные проекции из вентральной субкулумы к внегипокампальным областям мозга, модулирующим активность мезолимбических дофаминергических нейронов (например, вентральную тегментальную область, префронтальную кору, паравентрикулярное ядро) (см. ниже и Melis, 2007, 2009b, Succu et al., 2008).
Этот механизм действия подтверждается экспериментами по внутримитровому микродиализу, которые показывают, что окситоцин, вводимый в брюшную суббукулу в дозах, которые индуцируют эрекцию полового члена, увеличивает производство оксида азота и концентрацию внеклеточного глутаминовой кислоты в диализате из вентральной субкулуля (Melis et al. , 2010) и внеклеточного допамина в ядре accumbens (Melis et al., 2007). Эти ответы были антагонизированы не только антагонистом рецептора окситоцина d (CH2) 5Tyr (Me) 2-Orn8-вазотоцином, но также ингибитором нейронального оксида азота-синтазы S-метилтиоциклулином и гемоглобином-поглотителем оксида азота, данным в брюшную суббукулу за несколько минут до окситоцина (Melis et al., 2010).
Более того, в соответствии с этим механизмом действия активация глутаматергической нейротрансмиссии NMDA, вводимая в брюшную суббукулу, индуцирует эрекцию полового члена (Melis et al., 2010). В настоящее время неизвестен фенотип эфферентных выступов из вентральной субикулумы, которые вызывают активацию мезолимбических допаминергических нейронов и увеличение внеклеточного дофамина в ядре accumbens. Однако, поскольку эрекция полового члена, вызванная окситоцином, инъецированным в брюшную суббукулу, происходит одновременно с увеличением внеклеточной глутаминовой кислоты в диализате из брюшной тегментальной области, но не от укусов ядра и антагонизируется (+) MK-801, мощный неконкурентный антагонист рецепторов возбуждающих аминокислот подтипа NMDA (Woodruff et al., 1987), вводимый в брюшную тегментальную область, но не в прилежащие ядра (см. рис. 2 и Melis et al., 2009b) , вероятно, эти проекции приводят к активации глутаматергической нейротрансмиссии в брюшной тегментальной области, которая, в свою очередь, активирует мезолимбические допаминергические нейроны, выступающие в ядро accumbens. Установлено, что повышенная концентрация глутаминовой кислоты, обнаруженная в брюшной тегментальной области после инъекции окситоцина в брюшную суббукулу, высвобождается из нейронов, происходящих из субкулума или других областей мозга (например, префронтальной коры). Тем не менее, это вызывает активацию мезолимбических дофаминергических нейронов и повышенное высвобождение допамина в ядре accumbens. Здесь активация дофаминовых рецепторов приводит к активации интактно-гипоталамических дофаминергических нейронов, высвобождая допамин в паравентрикулярном ядре, тем самым активируя окситоцинергические нейроны, выступающие в спинной мозг и опосредующие эрекцию полового члена (см. выше, и Melis et al., 2007, 2009a, Succu et al., 2008).
2.4. Амигдала
Амигдала - еще одна область мозга, богатая окситоциновыми волокнами и рецепторами (см. Freund-Mercier et al., 1987, Vaccari и др., 1998, Uhl-Bronner и др., 2005). Окситоцин здесь считается вовлеченным в различные функции: от анксиолиза, социальной памяти и познания, социально усиленного обучения, эмоциональной эмпатии, эмоциональной обработки лица и страха у людей к эректильной функции и сексуальному поведению (см. Kondo et al., 1998; Dominguez et. al., 2001, Ebner и др., 2005, Huber и др., 2005, Domes и др., 2007, Petrovic и др., 2008, Lee et al., 2009, Donaldson and Young, 2009, Hurlemann et al. , 2010). Однако способность окситоцина индуцировать эрекцию полового члена у самцов крыс, когда они индуцированы в заднедомном кортикальном ядре миндалины, была обнаружена только недавно (Melis et al., 2009b). Этот ответ происходил одновременно с увеличением внеклеточной концентрации допамина в диализате, полученном из оболочки ядра accumbens, как было обнаружено после инъекции окситоцина в брюшную субкулуму (Melis et al., 2009b). Механизм, с помощью которого окситоцин, инъецированный в постмодиальное корковое ядро миндалины, индуцирует эрекцию полового члена, на данный момент неизвестен. Имеющиеся данные показывают, что как эрекция полового члена, так и увеличение концентрации внеклеточного дофамина в диализате, полученном из ячеек accumbens, опосредованы активацией окситоцинергических рецепторов, поскольку оба ответа были отменены антагонистом рецептора окситоцина d (CH2) 5Tyr ( Me) 2-Orn8-вазотоцин, инъецированный в ядро амигдала за несколько минут до окситоцина (Melis et al., 2009b).
Независимо от того, какой механизм окситоцина активируется в заднемедиальном кортикальном ядре миндалины, сексуальный ответ, индуцированный пептидом, отменяется блокаде всех допаминергических рецепторов с цис-флупентиксолом, введенным в оболочку ядра accumbens, и блокаде NMDA-рецепторов с ( +) MK-801 вводили в брюшную тегментальную область, но не в ядро accumbens, как установлено для эрекции полового члена, вызванного окситоцином, введенным в брюшную суббукулу (Melis et al., 2009b). Это говорит о том, что окситоцин, введенный в заднемедиальное ядро миндалины, активирует нейротрансмиссию глутаминовой кислоты в брюшной тегментальной области. Это, в свою очередь, вызывает активацию мезолимбических допаминергических нейронов, что приводит к эрекции полового члена. В связи с исследованиями, в которых показаны нейронные пути, соединяющие это ядро миндалины с вентральной суббукулой (Canteras et al., 1995, French and Totterdell, 2003), эти данные повышают вероятность взаимодействия между этими двумя областями мозга, хотя прямые были описаны пути из миндалины либо в ядро accumbens, либо в брюшную тегментальную область (Kelley and Domesick, 1982; Witter, 2006).
2.5. Спинной мозг
Спинной мозг представляет собой еще одну область центральной нервной системы, которая содержит окситоцинергические волокна и рецепторы (Freund-Mercier et al., 1987, Uhl-Bronner и др., 2005), в которых окситоцин индуцирует эрекцию полового члена (Tang et al., 1998 , Veronneau-Longueville et al., 1999, Giuliano and Rampin, 2000, Giuliano et al., 2001). Как упоминалось выше, эти окситоцинергические волокна возникают в паравентрикулярном ядре гипоталамуса и способствуют нисходящим путям, контролирующим спинальные вегетативные нейроны, опосредующие эрекцию полового члена. Действительно, эти волокна образуют синаптические контакты в догазальных родовых преганглионарных симпатических и парасимпатических клетках в грудном и поясничном сакральном тракте со спинальными нейронами, иннервирующими кавернозные тела полового члена (Marson and McKenna, 1996, Giuliano and Rampin, 2000, Giuliano et al. , 2001). Эти синаптические контакты были продемонстрированы путем маркировки спинальных нейронов, происходящих из пениса, и достижения спинного мозга с помощью специфических ретроградных индикаторов, инъецированных в кавернозные тела, в сочетании с исследованиями двойной иммунофлуоресценции и конфокальной лазерной микроскопии (Tang et al., 1998, Veronneau-Longueville et al., 1999). В соответствии с этими исследованиями у анестезированных крыс-самцов интратекальная инъекция кумулятивных доз окситоцина в пояснично-крестцовом, но не на уровне торако-поясничного уровня вызывала внутрикавернозное давление в зависимости от дозы. Эти эффекты были отменены блокаде окситоцинергического рецептора с помощью d (CH2) 5Tyr (Me) 2-Orn8-вазотоцина и секцией тазовых нервов (Giuliano and Rampin, 2000, Giuliano et al., 2001). Эти результаты показывают, что окситоцин, действующий на пояснично-крестцовый спинной мозг, увеличивает внутрикавернозное давление и предполагает, что окситоцин, высвобождаемый при физиологической активации паравентрикулярного ядра, является мощным активатором спинальных эректильных нейронов, выступающих в кавернозные тела. Интересно, что эти проэректильные спинальные нейроны, на которых окситоцин действует, чтобы оказывать его эректильный эффект, также получают синаптические контакты из серотонинергических нейронов, происходящих в ядре paragigantocellularis ретикулярной формации продолговатого мозга (Marson and McKenna, 1992, Tang et al. ., 1998). Разрушение этих серотонинергических нейронов облегчает эякуляцию и пенильные рефлексы у самцов крыс (Marson and McKenna, 1992, Yells и др., 1992). Поскольку лекарственные средства, стимулирующие рецепторы 5HT2C, способствуют эрекции полового члена, когда им вводят внутрибрючно-желудочно, но не в паравентрикулярное ядро, а лекарственные средства, которые блокируют 5HT2C-рецепторы, уменьшают также эрекцию дофаминового агониста и окситоцина, индуцированную пенисом, тогда как антагонисты допамина не уменьшают эрекцию пениса, индуцированную агонистом 5HT2C (например, см. Stancampiano et al., 1994 и ссылки в ней), было также высказано предположение, что окситоцин облегчает действие проэректильных рецепторов 5HT2C на уровне пояснично-крестцового спинного мозга (Stancampiano et al., 1994). Альтернативно, окситоцин может влиять на активность спинальных нисходящих серотонинергических нейронов, действуя непосредственно в ядре paragigantocellularis, где происходят эти нейроны (см. Stancampiano et al., 1994).
3. Взаимодействие окситоцина, дофамина и глутаминовой кислоты в центральной нервной системе и эрекция полового члена
Как упоминалось в разделе 1, все окситоцинергические нейроны, присутствующие в центральной нервной системе, возникают в паравентрикулярном ядре и окружающих его структурах. Активность этих нейронов находится под контролем различных нейротрансмиттеров и / или нейропептидов. Среди наиболее изученных на паравентрикулярном уровне: допамин, глутаминовая кислота, гамма-аминомасляная кислота (ГАМК), оксид азота, эндоканнабиноиды, опиоидные пептиды, пептиды, высвобождающие гормон роста, связанные с VGF пептиды и сам окситоцин. Допамин, глутаминовая кислота, пептиды, высвобождающие гормон роста, VGF-производные пептиды и окситоцин являются стимулирующими, например, эти соединения и их агонисты способствуют эрекции полового члена при введении в паравентрикулярное ядро, тогда как ГАМК, опиоидные пептиды и эндоканнабиноиды ингибируют, например, эти соединения или их агонисты ингибируют эрекцию полового члена (см. Meisel and Sachs, 1994, Witt and Insel, 1994, Argiolas и Melis, 1995, 2004, 2005, Giuliano и Rampin, 2000, 2004, McKenna, 2000, Andersson, 2001, Hull и др., 2002).
Несколько линий экспериментальных данных свидетельствуют о том, что эти окситоцинергические нейроны и вышеупомянутые нейротрансмиттеры и нейропептиды участвуют в контроле над эректильной функцией и сексуальным поведением в разных физиологических условиях. Кроме того, окситоцин, высвобождаемый в областях внегипоталамического мозга, таких как брюшная тегментальная область, гиппокамп и его области, миндалина и спинной мозг, могут влиять на активность этих нейронов, на которые влияют окситоцинергические синапсы. В настоящий момент единственными нейронами, важными для эрекции полового члена, на которых поражаются окситоцинергические синапсы, идентифицированы с уверенностью, являются клеточные тела мезолимбических допаминергических нейронов хвостовой вентральной тегментальной области, выступающие в оболочку ядра accumbens (Melis et al., 2007 , Succu et al., 2008) и проэректильных спинальных нейронов, выступающих из пояснично-крестцового тракта в кавернозные тела (см. Giuliano and Rampin, 2000, Giuliano et al., 2001) (см. Также разделы 2.2 и 2.5) , Действительно, хотя окситоцинергические синапсы и рецепторы были также идентифицированы в брюшной суббукуле, миндалине и спинном мозге, областях, которые важны для эрекции полового члена (см. Выше), в этих областях тип нейротрансмиттера / s, присутствующий в нейронах на которые поражают окситоцинергические нервные окончания, до сих пор неизвестны.
В этом разделе обзора кратко излагается недавняя литература о механизмах, лежащих в основе эректильного эффекта окситоцина, вводимого в хвостовую вентральную тегментальную область, вентральную суббукуму гиппокампа и спинного мозга. Особое внимание уделено взаимодействию пептида с дофамином и глутаминовой кислотой в этих областях и роли, которую это взаимодействие может играть в центральном управлении эректильной функцией. Краткий обзор эффектов допамина и глутаминовой кислоты на окситоцинергические нейроны в паравентрикулярном ядре, которые также играют ключевую роль в эректильной функции, предоставляется во-первых, чтобы информировать читателя о раннем состоянии исследований в этой области, поскольку эти исследования уже широко рассмотрены (см. Argiolas и Melis, 1995, 2004, 2005, Melis и Argiolas, 2003). Также в этом случае особое внимание уделяется самым последним результатам, которые предполагают важную роль как связи допамин-окситоцина, так и связи глутаминовой кислоты с окситоцином не только в половой деятельности (эрекция полового члена и совокупление), но также и в сексуальных возбуждение и сексуальная мотивация.
3.1. Допамин-окситоцинное взаимодействие в паравентрикулярном ядре
Ассоциация способность агонистов допамина индуцировать эрекцию полового члена путем активации центральных окситоцинергических нейронов было предложено сразу же после открытия, что апоморфин индуцирует эрекцию полового члена при инъецировании в паравентрикулярное ядро (Melis et al., 1987), когда был обнаружен антагонист рецептора окситоцина d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин, инъецированный интрацеребровентрикулярно (icv) способный практически полностью уменьшить эрекцию полового члена, вызванную не только окситоцином, данным icv, но также и апоморфином подкожно (Argiolas et al., 1987b). Эти результаты сопровождались результатами других исследований, показывающих сходные результаты, когда d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин получали icv, а апоморфин вводили непосредственно в паравентрикулярное ядро (Melis et al., 1989b), lчто дофаминовые агонисты индуцируют эрекцию полового члена путем активации паравентрикулярных окситоцинергических нейронов, выступающих в области экстра-гипоталамуса мозга и, в частности, к спинному мозгу (см. Argiolas и Melis, 1995, 2004, 2005). В соответствии с этой гипотезой у анестезированных крыс недавно была обнаружена блокада пояснично-сакральных окситоцинергических рецепторов антагонистом рецептора непептидного окситоцина, который был способен уничтожить индуцированные апоморфином повышения внутрикавернозного давления, индуцированного апоморфином агониста допамина, что свидетельствует о паравалентно-спинальный окситоцинергический путь, участвующий в эрекции полового члена (Baskerville et al., 2009).
Исследования, направленные на идентификация рецептора допамина, ответственного за индукцию эрекции полового члена, показали, что агонисты рецепторов дофаминового паравентикулярного ядра индуцируют эрекцию полового члена, действуя на дофаминовые рецепторы семейства D2, как описано с помощью агонистов дофаминовых рецепторов, которые даны системно (см. Melis et al., 1987, Eaton и др., 1991, Melis and Argiolas, 1995a). Соответственно, было найдено, что апоморфин, сильнодействующий смешанный агонист-рецептор D1 / D2 и квинпирол, мощный агонист селективного D2 рецептора, но не SKF 38393, селективный агонист рецептора D1, введенный в это ядро гипоталамуса, способен индуцировать эрекцию полового члена дозозависимым образом , и сексуальный ответ, индуцированный этими агонистами рецептора D2, был отменен антагонистами рецептора D2, такими как галоперидол и 1-сульпирид, но не SCH 23390, селективным антагонистом рецептора D1 (Melis et al., 1987). Способность апоморфина индуцировать эрекцию полового члена при введении в паравентрикулярное ядро также подтверждается исследованиями телеметрии, показывающими, что агонист дофамина, вводимый в паравентрикулярное ядро, способен увеличивать внутрикавернозное давление у крыс-самцов без изменения системного кровяного давления (Chen et al. , 1999, Giuliano and Allard, 2001), обнаруженные после системной инъекции (Bernabè et al., 1999). Эти исследования также подтвердили основную роль рецепторов D2, поскольку агонисты рецептора D1 обычно оказывались неспособными увеличить внутрикавернозное давление при введении в паравентрикулярное ядро (Chen et al., 1999).
Затем было доступно несколько строк экспериментальных данных, предполагающих, что паравентрикулярные рецепторы D2, стимуляция которых индуцирует эрекцию полового члена, расположены на клеточных телах окситоцинергических нейронов. Во-первых, паравентрикулярное ядро содержит дофаминергические нервные терминалы, которые относятся к так называемым инкортогипоталамическим дофаминергическим нейронам. Клеточные тела этих нейронов расположены в группах A13 и A14 из Dahlstrom и Fuxe (1964), широко представлены и иннервируют несколько гипоталамических структур, в том числе паравентрикулярные окситоцинергические нейроны, выступающие в нейрогипофиз и / или внегипоталамические области мозга (Buijs et al., 1984, Lindvall et al., 1984).
Участие этих допаминергических нейронов на паравентрикулярном уровне в контроле эрекции и спаривания полового члена подтверждается исследованиями микродиализа, показывающими, что концентрации внеклеточного дофамина и 3,4-дигидроксифенилуксусной кислоты (DOPAC), ее основного метаболита, увеличиваются в диализате, полученном из паравентрикулярное ядро половозрелых самцов крыс, демонстрирующих бесконтактные эрекции, когда их вводят в недоступную овариэктомированную эстроген + прогестерон-праймированную восприимчивую самку (Melis et al., 2003).
Увеличение допамина и допак-концентраций было еще выше, когда было разрешено копуляцию с восприимчивой самкой (Melis et al., 2003), которая была обнаружена в медиальной преоптической области (Hull et al., 1995) и в ядре accumbens (Pfaus и Everitt, 1995). Во-вторых, несколько исследований показывают, что эрекция полового члена, вызванная стимуляцией паравентрикулярных рецепторов D2, опосредуется окситоцином, высвобождаемым в этих областях. Соответственно, апоморфин, данный в дозах, которые индуцируют эрекцию полового члена, оказался способным увеличивать концентрацию окситоцина не только в плазме крыс и обезьян (Melis et al., 1989a, Cameron et al., 1992), но и в экстрагиталомаксимальном мозге таких областях, как гиппокамп (Melis et al., 1990). В соответствии с этими результатами было показано, что апоморфин, введенный в паравентрикулярное ядро в дозе, которая индуцирует эрекцию полового члена, также может увеличивать также внеклеточную концентрацию дофамина в ядре accumbens, эффект, сниженный антагонистом рецептора окситоцина d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин вводили в брюшную тегментальную область (Succu et al., 2007, Melis et al., 2009a) (см. Также раздел 4). В-третьих, двусторонние электролитические поражения паравентрикулярного ядра, которые почти полностью устраняют окситоцин из внегипоталамических областей мозга (Hawthorn et al., 1985), отменяют апоморфин-индуцированную эрекцию полового члена (Argiolas et al., 1987a) и селективные антагонисты рецепторов окситоцина вводимые в боковые желудочки, но не в паравентрикулярное ядро, уменьшают дозозависимую апоморфин-индуцированную эрекцию полового члена с потенцией, параллельной активности этих соединений в блокирующих рецепторах окситоцина (Melis et al., 1989b). Антагонисты рецепторов окситоцина также чрезвычайно эффективны в снижении облегчения мужского сексуального поведения, вызванного не только окситоцином, но также апоморфином (Argiolas et al., 1988, 1989).
Что касается механизма, посредством которого рецепторы D2, активированные дофамином или агонистами дофаминовых рецепторов, увеличивают активность окситоцинергических нейронов, тем самым высвобождая окситоцин в областях экстрагиоталамического мозга и в спинном мозге, многочисленные экспериментальные данные sподтверждают гипотезу о том, что стимуляция рецепторов D2 увеличивает концентрацию внутриклеточных ионов Ca2 + внутри клеток клеток окситоцинергических нейронов, что приводит к активации оксида азота-синтазы, Ca2 + -кадмодулинзависимый фермент, который присутствует в этих клеточных телах (Vincent and Kimura, 1992, Torres и др., 1993, Sanchez и др., 1994, Sato-Suzuki et al., 1998). Увеличение производства оксида азота вызывает, в свою очередь, активацию окситоцинергических нейронов. Соответственно, (1) апоморфин-индуцированное эрекция полового члена предотвращалось блокаторами органических кальциевых каналов и by_-conotoxin GVIA, мощным и селективным блокатором зависимых от напряжения каналов Ca2 + N-типа (McCleskey и др., 1987), которые были представлены в паравентрикулярном ядро (см. Argiolas et al., 1990 и ссылки в нем); (2) апоморфин, индуцированный апоморфином, предотвращался ингибиторами оксида азота-синтазы, вводимыми в паравентрикулярное ядро (Melis et al., 1994c); и (3) апоморфин и другие агонисты рецептора D2, данные в дозах, которые индуцируют эрекцию полового члена, увеличивают производство оксида азота в паравентрикулярном диализате, полученном внутримицеллярным микродиализом, что было снижено ингибиторами паравентрикулярной оксид-синтазы азота, полученной в дозах, которые снижают D2-рецепторная агонистидизированная эрекция полового члена (Melis et al., 1996). Механизм, посредством которого оксид азота активирует паравентрикулярные окситоцинергические нейроны, до сих пор неизвестен, хотя имеющиеся данные свидетельствуют о том, что оксид азота действует как внутриклеточный мессенджер и что гуанилатциклаза не участвует. Действительно, активный фосфодиэстеразрезистивный аналог циклического GMP, 8-бромциклического GMP, был обнаружен неспособным индуцировать эрекцию полового члена при введении в паравентрикулярное ядро (рис. 2) (см. Melis and Argiolas, 1995b и ссылки в нем).
Вышеприведенная интерпретация часто считалась не убедительной, главным образом потому, что стимуляция рецепторов дофамина D2 обычно связана с ингибированием, а не с возбуждением клеточных тел нейронов, содержащих эти рецепторы, через различные механизмы, связанные с белком G (см. Sokoloff и Schwartz, 1995). Однако возможное объяснение этого несоответствия, которое прямо связано с прямой стимуляцией паравентрикулярных окситоцинергических нейронов допамином, недавно было предложено обнаружением G-протеин-дофамин D4 рецептор, член семейства рецепторов D2 (D2, D3 и D4), стимуляция которого увеличивает приток Ca2 + в клеточных препаратах, содержащих клонированную версию этого подтипа рецептора (Moreland et al., 2004). Более того, было обнаружено, что селективный агонист рецептора D4 (например, ABT 724) (N-метил-4- (2-цианофенил) пиперазинил-3метилбензамидмалеат) способен индуцировать эрекцию полового члена у самцов крыс при системном (Brioni et al., 2004). Этот эффект не был обнаружен с помощью селективного агониста подтипа D2 PNU-95666E (R-5,6-дигидро-N, N-диметил-4Himidazo [4,5,1-i] хинолин-5-амин) (Hsieh et al., 2004), который также не смог увеличить приток Ca2 + в клеточных препаратах, содержащих клонированную версию подтипа рецептора D4 (Brioni et al., 2004, Moreland et al., 2004). В соответствии с приведенной выше гипотезой и результатами PD 168,077 (N-метил-4- (2-цианофенил) пиперазинил-3-метилбензамидмалеат), PIP-3EA (2- [4- (2-метоксифенил) пиперазин-1-илметил] имидазо [1,2-a] пиридин) и других селективных агонистов рецептора D4 (Heier et al., 1997, Melis et al., 2006b, Löber et al., 2009), были обнаружены в способных индуцировать эрекцию полового члена при инъецировании системно, icv и в паравентрикулярное ядро, хотя и менее эффективно, чем апоморфин. Проэректильный эффект этих агонистов рецептора D4 был предотвращен L-745,870 (3- (4- [хлорфенил] пиперазин-1-ил) метил-1H-пирроло [2,3-B] пиридин-тригидрохлорид), селективный рецептор D4 антагониста (Patel et al., 1997, Melis et al., 2005, 2006b, Löber et al., 2009).
Наконец, проэректильный эффект вышеуказанных агонистов рецептора D4 также был снижен ингибиторами оксида азота-синтазы, введенными в паравентрикулярное ядро, и d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин, антагонистом селективного антагониста окситоцина учитывая icv, но не в паравентрикулярном ядре. Эти результаты согласуются с гипотезой о том, что агонисты рецептора D4 также стимулируют окситоцинергические нейроны, активируя оксид азота-синтазу и высвобождая окситоцин в областях экстрагиоталамического мозга, что, в свою очередь, способствует эрекции полового члена, как показано для агонистов апоморфина и классического D2 (Melis et al. ., 2005, 2006b, Löber и др., 2009).
Вышеприведенные данные также подтверждают гипотезу о том, что допамин индуцирует эрекцию полового члена, воздействуя на рецепторы D4, расположенные на клеточных телах паравентрикулярных окситоцинергических нейронов, и которые вызывают увеличение притока Ca2 + в клеточные тела окситоцинергических нейронов, что приводит к увеличению производства оксида азота. Оксид азота, в свою очередь, активирует окситоцинергические нейроны, чтобы высвободить окситоцин во внегипоталамических областях мозга и в спинном мозге, как уже обсуждалось. В этой связи, следует отметить, что рецепторы допамина были идентифицированы в клеточных телах окситоцинергических нейронов в паравентрикулярном ядре только недавно с помощью двойных иммунофлуоресцентных исследований с использованием высокоселективных антител к D2, D3 и D4 и с окситоциновыми антителами. Эти исследования показали экспрессию всех трех подтипов D2рецепторов (D2, D3 и D4), которые совместно локализованы отдельно в клеточных телах окситоцинергических нейронов в паравентрикулярном ядре (а также в супраоптическом ядре и медиальной преоптической области) (Baskerville и Douglas, 2008, Baskerville и др., 2009).
Это обеспечивает сильную нейроанатомическую поддержку возможности того, что агонисты дофамина и дофаминового рецептора типа D2 индуцируют эрекцию полового члена путем активации непосредственно окситоцинергических нейронов, выступающих в области экстрагипоталамического мозга, упомянутых выше, например, спинного мозга, брюшной тегментальной области, гиппокампа и миндалины. Однако эти данные не дают никакой помощи в идентификации подтипа рецептора D2 / s, стимуляция которого вызывает эректильную реакцию. К сожалению, никакая помощь не может быть получена даже из исследований, направленных на выявление окситоцинергических нейронов, активированных агонистами дофаминовых рецепторов в паравентрикулярном ядре. Действительно, несмотря на различную активность по различным подтипам допамин-рецепторов, либо агонисты смешанного дофаминового рецептора (например, апоморфин), либо селективные агонисты рецептора D2 (например, quinpirole, который действует на все подтипы D2-рецепторов) или селективные агонисты рецептора D4 активацию окситоцинергических нейронов, измеряемую увеличением белка FOS в парвоцеллюлярных окситоцинергических нейронах паравентрикулярного ядра (Bitner et al., 2006). Однако этот вывод был недавно поставлен под сомнение, поскольку увеличение белка FOS в паравентрикулярных окситоцинергических нейронах было обнаружено только тогда, когда эрекция полового члена была вызвана кинероланом, который действует главным образом на подтипы D2 и D3, но не PD 168077, агонистом рецептора D4, несмотря на способность обоих соединений индуцировать сексуальный ответ (Baskerville et al., 2009).
Дальнейшие эксперименты с селективными агонистами других подтипов D2-рецепторов (в основном D2 и D3) затем необходимы для определения точной роли каждого подтипа рецептора допамина в контроле эректильной функции на паравентрикулярном уровне. В связи с этим, как уже упоминалось ранее, апоморфин, который эффективно действует на все подтипы допамин-рецепторов (см. Brioni et al., 2004 и ссылки в нем), намного эффективнее агонистов рецепторов D4 в индуцировании эрекции полового члена при введении в паравентрикулярный ядро. Это может быть объяснено более высоким сродством апоморфина к D4-рецепторам по сравнению с аналогами тестируемых агонистов рецептора D4, или, альтернативно, агонисты рецептора D4 могут действовать как частичные агонисты рецептора D4, или сопутствующая активация различных подтипов рецептора допамина апоморфином может производят более высокую активацию окситоцинергических нейронов, опосредующих эрекцию полового члена, чем активация только агонистами рецептора D2 только подтипа рецептора D4.
Взаимодействие между дофаминовыми D1 и D2-рецепторами уже описано в контроле сексуального поведения на уровне медиальной преоптической области (см. Hull et al., 1989). В случае, когда неспособность селективных агонистов рецептора D2 индуцировать эрекцию полового члена (Hsieh et al., 2004) будет подтверждена (но см. Depoortère et al., 2009), например, даже после инъекции этих соединений в паравентрикулярное ядро , важную роль для рецепторов D3 самостоятельно или совместно с рецепторами D4 при активации окситоцинергических нейронов, опосредующих эрекцию полового члена, следует проанализировать подробно (см. Baskerville et al., 2009). К сожалению, селективные агонисты рецептора D2 и D3 (например, которые различаются по своему сродству к этим двум подтипам рецептора по крайней мере на четыре или пять порядков величины in vitro) в настоящее время недоступны. По этой причине недавнее предположение о том, что рецепторы D3 опосредуют эрекцию полового члена, вызванную классическими агонистами рецептора D2, которая основана главным образом на способности предполагаемых антагонистов рецептора D3, охарактеризованных в экспериментах in vitro, уменьшить эрекцию полового члена, вызванную классическими агонистами D2, такими как апоморфин, квинпирол и прамипексол, которые потенциально активируют все подтипы рецептора дофамина D2 (Collins et al., 2009), обязательно должны быть подтверждены с помощью других экспериментов. Эта валидация необходима также потому, что в этом исследовании не обнаружено влияния агонистов рецептора D4 на эрекцию полового члена, что резко контрастирует с результатами приведенных выше исследований, которые демонстрируют проэректильный эффект агонистов рецептора D4. Действительно, даже способность апоморфина индуцировать эрекцию полового члена (и зевать) у мышей с нокаутом рецептора D4 с потенцией, идентичной той, которая наблюдается у нокаутных мышей дикого типа D4, и способность антагонистов рецептора D3 отменить ответ апоморфина у этих животных ( Collins et al., 2009) не могут рассматриваться как окончательное доказательство селективной роли подтипа D3-рецептора в эрекции пениса, индуцированного агонистом рецептора D2. Различия в различиях, исследования с нейропередатчиком / нейропептидом и / или переносчиком гена нейротрансмиттера / нейропептидного рецептора (нейротрансмиттер / нейропептид и / или нейротрансмиттер / норопептидные рецепторы-нокаутирующие животные) обычно добавляли дополнительную путаницу и осложнения в подтверждение предполагаемой сексуальной роли нейротрансмиттеров и / или нейропептиды и их рецепторы. А именно, удаление гена окситоцина приводит к выбиванию окситоцина мышами, которые спариваются и совокупляются обычно, как если бы окситоцин не был необходим для спаривания и копуляции. Также гомозиготные мышиные нокаутирующие мышей окситоцина демонстрируют нормальное спаривание и родоразрешение, хотя с выраженным ухудшением понижения молока (Nishimori et al., 1996; Young et al., 1996). Абляция гена, кодирующего синтазу оксида азота на основе нейронов, также приводит к выбиванию мышей синтазы оксида азота, которые спариваются и совокупляются обычно (Huang et al., 1993). Однако эти данные, вероятно, указывают на важную особенность репродуктивной физиологии, т. Е. Избыточность систем, участвующих в ее контроле на центральном и периферическом уровнях.
Такая избыточность, безусловно, имеет эволюционное происхождение, поскольку она гарантирует прохождение генов следующему поколению для выживания вида. Поэтому тот факт, что абляция гена рецептора D4 не влияет на эректильный эффект апоморфина, предполагает, что рецепторы D4, такие как окситоцин и оксид азота, являются лишь несколькими из посредников, работающих в системах, контролирующих эректильную функцию, а не что нет никакой роли для этих рецепторов в контроле эрекции полового члена и сексуального поведения. Обнаружено, что неудача агонистов D4 индуцировать эрекцию полового члена при системном применении к крысам-самцам разных штаммов была недавно сообщена другим исследованием (Depoortère et al., 2009). Однако, в отличие от работы Collins et al. (2009), и сделать картину о роли различных подтипов D2 в контроле эрекции полового члена еще более озадачивающей, это исследование также показывает, что предполагаемые селективные антагонисты рецепторов D3, которые системно не были в состоянии уменьшить апоморфин-индуцированную эрекцию полового члена в мужские крысы штамма более чувствительны к эрективному эффекту апоморфина, тогда как сексуальный ответ (и зевая) был антагонизирован селективным антагонистом D2 L-741,626 (3 - [[4- (4-хлорфенил) -4-гидроксипиперидин -1-ил] метил-1H-индол), заставляя авторов предположить, что рецепторы D2, а не D3 и D4-рецепторы, играют важную роль в эрекции пениса, индуцированной агонистом D2 (Depoortère et al., 2009). Наконец, возможность того, что возбуждающий эффект агонистов дофаминовых рецепторов на окситоцинергические нейроны, опосредующие эрекцию полового члена, по меньшей мере частично, является косвенным, а не прямым, например, опосредованным или подверженным влиянию изменений в активности других нейромедиаторов нейропептидов, способных модулировать активность окситоцинергических нейронов в паравентрикулярном ядре, нельзя полностью исключить.
3.2. Взаимодействие глутаминовой кислоты и окситоцина в паравентрикулярном ядре
Паравентрикулярное ядро гипоталамуса очень богато синапсами, содержащими возбуждающую аминокислоту в качестве нейротрансмиттера (например, глутаминовой кислоты и аспарагиновой кислоты) (Van Den Pol, 1991). Возбуждающие аминокислоты в этом ядре участвуют в многочисленных функциях, включая эрекцию полового члена и сексуальное поведение (Roeling et al., 1991, Melis et al., 1994b, 2000, 2004b). Соответственно, N-метил-d-аспарагиновая кислота (NMDA), селективный агонист подтипа NMDA-рецептора, но не (±) -_-амино-3-гидрокси-5-метил-изоксазол-4-пропионовая кислота (AMPA) , был обнаружен селективный агонист подтипа рецептора AMPA или (±) -транс (1) -амино-1,3-циклопентандикарбоновой кислоты (ACPD), селективный агонист подтипа метаботропного рецептора, который способен индуцировать эрекцию полового члена при введении в паравентрикулярное ядро свободно движущихся крыс (Melis et al., 1994b). Проэректильный эффект 948 MR Melis, A. Argiolas / Neuroscience и Biobehavioral Reviews 35 (2011) 939-955 NMDA предотвращался (+) MK-801, неконкурентным антагонистом NMDA-рецептора (Woodruff et al., 1987 ), вводимого в паравентрикулярное ядро (Melis et al., 1994b). В соответствии с этими результатами в исследованиях телеметрии, направленных на мониторинг внутрикавернозного давления, NMDA был признан гораздо более активным, чем агонисты других подтипов возбуждающих аминокислотных рецепторов при введении в паравентрикулярное ядро при увеличении внутрикавернозного давления у бодрствующих или обезболивающих самцов крыс (Zahran et al., 2000, Chen и Chang, 2003).
Как было указано выше для окситоцина и допамина, вероятно, что рецепторы NMDA, опосредующие эрекцию полового члена, расположены в клеточных телах окситоцинергических нейронов, так как нервные окончания возбуждающих аминокислот сталкиваются с клетками окситоцинергических клеток в паравентрикулярном ядре (Van Den Pol, 1991). По аналогии с тем, что обнаружено с агонистами дофаминовых рецепторов, проэректильный эффект NMDA, по-видимому, опосредуется активацией окситоцинергической нейротрансмиссии, отменяемой антагонистом окситоцина d (CH2) 5Tyr (Me) 2-Orn8-вазотоцином, данным icv, но не в паравентрикулярное ядро (см. Argiolas и Melis, 1995, 2004, 2005 и ссылки в них). Подобным образом, индуцированная NMDA активация окситоцинергической нейротрансмиссии также является вторичной по отношению к активации синтазы оксида азота, поскольку индуцированная NMDA эрекция полового члена предотвращается ингибиторами оксида азота-синтазы (метиловый эфир N-нитро-N-метил-аргинина и N- метил-тио-1-цитруллин), вводимый в паравентрикулярное ядро, и NMDA, вводимый в паравентрикулярное ядро в дозах, которые индуцируют эрекцию полового члена, увеличивает образование оксида азота в ядре гипоталамуса (см. Argiolas and Melis, 1995, 2004, 2005 и ссылки на них ). Что касается агонистов рецептора допамина, индуцированная NMDA активация оксидсинтазы азота может также быть вторичной по отношению к повышенному притоку Ca2 + в телах окситоцинергических клеток через CaMNUMX + -канальные NMDA-рецепторы, как показано в нескольких нейронных препаратах (обзор см. Snyder, 2; Southam и Garthwaite, 1992, Schuman и Madison, 1993 и ссылки в них). Оксид азота, в свою очередь, активирует окситоцинергическую нейротрансмиссию (см. Выше). Происхождение глутаматергических проекций, которые активируют паравентрикулярные окситоцинергические нейроны, опосредующие эрекцию полового члена, неизвестно, хотя некоторые нейроанатомические и электрофизиологические данные свидетельствуют о том, что они могут возникнуть, по крайней мере частично, в гиппокампе (Saphier and Feldman, 1987, Chen et al., 1992) , Хотя дальнейшая работа необходима, чтобы лучше охарактеризовать происхождение глутаматергических проекций на паравентрикулярное ядро, участие глутаминовой кислоты в паравентрикулярном ядре в борьбе с эрекцией полового члена и сексуальным поведением явно подтверждается исследованиями микродиализа. Соответственно, внеклеточные концентрации глутаминовой кислоты и аспарагиновой кислоты были увеличены в диализате, полученном из паравентрикулярного ядра самцов крыс, показывающих бесконтактные эрекции, когда их вводили в присутствии недоступных эстрогенов + прогестерон-восприимчивых самок крыс (Melis et al., 2004b), эрекции полового члена, которые также опосредуются активацией центральной окситоцинергической передачи (Melis et al., 1999a, b). Такие увеличения были обнаружены еще выше при допущении копуляции с восприимчивой самкой (Melis et al., 2004a). В соответствии с гипотезой о том, что повышенная активность возбуждающих аминокислот возникает в паравентрикулярном ядре при эрекции и спаривании полового члена, как бесконтактные эрекции, так и копулятивное поведение (во время которых возникают эрекции полового члена) снижаются за счет блокады NMDA-рецепторов в паравентрикулярном ядре , и за этим снижением следует уменьшение увеличения производства оксида азота, которое происходит в этом гипоталамическом ядре в этих физиологических контекстах (Melis et al., 2000). Увеличение концентрации внеклеточного глутаминовой кислоты, вторичное по отношению к уменьшенному высвобождению ГАМК из ГАМКергических нервных окончаний, падающих на возбуждающие аминокинетические синапсы, сопоставимые с клетками окситоцинергических клеток, также было обнаружено в паравентрикулярном ядре после блокады каннабиноидных рецепторов CB1 антагонистом CB1 SR 141761A, вводимые в боковые желудочки или непосредственно в паравентрикулярное ядро в дозах, которые индуцируют эрекцию полового члена (см. Succu et al., 2006, Castelli et al., 2007). Такое увеличение привело к активации синтазы оксида азота в клеточных телах окситоцинергических нейронов, увеличивая производство оксида азота. Оксид азота, в свою очередь, активирует окситоцинергические нейроны, опосредующие эрекцию полового члена, как описано выше. В соответствии с таким механизмом SR 141761A индуцировала эрекцию пениса, снижалась блокадой NMDA-рецепторов и ингибиторами оксид-синтазы, но не блокировкой дофаминовых или окситоциновых рецепторов в паравентрикулярном ядре, в то время как это предотвращалось блокадой центральных окситоциновых рецепторов антагонистами рецепторов окситоцина, получавших icv
3.3. Окситоцин-дофаминовое взаимодействие в брюшной тегментальной области
Окситоцин индуцирует эрекцию полового члена при инъецировании в хвостовую часть вентральной тегментальной области дозозависимым образом (Melis et al., 2007). Самая низкая активная доза, вводимая в одностороннем порядке, составляла 20 нг, тогда как самая высокая доза была 100 нг. Эффект окситоцина опосредуется активацией окситоцинергических рецепторов, так как сексуальный ответ отменяется предшествующей инъекцией антагониста окситоцина d (CH2) 5Tyr (Me) 2-Orn8-вазотоцина в хвостовой вентральной тегментальной области. Эти рецепторы локализуются в клеточных телах дофаминергических нейронов, которые выступают главным образом в оболочку ядра accumbens. Соответственно, (1) двойные исследования иммунофлюоресценции показывают, что в хвостовой вентральной области тектографической области окситоцинергические волокна находятся в тесном контакте с клеточными телами дофаминергических нейронов, большинство из которых были положительно помечены для тирозин-гидроксилазы и содержат ретроградный трассирующее вещество Fluorogold ранее (Melis et al., 2007) и (2) вентральной тегментальной области, индуцированной окситоцином, эрекция полового члена происходит одновременно с увеличением концентрации внеклеточного дофамина в диализате, полученном из оболочки ядро accumbens (Melis et al., 2007). Окситоцин-индуцированная эрекция полового члена также происходит одновременно с увеличением образования оксида азота в брюшной тегментальной области, причем оба ответа антагонизированы не только d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин, но и ингибитором синтазы оксида азота S- метил-тио-1-цитруллин, а также _-конотоксин, зависимый от напряжения блокиратор каналов Ca2 + и ODQ (1H- [1,2,4] оксадиазол [4,3-a] хиноксалин-1-он), мощный ингибитор гуанилата циклоазы, все они указаны в каудальной вентральной тегментальной области перед окситоцином (Succu et al., 2008). Так как многие из меченых фторголдом клеток дофаминергических клеток, контактирующих с окситоцинергическими волокнами, оказались положительными для тирозингидроксилазы в хвостовой вентральной тегментальной области, также были позитивно помечены для оксида азота-синтазы и гуанилатциклазы (Succu et al., 2008), окситоцина индуцированная эрекция полового члена может быть опосредована следующим механизмом. Активация окситоцинергических рецепторов в допаминергических клеточных телах пептидом увеличивает приток Ca2 + внутри клеток клеток дофаминергических нейронов. Это активирует оксид азота-синтазу, Ca2 + -кадмодулин-зависимый фермент, тем самым увеличивая производство оксида азота. Оксид азота, в свою очередь, активирует гуанилатциклазу, что приводит к увеличению концентрации циклического GMP. Циклический GMP активирует дофаминергические нейроны, выступающие в ядро accumbens. Роль циклического GMP в эрекции полового члена, индуцированного окситоцином, введенным в хвостовую вентральную тегментальную область, также подтверждается способностью 8-бромциклического GMP, активного фосфодиэстеразоустойчивого аналога циклического GMP, чтобы индуцировать эрекцию полового члена при инъекции в каудальной брюшной тегментальной области и увеличить внеклеточный допамин в диализате из ядра accumbens (Succu et al., 2008, Melis et al., 2009a). Это противоречит механизму, посредством которого оксид азота активирует окситоцинергические нейроны в паравентрикулярном ядре, являясь 8-бромциклическим GMP, неспособным индуцировать эрекцию полового члена при введении в это ядро (Melis and Argiolas, 1995b) (рис. 2). Что касается нейронных путей, активированных допамином в ядре accumbens, что приводит к эрекции полового члена, они до сих пор неизвестны. Однако имеющиеся данные свидетельствуют о том, что эти пути активируют нейротрансмиссию допамина в паравентрикулярном ядре гипоталамуса. Соответственно, индуцированная окситоцином эрекция полового члена происходит одновременно с увеличением внеклеточного допамина не только в а также в паравентрикулярном ядре и антагонизируется антагонистом галоперидола рецептора допамина, вводимым в паравентрикулярное ядро (Melis et al., 2007). Эти результаты подтверждают идею о том, что окситоцинергические нейроны, возникающие в паравентрикулярном ядре, и выступающие в хвостовую вентральную тегментальную область, при активированном высвобождении окситоцина в этой области, тем самым активируя NO-циклическую систему передачи сигналов GMP, который, в свою очередь, активирует мезолимбические дофаминергические нейроны (Melis et al., 2007, 2009a, Succu et al., 2008). Дофамин, высвобождаемый в ядре, в свою очередь активирует нейронные пути, приводящие к активации интактно-гипоталамических дофаминергических нейронов, которые стимулируют паравентрикулярные окситоцинергические нейроны, выступающие в спинальный мозг, опосредующий эрекцию полового члена. В то же время допамин, высвобождаемый в паравентрикулярном ядре, может также активировать окситоцинергические нейроны, выступающие в области экстрагифоталамического мозга, такие как брюшная тегментальная область, гиппокамп, миндалина и, возможно, другие области мозга.
Как упоминалось выше, в соответствии с этой гипотезой апоморфин, вводимый в паравентрикулярное ядро в дозе, которая индуцирует эрекцию полового члена, также увеличивает внеклеточную концентрацию дофамина в ядре accumbens, эффект, сниженный антагонистом рецептора окситоцина d (CH2) 5Tyr (Me ) 2-Orn8-вазотоцин, вводимый в брюшную тегментальную область (Succu et al., 2007, Melis et al., 2009a). Вместе вышеуказанные нейронные пути могут представлять собой гипотетические нейронные схемы, включающие допамин, окситоцин и другие нейротрансмиттеры (например, глутаминовую кислоту, см. Ниже), влияющие не только на сексуальные характеристики, но также на сексуальную мотивацию и сексуальное вознаграждение (см. раздел 4).
3.4. Взаимодействие окситоцин-глутаминовой кислоты в брюшной суббулюме гиппокампа
Окситоцин индуцирует эрекцию полового члена при введении в брюшную, но не в дорзальную субкулуму, в зависимости от дозы (Melis et al., 2009b). Сексуальный ответ опосредуется стимуляцией рецепторов окситоцина, отменяя предыдущую инъекцию d (CH2) 5Tyr (Me) 2-Orn8-вазотоцина, введенную в тот же участок окситоцина, что и в других областях мозга (см. Выше) , Что касается локализации этих рецепторов, имеющиеся данные свидетельствуют о том, что они локализованы в клеточных телах нейронов, богатых оксидом азота-синтазой.
Соответственно, исследования на микродиализе показывают, что эксикция эритроцитов, индуцированная окситоцином, происходит одновременно с увеличением образования оксида азота в брюшной суббулюле, и это увеличение отменяется не только предшествующей инъекцией ингибитора оксидсинтазы азота S-метилтио-1-цитруллина и гемоглобином, поглощающим азотную кислоту, но также и d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин, все они приведены в один и тот же сайт окситоцина в дозах, которые антагонизируют эрекцию полового члена (Melis et al., 2010). Более важно, что индуцированная окситоцином эрекция полового члена происходит также одновременно с увеличением концентрации внеклеточной глутаминовой кислоты в брюшной подкулуле, которая лишь частично противодействует неконкурентному антагонисту NMDA-рецептора (+) MK-801, вводимому в брюшную суббукулу (Melis et al., 2010). Вместе эти результаты показывают, что новообразованный оксид азота, действуя как межклеточный мессенджер, активирует нейротрансмиссию глутаминовой кислоты, приводящую к эрекции полового члена, возможно, через нейронные эфферентные выступы из вентральной суббукула в области экстрагипокампального мозга. В соответствии с этой гипотезой, NMDA, вводимый в брюшную суббукулу, индуцирует эрекцию полового члена дозозависимым образом, и этот эффект полностью антагонизируется предшествующей инъекцией в тот же участок (+) MK-801, но не S-метил-тио-1-цитруллином , гемоглобин или d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин (Melis et al., 2010). Что касается нейронных эфферентных путей, выступающих в области экстрагипокампальных мозгов, активированных возбуждающими аминокислотами (то есть глутаминовой кислотой) в брюшной суббулюле, вполне вероятно, что они являются глутаматергическими, как и большинство эфферентных выступов гиппокампа. На данный момент можно предположить, что эти проекции модулируют активность мезолимбических дофаминергических нейронов, которые, в свою очередь, модулируют активность интактно-гипоталамических дофаминергических нейронов в паравентрикулярном ядре, что приводит к активации окситоцинергических нейронов опосредующая эрекция полового члена, как уже обсуждалось (см. выше).
Соответственно, эрекция полового члена, индуцированная окситоцином вентрального субикулума, сопровождается одновременным увеличением концентрации внеклеточного допамина в оболочке ядра accumbens, и это увеличение, как эрекция полового члена, отменяется d (CH2) 5Tyr (Me) 2- Orn8-вазотоцин, вводимый в брюшную субкулуму до окситоцина (Melis et al., 2009b). Кроме того, поскольку влагалищная субтулюма, индуцированная окситоцином, эрекция полового члена также снижается посредством (+) MK-801, введенного в брюшную тегментальную область, но не в ядро accumbens (Melis et al., 2009b) и происходит одновременно с увеличением внеклеточного глутаминовой кислоты в брюшной тегментальной области, но не в прилежащих ядрах, причем оба ответа отменены d (CH2) 5Tyr (Me) -Orn8-вазотоцин, вводимым в брюшную субкулуму перед окситоцином (см. рис. 3), вполне вероятно, что активация мезолимбических допаминергических нейронов является вторичной по отношению к повышенной глутаматергической нейротрансмиссии в брюшной тегментальной области. Это говорит о том, что взаимодействие глутаминовой кислоты и допамина, контролирующее эрекцию полового члена, существует в брюшной тегментальной области. Дальнейшие исследования необходимы для того, чтобы выяснить, являются ли эрективные эфферентные глутаэтергические пути от суббукула до брюшной тегментальной области прямыми или косвенными, то есть через префронтальную кору или другие области мозга (см. Melis et al., 2009b и ссылки в ней). Поскольку паравентрикулярное ядро также получает глутаматергические выступы из гиппокампа (см. Выше и Сапье и Фельдман, 1987), и глутаминовая кислота активирует паравентрикулярные окситоцинергические нейроны, включая те, которые выступают в брюшную тегментальную область (см. Argiolas и Melis, 2005 и ссылки в них), и окситоцин в брюшной тегментальной области индуцирует эрекцию полового члена и увеличивает активность мезолимбического дофаминергического нейронаs (см. выше), возникает соблазн предположить, что pаорвентрикулярные окситоцинергические нейроны могут также участвовать, по крайней мере частично, в активации мезолимбических дофаминергических нейронов окситоцином, вводимым в брюшную субкулуму (см. раздел 4).
4. Заключительные замечания
Исследования, рассмотренные выше, подтверждают и расширяют ранние результаты, показывающие, что у самцов крыс окситоцин играет ключевую роль в центральном контроле эрекции полового члена на уровне паравентрикулярного ядра гипоталамуса и спинного мозга. В частности, наиболеечто окситоцин влияет на эрекцию полового члена, также воздействуя в других областях головного мозга, т. е. вентральную тегментальную область, вентральную суббукулу и заднемедиальное кортикальное ядро миндалины.
На паравентрикулярном уровне наиболее важным новым нахождением является открытие экспрессии всех дофаминовых рецепторов семейства D2 (D2, D3 и D4) в клеточных телах окситоцинергических нейронов в паравентрикулярном ядре (и в супраоптическом ядре и медиальная преоптическая область) (Baskerville and Douglas, 2008, Baskerville et al., 2009). Это обеспечивает сильные нейроанатомические подтверждают гипотезу о том, что агонисты допамина и дофаминового рецептора могут активировать непосредственно окситоцинергические нейроны, участвующие в эректильной функции, и проецировать не только на спинной мозг, но и на экстрагиталомальные области мозга, В этом отношении также важно открытие того, что увеличение внутрикавернозного давления, индуцированного агонистом рецептора допамина, снижается блокаде окситоцинергических рецепторов в пояснично-крестцовом спинном мозге (Baskerville et al., 2009). Действительно, хотя такие доказательства были получены у анестезированных крыс-мужчин, обнаружение подтверждает активацию паравалентно-спинального окситоцинергического нисходящего пути, вовлеченного в эрекцию полового члена, индуцированную агонистом рецептора допамина. ЧАСТем не менее, еще предстоит выяснить, является ли эрекция полового члена, вызванная стимуляцией дофаминовых рецепторов, присутствующих в телах окситоцинергических клеток, является вторичной по отношению к активации определенного подтипа рецептора допамина семейства D2 (D2, D3 или D4) или если эти подтипы рецепторов взаимодействуют в модуляции эректильного ответа, возможно, по-разному в зависимости от контекста, в котором происходит эрекция полового члена (см. Moreland et al., 2004, Enguehard-Gueiffier et al., 2006, Melis et al., 2006a, b; Löber et al., 2009; Collins et al., 2009; Depoortère et al., 2009; Baskerville et al., 2009).
Другим важным новым нахождением является то, что окситоцин индуцирует эрекцию полового члена при введении не только в паравентрикулярное ядро, но и в область CA1 гиппокампа, но также в брюшную тегментальную область, вентральную субикулуму и заднечеловеческое кортикальное ядро миндалины. Эти области мозга не были проверены в более ранних исследованиях, показывающих, что окситоцин увеличил спонтанные эпизоды эрекции полового члена у самцов крыс, хотя они получают как окситоцинергические проекции пояснично-крестцового спинного мозга из паравентрикулярного ядра. Было обнаружено, что окситоцин способен увеличивать спонтанные эпизоды эрекции полового члена, которые встречаются у взрослых самцов крыс при отсутствии каких-либо сексуальных стимулов, таких как те, которые происходят из-за наличия доступной или недоступной восприимчивой (эстроген-прогестероновой) овариэктомированной женской крысы или манипуляции с гениталиями, когда они вводятся в паравентрикулярное ядро и поле CA1 гиппокампа, но не в дорзальной суббулюле, боковой перегородке, хвостатотом ядре, медиальной преоптической области, вентромедиальном ядре и надоптическом ядре (Melis et al. , 1986). Во всех этих исследованиях эрекция полового члена обычно учитывалась, когда пенис выходил из пениса в оболочку наблюдателем, который не знал об этих методах непосредственно во время эксперимента или позже, наблюдая эксперимент, записанный на видеокассету с помощью устройства видеокамеры. Каждый эпизод эрекции полового члена длится в течение 0.5-1 мин и обычно сопровождается ушиванием полового члена и / или сгибаниями бедра. Для этих крыс обычно не проводится эксперимент, чтобы выяснить влияние сексуального опыта, возраста или если эти крысы можно разделить на низких или высоких ответчиков на эректильный эффект окситоцина, вводимого в различные области мозга. Это относится также к большинству исследований, посвященных проэректильному эффекту других нейропептидов и лекарств, которые увеличивают спонтанные эпизоды эрекции полового члена, включая агонисты допамина, возбуждающие аминокислоты, ACTH-MSH, гексарелин и VGF-пептиды. Однако эректильный эффект этих соединений неоднократно подтверждался методами телеметрии, которые определяют возникновение эрекции полового члена путем увеличения внутрикавернозного давления, которое происходит спонтанно или после введения этих соединений различными путями, то есть системно, внутримышечно-мозговыми или непосредственно в определенные ядра мозга, после имплантата микротрансдуктора давления непосредственно в кавернозные тела (см. Bernabè et al., 1999). В брюшной тегментальной области брюшная субкулума и заднемедиальное ядро миндалины также окситоцин индуцирует эрекцию полового члена, действуя на окситоцинергические рецепторы. Это приводит к активации мезолимбических допаминергических нейронов, происходящих в брюшной тегментальной области и выступающих в оболочку ядра accumbens, как измеряется увеличением внеклеточной концентрации дофамина в диализате, полученном из оболочки ячеек accumbens, и уменьшением эректильного ответа, индуцированного пептидом, введенным в эти экстра-гипоталамические области, обнаруженным после блокады допаминергических рецепторов в ядро accumbens (см. ниже). Что касается механизмов, активированных стимуляцией окситоцинергических рецепторов в этих зонах мозга, которые приводят к активации мезолимбических дофаминергических нейронов и эрекции полового члена, лучше всего выясняются те, которые возникают в хвостовой вентральной тегментальной области. Действительно, результаты фармакологической и иммунофлюоресценции показывают, что на нервные окончания окситоцина проникают на клеточные тела дофаминергических нейронов, выступающих в оболочку ядра accumbens (Melis et al., 2007, 2009a, Succu et al., 2008). Многие из этих нейронов богаты синтазой оксида азота и в гуанилатциклазе. Стимуляция окситоцинергических рецепторов в клеточных телах этих допаминергических нейронов вызывает активацию синтазы оксида азота, приводящую к увеличению производства оксида азота. Оксид азота, в свою очередь, активирует гуанилатциклазу, тем самым увеличивая концентрацию циклического GMP, что приводит к активации мезолимбических дофаминергических нейронов и высвобождению допамина в ядре accumbens, что измеряется увеличением внеклеточного допамина в диализате из захвата ядра, полученного микроциализом внутримышечно (Succu et al., 2008 ). Допамин, высвобождаемый в ядре accumbens, в свою очередь активирует нейронные пути, ведущие к эрекции полового члена. Это подтверждается способностью антагонистов дофаминового рецептора галоперидолом и / или цис-флупентиксолом, вводимым в ядро accumbens, для уменьшения абсорбции полового члена вентральной тегментальной области (Succu et al., 2008). Один из проэректильных путей, по-видимому, активирует интра-гипоталамические дофаминергические нейроны, в частности те, которые проецируются на клеточные тела паравентрикулярных окситоцинергических нейронов. Действительно, окситоцин, инъецированный в хвостовую вентральную тегментальную область, увеличивает внеклеточный допамин не только в прилежащем ядре, но также в паравентрикулярном ядре, а блокада дофаминовых рецепторов в паравентрикулярном ядре уменьшает значительную эрекцию полового члена вентральной области, основанной на окситоцине (Succu et al. , 2007, 2008, Melis и др., 2007, 2009a). Существование этих ячеек прилегающих допамин-паравентрикулярных допамин-паравентрикулярных окситоцин-вентральных тегментальных областей окситоцин-дофаминовых звеньев также предлагается способностью проэректильной дозы апоморфина и агониста рецептора D4 PD 168077, вводимого в паравентрикулярное ядро, для увеличения внеклеточного допамина в оболочке ядра accumbens (Succu et al., 2007), ответ который отменяется d (CH2) 5Tyr (Me) -Orn8-вазотоцин, вводимый в брюшную тегментальную область (Melis et al., 2009a, см. также ниже). Тем не менее, необходима дальнейшая работа для определения нейронных путей, которые соединяют ядро accumbens с интровер-гипоталамической допаминергической системой.
Механизм, посредством которого окситоцин индуцирует эрекцию полового члена и активирует мезолимбические допаминергические нейроны при введении в брюшную субкулуму или в заднемедиальное ядро миндалины, в настоящее время лишь частично понимается. В этих областях также окситоцин активирует свои рецепторы, которые приводят к активации синтазы оксида азота, тем самым увеличивая производство оксида азота. Оксид азота, в свою очередь, активирует неизвестные эфферентные выступы, которые, по-видимому, увеличивают глутаматергическую нейротрансмиссию в брюшной тегментальной области. Затем глутаминовая кислота стимулирует мезолимбические допаминергические нейроны, приводя к эрекции полового члена. Эта гипотеза опирается главным образом на способность окситоцина, введенного в брюшную субкулуму, увеличить внеклеточную глутаминовую кислоту в брюшной тегментальной области (рис. 3) и неконкурентного антагониста NMDA-рецептора (+) MK-801, введенного в брюшную тегментальную область, но не в прилежащих ядрах, для уменьшения эрекции полового члена, вызванной окситоцином, вводимым либо в брюшную суббукулу, либо в заднемедиальное ядро амигдала (Melis et al., 2009b). В настоящее время доступны более подробные сведения о введении полости пениса, индуцированного окситоцином вентральной суббукуле. Здесь окситоцин-индуцированная эрекция полового члена является вторичной по отношению к активации окситоцинергических рецепторов, расположенных в клеточных телах нейронов, содержащих оксид азота-синтазы. Это приводит к увеличению производства оксида азота, который активирует глутаматергическую нейротрансмиссию, действуя как межклеточный мессенджер с механизмом, подобным механизму, описанному для долгосрочного потенцирования (см. Snyder, 1992, Southam and Garthwaite, 1993, Schuman and Madison, 2004) , В соответствии с этой гипотезой индуцированная окситоцином эрекция полового члена сопровождается одновременным увеличением внеклеточной глутаминовой кислоты в диализате из брюшной подкулуля и стимуляцией возбуждающих аминокислотных рецепторов в брюшной суббукуле NMDA, индуцирует эрекцию полового члена. Глутаминовая кислота, в свою очередь, активирует нервные эфферентные выступы, которые приводят к активации мезолимбических дофаминергических нейронов в брюшной тегментальной области, как описано выше. Если эти механизмы действуют и в заднемедиальном ядре миндалины, в настоящее время неизвестно. Более того, необходимы дальнейшие исследования, чтобы доказать, что (1) окситоцинергические нервные окончания и рецепторы в брюшной суббулюле и в заднемедиальном ядре миндалины локализуются в клеточных телах нейронов, содержащих оксид азота-синтазы (2), если эти нейроны в конечном итоге под контролем синтапсов возбуждающих аминокислот (глутаматергических) и (3) для идентификации сигнальной системы, активированной оксидом азота. В связи с этим следует отметить, что способность окситоцина повышать активность оксида азота-синтазы в клеточных телах дофаминергических нейронов в хвостовой вентральной тегментальной области и еще неизвестных нейронов в вентральной суббулюле и заднемедиальном ядре миндалины, напоминает способность окситоцина активировать оксид азота-синтазу в клеточных телах окситоцинергических нейронов в паравентрикулярном ядре (Melis et al., 1997). Однако, в то время как в брюшной тегментальной области повышенное производство оксида азота в клеточных телах дофаминергических нейронов приводит к активации этих нейронов путем активации гуанилатциклазы и увеличения циклического GMP, это не происходит в паравентрикулярном ядре. Соответственно, 8-бромциклический GMP, вводимый в паравентрикулярное ядро, не вызывает эрекции полового члена, тогда как при введении в брюшную тегментальную область. Другой путь передачи сигналов, отличный от системы окислительно-окислительного GMP азота, затем участвует на паравентрикулярном уровне при активации окситоцинергических нейронов, опосредующих эрекцию полового члена эндогенным и / или экзогенным оксидом азота (Melis and Argiolas, 1995b, Melis et al., 1997) (рис. , 1). С другой стороны, циклический GMP в брюшной тегментальной области, по-видимому, играет также ключевую роль в активации мезолимбических дофаминергических нейронов и в увеличении внеклеточного допамина, встречающегося в диализате, полученном из оболочки ядровых приступов самцов крыс выбранный для показа или отсутствия неконтактных эрекций полового члена, когда он помещается в присутствии недоступной овариэктомированной восприимчивой (эстроген + прогестерон), крысы. В этих экспериментальных условиях у самцов крыс, демонстрирующих бесконтактные эрекции полового члена, увеличение ожидаемой концентрации внеклеточного допамина, как и ожидалось, увеличивается, хотя и незначительно, ингибиторами фосфодиэстеразы, вводимыми в хвостовую вентральную тегментальную область (Sanna et al., 2009).
Способность окситоцина, вводимого в брюшную тегментальную область, в вентральную субкулуму и в заднечеловеческое кортикальное ядро миндалины, вместе с агонистами допамина, вводимыми в паравентрикулярное ядро, индуцировать эрекцию полового члена и активировать мезолимбические допаминергические нейроны, заслуживает некоторого комментария , Во-первых, механизмы, подобные описанным выше, могут действовать, когда эрекция полового члена происходит в физиологических контекстах, таких как при спаривании (когда происходит эрекция полового члена) или во время бесконтактных эрекций полового члена. Эти эрекции представляют собой феромоновую опосредованную эрекцию полового члена, неотличимую от тех, которые индуцируются лекарственными средствами или окситоцином, которые возникают, когда половозрелые крысы-самцы вводят в присутствие недоступной восприимчивой (овариэктомизированной эстроген + прогестерон-праймер) женской крысы и считаются показателем полового возбуждение (Sachs, 1997, 2007). Действительно, хотя эти результаты не показывают, что окситоцин в этих областях играет определенную роль в эрекции полового члена, происходящих в физиологическом контексте или после введения лекарственного средства, они добавляют дополнительную силу к ранним результатам, предполагая, что эти области мозга принадлежат тем, где окситоцин при централизованном воздействии не только спонтанные эпизоды эрекции полового члена, наблюдаемые после проэректильных лекарств, но и улучшение мужского (и женского) сексуального поведения (см. Argiolas and Melis, 2004 и ссылки в нем). Соответственно, концентрация окситоцина увеличивается в гиппокампе самцов крыс, получавших проэректильную дозу апоморфина, классического агониста дофамина (Melis et al., 1990) и d (CH2) 5Tyr (Me) -Orn8-вазотоцин, который блокирует окситоцин (Argiolas et al., 1987a), а также облегчающий эффект апоморфина на мужское копулятивное поведение (Argiolas et al., 1987b) у половозрелых самцов крыс, во время которого в эрекции копулы полового члена происходят. d (CH2) 5Tyr (Me) -Orn8-вазотоцин также чрезвычайно эффективен в снижении бесконтактных эрекций у половозрелых самцов крыс, когда их вводили в количества нанограмм в боковые желудочки, но не в PVN (Melis et al., 1999a).
Во-вторых, мезолимбические допаминергические нейроны играют ключевую роль в мотивационных и полезных свойствах естественных усиливающих стимулов, таких как питание, вода и сексуальная активность (Fibiger и Phillips, 1988, Wise и Rompre, 1989, Everitt, 1990). В частности, считается, что дофамин, высвобождаемый из этих нейронов, опосредует перенос мотивационных аспектов естественных раздражителей в целевое поведение, например, в случае сексуальной активности, поиска сексуального партнера и полового акта, чтобы достичь вознаграждения и удовлетворения (Goto и Grace, 2005). Соответственно, концентрация внеклеточного дофамина увеличивается в диализате от ядровых приступов у половозрелых самцов крыс во время воздействия недоступной овариэктомированной эстроген + прогестерон-праймированной восприимчивой женской крысы, и такое увеличение было еще выше, когда мужской крысе позволяли совокупляться с восприимчивой самкой (Pfaus и Everitt, 1995).
В-третьих, настоящие результаты подтверждают гипотезу о том, что нейронная цепь соединяет паравентрикулярное ядро с вентральной тегментальной областью прямо или косвенно (через вентральную субикулуму и / или заднечеловеческое кортикальное ядро миндалевидной клетки) и ядро accumbens, а отсюда через неизвестные пути назад к паравентрикулярному ядру для контроля активности окситоцинергических нейронов, проецирующих спинальный мозг, опосредующий эрекцию полового члена, и окситоцинергических нейронов, выступающих в брюшную тегментальную область, вентральную субикулуму и заднечеловеческое кортикальное ядро миндалины, модулируя таким образом активность мезолимбических дофаминергических нейронов (рис. 4). Эта сложная нейронная цепь может играть роль в интеграции нейронных активностей, связанных с контролем завершающего (эректильно-эякуляторного) и опережающих (мотивационных и полезных) аспектов сексуального поведения мужчин в физиологическом контексте. Действительно, внеклеточный допамин увеличивается в ядре accumbens (Pfaus и Everitt, 1995) и в паравентрикулярном ядре половозрелых самцов крыс во время контакта с недоступной восприимчивой крысиной крысы, когда возникают бесконтактные эрекции, и даже больше, когда копуляция разрешена, например, когда возникают спазмы полового члена (Melis et al., 2003). Таким образом, хотя необходимы дальнейшие исследования для выяснения роли эндогенного окситоцина в брюшной тегментальной области, вентральной суббукуле и миндалине во время бесконтактных эрекций и сексуального поведения, тогда может быть разумным предположить, что этот гипотетический нейронный контур, внося свой вклад в в то же время могут активировать мезолимбическую дофаминергическую систему, обеспечивающую нейронный субстрат для объяснения полезных свойств сексуальной активности (Everitt, 1990, Pfaus и Everitt, 1995). В этой связи следует отметить, что мезолимбическая дофаминергическая система, активированная окситоцином, вводимым в брюшную тегментальную область, активируется такими же наркотиками, как опиаты, каннабиноиды, амфетамин, кокаин и алкоголь (Tanda et al., 1997) и обнаружено, что окситоцин способен снижать толерантность и зависимость от кокаина, морфина, спирта и каннабиноидов (Kovacs et al., 1998, Cui et al., 2001). В заключении, по-видимому, окситоцин, выделяемый не только в брюшной тегментальной области, но также в вентральной суббукуле и заднем конце кортикального ядра миндалины, может активировать мезолимбические дофаминергические нейроны, которые могут быть вовлечены в аппетитные и полезные эффекты сексуальной активности , Активация мезолимбических допаминергических нейронов может быть прямой, через окситоцинергические рецепторы в клеточных телах мезолимбических дофаминергических нейронов, или косвенным путем активации нейротрансмиссии глутаминовой кислоты в брюшной тегментальной области.
Допамин, высвобождаемый в раковине accumbens, модулирует, в свою очередь, активность интактно-гипоталамических допаминергических нейронов в паравентрикулярном ядре, вызывая либо эрекцию полового члена (через активацию окситоцинергических нейронов, выступающих в спинной мозг), либо сексуальную мотивацию и вознаграждение (посредством активации окситоцинергических нейроны, выступающие в брюшную тегментальную область, брюшную суббукулу или заднечеловеческое кортикальное ядро миндалины). Так как дофамин также высвобождается в оболочке окутанного ядра и в паравентрикулярном ядре, когда эрекция полового члена происходит в физиологических условиях (например, бесконтактные эрекции и копуляция) (Succu et al., 2007; Melis et al., 2003, 2007), вероятно, что центральные окситоцинергические нейроны участвуют в нейронных цепях, опосредующих взаимодействие мезолимбика с интактно-гипоталамической допаминергической системой. Эти нейронные цепи могут играть роль не только в завершающей фазе сексуального поведения (например, эрекция полового члена и совокупление), но также в сексуальной мотивации, сексуальном возбуждении и сексуальной награде.
Схематическое представление гипотетической нейронной схемы, включающей окситоцин, влияющий на сексуальную мотивацию, полезность и сексуальную активность, как это было предложено в результате этой главы и предыдущих докладов. Окситоцинергические нейроны, возникающие в паравентрикулярном ядре и выступающие в спинной мозг при активации, например, дофамином и глутаминовой кислотой (но также и другими нейромедиаторами и / или нейропептидами), способствуют эрекции полового члена и сексуальной активности путем активации окситоцинергических нейронов, выступающих в спинной мозг. Допамин и глутаминовая кислота (но также нейротрансмиттеры и нейропептиды) в паравентрикулярном ядре также активируют окситоцинергические нейроны, выступающие в брюшную тегментальную область, тем самым активируя мезолимбические допаминергические нейроны, выступающие в ядро accumbens, модулируя сексуальную мотивацию и вознаграждение. Дофамин, высвобождаемый в ядре accumbens (NAs), активирует, в свою очередь, еще неизвестные нейронные пути, которые увеличивают активность интактно-гипоталамических дофаминергических нейронов (происходящих из групп A13-A14 Dahlstrom и Fuxe), поражающих других на окситоцинергических нейронах, включая те, которые направлены на спинного мозга, что приводит к эрекции полового члена. Эту схему можно также активировать окситоцином, инъецированным не только в хвостовую вентральную тегментальную область, но также в брюшную субкулуму и в миндалину, которые также получают окситоцинергическую иннервацию из паравентрикулярного ядра, возможно, через прямой или косвенный глутаматергический эфферентный вентральный тегментальной области, что приводит к модуляции как сексуальной мотивации, так и эрекции полового члена. Наконец, вышеуказанная схема может быть также активирована сексуальными стимулами и феромонами, поскольку увеличение внеклеточного допамина и глутаминовой кислоты в паравентрикулярном ядре (и в медиальной преоптической области) во время феромонных опосредованных бесконтактных эрекций и копуляции (для соответствующих ссылок см. Список литературы).
Благодарности Эта работа была частично поддержана грантом итальянского министерства университета и исследований для AA и MRM
Рекомендации
Андерссон, KE, 2001. Фармакология эрекции полового члена. Pharmacol. Преподобный 53, 417-450. Argiolas, A., 1994. Оксид азота является центральным медиатором эрекции полового члена. Нейрофармакология 33, 1339-1344. Argiolas, A., 1999. Нейропептиды и сексуальное поведение. Neurosci. Biobehav. Преподобный 23, 1127-1142. Argiolas, A., Gessa, GL, 1991. Центральные функции окситоцина. Neurosci. Biobehav. Преподобный 15, 217-231. Argiolas, A., Melis, MR, 1995. Нейромодуляция эрекции полового члена: обзор роли нейротрансмиттеров и нейропептидов. Prog. Neurobiol. 47, 235-255. Argiolas, A., Melis, MR, 2004. Роль окситоцина и паравентрикулярного ядра в сексуальном поведении мужских млекопитающих. Physiol. Behav. 83, 309-317. Argiolas, A., Melis, MR, 2005. Центральный контроль эрекции полового члена: роль паравентрикулярного ядра гипоталамуса. Prog. Neurobiol. 76, 1-21. Argiolas, A., Collu, M., Gessa, GL, Melis, MR, Serra, G., 1988. Антагонист окситоцина d (CH2) 5Tyr (Me) -Orn8-вазотоцин антагонизирует мужское копулятивное поведение у крыс. E. J. Pharmacol. 149, 389-392. Арджиолас, А., Коллу, М., Д'Акуила, П., Гесса, Г.Л., Мелис, М.Р., Серра, Г., 1989. Стимулирование апоморфина мужского копулятивного поведения предотвращается антагонистом окситоцина d (CH2) 5Tyr (Me) -Orn8-вазотоцином у крыс. Pharmacol. Biochem. Behav. 33, 81-83. Argiolas, A., Melis, MR, Gessa, GL, 1985. Внутрижелудочковый окситоцин индуцирует зевоту и эрекцию полового члена у крыс. E. J. Pharmacol. 117, 395-396. Argiolas, A., Melis, MR, Gessa, GL, 1986. Окситоцин: чрезвычайно мощный индуктор эрекции полового члена и зевая у самцов крыс. E. J. Pharmacol. 130, 265-272. Argiolas, A., Melis, MR, Mauri, A., Gessa, GL, 1987a. Паравентикулярное поражение ядра предотвращает зияние и эрекцию полового члена, вызванную апоморфином и окситоцином, но не ACTH у крыс. Brain Res. 421, 349-352. Argiolas, A., Melis, MR, Vargiu, L., Mauri, A., Gessa, GL, 1987b. d (CH2) 5Tyr (Me) -Orn8-вазотоцин, мощный антагонист окситоцина, антагонизирует эрекцию полового члена и зевоту, вызванную окситоцином и апоморфином, но не ACTH 1-24. E. J. Pharmacol. 134, 221-224. Argiolas, A., Melis, MR, Stancampiano, R., Gessa, GL, 1990. _-Conotoxin предотвращает апоморфин и окситоцин-индуцированную эрекцию полового члена и зевая у самцов крыс. Pharmacol. Biochem. Behav. 37, 253-257. Arletti, R., Bertolini, A., 1985. Окситоцин стимулирует поведение лордоза у самок крыс. Нейропептиды 6, 247-255. Arletti, R., Bazzani, C., Castelli, M., Bertolini, A., 1985. Окситоцин улучшает мужские копулятивные показатели у крыс. Horm. Behav. 19, 14-20. Arletti, R., Benelli, A., Bertolini, A., 1990. Сексуальное поведение стареющих самцов крыс стимулируется окситоцином. E. J. Pharmacol. 179, 377-382. Arletti, R., Calzà, L., Giardino, L., Benelli, A., Cavazzutti, E., Bertolini, A., 1997. Сексуальная импотенция связана с уменьшением производства окситоцина и увеличением производства опиоидных пептидов в паравентрикулярном ядре гипоталамуса. Neurosci. Lett. 233, 65-68. Bancila, M., Giuliano, F., Rampin, O., Mailly, P., Brisorgueil, MJ, Clas, A., Verge, D., 2002. Доказательства прямой проекции от паравентрикулярного ядра гипоталамуса к предполагаемым серотонинергическим нейронам ядра paragigantocellularis, участвующим в контроле эрекции у крыс. E. J. Neurosci. 16, 1240-1249. Burnett, AL, Lowenstein, CJ, Bredt, DS, Chang, TSK, Snyder, SH, 1992. Оксид азота: физиологический медиатор эрекции полового члена. Наука 257, 401-403. Баскервиль, Т.А., Дуглас, А.Я., 2008. Взаимодействие между дофамином и окситоцином в борьбе с сексуальным поведением. Prog. Brain Res. 170, 277-289. Baskerville, TA, Allard, J., Wayman, C., Douglas, AJ, 2009. Допамин-окситоцин взаимодействие в эрекции полового члена. E. J. Neurosci. 30, 2151-2164. Benelli, A., Bertolini, A., Poggioli, R., Cavazzutti, E., Calzà, L., Giardino, L., Arletti, R., 1995. Оксид азота участвует в мужском сексуальном поведении крыс. E. J. Pharmacol. 294, 505-510. Bernabè, J., Rampin, O., Sachs, BD, Giuliano, F., 1999. Внутрикавернозное давление при эрекции у крыс: интегративный подход, основанный на телеметрической записи. Am. J. Physiol. 276, R441-R449. Bitner, RS, Nikkel, AL, Otte, S., Martino, B., Barlow, EH, Bhatia, P., Stewart, AO, Brioni, JD, Decker, MW, Moreland, RB, 2006. Передача сигналов Dopamine D4 в крысином паравентрикулярном гипоталамическом ядре: свидетельство естественной связи, включающей немедленную раннюю индукцию гена и фосфорилирование активированной митогенной протеинкиназой. Нейрофармакология 50, 521-531. Brioni, JD, Moreland, RB, Cowart, M., Hsieh, GC, Stewart, AO, Hedlund, P., Donnelly-Roberts, DL, Nakane, M., Lynch 3rd., J., Kolasa, T., Polakowski , JS, Osinski, MA, Marsh, K., Andersson, KE, Sullivan, JP, 2004. Активация дофаминовых D4-рецепторов ABT-724 индуцирует эрекцию полового члена у крыс. Proc. Natl. Акад. Sci. США 101, 6758-6763. Buijs, RM, 1978. Внутри- и экстрагипоталамические пути вазопрессина и окситоцина у крысы. Cell Tissue Res. 192, 423-435. Buijs, RM, Geffard, M., Pool, CW, Hoorneman, EMD, 1984. Допаминергическая иннервация супраоптического и паравентрикулярного ядра. Легкое и электронное микроскопическое исследование. Brain Res. 323, 65-72. Caldwell, JD, Prange, AJ, Pedersen, CA, 1986. Окситоцин облегчает сексуальную восприимчивость самцов крыс, обработанных эстрогенами. Нейропептиды 7, 175-189. Cameron, JL, Pomerantz, SM, Layden, LM, Amico, JA, 1992. Допаминергическая стимуляция концентраций окситоцина в плазме мужской и женской обезьян апоморфином и агонистом рецептора D2. J. Clin. Эндокринол. Metab. 75, 855-860. Canteras, NS, Simerly, RB, Swanson, LW, 1995. Организация проекций из медиального ядра миндалины: исследование PHAL у крысы. J. Комп. Neurol. 360, 213-245. Carmichael, MS, Humbert, R., Dixen, J., Palmisano, G., Greeleaf, W., Davidson, JM, 1987. Окситоцин плазмы увеличивается в сексуальной реакции человека. J. Clin. Эндокринол. Metab. 64, 27-31. Картер, CS, 1992. Окситоцин и сексуальное поведение. Neurosci. Biobehav. Преподобный 16, 131-144. Carter, CS, Lederhendler, II, Kirkpatrick, B., 1997. Интерактивная нейробиология принадлежности, Annals of New York Academy of Sciences, vol. 807. Нью-Йоркская академия наук, Нью-Йорк. Castelli, MP, Piras, AP, Melis, T., Succu, S., Sanna, F., Melis, MR, Collu, S., Ennas, MG, Diaz, G., Mackie, K., Argiolas, A. , 2007. Каннабиноидные рецепторы CB1 в паравентрикулярном ядре и центральный контроль эрекции полового члена: иммуноцитохимия, авторадиография и поведенческие исследования. Neuroscience 147, 197-206. Chen, KK, Chang, LS, 2003. Влияние агонистов возбуждающих аминокислотных рецепторов на эрекцию полового члена после введения в паравентрикулярное ядро гипоталамуса у крыс. J. Urol. 62, 575-580. Chen, KK, Chan, JYH, Chang, LS, Chen, MT, Chang, SHH, 1992. Выявление эрекции полового члена после активации гиппокампального образования у крысы. Neurosci. Lett. 141, 218-222. Chen, KK, Chan, JYH, Chang, LS, 1999. Допаминергическая нейротрансмиссия в паравентрикулярном ядре гипоталамуса в центральной регуляции эрекции полового члена у крысы. J. Urol. 162, 237-242. Collins, GT, Truccone, A., Haji-Abdi, F., Newman, AH, Grundt, P., Rice, KC, Husbands, SM, Greedy, BM, Enguehard-Gueiffer, C., Gueiffer, A., Chen , J., Wang, S., Katz, JL, Grandy, DK, Sunahara, RK, Woods, JH, 2009. Проэректильные эффекты агонистов, подобных дофамину D2, опосредуются рецептором D3 у крыс и мышей. J. Pharmacol. Exp. Ther. 329, 210-217. Coolen, LM, Allard, J., Truitt, WA, McKenna, KE, 2004. Центральное регулирование эякуляции. Physiol. Behav. 83, 203-215. Cui, SS, Bowen, RC, Gu, GB, Hannesson, BK, Yu, PH, Zhang, X., 2001. Предотвращение синдрома отмены каннабиноида литием: вовлечение окситоцинергической нейронной активации. J. Neurosci. 21, 9867-9876. Дальстром, A., Fuxe, K., 1964. Доказательства существования моноаминсодержащих нейронов в центральной нервной системе. I. Демонстрация моноаминов в клеточных телах нейронов ствола мозга. Acta Physiol. Сканд. 62 (доп. 232), 1-54. Depoortère, R., Bardin, L., Rodrigues, M., Abrial, E., Aliaga, M., Newman-Tancredi, A., 2009. Эрекция полового члена и зевота, индуцированные агонистами рецептора дофамина D2-типа у крыс: влияние штамма и вклада дофамина D2, но не D3 и D4-рецепторов. Behav. Pharmacol. 20, 303-311. Domes, G., Heinrichs, M., Buchel, C., Braus, DF, Herpertz, SC, 2007. Окситоцин ослабляет ответы миндалины на эмоциональные лица независимо от валентности. Biol Психиатрия 62, 11871190. Dominguez, J., Riolo, JV, Xu, Z., Hull, ME, 2001. Регулирование медиальной амигдалой копуляции и медиального преоптического допамина. J. Neurosci. 21, 349-355. Donaldson, ZR, Young, LJ, 2009. Окситоцин, вазопрессин и нейрогенетика социальности. Наука 322, 900-904. Eaton, RG, Markowski, VF, Lumley, LA, Thompson, JT, Moses, J., Hull, EM, 1991. Рецепторы D2 в паравентрикулярном ядре регулируют генитальные реакции и совокупление у самцов крыс. Pharmacol. Biochem. Behav. 39, 177-181. Ebner, K., Bosch, OJ, Krömer, SA, Singewald, N., Neumann, ID, 2005. Выделение окситоцина в центральной миндалине крысы модулирует поведение, снимающее стресс, и высвобождение возбуждающих аминокислот. Нейропсихофармакология 30, 223-230. Enguehard-Gueiffier, C., Hübner, H., El Hakmaoui, A., Allouchi, H., Gmeiner, P., Argiolas, A., Melis, MR, Gueiffier, A., 2006. 2 - [(4-фенилпиперазин-1-ил) метил] имидазо (ди) азины в качестве селективных D4-лигандов. Индукция эрекции полового члена 2- [4- (2-метоксифенил) пиперазин-1-илметил] имидазо [1,2-a] пиридин (PIP3EA), мощный и селективный агонист D4. J. Med. Химреагент 49, 3938-3947. Everitt, BJ, 1990. Сексуальная мотивация: нейронный и поведенческий анализ механизмов, лежащих в основе аппетитных и копулятивных ответов самцов крыс. Neurosci. Biobehav. Преподобный 14, 217-232. Fibiger, HC, Phillips, AG, 1988. Мезокортиколимбическая система дофамина и вознаграждение. Ann. N. Y. Акад. Sci. 5, 206-215. Французский, SJ, Totterdell, S., 2003. Отдельные ядра-акцепс-проекционные нейроны ядра получают как базолатеральную амигдалу, так и вентральные субикулярные афференты у крыс. Neuroscience 119, 19-31. 954 MR Мелис А. Argiolas / Neuroscience and Biobehavioral Reviews 35 (2011) 939-955 Freund-Mercier, MJ, Richard, P., 1981. Возбудительные эффекты внутрижелудочковых инъекций окситоцина на рефракцию выброса молока у крысы. Neurosci. Lett. 23, 193-198. Freund-Mercier, MJ, Richard, P., 1984. Электрофизиологические данные для облегчения контроля над нейронами окситоцина окситоцином при сосании у крысы. J. Physiol. (Lond.) 352, 447-466. Freund-Mercier, MJ, Stoeckel, ME, 1995. Соматодендритные ауторецепторы на окситоциновых нейронах. In: Ivell, R., Russel, JA (Ред.), Окситоцин, клеточные и молекулярные подходы в медицине и исследованиях. Adv. Exp. Med. Biol., 365. Пленум Пресс, Нью-Йорк и Лондон, стр. 185-194. Freund-Mercier, MJ, Stoeckel, ME, Palacios, JM, Pazos, JM, Richard, PH, Porte, A., 1987. Фармакологические характеристики и анатомическое распределение сайтов связывания окситоцина 3H в мозге крысы Вистара, изучаемых авторадиографией. Neuroscience 20, 599-614. Джулиано, Ф., Рампин, О., 2000. Центральный контроль эрекции полового члена. Neurosci. Biobehav. Преподобный 24, 517-533. Giuliano, F., Allard, J., 2001. Допамин и сексуальная функция. Int. J. Импотенция Res. 13 (доп. 3), 18-28. Джулиано, Ф., Рампин, О., 2004. Нейронный контроль эрекции. Physiol. Behav. 83, 189-201. Giuliano, F., Bernabè, J., McKenna, KE, Longueville, F., Rampin, O., 2001. Спинномозговой проректилирующий эффект окситоцина у анестезированных крыс. Am J. Physiol. Регул. Integ. Комп. Physiol. 280, R1870-R1877. Goto, Y., Grace, AA, 2005. Дофаминергическая модуляция лимбического и кортикального притока ядровых акцепсов в целенаправленном поведении. Туземный Neurosci. 8, 805-812. Hawthorn, J., Ang, VT, Jenkins, JS, 1985. Воздействие поражений в гипоталамических паравентрикулярных, супраоптических и супрахиазматических ядрах на вазопрессин и окситоцин в головном и спинном мозге крыс. Brain Res. 346, 51-57. Heier, RF, Dolak, LA, Duncan, JN, Hyslop, DK, Lipton, MF, Martin, LJ, Mauragis, MA, Piercey, MF, Nichols, NF, Schreur, PJ, Smith, MW, Moon, MW, 1997. Синтез и биологическая активность (R) -5,6-дигидро-N, N-диметил-4H-имидазо [4,5,1-ij] хинолин-5-амин) и его метаболитов. J. Med. Химреагент 40, 639-646. Хси, Г.К., Холлингсворт, PR, Мартино, Б., Чанг, Р., Терранова, М.А., О'Нил, А.Б., Линч, Дж.Дж., Морленд, Р.Б., Доннелли-Робертс, Д.Л., Коласа, Т., Микуса, JP , Маквей, Дж. М., Марш, К. К., Салливан, Дж. П., Бриони, Дж. Д., 2004. Центральные механизмы, регулирующие эрекцию полового члена у сознательных крыс: дофаминергические системы, связанные с эффектом апорефина при проректилировании. J. Pharmacol. Exp. Ther. 308, 330-338. Huang, PL, Dawson, TM, Bredt, DS, Snyder, SH, Fishman, MC, 1993. Целенаправленное разрушение гена синтазы оксида азота нейронов. Ячейка 75, 1273-1286. Huber, D., Veinante, P., Stoop, R., 2005. Вазопрессин и окситоцин возбуждают различные нейронные популяции в центральной миндалине. Наука 308, 245-248. Hull, EM, Warner, RK, Bazzett, TJ, Eaton, RC, Thompson, JT, 1989. Коэффициент D2 / D1 в медиальной преоптической области влияет на совокупление самцов крыс. J. Pharmacol. Exp. Ther. 251, 422-427. Hull, EM, Du, J., Lorrain, DS, Matuszewich, L., 1995. Внеклеточный допамин в медиальной преоптической области: последствия для сексуальной мотивации и гормонального контроля копуляции. J. Neurosci. 15, 7465-7471. Hull, EM, Meisel, RL, Sachs, BD, 2002. Мужское сексуальное поведение. В: Pfaff, DW, Arnold, AP, Etgen, AM, Fahrbach, SE, Rubin, RT (Ред.), Гормоны, мозг и поведение. Academic Press, Нью-Йорк, стр. 3-137. Hurlemann, R., Patin, A., Onur, OA, Cohen, MX, Baumgartner, T., Metzler, S., Dziobek, I., Gallinat, J., Wagner, M., Maier, W., Kendrick, KM, 2010. Окситоцин усиливает амидаль-зависимое, социально усиленное обучение и эмоциональное сочувствие у людей. J. Neurosci. 30, 4999-5007. Ivell, R., Russel, JA, 1995. Окситоцин: клеточные и молекулярные подходы в медицине и исследованиях. Достижения в экспериментальной медицине и биологии, том. 395. Пленум Пресс, Нью-Йорк. Kelley, AE, Domesick, VB, 1982. Распределение проекции от образования гиппокампа к ядру прилежащего в крысе: исследование пероксидазы антероград и ретроградного хрена. Neuroscience 7, 2321-2335. Kimura, Y., Naitou, Y., Wanibuchi, F., Yamaguchi, T., 2008. Активация рецептора 5-HT (2C) является общепринятым механизмом на фоне проректилирующих эффектов апоморфина, окситоцина и меланотана-II у крыс. E. J. Pharmacol. 589, 157-162. Кондо, Ю., Сакс, Б. Д., Сакума, Ю., 1998. Важность медиальной миндалины в эрекции полового члена крысы, вызванная отдаленными раздражителями у эстральных женщин. Behav. Brain Res. 91, 215-222. Kovacs, GL, Sarnyai, Z., Szabo, G., 1998. Окситоцин и наркомания: обзор. Психонейроэндокринология 23, 945-962. Lee, HJ, Macbeth, AH, Pagani, JH, Scott Young 3rd, W., 2009. Окситоцин: великий помощник жизни. Prog. Neurobiol. 88, 127-151. Lindvall, O., Bjorklund, A., Skagerberg, G., 1984. Селективная изотомическая демонстрация допамин-терминальных систем у крысиного ди- и телеэнцефалона: новые доказательства дофаминергической иннервации гипоталамических нейросекреторных ядер. Brain Res. 306, 19-30. Лю, YC, Саламоне, JD, Sachs, BD, 1997. Нарушение половой реакции после поражения паравентрикулярного ядра гипоталамуса у самцов крыс. Behav. Neurosci. 111, 1361-1367. Löber, S., Tschammer, N., Hübner, H., Melis, MR, Argiolas, A., Gmeiner, P., 2009. Азулен-каркас как новый биоизостер: конструкция мощных дофаминовых рецепторов D4, индуцирующих эрекцию полового члена. Химреагент Med. Химреагент 4, 325-328. McCleskey, EW, Fox, AP, Feldman, DH, Cruz, LJ, Olivera, BM, Tsien, RW, Yoshikami, D., 1987. _-Conotoxin: прямая и постоянная блокада определенных типов кальциевых каналов в нейронах, но не мышцах. Prot. Туземный Акад. Sci. США 84, 4327-4331. McKenna, KE, 2000. Некоторые предложения относительно организации контроля центральной нервной системы эрекции полового члена. Neurosci. Biobehav. Преподобный 24, 535-540. Marson, L., McKenna, KE, 1992. Роль 5-гидрокситриптамина в нисходящем торможении спинальных половых рефлексов. Exp. Brain Res. 88, 313-318. Marson, L., McKenna, KE, 1996. Группы клеток ЦНС, участвующие в контроле мышц ischiocavernosus и bulbospongiosus: исследование транснейронального трассировки с использованием вируса псевдорабильности. J. Комп. Neurol. 374, 161-179. Meisel, RL, Sachs, BD, 1994. Физиология мужского сексуального поведения. В: Knobil, E., Neil, J. (Ред.), «Физиология размножения», т. 2, второе издание. Raven Press, Нью-Йорк, стр. 3-96. Melin, P., Kihlstrom, JE, 1963. Влияние окситоцина на сексуальное поведение у самцов кроликов. Эндокринология 73, 433-435. Melis, MR, Argiolas, A., 1995a. Допамин и сексуальное поведение. Neurosci. Biobehav. Преподобный 19, 19-38. Melis, MR, Argiolas, A., 1995b. Доноры оксида азота индуцируют эрекцию полового члена и зияют при введении в центральную нервную систему самцов крыс. E. J. Pharmacol. 294, 1-9. Melis, MR, Argiolas, A., 2003. Центральная окситоцинергическая нейротрансмиссия: лекарственная мишень для терапии психогенной эректильной дисфункции. Тек. Цели лекарств 4, 55-66. Melis, MR, Argiolas, A., Gessa, GL, 1986. Окситоцин-индуцированная зевота и эрекция полового члена: сайт действия в головном мозге. Brain Res. 398, 259-265. Melis, MR, Argiolas, A., Gessa, GL, 1987. Апоморфин-индуцированная зевота и эрекция полового члена: место действия в головном мозге. Brain Res. 415, 98-104. Melis, MR, Argiolas, A., Gessa, GL, 1989a. Апоморфин увеличивает уровни окситоцина в плазме у крыс. Neurosci. Lett. 98, 351-355. Melis, MR, Argiolas, A., Gessa, GL, 1989b. Доказательства того, что апоморфин индуцирует эрекцию полового члена и зевоту, высвобождая окситоцин в центральной нервной системе. E. J. Phamacol. 164, 565-570. Melis, MR, Argiolas, A., Stancampiano, R., Gessa, GL, 1990. Влияние апоморфина на концентрации окситоцина в разных областях мозга и плазме самцов крыс. E. J. Pharmacol. 182, 101-107. Melis, MR, Mauri, A., Argiolas, A., 1994a. Апоморфин- и окситоцин-индуцированная эрекция полового члена и зевота у интактных и кастрированных самцов крыс: влияние половых стероидов. Нейроэндокринология 59, 349-354. Melis, MR, Stancampiano, R., Argiolas, A., 1994b. Эрекция полового члена и зевота, вызванная паравентрикулярными инъекциями NMDA, опосредуются окситоцином. Pharmacol. Biochem. Behav. 48, 203-207. Melis, MR, Stancampiano, R., Argiolas, A., 1994c. Профилактика метиловым эфиром NG-нитро-1-аргинина апоморфин- и окситоцин-индуцированной эрекции полового члена и зевота: место действия в головном мозге. Pharmacol. Biochem. Behav. 48, 799-804. Melis, MR, Succu, S., Argiolas, A., 1996. Агонисты допамина увеличивают образование оксида азота в паравентрикулярном ядре гипоталамуса: корреляция с эрекцией полового члена и зевотой. E. J. Neurosci. 8, 2056-2063. Melis, MR, Succu, S., Iannucci, U., Argiolas, A., 1997. Окситоцин увеличивает образование оксида азота в паравентрикулярном ядре гипоталамуса: корреляция с эрекцией полового члена и зевотой. Рег. Пептиды 69, 105-112. Melis, MR, Succu, S., Mauri, A., Argiolas, A., 1998. Производство оксида азота увеличивается в паравентрикулярном ядре гипоталамуса самцов крыс во время бесконтактных эрекций и спаривания полового члена. E. J. Neurosci. 10, 1968-1974. Melis, MR, Spano, MS, Succu, S., Argiolas, A., 1999a. Антагонист окситоцина d (CH2) 5Tyr (Me) 2-Orn8-вазотоцин снижает бесконтактную эрекцию полового члена у самцов крыс. Neurosci. Lett. 265, 171-174. Melis, MR, Succu, S., Spano, MS, Argiolas, A., 1999b. Морфин, вводимый в паравентрикулярное ядро гипоталамуса, предотвращает бесконтактную эрекцию и ухудшает совокупление: вовлечение оксида азота. E. J. Neurosci. 11, 1857-1864. Melis, MR, Spano, MS, Succu, S., Argiolas, A., 2000. Влияние антагонистов рецепторов возбуждающей аминокислоты, допамина и окситоцина на бесконтактные эрекции полового члена и образование паравентрикулярных оксидов азота у самцов крыс. Behav. Neurosci. 114, 849-857. Melis, MR, Succu, S., Mascia, MS, Cortis, L., Argiolas, A., 2003. Внеклеточный допамин увеличивается в паравентрикулярном ядре самцов крыс во время сексуальной активности. E. J. Neurosci. 17, 1266-1272. Melis, MR, Succu, S., Mascia, MS, Argiolas, A., 2004a. Антагонизм каннабиноидных CB1 рецепторов в паравентрикулярном ядре самцов крыс индуцирует эрекцию полового члена. Neurosci. Lett. 359, 17-20. Melis, MR, Succu, S., Mascia, MS, Cortis, L., Argiolas, A., 2004b. Внеклеточные возбуждающие аминокислоты увеличиваются в паравентрикулярном ядре самцов крыс во время половой активности: главная роль NMDA рецепторов в эректильной функции. E. J. Neurosci. 19, 2569-2575. Melis, MR, Succu, S., Mascia, MS, Argiolas, A., 2005. PD-168,077, селективный агонист рецептора дофамина D4, индуцирует эрекцию полового члена при введении в паравентрикулярное ядро самцов крыс. Neurosci. Lett. 379, 59-62. Melis, MR, Succu, S., Mascia, MS, Sanna, F., Melis, T., Succu, S., Castelli, MP, Argiolas, A., 2006a. SR 141716A-индуцированная эрекция полового члена у самцов крыс: участие паравентрикулярной глутаминовой кислоты и оксида азота. Нейрофармакология 50, 219-228. Melis, MR, Succu, S., Sanna, F., Mascia, MS, Melis, T., Enguehard-Gueiffier, C., Hubner, H., Gmenier, P., Gueiffier, A., Argiolas, A., 2006b. PIP3EA и PD168077, два селективных агониста рецептора дофамина D4, индуцируют эрекцию полового члена у самцов крыс: сайт и механизм действия в головном мозге. E. J. Neurosci. 24, 2021-2030. Melis, MR, Melis, T., Cocco, C., Succu, S., Sanna, F., Pillolla, G., Boi, A., Ferri, GL, Argiolas, A., 2007. Окситоцин, вводимый в брюшную тегментальную область, индуцирует эрекцию полового члена и увеличивает внеклеточный допамин в ядре accumbens MR Мелис А. Argiolas / Neuroscience и Biobehavioral Reviews 35 (2011) 939-955 955 и паравентрикулярное ядро гипоталамуса самцов крыс. E. J. Neurosci. 26, 1026-1035. Melis, MR, Sanna, F., Succu, S., Zarone, P., Boi, A., Argiolas, A., 2009a. Роль окситоцина в опережающих и завершающих стадиях сексуального поведения мужской крысы. В: Jastrow, H., Feuerbach, D. (Ред.), Справочник по исследованию окситоцина: синтез, хранение и высвобождение, действия и лекарственные формы. Nova Publishers Inc, Нью-Йорк, США, стр. 109-125. Melis, MR, Succu, S., Sanna, F., Boi, A., Argiolas, A., 2009b. Окситоцин, инъецированный в брюшную субкулуму или заднечеловеческое кортикальное ядро миндалевидной железы, индуцирует эрекцию полового члена и увеличивает внеклеточный допамин в прилежащих ядрах самцов крыс. E. J. Neurosci. 30, 1349-1357. Melis, MR, Succu, S., Cocco, C., Caboni, E., Sanna, F., Boi, A., Ferri, GL, Argiolas, A., 2010. Окситоцин индуцирует эрекцию полового члена при введении в брюшную субкулуму: роль оксида азота и глутаминовой кислоты. Нейрофармакология 58, 1153-1160. Moreland, RB, Nakane, M., Donnelly-Roberts, DL, Miller, LN, Chang, R., Uchic, ME, Terranova, MA, Gubbins, EJ, Helfrich, RJ, Namovic, MT, El-Kouhen, OF, Мастера, JN, Brioni, JD, 2004. Сравнительная фармакология стабильных клеточных линий рецептора дофамина D (2) -подобного рецептора, связанного с потоком кальция через Galpha (qo5). Biochem. Pharmacol. 68, 761-772. Moos F., Freund-Mercier, MJ, Guerne, Y., Guerne, JM, Stoeckel, ME, Richard, P., 1984. Выделение окситоцина и вазопрессина с помощью магноцеллюлярных ядер in vitro: специфическое облегчающее действие окситоцина на собственное выделение. J. Эндокринол. 102, 63-72. Murphy, MR, Seckl, JR, Burton, S., Checkley, SA, Lightman, SL, 1987. Изменения секреции окситоцина и вазопрессина во время половой активности у мужчин. J. Clin. Эндокринол. Metab. 65, 738-741. Nishimori, K., Young, LJ, Guo, Q., Wang, Z., Insel, TR, Matzuk, MM, 1996. Окситоцин необходим для кормления грудью, но не является существенным для родов или репродуктивного поведения. Proc. Natl. Акад. Sci. США 93, 11699-11704. Patel S., Freedman S., Chapman, KL, Emms, F., Fletcher, AE, Knowles, M., Marwood, R., Mccallister, G., Myers, J., Curtis, J., Kulagowski, JJ, Leeson, PD, Ridgill, M., Graham, M., Matheson, S., Rathbone, D., Watt, AP, Bristow, LJ, Rupniak, NM, Baskin, E., Lynch, JJ, Ragan, CI , 1997. Биологический профиль L 745,870, селективный антагонист с высоким сродством к рецептору дофамина D4. J. Pharmacol. Exp. Ther. 283, 636-647. Pedersen, CA, Caldwell, JD, Jirikowski, GF, Insel, TR, 1992. Окситоцин в материнском, сексуальном и социальном поведении, Annals of the New York Academy of Sciences, vol. 652. Нью-Йоркская академия наук, Нью-Йорк. Petrovic, P., Kalisch, R., Singer, T., Dolan, RJ, 2008. Окситоцин ослабляет аффективные оценки условных лиц и активности миндалин. J. Neurosci. 28, 6607-6615. Pfaus, JG, Everitt, BJ, 1995. Психофармакология сексуального поведения. В: Knobil, FE, Kupfer, DJ (Ред.), Психофармакология: Четвертое поколение прогресса. Raven Press, Нью-Йорк, стр. 742-758. Rajfer, J., Aronson, WJ, Bush, PA, Dorey, FJ, Ignarro, LJ, 1992. Оксид азота как медиатор релаксации кавернозного тела в ответ на неадренергическую, нехолинергическую нейротрансмиссию. N. Engl. J. Med. 326, 90-94. Roeling, TAP, Van Erp, AMM, Meelis, W., Kruk, MR, Veening, JG, 1991. Поведенческие эффекты NMDA, вводимые в гипоталамическое паравентрикулярное ядро крысы. Brain Res. 550, 220-224. Sachs, BD, 1997. Эрекция вызвана у самцов крыс воздушным ароматом у эстрадных женщин. Physiol. Behav. 62, 921-924. Sachs, BD, 2000. Контекстуальные подходы к физиологии и классификации эректильной функции, эректильной дисфункции и сексуального возбуждения. Neurosci. Biobehav. Преподобный 24, 541-560. Sachs, BD, 2007. Контекстное определение мужского сексуального возбуждения. Horm. Behav. 51, 569-578. Sanchez, F., Alonso, JR, Arevalo, R., Blanco, E., Aijon, J., Vazquez, R., 1994. Сосуществование НАДФ-диафоразы с вазопрессином и окситоцином в гипоталамо-магноцеллюлярных нейросекреторных ядрах крысы. Cell Tissue Res. 276, 31-34. Sanna, F., Succu, S., Boi, A., Melis, MR, Argiolas, A., 2009. Ингибиторы 5 фосфодиэстеразы облегчают бесконтактную эрекцию у самцов крыс: сайт действия в головном мозге и механизм действия. J. Секс. Med. 6, 2680-2689. Saphier, D., Feldman, S., 1987. Влияние септальных и гиппокампальных стимулов на паравентрикулярные нейроны ядра. Neuroscience 20, 749-755. Сато-Сузуки, И., Кита, И., Огури, М., Арита, Х., 1998. Стереотипные зияющие реакции, вызванные электрической и химической стимуляцией паравентрикулярного ядра крысы. J. Neurophysiol. 80, 2765-2775. Schuman, EM, Madison, DV, 1994. Оксид азота и синаптическая функция. Ann. Преподобный Neurosci. 17, 153-183. Snyder, SH, 1992. Оксид азота: сначала в новом классе нейротрансмиттеров? Наука 254, 494-496. Sofroniew, MV, 1983. Вазопрессин и окситоцин в мозге и спинном мозге млекопитающих. Тенденции Neurosci. 6, 467-472. Sokoloff, P., Schwartz, JC, 1995. Новые рецепторы допамина спустя полвека. Тенденции Фармакол. Sci. 16, 270-275. Southam, E., Garthwaite, J., 1993. Оксидно-циклический путь передачи сигналов GMP в мозге крысы. Нейрофармакология 32, 1267-1277. Stancampiano, R., Melis, MR, Argiolas, A., 1994. Эрекция полового члена и зевота, индуцированные агонистами 5-HT1c у самцов крыс: связь с допаминергической и окситоцинергической передачей. E. J. Pharmacol. 261, 149-155. Succu, S., Mascia, MS, Sanna, F., Melis, T., Argiolas, A., Melis, MR, 2006. Антагонист рецептора каннабиноида CB1 SR 141716A индуцирует эрекцию полового члена путем увеличения внеклеточной глутаминовой кислоты в паравентрикулярном ядре самцов крыс. Behav. Brain Res. 169, 274-281. Succu, S., Sanna, F., Melis, T., Boi, A., Argiolas, A., Melis, MR, 2007. Стимуляция дофаминовых рецепторов в паравентрикулярном ядре гипоталамуса самцов крыс индуцирует эрекцию полового члена и увеличивает внеклеточный допамин в ядре accumbens: вовлечение центрального окситоцина. Нейрофармакология 52, 1034-1043. Succu, S., Sanna, F., Cocco, C., Melis, T., Boi, A., Ferri, GL, Argiolas, A., Melis, MR, 2008. Окситоцин индуцирует эрекцию полового члена при введении в брюшную тегментальную область самцов крыс: роль оксида азота и циклического GMP. E. J. Neurosci. 28, 813-821. Tanda, G., Pontieri, FE, Di Chiara, G., 1997. Каннабиноиды и активация героина передачи мезолимбического дофамина с помощью общего механизма опиоидного рецептора mu1. Наука 276, 2048-2050. Tang, Y., Rampin, O., Calas, A., Facchinetti, P., Giuliano, F., 1998. Окситоцинергическая и серотонинергическая иннервация идентифицированных пояснично-крестцовых ядер, контролирующих эрекцию полового члена у самцов крыс. Neuroscience 82, 241-254. Теодоз, DT, 1985. Окситоцин-иммунореактивные терминалы синапса на окситоцин-нейронах в супраоптических ядрах. Природа (Лондон) 313, 682-684. Tindall, JS, 1974. Стимулы, вызывающие выделение окситоцина. В: Geiger, SR, Knobil, E., Sawyer, WH, Greef, R., Astwood, EB (Ред.), «Справочник физиологии». Секта. 7, эндокринология, том. IV. Американское общество физиологии, Вашингтон, округ Колумбия, стр. 257-267. Torres, G., Lee, S., Rivier, C., 1993. Онтогенез синтазы оксиданта крысиного гипоталамуса и колокализация с нейропептидами. Mol. Cell. Neurosci. 4, 155-163. Uhl-Bronner, S., Waltisperger, E., Martinez-Lorenzana, G., Condes, LM, Freund-Mercier, MJ, 2005. Сексуально диморфная экспрессия сайтов связывания окситоцина в переднем мозге и спинном мозге крысы. Neuroscience 135, 147-154. Vaccari, C., Lolait, SJ, Ostrowski, NL, 1998. Сравнительное распределение вазопрессина V1b и рецепторов рибонуклеиновых кислот рецептора окситоцина в головном мозге. Эндокринология 139, 5015-5033. Ван Ден Пол, А., 1991. Глутаматная и аспартатная иммунореактивность в гипоталамических пресинаптических аксонах. J. Neurosci. 11, 2087-2101. Veronneau-Longueville, F., Rampin, O., Freund-Mercier, MJ, Tang, Y., Calas, A., Marson, L., McKenna, KE, Stoeckel, ME, Benoit, G., Giuliano, F. , 1999. Окситоцинергическая иннервация вегетативных ядер, контролирующих эрекцию полового члена у крысы. Neuroscience 93, 1437-1447. Винсент, SR, Кимура, Х., 1992. Гистохимическое картирование синтазы оксида азота в мозге крысы. Neuroscience 46, 755-784. Wagner, CK, Clemens, LG, 1993. Нейрофизин-содержащий путь от паравентрикулярного ядра гипоталамуса к половому диморфному моторному ядру в поясничном спинном мозге. J. Комп. Neurol. 336, 106-116. Winslow, JT, Insel, TR, 1991. Социальный статус в парах мужчин-обезьян-белок определяет поведенческую реакцию на центральное введение окситоцина. J. Neurosci. 11, 2032-2038. Wise, RA, Rompre, P.-P., 1989. Дофамин мозга и награда. Ann. Преподобный Psychol. 40, 191-225. Witt, DM, Insel, TR, 1994. Мужское сексуальное поведение активирует c-fos-подобный белок в нейронах окситоцина в паравентрикулярном ядре гипоталамуса. J. Neuroendocrinol. 6, 13-18. Witter, MP, 2006. Соединения субкулума крысы: топография по отношению к столбчатой и ламинарной организации. Behav Brain Res. 174, 251-264. Woodruff, GN, Foster, AC, Gill, R., Kemp, JA, Wong, EH, Iversen, LL, 1987. Взаимодействие между MK-801 и рецепторами для N-метил-d-аспартата: функциональные последствия. Нейрофармакология 26, 903-909. Yamashita, H., Shigeru, О., Inenaga, K., Kasai, M., Uesugi, S., Kannan, H., Kaneko, T., 1987. Окситоцин преимущественно возбуждает предполагаемые нейроны окситоцина в супраоптическом ядре крысы in vitro. Brain Res. 416, 364-368. Yells, DP, Hendricks, SE, Prendergast, MA, 1992. Поражения ядра paragigantocellularis: влияние на спаривание у самцов крыс. Brain Res. 596, 73-79. Young, WS, Shepard, E., Amico, J., Hennighausen, L., LaMarca, ME, McKinney, C., Ginns, EI, 1996. Дефицит окситоцина мыши предотвращает выпадение молока, но не фертильность или роды. J. Neuroendocrinol. 8, 847-854. Zahran, AR, Vachon, P., Courtois, F., Carrier, S., 2000. Увеличение внутрикавернозного давления пениса после инъекций агонистов рецепторов возбуждающих аминокислот в гипоталамическом паравентрикулярном ядре анестезированных крыс. J. Urol.