Комментарии: Этот обзор был подготовлен руководителем NIDA Норой Волков и ее командой. Это оставляет мало сомнений в том, что химическая зависимость и поведенческая зависимость имеют одни и те же или похожие механизмы и нейронные схемы. Это имеет смысл, поскольку химическая зависимость угоняет нервную систему для связи, секса и еды. Поскольку секс высвобождает вдвое больше допамина, как едят ваши любимые блюда, и пользователь может сохранить порно допамина повышен в течение нескольких часов, он с ума, чтобы предложить, что порно-зависимость не может существовать.
Curr Top Behav Neurosci. 2011 Октябрь 21.
Волков Н.Д., Ван Г.Дж., Фаулер Дж.С., Томаси Д., Балер Р.
Источник
Национальный институт по борьбе со злоупотреблением наркотиками, 6001 Executive Boulevard 6001, кабинет 5274, Bethesda, MD, 20892, США, [электронная почта защищена].
Абстрактные
Как наркоманию, так и ожирение можно определить как расстройства, при которых ценность одного вида вознаграждения (наркотики и пища соответственно) повышается ненормально по сравнению с другими и за их счет. Эта модель согласуется с тем фактом, что и лекарства, и пища обладают мощным укрепляющим действием, частично опосредованным увеличением дофамина в лимбической системе, что при определенных обстоятельствах или у уязвимых людей может подавить механизмы гомеостатического контроля мозга. Подобные параллели вызвали значительный интерес к пониманию общих уязвимостей и траекторий между зависимостью и ожирением. Теперь открытия в области визуализации мозга начали выявлять общие черты между этими двумя состояниями и определять некоторые из перекрывающихся контуров мозга, дисфункции которых могут объяснять стереотипные и связанные с ними поведенческие нарушения у людей. TЭти результаты свидетельствуют о том, что как страдающие ожирением, так и наркозависимые люди страдают от нарушений в дофаминергических путях, которые регулируют нейронные системы, связанных не только с чувствительностью к вознаграждению и стимулирующей мотивацией, но также с условием (память / обучение), импульсным контролем (поведенческое торможение), стрессовой реактивностью и интероцептивная осведомленность. Здесь мы интегрируем результаты, полученные преимущественно из позитронно-эмиссионной томографии, которые проливают свет на роль дофамина в наркомании и ожирении, и предлагаем обновленную рабочую модель, которая поможет определить стратегии лечения, которые могут принести пользу обоим этим условиям.
1 проверка данных
2 Роль допамина в остром вознаграждении лекарствам и пище
3 DA визуализации в ответ на наркотики и условные сигналы в зависимости
4 Влияние дисфункции на ингибирующий контроль
5 Участие мотивационных цепей
6 Вовлечение интероцептивной схемы
7 Схема отвращения
8 Вознаграждение за патологические лекарства и продукты питания: обновленная рабочая модель
1 проверка данных
Дофамин (DA) считается ключом к полезным эффектам естественного и лекарственного вознаграждения. Однако его роль в потере контроля и компульсивного поведения, связанного с зависимостью и ожирением, гораздо менее ясна. Исследования ПЭТ сыграли решающую роль в характеристике роли систем DA головного мозга в зависимости (в дополнение к ее роли в поощрении наркотиков) и в ожирении. Действительно, наркотики злоупотребления (включая алкоголь) потребляются людьми или самоконтролируемыми лабораторными животными, потому что они по своей природе полезны, эффект, который опосредован их усиливающими DA свойствами в мезолимбической системе (Wise 2009). ЧАСтем не менее, в случае зависимости, исследования визуализации показали, что расстройство влияет не только на схему вознаграждения DA, но и на другие пути DA, участвующие в модуляции обусловленности / привычек, мотивации и исполнительных функций (сдерживающий контроль, приписывание отличия и принятие решения). -производство), и что дефицит DA может также участвовать в усилении реактивности на стресс и нарушении интероцептивной осведомленности, связанной с зависимостью. Доклинические и клинические исследования также выявили другие нейротрансмиттеры (и нейропептиды), которые играют важную роль в вознаграждении и зависимости от наркотиков. (т. е. каннабиноиды, опиоиды) и принимают непосредственное участие в нейропластических изменениях, которые следует за многократным употреблением наркотиков (т. е. глутамат, опиоиды, ГАМК, кортикотропин-рилизинг-фактор). Глутаматергическая система особенно важна в этом отношении, потому что она опосредует нарушения как долгосрочной потенциации, так и длительной депрессии, которые наблюдались на животных моделях хронического введения лекарств. (Thomas et al. 2008). Обзоры, относящиеся к этим дополнительным системам, можно найти в другом месте (Kalivas 2009; Кооб 1992).
Поскольку лекарства активируют те же системы вознаграждения, которые лежат в основе пищевого вознаграждения, не совсем неожиданно, что, в общем, исследования с визуализацией головного мозга подтвердили идею о том, что нарушения в цепях, модулированных DA, также связаны с патологическим компульсивным поведением в еде., Пищевые сигналы, такие как сигналы лекарств, увеличивают внеклеточный DA в стриатуле и стимулируют мотивацию к поведению, которое необходимо для приобретения и употребления пищи, что свидетельствует о вовлечении DA не только в вознаграждение за пищу, но и в негедоническую мотивацию. свойства пищи (то есть потребности в калориях) и снижение подавляющего контроля, наблюдаемое при компульсивном переедании (Avena et al. 2008; Волков и соавт. 2008a).
Здесь мы рассмотрим результаты исследований изображений, которые конкретно сосредоточены на перекрытиях в мозговых цепях, которые нарушаются при ожирении и наркомании. Однако стоит помнить, что регулирование поведения при приеме пищи намного сложнее, чем регулирование приема лекарств. Последний в основном опосредован полезными эффектами лекарств, тогда как первый модулируется не только его полезными эффектами (гедонистическими факторами), но также множественными периферическими и центральными факторами, которые ощущают потребности организма в питательных веществах, необходимые для выживания (гомеостатические факторы). Интересно, что появляется все больше доказательств того, что гомеостатические факторы (например, инсулин, лептин, грелин) модулируют потребление пищи частично путем увеличения или уменьшения чувствительности цепей вознаграждения мозга к пищевым стимулам (Volkow et al. 2011a).
2 Роль допамина в остром вознаграждении лекарствам и пище
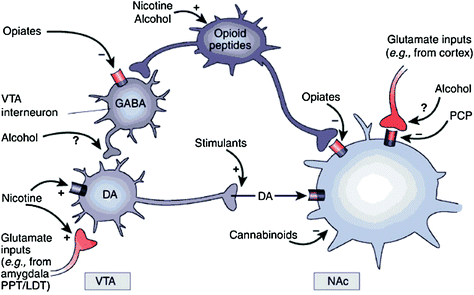
Прямо или косвенно, все наркотики вызывают способность увеличивать DA в прилежащем ядре (NAc) посредством специфических взаимодействий с различными молекулярными мишенями (Nestler). 2004) (Инжир. 1). Мезолимбический путь DA [клетки DA в области вентрального сегмента (VTA), которые проецируются в NAc], по-видимому, имеет решающее значение для вознаграждения лекарством (Wise 2009). Однако, как описано ниже, другие пути DA [мезостриатальные (клетки DA в черной субстанции, выступающие в дорсальную полосатую кишку) и мезокортикальные (клетки DA в VTA, выступающие в лобную кору)] также способствуют вознаграждению и зависимости от лекарств (Wise 2009). В целом, похоже, что полезные и кондиционирующие эффекты лекарств преимущественно обусловлены фазовым выстрелом клеток DA, что приводит к значительному и кратковременному увеличению DA. Напротив, последующие изменения в исполнительной функции, которые происходят в зависимости, связаны с изменениями в тонизирующей клетке DA и приводят к более низким, но более стабильным уровням DA (Grace 2000; Wanat et al. 2009). Это, в свою очередь, указывает на рецепторы D1 (D1R), которые являются низкоаффинными рецепторами DA, которые стимулируют передачу сигналов циклического АМФ, участвуя как в остром вознаграждении лекарств, так и в кондиционировании, поскольку они связаны с необходимыми высокими концентрациями DA стимулировать D1R. Напротив, D2R, которые ингибируют передачу сигналов циклического АМФ, стимулируются как фазовым, так и тоническим DA. Обратите внимание, что из-за отсутствия специальных радиотрасеров для визуализации PET рецепторов DA типов D1, D3, D4 и D5 большинство исследований по изучению влияния наркотиков и наркомании на мозг человека были сосредоточены на D2R.
Рис 1 Наркотики злоупотребления воздействуют на вознаграждение и вспомогательные контуры через различные механизмы, однако все они приводят к сходным дофаминергическим эффектам в VTA и NAc., Таким образом, стимуляторы непосредственно стимулируют DA в акумбальной области, в то время как опиаты делают это путем снижения ингибирующего тонуса GABAergic интернейронов при передаче сигналов DA как в VTA, так и в NAc. В то время как механизмы злоупотребления другими лекарственными средствами менее ясны, имеются данные, свидетельствующие о том, что никотин может активировать VTA DA непосредственно через никотиновый ацетилхолиновый рецептор (nAChR) на этих нейронах и косвенно посредством стимуляции его рецепторов на глутаматергических нервных окончаниях, которые иннервируют клетки DA. Алкоголь, по-видимому, ингибирует GABAergic терминалы в VTA, приводя к дезингибированию DA-нейронов в VTA. Каннабиноиды действуют, в частности, посредством активации рецепторов CB1 на глутаматергических и ГАМКергических нервных окончаниях в NAc и на самих нейронах NAc. Фенциклидин (PCP) может действовать путем ингибирования постсинаптических NMDA-глутаматных рецепторов в NAc. Кроме того, есть некоторые свидетельства того, что никотин и алкоголь могут также взаимодействовать с эндогенными опиоидными и каннабиноидными путями (не показано). PPT / LDT, ножной сегментарный поясничный / боковой дорсальный сегментатум. Перепечатано с разрешения Nestler (2005)
На людях исследования ПЭТ показали, что некоторые препараты [стимуляторы (Drevets et al. 2001; Волков и соавт. 1999b), никотин (Brody et al. 2009), алкоголь (Boileau et al. 2003) и марихуану (Bossong et al. 2009)] увеличение DA в дорсальной и брюшной полосатых (где находится NAc). В этих исследованиях используются несколько радиоиндикаторов, таких как [11C] raclopride, которые связываются с D2R, но только тогда, когда они не связывают эндогенный DA (незанятый), который в базовых условиях соответствует 85 – 90% стриатального D2R (Abi-Dargham et al. 1998). Таким образом, сравнение [11Связывание C] raclopride после плацебо и после введения препарата может помочь нам оценить уменьшение доступности D2R, вызванное препаратом (или другими стимулами, которые могут увеличить DA). Эти снижения в [11C] раклопридное связывание пропорционально увеличению DA (Breier et al. 1997). Эти исследования показали, что медикаментозное увеличение DA в полосатом теле пропорционально интенсивности субъективного опыта эйфории или «высокой» [см. Обзор (Volkow et al. 2009a)] (Инжир. 2).
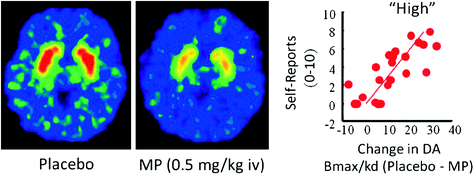
Рис 2 Эффекты внутривенного введения метилфенидата (МП) при связывании раклоприда и взаимосвязь между повышением уровня стриатальной DA, индуцированным МП в полосатом теле, и самоотчеты о «высоком». Модифицировано из Volkow et al. (1999b)
Исследования ПЭТ также выявили четкую, прямую связь между фармакокинетическим профилем препарата (т. Е. Скоростью, с которой он входит и покидает мозг) и его усиливающим эффектом. В частности, чем быстрее лекарство достигает пиковых уровней в мозге, тем интенсивнее «высокий» (Volkow et al. 2009a). Например, для эквивалентного уровня кокаина, достигающего мозга (оцениваемого с помощью ПЭТ), когда кокаин быстро проникал в мозг (курение или внутривенное введение), он вызывал более интенсивный «высокий» уровень, чем когда он поступал с более медленной скоростью (фыркнул) (Volkow et al. 2000). Это согласуется с доклиническими исследованиями, показывающими сходную корреляцию между фармакокинетическим профилем препарата и его усиливающими свойствами (Balster and Schuster 1973). ЯРазумно предположить, что такое резкое и большое увеличение DA, вызванное наркотиками, может имитировать быстрое и большое увеличение DA, возникающее в результате фазового запуска DA, связанного в мозгу с обработкой информации о вознаграждении и значимости. (Schultz 2010). Такое вызванное лекарственным средством увеличение DA в NAc может быть необходимо для зависимости, но тот факт, что они встречаются также у лиц без зависимости, указывает на то, что они недостаточны для объяснения импульсивного и компульсивного употребления наркотиков, характерного для зависимости.
В настоящее время имеются доказательства того, что сопоставимые дофаминергические реакции связаны с пищевым вознаграждением и что эти механизмы также могут играть роль в чрезмерном потреблении пищи и ожирении. Хорошо известно, что определенные продукты, особенно те, которые богаты сахарами и жирами, очень полезны (Lenoir et al. 2007). Высококалорийная пища может способствовать перееданию (еде, не связанной с энергетическими потребностями) и вызывать усвоенные ассоциации между стимулом и вознаграждением (обусловливанием). С точки зрения эволюции, это свойство вкусовых продуктов раньше было выгодно в условиях, когда источники пищи были недостаточны и / или ненадежны, потому что это гарантировало, что пища съедалась, когда она была доступна, позволяя запасать энергию в организме (в виде жира) для будущего использования. , К сожалению, в таких обществах, как наше, где еда обильна и постоянно доступна, эта адаптация стала проблемой.
Несколько нейротрансмиттеров, включая DA, каннабиноиды, опиоиды и серотонин, а также гормоны и нейропептиды, участвующие в гомеостатической регуляции потребления пищи, такие как инсулин, орексин, лептин и грелин, были вовлечены в полезные эффекты пищи (Аткинсон 2008; Cason et al. 2010; Cota et al. 2006). Из них DA был наиболее тщательно исследован и является наиболее характерным. Эксперименты на грызунах показали, что при первом воздействии пищевого вознаграждения активация нейронов DA в VTA увеличивается с результирующим увеличением высвобождения DA в NAc (Norgren et al. 2006). Точно так же у здоровых людей с нормальным весом при приеме внутрь вкусной пищи было показано высвобождение DA в дорсальном полосатом теле пропорционально показателям приятности приема пищи (Small et al. 2003) (Инжир. 3). Однако, как видно из исследований, проведенных с наркоманами, вызванное пищей увеличение только DA стриатального ДА не может объяснить разницу между нормальным потреблением пищи и чрезмерным компульсивным потреблением пищи, поскольку это также наблюдается у здоровых людей, которые не употребляют чрезмерно много пищи. Таким образом, как и в случае с зависимостью, последующие адаптации могут быть связаны с потерей контроля над приемом пищи.
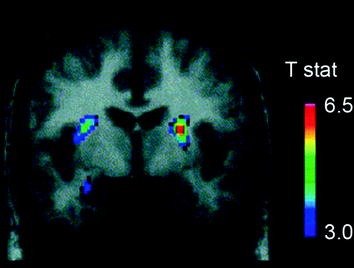
Рис 3 Высвобождение допамина, вызванное кормлением. Корональное сечение на Т-карте статистически значимых сокращений в [11С] потенциал связывания раклоприда (АД) после кормления. Цветная полоса представляет значения статистики t. (Перепечатано с разрешения Small et al. 2003)
3 DA визуализации в ответ на наркотики и условные сигналы в зависимости
Роль DA в подкреплении более сложна, чем просто кодирование вознаграждения как такового (гедоническое удовольствие); например, стимулы, которые вызывают быстрое и большое увеличение DA, также вызывают условные ответы и вызывают побудительную мотивацию для их приобретения (Owesson-White et al. 2009). Это важно, потому что в процессе кондиционирования нейтральные стимулы, связанные с подкрепляющим средством (будь то природное или подкрепляющее средство для лекарств), сами приобретают способность увеличивать DA в стриатуме (включая NAc) в ожидании награды, что порождает сильная мотивация искать препарат (Owesson-White et al. 2009). Однако разобщение механизмов вознаграждения и обусловливания в процессе наркомании является более сложной задачей, чем при употреблении пищи, потому что наркотики, благодаря своему фармакологическому действию, непосредственно активируют нейроны DA (то есть никотин) или увеличивают высвобождение DA (то есть амфетамина).
Исследования томографии мозга, в которых сравнивалось увеличение DA, вызванное стимулирующим лекарственным средством метилфенидатом (MP) или амфетамином (AMPH) среди субъектов с кокаиновой зависимостью по сравнению с контролем, показали заметное ослабление вызванного MP или AMPH повышений DA в стриатуме (на 50% ниже у детей, подвергшихся детоксикации). и 80% среди активных лиц, злоупотребляющих наркотиками) и меньшие самоотчеты о полезных эффектах препарата по сравнению с контрольной группой, не злоупотребляющей наркотиками (Martinez et al. 2007; Волков и соавт. 1997) (Инжир. 4). Это было удивительно, поскольку MP и AMPH фармакологически сходны с кокаином и метамфетамином соответственно, и лица, злоупотребляющие наркотиками, не могут различить их при внутривенном введении. Поскольку было отмечено заметное снижение вызванного лекарственными средствами увеличения DA, независимо от того, были ли детоксифицированы лица, злоупотребляющие кокаином, или нет, это указывает на то, что состояние отмены не является мешающим фактором (Volkow et al. 2011b). Эти и связанные результаты (Volkow et al. 2009a) согласуются с гипотезой о том, что гедонистический ответ становится дефицитным у наркозависимых людей, и еще более усиливают представление о том, что острые фармакологические эффекты DA, усиливающие фармакологическое действие, не могут сами по себе объяснить возросшую мотивацию к их потреблению.
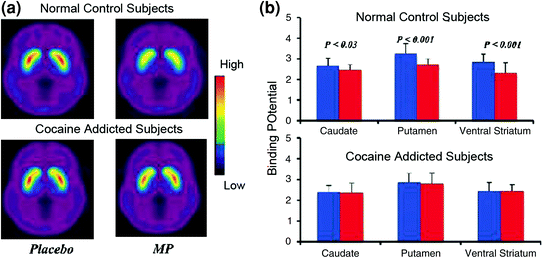
Рис 4 Изменения DA, индуцированные внутривенным введением MP в контроле и у активных субъектов, кокаиновых, Средний неразмещенный потенциал связывания (BPND) изображений [11C] raclopride у активных субъектов с кокаиновой зависимостью (n = 19) и в контроле (n = 24), протестированных после плацебо и после внутривенного введения. b Доступность D2R (BPND) в хвостатом, путаменовом и вентральном стриатуме после плацебо (синий) и после МР (красный) в контрольной группе и у субъектов с кокаиновой зависимостью. MP снижал D2R у контролей, но не у субъектов с кокаиновой зависимостью. Обратите внимание, что лица, злоупотребляющие кокаином, демонстрируют как снижение базовой доступности стриатального D2R (мера плацебо), так и снижение высвобождения DA, когда дано внутривенное МП (измеряется как уменьшение доступности D2R от исходного уровня). Хотя можно подвергнуть сомнению степень, в которой низкая доступность D2R в полосатом теле у субъекта с кокаиновой зависимостью ограничивает способность обнаруживать дальнейшее снижение от MP, тот факт, что субъекты с кокаиновой зависимостью показывают снижение доступности D2R при воздействии кокаиновыми сигналами, указывает на то, что ослабленные эффекты МП на [11С] раклопридное связывание отражает снижение высвобождения DA. Перепечатано с разрешения (Volkow et al. 1997; Wang et al. 2010)
Реакция нейронов VTA DA на полезные стимулы изменяется при многократном воздействии.
В то время как клетки DA срабатывают при первом воздействии новой награды, повторное воздействие DA заставляет нейроны прекращать стрельбу при потреблении награды и пожаре вместо этого, когда они подвергаются воздействию стимулов, которые предсказывают вознаграждение (Schultz et al. 1997). Это, вероятно, лежит в основе роли DA в обучении и обусловленности. Действительно, индуцированная лекарственными средствами фазовая передача сигналов DA может в конечном итоге вызвать нейроадаптацию во вспомогательных контурах, которые связаны с формированием привычки и поведенческой обусловленностью. TЭти изменения в основном индуцируются передачей сигналов D1R и синаптическими изменениями в модуляции глутамата NMDA и AMPA-рецепторов. (Люшер и Маленка 2011; Zweifel et al. 2009). Набор этих цепей важен для прогрессирования заболевания, потому что последующие условные реакции помогают объяснить сильное желание наркотика (тяга) и навязчивое использование, которое возникает, когда зависимые субъекты подвергаются воздействию сигналов, связанных с наркотиками. Эта гипотеза согласуется с независимыми наблюдениями (Volkow et al. 2006b; Вонг и соавт. 2006), которые демонстрируют силу воздействия кия-ассоциированного сигнала на повышение уровня DA в дорсальном стриатуме и вызывают сопутствующее усиление субъективного ощущения тяги к наркоманам, употребляющим детоксифицированный кокаин (рис. 5). Поскольку спинной стриатум играет роль в обучении навыкам (Belin et al. 2009; Инь и соавт. 2004), ассоциация, вероятно, будет отражать усиление привычек по мере прогрессирования хронической зависимости. Это говорит о том, что основное нарушение в зависимости может быть связано с вызванными DA условными реакциями, которые приводят к привычкам, приводящим к интенсивному влечению и навязчивому потреблению наркотиков. Интересно, что при активном использовании субъектов с кокаиновой зависимостью увеличение DA, вызванное условными сигналами, кажется, даже больше, чем те, которые вырабатываются самим стимулятором, как оценивали две отдельные группы субъектов (Volkow et al. 2011b, 2006b), предполагая, что условные ответы могут управлять передачей сигналов DA, которая поддерживает мотивацию к приему препарата, даже когда его фармакологические эффекты, по-видимому, снижены. Таким образом, хотя лекарства могут первоначально вызывать чувство немедленного вознаграждения за счет высвобождения DA в вентральном стриатуме, при многократном использовании и по мере развития привычки, по-видимому, происходит переход от лекарства к условному раздражителю. Согласно исследованиям на лабораторных животных, глутаматергические проекции из префронтальной коры и миндалины в VTA / SN и NAc опосредуют эти условные реакции (Kalivas 2009). Таким образом, простое предсказание вознаграждения может в конечном итоге стать вознаграждением, которое мотивирует поведение, необходимое для потребления наркотиков (или продуктов питания).
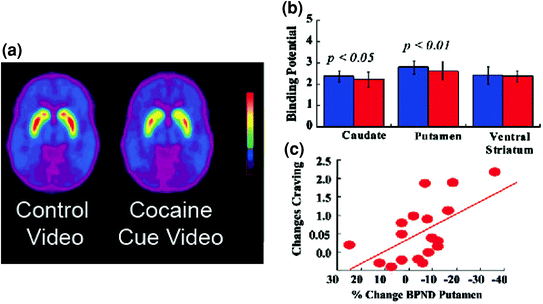
Рис 5 Изменения DA, вызванные условными сигналами у активных субъектов с кокаиновым, Изображения среднего неразрывного потенциала связывания (BPND) раклоприда [11C] у субъектов с кокаиновой зависимостью (n = 17), протестированных при просмотре нейтрального видео (сцены природы) и при просмотре видео с кокаиновыми сигналами (субъекты, принимающие кокаин). b Доступность D2R (BPND) в хвостатом, путаменовом и вентральном стриатуме для нейтрального видео (синего цвета) и видео с кокаиновыми репликами (красного цвета). Сигналы кокаина снижали D2R в хвостатой и путаменовой областях. c Корреляции между изменениями в D2R (отражающими увеличение DA) и самоотчетами о тяге кокаина, вызванной видеокамерами кокаиновых сигналов. Модифицировано из исх. (Volkow et al. 2006b)
IИнтересно, что этот тип функциональных «переключателей» также сообщается для естественных усилителей, которые могут вызывать эквивалентное и постепенное смещение DA, от вентральных к более дорсальным областям стриатума во время перехода от нового стимула, который по своей природе награждение тем из связанных сигналов, которые предсказывают это. Этот переход передается через сигнализацию DA, которая, по-видимому, кодирует «ошибку предсказания вознаграждения» (Шульц 2010). Обширные глутаматергические афференты к нейронам DA из областей, вовлеченных в обработку сенсорной (инсула или первичной вкусовой коры), гомеостатической (гипоталамус), поощрительной (NAc), эмоциональной (миндалины и гиппокампа) и мультимодальной (орбитофронтальной коры для определения принадлежности) , модулировать их деятельность в ответ на награды и условные сигналы (Гейслер и Мудрый 2008). Более конкретно, проекции из миндалины и орбитофронтальной коры (OFC) на нейроны DA и на NAc участвуют в условных реакциях на пищу (Петрович 2010). Действительно, визуальные исследования показали, что, когда мужчин без ожирения просили подавить их тягу к еде - в то время как они подвергались воздействию пищи - они проявляли пониженную метаболическую активность в миндалинах и OFC (а также в гиппокампе), инсуле и стриатуме, и что снижение OFC было связано с уменьшением тяги к пище (Wang et al. 2009). Подобное ингибирование метаболической активности в OFC (а также в NAc) наблюдалось у лиц, злоупотребляющих кокаином, когда их просили подавить тягу к наркотику при воздействии кокаиновых сигналов (Volkow et al. 2009b).
Тем не менее, появление таких сильно обусловленных репликами пристрастий, которые возникают в отношении пищи также у здоровых людей, которые не переедают, не было бы столь разрушительным, если бы они не были связаны с растущим дефицитом способности мозга ингибировать неадаптивное поведение.
4 Влияние дисфункции на ингибирующий контроль
Способность подавлять доминантные реакции обязательно способна помочь человеку избежать участия в ненадлежащем поведении, таком как употребление наркотиков или прием пищи за границу сытости, и, таким образом, повышение его / ее уязвимости к зависимости (или ожирению) (Волков и Фаулер) 2000; Волков и соавт. 2008a).
Исследования ПЭТ выявили значительное снижение доступности D2R в стриатуме субъектов с зависимостью, которые сохраняются в течение месяцев после длительной детоксикации [rev. (Volkow et al. 2009a)]. Точно так же доклинические исследования на грызунах и нечеловеческих приматах показали, что повторное воздействие лекарств связано со снижением уровней D2R в полосатом теле (Nader et al. 2006; Танос и соавт. 2007; Волков и соавт. 2001). В стриатуме D2R опосредуют передачу сигналов в стриатальном непрямом пути, который модулирует префронтальные области; и было показано, что его подавление усиливает сенсибилизацию к воздействию лекарств на животных моделях (Ferguson et al. 2011). У людей, употребляющих наркотики, снижение D2R в полосатом теле связано со снижением активности префронтальных областей, о чем свидетельствует снижение базового метаболизма глюкозы (маркера функции мозга) в OFC, передней поясной извилине (ACC) и дорсолатеральной префронтальной коре (DLPFC). ) (Volkow et al. 2001, 1993, 2007) (Инжир. 6). Поскольку OFC, ACC и DLPFC участвуют в атрибуции значимости, сдерживающем контроле / регулировании эмоций и принятии решений, соответственно, постулируется, что их неправильная регуляция с помощью D2R-опосредованной передачи сигналов DA у зависимых субъектов может лежать в основе повышенной мотивационной ценности лекарств в их поведении и потери контроля над приемом наркотиков (Волков и Фаулер 2000). Кроме того, поскольку нарушения OFC и ACC связаны с компульсивным поведением и импульсивностью (Fineberg et al. 2009), Нарушенная DA модуляция этих регионов, вероятно, будет способствовать компульсивному и импульсивному потреблению наркотиков, наблюдаемому при наркомании (Гольдштейн и Волков 2002). Действительно, у лиц, злоупотребляющих метамфетамином, низкий уровень стриатального D2R был связан с импульсивностью (Lee et al. 2009), и это также предсказывало компульсивное введение кокаина у грызунов (Everitt et al. 2008). Возможен и обратный сценарий, при котором первоначальная уязвимость к употреблению наркотиков уже существует в префронтальных регионах и когда повторное употребление наркотиков вызывает дальнейшее снижение стриатального D2R. Действительно, исследование, проведенное на субъектах, которые, несмотря на высокий риск алкоголизма (положительная семейная история алкоголизма), не были алкоголиками, выявило более высокую, чем нормальную, доступность стриального D2R, что было связано с нормальным метаболизмом при ОФК, АКС и DLPFC (Волков). и другие. 2006a). Это говорит о том, что у этих субъектов, подверженных риску алкоголизма, нормальная префронтальная функция была связана с усилением передачи сигналов D2R в полосатом теле, что, в свою очередь, могло защитить их от злоупотребления алкоголем.
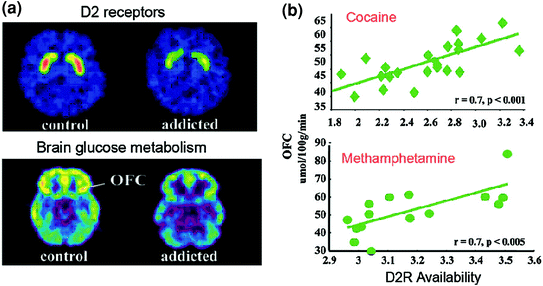
Рис 6 Корреляции между доступностью D2R в полосатом теле и метаболизмом в префронтальных областях мозга. Аксиальные изображения мозга для контроля и для субъекта с кокаиновой зависимостью для базовых изображений наличия D2R в стриатуме (получено с помощью [11C] raclopride) и метаболизм глюкозы в мозге в OFC (получен с [18ФДГ). b Корреляции между полосатым D2R и метаболизмом в OFC у субъектов с кокаиновой зависимостью и метамфетамином. Перепечатано из Volkow et al. (2009a) Авторское право (2009), с разрешения Elsevier
Как и ожидалось, доказательства нарушения регуляции в цепях контроля также были обнаружены среди людей с ожирением. Как доклинические, так и клинические исследования предоставили доказательства снижения передачи сигналов D2R в стриату, что, как упоминалось выше, связано с вознаграждением (NAc), но также с установлением привычек и процедур (дорсального полосатого тела) при ожирении.у (Гейгер и др. 2009; Wang et al. 2001). Важно отметить, что снижение доступности D2R в полосатом теле было связано с компульсивным потреблением пищи у тучных грызунов (Джонсон и Кенни 2010) и со сниженной метаболической активностью в OFC и ACC у людей с ожирением (Volkow et al. 2008b) (Инжир. 7а-с). Учитывая, что дисфункция в OFC и ACC приводит к обязательности [см. Обзор (Fineberg et al. 2009)], это может быть частью механизма, с помощью которого передача сигналов D2R в низком стриате облегчает гиперфагию (Davis et al. 2009). Кроме того, поскольку снижение передачи сигналов, связанных с D2R, также может снизить чувствительность к другим естественным преимуществам, этот дефицит у людей с ожирением может также способствовать компенсаторному перееданию (Geiger et al. 2008).
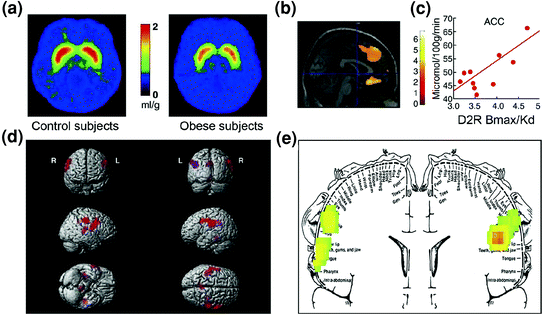
Рис 7 Гиперфагия может быть вызвана стремлением компенсировать ослабленный контур вознаграждения (обработанный кортикостриатальными контурами, регулируемыми допамином) в сочетании с повышенной чувствительностью к вкусовым качествам (гедонические свойства пищи, частично обработанной через соматосенсорную кору). a Усредненные изображения доступности рецептора DA D2 (D2R) в контроле (n = 10) и у субъектов с патологическим ожирением (n = 10). b Результаты (статистическое параметрическое картирование) SPM, идентифицирующие области в головном мозге, где D2R был связан с метаболизмом глюкозы, они включали медиальный OFC, ACC и дорсолатеральный PFC (область не показана). c Наклон регрессии между D2R полосатого тела и метаболической активностью в ACC у субъектов с ожирением. d Трехмерные изображения SPM, показывающие области с более высоким метаболизмом у людей с ожирением, чем у худощавых (P <0.003, без коррекции). e Результаты SPM с цветовой кодировкой отображаются в корональной плоскости с наложенной диаграммой соматосенсорного гомункула. Результаты (значение z) представлены с использованием шкалы радуги, где красный> желтый> зеленый. По сравнению с худыми субъектами, у тучных субъектов был более высокий исходный метаболизм в соматосенсорных областях, где представлены рот, губы и язык и которые участвуют в обработке вкусовых качеств пищи. Изменено с разрешения Volkow et al. (2008a) (a – c) и Wang et al. (2002) (д, д)
Эта гипотеза согласуется с доклиническими данными, показывающими, что снижение активности DA в VTA приводит к резкому увеличению потребления продуктов с высоким содержанием жира (Stoeckel et al. 2008). Аналогично, по сравнению с людьми с нормальной массой тела, у людей с ожирением, которым были представлены фотографии высококалорийной пищи (стимулы, на которые они обусловлены), отмечалась повышенная нервная активация в областях, которые являются частью цепей вознаграждения и мотивации (NAc, дорсальный стриатум, OFC , ACC, миндалина, гиппокамп и инсула) (Киллгор и Юргелун-Тодд 2005). Напротив, в контроле с нормальным весом активация ACC и OFC (областей, участвующих в атрибуции значимости, которые проецируются в NAc) во время представления высококалорийной пищи, оказалась отрицательно коррелированной с их индексом массы тела (ИМТ) ( Stice и соавт. 2008b). Это говорит о динамическом взаимодействии между количеством съеденной пищи (частично отражается в ИМТ) и реакционной способностью областей поощрения к высококалорийной пище (отражается в активации OFC и ACC) у людей с нормальным весом, которая теряется в ожирение.
Удивительно, но у людей с ожирением наблюдалась меньшая активация цепей вознаграждения от фактического потребления пищи (называемая совокупным вознаграждением за пищу), чем у худых, в то время как они демонстрировали большую активацию соматосенсорных областей коры, которые обрабатывают вкус, когда они ожидали потребления (Stice et al. 2008b). Последнее наблюдение соответствовало регионам, в которых предыдущее исследование выявило повышенную активность у испытуемых с ожирением на исходном уровне (без стимуляции) (Wang et al. 2002) (Инжир. 7д, д). Повышенная активность областей, которые обрабатывают вкусовые качества, может заставить субъектов, страдающих ожирением, отдавать предпочтение пище по сравнению с другими природными усилителями, тогда как снижение активации дофаминергических мишеней фактическим потреблением пищи может привести к чрезмерному потреблению в качестве средства компенсации слабой передачи сигналов, опосредованной D2R (Stice et al. 2008a). Эта пониженная реакция схемы вознаграждения на потребление пищи у субъектов с ожирением напоминает снижение уровня DA, вызванного употреблением наркотиков у зависимых лиц по сравнению с субъектами без зависимости.
Префронтальная кора (ПФК) играет решающую роль в исполнительной функции, включая тормозной контроль (Миллер и Коэн 2001). Эти процессы модулируются D1R и D2R (предположительно также D4R), и, таким образом, снижение активности PFC, как при наркомании, так и при ожирении, может способствовать плохому контролю и высокой принудительности. Доступность D2R ниже нормального уровня в стриатуме людей с ожирением, что было связано со снижением активности PFC и ACC (Volkow et al. 2008b) поэтому может способствовать их недостаточному контролю за потреблением пищи. В самом деле, отрицательная корреляция между ИМТ и полосатым D2R отмечена у тучных (Wang et al. 2001) и в избыточном весе (Haltia et al. 2007a) люди поддерживают это. Лучшее понимание механизмов, которые приводят к нарушению функции ПФУ при ожирении (или зависимости), может способствовать разработке стратегий, направленных на улучшение или, возможно, даже на обратный характер, конкретных нарушений в важных когнитивных областях. Например, задержка дисконтирования, которая представляет собой тенденцию обесценивать вознаграждение как функцию временной задержки его доставки, является одной из наиболее широко исследованных когнитивных операций в отношении расстройств, связанных с импульсивностью и принудительностью. Дисконтирование задержек наиболее полно исследовалось у наркоманов, которые демонстрируют преувеличенное предпочтение небольших, но немедленных, а не крупных, но задержанных наград (Bickel et al. 2007). Тем не менее, несколько исследований, проведенных с людьми, страдающими ожирением, также обнаружили доказательства предпочтения высоких, немедленных вознаграждений, несмотря на повышенный шанс понести более высокие будущие потери (Brogan et al. 2010; Weller et al. 2008). А совсем недавно другое исследование обнаружило положительную корреляцию между ИМТ и гиперболическим дисконтированием, согласно которому будущие отрицательные выплаты дисконтируются меньше, чем будущие положительные выплаты (Ikeda et al. 2010). Интересно, что задержка дисконтирования, по-видимому, зависит от функции вентрального полосатого тела (Gregorios-Pippas et al. 2009) и PFC, включая боковой OFC (Bjork et al. 2009) и чувствителен к манипуляциям с DA (Pine et al. 2010). В частности, усиление передачи сигналов DA (с обработкой L DOPA) увеличило импульсивность и временное дисконтирование.
5 Участие мотивационных цепей
Дофаминергическая передача сигналов также модулирует мотивацию. Поведенческие качества, такие как энергичность, настойчивость и постоянные усилия по достижению цели, все подвержены модуляции DA, действующей через несколько целевых регионов, включая NAc, ACC, OFC, DLPFC, миндалины, дорсальный стриатум и вентральный паллидум (Salamone et al. 2007). Нарушение регуляции передачи сигналов DA связано с повышенной мотивацией к приобретению наркотиков, что является отличительной чертой зависимости, поэтому наркозависимые люди часто ведут себя экстремально, чтобы получить наркотики, даже если они влекут за собой известные серьезные и неблагоприятные последствия (Volkow and Li 2005). Потому что употребление наркотиков становится основной мотивационной причиной наркомании (Volkow et al. 2003), зависимые субъекты возбуждаются и мотивируются процессом получения лекарственного средства, но имеют тенденцию становиться замкнутыми и апатичными, когда подвергаются действиям, не связанным с наркотиками. Этот сдвиг был изучен путем сравнения моделей активации мозга, возникающих при воздействии условных сигналов, с теми, которые возникают в отсутствие таких сигналов. В отличие от снижения префронтальной активности, о котором сообщается у лиц, злоупотребляющих детоксифицированным кокаином, когда их не стимулируют наркотиками или лекарствами [см. Обзор (Volkow et al. 2009a)], эти префронтальные области становятся активированными, когда лица, злоупотребляющие кокаином, подвергаются воздействию стимулирующих тягу стимулов (лекарств или сигналов) (Grant et al. 1996; Волков и соавт. 1999a; Wang et al. 1999). Этот результат напоминает наблюдение о том, что лица, злоупотребляющие кокаином, изученные вскоре после эпизода переедания кокаина, продемонстрировали увеличение метаболической активности в ОФК и АКК (также в дорсальном стриатуме), что было связано с жаждой (Volkow et al. 1991).
Кроме того, когда ответы на в / в МР сравнивают между кокаиновыми и не зависимыми людьми, первые реагируют с повышенным метаболизмом в вентральной АКК и медиальной ОФК (эффект, связанный с жаждой), в то время как последние демонстрируют противоположный ответ, а именно уменьшаются метаболизм в этих регионах (Volkow et al. 2005). Это говорит о том, что активация этих префронтальных областей при воздействии лекарственного средства может быть специфической для зависимости и связана с повышенным желанием получить лекарство. Кроме того, исследование, которое побудило субъектов с кокаиновой зависимостью целенаправленно подавлять тягу при воздействии на них сигналов лекарств, показало, что у тех субъектов, которые были успешны в подавлении тяги, наблюдалось снижение метаболизма в медиальной ОФК (которая обрабатывает мотивационную ценность усилителя) и NAc (которая предсказывает вознаграждение) (Volkow et al. 2009b). Эти данные подтверждают участие OFC, ACC и стриатума в усилении мотивации к приобретению препарата, наблюдаемого при наркомании.
Как и ожидалось, OFC также причастен к тому, чтобы приписывать значимость продуктов питания (Grabenhorst et al. 2008; Роллс и МакКейб 2007), помогая оценить его ожидаемую приятность и вкус как функцию его контекста. Исследования ПЭТ с использованием ФДГ для измерения метаболизма глюкозы в мозге у людей с нормальным весом показали, что воздействие пищевого сигнала увеличивало метаболическую активность при ОФК, что было связано с ощущением голода и стремлением к еде (Wang et al. 2004). Усиленная активация OFC за счет стимуляции пищи, вероятно, отражает последующие дофаминергические эффекты и участвует в вовлечении DA в процесс потребления пищи. OFC играет роль в обучении ассоциациям стимуляции и стимулирования (Cox et al. 2005; Галлахер и соавт. 1999), поддерживает условно-контрольное кормление (Weingarten) 1983) и, вероятно, способствует перееданию независимо от сигналов голода (Огден и Уордл 1990). Действительно, дисфункция OFC была связана с перееданием (Мачадо и Бачевалье 2007).
Несмотря на некоторые несоответствия между исследованиями, данные визуализации головного мозга также подтверждают мнение о том, что структурные и функциональные изменения в областях мозга, вовлеченных в исполнительную функцию (включая сдерживающий контроль), могут быть связаны с высоким ИМТ у здоровых людей. Например, исследование МРТ, проведенное на пожилых женщинах с использованием морфометрии на основе вокселей, выявило отрицательную корреляцию между ИМТ и объемами серого вещества (включая лобные области), что в OFC было связано с нарушением исполнительной функции (Walther et al. 2010). Используя ПЭТ для измерения метаболизма глюкозы в мозге у здоровых людей, мы сообщили об отрицательной корреляции между ИМТ и метаболической активностью в DLPFC, OFC и ACC. В этом исследовании метаболическая активность в префронтальных регионах предсказывала эффективность субъектов в тестах исполнительной функции (Volkow et al. 2009c). Сходным образом, спектроскопическое исследование ядерного магнитного резонанса (ЯМР) у здоровых людей среднего возраста и пожилых людей показало, что ИМТ был отрицательно связан с уровнями N-ацетил-аспартата (маркера целостности нейронов) во фронтальной коре и ACC (Gazdzinski et al. 2008; Волков и соавт. 2009c).
Исследования мозга, сравнивающие тучных и худых людей, также сообщают о более низкой плотности серого вещества во фронтальных областях (лобная жаберная и средняя лобная извилина) и в постцентральной извилине и путамене (Pannacciulli et al. 2006). Другое исследование не обнаружило различий в объемах серого вещества между тучными и худыми субъектами, она действительно зафиксировала положительную корреляцию между объемом белого вещества в базальных структурах мозга и соотношением талии и бедра, тенденция, которая была частично обращена диетой (Haltia et al. 2007b). Интересно, что корковые зоны, такие как DPFC и OFC, которые участвуют в ингибирующем контроле, также были обнаружены активированными в успешных диетах в ответ на потребление пищи (DelParigi et al. 2007), предлагая потенциальную цель для поведенческой переподготовки при лечении ожирения (а также при наркомании).
6 Вовлечение интероцептивной схемы
Исследования нейровизуализации показали, что средний островок играет ключевую роль в еде, кокаине и сигаретах. (Bonson et al. 2002; Pelchat et al. 2004; Wang et al. 2007). Важность островка была подчеркнута исследованием, в котором сообщалось, что курильщики с повреждениями в этом регионе (но не курильщики с контрольным повреждением, которые перенесли внесинсулярные поражения) смогли легко бросить курить, не испытывая ни тяги, ни рецидива (Naqvi et al. , 2007). Островок, особенно его более передние области, взаимно связан с несколькими конечностями (например, вентромедиальной префронтальной корой, миндалиной и вентральным полосатым отростком) и, по-видимому, выполняет интероцептивную функцию, объединяя вегетативную и висцеральную информацию с эмоциями и мотивацией, таким образом обеспечивая осознание этих побуждений (Накви и Бечара 2009). Действительно, исследования поражения головного мозга предполагают, что вентромедиальный ПФК и инсула являются необходимыми компонентами распределенных цепей, которые поддерживают принятие эмоциональных решений (Clark et al. 2008). В соответствии с этой гипотезой, исследования изображений последовательно показывают дифференциальную активацию инсула во время тяги (Brody et al. 2009; Goudriaan et al. 2010; Накви и Бечара 2009; Wang et al. 1999). Соответственно, было высказано предположение, что реактивность этой области мозга служит биомаркером, помогающим прогнозировать рецидив (Janes et al. 2010).
Островок также является основной вкусовой зоной, которая участвует во многих аспектах пищевого поведения, таких как вкус. Кроме того, ростральный островок (связанный с первичной корой вкуса) предоставляет информацию для OFC, которая влияет на его мультимодальное представление о приятности или ценности вознаграждения поступающей пищи (Rolls 2008). Из-за участия инсула в интероцептивном смысле тела, в эмоциональном сознании (Крейг 2003) и в мотивации и эмоциях (Rolls 2008), можно ожидать вклад островных нарушений при ожирении. Действительно, растяжение желудка приводит к активации задней инсулы, что, вероятно, отражает ее роль в осознании состояний тела (в данном случае полноты) (Wang et al. 2008). Более того, у худых, но не у лиц с ожирением, растяжение желудка приводило к активации миндалины и дезактивации передней инсулы (Tomasi et al. 2009). Отсутствие реакции миндалины у лиц с ожирением может отражать притупленное интероцептивное осознание телесных состояний, связанных с сытостью (полный желудок). Даже несмотря на то, что модуляция островковой активности DA недостаточно изучена, общепризнано, что DA участвует в реакциях на дегустацию вкусных продуктов, которые опосредуются через островок (Hajnal и Norgren 2005). Исследования с использованием изображений человека показали, что дегустация вкусных продуктов активизировала области инсула и среднего мозга (DelParigi et al. 2005; Фрэнк и др. 2008). Однако передача сигналов DA также может быть необходима для определения содержания калорий в пище. Например, когда женщины с нормальным весом попробовали подсластитель с калориями (сахарозой), активизировались области как инсула, так и допаминергического среднего мозга, тогда как дегустация не содержащего калорий подсластителя (сукралозы) только активировала инсулю (Frank et al. 2008). При дегустации жидкой муки, состоящей из сахара и жира, субъекты с ожирением демонстрируют большую активацию по сравнению с обычными контролями (DelParigi et al. 2005). Напротив, субъекты, которые выздоровели от нервной анорексии, показывают меньшую активацию в инсулине при дегустации сахарозы и не связывают чувство приятности с активацией островка, как это наблюдалось у нормальных контролей (Wagner et al. 2008). В совокупности эти результаты дают основание полагать, что нарушение регуляции островка в ответ на вкусовые стимулы может быть связано с нарушением контроля над различными формами аппетита.
7 Схема отвращения
Как упоминалось ранее, тренировка (обусловливание) сигнала, предсказывающего вознаграждение, приводит к срабатыванию дофаминергических клеток в ответ на предсказание вознаграждения, а не на само вознаграждение. С другой стороны, и в соответствии с этой логикой было замечено, что дофаминергические клетки будут стрелять меньше, чем обычно, если ожидаемое вознаграждение не будет реализовано (Schultz et al. 1997). Совокупные доказательства (Christoph et al. 1986; Lisoprawski et al. 1980; Мацумото и Хикосака 2007; Нишикава и соавт. 1986) указывает на габенулу как на одну из областей, которая контролирует уменьшение обжига дофаминергических клеток в VTA, которое может следовать за неспособностью получить ожидаемое вознаграждение (Kimura et al. 2007). Таким образом, повышенная чувствительность габенулы в результате хронического воздействия лекарств может лежать в основе большей реактивности на сигналы лекарств. В самом деле, активация габенулы у субъектов с кокаиновой зависимостью была связана с поведенческим рецидивом приема наркотиков после воздействия кия (Brown et al. 2011; Чжан и соавт. 2005). В случае никотина никотиновые рецепторы α5 в габенуле, по-видимому, модулируют неприятные реакции на большие дозы никотина (Fowler et al. 2011); и рецепторы α5 и α2 в габенуле участвуют в отмене никотина (Salas et al. 2009). Из-за противоположного ответа habenula на ответ нейронов DA на вознаграждение (деактивацию) и его активацию при воздействии аверсивных стимулов, мы ссылаемся здесь на передачу сигналов habenula как передачу «антиреволюционного» входа.
Похоже, хабенула играет аналогичную роль в отношении награды за еду. Пищевая диета с хорошим вкусом может вызвать ожирение у крыс, при этом увеличение веса коррелирует с увеличением связывания μ-опиоидного пептида в базолатеральной и базомедиальной миндалинах. Интересно, что срединная габенула показала значительно более высокое связывание μ-опиоидного пептида (примерно на 40%) после контакта с приемлемой пищей у крыс, которые набрали вес (тех, кто потреблял больше пищи), но не у тех, кто этого не делал (Smith et al. 2002). Это говорит о том, что габенулы могут быть вовлечены в переедание в условиях наличия приемлемой пищи. Более того, нейроны сегментарного ростромедиального ядра, которые получают основной вклад от латеральной габенулы, проецируются на нейроны VTA DA и активируются после лишения пищи (Jhou et al. 2009). Эти результаты согласуются с ролью габенулы в опосредовании реакций на отвращающие раздражители или состояния, такие как те, которые возникают во время диеты или отмены препарата.
Участие габенулы в качестве антинаградного центра в эмоциональных сетях согласуется с предшествующими теоретическими моделями зависимости, которые постулировали сенсибилизированные антиреферальные реакции (опосредованные через повышенную чувствительность миндалины и повышенную передачу сигналов через фактор высвобождения кортикотропина) в качестве движущей силы приёма лекарств в зависимости (Кооб и Ле Моал 2008). Подобные антиреволюционные реакции могут также способствовать чрезмерному употреблению пищи при ожирении.
8 Вознаграждение за патологические лекарства и продукты питания: обновленная рабочая модель
TДля того, чтобы противостоять желанию употреблять наркотики или есть после достижения точки сытости, требуется правильное функционирование нейронных цепей, участвующих в нисходящем контроле, чтобы противостоять условным реакциям, которые предсказывают вознаграждение от приема пищи / лекарства и желание глотать пищу. продукты питания / наркотики. Здесь мы выделили шесть из этих схем: вознаграждение / значимость, обусловленность / привычки, сдерживающий контроль / исполнительная функция, мотивация / побуждение, перехват и предотвращение отвращения / реактивность на стресс (рис. 8). Основываясь на данных визуализации, представленных здесь, мы постулируем, что это несоответствие между ожидаемым эффектом лекарства / пищи (условные реакции) и притупленным нейрофизиологическим эффектом, которое поддерживает прием лекарств или чрезмерное потребление пищи в попытке достичь ожидаемая награда. Кроме того, независимо от того, были ли они протестированы в ранние или длительные периоды воздержания / диеты, субъекты с наркозависимостью / ожирением демонстрируют более низкий уровень D2R в стриатуме (включая NAc), что связано со снижением базовой активности в лобных областях мозга, что связано с атрибуцией выраженности (орбитофронтальной коры) и ингибированием контроль (ACC и DLPFC), нарушение которого приводит к обязательности и импульсивности. Fнаконец, появляются данные о роли интероцептивных и отвращающих схем в системных дисбалансах, которые приводят к навязчивому потреблению либо лекарств, либо продуктов питания.
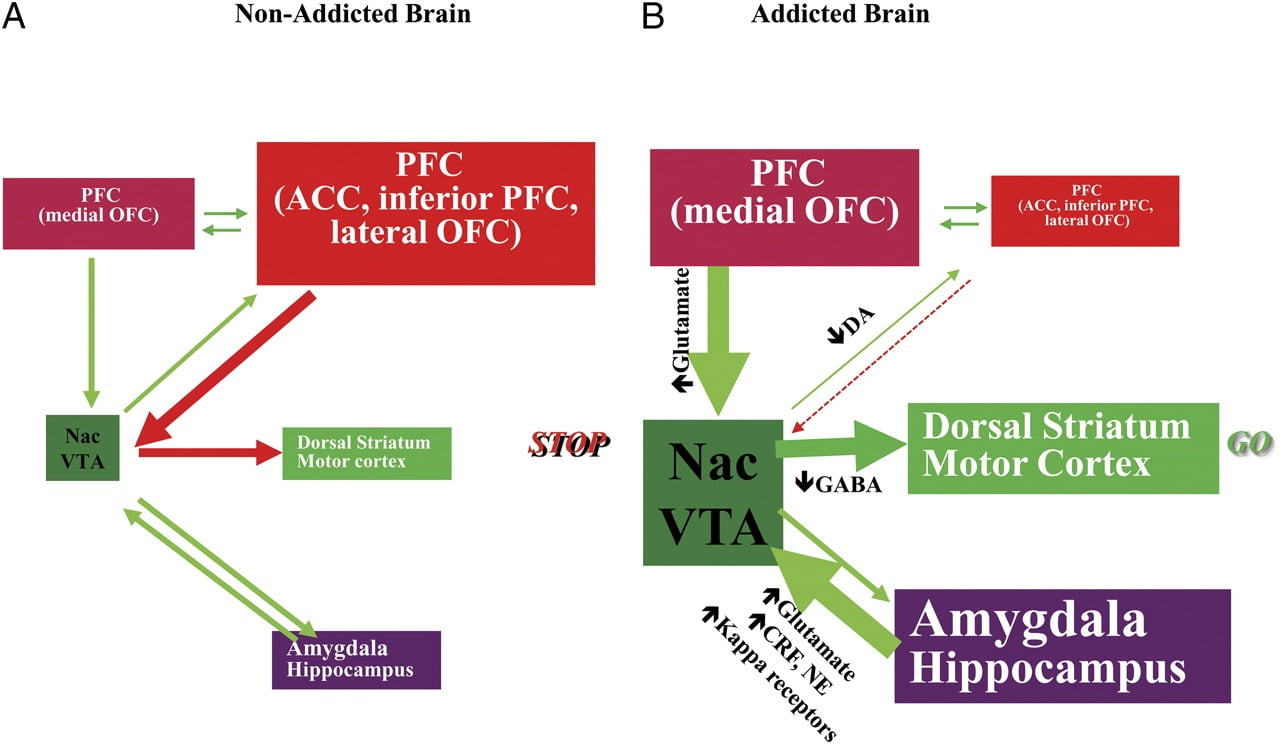
Рис 8 Модель, предлагающая сеть взаимодействующих цепей, сбоев, которые способствуют сложному набору стереотипного поведения, лежащего в основе наркомании и хронического переедания: вознаграждение (прилежащее ядро, VTA и вентральный паллидум), кондиционирование / память (миндалина, медиальный OFC для определения значимости, гиппокампа и дорсального полосатого тела для привычек), исполнительный контроль (DLPFC, ACC, нижняя лобная кора и боковой OFC), мотивация / драйв (медиальная ОФК для атрибуции значимости, вентральной АКК, ВТА, СН, дорсального полосатого тела и моторной коры). Nac, прилежащее ядро, интероцепция (Insula и ACC) и отвращение / избегание (Habenula). a Когда эти цепи сбалансированы, это приводит к надлежащему сдерживающему контролю и принятию решений. b Во время зависимости, когда повышенная ожидаемая ценность лекарства в цепях вознаграждения, мотивации и памяти преодолевает цепь управления, благоприятствуя петле положительной обратной связи, инициируемой потреблением лекарства и увековечиваемой усиленной активацией мотивации / влечения и схемы памяти. Эти контуры также взаимодействуют с контурами, участвующими в регуляции настроения, включая стрессовую реактивность (которая включает миндалины, гипоталамус, габенулу) и интероцепцию (которая включает инсула и ACC и способствует осознанию жажды). Некоторые нейротрансмиттеры вовлечены в эти нейроадаптации, включая глутамат, ГАМК, норэпинефрин, кортикотропин-рилизинг-фактор и опиоидные рецепторы. CRF, кортикотропин-рилизинг-фактор; NE, норэпинефрин. Модифицировано с разрешения Volkow et al. (2011b)
Как следствие последовательного нарушения в этих цепях, люди могут испытывать 1) повышенную мотивационную ценность лекарства / пищи (вторично по отношению к изученным ассоциациям через обусловливание и привычки) за счет других подкрепляющих факторов (вторично по отношению к уменьшенной чувствительности схемы вознаграждения). ), 2) нарушение способности подавлять преднамеренные (целенаправленные) действия, вызванные сильным желанием принимать лекарство / пищу (вторично по отношению к нарушенной исполнительной функции), которые приводят к компульсивному приему лекарства / пищи, и 3) повышенную стрессовую реактивность и отвращение избегания, которое приводит к импульсивному приему лекарств для выхода из состояния отвращения.
Эта модель предлагает многоплановый терапевтический подход к зависимости, предназначенный для уменьшения усиливающих свойств лекарственного средства / пищи, восстановления / улучшения полезных свойств природных усилителей, подавления обусловленных усвоенных ассоциаций, усиления мотивации для деятельности, не связанной с лекарством / пищей, уменьшения стрессовой реактивности улучшают настроение и усиливают подавляющий контроль общего назначения.
Благодарности
Авторы хотели бы поблагодарить поддержку очной программы NIAAA Национального института здоровья.
Рекомендации