КОММЕНТАРИИ: обзор ведущего исследователя ожирения и пищевой зависимости.
Том 69, выпуск 4, 24 Февраль 2011, страницы 664-679
http://dx.doi.org/10.1016/j.neuron.2011.02.016,
Обзор
Paul J. Kenny1, ,
Лаборатория поведенческой и молекулярной нейронауки 1, кафедра молекулярной терапии, Научно-исследовательский институт Скриппса, Юпитер, FL 33458, США
________________________________________
Пища потребляется для поддержания баланса энергии на гомеостатических уровнях. Кроме того, вкусная пища также потребляется для гедонистических свойств, не зависящих от энергетического статуса. Такое потребление, связанное с вознаграждением, может привести к превышению потребностей в потреблении калорий и считается основным виновником стремительно растущих показателей ожирения в развитых странах. По сравнению с гомеостатическими механизмами питания, гораздо меньше известно о том, как гедонистические системы в мозге влияют на потребление пищи. Интригующе, чрезмерное потребление вкусной пищи может вызвать нейроадаптивные реакции в схемах вознаграждения мозга, похожие на наркотики злоупотребления. Кроме того, сходная генетическая уязвимость в системах вознаграждения мозга может увеличить предрасположенность к наркомании и ожирению. Здесь будут рассмотрены последние достижения в нашем понимании схем мозга, которые регулируют гедонистические аспекты поведения кормления. Также будут рассмотрены новые данные, свидетельствующие о том, что ожирение и наркомания могут распространяться на общие гедонистические механизмы.
________________________________________
Основной текст
«Нет никакой искренней любви, кроме любви к еде».
Джордж Бернард Шоу
Введение
Ожирение, определяемое как индекс массы тела (ИМТ)> 30, представляет собой состояние, при котором ожирение является аномально высоким и может быть результатом гиперфагии или снижения скорости метаболизма (O'Rahilly, 2009). Чрезмерное ожирение является основным фактором риска сердечно-сосудистых заболеваний, рака, диабета 2 типа и расстройств настроения, при этом люди с ожирением часто подвергаются социальной стигматизации ([Bean et al., 2008], [Центры по контролю и профилактике заболеваний, 2009] и [Luppino et al., 2010]). По данным Центра по контролю за заболеваниями (CDC), расходы на здравоохранение, связанные с ожирением, в США с 1998 по 2000 год составили около 213 миллиардов долларов. Кроме того, 300,000 1999 смертей в Соединенных Штатах каждый год можно отнести к заболеваниям, связанным с избыточным весом и ожирением (Allison et al., 30), причем ожирение является второй ведущей причиной предотвратимой смерти после употребления табака. Тем не менее распространенность ожирения в западных обществах продолжает резко расти, и по текущим оценкам более 2010% взрослого населения США страдают ожирением (Flegal et al., XNUMX).
Большинство концептуализации регулирования питания предлагают, чтобы две параллельные системы взаимодействовали, чтобы влиять на потребление пищи ([Hommel et al., 2006], [Lutter and Nestler, 2009] и [Morton et al., 2006]). Гомеостатическая система включает гормональные регуляторы уровней голода, сытости и ожирения, такие как лептин, грелин и инсулин, которые действуют на цепи гипоталамуса и мозгового ствола, чтобы стимулировать или ингибировать питание, чтобы поддерживать соответствующие уровни энергетического баланса. Дисфункция в компонентах гомеостатической системы, такая как врожденная недостаточность лептина, может привести к устойчивому состоянию положительного энергетического баланса и развитию ожирения ([Campfield et al., 1995], [Halaas et al., 1995] и [Pelleymounter et al., 1995]). Механизмы, с помощью которых гормональные регуляторы голода и сытости действуют на схемы гипоталамуса и мозгового ствола для поддержания энергетического гомеостаза, подробно описаны в другом месте, а читатели, интересующиеся этой темой, относятся ко многим замечательным обзорам по этому вопросу (например, [Абизайд et al., 2006a] и [Gao and Horvath, 2007]).
Помимо метаболических систем, системы вознаграждения мозга также играют важную роль в пищевом поведении ([Lutter and Nestler, 2009] и [Saper et al., 2002]). Как правило, продукты со слабым вкусом не едят в избытке, тогда как вкусные продукты часто употребляют даже после удовлетворения энергетических потребностей. Легкость доступа к аппетитной высококалорийной пище считается основным экологическим фактором риска ожирения (Volkow and Wise, 2005), а чрезмерное потребление вкусной еды считается основным фактором, способствующим недавнему всплеску ожирения ([Finkelstein et al., 2005], [Hill et al., 2003] и [Swinburn et al., 2009]). Действительно, получение приятного эффекта от вкусной еды является мощной мотивирующей силой, которая у некоторых людей может подавлять гомеостатические сигналы ([Shomaker et al., 2010], [Sunday et al., 1983] и [Zheng et al., 2009]) . Когда у крыс есть выбор, они в подавляющем большинстве предпочитают потреблять бескалорийный раствор сахарина, а не самостоятельно вводить внутривенные инфузии кокаина (Lenoir et al., 2007). Более того, сытые крысы добровольно подвергаются воздействию сильного холода (-15 ° C), сильной тепловой боли или отвращения к ударам ногами, чтобы получить вкусные продукты, такие как песочное печенье, мясной паштет, арахисовое масло, кока-кола, конфеты M&M, шоколад. чипсы или йогуртовые капли, даже когда менее вкусная стандартная еда доступна бесплатно ([Cabanac and Johnson, 1983], [Foo and Mason, 2005] и [Oswald et al., 2010]). Эти результаты подчеркивают, насколько сильно макронутриенты в вкусной пище могут стимулировать системы вознаграждения мозга независимо от их калорийности ([Wang et al., 2004a] и [Wang et al., 2004b]) и насколько высокой может быть мотивация потреблять вкусную пищу. даже при отсутствии потребности в гомеостатической энергии. Наркотики, вызывающие злоупотребление, такие как кокаин или никотин, аналогичным образом могут вызывать высокий уровень потребительского поведения, даже если они лишены калорийной или питательной ценности. Фактически, из-за большого сходства между перееданием при ожирении и чрезмерным употреблением наркотиков при наркомании (Volkow and Wise, 2005) утверждалось, что ожирение следует рассматривать как заболевание мозга и включать в качестве диагностической категории в предстоящее пятое издание. Руководства по диагностике и статистике психических расстройств (DSM-V) ([Devlin, 2007] и [Volkow and O'Brien, 2007]). По сравнению с гомеостатическими механизмами пищевого поведения гораздо меньше известно о том, как именно гедонистические системы влияют на потребление пищи. Точно так же остается неясным влияние внутренних или вызванных диетой изменений на реакцию систем вознаграждения мозга и то, как эти эффекты способствуют перееданию и ожирению. Ниже резюмируются недавние данные, свидетельствующие о достижениях в нашем понимании гедонистических механизмов питания и вызванных диетой изменений стимулирующей активности мозга, которые могут способствовать развитию ожирения.
Активация систем вознаграждения мозга в ответ на полезную пищу: взаимодействие с гормональными регуляторами энергетического баланса
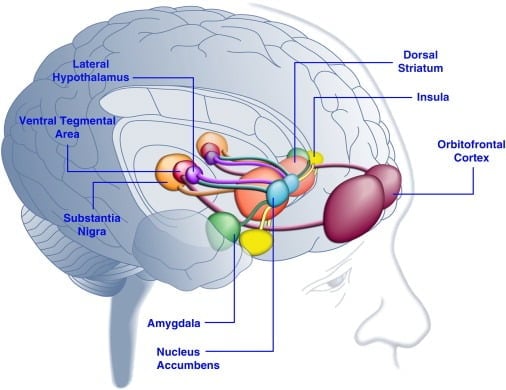
Потребление вкусной пищи может улучшить настроение у людей ([Dallman et al., 2003] и [Macht and Mueller, 2007]) и поддерживать установление предпочтения условных мест у лабораторных животных ([Imaizumi et al., 2001] и [ Sclafani et al., 1998]). Эти эффекты, вероятно, связаны с стимуляцией систем вознаграждения мозга полезной пищей (рисунок 1). Действительно, исследования в области визуализации человеческого мозга показали, что визуальные или обонятельные сигналы пищи, связанные с пищевыми продуктами и продуктами питания, могут активировать схемы мозга кортиколимбика и мезоприемника, вовлеченные в награду, в первую очередь области ортофронтальной коры (OFC), insula, миндалины, гипоталамуса, полосатого и среднего мозга в том числе вентральную тегментальную область (VTA) и основную нигру (SN) ([Bragulat et al., 2010], [Pelchat et al., 2004], [Schur et al., 2009] и [Simmons et al., 2005] ). Стройатум, изолят, передняя корунтовая кора и структуры среднего мозга кодируют субъективную ценность вознаграждений независимо от их типа (например, питание, пол, денежные вознаграждения), что согласуется с ролью этой нейронной сети в общем гедоническом представлении (Sescousse et al. , 2010). Напротив, OFC играет особенно заметную роль в представлениях, связанных со значением конкретных типов вознаграждений, включая вкусную пищу ([Man et al., 2009], [Rolls, 2008] и [Sescousse et al., 2010] ). Голод может усилить благоприятную пищевую активацию областей кортиколимбика и среднего мозга у людей (LaBar et al., 2001). Например, интенсивность активации вентрального стриатума, миндалины, инсулы и ОФК в ответ на высококалорийную вкусную пищу была намного выше, когда у людей были голодные, а не сытые (Голдстоун и др., 2009). Это согласуется с тем фактом, что периоды голода и диеты увеличивают самооцененные рейтинги «власти» вкусной пищи и стремление к «соблазнительной» пище ([Hofmann et al., 2010] и [Rolls et al., 1983] ). И наоборот, перекармливание может уменьшить реакцию нейронов на вкусную пищу, особенно в островной коре и гипоталамусе (Cornier et al., 2009). Следовательно, на гедоническую ценность пищи влияет метаболическое состояние, предполагая, что регуляторы метаболизма, такие как лептин и грелин, могут влиять на активность гедонических систем в головном мозге. В соответствии с этим представлением у людей, лечившихся лептином или пептидом постпрандиального фактора YY3-36 (PYY), полученным из кишечника, ([Batterham et al., 2007] и [Farooqi et al., 2007]) или теми, которые подверглись желудочному вздутию имитируя прием пищи (Wang et al., 2008), уменьшила активность в областях мозга, связанных с наградами. Напротив, пациенты с гиперфагией с врожденным дефицитом лептина демонстрируют повышенную активность в островковой коре и полосатом теле в ответ на образы пищи (Baicy et al., 2007) и [Farooqi et al., 2007]). У этих людей лептин-заместительная терапия ослабляла усиленную островную и полосатую активность и уменьшала самооценку вкуса пищи ([Baicy et al., 2007] и [Farooqi et al., 2007]). Лептин также блокирует полезные свойства сахарозы у крыс, ограниченных в пище, подобных антагонисту рецептора допамина α-флупентиксола (Figlewicz et al., 2001). Более того, рецепторы лептина экспрессируются на дофаминовых нейронах среднего мозга в VTA и SN (Figlewicz et al., 2003), что указывает на то, что лептин может влиять на гедонистические аспекты поведения кормления посредством модуляции передачи мезостриальной допамина. Подтверждая эту возможность, вливания лептина в VTA ингибировали активность нейронов допамина и уменьшали потребление пищи у крыс (Hommel et al., 2006, см. Также Krügel et al., 2003). Напротив, нокдаун лептин-рецепторов в VTA увеличивал потребление пищи, улучшал двигательную активность и увеличивал предпочтение вкусной пищи у крыс (Hommel et al., 2006). Лептин, таким образом, оказывает ингибирующее влияние на передачу дофамина мезоаквбенса, систему нейротрансмиттеров, которая была сильно вовлечена в вознаграждение и мотивацию, но в меньшей степени - в энергетический гомеостаз ([A Araujo et al., 2010] и [Vucetic and Reyes, 2010]). Позднее было показано, что гормон-грелин, связанный с голодом ([Kojima et al., 1999] и [Nakazato et al., 2001]), усиливает активацию гедонистических систем в головном мозге в ответ на пищевые сигналы (Malik et al. , 2008). В частности, грелин улучшал активацию OFC, амигдала, insula, striatum, VTA и SN в ответ на снимки очень вкусной пищи у людей с ожирением (Malik et al., 2008). У крыс ghrelin оказывает стимулирующее действие на дофаминовые системы среднего мозга ([Abizaid et al., 2006b], [Jerlhag et al., 2006] и [Jerlhag et al., 2007]) и увеличивает полезную ценность вкусной пищи (Perello et al., 2010).
Рисунок 1. Области человеческого мозга, активируемые в ответ на вкусную пищу или пищевые сигналы. Считается, что орбитофронтальная кора и миндалина кодируют информацию, связанную с вознаграждением за пищу ([Baxter and Murray, 2002], [Holland and Gallagher, 2004], [Kringelbach et al., 2003], [O'Doherty et al. , 2002] и [Rolls, 2010]). Insula обрабатывает информацию, относящуюся к вкусу пищи и ее гедонистической оценке ([Balleine and Dickinson, 2000] и [Small, 2010]). Прилежащее ядро и дорсальное полосатое тело, которые получают дофаминергический вход из вентральной области покрышки и черной субстанции, регулируют мотивационные и стимулирующие свойства пищи ([Baicy et al., 2007], [Berridge, 1996], [Berridge, 2009], [Farooqi et al., 2007], [Malik et al., 2008] и [Söderpalm and Berridge, 2000]). Латеральный гипоталамус может регулировать положительные реакции на вкусную пищу и управлять поведением, связанным с поиском пищи (Kelley et al., 1996). Эти мозговые структуры действуют согласованным образом, регулируя изучение гедонистических свойств пищи, смещая внимание и усилия к получению пищевых вознаграждений и регулируя стимулирующую ценность внешних стимулов, которые предсказывают наличие пищевых вознаграждений (Dagher, 2009). Для ясности показаны не все взаимосвязи между этими структурами.
Подобные области мозга активируются вкусной пищей в мозге крысы как активированные у людей, как измерено экспрессией немедленных ранних генов (IEG), таких как c-fos, arc или zif268. Действительно, вкусная пища активирует дорсальный и вентральный стриатум, VTA, латеральный гипоталамус (LH) и центральные и базолатеральные ядра миндалины и связанные с наградами корковые структуры у крыс ([Angeles-Castellanos et al., 2007], [Park and Carr, 1998] и [Schiltz et al., 2007]). Интересно отметить, что иммунореактивность Fos фактически снижалась в латеральной и медиальной хабенуле у крыс после приемлемого потребления пищи (LHb) (Park and Carr, 1998). У нечеловеческих приматов LHb активируется отвратительными стимулами или отсутствием ожидаемых вознаграждений и препятствует доставке награды за вкусный сок (Matsumoto and Hikosaka, 2007). Кроме того, активность LHb ингибирует связанные с лекарством мезоакббсы, содержащие дофамин, с помощью непрямого пути, включающего ростромедиальное тегментарное ядро (RMTg) (Jhou et al., 2009). Поэтому деятельность Хабенулара обратно связана с пищевой гедоникой, предполагая, что сакенуральный комплекс может влиять на негомеостатическое питание. Действительно, недавно было показано, что активация LHb снижает потребление сахарозы у крыс, тогда как поражения LHb усиливают поведение поиска сахарозы (Friedman et al., 2011). Принимая во внимание, что хаменеловый комплекс является небольшим и сложным для идентификации и функционального образа у людей (Salas et al., 2010), это может объяснить, почему изменения в активности habenular не сообщаются в исследованиях изображений человека в ответ на вкусную пищу.
Мозговые сети, которые регулируют питание гедониста: системы дофамина среднего мозга
Дофаминовый путь мезоаккумбенса активируется у людей и лабораторных животных в ответ на прием пищи или сигналы, связанные с аппетитом, а лептин, грелин и другие регуляторы аппетита влияют на активность этой системы. Это говорит о том, что дофаминовые системы среднего мозга играют важную роль в потреблении вкусной пищи. Возможно, самым четким признаком того, что передача дофамина в среднем мозге влияет на потребление вкусной пищи у людей, является тот факт, что пациенты с болезнью Паркинсона (БП), у которых наблюдается дегенерация дофаминсодержащих нейронов среднего мозга, как правило, потребляют меньше пищи, чем здоровые люди (Nirenberg и Waters, 2006). Более того, лечение пациентов с БП агонистами дофаминовых рецепторов может вызвать компульсивное потребление вкусной еды ([Dagher and Robbins, 2009] и [Nirenberg and Waters, 2006]). Фактически, агонисты дофаминовых рецепторов могут вызывать гедонистическое переедание даже у лиц без БП (Cornelius et al., 2010). У животных приятные на вкус растворы сахарозы стимулируют передачу дофамина в NAc (Hernandez and Hoebel, 1988), эффект согласуется с исследованиями изображений человеческого мозга (Small et al., 2003). Используя циклическую вольтамперометрию с быстрым сканированием, было показано, что сигналы, предсказывающие доставку сахарозы или неожиданную доставку сахарозы, вызывают передачу дофамина в NAc ([Roitman et al., 2004] и [Roitman et al., 2008]). Кроме того, неожиданная доставка ядовитых растворов хинина имела противоположный эффект, уменьшая передачу дофамина в прилежащей области (Roitman et al., 2008). Наконец, мыши, у которых был инактивирован фермент тирозингидроксилаза (TH), что привело к дефициту дофамина, по-прежнему демонстрируют заметное предпочтение растворам сахарозы (или сахарина) по сравнению с водой, но потребляют меньше общего количества сахарозы, чем контрольные мыши ( Кэннон и Пальмитер, 2003 г.). Это говорит о том, что мыши с дефицитом дофамина все еще могут определять вкусовые качества сахарозы и предпочитают эти растворы воде, но не могут поддерживать потребление вкусных растворов. Поэтому было высказано предположение, что передача дофамина мезоаккумбенсом регулирует мотивационные аспекты пищевого поведения, которые участвуют в добыче пищи, и что другие системы нейротрансмиттеров, вероятно, регулируют гедонистические аспекты потребления вкусной пищи.
Мозговые сети, которые регулируют питание гедонистов: системы стриатогитофалома
Инфузия агонистов μ-опиоидных рецепторов, таких как [D-Ala2-N-Me-Phe4-gly-ol5] -энкефалин (DAMGO) в NAc, стимулирует поведение кормления у крыс с доступом к свободному доступу к пище (то есть к внедоматозному питанию) ( [Peciña и Berridge, 2005] и [Zhang et al., 1998]). И наоборот, антагонисты опиоидных рецепторов, введенные в NAc, уменьшают потребление предпочтительной пищи, не влияя на потребление менее приемлемых альтернатив (Kelley et al., 1996). Эти данные согласуются с мнением о том, что полосатые опиоидные системы регулируют гедонические свойства приемлемой пищи. Особенно важная роль в нетемостатическом кормлении играет область оболочки NAc и, в частности, гедонистические «горячие точки» в ростродорсальной области медиальной оболочки ([Peciña and Berridge, 2005] и [Peciña et al., 2006b]). Поскольку активация μ-опиоидного рецептора приводит к ингибированию активности средней колючей нейроны в NAc, было предложено, чтобы оболочка NAc оказывала тонизирующее ингибирующее влияние на вкусовое потребление пищи (Kelley et al., 2005). В соответствии с этой точкой зрения, стимуляция ингибирующих ГАБАА или ГАБАВ-рецепторов ([Basso and Kelley, 1999] и [Stratford and Kelley, 1997]) или блокада возбуждающих ионотропных глутаматных рецепторов (Maldonado-Irizarry et al., 1995) в оболочке NAc увеличивает потребление пищи. Аналогичным образом, экситотоксическое поражение оболочки NAc также увеличивает потребление пищи и повышает чувствительность к пищевому вознаграждению ([Johnson et al., 1996] и [Maldonado-Irizarry and Kelley, 1995]). В частности, потребление энергии-плотной вкусной пищи предпочтительно инициируется этими манипуляциями ([Basso and Kelley, 1999], [Kelley et al., 2005] и [Zhang et al., 1998]).
Учитывая большое влияние сигнальной сигнализации на гедоническое питание, Томпсон и Суонсон (2010) использовали схему отслеживания цепи, чтобы точно идентифицировать точные анатомические сети, через которые NAc может влиять на приемлемое потребление пищи. В этих изящных исследованиях крысы получили две неперекрывающиеся инъекции антероградных / ретроградных трассеров (называемых МОИ) в участки оболочки NAc, которые сильно влияли на вкусовое потребление пищи, и были идентифицированы афферентно-эфферентные связи. Было показано, что сайты, связанные с кормлением в NAc, распространяют тормозные проекции преимущественно на передний LH и вентральный паллидум (VP) (Thompson and Swanson, 2010). В отличие от остальной части NAc, которая плотно прилегает к VTA, гедонические горячие точки, связанные с пищевыми продуктами в проекте оболочки NAc, к межфаскулярному ядру (IFN), структура, расположенная рядом с VTA, которая обращается к дофаминергическим проекциям обратным образом назад NAc (Thompson и Swanson, 2010). Кроме того, передний LH выступает в LHb (Thompson and Swanson, 2010), снова предполагая, что сакенуральный комплекс может играть роль в пищевой гедонике (Friedman et al., 2011).
Вышеприведенные данные показывают, что ЛГ получает заметный ингибирующий вход от сайтов в NAc, которые оказывают тонизирующее ингибирующее влияние на приемлемое потребление пищи. ЛГ также обладает функциональной связностью с другими кортикальными и лимбическими участками мозга, участвующими в организации и руководстве поведением к получению вкусной пищи (рис. 1), такой как OFC, insula и миндалина. Важно отметить, что инактивация LH отменяет стимулирующие эффекты манипуляций NAc на потребление пищи ([Maldonado-Irizarry et al., 1995] и [Will et al., 2003]). Кроме того, инактивация NAc-оболочки усиливает активность LH, особенно нейронов LH, которые синтезируют нейропептидный hypocretin (также известный как orexin), как измерено иммунореактивностью Fos ([Baldo et al., 2004] и [Stratford and Kelley, 1999 ]). Действительно, вливание агониста μ-опиоидного рецептора DAMGO в оболочку NAc активирует гипокретинсодержащие нейроны в гипоталамусе (Zheng et al., 2007), а нарушение передачи гипокретина в VTA отменяет вкусное потребление пищи, вызванное инфузиями внутри NAC DAMGO (Zheng et al., 2007). Таким образом, гедонические горячие точки в оболочке NAc оказывают ингибирующее тонизирующее действие на нейроны LH и, в частности, гипокретинсодержащие нейроны (Louis et al., 2010), тем самым ограничивая потребление вкусной пищи. Нарушение этого сигнала «стоп-сигнала», связанного с усилением, посредством расширенной сигнализации о опиоидных рецепторах, например, приводит к усиленной активности ЛГ, которая приводит к высокотемпературному потреблению вкусной пищи (рис. 2).
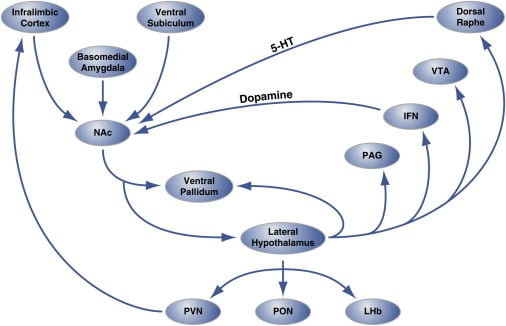
Рисунок 2. Организация на уровне цепей гедонистических «горячих точек» в оболочке Nucleus Accumbens, которая регулирует употребление гедонистической пищи
Область оболочки ядра accumbens (NAc) получает иннервацию от участков кортикального и лимбического мозга и проектов к боковому гипоталамусу и брюшному паллидуму. В свою очередь, боковой гипоталамус также выступает в виде вентрального паллида, а также PAG, IFN, VTA и дорсального ядра рапса. IFN и дорсальный раш расширяют дофаминергические и серотонинергические проекции, соответственно, обратно к NAc. Боковой гипоталамус также иннервирует структуры таламических (PVN и PON) и эпиталамических (LHb). Не показаны незначительные проекции от бокового гипоталамуса до септальных областей мозга. 5-HT, серотонин; ИФН, межфациальное ядро; LHb, латеральная оболочка; PON, преоптическое ядро; PVN, паравентрикулярное ядро таламуса; VTA, брюшная тегментальная область. Рисунок адаптирован с разрешения Thompson и Swanson (2010).
Мозговые сети, которые регулируют питание гедонистов: стриатопаллидальные системы
В дополнение к LH, нейроны оболочки NAc также проектируют VP (рис. 2). В интересной серии экспериментов было показано, что обратные проекции на ВП и ЛГ могут регулировать диссоциирующие аспекты внегоостатического питания (Smith and Berridge, 2007). Вливания DAMGO в оболочку NAc или VP увеличивали орофациальные реакции на растворы сахарозы, предположительно отражающие реакции «симпатии» у крыс (т. Е. Реакцию вкуса), а также повышенное потребление пищи (Smith and Berridge, 2007). Вливания налоксона в NAc или VP уменьшали реакции на симпатию лица к сахарозе, предполагая, что синхронизированная передача опиоидов в NAc и VP необходима для обработки информации, связанной с вкусом пищи. Однако налоксон, влитый в NAc, но не VP, уменьшал внедоматозную еду (Smith and Berridge, 2007), что указывает на то, что внегоостатическая пища происходит независимо от этой связи NAc → VP и вместо этого скорее полагается на путь NAc → LH ([Smith and Berridge, 2007] и [Taha et al., 2009]). В соответствии с представлением о том, что аспекты внеклеточного питания могут быть диссоциированы, записи с одной единицей показали, что популяция нейронов NAc, по-видимому, избирательно кодирует информацию, относящуюся к относительным усиливающим свойствам пищи (то есть вкусовой способности) (Taha and Fields, 2005) , У одних и тех же крыс изменения активности второй популяции нейронов NAc, по-видимому, совпадали с началом питания (Taha and Fields, 2005).
Мозговые сети, которые регулируют питание гедонов: системы амигдалара
Кроме того, поддерживая представление о том, что аспекты неготоэстотического питания являются диссоциируемыми, налоксоновые вливания в оболочку NAc или VP, но не базалатеральную миндалу (BLA), уменьшают вкусовые качества растворов сахарозы (Wassum et al., 2009). Однако, когда антагонисты μ-опиоидных рецепторов налоксона или CTOP были введены в BLA, но не в оболочку NAc или VP, наблюдалось заметное ослабление повышенной мотивации для ответа на растворы сахарозы, обычно наблюдаемые в голодном состоянии ([Wassum et al. ., 2011] и [Wassum et al., 2009]). Это говорит о том, что стимулирующие свойства сахарозы регулируются схемами амигдалара. В целом, приведенные выше данные показывают, что различные аспекты гедонистической еды, такие как обработка информации, связанной с вкусом пищи, поведением подхода и увеличением стимулирующей ценности вкусной пищи у голодных животных, дифференциально регулируются дискретными микросхемами в контексте более крупные кортиколимбико-стриатопаллидально-гипоталамические-таламокортикальные схемы (рис. 2).
Адаптация в мозговых гедонических кругах приводит к компульсивному питанию?
Функциональная значимость гедонических горячих точек в оболочке NAc и их влияние на более широкие схемы, связанные с питанием в головном мозге, были рассмотрены Kelley et al. (2005). Они выдвигают гипотезу о том, что путь NAc shell → LH, а также зоны регуляции мозга вверх и вниз по течению (рис. 2), служат целью «дозорного» (Kelley et al., 2005). В частности, они предлагают, чтобы даже у голодных животных, когда пища для еды была сильной, способность прекратить кормление должна сохраняться в случае угроз со стороны окружающей среды (Kelley et al., 2005). Таким образом, активация нейронных оболочек NAc и сопутствующее ингибирование нейронов LH могут нарушать текущее питание и способствовать переключению поведения на более подходящие адаптивные ответы, такие как замораживание или побег (Kelley et al., 2005). Если это действительно так, тогда важно будет выяснить, скомпрометирован ли этот путь контроля NAc оболочки → LH чрезмерным потреблением вкусной пищи или генетическими факторами, которые влияют на уязвимость к ожирению. Имея это в виду, наша лаборатория и другие недавно сообщили о том, что чрезмерное потребление вкусной калорийной пищи связано с появлением компульсивного поведения кормления у крыс ([Johnson and Kenny, 2010], [Latagliata et al., 2010] и [Освальд и др., 2010]). В частности, мы обнаружили, что вкусное потребление пищи у тучных крыс было устойчивым к нарушению отвратительным условным раздражителем, который предсказывал отрицательный результат (электрический footshock) (Johnson and Kenny, 2010). Таким образом, будет важно проверить, являются ли дефициты в контрольном пути оболочки NAc → LH, вызванные перееданием, по меньшей мере частично, вносят свой вклад в заметный отказ людей с избыточным весом и ожирением использовать информацию о вредных последствиях их завершающего поведения, чтобы уменьшить потребление пищи ,
Измененная деятельность по стимулированию мозга при ожирении: исследования визуализации мозга человека
Получение стимулирующих эффектов приемлемой пищи на системы вознаграждения мозга считается важным мотивационным фактором, способствующим перееданию. Таким образом, важный вопрос заключается в том, могут ли изменения функции вознаграждения мозга способствовать развитию ожирения. Интуитивное предсказание заключается в том, что усиленная конститутивная отзывчивость систем вознаграждения мозга на вкусную пищу приведет к перееданию и увеличению веса. В соответствии с этой гипотезой люди с высоким уровнем чувствительности к признаку признаков проявляют повышенную активность в областях мозга, вовлеченных в награду за питание, включая NAc, amygdala, OFC и VP, при воздействии вкусной пищи, такой как шоколадный торт и пицца (Beaver et al. , 2006). Тучные индивидуумы аналогичным образом демонстрируют повышенную активацию схем вознаграждения мозга в ответ на вкусную пищу или связанные с пищей сигналы по сравнению с бережливым контролем ([Gautier et al., 2000], [Karhunen et al., 1997] и [Rothemund et al., 2007 ]). Высокий уровень чувствительности к признаку признаков также коррелировал с увеличением массы тела у людей ([Davis et al., 2004] и [Franken and Muris, 2005]). Однако важно отметить, что женщина с ожирением (ИМТ> 30) имела более высокий уровень ангедонии (т.е. пониженную исходную чувствительность к вознаграждению), чем женщина с избыточным весом (ИМТ> 25 <30) (Davis et al., 2004). Аналогично, Stice and coorkers (2008b) показали, что девочки с ожирением-подростками увеличили активацию островков и других областей коры головного мозга в ответ на вкусную пищу или связанные с пищей сигналы по сравнению с субъектами постного контроля, но эта активация хвостатодной области стриатум в ответ на вкусную пищу обратно коррелировал с ИМТ у пациентов с ожирением. Кроме того, женщины, которые набрали вес в течение 6 месячного периода, имели заметное снижение активности полосатого тела в ответ на вкусную пищу в течение этого периода времени по сравнению с женщинами, которые не набирали вес (Stice et al., 2010a). Принимая все это вместе, кажется, что гиперчувствительность схем вознаграждения может предрасполагать человека к перееданию и увеличению веса (Stice et al., 2010b). Однако по мере увеличения веса увеличивается дефицит активности отдельных компонентов системы вознаграждения мозга, особенно полосатого тела, может появиться. Было высказано предположение о том, что появление этого состояния вознаграждения гипосенсибилити может увековечить чрезмерное потребление приемлемой пищи для преодоления такого дефицита вознаграждения ([Stice et al., 2008a] и [Wang et al., 2002]). Следовательно, слишком мало или слишком много продовольственной награды, как представляется, увеличивает уязвимость к перееданию и ожирению (Stoeckel, 2010). Привлекательная концептуальная основа для согласования этих, по-видимому, противоположных точек зрения заключается в том, что кортиколимбические области, участвующие в организации поведения в отношении получения продовольственных вознаграждений и прогнозирования ожидаемого будущего продовольственного вознаграждения, могут стать гиперактивными у людей с избыточным весом и у людей, предрасположенных к ожирению. Напротив, половые участки мозга, которые обрабатывают фактический опыт удовольствия от гедонистической еды, могут постепенно становиться менее функциональными у этих же людей. Следовательно, относительная мотивационная ценность приемлемого пищевого продукта будет увеличиваться во время развития ожирения в то же время, когда уменьшается гедонистическая ценность, получаемая от потребления приемлемой пищи.
Измененная деятельность по профилактике головного мозга при ожирении: исследования грызунов
Эффекты вкуса потребления пищи на системы вознаграждения мозга были непосредственно оценены у лабораторных животных с помощью процедуры вознаграждения за стимуляцию мозга (BSR). Хорошо известно, что электрическая стимуляция ЛГА, которая принимает тонизирующий ингибирующий входной сигнал от accumbal гедонических горячих точек (рис 2), является весьма полезной и крысы работать самостоятельно стимулировать эту область мозга, например, (Markou и Франк, 1987 ). В дополнение к поддержанию поведения самостимуляции электрическая стимуляция ЛГ также может вызывать интенсивные приступы питания (Margules and Olds, 1962), и было предложено, чтобы полезные свойства стимуляции ЛГ могли быть связаны с внутренней ролью этого мозга в аппетитных и стимулирующих свойствах пищи (Margules and Olds, 1962). В соответствии с этим взглядом голод и потеря веса повышают чувствительность крыс к самостимуляции LH (Бланделл и Херберг, 1968), [Carr and Simon, 1984] и [Margules and Olds, 1962]), эффект которые могут быть заблокированы внутричерепной внутрижелудочковой инфузией лептина (Fulton et al., 2000). И наоборот, электрическая самостимуляция LH ингибируется у насыщенных животных (Wilkinson and Peele, 1962). Действительно, перекармливание крыс через внутрижелудочную питательную трубку (Hoebel and Teitelbaum, 1962), вздутие желудка или внутривенную инфузию глюкагона, которая имитирует постпрандиальную сытость ([Hoebel, 1969], [Hoebel и Balagura, 1967] и [Mount and Hoebel, 1967] ), все ослабляют реакцию на стимуляцию ЛГ. Фактически, крысы, которые ранее энергично реагировали на стимуляцию стимуляции ЛГ, будут реагировать так, как если бы эта стимуляция была отвратительной после приема пищи или развития ожирения (Hoebel and Thompson, 1969). Следовательно, хроническое ограничение пищи и потеря веса усиливаются, тогда как перекармливание уменьшает чувствительность сайтов, связанных с наградами, в ЛГ. Таким образом, чувствительность нейронов LH к полезной электрической стимуляции может дать важную информацию о функционировании схемы мозга, которая регулирует гедонические реакции на пищу.
Поскольку легкость доступа к энергоемкой вкусной пище и последующее чрезмерное потребление считается одним из основных факторов окружающей среды, способствующих ожирению (Volkow and Wise, 2005), наша лаборатория недавно использовала процедуру BSR для оценки активности мозговой награды у крыс с расширенным доступом к вкусной пище , В частности, мы записали ответ на электростимуляцию ЛГ у крыс, у которых был доступ ad libitum к питательной чау в одиночку или чау в сочетании с ежедневным доступом 18-23 к приемлемой диете. Эта диета состояла из чизкейка, бекона, колбасы и других аппетитных продуктов питания (Johnson and Kenny, 2010). Мы обнаружили, что крысы с расширенным доступом к вкусной пище быстро приобрели значительное количество веса и продемонстрировали прогрессивно ухудшающийся дефицит мозговой награды (отраженный как снижение чувствительности к стимулированию стимуляции ЛГ) (Johnson and Kenny, 2010; Figure 3). Это говорит о том, что развитие ожирения, вызванного диетой, связано с постепенным снижением чувствительности сайтов вознаграждения в ЛГ (Johnson and Kenny, 2010). У взрослых крыс также отмечалось, что у взрослых крыс обнаружены недостатки, которые ранее имели неограниченный доступ к сахарозе или высокожирной пище в подростковом возрасте [Teegarden et al., 2009], [Vendruscolo et al., 2010a] и [Vendruscolo et al., 2010b]). Эти эффекты у крыс напоминают уменьшенную стриатальную активацию в ответ на награду за питание, описанную выше у людей, поскольку они набирали вес в течение 6 месячного периода (Stice et al., 2010a, см. Рисунок 4). Подобные диетические дефициты дефицита у крыс с избыточным весом и, возможно, у людей, которые набирают вес, скорее всего, отражают контратативный ответ в схемах вознаграждения за питание, чтобы противостоять их чрезмерной стимуляции вкусной едой (Johnson and Kenny, 2010). Важным аспектом этого вывода является то, что аналогичные дефициты в функции вознаграждения также обнаруживаются у крыс, которые чрезмерно потребляют кокаин или героин ([Ahmed et al., 2002], [Kenny et al., 2006] и [Markou and Koob, 1991]; Рисунок 3). На самом деле было выдвинуто предположение, что дисфункция, вызванная лекарственными средствами, может способствовать переходу от контролируемого к неконтролируемому употреблению наркотиков, предоставляя новый источник мотивации потреблять препарат для смягчения стойкого состояния уменьшенной награды ([Ahmed and Koob , 2005] и [Koob и Le Moal, 2008]). Таким образом, возможно, что дефицит чувствительности участков вознаграждения в ЛГ, вызванный перееданием, может увеличить долгосрочную стойкость вкусового потребления пищи у крыс с избыточным весом, изменив предпочтение в отношении пищи к пище с более высоким гедоническим воздействием, чтобы облегчить стойкое состояние отрицательного вознаграждение.
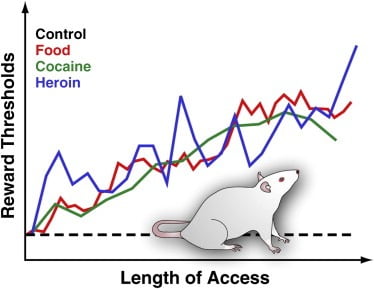
Рисунок 3. Пороги вознаграждения у крыс с расширенным ежедневным доступом к востребованной пище, кокаину или героин
Чтобы измерить пороговые значения вознаграждения, стимулирующий электрод хирургически имплантируется в латеральный гипоталамус крыс, область, в которой электрическая стимуляция сильно вознаграждает и может вызвать интенсивные приступы питания. После выздоровления животные могут самостоятельно стимулировать эту область, поворачивая колесо. После установления стабильного поведения самостимуляции определяется минимальная интенсивность стимуляции, которая поддерживает поведение самостимуляции (т. Е. Порог вознаграждения). Этот порог вознаграждения обеспечивает оперативную меру деятельности системы вознаграждения. Пороги вознаграждения остаются стабильными и неизменными у контрольных крыс, которые имеют доступ к стандартной лабораторной чау и остаются наименее лекарственными. Однако пороги постепенно повышаются у крыс с расширенным ежедневным доступом к энергетически плотной приемлемой диете, состоящей из вкусных продуктов питания (например, чизкейк, бекон, шоколад и т. Д.). Точно так же пороговые уровни вознаграждения постепенно повышались у крыс, которые ежедневно расширяли доступ к внутривенным вливаниям кокаина или героина. Повышенный порог вознаграждения интерпретируется с учетом снижения чувствительности системы вознаграждения мозга. Эти эффекты предполагают, что чрезмерное потребление приемлемой пищи и связанное с ней увеличение веса могут вызывать глубокие дефициты в мозговой награде, подобные тем, которые вызваны чрезмерным потреблением наркотических веществ
Рисунок 4. Пластическая пластичность в брюшной полости в ожирении. Увеличение веса связано с уменьшенной стригальной активацией в ответ на вкусную пищу, измеряемой с помощью МРТ, и более низкими уровнями доступности полового дофамина D2 (D2R) у людей (подробности см. В тексте).
Дефицитная допаминная сигнализация D2-рецептора при ожирении
В нескольких последних докладах были выявлены потенциальные механизмы, благодаря которым дефицит вознаграждения может возникнуть в ответ на чрезмерное потребление вкусной пищи во время развития ожирения. Как отмечалось выше, женщины, которые набрали вес в течение 6 месячного периода, имели заметное снижение активности полосатого тела в ответ на вкусную пищу в течение этого периода времени по сравнению с женщинами, которые не набирали вес (Stice et al., 2010a, Рисунок 4). Постные индивидуумы, которым разрешено есть свою любимую еду для насыщения, имели более низкие уровни связывания антагониста рецептора дофамина D2 (D2R) раклоприда в стриатуме (Small et al., 2003), что указывает на то, что сигнализация D2R снижается в ответ на вкусное потребление пищи. Действительно, у лиц с ожирением более низкий уровень доступности полосатого D2R по сравнению с белковым контролем ([Barnard et al., 2009], [Stice et al., 2008a] и [Wang et al., 2001]; Рисунок 4), тогда как потеря веса у пациентов с ожирением ассоциируется повышенная плотность полосатого D2R (Wang et al., 2008). Учитывая, что передача полосатого дофамина играет ключевую роль в регулировании гедонистической пищи, адаптивное снижение передачи сигналов D2R может способствовать уменьшению чувствительности полосатого тела к приемлемой пище для людей с ожирением. Чтобы проверить эту возможность, Мал и коллеги изучали активность в схемах вознаграждения мозга в ответ на приятный молочный коктейль у контрольных людей и людей, несущих аллель TaqIA A1 (Felsted et al., 2010). Полиморфизм длины рестрикционного фрагмента TaqIA находится ниже по течению от гена D2R (Neville et al., 2004), а индивидуумы, несущие аллель A1 полиморфизма, имеют между 30% -40% меньше полосатых D2Rs по сравнению с теми, кто не несет аллель ([Jönsson et al., 1999], [Ritchie and Noble, 2003] и [Stice et al., 2010b]). Кроме того, носители аллелей A1 также имеют пониженный метаболизм глюкозы в полосатых и корковых областях мозга, участвующих в гедонистических ответах на пищу (Jönsson et al., 1999). Лица, укрывающие аллель TaqIA A1, чрезмерно представлены в группах с ожирением ([Barnard et al., 2009], [Stice et al., 2008a] и [Wang et al., 2001]). Кроме того, аллель A1 также повышает уязвимость к наркотической зависимости от алкоголя, опиоидов и психомоторных стимуляторов ([Lawford et al., 2000], [Noble et al., 1993] и [Noble et al., 2000]). Было обнаружено, что области среднего мозга, в том числе VTA и SN, которые обеспечивают дофаминергический вклад в полосатый ствол, активировались в ответ на приятный молочный коктейль у контрольных лиц (Felsted et al., 2010). Напротив, активность в этих участках мозга фактически уменьшалась в ответ на награду за питание в носителях аллелей A1 (Felsted et al., 2010). Подобные обратные ответы при активации мозга между аллельными носителями A1 и несущими были также обнаружены в таламических и корковых средах мозга (Felsted et al., 2010). Эти данные в значительной степени согласуются с ключевой ролью D2R в регулировании мезостроальной реакции на вкусную пищу. Stice и его коллеги (2008a) обнаружили обратную корреляцию между ИМТ и активацией полосатого тела (хвостат и putamen) в ответ на вкусный шоколадный молочный коктейль у пациентов с больными. Более того, эта обратная связь наиболее очевидна у индивидуумов, несущих аллель TaqIA A1 (Stice et al., 2008a). Будущее увеличение веса у этих людей, измеренное через 1 год после первоначальной визуализации головного мозга, показало, что величина стриатальной активации в ответ на вкусную пищу отрицательно коррелировала с увеличением веса у субъектов с аллелем A1 и положительно коррелировала в субъектах аллелей без A1 ( Stice et al., 2008a). В последующем исследовании сообщалось, что величина стриатальной активации в ответ на предполагаемое употребление вкусной пищи, в отличие от ее фактического потребления, была обратно пропорциональна увеличению веса в следующем году у субъектов с аллели A1, но положительно коррелирует в субъектах аллелей, отличных от A1 (Stice et al., 2010b). Эти данные свидетельствуют о том, что D2Rs регулируют стригальную реакцию на вкусную пищу и что уменьшенная сигнализация D2R, вызванная увеличением массы тела или генетическими факторами, может повысить уязвимость к ожирению.
Недостаточная сигнализация D2R способствует снижению дефицита при ожирении
Подобно пониженным уровням стриатального D2R у людей с ожирением, уровни D2R также снижаются у мышей и крыс, которым кормили вкусную диету (например, [Colantuoni et al., 2001], [Geiger et al., 2009] и [Johnson and Kenny , 2010]) и у крыс, генетически предрасположенных к ожирению (крысы Цукера) (Thanos et al., 2008). Наша лаборатория непосредственно изучила роль нарушения полосатой передачи дофамина в целом и уменьшает передачу сигналов D2R, в частности, в зависимости от наркомании, которые возникают у крыс во время развития ожирения (см. Рисунок 5). В частности, мы тестировали эффекты уменьшения экспрессии полосатых D2R у крыс с использованием вирусной опосредованной РНК-интерференции, а затем оценивали пороговые значения BSR, когда крысы имели доступ только к чау или только в чаше в сочетании с ежедневным доступом 18-23 hh к приемлемым высокоэнергетическим диете (т. е. столовой диете) (Johnson and Kenny, 2010). Мы обнаружили, что ответ на полезную стимуляцию ЛГ начал снижаться почти сразу после контакта с калорийной диетой у крыс нокдауна D2R (Johnson and Kenny, 2010, рисунок 5). Снижение уровня стриалата D2R, таким образом, быстро ускоряет появление гипофункции вознаграждения у крыс с расширенным доступом к высокопривлекательной пище, процесс, который обычно занимает много недель, чтобы появиться у контрольных крыс с расширенным доступом к приемлемой диете. Тем не менее, нокдаун стриатальных D2R у крыс с доступом к чау-чау не только не реагировал на поощрение стимуляции ЛГ, предполагая, что ослабленная полосатая сигнализация D2R взаимодействует с другими адаптивными реакциями, вызванными диетой, в схемах вознаграждения мозга, чтобы вызвать положительную гипочувствительность. В дополнение к пониженным уровням D2R, другие аспекты полосатой дофаминергической передачи также изменяются в мозге тучных крыс. Например, крысы Sprague-Dawley порождали избирательность, чтобы быстро набирать вес на высокоэнергетической диете (склонности к ожирению крыс) имели более низкие базальные и вызванные уровни дофамина в NAc, чем крысы, которые устойчивы к увеличению массы тела (резистентные к ожирению крысы) (Geiger et al., 2008, см. также Rada et al., 2010). У крыс, подверженных ожирению, также снижаются уровни биосинтетических и складских механизмов допамина, что свидетельствует о том, что неудача в производстве и высвобождении допамина способствует дефициту трансплантата дофамина стриатума у тучных крыс (Geiger et al., 2008). Крысы, которые развивали ожирение через чрезмерное потребление приемлемой высокоэнергетической диеты, также имели более низкие базальные и вызванные уровни дофамина в NAc по сравнению с крысами, которые имели доступ только к стандартной чау ([Davis et al., 2008] и [Geiger et al., 2009]). Важно отметить, что еды стандартного чау было достаточно, чтобы увеличить уровни допамина в NAc контрольных крыс, тогда как только очень вкусные пищевые продукты были достаточными для того, чтобы вызывать ускорение допамина у тучных крыс, у которых была история расширенного доступа к вкусной пище (Geiger et al., 2009). Эти данные показывают, что развитие ожирения у крыс связано с дисфункцией при мезостриальной передаче дофамина, что наиболее заметно у полосатых D2R, и что недостаточная сигнализация D2R способствует возникновению дефицита вознаграждения во время развития ожирения у крыс. Это согласуется с тем фактом, что подавление стриатальных D2R является заметным нейроадаптивным ответом на увеличение веса у людей ([Barnard et al., 2009], [Stice et al., 2008a] и [Wang et al., 2001]), и эта недостаточная полосатая сигнализация D2R может приводить к размыванию стриатальных ответов на гедоническую пищу у людей, тем самым предрасполагая человека к увеличению веса в будущем ([Stice et al., 2008a] и [Wang et al., 2001]).
Рисунок 5. Дофаминовые рецепторы D2, дисфункция вознаграждения и компульсивность при ожирении - нокдаун дофаминовых рецепторов D2 (D2R) в полосатом теле крыс ускоряет появление дисфункции вознаграждения и компульсивного переедания у крыс с расширенным доступом к приемлемой пище..
Недостаточная сигнализация D2R может вызвать компульсивное питание при ожирении
Ожирение характеризуется перееданием, которое сохраняется, несмотря на выраженное желание ограничить потребление и знание глубоких отрицательных последствий для здоровья и социальных последствий продолжающегося чрезмерного потребления ([Booth et al., 2008], [Delin et al., 1997] и [Puhl et al., 2008]). Это подтверждается тем фактом, что многие пациенты с ожирением будут подвергаться потенциально опасной хирургической операции с бариатрией (желудочный шунт) для контроля их веса (Yurcisin et al., 2009), но часто рецидивируют до переедания, хотя операция уменьшает субъективные оценки голода и уменьшает способность потреблять большое количество пищи ([Kalarchian et al., 2002] и [Saunders, 2001]). Наркомания аналогичным образом определяется как потеря тормозного контроля над потреблением наркотиков и постоянством в привычке, несмотря на осознание потенциально разрушительных последствий для здоровья, социальных или финансовых последствий (DSM-IV, Американская психиатрическая ассоциация, 1994). Таким образом, ожирение и наркомания разделяют признаки компульсивных расстройств в том, что существует явная неспособность использовать информацию о будущих вредных последствиях для умеренного потребления и упорства в потреблении, несмотря на наличие менее вредных альтернативных форм поведения.
Компульсивное употребление наркотиков было оперативно определено у грызунов как потребление, которое устойчиво к подавлению посредством наказания или экологических стимулов, предсказывающих наказание ([Pelloux et al., 2007] и [Vanderschuren and Everitt, 2004]). Периоды расширенного доступа к кокаину и другим наркотикам могут привести к появлению компульсивного поведения, связанного с употреблением наркотиков у крыс ([Ahmed and Koob, 1998], [Deroche-Gamonet et al., 2004] и [Vanderschuren and Everitt, 2004] ). Действительно, крысы с историей обширного потребления потребления кокаина демонстрируют потребление, которое устойчиво к нарушению отвратительным условным раздражителем (CS), предсказывающим отрицательный результат (т. Е. Световой сигнал, который предсказывает доставку отвратительной ноги) ([Белин и др., 2008] и [Vanderschuren and Everitt, 2004]). И наоборот, та же самая аверсивная КС может глубоко снизить реакцию на наркотики у крыс с относительно ограниченным доступом к препарату. Учитывая сходство между компульсивным употреблением наркотиков при наркомании и перееданием при ожирении, мы недавно исследовали, будут ли тучные крысы потреблять вкусную пищу компульсивно-любимым способом, и если полосатые D2R играют роль в этом процессе (Johnson and Kenny, 2010). Мы обнаружили, что тучные крысы с историей расширенного доступа к вкусной пище продолжали питаться вкусной пищей даже в присутствии ядовитой CS (легкой подсказки), которая предсказывала доставку аверсивной ноготки (Johnson and Kenny, 2010). Напротив, та же самая аверсивная КС нарушала вкусное потребление пищи у постных крыс с очень ограниченным воздействием энергии-плотной вкусной пищи. Таким образом, употребление в пищу потребления пищи может стать компульсивным у тучных крыс во многом таким же образом, что потребление кокаина может стать компульсивным. В соответствии с этой интерпретацией данных мыши, которые ранее имели доступ к приемлемой диете с высоким содержанием жиров, проводили больше времени в аверсивной среде (ярко освещенной), чтобы получить вкусную пищу, чем мыши, у которых не было предыдущего опыта диеты (Teegarden and Bale , 2007). Из-за страха перед хищничеством ярко освещенные открытые арены очень отвратительны для мышей (Suarez и Gallup, 1981). Поэтому мышки становятся устойчивыми к потенциально негативным последствиям их поведения в отношении кормов и будут рисковать хищничеством для получения вкусной пищи, даже если менее приемлемая пища доступна при гораздо меньшей опасности.
Интригующе, что аллель A1 полиморфизма TaqIA, который приводит к снижению плотности полосатого D2R (Noble, 2000) и притупленной полосатой активации в ответ на вкусную пищу (Stice et al., 2008a), также связан с дефицитом в обучении, чтобы избежать действий, которые (Klein et al., 2007). Именно такой тип неспособности использовать информацию, связанную с будущими негативными последствиями переедания, может способствовать развитию компульсивного питания у людей с ожирением. Мы обнаружили, что появление компульсивного питания у крыс, имеющих доступ к вкусной пище, резко ускорилось после ночного прохода стриатального D2R (Johnson and Kenny, 2010). На самом деле, крысы со стриатальным нокдауном D2R, которые ранее имели только 14-дни расширенного доступа к энергоемкой вкусной пище, показали приятное потребление пищи, которое было устойчиво к сбою со стороны аверсивной CS (Johnson and Kenny, 2010; Рисунок 5). Тем не менее, этот 14 дневной период ограниченного воздействия на вкусную пищу был недостаточным, чтобы вызвать компульсивное употребление в контрольных крысах (Johnson and Kenny, 2010). Эти данные свидетельствуют о том, что зависимость от привыкания к потреблению пищевых продуктов может возникнуть у тучных крыс. Кроме того, недостаточная полосатая сигнализация D2R, которая ускоряет появление повышенной гипочувствительности в ответ на вкусовое избыточное потребление пищи, также ускоряет появление компульсивного питания (рисунок 5).
Взаимодействие между D2R и гормональными регуляторами энергетического баланса при ожирении
Экзогенный лептин, вводимый в VTA, ингибирует передачу и кормление допамином мезоацбэнсов ([Hommel et al., 2006] и [Krügel et al., 2003]). В дополнение к его острому ингибирующему действию на дофаминовые системы среднего мозга, накапливается доказательство того, что сигнализация тонического лептина может также быть необходима для поддержания соответствующих уровней мезоструйной передачи сигналов допамина. Флиер и его коллеги обнаружили, что ob / ob мыши имели более низкие уровни тирозингидроксилазы в дофаминовых нейронах среднего мозга, ключевом ферменте в биосинтезе допамина (Fulton et al., 2006). Кроме того, мыши ob / ob уменьшали выделение допамина в NAc (Fulton et al., 2006) и уменьшали соматодендритные везикулярные запасы допамина в VTA и SN (Roseberry et al., 2007). Эти недостатки в производстве допамина и аппаратуре сигнальной трансдукции у мышей ob / ob были исправлены обработкой лептином ([Fulton et al., 2006] и [Pfaffly et al., 2010]). Фактически, лептин, вводимый только в ЛГ, был достаточным для коррекции дисфункциональной передачи дофамина у мышей ob / ob (Leinninger et al., 2009), предполагая, что клетки, экспрессирующие лептин-рецептор, в действии LH поддерживают соответствующие уровни сигнальной дозы дофамина. В дополнение к уменьшению продуцирования и высвобождению допамина мыши ob / ob также имели более низкие уровни экспрессии D2R в полосатом теле (Pfaffly et al., 2010). Кроме того, экзогенное лептиновое лечение в режиме, которое приводит к развитию нечувствительности к сигнальной передаче лептина (то есть устойчивость к лептину), значительно снижает уровни стригального D2R у мышей дикого типа (Pfaffly et al., 2010). Тучные крысы развивают резистентность лептина в VTA ([Matheny et al., 2011] и [Scarpace et al., 2010]), а также имеют более низкие уровни TH в VTA, уменьшенное выделение дофамина в полосатом теле и уменьшенные уровни стригального D2R (Гейгер et al., 2008). В совокупности эти данные показывают, что лептин обладает комплексными действиями на дофаминовых системах среднего мозга. С одной стороны, острая активация рецепторов лептина в VTA оказывает ингибирующее действие на передачу дофамина мезоацкембенов и может ингибировать поведение кормления ([Hommel et al., 2006] и [Krügel et al., 2003]). С другой стороны, сигнализация лептина в среднем мозге необходима для поддержания соответствующего производства допамина и передачи сигнала, а генетический дефицит в сигнальной связи лептина или развитие резистентности лептина при ожирении глубоко нарушает системы допамина мезоацбэнс. Таким образом, представляется интересной возможность того, что развитие резистентности лептина в дофаминергических нейронах среднего мозга при развитии ожирения может играть центральную роль в нарушении полосатой передачи сигналов D2R, которая, по-видимому, приводит к появлению склонности к наркомании, а также к компульсивному перееданию (Рисунок 5) у тучных крыс.
В дополнение к комплексным последствиям передачи лептина на мезостриальную дофаминергическую передачу накапливаются доказательства того, что D2R могут, в свою очередь, регулировать передачу лептина. Агонист бромокриптина D2R снижает циркулирующие уровни лептина ([Doknic et al., 2002], [Kok et al., 2006] и [Mastronardi et al., 2001]), что указывает на то, что D2R оказывают ингибирующее влияние на уровни лептина. Кроме того, мыши с нулевой мутацией в гене D2R имеют повышенную сигнализацию лептина в гипоталамусе и более чувствительны к аноректическим эффектам лептина (Kim et al., 2010). Хорошо известно, что уровни лептина растут во время развития ожирения (гиперлептинемия), однако сопутствующее снижение чувствительности к сигнальной передаче лептина (т. Е. Сопротивление лептину) (Hamilton et al., 1995). Таким образом, представляется интересной возможность того, что снижение в полосатой передаче сигналов D2R при развитии ожирения может представлять собой компенсаторный ответ на чрезмерное потребление приемлемого пищевого продукта и увеличение веса, которое увеличивает циркулирующие уровни лептина и увеличивает его эффективность сигнализации для преодоления развития устойчивости лептина. Такое действие может усилить ингибирующее действие лептина на полосатые системы, которые регулируют чувствительность к приемлемым пищевым продуктам ([Farooqi et al., 2007], [Fulton et al., 2006] и [Hommel et al., 2006]), тем самым действуя чтобы ослабить гедонистические реакции на вкусную пищу. Полагая это обнаружение вместе с регуляторной ролью лептина на D2R, описанным выше, кажется, что сигнализация лептина и D2R может быть объединена обратным образом для регулирования гомеостатических и гедонических аспектов поведения кормления.
Нарушенные системы стресса головного мозга при ожирении
Лептин сигнализирует в среднем мозге, чтобы регулировать передачу дофамина мезоацбэнсов и реакцию на гедоническую пищу. Однако нейроны в VTA, которые экспрессируют рецепторы лептина, редко выступают в NAc и вместо этого демонстрируют более заметные проекции на центральное ядро миндалины (CeA) (Leshan et al., 2010). Известно, что в контексте поведения кормления CeA регулирует ингибирующее воздействие вредных экологических воздействий на потребление пищи (Petrovich et al., 2009). В частности, поражения CeA, но не базалатеральной амигдалы (BLA), отменяют ингибирующее действие парникового условного раздражителя на кормление, предполагая, что CeA имеет решающее значение для ингибирующего контроля над кормовым поведением в ответ на экологические сигналы, предсказывающие отрицательный результат ( Петрович и др., 2009). Тучные крысы или крысы без носа с полосатым нокдауном D2R и доступом к вкусной еде продолжают потреблять вкусную пищу компульсивным образом в присутствии отвратительной CS. Эти эффекты поразительно сходны с нарушением реактивности к Aversive CS у крыс, пораженных CeA (Petrovich et al., 2009). Таким образом, будет важно определить, являются ли изменения в активности CeA, возможно, вследствие стриатальной регуляции D2R или развития резистентности лептина в среднем мозге, способствует возникновению компульсивноподобной пищи у тучных крыс.
Помимо регулирования воздействия вредных экологических стимулов на пищевое поведение, CeA также может играть ключевую роль в гедонистическом питании, связанном со стрессом. У людей стресс сильно мотивирует выбор и потребление высококалорийной аппетитной пищи независимо от потребности в калориях ([Gluck et al., 2004], [Kandiah et al., 2006] и [O'Connor et al., 2008]) , а ожирение связано с повышенной секрецией глюкокортикоидов, связанной со стрессом ([Björntorp and Rosmond, 2000] и [la Fleur, 2006]). Экологические и социальные факторы стресса также вызывают гиперфагию от высококалорийной аппетитной пищи у грызунов и обезьян, при этом потребление вкусной пищи потенциально снижает неблагоприятные последствия стресса ([Dallman et al., 2003], [Dallman et al., 2006], [Pecoraro et al. al., 2004] и [Wilson et al., 2008]). Кроме того, вызывающий стресс препарат йохимбин может восстановить у крыс ранее подавленные реакции поиска аппетитной пищи (нажатие на рычаг), эффект ослабляется антагонистом рецептора кортикотропин-рилизинг-фактора-1 (CRF-1) анталармином (Ghitza et al., 2006 ). Важно отметить, что точное влияние стресса на потребление пищи людьми и лабораторными животными зависит от природы и силы фактора стресса, типа пищи, доступной для употребления (вкусная или мягкая), массы тела и пола (Dallman , 2010).
Мыши с расширенным доступом к приемлемой диете с высоким содержанием жиров уменьшали экспрессию CRF гормона стресса в CeA (Teegarden and Bale, 2007). И наоборот, мыши, которые подвергаются «снятию» с приемлемой диеты, увеличивали экспрессию CRF в CeA (Teegarden and Bale, 2007). Этот последний эффект очень похож на увеличенную экспрессию CRF в CeA, обнаруженную у крыс, подвергающихся уходу со всех основных наркотических средств (Koob, 2010). Поскольку дальнейшее употребление наркотиков может нормализовать этот отвратительный нейробиологический ответ на вывод препарата, было высказано предположение, что гиперактивная передача CRF в CeA и других лимбических структурах может способствовать развитию компульсивного употребления наркотиков (Koob and Zorrilla, 2010). В соответствии с этим мнением мышам, перенесшим вывод из вкусной энергоемкой пищи, которая повышала уровни CRF в CeA, проводила значительно больше времени в аверсивной (ярко освещенной) среде для получения вкусной пищи, чем мышам без предшествующего опыта пищи, даже хотя менее привлекательный был доступен в небезопасной (темно освещенной) среде (Teegarden и Bale, 2007). Поэтому мышки становятся устойчивыми к потенциально негативным последствиям их поведения в кормлении и рискуют хищничеством для получения вкусной пищи, даже если менее приемлемая пища доступна при гораздо меньшей опасности, частично для ослабления передачи CRF в CeA (Teegarden and Bale, 2007). Несколько дополнительных доказательств подтверждают роль передачи CRF при компульсивном питании. В частности, недавнее исследование оценило влияние антагониста рецептора CRF-1 R121919 на потребление пищи у крыс, подвергающихся циклическим изменениям в их рационе, в которых они имели доступ к стандартным чау-часам 5 дней в неделю и к доступу к приемлемой сахарной диете 2 days per неделю (Cottone и др., 2009). После 7 недель этого циклического изменения в рационе R121919 смягчил чрезмерное потребление очень вкусной диеты и повышенное потребление мягкой чау (Cottone et al., 2009). Кроме того, уровни экспрессии CRF в CeA были увеличены у крыс с циклическим циклом во время выхода из приемной диеты, но вернулись к исходным уровням после повторного воздействия на приемлемую диету (Cottone et al., 2009). Наконец, CRF-регулирование передачи GABAergic в CeA было усилено у крыс с циклическими препаратами, которые подвергались выходу из приемлемой диеты по сравнению с контрольными крысами, которые ранее имели доступ только к мягкой чау, что отразилось на том, что R121919 нарушил вызванный GABAergic ингибирующий постсинаптический потенциал в CeA от циклических крыс при концентрации, которая не изменяла передачу в срезах от контрольных крыс (Cottone et al., 2009). Интересно, что аналогичный эффект CRF на передачу GABAergic в CeA также наблюдался у крыс, которые подвергаются отходу от хронического воздействия этанола (Roberto et al., 2010). Наконец, CeA, костяное ядро стричевой оконечности (BNST) и NAc-оболочки представляет собой более крупную смежную структуру, называемую «расширенной амигдалой». Вливание CRF в оболочку NAc на участках, которые стимулируют гедоническую пищу, усиливает мотивационную значимость окружающей среды который ранее был сопряжен с доступностью вкусной пищи (Peciña et al., 2006a). Таким образом, стресс может повысить значимость парных экологических сигналов, связанных с питанием, путем модуляции активности нейронов оболочки NAc. В совокупности эти данные свидетельствуют о том, что чрезмерное потребление приемлемых пищевых продуктов или наркотических средств может вызвать подобные нейроадаптивные реакции в экстрагипоталамических стрессовых путях в головном мозге, что может способствовать компульсивному завершающему поведению.
Выводы
В последнее время был достигнут значительный прогресс в выявлении систем мозга, участвующих в гедонистических эффектах вкусной пищи и адаптациях, которые происходят в этих контурах в ответ на чрезмерное потребление вкусной пищи и увеличение веса. Поразительно, что сходные системы мозга и общие адаптивные реакции запускаются в ответ на потребление как вкусной пищи, так и лекарств, вызывающих привыкание. В частности, чрезмерное потребление вкусной еды или злоупотребляемых наркотиков вызывает аналогичный дефицит отзывчивости систем вознаграждения мозга. Приятная пища и препараты, вызывающие привыкание, вызывают дефицит передачи дофамина в полосатом теле и экспрессию полосатого тела D2R. Вкусная еда и наркотики, вызывающие привыкание, также вызывают появление компульсивно-подобного консумматического поведения у грызунов и вызывают реакции на внегипоталамический стресс. Наконец, общие генетические уязвимости в системах вознаграждения мозга могут предрасполагать людей к перееданию и ожирению, а также к употреблению наркотиков и наркомании. Фактически, основываясь на этих и других сходствах между ожирением и наркозависимостью, утверждалось, что ожирение должно быть включено в качестве диагностической категории в готовящийся к выпуску DSM-V ([Devlin, 2007] и [Volkow and O'Brien, 2007] ). Имея это в виду, важнейшие области будущих исследований будут включать дальнейшее изучение потенциальных нейробиологических совпадений между компульсивным перееданием и употреблением наркотиков. Например, будет важно проверить, связано ли ожирение с развитием привычного потребительского поведения, возникающего в результате пластичности спинного полосатого тела, точно так же, как наркомания может быть связана с ремоделированием полосатого тела и появлением привычки к поиску наркотиков. поведения ([Everitt and Robbins, 2005], [Hollander et al., 2010] и [Kasanetz et al., 2010]). Кроме того, области коры головного мозга, участвующие в исполнительном контроле и принятии решений (например, префронтальная кора) и в интероцептивной обработке (островная кора), в значительной степени вовлечены в наркозависимость ([Everitt et al., 2008], [Fineberg et al., 2010 ], [Koob and Volkow, 2010] и [Naqvi and Bechara, 2009]), но мало что известно об их точной роли в компульсивном переедании и ожирении, например ([Nair et al., 2011] и [Volkow et al. , 2009]). Взятые вместе, данные, рассмотренные выше, подтверждают представление о том, что ожирение и наркомания могут возникать из аналогичных нейроадаптивных реакций в цепях вознаграждения мозга, и предполагают, что известные механизмы зависимости могут обеспечить эвристическую основу для понимания ожирения.
Благодарности
Автор получает гранты от Национального института по борьбе со злоупотреблением наркотиками (NIDA). Автор благодарен Пол Джонсону и Кристи Фаулер за ценные идеи и комментарии к рукописи. Это рукописный номер 21042 от Научно-исследовательского института Скриппса.
Рекомендации
1.
o Abizaid и др., 2006a
o A. Abizaid, Q. Gao, TL Horvath
o Мысли о питании: механизмы мозга и баланс периферической энергии
o Neuron, 51 (2006), стр. 691-702
o
2.
o Abizaid и др., 2006b
o A. Abizaid, ZW Liu, ZB Andrews, M. Shanabrough, E. Borok, JD Elsworth, RH Roth, MW Sleeman, MR Picciotto, MH Tschöp et al.
o Грелин модулирует активность и синаптическую входную организацию нейранов дофамина среднего мозга при популяризации аппетита
o J. Clin. Invest., 116 (2006), стр. 3229-3239
o
3.
o Ахмед и Кооб, 1998
o SH Ahmed, GF Koob
o Переход от умеренного к чрезмерному употреблению наркотиков: изменение гедонического уставки
o Наука, 282 (1998), стр. 298-300
o
4.
o Ахмед и Кооб, 2005
o SH Ahmed, GF Koob
o Переход к наркомании: отрицательная модель подкрепления, основанная на аллостатическом снижении функции вознаграждения
o Психофармакология (Berl.), 180 (2005), pp. 473-490
o
5.
o Ahmed et al., 2002
o SH Ahmed, PJ Kenny, GF Koob, A. Markou
o Нейробиологические данные для гедонистического аллостаза, связанные с эскалацией использования кокаина
o Nat. Neurosci., 5 (2002), стр. 625-626
o
6.
o Allison и др., 1999
o DB Allison, KR Fontaine, JE Manson, J. Stevens, TB VanItallie
o Ежегодная смертность, связанная с ожирением в Соединенных Штатах
o JAMA, 282 (1999), стр. 1530-1538
o
7.
o Американская психиатрическая ассоциация, 1994
o Американская психиатрическая ассоциация
o Диагностическое и статистическое руководство по психическим расстройствам
o (Четвертое издание) Американская психиатрическая ассоциация, Вашингтон, округ Колумбия (1994)
o
8.
o Angeles-Castellanos et al., 2007
o M. Angeles-Castellanos, J. Mendoza, C. Escobar
o Ограниченные графики кормления фазовый сдвиг суточных ритмов c-Fos и белка Per1 иммунореактивность в кортиколимбических областях у крыс
o Neuroscience, 144 (2007), стр. 344-355
o
9.
o Baicy et al., 2007
o К. Байси, Э. Д. Лондон, Дж. Монтероссо, М. Л. Вонг, Т. Делибаси, А. Шарма, Дж. Лицинио
o Лептинская замена изменяет реакцию мозга на пищевые сигналы у детей с дефицитом генетически лептина
o Proc. Natl. Акад. Sci. США, 104 (2007), стр. 18276-18279
o
10.
o Baldo et al., 2004
o Б. А. Бальдо, Л. Гуаль-Бонилья, К. Сиджапати, Р. А. Даниэль, К. Ф. Лэндри, А. Е. Келли
o Активация субпопуляции гипоталамических нейронов, содержащих orexin / hypocretin, с помощью GABAA-опосредованного ингибирования оболочки ядра accumbens, но не воздействия новой среды
o Eur. J. Neurosci., 19 (2004), стр. 376-386
o
11.
o Balleine и Dickinson, 2000
o BW Balleine, A. Dickinson
o Влияние поражений островковой коры на инструментальное кондиционирование: доказательства роли в памяти стимула
o J. Neurosci., 20 (2000), стр. 8954-8964
o
12.
o Barnard et al., 2009
o Н. Д. Барнард, Э. П. Благо, Т. Ричи, Дж. Коэн, Д. Д. Дженкинс, Г. Тернер-Макгриев, Л. Глоде, А. А. Грин, Х. Фердоузиан
o D2 дофаминовый рецептор Taq1A полиморфизм, масса тела и диетическое потребление в диабете типа 2
o Питание, 25 (2009), стр. 58-65
o
13.
o Бассо и Келли, 1999
o А.М. Бассо, А.Е. Келли
o Кормление, вызванное стимуляцией рецептора ГАМК (А) в оболочке окунающего ядра: региональное картирование и характеристика макронутриентов и предпочтений вкуса
o Behav. Neurosci., 113 (1999), стр. 324-336
o
14.
o Batterham et al., 2007
o RL Batterham, DH ffytche, JM Rosenthal, FO Zelaya, GJ Barker, DJ Withers, SC Williams
o Модуляция PYY областей коры головного мозга и гипоталамуса предсказывает поведение кормления у людей
o Природа, 450 (2007), стр. 106-109
o
15.
o Бакстер и Мюррей, 2002
М.Г. Бакстер, Е.А. Мюррей
o Амигдала и награда
o Nat. Rev. Neurosci., 3 (2002), стр. 563-573
o
16.
o Bean et al., 2008
o М. К. Бин, К. Стюарт, М. Е. Ольбриш
o Ожирение в Америке: последствия для клинических и медицинских психологов
o J. Clin. Psychol. Med. Настройки, 15 (2008), стр. 214-224
o
17.
o Beaver и др., 2006
o JD Beaver, AD Lawrence, J. van Ditzhuijzen, MH Davis, A. Woods, AJ Calder
o Индивидуальные различия в приведении вознаграждения предсказывают нервные реакции на изображения пищи
o J. Neurosci., 26 (2006), стр. 5160-5166
o
18.
o Белин и др., 2008
o Д. Белин, А. К. Мар, JW Далли, Т. В. Роббинс, Б. Дж. Эверитт
o Высокая импульсивность предсказывает переход к компульсивному кокаину
o Наука, 320 (2008), стр. 1352-1355
o
19.
o Berridge, 1996
o KC Berridge
o Награда за питание: Мозговые субстраты желаний и симпатий
o Neurosci. Biobehav. Rev., 20 (1996), стр. 1-25
o
20.
o Berridge, 2009
o KC Berridge
o «Liking» и «желаемые» награды за продукты питания: субстраты и роли мозга в нарушениях питания
o Physiol. Behav., 97 (2009), стр. 537-550
o
21.
o Björntorp и Rosmond, 2000
o P. Björntorp, R. Rosmond
o Ожирение и кортизол
o Питание, 16 (2000), стр. 924-936
o
22.
o Бланделл и Херберг, 1968
o JE Blundell, LJ Herberg
o Относительные эффекты дефицита питания и периода депривации на скорость электрической самостимуляции латерального гипоталамуса
o Природа, 219 (1968), стр. 627-628
o
23.
o Бут и др., 2008
o Бультон ML, RL Wilkenfeld, DL Pagnini, SL Booth, LA King
o Восприятие подростков с избыточным весом и ожирением: вес изучения мнения
o J. Paediatr. Здоровье детей, 44 (2008), стр. 248-252
o
24.
o Bragulat et al., 2010
o В. Брагулат, М. Джемиджич, К. Бруно, К. А. Кокс, Т. Талаваж, Р. В. Консидин, Д. А. Карекен
o Связанные с пищевыми продуктами запахи зондов с головным мозгом во время голода: экспериментальное исследование FMRI
o Ожирение, Серебряная весна, MD (2010)
o
25.
o Кабанак и Джонсон, 1983
o М. Кабанак, К.Г. Джонсон
o Анализ конфликта вкуса и холодного воздействия у крыс
o Physiol. Behav., 31 (1983), стр. 249-253
o
26.
o Campfield et al., 1995
o LA Campfield, FJ Smith, Y. Guisez, R. Devos, P. Burn
o Рекомбинантный мышиный OB-белок: доказательства периферического сигнала, связывающего ожирение и центральные нейронные сети
o Наука, 269 (1995), стр. 546-549
o
27.
o Cannon и Palmiter, 2003
o CM Cannon, RD Palmiter
o Вознаграждение без допамина
o J. Neurosci., 23 (2003), стр. 10827-10831
o
28.
o Карр и Саймон, 1984
o KD Carr, EJ Simon
o Потенцирование вознаграждения голодом опосредованно опиоидом
o Brain Res., 297 (1984), стр. 369-373
o
29.
o Центры по контролю и профилактике заболеваний, 2009
o Центры по контролю и профилактике заболеваний (2009). Тенденции ожирения в США (Атланта: Центры по контролю и профилактике заболеваний).
o
30.
o Colantuoni et al., 2001
o C. Colantuoni, J. Schwenker, J. McCarthy, P. Rada, B. Ladenheim, JL Cadet, GJ Schwartz, TH Moran, BG Hoebel
o Чрезмерное потребление сахара меняет связывание с дофаминовыми и му-опиоидными рецепторами в мозге
o Neuroreport, 12 (2001), стр. 3549-3552
o
31.
o Cornelius et al., 2010
o JR Корнелиус, М. Типпманн-Пейкерт, Н. Л. Слокумб, К. Ф. Фририхс, М. Х. Зильбер
o Нарушения контроля импульсов с использованием дофаминергических средств в синдроме беспокойных ног: исследование случай-контроль
o Сон, 33 (2010), стр. 81-87
o
32.
o Cornier et al., 2009
o М. А. Корнье, А. К. Зальцберг, Д. Д. В конце концов, Д. Х. Бессесен, Д. К. Рохас, Д. Р. Трегеллас
o Влияние перекармливания на реакцию нейронов на визуальные пищевые сигналы у тонких и уменьшенных лиц с ожирением
o PLoS ONE, 4 (2009), p. e6310 http://dx.doi.org/10.1371/journal.pone.0006310
o
33.
o Cottone и др., 2009
o P. Cottone, V. Sabino, M. Roberto, M. Bajo, L. Pockros, JB Frihauf, EM Fekete, L. Steardo, KC Rice, DE Grigoriadis et al.
o Подбор системы CRF опосредует темную сторону компульсивного питания
o Proc. Natl. Акад. Sci. США, 106 (2009), стр. 20016-20020
o
34.
o Дагер, 2009
o А. Дагер
o Нейробиология аппетита: голод как зависимость
o Int. J. Obes. (Lond.), 33 (Suppl 2) (2009), стр. S30-S33
o
35.
o Дагер и Роббинс, 2009
o A. Dagher, TW Robbins
o Личность, зависимость, дофамин: выводы о болезни Паркинсона
o Neuron, 61 (2009), стр. 502-510
o
36.
o Даллман, 2010
o М. Ф. Даллман
o Стресс-индуцированное ожирение и эмоциональная нервная система
o Тенденции эндокринола. Metab., 21 (2010), стр. 159-165
o
37.
o Dallman et al., 2003
М. Ф. Даллман, Н. Пекораро, С. Ф. Акана, С. Е. Ла Флер, Ф. Гомес, Х. Хоухьяр, М. Е. Белл, С. Бхатнагар, К. Д. Лаугеро, С. Манало
o Хронический стресс и ожирение: новый взгляд на «удобную пищу»
o Proc. Natl. Акад. Sci. США, 100 (2003), стр. 11696-11701
o
38.
o Dallman et al., 2006
o MF Dallman, NC Pecoraro, SE La Fleur, JP Warne, AB Ginsberg, SF Akana, KC Laugero, H. Houshyar, AM Strack, S. Bhatnagar, ME Bell
o Глюкокортикоиды, хронический стресс и ожирение
o Прог. Brain Res., 153 (2006), стр. 75-105
o
39.
o Davis et al., 2004
o C. Davis, S. Strachan, M. Berkson
o Чувствительность к награде: последствия для переедания и избыточного веса
o Аппетит, 42 (2004), стр. 131-138
o
40.
o Davis et al., 2008
o JF Davis, AL Tracy, JD Schurdak, MH Tschöp, JW Lipton, DJ Clegg, SC Benoit
o Воздействие повышенных уровней диетического жира ослабляет вознаграждение психостимулятора и оборот мезолимбического допамина у крысы
o Behav. Neurosci., 122 (2008), стр. 1257-1263
o
41.
o de Araujo et al., 2010
o IE de Araujo, X. Ren, JG Ferreira
o Метаболическое восприятие в дофаминовых системах мозга
o Результаты Пробл. Cell Differ., 52 (2010), стр. 69-86
o
42.
o Delin et al., 1997
o CR Delin, JM Watts, JL Saebel, PG Anderson
o Поведение пищи и опыт голода после операции желудочного шунтирования для болезненного ожирения
o Obes. Surg., 7 (1997), стр. 405-413
o
43.
o Deroche-Gamonet и др., 2004
o В. Дероше-Гамонет, Д. Белин, П. В. Пьяцца
o Свидетельство о склонности к наркомании у крысы
o Наука, 305 (2004), стр. 1014-1017
o
44.
o Девлин, 2007
o МД Девлин
o Есть ли место для ожирения в DSM-V?
o Int. J. Eat. Disord., 40 (Suppl) (2007), стр. S83-S88
o
45.
o Doknic et al., 2002
o M. Doknic, S. Pekic, M. Zarkovic, M. Medic-Stojanoska, C. Dieguez, F. Casanueva, V. Popovic
o Допаминергический тон и ожирение: понимание пролактиномы, обработанных бромокриптином
o Eur. J. Endocrinol., 147 (2002), стр. 77-84
o
46.
o Эверитт и Роббинс, 2005
o BJ Everitt, TW Robbins
o Нейронные системы арматуры для наркомании: от действий к привычкам к принуждению
o Nat. Neurosci., 8 (2005), стр. 1481-1489
o
47.
o Everitt et al., 2008
o BJ Everitt, D. Belin, D. Economidou, Y. Pelloux, JW Dalley, TW Robbins
o Обзор. Нейронные механизмы, лежащие в основе уязвимости для развития компульсивных привычек наркозависимости и зависимости
o Филос. Сделка R. Soc. Лонд. B Biol. Sci., 363 (2008), стр. 3125-3135
o
48.
o Farooqi et al., 2007
o И. С. Фаруки, Э. Буллмор, Дж. Кио, Дж. Гиллард, С. О'Рахилли, П. К. Флетчер
Лептин регулирует половые области и поведение человека
o Science, 317 (2007), p. 1355
o
49.
o Felsted и др., 2010
o JA Felsted, X. Ren, F. Chouinard-Decorte, DM Small
o Генетически определенные различия в реакции мозга на первичное продовольственное вознаграждение
o J. Neurosci., 30 (2010), стр. 2428-2432
o
50.
o Figlewicz et al., 2001
o DP Figlewicz, MS Higgins, SB Ng-Evans, PJ Гавел
o Лептин отменяет предпочтение предпочтения, обусловленного сахарозой, у крыс с ограниченными возможностями питания
o Physiol. Behav., 73 (2001), стр. 229-234
o
51.
o Figlewicz et al., 2003
o DP Figlewicz, SB Evans, J. Murphy, M. Hoen, DG Baskin
o Экспрессия рецепторов для инсулина и лептина в брюшной тегментальной области / субстанция нигра (VTA / SN) крысы
o Brain Res., 964 (2003), стр. 107-115
o
52.
o Fineberg et al., 2010
О. А. Файнберг, М. Н. Потенца, С. Р. Чемберлен, Г. А. Берлин, Л. Мензис, А. Бечара, Б. Дж. Саакян, Т. В. Роббинс, Э. Т. Буллмор, Э. Холландер
o Прощупывание компульсивного и импульсивного поведения, от моделей животных до эндофенотипов: обзор повествования
o Нейропсихофармакология, 35 (2010), с. 591-604
o
53.
o Finkelstein et al., 2005
o Е. А. Финкельштейн, К. Дж. Рум, К. М. Коса
o Экономические причины и последствия ожирения
o Annu. Rev. Public Health, 26 (2005), стр. 239-257
o
54.
o Flegal и др., 2010
o KM Flegal, MD Carroll, CL Ogden, LR Curtin
o Распространенность и тенденции ожирения среди взрослых американцев, 1999-2008
o JAMA, 303 (2010), стр. 235-241
o
55.
o Foo and Mason, 2005
o H. Foo, P. Mason
o Подавление сенсора во время кормления
o Proc. Natl. Акад. Sci. США, 102 (2005), стр. 16865-16869
o
56.
o Франкен и Мурис, 2005
o И. Х. Франкен, П. Мурис
o Индивидуальные различия в чувствительности к вознаграждению связаны с потреблением пищи и относительной массой тела у здоровых женщин
o Аппетит, 45 (2005), стр. 198-201
o
57.
o Friedman et al., 2011
o A. Friedman, E. Lax, Y. Dikshtein, L. Abraham, Y. Flaumenhaft, E. Sudai, M. Ben-Tzion, G. Yadid
o Электрическая стимуляция латерального хаменула оказывает ингибирующее действие на сахарозное самоуправление
o Нейрофармакология, 60 (2011), стр. 381-387
o
58.
o Fulton et al., 2000
С. Фултон, Б. Вудсайд, П. Шизгал
o Модуляция схемы вознаграждения мозга лептином
o Наука, 287 (2000), стр. 125-128
o
59.
o Fulton et al., 2006
С. Фултон, П. Писсиос, Р. П. Манчон, Л. Стайлз, Л. Франк, Е. Н. Потос, Э. Маратос-Флиер, Дж. С. Флиер
o Лептинская регуляция пути допамина мезоакбенов
o Neuron, 51 (2006), стр. 811-822
o
60.
o Гао и Хорват, 2007
o Q. Gao, TL Horvath
o Нейробиология питания и затрат энергии
o Annu. Rev. Neurosci., 30 (2007), стр. 367-398
o
61.
o Gautier et al., 2000
o JF Gautier, K. Chen, AD Salbe, D. Bandy, RE Pratley, M. Heiman, E. Ravussin, EM Reiman, PA Tataranni
o Дифференциальные реакции головного мозга на насыщение у тучных и худощавых мужчин
o Диабет, 49 (2000), стр. 838-846
o
62.
o Гейгер и др., 2008
o BM Geiger, GG Behr, LE Frank, AD Caldera-Siu, MC Beinfeld, EG Kokkotou, EN Pothos
o Доказательства дефектного мезолимбического дофаминового экзоцитоза у крыс, подверженных ожирению
o FASEB J., 22 (2008), стр. 2740-2746
o
63.
o Гейгер и др., 2009
o Б. М. Гейгер, М. Хабурджак, Н. М. Авена, М. К. Мойер, Б. Г. Хобель, Е. Н. Потос
o Недостатки нейропередачи мезолимбического дофамина в рационе диетического ожирения
o Neuroscience, 159 (2009), стр. 1193-1199
o
64.
o Ghitza et al., 2006
o UE Ghitza, SM Grey, DH Epstein, KC Rice, Y. Shaham
o Нейропсихофармакология
o Анксиогенный препарат йохимбин восстанавливает вкусную пищу, ищущую в модели рецидива крысы: роль рецепторов CRF (1), 33 (2006), pp. 2188-2196
o
65.
o Gluck et al., 2004
o М Г Глюк, А. Гелиберт, Дж. Хунг, Э. Яхав
o Кортизол, голод и желание выпивать едят после теста на холодное стресс у женщин с ожирением с расстройством пищевого поведения
o Психосома. Med., 66 (2004), стр. 876-881
o
66.
o Голдстоун и др., 2009
О. А. Голдстоун, К. Г. Прехтль де Эрнандес, Дж. Д. Бивер, К. Мухаммед, К. Крозе, Г. Белл, Г. Дуригель, Э. Хьюз, А. Д. Вальдман, Г. Фрост, Д. Д. Белл
o Пост смещает системы вознаграждения мозга на высококалорийные продукты
o Eur. J. Neurosci., 30 (2009), стр. 1625-1635
o
67.
o Halaas и др., 1995
o JL Halaas, KS Gajiwala, M. Maffei, SL Cohen, BT Chait, D. Rabinowitz, RL Lallone, SK Burley, JM Friedman
o Снижающие вес эффекты плазменного белка, кодируемого ожирением гена
o Наука, 269 (1995), стр. 543-546
o
68.
o Hamilton et al., 1995
o Б. С. Гамильтон, Д. Палья, А. Я. Кван, М. Дейтель
o Повышенная экспрессия мРНК с ожирением в жировых клетках сальса от людей с ожирением
o Nat. Med., 1 (1995), стр. 953-956
o
69.
o Эрнандес и Хебель, 1988
Л. Л. Эрнандес, Б. Г. Хебель
o Вознаграждение за еду и кокаин увеличивают внеклеточный допамин в прилежащем ядре, измеряемый микродиализом
o Life Sci., 42 (1988), стр. 1705-1712
o
70.
o Hill et al., 2003
o JO Hill, HR Wyatt, GW Reed, JC Peters
o Ожирение и окружающая среда: куда мы идем?
o Наука, 299 (2003), стр. 853-855
o
71.
o Hoebel, 1969
o BG Hoebel
o Кормление и самостимуляция
o Ann. NY Acad. Sci., 157 (1969), стр. 758-778
o
72.
o Хоебель и Балагура, 1967
o BG Hoebel, S. Balagura
o Самостимуляция бокового гипоталамуса, модифицированного инсулином и глюкагоном
o Physiol. Behav., 2 (1967), стр. 337-340
o
73.
o Hoebel и Teitelbaum, 1962
o BG Hoebel, P. Teitelbaum
o Гипоталамический контроль питания и самостимуляции
o Наука, 135 (1962), стр. 375-377
o
74.
o Hoebel и Thompson, 1969
o BG Hoebel, RD Thompson
o Отвращение к латеральной стимуляции гипоталамуса, вызванное внутрижелудочным питанием или ожирением
o J. Comp. Physiol. Psychol., 68 (1969), стр. 536-543
o
75.
o Hofmann et al., 2010
o W. Hofmann, GM van Koningsbruggen, W. Stroebe, S. Ramanathan, H. Aarts
o Как радость разворачивается: гедонистические ответы на соблазнительную пищу
o Психол. Sci., 21 (2010), стр. 1863-1870
o
76.
Голландия и Галлахер, 2004
o ПК Голландия, М. Галлахер
o Амигдала-фронтальные взаимодействия и ожидаемое вознаграждение
o Curr. ОПИН. Neurobiol., 14 (2004), стр. 148-155
o
77.
o Hollander et al., 2010
o JA Hollander, HI Im, AL Amelio, J. Kocerha, P. Bali, Q. Lu, D. Willoughby, C. Wahlestedt, MD Conkright, PJ Kenny
o Струйная микроРНК контролирует потребление кокаина через сигнализацию CREB
o Природа, 466 (2010), стр. 197-202
o
78.
o Hommel et al., 2006
o JD Hommel, R. Trinko, RM Sears, D. Georgescu, ZW Liu, XB Gao, JJ Thurmon, M. Marinelli, RJ DiLeone
o Передача сигналов рецептора Лептина в дофаминовых нейронах среднего мозга регулирует питание
o Neuron, 51 (2006), стр. 801-810
o
79.
o Imaizumi et al., 2001
o M. Imaizumi, M. Takeda, A. Suzuki, S. Sawano, T. Fushiki
o Предпочтение для жирной пищи у мышей: Жареный картофель по сравнению с отварным картофелем
o Аппетит, 36 (2001), стр. 237-238
o
80.
o Jerlhag et al., 2006
o E. Jerlhag, E. Egecioglu, SL Dickson, M. Andersson, L. Svensson, JA Engel
o Грелин стимулирует локомоторную активность и обводнение допамина через центральные холинергические системы у мышей: последствия для его участия в мозговой награде
o наркоман. Biol., 11 (2006), стр. 45-54
o
81.
o Jerlhag et al., 2007
o E. Jerlhag, E. Egecioglu, SL Dickson, A. Douhan, L. Svensson, JA Engel
o Администрация Грелина в тегментарные области стимулирует локомоторную активность и увеличивает внеклеточную концентрацию дофамина в ядре accumbens
o наркоман. Biol., 12 (2007), стр. 6-16
o
82.
o Jhou et al., 2009
o TC Jhou, HL Fields, MG Baxter, CB Saper, PC Holland
o Ростромедиальное тегментальное ядро (RMTg), ГАМКергический афферент к нейронам дофамина среднего мозга, кодирует аверсивные раздражители и подавляет двигательные реакции
o Neuron, 61 (2009), стр. 786-800
o
83.
Джонсон и Кенни, 2010
o PM Johnson, PJ Kenny
o Дофаминовые D2-рецепторы в зависимости от склонности к дисфункции и компульсивное питание у тучных крыс
o Nat. Neurosci., 13 (2010), стр. 635-641
o
84.
o Johnson et al., 1996
o PI Johnson, MA Parente, JR Stellar
o NMDA-индуцированные поражения ядра accumbens или вентрального паллидума повышают полезность пищи для лишенных крыс
o Brain Res., 722 (1996), стр. 109-117
o
85.
o Jönsson et al., 1999
o Е.Г. Йонссон, М.М. Нётен, Ф. Грюнаге, Л. Фард, Я. Накашима, П.Пеппинг, Г.К.Седваль
o Полиморфизмы в гене рецептора DOPNUMX дофамина и их связь с плотностью полосатого дофаминового рецептора здоровых добровольцев
o Mol. Психиатрия, 4 (1999), стр. 290-296
o
86.
o Kalarchian et al., 2002
o М. А. Каларчан, М. Д. Маркус, Г. Т. Уилсон, Е. В. Лабуви, Р. Е. Бролин, Л. Б. Ламарка
o Переедание пищи у пациентов с обходным желудочом при длительном наблюдении
o Obes. Surg., 12 (2002), стр. 270-275
o
87.
o Kandiah et al., 2006
o J. Kandiah, M. Yake, J. Jones, M. Meyer
o Стресс влияет на аппетит и удобство предпочтений в еде в колледжах
o Nutr. Res., 26 (2006), стр. 118-123
o
88.
o Karhunen et al., 1997
o Ж.Ж. Кархунен, Р.И. Лаплалайнен, Е.Я. Ваннинен, Дж. Т. Куйкка, М.И. Ууситупа
o Региональный церебральный кровоток во время питания у женщин с ожирением и нормальной массой тела
o Мозг, 120 (1997), стр. 1675-1684
o
89.
o Kasanetz et al., 2010
o Ф. Касанец, В. Дероше-Гамонет, Н. Берсон, Э. Баладо, М. Лафуркаде, О. Манцони, П. В. Пьяцца
o Переход к наркомании связан с постоянным нарушением синаптической пластичности
o Наука, 328 (2010), стр. 1709-1712
o
90.
o Kelley et al., 1996
o AE Kelley, EP Bless, CJ Swanson
o Исследование влияния антагонистов опиатов, влитых в ядро, принимающее при кормлении и сахарозе, выпитое у крыс
o J. Pharmacol. Exp. Ther., 278 (1996), стр. 1499-1507
o
91.
o Kelley et al., 2005
o AE Kelley, BA Baldo, WE Pratt, MJ Will
o Кортикотрайно-гипоталамическая схема и пищевая мотивация: интеграция энергии, действия и вознаграждения
o Physiol. Behav., 86 (2005), стр. 773-795
o
92.
o Kenny et al., 2006
o PJ Kenny, SA Chen, O. Kitamura, A. Markou, GF Koob
o Условный отбор потребляет потребление героина и снижает чувствительность к награде
o J. Neurosci., 26 (2006), стр. 5894-5900
o
93.
o Kim et al., 2010
o KS Kim, YR Yoon, HJ Lee, S. Yoon, SY Kim, SW Shin, JJ An, MS Kim, SY Choi, W. Sun, JH Baik
o Повышенная гипоталамическая сигнализация лептина у мышей, у которых отсутствуют дофаминовые D2-рецепторы
o J. Biol. Chem., 285 (2010), стр. 8905-8917
o
94.
o Klein et al., 2007
o TA Klein, J. Neumann, M. Reuter, J. Hennig, DY von Cramon, M. Ullsperger
o Генетически определенные различия в обучении от ошибок
o Наука, 318 (2007), стр. 1642-1645
o
95.
o Kojima и др., 1999
o M. Kojima, H. Hosoda, Y. Date, M. Nakazato, H. Matsuo, K. Kangawa
o Грелин - это высвобождающий гормон ацилированный пептид из желудка
o Природа, 402 (1999), стр. 656-660
o
96.
o Kok et al., 2006
o P. Kok, F. Roelfsema, M. Frölich, J. van Pelt, AE Meinders, H. Pijl
o Активация дофаминовых рецепторов D2 снижает циркадные концентрации лептина у женщин с ожирением
o J. Clin. Эндокринол. Metab., 91 (2006), стр. 3236-3240
o
97.
o Koob, 2010
o GF Koob
o Роль CRF и связанных с CRF пептидов в темной стороне зависимости
o Brain Res., 1314 (2010), стр. 3-14
o
98.
o Koob и Le Moal, 2008
o Г. Ф. Кооб, М. Ле Моаль
o Наркомания и противовоспалительная система мозга
o Annu. Rev. Psychol., 59 (2008), стр. 29-53
o
99.
o Koob и Volkow, 2010
o Г. Ф. Кооб, Н. Д. Волков
o Нейроциркуляция зависимости
o Нейропсихофармакология, 35 (2010), с. 217-238
o
100.
o Koob и Zorrilla, 2010
o GF Koob, EP Zorrilla
o Нейробиологические механизмы зависимости: Фокус на кортикотропин-освобождающий фактор
o Curr. ОПИН. Investig. Наркотики, 11 (2010), стр. 63-71
o
101.
o Kringelbach et al., 2003
o ML Kringelbach, J. O'Doherty, ET Rolls, C. Andrews
o Активация человеческой орбитофронтальной коры до жидкого пищевого стимула коррелирует с ее субъективной приятностью
o Cereb. Cortex, 13 (2003), стр. 1064-1071
o
102.
o Krügel и др., 2003
o U. Krügel, T. Schraft, H. Kittner, W. Kiess, P. Illes
o Освобождение базального и кормящего дофамина в ядре крысы упирается в лептин
o Eur. J. Pharmacol., 482 (2003), pp. 185-187
o
103.
o la Fleur, 2006
o SE la Fleur
o Влияние глюкокортикоидов на поведение кормления у крыс
o Physiol. Behav., 89 (2006), стр. 110-114
o
104.
o LaBar и др., 2001
o KS LaBar, DR Gitelman, TB Parrish, YH Kim, AC Nobre, MM Mesulam
o Голод избирательно модулирует кортиколимбическую активацию для пищевых стимулов у людей
o Behav. Neurosci., 115 (2001), стр. 493-500
o
105.
o Latagliata et al., 2010
o EC Latagliata, E. Patrono, S. Puglisi-Allegra, R. Ventura
o Поиск пищи, несмотря на вредные последствия, находится под префронтальным корковым норадренергическим контролем
o BMC Neurosci., 11 (2010), p. 15
o
106.
o Lawford et al., 2000
o BR Lawford, RM Young, EP Noble, J. Sargent, J. Rowell, S. Shadforth, X. Zhang, T. Ritchie
o аллель и опиоидная зависимость D (2) дофаминового рецептора A (1): связь с употреблением героина и ответ на лечение метадоном
o Am. J. Med. Genet., 96 (2000), стр. 592-598
o
107.
o Leinninger et al., 2009
o Г. М. Лейнингер, Ю. Х. Йо, Р. Л. Лэшан, Г. В. Луис, Х. Янг, Дж. Г. Баррера, Х. Уилсон, Д. М. Опланд, М. А. Фаузи, Ю. Гонг и др.
o Лептин действует через лептин-рецепторные латеральные гипоталамические нейроны для модуляции мезолимбической системы дофамина и подавления питания
o Cell Metab., 10 (2009), стр. 89-98
o
108.
o Lenoir и др., 2007
o M. Lenoir, F. Serre, L. Cantin, SH Ahmed
o Интенсивная сладость превосходит награду кокаина
o PLoS ONE, 2 (2007), p. e698 http://dx.doi.org/10.1371/journal.pone.0000698
o
109.
o Leshan et al., 2010
o RL Leshan, DM Opland, GW Louis, GM Leinninger, CM Patterson, CJ Rhodes, H. Münzberg, MG Myers Jr.
o Нейроны рецепторов нейронов вентральной тегментальной области специфически проектируют и регулируют транскрипционные нейроны, регулируемые кокаином и амфетамином расширенной центральной миндалины
o J. Neurosci., 30 (2010), стр. 5713-5723
o
110.
o Louis et al., 2010
o GW Louis, GM Leinninger, CJ Rhodes, MG Myers Jr.
o Прямая иннервация и модуляция нейреонов orexin латеральными гипоталамическими нейронами LepRb
o J. Neurosci., 30 (2010), стр. 11278-11287
o
111.
o Luppino et al., 2010
o FS Luppino, LM de Wit, PF Bouvy, T. Stijnen, P. Cuijpers, BW Penninx, FG Zitman
o Избыточный вес, ожирение и депрессия: систематический обзор и метаанализ продольных исследований
o Arch. Gen. Psychiatry, 67 (2010), стр. 220-229
o
112.
o Люттер и Нестлер, 2009
o M. Lutter, EJ Nestler
o Гомеостатические и гедонические сигналы взаимодействуют в регуляции приема пищи
o J. Nutr., 139 (2009), стр. 629-632
o
113.
o Махт и Мюллер, 2007
o M. Macht, J. Mueller
o Непосредственные эффекты шоколада на экспериментально индуцированные состояния настроения
o Аппетит, 49 (2007), стр. 667-674
o
114.
o Мальдонадо-Иризарри и Келли, 1995
o CS Мальдонадо-Иризарри, А.Е. Келли
o Экситотоксические поражения ядрых и оболочечных субрегионов ядра accumbens дифференциально нарушают регуляцию массы тела и двигательную активность у крыс
o Brain Res. Bull., 38 (1995), стр. 551-559
o
115.
o Maldonado-Irizarry и др., 1995
o CS Мальдонадо-Иризарри, CJ Swanson, AE Kelley
o Глютаматные рецепторы в ядре accumbens shell контролируют поведение кормления через боковой гипоталамус
o J. Neurosci., 15 (1995), стр. 6779-6788
o
116.
o Malik et al., 2008
С. Малик, Ф. МакГлон, Д. Бедросян, А. Дагер
o Грелин модулирует деятельность мозга в областях, которые контролируют аппетитное поведение
o Cell Metab., 7 (2008), стр. 400-409
o
117.
o Man et al., 2009
o MS Man, HF Clarke, AC Roberts
o Роль орбитофронтальной коры и медиального стриатума в регуляции препотентных ответов на продовольственные награды
o Cereb. Cortex, 19 (2009), стр. 899-906
o
118.
o Маргулы и старые, 1962
o DL Margules, J. Olds
o Идентичные системы «кормления» и «награждения» в латеральном гипоталамусе крыс
o Наука, 135 (1962), стр. 374-375
o
119.
o Марку и Фрэнк, 1987
o А. Марку, Р. А. Франк
o Влияние размещения операндов и электродов на функции ответа продолжительности продолжительности самостимуляции
o Physiol. Behav., 41 (1987), стр. 303-308
o
120.
o Марку и Кооб, 1991
o A. Markou, GF Koob
o Посткокаиновая анхедония. Животная модель вывода кокаина
o Нейропсихофармакология, 4 (1991), с. 17-26
o
121.
o Mastronardi et al., 2001
o CA Mastronardi, WH Yu, VK Srivastava, WL Dees, SM McCann
o Липополисахарид-индуцированное высвобождение лептина контролируется с помощью нейронов
o Proc. Natl. Акад. Sci. США, 98 (2001), стр. 14720-14725
o
122.
o Matheny et al., 2011
o M. Matheny, A. Shapiro, N. Tumer, PJ Scarpace
o Специфическая для региона диета и индуцированная лептином резистентность к лептину включают вентральную тегментальную область у крыс
o Нейрофармакология (2011) http://dx.doi.org/10.1016/j.neuropharm.2010.11.002 в печати. Опубликован онлайн Ноябрь 5, 2010
o
123.
o Мацумото и Хикосака, 2007
o М. Мацумото, О. Хикосака
o Боковые habenula как источник отрицательных сигналов вознаграждения в дофаминовых нейронах
o Природа, 447 (2007), стр. 1111-1115
o
124.
o Morton et al., 2006
o GJ Morton, DE Cummings, DG Baskin, GS Barsh, MW Schwartz
o Контроль центральной нервной системы потребления пищи и массы тела
o Природа, 443 (2006), стр. 289-295
o
125.
o Mount и Hoebel, 1967
o G. Mount, BG Hoebel
o Боковая гипостимулятивная самостимуляция: Самоопределяющийся порог, увеличиваемый при приеме пищи
o Psychon. Sci., 9 (1967), стр. 265-266
o
126.
o Nair и др., 2011
О. С. Наир, Б. М. Наварр, К. Чифани, Л. Л. Пикенс, Дж. М. Боссерт, Ю. Шахам
o Роль дорсальной медиальной префронтальной коры головного мозга дофамина D1-семейных рецепторов при рецидиве с высоким содержанием жиров пищи, вызванной анксиогенным лекарством йохимбином
o Нейропсихофармакология, 36 (2011), с. 497-510
o
127.
o Nakazato et al., 2001
М. Наказато, Н. Мураками, Ю. Дай, М. Коджима, Х. Мацуо, К. Кангава, С. Мацукура
o Роль грелина в центральной регуляции питания
o Природа, 409 (2001), стр. 194-198
o
128.
o Накви и Бечара, 2009
o NH Naqvi, A. Bechara
o Скрытый остров зависимости: изоляция
o Тенденции Neurosci., 32 (2009), стр. 56-67
o
129.
o Невилл и др., 2004
o MJ Neville, EC Johnstone, RT Walton
o Идентификация и характеристика ANKK1: ген новой киназы, тесно связанный с DRD2 на хромосомной полосе 11q23.1
o Хум. Mutat., 23 (2004), стр. 540-545
o
130.
o Nirenberg и Waters, 2006
o MJ Nirenberg, C. Waters
o Компульсивное питание и увеличение веса, связанное с использованием агониста дофамина
o Mov. Disord., 21 (2006), стр. 524-529
o
131.
o Благородный, 2000
o EP Noble
o Наркомания и процесс ее вознаграждения через полиморфизмы гена рецептора дофамина D2: обзор
o Eur. Психиатрия, 15 (2000), стр. 79-89
o
132.
o Noble et al., 1993
o EP Noble, K. Blum, ME Khalsa, T. Ritchie, A. Montgomery, RC Wood, RJ Fitch, T. Ozkaragoz, PJ Sheridan, MD Anglin et al.
o Аллельная ассоциация гена рецептора дофамина D2 с кокаиновой зависимостью
o Наркомания зависит., 33 (1993), стр. 271-285
o
133.
o Noble et al., 2000
o EP Noble, X. Zhang, TL Ritchie, RS Sparkes
o Гаплотипы в локусе DRD2 и сильном алкоголизме
o Am. J. Med. Genet., 96 (2000), стр. 622-631
o
134.
o О'Коннор и др., 2008 г.
o Д. Б. О'Коннор, Ф. Джонс, М. Коннер, Б. Макмиллан, Э. Фергюсон
o Последствия ежедневных неприятностей и стиля питания при поедании
o Health Psychol., 27 (1, Suppl) (2008), стр. S20-S31
o
135.
o О'Догерти и др., 2002 г.
o JP O'Doherty, R. Deichmann, HD Critchley, RJ Dolan
o Нейронные реакции во время предвкушения вознаграждения за первичный вкус
o Neuron, 33 (2002), стр. 815-826
o
136.
о О'Рахилли, 2009
о С. О'Рахилли
o Генетика человека освещает пути метаболической болезни
o Природа, 462 (2009), стр. 307-314
o
137.
o Освальд и др., 2010
o К. Д. Освальд, Д. Л. Мурдо, В. Л. Кинг, М. М. Богьяно
o Мотивация для вкусной пищи, несмотря на последствия в животной модели выпивки
o Int. J. Eat. Disord. (2010) http://dx.doi.org/10.1002/eat.20808 в прессе. Опубликован онлайн Февраль 22, 2010
o
138.
o Парк и Карр, 1998
o TH Park, KD Carr
o Нейроанатомические закономерности фос-подобной иммунореактивности, индуцированные приемлемой пищей и питательной средой у крыс, обработанных физиологическим раствором и налтрексоном
o Brain Res., 805 (1998), стр. 169-180
o
139.
o Peciña и Berridge, 2005
o S. Peciña, KC Berridge
o Гедоническое горячее пятно в оболочке окунающего ядра: где му-опиоиды вызывают повышенное гедоническое воздействие сладости?
o J. Neurosci., 25 (2005), стр. 11777-11786
o
140.
o Peciña et al., 2006a
o S. Peciña, J. Schulkin, KC Berridge
o Nucleus accumbens кортикотропин-освобождающий фактор увеличивает стимулируемую кией мотивацию для получения сахарозы: Парадоксальные положительные стимулирующие эффекты в стрессе?
o BMC Biol., 4 (2006), p. 8
o
141.
o Peciña et al., 2006b
o S. Peciña, KS Smith, KC Berridge
o Гедонические горячие точки в мозге
o Neuroscientist, 12 (2006), стр. 500-511
o
142.
o Pecoraro et al., 2004
o Н. Пекораро, Ф. Рейес, Ф. Гомес, А. Бхаргава, М. Ф. Даллман
o Хронический стресс способствует вкусовой кормлению, что снижает признаки стресса: эффекты прямой и обратной связи от хронического стресса
o Эндокринология, 145 (2004), стр. 3754-3762
o
143.
o Pelchat et al., 2004
М. Л. Пельчат, А. Джонсон, Р. Чан, Дж. Вальдес, Д. Д. Рагланд
o Изображения желания: Активация пищи во время МРТ
o Neuroimage, 23 (2004), стр. 1486-1493
o
144.
o Pelleymounter et al., 1995
o М. А. Пеллемунтер, М. Дж. Каллен, М. Б. Бейкер, Р. Хехт, Д. Уинтерс, Т. Бун, Ф. Коллинз
o Эффекты ожирения продукта гена на регуляцию массы тела у мышей ob / ob
o Наука, 269 (1995), стр. 540-543
o
145.
o Pelloux et al., 2007
o Y. Pelloux, BJ Everitt, A. Dickinson
o Компульсивный поиск наркотиков у крыс под наказанием: последствия употребления наркотиков
o Психофармакология (Berl.), 194 (2007), pp. 127-137
o
146.
o Perello et al., 2010
М. Перэлло, И. Саката, С. Бирнбаум, Ч. Чанг, С. Осборн-Лоуренс, С. А. Ровинский, Дж. Волошин, М. Янагисава, М. Люттер, Д. М. Зигман
o Грелин повышает полезную ценность диеты с высоким содержанием жиров в зависимости от orexin
o Biol. Психиатрия, 67 (2010), стр. 880-886
o
147.
o Петрович и др., 2009
o Г. Д. Петрович, К. А. Росс, П. Моди, П. К. Холланд, М. Галлахер
o Центральный, но не базолатеральный, миндалина имеет решающее значение для контроля кормления с помощью аверсивных выученных сигналов
o J. Neurosci., 29 (2009), стр. 15205-15212
o
148.
o Pfaffly и др., 2010
o J. Pfaffly, M. Michaelides, GJ Wang, JE Pessin, ND Volkow, PK Thanos
o Лептин увеличивает связывание рецептора D2 стриалального дофамина у мышей с дефицитом лептина (ob / ob)
o Synapse, 64 (2010), стр. 503-510
o
149.
o Puhl et al., 2008
o RM Puhl, CA Moss-Racusin, MB Schwartz, KD Brownell
o Стигматизация веса и снижение смещения: перспективы избыточного веса и ожирения взрослых
o Здравоохранение. Res., 23 (2008), стр. 347-358
o
150.
o Rada и др., 2010
o P. Rada, ME Bocarsly, JR Barson, BG Hoebel, SF Leibowitz
o Уменьшение допамина accumbens у крыс Sprague-Dawley, склонных к перееданию богатой жиром диеты
o Physiol. Behav., 101 (2010), стр. 394-400
o
151.
o Ritchie и Noble, 2003
o T. Ritchie, EP Noble
o Ассоциация семи полиморфизмов гена рецептора D2-дофамина с характеристиками связывания с рецепторами мозга
o Нейрохим. Res., 28 (2003), стр. 73-82
o
152.
o Roberto et al., 2010
o M. Roberto, MT Cruz, NW Gilpin, V. Sabino, P. Schweitzer, M. Bajo, P. Cottone, SG Madamba, DG Stouffer, EP Zorrilla et al.
o Освобождение гамма-аминомасляной кислоты, индуцируемое высвобождением кортикотропина, играет ключевую роль в зависимости от алкоголя
o Biol. Психиатрия, 67 (2010), стр. 831-839
o
153.
o Roitman et al., 2004
o М. Ф. Ройтман, Г. Д. Штубер, П. Э. Филлипс, Р. М. Вайтман, Р. М. Карелли
o Допамин работает как субсекундный модулятор для поиска пищи
o J. Neurosci., 24 (2004), стр. 1265-1271
o
154.
o Roitman et al., 2008
o М. Ф. Ройтман, Р. А. Уилер, Р. М. Вайтман, Р. М. Карелли
o Химические реакции в реальном времени в ядре accumbens дифференцируют полезные и отвратительные стимулы
o Nat. Neurosci., 11 (2008), стр. 1376-1377
o
155.
o Rolls, 2008
o ET Rolls
o Функции ортофронтальной и предгенной коры головного мозга во вкусе, обонянии, аппетите и эмоциях
o Acta Physiol. Хунг., 95 (2008), стр. 131-164
o
156.
o Rolls, 2010
o ET Rolls
o Обработка вкусовых, обонятельных и пищевых текстур в мозге и ожирение
o Int. J. Obes. (Lond.) (2010) http://dx.doi.org/10.1038/ijo.2010.155 в прессе. Опубликован онлайн Август 3, 2010
o
157.
o Rolls et al., 1983
o ET Rolls, BJ Rolls, EA Rowe
o Сенсорно-специфическое и мотивационное насыщение для зрения и вкуса пищи и воды у человека
o Physiol. Behav., 30 (1983), стр. 185-192
o
158.
o Roseberry et al., 2007
o AG Roseberry, T. Painter, GP Mark, JT Williams
o Уменьшение везикулярных запасов соматодендритных дофаминов у мышей с дефицитом лептина
o J. Neurosci., 27 (2007), стр. 7021-7027
o
159.
o Rothemund et al., 2007
o Y. Rothemund, C. Preuschhof, G. Bohner, HC Bauknecht, R. Klingebiel, H. Flor, BF Klapp
o Дифференциальная активация спинного полосатого тела высококалорийными визуальными пищевыми стимулами у лиц с ожирением
o Neuroimage, 37 (2007), стр. 410-421
o
160.
o Salas и др., 2010
o Р. Салас, П. Болдуин, М. де Бьяси, PR Монтегю
o Ответы BOLD на ошибки прогноза отрицательной награды в человеческом habenula
o Фронт. Hum. Neurosci., 4 (2010), p. 36
o
161.
o Saper et al., 2002
o CB Saper, TC Chou, JK Elmquist
o Потребность в корме: гомеостатический и гедонический контроль за едой
o Neuron, 36 (2002), стр. 199-211
o
162.
o Сондерс, 2001
o Р. Сондерс
o Компульсивное питание и хирургическое шунтирование желудка: Что же такое голод?
o Obes. Surg., 11 (2001), стр. 757-761
o
163.
o Scarpace et al., 2010
o PJ Scarpace, M. Matheny, Y. Zhang
o Колесная передача исключает высокий уровень жировых отложений и усиливает сигнализацию лептина в брюшной тегментальной области
o Physiol. Behav., 100 (2010), стр. 173-179
o
164.
o Schiltz et al., 2007
o CA Schiltz, QZ Bremer, CF Landry, AE Kelley
o Ключи, связанные с питанием, изменяют функциональную связность передних мозгов, как оценивается с немедленным ранним выражением гена и проэнкефалина
o BMC Biol., 5 (2007), p. 16
o
165.
o Schur et al., 2009
o EA Schur, NM Kleinhans, J. Goldberg, D. Buchwald, MW Schwartz, K. Maravilla
o Активация в области регулирования энергии мозга и центров вознаграждения с помощью пищевых сигналов зависит от выбора визуального стимула
o Int. J. Obes. (Lond.), 33 (2009), стр. 653-661
o
166.
o Sclafani et al., 1998
o A. Sclafani, RJ Bodnar, AR Delamater
o Фармакология пищевых условных предпочтений
o Аппетит, 31 (1998), стр. 406
o
167.
o Sescousse et al., 2010
o G. Sescousse, J. Redouté, JC Dreher
o Архитектура кодирования ценности вознаграждения в человеческой орбитофронтальной коре
o J. Neurosci., 30 (2010), стр. 13095-13104
o
168.
o Shomaker и др., 2010
o LB Shomaker, M. Tanofsky-Kraff, JM Zocca, A. Courville, M. Kozlosky, KM Columbo, LE Wolkoff, SM Brady, MK Crocker, AH Ali et al.
o Питание при отсутствии голода у подростков: прием после еды большого количества по сравнению с таковой после стандартизированной еды
o Am. J. Clin. Nutr., 92 (2010), стр. 697-703
o
169.
o Simmons et al., 2005
o WK Simmons, A. Martin, LW Barsalou
o Фотографии аппетитных продуктов активируют вкусные коры для вкуса и вознаграждения
o Cereb. Cortex, 15 (2005), стр. 1602-1608
o
170.
o Маленький, 2010
o DM Small
o Вкусное представление в человеческой изоляции
o Мозговая структура. Функц., 214 (2010), стр. 551-561
o
171.
o Small et al., 2003
o DM Small, M. Jones-Gotman, A. Dagher
o Подавление, индуцированное подачей допамина в дорсальном полосатом теле, коррелирует с оценками вкуса пищи у здоровых добровольцев-добровольцев
o Neuroimage, 19 (2003), стр. 1709-1715
o
172.
o Смит и Берридж, 2007
o К. С. Смит, К. К. Берридж
o Опиоидный лимбический контур для вознаграждения: взаимодействие между гедоническими горячими точками ядра accumbens и вентральным паллидом
o J. Neurosci., 27 (2007), стр. 1594-1605
o
173.
o Söderpalm и Berridge, 2000
o AH Söderpalm, KC Berridge
o Потребление пищи после диазепама, морфина или мусцимола: микроинъекции В оболочке ядра
o Фармакол. Biochem. Behav., 66 (2000), стр. 429-434
o
174.
o Stice et al., 2008a
o E. Stice, S. Spoor, C. Bohon, DM Small
o Связь между ожирением и притуплением полосатого отклика на питание модерируется аллелем TaqIA A1
o Наука, 322 (2008), стр. 449-452
o
175.
o Stice et al., 2008b
o E. Stice, S. Spoor, C. Bohon, MG Veldhuizen, DM Small
o Отношение вознаграждения от приема пищи и ожидаемого приема пищи к ожирению: исследование функционального магнитного резонанса
o J. Abnorm. Psychol., 117 (2008), стр. 924-935
o
176.
o Stice et al., 2010a
o E. Stice, S. Yokum, K. Blum, C. Bohon
o Увеличение веса связано с уменьшением полосатого отклика на вкусную пищу
o J. Neurosci., 30 (2010), стр. 13105-13109
o
177.
o Stice et al., 2010b
o E. Stice, S. Yokum, C. Bohon, N. Marti, A. Smolen
o Ответная реакция схемы на питание предсказывает будущее увеличение массы тела: Модирующие эффекты DRD2 и DRD4
o Neuroimage, 50 (2010), стр. 1618-1625
o
178.
o Stoeckel, 2010
o Stoeckel, LE (2010). Принцип ожирения. Scientific American. Июнь 8, 2010. http://www.scientificamerican.com/article.cfm?id=the-goldilocks-principle-obesity.
o
179.
o Стратфорд и Келли, 1997
o TR Stratford, AE Kelley
o ГАМК в оболочке окунания ядра участвует в центральной регуляции поведения кормления
o J. Neurosci., 17 (1997), стр. 4434-4440
o
180.
o Стратфорд и Келли, 1999
o TR Stratford, AE Kelley
o Доказательства функциональной связи между оболочкой оккумбиса ядра и латеральным гипоталамусом, поддерживающим контроль за питанием
o J. Neurosci., 19 (1999), стр. 11040-11048
o
181.
o Суарес и Гэллап, 1981
o SD Suarez, GGJ Gallup
o Этологический анализ поведения открытых полей у крыс и мышей
o Узнайте. Motiv., 12 (1981), стр. 342-363
o
182.
o Sunday et al., 1983
o SR Sunday, SA Sanders, G. Collier
o Пэбилити и схемы питания
o Physiol. Behav., 30 (1983), стр. 915-918
o
183.
o Swinburn и др., 2009
o B. Swinburn, G. Sacks, E. Ravussin
o Увеличение продовольственного снабжения энергией более чем достаточно, чтобы объяснить эпидемию ожирения в США
o Am. J. Clin. Nutr., 90 (2009), стр. 1453-1456
o
184.
o Taha и Fields, 2005
o SA Taha, HL Fields
o Кодирование вкусовых качеств и аппетитных поведений различными группами нейронов в ядре accumbens
o J. Neurosci., 25 (2005), стр. 1193-1202
o
185.
o Taha et al., 2009
o С.А. Таха, Ю. Кацуура, Д. Ноорваш, А. Серусси, HL Fields
o Конвергентные, а не последовательные, полосатые и паллидальные цепи регулируют вызванное опиоидами потребление пищи
o Neuroscience, 161 (2009), стр. 718-733
o
186.
o Teegarden и Bale, 2007
o SL Teegarden, TL Bale
o Снижение диетического предпочтения приводит к увеличению эмоциональности и риску рецидива диеты
o Biol. Психиатрия, 61 (2007), стр. 1021-1029
o
187.
o Teegarden et al., 2009
o SL Teegarden, AN Scott, TL Bale
o Раннее воздействие на жирную диету способствует долгосрочным изменениям в диетических предпочтениях и центральной сигнатуре награды
o Neuroscience, 162 (2009), стр. 924-932
o
188.
o Thanos et al., 2008
o PK Thanos, M. Michaelides, YK Piyis, GJ Wang, ND Volkow
o Ограничение питания заметно увеличивает дофамин D2-рецептор (D2R) у крысиной модели ожирения, как оценивается с помощью in-vivo muPET-изображения ([11C] раклоприд) и in-vitro ([3H] spiperone) авторадиография
o Synapse, 62 (2008), стр. 50-61
o
189.
o Томпсон и Свансон, 2010
o RH Thompson, LW Swanson
o Анализ структурной связности, основанный на гипотезе, поддерживает сеть по иерархической модели архитектуры мозга
o Proc. Natl. Акад. Sci. США, 107 (2010), стр. 15235-15239
o
190.
o Vanderschuren и Everitt, 2004
o Л. Дж. Вандершурен, Б. Дж. Эверитт
o Поиск наркотиков становится компульсивным после длительного самообслуживания кокаина
o Наука, 305 (2004), стр. 1017-1019
o
191.
o Vendruscolo et al., 2010a
o LF Vendruscolo, AB Gueye, M. Darnaudéry, SH Ahmed, M. Cador
o Сахарное перепроизводство в подростковом возрасте избирательно изменяет мотивацию и функцию вознаграждения у взрослых крыс
o PLoS ONE, 5 (2010), p. e9296 http://dx.doi.org/10.1371/journal.pone.0009296
o
192.
o Vendruscolo et al., 2010b
o LF Vendruscolo, AB Gueye, JC Vendruscolo, KJ Clemens, P. Mormède, M. Darnaudéry, M. Cador
o Снижение употребления алкоголя у взрослых крыс, подвергшихся воздействию сахарозы в подростковом возрасте
o Нейрофармакология, 59 (2010), стр. 388-394
o
193.
o Волков и О'Брайен, 2007 г.
o Н. Д. Волков, С. П. О'Брайен
o Вопросы для DSM-V: следует ли включать ожирение в виде расстройства головного мозга?
o Am. J. Psychiatry, 164 (2007), стр. 708-710
o
194.
o Волков и Мудрый, 2005
o Н. Д. Волков, Р. А. Мудрый
o Как наркомания помогает нам понять ожирение?
o Nat. Neurosci., 8 (2005), стр. 555-560
o
195.
o Volkow и др., 2009
o ND Volkow, GJ Wang, F. Telang, JS Fowler, RZ Goldstein, N. Alia-Klein, J. Logan, C. Wong, PK Thanos, Y. Ma, K. Pradhan
o Обратная связь между ИМТ и префронтальной метаболической активностью у здоровых взрослых
o Ожирение (Серебряная весна), 17 (2009), стр. 60-65
o
196.
o Vucetic and Reyes, 2010
o Z. Vucetic, TM Reyes
o Центральная дофаминергическая схема контроля приема пищи и вознаграждения: последствия для регулирования ожирения
o Wiley Interdiscip. Rev. Syst. Biol. Med., 2 (2010), стр. 577-593
o
197.
o Wang et al., 2001
o GJ Wang, ND Volkow, J. Logan, NR Pappas, CT Wong, W. Zhu, N. Netusil, JS Fowler
o Дофамин мозга и ожирение
o Lancet, 357 (2001), стр. 354-357
o
198.
o Wang et al., 2002
o GJ Wang, ND Volkow, JS Fowler
o Роль допамина в мотивации к употреблению в пищу у людей: последствия для ожирения
o Экспертное мнение. Ther. Цели, 6 (2002), стр. 601-609
o
199.
o Wang et al., 2004a
o GJ Wang, ND Volkow, F. Telang, M. Jayne, J. Ma, M. Rao, W. Zhu, CT Wong, NR Pappas, A. Geliebter, JS Fowler
o Воздействие аппетитных пищевых стимулов заметно активизирует человеческий мозг
o Neuroimage, 21 (2004), стр. 1790-1797
o
200.
o Wang et al., 2004b
o GJ Wang, ND Volkow, PK Thanos, JS Fowler
o сходство между ожирением и наркоманией, оцениваемое с помощью нейрофункциональной визуализации: обзор концепции
o J. Addict. Dis., 23 (2004), стр. 39-53
o
201.
o Wang et al., 2008
o GJ Wang, D. Tomasi, W. Backus, R. Wang, F. Telang, A. Geliebter, J. Korner, A. Bauman, JS Fowler, PK Thanos, ND Volkow
o Раздражение желудка активирует схему насыщения в мозге человека
o Neuroimage, 39 (2008), стр. 1824-1831
o
202.
o Wassum et al., 2009
o KM Wassum, SB Ostlund, NT Maidment, BW Balleine
o Четкие опиоидные схемы определяют привлекательность и желательность награждения событий
o Proc. Natl. Акад. Sci. США, 106 (2009), стр. 12512-12517
o
203.
o Wassum et al., 2011
o KM Wassum, IC Cely, BW Balleine, NT Maidment
o активация μ-опиоидного рецептора в базалатеральной амигдале опосредует изучение возрастания, но не снижает стимулирующую ценность вознаграждения за питание
o J. Neurosci., 31 (2011), стр. 1591-1599
o
204.
o Уилкинсон и Пил, 1962
o HA Wilkinson, TL Peele
o Модификация внутричерепной самостимуляции путем голодания
o Am. J. Physiol., 203 (1962), стр. 537-540
o
205.
o Will et al., 2003
o MJ Will, EB Franzblau, AE Kelley
o Мукопиоиды Nucleus accumbens регулируют потребление диеты с высоким содержанием жиров посредством активации распределенной сети мозга
o J. Neurosci., 23 (2003), стр. 2882-2888
o
206.
o Wilson et al., 2008
o М.Э. Уилсон, Дж. Фишер, А. Фишер, В. Ли, Р.Б. Харрис, Т. Дж. Бартнесс
o Количественное определение потребления пищи у социально помещенных обезьян: влияние социального статуса на потребление калорий
o Physiol. Behav., 94 (2008), стр. 586-594
o Статья | PDF (553 K) |
Просмотреть запись в Scopus
| Процитировано в Scopus (22)
207.
o Yurcisin et al., 2009
o Б.М. Юрсисин, М.М. Гаддор, Е.Ю. Демария
o Ожирение и бариатрическая хирургия
o Clin. Chest Med., 30 (2009), стр. 539-553, ix
o
208.
o Zhang et al., 1998
o M. Zhang, BA Gosnell, AE Kelley
o Потребление высокожирной пищи избирательно усиливается стимуляцией стимуляции мю-опиоидного рецептора в ядре accumbens
o J. Pharmacol. Exp. Ther., 285 (1998), стр. 908-914
o Просмотреть запись в Scopus
| Процитировано в Scopus (148)
209.
o Zheng et al., 2007
o H. Zheng, LM Patterson, HR Berthoud
o Орексиновая сигнализация в брюшной тегментальной области необходима для аппетита с высоким содержанием жиров, вызванного опиоидной стимуляцией ядра accumbens
o J. Neurosci., 27 (2007), стр. 11075-11082
o Просмотреть запись в Scopus
| Процитировано в Scopus (64)
210.
o Zheng et al., 2009
o H. Zheng, NR Lenard, AC Shin, HR Berthoud
o Регулирование аппетита и регулирование энергетического баланса в современном мире: управляемый головами мозг переопределяет сигналы повторения
o Int. J. Obes. (Lond.), 33 (Suppl 2) (2009), стр. S8-S13
o Просмотреть запись в Scopus
| Процитировано в Scopus (34)