Научные доклады объем 9, Номер статьи: 16918 (2019)
Абстрактные
Чрезмерное потребление сахарозы вызывает страстное влечение, которое может лежать в основе эпидемии ожирения. Опиоиды и дофамин опосредуют полезные эффекты злоупотребления наркотиками и естественные выгоды от стимулов, таких как вкусная еда. Мы исследовали влияние сахарозы с помощью ПЭТ-визуализации с [11C] карфентанил (агонист μ-опиоидных рецепторов) и [11С] раклоприд (антагонист дофаминовых рецепторов D2 / 3) у семи самок анестезированных геттингенских мини-свиней. Затем мы предоставили минипигам доступ к раствору сахарозы в течение одного часа в течение 12 дней подряд и снова провели визуализацию через 24 часа после последнего доступа к сахарозе. В меньшей выборке из пяти мини-свиней мы выполнили дополнительную [11C] Карфентанил ПЭТ сессия после первого воздействия сахарозы. Мы рассчитали воксельные потенциалы связывания (АДND) используя мозжечок в качестве области неперемещаемого связывания, проанализировал различия с помощью статистического непараметрического картирования и провел региональный анализ. После 12 дней доступа сахарозы, BPND у обоих индикаторов значительно уменьшилось в полосатом теле, прилежащем ядре, таламусе, миндалине, поясной коре и префронтальной коре, что согласуется с понижением регуляции плотности рецепторов. После однократного воздействия сахарозы мы обнаружили снижение связывания [11C] карфентанил в прилежащем ядре и поясной коре, что соответствует высвобождению опиоидов. Более низкая доступность опиоидных и дофаминовых рецепторов может объяснить аддиктивный потенциал, связанный с потреблением сахарозы.
Введение
Пять процентов населения мира страдают от клинического ожирения1, Как признак метаболического синдрома, ожирение связано с диабетом 2 типа, сердечно-сосудистыми заболеваниями, респираторными проблемами и риском депрессии и, возможно, деменции2, Увеличенное потребление энергетически плотных продуктов преувеличило физиологическое различие между гомеостатическим голодом, который следует за лишением пищи, и гедонистическим голодом, или «жаждой», которая происходит в отсутствие депривации3,4, Поскольку гомеостатическая регуляция сама по себе не может объяснить рост ожирения в настоящее время, необходимо проверить влияние на мозг механизмов вознаграждения и удовольствия от вызывающих привыкание свойств очень вкусной пищи.
Потребление сахарозы связано с ожирением, и сахароза все чаще считается веществом, вызывающим привыкание5, Некоторые результаты расходятся с этим утверждением из-за трудностей в отделении непривлекательного потребления пищи от гедонистических пищевых реакций и в определении вызывающего привыкание ингредиента в обработанной пище, а также из-за различных механизмов, посредством которых пища изменяет схемы мозга через естественные пути.6, Тем не менее, в определенных контекстах потребление сахарозы действительно вызывает вознаграждение и тягу, сравнимую по величине с теми, что вызваны наркотиками, вызывающими чрезмерное потребление и возможное ожирение6,7.
Голод связан с «желанием», которое тесно связано с эффектами дофаминергической нейротрансмиссии при ряде выгодных обстоятельств.8, но остается неясным, как действие дофамина (DA) модулируется в ответ на компульсивное питание. Потребление вкусной пищи связано с «симпатией», опосредованной прежде всего эндогенной опиоидной системой, особенно μ-опиоидным рецептором (μOR)9,10, что может способствовать чрезмерному потреблению при дерегулировании. В настоящем отчете мы проверяем утверждение о том, что сахароза приводит к высвобождению опиоидов и дофамина, что снижает доступность рецепторов μOR и DA D2 / 3. Доступность является показателем количества незанятых рецепторов, доступных для связывания метки, и в принципе не различает занятость лиганда и плотность рецептора.11.
Начало компульсивного приема пищи зависит от множества факторов, и причинно-следственные связи на людях поднимают этические проблемы. Поэтому большинство исследований посвящено поведению кормления у крыс.12, Хотя у крыс есть «сладкоежка», их гомеостатические механизмы, важные для увеличения веса, метаболизма и типа накопления жира, значительно отличаются от таковых у людей. Геттингенская мини-свинья - это большое всеядное животное с хорошо развитым гиренфалическим мозгом, которое можно получать с достаточным разрешением. Его четко определенные субкортикальные и префронтальные области коры13 обеспечить более прямой перевод на функции человеческого мозга. Здесь мы используем изображения позитронно-эмиссионной томографии (ПЭТ) для тестирования в естественных условиях Наличие μOR и DA D2 / 3 в минипиговой модели субхронического воздействия сахарозы. В меньшей выборке мы исследовали непосредственное влияние на занятость μOR после первого воздействия сахарозы. Наконец, мы проверили взаимосвязь между изменениями в доступности рецепторов двух трассеров.
Итоги
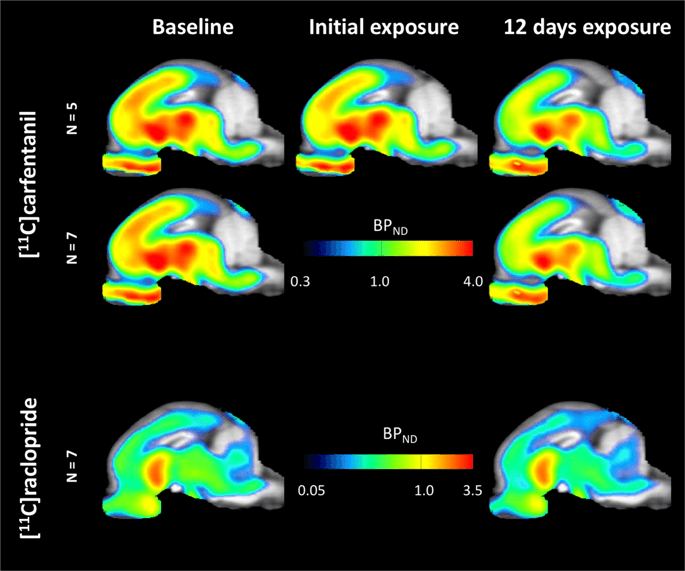
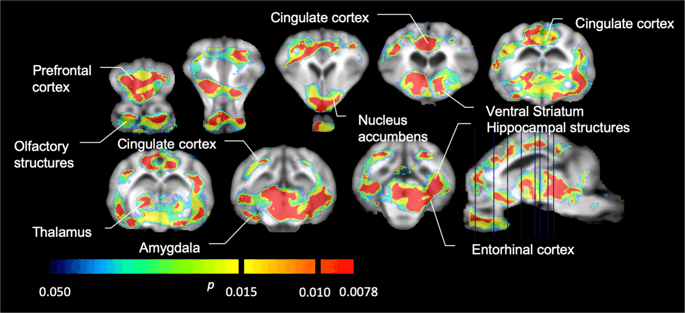
Средние параметрические карты [11C] карфентанил и [11C] раклопридный потенциал связывания (BPND) показаны на рис. 1, Проанализировать изменения, происходящие после первого воздействия сахарозы на пяти мини-свиньях по сравнению с исходным уровнем и через один день после 12th Доступ к сахарозе у семи мини-свиней по сравнению с исходным уровнем, мы использовали теорию перестановок и нерегионально ограниченный анализ всего мозга, предпочтительный метод для образцов такого размера14.
Средний вокселевый не смещаемый потенциал связывания (АДND) карты наложены на изображения МРТ в сагиттальном виде. Данные представлены для [11C] карфентанил BPND из 5 мини-свиней, изображенных в начале исследования, после первоначального воздействия сахарозы и после 12 дней воздействия сахарозы (верхний ряд). [11C] карфентанил BPND из всех 7 мини-свиней, изображенных в начале исследования и после 12 дней доступа к сахарозе, представлены в среднем ряду. [11C] раклоприд BPND из всех 7 мини-свиней, изображенных в начале исследования и после 12-дневного доступа сахарозы, показаны в нижнем ряду. Обратите внимание, что цветовая шкала экспоненциально, чтобы выделить [11C] раклоприд BPND в внеземных регионах.
Начальное воздействие сахарозы
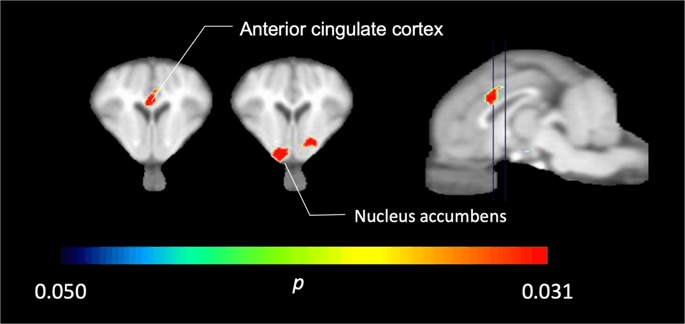
На пяти мини-свинках, изображенных с [11C] Карфентанил на исходном уровне и сразу после первого воздействия сахарозы, мы обнаружили значительное снижение связывания трассера в передней части поясной извилины и прилежащем ядре в ответ на сахарозу, как показано цветом на рис. 2, что указывает на p <0.05. Мы обнаружили снижение связывания индикатора на 14% в обеих областях по сравнению с исходным уровнем.
Значительное снижение в [11C] карфентанил BPND после первого воздействия воды сахарозой по сравнению с исходным уровнем (n = 5). Только вокселы со значительным (p <0.05) показаны как цветные области, проецируемые на Т1-взвешенные разрезы МРТ на уровне передней поясной коры (слева) и прилежащего ядра (в центре) из стереотаксического атласа головного мозга мини-свиней. Обратите внимание, что максимальный уровень значимости, достижимый с 5 животными, равен 2.-5 ≈ 0.031 (см. Цветную полосу). Данные представлены на срезах головного мозга свиньи на уровнях, указанных на сагиттальном изображении (справа).
12 дней доступа сахарозы
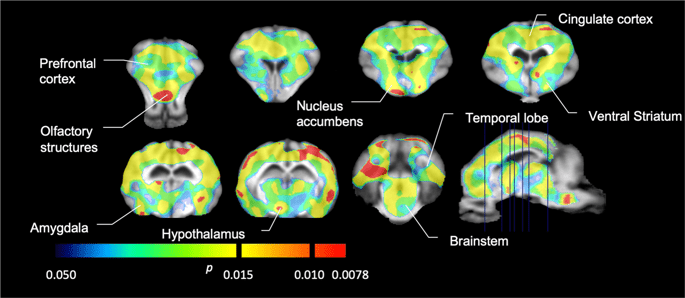
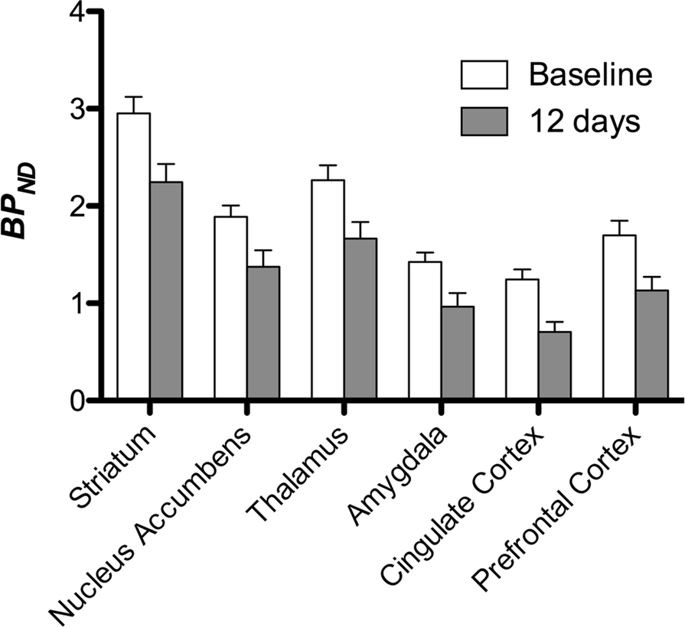
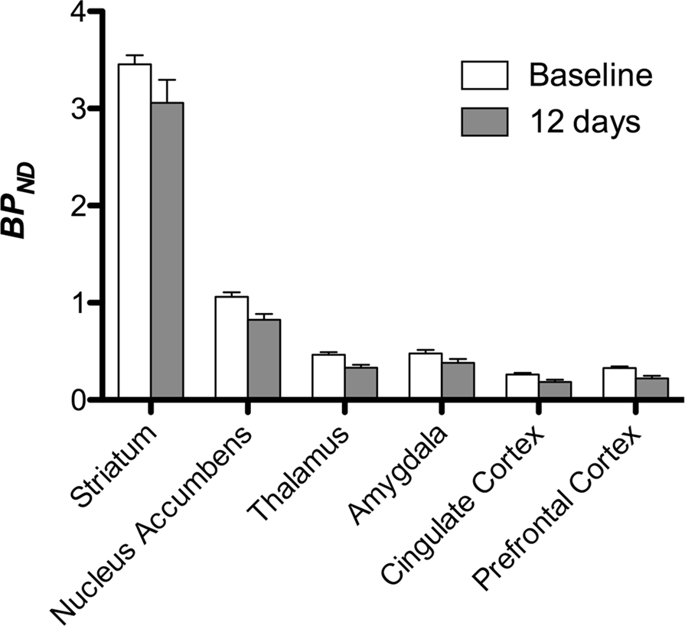
Затем мы выполнили анализ семи мини-свиней с изображением [11C] карфентанил в начале исследования и после 12 дней доступа к сахарозе; обнаружено значительное снижение связывания метки у животных, подвергшихся воздействию сахарозы, по сравнению с исходным уровнем. Наиболее сильно пораженные области показаны красным на рис. 3 (p <0.01) и включают части обонятельных структур, прилежащего ядра / брюшного полосатого тела и височной коры / доли, за которыми следуют области, показанные желтым (p <0.015), которые включают части префронтальной коры, поясной коры, миндалины и ствола мозга. . Для получения БПND Значения и оценки изменения в процентах, мы провели региональный анализ и получили средние значения в каждом регионе на исходном уровне и после потребления сахарозы (рис. 4).
Значительное снижение в [11C] потенциал связывания карфентанила (BPND) между исходным уровнем и после 12 дней воздействия сахарозы водой (n = 7). Воксели со значительным (p <0.05) уменьшение показано как цветные области, проецируемые на Т1-взвешенные срезы МРТ из стереотаксического атласа головного мозга мини-свиньи. Данные представлены на коронарных срезах головного мозга на уровнях, указанных на сагиттальном изображении (справа внизу). Обратите внимание, что максимальный уровень значимости, достижимый с 7 животными, равен 2.-7 ≈ 0.0078 (см. Цветную полосу).
Мы использовали [11C] раклоприд как индикатор DA D2 / 3 -рецепторов в полосатом и экстрастриатальном отделах головного мозга у мини-свиней в начале исследования и через 12 дней доступа к сахарозе (рис. 1). Мы обнаружили снижение связывания индикаторов у животных, подвергшихся воздействию сахарозы, по сравнению с исходным уровнем с наибольшими эффектами (p <0.01) в областях префронтальной коры, прилежащего ядра / вентрального полосатого тела, поясной коры, миндалевидного тела, таламуса, среднего мозга, областей гиппокампа и обонятельных областей. (Инжир. 5). Данные регионального анализа представлены на рис. 6.
Значительное снижение в [11C] раклопридный потенциал связывания (BPND) между исходным уровнем и после 12 дней воздействия сахарозы водой (n = 7). Воксели со значительным (p <0.05) уменьшение показано как цветные области, проецируемые на Т1-взвешенные срезы МРТ из стереотаксического атласа головного мозга мини-свиньи. Данные представлены на корональных срезах головного мозга свиньи на уровнях, указанных на сагиттальном изображении (внизу справа). Обратите внимание, что максимальный уровень значимости, достижимый с 7 животными, равен 2.-7 ≈ 0.0078 (см. Цветную полосу).
Корреляции между [11C] раклоприд и [11C] Карфентанил данные
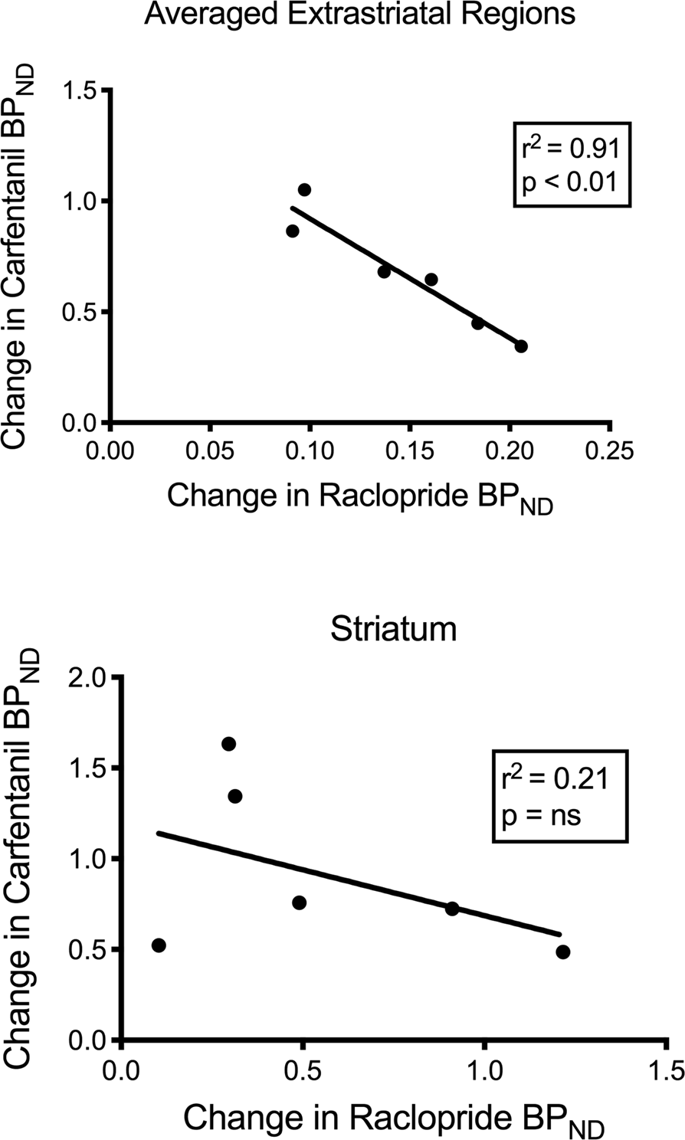
Мы проверили потенциальную корреляцию между [11C] раклоприд и [11C] Карфентанил значения АДND в полосатых и не полосатых областях у мини-свиней в начале исследования и после 12 дней приема сахарозы без каких-либо ассоциаций. Затем мы проверили, коррелировали ли снижения связывания трассера, и сравнили изменения АДND за [11C] raclopride с изменениями BPND за [11С] карфентанил только в мини-свиньях с более низким АДND обоих индикаторов после приема сахарозы (n = 6). Мы обнаружили значительные отрицательные корреляции в усредненных2 = 0.91, p <0.01), но не в полосатом теле (рис. 7).
Корреляции между минусом после спада [11C] раклоприд и [11C] Карфентанил связывающие потенциалы (АДND) у мини-свиней со сниженным связыванием метки после приема сахарозы (n = 6). Представлены данные по усредненным экстрастриатальным регионам (вверху) и стриатуме (внизу). Коэффициент детерминации (р2) и значения p показаны для каждого графика.
Обсуждение
Мы определили влияние многократного прерывистого доступа к сахарозе на опиоидную и DA нейротрансмиссию в мозге млекопитающих. продольный в естественных условиях ПЭТ-визуализация рецепторов µOR и DA D2 / 3 показала снижение доступности рецепторов по всей цепи вознаграждения, включая прилежащее ядро, префронтальную кору и переднюю поясную извилину. Результаты ясно показывают, что сахароза воздействует на механизмы вознаграждения аналогично наркотикам.
Известно, что потребление сахарозы в качестве приятного на вкус вещества высвобождает DA и вызывает зависимость у грызунов.15с сахарозой, показанной в некоторых случаях даже более приятной, чем кокаин у грызунов. Таким образом, грызуны работают более интенсивно, чтобы получить сахарозу, чем кокаин, даже в отсутствие недостатка пищи5, Однако эффекты сахарозы регулируются как гомеостатической системой, так и гедонистическими схемами вознаграждения.16,17 которые могут опосредовать различие между питательными и гедоническими аспектами действия сахарозы18, Мы выбрали один час в день, чтобы способствовать «перееданию», так как предыдущие исследования на крысах показали более высокое потребление в течение первого часа ежедневного доступа в периодическом режиме.15,19, Поведенческие исследования потребления пищи часто нацелены на животных с ограниченным кормом, но дизайн может не обязательно отражать те же нервные механизмы, активные при ожирении. Свиньи в настоящем исследовании не были ограничены в еде и получали обычные рационы в дополнение к доступу к сахарозе.
Опиоидные рецепторы (OR) широко экспрессируются в мозге, особенно в структурах, которые, как известно, модулируют процессы приема пищи и поощрения20, Было показано, что OR важны для полезного и рецидивирующего воздействия кокаина21,22,23,24, Изменения в связывании также были связаны с гомеостатическими реакциями на еду и удовольствием, связанным с приемлемой едой25, В частности, «симпатия» пищи связана с эндогенной опиоидной системой, особенно с µOR9,10 в оболочке прилежащего ядра и вентрального паллидума26, Вливания агониста μOR в отдельные части прилежащего ядра и вентрального паллидума значительно усиливают «симпатичные» поведения, включая выпячивания языка и лизание лап, после увеличения приемлемого потребления пищи27,28,29, Еще одним доказательством опиоидной передачи сигналов при обработке гедонической регуляции являются антагонисты μOR, которые ослабляют потребление приемлемой пищи в обоих случаях. вволюкорма и животные с ограниченным кормом, но с более ограниченным влиянием на потребление невкусных стандартных гранул30,31, У людей антагонисты µOR уменьшают кратковременное потребление пищи и снижают приятность вкуса32,33,34, Опиоидная передача сигналов в базолатеральной миндалине также способствует «желанию» пищи посредством модуляции поиска награды и стимулирующей ценности пищи35.
С [11C] Карфентанил, мы получили изображения связывания трассера, который чувствителен как к уровням μOR, так и к выбросу в мозг эндогенных опиоидов.36,37, Мы обнаружили немедленную потерю доступности μOR в областях прилежащего ядра и передней поясной извилины, специфических областях мозга пути вознаграждения, после первоначального потребления сахарозы пятью мини-свиньями, что согласуется с высвобождением эндогенного опиоида. Предыдущие исследования показали, что вкусная еда может вызывать чувство удовольствия38 стимулируя высвобождение опиоидов. После 12 дней доступа сахарозы мы наблюдали снижение [11C] Карфентанил связывание, которое имеет несколько возможных объяснений39 включая высвобождение эндогенного опиоида и связывание с µOR, интернализацию µOR в результате повышенного связывания опиоида и усиление активации рецептора DA D2 / 3, приводящее к гетерологичной десенсибилизации µOR40.
В поддержку настоящих выводов [11C] Карфентанил исследования пациентов с булимией41ожирение42,43,44и переедание45, показать снижение доступности рецепторов. Тем не менее, это хронические заболевания, тогда как мини-свиньи получали сахарозу только в течение 12 дней. В исследовании острого пищевого поведения у здоровых мужчин кормление приводило к сильному и широко распространенному выделению эндогенного церебрального опиоида, как при наличии, так и при отсутствии гедонии, предполагая, что высвобождение опиоида отражает метаболические и гомеостатические, а также гедонические реакции.25, Это исследование, вместе с другим, которое показало пациентов после жидкой муки со вкусом шоколада44, имеет непосредственное отношение к острому исследованию пяти мини-свиней после первого воздействия сахарозы, но отличается от исследования субхронического воздействия сахарозы в течение 12 дней, где снижение доступности рецепторов более вероятно отражает повторную чрезмерную стимуляцию и сопутствующее подавление μOR.
Префронтальная кора важна для принятия решений и приписывания ценности предметам, и, следовательно, μOR в префронтальной коре может быть ответственным за измененную оценку пищевой значимости, которая может повысить аддиктивный потенциал пищи. Мы обнаружили снижение связывания в префронтальной коре, что согласуется с предыдущими исследованиями, показывающими, что диета с высоким содержанием жира снижает уровень мРНК µOR в префронтальной коре.46 и что введение агониста μOR в префронтальную кору увеличивает потребление сладкой пищи47, Опять же, однако, возникает вопрос, является ли диета с высоким содержанием жиров более хроническим состоянием, которое, скорее всего, опосредует подавление рецепторов по сравнению с более короткой схемой кормления сахарозой, что предполагает длительное высвобождение эндогенных опиоидов, которые вытесняют индикаторный карфентанил, связанный с µOR даже после 12 дней сахарозы.
DA был замешан в наградах как от наркотиков, так и от поведения. Было обнаружено, что хроническое употребление кокаина ингибирует передачу сигналов DA48, Уровни рецепторов DA D1 и D2 / 3 изменяются никотином в мозге свиньи49и у приматов, не являющихся людьми, с историей злоупотребления кокаином50в соответствии с подавлением рецепторов D2 / 3 в мозге людей, употребляющих кокаин51,52, Что касается наркотиков, было показано, что сахароза активирует рецепторы DA D119 и увеличить выпуск DA53усиливая роль DA в «желании» по отношению к приемлемой еде. Предыдущие исследования ПЭТ продемонстрировали снижение доступности рецепторов DA D2 / 3 в полосатом теле при патологическом ожирении по сравнению со средним весом54,55, сходный по величине с сокращением у наркозависимых пациентов56и у животных с моделями ожирения57, В исследованиях на грызунах нокдаун рецепторов D2 / 3 в стриатуме способствует развитию компульсивного поиска пищи у крыс, имеющих доступ к приемлемой пище57.
Наши наблюдения о снижении доступности D2 / 3-рецепторов у свиньи могут указывать на повышенные уровни DA в ответ на стимулирующую значимость, связанную с потреблением сахарозы, поскольку DA высвобождается как часть желания злоупотреблять наркотиками и других приятных действий52,58,59,60, Поскольку свиньи были анестезированы во время визуализации и не получали сахарозу в течение 24 часов, снижение D2 / 3 BP.ND более вероятно, отражает уменьшение количества рецепторов в ответ на длительное увеличение высвобождения DA на каждом из 12 дней доступа сахарозы. Снижение может повысить пороги вознаграждения мозга, связанные с пониженной регуляцией стриатальных DA D2-рецепторов. Это может объяснить повышенную восприимчивость к злоупотреблению наркотиками, наблюдаемую в предыдущих исследованиях по перееданию сахарозы на крысах, что привело к перекрестной сенсибилизации к кокаину, гиперактивности после приема амфетамина в низких дозах, увеличению потребления алкоголя при воздержании от сахарозы и устойчивости к обезболивающему действию опиатов.6.
Предыдущее исследование ожирения на мини-свинье в Геттингене выявило снижение мозгового кровотока в прилежащем ядре, вентральном сегменте (VTA) и префронтальной коре с однофотонной эмиссионной компьютерной томографией (SPECT) головного мозга.61, В соответствии с этими данными мы наблюдали снижение связывания DA D2 / 3 в области вентрофоребрана, содержащей прилежащее ядро, и в префронтальной коре. Внеклеточные уровни DA увеличиваются в 3 раза в прилежащем ядре после приема сахарозы у свободно движущихся крыс, подвергающихся микродиализу.62, У сахарозозависимых животных повторное потребление сахарозы может привести к высвобождению DA из оболочки accumbens core63, Животные, получавшие ограниченную диету с ограниченным доступом к сахарозе, имели более низкое связывание с рецептором DA D2 в оболочке accumbens kernel и дорсальном стриатуме.64, Ограниченные диеты с высоким содержанием жиров и сахарозы могут привести к длительной понижающей регуляции мРНК рецепторов D1 и D2 в прилежащем ядре65, Микродиализное исследование влияния вкусовой пищи выявило повышенное высвобождение DA в прилежащем ядре и префронтальной коре, когда пища еще считалась новой; как только крысы привыкли к новой пище, повышенное выделение притуплялось в прилежащем ядре, но не в префронтальной коре.66, Дифференциальная восприимчивость к привыканию и обусловливанию активности в двух областях может объяснить большее увеличение, наблюдаемое в префронтальной коре, чем в прилежащем ядре мини-свиней, подвергшихся воздействию того же вкусового вещества, которое утратило новизну через двенадцать дней. Однако, поскольку мы не изображали мини-свиньи с [11C] raclopride после первого введения сахарозы, это объяснение является спекулятивным.
Префронтальная кора головного мозга модулирует исполнительную функцию, принятие решений и самоконтроль67, Дисфункциональная нейротрансмиссия DA в префронтальной коре нарушает модуляцию обработки вознаграждения, предполагая нарушение исполнительной функции и навыков принятия решений у людей с ожирением68,69, Кроме того, исследование на ПЭТ на человеке коррелировало снижение метаболизма лобной коры со снижением связывания стриатального D2 при ожирении.70, Здесь мы обнаруживаем снижение доступности D2 / 3-рецепторов в префронтальной коре, включая орбитофронтальную кору свиней, подвергшихся воздействию режима сахарозы.
Дофаминергические нейроны VTA посылают проекции в гиппокамп и миндалину, где они поддерживают привычное поведение71 и опосредуют кодирование и поиск кондиционирования для наркотиков72,73 и еда киев74,75, Визуализация человеческого мозга показала активацию гиппокампа в ответ на тягу к еде и дегустацию76, В соответствии с нашими данными о снижении доступности D2 / 3-рецепторов гиппокампа и миндалины в ответ на сахарозу, картирование мозга человека с помощью [18F] fallypride показал индуцированное кокаиновым выделением DA в миндалинах и гиппокампе77, В мозге грызунов воздействие кокаиновой метки вызывало высвобождение DA в миндалине78и изменения уровня DA миндалины влияли на индуцированное кием поведение при поиске кокаина79.
В исследовании лиц с ожирением связь между доступностью D2 / 3 и μOR, известная как существующая в полосатых областях худых людей, была нарушена в вентральном полосатом теле80, Мы сравнили значения БПND из двух трассеров, чтобы проверить, воспроизводят ли данные этот эффект. В отличие от худых людей, в настоящее время мозг свиней не имел корреляции между значениями АДND из двух индикаторов, на исходном уровне или после воздействия сахарозы. Затем мы проверили, будут ли животные с наибольшим снижением связывания трассера раклоприда также иметь наибольшее снижение связывания трассера карфентанила, но вместо этого мы обнаружили отрицательную корреляцию в усредненных экстрастриатальных областях, предполагая, что животные с наибольшим изменением потенциала связывания Трассер раклоприд имел самое низкое изменение потенциала связывания трассера карфентанила. Обратная зависимость между изменениями предполагает, что влияние потребления сахарозы на доступность соответствующих рецепторов регулируется в противоположных направлениях. Известно, что чрезмерное потребление приемлемой еды или лекарств может быть вызвано желанием или симпатией, или и тем, и другим.60,81, Вполне возможно, что величина желания, вызванного допамином, сводит на нет величину симпатии, вызванной опиоидами, или наоборот. Последние данные указывают на роль ГАМКA рецепторы в VTA и холинергические терминалы в стриатуме и, возможно, в коре, которые действуют как переключатели между дофамин-зависимым и дофамин-независимым механизмами действия опиоидов82,83 это может объяснить взаимность эффектов допамина и опиоидов в экстрастриатальных областях свиньи, определенных здесь.
Недостатком ПЭТ, также у сравнительно крупных животных, является ограниченное пространственное разрешение томографии, которое влияет на результаты от небольших областей мозга, вовлеченных в поведение, связанное с пищей. Однако, несмотря на эти опасения, [11Связывание C] raclopride ранее было зафиксировано как в стриатальной, так и в экстрастриатальной областях.84,85,86,87, Использование [11C] raclopride для маркировки одного и того же типа рецепторов не вызывает беспокойства по поводу потенциальных различий аффинности, которые могут повлиять на использование отдельных трассеров для одних и тех же рецепторов в разных регионах. Недавние исследования включали записи об экстрастриатальном связывании [11С] раклоприда. Алакуртти и др., обнаружил хорошую воспроизводимость мер связывания стриатального раклоприда в стриатуме с воспроизводимостью только от хорошей до умеренной в коре85, В более позднем исследовании Свенссон и др., обсудили несколько вопросов, влияющих на использование [11C] раклоприд как маркер экстрастриатальных рецепторов D2 / 3 в исследовании здоровых людей, включая плохую воспроизводимость в коре и ограниченное снижение связывания экстрастриатальных клеток в лобной коре в ответ на блокирующий агент D2 / 388, Сравнение тест-повторное тестирование выявило вариабельность 4–7% в стриатуме и 13–59% в кортикальных областях, но время между осмотрами в среднем составляло 20 дней, в отличие от более информативных 1-2 дней в большинстве исследований. Ряд факторов в жизни этих субъектов, возможно, успел повлиять на результаты. Действительно, мы здесь показываем, что простое добавление потребления сахарозы к утренней рутине в течение 12 дней могло повлиять на меры связывания, полученные через две недели. Другие факторы, такие как видеоигры, покупки, вступление в новые романтические отношения и сексуальные отношения, употребление наркотиков или изменение диеты и физических упражнений, могут влиять на уровень экстрастриатального дофамина с потенциалом для большого разнообразия наборов данных. Текущее исследование на мини-свиньях представило хорошо контролируемую схему с единственной переменной - отсутствием или присутствием сахарозы в рационе. В этом контексте данные по семи животным имели достаточно низкую вариабельность в соответствующих экстрастриатальных областях, чтобы идентифицировать статистически значимое снижение связывания в ответ на сахарозу.
Ограничением текущего исследования является использование анестетиков, необходимых для обеспечения неподвижности во время в естественных условиях изображение животных. Эффекты специфических анестетиков и их взаимодействия с лекарственными средствами или другими вмешательствами могут нарушить связывание радиолигандов.89,90, Кетамин является антиглутаматергическим препаратом с быстрым антидепрессивным действием в субанестезирующих дозах.91,92,93, которые не уменьшают полосатость [11C] раклоприд связывание у людей94, Однако было обнаружено, что S-кетамин снижает доступность связывания дофаминовых рецепторов D2 / 3 в полосатом теле сознательных приматов, не являющихся человеком95, Изофлуран является распространенным анестетиком в ПЭТ животных. В предыдущих исследованиях мы обнаружили скопление полосатого тела [11C] SCH23390, радиолиганд дофаминовых D1-рецепторов, который должен быть значительно выше у мини-свиней, анестезированных изофлураном, а не пропофолом, что предполагает восприимчивость дофаминергической нейротрансмиссии к эффектам анестезии96, В текущем исследовании все мини-свиньи были визуализированы в оба момента времени под предварительным лечением кетамином и изофлурановой анестезией, что делает настоящие сравнения достоверными.
Заключение
Чрезмерное потребление вкусной пищи может как вызывать, так и становиться результатом зависимости с прямыми последствиями для здоровья при ожирении. Мы проверили утверждение, что опиоиды и дофамин обеспечивают награды, важные для выживания, а также для злоупотребления наркотиками. Мини-свиньи с прерывистым доступом к раствору сахарозы в течение 12 дней подряд продемонстрировали снижение доступности дофамина D2 / 3 и μ-опиоидных рецепторов в стриатальном и экстрастриатальном отделах головного мозга, подразумевая, что продукты с высоким содержанием сахарозы влияют на схемы вознаграждения мозга так же, как это наблюдается при употреблении наркотических средств, вызывающих зависимость потребляются. Первоначальное однократное воздействие сахарозы соответствовало выбросу опиоидов в области мозга, активные в награду. Изменения доступности опиоидов и допамина объясняют аддиктивный потенциал сахарозы, потребляемой в избытке.
Материалы и методы
Этика животных
Это исследование было одобрено и регламентировано Датской инспекцией по экспериментам на животных, и все эксперименты проводились в соответствии с директивой Европейского парламента и Совета по защите животных, используемых в научных целях, 2010/63 / EU и руководящими принципами ARRIVE. Мы использовали семь четырнадцатимесячных самок гёттингенских мини-свиней (Ellegaard, Dalmose, Denmark). Минипигам давали гранулированную диету (6 дл, 2 раза в день, Special Diets Services, Орхус, Дания) с доступной водопроводной водой вволю, Температура окружающей среды составляла 20–22 ° C, относительная влажность 50–55%, а воздух менялся восемь раз каждый час.
Прерывистое потребление сахарозы
Мы представили семь мини-свиней с [11C] раклоприд и [11С] карфентанил на исходном уровне, и снова один день после 12 последовательных дней воздействия воды сахарозой. Воздействие сахарозы состояло из одного часа доступа воды к сахарозе (сахароза, Dansukker, Копенгаген, Дания) (500 г сахарозы в 2 литрах воды) ежедневно в течение 12-дневного периода. Количество потребляемой сахарозы регистрировали, и все мини-свиньи потребляли 2 литра в день. Мы также представили пять таких же мини-свиней с [11C] карфентанил, через 30 минут после первого доступа сахарозы, для изучения острого высвобождения опиоидов.
Мини-свиньи набрали в среднем 13.6% массы тела с 25.4 кг (± 0.73 SEM) на исходном уровне до 28.9 кг (± 0.69 SEM) после 12-дневного воздействия сахарозы, что было значительно выше (односторонний t-критерий, p < 0.001), чем увеличение, наблюдаемое в выборке контрольных мини-свиней, полученной в предыдущих исследованиях, где вес увеличился в среднем всего на 4.9% за тот же период развития.
Визуализация мозга ПЭТ
Мы голодали свиней в течение ночи и имели свободный доступ к воде до визуализации. Мы предварительно лекарства и анестезировали мини-свиньи, как описано ранее97 и поместили их на спину в устройство ПЭТ / КТ (Siemens Biograph 64 Truepoint PET). Мы провели низкодозовое КТ-сканирование перед каждым получением ПЭТ для анатомического определения и коррекции ослабления данных о выбросах ПЭТ. Нам внутривенно вводят [11C] раклоприд в начале исследования (360 ± 18 МБк, удельная активность 77 ± 76 ГБк / мкмоль, инъецированная масса 0.12 ± 0.08 мкг / кг) и через 12 дней с сахарозой (374 ± 54 МБк, удельная активность 127 ± 85 ГБк / мкмоль, впрыскиваемая масса 0.06 ± 0.05 мкг / кг) и [11В] карфентанил в начале исследования (377 ± 43 МБк, удельная активность 311 ± 195 ГБк / мкмоль, инъецированная масса 0.03 ± 0.02 мкг / кг) и через 12 дней сахарозы (337 ± 71 МБк, удельная активность 177 ± 157 ГБк / мкмоль, вводили массу 0.06 ± 0.08 мкг / кг через ушную вену в 10 мл физиологического раствора в течение первой минуты 90-минутного сканирования. Мы реконструировали данные ПЭТ с использованием TrueX 3D OSEM (3 итерации, 21 подмножество), матрицы 256 × 256 × 109 и 2-мм фильтра Гаусса, используя временную структуру 5 × 60, 3 × 300, 4 × 600. , 2 × 900 секунд (всего 14 кадров, 90 минут). На исходном уровне и после 12 дней сахарозы мини-свиньи были визуализированы с обоими трейсерами, введенными с интервалом не менее 100 минут, из-за периода полураспада [11C] ПЭТ трассеры. После завершения последнего сеанса ПЭТ мы умерщвляли мини-свиней под глубоким наркозом путем внутривенной передозировки пентобарбитала (100 мг / кг).
Количественный анализ и статистика
Мы выполнили этапы предварительной обработки с использованием PMOD 3.7 (PMOD Technologies Ltd, Цюрих, Швейцария). Чтобы определить параметры стереотаксической трансформации из усредненных по времени ПЭТ-изображений, мы использовали лиганд-специфичные шаблоны. Мы применили сгенерированные матрицы преобразования и поля деформации к соответствующим динамическим временным рядам ПЭТ. Мы сгенерировали параметрические изображения [11C] раклопридный потенциал связывания (BPNDс помощью полилинейного эталонного метода ткани Ичизе и его коллег98, Мы создали изготовленную на заказ маску мозжечка, которая исключала черви, чтобы получить радиоактивность ткани мозжечка с течением времени в области незначительной плотности рецептора DA D2 / 3. Мы сгенерировали параметрические изображения [11C] карфентанил с использованием реализации эталонной модели ткани Логана99,100 с t * = 30 мин Исследования [11C] связывание карфентанила в мозге человека использовало затылочную кору в качестве контрольной области36; однако у свиньи, согласно кривым временной активности, неперемещаемое связывание в мозжечке было ниже, чем в затылочной коре, что согласуется с результатами авторадиографического исследования на крысах.101, Поэтому мы выбрали мозжечок в качестве контрольной области в текущем исследовании.
статистический анализ
Мы подвергли карты анализу вокселей с помощью статистического непараметрического отображения (SnPM v13.01, http://warwick.ac.uk/snpm) SPM инструментарий, который использует непараметрическую теорию перестановок, чтобы обеспечить основу для статистического вывода, подход, показавший себя хорошо для небольших выборок благодаря строгому контролю ложных срабатываний14 и применяется, как описано ранее102, Эксперт в области нейроанатомии свиней (DO) сравнил полученные изображения с пороговым значением до уровня 5% значимости с высоким разрешением Göttingen minipig atlas103,104 определить и обозначить области пониженного DA D2 / 3 и µOR BPND от исходного уровня до состояния после сахарозы. Затем мы выполнили анализ области интереса (ROI), чтобы извлечь BPND Значения определенных областей, представляющих интерес, основаны на анализе SnPM, в том числе полосатое тело, прилежащее ядро, таламус, миндалина, поясная извилина и префронтальная кора. Никакой дополнительной статистики по анализу ROI не проводилось, так как было обнаружено, что эти регионы являются значимыми при использовании SnPM.
Рекомендации
- 1.
Смит, С. и Херон, А. Диабет и ожирение: две эпидемии. Nat Med 12, 75 – 80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Флегал, К.М., Кэрролл, доктор медицины, Огден, С.Л. и Кертин, Л.Р. Распространенность и тенденции ожирения среди взрослых в США, 1999–2008 гг. JAMA 303, 235 – 241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Дэвис, Калифорния и др., Дофамин для «хотения» и опиоиды для «симпатии»: сравнение взрослых людей с ожирением с перееданием и без него. Ожирение (Серебряная весна) 17, 1220 – 1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Древновски А. Ожирение и пищевая среда: плотность энергии в рационе и стоимость рациона. Американский журнал профилактической медицины 27, 154 – 162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Ленуар М., Серр Ф., Кантин Л. и Ахмед Ш. Сильная сладость превосходит кокаиновую награду. PLoS One 2, с698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ахмед, С., Авена, Н. М., Берридж, К. К., Гирхардт, А. и Гиллем, К. Ин. Нейронаука в 21 веке (ed. Phaff, DW) (Springer, 2012).
- 7.
Авена, Н.М., Голд, Дж. А., Кролл, С. и Голд, М.С. Дальнейшие разработки в нейробиологии питания и наркомании: обновленная информация о состоянии науки. Питание 28, 341 – 343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Лейтон, М. В Удовольствия мозга (под редакцией Крингельбаха, М.Л. и Берриджа, KC) (Oxford University Press, 2010).
- 9.
Натан, П.Дж. и Буллмор, ET. От гедоники вкуса к мотивационному влечению: центральные мю-опиоидные рецепторы и переедание. Int J Neuropsychopharmacol 12, 995 – 1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, KC Продовольственная награда: мозговые субстраты желания и симпатии. Нейронаука и биобиологические обзоры 20, 1-25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Картирование нейрорецепторов в действии: определение и интерпретация потенциалов связывания после 20 лет прогресса. Int Rev Neurobiol 63, 1 – 20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Авена, Н.М., Бокарсли, М.Э. и Хобель, Б.Г. Модели переедания сахара и жира на животных: связь с пищевой зависимостью и увеличением массы тела. Методы Мол Биол 829, 351 – 365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Джелсинг, Дж. и др., Префронтальная кора головного мозга Gottingen minipig определяется критериями нейропроекции и цитоархитектурой. Brain Res Bull 70, 322 – 336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Николс, Т.Э. и Холмс, А.П. Непараметрические перестановочные тесты для функциональной нейровизуализации: учебник с примерами. Hum Brain Mapp 15, 1-25 (2002).
- 15.
Авена, Н.М., Рада, П. и Хобель, Б.Г. Доказательства сахарной зависимости: поведенческие и нейрохимические эффекты периодического чрезмерного потребления сахара. Нейронаука и биобиологические обзоры 32, 20 – 39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Алонсо-Алонсо, М. и др., Система продовольственного вознаграждения: текущие перспективы и будущие потребности в исследованиях. Nutr Rev 73, 296 – 307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Фиглевич, Д. П., Беннет-Джей, Дж. Л., Киттлсон, С., Сиполс, А. Дж. И Завош, А. Самостоятельное введение сахарозы и активация ЦНС у крыс. Am J Physiol Regul Integr Comp Physiol 300, Р876–884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA и др., Отдельные схемы кодируют гедонистическую и пищевую ценность сахара. Природа нейробиологии 19, 465 – 470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Колантуони, C. и др., Чрезмерное потребление сахара изменяет связывание с дофаминовыми и мю-опиоидными рецепторами в мозге. Neuroreport 12, 3549-3552 (2001).
- 20.
Перт, CB, Кухар, MJ и Снайдер, SH Опиатный рецептор: авторадиографическая локализация в головном мозге крысы. Proc Natl Acad Sci США 73, 3729-3733 (1976).
- 21.
Содерман, А.Р. и Унтервальд, Е.М. Кокаиновая награда и гиперактивность у крыс: участки модуляции мю-опиоидных рецепторов. неврология 154, 1506 – 1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Уорд, С.Дж., Мартин, Т.Дж. и Робертс, округ Колумбия. Бета-фуналтрексамин влияет на самовведение кокаина у крыс, реагирующих на прогрессивную пропорцию подкрепления. Фармакология, биохимия и поведение 75, 301-307 (2003).
- 23.
Шредер, JA и др., Роль мю опиоидных рецепторов в кокаин-индуцированной активности, сенсибилизации и вознаграждении у крыс. Психофармакология 195, 265 – 272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW Восстановление, вызванное кокаином, требует эндогенной стимуляции мю-опиоидных рецепторов в вентральном паллидуме. Журнал нейронауки: официальный журнал Общества нейронауки 25, 4512 – 4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Тулари, JJ и др., Кормление высвобождает эндогенные опиоиды у людей. J Neurosci 37, 8284 – 8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Смит, К.С. и Берридж, К.С. Опиоидная лимбическая цепь для вознаграждения: взаимодействие между гедоническими горячими точками прилежащего ядра и брюшного паллидума. J Neurosci 27, 1594 – 1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, KC Опиоидный участок в оболочке прилежащего ядра опосредует прием пищи и гедонистическое «пристрастие» к пище: карта на основе микроинъекционных шлейфов Fos. Brain Res 863, 71-86 (2000).
- 28.
Zhang, M. и Kelley, AE. Потребление растворов сахарина, соли и этанола увеличивается путем инфузии мю-опиоидного агониста в прилежащее ядро. Психофармакология 159, 415 – 423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA, Kelley, AE. Прием пищи с высоким содержанием жиров избирательно усиливается за счет стимуляции мю-опиоидных рецепторов в прилежащем ядре. Журнал фармакологии и экспериментальной терапии 285, 908-914 (1998).
- 30.
Левин, А.С., Велдон, Д.Т., Грейс, М., Клири, Дж. П. и Биллингтон, С.Дж. Налоксон блокирует ту часть кормления, которая обусловлена сладким вкусом у крыс, ограниченных в корме. Am J Physiol 268, Р248–252 (1995).
- 31.
Гласс, MJ, Биллингтон, CJ & Levine, AS Опиоиды и потребление пищи: распределенные функциональные нервные пути? Neuropeptides 33, 360 – 368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Фантино, М., Хосотт, Дж. И Апфельбаум, М. Антагонист опиоидов налтрексон снижает предпочтение сахарозы у людей. Am J Physiol 251, Р91–96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Арбизи, Пенсильвания, Биллингтон, С.Дж. и Левин, А.С. Влияние налтрексона на порог обнаружения и распознавания вкуса. Аппетит 32, 241 – 249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Древновски, А., Кран, Д.Д., Демитрак, М.А., Нэрн, К. и Госнелл, Б.А. Налоксон, блокатор опиатов, снижает потребление сладкой высокожирной пищи у страдающих ожирением и худощавых женщин-переедающих. Am J Clin Nutr 61, 1206-1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW. Четкие опиоидные цепи определяют вкусовые качества и желательность поощрительных мероприятий. Proc Natl Acad Sci США 106, 12512 – 12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Коласанти, А. и др., Эндогенное высвобождение опиоидов в системе вознаграждения головного мозга человека, вызванное острым введением амфетамина. Biol психиатрии 72, 371 – 377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Мик, я и др., Индуцированное амфетамином выделение эндогенного опиоида в мозге человека, обнаруженное с помощью [11C] карфентанила PET: репликация в независимой когорте. Int J Neuropsychopharmacol, 1 – 6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Gray, RW Опиоидные пептиды и контроль пищевого поведения человека. Нейронаука и биобиологические обзоры 26, 713-728 (2002).
- 39.
Шпренгер, Т., Бертеле, А., Платцер, С., Беккер, Х. и Толле, Т.Р. Чему учиться в естественных условиях опиоидергическая томография мозга? Eur J Боль 9, 117 – 121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM и Cuntapay, M. Допамин-опиоидные взаимодействия в полосатом теле крысы: модулирующая роль дофаминовых рецепторов D1 в опосредованной дельта-опиоидным рецептором передаче сигнала. Нейрофармакология 39, 372-381 (2000).
- 41.
Бенчериф, Б. и др., Региональное связывание мю-опиоидных рецепторов в островковой коре уменьшается при нервной булимии и обратно коррелирует с поведением натощак. Журнал ядерной медицины: официальное издание, Общество ядерной медицины 46, 1349-1351 (2005).
- 42.
Карлссон, HK и др., Ожирение связано со снижением мю-опиоидной, но неизменной доступности дофаминовых рецепторов D2 в мозге. J Neurosci 35, 3959 – 3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Карлссон, HK и др., Потеря веса после бариатрической операции нормализует работу опиоидных рецепторов мозга при патологическом ожирении. Мол Психиатрия 21, 1057 – 1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, JK Эндогенные опиоидные механизмы влияют на ожирение и потерю веса у людей. J Clin Endocrinol Metab 100, 3193 – 3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Маджури Дж. и др., Нейротрансмиссия дофамина и опиоидов при поведенческих зависимостях: сравнительное исследование ПЭТ при патологической азартной игре и переедании. Нейропсихофармакологии 42, 1169 – 1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Вучетик, З., Киммел, Дж. И Рейес, Т.М. Хроническая диета с высоким содержанием жиров стимулирует постнатальную эпигенетическую регуляцию мю-опиоидных рецепторов в головном мозге. Нейропсихофармакология: официальное издание Американского колледжа нейропсихофармакологии 36, 1199 – 1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA Индукция гиперфагии и потребления углеводов путем стимуляции мю-опиоидных рецепторов в ограниченных областях лобной коры. Журнал нейронауки: официальный журнал Общества нейронауки 31, 3249 – 3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. Хронический кокаин ослабляет передачу сигналов дофамина во время интоксикации кокаином и нарушает баланс передачи сигналов рецептора D1 над D2. Журнал нейронауки: официальный журнал Общества нейронауки 33, 15827 – 15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Камминг П. и др., Влияние острого никотина на гемодинамику и связывание [11C] раклоприда с дофаминовыми D2,3 рецепторами в головном мозге свиньи. NeuroImage 19, 1127-1136 (2003).
- 50.
Мур, Р.Дж., Винсант, С.Л., Надер, М.А., Поррино, Л.Дж. и Фридман, Д.П. Влияние самовведения кокаина на дофаминовые D2 рецепторы у макак-резусов. Synapse 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Волков, Н.Д. и др., Кокаиновые сигналы и допамин в дорсальном полосатом теле: механизм тяги при кокаиновой зависимости. Журнал нейронауки: официальный журнал Общества нейронауки 26, 6583 – 6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Вонг, Д.Ф. и др., Повышенная занятость дофаминовых рецепторов в стриатуме человека во время вызываемого киюинового пристрастия кокаина. Нейропсихофармакологии 31, 2716 – 2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Хайнал, А., Смит, Г. П. и Норгрен, Р. Оральная стимуляция сахарозой увеличивает уровень дофамина прилежащего вещества у крыс. Am J Physiol Regul Integr Comp Physiol 286, Р31–37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Волков, Н. Д., Фаулер, Дж. С., Ван, Г. Дж., Балер, Р. и Теланг, Ф. Визуализация роли дофамина в наркомании и наркомании. Нейрофармакология 56(Приложение 1), 3–8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Ванг, Дж. Дж. и др., Мозговое допамин и ожирение. Ланцет 357, 354-357 (2001).
- 56.
Ван, Г.Дж., Волков, Н.Д., Танос, П.К. и Фаулер, Дж. С. Сходство между ожирением и наркозависимостью, оцененное с помощью нейрофункциональной визуализации: обзор концепции. Журнал наркологических заболеваний 23, 39 – 53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Джонсон, П.М. и Кенни, П.Дж. Дофаминовые рецепторы D2 при зависимой дисфункции вознаграждения и компульсивном переедании у тучных крыс. Природа нейробиологии 13, 635 – 641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Берридж, К.С. и Крингельбах, М.Л. Аффективная нейробиология удовольствия: награда у людей и животных. Психофармакология 199, 457 – 480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Берридж, К.С. и Крингельбах, М.Л. Системы удовольствия в мозге. Нейрон 86, 646 – 664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Шульц В. Сигнал прогнозирующего вознаграждения дофаминовых нейронов. J Neurophysiol 80, 1 – 27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH. Изменения активности мозга после ожирения, вызванного диетой. тучность 19, 749 – 756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. & Norgren, R. Механизмы допамина Accumbens в потреблении сахарозы. Brain Res 904, 76-84 (2001).
- 63.
Рада, П., Авена, Н.М. и Хобель, Б.Г. Ежедневное переедание сахара многократно высвобождает дофамин в прилежащей оболочке. неврология 134, 737 – 744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Белло, Н.Т., Лукас, Л.Р. и Хайнал, А. Повторный доступ к сахарозе влияет на плотность рецептора дофамина D2 в полосатом теле. Neuroreport 13, 1575-1578 (2002).
- 65.
Альсио Дж. и др., Экспрессия генов дофаминового рецептора D1 снижается в прилежащем ядре при длительном воздействии вкусной пищи и различается в зависимости от вызванного диетой фенотипа ожирения у крыс. неврология 171, 779 – 787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Бассарео, В. и Ди Кьяра, Дж. Различное влияние ассоциативных и неассоциативных механизмов обучения на реакцию префронтальной и прилежащей передачи дофамина на пищевые стимулы у крыс, получавших ad libitum. J Neurosci 17, 851-861 (1997).
- 67.
Волков, Н.Д., Ван, Г.Дж., Томази, Д. и Балер, Р.Д. Несбалансированные нейронные цепи при зависимости. Curr Opin Neurobiol 23, 639 – 648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Броган, А., Хеви, Д. и Пигнатти, Р. Анорексия, булимия и ожирение: общие недостатки в принятии решений по задаче об азартных играх штата Айова (IGT). J Int Neuropsychol Soc 16, 711 – 715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Дэвис, К., Левитан, Р. Д., Маглиа, П., Бьюэлл, К. и Кеннеди, Дж. Л. Дефицит принятия решений и переедание: модель риска ожирения. Obes Res 12, 929 – 935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Волков, Н.Д. и др., Рецепторы стриталя D2 с низким допамином связаны с префронтальным метаболизмом у лиц с ожирением: возможные способствующие факторы. NeuroImage 42, 1537 – 1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, BW Центральное ядро миндалевидного тела взаимодействует с дорсолатеральным стриатумом, чтобы регулировать приобретение привычек. J Neurosci 32, 1073 – 1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Грант С. и др., Активация цепей памяти во время кия-индуцированной тяги кокаина. Proc Natl Acad Sci США 93, 12040-12045 (1996).
- 73.
Чайлдресс, AR и др., Лимбическая активация во время кия-индуцированной тяги кокаина. Am J Psychiatry 156, 11 – 18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Малер, С.В. и Берридж, К.С. Что и когда «хотеть»? Основанное на миндалевидном теле сосредоточение внимания на сахаре и сексе. Психофармакология 221, 407 – 426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Кооб, Г. Ф. и Волков, Н. Д. Нейробиология зависимости: нейросхемный анализ. Ланцет Психиатрия 3, 760 – 773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Хаазе, Л., Серф-Дюкастель, Б. и Мерфи, К. Активация коры головного мозга в ответ на чисто вкусовые стимулы во время физиологических состояний голода и сытости. NeuroImage 44, 1008 – 1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Фотрос А. и др., Высвобождение допамина, вызванное кокаиновой репликой, в миндалевидном теле и гиппокампе: исследование ПЭТ [(1) (8) F] с высоким разрешением у пациентов с кокаинзависимой зависимостью. Нейропсихофармакологии 38, 1780 – 1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Вайс, Ф. и др., Контроль поведения кокаина в поисках кокаина с помощью связанных с наркотиками стимулов у крыс: влияние на восстановление убитых уровней оперант-ответного и внеклеточного дофамина в миндалине и прилежащем ядре. Proc Natl Acad Sci США 97, 4321-4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Антагонизм к рецепторам D1 или D2 допамина в базолатеральной миндалине по-разному изменяет приобретение ассоциаций кокаин-сигнал, необходимых для возобновления поиска кокаина, вызванного сигналом. неврология 137, 699 – 706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Туоминен Л. и др., Аберрантное мезолимбическое дофамин-опиатное взаимодействие при ожирении. NeuroImage 122, 80 – 86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Шульц, В. Поведенческие дофаминовые сигналы. Тенденции Neurosci 30, 203 – 210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Тинг, AKR и ван дер Кой, Д. Нейробиология опиатной мотивации. Холодная весна Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP. Никотиновые и опиоидные рецепторы регуляции передачи, опосредованной дофаминовым D2-рецептором в полосатом теле. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Номура, Ю. и др., Связанное с возрастом снижение доступности дофаминовых рецепторов D2 / 3, измеренное с помощью [C-11] раклоприда в нешиатальных областях мозга человека: сравнение четырех методов. NeuroImage 41T133 – T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Алакуртти, К. и др., Долговременный тест-повторная проверка достоверности связывания с рецептором стриатального и экстрастриатального допамина D2 / 3: исследование с [(11) C] раклопридом и ПЭТ с высоким разрешением. J Cereb Blood Flow Metab 35, 1199 – 1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Пиччини, П., Павезе, Н. и Брукс, Д. Д. Эндогенное высвобождение дофамина после фармакологических проблем при болезни Паркинсона. Энн Neurol 53, 647 – 653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Савамото, Н. и др., Когнитивный дефицит и выброс стриато-лобного дофамина при болезни Паркинсона. Мозг 131, 1294 – 1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Свенссон, JE и др., Обоснованность и достоверность количественного определения связывания внеклеточного [(11) C] раклоприда в мозге живого человека. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Цукада, Х. и др., Изофлурановая анестезия усиливает ингибирующее действие кокаина и GBR12909 на переносчик дофамина: исследования ПЭТ в сочетании с микродиализом в мозге обезьяны. Brain Res 849, 85-96 (1999).
- 90.
Хассун, В. и др., ПЭТ исследование связывания [11C] раклоприда в полосатом теле бодрствующей кошки: эффекты анестетиков и роль мозгового кровотока. Европейский журнал ядерной медицины и молекулярной визуализации 30, 141 – 148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Серафини, Г., Хоуленд, Р., Роведи, Ф., Жирарди, П. и Аморе, М. Роль кетамина в устойчивой к лечению депрессии: систематический обзор. Curr Neuropharmacol 12, 444 – 461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Берман, РМ и др., Антидепрессантное действие кетамина у пациентов с депрессией. Biol психиатрии 47, 351-354 (2000).
- 93.
Браун, Калифорния, и Лаки, И. Антидепрессивные эффекты кетамина: механизмы, лежащие в основе новых быстродействующих антидепрессантов. Фронт Фармакол 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Аалто С. и др., Кетамин не снижает связывания стриатального допамина с рецептором D2 у человека. Психофармакология 164, 401 – 406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Хашимото К., Какиучи Т., Охба Х., Нишияма С. и Цукада Х. Снижение связывания дофаминового рецептора D2 / 3 в полосатом теле после однократного введения эскетамина, но не R-кетамина: ПЭТ учиться на сознательных обезьянах. Eur Arch Psychiatry Clin Neurosci 267, 173 – 176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Альструп, АК и др., Влияние анестезии и видов на поглощение или связывание радиолигандов в естественных условиях в Геттингенской минипиг. BioMed Research International 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Лиллеруп, ТП и др., Продольная моноаминергическая ПЭТ-визуализация хронического ингибирования протеасом у мини-свиней. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE Стратегии улучшения оценки параметров нейрорецепторов с помощью анализа линейной регрессии. J Cereb Blood Flow Metab 22, 1271 – 1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Логан, Дж. и др., Соотношение объемов распределения без отбора проб крови из графического анализа данных ПЭТ. J Cereb Blood Flow Metab 16, 834 – 840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Эндрес, К.Дж., Бенчериф, Б., Хилтон, Дж., Мадар, И. и Фрост, Дж. Дж. Количественная оценка мю-опиоидных рецепторов мозга с помощью [11C] карфентанила: методы эталонной ткани. Nucl Med Biol 30, 177-186 (2003).
- 101.
Панксепп, Дж. И Бишоп, П. Авторадиографическая карта связывания (3H) дипренорфина в мозге крысы: эффекты социального взаимодействия. Brain Res Bull 7, 405-410 (1981).
- 102.
Ландау, AM и др., Электросудорожная стимуляция по-разному влияет на связывание [(11) C] 100,907 5 леев с кортикальными и подкорковыми 2HTXNUMXA-рецепторами в головном мозге свиньи. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Бьяркам, CR, Глуд, А.Н., Орловски, Д., Соренсен, JCH, и Паломеро-Галлахер, Н. Конечный мозг мини-свиньи Геттингена, цитоархитектура и анатомия поверхности коры. Эффект мозговой структуры 222, 2093 – 2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Орловски, Д., Глуд, А.Н., Паломеро-Галлахер, Н., Соренсен, JCH и Бьяркам, С.Р. Гистологический онлайн-атлас мозга миниатюрной свиньи Геттингена. Heliyon 5, с01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Благодарности
Финансирование исследования финансировалось Орхусским университетом «Грант на разработку проекта AU» для AML. Мы благодарны за техническую поддержку со стороны сотрудников ПЭТ-центра Орхусской университетской больницы и Фермы Орхусского университета за помощь в лечении животных. Мы благодарим профессора Мортена Крингельбаха, профессора Йоргена Шил-Крюгера и доцента Арне Мёллера за помощь в начале этих исследований.
Этические декларации
Конфликт интересов
Авторы не заявляют никаких конкурирующих интересов.
Дополнительная информация
Примечание издателя Природа Спрингера остается нейтральной в отношении юрисдикционных требований в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья лицензируется в соответствии с международной лицензией Creative Commons Attribution 4.0, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы предоставили соответствующий кредит первоначальному автору (авторам) и источнику. ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие материалы третьих лиц, представленные в этой статье, включены в лицензию Creative Commons этой статьи, если иное не указано в кредитной линии материала. Если материал не включен в лицензию Creative Commons данной статьи и ваше предполагаемое использование не разрешено законодательством или превышает допустимое использование, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.