COMENTARIOS: Excelente revisión de casi todas las investigaciones relevantes sobre los receptores de andrógenos, la dopamina y la función sexual. Fantástico dibujo de las interrelaciones del circuito hipotálamo-recompensa.
Horm Behav. 2008 mayo; 53(5): 647-658.
Publicado en línea 2008 Febrero 13. doi 10.1016 / j.yhbeh.2008.01.010
Resumen
La adolescencia se asocia con aumentos en los comportamientos de búsqueda de placer, que, a su vez, están configurados por la activación puberal del eje hipotálamo-hipófisis-gonadal. En modelos animales de comportamientos naturalmente gratificantes, como el sexo, los andrógenos testiculares contribuyen al desarrollo y la expresión del comportamiento en los machos. Para efectuar la maduración del comportamiento, el cerebro experimenta una remodelación significativa durante la adolescencia, y muchos de los cambios también son sensibles a los andrógenos, supuestamente que actúan a través de los receptores de andrógenos (AR). Dada la delicada interacción de las hormonas gonadales y el desarrollo cerebral, no es sorprendente que la interrupción de los niveles hormonales durante este período sensible altere significativamente los comportamientos de los adolescentes y los adultos. En los hámsters machos, se requiere la exposición a la testosterona durante la adolescencia para la expresión normal de la conducta sexual adulta. Los machos privados de andrógenos durante la pubertad muestran déficits sostenidos en el apareamiento. A la inversa, los andrógenos solos no son suficientes para inducir el apareamiento en machos prepúberes, aunque la RA cerebral está presente antes de la pubertad. En este contexto, el uso generalizado de esteroides anabólico-androgénicos (AAS) durante la adolescencia es una preocupación importante. El abuso de AAS tiene el potencial de alterar tanto el tiempo como los niveles de andrógenos en los varones adolescentes. En los hámsters, la exposición a AAS de los adolescentes aumenta la agresión y causa cambios duraderos en los sistemas de neurotransmisores. Además, los AAS también son reforzantes, como lo demuestra la autoadministración de testosterona y otros AAS. Sin embargo, evidencia reciente sugiere que los efectos de refuerzo de los andrógenos pueden no requerir AR clásica. Por lo tanto, se requiere un mayor examen de las interacciones entre los andrógenos y las conductas gratificantes en el cerebro adolescente para una mejor comprensión del abuso de AAS.
General
La adolescencia despierta el cerebro tanto a gusto como a riesgo. En los adolescentes humanos, esto frecuentemente toma la forma de experimentación con drogas y sexo. En los Estados Unidos, la edad media para el primer coito en los hombres es 16.4 años, y el 65% ha tenido relaciones sexuales por grado 12th (Fundación de la Familia Kaiser, 2005). Asimismo, esta población tiene las tasas más altas de uso de drogas ilícitas en los Estados Unidos. Según la Encuesta nacional de 2004 sobre el uso y la salud de las drogas, el 38% de hombres de edades 18-25 consumió una droga ilícita en el último año (SAMHSA / OEA, 2005). Además, 31% de los adolescentes varones consumieron drogas o alcohol durante su último encuentro sexual (Fundación de la Familia Kaiser, 2005). Además, la adolescencia es un momento crucial en la etiología de ciertas psicopatologías, como depresión, ansiedad, trastornos alimentarios y trastornos de la conducta. Planteamos que la secreción puberal de las hormonas gonadales, su activación de los receptores de esteroides en el cerebro y la interacción entre la hormona y la experiencia en el desarrollo del cerebro adolescente contribuyen a los cambios de comportamiento observados durante la adolescencia.
Nuestro objetivo aquí es revisar la evidencia de que los andrógenos gonadales median la maduración del adolescente y el desempeño adulto de comportamientos motivados, así como las propiedades gratificantes de estos comportamientos. También presentamos evidencia de que la testosterona en sí misma es gratificante, lo que probablemente contribuye a los cambios en la maduración de los comportamientos motivados durante la adolescencia, cuando los niveles de testosterona se disparan. El enfoque de este documento se centra en nuestros estudios de circuitos neuronales que subyacen en el comportamiento sexual masculino, especialmente en el hámster sirio, con especial énfasis en la interacción entre la testosterona y la dopamina (DA). Proponemos que los andrógenos de la pubertad tienen efectos transitorios y a largo plazo en los circuitos de recompensa y el comportamiento motivado. Además, planteamos la hipótesis de que la suplementación con andrógenos exógenos en forma de esteroides anabólicos-androgénicos (AAS, por sus siglas en inglés) aumenta las influencias normales de los andrógenos de la pubertad, lo que afecta negativamente el desarrollo del cerebro y el comportamiento de los adolescentes.
La adolescencia como periodo sensible para el desarrollo cerebral.
En última instancia, el cerebro es tanto un desencadenante como un objetivo de la acción de los andrógenos durante la adolescencia. En niños pequeños (<12 años) y hámsteres jóvenes (<28 días de edad), los andrógenos y gonadotropinas circulantes se encuentran en niveles basales. A medida que aumenta la secreción de hormona luteinizante de la glándula pituitaria anterior en respuesta a la hormona liberadora de gonadotropina hipotalámica, las concentraciones de testosterona circulante aumentan significativamente. Esto ocurre en el estadio II / III de Tanner (14 años) en los niños y en los 28 días de edad en los hámsteres. Cuando los niños alcanzan la etapa IV / V de Tanner (alrededor de los 16 años de edad) o cuando los hámsteres tienen entre 50 y 60 días de edad, la testosterona endógena se encuentra dentro del rango de los machos adultos. La secreción de hormonas puberales coincide con el período de la adolescencia, que tiene lugar aproximadamente entre los 12 y los 20 años de edad en el ser humano. Las hormonas puberales no solo actúan sobre los tejidos periféricos para provocar la aparición de características sexuales secundarias que son signos evidentes de la pubertad, sino que también actúan de manera central para influir tanto en la remodelación del cerebro adolescente como en la maduración del comportamiento. Además, los cambios fisiológicos y neurológicos provocados por las hormonas de la pubertad conducen a cambios significativos en la experiencia de un individuo, lo que en sí mismo puede alterar profundamente el curso del desarrollo cerebral. Por lo tanto, el aumento de las hormonas esteroides sexuales en la pubertad, impulsado por la maduración cronometrada del desarrollo del eje neuroendocrino reproductivo, moldea a su vez el desarrollo conductual del adolescente a través de influencias tanto directas como indirectas sobre el sistema nervioso.
La adolescencia humana ahora es reconocida como un período importante y dinámico de desarrollo neuronal durante el cual se remodelan y refinan los circuitos conductuales. Aunque el cerebro de un niño de 5 años ya es 90% de su tamaño adulto (Dekaban, 1978), remodelación significativa aún está por venir. Este concepto fue avivado por investigaciones en humanos y animales que documentan que muchos de los procesos de desarrollo básicos que ocurren durante el desarrollo cerebral perinatal se recapitulan durante la adolescencia. Estos procesos incluyen la neurogénesis (Eckenhoff y Rakic, 1988; Él y Crews, 2007; Pinos, Collado, Rodriguez-Zafra, Rodriguez, Segovia y Guillamon, 2001; Rankin, Partlow, McCurdy, Giles y Fisher, 2003), muerte celular programada (Núñez, Lauschke y Juraska, 2001; Nunez, Sodhi y Juraska, 2002), elaboración y poda de arborizaciones y sinapsis dendríticas (Andersen, Rutstein, Benzo, Hostetter y Teicher, 1997; Huttenlocher y Dabholkar, 1997; Lenroot y Giedd, 2006; Sowell, Thompson, Leonard, Welcome, Kan y Toga, 2004), mielinización (Benes, Turtle, Khan y Farol, 1994; Paus, Collins, Evans, Leonard, Pike y Zijdenbos, 2001; Sowell, Thompson, Tessner y Toga, 2001), y la diferenciación sexual (Chung, De Vries y Swaab, 2002; Davis, Shryne y Gorski, 1996; Nunez et al., 2001). Por lo tanto, la trayectoria de desarrollo del cerebro postnatal no es lineal, sino que se caracteriza por una explosión adolescente de rápido cambio e involucra eventos tanto progresivos como regresivos. Como sabe cualquier biólogo del desarrollo, los períodos de cambio rápido en el desarrollo indican una mayor sensibilidad y vulnerabilidad tanto al cambio dependiente de la experiencia como a las consecuencias adversas de la perturbación y el insulto, y no hay ninguna razón para pensar que el desarrollo del cerebro humano adolescente sea una excepción (Andersen, 2003; Lanza, 2000). Por lo tanto, se predice que las perturbaciones en el tiempo de las influencias de la hormona puberal en el cerebro adolescente tendrán consecuencias duraderas para la conducta adulta.
Andrógenos y circuitos neurales para el comportamiento motivado
Debido a que la adolescencia es una fase transitoria y dinámica de desarrollo, sería difícil evaluar el cerebro y el comportamiento del adolescente de forma aislada. En cambio, para apreciar el carácter único de la adolescencia, es útil contrastarlo con el cerebro y el comportamiento de los adultos maduros. Por lo tanto, con el enfoque de este artículo sobre el comportamiento sexual masculino y la recompensa, aquí es importante introducir los circuitos neuronales para la cópula y la motivación sexual en hombres adultos, incluido el papel de las hormonas esteroides gonadales en la activación del comportamiento y la distribución de receptores para los andrógenos. (AR) y estrógenos (ER).
Las AR están presentes en grupos celulares que forman los circuitos neuronales que median los comportamientos sociales gratificantes, como el sexo. Además, las RA cerebrales se expresan antes de la pubertad en hámsters y están reguladas por los andrógenos tanto en machos juveniles como adultos (Kashon, Hayes, Shek y Sisk, 1995; Meek, Romeo, Novak y Sisk, 1997). En el cerebro de roedores, hay una superposición sustancial en la distribución de AR y ER (Madera y Newman, 1995), y aromatasa (Celotti, Negri-Cesi y Poletti, 1997), incluidas las formas α y β del receptor de estrógeno (Shughrue, Lane, y Merchenthaler, 1997). Al unirse al ligando, AR y ER "clásicos" funcionan como factores de transcripción para inducir la transcripción y síntesis de nuevas proteínas. No es sorprendente que estos efectos sigan un curso de tiempo relativamente lento, con un inicio de acción retardado. Estimulación esteroidea del comportamiento sexual del hámster macho (Noble y Alsum, 1975) es consistente con acciones a través de acciones genómicas clásicas. Por ejemplo, se requieren 2 semanas de exposición a esteroides para restaurar el apareamiento en castrados a largo plazo. Estudios más recientes en ratas también han demostrado efectos celulares rápidos de andrógenos en regiones del cerebro que poseen pocos receptores clásicos (Mermelstein, Becker y Surmeier, 1996). Se piensa que estas acciones esteroides están mediadas por receptores no genómicos. Mientras que la distribución de AR clásica y ER en el cerebro del hámster es relativamente restringida (Madera y Swann, 1999), los objetivos cerebrales potenciales para la acción androgénica no genómica son mucho más amplios.
El área preóptica medial (MPOA) desempeña un papel central en la copulación en machos, desde peces de colores hasta humanos (revisado en Casco, madera y McKenna, 2006). Además, el MPOA de hámster transduce hormonas esteroides gonadales a través de AR y ER abundantes, y los implantes de testosterona en MPOA son suficientes para restablecer la actividad sexual en los castrados a largo plazo (Madera y Swann, 1999). En ratas macho, los esteroides gonadales actúan en el MPOA para regular la liberación basal de DA (Putnam, Sato y Hull, 2003) y estimular el apareamiento (Casco, Du, Lorrain y Matuszewich, 1995). Inicialmente, hay un aumento modesto en DA cuando una mujer se presenta detrás de una pantalla. Durante la copulación, MPOA DA aumenta aún más (+ 50% de la línea de base), y este efecto requiere andrógenos (Hull et al., 1995; Putnam et al., 2003). No es sorprendente que en los machos castrados que no se aparean, el MPOA DA no se incremente (Hull et al., 1995). Es un tanto difícil interpretar este resultado, ya que la falta de liberación de DA se confunde con la ausencia de actividad sexual. Sin embargo, la liberación de DA en MPOA se correlaciona con la pérdida de apareamiento en los castrados a corto plazo (Hull et al., 1995), y con la restauración de la actividad sexual inducida por la testosterona en los castrados a largo plazo (Du, Lorrain y Hull, 1998; Putnam, Du, Sato y Hull, 2001).
Dentro del MPOA del roedor, los metabolitos androgénicos y estrogénicos de la testosterona desempeñan papeles específicos en la regulación del apareamiento (Putnam et al., 2003; Putnam, Sato, Riolo y Hull, 2005). La latencia para iniciar la copulación (montaje o intromit) es una medida de la motivación sexual. La latencia a la actividad sexual es sensible a los estrógenos, a través del mantenimiento de la sintasa de óxido nítrico MPOA, que a su vez, mantiene los niveles basales de DA. Los castrados tratados con estrógeno muestran altos niveles basales de DA, que se correlacionan fuertemente con la capacidad de iniciar la copulación. Sin embargo, no muestran los aumentos inducidos por la mujer y la cópula en la liberación de DA, que se correlacionan fuertemente con el rendimiento sexual. En consecuencia, su rendimiento sexual está por debajo de los niveles intactos. Por otro lado, los castrados tratados con andrógenos no aromatizables solos no muestran niveles basales elevados de DA, y no pueden iniciar la copulación. Por lo tanto, para un desempeño sexual normal, se requieren estrógenos y andrógenos. El desempeño sexual generalmente se expresa como medidas de frecuencia de montajes, intromisiones y eyaculaciones. Solo cuando se reemplazan los estrógenos y los andrógenos, los machos castrados exhiben niveles elevados de DA (y medidas de latencia más cortas) y aumentos de DA inducidos por la mujer y la cópula (y medidas de frecuencia aumentadas). De esta manera, los estrógenos en MPOA contribuyen a la motivación sexual, y tanto los estrógenos como los andrógenos para el desempeño sexual.
Aunque la testosterona es necesaria para la liberación de MPOA DA durante el comportamiento de la copulación masculina y para aparearse, ni la testosterona ni el apareamiento por sí solos pueden provocar la DA en MPOA. En su lugar, también se requieren señales quimiosensoriales de hembras conspecíficas para la liberación de DA en MPOA. En roedores, los estímulos quimiosensoriales son la modalidad sensorial primaria para iniciar el comportamiento sexual masculino ( ). Las señales quimiosensoriales se transmiten desde los bulbos olfativos a MPOA a través del núcleo amigdaloide medial y el núcleo del lecho de la estría terminal, estructuras con AR y ER abundantes (Madera y Swann, 1999). Para determinar el papel de las señales quimiosensoriales en la DA inducida por el apareamiento, medimos la MPOA DA durante el apareamiento en hámsters machos intactos con gónadas con bulbectomía olfatoria unilateral (UBx, Triemstra, Nagatani y Madera, 2005). Aunque la extracción bilateral de los bulbos olfativos elimina la actividad sexual y la liberación de MPOA DA, la bulectomía unilateral no interfiere con el apareamiento. En este estudio, la cópula indujo la liberación de MPOA DA cuando se midió contralateral al bulbo olfativo lesionado, pero no en el hemisferio ipsilateral ( ). Se observaron resultados similares en ratas macho con lesiones de la amígdala medial (Domínguez, Riolo, Xu y Hull, 2001). En un estudio relacionado, la estimulación química de la amígdala medial en ratas indujo una liberación de MPOA DA equivalente a la de la copulación (Domínguez y casco, 2001). Tomados en conjunto, estos datos sugieren que la testosterona crea un ambiente permisivo que permite que los estímulos sensoriales externos alcancen el MPOA e induzcan la liberación de DA durante la copulación.

En última instancia, el comportamiento sexual y otras recompensas naturales activan las vías de recompensa neuronal. El circuito mesocorticolímbico DA consiste en el área tegmental ventral (VTA), el núcleo accumbens (Acb) y la corteza prefrontal (Pfc). Los cuerpos de células de dopamina que residen en el proyecto de VTA rostralmente al Acb y Pfc (Koob y Nestler, 1997). En ratas, DA se libera en Acb durante el sexo (Pfaus, Damsma, Nomikos, Wenkstern, Blaha, Phillips y Fibiger, 1990). Muchas drogas de abuso también actúan en el sistema mesolímbico de DA para aumentar la liberación de DA (anfetaminas) o inhibir la recaptación de DA (cocaína, Di Chiara y Imperato, 1988), reforzando así sus propiedades adictivas. De esta manera, la testosterona tiene el potencial de afectar la liberación de DA en Acb, tanto a través de la mejora de la conducta sexual, como a través de sus acciones como una droga de abuso (ver más abajo).
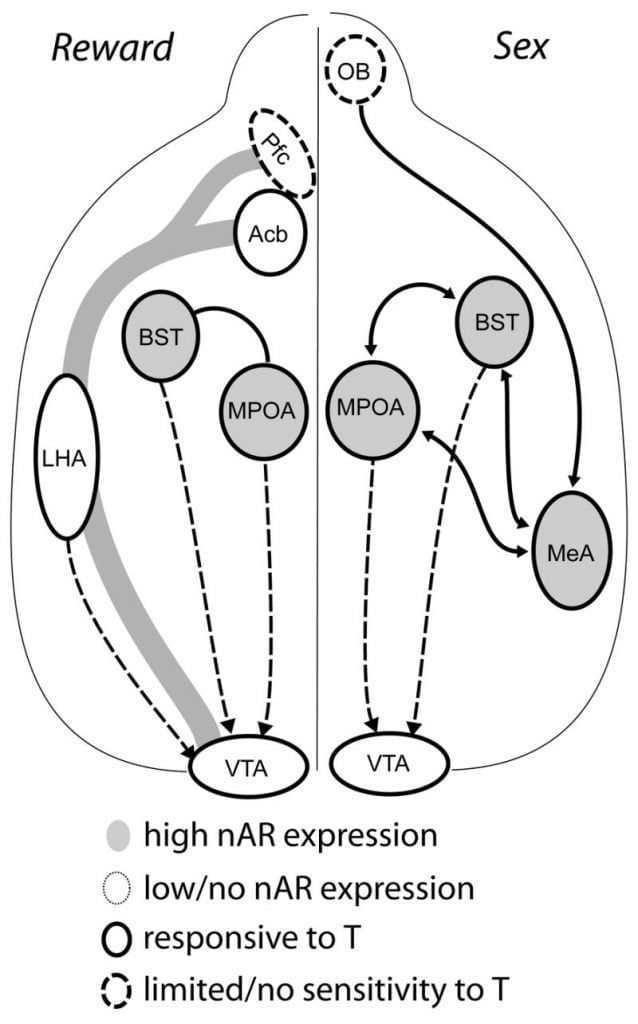
La evidencia actual sugiere que el sistema mesocorticolímbico DA madura durante la adolescencia. Las densidades de fibra de Acb DA aumentan dramáticamente durante la adolescencia en los jerbos, lo que sugiere que la maduración significativa de las proyecciones dopaminérgicas VTA al Acb ocurre durante el período de la adolescencia (Lesting, Neddens y Teuchert-Noodt, 2005). Además, el aporte dopaminérgico a las células érgicas de GABA (ácido γ-aminobutírico) en la corteza prefrontal medial de rata es enriquecido y modulado por los sistemas serotoninérgicos durante el desarrollo de la pubertad (Benes, Taylor y Cunningham, 2000), y la manipulación de andrógenos en ratas adultas conduce a cambios en la densidad del axón dopaminérgico dentro de la corteza prefrontal (Kritzer, 2003). El Pfc, Acb y el VTA tienen poca AR o ER, aunque ERβ está presente en el VTA (Shughrue et al., 1997). Por lo tanto, parece probable que los andrógenos afecten el sistema mesocorticolímbico DA a través de aferentes sensibles a los andrógenos o a través de ERβ en el VTA como en el hipotálamo (Handa et al., Este problema). Nuestros datos muestran que las células sensibles a los andrógenos en hámsters machos se proyectan al VTA desde estructuras asociadas con comportamientos sensibles a los esteroides. Por ejemplo, tanto el MPOA como el núcleo del lecho de la estría terminal (BST) contienen un gran número de células AR positivas que se proyectan al VTA (Sato y Madera, 2006). El pálido ventral, el principal objetivo eferente de Acb (Zahm y Heimer, 1990), también contiene muchas células AR positivas que se proyectan al VTA. Estas proyecciones brindan una oportunidad para que los andrógenos modifiquen la actividad del sistema DA mesocorticolímbico.
Organización del comportamiento dependiente de esteroides durante la adolescencia.
La visión tradicional de la acción hormonal en el comportamiento de los adolescentes se basa en los efectos activadores de las hormonas esteroides, que se refieren a la capacidad de los esteroides para facilitar el comportamiento en contextos sociales específicos mediante la acción dentro de las células diana en el comportamiento subyacente de los circuitos neuronales. Los efectos de activación son transitorios en el sentido de que aparecen y desaparecen con la presencia y ausencia de hormonas, y suelen asociarse con la expresión de la conducta adulta. En contraste, los efectos organizacionales se refieren a la capacidad de los esteroides para esculpir la estructura del sistema nervioso durante el desarrollo. La organización estructural es permanente, persiste más allá del período de exposición a la hormona y determina las respuestas neuronales y de comportamiento a los esteroides en la edad adulta. Nuestra comprensión de la relación de desarrollo entre los efectos organizativos y de activación de las hormonas esteroides ha evolucionado en los últimos años de 50. Phoenix y sus colegas propusieron por primera vez que las respuestas de comportamiento (activacionales) de los adultos a las hormonas esteroides estén programadas (organizadas) por las hormonas esteroides durante un período de desarrollo perinatal altamente sensible (Phoenix, Goy, Gerall y Young, 1959). Más tarde, Scott y sus colegas establecieron las bases teóricas para la existencia de múltiples períodos sensibles para la organización progresiva del sistema nervioso, y observaron que es más probable que ocurran períodos sensibles durante períodos de rápido cambio de desarrollo (1974). Posteriormente, Arnold y Breedlove señalaron que la organización del cerebro dependiente de esteroides puede ocurrir fuera de los períodos sensibles del desarrollo (Arnold y Breedlove, 1985). En los últimos años de 15, la investigación que emplea una variedad de modelos animales y sistemas de comportamiento deja en claro que el cerebro adolescente es sensible a los efectos de activación y organización de los esteroides gonadales (revisado en Sisk y Zehr, 2005). Y, al igual que otros períodos de rápido cambio en el desarrollo, la adolescencia representa una ventana de oportunidad definida para la remodelación cerebral dependiente de esteroides.
Nuestro trabajo sobre el uso del hámster como modelo animal proporciona evidencia de que los esteroides modifican los comportamientos sociales masculinos durante la adolescencia (Schulz, Menard, Smith, Albers y Sisk, 2006; Schulz y Sisk, 2006). Antes de la pubertad, el tratamiento con testosterona no puede activar el comportamiento sexual en hámsters, lo que sugiere que aún no se han producido procesos de maduración que hacen que los circuitos neuronales sean susceptibles de activación o de organización por las hormonas esteroides (Meek et al., 1997; Romeo, Richardson y Sisk, 2002a). Por el contrario, mientras que la expresión abierta del comportamiento reproductivo masculino en la edad adulta no requiere absolutamente la presencia de esteroides gonadales durante la adolescencia, la expresión máxima del comportamiento sí lo requiere. Comparando el comportamiento reproductivo masculino en machos castrados antes de la pubertad (NoT@P) o postpuberalmente (T@P) y luego tratados con testosterona en la edad adulta, los castrados prepuberales NoT@P tienen al menos un 50% de déficit en el comportamiento masculino en comparación con los machos castrados después de la adolescencia ( , Schulz, Richardson, Zehr, Osetek, Menard y Sisk, 2004). Además, las deficiencias en el comportamiento reproductivo son duraderas y no pueden superarse ni con el tratamiento prolongado de testosterona ni con la experiencia sexual en la edad adulta (Schulz et al., 2004). De manera similar, después del tratamiento con estrógenos y progesterona, los machos NoT@P muestran latencias de lordosis más cortas y duraciones de lordosis más largas que los machos castrados en la edad adulta.Schulz et al., 2004), lo que sugiere que los castrados prepúberes están menos defeminados que los machos expuestos a la testosterona puberal.

Puede ser que los hombres NoT@P sufran de una disminución de la motivación sexual. Una forma de abordar esta pregunta es comparar las latencias para participar tanto en la investigación anogenital (AGI) como en el montaje entre machos gonadectomizados antes (NoT@P) y después de la pubertad (T@P). Si la motivación sexual depende de la exposición a hormonas gonadales durante la adolescencia, predeciríamos latencias más prolongadas para participar en el comportamiento sexual en los hombres NoT@P. De hecho, con la exposición repetida a las hembras en celo, los machos NoT@P tardan más en comenzar el AGI y el montaje en comparación con los machos T@P ( ). Así, además de organizar los aspectos del desempeño sexual, parece que las hormonas puberales también organizan los aspectos gratificantes del comportamiento sexual. En apoyo de esta posibilidad, la administración central del agonista DA apomorfina en la edad adulta restaura el comportamiento de montaje de los machos NoT@P a los niveles típicos de los adultos, lo que sugiere que la testosterona durante la adolescencia normalmente organiza los circuitos neuronales dopaminérgicos (Salas-Ramirez, Montalto y Sisk, 2006). ). No obstante, quedan muchas preguntas interesantes. ¿Presionaría un macho NoT@P por una hembra en estro o desarrollaría una preferencia de lugar condicionada para un lugar de apareamiento? La investigación futura explorará el papel de las hormonas puberales en la organización de la motivación sexual y el rendimiento sexual.

Latencias y duraciones de la investigación anogenital (AGI) exhibidas por hámsteres machos gonadectomizados antes de la pubertad (NoT@P) o después de la pubertad (T@P). Todos los machos fueron preparados con testosterona en la edad adulta, 7 semanas después de la gonadectomía y una semana antes de la primera prueba de comportamiento. A. Los machos T@P mostraron latencias AGI similares en las tres pruebas con una hembra en celo, mientras que los machos NoT@P aumentaron las latencias AGI durante la tercera prueba con una hembra en celo. B. Los machos T@P disminuyeron las latencias de monta en las tres pruebas de comportamiento con una hembra en estro, mientras que los machos noT@P no mostraron cambios en la latencia de monta en las tres pruebas de comportamiento. Estos datos sugieren que las hormonas gonadales puberales tienen efectos facilitadores duraderos en la motivación de los hombres adultos para involucrarse en el comportamiento sexual con una mujer. (Datos no publicados de sujetos animales en Schulz, KM, Richardson, HN, Zehr, JL, Osetek, AJ, Menard, TA y Sisk, CL, 2004).
Respuestas conductuales prepúberes a los esteroides.
Uno de los enigmas persistentes del desarrollo del comportamiento de los adolescentes es por qué la activación del comportamiento reproductivo en respuesta a la exposición a esteroides se atenúa en los hámsters machos prepúberes. Si los niveles bajos de andrógenos antes de la pubertad limitan la expresión del comportamiento sexual masculino en los machos prepúberes, entonces la suplementación con andrógenos endógenos en los machos prepúberes debería provocar el apareamiento. Esto resulta no ser el caso (Meek et al., 1997; Romeo, Cook-Wiens, Richardson y Sisk, 2001; Romeo, Wagner, Jansen, Diedrich y Sisk, 2002b), a pesar del hecho de que el número y la distribución de AR y ER a lo largo del circuito de apareamiento son similares en los castas prepúberes y en adultos tratados con hormonas (Meek et al., 1997; Romeo, Diedrich y Sisk, 1999; Romeo et al., 2002a). Por lo tanto, parece que los andrógenos y AR son necesarios pero no suficientes para la expresión del comportamiento sexual masculino.
Los esfuerzos para identificar los factores que limitan la actividad sexual antes de la pubertad han sido hasta ahora mixtos. Las respuestas de Fos a las señales quimiosensoriales de hembras con celo son similares en hámsters machos prepúberes y adultos (Romeo, Parfitt, Richardson y Sisk, 1998). Estos datos demuestran que los mecanismos de transducción sensorial están maduros antes de la pubertad. Por lo tanto, los machos juveniles son capaces de detectar señales quimiosensoriales de las hembras; Donde difieren de los adultos es en cómo responden a esas señales. Una posible explicación es que los varones prepúberes no están motivados para participar en el comportamiento sexual. Hemos encontrado que los hámsters machos prepúberes no muestran un aumento de las respuestas dopaminérgicas en el MPOA en respuesta a las feromonas femeninas, mientras que los machos adultos sexualmente ingenuos muestran respuestas dopaminérgicas robustas del MPOA a los mismos estímulos ( , Schulz, Richardson, Romeo, Morris, Lookingland y Sisk, 2003). De manera similar, los varones prepúberes no muestran el aumento típico de los adultos en la testosterona circulante después de la exposición a las feromonas femeninas (Parfitt, Thompson, Richardson, Romeo y Sisk, 1999). Por lo tanto, las feromonas femeninas parecen ser un estímulo no condicionado para las respuestas neuroquímicas y neuroendocrinas en varones adultos, pero no prepúberes, lo que sugiere que la prominencia de estos estímulos sensoriales socialmente relevantes cambia durante el desarrollo puberal, posiblemente relacionado con la adquisición de propiedades gratificantes y la motivación sexual. Además, aunque la testosterona facilita el AGI de una hembra en los machos prepúberes, este efecto depende de si el macho ha tenido o no exposición previa a una hembra de estro. Quizás sorprendentemente, el tratamiento con testosterona disminuye la latencia y aumenta la duración de la IAG solo en hombres prepúberes sexualmente ingenuos ( ). Además, los hombres prepúberes que han tenido una experiencia previa con una mujer muestran latencias AGI mucho más largas y duraciones AGI más cortas que los hombres que interactúan con mujeres receptivas por primera vez ( ). Estos datos sugieren que las interacciones con una hembra de estro son aversivas en lugar de gratificantes antes de la pubertad, eliminando así cualquier efecto facilitador de la testosterona en el AGI durante las interacciones posteriores con una hembra. Sería interesante saber si las consecuencias negativas del comportamiento de la exposición temprana a una hembra de estro persisten en la adolescencia y la edad adulta, especialmente dado que la exposición repetida a las hembras de celo durante La adolescencia en general facilita la expresión del comportamiento reproductivo masculino (Molenda-Figueira, Salas-Ramírez, Schulz, Zehr, Montalto y Sisk, 2007).

Respuestas dopaminérgicas del área preóptica medial masculina prepúberes y adultos (MPOA) a las feromonas femeninas contenidas en las secreciones vaginales. Los machos adultos muestran un aumento en la actividad dopaminérgica de MPOA con la exposición a las secreciones vaginales femeninas, mientras que los machos prepúberes no muestran un aumento en las respuestas dopaminérgicas de MPOA a las feromonas femeninas. (Redibujado de Schulz, KM, Richardson, HN, Romeo, RD, Morris, JA, Lookingland, KJ y Sisk, CL, 2003).

Aunque el tratamiento con andrógenos prepúberes no puede inducir la copulación, un trabajo reciente de nuestro laboratorio sugiere que el sistema nervioso del hámster es sensible a las acciones organizativas de la testosterona en el comportamiento reproductivo antes de la adolescencia (Schulz, Zehr, Salas-Ramirez y Sisk, 2007). La castración más 19 días de exposición a la testosterona antes o durante, pero no después de la adolescencia, facilitó el aumento del comportamiento cuando la testosterona se reemplazó en la edad adulta. Los varones expuestos a testosterona antes de la pubertad también mostraron más intromisiones en la edad adulta que los hombres expuestos a testosterona durante o después de la pubertad (Schulz et al., 2007). Estos datos sugieren que la capacidad de la testosterona para organizar los circuitos neuronales del comportamiento disminuye con la edad y que la adolescencia marca el final de un período prolongado postnatal sensible a la exposición a la testosterona.
Andrógenos farmacologicos
Los datos anteriores sugieren que los esteroides gonadales endógenos mejoran los comportamientos motivados durante la adolescencia. Ahora, ¿qué sucede si uno se auto administra andrógenos a niveles hasta concentraciones fisiológicas normales de 100x? Este es el problema del abuso de esteroides anabólico-androgénicos (AAS) (revisado en Brower, 2002; Clark y Henderson, 2003). Aquí es apropiada una breve digresión: todos los AAS son derivados de la testosterona, todos los AAS tienen un esqueleto de carbono con anillos fusionados con 4, la mayoría tienen carbonos 19. Los AAS se utilizan principalmente por sus efectos anabólicos (musculación). Sin embargo, como su nombre lo indica, AAS también tienen propiedades androgénicas. La testosterona es una opción lógica en estudios con animales para explorar mecanismos fundamentales de la recompensa de andrógenos. Sigue siendo una opción popular para los usuarios humanos, la mayoría de las veces en forma de ésteres de testosterona de acción prolongada, como el propionato de testosterona. En 2006, la testosterona fue la sustancia prohibida más común detectada en pruebas de orina en laboratorios acreditados por WADA (AMA, 2006). La testosterona representó la mayor fracción (34%) de las pruebas de orina positivas para AAS en los Juegos Olímpicos de Sydney 2000 (Van Eenoo y Delbeke, 2003). Del mismo modo, en pruebas de orina de usuarios de AAS, 41% dio positivo para testosterona (Brower, Catlin, Blow, Eliopulos, Beresford, 1991). En dosis altas, los AAS producen cambios de comportamiento significativos. En particular, debido a su estrecha relación con la testosterona, el uso de AAS en la adolescencia parecería perturbar el medio esteroide normal del sistema nervioso humano adolescente en desarrollo, incluida la cantidad, el momento y el tipo de exposición a los esteroides.
Al igual que con otras drogas ilícitas, el abuso humano de AAS es un problema de la adolescencia. Según la Encuesta Nacional de Hogares 1994 sobre el Uso de Drogas (SAMHSA / OEA, 1996), el uso de esteroides alcanza su punto máximo en la adolescencia tardía a los 18 años de edad. Además, en la encuesta Monitoreando el futuro (Johnston, O'Malley y Bachman, 2003), la incidencia de por vida del uso de esteroides entre los estudiantes de secundaria (2.7%) fue comparable a la de la cocaína crack (3.5%) o la heroína (1.4%). El uso de esteroides también es cada vez más común en las edades más jóvenes: 2.5% de los estudiantes de grado 8 (años 13-14) han usado esteroides, similar a la incidencia de crack (2.5%) y uso de heroína (1.6%). Esta tendencia hacia el uso de AAS en la adolescencia temprana es particularmente preocupante en vista de las preocupaciones 1) de que los adolescentes pueden ser particularmente vulnerables al abuso de AAS y 2) de que la exposición de los adolescentes a AAS a niveles farmacológicos puede alterar sustancialmente la maduración normal del cerebro y Comportamiento para producir respuestas morfológicas y de comportamiento exageradas, aguda y crónicamente.
La agresión inapropiada es la respuesta de comportamiento que se asocia con más frecuencia con el abuso humano de AAS. En informes de casos publicados, el uso de esteroides se ha implicado en varios asesinatos violentos (Conacher y Workman, 1989; Papa y Katz, 1990; Pope, Kouri, Powell, Campbell y Katz, 1996; Schulte, Hall y Boyer, 1993). En las encuestas de los usuarios actuales de AAS, la agresividad y la irritabilidad elevadas fueron los efectos secundarios más comunes del uso de AAS (Bond, Choi, y el Papa, 1995; Galligani, Renck y Hansen, 1996; Midgley, Heather y Davies, 2001; Parrott, Choi y Davies, 1994; Perry, Kutscher, Lund, Yates, Holman y Demers, 2003). Sin embargo, dada la variedad de exposiciones a los andrógenos, la variedad de síntomas psiquiátricos y el potencial de disfunción psiquiátrica preexistente, es difícil determinar el papel preciso de los SAA en estos casos de agresión humana. Los resultados de estudios prospectivos de voluntarios humanos que recibieron inyecciones de AAS se han mezclado: Tricker y otros (1996) y O'Connor y otros (2004) no informaron aumentos en la conducta de enojo, mientras que otros estudios han observado un aumento de la agresión (Daly, Su, Schmidt, Pickar, Murphy y Rubinow, 2001; Hannan, Friedl, Zold, Kettler y Plymate, 1991; Kouri, Lukas, Pope y Oliva, 1995; Papa y Katz, 1994; Su, Pagliaro, Schmidt, Pickar, Wolkowitz y Rubinow, 1993). No obstante, es importante tener en cuenta que las dosis administradas a voluntarios humanos son mucho más bajas que las recomendadas en los sitios web de culturismo, y la duración del tratamiento es generalmente corta. Por lo tanto, en general, parece justo concluir que los AAS tienen el potencial de mejorar el comportamiento agonístico, al menos en individuos susceptibles. Pope et al (1994) encontraron que los AAS provocan síntomas psiquiátricos en individuos vulnerables.
Los estudios en animales también han proporcionado evidencia convincente de la agresión inducida por AAS. Los hámsters machos adolescentes tratados de manera crónica con dosis altas de esteroides tienen latencias de ataque más cortas y un mayor número de ataques y mordidas hacia un intruso masculino en comparación con los machos no tratados (Harrison, Connor, Nowak, Nash y Melloni, 2000; Melloni, Connor, Hang, Harrison y Ferris, 1997). De manera similar, una leve provocación (pizca de la cola) produce un aumento persistente en la agresión en ratas macho adolescentes, incluida la agresión hacia las hembras (Cunningham y McGinnis, 2006). Aún más preocupante, la exposición de los adolescentes a AAS en hámsters provoca aumentos duraderos en el comportamiento agonístico que persiste después de que se suspende el uso de esteroides (Grimes y Melloni, 2006). Estos cambios de comportamiento están acompañados por una remodelación duradera de los circuitos neuronales en el hipotálamo anterior. En particular, la exposición a AAS de los adolescentes en hámsters mejora la arginina vasopresina (AVP, Grimes y Melloni, 2006) y regula a la baja la serotonina y los receptores serotoninérgicos 5HT1A y 5HT1B (Ricci, Rasakham, Grimes y Melloni, 2006). No debería sorprender que AAS altere también los niveles cerebrales de AR. La exposición crónica a testosterona o nandrolona regula al alza la AR nuclear celular en ratas macho (Menard y Harlan, 1993; Wesson y McGinnis, 2006). Por lo tanto, existe la posibilidad de que los AAS mejoren los comportamientos dependientes de los andrógenos, tanto al complementar los andrógenos endógenos como al aumentar la capacidad de respuesta androgénica a través de una mayor expresión de AR.
Comparado con el comportamiento agonístico, los AAS tienen un efecto menos marcado en el comportamiento de apareamiento en roedores machos, y la respuesta depende del esteroide particular usado (revisado en Clark y Henderson, 2003). En los hámsters machos que consumen testosterona en soluciones orales, las eyaculaciones aumentaron de una manera dosis dependiente (Wood, 2002). Sin embargo, ni la testosterona ni la nandrolona mejoraron el apareamiento en ratas macho adolescentes. El estanozolol, un AAS relativamente menos potente con una actividad androgénica mínima, en realidad inhibió el apareamiento y la agresión (Farrell y McGinnis, 2003), probablemente al reducir los niveles de andrógenos endógenos.
Es particularmente importante tener en cuenta que los hámsters adolescentes y adultos pueden mostrar diferentes respuestas de comportamiento a la exposición a AAS. Si bien los AAS aumentaron notablemente el comportamiento agonista en los varones adolescentes, el mismo tratamiento en la edad adulta produjo solo un modesto aumento en el comportamiento agresivo y disminuyó significativamente el comportamiento sexual (Salas-Ramírez, Montaldo y Sisk, 2008). Esto es consistente con el concepto de la adolescencia como un período sensible para la acción de los andrógenos. Además, al igual que los hámsters machos adultos adquieren tolerancia a la testosterona exógena (Peters y madera, 2005), creemos que los machos en desarrollo adquieren tolerancia a la testosterona a medida que maduran. Por lo tanto, los efectos del cambio de AAS en el desarrollo de los adolescentes, y la exposición a AAS de los adolescentes pueden causar un comportamiento agresivo y sexual excesivo que puede persistir hasta la edad adulta.
Refuerzo de los efectos de los andrógenos.
El apareamiento y la lucha son gratificantes (al menos si ganas la pelea). Las ratas macho presionarán una palanca repetidamente para copular con una hembra (Everitt y Stacey, 1987). Del mismo modo, los ratones machos y hámsters hembras formarán una preferencia de lugar condicionado (CPP) para los lugares donde previamente han ganado peleas (Martínez, Guillén-Salazar, Salvador y Simón, 1995; Meisel y Jope, 1994). Si el AAS puede mejorar los comportamientos sociales gratificantes por encima de los niveles que normalmente se observan en los hombres intactos con gónadas, es lógico esperar que la testosterona en sí pueda ser gratificante. Esto se ha probado utilizando dos modelos animales bien establecidos para recompensa y refuerzo: CPP y autoadministración. Los resultados de estos estudios demuestran que la testosterona se está reforzando en un contexto experimental donde los efectos anabólicos y el rendimiento deportivo son irrelevantes. Con CPP, la sustancia de prueba se empareja repetidamente con un entorno único (por ejemplo, una cámara en particular en el aparato de prueba). Una vez que el animal asocia la sustancia de prueba de refuerzo con ese ambiente, buscará el ambiente incluso en ausencia de recompensa. Los primeros informes de la recompensa de andrógenos en animales de laboratorio utilizaron inyecciones sistémicas de testosterona para inducir CPP en ratones machos (Arnedo, Salvador, Martínez-Sanchis y González-Bono, 2000; Arnedo, Salvador, Martínez-Sanchis y Pellicer, 2002) y ratas (Alexander, Packard y Hines, 1994; de Beun, Jansen, Slangen y Van de Poll, 1992). Posteriormente, nuestro laboratorio utilizó la autoadministración de testosterona para demostrar el refuerzo de andrógenos (Johnson y Wood, 2001). Descubrimos que los hámsters machos consumirán voluntariamente soluciones orales de testosterona utilizando las pruebas de elección de la botella 2 y el consumo de alcohol inducido por los alimentos. En estudios posteriores, demostramos la autoadministración iv en ratas macho y hámsters (Wood, Johnson, Chu, Schad y Self, 2004). La administración intravenosa elimina los posibles efectos de confusión del sabor o el relleno intestinal en la ingesta de andrógenos.
En el contexto del abuso de AAS, es importante diferenciar entre los efectos centrales y periféricos de los andrógenos. Dado que la testosterona tiene efectos generalizados en todo el cuerpo, se podría argumentar que la recompensa y el refuerzo con inyecciones sistémicas de testosterona es secundario a las acciones anabólicas y androgénicas sistémicas de la testosterona. En otras palabras, tal vez la testosterona reduce la fatiga muscular y mejora la función de las articulaciones para que los animales solo sentir mejor. De hecho, esta explicación se ha utilizado en la literatura clínica (aunque sin evidencia experimental) para argumentar en contra del potencial de dependencia y adicción al AAS (DiPasquale, 1998). Sin embargo, Packard et al (Packard, Cornell y Alexander, 1997) mostró que las inyecciones de testosterona directamente en el cerebro de rata pueden inducir CPP. Asimismo, nuestro laboratorio ha demostrado la autoadministración de testosterona intracerebroventricular (icv) en hámsters machos (Wood et al., 2004). La CPP intracerebral y la autoadministración de icv con testosterona argumentan los objetivos centrales que median el refuerzo de andrógenos.
Es notable que el refuerzo con testosterona no sigue necesariamente los mismos mecanismos previamente establecidos para los efectos de los esteroides en el comportamiento sexual. Como se mencionó anteriormente, el MPOA es un sitio clave para la organización del comportamiento sexual masculino en roedores (Casco, Meisel y Sachs, 2002). En los hámsters, el MPOA tiene abundantes receptores de esteroides, y los implantes de testosterona en el MPOA restauran la actividad sexual en los castrados a largo plazo (Madera y Swann, 1999). El curso del tiempo de estos efectos esteroideos es lento: el comportamiento de montaje persiste durante semanas después de la orquidectomía, y es necesaria una exposición prolongada a los esteroides para restablecer el apareamiento en castrados a largo plazo (Noble y Alsum, 1975). Sin embargo, las inyecciones de testosterona en MPOA de ratas macho no inducen CPP (Rey, Packard y Alexander, 1999). Esto sugiere que otras regiones del cerebro son importantes para el refuerzo de andrógenos.
En contraste, las ratas macho formarán un CPP para las inyecciones de testosterona en Acb (Packard et al., 1997). Al igual que con otras drogas de abuso, es probable que la DA sea un neurotransmisor clave para el refuerzo de la testosterona: la CPP inducida por la inyección sistémica de testosterona está bloqueada por los antagonistas de los receptores de dopamina D1 y D2 (Schroeder y Packard, 2000). Sin embargo, a diferencia de otras drogas de abuso, nuestros estudios en hámsters sugieren que la testosterona no induce la liberación de Acb DA (Triemstra, Sato, y madera, en prensa). Del mismo modo, los estudios en ratas macho muestran que los andrógenos no tienen ningún efecto sobre los niveles basales de DA o la liberación de DA estimulada por anfetaminas (Birgner, Kindlundh-Hogberg, Nyberg y Bergstrom, 2006; pero también ver Clark, Lindenfeld y Gibbons, 1996). Además, la testosterona ejerce una influencia relativamente menor en los niveles de tejido Acb DA (Thiblin, Finn, Ross y Stenfors, 1999). Juntos, estos datos sugieren que aunque el refuerzo de testosterona puede alterar la actividad de la DA en Acb, los mecanismos pueden ser distintos de los de la cocaína u otros estimulantes. En este sentido, los datos recientes sugieren que la exposición crónica a AAS puede alterar la sensibilidad a DA al alterar el metabolismo de DA (Kurling, Kankaanpaa, Ellermaa, Karila y Seppala, 2005), niveles de receptores de DA (Kindlundh, Lindblom, Bergstrom, Wikberg y Nyberg, 2001; Kindlundh, Lindblom y Nyberg, 2003) o el transportador DA (Kindlundh, Bergstrom, Monazzam, Hallberg, Blomqvist, Langstrom y Nyberg, 2002).
En la actualidad, las señales de esteroides específicos, los receptores y los sitios de acción del cerebro para el refuerzo de testosterona son desconocidos. Basado en un estudio reciente de hámsters de nuestro laboratorio, los efectos de refuerzo de la testosterona parecen estar mediados por los andrógenos y los estrógenos (DiMeo y Madera, 2006). Los AAS de abuso común incluyen andrógenos tanto aromatizables como no aromatizables (Gallaway, 1997; AMA, 2006). Esto implica que tanto AR como ER pueden transducir estímulos esteroideos para obtener una recompensa. Existe la posibilidad adicional de que el refuerzo de testosterona esté mediado por una combinación de receptores clásicos y no genómicos.
Varias líneas de evidencia apuntan a las acciones de los receptores no genómicos en los efectos reforzantes de AAS. Además de la escasa distribución de AR en Acb y VTA, el curso temporal del refuerzo de andrógenos es rápido (<30 min), y el procesamiento de señales a través de AR clásico puede no ser lo suficientemente rápido para el refuerzo. En consecuencia, para probar el papel de la RA no genómica en el refuerzo de AAS, utilizamos dos técnicas complementarias ( ). En un experimento (Sato, Johansen, Jordan y Wood, 2006), permitimos a las ratas con la mutación de feminización testicular (Tfm, ver este problema) autoadministrarse dihidrotestosterona (DHT), un andrógeno no aromatizable. La mutación Tfm disminuye en gran medida la unión del ligando en AR. No obstante, las ratas Tfm y sus hermanos varones de tipo salvaje se autoadministraron aproximadamente la misma cantidad de DHT. Esto defiende los efectos no genómicos de la DHT. En un estudio posterior, determinamos si los hámsters machos se autoadministrarían DHT conjugado con albúmina de suero bovino (BSA, , Sato y Madera, 2007). Los conjugados DHT-BSA son impermeables a la membrana; por lo tanto sus efectos se limitan a la superficie celular. Hamsters autoadministrados DHT, como se demostró anteriormente (DiMeo y Madera, 2006). Mostraron una preferencia similar por los conjugados DHT-BSA, pero no pudieron autoadministrarse BSA solo.


Estos datos apuntan hacia un papel central para los AR de la superficie celular en el refuerzo de andrógenos. Actualmente, la naturaleza exacta de tales receptores no se conoce. Se ha sugerido que los andrógenos pueden actuar en la superficie celular mediante la unión a la membrana dedicada AR (Thomas, Vestirse, Pang, Berg, Tubbs, Benninghoff y Doughty, 2006, también ver este tema). Esto puede ser en forma de AR clásica extra-nuclear como se informó en el hipocampo (Sarkey et al., En este número). Alternativamente, estudios previos también han descrito sitios de unión a esteroides en otros sistemas de neurotransmisores. Específicamente, una variedad de hormonas esteroideas incluyendo AAS puede modular de forma alostérica el receptor GABA-A (Henderson, 2007; Lambert, Belelli, Peden, Vardy y Peters, 2003). Asimismo, los neuroesteroides sulfatados pueden modificar la actividad de N-Metil-D-subtipos de receptores de partidas (Malayev, Gibbs y Farb, 2002) receptores. Esta es un área importante para futuras investigaciones.
¿Por qué debería haber una membrana AR? Como se mencionó anteriormente, existe una asociación estrecha entre la secreción de andrógenos y las conductas sociales gratificantes. Podemos especular que el aumento en la secreción de testosterona que sigue al apareamiento o la lucha sirve para reforzar el comportamiento. Si es así, es necesario tener un acoplamiento rápido de estímulo (comportamiento) y recompensa (testosterona). Esto se puede lograr mejor mediante la unión a la membrana AR. En este sentido, sería interesante determinar si la contención de la secreción de andrógenos durante el apareamiento reduce los efectos gratificantes del comportamiento sexual.
Resumen
Aquí revisamos la evidencia de que los andrógenos son potentes mediadores de los comportamientos motivados por adultos y, además, que el momento de la exposición a los andrógenos durante los programas de desarrollo es el comportamiento motivado dependiente de los andrógenos en la edad adulta. Los esteroides anabólicos se están convirtiendo rápidamente en una droga predilecta del abuso por parte de los adolescentes en los Estados Unidos. Si bien AAS puede no tener la potencia adictiva de la cocaína o la heroína, apenas estamos empezando a comprender el potencial de refuerzo y adicción a los andrógenos. En particular, a medida que los deportes juveniles se vuelven más competitivos, aumenta la presión sobre los atletas en desarrollo para que usen esteroides, a partir de edades más tempranas. Esta tendencia es preocupante en vista de la nueva evidencia de maduración neural sensible a los esteroides en adolescentes.
A pesar de una mayor conciencia por parte de las comunidades públicas y científicas de los profundos cambios neuronales que acompañan a la adolescencia, el estudio experimental de la neurobiología del desarrollo de la pubertad ha sido limitado. Se necesitan modelos animales de desarrollo adolescente para investigar cómo el momento de la exposición a la hormona durante el desarrollo aumenta el riesgo de un individuo de psicopatología y uso de drogas, y qué tipo de experiencias mitigan o amplifican los efectos conductuales de las desviaciones en el momento puberal. Por ejemplo, factores sociales como la influencia de los compañeros exacerban los efectos del momento puberal para el uso de sustancias y alcohol (Biehl, Natsuaki y Ge, 2007; Patton, Novy, Lee y Hickok, 2004; Simons-Morton y Haynie, 2003; Wichstrom y Pedersen, 2001). Los modelos animales del momento puberal también informarán los esfuerzos de investigación humanos y potencialmente conducirán a intervenciones terapéuticas más efectivas durante la adolescencia.
AGRADECIMIENTOS
Agradecemos a Eleni Antzoulatos, Cortney Ballard, Lucy Chu, Kelly Peters, Jennifer Triemstra, Jane Venier, Lisa Rogers y Pamela Montalto por la asistencia con estos estudios. Este trabajo fue apoyado por subvenciones de los NIH (DA12843 a RIW, MH68764 a CLS, y MH070125 a KMS).
Notas a pie de página
Descargo de responsabilidad del editor: Este es un archivo PDF de un manuscrito sin editar que ha sido aceptado para publicación. Como servicio a nuestros clientes, proporcionamos esta primera versión del manuscrito. El manuscrito se someterá a revisión, composición y revisión de la prueba resultante antes de que se publique en su forma final. Tenga en cuenta que durante el proceso de producción se pueden descubrir errores que podrían afectar el contenido, y todas las exenciones de responsabilidad legales que se aplican a la revista pertenecen.
Referencias
- Alexander GM, Packard MG, Hines M. Testosterona tiene propiedades afectivas gratificantes en ratas macho: implicaciones para la base biológica de la motivación sexual. Neurociencia del comportamiento. 1994;108: 424-8. [PubMed]
- Andersen SL. Trayectorias del desarrollo cerebral: ¿punto de vulnerabilidad o ventana de oportunidad? Reseñas de neurociencia y bioconducta. 2003;27: 3-18. [PubMed]
- Andersen SL, Rutstein M, Benzo JM, Hostetter JC, Teicher MH. Diferencias sexuales en la sobreproducción y eliminación de receptores de dopamina. Neuroreport. 1997;8: 1495-8. [PubMed]
- Arnedo MT, Salvador A, Martinez-Sanchis S, Gonzalez-Bono E. Propiedades gratificantes de la testosterona en ratones machos intactos: un estudio piloto. Farmacología, bioquímica y comportamiento. 2000;65: 327-32.
- Arnedo MT, Salvador A, Martinez-Sanchis S, Pellicer O. Efectos gratificantes similares de la testosterona en ratones calificados como individuos de latencia de ataque cortos y largos. Biología de la adicción. 2002;7: 373-9. [PubMed]
- Arnold AP, Breedlove SM. Efectos organizacionales y de activación de los esteroides sexuales en el cerebro y el comportamiento: un nuevo análisis. Hormonas y comportamiento. 1985;19: 469-98. [PubMed]
- Benes FM, Taylor JB, Cunningham MC. Convergencia y plasticidad de los sistemas monoaminérgicos en la corteza prefrontal medial durante el período postnatal: implicaciones para el desarrollo de la psicopatología. Corteza cerebral. 2000;10: 1014-27. [PubMed]
- Benes FM, Turtle M, Khan Y, Farol P. La mielinización de una zona de relevo clave en la formación del hipocampo ocurre en el cerebro humano durante la infancia, la adolescencia y la edad adulta. Archivos de Psiquiatría General. 1994;51: 477-84. [PubMed]
- Biehl MC, Natsuaki MN, Ge XJ. La influencia del tiempo puberal en el consumo de alcohol y en las trayectorias de consumo de alcohol. Revista de Juventud y Adolescencia. 2007;36: 153-167.
- Birgner C, Kindlundh-Hogberg AM, Nyberg F, Bergstrom L. Cartas de Neurociencia. 2006. Niveles extracelulares alterados de DOPAC y HVA en la cáscara del núcleo accumbens de rata en respuesta a la administración subcrónica de nandrolona y una exposición posterior a la anfetamina.
- Bond AJ, Choi PY, Pope HG., Jr. Evaluación del sesgo de atención y el estado de ánimo en usuarios y no usuarios de esteroides anabólico-androgénicos. Dependencia de drogas y alcohol. 1995;37: 241-5. [PubMed]
- Brower KJ. Abuso de esteroides anabólicos y dependencia. Informes de psiquiatría actuales. 2002;4: 377-87. [PubMed]
- Brower KJ, Catlin DH, Blow FC, Eliopulos GA, Beresford TP. Evaluación clínica y análisis de orina para el abuso y la dependencia de esteroides anabólico-androgénicos. Revista Estadounidense de Abuso de Drogas y Alcohol. 1991;17: 161-171. [PubMed]
- Celotti F, Negri-Cesi P, Poletti A. Metabolismo de los esteroides en el cerebro de los mamíferos: reducción de 5alpha y aromatización. Boletín de investigación del cerebro. 1997;44: 365-75. [PubMed]
- Chung WC, De Vries GJ, Swaab DF. La diferenciación sexual del núcleo del lecho de la estría terminal en humanos puede extenderse hasta la edad adulta. Journal of Neuroscience. 2002;22: 1027-33. [PubMed]
- Clark AS, Henderson LP. Respuestas conductuales y fisiológicas a los esteroides anabólico-androgénicos. Reseñas de neurociencia y bioconducta. 2003;27: 413-36. [PubMed]
- Clark AS, Lindenfeld RC, Gibbons CH. Esteroides anabolicoandrogénicos y recompensa cerebral. Farmacología, bioquímica y comportamiento. 1996;53: 741-5.
- Conacher GN, Workman DG. Crimen violento posiblemente asociado con el uso de esteroides anabólicos. American Journal of Psychiatry. 1989;146: 679. [PubMed]
- Cunningham RL, McGinnis MI. La provocación física de ratas macho expuestas a esteroides androgénicos anabólicos puberales provoca agresión hacia las hembras. Hormonas y comportamiento. 2006;50: 410-6. [PubMed]
- Daly RC, Su TP, Schmidt PJ, Pickar D, Murphy DL, Rubinow DR. Líquido cefalorraquídeo y cambios de comportamiento después de la administración de metiltestosterona: hallazgos preliminares. Archivos de Psiquiatría General. 2001;58: 172-7. [PubMed]
- Davis EC, Shryne JE, Gorski RA. Los dimorfismos sexuales estructurales en el núcleo periventricular anteroventral del hipotálamo de rata son sensibles a los esteroides gonadales perinatalmente, pero se desarrollan peripúberes. Neuroendocrinología. 1996;63: 142-8. [PubMed]
- de Beun R, Jansen E, Slangen JL, Van de Poll NE. La testosterona como estímulo apetitivo y discriminativo en ratas: efectos dependientes de la dosis y el sexo. Fisiología y comportamiento. 1992;52: 629-34. [PubMed]
- Dekaban AS. Cambios en los pesos cerebrales durante el transcurso de la vida humana: relación entre los pesos cerebrales y las alturas corporales y los pesos corporales. Anales de Neurología. 1978;4: 345-56. [PubMed]
- Di Chiara G, Imperato A. Las drogas que abusan de los seres humanos aumentan preferentemente las concentraciones sinápticas de dopamina en el sistema mesolímbico de ratas que se mueven libremente. Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 1988;85: 5274-8. [Artículo gratuito de PMC] [PubMed]
- DiMeo AN, madera RI. Autoadministración de estrógenos y dihidrotestosterona en hámsters machos. Hormonas y comportamiento. 2006;49: 519-26. [PubMed]
- DiPasquale M. esteroides anabólicos. En: Tarter RE, Ammerman RT, Ott PJ, editores. Manual de Abuso de Sustancias. Plenum Press; NY: 1998. pp. 547 – 565.
- Dominguez J, Riolo JV, Xu Z, Hull EM. Regulación por la amígdala medial de la cópula y liberación de dopamina preóptica medial. Journal of Neuroscience. 2001;21: 349-355. [PubMed]
- Dominguez JM, Hull EM. La estimulación de la amígdala medial mejora la liberación de dopamina preóptica medial: implicaciones para el comportamiento sexual de la rata macho. Investigación del cerebro. 2001;917: 225-229. [PubMed]
- Du J, Lorrain DS, Hull EM. La castración disminuye la extracelular, pero aumenta la dopamina intracelular en el área preóptica medial de ratas macho. Investigación del cerebro. 1998;782: 11-17. [PubMed]
- Eckenhoff MF, Rakic P. Nature y el destino de las células proliferativas en el giro dentado del hipocampo durante la vida útil del mono rhesus. Journal of Neuroscience. 1988;8: 2729-47. [PubMed]
- Everitt BJ, Stacey P. Estudios de comportamiento instrumental con refuerzo sexual en ratas macho (Rattus norvegicus): II. Efectos de las lesiones del área preóptica, castración y testosterona. Revista de psicología comparada. 1987;101: 407-19. [PubMed]
- Gallaway S. La Biblia de los esteroides. Belle International Press; Sacramento, CA: 1997.
- Galligani N, Renck A, Hansen S. Perfil de la personalidad de los hombres que usan esteroides androgénicos anabólicos. Hormonas y comportamiento. 1996;30: 170-5. [PubMed]
- Grimes JM, Melloni RH., Jr Alteraciones prolongadas en el sistema neural de la serotonina después del cese de la exposición a esteroides anabólicos-androgénicos en adolescentes en hámsters (Mesocricetus auratus) Neurociencia del comportamiento. 2006;120: 1242-51. [PubMed]
- Hannan CJ, Jr, Friedl KE, Zold A, Kettler TM, Plymate SR. Cambios psicológicos y séricos del ácido homovanílico en hombres a los que se les administraron esteroides androgénicos. Psiconeuroendocrinología. 1991;16: 335-43. [PubMed]
- Harrison RJ, Connor DF, Nowak C, Nash K, Melloni RH., Jr El tratamiento crónico con esteroides anabólico-androgénicos durante la adolescencia aumenta la vasopresina hipotalámica anterior y la agresión en hámsters intactos. Psiconeuroendocrinología. 2000;25: 317-38. [PubMed]
- Él J, Crews FT. La neurogénesis disminuye durante la maduración cerebral desde la adolescencia hasta la edad adulta. Farmacología, bioquímica y comportamiento. 2007;86: 327-33.
- Henderson LP. Modulación de esteroides de la transmisión mediada por el receptor GABAA en el hipotálamo: efectos sobre la función reproductiva. Neurofarmacología. 2007;52: 1439-53. [Artículo gratuito de PMC] [PubMed]
- Casco EM, Du J, Lorrain DS, Matuszewich L. Dopamina extracelular en el área preóptica medial: implicaciones para la motivación sexual y el control hormonal de la cópula. Journal of Neuroscience. 1995;15: 7465-7471. [PubMed]
- Casco EM, Meisel RL, Sachs BD. Comportamiento sexual masculino. En: Pfaff DW, Arnold AP, Etgen AM, Fahrbach SE, Rubin RT, editores. Hormonas, cerebro y comportamiento. Prensa Académica; Nueva York: 2002. pp. 3 – 137.
- Casco EM, madera RI, McKenna KE. Neurobiología del comportamiento sexual masculino. En: Neill JD, editor. Fisiología de la reproducción. Vol. 1. Elsevier Press; Nueva York: 2006. pp. 1729 – 1824.
- Huttenlocher PR, Dabholkar AS. Diferencias regionales en la sinaptogénesis en la corteza cerebral humana. Revista de Neurología Comparada. 1997;387: 167-78. [PubMed]
- Johnson LR, Wood RI. Autoadministración de testosterona oral en hámsters machos. Neuroendocrinología. 2001;73: 285-92. [PubMed]
- Johnston LD, O'Malley PM, Bachman JG. Alumnos de secundaria (Publicación NIH No. 03 – 5375) I. Bethesda, MD: Instituto Nacional sobre el Abuso de Drogas; 2003. Seguimiento de los resultados de la encuesta nacional de Future sobre el uso de drogas, 1975 – 2002.
- Fundación de la familia Kaiser. Actividad sexual adolescente en los Estados Unidos. 2005. pp. # 3040 – 02.
- Kashon ML, Hayes MJ, Shek PP, Sisk CL. Regulación de la inmunorreactividad del receptor de andrógenos en el cerebro por andrógenos en hurones masculinos prepúberes. Biología de la reproducción. 1995;52: 1198-205. [PubMed]
- Kindlundh AM, Bergstrom M, Monazzam A, Hallberg M, Blomqvist G, Langstrom B, Nyberg F. Efectos dopaminérgicos después del tratamiento crónico con nandrolona visualizado en cerebro de rata mediante tomografía por emisión de positrones. Progreso en Neuropsicofarmacología y Psiquiatría Biológica. 2002;26: 1303-8.
- Kindlundh AM, Lindblom J, Bergstrom L, Wikberg JE, Nyberg F. El decanoato de nandrolona esteroide anabólico-androgénico afecta la densidad de los receptores de dopamina en el cerebro de rata macho. Revista Europea de Neurociencia. 2001;13: 291-6. [PubMed]
- Kindlundh AM, Lindblom J, Nyberg F. La administración crónica con decanoato de nandrolona induce alteraciones en el contenido de transcripción génica de dopamina D (1) y D (2) en el cerebro de ratas. Investigación del cerebro. 2003;979: 37-42. [PubMed]
- King BE, Packard MG, Alexander GM. Propiedades afectivas de las inyecciones en el área preóptica intra-medial de testosterona en ratas macho. Cartas de Neurociencia. 1999;269: 149-52. [PubMed]
- Koob GF, Nestler EJ. La neurobiología de la drogadicción. Revista de neuropsiquiatría y neurociencias clínicas. 1997;9: 482-97. [PubMed]
- Kouri EM, Lukas SE, Pope HG, Jr, Oliva PS. Aumento de la respuesta agresiva en voluntarios varones después de la administración de dosis gradualmente crecientes de cipionato de testosterona. Dependencia de drogas y alcohol. 1995;40: 73-9. [PubMed]
- Kritzer MF. La gonadectomía a largo plazo afecta la densidad de la tirosina hidroxilasa, pero no la dopamina beta beta hidroxilasa, la colina acetiltransferasa o los serones inmunoreactivos a la serotonina en las cortezas prefrontales mediales de ratas macho adultas. Corteza cerebral. 2003;13: 282-296. [PubMed]
- Kurling S, Kankaanpaa A, Ellermaa S, Karila T, Seppala T. El efecto del tratamiento subcrónico de decanoato de nandrolona en los sistemas neuronales dopaminérgicos y serotoninérgicos en el cerebro de ratas. Investigación del cerebro. 2005;1044: 67-75. [PubMed]
- Lambert JJ, Belelli D, Peden DR, Vardy AW, Peters JA. Modulación neuroesteroidea de los receptores GABAA. Avances en neurobiología. 2003;71: 67-80. [PubMed]
- Lenroot RK, Giedd JN. Desarrollo del cerebro en niños y adolescentes: perspectivas de la resonancia magnética anatómica. Revisión de neurociencia y bioconducta. 2006;30: 718-29.
- Lesting J, Neddens J, Teuchert-Noodt G. Ontogenia de la inervación de la dopamina en el núcleo accumbens de los jerbos. Investigación del cerebro. 2005;1066: 16-23. [PubMed]
- Malayev A, Gibbs TT, Farb DH. La inhibición de la respuesta de NMDA por el sulfato de pregnenolona revela la modulación selectiva del subtipo de los receptores de NMDA por los esteroides sulfatados. Revista británica de farmacología. 2002;135: 901-9. [Artículo gratuito de PMC] [PubMed]
- Martínez M, Guillen-Salazar F, Salvador A, Simón VM. Agresión intermale exitosa y preferencia de lugar condicionado en ratones. Fisiología y comportamiento. 1995;58: 323-8. [PubMed]
- Meek LR, Romeo RD, Novak CM, Sisk CL. Acciones de la testosterona en hámsters machos prepúberes y pospúberes: disociación de los efectos sobre el comportamiento reproductivo y la inmunorreactividad del receptor de andrógenos en el cerebro. Hormonas y comportamientos. 1997;31: 75-88.
- Meisel RL, Joppa MA. Preferencia de lugar condicionado en hámsters hembras después de encuentros agresivos o sexuales. Fisiología y comportamiento. 1994;56: 1115-8. [PubMed]
- Melloni RH, Jr, Connor DF, Hang PT, Harrison RJ, Ferris CF. Exposición a esteroides anabolicoandrogénicos durante la adolescencia y comportamiento agresivo en hámsters dorados. Fisiología y comportamiento. 1997;61: 359-64. [PubMed]
- Menard C, Harlan R. Regulación al alza de la inmunorreactividad del receptor de andrógenos en el cerebro de rata por los esteroides anabólicos androgénicos. Investigación del cerebro. 1993;622: 226-236. [PubMed]
- Mermelstein PG, Becker JB, Surmeier DJ. El estradiol reduce las corrientes de calcio en las neuronas neostáticas de rata a través de un receptor de membrana. Journal of Neuroscience. 1996;16: 595-604. [PubMed]
- Midgley SJ, Heather N, Davies JB. Niveles de agresión entre un grupo de usuarios de esteroides anabólico-androgénicos. Medicina, ciencia y derecho. 2001;41: 309-14.
- Molenda-Figueira HN, Salas-Ramírez KY, Schulz KM, Zehr JL, Montalto PR, Sisk CL. La experiencia social de los adolescentes restaura el comportamiento eyaculatorio en adultos en hámsters sirios machos que carecen de testosterona puberal. Sociedad para la neuroendocrinología conductual; Pacific Grove, CA: 2007.
- Noble RG, Alsum PB. Dimorfismos sexuales dependientes de hormonas en el hámster dorado (Mesocricetus auratus) Fisiología y comportamiento. 1975;14: 567-74. [PubMed]
- Nunez JL, Lauschke DM, Juraska JM. Muerte celular en el desarrollo de la corteza posterior en ratas macho y hembra. Revista de Neurología Comparada. 2001;436: 32-41. [PubMed]
- Nunez JL, Sodhi J, Juraska JM. Las hormonas ováricas después del día postnatal 20 reducen el número de neuronas en la corteza visual primaria de la rata. Revista de Neurobiología. 2002;52: 312-21. [PubMed]
- O'Connor DB, Archer J, Wu FC. Efectos de la testosterona sobre el estado de ánimo, la agresividad y el comportamiento sexual en hombres jóvenes: un estudio cruzado, doble ciego, controlado con placebo. Revista de endocrinología clínica y metabolismo. 2004;89: 2837-45. [PubMed]
- Packard MG, Cornell AH, Alexander GM. Recompensar las propiedades afectivas de las inyecciones de testosterona dentro del núcleo accumbens. Neurociencia del comportamiento. 1997;111: 219-24. [PubMed]
- Parfitt DB, Thompson RC, Richardson HN, Romeo RD, Sisk CL. El ARNm de GnRH aumenta con la pubertad en el cerebro del hámster sirio masculino. Revista de Neuroendocrinología. 1999;11: 621-7. [PubMed]
- Parrott AC, Choi PY, Davies M. Uso de esteroides anabólicos por atletas aficionados: efectos sobre los estados de ánimo psicológicos. Revista de medicina deportiva y aptitud física. 1994;34: 292-8. [PubMed]
- Patton PE, Novy MJ, Lee DM, Hickok LR. El diagnóstico y el resultado reproductivo después del tratamiento quirúrgico del útero septado completo, cérvix duplicado y tabique vaginal. Revista estadounidense de obstetricia y ginecología. 2004;190: 1669 – 75. 1675 – 8. [PubMed]
- Paus T, Collins DL, Evans AC, Leonard G, Pike B, Zijdenbos A. Maduración de la materia blanca en el cerebro humano: una revisión de los estudios de resonancia magnética. Boletín de investigación del cerebro. 2001;54: 255-66. [PubMed]
- Perry PJ, Kutscher EC, Lund BC, Yates WR, Holman TL, Demers L. Medidas de la agresión y cambios de humor en los levantadores de pesas masculinos con y sin uso de esteroides anabólicos androgénicos. Revista de Ciencias Forenses. 2003;48: 646-51. [PubMed]
- Peters KD, Wood RI. Dependencia androgénica en hámsters: sobredosis, tolerancia y posibles mecanismos opioidérgicos. Neurociencia. 2005;130: 971-81. [PubMed]
- Pfaus JG, Damsma G, Nomikos GG, Wenkstern DG, Blaha CD, Phillips AG, Fibiger HC. El comportamiento sexual aumenta la transmisión de dopamina central en la rata macho. Investigación del cerebro. 1990;530: 345-348. [PubMed]
- Phoenix CH, Goy RW, Gerall AA, WC jóvenes. Acción organizativa del propionato de testosterona administrado prenatalmente en los tejidos que median el comportamiento de apareamiento en el conejillo de indias hembra. Endocrinología. 1959;65: 369-82. [PubMed]
- Pinos H, Collado P, Rodríguez-Zafra M, Rodríguez C, Segovia S, Guillamon A. El desarrollo de las diferencias sexuales en el locus coeruleus de la rata. Boletín de investigación del cerebro. 2001;56: 73-8. [PubMed]
- Papa HG, Jr, Katz DL. Homicidio y casi homicidio por parte de usuarios de esteroides anabólicos. [Ver comentario] Revista de Psiquiatría Clínica. 1990;51: 28-31. [PubMed]
- Papa HG, Jr, Katz DL. Efectos psiquiátricos y médicos del uso de esteroides anabólico-androgénicos. Un estudio controlado de los atletas 160. Archivos de Psiquiatría General. 1994;51: 375-82. [PubMed]
- Papa HG, Jr, Kouri EM, Powell KF, Campbell C, Katz DL. El uso de esteroides anabólico-androgénicos entre los presos 133. Psiquiatría integral. 1996;37: 322-7. [PubMed]
- Putnam SK, Du J, Sato S, casco EM. La restauración de la testosterona del comportamiento copulatorio se correlaciona con la liberación de dopamina preóptica medial en ratas macho castradas. Hormonas y comportamiento. 2001;39: 216-224. [PubMed]
- Putnam SK, Sato S, Casco EM. Efectos de los metabolitos de la testosterona en la cópula y la liberación de dopamina preóptica medial en ratas macho castradas. Hormonas y comportamiento. 2003;44: 419-26. [PubMed]
- Putnam SK, Sato S, Riolo JV, casco EM. Efectos de los metabolitos de la testosterona en la cópula, la dopamina preóptica medial y la inmunorreactividad NOS en ratas macho castradas. Hormonas y comportamiento. 2005;47: 513-522. [PubMed]
- Rankin SL, Partlow GD, McCurdy RD, Giles ED, Fisher KR. Neurogénesis posnatal en la vasopresina y el núcleo que contiene oxitocina del hipotálamo de cerdo. Investigación del cerebro. 2003;971: 189-96. [PubMed]
- Ricci LA, Rasakham K, Grimes JM, Melloni RH., Jr Serotonin-1A actividad y expresión del receptor modulan la agresión inducida por esteroides anabólicos / androgénicos en adolescentes en hámsters. Farmacología, bioquímica y comportamiento. 2006;85: 1-11.
- Romeo RD, Cook-Wiens E, Richardson HN, Sisk CL. La dihidrotestosterona activa el comportamiento sexual en hámsters machos adultos pero no en juveniles. Fisiología y comportamiento. 2001;73: 579-84. [PubMed]
- Romeo RD, Diedrich SL, Sisk CL. Inmunorreactividad del receptor de estrógeno en hámsters sirios machos adultos y prepúberes. Cartas de Neurociencia. 1999;265: 167-70. [PubMed]
- Romeo RD, Parfitt DB, Richardson HN, Sisk CL. Las feromonas provocan niveles equivalentes de inmunorreactividad de Fos en hámsters sirios machos adultos y prepúberes. Hormonas y comportamiento. 1998;34: 48-55. [PubMed]
- Romeo RD, Richardson HN, Sisk CL. La pubertad y la maduración del cerebro masculino y el comportamiento sexual: replanteamiento de un potencial de comportamiento. Reseñas de neurociencia y bioconducta. 2002a;26: 381-91. [PubMed]
- Romeo RD, Wagner CK, Jansen HT, Diedrich SL, Sisk CL. El estradiol induce receptores de progesterona hipotalámica pero no activa el comportamiento de apareamiento en hámsters machos (Mesocricetus auratus) antes de la pubertad. Neurociencia del comportamiento. 2002b;116: 198-205. [PubMed]
- Salas-Ramírez KY, Montalto PR, Sisk CL. Los esteroides androgénicos anabólicos (AAS) afectan de manera diferente los comportamientos sociales en hámsters sirios adolescentes y adultos. Hormonas y comportamiento. 2008 en prensa.
- SAMHSA / OEA. Publicación de DHHS No (SMA) 1996. Encuesta Nacional de Hogares de 1994 sobre el Abuso de Drogas, Hallazgos Principales 1994; pp. 96 – 3085.
- SAMHSA / OEA. Resultados de la Encuesta Nacional 2004 sobre Uso de Drogas y Salud: Hallazgos Nacionales. 2005. Serie NSDUH H-28, número de publicación de DHHS SMA 05 – 4062.
- Sato SM, Johansen J, Jordan CL, Wood RI. Autogestión androgénica en ratas Tfm. 10th Reunión Anual de la Sociedad para la Neuroendocrinología del Comportamiento. 2006.
- Sato SM, Madera RI. Autoadministración de esteroides anabólico-androgénicos (aas) impermeables a la membrana en hámsters sirios. 11th Reunión Anual de la Sociedad de Neuroendocrinología del Comportamiento. 2007.
- Schroeder JP, Packard MG. Papel de los subtipos de receptores de dopamina en la adquisición de una preferencia de lugar condicionada por testosterona en ratas. Cartas de Neurociencia. 2000;282: 17-20. [PubMed]
- Schulte HM, Hall MJ, Boyer M. Violencia doméstica asociada con el abuso de esteroides anabólicos. American Journal of Psychiatry. 1993;150: 348. [PubMed]
- Schulz KM, Menard TA, Smith DA, Albers HE, Sisk CL. La exposición a hormonas testiculares durante la adolescencia organiza el comportamiento de marcaje en el flanco y la unión al receptor de vasopresina en el tabique lateral. Hormonas y comportamiento. 2006;50: 477-83. [PubMed]
- Schulz KM, Richardson HN, Romeo RD, Morris JA, Lookingland KJ, Sisk CL. Las respuestas dopaminérgicas del área preóptica medial a las feromonas femeninas se desarrollan durante la pubertad en el hámster sirio macho. Investigación del cerebro. 2003;988: 139-45. [PubMed]
- Schulz KM, Richardson HN, Zehr JL, Osetek AJ, Menard TA, Sisk CL. Las hormonas gonadales masculinizan y defeminan los comportamientos reproductivos durante la pubertad en el hámster sirio masculino. Hormonas y comportamiento. 2004;45: 242-9. [PubMed]
- Schulz KM, Sisk CL. Las hormonas de la pubertad, el cerebro adolescente y la maduración de los comportamientos sociales: lecciones del hámster sirio. Endocrinología molecular y celular. 2006:254–255. 120–6.
- Schulz KM, Zehr JL, Salas-Ramirez KY, Sisk CL. Planificador de reuniones de neurociencia. Sandiego, CA: Society for Neuroscience; 2007. ¿Es la adolescencia un segundo período sensible para los efectos organizativos de la testosterona en el comportamiento reproductivo masculino en adultos? 2007 en línea.
- Scott JP, Stewart JM, De Ghett VJ. Periodos críticos en la organización de los sistemas. Psicobiología del desarrollo. 1974;7: 489-513. [PubMed]
- Shughrue PJ, Lane MV, Merchenthaler I. Distribución comparativa de ARNm alfa y beta de estrógeno en el sistema nervioso central de rata. Revista de Neurología Comparada. 1997;388: 507-25. [PubMed]
- Simons-Morton BG, Haynie DL. Predictores psicosociales del aumento de la etapa de tabaquismo entre los estudiantes de sexto grado. American Journal of Health Behavior. 2003;27: 592-602. [PubMed]
- Sisk CL, Zehr JL. Las hormonas pubertales organizan el cerebro y el comportamiento del adolescente. Las fronteras en neuroendocrinología. 2005;26: 163-74. [PubMed]
- Sowell ER, Thompson PM, Leonard CM, Bienvenido SE, Kan E, Toga AW. Mapeo longitudinal del grosor cortical y crecimiento cerebral en niños normales. Journal of Neuroscience. 2004;24: 8223-31. [PubMed]
- Sowell ER, Thompson PM, Tessner KD, Toga AW. Mapeo del crecimiento cerebral continuo y la reducción de la densidad de la materia gris en la corteza frontal dorsal: relaciones inversas durante la maduración cerebral postadolescente. Journal of Neuroscience. 2001;21: 8819-29. [PubMed]
- Spear LP. El cerebro adolescente y las manifestaciones conductuales relacionadas con la edad. Revisión de neurociencia y bioconducta. 2000;24: 417-63.
- Su TP, Pagliaro M, Schmidt PJ, Pickar D, Wolkowitz O, Rubinow DR. Efectos neuropsiquiátricos de los esteroides anabólicos en voluntarios varones normales. JAMA. 1993;269: 2760-4. [PubMed]
- Thiblin I, Finn A, Ross SB, Stenfors C. Aumento de las actividades dopaminérgicas y 5-hidroxitriptaminérgicas en el cerebro de ratas macho después de un tratamiento prolongado con esteroides androgénicos anabólicos. Revista británica de farmacología. 1999;126: 1301-6. [Artículo gratuito de PMC] [PubMed]
- Thomas P, Dressing G, Pang Y, Berg H, Tubbs C, Benninghoff A, Doughty K. Progestina, estrógenos y andrógenos G-receptores de proteínas acoplados en gónadas de peces. Esteroides 2006;71: 310-6. [PubMed]
- Tricker R, Casaburi R, Storer TW, Clevenger B, Berman N, Shirazi A, Bhasin S. Los efectos de las dosis suprafisiológicas de testosterona en el comportamiento enojado en hombres eugonadales sanos: un estudio de un centro de investigación clínica. Revista de endocrinología clínica y metabolismo. 1996;81: 3754-8. [PubMed]
- Triemstra JL, Nagatani S, Wood RI. Las señales quimiosensoriales son esenciales para la liberación de dopamina inducida por el apareamiento en el MPOA de hámsters sirios machos. Neuropsicofarmacología. 2005;30: 1436-42. [PubMed]
- Triemstra JL, Sato SM, Wood RI. La testosterona y el núcleo accumbens dopamina en el hámster sirio macho. Psiconeuroendocrinología (en prensa)
- Van Eenoo P, Delbeke FT. La prevalencia del dopaje en Flandes en comparación con la prevalencia del dopaje en los deportes internacionales. Revista Internacional de Medicina Deportiva. 2003;24: 565-570. [PubMed]
- La wada Hallazgos analíticos adversos reportados por laboratorios acreditados. 2006. http://www.wada-ama.org.
- Wesson DW, McGinnis MI. Apilamiento de esteroides androgénicos anabólicos (SAA) durante la pubertad en ratas: una evaluación neuroendocrina y de comportamiento. Farmacología, bioquímica y comportamiento. 2006;83: 410-9.
- Wichstrom L, Pedersen W. Uso de esteroides anabólico-androgénicos en la adolescencia: ¿ganar, verse bien o ser malo? Revista de Estudios sobre el Alcohol. 2001;62: 5-13. [PubMed]
- Wood RI, Johnson LR, Chu L, Schad C, Self DW. Refuerzo de testosterona: autoadministración intravenosa e intracerebroventricular en ratas macho y hámsters. Psicofarmacología. 2004;171: 298-305. [PubMed]
- Madera RI, Newman SW. Los receptores de andrógenos y estrógenos coexisten con neuronas individuales en el cerebro del hámster sirio. Neuroendocrinología. 1995;62: 487-97. [PubMed]
- Madera RI, Swann JM. Integración neuronal de señales quimiosensoriales y hormonales que controlan el comportamiento sexual masculino. En: Wallen K, Schneider JS, editores. Reproducción en contexto. MIT Press; Cambridge: 1999. pp. 423 – 444.
- Zahm DS, Heimer L. Dos vías transpallidales que se originan en el núcleo accumbens de rata. Revista de Neurología Comparada. 1990;302: 437-46. [PubMed]