Frente. Behav. Neurosci., 23 marzo 2016 | http://dx.doi.org/10.3389/fnbeh.2016.00054

 Masroor R. Shariff1,
Masroor R. Shariff1,  Arnauld Belmer1,
Arnauld Belmer1,  Matthew J. Fogarty2,
Matthew J. Fogarty2,  Erica wh mu2,
Erica wh mu2, 

- 1Instituto de Investigación Traslacional e Instituto de Salud e Innovación Biomédica, Universidad de Tecnología de Queensland, Brisbane, QLD, Australia
- 2Escuela de Ciencias Biomédicas, Universidad de Queensland, Brisbane, QLD, Australia
La dieta moderna se ha endulzado mucho, resultando en niveles sin precedentes de consumo de azúcar, particularmente entre los adolescentes. Si bien se sabe que la ingesta crónica de azúcar a largo plazo contribuye al desarrollo de trastornos metabólicos, como la obesidad y la diabetes tipo II, se sabe poco sobre las consecuencias directas del consumo de azúcar en el cerebro como por atracones a largo plazo. segundoDebido a que el azúcar puede causar la liberación de dopamina en el núcleo accumbens (NAc) de manera similar a las drogas de abuso, investigamos cambios en la morfología de las neuronas en esta región del cerebro después de binge- a corto (4 semanas) y largo plazo (12 semanas) como el consumo de sacarosa usando un paradigma de elección intermitente de dos botellas. Utilizamos la tinción de Golgi-Cox para impregnar las neuronas espinosas medias (MSN) del núcleo y cáscara de NAc de ratas consumidoras de sacarosa a corto y largo plazo y las comparamos con los controles de agua de la misma edad. Demostramos que el consumo prolongado de sacarosa similar al atracón disminuyó significativamente la longitud dendrítica total de los MSN con cáscara NAc en comparación con las ratas de control de la misma edad. También encontramos que la reestructuración de estas neuronas se debió principalmente a la reducción de la complejidad dendrítica distal. A la inversa, observamos un aumento de las densidades de la columna vertebral en los órdenes de las ramas distales de los MSN con cáscara NAc de ratas consumidoras de sacarosa a largo plazo. Combinados, estos resultados resaltan los efectos neuronales de la ingesta prolongada de sacarosa de la sacarosa en la morfología de MSN de concha NAc.
Introducción
En los últimos años 40, ha habido un aumento documentado en el consumo de bebidas azucaradas y alimentos que contienen azúcares añadidos (Nielsen et al., 2002; Popkin, 2010; Ng et al., 2012), con informes que estiman que hasta el 75% de todos los alimentos y bebidas contienen altas cantidades de azúcares agregados (Ford y Dietz, 2013; Bray y Popkin, 2014). Durante este período, también ha habido un aumento simultáneo en la prevalencia de obesidad y diabetes tipo II, particularmente entre adolescentes (Arslanian, 2002; Reinehr, 2013; Dabelea et al., 2014; Fryar et al., 2014). Estudios recientes han demostrado que los niños con sobrepeso y obesos a menudo consumen altas cantidades de azúcar agregada, sin embargo, la contribución de las dietas altas en azúcar al aumento en la incidencia de niños con sobrepeso y obesos sigue siendo controvertida (Hu, 2013; Bray y Popkin, 2014; Bucher Della Torre et al., 2015).
Mientras que un creciente cuerpo de evidencia indica que el consumo de dietas altas en azúcar puede, en parte, contribuir al aumento de peso entre los niños y adolescentes (Malik et al., 2010; Te Morenga et al., 2013; Bray y Popkin, 2014), se ha prestado menos atención a las consecuencias adversas no metabólicas derivadas de la ingesta excesiva de azúcar. Curiosamente, algunos patrones de comportamiento y psicológicos comunes a menudo surgen entre un subconjunto de quienes comen en exceso y mantienen dietas altas en azúcar. Los más notables son el desarrollo de trastornos de la alimentación que incluyen atracones compulsivos, combinados con la aparición simultánea de síntomas psicológicos que incluyen falta de motivación y depresión (revisado en Sheehan y Herman, 2015). Además, dado que los individuos que comen en exceso a menudo exhiben una pérdida de control y una incapacidad para autolimitar su consumo de azúcar, es probable que estos comportamientos surjan como resultado de adaptaciones neurológicas en regiones del cerebro que evalúan el valor hedónico de alimentos altamente sabrosos. (Saper et al., 2002; Lutter y Nestler, 2009; Kenny, 2011). Este razonamiento también está respaldado por pruebas en humanos que demuestran que el azúcar y la dulzura pueden causar antojos similares a los inducidos por drogas adictivas como el alcohol y la nicotina (Volkow et al., 2012).
Aunque las propiedades adictivas del azúcar todavía son especulativas, estas observaciones se combinaron con estudios que demuestran la contribución de la ingesta excesiva de azúcar a los cambios en los circuitos de recompensa y el desarrollo de conductas y estados emocionales de tipo adictivo en modelos animales. (Avena et al., 2008; Benton, 2010; Ventura et al., 2014), garantiza la necesidad de una mayor investigación. Estudios previos en roedores han demostrado que el acceso intermitente a la sacarosa altera la actividad de varios neurotransmisores dentro del sistema mesolímbico, incluida la dopamina, los opioides y la acetilcolina. Avena et al., 2008). Se ha demostrado que el consumo excesivo de sacarosa facilita la liberación de dopamina en el núcleo accumbens (NAc), de manera similar a las drogas de abuso (Avena et al., 2008). Además, hemos demostrado que el consumo a largo plazo de sacarosa utilizando un paradigma de elección de dos botellas de acceso intermitente 24 h (Simms et al., 2008) modula la expresión del receptor nicotínico de acetilcolina (nAChR) en la NAc (Shariff et al., En prensa.). Curiosamente, también hemos observado que los compuestos nAChR que se sabe que modulan la actividad de la dopamina y la acetilcolina en la NAc tienen diferentes efectos sobre el consumo de sacarosa después de la ingesta a corto y largo plazo (Shariff et al., En prensa.).
Si bien estos estudios han demostrado similitudes en los cambios de comportamiento y neuroquímicos causados por el acceso intermitente al azúcar y las drogas de abuso, no se sabe si estos efectos facilitan cambios en la morfología neuronal en el NAc. TEsto contrasta con sustancias de abuso como la cocaína, la anfetamina y la nicotina que producen cambios bien caracterizados en la morfología de las neuronas espinosas medias (MSN) en la NAc, incluido el aumento de la densidad de la columna y la complejidad dendrítica alterada. (Robinson y Kolb, 1999, 2004; Li et al., 2003; Crombag et al., 2005). Debido a que anteriormente hemos demostrado que la exposición a largo plazo (semana 12) al alcohol y la sacarosa utilizando el paradigma de elección intermitente de dos botellas produce una respuesta diferencial a las intervenciones farmacoterapéuticas en comparación con la ingesta a corto plazo (semanas 4; Steensland et al., 2007; Shariff et al., En prensa.), evaluamos los efectos del consumo de sacarosa a corto y largo plazo en la morfología de MSN en la NAc. Permitimos que las ratas adolescentes consumieran sacarosa en forma de atracón durante 4 (a corto plazo) o 12 (a largo plazo) semanas y luego analizamos la morfología de las NAc MSN de ratas consumidoras de sacarosa a corto y largo plazo y comparamos esto con Controles pareados por edad que solo tuvieron acceso al agua. Nuestros resultados muestran que los MSN de la cáscara de NAc se modifican después del consumo de sacarosa a largo plazo, pero no a corto plazo, lo que reduce la longitud dendrítica y aumenta la densidad de la columna dendrítica distal. Además, encontramos que la morfología de los MSN del núcleo NAc se mantuvo relativamente intacta luego del consumo de sacarosa a corto y largo plazo. Estos resultados resaltan una consecuencia neurológica directa del consumo de sacarosa a largo plazo de forma compulsiva. Además, estos datos demuestran la necesidad de estudios adicionales dirigidos a dilucidar los cambios moleculares y neuroquímicos que acompañan a la reestructuración morfológica de los MSN de cáscara NAc inducidos por una ingesta prolongada de sacarosa.
Materiales y Métodos
Declaración de Ética
Todos los procedimientos experimentales se llevaron a cabo de acuerdo con el Código Australiano para el Cuidado y Uso de Animales con Fines Científicos, 8th Edition (Consejo Nacional de Salud e Investigación Médica, 2013). Los protocolos fueron aprobados por el Comité de Ética Animal de la Universidad de Tecnología de Queensland y el Comité de Ética Animal de la Universidad de Queensland.
Animales y vivienda
Ratas Wistar macho de cinco semanas de edad (adolescentes) (Control: 176.4 ± 4.8 g; Sucrosa: 178.3 ± 5.0 g) (ARC, WA, Australia), se alojaron individualmente en Plexiglas ventilados de doble nivel® jaulas Las ratas se aclimataron a las condiciones individuales de alojamiento, manejo y ciclo de luz inversa 5 días antes del inicio de los experimentos. Todas las ratas se alojaron en un cuarto con ciclo de luz / oscuridad invertido con clima de 12-hr (las luces apagadas en 9 am) con chow estándar para ratas y agua disponible ad libitum.
Paradigma de consumo de bebidas con dos botellas de acceso intermitente
El acceso intermitente a la elección de dos botellas de sacarosa 5% del paradigma de consumo (Simms et al., 2008) fue adaptado de Sabio (1973). Todos los fluidos se presentaron en botellas plásticas graduadas de 300 ml, con bebederos de acero inoxidable insertados a través de dos ojales en la parte frontal de la jaula después del comienzo del ciclo de luz oscura. Los pesos de cada botella se registraron antes de la presentación de la botella. Dos botellas fueron presentadas simultáneamente: una botella conteniendo agua; el segundo frasco contiene 5% (p / v) de sacarosa. La colocación de la botella de sacarosa 5% (w / v) se alternó con cada exposición para controlar las preferencias laterales. Las botellas se pesaron 24 h después de la presentación de los fluidos y las medidas se tomaron al 0.1 g más cercano. El peso de cada rata también se midió para calcular los gramos de ingesta de sacarosa por kilogramo de peso corporal. En el día 1 del período de consumo, ratas (n = 6 – 9) tuvieron acceso a una botella de 5% (w / v) de sacarosa y una botella de agua. Después de 24 h, la botella de sacarosa se reemplazó con una segunda botella de agua que estaba disponible para el próximo 24 h. Este patrón se repitió los miércoles y viernes. Las ratas tenían acceso ilimitado al agua todos los demás días. El consumo de sacarosa en forma de atracones provocó una escalada en la ingesta total de sacarosa (ml) con el tiempo (Figura complementaria 1) y estuvo acompañado de niveles de consumo de referencia estables basados en el peso corporal [20 ± 5 g / kg del 5% (w / v)] durante las [semanas de ~ ~ 4 (sesiones de consumo de 13) a corto plazo] y a largo plazo ~ Semanas 12 (sesiones de bebida 37)] períodos de bebida. Un grupo separado de ratas de control (n = 6 – 9) tuvieron acceso al agua en ambas botellas (es decir, sin sacarosa) en las mismas condiciones descritas anteriormente. El peso corporal medio de las ratas control y que consumían sacarosa al final de la exposición a corto plazo fue 405.7 ± 40.8 gy 426.4 ± 31.2 g respectivamente. Al final de la exposición a largo plazo, el peso corporal medio para los grupos control y sacarosa fue 578.8 ± 53.4 gy 600.2 ± 45.2 g.
Tinción de Golgi-Cox
Después de la última sesión de bebida, se transfirieron ratas de las instalaciones de animales para permitir el procesamiento de las muestras de cerebro en las instalaciones de histología de la Escuela de Ciencias Biomédicas de la Universidad de Queensland (Santa Lucía, Australia). Se tomaron todas las medidas aprobadas para reducir el estrés durante el transporte, tras lo cual se permitió que las ratas se recuperaran durante la noche. Al día siguiente, las ratas se sacrificaron mediante sobredosis de pentobarbital sódico (60 – 80 mg / kg, ip Vetcare, Brisbane, Australia) y se perfundieron intracardialmente con ~ 300 ml de líquido cerebroespinal artificial que contenía, (en mM): 130 NaCl, 3 KCl, 26 NaHCO3, 1.25 NaH2PO4, 5 MgCl2, 1 CaCl2, y 10 D-glucosa. Luego se decapitó a cada animal y se extrajo el cerebro y se incubó en la oscuridad en solución de Golgi-Cox que contenía 5% de dicromato de potasio, 5% de cromato de potasio y 5% de cloruro de mercurio (todos los productos químicos de Sigma-Aldrich) que se prepararon recientemente 3 días antes del sacrificio como se describe anteriormente (Rutledge et al., 1969). La incubación de la tinción de Golgi-Cox y los métodos de posprocesamiento se modificaron a partir de Ranjan y Mallick (2010). Los cerebros de animales que consumen sacarosa a corto plazo se incubaron durante 6 días a 37 ° C, mientras que los cerebros de animales que consumían sacarosa a largo plazo se incubaron durante 10 días, con un cambio a una solución fresca de Golgi-Cox después de 4 días de incubación.
Tras la incubación, se cortaron secciones coronales de 300 μm utilizando un microtomo vibrante Zeiss Hyrax V50 (Carl Zeiss, Alemania). Luego, las rodajas se colocaron secuencialmente en placas de pocillos 24 llenas con 30% (p / v) de sacarosa en solución salina tamponada con fosfato 0.1 M y se procesaron como se describe en (Ranjan y Mallick, 2010). En resumen, las secciones se deshidrataron en 50% de etanol durante 5 min, luego se colocaron en 0.1 M NH4Solución de OH para 30 min, se enjuaga dos veces con agua destilada para 5 min y se coloca en el fijador de película Fujihunt (Fujifilm, Singapur) para 30 min en la oscuridad. Las rodajas se enjuagaron dos veces en agua destilada durante 2 min cada una y se deshidrataron en 70, 90, 95 y 100% etanol dos veces durante 5 min cada una. Luego, las secciones se aclararon en solución CXA (1: 1: 1 cloroformo: xileno: alcohol) durante 10 min y se montaron en DPX (Sigma-Aldrich) en portaobjetos Superfrost Plus (Menzel-Glaser, Lomb Scientific, Australia) y con tapa protectora (Menzel-Glaser, Alemania). Los portaobjetos se dejaron en la oscuridad para que se secaran a temperatura ambiente durante la noche.
Selección y rastreo neuronal en el núcleo accumbens
Los cortes coronales entre bregma + 2.8 y + 1.7 se examinaron en busca de MSN dentro del núcleo y la cubierta de la NAc, utilizando el ventrículo lateral y la comisura anterior como puntos de referencia con la ayuda de un atlas cerebral de rata (Paxinos y Watson, 2007) (Figura 1). La función de contorno en Neurolucida 7 (MBF Bioscience, VT, EE. UU.) Se usó para demarcar el núcleo NAc y la envoltura NAc en cada corte (Figura 2). Entre 2 y 9, las neuronas por región por animal se rastrearon para los parámetros de longitud dendrítica usando un objetivo 63x o para las densidades de la columna vertebral (reportadas como espinas por 100 μm) usando un objetivo 100x en un Zeiss Axioskop II (Carl Zeiss, Alemania) usando un automatizado xyz Etapa conducida por Neurolucida.® Software 7 (MBF Biosciences, VT, EE. UU.). Todo el rastreo se realizó de forma ciega con respecto al tratamiento. Los parámetros morfológicos de las neuronas impregnadas de Golgi-Cox se analizaron de manera similar a los informes anteriores (Klenowski et al., 2015).
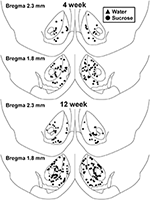
Figura 1. Mapa que muestra las ubicaciones de las neuronas espinosas medias muestreadas desde el núcleo del núcleo accumbens y la cáscara de las ratas consumidoras de sacarosa 4 y 12 week y los controles emparejados por edad. Los dos paneles superiores muestran las ubicaciones de las neuronas muestreadas desde el núcleo del núcleo accumbens y la cubierta de los animales de control de la semana 4 (triángulos) y sacarosa (círculos). Los dos paneles inferiores muestran las posiciones de las neuronas muestreadas de los animales de control de la semana 12 (triángulos) y sacarosa (círculos).
Análisis estadístico
La media y el error estándar de la media (SEM) se calcularon para cada conjunto de datos con el animal como n, utilizando los datos de morfometría media de todos los MSN de NAc de núcleo o shell (n = 7 para shell NAc y n = 6 para NAc core 4-week, n = 9 para grupos de 12 semanas). Donde se indique, estudiante de dos colas no emparejado tSe realizaron pruebas o ANOVA de dos vías con las pruebas posteriores de Bonferroni para todos los análisis que involucran la comparación de medias grupales, utilizando GraphPad Prism versión 6.02 (GraphPad Software, San Diego, CA). Significación estadística fue aceptada en P <0.05. Todos los datos en la sección de resultados se presentan como medias ± SEM. Los cambios porcentuales se calculan en relación con el valor de control.
Resultados
Las neuronas espinosas medianas del núcleo Accumbens Shell han disminuido la longitud dendrítica, disminuyeron la complejidad dendrítica pero aumentaron la densidad media de la columna vertebral en las órdenes de las ramas distales después del consumo de sacarosa a largo plazo pero no a corto plazo
Tras el consumo de sacarosa a corto plazo (4 semanas), no hubo diferencias significativas en los parámetros morfométricos de MSN de concha NAc (Tabla 1). Tampoco hubo diferencias significativas entre el consumo de sacarosa a corto plazo y los MSN de la capa NAc de control del agua en los análisis relacionados con el orden de las ramas centrífugas. A saber, segmentos dendríticos por orden de sucursal (P = 0.4111), longitud dendrítica media por orden de rama (P = 0.5581) y la densidad media de la columna vertebral por orden de rama (P = 0.2977, ANOVA de dos vías) no fueron significativamente diferentes entre los grupos. Un mapa de ubicación que muestra las posiciones aproximadas de las neuronas muestreadas se muestra en la Figura 1.

Tabla 1. Parámetros morfológicos generales de las neuronas espinosas medias de la cáscara del núcleo accumbens de ratas consumidoras de sacarosa a corto plazo y controles de agua de la misma edad.
Después del consumo a largo plazo (12 semanas) de sacarosa, la longitud total del árbol dendrítico de los MSN de cáscara NAc disminuyó un 21% en comparación con los controles que consumen agua (Agua: 1827 ± 148 μm, n = 9; Sacarosa 1449 ± 78 μm, n = 9, *P = 0.0384, estudiante de dos colas no apareado t-prueba, figura 2, Mesa 2). La comparación del número medio de bifurcaciones dendríticas (nodos) y terminaciones dendríticas entre los grupos de agua y sacarosa reveló un nivel reducido (aunque no significativo) de complejidad dendrítica en los MSN de concha NAc (nodos: Agua 12.9 ± 1.4 n = 9, sacarosa 10.1 ± 0.8 n = 9, P = 0.0879; terminaciones: agua 17.9 ± 1.4 n = 9, sacarosa 14.8 ± 0.7 n = 9, P = 0.0657, estudiante de dos colas no apareado t-test, tabla 2). No hubo cambio en el volumen de soma (P = 0.9400), longitud media del árbol dendrítico (P = 0.1646) o densidad total de la columna vertebral (P = 0.3662) en MSN con cáscara NAc de ratas que consumen sacarosa a largo plazo en comparación con los controles de agua. Estos parámetros morfométricos se detallan en la tabla. 2.
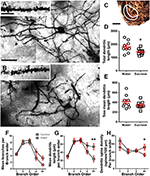 Figura 2. Disminución de la longitud del árbol dendrítico y aumento de la densidad de la espina dendrítica distal de neuronas espinosas medias (MSN) del núcleo accumbens (NAc) de ratas tratadas con sacarosa a largo plazo en comparación con ratas de control. (A, B) Mostrar representaciones de campo claro tratado con sacarosa de control (arriba) y a largo plazo (semana 12) zmosaicos de la pila de MSN impregnados de Golgi de la cáscara NAc (ampliación 63x). Inserción de (A, B) muestra imágenes de campo claro de control y tratadas con sacarosa a largo plazo de dendritas MSN impregnadas de Golgi y espinas dendríticas de la cáscara NAc (ampliación 100x). (C) muestra las regiones anatómicas de las que se tomaron muestras de MSN en este estudio. (D) muestra un diagrama de dispersión de la disminución del cenador dendrítico total MSN (media ± SEM) de la cáscara NAc en animales de sacarosa a largo plazo (cuadrados) en comparación con los controles (círculos), estudiantes no apareados t-prueba, *P <0.05, n = 9; control y n = 9; 12 semana sacarosa. (E) muestra un diagrama de dispersión de la longitud media del árbol dendrítico MSN sin cambios (media ± SEM) de la cáscara NAc en animales de sacarosa a largo plazo (cuadrados) en comparación con los controles (círculos), estudiantes no pareados t-prueba, P > 0.05, n = 9; control y n = 9; 12 semana de sacarosa. Análisis de orden de rama (media ± SEM) del número de segmento dendrítico por orden de rama (F), longitud dendrítica media por orden de rama (G) y densidad de la columna dendrítica por orden de rama (H). El consumo a largo plazo de sacarosa disminuyó la longitud dendrítica en los órdenes de las ramas distales (5 +) y aumentó la densidad de la columna dendrítica en los órdenes de las ramas distales (4 +) en comparación con los controles (G, H), ANOVAs bidireccionales con post-pruebas de Bonferroni, *P <0.05, **P <0.01, n = 9; control y n = 9; sacarosa a largo plazo. Barras de escala: (A, B) = 20 μm; inserción de (A, B) = 10 μm; (C) = 1 mm.
Figura 2. Disminución de la longitud del árbol dendrítico y aumento de la densidad de la espina dendrítica distal de neuronas espinosas medias (MSN) del núcleo accumbens (NAc) de ratas tratadas con sacarosa a largo plazo en comparación con ratas de control. (A, B) Mostrar representaciones de campo claro tratado con sacarosa de control (arriba) y a largo plazo (semana 12) zmosaicos de la pila de MSN impregnados de Golgi de la cáscara NAc (ampliación 63x). Inserción de (A, B) muestra imágenes de campo claro de control y tratadas con sacarosa a largo plazo de dendritas MSN impregnadas de Golgi y espinas dendríticas de la cáscara NAc (ampliación 100x). (C) muestra las regiones anatómicas de las que se tomaron muestras de MSN en este estudio. (D) muestra un diagrama de dispersión de la disminución del cenador dendrítico total MSN (media ± SEM) de la cáscara NAc en animales de sacarosa a largo plazo (cuadrados) en comparación con los controles (círculos), estudiantes no apareados t-prueba, *P <0.05, n = 9; control y n = 9; 12 semana sacarosa. (E) muestra un diagrama de dispersión de la longitud media del árbol dendrítico MSN sin cambios (media ± SEM) de la cáscara NAc en animales de sacarosa a largo plazo (cuadrados) en comparación con los controles (círculos), estudiantes no pareados t-prueba, P > 0.05, n = 9; control y n = 9; 12 semana de sacarosa. Análisis de orden de rama (media ± SEM) del número de segmento dendrítico por orden de rama (F), longitud dendrítica media por orden de rama (G) y densidad de la columna dendrítica por orden de rama (H). El consumo a largo plazo de sacarosa disminuyó la longitud dendrítica en los órdenes de las ramas distales (5 +) y aumentó la densidad de la columna dendrítica en los órdenes de las ramas distales (4 +) en comparación con los controles (G, H), ANOVAs bidireccionales con post-pruebas de Bonferroni, *P <0.05, **P <0.01, n = 9; control y n = 9; sacarosa a largo plazo. Barras de escala: (A, B) = 20 μm; inserción de (A, B) = 10 μm; (C) = 1 mm.
Tabla 2. Parámetros morfológicos generales de las neuronas espinosas medias de la cáscara del núcleo accumbens de ratas consumidoras de sacarosa a largo plazo y controles de agua de la misma edad.
Luego de la caracterización de la morfología dendrítica general de las MSN con cáscara NAc que consumen sacarosa a largo plazo, analizamos las arborizaciones dendríticas y las densidades de la columna vertebral con respecto a sus características de orden de ramificación. Nuestra evaluación exhaustiva de los árboles dendríticos cuantificó el número de segmentos dendríticos por orden de ramificación, la longitud media de los segmentos dendríticos por orden de ramificación y la densidad media de la columna vertebral por orden de ramificación de los MSN con cáscara NAc de control de agua y ratas consumidoras de sacarosa. En la Tabla se presenta un resumen de los datos y análisis de los pedidos de sucursal. 3.
 Tabla 3. Características del orden de las ramas de las neuronas espinosas medias de ratas que beben agua y sacarosa a largo plazo.
Tabla 3. Características del orden de las ramas de las neuronas espinosas medias de ratas que beben agua y sacarosa a largo plazo.El número promedio de segmentos de rama dendrítica por orden de rama de los MSN de concha NAc se redujo significativamente en ratas consumidoras de sacarosa a largo plazo en comparación con los controles de agua (**P = 0.0015, ANOVA de dos vías). Las pruebas posteriores de Bonferroni revelaron una tendencia hacia un número reducido de segmentos de rama en 4th (Agua: 5.2 ± 0.9, n = 9; Sacarosa 3.3 ± 0.8, n = 9, P = 0.0675, figura 2F, Mesa 3), y órdenes 5th y superiores a sucursales (Agua: 3.3 ± 0.7, n = 9; Sacarosa 1.2 ± 0.3, n = 9, P = 0.0566, figura 2F, Mesa 3). La longitud media del segmento dendrítico por orden de ramificación de NAc shell MSN también se redujo significativamente en ratas consumidoras de sacarosa a largo plazo en comparación con los controles de agua (*P = 0.0444, ANOVA de dos vías). Las pruebas posteriores de Bonferroni mostraron una reducción del 55% en las ramas de orden 5th y más allá (Agua: 53.9 ± 7.2 μm, n = 9; Sacarosa 24.1 ± 7.5 μm, n = 9, **P = 0.0038, figura 2G, Mesa 3).
El análisis del orden de las ramas mostró un aumento significativo en la densidad de la columna dendrítica de los MSN con cáscara NAc de ratas consumidoras de sacarosa a largo plazo en comparación con los controles (*P = 0.0124, ANOVA de dos vías). Las pruebas posteriores de Bonferroni mostraron un aumento de la densidad de la columna vertebral del 57% en las ramas distales del orden 4th y más allá (Agua: 33.4 ± 4.2, n = 9; Sacarosa 52.5 ± 6.8, n = 9, P = 0.0271 *, recuadro de Figuras 2A, B, H, Mesa 3). Las imágenes representativas de la arquitectura general de MSN y la densidad de la columna distal (recuadro) se muestran en las Figuras 2A, B.
Tomados en conjunto, estos resultados indican que el consumo de sacarosa a corto plazo tiene poco efecto sobre los parámetros morfológicos de los MSN dentro de la capa de NAc. Sin embargo, después de un consumo prolongado, hay una disminución significativa en la longitud y complejidad del eje neuronal, particularmente en las ramas dendríticas distales. Los aumentos concomitantes de la densidad de la columna distal también son evidentes en los MSN con cáscara NAc de ratas que consumen sacarosa a largo plazo.
Las neuronas espinosas medias del núcleo de Nucleus Accumbens tienen una complejidad de ramificación reducida después del consumo de sacarosa a largo plazo, pero no a corto plazo
Tras el consumo a corto plazo de sacarosa, no hubo diferencias significativas en los parámetros morfométricos de MSN del núcleo NAc (Tabla 4). Tampoco hubo diferencias significativas entre el consumo de sacarosa durante la semana 4 y los MSN centrales del control del agua en los análisis relacionados con el orden de las ramas centrífugas. A saber, segmentos dendríticos por orden de sucursal (P = 0.7717), longitud dendrítica media por orden de rama (P = 0.2096) y la densidad media de la espina por orden de rama (P = 0.3521, ANOVA de dos vías) no fueron diferentes entre los grupos.
 Tabla 4. Parámetros morfológicos generales de las neuronas espinosas medias del núcleo del núcleo accumbens de ratas consumidoras de sacarosa a corto plazo y controles de agua de la misma edad.
Tabla 4. Parámetros morfológicos generales de las neuronas espinosas medias del núcleo del núcleo accumbens de ratas consumidoras de sacarosa a corto plazo y controles de agua de la misma edad.El consumo prolongado de sacarosa tampoco tuvo un valor significativo en los parámetros morfométricos de MSN del núcleo de NAc (Tabla 5). El número promedio de segmentos de rama dendrítica por orden de rama de los MSN centrales de NAc se redujo significativamente en ratas consumidoras de sacarosa a largo plazo en comparación con los controles de agua (*P = 0.0416, ANOVA de dos vías), sin embargo, no hubo diferencias significativas en la longitud dendrítica media por orden de ramificación (P = 0.0995) y la densidad media de la columna vertebral por orden de rama (P = 0.4888, ANOVA de dos vías) entre MSN en el núcleo de NAc de ratas consumidoras de sacarosa a largo plazo en comparación con los controles de agua. En conjunto, nuestros datos muestran que el núcleo de NAc no responde tan bien al consumo de sacarosa a largo plazo en comparación con los MSN de la región de cáscara de NAc.
 Tabla 5. Parámetros morfológicos generales de neuronas espinosas medias del núcleo del núcleo accumbens de ratas consumidoras de sacarosa a largo plazo y controles de agua de la misma edad.
Tabla 5. Parámetros morfológicos generales de neuronas espinosas medias del núcleo del núcleo accumbens de ratas consumidoras de sacarosa a largo plazo y controles de agua de la misma edad.Discusión
El aumento de la disponibilidad de alimentos altamente endulzados en la dieta occidental no solo ha contribuido al aumento de la prevalencia y la carga económica de la obesidad y la diabetes tipo II, sino que también ha provocado la aparición de trastornos de la alimentación como el atracón (Swanson y otros, 2011; Kessler y otros, 2013; Davis, 2015). Si bien las propiedades adictivas de los azúcares, incluida la fructosa y la sacarosa, siguen siendo especulativas, existe una sorprendente similitud en el comportamiento y en los correlatos neurales que se manifiestan como resultado de una ingesta excesiva y un consumo prolongado de drogas. (Avena et al., 2008, 2011). Además, el azúcar activa los circuitos de recompensa del cerebro de una manera similar a las drogas de abuso (Volkow et al., 2012), y los resultados de estudios en humanos sugieren que el azúcar y la dulzura pueden inducir antojos que son comparables en magnitud a los inducidos por drogas adictivas como el alcohol y la nicotina. (Volkow et al., 2012). Por lo tanto, utilizamos un modelo de consumo de sacarosa de atracón en ratas para determinar los efectos del consumo de sacarosa a corto plazo (semanas 4) y a largo plazo (semanas 12) en la morfología neuronal de MSN en la NAc, un componente clave del circuito de recompensa superpuesta Eso está modulado por el azúcar y las drogas adictivas. Mostramos que los MSN de la cáscara NAc de ratas crónicas que consumen sacarosa a largo plazo han disminuido significativamente la longitud y complejidad dendríticas, pero aumentaron la densidad de la columna dendrítica distal. El consumo a largo plazo de sacarosa no tuvo ningún efecto en la morfología de los MSN del núcleo de NAc, mientras que el consumo a corto plazo de sacarosa tampoco tuvo un efecto significativo en la morfología de MSN del núcleo o la capa de NAc. Estos resultados no solo demuestran un efecto directo de la ingesta prolongada de sacarosa en forma de atracones en la morfología neuronal de los MSN con cáscara NAc, sino que también resaltan las consecuencias potencialmente dañinas del consumo prolongado de dietas con alto contenido de azúcar.
La NAc, que forma parte del cuerpo estriado ventral, está compuesta principalmente de MSN, que se caracterizan morfológicamente como neuronas de tamaño mediano con extensas arborizaciones dendríticas y alta densidad de la columna vertebral (Kemp y Powell, 1971; Graveland y DiFiglia, 1985; Rafols et al., 1989; Kawaguchi et al., 1990). Las neuronas glutamatérgicas y dopaminérgicas son las dos entradas aferentes primarias a la NAc, principalmente en contacto con los ejes dendríticos y las espinas de los MSN. (Arboledas, 1980; Kaiya y Namba, 1981; Groves et al., 1994). Específicamente, la carcasa y el núcleo de NAc reciben entrada glutamatérgica de áreas corticales funcionalmente distintas (Brog et al., 1993). La concha NAc también está inervada por aferentes excitadores de regiones subcorticales como el hipocampo, el tálamo y la amígdala basolateral (Brog et al., 1993; Wright y Groenewegen, 1995). Estudios previos han demostrado que estos insumos glutamáticos desempeñan un papel fundamental en la motivación y en los comportamientos dirigidos a los objetivos, como la búsqueda de alimentos y recompensas. (Maldonado-Irizarry et al., 1995; Kelley y Swanson, 1997; Reynolds y Berridge, 2003; Richard y Berridge, 2011). La otra entrada predominante en NAc MSN es de aferentes dopaminérgicos que se proyectan desde el área ventral tegmental (Lindvall y Björklund, 1978; Veening et al., 1980; Kalivas y Miller, 1984). Curiosamente, estudios previos que utilizaron modelos similares de acceso intermitente al azúcar han demostrado que el consumo resultante de un atracón produce un aumento en la dopamina extracelular en la NAc de manera similar (aunque en menor medida) a las drogas de abuso. (Rada et al., 2005; Avena et al., 2006), y puede modular la expresión del receptor de dopamina (Colantuoni et al., 2001, 2002) en el núcleo y la concha de NAc. Curiosamente, el consumo excesivo de sacarosa provoca una escalada en el consumo a lo largo del tiempo de manera similar a la autoadministración de drogas de abuso como la cocaína y la heroína.nAhmed y Koob, 1998; Ahmed et al., 2000, 2003) que se asocia con el desarrollo de un estado "adictivo".
Nuestro análisis de la morfometría de orden de ramificación muestra que la reducción general en la longitud dendrítica de los MSN de concha NAc causada por la ingesta de sacarosa a largo plazo, se debe principalmente a las reducciones en la complejidad de los órdenes de ramificación distales. Observamos una ramificación distal reducida (órdenes 4th y 5th y por encima de las ramificaciones) y una longitud media significativamente reducida en las órdenes 5th y por encima de las dendritas, combinadas con una mayor densidad de la columna vertebral en estas órdenes de ramificaciones. Un factor común que puede influir en este tipo de reestructuración dendrítica incluye cambios en la conectividad y / o función sináptica (Russo et al., 2010). Estudios anteriores han demostrado que las sinapsis glutamatérgicas en MSN se forman principalmente en espinas, particularmente en dendritas distales (Groenewegen et al., 1999). Además, la co-localización de dopamina y glutamatérgicos de la corteza prefrontal (Sesack y Pickel, 1992), hipocampo (Totterdell y Smith, 1989; Sesack y Pickel, 1990), y amígdala (Johnson et al., 1994) se han observado en espinas dendríticas de MSNs. Estas observaciones, combinadas con el aumento de la densidad de la columna vertebral después del consumo de sacarosa a largo plazo observado en nuestro estudio, respaldan la formación de un aumento de entradas excitadoras. Por lo tanto, surge la posibilidad de que los efectos persistentes causados por la ingesta prolongada de sacarosa similar al atracón puedan facilitar el aumento de la actividad sináptica excitadora en las dendritas distales de los MSN en la capa de NAc. En consecuencia, la reducción y / o retracción de las dendritas distales puede resultar a través de un mecanismo homeostático sináptico. (Reissner y Kalivas, 2010), sin embargo esto queda por determinar.
Es interesante observar que Crombag y sus colegas demostraron que no hubo un aumento en la densidad de la columna vertebral en la cáscara NAc después del consumo de sacarosa 4-semana a través del paradigma de autoadministración de la nariz a pesar de una adquisición más robusta y una mayor tasa de respuesta a la sacarosa en comparación con anfetaminaCrombag et al., 2005). Su observación de una ausencia de cambio en la densidad de la columna vertebral en las semanas 4 refleja nuestros hallazgos. Sin embargo, en contraste, nuestro estudio demuestra que luego de la exposición a largo plazo (semana 12) al consumo crónico de sacarosa, hay un aumento significativo en la densidad de la columna distal en los MSN de ratas con experiencias de sacarosa. Además, nuestro laboratorio ha demostrado previamente que el consumo de sacarosa a largo plazo (semana 12) facilita una respuesta farmacológica diferencial a los farmacoterapéuticos que se ha demostrado que modulan las respuestas de dopamina y acetilcolina al nivel de la NAc (Shariff et al., En prensa.). En conjunto, esto sugiere que la exposición a la sacarosa a largo plazo (semanas 12 y más allá), que refleja con mayor precisión los escenarios del mundo real, produce adaptaciones morfológicas a nivel de la NAc.
En términos de drogas de abuso, la exposición repetida a varias drogas produce cambios duraderos en la estructura de las dendritas y espinas dendríticas. Por ejemplo, tanto las anfetaminas como la cocaína aumentan la densidad de la columna vertebral en la NAc tanto en la cáscara como en el núcleo (Robinson y Kolb, 2004). También se ha demostrado que la exposición a la nicotina aumenta la densidad de la columna vertebral en la capa de NAc. Por el contrario, la exposición a la morfina conduce a una disminución en la densidad de la columna vertebral y la complejidad de la rama dendrítica (Robinson y Kolb, 2004). En términos de consumo de sacarosa a largo plazo, observamos un aumento en la densidad de la columna vertebral similar a la anfetamina, la cocaína y la nicotina y en comparación con el efecto de la morfina. Sin embargo, a diferencia de la anfetamina y la cocaína, pero similar a la nicotina, el aumento de la densidad de la columna vertebral en la exposición a largo plazo a la sacarosa se limita a la capa de NAc. También es interesante que los cambios tanto en la ramificación dendrítica (Robinson y Kolb, 1999) y la densidad de la columna vertebral (Li et al., 2003) producidos por la anfetamina o la cocaína se limitan a las dendritas distales de las MSN en la NAc, lo que refleja los hallazgos de nuestro estudio. Además, y corroborando los cambios descritos anteriormente, también se ha demostrado que el consumo de sacarosa aumenta la fuerza sináptica excitatoria en las neuronas de dopamina accumbal (Stuber et al., 2008b), así como otros componentes de la vía de recompensa mesolímbica (Stuber et al., 2008a; Chen et al., 2010). En conjunto, esto postula a la sacarosa como un potente modulador de la morfología de las neuronas luego de un uso prolongado y pesado, que es similar a los efectos observados por las drogas de abuso.
Aunque se requieren investigaciones adicionales para descubrir los mecanismos celulares y sinápticos que contribuyen a los cambios morfológicos observados en este estudio, nuestros resultados demuestran efectos neuronales significativos engendrados por el consumo a largo plazo de sacarosa. En particular, una consideración no examinada en nuestro estudio es si los efectos morfológicos observados de la sacarosa también pueden provocarse con edulcorantes no calóricos como la sacarina. En este sentido, es importante tener en cuenta que Lenoir y sus colegas han demostrado que la dulzura intensa supera la recompensa de la cocaína, ya sea generada por sacarina o sacarosa (Lenoir et al., 2007). Además, un reciente estudio publicado por nuestro laboratorio (Shariff et al., En prensa.) demuestra que la vareniclina, un agonista parcial del receptor nicotínico de acetilcolina, redujo la ingesta de sacarosa y sacarina en roedores siguiendo el mismo régimen de acceso intermitente a largo plazo utilizado en el presente estudio. Curiosamente, estudios previos han mostrado similitudes en los efectos agudos de los edulcorantes no calóricos como la sacarina y la sacarosa a nivel de la NAc (Scheggi et al., 2013; Tukey et al., 2013; Carelli y West, 2014). Sin embargo, se necesitan más estudios para determinar si los edulcorantes no calóricos pueden inducir efectos a largo plazo similares a los cambios en la morfología de los MSN de cáscara NAc causados por el consumo de sacarosa a largo plazo que se informa aquí.
La falta de efecto en la morfología de NAc MSN después del consumo de sacarosa a corto plazo, resalta la importancia de implementar estudios a largo plazo para evaluar el impacto del abuso prolongado de drogas o recompensas naturales como la sacarosa. En términos de dependencia, no solo los ciclos repetidos de ingesta compulsiva y abstinencia son componentes clave del ciclo de adicción, sino que cada vez más evidencia revela que la transición a la dependencia es un proceso progresivo que a menudo ocurre durante un período prolongado de tiempo. Si bien las propiedades adictivas de los azúcares siguen siendo inciertas, se está investigando cada vez más la plausibilidad de la adicción a otras recompensas no relacionadas con las drogas, como el sexo, los juegos de azar y los alimentos. Los resultados de este estudio agregan mérito a la hipótesis de que los azúcares como la sacarosa tienen potencialmente propiedades adictivas después de un consumo a largo plazo, como el consumo compulsivo. Nuestros resultados también tienen implicaciones para el creciente número de niños y adolescentes que mantienen hábitos alimenticios poco saludables (alto consumo de azúcar y atracones) en la edad adulta. En línea con el aumento del riesgo de desarrollar efectos metabólicos, también es posible que las consecuencias neurológicas y psiquiátricas que afectan el estado de ánimo y la motivación también puedan resultar de estos comportamientos.
Contribuciones de autor
Participé en diseño de investigación: PK, SB. Experimentos conducidos: PK, MS, AB, MF, EM. Análisis de los datos: PK, MF, MS. Interpretó los datos y contribuyó a la redacción del manuscrito: PK, MS, MF, EM, MB, SB. Todos los autores leyeron y aprobaron el manuscrito final para su presentación.
Declaracion de conflicto de interes
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Los revisores SC, SA y el Editor de manejo declararon su afiliación compartida, y el Editor de manejo declara que el proceso, sin embargo, cumplió con los estándares de una revisión justa y objetiva.
AGRADECIMIENTOS
Este trabajo fue apoyado por fondos de subvenciones del Consejo de Investigación Australiano (FT1110884) a SB y el Consejo Nacional de Investigación Médica y de Salud (1061979) a SB y MB.
Material suplementario
El Material complementario para este artículo se puede encontrar en línea en: http://journal.frontiersin.org/article/10.3389/fnbeh.2016.00054
Figura suplementaria 1. Ingesta de sacarosa y preferencia de las ratas consumidoras de sacarosa 4 y 12 semana. (A, B) muestran una escalada en la ingesta total de sacarosa (ml) durante 4 y 12 semanas de exposición. (DISCOS COMPACTOS) muestran alta preferencia por la sacarosa sobre el agua durante los períodos de presentación de la sacarosa
Referencias
Ahmed, SH, y Koob, GF (1998). Transición de la ingesta de drogas moderada a excesiva: cambio en el punto de ajuste hedónico. Ciencia: 282, 298 – 300. doi: 10.1126 / science.282.5387.298
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ahmed, SH, Lin, D., Koob, GF y Parsons, LH (2003). La escalada de la autoadministración de cocaína no depende de los niveles alterados de dopamina en el núcleo accumbens inducido por la cocaína. J. Neurochem. 86, 102 – 113. doi: 10.1046 / j.1471-4159.2003.01833.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ahmed, SH, Walker, JR y Koob, GF (2000). Aumento persistente en la motivación para tomar heroína en ratas con un historial de aumento de fármacos. Neuropsicofarmacología 22, 413–421. doi: 10.1016/S0893-133X(99)00133-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Arslanian, S. (2002). Diabetes tipo 2 en niños: aspectos clínicos y factores de riesgo. Horm Res 57 (Suppl. 1), 19 – 28. doi: 10.1159 / 000053308
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Avena, NM, Bocarsly, ME, Hoebel, BG y Gold, MS (2011). Se superpone en la nosología del abuso de sustancias y la sobrealimentación: las implicaciones traslacionales de la "adicción a la comida". Curr. Abuso de Drogas Rev. 4, 133 – 139. doi: 10.2174 / 1874473711104030133
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Avena, NM, Rada, P., y Hoebel, BG (2008). Evidencia de la adicción al azúcar: efectos neuroquímicos y de comportamiento de la ingesta intermitente y excesiva de azúcar. Neurosci. Biobehav. Rdo. 32, 20 – 39. doi: 10.1016 / j.neubiorev.2007.04.019
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Avena, NM, Rada, P., Moise, N. y Hoebel, BG (2006). La alimentación simulada de sacarosa en un horario de atracones libera repetidamente dopamina accumbens y elimina la respuesta a la sensación de acetilcolina. Neurociencia 139, 813 – 820. doi: 10.1016 / j.neuroscience.2005.12.037
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Benton, D. (2010). La plausibilidad de la adicción al azúcar y su papel en la obesidad y los trastornos alimentarios. Clinica Nutr. 29, 288 – 303. doi: 10.1016 / j.clnu.2009.12.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Bray, GA, y Popkin, BM (2014). Azúcar en la dieta y peso corporal: ¿hemos llegado a una crisis en la epidemia de obesidad y diabetes? ¡Maldita sea la salud! Vierta sobre el azúcar. Cuidado de la Diabetes 37, 950 – 956. doi: 10.2337 / dc13-2085
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Brog, JS, Salyapongse, A., Deutch, AY y Zahm, DS (1993). Los patrones de inervación aferente del núcleo y la cáscara en la parte "accumbens" del estriado ventral de rata: detección inmunohistoquímica de flúor-oro transportado retrógradamente. J. comp. Neurol. 338, 255 – 278. doi: 10.1002 / cne.903380209
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Bucher Della Torre, S., Keller, A., Laure Depeyre, J., y Kruseman, M. (2015). Bebidas azucaradas y riesgo de obesidad en niños y adolescentes: un análisis sistemático sobre cómo la calidad metodológica puede influir en las conclusiones. J. Acad. Nutr. Dieta. [Epub antes de imprimir]. doi: 10.1016 / j.jand.2015.05.020
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Carelli, RM y West, EA (2014). Cuando el buen gusto se vuelve malo: mecanismos neuronales subyacentes a la aparición de afecto negativo y la devaluación de la recompensa natural asociada por la cocaína. Neurofarmacología 76 (Pt B), 360 – 369. doi: 10.1016 / j.neuropharm.2013.04.025
Chen, BT, Hopf, FW y Bonci, A. (2010). Plasticidad sináptica en el sistema mesolímbico: implicaciones terapéuticas para el abuso de sustancias. Ana. NY Acad. Sci. 1187, 129 – 139. doi: 10.1111 / j.1749-6632.2009.05154.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Colantuoni, C., Rada, P., McCarthy, J., Patten, C., Avena, NM, Chadeayne, A., et al. (2002). La evidencia de que la ingesta intermitente y excesiva de azúcar causa la dependencia de opiáceos endógenos. Obes Res. 10, 478 – 488. doi: 10.1038 / oby.2002.66
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Colantuoni, C., Schwenker, J., McCarthy, J., Rada, P., Ladenheim, B., Cadet, JL, et al. (2001). La ingesta excesiva de azúcar altera la unión a los receptores de dopamina y opioides mu en el cerebro. Neuroreport 12, 3549–3552. doi: 10.1097/00001756-200111160-00035
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Crombag, HS, Gorny, G., Li, Y., Kolb, B. y Robinson, TE (2005). Efectos opuestos de la experiencia de autoadministración de anfetaminas en espinas dendríticas en la corteza prefrontal medial y orbital. Cereb. Corteza 15, 341 – 348. doi: 10.1093 / cercor / bhh136
Dabelea, D., Mayer-Davis, EJ, Saydah, S., Imperatore, G., Linder, B., Divers, J., et al. (2014). Prevalencia de diabetes tipo 1 y tipo 2 en niños y adolescentes de 2001 a 2009. JAMA 311, 1778 – 1786. doi: 10.1001 / jama.2014.3201
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Davis, C. (2015). La epidemiología y genética del trastorno por atracón (BED). CNS Spectr. 20, 522 – 529. doi: 10.1017 / s1092852915000462
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ford, ES y Dietz, WH (2013). Tendencias en el consumo de energía entre los adultos en los Estados Unidos: hallazgos de NHANES. A.m. J. Clin. Nutr. 97, 848 – 853. doi: 10.3945 / ajcn.112.052662
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Fryar, CD, Carroll, MD y Ogden, CL (2014). Prevalencia de sobrepeso, obesidad y obesidad extrema entre adultos: Estados Unidos, 1960 – 1962 a través de 2011 – 2012. Atlanta, GA: CDC.
Graveland, GA, y DiFiglia, M. (1985). La frecuencia y distribución de neuronas de tamaño mediano con núcleos con sangría en el neostriado de primates y roedores. Brain Res. 327, 307–311. doi: 10.1016/0006-8993(85)91524-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Groenewegen, HJ, Wright, CI, Beijer, AV y Voorn, P. (1999). Convergencia y segregación de entradas y salidas del estriado ventral. Ana. NY Acad. Sci. 877, 49–63. doi: 10.1111/j.1749-6632.1999.tb09260.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Arboledas, PM (1980). Terminaciones sinápticas y sus objetivos postsinápticos en neostriatum: especializaciones sinápticas reveladas a partir del análisis de secciones seriadas. Proc. Natl. Acad. Ciencia. EE.UU. 77, 6926 – 6929. doi: 10.1073 / pnas.77.11.6926
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Groves, PM, Linder, JC y Young, SJ (1994). 5: axones dopaminérgicos marcados con hidroxidopamina: reconstrucciones tridimensionales de axones, sinapsis y dianas postsinápticas en el neostriatum de ratas. Neurociencia 58, 593–604. doi: 10.1016/0306-4522(94)90084-1
Hu, FB (2013). Resuelto: existe evidencia científica suficiente de que disminuir el consumo de bebidas azucaradas reducirá la prevalencia de obesidad y enfermedades relacionadas con la obesidad. Obes Rdo. 14, 606 – 619. doi: 10.1111 / obr.12040
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Johnson, LR, Aylward, RL, Hussain, Z., y Totterdell, S. (1994). Entrada de la amígdala al núcleo de rata accumbens: su relación con la inmunoreactividad de la tirosina hidroxilasa y las neuronas identificadas. Neurociencia 61, 851–865. doi: 10.1016/0306-4522(94)90408-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kaiya, H., y Namba, M. (1981). Dos tipos de terminales nerviosas dopaminérgicas en el rata neostriatum. Un estudio ultraestructural. Neurosci. Lett. 25, 251–256. doi: 10.1016/0304-3940(81)90400-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kalivas, PW y Miller, JS (1984). Las neuronas neurotensinas en el área tegmental ventral se proyectan hacia el núcleo medial accumbens. Brain Res. 300, 157–160. doi: 10.1016/0006-8993(84)91351-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kawaguchi, Y., Wilson, CJ y Emson, PC (1990). Subtipos de proyección de células de la matriz neostriatal de rata reveladas por inyección intracelular de biocitina. J. Neurosci. 10, 3421-3438.
Kelley, AE y Swanson, CJ (1997). Alimentación inducida por el bloqueo de los receptores de AMPA y kainato en el estriado ventral: un estudio de mapeo de microinfusión. Behav. Brain Res. 89, 107–113. doi: 10.1016/S0166-4328(97)00054-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kemp, JM y Powell, TP (1971). La organización sináptica del núcleo caudado. Filosofia Trans. R. Soc. Lond. B Biol. Sci. 262, 403 – 412. doi: 10.1098 / rstb.1971.0103
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kenny, PJ (2011). Mecanismos de recompensa en la obesidad: nuevas perspectivas y orientaciones futuras. Neurona 69, 664 – 679. doi: 10.1016 / j.neuron.2011.02.016
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kessler, RC, Berglund, PA, Chiu, WT, Deitz, AC, Hudson, JI, Shahly, V., y otros. (2013). La prevalencia y los correlatos del trastorno por atracón en las Encuestas mundiales de salud mental de la Organización Mundial de la Salud. Biol. Psiquiatría 73, 904 – 914. doi: 10.1016 / j.biopsych.2012.11.020
Klenowski, PM, Fogarty, MJ, Belmer, A., Noakes, PG, Bellingham, MC y Bartlett, SE (2015). Caracterización estructural y funcional de cenizas dendríticas y entradas sinápticas GABAérgicas en interneuronas y células principales en la amígdala basolateral de rata. J. Neurofisiol. 114, 942 – 957. doi: 10.1152 / jn.00824.2014
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Lenoir, M., Serre, F., Cantin, L., y Ahmed, SH (2007). La dulzura intensa supera la recompensa de la cocaína. PLoS ONE 2: e698. doi: 10.1371 / journal.pone.0000698
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Li, Y., Kolb, B. y Robinson, TE (2003). La ubicación de los cambios persistentes inducidos por anfetaminas en la densidad de las espinas dendríticas en las neuronas espinosas medias en el núcleo accumbens y el caudado-putamen. Neuropsicofarmacología 28, 1082 – 1085. doi: 10.1038 / sj.npp.1300115
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Lindvall, O., y Björklund, A. (1978). Anatomía de los sistemas neuronales dopaminérgicos en el cerebro de rata. Adv. Biochem. Psychopharmacol. 19, 1-23.
Lutter, M., y Nestler, EJ (2009). Las señales homeostáticas y hedónicas interactúan en la regulación de la ingesta de alimentos. J. Nutr. 139, 629 – 632. doi: 10.3945 / jn.108.097618
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Maldonado-Irizarry, CS, Swanson, CJ y Kelley, AE (1995). Los receptores de glutamato en el núcleo accumbens controlan el comportamiento de alimentación a través del hipotálamo lateral. J. Neurosci. 15, 6779-6788.
Malik, VS, Popkin, BM, Bray, GA, Després, JP y Hu, FB (2010). Bebidas azucaradas, obesidad, diabetes mellitus tipo 2 y riesgo de enfermedad cardiovascular. Circulación 121, 1356 – 1364. doi: 10.1161 / CIRCULATIONAHA.109.876185
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ng, SW, Slining, MM y Popkin, BM (2012). Uso de edulcorantes calóricos y no calóricos en alimentos empacados para el consumidor de los EE. UU., 2005-2009. J. Acad. Nutr. Dieta. 112, 1828 – 1834 e1821 – e1826. doi: 10.1016 / j.jand.2012.07.009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Nielsen, SJ, Siega-Riz, AM y Popkin, BM (2002). Tendencias en la ingesta de energía en EE. UU. Entre 1977 y 1996: cambios similares observados en todos los grupos de edad. Obes Res. 10, 370 – 378. doi: 10.1038 / oby.2002.51
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Paxinos, G., y Watson, C. (2007). El cerebro de rata en coordenadas estereotáxicas. Amsterdam Boston, MA: Academic Press / Elsevier.
Popkin, BM (2010). ¿Qué hay de malo en el enfoque estadounidense de la obesidad? Mentor virtual 12, 316–320. doi: 10.1001/virtualmentor.2010.12.4.pfor2-1004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Rada, P., Avena, NM, y Hoebel, BG (2005). Los atracones diarios de azúcar liberan repetidamente dopamina en la cáscara de los accumbens. Neurociencia 134, 737 – 744. doi: 10.1016 / j.neuroscience.2005.04.043
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Rafols, JA, Cheng, HW y McNeill, TH (1989). Estudio de Golgi del estriado del ratón: cambios dendríticos relacionados con la edad en diferentes poblaciones neuronales. J. comp. Neurol. 279, 212 – 227. doi: 10.1002 / cne.902790205
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ranjan, A., y Mallick, BN (2010). Un método modificado para la tinción consistente y confiable de Golgi-cox en un tiempo significativamente reducido. Frente. Neurol. 1: 157. doi: 10.3389 / fneur.2010.00157
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Reinehr, T. (2013). La diabetes mellitus tipo 2 en niños y adolescentes. Mundo j. Diabetes 4, 270 – 281. doi: 10.4239 / wjd.v4.i6.270
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Reissner, KJ, y Kalivas, PW (2010). El uso de la homeostasis del glutamato como un objetivo para el tratamiento de trastornos adictivos. Behav. Pharmacol. 21, 514–522. doi: 10.1097/FBP.0b013e32833d41b2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Reynolds, SM y Berridge, KC (2003). Conjuntos motivacionales de glutamato en el núcleo accumbens: gradientes de concha rostrocaudal de miedo y alimentación. EUR. J. Neurosci. 17, 2187 – 2200. doi: 10.1046 / j.1460-9568.2003.02642.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Richard, JM y Berridge, KC (2011). La interacción de dopamina / glutamato de Nucleus accumbens cambia los modos para generar deseo frente a temor: D (1) solo para comer con apetito, pero D (1) y D (2) juntos para el miedo. J. Neurosci. 31, 12866 – 12879. doi: 10.1523 / JNEUROSCI.1339-11.2011
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Robinson, TE y Kolb, B. (1999). Alteraciones en la morfología de las dendritas y espinas dendríticas en el núcleo accumbens y la corteza prefrontal después de un tratamiento repetido con anfetamina o cocaína. EUR. J. Neurosci. 11, 1598 – 1604. doi: 10.1046 / j.1460-9568.1999.00576.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Robinson, TE y Kolb, B. (2004). Plasticidad estructural asociada a la exposición a drogas de abuso. Neurofarmacología 47 (Suppl. 1), 33 – 46. doi: 10.1016 / j.neuropharm.2004.06.025
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Russo, SJ, Dietz, DM, Dumitriu, D., Morrison, JH, Malenka, RC, y Nestler, EJ (2010). La sinapsis adicta: mecanismos de plasticidad sináptica y estructural en el núcleo accumbens. Tendencias Neurosci. 33, 267 – 276. doi: 10.1016 / j.tins.2010.02.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Rutledge, LT, Duncan, J. y Beatty, N. (1969). Un estudio de colaterales de axón de células piramidales en la corteza cerebral adulta parcialmente aislada y intacta. Brain Res. 16, 15–22. doi: 10.1016/0006-8993(69)90082-1
Saper, CB, Chou, TC y Elmquist, JK (2002). La necesidad de alimentar: control homeostático y hedónico de la alimentación. Neurona 36, 199–211. doi: 10.1016/S0896-6273(02)00969-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Scheggi, S., Secci, ME, Marchese, G., De Montis, MG, y Gambarana, C. (2013). Influencia de la palatabilidad en la motivación para operar con alimentos calóricos y no calóricos en ratas no privadas de alimentos y privadas de alimentos. Neurociencia 236, 320 – 331. doi: 10.1016 / j.neuroscience.2013.01.027
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sesack, SR, y Pickel, VM (1990). En el núcleo medial de la rata accumbens, el hipocampo y los terminales catecolaminérgicos convergen en neuronas espinosas y están en aposición entre sí. Brain Res. 527, 266–279. doi: 10.1016/0006-8993(90)91146-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sesack, SR, y Pickel, VM (1992). Efferentes corticales prefrontales en la sinapsis de rata en dianas neuronales sin etiqueta de terminales de catecolamina en el núcleo accumbens septi y en neuronas de dopamina en el área ventral tegmentaria. J. comp. Neurol. 320, 145 – 160. doi: 10.1002 / cne.903200202
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Shariff, M., Quik, M., Holgate, JY, Morgan, M., Patkar, OL, Tam, V., y otros. (en prensa). Los moduladores del receptor nicotínico de acetilcolina neuronal reducen la ingesta de azúcar. PLoS ONE.
Sheehan, DV, y Herman, BK (2015). Los factores psicológicos y médicos asociados con el trastorno por atracón no tratado. Remilgado. Care Companion CNS Disord. 17. doi: 10.4088 / PCC.14r01732
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Simms, JA, Steensland, P., Medina, B., Abernathy, KE, Chandler, LJ, Wise, R., et al. (2008). El acceso intermitente al 20% de etanol induce un alto consumo de etanol en ratas Long-Evans y Wistar. Alcohol. Clinica Exp. Res. 32, 1816 – 1823. doi: 10.1111 / j.1530-0277.2008.00753.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Steensland, P., Simms, JA, Holgate, J., Richards, JK, y Bartlett, SE (2007). La vareniclina, un agonista parcial del receptor nicotínico nicotínico alfa4beta2, disminuye selectivamente el consumo y la búsqueda de etanol. Proc. Natl. Acad. Ciencia. EE.UU. 104, 12518 – 12523. doi: 10.1073 / pnas.0705368104
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Stuber, GD, Hopf, FW, Hahn, J., Cho, SL, Guillory, A. y Bonci, A. (2008a). El consumo voluntario de etanol aumenta la fuerza sináptica excitadora en el área tegmental ventral. Alcohol. Clinica Exp. Res. 32, 1714 – 1720. doi: 10.1111 / j.1530-0277.2008.00749.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Stuber, GD, Klanker, M., de Ridder, B., Bowers, MS, Joosten, RN, Feenstra, MG, et al. (2008b). Las señales predictivas de recompensa aumentan la fuerza sináptica excitadora en las neuronas de dopamina del cerebro medio. Ciencia: 321, 1690 – 1692. doi: 10.1126 / science.1160873
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Swanson, SA, Crow, SJ, Le Grange, D., Swendsen, J. y Merikangas, KR (2011). Prevalencia y correlatos de los trastornos alimentarios en adolescentes. Los resultados de la encuesta de comorbilidad nacional replicación suplemento para adolescentes. Arco. Gen. Psiquiatría 68, 714 – 723. doi: 10.1001 / archgenpsychiatry.2011.22
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Te Morenga, L., Mallard, S., y Mann, J. (2013). Azúcares en la dieta y peso corporal: revisión sistemática y metanálisis de ensayos controlados aleatorios y estudios de cohortes. BMJ 346: e7492. doi: 10.1136 / bmj.e7492
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Totterdell, S., y Smith, AD (1989). Convergencia de hipocampo y dopaminérgico en neuronas identificadas en el núcleo accumbens de la rata. J. Chem. Neuroanat. 2, 285-298.
Tukey, DS, Ferreira, JM, Antoine, SO, D'Amour, JA, Ninan, I., Cabeza de Vaca, S., et al. (2013). La ingestión de sacarosa induce un tráfico rápido de receptores AMPA. J. Neurosci. 33, 6123 – 6132. doi: 10.1523 / JNEUROSCI.4806-12.2013
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Veening, JG, Cornelissen, FM y Lieven, PA (1980). La organización tópica de los aferentes al caudatoputamen de la rata. Un estudio de la peroxidasa de rábano picante. Neurociencia 5, 1253–1268. doi: 10.1016/0306-4522(80)90198-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ventura, T., Santander, J., Torres, R., y Contreras, AM (2014). Bases neurobiológicas del ansia de hidratos de carbono. Nutrición 30, 252 – 256. doi: 10.1016 / j.nut.2013.06.010
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Volkow, ND, Wang, GJ, Fowler, JS, Tomasi, D. y Baler, R. (2012). Comida y recompensa de drogas: circuitos superpuestos en la obesidad humana y la adicción. Curr. Parte superior. Behav. Neurosci. 11, 1–24. doi: 10.1007/7854_2011_169
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sabio, RA (1973). Ingesta voluntaria de etanol en ratas después de la exposición al etanol en varios programas. Psychopharmacologia 29, 203 – 210. doi: 10.1007 / BF00414034
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Wright, CI y Groenewegen, HJ (1995). Patrones de convergencia y segregación en el núcleo medial accumbens de la rata: relaciones de las aferentes cortical prefrontal, talámica media y basal amígdaloide. J. comp. Neurol. 361, 383 – 403. doi: 10.1002 / cne.903610304
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: consumo excesivo, neurona espinosa media, núcleo accumbens, sacarosa a largo plazo.
Cita: Klenowski PM, Shariff MR, Belmer A, Fogarty MJ, Mu EWH, Bellingham MC y Bartlett SE (2016) El consumo prolongado de sacarosa en una forma de atracón, altera la morfología de las neuronas espinosas medianas en el núcleo de Accumbens Shell. Frente. Behav. Neurosci. 10: 54. doi: 10.3389 / fnbeh.2016.00054
Recibido: 03 Diciembre 2015; Aceptado: 07 marzo 2016;
Publicado: 23 marzo 2016.
Editado por:
Djoher Nora Abrous, Instituto de Neurociencias de Burdeos, Francia
Revisado por:
Serge H. Ahmed, Centro Nacional de la Investigación Científica, Francia
Stéphanie Caille, Centro Nacional de la Investigación Científica, Francia
Copyright © 2016 Klenowski, Shariff, Belmer, Fogarty, Mu, Bellingham y Bartlett. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de atribución de Creative Commons (CC BY). Se permite el uso, distribución o reproducción en otros foros, siempre que se acredite al autor o licenciantes originales y que se cite la publicación original en esta revista, de acuerdo con la práctica académica aceptada. No se permite ningún uso, distribución o reproducción que no cumpla con estos términos.
* Correspondencia: Selena E. Bartlett, [email protected]
