Cerebro. 2013 Jan 31.
Politis m, Loane c, Wu K, O'Sullivan SS, Cabeza de madera Z, Kiferle L, Lawrence AD, Lees AJ, Piccini p.
Fuente: División de Ciencias del Cerebro, Departamento de Medicina, Hammersmith Hospital, Imperial College London, Londres W12 0NN, Reino Unido.
Resumen
La hipersexualidad con comportamiento sexual compulsivo es una fuente importante de morbilidad para los pacientes con enfermedad de Parkinson que reciben terapias de reemplazo de dopamina. Sabemos relativamente poco acerca de la fisiopatología de la hipersexualidad en la enfermedad de Parkinson, y se desconoce cómo los estímulos visuales sexuales, similares a los retratos de la sexualidad en los medios masivos de comunicación, pueden afectar el cerebro y el comportamiento en individuos tan susceptibles. Aquí, hemos estudiado grupo de pacientes 12 con enfermedad de Parkinson con hipersexualidad que utilizan un diseño de bloque de imágenes de resonancia magnética funcional que expone a los participantes tanto a señales sexuales, relacionadas con la recompensa como visuales neutrales. Planteamos la hipótesis de que la exposición a señales sexuales visuales desencadenaría un aumento del deseo sexual en pacientes con enfermedad de Parkinson con hipersexualidad que correspondería a cambios en la actividad cerebral en regiones vinculadas a la motivación sexual estimulada dopaminérgicamente.
Los pacientes con enfermedad de Parkinson con hipersexualidad se escanearon con ON y OFF los medicamentos de dopamina, y sus resultados se compararon con un grupo de pacientes con control de la enfermedad de Parkinson 12 sin hipersexualidad u otros trastornos de control de impulsos. La exposición a señales sexuales aumentó significativamente el deseo sexual y las respuestas hedónicas en el grupo de hipersexualidad de la enfermedad de Parkinson en comparación con los pacientes de control de la enfermedad de Parkinson. Estos cambios de comportamiento correspondieron a cambios significativos en la señal del nivel de oxígeno en la sangre en las regiones de la corteza límbica, paralímbica, temporal, occipital, somatosensorial y prefrontal que corresponden a los procesos emocional, cognitivo, autonómico, visual y motivacional.
Los datos de imágenes funcionales mostraron que el aumento del deseo sexual de los pacientes con hipersexualidad se correlacionaba con activaciones mejoradas en el cuerpo estriado ventral, y las cortezas cingulada y orbitofrontal. WCuando los pacientes con enfermedad de Parkinson con hipersexualidad estaban fuera de la medicación, los datos de imágenes funcionales mostraron una disminución en la activación durante la presentación de señales sexuales en relación con la rest.
Estas desactivaciones no se observaron cuando los pacientes estaban ON medicación, sugiriendo que las drogas de dopamina pueden liberar inhibición dentro de los circuitos neuronales locales en la corteza cerebral que pueden contribuir al comportamiento sexual compulsivo.
Los hallazgos de este estudio tienen implicaciones con respecto a la posible influencia de la exposición a la señal a través de la exposición a los medios de comunicación para mejorar la libido, lo que en este grupo de pacientes vulnerables puede tener consecuencias sociales devastadoras y, en ocasiones, sentencias de custodia.
La estimulación a través de la exposición a señales visuales sexuales en pacientes con enfermedad de Parkinson con hipersexualidad proporciona un ímpetu motivacional para buscar este comportamiento de recompensa a través de activaciones y desactivaciones de la corteza cerebral.
Introducción
Los trastornos del control de los impulsos, incluida la hipersexualidad y el comportamiento sexual compulsivo, son una fuente importante de morbilidad para los pacientes con enfermedad de Parkinson que reciben terapia de reemplazo de dopamina (Weintraub et al., 2006; Evans et al., 2009; Voon et al., 2009). La hipersexualidad con comportamiento sexual compulsivo comúnmente se manifiesta con solicitudes excesivas de sexo por parte de su cónyuge o pareja, mayor interés pornográfico, masturbación compulsiva, promiscuidad con visitas a prostitutas y, en algunos individuos predispuestos, a parafilias (por ejemplo, sadismo, bestialidad, travestismo; Quinn et al., 1983; Voon et al., 2006). La prevalencia de la hipersexualidad en la enfermedad de Parkinson fue del ∼3.5% en un estudio grande de pacientes que recibieron terapia con agonistas de dopamina, siendo los hombres más propensos a las mujeres a diagnosticar hipersexualidad (Weintraub et al., 2010). Un estudio más nuevo pero más pequeño ha sugerido una prevalencia algo mayor de hipersexualidad en la enfermedad de Parkinson de 7% y un vínculo con l-DOPA (Hassan et al., 2011). Estudios anteriores también han mostrado una conexión entre l-DOPA e hipersexualidad (Ballivet et al., 1973; Marrón et al., 1978; Uitti et al., 1989).
El contenido sexual en los medios se ha vuelto más explícito y accesible para el público en general, y la pornografía está disponible en Internet. Se ha afirmado que la exposición continua al material sexual puede estimular el exceso de preocupaciones socialmente inaceptables con el sexo en algunos individuos constitutivamente vulnerables e individuos que toman drogas dopaminérgicas (Rees et al., 2007). Los estudios en monos indican que una interacción sinérgica entre las drogas de dopamina y las señales sexuales aumenta notablemente la actividad sexual excesiva (Pomerantz, 1990). La importancia de que las señales estén altamente asociadas con la recompensa es consistente con la teoría de la importancia de los incentivos, ya que el "deseo" se produce por una interacción sinérgica entre el estado actual del sistema de dopamina mesolímbica y la presencia de recompensas o sus señales (Zhang et al., 2009; Berridge, 2012).
MASCOTA (Redouté et al., 2000) y la RM funcional (Arnow et al., 2002; Hamann et al., 2004; Walter et al., 2008Los estudios sobre el procesamiento neural de estímulos sexuales visuales en individuos sanos han demostrado que varias regiones, como el cuerpo estriado ventral, el hipotálamo, la amígdala, el cingulado y la corteza orbitofrontal están implicadas en el procesamiento visual de los estímulos sexuales. En un estudio reciente, utilizando PET y medidas indirectas de liberación de dopamina estriatal, se demostró que los pacientes con un trastorno de control de impulsos de la enfermedad de Parkinson tenían una mayor liberación de dopamina del estriado ventral después de la exposición visual relacionada con la recompensa en comparación con un grupo de pacientes con control de la enfermedad de Parkinson (O'Sullivan et al., 2011). Este hallazgo estuvo en línea con la teoría de la sensibilización de incentivos, que propone que la búsqueda compulsiva de recompensas surja de la atribución excesiva de la importancia de incentivos (o "deseo") para recompensas y sus señales, como resultado de neuroadaptaciones progresivas en proyecciones de dopamina a ventrículo estriado relacionado circuitos de motivación (Berridge et al., 2009).
Los estudios experimentales han demostrado que los circuitos neuronales dopaminérgicos en áreas como el estriado ventral, el hipotálamo, la amígdala y la corteza prefrontal medial desempeñan un papel en la motivación y la búsqueda sexual, especialmente en respuesta a las señales sexuales (Pfaus, 2010; Stolzenberg y Numan, 2011). Se ha demostrado que la sensibilización con medicamentos dopaminérgicos mejora la búsqueda de recompensas incluso naturales, incluidos los incentivos sexuales (Fiorino y Phillips, 1999; Nocjar y Panksepp, 2002; Afonso et al., 2009), como resultado de la atribución excesiva de la prominencia de incentivo para recompensar las señales. Además, el comportamiento sexual y los fármacos dopaminérgicos coactivan una población de neuronas en el estriado ventral, la amígdala, el hipotálamo y la corteza cingulada anterior, identificando los sitios potenciales donde las drogas pueden influir en el comportamiento sexual (Frohmader et al., 2010; Soporte et al., 2010).
De acuerdo con la teoría de la sensibilización de incentivos, la hipersexualidad en la enfermedad de Parkinson podría asociarse con un mayor procesamiento en las regiones cerebrales relacionadas con la motivación sexual y la reactividad de la señal, y estas activaciones podrían potenciarse con la medicación dopaminérgica. En el presente estudio, planteamos la hipótesis de que los pacientes con enfermedad de Parkinson con hipersexualidad mostrarían una actividad relacionada con la señal sexual aberrante en estas regiones relacionadas con la motivación sexual, que estaría modulada por medicamentos dopaminérgicos y vinculada a una mayor motivación sexual. Intentamos investigar esto mediante el examen de las alteraciones de la señal dependiente del nivel de oxígeno en la sangre (BOLD, por sus siglas en inglés) con MRI funcional (mediante la comparación de las respuestas en una exploración de medicamentos ON con una exploración de medicamentos OFF) y correlacionar los resultados de las imágenes con las evaluaciones conductuales de la motivación sexual.
Pacientes y métodos
Participantes y características clínicas.
Se estudiaron veinticuatro pacientes sin demencia con enfermedad de Parkinson idiopática (mesas 1 y 2). Doce de ellos cumplieron con los criterios diagnósticos operacionales propuestos para la hipersexualidad (Voon et al., 2006; Tabla complementaria 1). Los otros pacientes con 12 con enfermedad de Parkinson no tenían antecedentes de hipersexualidad u otros trastornos de control de impulsos y sirvieron como grupo de control. Frohmader et al. (2011) han demostrado que los efectos de los medicamentos dopaminérgicos en el comportamiento sexual compulsivo en modelos animales dependen de la experiencia concurrente de los medicamentos dopaminérgicos y la experiencia sexual. De manera similar, la hipersexualidad inducida por fármacos en la enfermedad de Parkinson solo se desarrolla en el contexto del uso repetido de medicamentos y no ocurre de forma aguda en la enfermedad de Parkinson. novo pacientes (Giladi et al., 2007). Por lo tanto, comparamos a los pacientes con enfermedad de Parkinson con hipersexualidad con un grupo de control de pacientes medicados con enfermedad de Parkinson.
Características clínicas de los participantes.
| Las características clínicas | Enfermedad de Parkinson con hipersexualidad. | Pacientes de control de la enfermedad de Parkinson. | P-propuesta de |
|---|---|---|---|
| Numero de asignaturas | 12 | 12 | |
| Edad (años ± SD) | 55.2 ± 9.2 | 62.3 ± 9.7 | 0.077 b |
| Sexo | 11 M / 1 F | 10 M / 2 F | |
| Duración de la enfermedad (años ± DE) | 9.6 ± 5.2 | 10.1 ± 6.4 | 0.85b |
| Puntaje de UPDRS OFF motor (Parte III) (media ± DE)a | 40.2 ± 10.1 | 34.9 ± 9.9 | 0.21b |
| UPDRS ON puntaje motor (Parte III) y% de mejora (media ± DE)a | 23.1 ± 8.2 (43.8 ± 9.7%) | 20.0 ± 5.5 (41.4 ± 11.7%) | 0.29 (0.59)b |
| Mini examen del estado mental (media ± SD) | 29.8 ± 0.4 | 28.9 ± 2.2 | 0.30c |
| LED diarioTOTAL (mg ± SD) | 600 ± 327 | 778 ± 278 | 0.17b |
| LED diarioL-DOPA (mg ± SD) | 288 ± 326 | 646 ± 264 | <0.05c |
| LED diarioDA (mg ± SD) | 311 ± 183 | 132 ± 143 | <0.01c |
a El promedio de cinco evaluaciones en cinco días diferentes.
b impar t-Test.
c prueba de Mann-Whitney.
Pacientes con control de la enfermedad de Parkinson = pacientes con enfermedad de Parkinson sin hipersexualidad u otras conductas impulsivo-compulsivas; M = hombre; F = mujer; SD = desviación estándar; UPDRS = Escala de calificación de la enfermedad de Parkinson unificada; LED = equivalente de levodopa. La dosis se calcula de forma similar al informe anterior (Politis et al., 2010): LED (mg) = (1 × = levodopa) + (0.77 × levodopa CR) + (1.43 × levodopa + entacapona) + (1.11 × levodopa CR + entacapona) + (20 × ropinirol) + (20 × ropinirol ER) + (100 × pramipexole) + (30 × rotigotine) + (10 × bromocriptine) + (8 × apomorphine) + (100 × pergolide) + (67 × cabergoline) Fórmula LED, en levodopa / carbidopa o benserazide calculado.
Pacientes con enfermedad de Parkinson con hipersexualidad.
| Materias | Sexo | Edad | Tipo de comportamiento de hipersexualidad. | Otros ICDs | Terapia dopaminérgica | LED diarioDA | LED diarioL-DOPA |
|---|---|---|---|---|---|---|---|
| HS1 | M | 46 | Pornografía / participar repetidamente en fantasías sexuales y urgencias. | CS | Cabergolina | 280 | 0 |
| HS2 | M | 65 | Tener relaciones sexuales con personas con las que normalmente no se asociaría / pasaría un tiempo excesivo obsesionado con el sexo o participar en actividades sexuales | El pramipexol | 267 | 0 | |
| HS3 | M | 72 | Sexo con personas con las que normalmente no se asociaría. | Ropinerole, levodopa | 180 | 700 | |
| HS4 | M | 65 | Asuntos vacíos / implicación con la pornografía en internet | El pramipexol | 200 | 0 | |
| HS5 | M | 50 | Paciente se negó a revelar | BE, CS | Ropinerole, levodopa | 180 | 800 |
| HS6 | F | 55 | Aumento de la actividad sexual | CS | El pramipexol | 200 | 0 |
| HS7 | M | 53 | pornografía | Pramipexol, levodopa | 240 | 260 | |
| HS8 | M | 53 | Asuntos vacíos / pensamientos sexuales obsesivos. | PG, BE, CS | Ropinerole | 360 | 0 |
| HS9 | M | 60 | Paciente se negó a revelar | BE, CS | Ropinerole, levodopa | 300 | 600 |
| HS10 | M | 41 | Pornografía / visitas frecuentes a prostitutas. | DDS | Cabergolina, levodopa | 530 | 500 |
| HS11 | M | 45 | Video pornografía / implicación con la pornografía en internet. | DDS | Pramipexol, levodopa | 200 | 600 |
| HS12 | M | 57 | Implicación con la pornografía en internet. | DDS, PG, BE | Ropinerole | 800 | 0 |
BE = comer en exceso; CS = compras compulsivas; DA = agonista de la dopamina; DDS = síndrome de desregulación de la dopamina; HS = hipesexualidad; CDI = trastorno de control de impulsos; PG = juego patológico.
La batería de evaluación clínica incluyó la estadificación de Hoehn y Yahr, la parte motora (Parte III) de la Escala de Clasificación de la Enfermedad de Parkinson Unificada (UPDRS, por sus siglas en inglés), Mini-Mental State Examination y el cálculo de los resultados diarios. l-DOPA dosis equivalente (LED). Ocho de los pacientes con 12 con hipersexualidad de la enfermedad de Parkinson presentaron al menos un trastorno adicional de control de impulsos (mesas 1 y 2).
El estudio recibió la aprobación ética del Comité de Ética de Investigación de Hammersmith y Queen Charlotte's Hospitals. Se obtuvo el consentimiento informado por escrito de todos los participantes de conformidad con la Declaración de Helsinki.
Evaluaciones de comportamiento
Antes y después del escaneo, se les pidió a los participantes que calificaran su libido y deseo sexual en una escala analógica visual (10 cm), anclados entre "el más bajo de la historia" (0 cm = puntos 0) y "el más" (10 cm = 10 puntos). Ambas escalas fueron autoinformadas y relacionadas con cómo se sintieron los participantes solo en la última hora. Las escalas de deseo de un solo elemento han demostrado ser tan confiables como los cuestionarios más largos de múltiples ítems (Oeste y Ussher, 2010). Como la mayoría de los pacientes con hipersexualidad de la enfermedad de Parkinson tenían trastornos adicionales de control de impulsos, también se administraron escalas similares de deseo para el juego, las drogas y los alimentos.
Procedimientos de escaneo de imágenes de resonancia magnética funcional
Los participantes fueron escaneados en dos mañanas separadas (entre 11: 00 y 13: 00 h) 7 días separados en un diseño aleatorio cruzado después de saltarse el desayuno y detener la medicación al menos 18 h antes de escanear. Los participantes fueron escaneados en la condición de medicación OFF prácticamente definida en una exploración y en la condición de medicación ON después de recibir una dosis oral de l-DOPA / benserazida (200/50 mg) dispersable 45 min antes del inicio de la exploración. El rendimiento motor se evaluó con las puntuaciones motoras UPDRS al inicio del estudio e inmediatamente antes de la exploración para garantizar que el paciente hubiera respondido a la medicación (definido como mejoras> 25% en las puntuaciones motoras UPDRS-III). El uso de lSe eligió DOPA porque todos los pacientes con enfermedad de Parkinson tomaban esto previamente, mientras que no todos estaban en el mismo agonista de la dopamina. Además, l-DOPA puede aumentar la motivación sexual en la enfermedad de Parkinson, y el comportamiento de hipersexualidad se ha observado en combinación con l-Tratamiento con DOPA, no solo tratamiento con agonista de dopamina (Ballivet et al., 1973; Marrón et al., 1978; Hassan et al., 2011).
Los participantes fueron colocados en el escáner con auriculares y almohadillas alrededor de la cabeza, los hombros y los brazos para asegurar la menor área de movimiento posible. Los movimientos se monitorizaron a lo largo de las exploraciones y en el caso de movimientos excesivos, la exploración se reinició o los volúmenes relevantes se eliminaron del análisis (5.2% de las ejecuciones se reiniciaron debido a temblor o discinesias). La adquisición de imágenes se llevó a cabo en un escáner de cuerpo entero 3 T Philips Intera. Se adquirieron datos de todo el cerebro con volúmenes 199 de T2* imagen ponderada de eco gradiente eco eco-planar en orden ascendente con un procedimiento de ajuste automático de orden superior (espesor de corte 3.25 mm; tiempo de repetición 3000 ms; tiempo de eco 30 ms; ángulo de giro de 90 °; campo de visión 190 × 219; matriz 112 × 112). El ángulo de adquisición del corte se estableció en −30 ° desde la línea de comisura anterior-posterior para reducir la caída de la señal del lóbulo frontal debido a los senos aéreos, con una z- corrección de gradiente de compensación para compensar los gradientes de susceptibilidad a través del plano (Deichmann et al., 2003; Piedra de Oro et al., 2009). Una T de alta resolución1También se recogió la exploración estructural del eco del campo turbo ponderado (tiempo de eco 4.6 ms; tiempo de repetición 9.7 ms; ángulo de giro 8 °; campo de visión 240 mm).
Paradigma funcional de resonancia magnética.
Durante la exploración de MRI funcional, se presentaron cinco tipos de imágenes en color en un diseño de bloque: (i) señales de drogas dopaminérgicas; (ii) señales de comida apetitosa; (iii) dinero y claves de juego; (iv) señales sexuales; y (v) señales neutrales. La gran mayoría de las señales visuales neutrales y relacionadas con la recompensa se obtuvieron del Sistema Internacional de Imágenes Afectivas (Largo et al., 2008) y se complementaron con imágenes de libre acceso obtenidas de sitios web. Se definió una señal sexual visual que incluía representaciones de contacto íntimo, besos apasionados, coqueteo físico e imágenes provocativas de mujeres u hombres (basados en el género: los hombres vieron a las mujeres y los hombres vieron a los hombres) con sus cuerpos parcialmente vestidos. Las señales visuales neutrales incluían paisajes y escenas de la naturaleza, objetos domésticos y patrones aleatorios. Los estímulos visuales sexuales del Sistema Internacional de Imágenes Afectivas han sido validados previamente y se ha demostrado que inducen niveles significativos de excitación sexual en estudios de IRM / psicofisiológicos funcionales previos (Bradley et al., 2001; Conaglen y Evans, 2006; Walter et al., 2008).
Imágenes de resolución similar se presentaron en bloques de 14.7 en dos tandas que duraron 9 min 56 s cada una. Cada bloque contenía siete imágenes diferentes de la misma categoría, con un total de seis bloques de cada tipo mostrados en un orden de bloques pseudoaleatorios con un orden de imagen aleatorio en cada bloque. El orden de ejecución fue contrapesado entre los participantes y las visitas. Cada imagen se mostró para 2100 ms, y cada bloque temático fue seguido por una diapositiva de calificación de 4000 ms, por lo que el participante tuvo que calificar de 1 a 5 cuánto les gustó el bloque de imágenes que vieron (con 1 siendo "Lo odié" y Siendo 5 'Me encantó'). Estas calificaciones se hicieron por voz y se registraron en una computadora. La diapositiva de calificación fue seguida por un intervalo entre intervalos de ms 1000 de una cruz de fijación. Las imágenes se vieron a través de un espejo montado sobre una bobina de cabeza RF de ocho canales, que mostraba imágenes de un proyector utilizando el sistema de presentación de imágenes IFIS-SA (In Vivo) y el software E-Prime (Psychology Software Tools Inc).
Análisis de datos de resonancia magnética funcional.
Los datos de las imágenes se analizaron utilizando la versión 5 del mapeo paramétrico estadístico (Wellcome Department of Imaging Neuroscience, UCL, Reino Unido). Los primeros cinco volúmenes de cada serie de resonancia magnética funcional se descartaron para permitir efectos de equilibrio, y todas las exploraciones funcionales se reajustaron al primer escaneo de la serie y luego nuevamente a la media de todos los volúmenes para la corrección de movimiento y tiempo de corte. Todas las exploraciones incluidas en el análisis final consistieron en <2 mm de movimiento en cada dirección. Exploramos los datos de los artefactos residuales utilizando la utilidad TSDiffAna implementada en la versión 5 del mapeo paramétrico estadístico, que produce imágenes de media y varianza para cada volumen funcional (http://imaging.mrc-cbu.cam.ac.uk/imaging/DataDiagnostics). Un artefacto se define como la coexistencia de un pico de varianza y una caída de intensidad media no correlacionada con el diseño experimental. No detectamos ningún objeto que necesitara una inspección más detallada. La imagen funcional media fue co-registrada en la T1 Imagen estructural. Las imágenes eco-planares se normalizaron en el espacio estereotáctico estándar del Instituto de Neurología de Montreal utilizando parámetros de la T segmentada.1 Imagen estructural y suavizado utilizando un ancho 8 mm de ancho total en la mitad del filtro gaussiano.
El análisis de primer nivel se realizó a nivel de participante único donde se crearon contrastes individuales en un modelo lineal general para cada condición de recompensa menos la línea de base (imágenes neutrales) y para el sexo menos otras recompensas (sexo versus otras recompensas). El modelo lineal general incluyó seis parámetros de movimiento y molestia, teniendo en cuenta el movimiento y otros artefactos de molestia que ocurren en tres direcciones de traslación (desplazamiento) y tres ejes de rotación (x, y, z traducción y x, y, z Rotación) para cada carrera. Los contrastes de interés producidos en esta etapa (por ejemplo, sexo versus neutral) se utilizaron en el análisis de efectos aleatorios grupales de segundo nivel. Un umbral estadístico de P Se usó <0.001 sin corregir y una extensión de grupo de más de 10 voxels (2 × 2 × 2 mm) para la activación usando análisis de cerebro completo con corrección para comparaciones múltiples usando la tasa de descubrimiento falso en P <0.05 (Genovés et al., 2002). Las coordenadas de la activación máxima de voxel dentro del cerebro se determinaron a nivel de grupo para las exploraciones de ON y OFF en pacientes con enfermedad de Parkinson con y sin hipersexualidad. También realizamos un análisis adicional entre el grupo (pacientes con control de la enfermedad de Parkinson versus enfermedad de Parkinson con hipersexualidad) y entre la condición (medicación OFF y ON) para investigar si los parámetros de movimiento eran más grandes en un paciente o grupo de condición que en el otro y encontramos que el movimiento no varió entre grupos y condiciones (P > 0.1 en ambos casos).
Como regional a priori existió una hipótesis, se llevaron a cabo análisis de efectos aleatorios adicionales de segundo nivel (contrastes de sexo versus neutral y de sexo versus otras recompensas en condiciones de ON y OFF) para regiones específicas de interés utilizando MarsBar (Bordo et al., 2002) con el mismo umbral estadístico (tasa de descubrimiento falso en P <0.05). Estas regiones fueron la corteza orbitofrontal, la corteza cingulada anterior, la corteza cingulada posterior, la amígdala, el estriado ventral y el hipotálamo. Los modelos de corteza orbitofrontal, corteza cingulada anterior, corteza cingulada posterior y amígdala se tomaron de la biblioteca de etiquetado anatómico automatizado que acompaña a MarsBar. Los mapas de objetos del cuerpo estriado ventral y del hipotálamo se construyeron dibujando estas regiones de interés en el software de imágenes médicas ANALYZE (versión 8.1, Fundación Mayo). Estos mapas de objetos se utilizaron luego para enmascarar el resto del cerebro permitiendo comparaciones dentro de volúmenes específicos (1850 mm3 En cada hemisferio para estriado ventral y 1380 mm.3 en cada hemisferio para el hipotálamo). Se extrajeron los valores de contraste de los participantes individuales (p. Ej., Sexo versus neutral) de cada región de interés para las exploraciones de medicación ON y OFF para la correlación con los datos de comportamiento.
análisis estadístico
Los análisis estadísticos se realizaron utilizando SPSS (versión 16, SPSS Inc) para Macintosh. Las comparaciones dentro de los grupos (p. Ej., La enfermedad de Parkinson con hipersexualidad en la exploración OFF del sexo frente a neutral) se realizaron mediante el uso de pares tse realizaron pruebas y comparaciones entre los grupos (p. ej., enfermedad de Parkinson con hipersexualidad OFF sexual versus neutral — versus — pacientes con control de la enfermedad de Parkinson sexual versus neutral) utilizando dos muestras t-pruebas Para el análisis clínico y de comportamiento, se analizaron la homogeneidad de la varianza y la gaussianidad con las pruebas de Bartlett y Kolmogorov-Smirnov. Las pruebas paramétricas y no paramétricas se utilizaron adecuadamente. Coeficiente de correlación de Pearson r y el rho de Spearmanρ(cuando las variables no se distribuyeron normalmente) se usaron para examinar la relación entre las puntuaciones del deseo sexual individual después de la exposición a las señales visuales sexuales y los valores de contraste de la región de interés BOLD individuales para el contraste sexual frente al neutral en los estados de los medicamentos ON y OFF. La corrección de Bonferroni se utilizó para contrarrestar el problema de las comparaciones múltiples.
Resultados
Análisis clínicos y de comportamiento.
Los pacientes con enfermedad de Parkinson con hipersexualidad estaban tomando significativamente más agonistas de dopamina y significativamente menos l-DOPA en comparación con los pacientes con control de la enfermedad de Parkinson. Los dos grupos no difirieron estadísticamente en ninguna de las otras características clínicas (edad, sexo, duración de la enfermedad, UPDRS parte III OFF, ON y respuesta después de l-DOPA, Mini-Mental State Examination, LED diario.TOTAL) (mesas 1 y 2).
Antes de la exploración OFF y ON, los pacientes con enfermedad de Parkinson con hipersexualidad y pacientes con control de la enfermedad de Parkinson no difirieron en las puntuaciones de deseo sexual (Tabla 3). Después de la exploración OFF y ON en la que los participantes habían estado expuestos a señales sexuales, los pacientes con enfermedad de Parkinson con hipersexualidad mostraron un aumento significativo en su deseo sexual en comparación con su calificación antes de la exploración y también mostraron un aumento significativo en comparación con el deseo sexual de Pacientes de control de la enfermedad de Parkinson, estos últimos permanecen relativamente estables antes y después de la exploración. Los pacientes con enfermedad de Parkinson con hipersexualidad tuvieron mayores aumentos en su deseo sexual en el ON en comparación con el escaneo de OFF (Tabla 3). La enfermedad de Parkinson con hipersexualidad y los grupos de control de la enfermedad de Parkinson no mostraron diferencias dentro o entre los grupos en cuanto a la comida, el juego y el deseo de drogas antes y después de los exámenes de encendido y apagado (datos no mostrados).
Deseo sexual antes y después de la exposición a estímulos visuales sexuales.
| Antes de los estímulos visuales sexuales. | Después de estímulos visuales sexuales. | P-valor | |
|---|---|---|---|
| Escaneo apagado | |||
| Pacientes control de EP (media ± EE) | 1.98 ± 0.59 | 2.25 ± 0.45 | 0.31a |
| PD HS (media ± SE) | 2.67 ± 0.56 | 3.70 ± 0.50 | <0.01a |
| P-valor | 0.40b | <0.05b | |
| En escaneo | |||
| Pacientes control de EP (media ± EE) | 1.32 ± 0.28 | 2.12 ± 0.60 | 0.18d |
| PD HS (media ± SE) | 2.01 ± 0.39 | 5.24 ± 0.41 | <0.001a |
| P-valor | 0.15c | <0.001b | |
| Escaneo apagado | En escaneo | ||
|---|---|---|---|
| Después de antes estímulos visuales sexuales | |||
| Pacientes control de EP (media ± EE) | 0.28 ± 0.26 | 0.80 ± 0.52 | 0.34d |
| PD HS (media ± SE) | 1.04 ± 0.32 | 3.23 ± 0.51 | <0.01a |
| P-valor | 0.08b | <0.01b | |
un emparejado t-Test.
b impar t-Test.
c prueba de Mann-Whitney.
Prueba de d pares pareados de Wilcoxon.
HS = hipersexualidad; PD = enfermedad de Parkinson.
A los pacientes con enfermedad de Parkinson con hipersexualidad les gustaron las señales visuales sexuales presentadas durante la IRM funcional significativamente más que los pacientes con control de la enfermedad de Parkinson (calidad de los datos = 85.2%; 3.4 ± 1.2 versus 2.1 ± 0.6, media ± SD; P <0.05, no emparejado t-prueba con la corrección de Welch), pero no hubo diferencia en sus calificaciones para las claves de recompensa relacionadas con las drogas, el dinero y el juego o la comida (P > 0.1 en todos los casos, no emparejado t-prueba con correcciones de Welch). No se encontraron diferencias entre las exploraciones ON y OFF.
Análisis de imágenes de resonancia magnética funcional de la región de interés
El análisis de la región de interés mostró que los pacientes con enfermedad de Parkinson con hipersexualidad tenían una actividad más fuerte (señal BOLD aumentada) que los pacientes con control de la enfermedad de Parkinson durante la exposición a señales visuales sexuales versus neutrales en los estados de medicación OFF en las siguientes regiones: corteza orbitofrontal (izquierda) : P <0.001, derecha: P <0.005), corteza cingulada anterior (izquierda: P <0.005, derecha: P <0.001), corteza cingulada posterior (izquierda: P <0.001, derecha: P <0.001), amígdala izquierda (P <0.05), estriado ventral (izquierda: P <0.05, derecha: P <0.05) e hipotálamo (izquierda: P <0.005, derecha: P <0.01) ( C – H). Para el mismo contraste en el estado de la medicación ON, se observó un conjunto similar de activaciones cerebrales regionales, y no hubo diferencias significativas en las activaciones entre las exploraciones ON y OFF. Cuando se comparó el efecto del estado de la medicación con APAGA frente a la ON solo en el grupo de pacientes con enfermedad de Parkinson con hipersexualidad, no encontramos diferencias en la activación.
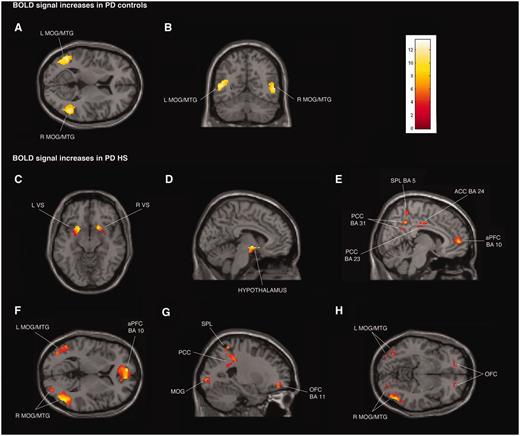
Secciones transversales, coronales y sagitales de los mapas estadísticos paramétricos que muestran incrementos significativos de la señal BOLD (áreas amarillas-rojas) asociadas con la exposición a imágenes sexuales comunes en pacientes con control de la enfermedad de Parkinson (EP) (A y B) y en pacientes con enfermedad de Parkinson con 12. hipersexualidad (PD HS) (C–H) durante los estados de activación y desactivación de la medicación. Los incrementos de la señal BOLD se ilustran en (A y B) giro temporal medio a la izquierda y derecha (MTG) y giro occipital medio (MOG) (x = −48, y = −59, z = 9),C) cuerpo estriado ventral (VS) (x = 18, y = 15, z = - 11),D) hipotálamo (x = −5, y = −4, z = −9), (E) corteza prefrontal anterior (aPFC), corteza cingulada anterior (ACC), lóbulo parietal superior (SPL) y corteza cingulada posterior (PCC) (x = 8, y = −16, z = 33),F) Giro temporal medio izquierdo y derecho y Giro occipital medio y corteza prefrontal anterior (x = −8, y = 56, z = 4), y (G y H) corteza orbitofrontal (OFC), lóbulo parietal superior, corteza cingulada posterior y giro temporal medio izquierdo y derecho y giro occipital medio (x = −24, y = 48, z = −8). La barra de color indica z-valores.

El análisis de la región de interés mostró que los pacientes con enfermedad de Parkinson con hipersexualidad tenían una actividad más fuerte durante la exposición sexual en comparación con otras señales visuales de recompensa en los estados de medicación OFF en las siguientes regiones: corteza orbitofrontal (izquierda: P <0.001, derecha: P <0.001), corteza cingulada anterior (izquierda: P <0.001, Derecha: P <0.001), corteza cingulada posterior (izquierda: P <0.001, derecha: P <0.001), estriado ventral (izquierda: P <0.001, derecha: P <0.001) e hipotálamo (izquierda: P <0.001, derecha: P <0.001). Se observaron activaciones similares durante el estado de medicación ON y no hubo diferencias significativas en las activaciones entre las exploraciones OFF y ON.
Análisis de imágenes de resonancia magnética funcional de cerebro completo
Actividad cerebral común entre pacientes con enfermedad de Parkinson con hipersexualidad y pacientes con control de la enfermedad de Parkinson
Los pacientes con enfermedad de Parkinson con hipersexualidad y pacientes con control de la enfermedad de Parkinson mostraron aumentos similares significativos en la señal BOLD durante la exposición a señales sexuales frente a neutras visuales en ambos estados de medicación ON y OFF bilateralmente en el giro temporal medio y el giro occipital medio ( A y B; Tablas Suplementarias 2A y C, Dato suplementarioA y C). Para el mismo contraste en el estado OFF, los pacientes con enfermedad de Parkinson con hipersexualidad y pacientes con control de la enfermedad de Parkinson mostraron una señal de BOLD significativamente significativa disminuida bilateralmente en el istmo de la circunvolución [Brodmann area (BA) 29 y 30], giro parahipocampal y cuneus (BA 17 ) ( A y B; Tablas Suplementarias 2B y D, Dato suplementarioB y D).
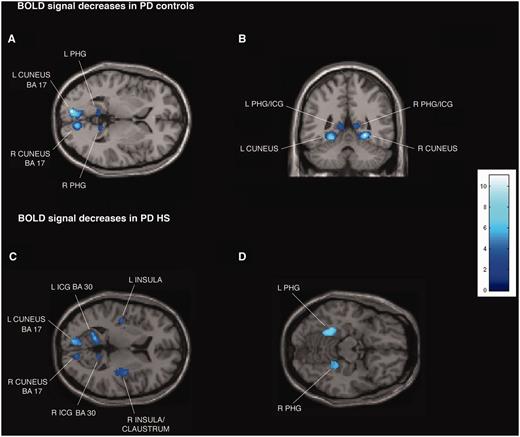
Las secciones transversales y coronales de los mapas paramétricos estadísticos que muestran disminuciones significativas de la señal BOLD (áreas oscuras y azules claras) asociadas con la exposición a imágenes sexuales comunes en pacientes con control de la enfermedad de Parkinson (EP) 12 (A y B) y en pacientes con 12 con enfermedad de Parkinson con hipersexualidad (HS) (C y D) durante el estado de medicación OFF. Las disminuciones de la señal BOLD se ilustran en (A y B) giro parahipocampal izquierdo y derecho (PHG), istmo del giro cingulado (ICG) y cuneus (x = −9, y = −47, z = 2),C) Giro parahipocampal izquierdo y derecho, cuneus, istmo del giro cingulado, ínsula y claustro derecho (x = −42, y = 14, z = 8), y (D) giro parahipocampal izquierdo y derecho (x = 22, y = 38, z = −14). En el estado de la medicación ON, en el grupo de pacientes con 12 con enfermedad de Parkinson con hipersexualidad, no se detectan disminuciones de la señal BOLD. La barra de color indica z-valores.

Actividad cerebral específica para pacientes con enfermedad de Parkinson con hipersexualidad.
El análisis de todo el cerebro confirmó los resultados de la región de interés y mostró un aumento adicional significativo de la señal BOLD en el grupo de pacientes con enfermedad de Parkinson con hipersexualidad en comparación con los pacientes con control de la enfermedad de Parkinson durante la exposición a señales visuales neutrales en los estados de medicamentos OFF y ON en el estado regiones siguientes: corteza prefrontal anterior bilateral (BA 10) y lóbulo parietal superior (BA 5 y 7), y activación lateralizada derecha en el lóbulo parietal inferior (BA 40) ( C – H; Tablas Suplementarias 2A y C, Dato suplementarioA y C). Para el mismo contraste en el estado OFF, los pacientes con enfermedad de Parkinson con hipersexualidad en comparación con los pacientes con control de la enfermedad de Parkinson mostraron una disminución significativa de la señal BOLD bilateralmente en la ínsula y claustrum derecha ( C y D; Tablas Suplementarias 2B y D, Dato suplementarioB y D). No hubo aumentos de la señal BOLD diferentes durante la exposición a señales visuales sexuales frente a neutrales en pacientes con enfermedad de Parkinson con hipersexualidad entre los estados de medicamento OFF y ON.
El análisis de todo el cerebro también confirmó los resultados de la región de interés en pacientes con enfermedad de Parkinson con hipersexualidad cuando se compararon las señales visuales con otras recompensas sexuales y mostró un aumento adicional significativo de la señal BOLD en los estados de los medicamentos APAGADO y ENCENDIDO en la corteza prefrontal dorsolateral bilateral (BA 9), y activación lateralizada derecha en la corteza prefrontal anterior (BA 10) y giro parahipocampal.
Efecto de l-DOPA medicación en la actividad cerebral en pacientes con enfermedad de Parkinson con hipersexualidad
En el grupo de pacientes con enfermedad de Parkinson con hipersexualidad en el estado de la medicación ENCENDIDA, las disminuciones observadas en el estado APAGADO y en el estado APAGADO y ENCENDIDO en los pacientes con control de la enfermedad de Parkinson (reducción de la señal BOLD durante la exposición a señales visuales sexuales versus neutras en el istmo de cingulate gyrus, parahipocampal gyrus, cuneus, insula y claustrum) fueron eliminados (Tablas Suplementarias 2B y D, Dato suplementarioB y D).
Actividad cerebral relacionada con otras señales visuales de recompensa en pacientes con enfermedad de Parkinson con hipersexualidad
No encontramos diferencias significativas dentro o entre los grupos para los pacientes con enfermedad de Parkinson con hipersexualidad y los pacientes con control de la enfermedad de Parkinson en cualquier otra condición de recompensa menos la línea de base (imágenes neutrales) (por ejemplo, señales de fármacos dopaminérgicos versus neutrales) en las exploraciones ON y OFF.
Correlaciones
En el grupo de pacientes con enfermedad de Parkinson con hipersexualidad, el deseo sexual posterior a la exposición a señales visuales sexuales se correlacionó en el estado de medicación OFF, con el contraste de actividad (sexo versus neutro) en la corteza cingulada posterior (r = 0.78, P <0.01) y estriado ventral (r = 0.80, P <0.01) ( A y B), y en el estado de medicación ON con la actividad en la corteza cingulada anterior (r = 0.87, P <0.001) y corteza orbitofrontal medial (r = 0.65, P <0.05) ( C y D). No se encontraron correlaciones en los pacientes con enfermedad de Parkinson con un grupo de hipersexualidad entre "gustar" las señales sexuales y la actividad cerebral durante la exposición a señales sexuales versus señales visuales neutrales tanto en el estado de los medicamentos ON como en el OFF. No se encontraron correlaciones entre las puntuaciones de deseo y los contrastes de actividad en el grupo de control de la enfermedad de Parkinson en los estados de medicación ON y OFF (P > 0.1 en todos los casos).
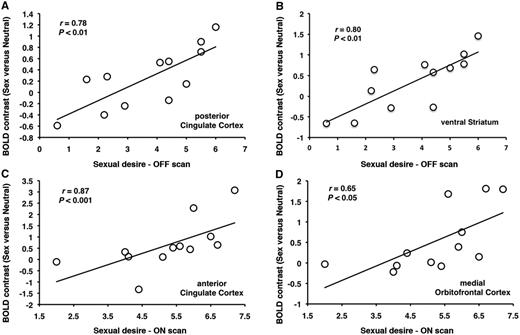
En pacientes con enfermedad de Parkinson con hipersexualidad, el deseo sexual posterior a la exposición a imágenes sexuales se correlaciona con aumentos en la activación en (A) corteza cingulada posterior y (B) cuerpo estriado ventral en el estado de medicación OFF y con aumentos en la activación en (Ccórtex cingulado anterior yB) y la corteza orbitofrontal medial durante el estado de medicación ON.

Discusión
La hipersexualidad es un efecto no deseado relativamente común del tratamiento dopaminérgico en la enfermedad de Parkinson, que en ocasiones puede tener consecuencias sociales devastadoras, como el divorcio, la ruina de la reputación de una persona e incluso la detención. Nuestro estudio tuvo como objetivo explorar los mecanismos que sustentan la hipersexualidad relacionada con el fármaco dopaminérgico en pacientes con enfermedad de Parkinson. Hemos utilizado evaluaciones conductuales de la motivación sexual y hemos utilizado un paradigma funcional de resonancia magnética con representaciones comunes de la sexualidad (similares a las proyectadas por los medios de comunicación) como señales visuales, y confirmamos que la exposición a tales señales era adecuada para aumentar el deseo sexual de los pacientes. Enfermedad de Parkinson con hipersexualidad mediante la activación de regiones cerebrales vinculadas a la motivación sexual (ver Tabla 4 para resumen de resultados).
Resumen de los resultados que muestran las diferencias y los puntos comunes en los aumentos regionales de la señal BOLD en los pacientes con enfermedad de Parkinson con y sin hipersexualidad en los estados de los medicamentos ON y OFF
| Enfermedad de Parkinson con hipersexualidad. | Pacientes de control de la enfermedad de Parkinson. | |||
|---|---|---|---|---|
| OFF y ON aumenta | OFF disminuye | ON disminuye | OFF y ON aumenta | OFF y ON disminuye |
| Giro temporal medio | Istmo del giro cingulado | Giro temporal medio | Istmo del giro cingulado | |
| Giro occipital medio | Giro parahipocampal | Giro occipital medio | Giro parahipocampal | |
| Cuneus | Cuneus | |||
| Estriado ventral | Claustrum | |||
| Amygdala | Insula | |||
| hipotálamo | ||||
| Corteza cingulada anterior | ||||
| Corteza cingulada posterior | ||||
| Corteza orbitofrontal | ||||
| Corteza prefrontal anterior | ||||
| Lóbulo parietal superior | ||||
| Lóbulo parietal inferior | ||||
De acuerdo con estudios de imagen funcional de estimulación sexual visual en individuos sanos (Redouté et al., 2000; Arnow et al., 2002; Walter et al., 2008), la exposición a señales sexuales visuales activó regiones de procesamiento visual parieto-temporal-occipital como el giro occipital medio y el giro temporal medio en los grupos de pacientes con enfermedad de Parkinson con hipersexualidad y los pacientes de control de la enfermedad de Parkinson. En pacientes con enfermedad de Parkinson con hipersexualidad, la exposición a señales visuales sexuales tanto en la medicación ON como en la OFF mostró una activación incrementada en la corteza orbitofrontal, la corteza cingulada anterior, la corteza cingulada posterior, el estriado ventral, la corteza prefrontal anterior, el lóbulo parietal superior, la amígdala y El hipotálamo, comparado con los pacientes con control de la enfermedad de Parkinson. Los pacientes con enfermedad de Parkinson con hipersexualidad mostraron un aumento significativo del deseo sexual y el gusto por el contenido sexual después de la exposición a las señales sexuales. Su deseo sexual se incrementó más cuando estaban ENCENDIDOS l-DOPA en comparación con la medicación OFF después de la exposición al contenido sexual. El papel crucial de la corteza cingulada anterior, la corteza cingulada posterior, el estriado ventral y la corteza orbitofrontal en la motivación sexual se destacó por el hecho de que el aumento de la activación en estas regiones se correlacionaba con el aumento del deseo sexual. Sin embargo, no se encontró una correlación entre la actividad cerebral regional y las puntuaciones de "gusto".
Los estudios en animales han demostrado que la dopamina participa en la motivación sexual y en el impulso desencadenado por señales sexuales en áreas que incluyen el cuerpo estriado ventral, el hipotálamo, la corteza prefrontal medial, la amígdala y la corteza cingulada anterior, y que un régimen de sensibilización de las drogas dopaminérgicas puede llevar a una búsqueda sexual exagerada y la depredación (Fiorino y Phillips, 1999; Nocjar y Panksepp, 2002; Afonso et al., 2009; Pfaus, 2010; Stolzenberg y Numan, 2011). Se requiere experiencia concurrente con drogas dopaminérgicas y actividad sexual para el desarrollo de un comportamiento sexual compulsivo (Frohmader et al., 2011), lo que refleja el inicio tardío de la hipersexualidad en la enfermedad de Parkinson después del tratamiento con fármacos dopaminérgicos (Giladi et al., 2007). Además, trabajos recientes han demostrado que las drogas de abuso pueden activar los mismos sistemas neuronales como una recompensa sexual, con un solapamiento en regiones como el hipotálamo y la corteza cingulada anterior (Frohmader et al., 2010). Nuestros hallazgos, junto con el trabajo previo en animales, apoyan la teoría de la sensibilización de incentivos como un marco para comprender los mecanismos de la hipersexualidad inducida por el fármaco dopaminérgico en la enfermedad de Parkinson. La teoría de la sensibilización de incentivos sostiene que la dopamina motiva la búsqueda de recompensas al atribuir prominencia de incentivo a los estímulos relacionados con la recompensa (como las señales visuales sexuales), la búsqueda desencadenante ("querer") del sexo y, en el caso de la hipersexualidad, se pueden atribuir señales de sexo. Con incentivo patológico saliente (Berridge et al., 2009). La teoría de la sensibilización de incentivos sostiene además que el "deseo" de recompensas, mediado por el neurocircuitaje ventral del estriado relacionado con la dopamina, puede crecer con el tiempo independientemente del "gusto" de la recompensa a medida que un individuo desarrolla la búsqueda compulsiva de recompensas (Berridge et al., 2009), y es notable aquí que la dopamina incrementó el deseo sexual evocado por la señal ("querer"), pero no calificó el "gusto" de las imágenes sexuales en pacientes con enfermedad de Parkinson con hipersexualidad.
Como la mayoría (8 de 12) de pacientes con enfermedad de Parkinson con hipersexualidad tenían al menos un trastorno adicional de control de impulsos (por ejemplo, juego patológico, atracón, etc.), quisimos probar si los cambios en las evaluaciones de comportamiento y activación cerebral después de la recompensa la exposición de referencia fue específica para el sexo o extendida a otras recompensas. El deseo y el gusto por los juegos de azar, las drogas y la comida no fueron diferentes dentro o entre los grupos de pacientes con enfermedad de Parkinson con hipersexualidad y los pacientes con control de la enfermedad de Parkinson antes y después de las exploraciones ON y OFF. De manera similar, no observamos diferencias entre los pacientes con enfermedad de Parkinson con hipersexualidad y los pacientes con control de la enfermedad de Parkinson en respuesta neural a otras señales visuales gratificantes en el análisis funcional de RMN, lo que indica que nuestros resultados de imágenes también fueron específicos de hipersexualidad. Sin embargo, también queríamos explorar la actividad cerebral específica relacionada con las señales visuales sexuales en comparación con otras recompensas. Los hallazgos revelaron una fuerte activación en las exploraciones de estado ON y OFF en la corteza orbitofrontal, la corteza cingulada anterior, la corteza cingulada posterior, el estriado ventral, la corteza prefrontal anterior, la corteza prefrontal dorsolateral, el giro parahipocampal y el hipotálamo, lo que confirma la importancia específica de estas regiones en Motivación y deseo sexual, al menos en el contexto de la hipersexualidad.
Esta mejora selectiva para las señales sexuales es notable. Trabajo en modelos animales por Berridge y colegas (Mahler y Berridge, 2009, 2012; DiFeliceantonio y Berridge, 2012) ha demostrado que la estimulación de los circuitos de opioides en la amígdala y el cuerpo estriado puede enfocar el "deseo" desencadenado por señales de manera muy limitada de manera que el ganador se lo lleve todo. En tales condiciones, una señal de recompensa favorita se convierte en un "imán motivacional" muy potente que atrae toda atracción hacia sí misma, a expensas de otras señales de recompensa, incluso en animales que también se sintieron atraídos por esas otras recompensas (Mahler y Berridge, 2009, 2012; DiFeliceantonio y Berridge, 2012). De manera similar, las señales de recompensa sexual se asociaron con una actividad mejorada de la amígdala en relación con otras señales de recompensa en personas con hipersexualidad y pueden haber sido seleccionadas selectivamente con una mayor atención de incentivo de manera "ganadora para todos", incluso en aquellas personas con comorbilidad trastornos del control de impulsos.
El aumento de la activación en el estriado ventral podría estar relacionado con el aumento de la liberación de dopamina en el estriado ventral (Mamparo et al., 2008), consistente con los datos de PET (O'Sullivan et al., 2011) y estudios previos que muestran una mayor liberación de dopamina relacionada con las señales sexuales en el estriado ventral de animales sensibilizados (Fiorino y Phillips, 1999). Se sabe que las lesiones en el hipotálamo y la amígdala afectan la motivación sexual en roedores machos y hembras, y la activación de la amígdala y el hipotálamo rastrea la excitación sexual en los estudios funcionales de IRM (Hamann et al., 2004). Se ha demostrado que el hipotálamo desempeña un papel central en el comportamiento sexual y se cree que está involucrado en el componente autonómico de la excitación sexual (Allen et al., 1989; Kupfermann et al., 1991; Meisel y Sachs, 1994; Georgiadis et al., 2010).
La corteza cingulada anterior es otra área paralímbica conectada a las regiones del cerebro anterior que controla varias funciones autónomas y neuroendocrinas (Stoléru et al., 1999). Estudios anteriores han relacionado la activación de la corteza cingulada anterior con el grado de tumescencia del pene (Redouté et al., 2000) y con el componente motivacional de la excitación sexual y el deseo (Redouté et al., 2000; Arnow et al., 2002; Karama et al., 2002; Walter et al., 2008). Las áreas parietales y la corteza cingulada posterior también se han relacionado con la especificidad de la señal en el deseo de recompensa (Garavan et al., 2000). La corteza orbitofrontal se ha vinculado a valoraciones explícitas de placer y deseo anticipados, y se cree que tiene un papel en la mediación de la experiencia de recompensa subjetiva (Kringelbach, 2005). Además, se ha sugerido que la activación de la corteza orbitofrontal y la corteza prefrontal se asocia con una sensación corporal agradable que se representa internamente durante la excitación sexual (Stoléru et al., 2003). Encontramos que el deseo sexual clasificado estaba correlacionado con la actividad en las regiones corticales (incluida la corteza cingulada anterior y la corteza orbitofrontal) además del estriado ventral, lo que puede ser coherente con la noción de que "carecer" de incentivo no se experimenta directamente en la conciencia consciente, y ese "deseo" explícito y consciente requiere un procesamiento cortical adicional de las salidas del estriado ventral (Berridge y Robinson, 1995).
En nuestro estudio, la actividad cerebral mejorada después de la exposición a señales sexuales no se vio influenciada por la administración de l-DOPA, como lo sugiere el aumento de la señal BOLD en los análisis de medicamentos ON y OFF. Sin embargo, la ausencia de una aguda l-El efecto DOPA no elimina el efecto de la interacción sinérgica del estado de dopamina mesolímbica y la presencia de señales sexuales para estimular el "deseo" mejorado de recompensa sexual en el grupo de pacientes con enfermedad de Parkinson con hipersexualidad (Berridge, 2012; Oei et al., 2012). Los pacientes con enfermedad de Parkinson con hipersexualidad, incluso en el estado DESCONECTADO, no están completamente libres de drogas y presumiblemente están sensibilizados, y en estudios con animales, aunque los efectos agudos de la anfetamina y la sensibilización pueden ser aditivos (Tindell et al., 2005), la sensibilización causada por la administración previa de anfetaminas causa señales de recompensa que desencadenan una búsqueda excesiva de su recompensa asociada, incluso cuando las ratas sensibilizadas se prueban en un estado libre de drogas (Wyvell y Berridge, 2001).
Curiosamente, en el grupo de pacientes con enfermedad de Parkinson con hipersexualidad tras aguda l-Desafío DOPA, las disminuciones observadas cuando se suspenden sus medicamentos y en el estado OFF y ON en los pacientes con control de la enfermedad de Parkinson (señal BOLD reducida durante la exposición a señales sexuales frente a señales visuales neutrales en el istmo de la circunvolución cingular, circunvolución parahipocampal, cuneus, ínsula y claustrum) fueron eliminados (para un efecto similar de la prueba de drogas dopaminérgicas en la adicción a la cocaína, ver Volkow et al., 2010). Estos resultados sugieren que los medicamentos de dopamina podrían eliminar la desactivación de las regiones cerebrales, lo que podría estar relacionado con cambios plásticos en un esfuerzo por inhibir la estimulación de la hipersexualidad. Aunque es difícil traducir la excitación o la inhibición de la activación neuronal en aumentos de la señal BOLD en voxels activados (Georgopoulos et al., 1982; Batini et al., 1984), los fármacos de dopamina podrían liberar esta inhibición a través de la actividad de las interneuronas inhibitorias que actúan dentro de los circuitos neuronales locales en la corteza cerebral. La liberación de inhibición neuronal en el istmo del giro cingulado, giro parahipocampal, cuneo, ínsula y claustrum cuando los pacientes están ENCENDIDOS, sus fármacos dopaminérgicos podrían asociarse con cambios de comportamiento concurrentes, ya que en este estudio hubo un aumento asociado en las puntuaciones de deseo sexual. Esta teoría está respaldada por el cese completo de la hipersexualidad después de la retirada de los medicamentos agonistas del receptor de dopamina (Mamikonyan et al., 2008; Munhoz et al., 2009).
La inhibición de la desactivación de la ínsula a través de drogas de dopamina podría conducir a la expresión de un comportamiento sexual patológico, ya que esta área paralímbica forma conexiones con regiones involucradas en la regulación autonómica (Oppenheimer et al., 1992), relaciona información sensorial altamente procesada con estados motivacionales (Stoléru et al., 1999) y, en combinación con la corteza somatosensorial secundaria, se ha informado que está involucrado en la necesidad percibida de expresar un comportamiento sexual abierto (Árabe et al., 2003). También se ha demostrado que el claustrum está involucrado en las respuestas emocionales y de motivación en los animales (Hamamura et al., 1997) y los humanos (Reiman et al., 1989) y se cree que está asociado con la motivación sexual (Rees et al., 2007). La desactivación en las regiones parahipocampales se ha informado después de la presentación de videoclips sexualmente explícitos; sin embargo, el papel potencial de estas desactivaciones no se comprende bien (Redouté et al., 2000).
En conclusión, este es el primer estudio que examina los mecanismos que sustentan la hipersexualidad en la enfermedad de Parkinson, y los hallazgos respaldan una cuenta basada en una motivación exagerada basada en la atención por incentivo basada en la atención. Además, nuestros hallazgos tienen algunas implicaciones con respecto al potencial de la exposición a la señal a través del acceso a los medios de comunicación para influir en el comportamiento sexual patológico en la enfermedad de Parkinson. La estimulación mediante señales eróticas comunes de individuos propensos a la hipersexualidad es capaz de proporcionar un ímpetu motivador para buscar recompensas sexuales a través de un aumento y disminución de las activaciones de la corteza cerebral, lo que podría conducir a consecuencias sociales y psicológicamente perjudiciales. Por lo tanto, la aplicación de restricciones en el tipo y la cantidad de exposición a señales visuales eróticas podría limitar la aparición de conductas sexuales anormales excesivas o desviadas en poblaciones vulnerables, como las que reciben medicamentos dopaminérgicos.
Oportunidades
Este trabajo fue apoyado por fondos del Reino Unido de Parkinson (J-0704).
Material suplementario
Material suplementario está disponible en Cerebro en línea.
