Dialogen Clin Neurosci. 2013 Dec;15(4):431-43.
Abstract
Ondanks het belang van een groot aantal psychosociale factoren, gaat drugverslaving in de kern gepaard met een biologisch proces: het vermogen van herhaalde blootstelling aan een misbruikend medicijn om veranderingen te veroorzaken in een kwetsbaar brein dat dwangmatig zoeken naar en nemen van medicijnen en verlies van controle veroorzaakt over drugsgebruik, dat een verslavingstoestand definieert. Hier bespreken we de soorten moleculaire en cellulaire aanpassingen die optreden in specifieke hersenregio's om verslaving-geassocieerde gedragsafwijkingen te mediëren. Deze omvatten veranderingen in genexpressie die gedeeltelijk worden bereikt via epigenetische mechanismen, plasticiteit in het neurofysiologische functioneren van neuronen en synapsen, en geassocieerde plasticiteit in neuronale en synaptische morfologie die gedeeltelijk wordt gemedieerd door veranderde neurotrofische factorsignalering. Elk van deze soorten door medicijnen geïnduceerde modificaties kunnen worden gezien als een vorm van "cellulair of moleculair geheugen". Bovendien valt op dat de meeste verslavingsgerelateerde vormen van plasticiteit sterk lijken op de soorten plasticiteit die zijn geassocieerd met meer klassieke vormen van 'gedragsgeheugen', misschien een weerspiegeling van het eindige repertoire van adaptieve mechanismen die beschikbaar zijn voor neuronen wanneer zij worden geconfronteerd met uitdagingen. Ten slotte hebben verslavinggerelateerde moleculaire en cellulaire aanpassingen betrekking op de meeste dezelfde hersenregio's die meer klassieke vormen van geheugen mediëren, in overeenstemming met de opvatting dat abnormale herinneringen belangrijke oorzaken zijn van verslavingssyndromen. Het doel van deze studies die gericht zijn op het expliciteren van de moleculaire en cellulaire basis van drugsverslaving is om uiteindelijk op biologische basis diagnostische tests te ontwikkelen, evenals effectievere behandelingen voor verslavingsstoornissen.
Introductie
Drugsverslaving, die kan worden gedefinieerd als het dwangmatig zoeken naar en nemen van drugs ondanks vreselijke gevolgen of verlies van controle over drugsgebruik, wordt veroorzaakt door langdurige medicijngeïnduceerde veranderingen die optreden in bepaalde hersengebieden.1 Slechts enkele individuen zijn echter verslaafd aan herhaalde blootstelling aan drugs, terwijl anderen in staat zijn om terloops een drug te gebruiken en te ontsnappen aan een verslavingssyndroom. Genetische factoren vormen ruwweg 50% van deze individuele variabiliteit in verslavingskwetsbaarheid, en deze mate van erfelijkheid komt overeen met alle belangrijke klassen verslavende middelen, waaronder stimulerende middelen, opiaten, alcohol, nicotine en cannabinoïden.2 Het is nog niet mogelijk geweest om de meeste genen te identificeren die dit genetische risico omvatten, waarschijnlijk als gevolg van de betrokkenheid van misschien honderden genetische variaties die samenkomen in een enkel individu om verslavingskwetsbaarheid (of, in andere individuen, resistentie) te verlenen.
De andere 50% van het risico op verslaving is te wijten aan een groot aantal omgevingsfactoren, die gedurende het hele leven voorkomen, die interageren met de genetische samenstelling van een individu om hem of haar in meer of mindere mate kwetsbaar te maken voor verslaving. Verschillende soorten omgevingsfactoren zijn betrokken bij verslaving, waaronder psychosociale stress, maar verreweg de krachtigste factor is de blootstelling aan een drug van misbruik zelf. Van bepaalde "gateway" -geneesmiddelen, in het bijzonder nicotine, is aangetoond dat ze de kwetsbaarheid voor een verslaving aan een ander medicijn vergroten.3 Bovendien is er steeds meer bewijs dat, ondanks een reeks genetische risico's voor verslaving in de bevolking, blootstelling aan voldoende hoge doses van een geneesmiddel gedurende lange tijd iemand kan transformeren die een relatief lagere genetische lading heeft in een verslaafde.4
Er is de afgelopen twee decennia grote vooruitgang geboekt bij het identificeren van zowel de discrete hersenregio's die belangrijk zijn bij het bemiddelen van een verslavingssyndroom, als de soorten veranderingen op moleculair en cellulair niveau die door geneesmiddelen in deze regio's worden veroorzaakt om de belangrijkste aspecten te onderbouwen van verslaving.1,5 Het circuit dat de meeste aandacht heeft gekregen, wordt het mesolimbische dopaminesysteem genoemd, waarbij dopamine-neuronen in het ventrale tegmentale gebied (VTA) van de middenhersenen worden gebruikt, die door de lucht gevormde neuronen in de nucleus accumbens innerveren (NAc, een deel van het ventrale striatum). Deze VTA-neuronen innervate ook vele andere voorhersenenregio's, waaronder hippocampus, amygdala en prefrontale cortex (PFC).
Het is logisch om deze drugsgeïnduceerde verslavingsmechanismen in dit volume op het geheugen te beschouwen om drie overlappende redenen.6
- Ten eerste kunnen alle door drugs geïnduceerde aanpassingen worden gezien als soorten "moleculair of cellulair geheugen:" de zenuwcel die dergelijke veranderingen ondergaat, is anders als gevolg van blootstelling aan geneesmiddelen en reageert daarom anders op datzelfde medicijn, naar andere medicijnen, of naar een groot aantal andere stimuli als resultaat.
- Ten tweede is het interessant dat veel, misschien de meeste, soorten veranderingen zijn geassocieerd met een verslavingstoestand (bijv. veranderde gentranscriptie, epigenetica, synaptische en whole cell plasticity, en neuronale morfologie en neurotrofe mechanismen) zijn ook betrokken bij traditionele vormen van 'gedragsgeheugen', zoals ruimtelijk geheugen, angstconditionering en operante conditionering, onder andere.
- Ten derde zijn onder de hersenregio's die worden beïnvloed door drugsmisbruik, die hoofd-neurale substraten voor gedragsgeheugen, waaronder hippocampus, amygdala en PFC. Dit valt samen met het toenemende besef dat sommige van de belangrijkste kenmerken van verslaving die klinisch worden waargenomen (bijv. Hunkering naar drugs en terugval) abnormaliteiten weerspiegelen in traditionele geheugencircuits, waarbij langdurige herinneringen aan de drugservaring dienen als krachtige aanjagers van verslavingspathologie.4,7,8 Omgekeerd hebben de beloningsregio's van de hersenen (bijv. VTA en NAc) een krachtige invloed op het gedragsgeheugen.
Dit artikel geeft een overzicht van de belangrijkste soorten moleculaire en cellulaire veranderingen die voorkomen in verschillende hersenregio's in diermodellen van verslaving, met de nadruk op de nucleus accumbens waarvoor de meeste informatie momenteel beschikbaar is. Belangrijk is dat het in toenemende mate mogelijk is om sommige van deze veranderingen in menselijke verslaafden te valideren op basis van studies van postmortale hersenen. Ondanks het feit dat drugsmisbruik verschillende chemische structuren hebben en op verschillende eiwitdoelen werken, is het opvallend dat veel prominente verslavingsgerelateerde aanpassingen veel voorkomen, en in sommige gevallen allemaal, drugsmisbruik en waarschijnlijk bijdragen aan gedeelde kenmerken van een verslavingsyndroom.4,9 Daarentegen zijn veel andere door geneesmiddelen geïnduceerde aanpassingen specifiek voor een bepaald medicijn en kunnen meer unieke aspecten van een bepaalde verslaving bemiddelen. We richten ons hier op misbruik- en opiaatmedicijnen, die in diermodellen dramatischere effecten produceren in vergelijking met andere geneesmiddelen. We belichten ook belangrijke gebieden voor toekomstig onderzoek die onze kennis van verslavingssyndromen verder zullen vergroten en deze vooruitgang vertalen in verbeterde diagnostische tests en behandelingen.
Transcriptionele en epigenetische mechanismen
De kennis dat verslaafden ondanks een jarenlange onthouding een verhoogd risico op terugval kunnen hebben, betekent dat verslaving door drugs veroorzaakte veranderingen in de hersenen zeer stabiel kan zijn. Dit heeft ertoe geleid dat verschillende groepen veranderingen in genexpressie als een belangrijk onderdeel van het verslavingsproces beschouwen (Figuur 1). Dienovereenkomstig onderzoeken van kandidaatgenen of genoom-breed onderzoek met DNA-microarrays en meer recent RNA-seq (high-throughput-sequencing van tot expressie gebrachte RNA's) heeft talloze genen geïdentificeerd waarvan de expressie is veranderd in een bepaald hersengebied in knaagdier- en primaatmodellen van verslaving en in menselijke verslaafden (bijv. refs 10-17). Voorbeelden van dergelijke genen worden besproken in de volgende secties van dit overzicht.
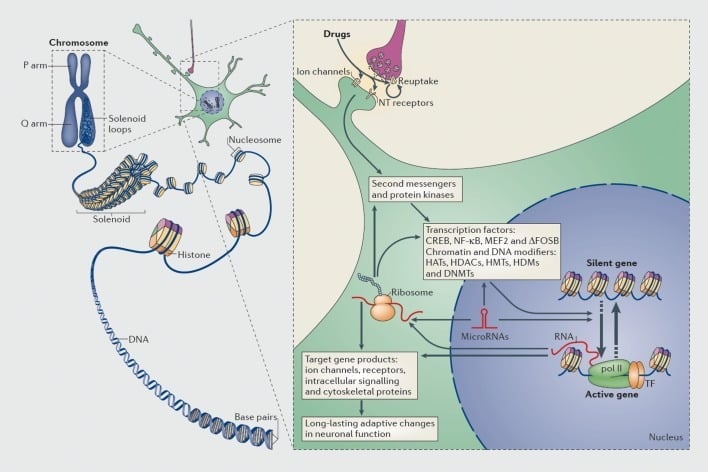
Mechanismen van transcriptionele en epigenetische regulatie door misbruik door drugs. In eukaryote cellen wordt DNA georganiseerd door het omhullen van histon-octomeren om nucleosomen te vormen, die vervolgens verder worden georganiseerd en gecondenseerd om chromosomen te vormen (linker deel). Alleen door tijdelijk gecomprimeerd chromatine te ontrafelen, kan het DNA van een specifiek gen voor de transcriptionele machine toegankelijk worden gemaakt. Geneesmiddelen van misbruik werken via synaptische doelen zoals heropnamemechanismen, ionkanalen en neurotransmitter (NT) -receptoren om intracellulaire signaalcascades te veranderen (rechter deel). Dit leidt tot de activering of remming van transcriptiefactoren (TF's) en vele andere nucleaire doelwitten, inclusief chromatine-regulerende eiwitten (getoond met dikke pijlen); de gedetailleerde mechanismen die betrokken zijn bij de synaptische regulatie van chromatine-regulerende eiwitten blijven slecht begrepen. Deze processen resulteren uiteindelijk in de inductie of repressie van bepaalde genen, inclusief die voor niet-coderende RNA's zoals microRNA's; veranderde expressie van sommige van deze genen kan op zijn beurt de gentranscriptie verder reguleren. Er wordt voorgesteld dat sommige van deze door drugs geïnduceerde veranderingen op het niveau van chromatine extreem stabiel zijn en daardoor ten grondslag liggen aan het langdurige gedrag dat verslaving bepaalt. CREB, cyclisch op AMP reagerend element-bindend eiwit; DNMT's, DNA-methyltransferasen; HATs, histon-acetyltransferasen; HDAC's, histon deacetylases; HDM's, histon demethylasen; HMT's, histon-methyltransferasen; MEF2, myocyte-specifieke enhancer-factor 2; NF-KB, nucleaire factor-KB; pol II, RNA polymerase II. Gereproduceerd van ref 44: Robison AJ, Nestler EJ. Transcriptionele en epigenetische verslavingsmechanismen. Nat Rev Neurosci. 2011; 12: 623-637.
Evenzo zijn veel typen transcriptiefactoren - eiwitten die binden aan regulerende gebieden van genen en daardoor de transcriptie van die genen verhogen of verlagen - betrokken geweest bij het mediëren van de langetermijneffecten van misbruik door drugs op genexpressie in de hersenen.. Belangrijke voorbeelden zijn CREB (cAMP-responselement-bindend eiwit), ΔFosB (een Fos-familie-transcriptiefactor), NFkB (kernfactor kB), MEF2 (myocyt-versterkende factor-2) en glucocorticoïde-receptoren, naast verschillende andere.5,10,18-22 Het is in toenemende mate mogelijk geworden om de cellulaire signaalroutes te begrijpen waardoor drugsmisbruik een bepaalde transcriptiefactor in de hersenen activeert en om een dergelijke activering causaal te koppelen aan de doelgenen van die transcriptiefactor en aan specifieke gedragsaspecten van verslaving (zie Figuur 1). Deze vooruitgang wordt geïllustreerd door de beschouwing van CREB en ΔFosB, de best bestudeerde transcriptiefactoren in verslavingsmodellen.
cAMP Responselement bindend eiwit
Stimulerende en opiaat drugs van misbruik activeren CREB in verschillende hersenregio's belangrijk voor verslaving, waaronder prominent in het NAc.23,24 Van CREB is bekend dat het in andere systemen wordt geactiveerd door cAMP, Ca2+en groeifactorenroutes,25 en het is nog niet bekend welke van deze de activering ervan medieert in NAc door drugs van misbruik. Van geneesmiddelactivatie van CREB in NAc is aangetoond dat het een klassiek negatief feedbackmechanisme vertegenwoordigt, waarbij CREB dient om de gevoeligheid van een dier voor de belonende effecten van deze medicijnen te verminderen (tolerantie) en om een negatieve emotionele toestand te bemiddelen tijdens het stoppen van het medicijn (afhankelijkheid).18,26,27 Deze effecten zijn recentelijk aangetoond om verhoogde zelftoediening van geneesmiddelen en terugval te stimuleren, vermoedelijk door een proces van negatieve versterking.28 Deze acties van CREB lijken zowel belangrijke subtypen van NAc medium stekelige neuronen te omvatten, die die overwegend D tot expressie brengen.1 versus D2 dopaminereceptoren.24 IInderdaad, een grote hoeveelheid literatuur heeft aangetoond dat CREB, handelend in de hippocampus en amygdala, een sleutelmolecule is in het gedragsgeheugen.29-31 Deze brede rol in verslaving en gedragsgeheugen weerspiegelt waarschijnlijk het feit dat neuronen doordrenkt zijn met een eindig aantal moleculaire mechanismen om zich aan te passen aan een constant veranderende omgeving.
Doelgenen voor CREB die dit gedragsfenotype mediëren zijn geïdentificeerd door middel van genoom-brede assays evenals meer geselecteerde inspanningen.10,18,32 Een voorbeeld is de opioïde peptidedynorphin: stimulerende inductie van dynorfine-expressie in NAc neuronen, gemedieerd via CREB, verhoogt de dynorfine-activering van k opioïde receptoren op VTA dopamine neuronen en onderdrukt daardoor dopaminerge transmissie naar de NAc en belemmerd beloning.18 Van verschillende andere CREB-doelen is aangetoond dat ze belangrijk zijn voor door drugs geïnduceerde synaptische plasticiteit, zoals hieronder wordt besproken. Hoewel CREB ook wordt geactiveerd in verschillende andere hersenregio's door stimulantia en opiaten,23,24 Er is minder bekend over de gedragsconsequenties van dit effect en de doelgenen waardoor ze ontstaan. Evenzo is er minder bekend over de rol van CREB bij het bemiddelen bij de acties van andere drugsmisbruik.19
ΔFosB
Acute blootstelling aan vrijwel elk misbruikend middel induceert alle transcriptiefactoren van de Fos-familie in NAc en verschillende andere hersenregio's. Deze inductie is snel maar ook zeer van voorbijgaande aard, waarbij de Fos-eiwitniveaus binnen 8 tot 12 uur weer normaal worden. Uniek bij deze Fos-familie-eiwitten is ΔFosB, een ingekort product van het FosB-gen, die vanwege zijn ongewone stabiliteit zich geleidelijk opstapelt door een reeks herhaalde blootstelling aan geneesmiddelen en wordt het overheersende Fos-eiwit dat onder deze omstandigheden tot expressie wordt gebracht.22,33 Bovendien houden de niveaus van ΔFosB vanwege deze stabiliteit weken aan na het stoppen van het geneesmiddel. Een dergelijke chronische inductie van ΔFosB is aangetoond voor vrijwel alle drugsmisbruik34 en, voor de meeste geneesmiddelen, is het selectief voor Dl-type NAc-neuronen.34,35 Het is ook geweest aangetoond in menselijke verslaafden.35 Een grote hoeveelheid literatuur heeft aangetoond dat dergelijke ΔFosB-inductie in D1-type NAc-neuronen verhogen de gevoeligheid van een dier voor geneesmiddelen en natuurlijke beloningen en bevorderen de zelftoediening van geneesmiddelen, vermoedelijk door een proces van positieve bekrachtiging (zie referenties 34 naar 38). Interessant is dat de geneesmiddelinductie van ΔFosB in NAc dramatischer is bij adolescente dieren, een tijd van grotere kwetsbaarheid voor verslaving,39 en het is aangetoond dat de inductie ervan door nicotine de gateway-achtige verbetering van de cocaïnebeloning van nicotine medieert.40
Wat betreft CREB zijn talrijke doelwitgenen voor ΔFosB geïdentificeerd in NAc door gebruik van kandidaatgen en genoom-brede benaderingen.10,32 Terwijl CREB dynorfine induceert, onderdrukt ΔFosB het, wat bijdraagt aan de pro-beloningseffecten van ΔFosB.38 Een ander ΔFosB-doelwit is cFos: als ΔFosB zich ophoopt bij herhaalde blootstelling van het geneesmiddel onderdrukt het c-Fos en draagt het bij tot de moleculaire switch waarbij ΔFosB selectief wordt geïnduceerd in de chronische met medicijnen behandelde toestand.41 Van veel andere ΔFosB-targets is aangetoond dat ze het vermogen van bepaalde drugs misbruikt om synaptische plasticiteit in het NAc te induceren en daarmee geassocieerde veranderingen in de dendritische arborisatie van NAc medium stekelige neuronen, zoals hieronder zal worden besproken.
De functionele gevolgen van ΔFosB-inductie in andere hersenregio's zijn minder goed bekend, hoewel de inductie ervan in orbitofrontale cortex (OFC) in enig detail is bestudeerd. Hier bemiddelt ΔFosB de tolerantie die optreedt bij de cognitieve-verstorende effecten van cocaïne tijdens een loop van chronische blootstelling, en deze aanpassing is geassocieerd met verhoogde cocaïne zelftoediening.42,43
Genoom-brede assays hebben verschillende potentiële doelwitgenen gesuggereerd die deze effecten mediëren.42 Ondanks de unieke temporele eigenschappen van ΔFosB en de wetenschap dat het wordt geïnduceerd in traditionele geheugencircuits (bijv. Hippocampus), is er nog geen verkenning geweest van de rol van ΔFosB in gedragsgeheugen, een interessant onderwerp voor toekomstig onderzoek.
Epigenetische mechanismen
In recentere jaren zijn transcriptiestudies een stap verder gegaan naar epigenetica44 (Zie Figuur 1), wat in brede zin kan worden gedefinieerd als een verandering in genexpressie die optreedt bij afwezigheid van een verandering in DNA-sequentie. Epigenetische mechanismen regelen de verpakking van DNA in een celkern via zijn interacties met histonen en vele andere typen nucleaire eiwitten, die samen chromatine omvatten. Genexpressie wordt gecontroleerd door de toestand van deze verpakking door de covalente modificatie van histonen, andere eiwitten en DNA zelf. Als slechts enkele voorbeelden, heeft acetylatie van histonen de neiging om genactivering te bevorderen, methylatie van histonen kan ofwel genactivering of repressie bevorderen afhankelijk van de Lys-rest die deze modificatie ondergaat, en methylatie van DNA is in het algemeen geassocieerd met genrepressie, hoewel bepaalde variante vormen van methylatie ( bijv. 5-hydroxymethylering) kan in verband worden gebracht met genactivering.
Epigenetica is een aantrekkelijk mechanisme omdat in andere systemen, bijvoorbeeld ontwikkelings- en kankerbiologie, bepaalde epigenetische modificaties permanent kunnen zijn. Om deze reden, epigenetica werd zowel in leer- en geheugenmodellen (bijv. refix 45-48) als in verslaving nagestreefd;44,49 in beide systemen zijn ingrijpende veranderingen gemeld in histonacetylering en methylatie en in DNA-methylatie. Als slechts één voorbeeld is het histon methyltransferase, G9a, betrokken in beide geheugen50 en verslaving.51,52 In verslavingsmodellen, G9a-expressie wordt gedownreguleerd in NAc als reactie op stimulerende of opiaat drugs van misbruik en tvan hem is aangetoond dat het de lonende effecten van deze medicijnen verhoogt.51,52 Interessant is dat cocaïne onderdrukking van G9a gemedieerd wordt door ΔFosB. G9a katalyseert de dimethylering van Lys9 van histon H3 (H3K9me2), een belangrijke bemiddelaar van genrepressie. ChIP-chip of ChIP-seq (chromatin immunoprecipitatie gevolgd respectievelijk door promotorfiches of high-throughput sequencing) is gebruikt om genoom-brede kaarten van de genen in NAc te verkrijgen die gewijzigd H3K9me2 vertonen na stimulerende of opiaatblootstelling.32,52,53 Door deze genlijsten te overlappen met genoomomvattende lijsten van genexpressieveranderingen en met genoom-brede kaarten van vele andere vormen van epigenetische modificaties (bijv. ΔFosB-binding, CREB-binding, andere histon-modificaties, enz.),32,53 het zou mogelijk moeten zijn om een steeds completere reeks genen te identificeren die worden gereguleerd door misbruikt drugs en om de onderliggende onderliggende epigenetische mechanismen te begrijpen.
Een andere vorm van epigenetische regulatie die betrokken is bij geheugen en verslaving is het genereren van microRNA's. Deze kleine, niet-coderende RNA's binden aan complementaire gebieden van mRNA's en onderdrukken daardoor hun translatie of induceren hun degradatie. Deletie van Argonaut, een eiwit dat cruciaal is voor de verwerking van miRNA's, verandert gedragsreacties op cocaïne, met verschillende effecten waargenomen voor D1- versus D2-type middelgrote stekelige neuronen.54 Van verschillende specifieke miRNA's is eveneens aangetoond dat ze worden gereguleerd door blootstelling aan geneesmiddelen en, op hun beurt, om gedragsreacties op de geneesmiddelen te beïnvloeden (bijv., Refs 55,56). Het zal spannend zijn in toekomstige studies om de mRNA-doelen van deze miRNA's te identificeren en te karakteriseren hoe ze het verslavingsproces beïnvloeden.
Synaptische plasticiteit
Dezelfde algemene typen synaptische modificaties op glutamaterge synapsen, die betrokken zijn bij hippocampus en amygdala in gedragsgeheugen (zie andere artikelen in dit nummer), hebben eveneens aangetoond te voorkomen in hersenbeloningsregio's in verslavingsmodellen en om belangrijk te zijn bij het bemiddelen het verslavingsproces.57,58 Dergelijke door drugs geïnduceerde synaptische plasticiteit is in verschillende hersenregio's beschreven, maar we concentreren ons hier op NAc, waar het grootste deel van het onderzoek tot nu toe is gericht (Figuur 2).
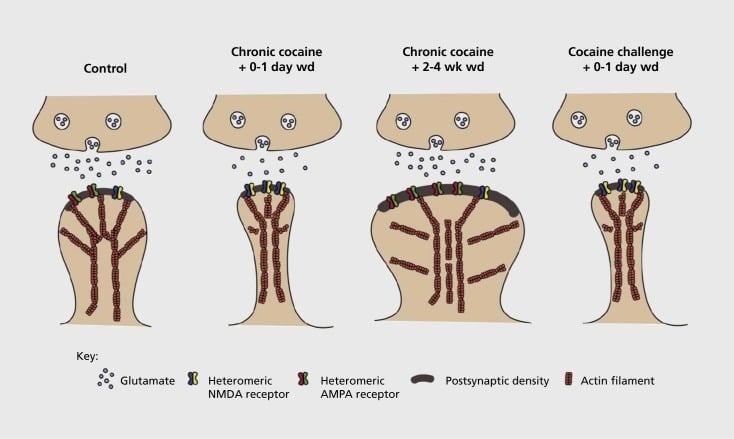
Model van verslavingsgerelateerde synaptische en structurele plasticiteit in nucleus accumbens (NAc). Chronische blootstelling aan cocaïne resulteert in een tijdsafhankelijke en voorbijgaande reorganisatie van α-amino-3-hydroxy-5-methyl-4-isoxazol-propionzuur (AMPA) en N-methyl-D-asparaginezuur (NMDA) glutamaatreceptoren bij NAc-medium synaps van spiny neuron (MSN), evenals structurele veranderingen in de wervelkolom hoofd van NAc MSN's die correleren met verschillende vormen van synaptische plasticiteit. Chronische cocaïne induceert bijvoorbeeld de oppervlakte-expressie van NMDA-receptoren, stille synapsvorming en langdurige depressie (LTD) op vroege tijdstippen van uitname. Tijdens langer intrekken (wd) keren deze synaptische veranderingen om met als resultaat verhoogde expressie van AMPA-receptoren aan het oppervlak, een consolidatie van de synaps in een paddestoelvormige wervelkolom en langdurige potentiatie (LTP). Deze effecten keren snel terug na blootstelling aan een uitdagende dosis cocaïne, wat leidt tot herstructurering van de wervelkolom in dunne stekels en een verlaging van de synaptische kracht.
Eerste experimenten toonden aan dat herhaalde blootstelling aan stimulerende drugs of misbruik een LTD (langdurige depressie) -achtige toestand induceert bij glutamaterge synapsen in het NAc.59 Meer recent werk heeft echter aangetoond dat dergelijke plasticiteit zeer tijdsafhankelijk is, waarbij LTD vroeg na de laatste blootstelling aan cocaïne evolueert naar een meer van een LTP-status (op lange termijn potentiëren) na langere wachttijden.60,61 Dit werk, dat tot nu toe hoofdzakelijk is uitgevoerd met behulp van de toegediende onderzoeker, in tegenstelling tot zelf toegediende geneesmiddelen, heeft de behoefte aan meer systematisch onderzoek naar zelftoedieningsmodellen gedefinieerd die de vormen van synaptische plasticiteit volgen die optreden bij glutamaterge synapsen in NAc over een gedetailleerd tijdsverloop van acquisitie van zelftoediening naar het onderhoud ervan, via verschillende momenten van terugtrekking en uitdoving, en als reactie op terugval-opwekkende stimuli. Werk tot nu toe heeft ook enkele van de moleculaire mechanismen gedefinieerd die bijdragen aan deze door drugs geïnduceerde synaptische plasticiteit, inclusief het transport van AMPA-receptoren naar de synaps, mogelijk gedeeltelijk gemedieerd via CaMKII (Ca2+/ calmoduline-afhankelijke proteïne kinase II) fosforylatie van bepaalde AMPA-receptorsubeenheden, evenals veranderde expressie van AMPA-receptorsubeenheden (bijvoorbeeld 60,62-65, Cijfers 2 en 3). Een rol voor CREB en ΔFosB is geïmpliceerd in deze verschijnselen, evenals in geassocieerde veranderingen in de morfologie van glutamaterge synapsen (zie hieronder). GluAl is bijvoorbeeld een doelwit voor CREB in NAc, waar GluA2 en CaMKII beide doelen zijn van ΔFosB, in dit hersengebied .35,36,66,67 In de toekomst zal het belangrijk zijn om specifieke aanpassingen aan tijdsafhankelijke veranderingen in synaptische functie en gedragskenmerken van verslaving te koppelen.
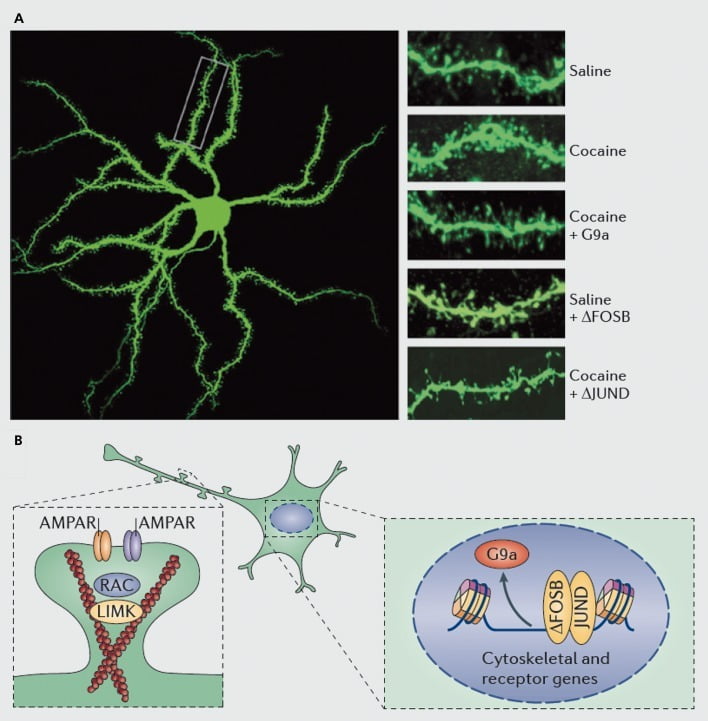
Moleculaire mechanismen die ten grondslag liggen aan cocaïne-inductie van dendritische stekels op nucleus accumbens (NAc) medium stekelige neuronen. A) toont door cocaïne geïnduceerde verhogingen van het aantal dendritische wervelkolom dat kan worden geblokkeerd door virale overexpressie van G9a of JunD (een antagonist van door AP1 gemedieerde transcriptie), of kan worden nagebootst door virale overexpressie van FosB. B) Regulatie van AMPA-receptor (AMPAR) -handel en van het actine-cytoskelet (links), evenals regulering van de transcriptie van glutamaatreceptoren en actine-regulerende eiwitten (bijvoorbeeld zoals gemedieerd via ΔFosB, rechts) bleken een belangrijke rol te spelen bij het mediëren van de regulering van de NAc-dendritische wervelkolomdichtheid door cocaïne. UMK, LIM-domeinkinase; RAC, Ras-gerelateerd C3-botulinumtoxinesubstraat.
Nieuwe experimentele hulpmiddelen maken het voor de eerste keer mogelijk om met toenemende nauwkeurigheid te definiëren welke schakelingen deze vormen van synaptische plasticiteit vertonen en welke gedragsafwijkingen ze bemiddelen. Bijvoorbeeld tde schil- en kernsubgebieden van NAc tonen verschillen in geneesmiddel-geïnduceerde synaptische plasticiteit, evenals D1- versus D2-type middelgrote stekelige neuronen binnen elk subgebied.60,63,64,67 Op dezelfde manier hebben optogenetische experimenten nieuw inzicht verschaft in de bijdrage van een bepaalde vorm van synaptische plasticiteit (bijv. LTD) aan specifieke populaties van glutamaterge synapsen in NAc, bijvoorbeeld die voortkomend uit mediale PFC versus basolaterale amygdala versus ventrale subiculum (de belangrijkste output van de hippocampus).68-70 Uiteindelijk zal het nodig zijn om door medicijnen geïnduceerde moleculaire aanpassingen in elk van deze afferente neuronen te bedekken met synaps-specifieke aanpassingen die voorkomen in hun postsynaptische dendrieten om een volledig begrip te krijgen van hoe misbruikende drugs het hersencircuit wijzigen om bepaalde aspecten van de hersenen aan te sturen. verslaafde staat. Dit streven vereist een grotere waardering van door geneesmiddelen geïnduceerde plasticiteit bij remmende synapsen in dezelfde hersengebieden, een gebied dat tot nu toe zeer weinig aandacht heeft gekregen.65
Plasticiteit van hele cellen
Hoewel de meerderheid van het onderzoek met neurofysiologische veranderingen in neuronen in drugsmisbruik verschijnselen, zoals in leer- en geheugenverschijnselen, zich heeft gericht op synaptische plasticiteit, is er ook steeds meer bewijs voor het belang van plasticiteit in de gehele cel. Plasticiteit van gehele cellen, ook aangeduid als homeostatische plasticiteit,71 omvat veranderingen in de intrinsieke prikkelbaarheid van een gehele zenuwcel op een manier dat het niet synaps-specifiek is. Aangezien bepaalde kenmerken van drugsverslaving een verhoogde of verminderde gevoeligheid voor een medicijn impliceren, is het logisch dat een verhoogde of verminderde elektrische prikkelbaarheid van bepaalde zenuwcellen bijdraagt aan deze gedragsaanpassingen.5
De Het best bewezen voorbeeld van plasticiteit van de gehele cel voor een misbruikend medicijn is het vermogen van chronische opiaten om de intrinsieke prikkelbaarheid van noradrenerge neuronen van de locus coeruleus (LC) te verhogen.).72 Deze verhoogde prikkelbaarheid wordt gemedieerd via CREB en de inductie ervan van bepaalde isovormen van adenylylcyclase, die een verhoogd vuren van LC-neuronen stimuleren, misschien door de inductie van Na + -kanalen.72-75 Deze hyperexcitabiliteit van LC-neuronen vertegenwoordigt een klassiek mechanisme van tolerantie en afhankelijkheid en stimuleert enkele tekenen en symptomen van opiaatontwenning. Interessant is dat CREB een vergelijkbare vorm van plasticiteit van gehele cellen medieert in NAc medium stekelige neuronen, die ook hyperexciteerbaar worden gemaakt door chronische blootstelling aan drugs van misbruik via CREB.76 Het zal dus van cruciaal belang zijn in toekomstige onderzoeken om te begrijpen hoe door CREB gemedieerde synaptische plasticiteit van glutamaterge synapsen op NAc medium stekelige neuronen65,66 summates met CREB-gemedieerde intrinsieke hyperexcitabiliteit van deze neuronen76 om gedragskenmerken van verslaving te beheersen.
Een ander voorbeeld van plasticiteit van gehele cellen in verslavingsmodellen is de hyperexcitabiliteit van VTA-dopaminneuronen die optreedt na chronische blootstelling aan opiaten van abusieve geneesmiddelen.en (Figuur 4).77,78 Deze aanpassing, die is gekoppeld aan morfologische veranderingen in deze zenuwcellen (zie volgende sectie), wordt niet gemedieerd door CREB, maar wordt bereikt via regulatie van neurotrofische signalisatiecascades, zoals hieronder beschreven.

Werkmodel van chronische morfine-geïnduceerde adaptaties in dopamine-neuronen van het ventrale tegmentale gebied (VTA). Chronische morfine verlaagt de hoeveelheid VTA-dopamine (DA), maar neemt toch de neuronale prikkelbaarheid toe, terwijl de overdracht van dopamine naar de nucleus accumbens afneemt. Het netto-effect van morfine is een minder responsieve beloningsroute, dwz beloningstolerantie. Downregulatie van IRS2-AKT-signalering in VTA medieert de effecten van chronische morfine op een bepaalde grootte en elektrische exciteerbaarheid; het effect op de prikkelbaarheid wordt gemedieerd via verlaagde γ-aminoboterzuur (GABA) A-stromen en onderdrukking van K 'kanaalexpressie. Morfine-geïnduceerde neerwaartse regulatie van mTORC2-activiteit in VTA is cruciaal voor deze morfine-geïnduceerde morfologische en fysiologische aanpassingen evenals voor tolerantietolerantie. In tegenstelling tot mT0RC2 verhoogt chronische morfine de mTORCI-activiteit, die deze morfine-geïnduceerde aanpassingen niet beïnvloedt. BDNF, van de hersenen afgeleide neurotrofe factor; IRS, insuline receptor substantie; mTORC, mTOR-complex; AKT, proteïne kinase B Geproduceerd van ref 77
Morfologische plasticiteit en neurotrofe mechanismen
Toenemend bewijs, veel van studies van hippocampus en cerebrale corticale neuronen, heeft aangetoond dat veranderingen in synaptische plasticiteit geassocieerd zijn met morfologische veranderingen bij synapsen. LTD en het genereren van stille synapsen zijn bijvoorbeeld geassocieerd met de vorming van dunne of stompe dendritische stekels, terwijl LTP wordt geassocieerd met grotere, paddestoelvormige stekels.79,80 Het is dus interessant dat het veld van drugsmisbruik zich al> 15 jaar richt op door drugs geïnduceerde veranderingen in dendritische stekels. Chronische blootstelling aan stimulerende drugs van misbruik verhoogt de dendritische wervelkolom dichtheid van middelgrote stekelige neuronen van de NAc, een verandering die de overhand heeft voor Dl-type neuronen.67,81,82 De inductie van stekels is grotendeels in verband gebracht met gesensibiliseerde gedragsreacties op deze geneesmiddelen, hoewel enig bewijsmateriaal in strijd is met deze visie.
Net als bij studies van synaptische plasticiteit is echter veel meer werk nodig om systemisch de veranderingen in dendritische stekels te definiëren die optreden tijdens een zelfmedicatie met geneesmiddelen, terugtrekking en terugval. STudies tot nu toe, waarbij een door de onderzoeker en zelf toegediend geneesmiddel is betrokken, suggereren zeer verschillende veranderingen in de wervelkolom die optreden op verschillende tijdstippen van terugtrekking en in NAc-schaal versus kernsubregio's.83-86 Het zal ook belangrijk zijn om de precieze moleculaire mechanismen te definiëren waardoor cocaïne of een ander stimulerend middel deze tijdsafhankelijke en celtypespecifieke effecten produceert. Van ΔFosB is aangetoond dat het zowel noodzakelijk als voldoende is voor de inductie van onvolgroeide stekels op DI-type NAc neuronen.35,51,67 Een dergelijke regulatie vindt plaats in samenwerking met de regulatie van cocaïne en ΔFosB van verschillende eiwitten waarvan bekend is dat ze de reorganisatie van het actine-cytoskelet reguleren. Als slechts één voorbeeld houdt transcriptionele regulatie van verschillende guanine nucleotide uitwisselingsfactoren en GTPase activerende eiwitten Rac1, een kleine GTPase, voor voorbijgaande dalingen in activiteit in reactie op elke cocaïneblootstelling, en dergelijke pulsatiele dalingen in Rac1 activiteit zijn getoond, gebruikmakende van optogenetische controle van Rac1, om inductie van onvolgroeide stekels te bemiddelen.87 Deze effecten van Racl treden vermoedelijk op door de controle van cofiline en andere actine regulerende eiwitten, waarvan ook is aangetoond dat het de cocaïneregulatie van de groei van de wervelkolom medieert.87,88 Het is echter belangrijk om te benadrukken dat dit slechts één route is die betrokken is bij de regulatie van onrijpe stekels door cocaïne, aangezien is aangetoond dat verschillende andere eiwitten ook een essentiële rol spelen, waaronder CDK5 (cycline-afhankelijke kinase-5), CaMKII, NFkB , MEF2, CREB, G9a en DNMT3 (DNA methyltransf erase 3a), om er maar een paar te noemen.20,21,35,51,67,89,90 Interessant is dat cocaïneregulatie van verschillende van deze genen, waaronder inductie van CDK5, CaMKII en NFkB, en onderdrukking van G9a, ook wordt gemedieerd via ΔFosB.20,35,51,91
Verrassend is dat opiaatmedicijnen met misbruik het tegenovergestelde effect hebben en de dendritische wervelkolomdichtheid van NAc medium stekelige neuronen verminderen.81 Er is weinig bekend over de gedragsgevolgen van deze aanpassing en de onderliggende moleculaire mechanismen die hierbij zijn betrokken. Dit fenomeen is, echter verrassend, aangezien CREB en ΔFosB door zowel stimulerende middelen als opiaten worden geïnduceerd en beide betrokken zijn bij stimulantiegemedieerde inductie van NAc dendritische wervelkolomdichtheid. Dit roept de vraag op hoe opiaten de dichtheid van NAc-ruggengraat onderdrukken ondanks hun inductie van deze factoren.
De andere belangrijke vorm van morfologische plasticiteit die wordt gezien in modellen voor drugsmisbruik, is de fysieke afname in cel-soma-grootte van VTA dopamine-neuronen veroorzaakt door chronische opiatenadministratie..77,92,93 Een vergelijkbare aanpassing vindt plaats als reactie op cannabinoïden.94 Deze krimp van VTA dopamine-neuronen, die optreedt bij opiaat zelftoediening93 en is gedocumenteerd in post-mortale onderzochte heroïneverslaafden,77 lijkt beloningstolerantie te mediëren en wordt geassocieerd met verminderde dopamine-afgifte in het NAc. Aanzienlijk bewijs duidt er nu op dat deze vermindering in de grootte van de cel soma wordt gemedieerd door opiaatonderdrukking van van de hersenen afkomstige expressie van de neurotrofe factor (BDNF) binnen deze neuronen. We hebben deze opiaatgeïnduceerde terugtrekking van BDNF-ondersteuning en VTA-neuroninkrimping direct in verband gebracht met verminderde activiteit van stroomafwaartse BDNF-signaalcascades in VTA-dopaminneuronen, in het bijzonder verminderde activiteit van IRS2 (insulinereceptorsubstraat-2), AKT (een serine-threonine) kinase) en TORC2 (doelwit van rapamycine-2, dat ongevoelig is voor rapamycine).77,93 We hebben deze downregulatie van BDNF-signalering ook direct gekoppeld aan de verhoogde prikkelbaarheid die morfine induceert in deze neuronen, zoals eerder opgemerkt.77,78 Inderdaad, de afgenomen cel-soma-grootte en verhoogde prikkelbaarheid zijn nauw gekoppeld, omdat inductie van de ene naar de andere leidt en vice versa. Deze controle over de exciteerbaarheid van cellen omvat onderdrukking van K+ kanalen en van GABAA stroom in deze neuronen.
Deze rol voor BDNF bij het beheersen van morfine-responsen op het niveau van de VTA contrasteert met de zeer verschillende betrokkenheid bij de acties van cocaïne en andere stimulerende middelen. Stimulerende middelen induceren BDNF-signalering naar het NAc, een effect als gevolg van verhoogde lokale synthese van BDNF evenals verhoogde afgifte uit verschillende afferente regio's.95 Bovendien is aangetoond dat verhoogde BDNF-signalering in NAc, maar niet in de VTA, de gedragseffecten van deze geneesmiddelen bevordert, inclusief hun zelftoediening.95,96 De tegenovergestelde regulatie van BDNF-signalering in de VTA-NAc-route door opiaten versus stimulantia verhoogt de mogelijkheid dat dergelijke verschillen de tegengestelde regulatie van NAc-dendritische stekels door de geneesmiddelen mediëren, een mogelijkheid die nu wordt onderzocht.
Toekomstige richtingen
Het bovenstaande verhaal onderstreept de enorme vooruitgang die is geboekt bij het begrijpen van de moleculaire en cellulaire aanpassingen die voorkomen in hersenbeloningsregio's als reactie op herhaalde blootstelling aan een drugsmisbruik en bij het relateren van individuele aanpassingen aan bepaalde gedragskenmerken van verslavingssyndromen in diermodellen . Ondanks deze vooruitgang blijven er grote vragen over. De meeste van onze bestaande kennis concentreert zich op de VTA en het NAc, met veel minder informatie over andere belangrijke limbische hersenregio's die ook cruciaal zijn voor drugsverslaving. Bovendien hebben alle experimentele demonstraties van de causale rol van een moleculair-cellulaire aanpassing in een drugsgerelateerd gedrag individuele aanpassingen één voor één gemanipuleerd. Het is duidelijk veel moeilijker om meerdere aanpassingen tegelijkertijd te manipuleren, maar het is ook essentieel, omdat we weten dat medicijnen een groot aantal ongelijksoortige soorten veranderingen produceren, zelfs binnen individuele neuronen, die waarschijnlijk op gecompliceerde manieren samenvatten om gedrag te beïnvloeden. Een dergelijke systeembiologische benadering zal cruciaal zijn om uiteindelijk de biologische onderbouwing van verslaving te doorbreken. Ten slotte bevinden pogingen om de moleculair-cellulaire mechanismen van herinneringen met betrekking tot verslaving te begrijpen zich op het punt waarop alle andere pogingen om de biologische basis van gedragsgeheugen te begrijpen nu worstelen: ons vermogen om biologische fenomenen te relateren aan een complex gedragsgeheugen blijft uiterst moeilijk. Het overwinnen van deze kloof is misschien wel de grootste uitdaging in de neurowetenschappen.
Geselecteerde afkortingen en acroniemen
- Nac
- nucleus accumbens
- CREB
- cAMP-responselement-bindend eiwit
- ΔFosB
- een transcriptiefactor van de Fos-familie
- VTA
- ventrale tegmental gebied
- AMPA
- α-amino-3-hydroxy-5-methyl-4-isoxazol-propionzuur
- LTD
- langdurige depressie
- LTP
- langdurige protentiation
- BDNF
- hersenafledende neurotrofe factor
- NKkB
- nucleaire factor kB
REFERENTIES