Dialogi Clin Neurosci. 2013 Dec;15(4):431-43.
Abstrakcyjny
Pomimo znaczenia licznych czynników psychospołecznych, najistotniejsze, uzależnienie od narkotyków wiąże się z procesem biologicznym: zdolnością do wielokrotnego narażenia na narkotyki w celu wywołania zmian w wrażliwym mózgu, który napędza kompulsywne poszukiwanie i przyjmowanie narkotyków oraz utratę kontroli nad używaniem narkotyków, które określają stan uzależnienia. Tutaj dokonujemy przeglądu rodzajów adaptacji molekularnych i komórkowych, które występują w określonych regionach mózgu, aby pośredniczyć w zaburzeniach behawioralnych związanych z uzależnieniem. Obejmują one zmiany w ekspresji genów osiągane częściowo poprzez mechanizmy epigenetyczne, plastyczność w neurofizjologicznym funkcjonowaniu neuronów i synaps oraz związaną z tym plastyczność w neuronalnej i synaptycznej morfologii pośredniczonej częściowo przez zmienioną sygnalizację czynnika neurotroficznego. Każdy z tych rodzajów indukowanych lekami modyfikacji można postrzegać jako formę „pamięci komórkowej lub molekularnej”. Co więcej, uderzające jest to, że większość związanych z uzależnieniem form plastyczności jest bardzo podobnych do rodzajów plastyczności, które są związane z bardziej klasycznymi formami „pamięci behawioralnej”, być może odzwierciedlając skończony repertuar mechanizmów adaptacyjnych dostępnych dla neuronów w obliczu środowiska wyzwania. Wreszcie, adaptacje molekularne i komórkowe związane z uzależnieniem obejmują większość tych samych regionów mózgu, które pośredniczą w bardziej klasycznych formach pamięci, zgodnie z poglądem, że nieprawidłowe wspomnienia są ważnymi czynnikami wpływającymi na zespoły uzależnień. Celem tych badań, których celem jest wyjaśnienie molekularnych i komórkowych podstaw uzależnienia od narkotyków, jest opracowanie biologicznie opartych testów diagnostycznych, a także bardziej skutecznych metod leczenia zaburzeń uzależnień.
Wprowadzenie
Uzależnienie od narkotyków, które można zdefiniować jako kompulsywne poszukiwanie i zażywanie narkotyków pomimo straszliwych konsekwencji lub utraty kontroli nad używaniem narkotyków, jest spowodowane długotrwałymi zmianami wywołanymi lekami, które występują w niektórych obszarach mózgu.1 Jednak tylko niektóre osoby ulegają uzależnieniu w obliczu powtarzającego się narażenia na leki, podczas gdy inne są zdolne do swobodnego używania leku i unikania zespołu uzależnień. Czynniki genetyczne odpowiadają w przybliżeniu za 50% tej indywidualnej zmienności podatności na uzależnienia, a ten stopień odziedziczalności jest prawdziwy dla wszystkich głównych klas uzależniających leków, w tym stymulantów, opiatów, alkoholu, nikotyny i kanabinoidów.2 Nie udało się jeszcze zidentyfikować większości genów, które składają się na to ryzyko genetyczne, prawdopodobnie z powodu zaangażowania setek odmian genetycznych sumujących się w pojedynczą osobę w celu nadania podatności na uzależnienie (lub, u innych osób, odporności).
Pozostałe 50% ryzyka uzależnienia wynika z szeregu czynników środowiskowych, występujących w ciągu całego życia, które wchodzą w interakcję ze składem genetycznym danej osoby, czyniąc ją w większym lub mniejszym stopniu podatną na uzależnienie. Z uzależnieniem wiąże się kilka rodzajów czynników środowiskowych, w tym stres psychospołeczny, ale zdecydowanie najpotężniejszym czynnikiem jest sama ekspozycja na narkotyk. Wykazano, że niektóre narkotyki, w szczególności nikotyna, zwiększają podatność na uzależnienie od innego narkotyku.3 Co więcej, istnieje coraz więcej dowodów na to, że pomimo szeregu zagrożeń genetycznych związanych z uzależnieniem w całej populacji, ekspozycja na wystarczająco wysokie dawki leku przez długi okres czasu może przekształcić osobę, która ma stosunkowo niższy ładunek genetyczny w uzależnionego.4
W ciągu ostatnich dwudziestu lat poczyniono znaczne postępy w identyfikacji zarówno dyskretnych obszarów mózgu, które są ważne w pośredniczeniu w zespole uzależnień, jak i rodzajów zmian na poziomie molekularnym i komórkowym, które leki indukują w tych regionach, aby leżały u podstaw kluczowych aspektów uzależnienia.1,5 Obwód, który otrzymał największą uwagę, określa się jako mezolimbiczny układ dopaminowy, który obejmuje neurony dopaminowe w brzusznym obszarze nakrywkowym (VTA) śródmózgowia unerwiającego średnie kolczaste neurony w jądrze półleżącym (NAc, część prążkowia brzusznego). Te neurony VTA unerwiają również wiele innych regionów przodomózgowia, w tym hipokamp, ciało migdałowate i korę przedczołową (PFC).
Sensowne jest rozważenie tych mechanizmów uzależnienia od narkotyków w tym tomie dotyczącym pamięci z trzech nakładających się powodów.6
- Po pierwsze, wszystkie adaptacje wywołane lekami można postrzegać jako typy „pamięci molekularnej lub komórkowej”: komórka nerwowa przechodząca takie zmiany jest inna w wyniku ekspozycji na lek, a zatem reaguje inaczej na ten sam lek, do innych leków lub do wielu innych bodźców.
- Po drugie, interesujące jest to, że wiele, a być może większość, rodzajów zmian, które są związane ze stanem uzależnienia (np. zmieniona transkrypcja genu, epigenetyka, plastyczność synaptyczna i całych komórek oraz morfologia neuronów i mechanizmy neurotroficzne) są również zaangażowane w tradycyjne formy „pamięci behawioralnej”, takie jak między innymi pamięć przestrzenna, warunkowanie strachowe i warunkowanie operanta.
- Po trzecie, wśród obszarów mózgu dotkniętych narkotykami są te, które są kluczowymi substratami neuronowymi dla pamięci behawioralnej, w tym hipokamp, ciało migdałowate i PFC. Zbiega się to z coraz większą świadomością, że niektóre z najważniejszych cech uzależnienia obserwowane klinicznie (np. Głód narkotykowy i nawrót) odzwierciedlają nieprawidłowości w tradycyjnych obwodach pamięci, z długotrwałymi wspomnieniami doświadczeń lekowych, które służą jako silne czynniki patologii uzależnień.4,7,8 Odwrotnie, regiony nagrody w mózgu (np. VTA i NAc) silnie wpływają na pamięć behawioralną.
Ten artykuł zawiera przegląd głównych typów zmian molekularnych i komórkowych, które występują w kilku regionach mózgu w zwierzęcych modelach uzależnienia, koncentrując się na jądrze półleżącym, dla którego większość informacji jest obecnie dostępna. Co ważne, można było w coraz większym stopniu potwierdzić niektóre z tych zmian u ludzi uzależnionych na podstawie badań mózgów pośmiertnych. Pomimo faktu, że narkotyki mają różne struktury chemiczne i działają na różne cele białkowe, uderzające jest to, że wiele znaczących adaptacji związanych z uzależnieniem jest wspólnych dla wielu, aw niektórych przypadkach wszystkich, nadużywania narkotyków i prawdopodobnie przyczynia się do wspólnych cech zespół uzależnień.4,9 W przeciwieństwie do tego, wiele innych adaptacji uzależnionych od narkotyków jest specyficznych dla danego leku i może pośredniczyć w bardziej unikalnych aspektach danego uzależnienia. Skupiamy się tutaj na narkotykach pobudzających i opiatowych, które dają bardziej dramatyczne efekty w modelach zwierzęcych w porównaniu z innymi lekami. Podkreślamy również ważne obszary przyszłych badań, które dodatkowo zwiększą naszą wiedzę na temat zespołów uzależnień i przełożą te postępy na ulepszone testy diagnostyczne i leczenie.
Mechanizmy transkrypcyjne i epigenetyczne
Wiedza, że uzależnieni mogą pozostać przy zwiększonym ryzyku nawrotu pomimo lat abstynencji, oznacza, że uzależnienie wiąże się z wywołanymi lekami zmianami w mózgu, które mogą być bardzo stabilne. Doprowadziło to kilka grup do rozważenia zmian w ekspresji genów jako ważnego składnika procesu uzależnienia (Rysunek 1). W związku z tym badania genów kandydujących lub badań całego genomu z wykorzystaniem mikromacierzy DNA, a ostatnio RNA-seq (wysokowydajne sekwencjonowanie ekspresjonowanych RNA) zidentyfikował liczne geny, których ekspresja jest zmieniona w danym regionie mózgu u uzależnionych modeli gryzoni i naczelnych oraz u ludzi uzależnionych (np. refs 10-17). Przykłady takich genów omówiono w kolejnych częściach tego przeglądu.
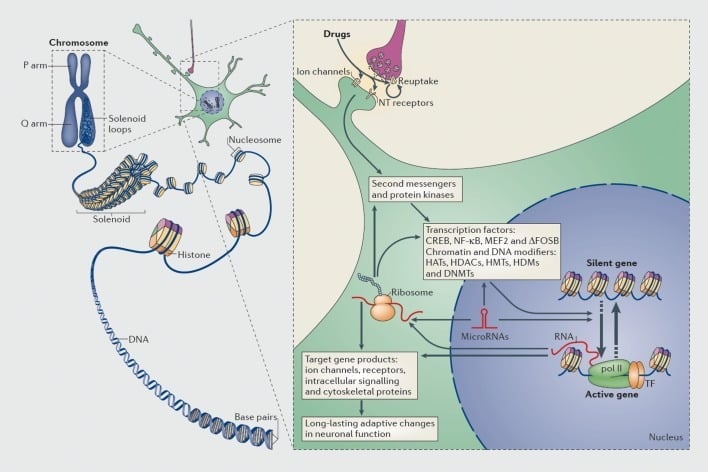
Mechanizmy regulacji transkrypcyjnej i epigenetycznej przez narkotyki. W komórkach eukariotycznych DNA organizuje się przez owinięcie wokół oktomerów histonów w celu utworzenia nukleosomów, które są następnie organizowane i skondensowane, tworząc chromosomy (lewa część). Tylko przez tymczasowe rozplatanie zagęszczonej chromatyny DNA określonego genu może zostać udostępnione maszynerii transkrypcyjnej. Narkotyki działają poprzez cele synaptyczne, takie jak mechanizmy wychwytu zwrotnego, kanały jonowe i receptory neuroprzekaźnika (NT), aby zmieniać wewnątrzkomórkowe kaskady sygnalizacyjne (prawa część). Prowadzi to do aktywacji lub hamowania czynników transkrypcyjnych (TF) i wielu innych celów jądrowych, w tym białek regulatorowych chromatyny (pokazanych grubymi strzałkami); szczegółowe mechanizmy biorące udział w regulacji synaptycznej białek regulatorowych chromatyny pozostają słabo poznane. Procesy te ostatecznie powodują indukcję lub represję poszczególnych genów, w tym genów niekodujących RNA, takich jak mikroRNA; zmieniona ekspresja niektórych z tych genów może z kolei dalej regulować transkrypcję genów. Proponuje się, że niektóre z tych indukowanych lekami zmian na poziomie chromatyny są wyjątkowo stabilne i tym samym leżą u podstaw długotrwałych zachowań, które definiują uzależnienie. CREB, białko wiążące element cykliczny reagujący na AMP; DNMT, metylotransferazy DNA; HAT, acetylotransferazy histonowe; HDAC, deacetylazy histonowe; HDM, demetylazy histonowe; HMT, metylotransferazy histonowe; MEF2, czynnik wzmacniający specyficzny dla miocytów 2; NF-kB, współczynnik jądrowy-KB; pol II, polimeraza RNA II. Reprodukcja z ref 44: Robison AJ, Nestler EJ. Transkrypcyjne i epigenetyczne mechanizmy uzależnienia. Nat Rev Neurosci. 2011; 12: 623-637.
Podobnie wiele rodzajów czynników transkrypcyjnych - białek, które wiążą się z regionami regulatorowymi genów, a tym samym zwiększają lub zmniejszają transkrypcję tych genów - odgrywa rolę w pośredniczeniu w długoterminowym wpływie narkotyków na ekspresję genów w mózgu. Wybitne przykłady obejmują CREB (białko wiążące element odpowiedzi cAMP), ΔFosB (czynnik transkrypcyjny z rodziny Fos), NFkB (czynnik jądrowy kB), MEF2 (czynnik wzmacniający miocyt-2) i receptory glukokortykoidowe, wśród wielu innych.5,10,18-22 Coraz bardziej możliwe było zrozumienie komórkowych szlaków sygnalizacyjnych, poprzez które narkotyki aktywują dany czynnik transkrypcyjny w mózgu i przyczynowo powiązano taką aktywację z genami docelowymi tego czynnika transkrypcyjnego oraz z określonymi behawioralnymi aspektami uzależnienia (zob. Rysunek 1). Postęp ten ilustruje rozważanie CREB i ΔFosB, które są najlepiej przebadanymi czynnikami transkrypcyjnymi w modelach uzależnień.
cAMP Białko wiążące element odpowiedzi
Aktywują narkotyki pobudzające i opiatowe CREB w kilku regionach mózgu ważnych dla uzależnienia, w tym w znacznym stopniu w NAc.23,24 Wiadomo, że CREB jest aktywowany w innych systemach przez cAMP, Ca2+i ścieżki czynników wzrostu,25 i nie wiadomo jeszcze, które z nich pośredniczy w jego aktywacji w NAc za pomocą narkotyków. Wykazano, że aktywacja leku CREB w NAc stanowi klasyczny mechanizm negatywnego sprzężenia zwrotnego, przy czym CREB służy do zmniejszenia wrażliwości zwierzęcia na satysfakcjonujące działanie tych leków (tolerancja) i do pośredniczenia w negatywnym stanie emocjonalnym podczas odstawienia leku (uzależnienie).18,26,27 Niedawno wykazano, że te działania zwiększają samopodawanie leku i nawrót choroby, prawdopodobnie w wyniku negatywnego wzmocnienia.28 Te działania CREB wydają się obejmować oba główne podtypy średnich kolczastych neuronów NAc, które wyrażają głównie D1 kontra D2 receptory dopaminy.24 ICo ciekawe, duża literatura wykazała, że CREB, działając w hipokampie i ciele migdałowatym, jest kluczową cząsteczką w pamięci behawioralnej.29-31 Ta szeroka rola w uzależnieniu i pamięci behawioralnej prawdopodobnie odzwierciedla fakt, że neurony są nasycone skończoną liczbą mechanizmów molekularnych, za pomocą których można dostosować się do stale zmieniającego się środowiska.
Docelowe geny dla CREB, które pośredniczą w tym fenotypie behawioralnym, zidentyfikowano w testach obejmujących cały genom, a także w bardziej wybranych wysiłkach.10,18,32 Jednym z przykładów jest peptyd opioidowy dynorphin: pobudzająca indukcja ekspresji dynorfiny w neuronach NAc, w której pośredniczy CREB, zwiększa aktywację dynorfiny receptorów opioidowych k na neuronach dopaminowych VTA, a tym samym hamuje transmisję dopaminergiczną do NAc i upośledza nagrodę.18 Wykazano, że kilka innych celów CREB jest ważnych dla indukowanej lekiem plastyczności synaptycznej, jak omówiono poniżej. Podczas gdy CREB jest także aktywowany w kilku innych regionach mózgu przez stymulanty i opiaty,23,24 mniej wiadomo na temat behawioralnych konsekwencji tego efektu i docelowych genów, przez które one występują. Podobnie mniej wiadomo o roli CREB w pośredniczeniu w działaniach innych narkotyków.19
ΔFosB
Ostra ekspozycja na praktycznie dowolny narkotyk wywołuje wszystkie czynniki transkrypcyjne z rodziny Fos w NAc i kilku innych regionach mózgu. Indukcja ta jest szybka, ale także bardzo przejściowa, a poziomy białka Fos powracają do normalnego poziomu w 8 do 12 godzin. Wyjątkowo wśród tych białek z rodziny Fos jest ΔFosB, skrócony produkt genu FosB, które dzięki swojej niezwykłej stabilności stopniowo gromadzą się w wyniku powtarzanego narażenia na lek i staje się dominującym białkiem Fos ulegającym ekspresji w tych warunkach.22,33 Ponadto, z powodu tej stabilności, poziomy ΔFosB utrzymują się przez tygodnie po odstawieniu leku. Taka przewlekła indukcja ΔFosB została wykazana dla praktycznie wszystkich leków nadużywanych34 i dla większości leków jest selektywny dla neuronów NAc typu Dl.34,35 Tak też było zademonstrowano u ludzi uzależnionych.35 Duża literatura wykazała, że taka indukcja ΔFosB w D1-neurony typu NAc zwiększają wrażliwość zwierzęcia na lek, a także naturalne nagrody i sprzyjają samopodawaniu leku, prawdopodobnie poprzez proces pozytywnego wzmocnienia (patrz refs 34 do 38). Co ciekawe, indukcja leku ΔFosB w NAc jest bardziej dramatyczna u dorastających zwierząt, czas większej podatności na uzależnienie,39 i wykazano, że jego indukcja przez nikotynę pośredniczy w podobnym do nikotyny wzmacnianiu nagrody za kokainę.40
Podobnie jak w przypadku CREB, liczne geny docelowe dla ΔFosB zidentyfikowano w NAc przez zastosowanie genu kandydującego i podejścia obejmującego cały genom.10,32 Podczas gdy CREB indukuje dynorfinę, ΔFosB ją hamuje, co przyczynia się do efektów pro-nagrody ΔFosB.38 Innym celem ΔFosB jest cFos: ponieważ ΔFosB gromadzi się z powtarzaną ekspozycją na lek, represjonuje c-Fos i przyczynia się do molekularnego przełączenia, dzięki czemu ΔFosB jest selektywnie indukowany w stanie przewlekłym leczonym lekiem.41 Wykazano, że wiele innych celów ΔFosB pośredniczy w zdolności pewnych nadużywanych leków do indukowania plastyczności synaptycznej w NAc i związanych z tym zmian w arborizacji dendrytycznej średnich kolczastych neuronów NAc, jak zostanie omówione poniżej.
Funkcjonalne konsekwencje indukcji ΔFosB w innych obszarach mózgu są mniej zrozumiałe, chociaż jej indukcja w korze oczodołowo-czołowej (OFC) została szczegółowo zbadana. W tym przypadku ΔFosB pośredniczy w tolerancji, która występuje w zaburzeniach kognitywnych zaburzających działanie kokainy podczas przebiegu przewlekłego narażenia, a ta adaptacja jest związana ze zwiększonym samopodawaniem kokainy.42,43
Testy obejmujące cały genom sugerują kilka potencjalnych genów docelowych, które pośredniczą w tych efektach.42 Pomimo wyjątkowych właściwości czasowych ΔFosB i wiedzy, że jest on indukowany w tradycyjnych obwodach pamięci (np. Hipokamp), nie przeprowadzono jeszcze eksploracji roli ΔFosB w pamięci behawioralnej, będącej interesującym tematem do przyszłych badań.
Mechanizmy epigenetyczne
W ostatnich latach badania transkrypcji posunęły się o krok dalej w kierunku epigenetyki44 (Patrz Rysunek 1), które można szeroko zdefiniować jako zmianę ekspresji genów, która występuje przy braku zmiany sekwencji DNA. Mechanizmy epigenetyczne kontrolują pakowanie DNA w jądrze komórkowym poprzez jego interakcje z histonami i wieloma innymi typami białek jądrowych, które łącznie zawierają chromatynę. Ekspresja genu jest kontrolowana przez stan tego opakowania poprzez kowalencyjną modyfikację histonów, innych białek i samego DNA. Jak tylko niektóre przykłady, acetylacja histonów ma tendencję do pobudzania aktywacji genów, metylacja histonów może promować aktywację lub represję genów w zależności od reszty Lys podlegającej tej modyfikacji, a metylacja DNA jest ogólnie związana z represją genów, chociaż pewne warianty metylacji ( np. 5-hydroksymetylacja) może być związana z aktywacją genu.
Epigenetyka jest atrakcyjnym mechanizmem, ponieważ w innych systemach, na przykład w biologii rozwojowej i nowotworowej, pewne modyfikacje epigenetyczne mogą być trwałe. Z tego powodu, epigenetyka była realizowana zarówno w modelach uczenia się i pamięci (np. refs 45-48), jak również w uzależnieniu;44,49 w obu systemach odnotowano głębokie zmiany w acetylacji i metylacji histonów oraz w metylacji DNA. Jako jeden przykład, metylotransferaza histonowa, G9a, jest zaangażowana w obie pamięci50 i uzależnienie.51,52 W modelach uzależnień, Ekspresja G9a jest obniżona w NAc w odpowiedzi na narkotyki pobudzające lub opiatowe i twykazano, że jego działanie poprawia nagradzające działanie tych leków.51,52 Co ciekawe, za hamowaniem kokainy G9a odpowiada atedFosB. G9a katalizuje dimetylację Lys9 histonu H3 (H3K9me2), głównego mediatora represji genów. Chip-chip lub ChIP-seq (immunoprecypitacja chromatyny, a następnie, odpowiednio, przez chipy promotora lub sekwencjonowanie o wysokiej przepustowości) zastosowano do uzyskania map genów w NAc, które wykazują zmienione H3K9me2 po ekspozycji na stymulant lub opiat.32,52,53 Nakładając te listy genów na listy zmian genów w całej genomie, oraz na mapy całego genomu wielu innych form modyfikacji epigenetycznych (np. Wiązanie ΔFosB, wiązanie CREB, inne modyfikacje histonów itp.),32,53 powinno być możliwe zidentyfikowanie coraz bardziej kompletnego zestawu genów, które są regulowane przez narkotyki i aby zrozumieć związane z tym mechanizmy epigenetyczne.
Inną formą regulacji epigenetycznej związanej z pamięcią i uzależnieniem jest wytwarzanie mikroRNA. Te małe, niekodujące RNA wiążą się z komplementarnymi regionami mRNA i tym samym tłumią ich translację lub indukują ich degradację. Delecja Argonauta, białka kluczowego dla przetwarzania miRNA, zmienia behawioralne odpowiedzi na kokainę, z wyraźnymi efektami obserwowanymi dla średnich kolczastych neuronów typu D1 w porównaniu z D2.54 Wykazano również, że kilka specyficznych miRNA jest regulowanych przez ekspozycję na lek i z kolei wpływa na reakcje behawioralne na leki (np. Refs 55,56). W przyszłych badaniach będzie ekscytujące, aby zidentyfikować cele mRNA tych miRNA i scharakteryzować, w jaki sposób wpływają one na proces uzależnienia.
Plastyczność synaptyczna
Wykazano, że te same ogólne typy modyfikacji synaptycznych w synapsach glutaminergicznych, które biorą udział w hipokampie i ciele migdałowatym w pamięci behawioralnej (patrz inne artykuły w tym numerze), występują podobnie w regionach nagradzających mózg w modelach uzależnień i są ważne w pośredniczeniu proces uzależnienia.57,58 Taka indukowana lekiem plastyczność synaptyczna została opisana w kilku regionach mózgu, jednak koncentrujemy się tutaj na NAc, gdzie większość badań skupia się do tej pory (Rysunek 2).
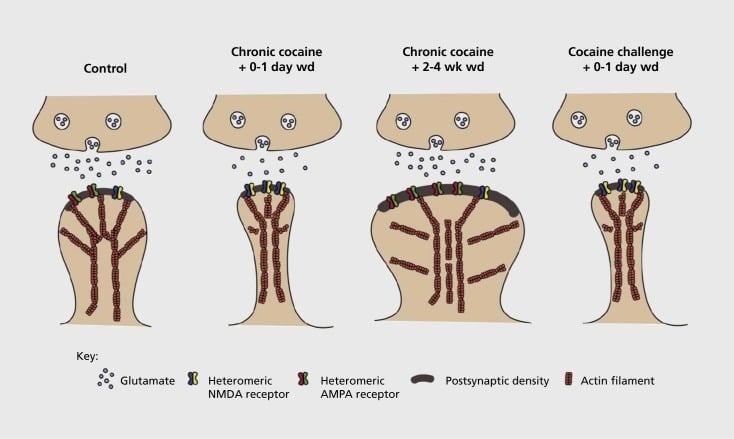
Model związanej z uzależnieniem plastyczności synaptycznej i strukturalnej w jądrze półleżącym (NAc). Chroniczna ekspozycja na kokainę powoduje zależną od czasu i przejściową reorganizację α-amino-3-hydroksy-5-metylo-4-kwasu izoksazolepropionowego (AMPA) i receptorów kwasu glutaminowego N-metylo-D-asparaginowego (NMDA) w ośrodku NAc synapsy neuronu kolczastego (MSN), jak również zmiany strukturalne w głowie kręgosłupa MSNs NAc, które korelują z odmiennymi formami plastyczności synaptycznej. Na przykład, przewlekła kokaina indukuje ekspresję powierzchniową receptorów NMDA, cichą formację synaps i długotrwałą depresję (LTD) we wczesnych punktach czasowych odstawienia. Podczas dłuższego wycofywania (wd) te zmiany synaptyczne odwracają się, czego wynikiem jest zwiększona ekspresja powierzchniowych receptorów AMPA, konsolidacja synapsy w kręgosłup w kształcie grzyba i długotrwałe wzmocnienie (LTP). Efekty te szybko powracają ponownie po ekspozycji na prowokującą dawkę kokainy, prowadząc do restrukturyzacji kręgosłupa w cienkie kolce i obniżenie siły synaptycznej.
Początkowe eksperymenty wykazały, że powtarzająca się ekspozycja na narkotyki pobudzające wywołuje stan przypominający LTD (długotrwała depresja) w synapsach glutaminergicznych w NAc.59 Jednak nowsze prace wykazały, że taka plastyczność jest wysoce zależna od czasu, ponieważ LTD występuje wcześniej po ostatniej ekspozycji na kokainę, przekształcając się bardziej w stan LTP (długotrwałe wzmocnienie), jak po dłuższych punktach czasowych odstawienia.60,61 Ta praca, która do tej pory była przeprowadzana głównie z wykorzystaniem podanego przez badacza - w przeciwieństwie do leków podawanych samodzielnie - określiła potrzebę bardziej systematycznych badań w modelach samopodawania, które śledzą formy plastyczności synaptycznej występujące w synapsach glutaminergicznych w NAc w trakcie szczegółowego przebiegu czasowego od nabycia samodzielnego podania do jego utrzymania, przez różne czasy wycofania i wymierania oraz w odpowiedzi na bodźce wywołujące nawrót. Dotychczasowe prace określiły także niektóre mechanizmy molekularne, które przyczyniają się do indukowanej lekiem plastyczności synaptycznej, w tym do przemieszczania receptorów AMPA do synapsy, być może częściowo za pośrednictwem CaMKII (Ca2+/ kinaza białkowa zależna od kalmoduliny II) fosforylacja pewnych podjednostek receptora AMPA, jak również zmieniona ekspresja podjednostek receptora AMPA (np. 60,62-65, Rysunki 2 i 3). Rola CREB i ΔFosB jest związana z tymi zjawiskami, jak również z towarzyszącymi im zmianami w morfologii synaps glutaminergicznych (patrz poniżej). Na przykład GluAl jest celem dla CREB w NAc, gdzie GluA2 i CaMKII są obydwoma celami ΔFosB w tym regionie mózgu .35,36,66,67 W przyszłości ważne będzie powiązanie konkretnych adaptacji ze zmianami funkcji synaptycznej zależnymi od czasu i cechami behawioralnymi uzależnienia.
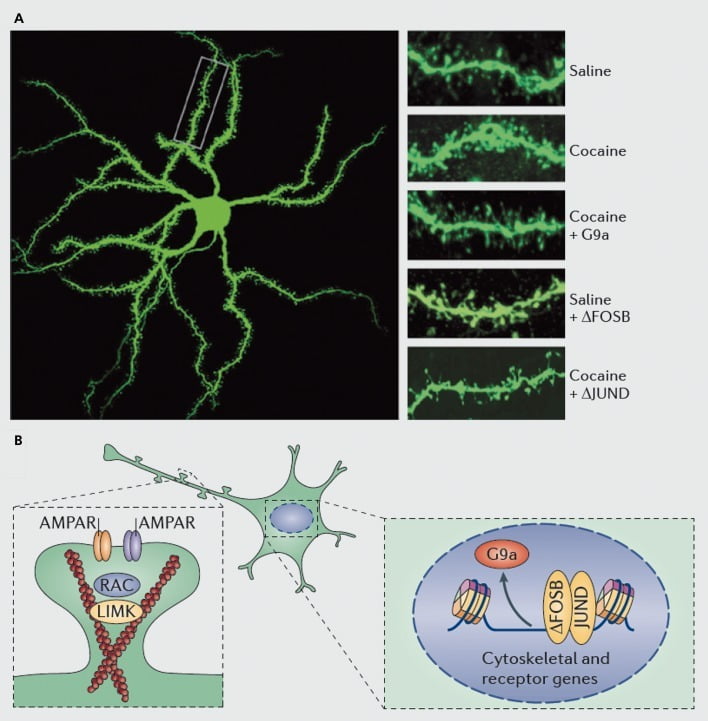
Molekularne mechanizmy leżące u podstaw indukcji kokainą kolców dendrytycznych na średnich neuronach kolczastych jądra półleżącego (NAc). A) pokazuje wywołany kokainą wzrost liczby kręgosłupa dendrytycznego, który może być blokowany przez wirusową nadekspresję G9a lub JunD (antagonista transkrypcji za pośrednictwem AP1) lub naśladowany przez wirusową nadekspresję FosB. B) Wykazano, że istotną rolę odgrywają regulacja przepływu receptorów AMPA (AMPAR) i cytoszkieletu aktynowego (po lewej), a także regulacja transkrypcji receptorów glutaminianu i białek regulatorowych aktyny (np. Za pośrednictwem ΔFosB, po prawej) w pośredniczeniu w regulowaniu przez kokainę gęstości dendrytycznej kręgosłupa NAc. UMK, kinaza domeny LIM; RAC, substrat toksyny botulinowej C3 związany z Ras.
Nowe narzędzia eksperymentalne umożliwiają po raz pierwszy z coraz większą precyzją określić, które poszczególne obwody wykazują te formy plastyczności synaptycznej i jakie nieprawidłowości behawioralne pośredniczą. Na przykład tskorupa i podregiony rdzeniowe NAc wykazują różnice w plastyczności synaptycznej indukowanej lekami, podobnie jak średnie neurony kolczaste typu D1-w porównaniu z D2 w każdym podregionie.60,63,64,67 Podobnie eksperymenty optogenetyczne dostarczyły nowych informacji na temat wkładu konkretnej formy plastyczności synaptycznej (np. LTD) w określonych populacjach synaps glutaminergicznych w NAc, na przykład tych pochodzących z przyśrodkowego PFC w porównaniu z podstawno-bocznym ciałem migdałowatym w porównaniu z podrzędem brzusznym (główne wyjście hipokampa).68-70 Ostatecznie konieczne będzie nałożenie indukowanych lekami adaptacji molekularnych w każdym z tych neuronów aferentnych z adaptacjami specyficznymi dla synaps, które występują w ich dendrytach postsynaptycznych, aby uzyskać pełne zrozumienie, w jaki sposób narkotyki modyfikują obwody mózgu, aby sterować określonymi aspektami stan uzależnienia. To przedsięwzięcie będzie wymagało większego uznania plastyczności wywołanej lekami w synapsach hamujących w tych samych obszarach mózgu, obszarze, któremu jak dotąd poświęcono bardzo mało uwagi.65
Plastyczność całych komórek
Podczas gdy większość badań dotyczących zmian neurofizjologicznych w neuronach w zjawiskach nadużywania narkotyków, jak w zjawiskach uczenia się i pamięci, koncentruje się na plastyczności synaptycznej, istnieje coraz więcej dowodów na znaczenie plastyczności całych komórek. Plastyczność całych komórek, określana również jako plastyczność homeostatyczna,71 obejmuje zmiany w wewnętrznej pobudliwości całej komórki nerwowej w sposób, który nie jest specyficzny dla synapsy. Biorąc pod uwagę, że pewne cechy uzależnienia od narkotyków wiążą się ze zwiększoną lub zmniejszoną wrażliwością na lek, ma to sens, że zwiększona lub zmniejszona pobudliwość elektryczna niektórych komórek nerwowych przyczynia się do tych adaptacji behawioralnych.5
Połączenia najlepiej znanym przykładem plastyczności całych komórek na lek nadużywający jest zdolność przewlekłych opiatów do zwiększenia wewnętrznej pobudliwości neuronów noradrenergicznych w locus coeruleus (LC).72 Ta zwiększona pobudliwość jest pośredniczona przez CREB i jego indukcję pewnych izoform cyklazy adenylowej, które napędzają zwiększone odpalanie neuronów LC być może przez indukcję kanałów Na +.72-75 Ta nadpobudliwość neuronów LC reprezentuje klasyczny mechanizm tolerancji i uzależnienia i napędza niektóre objawy i objawy odstawienia opiatów. Co ciekawe, CREB pośredniczy w podobnej formie plastyczności całych komórek w średnich neuronach kolczystych NAc, które również stają się nadpobudliwe przez chroniczną ekspozycję na leki nadużywające poprzez CREB.76 Dlatego w przyszłych badaniach kluczowe będzie zrozumienie, w jaki sposób CREB-pośrednia plastyczność synaptyczna synaps glutaminergicznych na średnich neuronach kolczystych NAc65,66 podsumowuje zależną od CREB wewnętrzną nadpobudliwość tych neuronów76 kontrolować behawioralne cechy uzależnienia.
Innym przykładem plastyczności całych komórek w modelach uzależnień jest nadpobudliwość neuronów dopaminowych VTA, która występuje po długotrwałej ekspozycji na leki opioidowe abusiRysunek 4).77,78 Ta adaptacja, która została powiązana ze zmianami morfologicznymi w tych komórkach nerwowych (patrz następna sekcja), nie jest pośredniczona przez CREB, lecz osiągnięta zamiast tego poprzez regulację neurotroficznych kaskad sygnalizacyjnych, jak opisano poniżej.

Działający model przewlekłych adaptacji indukowanych morfiną w neuronach dopaminowych brzusznej strefy nakrywkowej (VTA). Przewlekła morfina zmniejsza wielkość dopaminy VTA (DA), ale zwiększa pobudliwość neuronów, podczas gdy transmisja dopaminy do jądra półleżącego zmniejsza się. Efekt netto morfiny jest mniej wrażliwym szlakiem nagrody, tj. Tolerancją nagrody. Obniżenie poziomu sygnalizacji IRS2-AKT w VTA pośredniczy w działaniu przewlekłej morfiny na wielkość somy i pobudliwość elektryczną; wpływ na pobudliwość jest pośredniczony przez obniżone prądy kwasu γ-aminomasłowego (GABA) A i tłumienie ekspresji kanału K '. Indukowana morfiną regulacja aktywności mTORC2 w VTA jest kluczowa dla tych indukowanych morfiną adaptacji morfologicznych i fizjologicznych, jak również dla tolerancji nagrody. W przeciwieństwie do mT0RC2, przewlekła morfina zwiększa aktywność mTORCI, co nie wpływa na te indukowane morfiną adaptacje. BDNF, czynnik neurotroficzny pochodzenia mózgowego; IRS, substancja receptora insuliny; mTORC, kompleks mTOR; AKT, kinaza białkowa B Reprodukcja z ref 77
Plastyczność morfologiczna i mechanizmy neurotroficzne
Coraz więcej dowodów, w większości z badań hipokampowych i mózgowych neuronów korowych, wykazało, że zmiany plastyczności synaptycznej są związane ze zmianami morfologicznymi w synapsach. Na przykład LTD i generowanie cichych synaps wiąże się z tworzeniem cienkich lub krótkich kolców dendrytycznych, podczas gdy LTP jest związany z większymi kolcami w kształcie grzybów.79,80 Jest zatem interesujące, że dziedzina nadużywania narkotyków koncentruje się na wywołanych przez narkotyki zmianach w kolcach dendrytycznych przez ponad 15 lat. Chroniczna ekspozycja na narkotyki pobudzające zwiększają gęstość dendrytyczną kręgosłupa średnich neuronów kolczystych NAc, zmianę, która dominuje dla neuronów typu Dl.67,81,82 Indukcja kolców była w większości związana z uwrażliwionymi reakcjami behawioralnymi na te leki, chociaż niektóre dowody są sprzeczne z tym poglądem.
Jednakże, podobnie jak w przypadku badań plastyczności synaptycznej, potrzeba znacznie więcej pracy, aby systemowo zdefiniować zmiany w kolcach dendrytycznych, które występują podczas przebiegu samopodawania leku, odstawienia i nawrotu. Sdotychczasowe badania dotyczące narkotyku prowadzonego przez badacza i samodzielnego podawania sugerują bardzo różne zmiany kręgosłupa występujące w różnych punktach czasowych odstawienia iw skorupie NAc w stosunku do podregionów podstawowych.83-86 Ważne będzie również określenie precyzyjnych mechanizmów molekularnych, dzięki którym kokaina lub inny stymulant wywołuje te zależne od czasu i specyficzne dla komórek efekty. Wykazano, że ΔFosB jest zarówno niezbędny, jak i wystarczający do indukcji niedojrzałych kolców na neuronach NAc typu Dl.35,51,67 Taka regulacja występuje w połączeniu z regulacją kokainy i ΔFosB kilku białek znanych z kontrolowania reorganizacji cytoszkieletu aktynowego. Jako jeden przykład, regulacja transkrypcyjna kilku guaninowych czynników wymiany nukleotydów i białek aktywujących GTPazę wywołuje Rac1, małą GTPazę, dla przejściowego zmniejszenia aktywności w odpowiedzi na każdą ekspozycję na kokainę, i wykazano takie pulsacyjne spadki aktywności Rac1, stosując kontrolę optogenetyczną Rac1, aby pośredniczyć w indukcji niedojrzałych kolców.87 Te efekty Racl przypuszczalnie występują poprzez kontrolę kofiliny i innych białek regulatorowych aktyny, które, jak wykazano, pośredniczą w regulacji wzrostu kokainy przez kokainę.87,88 Należy jednak podkreślić, że jest to tylko jeden ze szlaków zaangażowanych w regulację niedojrzałych kolców przez kokainę, ponieważ wykazano, że kilka innych białek również odgrywa istotną rolę, w tym CDK5 (kinaza zależna od cyklin-5), CaMKII, NFkB , MEF2, CREB, G9a i DNMT3 (usuwanie metylotransfera DNA 3a), żeby wymienić tylko kilka.20,21,35,51,67,89,90 Co ciekawe, regulacja kokainy kilku z tych genów, w tym indukcja CDK5, CaMKII i NFkB oraz represja G9a, odbywa się również za pośrednictwem ΔFosB.20,35,51,91
Zaskakująco, leki uzależniające od opiatów wywierają odwrotny skutek i zmniejszają gęstość dendrytyczną kręgosłupa średnich neuronów kolczystych NAc.81 Niewiele wiadomo na temat behawioralnych konsekwencji tej adaptacji i związanych z nią mechanizmów molekularnych. To zjawisko jest jednak zaskakujące, biorąc pod uwagę, że CREB i ΔFosB są indukowane zarówno przez stymulanty, jak i opiaty, i oba są zaangażowane w indukowaną przez stymulanty indukcję gęstości dendrytycznej kręgosłupa NAc. Rodzi to pytanie, w jaki sposób opiaty tłumią gęstość kręgosłupa NAc pomimo indukcji tych czynników.
Inną główną formą plastyczności morfologicznej obserwowaną w modelach nadużywania narkotyków jest fizyczna redukcja wielkości komórek somatycznych neuronów dopaminowych VTA indukowana przez przewlekłe podawanie opiatów.77,92,93 Podobna adaptacja występuje w odpowiedzi na kannabinoidy.94 To kurczenie się neuronów dopaminowych VTA, które występuje przy samo-podawaniu opiatów93 i został udokumentowany u osób uzależnionych od heroiny zbadanych pośmiertnie,77 wydaje się pośredniczyć w tolerancji nagrody i wiąże się ze zmniejszonym uwalnianiem dopaminy w NAc. Znaczące dowody wskazują obecnie, że to zmniejszenie wielkości komórek somatycznych jest zależne od supresji opiatowej ekspresji neurotroficznego czynnika mózgowego (BDNF) w tych neuronach. Bezpośrednio powiązaliśmy to indukowane opiatem wycofanie wsparcia BDNF i kurczenie się neuronu VTA ze zmniejszoną aktywnością dalszych kaskad sygnalizacyjnych BDNF w neuronach dopaminowych VTA, szczególnie zmniejszoną aktywność IRS2 (substrat receptora insuliny-2), AKT (seryna-treonina kinaza) i TORC2 (cel rapamycyny-2, który jest niewrażliwy na rapamycynę).77,93 Jak również wspomniano wcześniej, powiązaliśmy tę redukcję sygnału BDNF bezpośrednio ze zwiększoną pobudliwością, którą indukuje morfina w tych neuronach.77,78 Rzeczywiście, zmniejszona wielkość komórek somatycznych i zwiększona pobudliwość są ściśle powiązane, ponieważ indukcja jednego prowadzi do drugiego i odwrotnie. Ta kontrola nad pobudliwością komórki wiąże się z tłumieniem K+ kanały i GABAA prąd w tych neuronach.
Ta rola BDNF w kontrolowaniu odpowiedzi morfiny na poziomie VTA kontrastuje z jej bardzo odmiennym zaangażowaniem w działania kokainy i innych stymulantów. Stymulanty indukują sygnalizację BDNF do NAc, efekt ze względu na zwiększoną miejscową syntezę BDNF, jak również zwiększone uwalnianie z kilku regionów aferentnych.95 Co więcej, wykazano, że zwiększona sygnalizacja BDNF w NAc, ale nie w VTA, promuje działanie behawioralne tych leków, w tym ich samopodawanie.95,96 Odwrotna regulacja sygnalizacji BDNF w szlaku VTA-NAc przez opiaty i stymulanty stwarza możliwość, że takie różnice pośredniczą w przeciwnej regulacji kolców dendrytycznych NAc przez leki, co jest obecnie przedmiotem badań.
Przyszłe kierunki
Powyższy opis podkreśla ogromny postęp, jaki dokonał się w zrozumieniu molekularnych i komórkowych adaptacji, które występują w regionach nagradzania mózgu w odpowiedzi na powtarzające się narażenie na narkotyki i powiązanie indywidualnych adaptacji z pewnymi behawioralnymi cechami zespołów uzależnień w modelach zwierzęcych . Pomimo tych postępów pozostają poważne pytania. Większość naszej obecnej wiedzy skupia się na VTA i NAc, a znacznie mniej informacji dostępnych jest na temat innych kluczowych obszarów mózgu limbicznych, które są również kluczowe dla uzależnienia od narkotyków. Ponadto wszystkie eksperymentalne demonstracje przyczynowej roli adaptacji molekularno-komórkowej w zachowaniu związanym z narkotykami manipulowały pojedynczymi adaptacjami pojedynczo. Manipulowanie wieloma adaptacjami w tym samym czasie jest oczywiście znacznie trudniejsze, ale jest również niezbędne, ponieważ wiemy, że leki wytwarzają dużą liczbę różnych rodzajów zmian nawet w obrębie pojedynczych neuronów, co prawdopodobnie sumuje się w skomplikowane sposoby wpływania na zachowanie. Takie podejście do biologii systemów będzie miało kluczowe znaczenie dla ostatecznego złamania biologicznych podstaw uzależnienia. Wreszcie, wysiłki zmierzające do zrozumienia molekularno-komórkowych mechanizmów wspomnień związanych z uzależnieniem znajdują się w punkcie, w którym wszystkie inne wysiłki zmierzające do zrozumienia biologicznych podstaw pamięci behawioralnej teraz się zmagają: nasza zdolność do powiązania zjawisk biologicznych ze złożoną pamięcią behawioralną pozostaje niezwykle trudna. Pokonanie tego podziału stanowi prawdopodobnie największe wyzwanie w neuronaukach.
Wybrane skróty i akronimy
- nac
- jądro półleżące
- CREB
- białko wiążące element odpowiedzi cAMP
- ΔFosB
- czynnik transkrypcyjny z rodziny Fos
- VTA
- brzuszny obszar nakrywki
- AMPA
- kwas α-amino-3-hydroksy-5-metylo-4-izoksazolepropionowy
- LTD
- długotrwała depresja
- LTP
- długoterminowe zabezpieczenie
- BDNF
- neurotroficzny czynnik mózgowy
- NKkB
- czynnik jądrowy kB
LITERATURA