OBSERVAȚII: O analiză a șefei Institutului Național pentru Abuzul de Droguri, Nora Volkow, și a echipei sale. Această revizuire listează cele 3 disfuncții neurobiologice majore implicate în toate dependențele. Pur și simplu menționate sunt: a) Desensibilizarea: un răspuns amuzant de plăcere din cauza scăderii semnalizării dopaminei; b) Sensibilizarea: răspunsul sporit al dopaminei la indicii de dependență, declanșatoare sau stres; și c) ipofonalitatea: circuite de autocontrol slăbite din cauza scăderii volumului și funcționării cortexului frontal. Aceleași modificări ale creierului au fost descrise de Societatea Americană pentru Medicina Dependenței (ASAM) noua definiție a dependenței lansat în august, 2011.
Volkow ND, Wang GJ, Fowler JS, Tomasi D, Telang F, Baler R. Bioessays. 2010 Sep; 32 (9): 748-55.
Institutul Național pentru Abuzul de Droguri, NIH, Bethesda, MD 20892, SUA.
Abstract
Pe baza constatărilor imagistice ale creierului, prezentăm un model conform căruia dependența apare ca un dezechilibru în prelucrarea și integrarea informațiilor între diferite circuite și funcții ale creierului.
Disfuncțiile reflectă:
(a) sensibilitatea scăzută a circuitelor de recompensare,
(b) sensibilitatea sporită a circuitelor de memorie la așteptările condiționate de droguri și indicii de droguri, reactivitatea stresului și starea de spirit negativă,
(c) și un circuit de control slăbit.
Deși experimentarea inițială cu un drog de abuz este în mare parte un comportament voluntar, utilizarea continuă a drogurilor poate afecta în cele din urmă circuitele neuronale din creier care sunt implicate în voința liberă, transformând consumul de droguri într-un comportament automat compulsiv. Abilitatea medicamentelor de dependență de a coopta semnalele neurotransmițătorilor între neuroni (inclusiv dopamina, glutamatul și GABA) modifică funcția diferitelor circuite neuronale, care încep să se încurce în diferite stadii ale unei traiectorii de dependență. La expunerea la medicament, indicii de droguri sau stresul aceasta duce la hiperactivarea nerestricționată a circuitului de motivație / conducere care are ca rezultat consumul compulsiv de drog care caracterizează dependența.
Introducere
Ultimii 25 ani de cercetări în domeniul neuroștiințelor au adus dovezi că dependența este o boală a creierului, oferind un argument puternic pentru menținerea acelorași standarde de îngrijire medicală pentru persoanele dependente ca cele care sunt comune altor boli cu impact public major, cum ar fi Diabet. Într-adevăr, cercetarea privind dependența a început să descopere secvența de evenimente și sechele de lungă durată care pot rezulta din abuzul persistent al unei substanțe dependente. Aceste studii au arătat modul în care consumul repetat de droguri poate viza moleculele cheie și circuitele creierului și, eventual, poate perturba procesele de ordine superioară care stau la baza emotiilor, cunoașterii și comportamentului. Am aflat că dependența se caracterizează printr-un ciclu extins de disfuncție în creier. Insuficiența începe, de obicei, în zonele evolutiv mai primitive ale creierului care procesează recompensa și apoi se îndreaptă către alte zone responsabile de funcții cognitive mai complexe. Astfel, pe lângă recompensă, indivizii dependenți pot experimenta perturbări grave ale învățării (memorie, condiționare, obișnuință), funcția executivă (inhibarea impulsului, luarea deciziilor, satisfacția întârziată), conștientizarea cognitivă (interocepție) și chiar emoțională funcții.
Desenând în mare măsură din rezultatele studiilor imagistice ale creierului care utilizează tomografie cu emisie de pozitroni (PET), introducem circuitele cheie ale creierului care sunt afectate de abuzul cronic de droguri și apoi prezentăm un model coerent, conform căruia dependența apare ca rezultatul net dezechilibrat procesarea informațiilor în și între aceste circuite. O înțelegere aprofundată a acestor procese graduale adaptive (neuroplastice) ale creierului și a factorilor de vulnerabilitate biologică și de mediu care le influențează probabilitatea este esențială pentru dezvoltarea unor abordări mai eficiente de prevenire și tratament pentru combaterea dependenței.
Dificultăți mari, dar scurte, de dopamină sunt necesare pentru dependență
Dependența este, în primul rând, o boală a sistemului de recompense al creierului. Acest sistem folosește neurotransmițătorul dopamină (DA) ca monedă principală pentru a transmite informații. Brain DA joacă un rol cheie în procesarea informațiilor despre sănătate [1, 2], care se află în centrul capacității sale de a reglementa sau de a influența recompensa [3, 4], așteptarea recompensei [5], motivația, emoțiile și sentimentele de plăcere. Eliberarea tranzitorie a DA în striatul ventral al creierului este un eveniment necesar, deși insuficient, în procesele complexe care generează senzația de recompensă: creșterea DA apare în mod pozitiv legată de intensitatea „ridicată” pe care o experimentează subiecții. Răspunsurile condiționate sunt obținute numai atunci când DA este eliberată în mod repetat ca aceste supratensiuni tranzitorii, ascuțite, ca răspuns la droguri sau la indicii asociate medicamentului.
Interesant este că, direct sau indirect, toate medicamentele de dependență funcționează prin declanșarea unor creșteri exagerate dar tranzitorii ale DA extracelulare într-o regiune cheie a sistemului de recompensă (limbic)6, 7], în mod specific, în nucleul accumbens (Nac) situat în striatum ventral. Astfel de supratensiuni DA se aseamănă și, în unele cazuri, depășesc cu mult, creșterile fiziologice declanșate de stimuli natural plăcuți (de obicei menționați ca întăriri sau recompense naturale). Asa cum ne-am fi asteptat, studiile de imagistica a creierului uman folosind tomografie cu emisie de pozitroni (PET), au aratat clar ca DA creste indusa de diferite clase de droguri (de exemplu,. stimulente (Fig. 1A), [8, 9], nicotină [10] și alcool [11]) în striatum ventral, sunt legate de experiența subiectivă a euforiei (sau ridicată) în timpul intoxicării [12, 13, 14]. Deoarece studiile privind PET pot fi realizate la subiecți umani treji, este de asemenea posibil să se traseze relația dintre rapoartele subiective ale efectelor medicamentului și schimbările relative ale nivelurilor DA. Majoritatea studiilor au arătat că cei care manifestă cea mai mare DA cresc după expunerea la medicamente [amfetamină, nicotină, alcool, metilfenidat (MPH)] prezintă, de asemenea, cea mai intensă intensitate sau euforie (Fig. 1B).
Studiile pe animale și la oameni au demonstrat că viteza cu care un medicament intră, acționează și părăsește creierul (de exemplu profilul său farmacocinetic) joacă un rol fundamental în determinarea efectelor sale de întărire. Într-adevăr, fiecare medicament de abuz a cărui farmacocinetică creierului a fost măsurată cu PET (cocaină, MPH, metamfetamină și nicotină) prezintă același profil atunci când administrarea este intravenoasă, de exemplu, nivelele de vârf în creierul uman sunt atinse în intervalul 10 min (Fig. 2A) și această absorbție rapidă este asociată cu "înaltă" (Fig. 2B). Bazându-se pe această asociere, rezultă că asigurarea faptului că un medicament dependent de admitere intră în creier cât mai încet ar trebui să fie o modalitate eficientă de a minimiza potențialul său de întărire, de aici și de responsabilitatea acestuia privind abuzul. Am proiectat un experiment pentru a testa exact această ipoteză cu medicamentul stimulent MPH, care, ca și cocaina, mărește DA prin încetinirea transportului înapoi în neuronul presinaptic (de exemplu prin blocarea transportoarelor DA), mărind astfel semnalul DA. Într-adevăr, am constatat că, în timp ce administrarea intravenoasă a MPH este adesea euforigenă, MPH administrată oral, care crește, de asemenea, DA în striatum [15], dar cu 6-la 12 ori mai lent farmacocinetica, nu este în mod obișnuit percepută ca armare [16, 17]. Astfel, eșecul MPH oral - sau amfetamină [18] pentru că - pentru a induce un maxim este probabil reflectarea absorbției lentă în creier [19]. Prin urmare, este rezonabil să se propună existența unei corelații strânse între rata la care un drog de abuz pătrunde în creier, ceea ce determină viteza la care DA crește în striatum ventral și efectele sale de întărire [20, 21, 22]. Cu alte cuvinte, pentru ca un medicament să exercite efecte de întărire, trebuie să ridice brusc DA. De ce ar trebui să fie așa?
Pe baza magnitudinii și duratei arderii neuronale, semnalizarea DA poate lua una din cele două forme de bază: faza sau tonic. Semnalarea fazică este caracterizată de o amplitudine ridicată și de o ardere de scurtă durată, în timp ce semnalarea tonică are în mod obișnuit o amplitudine scăzută și o durată mai lungă sau mai durabilă. Distincția este importantă deoarece se dovedește că semnalarea DA fazică este necesară pentru medicamentele de abuz pentru a induce "răspunsuri condiționate", care este una dintre neuroadaptările inițiale care urmează expunerii la stimuli de întărire (inclusiv un medicament). Unul dintre aspectele distinctive care leagă semnalizarea fazică cu condiționarea este implicarea D2R și a glutamatului n-metil-d- receptori ai acidului aspartic (NMDA)23]. Pe de altă parte, semnalul tonic DA joacă un rol în modularea memoriei de lucru și a altor procese executive. Unele dintre caracteristicile care disting acest mod de semnalizare de tipul fazic sunt faptul că acesta funcționează în principal prin receptori DA cu afinitate inferioară (receptori DA D1). Cu toate acestea, și în ciuda diferitelor mecanisme implicate, expunerea prelungită la medicament (și schimbările în semnalul tonic DA prin acești receptori) a fost, de asemenea, implicată în modificările neuroplastice care în cele din urmă au ca rezultat condiționarea [25] prin modificarea receptorilor de glutamat NMDA și alfa-amino-3-hidroxil-5-metil-4-izoxazon-propionat (AMPA)24].
Dovezile indică faptul că creșteri induse de droguri abrupte în arderea celulelor DA fiziologice DA mimice. Acest lucru explică de ce utilizarea cronică a unei substanțe dependente poate determina reacții atât de puternice condiționate de droguri în sine, de așteptările lor și de nenumăratele indicii (oameni, lucruri și locuri) asociate cu utilizarea lor. Cu toate acestea, în timp ce efectele acute de întărire a medicamentelor de abuz care depind de creșteri ale DA atât de rapide sunt probabil "necesare" pentru dezvoltarea dependenței, ele nu sunt în mod clar "suficiente". Expunerea repetată la medicament cauzează modificări ale funcției creierului DA deoarece ele rezultă din neuroadaptările secundare în alte sisteme de neurotransmițători (de exemplu glutamat [26] și poate, de asemenea, acidul γ-aminobutiiric (GABA)) care, în cele din urmă, afectează circuitele cerebrale suplimentare modulate de DA. Aceste circuite sunt în centrul secțiunilor următoare.
Abuzul de droguri cronice reglementează receptorii dopaminergici și producția de dopamină: "înaltă" este blocată
Faptul că consumul de droguri trebuie să devină cronic înaintea dependenței este un indiciu clar că boala este predestinată, la persoanele vulnerabile, de perturbațiile repetate ale sistemului de recompense. Aceste perturbări pot duce la neuroadaptări în multe alte circuite (motivație / conducere, control inhibitor / funcție executivă și memorie / condiționare) care sunt, de asemenea, modulate de DA [27]. Printre neuro-adaptările care au fost raportate în mod constant la subiecții dependenți sunt reducerile semnificative ale nivelurilor receptorilor D2R (afinitate ridicată) și în cantitatea de DA eliberată de celule DA [28] (Fig. 3). Este important faptul că aceste deficite sunt asociate cu o activitate metabolică regională redusă în zonele cortexului prefrontal (PFC) care sunt critice pentru performanța executivă corespunzătoare (de exemplu gingularul cingular anterior (CG) și cortexul orbitofrontal (OFC)) (Fig. 4A). Această observație ne-a determinat să presupunem că acesta poate fi unul dintre mecanismele care conectează întreruperea indusă de medicament în semnalizarea DA cu administrarea compulsivă a medicamentului și lipsa controlului asupra consumului de droguri care caracterizează dependența [29]. De asemenea, starea hipodopaminergică rezultată ar explica sensibilitatea scăzută a unei persoane dependente la recompensele naturale (de exemplu, hrană, sex etc.) și perpetuarea consumului de droguri ca mijloc de compensare temporară a acestui deficit [30]. Un corolar important al acestei cunoașteri este că abordarea acestor deficite (prin creșterea nivelului striatal al D2R și creșterea eliberării DA în striatum și în regiunile prefrontale) ar putea oferi o strategie clinică pentru ameliorarea impactului dependenței [31]. Există dovezi că inversarea stării hipodopaminergice poate avea un impact pozitiv asupra comportamentelor legate de abuzul de substanțe? Raspunsul este da. Studiile noastre arată că, forțând supraproducția D2R, adânc în sistemul de recompensă al șobolanilor experimentați cu cocaină sau alcool, putem reduce în mod semnificativ autoadministrarea cocainei [31] sau alcool [32], respectiv. În plus, la rozătoare, precum și la utilizatorii umani de metamfetamină [33], un nivel redus al striatalului de D2R este, de asemenea, asociat cu impulsivitate, iar la rozătoare prezice modele compulsive de autoadministrare a medicamentului (a se vedea mai jos).
Studiile de imagistică au arătat de asemenea că, la om, dependența este asociată cu o scădere a eliberării DA în striatum ventral și în alte regiuni ale striatumului și în răspunsuri plăcute la medicament la utilizatorii de droguri activi și detoxifiați (Fig. 5) [34]. Aceasta a fost o constatare neașteptată, deoarece sa presupus că dependența a reflectat o sensibilitate sporită față de răspunsurile recompensatoare (și, prin urmare, dopaminergice) la medicamente. La consumatorii de droguri, scăderea eliberării DA ar putea reflecta fie neurofiziologia perturbată în circuitul de recompensă (de exemplu în neuronii DA care eliberează DA în striatum) sau, alternativ, o reglare a feedback-ului perturbată a circuitului de recompensă prin căi prefrontale (controlul final) sau amigdale (emoționale) (căi glutamatergice prefrontal-striatale, amigdalarstriatale). Deoarece o disfuncție dopaminergică pură în striatum, observată în cazul consumatorului cronic de droguri, nu reflectă trăsăturile care caracterizează comportamentele dependente, cum ar fi impulsivitatea, pofta și recidiva declanșată de indicii de droguri, este foarte probabil ca regiunile prefrontale precum și amigdala) sunt de asemenea implicate aici, deoarece perturbarea lor ar permite sau cel puțin să influențeze aceste trăsături comportamentale.
Nivelurile scăzute ale receptorilor dopaminici (DR2) afectează controlul impulsivității prin cortexul prefrontal
S-a emis ipoteza că controlul depreciat asupra comportamentelor compulsive care iau comportamente care caracterizează dependența se poate datora în parte unor disfuncții specifice în regiunile frontale ale creierului [35]. Există acum o cantitate semnificativă de dovezi care susțin această noțiune, începând cu studiile pe animale care explorează legătura dintre D2R și controlul comportamental. Experimentele cu șobolani arată clar o corelație între D2R scăzut și impulsivitate [36] și între impulsivitatea și administrarea de droguri [37]. Dar care este legătura? Așa cum am menționat anterior, la pacienții care consumă droguri, D2R scazut mai mic se corelează semnificativ cu metabolismul scăzut al glucozei creierului în regiunile cheie ale PFC, cum ar fi OFC (implicat în atribuirea de saliență și a căror tulburare are ca rezultat comportamente compulsive) și în CG (implicat în controlul inhibitor monitorizarea erorilor și a căror perturbare are ca rezultat impulsivitatea) (Fig. 4B) [38, 39]. Mai mult, într-un studiu efectuat la persoane fizice (medie SD ± vârstă, 24 ± 3 ani), istoric familial al alcoolismului, dar care nu au fost alcoolici înșiși, am descoperit o asociere semnificativă între D2R striatal și metabolismul în regiunile frontale , OFC și PFC dorsolateral) și, de asemenea, în insula anterioară (implicată în interocepție, conștientizare de sine și pofta de droguri) [40] (Fig. 6). Interesant, acești indivizi aveau D2R striatal mai mare decât controalele asociate, fără istoric familial de alcoolism, deși nu diferă în metabolismul frontal. De asemenea, în controale, D2R striatal nu sa corelat cu metabolismul frontal. Acest lucru ne-a determinat să speculam că D2R striatal mai mare decât cel normal la subiecții cu un risc genetic ridicat pentru alcoolism îi protejează împotriva alcoolismului, în parte prin consolidarea activității în regiunile prefrontale. Când sunt combinate, aceste date sugerează că nivelurile ridicate de D2R în striatum ar putea proteja împotriva abuzului de droguri și a dependenței prin menținerea trăsăturilor impulsivității sub control, de exemplu, prin reglarea circuitelor implicate în inhibarea răspunsurilor comportamentale și în controlul emoțiilor.
În mod similar, am presupus că regiunile prefrontale sunt, de asemenea, implicate în reducerea eliberării striatelor DA (și a armării) observate la subiecții dependenți deoarece reglează arderea celulelor DA în midbrain și eliberarea DA în striatum. Pentru a testa această ipoteză, am evaluat relația dintre metabolismul inițial în PFC și creșterea DA DA striatală indusă de administrarea intravenoasă a MPH la martori și în alcoolicii detoxifiați. În concordanță cu ipoteza, în alcoolici nu am reușit să detectăm asocierea normală dintre metabolizarea prefrontală de bază și eliberarea DA în striatum, sugerând că scăderile marcate ale eliberării DA în striatum observate la alcoolici reflectă în parte o reglementare necorespunzătoare a activității creierului de către regiunile creierului prefrontal [34].
Astfel, am găsit o asociere între activitatea redusă de bază în PFC și D2R redus striatal la subiecții dependenți de droguri și între activitatea de bază a PFC și eliberarea DA în controalele care nu sunt prezente la indivizii dependenți. Aceste asociații evidențiază legăturile puternice dintre neuroadaptările în căile PFC și disfuncțiile din aval în sistemul de recompensare DA și motivațional, probabil datorită influenței PFC asupra impulsivității și compulsivității. Cu toate acestea, acestea nu reflectă fenomene comportamentale suplimentare, cum ar fi efectele indiciilor asociate consumului de droguri în declanșarea poftei, care ar presupune implicarea circuitelor de memorie și de învățare.
Amintirile condiționate și comportamentele stereotipice înlocuiesc "înaltul" ca șofer
Supra-stimularea celulelor DA în striatum ventral stabilește eventual noi legături funcționale în creier între actul de satisfacere a nevoii și evenimentele situaționale care o înconjoară (de exemplu, mediul înconjurător, rutina pregătirii medicamentului etc.), stabilind noi , puternice asociații învățate care pot declanșa un comportament. În cele din urmă, simpla memorare sau anticiparea medicamentului poate declanșa comportamentele impulsive care caracterizează indivizii dependenți. Cu consumul repetat de droguri, arderea celulelor DA în striatum începe să schimbe neurochimia care stă la baza învățării asociative. Acest lucru facilitează consolidarea unor urme de memorie maladaptivă conectate la medicament, care ajută la explicarea capacității tuturor stimulilor asociate drogurilor (în așteptarea învățată de a primi recompensa de droguri atunci când este expusă acestor stimuli) [41] pentru a declanșa imediat declanșarea celulelor DA. Și datorită rolului DA în motivație, aceste creșteri DA declanșează motivația necesară pentru a asigura recompensa [42]. Într-adevăr, atunci când șobolanii sunt expuși în mod repetat la un stimul neutru care este asociat cu medicamentul (condiționat), el poate provoca creșteri DA și poate reintroduce autoadministrarea medicamentului [43]. Astfel de răspunsuri condiționate sunt relevante din punct de vedere clinic în tulburările de utilizare a substanțelor, deoarece acestea sunt responsabile pentru probabilitatea ridicată a unei persoane dependente de a recidiva chiar și după perioade prelungite de detoxificare. Acum, tehnicile de imagistică a creierului ne permit să testați dacă expunerea oamenilor la indicii asociate consumului de droguri poate declanșa pofta de droguri, așa cum arată animalele de laborator.
Cu consumul repetat de droguri, arderea celulelor DA în striatum începe să schimbe neurochimia care stă la baza învățării asociative. Acest lucru facilitează consolidarea unor urme de memorie maladaptivă conectate la medicament, care ajută la explicarea capacității tuturor stimulilor asociate drogurilor (în așteptarea învățată de a primi recompensa de droguri atunci când este expusă acestor stimuli) [41] pentru a declanșa imediat declanșarea celulelor DA. Și datorită rolului DA în motivație, aceste creșteri DA declanșează motivația necesară pentru a asigura recompensa [42]. Într-adevăr, atunci când șobolanii sunt expuși în mod repetat la un stimul neutru care este asociat cu medicamentul (condiționat), el poate provoca creșteri DA și poate reintroduce autoadministrarea medicamentului [43]. Astfel de răspunsuri condiționate sunt relevante din punct de vedere clinic în tulburările de utilizare a substanțelor, deoarece acestea sunt responsabile pentru probabilitatea ridicată a unei persoane dependente de a recidiva chiar și după perioade prelungite de detoxificare. Acum, tehnicile de imagistică a creierului ne permit să testați dacă expunerea oamenilor la indicii asociate consumului de droguri poate declanșa pofta de droguri, așa cum arată animalele de laborator.
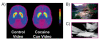
Această întrebare a fost investigată la utilizatorii abuzivi de cocaină. Folosind PET și [11C] racloprid, două studii independente au arătat că expunerea la un film despre cocaină (subiecți care fumează cocaină), dar nu la un film neutru (de scenarii naturale) a crescut DA striatal la subiecții umani dependenți de cocaină (Fig. 7) și că creșterile DA au fost asociate cu rapoarte subiective de poftă de droguri [44, 45]. Cu cât creșterile de DA sunt mai mari declanșate de expunerea la videoclipul cu cocaina-cues, cu atât mai intensă este poftă de droguri. Mai mult, magnitudinea creșterilor DA a fost, de asemenea, corelată cu scorurile de severitate a dependenței, evidențiind relevanța răspunsurilor condiționate în sindromul clinic al dependenței.
Este important de subliniat, totuși, că, în ciuda puterii prezumate a acestor asociații maladaptive, am adunat recent noi dovezi care sugerează că abuzatorii de cocaină își păstrează capacitatea de a inhiba în mod intenționat pofta. Prin urmare, strategiile de consolidare a reglementării fronto-striatale pot oferi beneficii terapeutice potențiale [46].
Rezumând
Unele dintre cele mai periculoase trăsături ale dependenței de droguri sunt dorința copleșitoare de a lua medicamente care pot reapărut chiar și după ani de abstinență și capacitatea sever compromisă a indivizilor dependenți de a inhiba căutarea de droguri odată ce poftă eruptează, în ciuda unor bine-cunoscute consecințe negative.
Am propus un model de dependență [47] care explică natura multidimensională a acestei boli prin propunerea unei rețele de patru circuite interdependente, ale căror rezultate disfuncționale combinate pot explica multe din caracteristicile comportamentale stereotipice ale dependenței: (a) recompensă, incluzând mai multe nuclee în ganglionii bazali, în special striatum ventral, a cărui Nac primește intrarea din zona ventriculară tegmentală și transmite informațiile către pallidum ventral (VP); (b) motivația / conducerea, localizată în OFC, cortexul subcallosal, striatum dorsal și cortexul motor; (c) memoria și învățarea, situate în amigdală și hipocamp; și (d) planificarea și controlul, localizate în cortexul prefrontal dorsolateral, anterior CG și cortexul frontal inferior. Aceste patru circuite primesc inervații directe de la neuronii DA, dar sunt, de asemenea, conectați unul cu celălalt prin proiecții directe sau indirecte (mai ales glutamatergice).
Cele patru circuite din acest model lucrează împreună și operațiunile lor se schimbă odată cu experiența. Fiecare dintre ele este legată de un concept important, respectiv: saliența (recompensa), starea internă (motivația / conducerea), asociațiile învățate (memoria, condiționarea) și rezolvarea conflictelor (control). În plus, aceste circuite interacționează de asemenea cu circuitele implicate în starea de spirit (inclusiv reactivitatea la stres) [48] și cu interocepție (care conduce la conștientizarea dorinței și a dispoziției de droguri) [49]. Am propus că modelul de activitate din rețeaua de patru circuite prezentat aici influențează modul în care un individ obișnuit face alegeri între alternativele concurente. Aceste alegeri sunt influențate sistematic de circuitele de recompensă, de memorie / condiționare, de motivație și de control, iar acestea, la rândul lor, sunt modelate de circuite care stau la baza starea de spirit și conștientizarea conștientă (Fig. 8A).
Răspunsul la un stimulent este afectat de sentimentul său momentan, și anume răsplata așteptată. La rândul său, așteptările de răsplată sunt prelucrate în parte de neuronii DA care se proiectează în striatum ventral și sunt influențați de proiecțiile glutamatergice din OFC (care atribuie valoarea de saliență ca funcție a contextului) și amigdala / hipocampusul (care mediază răspunsurile condiționate și amintirile de memorie). Valoarea stimulului este ponderată (comparată) cu cea a altor stimuli alternativi, dar și schimbările ca o funcție a nevoilor interne ale individului, care sunt modulate de starea de spirit (inclusiv reactivitatea stresului) și de conștientizarea interactivă. În special, expunerea la stres consolidează valoarea de siguranță a medicamentelor, în timp ce, în același timp, scade reglajul prefrontal al amigdalei [50]. În plus, deoarece expunerea cronică la medicamente este legată de sensibilizarea crescută la răspunsurile la stres, acest lucru explică de ce stresul poate declanșa o recidivă de droguri atât de des în situații clinice. Cu cât este mai mare valoarea de saliență a stimulului, parțial formată din experiențele memorate anterior, cu atât este mai mare activarea circuitului motivațional și cu atât este mai puternic să-l procurați. Decizia cognitivă de a acționa (sau nu) pentru a achiziționa stimulul este prelucrată parțial de către PFC și CG, care cântăresc echilibrul dintre rezultatele pozitive imediate și cele întârziate negative și cortexul frontal inferior (Broadmann Area 44) care funcționează pentru a inhiba răspunsul prepotant pentru a acționa [51].
Conform acestui model, în subiectul dependent (Fig. 8B), valoarea de saliență a medicamentului de abuz și a indicilor lui asociat este sporită în detrimentul altor recompense (naturale), a căror importanță este semnificativ redusă. Acest lucru ar explica motivația crescută de a căuta drogul. Totuși, expunerea acută la medicament restabilește, de asemenea, pragurile de recompensă, ceea ce duce la scăderea sensibilității circuitului de recompensă la agenți de întărire [52], care, de asemenea, ajută la explicarea valorii descrescătoare a substanțelor de întărire non-medicamentoase în cazul persoanei dependente. Un alt motiv pentru o mai bună relevanță a unui medicament îl constituie lipsa de obișnuință a răspunsurilor DA la medicamentele de abuz (toleranță) în comparație cu obișnuința obișnuită care există pentru recompensele naturale și care are ca rezultat satietate [53].
În plus, expunerea la stimuli condiționați este suficientă pentru a crește pragurile de recompensă [54]; astfel, am putea prezice că, într-o persoană dependentă, expunerea la un mediu cu indicii condiționate ar exacerba și mai mult sensibilitatea lor scăzută la recompensele naturale. În absența concurenței de către alți agenți de întărire, învățarea condiționată ridică dobândirea medicamentului la nivelul unei mișcări motivaționale principale pentru individ. Noi presupunem că indiciile de droguri (sau stresul) conduc la creșterea rapidă a DA în Nac în striatum ventral și în striatum dorsal care conduc motivația de a lua medicamentul și nu pot fi opuși în mod corespunzător de un PFC disfuncțional. Astfel, după consumul de droguri și intoxicație, amplificarea semnalelor DA ar duce la o supraactivare corespunzătoare a circuitelor motivaționale / de antrenare și de memorie, care dezactivează PFC (inhibarea prefrontală are loc cu activarea amigdală intensă) [50], blocând puterea PFC pentru a controla circuitul motivațional / de acționare. Fără acest control inhibitor, este stabilită o buclă de reacție pozitivă, care are ca rezultat consumul compulsiv de medicament. Deoarece interacțiunile dintre circuite sunt bidirecționale, activarea rețelei în timpul intoxicației servește la întărirea în continuare a valorii de saliență a medicamentului și a condiționării față de indicii de droguri.
Concluzii
Pe scurt, propunem un model care explică dependența după cum urmează: În timpul dependenței, valoarea sporită a indicilor de droguri din circuitul de memorie conduce la așteptări de recompensă și mărește motivația de a consuma medicamentul, depășind controlul inhibitor exercitat de un PFC deja disfuncțional. Deși creșterile DA induse de medicamente sunt puternic atenuate la subiecții dependenți de droguri, efectele farmacologice ale medicamentului devin răspunsuri condiționate în sine, determinând în continuare motivația de a lua medicamentul și favorizând o buclă de feedback pozitiv acum neopusă, din cauza deconectării a circuitului de control prefrontal. În același timp, este probabil ca și dependența să recalibreze circuitele care concretizează starea de spirit și conștientizarea conștientă (reprezentată de nuanțe mai închise de gri) (Fig. 8B) în moduri care, dacă s-ar corobora experimental, ar accentua în continuare echilibrul departe de controlul inhibitor și față de pofta și consumul de droguri compulsive.
Recunoaștem cu ușurință că acesta este un model simplificat: realizăm că și alte regiuni ale creierului trebuie să fie implicate în aceste circuite, că o regiune poate contribui la mai multe circuite și că alte circuite pot fi, de asemenea, implicate în dependență. În plus, deși acest model se axează pe DA, este evident din studiile preclinice că modificările în proiecțiile glutamatergice mediază multe dintre adaptările observate în dependență și că am discutat aici. De asemenea, este evidentă din studiile preclinice că alți neurotransmițători sunt implicați în efectele de întărire ale medicamentelor, inclusiv canabinoidele și opioidele. Din păcate, până de curând, accesul limitat la radiofrecvenții pentru imagistica PET a limitat capacitatea de a investiga implicarea altor neurotransmițători în recompensa de droguri și în dependență.
Abrevieri
- AMPA
- α-amino-3-hidroxil-5-metil-4-izoxazol-propionat
- CG
- cingulate gyrus
- CTX
- cortexul
- D2R
- tipul receptorului dopaminic 2 / 3
- DA
- dopamina
- F DG
- fluorodeoxyglucose
- GABA
- y-aminobutiiric
- HPA
- hipofiza axei hipotalamice
- MPH
- metilfenidatul
- Nac
- nucleul accumbens
- NMDA
- n-metil-d-acid aspartic
- OFC
- orbitofrontal cortex
- ANIMAL DE COMPANIE
- tomografie cu emisie de pozitroni
- PFC
- cortexul prefrontal
- VP
- ventral pallidum
Referinte
55. Fowler JS, Volkow ND, Logan J și colab. Captarea rapidă și legarea de durată a metamfetaminei în creierul uman: comparație cu cocaina. Neuroimage. 2008;43: 756-63. [Articol gratuit PMC] [PubMed