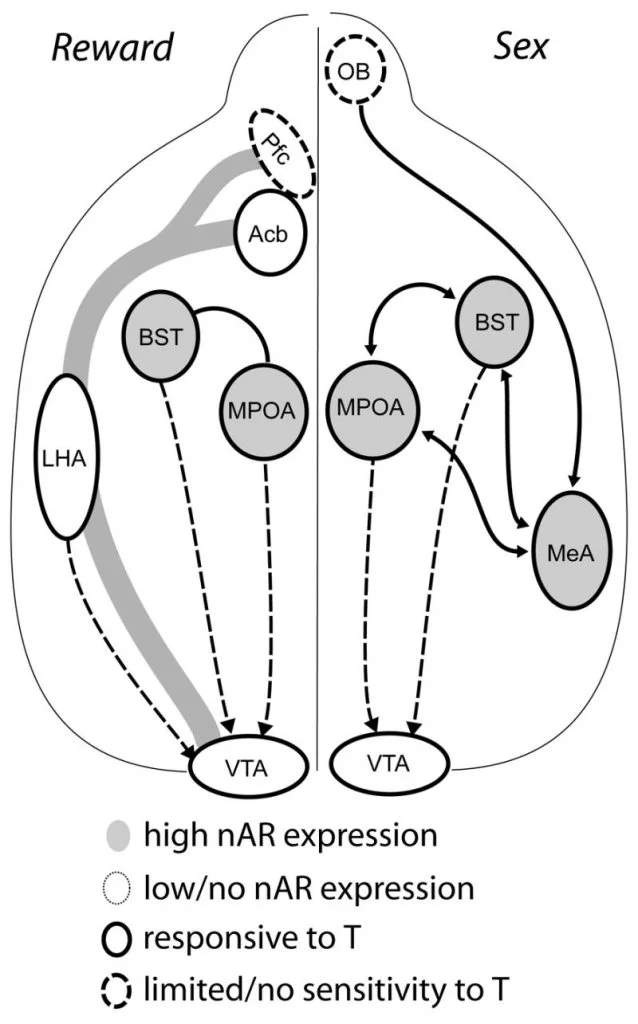
コメント:アンドロゲン受容体、ドーパミンおよび性機能に関するほぼすべての関連研究の優れたレビュー。 視床下部と報酬回路の相互関係を幻想的に描いています。
Horm Behav。 2008 5月。 53(5):647-658。
2008オンライン13を2月に公開。 土井: 10.1016 / j.yhbeh.2008.01.010
抽象
青年期は、視床下部-下垂体-性腺軸の思春期の活性化によって形成される喜びを求める行動の増加に関連しています。 性のような自然にやりがいのある行動の動物モデルでは、精巣のアンドロゲンが男性の行動の発達と発現に寄与します。 行動の成熟をもたらすために、脳は思春期の間に大幅なリモデリングを受け、多くの変化は同様にアンドロゲンに敏感で、おそらくアンドロゲン受容体(AR)を介して作用します。 生殖腺ホルモンと脳の発達の微妙な相互作用を考えると、この敏感な期間中のホルモンレベルの混乱が青年期と成人の行動を大きく変えることは驚くことではありません。 オスのハムスターでは、成人期の性行動の正常な発現には、青年期のテストステロンへの曝露が必要です。 思春期の間にアンドロゲンを奪われた男性は、交配の赤字を持続しました。 逆に、思春期前に脳のARが存在していても、思春期前の男性で交尾を誘発するにはアンドロゲンだけでは不十分です。 これに関連して、思春期における同化アンドロゲンステロイド(AAS)の広範な使用は重要な懸念事項です。 AASの乱用は、青年期の男性のアンドロゲンのタイミングとレベルの両方を変える可能性があります。 ハムスターでは、思春期のAAS暴露は攻撃性を高め、神経伝達物質システムの永続的な変化を引き起こします。 さらに、テストステロンおよび他のAASの自己投与によって示されるように、AAS自体が強化されています。 しかし、最近の証拠は、アンドロゲンの強化効果が古典的なARを必要としないかもしれないことを示唆しています。 したがって、アンドロゲンと思春期の脳のやりがいのある行動との相互作用をさらに調べることは、AAS乱用のより良い理解のために必要です。
概要
思春期は脳を快楽と危険の両方に目覚めさせます。 人間のティーンエイジャーでは、これは頻繁に薬物および性の実験の形を取ります。 米国では、男性の最初の性交の年齢の中央値は16.4歳であり、65%は12thグレードまでの性交を経験しています(カイザーファミリー財団、2005)。 同様に、この人口は米国で最高の違法薬物使用率を持っています。 薬物使用と健康に関する2004全国調査によると、38〜18の男性の25%が過去1年間に違法薬物を使用していました(SAMHSA / OAS、2005)。 さらに、10代の少年の31%が最後の性的出会いの際に薬物またはアルコールを使用しました(カイザーファミリー財団、2005)。 さらに、思春期は、うつ病、不安、摂食障害、行動障害などの特定の精神病理の病因における極めて重要な時期です。 性腺ホルモンの思春期分泌、脳内のステロイド受容体の活性化、およびホルモンと青年期の脳発達の経験との相互作用は、青年期に見られる行動変化に寄与すると考えられます。
ここでの私たちの目標は、性腺アンドロゲンが思春期の成熟とやる気のある行動の成人のパフォーマンスを仲介するという証拠と、これらの行動の価値ある特性を確認することです。 また、テストステロン自体がやりがいがあるという証拠を提示し、テストステロンのレベルが急上昇する思春期のやる気のある行動の成熟の変化に貢献する可能性があります。 この論文の焦点は、特にシリアンハムスターにおける、男性の性的行動の根底にある神経回路の研究にあり、テストステロンとドーパミン(DA)の相互作用に特に重点を置いています。 思春期のアンドロゲンは、報酬回路とやる気のある行動に一時的および長期的な効果があることを提案します。 さらに、同化アンドロゲンステロイド(AAS)の形で外因性アンドロゲンを補充すると、思春期のアンドロゲンの正常な影響が増大し、それによって思春期の脳の発達と行動に悪影響を与えるという仮説を立てています。
脳発達の敏感な時期としての青年期
最終的に、脳は青年期のアンドロゲン作用の引き金であり、標的でもあります。 若い男の子(<12歳)と若いハムスター(<28日齢)では、循環するアンドロゲンとゴナドトロピンは基礎レベルにあります。 視床下部ゴナドトロピン放出ホルモンに反応して下垂体前葉からの黄体形成ホルモンの分泌が増加すると、循環テストステロン濃度が大幅に増加します。 これは、男児ではタナー段階II / III(14歳)までに、ハムスターでは28日齢までに発生します。 男の子がタナーステージIV / V(約16歳)に達するまで、またはハムスターが50〜60日齢になるまでに、内因性テストステロンは成人男性の範囲内にあります。 思春期のホルモン分泌は、青年期と一致します。青年期は、人間の場合、約12〜20歳で起こります。 思春期ホルモンは、末梢組織に作用して思春期の明白な兆候である第二次性徴の出現を引き起こすだけでなく、青年期の脳のリモデリングと行動の成熟の両方に影響を与えるために中心的に作用します。 さらに、思春期のホルモンによってもたらされる生理学的および神経学的変化は、個人の経験に重大な変化をもたらし、それ自体が脳の発達の過程を大きく変える可能性があります。 したがって、生殖神経内分泌軸の発達的に時限成熟によって引き起こされる性ステロイドホルモンの思春期の増加は、次に、神経系への直接的および間接的な影響の両方を介して青年期の行動発達を形作る。
人間の思春期は現在、行動回路が改造され洗練されている神経発達の主要かつ動的な期間として認識されています。 5歳の子供の脳は、すでにその成人サイズの90%です(デカバン、1978)、重要な改造がまだ来ています。 この概念は、周産期の脳の発達中に発生する基本的な発達プロセスの多くが青年期に再現されることを文書化した人間と動物の両方の研究によって燃え上がった。 これらのプロセスには、神経新生(エッケンホフとラキック、1988; 彼とクルー、2007; ピノス、コラード、ロドリゲスザフラ、ロドリゲス、セゴビア、ギラモン、2001; ランキン、パートロー、マッカーディ、ジャイルズ、フィッシャー、2003)、プログラム細胞死(ヌシュ、ラウシュケ、ジュラスカ、2001; ヌネス、ソディ、ジュラスカ、2002)、樹状突起樹状突起およびシナプスの精緻化および剪定(Andersen、Rutstein、Benzo、Hostetter、およびTeicher、1997; Huttenlocher and Dabholkar、1997; LenrootとGiedd、2006; Sowell、Thompson、Leonard、Welcome、Kan、およびToga、2004)、髄鞘形成(Benes、Turtle、Khan、およびFarol、1994; パウス、コリンズ、エヴァンス、レナード、パイク、ザイデンボス、2001; Sowell、Thompson、Tessner、およびToga、2001)、および性的分化(チャン、デフリース、スワブ、2002; Davis、Shryne、およびGorski、1996; Nunezら、2001)。 したがって、出生後の脳の発達軌跡は線形ではなく、代わりに思春期の急激な変化のバーストを特徴とし、進行性および退行性の両方のイベントを伴います。 発達生物学者が知っているように、急速な発達変化シグナルの期間は、経験依存的な変化と摂動とin辱の悪影響の両方に対する感度と脆弱性を高め、人間の青年期の脳の発達は例外ではないと考える理由はありません(アンデルセン、2003; スピア、2000)。 したがって、思春期のホルモンが思春期の脳に影響を与えるタイミングの摂動は、成人の行動に長期的な影響を与えると予測されます。
やる気のある行動のためのアンドロゲンと神経回路
青年期は発達の一時的かつ動的な段階であるため、青年期の脳と行動を単独で評価することは困難です。 代わりに、青年期のユニークな特徴を理解するために、それを成熟した大人の脳と行動と対比することは役に立ちます。 したがって、この論文では男性の性的行動と報酬に焦点を当てて、行動の活性化における性腺ステロイドホルモンの役割やアンドロゲン受容体の分布など、成人男性の交尾と性的動機付けのための神経回路を導入することが重要です。 (AR)およびエストロゲン(ER)。
ARは、性別などのやりがいのある社会的行動を媒介する神経回路を形成する細胞群に存在します。 さらに、脳のARはハムスターの思春期前に発現し、若年および成人男性の両方でアンドロゲンによって上方制御されます(Kashon、Hayes、Shek、Sisk、1995; Meek、Romeo、Novak、Sisk、1997)。 げっ歯類の脳では、ARとERの分布にかなりの重複があります(ウッド&ニューマン、1995)、およびアロマターゼ(ネグリセシのセロッティ、1997のポレッティ)、エストロゲン受容体のαおよびβ型の両方を含む(Shughrue、Lane、Merchenthaler、1997)。 リガンドに結合すると、「古典的な」ARおよびERは転写因子として機能し、新しいタンパク質の転写および合成を誘導します。 当然のことながら、これらの効果は比較的遅い時間経過に従い、作用の開始が遅れます。 男性のハムスターの性的行動のステロイド刺激(ノーブルアンドアルサム、1975)は、古典的なゲノムアクションによるアクションと一致しています。 たとえば、2週間のステロイド暴露は、長期の去勢で交尾を回復するために必要です。 ラットのより最近の研究では、古典的な受容体をほとんど持たない脳領域でのアンドロゲンの急速な細胞効果も実証されています(メルメルシュタイン、ベッカー、およびサーマイヤー、1996)。 これらのステロイド作用は、非ゲノム受容体によって媒介されると考えられています。 一方、ハムスターの脳における古典的なARおよびERの分布は比較的制限されています(ウッドとスワン、1999)、非ゲノムアンドロゲン作用の潜在的な脳標的ははるかに広いです。
内側視索前野(MPOA)は、金魚からヒトへの雄の交尾において中心的な役割を果たします( ハル、ウッド、マッケンナ、2006)。 さらに、ハムスターMPOAは豊富なARおよびERを介して性腺ステロイドホルモンを変換し、MPOAのテストステロンインプラントは長期去勢動物の性的活動を回復するのに十分です(ウッドとスワン、1999)。 オスのラットでは、性腺ステロイドがMPOAで作用して基底DA放出を調節します(パトナム、佐藤、ハル、2003)そして交配を刺激する(Hull、Du、Lorrain、およびMatuszewich、1995)。 最初は、女性が画面の後ろに表示されると、DAがわずかに増加します。 交尾中、MPOA DAはさらに増加し(ベースラインの+ 50%)、この効果にはアンドロゲンが必要です(ハル他、1995; Putnam et al。、2003)。 驚くことではありませんが、交尾しない去勢雄では、MPOA DAは増加しません(ハル他、1995)。 DA放出の欠如は性的活動の欠如と混同されるため、この結果を解釈するのはやや困難です。 ただし、MPOAのDAリリースは、短期の去勢における交配の喪失と相関します(ハル他、1995)、およびテストステロン誘発性の長期去勢動物の性的活動の回復(Du、Lorrain、およびHull、1998; パトナム、ドゥ、佐藤、ハル、2001).
げっ歯類のMPOA内では、テストステロンのアンドロゲンおよびエストロゲンの代謝物は、交配の調節に特定の役割を果たします(Putnam et al。、2003; パトナム、佐藤、リオロ、ハル、2005)。 交尾を開始するまでの時間(マウントまたはイントロミット)は、性的動機付けの1つの尺度です。 性的活動への潜伏期は、MPOA一酸化窒素シンターゼの維持を通じてエストロゲンに敏感であり、これが基底DAレベルを維持します。 エストロゲンで治療された去勢動物は、高い基底DAレベルを示し、交尾を開始する能力と強く相関します。 ただし、女性および交尾によって誘発されるDA放出の増加は見られず、性的パフォーマンスと強く相関しています。 その結果、彼らの性的パフォーマンスは無傷のレベルを下回っています。 一方、非芳香族化アンドロゲンのみで治療された去勢動物は、基底DAレベルの上昇を示さず、交尾を開始できません。 したがって、通常の性的パフォーマンスには、エストロゲンとアンドロゲンの両方が必要です。 性的パフォーマンスは、通常、騎乗、挿入、射精の頻度測定として表されます。 エストロゲンとアンドロゲンの両方が置換された場合にのみ、去勢された男性はDAレベルの上昇(およびより短い潜伏期間の測定)および女性および交尾誘発のDAの増加(および頻度の増加の測定)を示します。 このように、MPOAのエストロゲンは性的動機付けに寄与し、エストロゲンとアンドロゲンの両方が性的パフォーマンスに寄与します。
テストステロンは、男性の交尾行動中のMPOA DAの放出と交配自体に必要ですが、テストステロンも交配だけでもMPOAでDAを誘発することはできません。 代わりに、同種の女性からの化学感覚キューは、MPOAのDAリリースにも必要です。 げっ歯類では、化学感覚刺激が男性の性的行動を開始するための主要な感覚モダリティです(図1)。 化学感覚の手がかりは、嗅球から内側扁桃核および終末条の床核、豊富なARおよびER(ウッドとスワン、1999)。 交配誘発性DAにおける化学感覚キューの役割を決定するために、片側嗅球切除術(UBx、 トリムストラ、長谷、ウッド、2005)。 嗅球の両側性除去は性的活動とMPOA DA放出を排除しますが、片側性球状切除は交尾を妨げません。 この研究では、同側半球ではなく、病変した嗅球の反対側で測定した場合、交尾によりMPOA DA放出が誘発されました(図2)。 同様の結果は、内側扁桃体の病変を持つ雄ラットで観察されました(ドミンゲス、リオロ、Xu、およびハル、2001)。 関連する研究では、ラットの内側扁桃体の化学的刺激は、交尾中と同等のMPOA DA放出を誘発しました(ドミンゲスとハル、2001)。 まとめると、これらのデータは、テストステロンが許容環境を作成し、外部感覚刺激がMPOAに到達し、交尾中にDA放出を誘導することを示唆しています。

図2
最終的に、性行動やその他の自然な報酬は、神経の報酬経路を活性化します。 中皮質辺縁系DA回路は、腹側被蓋野(VTA)、側坐核(Acb)、および前頭前野(Pfc)で構成されています。 VTAプロジェクトに存在するドーパミン細胞体は、AcbとPfc(コーブとネスラー、1997)。 ラットでは、性交時にDAがAcbに放出されます(Pfaus、Damsma、Nomikos、Wenkstern、Blaha、Phillips、およびFibiger、1990)。 乱用薬物の多くは、中脳辺縁系DAシステムでも作用して、DA放出を増加させたり(アンフェタミン)、DAの再取り込みを抑制します(コカイン、 ディ・キアラとインペラト、1988)、したがって、彼らの中毒性を強化します。 このように、テストステロンは、性的行動の強化と虐待の薬物としての行動の両方を通じて、AcbのDAの放出に影響を与える可能性があります(以下を参照)。
現在の証拠は、思春期の間に中皮質辺縁系DAが成熟することを示唆しています。 Acb DA繊維密度はスナネズミの思春期に劇的に増加し、青年期にVTAドーパミン作動性のAcbへの投射が有意に成熟することを示唆しています(レスティング、Neddens、およびTeuchert-Noodt、2005)。 さらに、ラット内側前前頭皮質のGABA(γ-アミノ酪酸)作動性細胞へのドーパミン作動性入力は、思春期の発達中にセロトニン作動性システムによって強化および調節されます(Benes、Taylor、およびCunningham、2000)、および成体ラットにおけるアンドロゲンの操作は、前頭前野内のドーパミン作動性軸索密度の変化につながります(クリッツァー、2003)。 Pfc、Acb、およびVTAにはARまたはERがほとんどありませんが、VTAにはERβが存在します(Shughrue et al。、1997)。 したがって、アンドロゲンは、視床下部のように、アンドロゲン感受性求心性神経またはVTAのERβを介して中皮質辺縁系DAシステムに影響を及ぼす可能性が高いと思われます(Handa et al。、この問題)。 私たちのデータは、オスのハムスターのアンドロゲン感受性細胞がステロイド感受性行動に関連する構造からVTAに投射することを示しています。 たとえば、MPOAと末端条床(BST)の両方に、VTAに突出する多数のAR陽性細胞が含まれています(佐藤と木、2006)。 腹側淡lid球、主なAcb遠心性標的(Zahm and Heimer、1990)、VTAに突出している多くのAR陽性細胞も含まれています。 これらの予測は、アンドロゲンが中皮質辺縁系DAシステムの活動を修正する機会を提供します。
青年期の行動のステロイド依存性組織
思春期の行動に対するホルモン作用の伝統的な見方は、ステロイドホルモンの活性化効果に基づいています。ステロイドホルモンは、行動の根底にある神経回路の標的細胞内の作用によって特定の社会的状況で行動を促進するステロイドの能力を指します。 活性化効果は、ホルモンの存在と不在に伴って出入りするという意味で一過性であり、通常、成人の行動の発現に関連しています。 対照的に、組織効果とは、発達中に神経系構造を彫刻するステロイドの能力を指します。 構造的組織は永続的であり、ホルモンへの曝露期間を超えて持続し、成人期のステロイドに対する神経および行動の反応を決定します。 ステロイドホルモンの組織的効果と活性化効果の発達的関係についての私たちの理解は、過去50年にわたって進化してきました。 フェニックスと同僚は、ステロイドホルモンに対する成人の行動(活性化)応答は、周産期の発達の最大限に敏感な期間にステロイドホルモンによってプログラム(組織化)されることを最初に提案しました(フェニックス、ゴイ、ジェラル、ヤング、1959)。 その後、スコットと同僚は、神経系の進行性組織化のための複数の敏感な期間の存在に関する理論的基礎を築き、敏感な期間は急速な発達変化(1974)の期間に発生する可能性が最も高いことに注意しました。 続いて、アーノルドとブリードラブは、脳のステロイド依存性の組織化は、発達の敏感な期間の外で発生する可能性があることを指摘しました(アーノルドとBreedlove、1985)。 過去の15年間、さまざまな動物モデルと行動システムを使用した研究により、思春期の脳は性腺ステロイドの活性化と組織化の両方の影響を受けやすいことが明らかになりました( シスクとツァー、2005)。 また、急速な発達変化の他の期間と同様に、思春期はステロイド依存性脳リモデリングの機会の定義されたウィンドウを表します。
ハムスターを動物モデルとして使用した私たちの研究は、青年期に男性の社会的行動がステロイドによって変更されるという証拠を提供しています(シュルツ、メナード、スミス、アルバース、シスク、2006; シュルツとシスク、2006)。 思春期前には、テストステロン治療はハムスターの性的行動を活性化できず、神経回路がステロイドホルモンによる活性化または組織化を受けやすくなる成熟プロセスがまだ発生していないことを示唆しています(Meek et al。、1997; ロミオ、リチャードソン、シスク、2002a)。 逆に、成人期における男性の生殖行動の明白な発現には、思春期における生殖腺ステロイドの存在が絶対に必要ではありませんが、行動を最大限に発現させるには必要となります。 思春期前 (NoT@P) または思春期後 (T@P) に去勢され、成人期にテストステロンで治療された男性の男性的な生殖行動を比較すると、思春期前の NoT@P 去勢者は、思春期後に去勢された男性と比較して、男性的な行動が少なくとも 50% 欠損しています。 (図3, シュルツ、リチャードソン、ゼア、オセテック、メナード、シスク、2004)。 さらに、生殖行動の赤字は長続きし、長期のテストステロン治療または成人期の性的経験によって克服することはできません(Schulzら、2004)。 同様に、エストロゲンとプロゲステロンによる治療後、NoT@P 雄は成人として去勢された雄よりも前弯潜時が短く、前弯持続期間が長くなります (Schulzら、2004)、思春期前の去勢動物は、思春期のテストステロンに曝露された男性よりも脱髄が少ないことを示唆しています。

図3
NoT@P男性は性的動機の低下に苦しんでいる可能性があります。 この疑問に対処する XNUMX つの方法は、思春期前 (NoT@P) と思春期後 (T@P) の性腺切除を受けた男性の間で、肛門性器調査 (AGI) とマウンティングの両方に従事するまでの時間を比較することです。 性的動機が思春期の生殖腺ホルモンへの曝露に依存しているのであれば、NoT@P オスでは性行動を起こすまでの潜伏期間が長くなることが予想されます。 実際、発情期のメスに繰り返し曝露すると、NoT@P オスは T@P オスと比べて、AGI とマウンティングを開始するまでに時間がかかります (図4)。 したがって、性的パフォーマンスの側面を組織化することに加えて、思春期ホルモンは性的行動の報酬の側面も組織化しているようです。 この可能性を裏付けるように、成人期にDAアゴニストであるアポモルヒネを中枢投与すると、NoT@P男性の増大行動が成人の典型的なレベルに回復し、青年期のテストステロンが通常はドーパミン作動性神経回路を組織化することが示唆される(Salas-Ramirez、Montalto、およびSisk、2006年) )。 それにもかかわらず、多くの興味深い疑問が残っています。 NoT@P のオスは発情期のメスを求めてバープレスをするでしょうか、それとも交尾場所に対する条件付けされた場所の好みを発達させるでしょうか? 今後の研究では、性的動機と性的パフォーマンスの組織化における思春期ホルモンの役割が調査される予定です。

図4
思春期前 (NoT@P) または思春期以降 (T@P) に生殖腺切除されたオスのハムスターによって示された肛門生殖器検査 (AGI) の潜時と持続時間。 すべての男性は、成人期に性腺切除後 7 週間、最初の行動検査の XNUMX 週間前にテストステロンで初回刺激を受けました。 A. T@P オスは、発情期メスとの XNUMX 回のテストで同様の AGI 潜時を示しましたが、NoT@P オスは、発情期メスとの XNUMX 回目のテストで AGI 潜時が増加しました。 B. T@P オスは、発情メスとの XNUMX つの行動テスト全体で乗馬潜時を減少させましたが、noT@P オスは XNUMX つの行動テスト全体で乗馬潜伏期間の変化を示さなかった。 これらのデータは、思春期の生殖腺ホルモンが、成人男性が女性と性的行動をする動機に永続的な促進効果を及ぼすことを示唆しています。 (動物被験者からの未発表データ シュルツ、KM、リチャードソン、HN、ツェル、JL、オセテック、AJ、メナード、TA、およびシスク、CL、2004).
ステロイドに対する思春期前の行動反応
思春期の行動発達の永続的なパズルの1つは、思春期前のオスのハムスターでステロイド曝露に応答した生殖行動の活性化が減衰する理由です。 思春期前の低レベルのアンドロゲンが思春期前の男性の男性の性行動の発現を制限する場合、思春期前の男性の内因性アンドロゲンの補充は交配を誘発するはずです。 これは事実ではないことがわかります(Meek et al。、1997; ロミオ、クックウィーンズ、リチャードソン、シスク、2001; ロミオ、ワーグナー、ヤンセン、ディードリッヒ、シスク、2002b)、交配回路全体でのARおよびERの数と分布は、ホルモン処理された思春期前および成人の去勢動物で類似しているという事実にもかかわらず(Meek et al。、1997; Romeo、Diedrich、Sisk、1999; Romeo他、2002a)。 したがって、男性の性行動の発現にはアンドロゲンとARが必要ですが、十分ではないようです。
思春期前に性的活動を制限する要因を特定する努力は、これまでのところ混合されています。 発情期の雌からの化学感覚キューに対するFosの反応は、思春期前および成体の雄のハムスターで類似しています(ロミオ、パルフィット、リチャードソン、シスク、1998)。 これらのデータは、感覚伝達機構が思春期前に成熟していることを示しています。 したがって、若い男性は、女性からの化学感覚キューを検出できます。 彼らが大人と違うのは、それらの手がかりにどのように反応するかです。 1つの潜在的な説明は、思春期前の男性が性的行動に従事する動機を持たないことです。 思春期前のオスのハムスターは、メスのフェロモンに反応してMPOAのドーパミン作動性応答の増加を示さないのに対し、性的にナイーブな成人のオスは、同じ刺激に対して堅牢なMPOAドーパミン作動性応答を示します(図5, シュルツ、リチャードソン、ロミオ、モリス、ルッキングランド、シスク、2003)。 同様に、思春期前の男性は、女性のフェロモンへの暴露後に循環テストステロンの成人に典型的な増加を示すことができません(Parfitt、Thompson、Richardson、Romeo、Sisk、1999)。 したがって、女性のフェロモンは、思春期前の男性ではなく、成人の神経化学反応および神経内分泌反応に対する無条件の刺激であるように思われ、これらの社会的に関連する感覚刺激の顕著性は、おそらく報酬特性の獲得と性的動機付けに関連して、思春期の発達を超えて変化することを示唆しています。 さらに、テストステロンは思春期前の男性の女性のAGIを促進しますが、この効果は、男性が以前に発情期の女性に曝露したことがあるかどうかに依存します。 おそらく驚くべきことに、テストステロン治療は性的にナイーブな思春期前の男性でのみ潜伏時間を短縮し、AGIの期間を延長します(図6)。 さらに、女性との以前の経験がある思春期前の男性は、初めて受容性の女性と相互作用する男性よりもはるかに長いAGI潜時と短いAGI持続時間を示します(図6)。 これらのデータは、発情期の女性との相互作用は思春期前に報酬を与えるのではなく嫌悪的であり、それにより女性とのその後の相互作用中のテストステロンのAGIに対する促進効果を排除することを示唆している。 特に、発情期の女性への繰り返しの曝露を考えると、発情期の女性への早期曝露の負の行動の結果が青年期および成人期まで持続するかどうかを知ることは興味深いでしょう 間に 青年期は一般に男性の生殖行動の表現を促進します(Molenda-Figueira、Salas-Ramirez、Schulz、Zehr、Montalto、Sisk、2007).

図5
膣分泌物に含まれる女性フェロモンに対する思春期前および成人男性内側視索前野(MPOA)ドーパミン作動性応答。 成人男性は女性の膣分泌物にさらされるとMPOAドーパミン作動性活性が増加しますが、思春期前の男性は女性フェロモンに対するMPOAドーパミン作動性応答の増加を示しません。 (から再描画 シュルツ、KM、リチャードソン、HN、ロミオ、RD、モリス、JA、ルッキングランド、KJ、シスク、CL、2003).

思春期前のアンドロゲン治療は交尾を誘発できないが、私たちの研究室の最近の研究は、ハムスター神経系が思春期前の生殖行動に対するテストステロンの組織化作用に敏感であることを示唆している(Schulz、Zehr、Salas-Ramirez、Sisk、2007)。 去勢と19日間のテストステロン暴露は、成人期にテストステロンが置換された場合、思春期の前または最中に行われましたが、思春期後はそうではありませんでした。 思春期前または後にテストステロンにさらされた男性よりも、成人期に思春期前にテストステロンにさらされた男性の方がより多くの侵入を示したSchulzら、2007)。 これらのデータは、行動神経回路を組織するテストステロンの能力が年齢とともに低下し、思春期がテストステロンへの曝露の長期にわたる出生後感受性期間の終わりを示すことを示唆しています。
薬理学的アンドロゲン
前述のデータは、内因性の性ステロイドが思春期のやる気のある行動を強化することを示唆しています。 さて、100xの通常の生理学的濃度までのレベルでアンドロゲンを自己投与するとどうなりますか? これは、同化アンドロゲンステロイド(AAS)乱用の問題です( Brower、2002; クラークとヘンダーソン、2003)。 ここで簡単な余談が適切です。すべてのAASはテストステロンの派生物であり、すべてのAASは4縮合環を持つ炭素骨格を持ち、ほとんどが19炭素を持ちます。 AASは、主に同化(筋肉増強)効果に使用されます。 しかし、その名前が示すように、AASにはアンドロゲン特性もあります。 テストステロンは、アンドロゲン報酬の基本的なメカニズムを調査するための動物研究における論理的な選択です。 同様に、人間のユーザーにも人気があり、ほとんどの場合、プロピオン酸テストステロンなどの長時間作用型テストステロンエステルの形で使用されます。 2006では、テストステロンは、WADA認定研究所の尿検査で検出された単一の最も一般的な禁止物質でした(和田、2006)。 テストステロンは、34シドニーオリンピックでのAAS陽性尿検査の最大割合(2000%)を占めました(Van Eenoo and Delbeke、2003)。 同様に、AASユーザーの尿検査では、41%がテストステロン陽性でした(Brower、Catlin、Blow、Eliopulos、Beresford、1991)。 高用量では、AASは著しい行動変化を引き起こします。 特に、テストステロンとの密接な関係のため、10代でのAASの使用は、ステロイド曝露の量、タイミング、およびタイプを含む、発達中のヒト青年神経系の通常のステロイド環境を混乱させるように思われます。
他の違法薬物と同様に、人間のAAS乱用は青年期の問題です。 1994 National Household Survey on Drug Use(SAMHSA / OAS、1996)、ステロイド使用は18歳で思春期後期にピークに達します。 さらに、Monitoring the Future調査(ジョンストン、オマリー、バッハマン、2003)、高校生におけるステロイド使用の生涯発生率(2.7%)は、クラックコカイン(3.5%)またはヘロイン(1.4%)に匹敵しました。 ステロイドの使用も若い年齢でますます一般的です:2.5thグレードの学生の8%(13–14年)は、クラック(2.5%)およびヘロイン使用(1.6%)の発生率と同様に、ステロイドを使用しています。 10代前半のAASの使用に対するこの傾向は、1)青年がAASの乱用に対して特に脆弱である可能性があること、および2)薬理学的レベルでのAASへの青年期の曝露が脳の正常な成熟を実質的に変更する可能性があるという懸念を考慮すると、特に厄介です誇張された形態学的および行動的反応を急性および慢性的に生み出す行動。
不適切な攻撃は、人間のAAS虐待に最も頻繁に関連する行動反応です。 公開された症例報告では、ステロイドの使用はいくつかの暴力的な殺人に関係している(ConacherおよびWorkman、1989; 教皇とカッツ、1990; 教皇、古宇利、パウエル、キャンベル、カッツ、1996; シュルテ、ホール、ボイヤー、1993)。 現在のAASユーザーの調査では、攻撃性と過敏性の上昇がAAS使用の最も一般的な行動の副作用でした(ボンド、チェ、ポープ、1995; ガリガニ、レンク、ハンセン、1996; Midgley、Heather、およびDavies、2001; Parrott、Choi、Davies、1994; ペリー、カッチャー、ルンド、イェーツ、ホルマン、デマーズ、2003)。 しかし、アンドロゲン曝露の範囲、精神症状の多様性、および既存の精神機能障害の可能性を考えると、これらの人間の攻撃の場合におけるAASの正確な役割を判断することは困難です。 AASの注射を受けたボランティアの前向き研究の結果は次のように混在しています。 トリッカー他(1996) および オコナー他(2004) 他の研究では攻撃性の増加が観察されているが、怒りの行動の増加は報告されていないDaly、Su、Schmidt、Pickar、Murphy、およびRubinow、2001; Hannan、Friedl、Zold、Kettler、およびPlymate、1991; コウリ、ルーカス、ポープ、オリバ、1995; 教皇とカッツ、1994; Su、Pagliaro、Schmidt、Pickar、Wolkowitz、およびRubinow、1993)。 それにもかかわらず、人間のボランティアに投与される用量は、ボディービルのウェブサイトで提唱されている用量よりもはるかに低く、治療の期間は一般に短いことに留意することが重要です。 したがって、バランス上、少なくとも感受性のある個人では、AASがアゴニスト行動を強化する可能性を持っていると結論付けることは公平であると思われる。 教皇他(1994) AASは脆弱な個人に精神症状を引き起こすことを発見しました。
動物研究はまた、AASによる攻撃性の説得力のある証拠を提供しています。 高用量ステロイドで慢性的に治療された思春期のオスのハムスターは、未治療のオスと比較して、攻撃潜伏期が短く、男性の侵入者に対する攻撃と咬傷の回数が多い(ハリソン、コナー、ノバック、ナッシュ、メロニ、2000; メローニ、コナー、ハング、ハリソン、フェリス、1997)。 同様に、軽度の挑発(テールピンチ)は、雌に対する攻撃性を含む、青年期の雄ラットにおける攻撃性の持続的な増加をもたらします(Cunningham and McGinnis、2006)。 さらに大きな懸念事項として、思春期のハムスターのAASへの曝露は、ステロイドの使用を中止した後も持続するアゴニスト行動の持続的な増加を引き起こします(Grimes and Melloni、2006)。 これらの行動変化には、視床下部前部の神経回路の永続的なリモデリングが伴います。 特に、ハムスターの思春期のAAS曝露は、アルギニンバソプレシン(AVP、 Grimes and Melloni、2006)およびセロトニンとセロトニン作動性の5HT1Aおよび5HT1B受容体をダウンレギュレートします(リッチ、ラザカム、グライムズ、メローニ、2006)。 AASがARの脳レベルも変更することは驚くことではありません。 テストステロンまたはナンドロロンへの慢性暴露は、雄ラットの細胞核ARを上方制御します(メナードとハーラン、1993; ウェッソンとマクギニス、2006)。 したがって、内因性アンドロゲンを補充すること、およびAR発現の増加を介してアンドロゲン応答性を高めることの両方により、AASがアンドロゲン依存性の行動を強化する可能性があります。
アゴニストの行動と比較して、AASは雄のげっ歯類の交尾行動に対する顕著な影響が少なく、反応は使用される特定のステロイドに依存します( クラークとヘンダーソン、2003)。 経口液剤でテストステロンを摂取しているオスのハムスターでは、射精が用量依存的に増加しました(Wood、2002)。 ただし、テストステロンもナンドロロンも思春期の雄ラットの交配を強化しませんでした。 最小のアンドロゲン活性を持つ比較的弱いAASであるスタノゾロールは、おそらく内因性アンドロゲンレベルを低下させることにより、交尾と攻撃の両方を実際に阻害しました(FarrellとMcGinnis、2003)。
思春期のハムスターと成体のハムスターは、AAS暴露に対して異なる行動反応を示す可能性があることに注意することが特に重要です。 AASは思春期の男性のアゴニスト行動を著しく強化しましたが、成人期の同じ治療では、攻撃的な行動がわずかに増加し、性的な行動が大幅に減少しました(2008、サラス・ラミレス、モンタルドおよびシスク)。 これは、アンドロゲン作用の敏感な時期としての思春期の概念と一致しています。 さらに、成人の雄ハムスターが外因性テストステロンに対する耐性を獲得するのと同じように(ピーターズアンドウッド、2005)我々は、発達中の男性が成熟するにつれてテストステロンに対する耐性を獲得すると考えています。 したがって、AASの影響は思春期の発達を通して変化し、思春期のAAS曝露は成人期まで持続する可能性がある過度の攻撃的および性的行動パターンを引き起こす可能性があります。
アンドロゲンの強化効果
交尾と戦いはそれぞれやりがいのあるものです(少なくともあなたが戦いに勝った場合)。 雄ラットは雌と交尾するためにレバーを繰り返し押すでしょう(エヴェリットアンドステイシー、1987) 同様に、オスのマウスとメスのハムスターは、彼らが以前に戦ったことがある場所の条件付き場所嗜好(CPP)を形成します(マルティネス、ギレン・サラザル、サルバドール、シモン、1995; マイゼルとジョッパ、1994) 生殖腺が損なわれていない男性で通常観察されるレベルを超えてAASがやりがいのある社会的行動を強化することができるならば、テストステロン自体がやりがいがあるかもしれないと期待することは論理的です。 これは、報酬と強化のために確立された2つの動物モデルを使用してテストされています:CPPと自己投与。 これらの研究の結果は、テストステロンが同化作用および運動能力が無関係である実験的状況において強化されていることを実証している。 CPPでは、試験物質は独特の環境(例えば試験装置内の特定の室)と繰り返し対にされる。 動物が補強用試験物質をその環境と関連づけると、彼は報酬がなくても環境を探し出すでしょう。 実験動物におけるアンドロゲン報酬の最初の報告は、オスのマウスにおいてCPPを誘発するためにテストステロンの全身注射を使用した(アルネド、サルバドール、マルティネス=サンキス、ゴンザレス=ボノ、2000; アルネド、サルバドール、マルチネス・サンキス、ペリサー、2002)とラット(アレクサンダー、パッカード、そしてハインズ、1994; ジャンヌ、スランゲン、ファン・デ・ポール、1992) その後、我々の研究室はアンドロゲン強化を実証するためにテストステロンの自己投与を使用しました。ジョンソンアンドウッド、2001) 我々は、男性ハムスターが自発的にテストステロンの経口溶液を2ボトル選択テストと食物誘発性飲酒の両方を使って消費することを発見しました。 後の研究で、我々はオスのラットとハムスターに静脈内自己投与を示しました。ウッド、ジョンソン、チュー、シャド、そしてセルフ、2004) 静脈内送達は、アンドロゲン摂取に対する味または腸充填の潜在的な交絡作用を排除する。
AASの乱用の状況では、アンドロゲンの中枢性と末梢性の影響を区別することが重要です。 テストステロンは全身に広範な効果があるので、全身性テストステロン注射による報酬と強化はテストステロンの全身性同化作用およびアンドロゲン作用に続発すると主張することができます。 言い換えれば、テストステロンは筋肉疲労を軽減し、関節機能を改善するので、動物は動物の健康に 感じます もっと良かった。 確かに、この説明は臨床実験で(実験的証拠はないが)AASへの依存および依存の可能性に対して議論するために使用されてきた(DiPasquale、1998) しかし、Packard et al(Packard、Cornell、およびAlexander、1997ラット脳へのテストステロンの直接注射はCPPを誘発し得ることを示した。 同様に、私たちの研究室は、男性ハムスターにおける脳室内(icv)テストステロン自己投与を実証しました(Woodら、2004) テストステロンを用いた脳内CPPおよびicv自己投与は、アンドロゲン強化を媒介する中心的標的を主張している。
テストステロンの強化が性行動へのステロイドの影響に対して以前に確立された同じメカニズムに必ずしも従うわけではないことは注目に値する。 前述したように、MPOAは男性のげっ歯類の性行動を組織化するための重要なサイトです(ハル、マイゼル、そしてサックス、2002) ハムスターでは、MPOAは豊富なステロイド受容体を持っています、そしてMPOAのテストステロンのインプラントは長期の去勢患者の性的活動を回復させます(ウッドとスワン、1999) これらのステロイド作用の時間的経過は遅く、睾丸摘出後数週間は装着行動が持続し、長期の去勢去勢患者における交尾を回復させるためには長期のステロイド暴露が必要です(ノーブルアンドアルサム、1975) しかしながら、雄ラットのMPOAへのテストステロンの注射はCPPを誘発することができません(キング、パッカード、アレクサンダー、1999) これは他の脳領域がアンドロゲン強化のために重要であることを示唆しています。
対照的に、雄ラットはAcbでテストステロン注射のCPPを形成します(Packard他、1997) 他の乱用薬物と同様に、DAはテストステロン強化のための重要な神経伝達物質である可能性があります。シュレーダーとパッカード、2000) しかしながら、他の乱用薬物とは異なり、ハムスターでの我々の研究はテストステロンがAcb DA放出を誘発しないことを示唆しています(トリエムストラ、佐藤、そして木、 報道中) 同様に、雄ラットの研究はアンドロゲンが基礎DAレベルまたはアンフェタミン刺激DA放出に影響を及ぼさないことを示しています(Birgner、Kindlundh-Hogberg、Nyberg、Bergstrom、2006; しかしまた見なさい クラーク、リンデンフェルト、ギボンズ、1996) さらに、テストステロンはAcb DA組織レベルに比較的小さな影響を及ぼします(チブリン、フィン、ロス、ステンファーズ、1999) まとめると、これらのデータはテストステロンの強化が最終的にはAcbのDA活性を変化させるかもしれないが、そのメカニズムはコカインや他の興奮剤のそれとは異なるかもしれないことを示唆している。 これに関して、最近のデータは、AASへの慢性的な曝露がDA代謝を変えることによってDAへの感受性を変えるかもしれないことを示唆している(Kurling、Kankaanpaa、Ellermaa、Karila、およびSeppala、2005)、DA受容体のレベル(Kindlundh、Lindblom、Bergstrom、Wikberg、およびNyberg、2001; Kindlundh、Lindblom、およびNyberg、2003)またはDAトランスポーター(2002のKindlundh、Bergstrom、Monazzam、Hallberg、Blomqvist、Langstrom、およびNyberg).
現在のところ、テストステロン強化のための特定のステロイドシグナル、受容体および脳の作用部位は知られていません。 我々の研究室からのハムスターの最近の研究に基づいて、テストステロンの強化効果はアンドロゲンとエストロゲンの両方によって仲介されるように見えます(ディメオアンドウッド、2006)。 一般的に乱用されているAASには、芳香化可能および非芳香化可能の両方のアンドロゲン(ギャラウェイ、1997; 和田、2006)。 これは、ARとERの両方が報酬のためにステロイド刺激を伝達する可能性があることを意味します。 テストステロン強化は、古典的受容体と非ゲノム受容体の組み合わせによって媒介される可能性があるという追加の可能性があります。
いくつかの証拠は、AASの強化効果における非ゲノム受容体の作用を示しています。 AcbおよびVTAにおけるARのまばらな分布に加えて、アンドロゲン強化の時間経過は迅速であり(<30分)、従来のARによる信号処理は強化に十分な速度ではない可能性があります。 したがって、AAS強化における非ゲノムARの役割をテストするために、XNUMXつの補完的な手法を利用しました(図7)。 1つの実験(佐藤、ヨハンセン、ヨルダン、およびウッド、2006)、精巣の雌性化変異(Tfm、この問題を参照)を持つラットに、芳香族化できないアンドロゲンであるジヒドロテストステロン(DHT)を自己投与することを許可しました。 Tfm変異は、ARでのリガンド結合を大幅に減少させます。 それにもかかわらず、Tfmラットとその野生型のオスの兄弟は、ほぼ同じ量のDHTを自己投与しました。 これは、DHTの非ゲノム効果を主張しています。 その後の研究では、オスのハムスターがウシ血清アルブミン(BSA、 図8, 佐藤と木、2007)。 DHT-BSAコンジュゲートは膜不透過性です。 したがって、その効果は細胞表面に限定されます。 以前に実証されたように、ハムスターはDHTを自己管理しました(ディメオアンドウッド、2006)。 彼らは、DHT-BSAコンジュゲートに対する同様の選好を示したが、BSA単独の自己投与は失敗した。
これらのデータは、アンドロゲン強化における細胞表面ARの中心的な役割を示しています。 現在、そのような受容体の正確な性質は知られていない。 アンドロゲンは、専用の膜AR(トーマス、ドレッシング、パン、バーグ、タブス、ベニングホフ、ダウティー、2006、この問題も参照してください)。 これは、海馬で報告されているように、核外の古典的なARの形である可能性があります(この号では、Sarkey et al。)。 あるいは、以前の研究では、他の神経伝達物質システムのステロイド結合部位も説明されています。 具体的には、AASを含むさまざまなステロイドホルモンは、GABA-A受容体をアロステリックに調節できます(ヘンダーソン、2007; ランバート、ベレリ、ペデン、バーディ、ピーターズ、2003)。 同様に、硫酸化された神経ステロイドは N- メチル - D-アスパラギン酸受容体サブタイプ(マレーエフ、ギブス、ファーブ、2002)受容体。 これは将来の研究にとって重要な分野です。
膜ARが必要なのはなぜですか? 前に説明したように、アンドロゲン分泌とやりがいのある社会的行動の間には密接な関係があります。 交尾または戦いに続くテストステロン分泌の増加は、行動を強化するのに役立つと推測できます。 もしそうなら、刺激(行動)と報酬(テストステロン)の迅速な結合が必要です。 これは、膜ARに結合することで最もよく達成できます。 この点で、交配中にアンドロゲン分泌をクランプすることが性行動の報酬効果を低下させるかどうかを判断することは興味深いでしょう。
まとめ
ここでは、アンドロゲンが成人の動機づけ行動の強力なメディエーターであり、さらに、開発プログラム中のアンドロゲン曝露のタイミングと成人期のアンドロゲン依存動機づけ行動の証拠を検討します。 アナボリックステロイドは、米国の若者による虐待の好まれる薬物になりつつあります。 AASにはコカインやヘロインの中毒性がありませんが、アンドロゲンの強化と依存症の可能性を理解し始めたばかりです。 特に、若者のスポーツの競争が激しくなるにつれて、若い世代からステロイドを使用するアスリートを開発する圧力が高まっています。 この傾向は、思春期のステロイドに敏感な神経成熟の新しい証拠を考慮して問題となっています。
思春期に伴う深部の神経の変化に対する一般社会と科学界の両方の認識が高まっているにもかかわらず、思春期の発達神経生物学の実験的研究は限られています。 思春期の発達の動物モデルは、発達中のホルモン曝露のタイミングがどのように精神病理学と薬物使用の個人のリスクを増加させるか、思春期のタイミングの逸脱の行動的影響を緩和または増幅する経験の種類を調査するために必要です。 たとえば、仲間の影響などの社会的要因は、物質およびアルコール使用の思春期のタイミングの影響を悪化させます(Biehl、Natsuaki、およびGe、2007; パットン、ノヴィ、リー、ヒコック、2004; サイモンズ・モートンとヘイニー、2003; WichstromおよびPedersen、2001)。 思春期のタイミングの動物モデルは、人間の研究努力を知らせ、思春期のより効果的な治療介入につながる可能性があります。
謝辞
これらの研究を支援してくれたエレニ・アンツウラトス、コルトニー・バラード、ルーシー・チュー、ケリー・ピーターズ、ジェニファー・トリエムストラ、ジェーン・ベニエ、リサ・ロジャース、パメラ・モンタルトに感謝します。 この作業は、NIHからの助成金(DA12843からRIW、MH68764からCLS、およびMH070125からKMS)によってサポートされています。
脚注
出版社の免責事項: これは、編集が許可されていない原稿のPDFファイルです。 私達の顧客へのサービスとして私達は原稿のこの初期版を提供しています。 原稿は、最終的に引用可能な形式で出版される前に、写本編集、組版、および結果として得られた証明のレビューを受けます。 制作プロセス中に、内容に影響を与える可能性のある誤りが発見される可能性があり、またジャーナルに適用されるすべての法的な免責事項が関係します。
参考文献
- アレクサンダーGM、パッカードMG、ハインズM.テストステロンは雄ラットにおいてやりがいのある感情的性質を持つ:性的動機の生物学的根拠に対する意味。 行動神経科学 1994。108:424-8。 [PubMedの]
- アンダーセンSL。 脳発達の軌跡:脆弱性の点または機会の窓? 神経科学および生物行動学的レビュー。 2003。27:3-18。 [PubMedの]
- Andersen SL、Rutstein M、Benzo JM、Hostetter JC、Teicher MH。 ドーパミン受容体の過剰生産と排泄における性差。 Neuroreport。 1997。8:1495-8。 [PubMedの]
- Arnedo MT、サルバドールA、Martinez-Sanchis S、Gonzalez-Bono E.無傷の雄マウスにおけるテストステロンの有益な特性:予備的研究。 薬理学、生化学および行動。 2000。65:327-32。
- Arnedo MT、サルバドールA、マルティネス-サンキスS、ペリセルO.短期および長期の攻撃潜伏期の個人として評価されたマウスにおけるテストステロンの同様の報酬効果。 中毒生物学。 2002。7:373-9。 [PubMedの]
- アーノルドAP、ブリードラブSM。 性ステロイドの脳および行動に対する組織的および活性化効果:再分析。 ホルモンと行動。 1985。19:469-98。 [PubMedの]
- Benes FM、Taylor JB、Cunningham MC。 出生後の期間の内側前頭前野におけるモノアミン作動系の収束性と可塑性精神病理学の発展に対する意義 大脳皮質。 2000。10:1014-27。 [PubMedの]
- Benes FM、Turtle M、Khan Y、FarolP。海馬形成における重要なリレーゾーンの髄鞘形成は、小児期、青年期、および成人期の間にヒトの脳で起こる。 一般精神医学のアーカイブ。 1994。51:477-84。 [PubMedの]
- Biehl MC、Natsuaki MN、Ge XJ。 思春期のタイミングがアルコール摂取と大量飲酒の軌跡に与える影響。 青年および青年のジャーナル。 2007。36:153-167。
- Birgner C、Kindlundh-Hogberg AM、Nyberg F、Bergstrom L. 神経科学の手紙 2006。 亜慢性ナンドロロン投与とそれに続くアンフェタミン負荷に応じたラット側坐核シェルのDOPACおよびHVAの細胞外レベルの変化。
- Bond AJ、Choi PY、Pope HG。、Jrアナボリックアンドロゲンステロイドの使用者と非使用者における注意の偏りと気分の評価。 薬物およびアルコール依存症。 1995。37:241-5。 [PubMedの]
- ブロワーKJ。 同化ステロイドホルモンの乱用と依存 最新の精神医学レポート 2002。4:377-87。 [PubMedの]
- Brower KJ、Catlin DH、Blow FC、Eliopulos GA、Beresford TP。 蛋白同化アンドロゲンステロイドの乱用と依存症の臨床評価と尿検査。 American Journal of Drug&AlcoholAbuse。 1991。17:161-171。 [PubMedの]
- Celotti F、Negri-Cesi P、Poletti A.哺乳類の脳におけるステロイド代謝:5alpha還元と芳香族化。 脳研究会報。 1997。44:365-75。 [PubMedの]
- チョンWC、デフリースGJ、スワブDF。 人間の末端線条の床核の性分化は、成人期にまで及ぶ場合があります。 神経科学ジャーナル。 2002。22:1027-33。 [PubMedの]
- クラークAS、ヘンダーソンLP。 同化アンドロゲンステロイドに対する行動的および生理学的反応。 神経科学および生物行動学的レビュー。 2003。27:413-36。 [PubMedの]
- クラークAS、リンデンフェルトRC、ギボンズCH。 同化アンドロゲンステロイドと脳の報酬。 薬理学、生化学および行動。 1996。53:741-5。
- Conacher GN、Workman DG。 おそらく同化ステロイドの使用に関連する暴力犯罪。 アメリカ精神医学会誌。 1989。146:679。 [PubMedの]
- Cunningham RL、McGinnis MY。 思春期の蛋白同化アンドロゲンステロイド暴露雄ラットの物理的誘発は、雌に対する攻撃性を誘発します。 ホルモンと行動。 2006。50:410-6。 [PubMedの]
- Daly RC、Su TP、Schmidt PJ、Pickar D、Murphy DL、Rubinow DR。 メチルテストステロン投与後の脳脊髄液と行動の変化:予備調査結果。 一般精神医学のアーカイブ。 2001。58:172-7。 [PubMedの]
- Davis EC、Shryne JE、Gorski RA。 ラット視床下部の前腹側脳室周囲核の構造的性的二型は、周産期に性腺ステロイドに敏感ですが、海綿体周囲に発達します。 神経内分泌学 1996。63:142-8。 [PubMedの]
- de Beun R、Jansen E、Slangen JL、Van de Poll NE。 ラットの食欲および識別刺激としてのテストステロン:性および用量依存効果。 生理学と行動。 1992。52:629-34。 [PubMedの]
- デカバンAS。 人間の生活期間中の脳重量の変化:脳重量と身長および体重との関係。 神経学の年報。 1978。4:345-56。 [PubMedの]
- Di Chiara G、Imperato A.ヒトに乱用された薬物は、自由に動くラットの中辺縁系のシナプスドーパミン濃度を優先的に増加させます。 アメリカ合衆国国立科学アカデミーの議事録。 1988。85:5274-8。 [PMCフリーの記事] [PubMedの]
- DiMeo AN、ウッドRI。 男性ハムスターにおけるエストロゲンとジヒドロテストステロンの自己投与 ホルモンと行動。 2006。49:519-26。 [PubMedの]
- DiPasquale M.アナボリックステロイド。 In:Tarter RE、Ammerman RT、Ott PJ、エディター。 薬物乱用のハンドブック。 プレナムプレス; NY:1998。 pp。547–565。
- ドミンゲスJ、リオロJV、シューZ、ハルEM。 交尾および内側視索前ドーパミン放出の内側扁桃体による調節。 神経科学ジャーナル。 2001。21:349-355。 [PubMedの]
- ドミンゲスJM、ハルEM 内側扁桃体の刺激は、内側視索前ドーパミン放出を促進します:雄ラットの性的行動への影響。 脳の研究 2001。917:225-229。 [PubMedの]
- Du J、Lorrain DS、Hull EM。 去勢は細胞外を減少させるが、雄ラットの内側視索前野の細胞内ドーパミンを増加させる。 脳の研究 1998。782:11-17。 [PubMedの]
- Eckenhoff MF、Rakic P.アカゲザルの寿命中の海馬歯状回における増殖細胞の性質と運命。 神経科学ジャーナル。 1988。8:2729-47。 [PubMedの]
- Everitt BJ、Stacey P.雄ラット(Rattus norvegicus)における性的強化を伴う器械的行動の研究:II。 視索前野病変、去勢、テストステロンの影響。 比較心理学ジャーナル。 1987。101:407-19。 [PubMedの]
- ギャラウェイ・S ステロイド聖書。 ベルインターナショナルプレス; カリフォルニア州サクラメント:1997。
- Galligani N、Renck A、Hansen S.同化アンドロゲンステロイドを使用している男性の性格プロファイル。 ホルモンと行動。 1996。30:170-5。 [PubMedの]
- Grimes JM、Melloni RH。、Jrハムスター(Mesocricetus auratus)における思春期のアナボリックアンドロゲンステロイド暴露の停止後のセロトニン神経系の長期変化 行動神経科学 2006。120:1242-51。 [PubMedの]
- Hannan CJ、Jr、Friedl KE、Zold A、Kettler TM、Plymate SR。 アンドロゲンステロイドを投与された男性の心理的および血清ホモバニリン酸の変化。 精神神経内分泌学。 1991。16:335-43。 [PubMedの]
- ハリソンRJ、コナーDF、ノバックC、ナッシュK、メロニRH。、青年期の慢性同化アンドロゲンステロイド治療は、視床下部前部のバソプレシンと無傷のハムスターの攻撃性を増加させます。 精神神経内分泌学。 2000。25:317-38。 [PubMedの]
- 彼J、クルーFT。 神経新生は、青年期から成人期までの脳の成熟中に減少します。 薬理学、生化学および行動。 2007。86:327-33。
- ヘンダーソンLP。 視床下部におけるGABAA受容体を介した伝達のステロイド調節:生殖機能への影響。 神経薬理学。 2007。52:1439-53。 [PMCフリーの記事] [PubMedの]
- Hull EM、Du J、Lorrain DS、Matuszewich L.内側視索前野における細胞外ドーパミン:性的動機付けおよび交尾のホルモン制御への影響。 神経科学ジャーナル。 1995。15:7465-7471。 [PubMedの]
- ハルEM、マイゼルRL、サックスBD。 男性の性的行動。 In:Pfaff DW、Arnold AP、Etgen AM、Fahrbach SE、Rubin RT、エディター。 ホルモン、脳、および行動。 アカデミックプレス; ニューヨーク:2002。 pp。3–137。
- Hull EM、Wood RI、McKenna KE。 男性の性行動の神経生物学。 で:ニールJD、エディター。 生殖の生理学。 巻 1。 Elsevier Press; ニューヨーク:2006。 pp。1729–1824。
- Huttenlocher PR、Dabholkar AS ヒト大脳皮質におけるシナプス形成の地域差 比較神経学のジャーナル。 1997。387:167-78。 [PubMedの]
- ジョンソンLR、ウッドRI。 男性ハムスターにおける経口テストステロン自己投与 神経内分泌学 2001。73:285-92。 [PubMedの]
- ジョンストンLD、オマリーPM、バックマンJG。 中学生(NIH出版番号03–5375) I.ベセスダ、MD:国立薬物乱用研究所; 2003。 薬物使用に関する将来の全国調査結果の監視、1975–2002。
- カイザーファミリー財団。 米国のティーンの性的活動。 2005。 pp。#3040–02。
- Kashon ML、Hayes MJ、Shek PP、Sisk CL。 思春期前の雄のフェレットにおけるアンドロゲンによる脳アンドロゲン受容体免疫反応性の調節。 生殖の生物学。 1995。52:1198-205。 [PubMedの]
- Kindlundh AM、Bergstrom M、Monazzam A、Hallberg M、Blomqvist G、Langstrom B、Nyberg F.ポジトロン放出断層撮影によってラット脳で視覚化されたナンドロロンによる慢性治療後のドーパミン作動性効果。 NeuroPsychopharmacology&BiologicalPsychiatryの進歩。 2002。26:1303-8。
- Kindlundh AM、Lindblom J、Bergstrom L、Wikberg JE、Nyberg F.アナボリックアンドロゲンステロイドであるデカン酸ナンドロロンは、雄ラットの脳のドーパミン受容体の密度に影響します。 European Journal of Neuroscience。 2001。13:291-6。 [PubMedの]
- Kindlundh AM、Lindblom J、Nyberg F.デカン酸ナンドロロンによる慢性投与は、ラット脳のドーパミンD(1)-およびD(2)-受容体の遺伝子転写物の変化を誘発します。 脳の研究 2003。979:37-42。 [PubMedの]
- キングBE、パッカードMG、アレクサンダーGM。 雄ラットにおけるテストステロンの内側視索前部注射の感情特性 神経科学の手紙 1999。269:149-52。 [PubMedの]
- コーブGF、ネスラーEJ。 薬物中毒の神経生物学 Journal of Neuropsychiatry&ClinicalNeurosciences。 1997。9:482-97。 [PubMedの]
- Kouri EM、Lukas SE、教皇HG、Jr、Oliva PS。 徐々に増加する用量のテストステロンシピオネートの投与後の男性志願者における攻撃的反応の増加。 薬物およびアルコール依存症。 1995。40:73-9。 [PubMedの]
- クリッツァーMF。 長期性腺摘出術は成体雄ラットの内側前頭前皮質におけるチロシンヒドロキシラーゼ - 密度に影響を与えるがドーパミン - ベータ - ヒドロキシラーゼ - 、コリンアセチルトランスフェラーゼ - またはセロトニン - 免疫反応性軸索には影響しない 大脳皮質。 2003。13:282-296。 [PubMedの]
- Kurling S、Kankaanpaa A、Ellermaa S、Karila T、Seppala T.ラットの脳のドーパミン作動性およびセロトニン作動性神経系に対する亜慢性ナンドロロンデカン酸治療の効果。 脳の研究 2005。1044:67-75。 [PubMedの]
- Lambert JJ、Belelli D、Peden DR、Vardy AW、Peters JA。 GABA A受容体の神経ステロイドによる調節 神経生物学の進歩。 2003。71:67-80。 [PubMedの]
- Lenroot RK、Giedd JN。 小児および青年における脳の発達解剖学的磁気共鳴画像法からの洞察 神経科学および生物行動学的レビュー。 2006。30:718-29。
- Lesting J、Neddens J、Teuchert-Noodt G.スナネズミの側坐核におけるドーパミン神経支配の個体発生。 脳の研究 2005。1066:16-23。 [PubMedの]
- マラエフA、ギブスTT、ファーブDH。 硫酸プレグネノロンによるNMDA応答の阻害は硫酸化ステロイドによるNMDA受容体のサブタイプ選択的調節を明らかにする British Journal of Pharmacology。 2002。135:901-9。 [PMCフリーの記事] [PubMedの]
- マルティネスM、ギレンサラザールF、サルバドールA、サイモンVM。 マウスの成功した雌間攻撃と条件付けされた場所の好み。 生理学と行動。 1995。58:323-8。 [PubMedの]
- ミークLR、ロミオRD、ノバクCM、シスクCL 思春期前および思春期後の雄ハムスターにおけるテストステロンの作用:生殖行動および脳アンドロゲン受容体免疫反応性への影響の分離。 ホルモンと行動。 1997。31:75-88。
- Meisel RL、Joppa MA。 攻撃的または性的な出会いの後の女性ハムスターの条件付き場所の好み。 生理学と行動。 1994。56:1115-8。 [PubMedの]
- メロニRH、Jr、コナーDF、ハングPT、ハリソンRJ、フェリスCF。 ゴールデンハムスターの思春期および攻撃的行動中の同化アンドロゲンステロイド曝露。 生理学と行動 1997。61:359-64。 [PubMedの]
- Menard C、Harlan R.アンドロゲン同化ステロイドによるラット脳におけるアンドロゲン受容体免疫反応性のアップレギュレーション。 脳の研究 1993。622:226-236。 [PubMedの]
- Mermelstein PG、Becker JB、Surmeier DJ。 エストラジオールは膜受容体を介してラット新線条体ニューロンのカルシウム電流を減少させる 神経科学ジャーナル。 1996。16:595-604。 [PubMedの]
- Midgley SJ、Heather N、Davies JB。 同化アンドロゲンステロイドユーザーのグループ間の攻撃性のレベル。 医学、科学、法。 2001。41:309-14。
- モレンダ・フィゲイラHN、サラス・ラミレスKY、シュルツKM、ゼールJL、モンタルトPR、シスクCL 思春期の社会的経験は、思春期のテストステロンを欠くオスのシリアンハムスターの成体の射精行動を回復させます。 行動神経内分泌学会; カリフォルニア州パシフィックグローブ:2007。
- ノーブルRG、アルサムPB。 ゴールデンハムスター(Mesocricetus auratus)のホルモン依存性性的二型 生理学と行動。 1975。14:567-74。 [PubMedの]
- ヌネスJL、ラウシュケDM、ジュラスカJM 雄および雌ラットの後部皮質の発達における細胞死。 比較神経学のジャーナル。 2001。436:32-41。 [PubMedの]
- ヌネスJL、ソディJ、ジュラスカJM 出生後20後の卵巣ホルモンは、ラットの一次視覚野のニューロン数を減少させます。 Journal of Neurobiology。 2002。52:312-21。 [PubMedの]
- オコナーDB、アーチャーJ、ウーFC。 若い男性の気分、攻撃性、性的行動に対するテストステロンの効果:二重盲検、プラセボ対照、クロスオーバー試験。 Journal of Clinical Endocrinology&Metabolism。 2004。89:2837-45。 [PubMedの]
- Packard MG、Cornell AH、Alexander GM。 テストステロンの側坐核内注射のやりがいのある感情的性質 行動神経科学 1997。111:219-24。 [PubMedの]
- Parfitt DB、Thompson RC、Richardson HN、Romeo RD、Sisk CL。 GnRH mRNAは、男性のシリアンハムスターの脳の思春期に伴い増加します。 神経内分泌学のジャーナル。 1999。11:621-7。 [PubMedの]
- Parrott AC、Choi PY、Davies M.アマチュア選手によるアナボリックステロイドの使用:心理的気分状態への影響。 スポーツ医学と体力のジャーナル。 1994。34:292-8。 [PubMedの]
- Patton PE、Novy MJ、Lee DM、Hickok LR。 完全な中隔子宮、重複した子宮頸部および膣中隔の外科的治療後の診断および生殖結果。 American Journal of Obstetrics&Gynecology。 2004。190:1669–75。 1675–8。 [PubMedの]
- Paus T、Collins DL、Evans AC、Leonard G、Pike B、Zijdenbos A.人間の脳の白質の成熟:磁気共鳴研究のレビュー。 脳研究会報。 2001。54:255-66。 [PubMedの]
- Perry PJ、Kutscher EC、Lund BC、Yates WR、Holman TL、Demers L.アンドロゲン性アナボリックステロイド使用の有無にかかわらず男性重量挙げ選手の攻撃性と気分の変化の測定。 フォレンジックサイエンスのジャーナル。 2003。48:646-51。 [PubMedの]
- ピーターズKD、ウッドRI。 ハムスターにおけるアンドロゲン依存性過剰摂取、耐性、および潜在的なオピオイド作動メカニズム 神経科学 2005。130:971-81。 [PubMedの]
- Pfaus JG、Damsma G、Nomikos GG、Wenkstern DG、Blaha CD、Phillips AG、Fibiger HC。 性的行動は雄ラットの中心ドーパミン伝達を促進します。 脳の研究 1990。530:345-348。 [PubMedの]
- フェニックスCH、ゴイRW、ジェラルAA、ヤングWC。 雌モルモットの交配行動を媒介する組織に対する出生前に投与されたプロピオン酸テストステロンの組織化作用。 内分泌学。 1959。65:369-82。 [PubMedの]
- ピノスH、コラードP、ロドリゲスザフラM、ロドリゲスC、セゴビアS、ギラモンA.ラットの青斑核における性差の発生。 脳研究会報。 2001。56:73-8。 [PubMedの]
- 教皇HG、Jr、カッツDL。 蛋白同化ステロイド使用者による殺人およびほぼ殺人。[コメントを参照] 臨床精神医学ジャーナル。 1990。51:28-31。 [PubMedの]
- 教皇HG、ジュニア、カッツDL。 同化アンドロゲンステロイド使用の精神医学的および医学的効果 160アスリートの対照研究 一般精神医学のアーカイブ。 1994。51:375-82。 [PubMedの]
- 教皇HG、Jr、古宇利EM、パウエルKF、キャンベルC、カッツDL 133囚人の間の同化アンドロゲンステロイドの使用。 総合精神医学 1996。37:322-7。 [PubMedの]
- パトナムSK、デュJ、佐藤S、ハルEM 交尾行動のテストステロン回復は、去勢雄ラットの内側視索前ドーパミン放出と相関します。 ホルモンと行動。 2001。39:216-224。 [PubMedの]
- パトナムSK、佐藤S、ハルEM 去勢雄ラットの交尾および内側視索前ドーパミン放出に対するテストステロン代謝産物の影響 ホルモンと行動。 2003。44:419-26。 [PubMedの]
- パトナムSK、佐藤S、リオーロJV、ハルEM 去勢雄ラットの交尾、内側視索前ドーパミン、およびNOS免疫反応性に対するテストステロン代謝産物の影響。 ホルモンと行動。 2005。47:513-522。 [PubMedの]
- ランキンSL、パートローGD、マッカーディRD、ジャイルズED、フィッシャーKR。 ブタ視床下部のバソプレシンおよびオキシトシン含有核における出生後神経発生 脳の研究 2003。971:189-96。 [PubMedの]
- Ricci LA、Rasakham K、Grimes JM、Melloni RH。、Jr Serotonin-1A受容体の活性と発現は、ハムスターの思春期の同化/アンドロゲン性ステロイド誘発性攻撃を調節します。 薬理学、生化学および行動。 2006。85:1-11。
- ロミオRD、クックウィーンズE、リチャードソンHN、シスクCL ジヒドロテストステロンは、成体のオスのハムスターでは性的行動を活性化しますが、少年では活性化しません。 生理学と行動。 2001。73:579-84。 [PubMedの]
- Romeo RD、Diedrich SL、Sisk CL。 思春期前および成人のオスのシリアンハムスターにおけるエストロゲン受容体の免疫反応性。 神経科学の手紙 1999。265:167-70。 [PubMedの]
- Romeo RD、Parfitt DB、Richardson HN、Sisk CL。 フェロモンは、思春期前および成体のオスのハムスターで同等レベルのFos免疫反応性を誘発します。 ホルモンと行動。 1998。34:48-55。 [PubMedの]
- ロメオRD、リチャードソンHN、Sisk CL。 思春期と男性の脳の成熟および性行動:行動の可能性を再現する。 神経科学および生物行動学的レビュー。 2002a;26:381-91。 [PubMedの]
- Romeo RD、Wagner CK、Jansen HT、Diedrich SL、Sisk CL エストラジオールは視床下部のプロゲステロン受容体を誘導しますが、思春期前の雄ハムスター(Mesocricetus auratus)の交尾行動を活性化しません。 行動神経科学 2002b;116:198-205。 [PubMedの]
- Salas-Ramirez KY、モンタルトPR、Sisk CL。 同化アンドロゲンステロイド(AAS)は、思春期および成人男性のシリアンハムスターの社会的行動に差別的に影響します。 ホルモンと行動。 2008 報道中。
- SAMHSA / OAS。 DHHS出版番号(SMA) 1996。 1994薬物乱用に関する全国世帯調査、主な調査結果1994。 pp。96–3085。
- SAMHSA / OAS。 薬物使用と健康に関する2004全国調査の結果:全国調査結果。 2005。 NSDUHシリーズH-28、DHHS出版番号SMA 05–4062。
- 佐藤SM、ヨハンセンJ、ジョーダンCL、ウッドRI。 Tfmラットにおけるアンドロゲンの自己投与。 行動神経内分泌学会10th Annual Meeting.2006。
- 佐藤SM、ウッドRI。 シリアンハムスターにおける膜不透過性同化アンドロゲンステロイド(aas)の自己投与。 行動神経内分泌学の社会の11th年次総会。2007。
- シュレーダーJP、パッカードMG。 ラットのテストステロン条件付け場所嗜好性の獲得におけるドーパミン受容体サブタイプの役割 神経科学の手紙 2000。282:17-20。 [PubMedの]
- シュルテHM、ホールMJ、ボイヤーM.アナボリックステロイド乱用に関連する家庭内暴力。 アメリカ精神医学会誌。 1993。150:348。 [PubMedの]
- シュルツKM、メナードTA、スミスDA、アルバースHE、シスクCL 青年期の精巣ホルモンへの曝露は、横隔膜の側面マーキング行動とバソプレッシン受容体結合を組織化します。 ホルモンと行動。 2006。50:477-83。 [PubMedの]
- シュルツKM、リチャードソンHN、ロミオRD、モリスJA、ルッキングランドKJ、シスクCL 雌のフェロモンに対する内側視索前野のドーパミン作動性反応は、オスのシリアンハムスターの思春期に発生します。 脳の研究 2003。988:139-45。 [PubMedの]
- シュルツKM、リチャードソンHN、ゼアJL、オセテックAJ、メナードTA、シスクCL 性腺ホルモンは、オスのシリアンハムスターの思春期の間に生殖行動を男性化し、女性の体を排除します。 ホルモンと行動。 2004。45:242-9。 [PubMedの]
- Schulz KM、Sisk CL。 思春期ホルモン、思春期の脳、社会的行動の成熟シリアのハムスターからの教訓 分子および細胞内分泌学。 2006:254–255. 120–6.
- Schulz KM、Zehr JL、Salas-Ramirez KY、Sisk CL。 神経科学会議プランナー。 カリフォルニア州サンディエゴ:Society for Neuroscience; 2007。 青年期は、成人男性の生殖行動に対するテストステロンの影響を整理するための第二の敏感な時期ですか? 2007オンライン。
- スコットJP、スチュワートJM、デゲットVJ。 システムの組織における重要な時期。 発達心理生物学 1974。7:489-513。 [PubMedの]
- Shughrue PJ、レーンMV、Merchenthaler I.ラット中枢神経系におけるエストロゲン受容体アルファおよびベータmRNAの比較分布。 比較神経学のジャーナル。 1997。388:507-25。 [PubMedの]
- サイモンズ・モートンBG、ヘイニーDL。 6年生における喫煙段階の増加の心理社会的予測因子。 健康行動のアメリカジャーナル。 2003。27:592-602。 [PubMedの]
- Sisk CL、Zehr JL。 思春期ホルモンは思春期の脳と行動を組織化します。 神経内分泌学のフロンティア 2005。26:163-74。 [PubMedの]
- Sowell ER、トンプソンPM、レナードCM、ウェルカムSE、カンE、トーガAW。 正常な子供の皮質の厚さと脳の成長の縦断的マッピング。 神経科学ジャーナル。 2004。24:8223-31。 [PubMedの]
- Sowell ER、Thompson PM、Tessner KD、Toga AW。 背側前頭皮質における継続的な脳成長と灰白質密度の減少のマッピング:思春期後の脳成熟中の逆の関係 神経科学ジャーナル。 2001。21:8819-29。 [PubMedの]
- スピアLP。 思春期の脳と加齢に伴う行動の発現 神経科学および生物行動学的レビュー。 2000。24:417-63。
- Su TP、Pagliaro M、Schmidt PJ、Pickar D、Wolkowitz O、Rubinow DR。 男性の正常志願者における同化ステロイドの神経精神医学的効果。 JAMA。 1993。269:2760-4。 [PubMedの]
- Thiblin I、Finn A、Ross SB、Stenfors C.同化アンドロゲンステロイドによる長期治療後の雄ラット脳のドーパミン作動性および5ヒドロキシトリプタミン作動性活性の増加。 British Journal of Pharmacology。 1999。126:1301-6。 [PMCフリーの記事] [PubMedの]
- Thomas P、ドレッシングG、Pang Y、Berg H、C管、Benninghoff A、Doughty K. Progestin、魚生殖腺におけるエストロゲンおよびアンドロゲンGタンパク質共役受容体。 ステロイド 2006。71:310-6。 [PubMedの]
- Tricker R、Casaburi R、Storer TW、Clevenger B、Berman N、Shirazi A、BhasinS。健康な真正男性の怒り行動に対する超生理学的用量のテストステロンの影響-臨床研究センターの研究。 Journal of Clinical Endocrinology&Metabolism。 1996。81:3754-8。 [PubMedの]
- Triemstra JL、長谷S、ウッドRI。 化学感覚の手がかりは、オスのシリアンハムスターのMPOAにおける交配誘発ドーパミン放出に不可欠です。 神経精神薬理学。 2005。30:1436-42。 [PubMedの]
- Triemstra JL、佐藤SM、ウッドRI。 シリアンハムスター雄におけるテストステロンと側坐核ドーパミン 精神神経内分泌学 (印刷中)
- Van Eenoo P、Delbeke FT。 国際スポーツでのドーピングの有病率と比較した、フランダースでのドーピングの有病率。 スポーツ医学の国際ジャーナル。 2003。24:565-570。 [PubMedの]
- 和田。 認定試験所による有害分析結果の報告 2006. http://www.wada-ama.org.
- Wesson DW、McGinnis MY。 ラットの思春期に同化アンドロゲンステロイド(AAS)をスタッキング:神経内分泌と行動の評価。 薬理学、生化学および行動。 2006。83:410-9。
- Wichstrom L、Pedersen W.思春期における同化アンドロゲンステロイドの使用:勝利、見栄え、または悪い? アルコールに関する研究のジャーナル。 2001。62:5-13。 [PubMedの]
- ウッドRI、ジョンソンLR、チューL、Schad C、自己DW。 テストステロン強化雄ラットおよびハムスターにおける静脈内および脳室内自己投与 精神薬理学。 2004。171:298-305。 [PubMedの]
- ウッドRI、ニューマンSW。 アンドロゲンおよびエストロゲン受容体は、シリアンハムスターの脳内の個々のニューロンと共存します。 神経内分泌学 1995。62:487-97。 [PubMedの]
- ウッドRI、スワンJM 男性の性行動を制御する化学感覚およびホルモン信号の神経統合。 In:Wallen K、Schneider JS、エディター。 コンテキストでの複製。 MIT Press; ケンブリッジ:1999。 pp。423–444。
- Zahm DS、Heimer L.ラット側坐核に由来する2つの経眼球経路。 比較神経学のジャーナル。 1990。302:437-46。 [PubMedの]