- 1カリアリ大学、カリアリ、イタリア、生物医学科学、神経科学および臨床薬理学セクション、および中毒の神経生物学センター
- 2カリアリ大学、カリアリ、イタリアの生命環境科学部、薬学、薬理学および栄養補助食品科学のセクション
- 3神経科学研究所、国立研究評議会、カリアリセクション、チッタデッラ大学、イタリア、カリアリ
ローマン・ハイ(RHA)およびロー・アボイダンス(RLA)の近交系ラットは、シャトルボックスでの能動的回避反応の獲得がそれぞれ速いか悪いかで異なり、性的に存在する場合の性的活動の違いを示します受容雌ラット。 確かに、RHAラットはRLAラットよりも高いレベルの性的動機付けと交尾能力を示し、性的活動を繰り返しても持続します。 これらの違いは、RHAラット対RLAラットの中脳辺縁系ドーパミン作動性システムのより高いトーンと相関しており、性活動中のRLAラットよりもRHAの側坐核から得られた透析液に見られるドーパミンのより高い増加によって明らかになりました。 この研究は、細胞外ドーパミンおよびノルアドレナリン(NA)も、アクセスできない雌ラットの存在下に置かれた雄のRHAおよびRLAラットの内側前頭前野(mPFC)からの透析液の増加を示し、より直接的な性的相互作用中に顕著になります。 ドーパミン(およびその主な代謝物3,4-ジヒドロキシフェニル酢酸、DOPAC)およびNAのこのような増加は、性的経験のない動物と経験のある動物の両方で見られましたが、次のとおりでした:(i)RLAラットよりRHAで; (ii)性的に経験のあるRHAおよびRLAラットでは、ナイーブなラットよりも。 最後に、mPFCのドーパミンとNAの違いは、RHAラットが性的にナイーブな状態と経験のある状態の両方でRLAラットよりも高いレベルの性的動機付けと交尾能力を示したため、性的活動のそれらに付随して発生しました。 これらの結果は、中脳辺縁系ドーパミン作動性システムで示唆されているように、RHAおよびRLAラットで見られる異なる交尾パターンに関与する可能性のあるノルアドレナリン作動性トーンの増加とともに、より高いドーパミン作動性トーンもmPFCで発生することを示唆しています。
概要
ローマン・ハイ(RHA)およびロー・アボイダンス(RLA)の非近交系ラット系統は、元々シャトルボックスでのアクティブな回避応答の迅速な獲得と劣悪な獲得のために選択されました(ビグナミ、1965; ブロードハーストとビッグナミ、1965; Driscoll andBättig、1982; フェルナンデス・テルエルら、2002; ジョルジ他、2007)性的に受容的な雌ラットの存在下に置かれた場合、性的活動に有意差を示します。 実際、RHAラットは、RLAラットよりも高いレベルの性的動機付けを示します。これは、これらのラットがアクセスできない受容雌の存在下で示す非接触陰茎勃起の数が多く、RLAラットよりも良好な交尾能力があることから明らかです。 2つのラット系統間の最初の交尾試験で主に見られる多数の交尾パラメーターの有意差によりサンナ他、2014a)。 RHAラットとRLAラットの間に見られる最も顕著な違いには、マウントと挿入を開始し、最初の交尾試験で射精するラットの割合があります(80%のRHAラットに対する40%のRHAラット、サンナ他、2014a)。 実験的証拠の大部分は、機能的に異なるドーパミン作動性の緊張がRHAとRLAラットの間の交尾の違いに関与していることを示唆しています。 実際、RHAおよびRLAラットの異なる交尾パターンは、アポモルフィン、性行動を促進する用量で投与される混合D1 / D2ドーパミン受容体アゴニスト、およびハロペリドール(D2ドーパミン受容体拮抗薬)によって異なるように修飾されることがわかっています性的行動を阻害する低用量(サンナ他、2014b)。 したがって、RLAラットは、アポモルヒネとハロペリドールによってそれぞれ誘発される性行動の促進と抑制に対してより敏感であることがわかりました。 RHAラットに対するRLAラット(サンナ他、2014b)。 この研究にとっておそらくより重要なことは、RHAラットとRLAラットの交尾パターンの違いは、中脳辺縁系ドーパミン作動性ニューロンの活動の違いにも関係していることです。Pfausら、1990; Pleimら、1990; ファウスとフィリップス、1991; Damsma et al。、1992; Wenksternら、1993; Balfourら、2004; Pitchers他、2010, 2013; Beloate et al。、2016)。 実際、性的にナイーブで性的に経験したRHAおよびRLAラットは側坐核からの透析液中の細胞外ドーパミンの基本値が同じであるという事実にもかかわらず、細胞外ドーパミンおよび3,4-ジヒドロキシフェニル酢酸の濃度(DOPAC、その主要代謝産物の1つ)、性的行動の予測段階と消費段階の両方で、ナイーブで性的に経験したRHAおよびRLAラットの側坐核シェルから得られた透析液で差次的に増加することがわかっています。 上記の違いは、性的にナイーブなRHAラットとRLAラットの間でより顕著でしたが、性行動の違いで見られるように、これらのラットでは減少する傾向がありますが、性的に経験したRHAラットとRLAラットの間で持続しました(サンナ他、2015).
性的活動中に見られる側坐核のドーパミン作動性活動の増加の機能的役割(性的行動の食欲および消費段階のいずれか)は、論争の問題であり、性的活動のように、摂食中に見られるものも強い動機付けの価。 したがって、側坐核のドーパミンは動機付けに関与し、中脳辺縁系ドーパミン作動性ニューロンは通常報酬ニューロンと呼ばれますが、最近の研究では、最近の研究は中脳辺縁ドーパミンが動機付けまたは報酬行動の主要な発現に関与していないという仮説を支持しています、むしろ、刺激と報酬の関連性の学習と記憶(Agmoら、1995; ベリッジとロビンソン、1998; 池本とパンクセップ、1999; Pitchers他、2013, 2014; Beloate et al。、2016; Salamoneら、2016)。 この仮説に沿って、側坐核のドーパミン受容体の遮断または腹側被蓋野のドーパミン作動性ニューロンの不活性化は、最近、オスのラットの交尾行動の食欲と消費の側面の発現を変えることができないことがわかった(Pitchers他、2013, 2014; Beloate et al。、2016).
ただし、RHAラットとRLAラットの間の性行動の上記の違いにおけるドーパミンを含む他の脳領域の役割を排除することはできません。 したがって、ドーパミンは、側坐核だけでなく、実験動物およびヒトにおいても、性行動の予測期および消費期に促進効果を及ぼすことがよく知られています(エヴェリット、1990; Pfausら、1990; ハル他、1991; Pfaus and Everitt、1995; メリスとアルギオラス、2011)だけでなく、内側視索前野、視床下部およびその核(すなわち、脳室傍核(PVN)など)の他の脳領域でも。 ファウスとフィリップス、1991; Argiolas and Melis、1995, 2005, 2013; ハル他、1995, 1999; メリスとアルギオラス、1995; Melisら、2003; Succu et al。、2007; Pfaus、2010)。 ドーパミンを含み、性行動に関与する可能性のある別の領域は、内側前頭前野(mPFC; Fernández-Guastiet al。、1994; AgmoおよびVillalpando、1995; Agmoら、1995; Hernández-Gonzáleset al。、1998, 2007; 掛山ら、2003; Balfourら、2006; Afonso他、2007; Davis他、2010; フェボ、2011)。 実際、この脳の領域では、中脳皮質のドーパミンニューロンの神経終末が見られ、その細胞体は中脳辺縁のドーパミンニューロンとして腹側被蓋領域に局在しています。 側坐核に関しては、性的行動におけるこの脳領域の正確な役割は明らかではありません。 実際、mPFCの病変は通常、性的受容性のある雌の雄ラットの性的行動を変えることができないことがわかっています(Fernández-Guastiet al。、1994; AgmoおよびVillalpando、1995; Agmoら、1995; Hernández-Gonzáleset al。、1998, 2007; 掛山ら、2003; Balfourら、2006; Afonso他、2007)、性的報酬に対する条件付き場所の好みの表現(Davis他、2010)。 しかし、性的報酬に対する条件付けされた場所の好みの外観を変えなかったmPFC病変は、同じ動物で嫌悪刺激と組み合わせたときに性的活動に対する条件付けされた嫌悪を形成する能力を廃止しました(Davis他、2010)オスのラットが近づきにくい性的に受容的なメスに近づく行動中の選択的な細胞発火がオスのラットのmPFCで測定されています(フェボ、2011)。 これらの発見は、性行動中のmPFCの活性化が、自然の強化因子に対する生来の反応の発現ではなく、目標指向行動の実行と制御のための外部と内部の情報の統合において役割を果たすことを示唆することにつながりました(参照 後藤とグレース、2005)。 したがって、側坐核とともに、mPFCは動機付けられた行動(目標指向行動)の変調に関与する複雑な神経系の一部であり、mPFCからの認知情報、扁桃体からの感情情報、およびコンテキストの統合が必要です。側坐核の海馬からの関連情報(後藤とグレース、2005).
実験的証拠は、mPFCでのドーパミン放出が動機づけ行動の適応調節に関与しており、これらのメカニズムの調節解除が統合失調症、注意欠陥、多動性障害などの精神障害などの病的または不適応状態で役割を果たすと考えられていることを示唆していますADHD)、うつ病(ダンロップとネメロフ、2007; Masana et al。、2011)、または薬物乱用とギャンブル行為(エブリットとロビンズ、2005)。 興味深いことに、mPFCで放出されるドーパミンの活性は、ドーパミンよりも高いレベルでmPFCに存在するノルアドレナリン(NA)、特にNAトランスポーター(NET)の影響を受ける可能性があります。 mPFCのドーパミン輸送体(DAT)(Carboni et al。、1990, 2006; Gresch et al。、1995; Westernik et al。、1998)が、NAの場合よりもさらに高いドーパミンの親和性も示しています(ホーン、1973)。 ドーパミンとNAは多くの場合、作業記憶と注意セットの形成から反転学習への移行、応答抑制、ストレスへの応答など、多くのmPFC機能で協力するため(参照 Robbins and Arnsten、2009)、これは、mPFCのドーパミン単独またはNAとともに、性行動で見られるものを含むRHAラットとRLAラットの行動の違いに役割を果たす可能性を高めます。
この仮説をテストするために、mPFCの中皮皮質ドーパミン作動性システムとノルアドレナリン作動性システムの活動は、2つのRHAとRLAラット系で脳内微量透析によって研究されました。 簡単に説明すると、ドーパミン(およびその主な代謝物DOPAC)およびNAは、性的ナイーブ(例:受容性のある女性に決してさらされていない)および性的経験のあるRHAのmPFCの縁前(PrL)および縁下(IL)区画から得られた透析液で測定され、 RLAラット(例えば、5回の予備交尾試験を受け、一定レベルの交尾活動を示す)は、電気化学的検出(HPLC-ECD)を組み合わせた高圧液体クロマトグラフィーによる直接の性的相互作用中にアクセスできない受容雌の存在下に置かれた場合。
材料と方法
動物
近交系RHAおよびRLA雄ラット(N =各行の30、実験作業開始時の重量≈300g)はすべて、イタリアのカリアリ大学の1998で設立されたコロニーからのものでした(ジョルジ他、2007)。 サルデーニャのコロニーの選択的育種に使用される手順は、すでに詳細に説明されています(ジョルジ他、2005).
すべての実験で使用した卵巣摘出刺激SD雌ラット(実験作業開始時の250〜300 g)は、Envigo(San Pietro al Natisone、イタリア)から入手しました。 実験開始前の最低38日、湿度60°Cで、動物をケージあたり4匹(20 cm×10 cm×24 cm)カリアリ大学生物医学科の収容施設に順応させた60%、反転12 h明/暗サイクル(08:00 hから20:00 hまで消灯)、水、および標準実験用食品 アドリブで。 実験中の操作ストレスを制限するために、馴化期間を通して動物を毎日1〜2分間処理しました。 さらに、動物の飼育室のメンテナンス担当者との接触は1人の付き添い人に限定され、ホームケージの寝具は実験の前日でも実験当日でも変更されませんでした。 すべての実験は、10:00 hと18:00 hの間で実行されました。 この研究は、欧州共同体のガイドライン、9月の指令22、2010(2010 / 63 / EU)およびイタリアの法律(DL March 4、2014、n。26)の推奨事項に従って実施されました。 プロトコルは、カリアリ大学の動物実験倫理委員会(承認番号361 / 2016-PR、4月08、2016からFS)によって承認されました。
実験グループ
性的にナイーブで性的に経験のある雄のRHAおよびRLAラットを使用しました。 性的にナイーブなラットは、性的に受容性の卵巣切除されたエストラジオールとプロゲステロンで刺激された雌に決してさらされなかったラットでした。 性的に経験したラットは、60日の間隔で受容性の雌と3分の5回の連続交尾試験をすでに受けたラットでした(サンナ他、2014a,b)。 雌は、交尾試験の前に、それぞれ安息香酸エストラジオール(ピーナッツ油中200μg/ラット)およびプロゲステロン(ピーナッツ油中0.5 mg /ラット)、48 hおよび6 hで処理することにより発情させられました。 発情は、実験の5時間前にメイ・グリュンワルド・ギムザの着色と膣塗抹標本1の顕微鏡検査によって検証された。 以前の研究と一致して(サンナ他、2014a,b, 2015)5つの予備交尾試験は、両方の系統のオスのローマラットが一定のレベルの交尾活動を示すのに十分であることが判明しました。たとえば、性的に経験したRHAおよびRLAラットは、最後の2つの試験のそれぞれで達成された少なくとも1回の射精の基準を満たしました(この基準を満たさなかった1匹のRHAラットと2匹のRLAラットは、この段階で廃棄されました)。 これらの予備的交尾試験の2日後、性的経験のあるローマのラットは、以下に説明するように、mPFCに微小透析プローブを埋め込むための定位固定手術を受けました(サンナ他、2015).
性的行動中のmPFCの微小透析
微量透析の前日、性的ナイーブまたは経験豊かなRHAおよびRLAラットを、イソフルラン麻酔(1.5%–2%; Harvard Apparatus、Holliston、MA、USA)の下で定位固定装置(Stoelting Co.、Wood Dale、IL、USA)に配置しました。垂直の自家製微量透析プローブ(透析膜≈3mmの自由表面; Melisら、2003)、mPFC、PrL、およびILコンパートメントに一方的に向けられています(座標:3.0 mm前部および0.7 mm外側からブレグマ、5.5 mm腹側から硬膜; パキシノスとワトソン、2004)。 実験の当日、動物はサイクルの暗期中に、薄暗い赤色光に照らされて別の内部に含まれる防音室にある交配ケージ(45 cm×30 cm×24 cm)に移されました小型のプレキシガラス製ケージ(15 cm×15 cm×15 cm)には、垂直壁に25穴(Ø2 mm)があり、視覚、嗅覚、音響を可能にしますが、直接の相互作用はできません。 2 hの馴化期間の後、微量透析プローブをCMA / 100微量注入ポンプ(Harvard Apparatus、Holliston、MA、USA)にポリエチレンチューブで接続し、リンゲル液(147 mM NaCl、3 mM KClおよび1.2 mMで灌流しました) CaCl2、pH 6.5)、2.5μl/ minの流量で。 細胞外液を含む灌流培地の2 hの平衡期間の後、37.5μLの透析液アリコートを、実験中に15分ごとに、記載のようにドーパミン、DOPACおよびNAの濃度を測定するために氷冷ポリエチレンチューブで収集しました以下。 少なくとも4つの透析液アリコートを収集した後、受容性の雌ラットを30分間、交配ケージ内にある小さなケージに導入しました。 これらの30分の間、他の2つの透析液アリコートが収集されました。 これらの条件では、オスのラットはメスと直接相互作用できませんが、非接触勃起を示します(以下を参照)。 この期間の後、小さなケージを取り外し、75分間交尾させ、他の5つの透析液アリコートを収集しました。 この期間の終わりに、メスを交配ケージから取り出し、追加の透析液アリコートを収集しました(Pfaus and Everitt、1995; Melisら、2003; サンナ他、2015)。 性的行動の予測的段階と消費的段階に関連する性的パラメーターは、実験を通して記録されました(以下を参照)。
性行為
特定の実験条件を知らない観察者、例えば性的経験のレベルやレベルを知らない観察者によって、性行動の予期的および消費的段階に関連する性的動機付けおよび交尾パフォーマンスのいくつかのパラメーターが実験を通して記録されたその実験で使用された動物の(以下を参照)。 簡単に説明すると、最初の非接触勃起までの潜伏時間(NCPEL、内側の小さなケージに受容雌を導入してから時間を計る)とその頻度(NCPEF、雌がいる期間に発生する非接触陰茎勃起の数内側のケージに存在する)が記録されました。 これらのフェロモンを介した陰茎勃起は、アクセスできない受容性の雌の存在下で性的に強力な雄ラットで発生し、性的興奮の重要な指標と考えられています(サックス他、1994; サックス、2000; Melisら、2003)。 性的相互作用が許可されたとき、たとえば、交尾、マウントおよび導入の待ち時間(MLおよびIL、内側の小さなケージの取り外しから最初のマウントまたは最初の導入までの時間)。 装着および導入の頻度(MFおよびIF、それぞれ最初の一連の交尾活動および全交尾期間中の装着および導入の数); 射精までの待ち時間(EL、最初のシリーズの最初の挿入から射精までの時間); 射精の頻度(EF、交尾試験中の射精の総数)および射精後間隔(PEI、最初の射精から次の挿入までの時間)を記録しました。 さらに、交尾の有効性(CE;特定のシリーズの導入回数を同じシリーズのマウントと導入の数の合計で割った数)および導入間隔(III;特定のシリーズの射精潜時の比率そして、そのシリーズの挿入の数)は、交尾活動の最初のシリーズについても計算されました(サックスアンドバーフィールド、1976; マイゼルとサックス、1994; Melisら、2003; サンナ他、2014a,b, 2015).
mPFCからの透析液中のドーパミン、DOPACおよびノルアドレナリン濃度の測定
ドーパミン、DOPACおよびNA濃度は、20デュアルセル(Coulochem II、ESA、ケンブリッジ、マサチューセッツ州)を使用した電気化学検出と組み合わせた高圧液体クロマトグラフィー(HPLC)により、mPFCからの同じ透析液アリコートの4011μLで測定しました既に説明した(Melisら、2003)。 検出は、+ 350および-180 mVの還元モードで実行されました。 HPLCにはSupelcosil C18カラム(7.5 cm×3.0 mm id、3μm粒子径; Supelco、Supelchem、ミラノ、イタリア)が装備されており、メタノール0.06%v / v、4.2を含む20 Mクエン酸塩/酢酸pH 0.1で溶出されました1 mL / minの流速および室温での移動相としてのEDTA、0.03μMトリエチルアミン、および0.6 mMドデシル硫酸ナトリウム アッセイの感度は、ドーパミンでは0.125 pg、DOPACでは0.1 pg、NAでは0.2 pgでした。
組織学
実験の終わりに、ラットは断頭によって殺され、脳はすぐに頭蓋骨から取り除かれ、4〜12日間15%水性ホルムアルデヒドに浸されました。 この期間後、40μm冠状脳切片を凍結ミクロトームで調製し、ニュートラルレッドで染色し、位相差顕微鏡で検査しました。 プローブの先端の位置は、一連の脳切片を通してプローブの道をたどることにより、mPFCにローカライズされました(図を参照) 1)。 結果の統計的評価のために、mPFCのPrLおよびILコンパートメントに透析膜の活性部分が正しく配置されていることが判明したラットのみを考慮しました(この段階で各実験グループから1匹のラットを廃棄しました)。
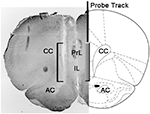 図1。 内側前頭前皮質(mPFC;のPrLおよびIL部分の微小透析プローブの軌跡を示すラット脳の冠状断面の概略図。 パキシノスとワトソン、2004)。 顕微鏡写真の角括弧は、マイクロダイアリープローブの透析膜の活性部分を示すニュートラルレッド染色部分の部分を示しています。 略語:PrL、縁前領域; IL、大脳辺縁系; AC、前交連; CC、脳梁。
図1。 内側前頭前皮質(mPFC;のPrLおよびIL部分の微小透析プローブの軌跡を示すラット脳の冠状断面の概略図。 パキシノスとワトソン、2004)。 顕微鏡写真の角括弧は、マイクロダイアリープローブの透析膜の活性部分を示すニュートラルレッド染色部分の部分を示しています。 略語:PrL、縁前領域; IL、大脳辺縁系; AC、前交連; CC、脳梁。
統計
生化学的データ(ドーパミン、DOPACおよびNA)および行動(NCPELおよびNCPEF、ML、ILおよびEL、MF、IFおよびEF、PEI)データの統計分析は、すべての実験対象(伝統的に雄ラットの研究で行われているように)交尾行動)または微小透析実験中に射精に交尾しなかった被験者を除外します。 最初のケースでは、すべての動物が分析に含まれる場合、雌がアクセスできないか、利用可能な雌とマウントまたは挿入または射精しない時間内にNCPEを示さなかった動物には、それぞれのフルレンジスコアが割り当てられました:1800男性は、女性がアクセスできない30分でNCPEを表示しませんでした。 男性が利用可能な女性と一緒にマウントまたは導入しなかった場合のMLおよびILの900 男性が射精に至らなかった場合はELの1800、男性が最初の射精後に挿入しなかった場合はPEIの600。 2番目のケースでは、射精に交尾しなかった動物は分析から除外されました。 これは、性的行動の違いが性的活動の2つのフェーズ中のローマのラット系統のmPFCの細胞外ドーパミン、DOPACおよびNAの濃度の違いと相関しているかどうかを評価するために行われました。分析された性的パラメータの固定値を割り当てることにより性的行動を示さなかった被験者の。
使用された実験条件間の起こりうる違いを検出し、よりよく特徴付けるために、ANOVAを使用していくつかの統計分析が実行されました。 ANOVAを実行する前に、異なる実験変数のそれぞれのデータセットを、ケースに応じてバートレットまたはレバインのテストを使用して、4つの実験グループ(すべての動物または射精に交尾するラットのみで実行)間の分散の均一性を検査しました。 分散に有意差が見つかった場合、データセットを対数変換し(実験Y値をLog Y値に変更)、分散の均一性を再確認してからANOVAで分析しました。 簡単に言えば、ナイーブおよび性的経験のある雄のRHAおよびRLAラットの交尾活動の最初のシリーズ(最初のマウント/導入から最初の射精後の最初のマウント/導入まで)およびその間に取得された行動パラメーター微小透析中は、被験者間の因子としてラット系統と性的経験レベルを使用することにより、二元配置ANOVAによって分析されました(行動パラメーターの平均値は表に報告されています 1 と F 表のANOVA分析の値と有意水準 2).
 テーブル1。 交尾活動の最初のシリーズで測定された交尾パラメーター(メスがオスにアクセスできるようになったときに最初のマウント/挿入から始まり、2番目のシリーズの最初のマウント/イントロミジョンで射精後の間隔の後に終了)および非接触陰茎性的にナイーブで経験豊かなRHAおよびRLAラットの勃起。
テーブル1。 交尾活動の最初のシリーズで測定された交尾パラメーター(メスがオスにアクセスできるようになったときに最初のマウント/挿入から始まり、2番目のシリーズの最初のマウント/イントロミジョンで射精後の間隔の後に終了)および非接触陰茎性的にナイーブで経験豊かなRHAおよびRLAラットの勃起。
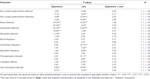 テーブル2. F 表に報告されたデータで実行された双方向ANOVAの値と有意水準 1 ラット系統(RHA対RLA)および性的経験レベル(ナイーブ対経験済み)を被験者間要因として使用します。
テーブル2. F 表に報告されたデータで実行された双方向ANOVAの値と有意水準 1 ラット系統(RHA対RLA)および性的経験レベル(ナイーブ対経験済み)を被験者間要因として使用します。
さらに、微量透析中に各ラットから得られたデータの全体的な分析は、ドーパミン、DOPACまたはNAの濃度または非接触勃起、マウント、挿入および射精の数の値をプロットすることによって得られたAUCを最初に計算することによって行われました。時間(交配ケージに雄ラットを導入してから実験終了まで1 hを開始-180 minを神経化学的値の15 minの分数に分割-または雌が交尾ケージに導入された時点行動パラメータの場合)、その後、ラット因子を使用して双方向のANOVAによる計算値を比較し、被験者間の要因としての性的経験レベル(神経化学的および行動パラメータのAUCの平均値を表に報告します) 4 と F 表のANOVA分析の値と有意水準 5)。 最後に、各データセットのより詳細なポイントツーポイント分析(つまり、ドーパミン、DOPAC、NAの濃度の値、非接触勃起、マウント、挿入、射精の時間の値)を要因分析によって実行しました。繰り返し測定のためのANOVA。ラットの系統を使用し、被験者の要因と時間(すなわち、透析液の割合)の間の性的経験のレベルを、被験者の要因( F これらのANOVA分析の値と有意水準は表に報告されています 6)。 同様の分析は、神経化学的パラメーターの基礎値のみを考慮して実施されました(受容女性の交配ケージへの導入前に収集された最後の4つの透析液アリコート)、その平均値は表に報告されています 3。 繰り返し測定の一般的な要因ANOVA、特に神経化学パラメーターのLine×TimeとExperience×Timeの交互作用を実行すると、1次ではなく2次の相互作用が見つかりました(表を参照) 6)、性的素朴または経験のあるRHAとRLAラット、または性的経験とvs.ナイーブRHAラットまたは性的経験のあるvsナイーブRLAラット。 の結果 事後に これらの2因子ANOVAによって明らかにされた有意な相互作用に対してTukeyのHSDテストを使用して実行されたペアワイズコントラストを図に報告します 2。 その他の場合はすべて、 事後に ANOVAはラット系統、性的経験レベルおよび時間の間の有意な相互作用を明らかにできなかったため、比較は報告されませんでした。 統計分析はすべて、Graph Pad 5(米国カリフォルニア州サンディエゴのPRISM)およびSTATISTICA 12(米国オクラホマ州タルサのStatsoft)で実行され、有意水準は P <0.05。
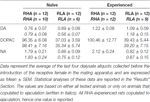 テーブル3。 性的ナイーブで経験のあるRHAおよびRLAラットの内側前頭前野(mPFC)からの透析液中の基礎ドーパミン(DA)、3,4-ジヒドロキシフェニル酢酸(DOPAC)およびノルアドレナリン(NA)濃度(nM)。
テーブル3。 性的ナイーブで経験のあるRHAおよびRLAラットの内側前頭前野(mPFC)からの透析液中の基礎ドーパミン(DA)、3,4-ジヒドロキシフェニル酢酸(DOPAC)およびノルアドレナリン(NA)濃度(nM)。
 テーブル4。 図に示された結果から得られた平均AUCの分析による、DA、DOPACおよびNA濃度の違い、および性的にナイーブなラットと経験のあるRHAおよびRLAラットの間の性行動の全体的な評価 2 および 3.
テーブル4。 図に示された結果から得られた平均AUCの分析による、DA、DOPACおよびNA濃度の違い、および性的にナイーブなラットと経験のあるRHAおよびRLAラットの間の性行動の全体的な評価 2 および 3.
 テーブル5. F 表に報告されたデータに対して実行された双方向ANOVAの値と有意水準 4 ラット系統(RHA対RLA)および性的経験レベル(ナイーブ対経験済み)を被験者間要因として使用します。
テーブル5. F 表に報告されたデータに対して実行された双方向ANOVAの値と有意水準 4 ラット系統(RHA対RLA)および性的経験レベル(ナイーブ対経験済み)を被験者間要因として使用します。
 テーブル6. F 図に示された結果に対して実行された反復測定の一般的な要因ANOVAの値と有意水準 2 および 3 ラット系統(L; RHA vs. RLA)および性的経験レベル(E)(ナイーブvs経験済み)を被験者因子間で、時間(T)(透析液画分)を被験者因子内で使用します。
テーブル6. F 図に示された結果に対して実行された反復測定の一般的な要因ANOVAの値と有意水準 2 および 3 ラット系統(L; RHA vs. RLA)および性的経験レベル(E)(ナイーブvs経験済み)を被験者因子間で、時間(T)(透析液画分)を被験者因子内で使用します。
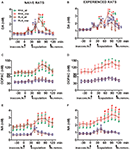 図2。 性的ナイーブからのmPFC透析液中のドーパミン(DA)、DOPACおよびノルアドレナリン(NA)濃度 (エース) 経験豊富なRHAおよびRLA雄ラット (B、D、F) 受容的な女性との性的活動中。 mPFCに定位的に埋め込まれた微小透析プローブを用いた両系統の性的にナイーブ(すなわち、性的に受容的な女性にこれまでさらされたことがない)および性的経験(5回の交尾試験を受けた)を個別に交配ケージに入れました。 「材料と方法」セクションに記載されているように、微量透析プローブに透析バッファーを灌流しました。 基礎値を決定するための4つの透析液アリコートの収集後、アクセスできない受容性の雌を交配装置の小さなケージ内に配置しました(時間= 0、inaccess.fe)。 30分後、小さなケージを取り外し、75分の間交尾を許可し(交尾)、その後メスを交配ケージから削除しました(fe.remov)。 実験中、非接触勃起と交尾パラメーターを測定し、透析液アリコートを15分ごとに収集し、「材料と方法」セクションで説明したようにドーパミン、DOPACおよびNAについて分析しました。 値は、グループごとのすべての12ラットによって取得された値の平均値±SEM(RHA_all =緑色の実線、RLA_all =茶色の実線)または射精のみに交尾した値(RHA_cop =赤色の破線、RLA_cop =青色の破線)です。 経験豊富なRHAラットでは、すべての動物が交尾に達し、値は同じです。 *P グループの基礎値(女性なし)に関して<0.05(RHA_allの場合は緑、RHA_copの場合は赤、RLA_allの場合は茶色、RLA_copの場合は青)。 #P RLAグループの対応する値に関して<0.05(赤、RHA_all対RLA_all;緑、RHA_cop対RLA_cop); §P 性的にナイーブなラットの時間一致値に関して<0.05(緑、経験豊富なRHA_all対ナイーブRHA_all;赤、経験豊富なRHA_cop対ナイーブRHA_cop;茶色、経験豊富なRLA_all対ナイーブRLA_all;青、経験豊富なRLA_cop対ナイーブRLA_cop)(「材料と方法」、「統計」サブセクションで説明されているように、対数変換後に表示されたデータに対して行われる双方向ANOVA、続いてTukeyのHSDテスト)。
図2。 性的ナイーブからのmPFC透析液中のドーパミン(DA)、DOPACおよびノルアドレナリン(NA)濃度 (エース) 経験豊富なRHAおよびRLA雄ラット (B、D、F) 受容的な女性との性的活動中。 mPFCに定位的に埋め込まれた微小透析プローブを用いた両系統の性的にナイーブ(すなわち、性的に受容的な女性にこれまでさらされたことがない)および性的経験(5回の交尾試験を受けた)を個別に交配ケージに入れました。 「材料と方法」セクションに記載されているように、微量透析プローブに透析バッファーを灌流しました。 基礎値を決定するための4つの透析液アリコートの収集後、アクセスできない受容性の雌を交配装置の小さなケージ内に配置しました(時間= 0、inaccess.fe)。 30分後、小さなケージを取り外し、75分の間交尾を許可し(交尾)、その後メスを交配ケージから削除しました(fe.remov)。 実験中、非接触勃起と交尾パラメーターを測定し、透析液アリコートを15分ごとに収集し、「材料と方法」セクションで説明したようにドーパミン、DOPACおよびNAについて分析しました。 値は、グループごとのすべての12ラットによって取得された値の平均値±SEM(RHA_all =緑色の実線、RLA_all =茶色の実線)または射精のみに交尾した値(RHA_cop =赤色の破線、RLA_cop =青色の破線)です。 経験豊富なRHAラットでは、すべての動物が交尾に達し、値は同じです。 *P グループの基礎値(女性なし)に関して<0.05(RHA_allの場合は緑、RHA_copの場合は赤、RLA_allの場合は茶色、RLA_copの場合は青)。 #P RLAグループの対応する値に関して<0.05(赤、RHA_all対RLA_all;緑、RHA_cop対RLA_cop); §P 性的にナイーブなラットの時間一致値に関して<0.05(緑、経験豊富なRHA_all対ナイーブRHA_all;赤、経験豊富なRHA_cop対ナイーブRHA_cop;茶色、経験豊富なRLA_all対ナイーブRLA_all;青、経験豊富なRLA_cop対ナイーブRLA_cop)(「材料と方法」、「統計」サブセクションで説明されているように、対数変換後に表示されたデータに対して行われる双方向ANOVA、続いてTukeyのHSDテスト)。
結果
RHAおよびRLAラットは、異なる数の非接触勃起と異なる行動パターンを示します
以前の研究に沿って(サンナ他、2014a,b, 2015)、脳内微量透析によるmPFCからの透析液アリコートの収集中に、受容性の雌と一緒になったときに、異なる数の性的にナイーブな雄のRHAおよびRLAラットが性的活動に従事するようになりました。 手短に言えば、この研究では、10性的ナイーブ雄RHAラットのうち12(83%)が最初の交尾試験で射精に交尾し、6ナイーブRLAラットのうち12のみ(50%)が微量透析実験中に交尾しました。 この差は、性的経験のある男性RHAおよびRLAラット(5回の交尾試験後)でも見られましたが、弱められましたが、すべての12 RHAラットは、微量透析中に9 RLAラットのうち12に対して射精に達しました。 常に以前の研究と一致しており、この研究でも、2匹のローマンラット系統は、性的相互作用中の交尾行動の異なるパターンだけでなく、近づき難い受容性の雌にさらされた場合、異なる潜伏期および非接触陰茎勃起の頻度を示した。 これらの違いは、射精に交尾したかどうかに関係なく、特定のグループのすべての実験動物のデータを検討したときに発見されました(例えば、行動を示さなかった動物、つまり交尾しなかったラットにフルスコアを割り当てることにより)射精)または特定のグループの行動のみを示した動物のデータを考慮した場合(例:射精に交尾した動物;表 1)。 したがって、非接触勃起(NCPE)の値と、双方向ANOVAによる交尾活動の最初のシリーズで測定された交尾パラメーターの値の統計分析により、すべての実験ラットまたは交尾ラットのみを考慮した場合の2つのラット系統の間に有意差が明らかになりました4つの実験グループ(表を参照 2)。 実際、すべての実験動物から得られたデータを考慮すると、非接触勃起の数が多く、RLAラットと比較してRHAラットではNCPEL、ML、IL、およびPEIが有意に短かった。 さらに、RLAラットと比較してRHAラットでは、EFとCEが高く、IIIは有意に短かった。 2つのローマのラット系統間の上記の違いのいくつかは、交尾テストを繰り返すと減少または消失する傾向がありました。 それにもかかわらず、これらの違いのいくつかは、繰り返される性的経験による性的行動の安定化後も依然として存在していました。 EFを除き、射精に交尾した4つの実験グループの動物の値のみを考慮すると、同様の結果が得られました(表を参照) 1, 2).
性的にナイーブで経験のあるRHAおよびRLAラットからのmPFC透析液中の細胞外ドーパミン、DOPACおよびノルアドレナリンの基礎濃度
現在の実験条件下では、すべての(例えば、射精に交尾したかどうかに関わらず)性的にナイーブなRHAおよびRLAラットのmPFCから得られた透析液中のドーパミン、DOPACおよびNAの量は、ドーパミンの2.32 pgおよび2.11 pgでした。 DONUMの322.56 pgと124.42 pg、NAの6.05 pgと2.24 pg、それぞれ透析液20μl。 性的経験のあるRHAおよびRLAラットのmPFCから得られた透析液で同様の量が測定されました(ドーパミン:3.73 pgおよび3.33 pg、DOPAC:353.62 pgおよび133.32 pg、NA:RHAおよびRLAラットの7.17 pgおよび2.78 pg) 。 これらの値は、RHAラットのmPFCにおける細胞外ドーパミンおよびDOPACの≅0.8–1.2 nMおよび≅95–100 nM、および細胞外NAの≅1.8–2.2 nM、およびconcentration0.8–1.2 nMの濃度を示します。 RLAラットのmPFCにおける、細胞外ドーパミンおよびDOPACの場合は≅35–40 nM、細胞外NAの場合は≅0.6–0.9 nM(表 3)。 上記の値は、mPFC細胞外液による透析バッファーの2時間の平衡期間後に得られました。 本物のドーパミン、DOPACおよび透析プローブのNAの回収率は20%に近いと推定されたため、細胞外ドーパミン、DOPACおよびNA濃度は、ドーパミン、≅4の両方のラインで≅5–500 nMに近いと推定されるRHAラットとRLAラットのmPFCにおけるDOPACの場合は≅200 nM、NAの場合は≅10および≅4nM。 対数変換後、上記の値で繰り返し測定された要因ANOVAは、性的にナイーブなラットと性的に経験のあるラットの間でドーパミンの基礎レベルに有意差があることを明らかにしましたF(1,44,132) = 26.05、 P <0.001)、およびDOPACの基礎レベル(F(1,44,132) = 63.36、 P <0.001)およびNA(F(1,44,132) = 42.14、 P <0.001)RHAラットとRLAラットの間(小さなケージに雌を導入する前に収集された最後のXNUMXつのサンプル)。 微小透析実験中に射精に交尾したラットのみを考慮した場合にも、同様の値が見られました(表 3)。 また、この場合、対数変換後の値に対して行われた反復測定の要因ANOVAは、性的にナイーブなラットと性的に経験したラットの間でドーパミンの基礎レベルに有意差を示しました(F(1,33,99) = 26.97、 P <0.001)、およびDOPACの基礎レベル(F(1,33,99) = 42.95、 P <0.001)およびNA(F(1,33,99) = 27.63、 P <0.001)RHAラットとRLAラットの間。
性的未経験および経験のあるRHAおよびRLAラットからのmPFC透析液中の細胞外ドーパミン、DOPACおよびノルアドレナリンの濃度は、性的活動中に異なって変化する
内側の小さなケージにアクセスできない受容性の雌が存在し、その後の直接的な性的相互作用により、性的ナイーブおよび経験のある雄RHAおよびRLAラットの両方から得られたmPFC透析液中の細胞外ドーパミン、DOPACおよびNAの濃度が増加しましたが、すべての実験動物または射精に交尾した動物のみを検討する場合の、2つのラット系統と経験レベル 2)。 実際、ドーパミン、DOPAC、およびNAの濃度のAUCの2因子ANOVAは、テスト全体のドーパミン、DOPAC、およびNAの全体的な含有量が、RLAラットと比較してRHAラットおよび性的経験のないラットとナイーブラットの比較(表を参照 4 AUC値と表の場合 5 for F 値と有意水準)。 これらの違いは、実験に沿った2つの性的にナイーブで経験豊かなラット系統のドーパミン、DOPACおよびNA量の反復測定のためのポイントツーポイント要因分析によりさらに確認され、ライン、経験、時間および有意なライン×時間の重要な主効果を明らかにしましたand Experience×Time first order Interaction(表を参照 6 for F 値と有意水準)。
性的ナイーブRHAおよびRLAラットから得られたmPFC透析液中の細胞外ドーパミン、DOPACおよびノルアドレナリンの濃度は、性的活動中に異なって変化する
性的にナイーブなRHAおよびRLAラットでは、アクセスできないメスの存在下で最初に増加したのはDOPACではなく細胞外ドーパミンでしたが、NAはRHAラットでのみ増加しました。 ナイーブRHAラットでは、DOPACおよびNAで見られる性的相互作用の最初の15分で、細胞外ドーパミンがさらに増加しました。 細胞外ドーパミン、DOPAC、およびNAの増加は、すべての交尾時間にわたって続き、ドーパミン、DOPAC、およびNAはそれぞれ60分、75分、および75分でピーク値に達し、次に細胞外ドーパミン、そして程度は低いがDOPACおよびNA 、女性の除去後、基礎値と同様の値に減少しました。
一方、細胞外ドーパミン、DOPACおよびNAの最初の有意な増加とピーク値は、交尾の最初の15分の間にナイーブRLAラットで発生しました。 ただし、RHAラットとは異なり、RLAラットの細胞外ドーパミンでは、DOPACおよびNAは、女性との直接的な相互作用の最初の30分以内に基底値と同様の値に戻る傾向がありました(図を参照) 2A、C、E).
最後に、交尾中、細胞外ドーパミンの増加は、RLAラットよりも性的にナイーブなRHAの方が大きく持続的でした(図を参照) 2A)一方、雌の不在下では、2つのラット系統にわたって濃度は類似していましたが、同一ではありませんでした(上記および表を参照) 3)。 興味深いことに、DOPACのパーセント増加と、受容性女性の存在下でのNA濃度の2つのローマ線の間に差は見られませんでしたが、DOPACとNA濃度の絶対値は2倍以上の差があります両方の基底状態で2つのラット系統間で観察されました(表を参照 3)および受容性の女性とのテスト全体(図を参照) 2C、E).
性的経験のあるRHAおよびRLAラットから得られたmPFC透析液中の細胞外ドーパミン、DOPACおよびノルアドレナリンの濃度は、性的活動中に異なって変化する
性的にナイーブなRHAおよびRLAラットで見られるように、近づきにくい雌の存在とそれに続く直接的な性的相互作用により、性的に経験した雄のRHAおよびRLAラットから得られたmPFC透析液中の細胞外ドーパミンおよびDOPACが増加しました。 ただし、この場合も、すべての実験動物を考慮したとき、または射精に交尾した動物のみを考慮して、ラット系統関連の違いが見つかりました(図 2)。 性的に経験したRHAおよびRLAラットでは、アクセスできない雌で細胞外ドーパミンの最初の増加が起こった。 その後、ドーパミン濃度は両方のラット系統の交尾中に増加しました。 ドーパミン濃度は、交尾の45–60分後にピーク値に達し、交尾試験の終了時に基礎値に向かってゆっくりと減少しました(図を参照) 2B)。 性的にナイーブなラットと同様に、細胞外ドーパミン濃度は、性交経験のあるRHAラットと比較して、主に交尾期の中央部(30〜45の交尾後)に採取した透析液のアリコートでRLAラットと比較しました。 DOPAC濃度は、RHAラットでのみアクセスできない雌の存在中に増加しましたが、交尾中に両方のラット系統で同程度に増加し(75〜90分でピーク値)、終了時に基底値に戻る傾向がありました。交尾試験(図を参照 2D)。 RHAラットでは90分で、RLAラットでは45分でピーク値に達する雌を導入した後、性的経験のあるラット系統の両方でNA濃度も増加しました(図を参照) 2F)。 ドーパミンとの差異(上記参照)で、すべての動物と射精のみに達した動物を考慮すると、両方の系統の性的経験のあるラットのDOPACおよびNA濃度の増加に同様の差が見られました。 しかし、性的にナイーブなラットで見られるように、DOPACとNA濃度の増加率は類似していましたが、テストを通して(すなわち、前、最中、後)性的に経験したRHAとRLAラットの間でDOPACとNAの絶対値の有意差が見つかりました受容雌の存在)、RHAラットはRLAラットよりも高い値を示しています(表を参照) 3 基礎値と数値について 2D、F テスト全体に沿った値の場合)。
性的経験は、性的活動中にRHAおよびRLAラットから得られたmPFC透析液のドーパミンおよびノルアドレナリン濃度の変化に影響を与えます
性的にナイーブで経験のあるRHAおよびRLAラットの細胞外ドーパミンとNAの濃度の比較は、すべての実験動物を考慮すると、性的経験が両方のラット系統の細胞外ドーパミンの濃度と、それほどではないがNAの濃度を変えることを示しましたまたは射精のみに交尾したもの(図 2A、B、E、F)。 したがって、両系統の性的にナイーブなラットと経験を積んだラットの間でドーパミンの基礎値に有意差が生じた(表を参照) 3)および交尾活動中のドーパミン値は、一般に、性的経験のあるRHAおよびRLAラットで、ナイーブな対応物と比較して高かった(図を参照) 2B)。 さらに、性的経験のあるRHAラットでは、近づきにくい雌の存在中に見られたドーパミンの増加は、性的ナイーブラットで見られたのと同じ時間的パターンに従いましたが、交尾中に時間的パターンの違いが見られました。 実際、この場合、性的にナイーブなRHAラット(60分で1つのメインピーク)で観察されたものとは異なり、2つのメインピーク値が見つかりました。1つ目は15分後、2つ目は45分後の交尾です。 この最後の増加の後、ドーパミン値は基礎値に戻る傾向がありました(図を参照) 2B).
同様の写真は、性的にナイーブなRLAラットと経験豊富なRLAラットで見つかりました。 実際、RHAラットで見られるものと同様に、経験豊富なRLAラットでも、細胞外ドーパミンの3つの主な増加を特徴とする時間的パターンが見つかりました。1つ目はアクセス不能なメス、2つ目は交尾中、つまり15 minおよび60後交尾の最小値(図を参照 2A、B)。 一般に、性的経験は、性的にナイーブな状態から経験を積んだ状態に移行するときに、両方のラット系統でドーパミン放出の時間的パターンに、より長期にわたる変化をもたらすようです。
図に示すように 2C–F、両系統のナイーブラットと経験のあるラットの間でDOPACおよびNA濃度にわずかな違いのみが検出されました。 ただし、細胞外NAには、ナイーブラットと比較して経験値が高い値に向かう重要ではない傾向が、基礎で観察されました(受容雌の導入前、表を参照) 3)およびAUCの値から明らかなように、NA全体の量(表を参照) 4)全体の試験から得られた細胞外濃度で計算(受容性の雌の存在前および存在中)。 最後に、NA濃度の時間的パターンは、両方のラット系統の経験のあるラットをナイーブなラットと比較すると非常に類似しており、性的経験はその増加パターンの変化ではなく、細胞外NAの一般的な増加につながることを示しています(図を参照) 2E、F).
性的未経験および経験のあるRHAおよびRLAラットから得られたmPFC透析液中の細胞外ドーパミンおよびノルアドレナリンの濃度の変化は、性的行動の変化と同時に発生します。
試験中に性的にナイーブで経験豊かなRHAおよびRLAラットの両方で見られたmPFCから得られた透析液中の細胞外ドーパミン、DOPACおよびNAの濃度の違い(図 2)実験の2つの主な段階で測定されたさまざまな性的パラメーターの変更と一緒に発生しました(すなわち、それぞれ女性がアクセスできず、男性が利用できます)。これには、非接触陰茎勃起が含まれます(図 3A、B)、マウント(図 3C、D)、紹介(図 3E、F)と射精(図 3G、H)。 これらの違いは、すべての実験動物または射精のみに交尾した動物のいずれかを検討したときに発見されました。 実際、これらのパラメーターのAUC値の双方向ANOVAによる予備分析(表を参照 4 AUC値と表の場合 5 for F 値と有意水準)に続いて、反復測定の要因ANOVAによる実験に沿ったこれらのパラメーターの値のポイントツーポイント分析により、ライン、経験、時間、有意な一次線×時間および経験×時間相互作用の重要な主効果が明らかになりました、マウントの重要な2次相互作用(表を参照 6 for F 値と有意水準)。 したがって、以前の研究(サンナ他、2015):(i)性的にナイーブなRHAラットは、対応するRLAよりも多くの非接触陰茎勃起、マウント、挿入および射精を示しました。 (ii)性的に経験したRHAラットは、対応するRLAよりも多くの非接触陰茎勃起、挿入、射精を示しました。 (iii)両方の系統の性的経験のあるラット、特にRLAラットは、性的に素朴な対応物よりも多くの非接触陰茎勃起、挿入、射精を示した。 実際、RHAラットでは、性的経験によって生じる変化の大部分は、行動パラメータの頻度ではなく時間経過で発生しました(たとえば、経験のあるラットは主にテストの前半で交尾しましたが、テスト中の同様の交尾傾向)、RLAラットでは、性的経験により主に性的行動のより顕著な一般的な改善がもたらされました。これは、経験に基づいたRLAラットの交尾パラメータの値の変化によって明らかにされたように、ナイーブな対応。
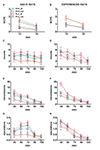 図3。 性的ナイーブから記録された非接触陰茎勃起(NCPE)、マウント、挿入および射精の数の変化 (A、C、E、G) 経験豊富なRHAおよびRLAラット (B、D、F、H) 図に報告されている微小透析実験中 2。 すべての実験条件は、図の凡例に記載されているものと同一でした 2。 値は、グループごとのすべての12ラット(フルタイムスコアが割り当てられたものを含む、RHA =緑の実線、RLA =茶色の実線)または射精のみに交尾したもの(RHA =赤の破線)によって得られた値の平均±SEMです。 ; RLA =青い破線。 経験豊富なRHAラットでは、すべての動物が交尾に達し、値は同じです。 ラット系統因子(RHA対RLA)の間に有意な相互作用がないため、表に示すように、双方向ANOVAを使用してデータを分析することにより、性的経験レベル因子(ナイーブvs経験済み)と時間が見つかりました 6, 事後に 「材料と方法」、「統計」サブセクションで説明されているように、比較は報告されませんでした。
図3。 性的ナイーブから記録された非接触陰茎勃起(NCPE)、マウント、挿入および射精の数の変化 (A、C、E、G) 経験豊富なRHAおよびRLAラット (B、D、F、H) 図に報告されている微小透析実験中 2。 すべての実験条件は、図の凡例に記載されているものと同一でした 2。 値は、グループごとのすべての12ラット(フルタイムスコアが割り当てられたものを含む、RHA =緑の実線、RLA =茶色の実線)または射精のみに交尾したもの(RHA =赤の破線)によって得られた値の平均±SEMです。 ; RLA =青い破線。 経験豊富なRHAラットでは、すべての動物が交尾に達し、値は同じです。 ラット系統因子(RHA対RLA)の間に有意な相互作用がないため、表に示すように、双方向ANOVAを使用してデータを分析することにより、性的経験レベル因子(ナイーブvs経験済み)と時間が見つかりました 6, 事後に 「材料と方法」、「統計」サブセクションで説明されているように、比較は報告されませんでした。
議論
この研究は、嫌悪条件に応じて著しく異なる対処スタイルを示すRHAおよびRLAラットを示す以前の研究の発見を確認および拡張します(Driscoll andBättig、1982; ジョルジ他、2003a; シュタイマーとドリスコ、2003)、アクセスできない受容性の女性の存在下で、古典的な交尾試験中に異なる行動パターンを示す(サンナ他、2014a,b, 2015)。 したがって、この研究はまた、性的にナイーブなRHAラット(以前は受容性のある女性にさらされたことがない)が、性的にナイーブなRLAラットと比較して、より高い性的動機付けとより良い性的パフォーマンスを示したことを示しています。たとえば、RHAラットは、より多くの非接触陰茎勃起(フェロモン-性的興奮の指標と考えられる陰茎勃起の誘発。 サックス他、1994; サックス、2000)および以前の研究で見つかったいくつかの交尾パラメータの異なる性的変化(サンナ他、2014a,b, 2015)。 これらの違いは、性的経験を獲得した後、つまり、5つの暴露による性的行動の安定化と受容性のある雌との交尾試験の後、両方のローマ系ラット系統で依然として持続しました。 この研究はまた、RHAとRLAの両方のラット系統で、ナイーブまたは経験のある状態で、非接触陰茎勃起と性的相互作用が、細胞外ドーパミン(およびその主要代謝物DOPACの濃度の増加に付随して発生したことを初めて示しています)および両方のローマラット系統のmPFCからの脳内微量透析により得られた透析液中のNA。 興味深いことに、mPFCの細胞外ドーパミンとNAのこれらの増加は、ラットの表現型または性的経験のレベルの違いと関連しているようです。 したがって、結果セクションで広く示されているように、性的ナイーブおよび経験豊かなRHAラットは、性行動の欲求期および消費期の両方でRLAの対応物と比較した場合、細胞外ドーパミンおよびNAのより長く持続的な増加を示しました。 さらに、両方のローマ系の性的経験のあるラットは、ナイーブな対応物と比較して、性行動の両方の段階で、mPFCの細胞外ドーパミンおよびNAのより長く持続的な増加を示しました。 最後に、mPFCの細胞外ドーパミンとNAの上記のすべての違いは、性行動の行動パラメーターの違いと明らかに関連していた。例えば、両方のローマ系の性的経験のあるラットは、ナイーブな対照と比較して、より高い性的動機とより良い交尾パフォーマンスを示したまた、性的にナイーブで経験豊富なRHAラットは、性的にナイーブで経験豊富なRLAのラットと比較して、より高い性的動機とより良い交尾パフォーマンスを示しました。
性的活動中にmPFC透析液に見られる細胞外ドーパミンの増加については、雌が性交受容器に導入されてから最初の15分で最初の増加が起こりました。この状態では、非接触の陰茎勃起。 交尾のために雌が雄にアクセス可能にされた後の最初の15分で、細胞外ドーパミンの2番目の大きな増加が発生しました。 興味深いことに、ナイーブ状態では細胞外ドーパミンが主にテストの最初の部分で増加し、アクセス可能な女性は2番目の部分で基礎値に戻る傾向がありましたが、性的経験のある状態ではドーパミンはテスト全体を通して上昇し、ピーク値に達しましたローマの両方のラット系統における交尾の45–60分後。
性的にナイーブで経験豊かな状態のRHAラットとRLAラットの性的活動のさまざまな段階での細胞外ドーパミンの上記の違いとは別に、この研究は、以前の2つのローマのラット系統間の細胞外DOPAC濃度の予期しない重要かつ非常に有意な違いも示しています(すなわち、 、基礎値)、および交配器具への受容雌の導入後。 したがって、mPFC透析液中の細胞外DOPACの基礎値は、RHAラットで見られる値よりも約2.6倍高いことがわかりました。 RHAラットとRLAラットの間のこの違いは、これらの実験条件で2つのローマのラット系統から得られたmPFC透析液の細胞外ドーパミンの基礎値にごくわずかな違いがあるにもかかわらず、性的ナイーブおよび経験条件で発生し、持続しました。 総合すると、これらの違いは、2つのローマのラット系統間のmPFCレベルでのドーパミン代謝回転が異なることを示している可能性があります。 したがって、DOPAC濃度は通常、放出されたドーパミンの量を反映し、ドーパミン作動性神経終末によって再捕捉され、モノアミノオキシダーゼ(MAO; カールソン、1975)。 したがって、RHAラットで見られるより高い基底DOPAC濃度は、RHAラットのmPFCでドーパミン作動性神経終末により多量のドーパミンが放出および再捕捉されること、たとえばRLAに比べてRHAラットの中皮ドーパミン作動性システムのより高い基底活性ラット。 RLAラットよりもRHAラットの方が中皮皮質ドーパミン作動性緊張が高いことは、RLAのラットよりも性的にナイーブで経験豊富なRHAラットからのmPFC透析液の性的活動中に見られる細胞外ドーパミン濃度が高いことによっても裏付けられています。 これに関して、ドーパミン作動性の高い緊張が、少なくとも部分的に、RHAおよびRLAラットに存在する多くの異なる、さらには反対の行動特性の原因であると考えられていることを思い出すことは適切です。 したがって、RHAラットは活発な銅、非常に衝動的、新規性および感覚の探求者であり、中毒のいくつかのクラスの薬物を摂取および乱用する傾向がありますが、RLAラットは反応性の銅であり、過感情であり、うつ病のような症状を発症する傾向があります(Zeier et al。、1978; ジョルジ他、1994, 2003b, 2007; Corda et al。、1997, 2014; Escorihuela et al。、1999; シュタイマーとドリスコ、2003; レッカ他、2004; Giménez-Llortet al。、2005; Carrascoら、2008; Fattore et al。、2009; モレノ他、2010; Coppens et al。、2012; Díaz-Moránet al。、2012; Sabariego et al。、2013; マンゾら、2014a,b; Oliveras et al。、2015)、性的ナイーブで経験豊かなRHAラット対RHAラットの高い性的動機付けと交尾能力の向上を含む(サンナ他、2015)。 性的にナイーブで経験豊富なRHAラットのmPFCからの透析液に見られる細胞外ドーパミンの濃度のより高い増加は、RLAの対応物に関して性的にナイーブで経験豊富なRHAラットの側坐核からの透析液に見られるより高い細胞外ドーパミン濃度に似ています(サンナ他、2015)。 ただし、mPFCとは異なり、性的にナイーブなRHAとRLAの両方のラットの側坐核からの透析液中の細胞外ドーパミンとDOPACの基礎レベルは、有意差はありませんでした(サンナ他、2015)。 したがって、性的ナイーブで経験のあるRHAラットの側坐核におけるより高い中脳辺縁系ドーパミン作動性緊張は、受容体の存在下でのRLA対応物と比較した場合、RHAラットの側坐核からの透析液に見られるより高い細胞外ドーパミン濃度によってのみ推測される可能性がありますこの研究でmPFCで発生することがわかったRHAラットおよびRLAラットのDOPAC濃度のより高い基底レベルとより低い基底レベルによってそれぞれ明らかにされた、異なる基底ドーパミン作動性活性ではない雌。 これは、RHAラットのmPFCからの透析液中の細胞外ドーパミンレベルがRLAラットのそれよりも高いことが判明した一方で、側坐核の透析液から同様のドーパミンレベルが見つかったことを示す以前のレポートの結果とも一致しています異なる実験条件下でのRHAおよびRLAラットの両方(D'Angio et al。、1988; Scatton et al。、1988; Willig et al。、1991; ジョルジ他、2003a, 2007)。 上記のmPFCと側坐核の違いにもかかわらず、性的経験は、性的ナイーブから経験状態に移行する際に、両方のローマのラット系統のドーパミン放出の時間的パターンの長期的増加をmPFCで生じさせるようです。通常、RLAラットよりRHAラットで高かった。 これは、性的経験が細胞外ドーパミン増加をRHAラットの交尾試験の最初の部分にシフトする傾向があり、RLAラットの交尾試験全体を通して増加した側坐核で見られるものとは多少異なります(サンナ他、2015).
私たちの知る限り、この研究は、ドーパミンで見られるように、RHAラットとRLAラットの両方のmPFCからの透析液の性的活動中に、細胞外ドーパミンだけでなく、細胞外NAも増加することを初めて示しました。ローマのネズミ系統と性的経験に関する違い。 特に、RHAラットとRLAラットの両方のmPFCからの透析液で非常に類似していることがわかった基礎ドーパミンレベルとの差異で、RHAラットのmPFCからの透析液の細胞外NAの基礎レベルは有意に高かった(約2,5-fold )RLAラットのものより。 これらの違いの理由は不明ですが、ドーパミンとDOPACについて前述したように、これらの結果は、RLAラットと比較した場合、RHAラットのmPFC皮質に少なくともより高い基礎ノルアドレナリン作動性緊張が存在することを示している可能性があります。 そのようなより高いノルアドレナリン作動性緊張は、ドーパミンについて上記で議論したように、RHAおよびRLAラットに存在する異なる、しばしば反対の行動特性にも関与している可能性があります。 mPFCのRLAラットよりもRHAラットの方が高いノルアドレナリン作動性調子をさらに支持するのは、性的ナイーブと経験条件の両方で性的活動中にも基底細胞外NAレベルの違いが持続することを示す結果からです。 RHAラットのmPFC透析液は、アクセスできない雌にさらされ、すべての交尾期間中にRLAラットよりはるかに多く、NAレベルは交尾期間の最初の15分でのみ増加し、その後NAレベルは基礎値に戻りました。 細胞外NAレベルのこれらの変化は、性的ナイーブと経験の両方の状態で見られましたが、NAレベルの増加は、性的ナイーブの対応物と比較して、性的経験のあるRHAおよびRLAラットで高かったです。 したがって、性的経験は明らかに、ドーパミンについて既に議論したように、RHAラットおよびそれほどではないがRLAラットのmPFCにおけるノルアドレナリン作動性活性のさらなる増強を誘発します。 RLAラットと比較した場合、RHAラットのmPFCにおけるノルアドレナリン作動性およびドーパミン作動性の同時のトーンは、いくつかのコメントに値します。 実際、mPFCのノルアドレナリン作動性活性は、異なるメカニズムを介してドーパミン放出に影響を与えることが報告されています(たとえば、 Carboni et al。、1990, 2006; Gresch et al。、1995; Westernik et al。、1998 およびその中の参照)。 これらの1つはNETの活性に関連しており、PFCのホモジネートから得られたシナプトソームのNAよりもさらに高い親和性でドーパミンに結合することが示されました(ホーン、1973)。 これがmPFCで発生する場合 インビボの、mPFCで放出されたドーパミンは、ドーパミン作動性だけでなく、ノルアドレナリン作動性神経終末によっても、NAの速度よりもさらに速い速度で再捕捉される可能性があります。 これは、シナプス間隙から除去されたドーパミンの量を補うために、ドーパミン作動性末端からのドーパミン放出の増加(例えば、ドーパミン作動性緊張の増加)を引き起こす可能性があります。 したがって、RHAラットに見られるより高いノルアドレナリン作動性の緊張は、RLAラットと比較した場合、RHAラットのmPFCに見られるより高いドーパミン作動性の緊張に少なくとも部分的に寄与する可能性があります。 この可能性を検証するには、さらなる研究が必要です。 特に、RHAラットとRLAラットの間のmPFCでこの研究で特定されたノルアドレナリン作動性活性の違いは、抗うつ剤治療に対する異なる反応にも役割を果たす可能性があります。 実際、RHAラットは回復力のモデルと見なされ、RLAラットはうつ病に対する脆弱性のモデルと見なされます。 したがって、デシプラミン、フルオキセチン、クロリミプラミンなどの抗うつ薬による急性または慢性治療はすべて、RHAラットの反応に影響を与えることなく、RLAラットの強制水泳試験における行動反応を大幅に改善しました(Piras et al。、2010, 2014).
最後に、この研究は、mPFCが性的行動の制御に関与していることを示す以前の調査結果を確認および拡張しますが、性的行動におけるこの脳領域の正確な役割は明らかではありません(Fernández-Guastiet al。、1994; AgmoおよびVillalpando、1995; Agmoら、1995; Hernández-Gonzáleset al。、1998, 2007; 掛山ら、2003; Balfourら、2006; Afonso他、2007; Davis他、2010; フェボ、2011)。 最近、単一の細胞発火記録パラダイムを使用して、アクセスできない性的受容性の雌に向かって雄ラットの行動に近づいている間にmPFCで選択的な細胞発火が示されました(フェボ、2011)。 おもしろいことに、アクセス不能な受容体に対するオスの最初の暴露中に応答しなかったニューロンは、あたかも以前の経験が行動応答の変化につながる塑性変化を誘発できたかのように、2回目の暴露中にアクティブになります。 それにもかかわらず、mPFCのイボテン酸による病変は、性的受容性の雌を持つ雄ラットの性的行動も、性的報酬に対する条件付け場所の好みの発現も変えることができなかった。 ただし、嫌悪刺激と組み合わせた場合に性的活動に対する条件付き嫌悪を形成する能力は、これらの病変動物では完全に消失していることがわかりました(Davis他、2010)。 これは、性行動中のmPFCの活性化が、自然の強化因子に対する生来の反応の発現ではなく、目標指向行動の実行と制御のための外部情報と内部情報の統合に役割を果たすことを示唆しています 後藤とグレース、2005)。 この研究にとってより重要なことは、側坐核、腹側被蓋野、内側視索前野、線条の床核、扁桃体基底外側部および視床下核視床核などの性的動機づけおよび性的行動に関与する脳領域がいくつかの研究で示されていることです性行為中のmPFCから(参照 Balfourら、2006)。 これらの脳領域の多くは、性的動機付けや報酬から性的パフォーマンスまで、性的行動の制御に関与する複雑な神経回路に参加しています。 この回路には、視床下部(PVN)のPVNから発生し、腹側被蓋野、側坐核、海馬、扁桃体、PFC、線条の基底核、延髄および脊髄、中脳/中脳ドーパミン作動性に投射するオキシトシン作動性ニューロンが含まれます腹側被蓋野から側坐核およびPFC、投射の視床下部ドーパミン作動性ニューロン、および回路のいくつかの領域で局所およびシステムレベルで関与するグルタミン酸作動性ニューロンに投射するニューロン メリスとアルギオラス、1995, 2011; Melisら、2003, 2007, 2009, 2010; Succu et al。、2007, 2008, 2011)。 したがって、性的活動中に見られるmPFCからの透析液中の細胞外ドーパミン(NAも)の増加は、mPFCがこの回路の活発な部分であること、つまり、中皮質ドーパミン作動性ニューロンが性的活動の制御に一緒に関与していることを示している可能性がありますノルアドレナリン作動性、中脳辺縁系、ドーパミン作動性、オキシトシン作動性、およびグルタミン酸作動性ニューロンを使用しますが、性的行動の発現には厳密に必要ではないようです(Davis他、2010)。 この仮説に沿って、この研究は、性的活動中のmPFCにおけるドーパミンおよびNA放出の違いが、非接触陰茎勃起の数の違いおよび交尾パラメータの変化に付随して生じ、ドーパミンおよびNAの放出がより高いことを示しているローマのラット系統と、性的にナイーブで経験豊かな状態の両方における、より高い性的動機付けおよびより良好な交尾パフォーマンスに関連する食欲および消費段階。
上記の議論は主に、性的活動中に雄ラットの側坐核に生じる細胞外ドーパミンのよく知られた増加に基づいています(Pfausら、1990; Pleimら、1990; ファウスとフィリップス、1991; Damsma et al。、1992; Wenksternら、1993)。 ただし、ドーパミンおよび他の神経伝達物質は、ストレス時またはそれに対処するときなど、他の実験条件ではmPFC(および側坐核)で放出される可能性があります(Thierryら、1976; Faddaら、1978)、性的行動と厳密には関係ありません。 したがって、ドーパミンの増加はmPFCの細胞外ドーパミン(この研究)または側坐核(サンナ他、2015)は、性的活動よりも、性的受容女性の存在および/または性的受容性の女性との相互作用に二次的なストレス、またはその対処に関連しています。 これは、RHAラットとRLAラットに関連性があり、嫌悪条件に応じて著しく異なる対処スタイルと異なる視床下部-下垂体-副腎軸の活性化を示します(RLAラットは、RHAラットよりはるかに高いこの軸の活性化を示します;参照 Carrascoら、2008; Díaz-Moránet al。、2012)。 これはまた、ストレスホルモン(すなわち、コルチコステロイド)がmPFCおよび他の脳領域のドーパミン作動性活動に影響を与える可能性を高めます。 確かに、RLAラットは反応性コッパーであり、運動低下と凍結を特徴とする過感情的な行動を示しますが、RHAラットはストレッサーの制御を獲得することを目的とした積極的な対処行動を示します(Driscoll andBättig、1982; Willig et al。、1991; Escorihuela et al。、1999; シュタイマーとドリスコ、2003; ジョルジ他、2007)。 これが性的にナイーブなラット(これまで受容性の雌と相互作用したことがない)、特に性的にナイーブなRLAラット(上記を参照)で発生する可能性があることを完全に排除することは不可能ですが、これはありそうにありません。 私たちの実験条件では、あらゆる種類のストレスを回避するために可能な限りのことが行われ(「材料と方法」のセクションを参照)、実験は、男性が女性とすぐに相互作用するのではなく、女性に30分間さらされた後にのみ相互作用するように編成されます、ドーパミンの測定された増加は、性的相互作用の間に発生するものよりもはるかに低いです。 ローマのラットのmPFC(および側坐核)で見られるドーパミンの増加(性的にナイーブなRHAおよびRLAラットは、mPFCおよび側坐核からの透析液中の細胞外ドーパミンの基礎レベルが非常に似ている)が実際に二次的であった場合女性によるストレス、または女性の存在/相互作用への対処:(i)ドーパミンの増加は、男性が女性の存在下に置かれた最初の期間ではるかに高く、その後ではなく、交尾中に見つかったように; (ii)ドーパミンの増加は、安定した性的活動の獲得後、つまり学習プロセス(新規性への対処を含む)が完了し、性的実行においてわずかな役割しか果たさない場合、消失または大幅に減少すると予想されます。対照的に、性的活動が繰り返されると発生し続けます。 言い換えれば、mPFC(および側坐核)の細胞外ドーパミンは、性行動が学習された後でも、交尾中に常に増加します。 mPFC(および側坐核;その中の「はじめにと参考文献」のセクションを参照)におけるドーパミン活性のこの増加の機能的役割を明らかにするために、さらなる研究が必要です。
結論として、この研究は、性的受容女性との相互作用が、性的ナイーブ(性的刺激に決してさらされない)のmPFCからの透析液中の細胞外ドーパミンとNAの増加につながることを初めて示します)性的経験(5回の予備的交尾試験を受け、安定した性的パフォーマンスを示す)RHAおよびRLAラットは、嫌悪条件および性的受容性の女性との交尾行動の異なるパターンに応じて著しく異なる対処スタイルを示します。 したがって、性的活動の予測段階と消費段階の両方で、対応するRLAに比べて、性的にナイーブで経験のあるRHAラットの透析液でドーパミンとNAの濃度が高いことがわかりました。 これらの結果は、側坐核のドーパミンについて報告されているように、一部にはRLAラットよりもRHAラットのmPFCのドーパミン作動性およびノルアドレナリン作動性の緊張が原因である可能性があります(サンナ他、2015)。 さらに、細胞外mPFCドーパミンとNAは、性的経験のあるRHAと、程度は低いが、基底状態の性的ナイーブな相手と比較して、性的行動の欲求と消費段階の間にRLAラットでより高いことがわかった。 これは、両方のローマのラット系統の側坐核のドーパミンで見られるように、性的経験がmPFCのドーパミンとNAの神経伝達をさらに強化する形成過程を誘発することを示唆しています(サンナ他、2015)。 2つのローマ系のmPFCにおけるドーパミン作動性およびノルアドレナリン作動性神経伝達の上記の違いは、性的行動の異なるパターンだけでなく、これら2つのラット系を特徴付ける異なる、しばしば反対の行動特性にも役割を果たす可能性があります。
著者寄稿
FS、AA、MRM、OG、MGCがプロジェクトを設計しました。 FSとJBは、性行動と微量透析実験からのデータを設計、実行、分析しました。 MAP、OG、およびMGCは、ローマのラットを選択し、繁殖させました。 FS、AA、MRM、OG、MGCが研究を監督しました。 FS、AA、MRM、OG、MGCが原稿を書きました。 すべての著者が結果を議論し、原稿にコメントしました。
資金調達
この研究は、サルデーニャ自治州(ARS)(LR 2014 / 14)からFSへのイタリア大学研究大学(MIUR)(Scientific Independance of young Researchers、SIR 7、Code no.RBSI7IUX2007)からの助成金によって部分的に支援されました、「サルデーニャの科学研究と技術革新の推進」、欧州社会基金、2007〜2013、プロジェクトコード番号CRP-59842)からOGへ、カリアリ大学からAA、MRM、FS、OG、MGCへ。
利益相反に関する声明
著者らは、潜在的な利益相反として解釈される可能性がある商業的または金銭的関係がない状態で研究が行われたと宣言しています。
謝辞
カリアリ大学のバーバラツベリ博士、動物の飼育と飼育。
参考文献
Afonso、VM、Sison、M、Lovic、V.、およびFleming、AS(2007)。 雌ラットの内側前頭前野皮質病変は性的および母性的行動とそれらの逐次的構成に影響する ふるまい。 神経症。 121、515〜526。 土井:10.1037 / 0735-7044.121.3.515
Agmo、A。、およびVillalpando、A。(1995)。 中枢神経刺激剤は、内側前頭前皮質病変を有する雄ラットの性行動を促進します。 Brain Res。 696, 187–193. doi: 10.1016/0006-8993(95)00853-i
Agmo、A.、Villalpando、A.、Picker、Z。、およびFernández、H.(1995)。 雄ラットの内側前頭前野の病変と性行動。 Brain Res。 696, 177–186. doi: 10.1016/0006-8993(95)00852-h
Argiolas、A。、およびMelis、MR(1995)。 陰茎勃起の神経調節:神経伝達物質と神経ペプチドの役割の概要。 プログレ Neurobiol。 47, 235–255. doi: 10.1016/0301-0082(95)00020-8
Argiolas、A。、およびMelis、MR(2005)。 陰茎勃起の中枢制御:視床下部の傍室核の役割。 プログレ Neurobiol。 76、1〜21。 土井:10.1016 / j.pneurobio.2005.06.002
Argiolas、A。、およびMelis、MR(2013)。 ニューロペプチドと過去から現在までの性的行動の中央制御:レビュー。 プログレ Neurobiol。 108、80〜107。 土井:10.1016 / j.pneurobio.2013.06.006
バルフォア、ME、ブラウン、JL、ユー、L。、およびクーレン、LM(2006)。 雄ラットの性行動後の神経活性化への内側前頭前野からの遠心性の潜在的寄与 神経科学 137、1259〜1276。 土井:10.1016 / j.neuroscience.2005.11.013
バルフォア、ME、ユー、L。、およびクーレン、LM(2004)。 性行動と性関連の環境手がかりは、雄ラットの中脳辺縁系を活性化します。 神経精神薬理学 29、718〜730。 土井:10.1038 / sj.npp.1300350
Beloate、LN、Omrani、A.、Adan、RA、Webb、IC、およびCoolen、LM(2016)。 雄ラットの性行動中の腹側被蓋領域ドーパミン細胞活性化は、性的禁欲に続く神経可塑性およびd-アンフェタミン交差感作を調節します。 J.Neurosci。 36、9949〜9961。 土井:10.1523 / JNEUROSCI.0937-16.2016
K. Berridge、およびT. Robinson(1998)。 報酬におけるドーパミンの役割は何ですか?快楽への影響、報酬学習、またはインセンティブ顕著性? 脳の解像度。 牧師 28, 309–369. doi: 10.1016/s0165-0173(98)00019-8
Bignami、G.(1965)。 ラットにおける回避条件付けの高率および低率の選択。 アニメ。 ふるまい。 13, 221–227. doi: 10.1016/0003-3472(65)90038-2
ブロードハースト、PL、およびBignami、G。(1965)。 心因性選択の相関効果:ローマの高および低回避ラットの系統の研究。 ふるまい。 結果 その 3, 273–280. doi: 10.1016/0005-7967(64)90033-6
Carboni、E.、Silvagni、A.、Vacca、C。、およびDi Chiara、G.(2006)。 側坐核シェル、末端条の床核および前頭前皮質における細胞外ドーパミン増加に対するノルエピネフリンおよびドーパミンキャリア遮断の累積効果。 J.Neurochem。 96、473〜481。 土井:10.1111 / j.1471-4159.2005.03556.x
カーボニ、E。、タンダ、GL、フラウ、R。、およびディキアラ、G。(1990)。 ノルアドレナリンキャリアの遮断は前頭前野の細胞外ドーパミン濃度を増加させる:ドーパミンが取り込まれるという証拠 インビボの ノルアドレナリン作動性端末によって。 J.Neurochem。 55, 1067–1070. doi: 10.1111/j.1471-4159.1990.tb04599.x
カールソン、A。(1975)。 「ドーパミン代謝の受容体媒介制御」、 シナプス前および後受容体、eds E. UsdinおよびWE Bunney(ニューヨーク、NY:Marcel Deker)、49–65。
Carrasco、J.、Márquez、C.、Nadal、R.、Tobeña、A.、Fernández-Teruel、A.およびArmario、A.(2008)。 近交系ローマラット系統における視床下部-下垂体-副腎軸の中枢および末梢成分の特徴 精神神経内分泌学 33、437〜445。 土井:10.1016 / j.psyneuen.2008.01.001
Coppens、CM、de Boer、SF、Steimer、T。、およびKoolhaas、JM(2012)。 ローマの高低回避ラットにおける衝動性と攻撃的な行動:ベースラインの違いと青年期の社会的ストレスは変化を誘発した。 フィジオル。 ふるまい 105、1156〜1160。 土井:10.1016 / j.physbeh.2011.12.013
MG、コルダ、レッカ、D。、ピラス、G。、ディキアラ、G。、およびジョルジ、O。(1997)。 ローマの高回避ラットおよびローマの低回避ラットの中枢神経系におけるドーパミン作動性およびGABA作動性神経伝達の生化学的パラメーター。 行動。 ジュネ。 27、527〜536。 土井:10.1023 / A:1021452814574
MG、コルダ、ピラス、G、マサチューセッツ州ピルドゥ、O。ジョルジ(2014)。 ローマの高回避性および低回避性ラットの側坐核シェルのドーパミン産出に対する自発的エタノール消費の異なる効果:行動および脳微小透析研究。 World J. Neurosci。 4、279–292。 doi:10.4236 / wjns.2014.43031
A.ダルストローム、およびK.フックス(1964)。 中枢神経系におけるモノアミン含有ニューロンの存在の証拠。 I.脳幹ニューロンの細胞体におけるモノアミンの実証。 Acta Physiol。 スキャンされました。 補足 62、1-54。
Damsma、G.、Pfaus、J.、Wenkstern、D.、Phillips、A。、およびFibiger、H.(1992)。 性的行動は、雄ラットの側坐核および線条体のドーパミン伝達を増加させる:新規性および移動との比較。 ふるまい。 神経症。 106、181〜191。 土井:10.1037 / 0735-7044.106.1.181
D'Angio、M.、Serrano、A.、Driscoll、P。、およびScatton、B.(1988)。 ストレスの多い環境刺激は、低情動(ローマ高回避)ラットの前頭前野における細胞外DOPACレベルを増加させますが、高情動(ローマ低回避)ラットでは増加しません。 と インビボの ボルタンメトリー Brain Res。 451, 237–247. doi: 10.1016/0006-8993(88)90768-8
Davis、JF、Loos、M.、Di Sebastiano、AR、Brown、JL、Lehman、MN、Coolen、LM(2010)。 内側前頭前野の病変は、雄ラットの不適応な性行動を引き起こします。 Biol。 精神医学 67、1199〜1204。 土井:10.1016 / j.biopsych.2009.12.029
Díaz-Morán、S.、Palència、M.、Mont-Cardona、C.、Cañete、T.、Blázquez、G.、Martínez-Membrives、E.、et al。 (2012)。 遺伝的に異種のラットにおける対処スタイルとストレスホルモン反応:ローマラット系統との比較。 Behav。 Brain Res。 228、203〜210。 土井:10.1016 / j.bbr.2011.12.002
P. Driscoll、およびK.Bättig(1982)。 「アクティブな双方向回避パフォーマンスの極端な違いのために選択されたラットの行動、感情、および神経化学的プロファイル」 脳の遺伝学、編 I.リーブリッヒ(アムステルダム:エルゼビア)、95–123。
ダンロップ、BW、およびネメロフ、CB(2007)。 うつ病の病態生理におけるドーパミンの役割。 アーチ。 一般精神医学 64、327〜337。 土井:10.1001 / archpsyc.64.3.327
エスコリウエラ、RM、フェルナンデス・テルエル、A。、ギル、L。、アギラール、R。、トベニャ、A。、およびドリスコル、P。(1999)。 近交系の高回避および低回避ラット:不安、目新しさ、シャトルボックスの行動の違い。 フィジオル。 ふるまい 67, 19–26. doi: 10.1016/S0031-9384(99)00064-5
Everitt、BJ(1990)。 性的動機:雄ラットの食欲および交尾反応の根底にあるメカニズムの神経および行動分析。 Neurosci。 Biobehav。 Rev. 14, 217–232. doi: 10.1016/s0149-7634(05)80222-2
Everitt、BJ、およびRobbins、TW(2005)。 薬物中毒のための強化の神経システム:行動から習慣、強迫まで。 Nat。 神経症。 8、1481–1489。 doi:10.1038 / nn1579
Fadda、F.、Argiolas、A.、Melis、MR、Tissari、AH、Onali、PL、およびGessa、GL(1978)。 大脳皮質およびn。側坐核における3,4-ジヒドロキシフェニル酢酸(DOPAC)レベルのストレス誘発性増加:ジアゼパムによる逆転。 ライフサイエンス 23, 2219–2224. doi: 10.1016/b978-0-08-023768-8.51934-4
Fattore、L.、Piras、G.、MG、Corda、およびGiorgi、O.(2009)。 ローマの高回避および低回避ラット系統は、静脈内コカイン自己投与の獲得、維持、絶滅および回復が異なります。 神経精神薬理学 34、1091〜1101。 土井:10.1038 / npp.2008.43
Febo、M.(2011)。 性的受容雌へのアプローチ中の雄ラットにおける前頭前野細胞発火:コカインとの相互作用。 Synapse 65、271〜277。 doi:10.1002 / syn.20843
A.フェルナンデス-グアスティ、オマーニャ-サパタ、I。、ルハン、M。、コンデスララ、M。(1994)。 坐骨神経結紮が性的経験のある未経験の雄ラットの性的行動に及ぼす作用:前頭極皮剥皮の効果。 フィジオル。 ふるまい 55, 577–581. doi: 10.1016/0031-9384(94)90119-8
フェルナンデス・テルエル、A。、ドリスコル、P。、ギル、L。、アギラール、R。、トベニャ、A。、およびエスコリウエラ、RM(2002)。 インセンティブを求める行動が異なる2つのラット系統(RHA / VerhおよびRLA / Verh)の新規性探索、サッカリンおよびエタノール摂取に対する環境強化の永続的な効果。 Pharmacol。 Biochem。 Behav。 73, 225–231. doi: 10.1016/s0091-3057(02)00784-0
Giménez-Llort、L.、Cañete、T.、Guitart-Masip、M.、Fernández-Teruel、A。、およびTobeña、A.(2005)。 ローマの高回避性および低回避性ラットにおける2つの特徴的なアポモルフィン誘発表現型。 フィジオル。 ふるまい 86、458〜466。 土井:10.1016 / j.physbeh.2005.07.021
ジョルジ、O。、レッカ、D。、ピラス、G。、およびコルダ、MG(2005)。 急性または反復アンフェタミン注射後の側坐核のコアおよびシェルにおけるドーパミン放出の示差的活性化:ローマの高回避性および低回避性ラット系統における比較研究。 神経科学 135、987〜998。 土井:10.1016 / j.neuroscience.2005.06.075
ジョルジ、O。、レッカ、D。、ピラス、G。、ドリスコル、P。、およびコルダ、MG(2003a)。 嫌悪条件への対処戦略が異なる、精神遺伝学的に選択された2系統のラットにおける中皮質ドーパミン放出と恐怖関連行動との解離。 ユーロ。 J.Neurosci。 17、2716〜2726。 土井:10.1046 / j.1460-9568.2003.02689.x
ジョルジ、O。、ピラス、G。、レッカ、D。、ハンソン、S。、ドリスコル、P。、およびコルダ、MG(2003b)。 ローマの高回避性および低回避性ラットにおける中枢セロトニン作動性伝達の異なる神経化学的特性 J.Neurochem。 86、422〜431。 土井:10.1046 / j.1471-4159.2003.01845.x
ジョルジ、O。、オーランディ、M。、エスコリウエラ、RM、ドリスコル、P。、レッカ、D。、およびコルダ、MG(1994)。 ローマの高回避性およびローマの低回避性ラットの脳におけるGABA作動性およびドーパミン作動性伝達。 Brain Res。 638, 133–138. doi: 10.1016/0006-8993(94)90642-4
ジョルジ、O。、ピラス、G。、およびコルダ、MG(2007)。 精神遺伝学的に選択されたローマの高回避性および低回避性ラット系統:薬物中毒に対する個々の脆弱性を研究するモデル。 Neurosci。 Biobehav。 Rev. 31、148〜163。 土井:10.1016 / j.neubiorev.2006.07.008
Goto、Y。、およびGrace、AA(2005)。 目標指向行動の側坐核の辺縁および皮質駆動のドーパミン作動性調節。 Nat。 神経症。 8、805–812。 doi:10.1038 / nn1471
Gresch、PJ、Sved、AF、Zigmond、MJ、Finlay、JM(1995)。 ラット内側前頭前野の細胞外ドーパミンに対する内因性ノルエピネフリンの局所的影響 J.Neurochem。 65、111〜116。 土井:10.1046 / j.1471-4159.1995.65010111.x
ヘルナンデス・ゴンサレス、M。、ゲバラ、マサチューセッツ、セルバンテス、M。、モラリ、G。、およびコルシカブレラ、M。(1998)。 要因分析の結果としての雄ラットの性的相互作用中の皮質前頭脳波の特徴的な周波数帯域。 J.生理学 92, 43–50. doi: 10.1016/s0928-4257(98)80022-3
エルナンデス・ゴンサレス、M。、プリエト・ベラコエチア、CA、アルテアガ・シルバ、M。、およびゲバラ、MA(2007)。 ラットの性的動機付けタスク中の内側および眼窩前頭前皮質の異なる機能。 フィジオル。 ふるまい 90、450〜458。 土井:10.1016 / j.physbeh.2006.10.006
ホーン、AS(1973)。 ラット脳ホモジネートにおけるノルアドレナリン作動性およびドーパミン作動性ニューロンからのシナプトソームへのカテコールアミンの取り込みを阻害するための構造活性相関。 Br。 J.Pharmacol。 47, 332–338. doi: 10.1111/j.1476-5381.1973.tb08331.x
Hull、EM、Du、J.、Lorrain、DS、およびMatuszewich、L.(1995)。 内側視索前野における細胞外ドーパミン:性的動機づけおよび交尾のホルモン制御に対する意味。 J.Neurosci。 15、7465-7471。
Hull、EM、Lorrain、DS、Du、J.、Matuszewich、L.、Lumley、LA、Putnam、SK、et al。 (1999)。 性行動の制御におけるホルモンと神経伝達物質の相互作用。 Behav。 Brain Res。 105, 105–116. doi: 10.1016/s0166-4328(99)00086-8
Hull、EM、Weber、MS、Eaton、RC、Dua、R.、Markowski、VP、Lumley、L.など (1991)。 腹側被蓋野のドーパミン受容体は、雄ラットの交尾の運動成分に影響するが、動機付けや反射作用には影響しない。 Brain Res。 554, 72–76. doi: 10.1016/0006-8993(91)90173-S
池本、S。、およびパンクセップ、J。(1999)。 動機付けられた行動における側坐核ドーパミンの役割:報酬を求めることに特に関連する統一解釈。 脳の解像度。 牧師 31, 6–41. doi: 10.1016/S0165-0173(99)00023-5
掛山真理、S根英雄、宮原Y、遠山真理(2003)。 2,3,7,8-tetrachlorodibenzo-p-dioxinへの周産期暴露は、成人期の新皮質および雄ラットの性行動におけるBDNF mRNAの活性依存性発現を変化させます。 神経毒性学 24, 207–217. doi: 10.1016/S0161-813x(02)00214-0
Lecca、D.、Piras、G.、Driscoll、P.、Giorgi、O.、およびCorda、MG(2004)。 側坐核のシェルとコアでのドーパミン出力の異なる活性化は、習慣性薬物に対する運動反応に関連しています:ローマの高回避および低回避ラットにおける脳透析研究。 神経薬理学 46、688〜699。 土井:10.1016 / j.neuropharm.2003.11.011
Manzo、L.、Gómez、MJ、Callejas-Aguilera、JE、Donaire、R.、Sabariego、M.、Fernández-Teruel、A.、et al。 (2014a)。 エタノール嗜好と感覚/ノベルティ探索の関係。 フィジオル。 ふるまい 133、53〜60。 土井:10.1016 / j.physbeh.2014.05.003
Manzo、L.、Gomez、MJ、Callejas-Aguilera、JE、Fernández-Teruel、A.、Papini、MR、およびTorres、C.(2014b)。 ラットのインセンティブ喪失により誘発される抗不安セルフメディケーション。 フィジオル。 ふるまい 123、86〜92。 土井:10.1016 / j.physbeh.2013.10.002
Masana、M.、A。Bortolozzi、およびArtigas、F.(2011)。 ノルアドレナリン作動薬による中皮ドーパミン作動性伝達の選択的強化:統合失調症の治療機会。 Int。 J.Neurophyschopharmacol。 14、53〜68。 土井:10.1017 / s1461145710000908
Meisel、RL、およびSachs、BD(1994)。 「男性の性的行動の生理学」 生殖の生理学、Vol。 2、2nd Edn。、E。KnobilおよびJ. Neil(ニューヨーク、NY:Raven Press)、3–96。
Melis、MR、およびArgiolas、A.(1995)。 ドーパミンと性的行動 Neurosci。 Biobehav。 Rev. 19, 19–38. doi: 10.1016/0149-7634(94)00020-2
Melis、MR、およびArgiolas、A。(2011)。 陰茎勃起の中央制御:雄ラットにおけるオキシトシンの役割とドーパミンおよびグルタミン酸との相互作用の再訪。 Neurosci。 Biobehav。 Rev. 35、939〜955。 土井:10.1016 / j.neubiorev.2010.10.014
Melis、MR、Melis、T.、Cocco、C.、Succu、S.、Sanna、F.、Pillolla、G.、et al。 (2007)。 腹側被蓋領域に注入されたオキシトシンは、陰茎勃起を誘発し、雄ラットの視床下部の側坐核および室傍核の細胞外ドーパミンを増加させます。 ユーロ。 J.Neurosci。 26、1026〜1035。 土井:10.1111 / j.1460-9568.2007.05721.x
Melis、MR、Succu、S.、Cocco、C.、Caboni、E.、Sanna、F.、Boi、A.、et al。 (2010)。 オキシトシンは、腹側海馬台に注入すると陰茎勃起を誘発します。一酸化窒素とグルタミン酸の役割。 神経薬理学 58、1153〜1160。 土井:10.1016 / j.neuropharm.2010.02.008
Melis、MR、Succu、S.、Mascia、MS、Cortis、L。、およびArgiolas、A.(2003)。 細胞外ドーパミンは、性的活動中に雄ラットの傍室核で増加します。 ユーロ。 J.Neurosci。 17、1266〜1272。 土井:10.1046 / j.1460-9568.2003.02558.x
Melis、MR、Succu、S.、Sanna、F.、Boi、A。、およびArgiolas、A。(2009)。 オキシトシンを扁桃体の腹側海馬台または後内側皮質核に注入すると、雄ラットの側坐核における陰茎勃起が誘発され、細胞外ドーパミンレベルが増加します。 ユーロ。 J.Neurosci。 30、1349〜1357。 土井:10.1111 / j.1460-9568.2009.06912.x
モレノ、M。、カルドナ、D。、ゴメス、MJ、サンチェス-サンテド、F。、トベニャ、A。、フェルナンデス-テルエル、A。、他 (2010)。 ローマの高回避性および低回避性ラット系統における衝動性の特性化:行動および神経化学の違い。 神経精神薬理学 35、1198〜1208。 土井:10.1038 / npp.2009.224
Oliveras、I.、Rio-Alamos、C.、Cañete、T.、Blazquez、G.、Martínez-Membrives、E.、Giorgi、O。など (2015)。 プレパルス抑制は、近交系ローマ高回避および低回避ラットおよび遺伝的に不均一なNIH-HSラットにおける空間作業記憶能力を予測します。 前面。 ふるまい。 神経症。 9:213 土井:10.3389 / fnbeh.2015.00213
Pfaus、JG(2010)。 ドーパミン:男性が少なくとも200百万年にわたって交尾するのを助ける:Kleitz-Nelson et al。 (2010)。 ふるまい。 神経症。 124、877〜880。 土井:10.1037 / a0021823
Pfaus、JG、Damsma、G.、Nomikos、GG、Wenkstern、DG、Blaha、CD、Phillips、AGなど (1990)。 性的行動は雄ラットの中心ドーパミン伝達を促進します。 Brain Res。 530, 345–348. doi: 10.1016/0006-8993(90)91309-5
Pfaus、JG、およびEveritt、BJ(1995)。 「性行動の精神薬理学」 精神薬理学:進歩の第4世代、eds FE BloomとDJ Kupfer(ニューヨーク、ニューヨーク:Raven Press)、742–758。
Pfaus、JG、およびPhillips、AG(1991)。 雄ラットの性行動の予測的および消費的側面におけるドーパミンの役割。 ふるまい。 神経症。 105、727〜747。 土井:10.1037 / 0735-7044.105.5.727
Piras、G.、Giorgi、O.、およびCorda、MG(2010)。 嫌悪条件への対処戦略が異なる、精神遺伝学的に選択された2系統のラットの強制水泳試験のパフォーマンスに対する抗うつ薬の効果。 精神薬理学 211, 403–414. doi: 10.1007/s00213-010-1904-x
ピラス、G。、ピルドゥ、MA、ジョルジ、O。、およびコルダ、MG(2014)。 ストレス誘発性うつ病に対する脆弱性の推定遺伝モデル(ローマン低回避ラット)および抵抗性(ローマン高回避ラット)における慢性抗うつ薬治療の効果。 精神薬理学 231, 43–53. doi: 10.1007/s00213-013-3205-7
Pitchers、KK、Frohamader、KS、Vialou、V.、Mouzon、K.、Nestler、EJ、Lehman、MNなど (2010)。 側坐核のΔFosBは、性的報酬の効果を強化するために重要です。 遺伝子脳行動。 9, 831–840. doi: 10.1111/j.1601-183X.2010.00621.x
ピッチャーズ、KK、コペンズ、CM、ベロイト、LN、フラー、J。、ヴァン、S。、フロマダー、KS、他 (2014)。 腹側被蓋領域のドーパミン作動性ニューロンの内因性オピオイド誘発神経可塑性は、自然およびオピエート報酬に影響します。 J.Neurosci。 34、8825〜8836。 土井:10.1523 / JNEUROSCI.0133-14.2014
投手、KK、Vialou、V.、Nestler、EJ、Laviolette、SR、Lehman、MN、およびCoolen、LM(2013)。 自然および薬物の報酬は、ΔFosBを主要なメディエーターとして、一般的な神経可塑性メカニズムに作用します。 J.Neurosci。 33、3434〜3442。 土井:10.1523 / JNEUROSCI.4881-12.2013
Pleim、E.、Matochik、J.、Barfield、R。、およびAuerbach、S.(1990)。 ラットの側坐核におけるドーパミン放出と男性の性的行動との相関。 Brain Res。 524, 160–163. doi: 10.1016/0006-8993(90)90507-8
ロビンズ、TW、およびアルンステン、AFT(2009)。 前頭実行機能の神経精神薬理学:モノアミン作動性調節。 アン。 Rev. Neurosci。 32、267–287。 土井:10.1146 / annurev.neuro.051508.135535
サバリエゴ、M。、モロン、I。、ゴメス、MJ、ドネア、R。、トベニャ、A。、フェルナンデス-テルエル、A。、他 (2013)。 近交系ローマン・ハイ(RHA-I)およびローマン・ロー-(RLA-I)回避ラットにおけるインセンティブ損失と海馬遺伝子発現。 Behav。 Brain Res。 257、62〜70。 土井:10.1016 / j.bbr.2013.09.025
サックス、BD(2000)。 生理機能と勃起機能、勃起機能障害、性的興奮の分類に対するコンテキストアプローチ。 Neurosci。 Biobehav。 Rev. 24, 541–560. doi: 10.1016/S0149-7634(00)00022-1
サックス、BD、アカソフ、K。、シトロ、JK、ダニエルズ、SB、ナトリ、JH(1994)。 ラットの発情雌からの非接触刺激は、陰茎勃起を引き起こします。 フィジオル。 ふるまい 55, 1073–1079. doi: 10.1016/0031-9384(94)90390-5
サックス、BD、およびバーフィールド、RJ(1976)。 ラットにおける男性の交尾行動の機能分析。 前売 スタッド。 行動。 7, 91–154. doi: 10.1016/s0065-3454(08)60166-7
Salamone、JD、Pardo、M.、Yohn、SE、López-Cruz、L.、San Miguel、N。、およびCorrea、M.(2016)。 中脳辺縁系ドーパミンとやる気のある行動の調節。 Curr。 上。 ふるまい。 神経症。 27, 231–257. doi: 10.1007/7854_2015_383
サンナ、F。、コルダ、MG、メリス、MR、ピルドゥ、MA、ジョルジ、O。、およびアルジオラス、A。(2014a)。 オスの高低回避ラットは、交尾行動の異なるパターンを示します:スプラーグドーリーラットとの比較。 フィジオル。 ふるまい 127、27〜36。 土井:10.1016 / j.physbeh.2014.01.002
サンナ、F。、ピルドゥ、MA、コルダ、MG、アルジオラス、A。、ジョルジ、O。、およびメリス、MR(2014b)。 ドーパミンは、ローマの高回避ラットと低回避ラットの交尾行動のさまざまなパターンに関与しています:アポモルフィンとハロペリドールの研究。 Pharmacol。 Biochem。 Behav。 124、211〜219。 土井:10.1016 / j.pbb.2014.06.012
サンナ、F。、ピルドゥ、MA、コルダ、MG、メリス、MR、ジョルジ、O。、およびアルジオラス、A。(2015)。 ローマの高回避ラットと低回避ラットの性行動の違いにおけるドーパミンの関与:脳内微量透析研究。 Behav。 Brain Res。 281、177〜186。 土井:10.1016 / j.bbr.2014.12.009
スキャットン、B。、ダンジオ、M。、ドリスコル、P。、およびセラーノ、A。(1988)。 あ インビボの 感情レベルの異なるラットの系統における環境刺激に対する中皮質および中側坐核ドーパミン作動性ニューロンの応答のボルタンメトリー研究。 アン。 NY Acad。 科学 537, 124–137. doi: 10.1111/j.1749-6632.1988.tb42101.x
Steimer、T.、およびDriscoll、P.(2003)。 精神遺伝的に選択されたローマの高(RHA)および低(RLA)回避ラットにおける発散ストレス応答と対処スタイル:行動、神経内分泌、および発達の側面。 ストレス 6、87〜100。 土井:10.1080 / 1025389031000111320
Succu、S.、Sanna、F.、Argiolas、A。、およびMelis、MR(2011)。 海馬腹側海馬台に注入されたオキシトシンは、腹側被蓋領域のグルタミン酸作動性神経伝達を増加させることにより、雄ラットの陰茎勃起を誘発します。 神経薬理学 61、181〜188。 土井:10.1016 / j.neuropharm.2011.03.026
Succu、S.、Sanna、F.、Cocco、C.、Melis、T.、Boi、A.、Ferri、GL、et al。 (2008)。 オキシトシンは、雄ラットの腹側被蓋領域に注射すると陰茎勃起を誘発します。一酸化窒素とサイクリックGMPの役割。 ユーロ。 J.Neurosci。 28、813〜821。 土井:10.1111 / j.1460-9568.2008.06385.x
Succu、S.、Sanna、F.、Melis、T.、Boi、A.、Argiolas、A。、およびMelis、MR(2007)。 雄ラットの視床下部の傍室核におけるドーパミン受容体の刺激は、陰茎勃起を誘発し、側坐核の細胞外ドーパミンを増加させる:中枢オキシトシンの関与。 神経薬理学 52、1034〜1043。 土井:10.1016 / j.neuropharm.2006.10.019
ティエリー、AM、タッシン、JP、ブラン、G。、およびグロウィンスキー、J。(1976)。 ストレスによる中皮質DAシステムの選択的活性化。 自然 263、242〜244。 土井:10.1038 / 263242a0
Wenkstern、D.、Pfaus、J.、Fibiger、H。(1993)。 ドーパミンの伝達は、オスのラットの性的受容性のメスのラットへの最初の暴露中に側坐核で増加します。 Brain Res。 618, 41–46. doi: 10.1016/0006-8993(93)90426-N
Westernik、BHC、De Boer、P.、De Vries、JB、およびLong、S.(1998)。 抗精神病薬は、ラット脳の内側前頭前野におけるドーパミンおよびノルアドレナリンの放出に対して同様の効果を誘発します。 ユーロ。 J. Pharmacol。 361, 27–33. doi: 10.1016/s0014-2999(98)00711-0
Willig、F.、M'Harzi、M.、Bardelay、C.、Viet、D。、およびDelacour、J。(1991)。 作業記憶の研究のための心因性モデルとしてのローマ株:行動および生化学データ。 Pharmacol。 Biochem。 Behav。 40, 7–16. doi: 10.1016/0091-3057(91)90313-q
キーワード:性行動、ドーパミン、ノルアドレナリン、mPFC、微量透析、RHAおよびRLAラット
引用:Sanna F、Bratzu J、Piludu MA、Corda MG、Melis MR、Giorgi OおよびArgiolas A(2017)ドーパミン、ノルアドレナリン、およびローマ高位および低位回避雄ラットの性行動の違い:内側前頭前野の微小透析研究。 前面。 行動。 神経科学。 11:108。 土井:10.3389 / fnbeh.2017.00108
受信:22 12月2016; 受け入れ:19 5月2017;
公開:07 6月2017。
 ファブリツィオ・サンナ
ファブリツィオ・サンナ ジェシカ・ブラッツ
ジェシカ・ブラッツ マリア・A・ピルドゥ
マリア・A・ピルドゥ マリア・G・コルダ
マリア・G・コルダ マリア・R・メリス
マリア・R・メリス オスヴァルド・ジョルジ
オスヴァルド・ジョルジ アントニオ・アルジョラス
アントニオ・アルジョラス